Застосування sdf-1 для лікування та/або профілактики неврологічних захворювань
Номер патенту: 96926
Опубліковано: 26.12.2011
Автори: Бошерт Урсула, Вожсік Жером, Вітт П'єр Ален, Праудфут Аманда, Каді Лінда
Формула / Реферат
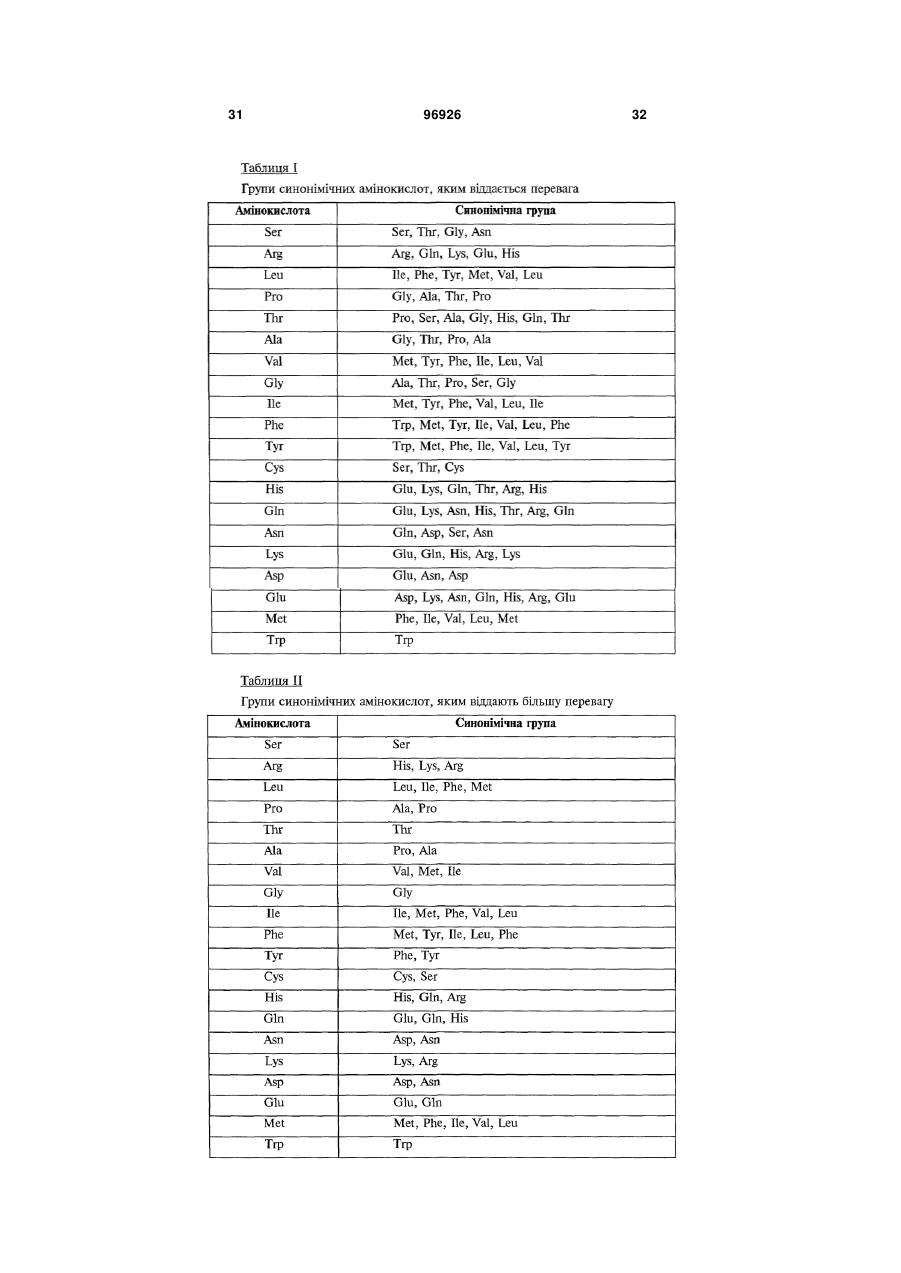
1. Застосування SDF-1 для виготовлення лікарського засобу для лікування та/або профілактики неврологічного захворювання, вибраного з групи, яку складають невропатія, демієлінізуюче захворювання периферичної нервової системи, периферична невропатія, первинний прогресуючий розсіяний склероз (MS), вторинний прогресуючий розсіяний склероз (MS), хронічний запальний розсіяний склероз, демієлінізуюча поліневропатія (CIDP) та синдром Гійєна-Барре (GBS), причому SDF-1 вибраний з групи, яку складають:
a) поліпептид, який містить амінокислоти послідовності № 1;
b) поліпептид, який містить амінокислоти послідовності № 4;
c) поліпептид, який містить амінокислоти послідовності № 7;
d) поліпептид (а)-(с), який додатково містить сигнальну послідовність, за варіантом, якому віддається перевага, амінокислоти послідовності № 5;
е) мутеїн будь-якого з поліпептидів (a)-(d), де амінокислотна послідовність має щонайменше 80% або 90% ідентичність із щонайменше однією з послідовностей від (а) до (с), причому цей мутеїн зв'язується з рецептором CXCR4;
f) мутеїн будь-якого з поліпептидів (a)-(d), який кодується послідовністю ДНК, яка гібридизується з комплементом нативної послідовності ДНК, яка кодує будь-який з поліпептидів (а)-(с) за умов підвищеної жорсткості, причому цей мутеїн зв'язується з рецептором CXCR4;
g) мутеїн будь-якого з поліпептидів (a)-(d), де всі зміни в амінокислотній послідовності є консервативними амінокислотними замінами в амінокислотних послідовностях будь-якого з поліпептидів (а)-(с);
h) сіль або ізоформа, гібридний білок, функціональна похідна або активна фракція будь-якого з поліпептидів (a)-(d), що зв'язується з рецептором CXCR4.
2. Застосування за п. 1, причому периферичною невропатією є діабетична невропатія або біль невротичного походження.
3. Застосування за будь-яким із попередніх пунктів, причому SDF-1 злитий з молекулою-носієм, пептидом або білком, який стимулює пepexід через гематоенцефалічний бар'єр.
4. Застосування за будь-яким із попередніх пунктів, причому SDF-1 є пегільованим.
5. Застосування за п. 3, причому гібридний білок характеризується злиттям з імуноглобуліном (Ig).
6. Застосування за будь-яким із попередніх пунктів, причому лікарський засіб додатково містить інтерферон та/або остеопонтин, та/або кластерин для одночасного, послідовного або окремого застосування.
7. Застосування за п. 6, причому інтерфероном є β-інтерферон.
8. Застосування за будь-яким із попередніх пунктів, причому SDF-l застосовують у кількості приблизно від 0,001 до 1 мг/кг маси тіла або приблизно від 0,01 до 10 мг/кг маси тіла чи приблизно 9, 8, 7, 6, 5, 4, 3, 2 або 1 мг/кг маси тіла чи приблизно від 0,1 до 1 мг/кг маси тіла.
9. Застосування нуклеїновокислотної молекули для виготовлення лікарського засобу для лікування та/або профілактики неврологічного захворювання, вибраного з групи, яку складають невропатія, демієлінізуюче захворювання периферичної нервової системи, периферична невропатія, первинний прогресуючий розсіяний склероз (MS), вторинний прогресуючий розсіяний склероз (MS), хронічний запальний розсіяний склероз, демієлінізуюча поліневропатія (CIDP) та синдром Гійєна-Барре (GBS), причому згадана нуклеїновокислотна молекула містить нуклеїновокислотну ПОСЛІДОВНІСТЬ № 6 або нуклеїновокислотну послідовність, яка кодує поліпептид, який містить амінокислотну послідовність, вибрану з групи, яку складають:
a) поліпептид, який містить амінокислоти послідовності № 1;
b) поліпептид, який містить амінокислоти послідовності № 4;
c) поліпептид, який містить амінокислоти послідовності № 7;
d) поліпептид (а)-(с), який додатково містить сигнальну послідовність, за варіантом, якому віддається перевага, амінокислоти послідовності № 5;
е) мутеїн будь-якого з поліпептидів (a)-(d), де амінокислотна послідовність має щонайменше 80% або 90% ідентичність із щонайменше однією з послідовностей від (а) до (с), причому цей мутеїн зв'язується з рецептором CXCR4;
f) мутеїн будь-якого з поліпептидів (a)-(d), який кодується послідовністю ДНК, яка гібридизується з комплементом нативної послідовності ДНК, яка кодує будь-який з поліпептидів (а)-(с) за умов підвищеної жорсткості, причому цей мутеїн зв'язується з рецептором CXCR4;
g) мутеїн будь-якого з поліпептидів (a)-(d), де всі зміни в амінокислотній послідовності є консервативними амінокислотними замінами в амінокислотних послідовностях будь-якого з поліпептидів (а)-(с);
h) сіль або ізоформа, гібридний білок, функціональна похідна або активна фракція будь-якого з поліпептидів (a)-(d), що зв'язується з рецептором CXCR4.
10. Застосування за п. 9, причому нуклеїновокислотна молекула додатково містить послідовність експресійного вектора.
11. Застосування за будь-яким із пп. 9-10 для генотерапії.
12. Застосування вектора для спричинення та/або посилення ендогенного продукування SDF-1 у клітині при виготовленні лікарського засобу для лікування та/або профілактики неврологічного захворювання, вибраного з групи, яку складають невропатія, демієлінізуюче захворювання периферичної нервової системи, периферична невропатія, первинний прогресуючий розсіяний склероз (MS), вторинний прогресуючий розсіяний склероз (MS), хронічний запальний розсіяний склероз, демієлінізуюча поліневропатія (CIDP) та синдром Гійєна-Барре (GBS), причому SDF-1 вибраний з групи, яку складають:
a) поліпептид, який містить амінокислоти послідовності № 1;
b) поліпептид (а), який додатково містить сигнальну послідовність, за варіантом, якому віддається перевага, амінокислоти послідовності № 5;
c) мутеїн будь-якого з поліпептидів (a)-(b), де амінокислотна послідовність має щонайменше 80% або 90% ідентичність із послідовністю (а), причому цей мутеїн зв'язується з рецептором CXCR4;
d) мутеїн будь-якого з поліпептидів (a)-(b), який кодується послідовністю ДНК, яка гібридизується з комплементом нативної послідовності ДНК, яка кодує поліпептид (а) за умов підвищеної жорсткості, причому цей мутеїн зв'язується з рецептором CXCR4;
e) мутеїн будь-якого з поліпептидів (a)-(b), де всі зміни в амінокислотній послідовності є консервативними амінокислотними замінами в амінокислотних послідовностях поліпептиду (а).
13. Застосування за п. 12 для генотерапії.
14. Застосування клітини, яка зазнала генетичної модифікації, для продукування SDF-1 при виготовленні лікарського засобу для лікування та/або профілактики неврологічного захворювання, вибраного з групи, яку складають невропатія, демієлінізуюче захворювання периферичної нервової системи, периферична невропатія, первинний прогресуючий розсіяний склероз (MS), вторинний прогресуючий розсіяний склероз (MS), хронічний запальний розсіяний склероз, демієлінізуюча поліневропатія (CIDP) та синдром Гійєна-Барре (GBS), причому SDF-1 вибраний з групи, яку складають:
a) поліпептид, який містить амінокислоти послідовності № 1;
b) поліпептид, який містить амінокислоти послідовності № 4;
c) поліпептид, який містить амінокислоти послідовності № 7;
d) поліпептид (а)-(с), який додатково містить сигнальну послідовність, за варіантом, якому віддається перевага, амінокислоти послідовності № 5;
е) мутеїн будь-якого з поліпептидів (a)-(d), де амінокислотна послідовність має щонайменше 80% або 90% ідентичність із щонайменше однією з послідовностей від (а) до (с), причому цей мутеїн зв'язується з рецептором CXCR4;
f) мутеїн будь-якого з поліпептидів (a)-(d), який кодується послідовністю ДНК, яка гібридизується з комплементом нативної послідовності ДНК, яка кодує будь-який з поліпептидів (а)-(с) за умов підвищеної жорсткості, причому цей мутеїн зв'язується з рецептором CXCR4;
g) мутеїн будь-якого з поліпептидів (a)-(d), де всі зміни в амінокислотній послідовності є консервативними амінокислотними замінами в амінокислотних послідовностях будь-якого з поліпептидів (а)-(с);
h) сіль або ізоформа, гібридний білок, функціональна похідна або активна фракція будь-якого з поліпептидів (a)-(d), що зв'язується з рецептором CXCR4.
15. Фармацевтична композиція, яка містить SDF-1 та інтерферон, факультативно разом з одним або декількома фармацевтично прийнятними наповнювачами, для лікування та/або профілактики неврологічного захворювання, вибраного з групи, яку складають невропатія, демієлінізуюче захворювання периферичної нервової системи, периферична невропатія, первинний прогресуючий розсіяний склероз (MS), вторинний прогресуючий розсіяний склероз (MS), хронічний запальний розсіяний склероз, демієлінізуюча поліневропатія (CIDP) та синдром Гійєна-Барре (GBS), причому SDF-1 вибраний з групи, яку складають:
a) поліпептид, який містить амінокислоти послідовності № 1;
b) поліпептид, який містить амінокислоти послідовності № 4;
c) поліпептид, який містить амінокислоти послідовності № 7;
d) поліпептид (а)-(с), який додатково містить сигнальну послідовність, за варіантом, якому віддається перевага, амінокислоти послідовності № 5;
е) мутеїн будь-якого з поліпептидів (a)-(d), де амінокислотна послідовність має щонайменше 80% або 90% ідентичність із щонайменше однією з послідовностей від (а) до (с), причому цей мутеїн зв'язується з рецептором CXCR4;
f) мутеїн будь-якого з поліпептидів (a)-(d), який кодується послідовністю ДНК, яка гібридизується з комплементом нативної послідовності ДНК, яка кодує будь-який з поліпептидів (а)-(с) за умов підвищеної жорсткості, причому цей мутеїн зв'язується з рецептором CXCR4;
g) мутеїн будь-якого з поліпептидів (a)-(d), де всі зміни в амінокислотній послідовності є консервативними амінокислотними замінами в амінокислотних послідовностях будь-якого з поліпептидів (а)-(с);
h) сіль або ізоформа, гібридний білок, функціональна похідна або активна фракція будь-якого з поліпептидів (a)-(d), що зв'язується з рецептором CXCR4.
16. Фармацевтична композиція, яка містить SDF-1 та остеопонтин, факультативно разом з одним або декількома фармацевтично прийнятними наповнювачами, для лікування та/або профілактики неврологічного захворювання, вибраного з групи, яку складають невропатія, демієлінізуюче захворювання периферичної нервової системи, периферична невропатія, первинний прогресуючий розсіяний склероз (MS), вторинний прогресуючий розсіяний склероз (MS), хронічний запальний розсіяний склероз, демієлінізуюча поліневропатія (CIDP) та синдром Гійєна-Барре (GBS), причому SDF-1 вибраний з групи, яку складають:
a) поліпептид, який містить амінокислоти послідовності № 1;
b) поліпептид, який містить амінокислоти послідовності № 4;
c) поліпептид, який містить амінокислоти послідовності № 7;
d) поліпептид (а)-(с), який додатково містить сигнальну послідовність, за варіантом, якому віддається перевага, амінокислоти послідовності № 5;
е) мутеїн будь-якого з поліпептидів (a)-(d), де амінокислотна послідовність має щонайменше 80% або 90% ідентичність із щонайменше однією з послідовностей від (а) до (с), причому цей мутеїн зв'язується з рецептором CXCR4;
f) мутеїн будь-якого з поліпептидів (a)-(d), який кодується послідовністю ДНК, яка гібридизується з комплементом нативної послідовності ДНК, яка кодує будь-який з поліпептидів (а)-(с) за умов підвищеної жорсткості, причому цей мутеїн зв'язується з рецептором CXCR4;
g) мутеїн будь-якого з поліпептидів (a)-(d), де всі зміни в амінокислотній послідовності є консервативними амінокислотними замінами в амінокислотних послідовностях будь-якого з поліпептидів (а)-(с);
h) сіль або ізоформа, гібридний білок, функціональна похідна або активна фракція будь-якого з поліпептидів (a)-(d), що зв'язується з рецептором CXCR4.
17. Фармацевтична композиція, яка містить SDF-1 та кластерин, факультативно разом з одним або декількома фармацевтично прийнятними наповнювачами, для лікування та/або профілактики захворювання, вибраного з групи, яку складають невропатія, демієлінізуюче захворювання периферичної нервової системи, периферична невропатія, первинний прогресуючий розсіяний склероз (MS), вторинний прогресуючий розсіяний склероз (MS), хронічний запальний розсіяний склероз, демієлінізуюча поліневропатія (CIDP) та синдром Гійєна-Барре (GBS), причому SDF-1 вибраний з групи, яку складають:
a) поліпептид, який містить амінокислоти послідовності № 1;
b) поліпептид, який містить амінокислоти послідовності № 4;
c) поліпептид, який містить амінокислоти послідовності № 7;
d) поліпептид (а)-(с), який додатково містить сигнальну послідовність, за варіантом, якому віддається перевага, амінокислоти послідовності № 5;
е) мутеїн будь-якого з поліпептидів (a)-(d), де амінокислотна послідовність має щонайменше 80% або 90% ідентичність із щонайменше однією з послідовностей від (а) до (с), причому цей мутеїн зв'язується з рецептором CXCR4;
f) мутеїн будь-якого з поліпептидів (a)-(d), який кодується послідовністю ДНК, яка гібридизується з комплементом нативної послідовності ДНК, яка кодує будь-який з поліпептидів (а)-(с) за умов підвищеної жорсткості, причому цей мутеїн зв'язується з рецептором CXCR4;
g) мутеїн будь-якого з поліпептидів (a)-(d), де всі зміни в амінокислотній послідовності є консервативними амінокислотними замінами в амінокислотних послідовностях будь-якого з поліпептидів (а)-(с);
h) сіль або ізоформа, гібридний білок, функціональна похідна або активна фракція будь-якого з поліпептидів (a)-(d), що зв'язується з рецептором CXCR4.
Текст
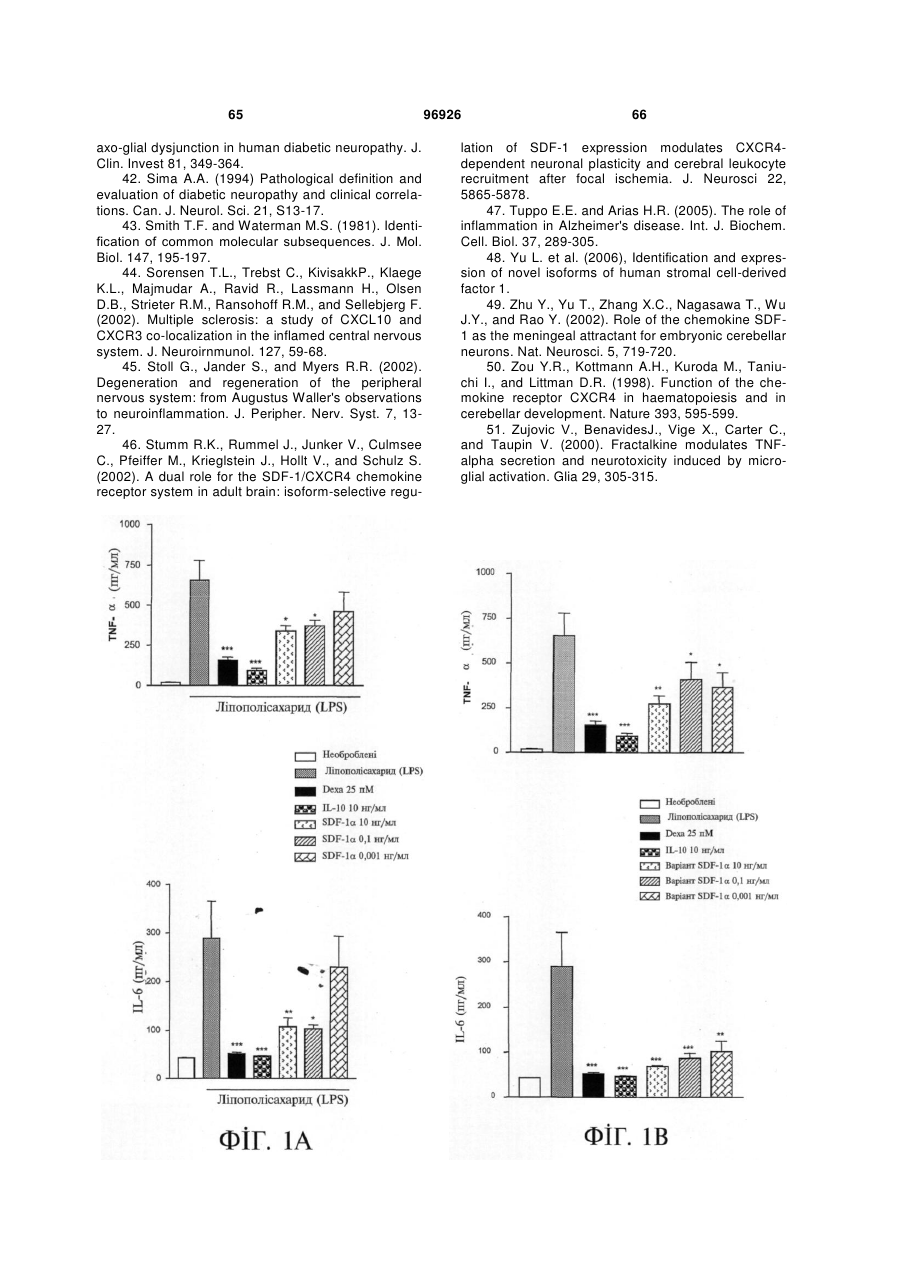
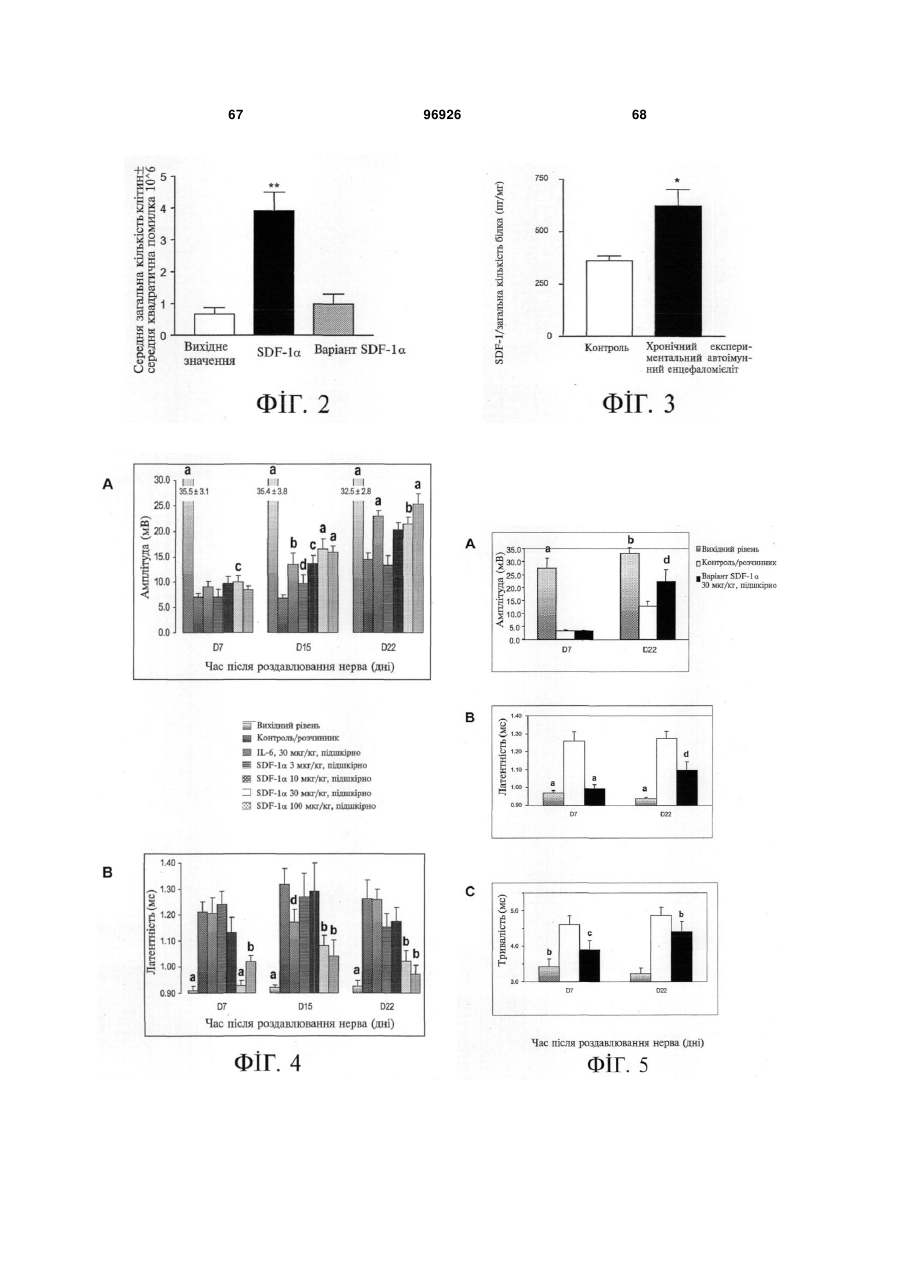
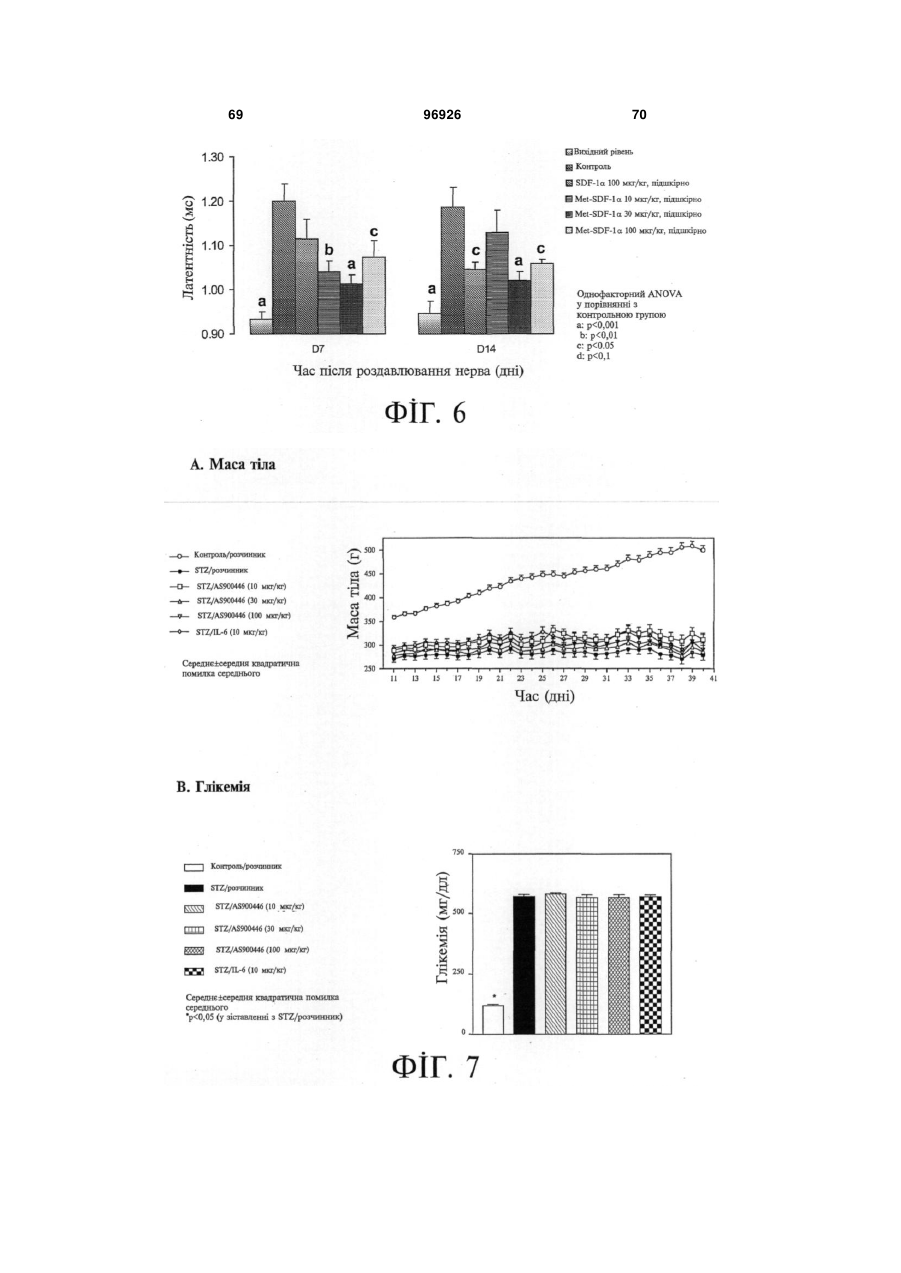
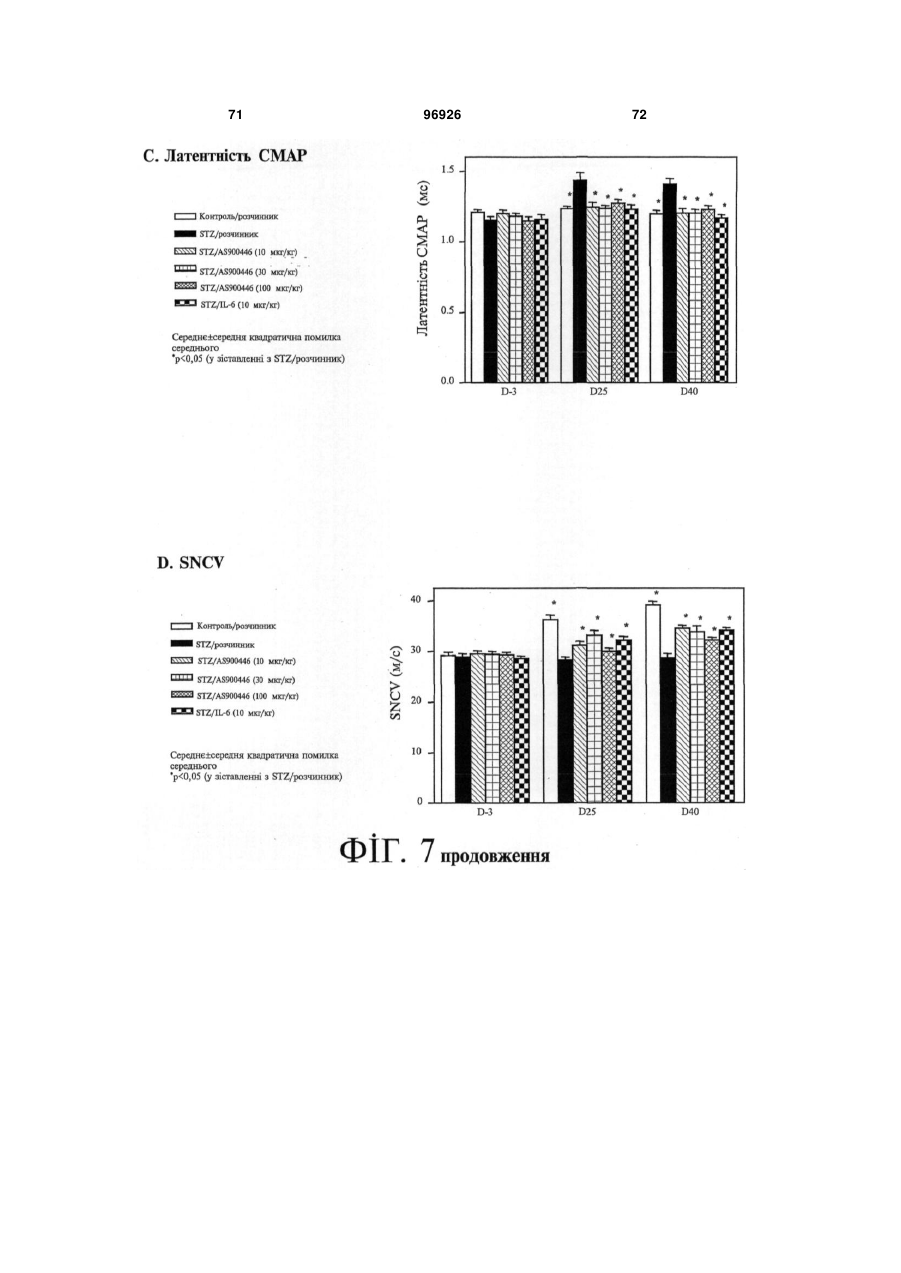
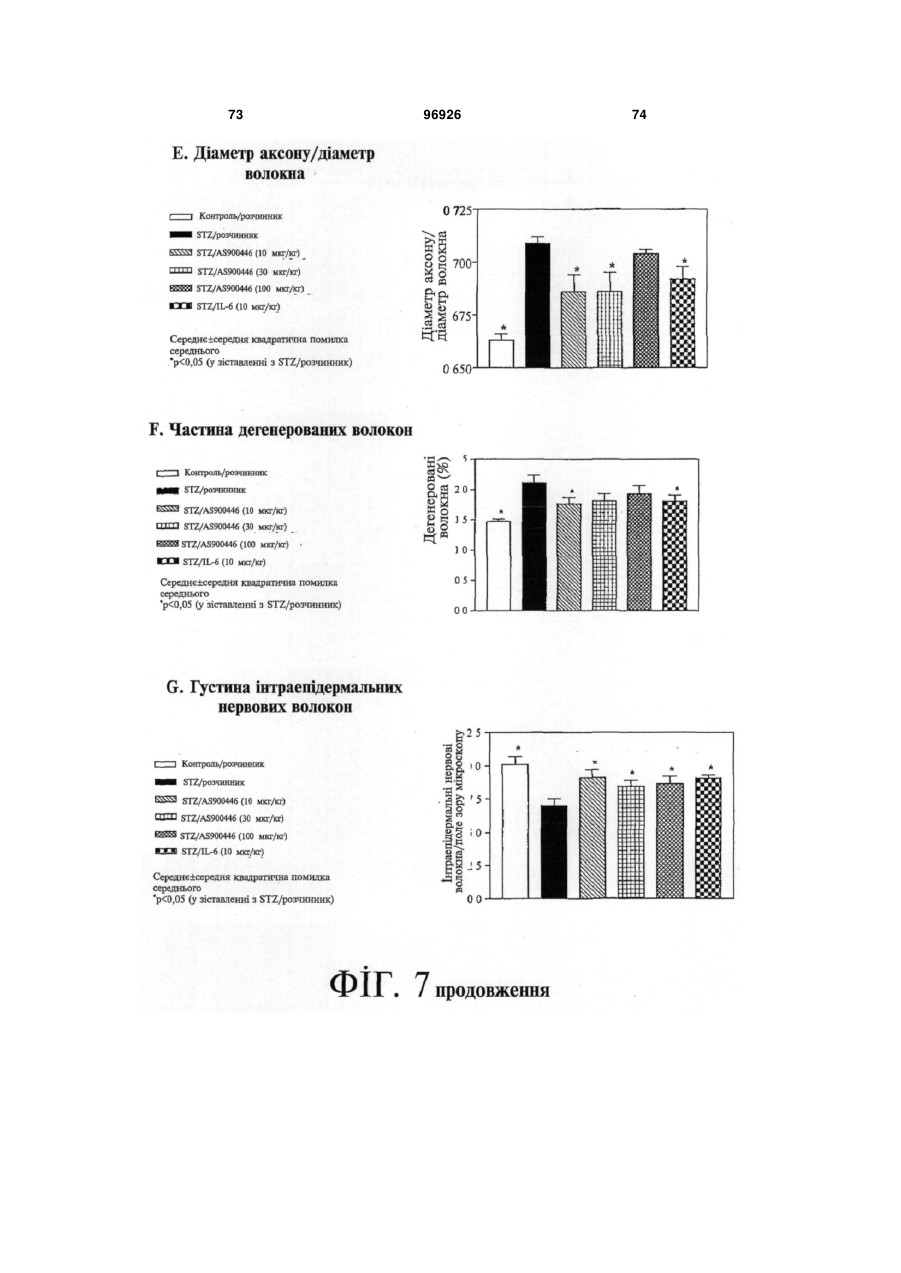
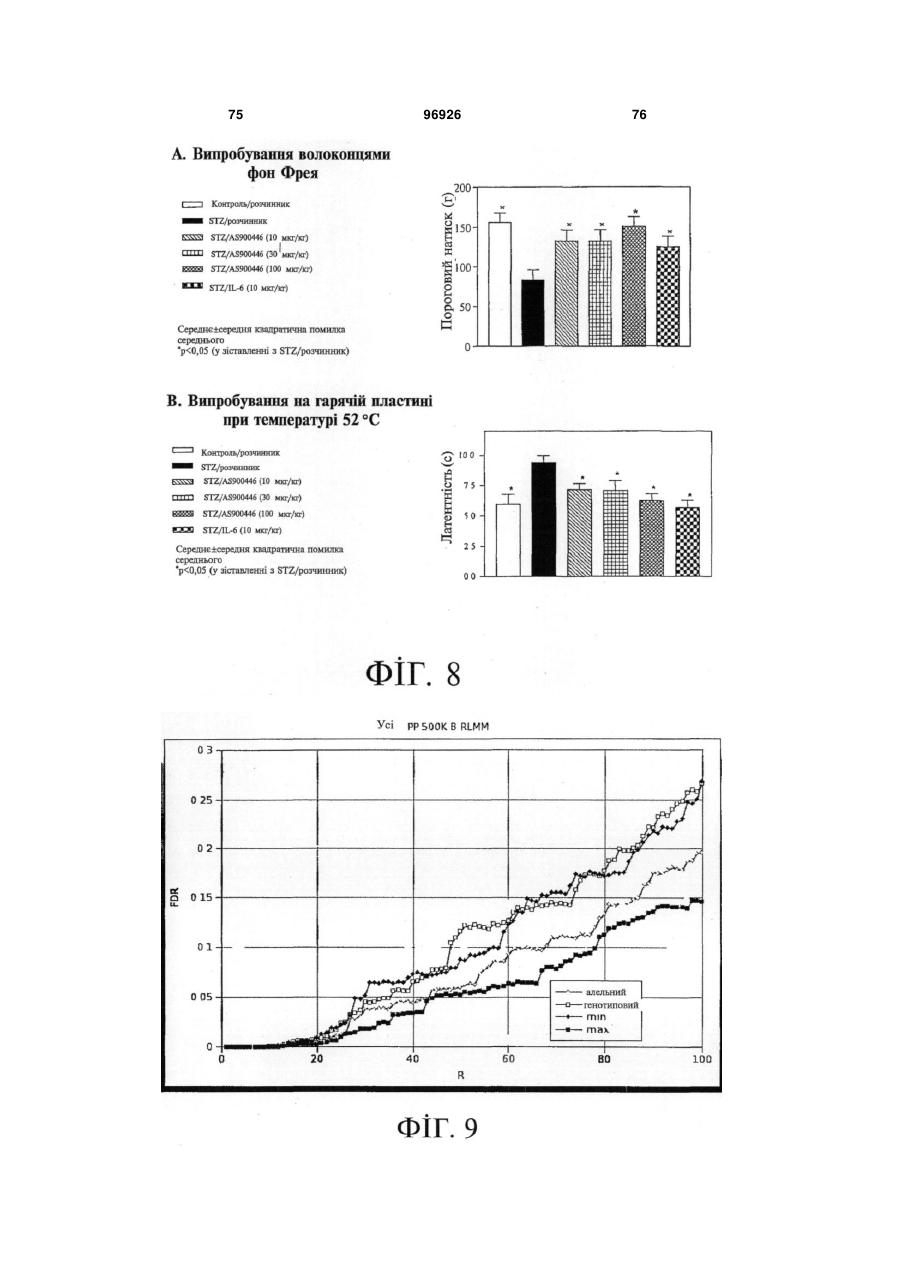
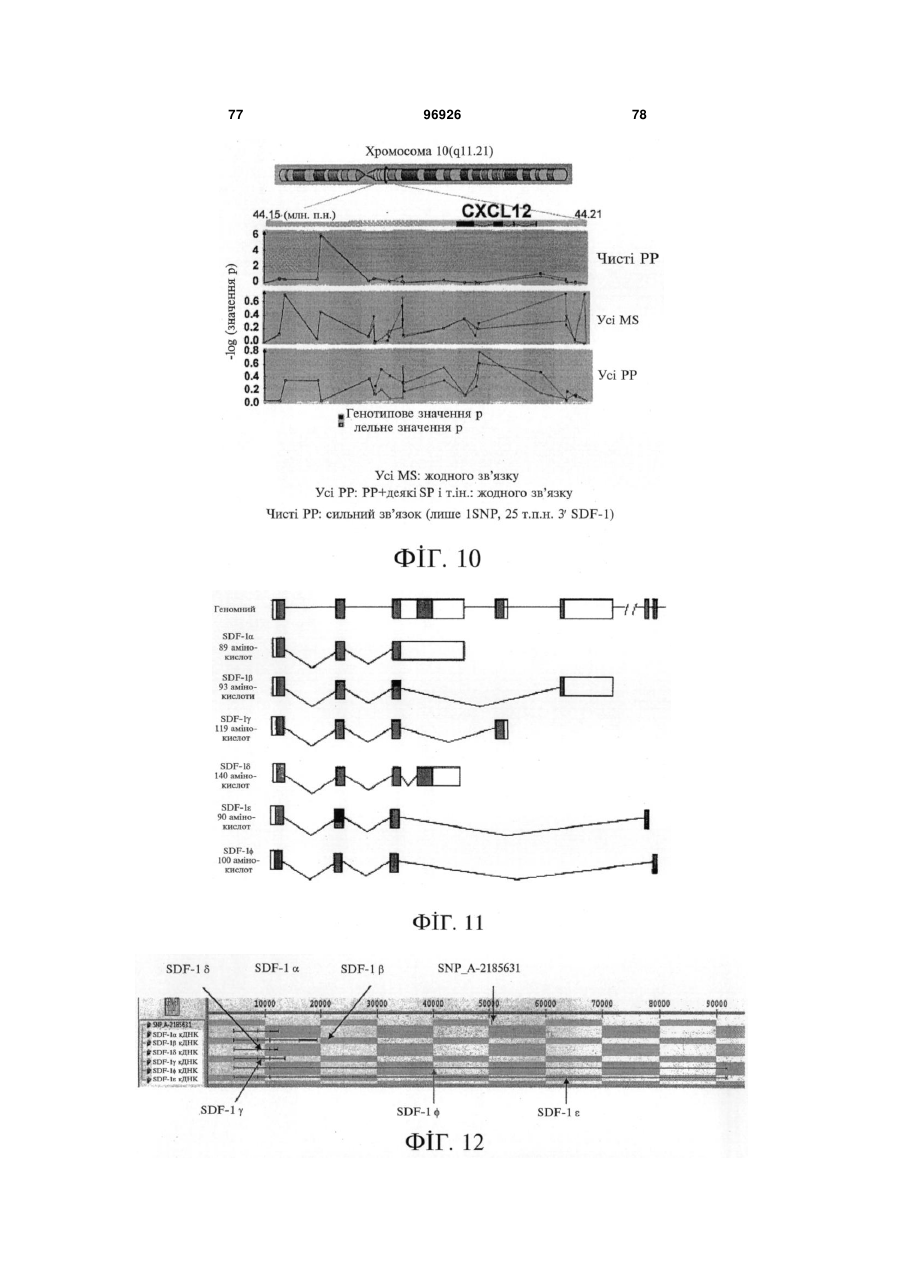
1. Застосування SDF-1 для виготовлення лікарського засобу для лікування та/або профілактики неврологічного захворювання, вибраного з групи, яку складають невропатія, демієлінізуюче захворювання периферичної нервової системи, периферична невропатія, первинний прогресуючий розсіяний склероз (MS), вторинний прогресуючий розсіяний склероз (MS), хронічний запальний розсіяний склероз, демієлінізуюча поліневропатія (CIDP) та синдром Гійєна-Барре (GBS), причому SDF-1 вибраний з групи, яку складають: a) поліпептид, який містить амінокислоти послідовності № 1; b) поліпептид, який містить амінокислоти послідовності № 4; c) поліпептид, який містить амінокислоти послідовності № 7; d) поліпептид (а)-(с), який додатково містить сигнальну послідовність, за варіантом, якому віддається перевага, амінокислоти послідовності № 5; е) мутеїн будь-якого з поліпептидів (a)-(d), де амінокислотна послідовність має щонайменше 80% або 90% ідентичність із щонайменше однією з 2 (19) 1 3 лікування та/або профілактики неврологічного захворювання, вибраного з групи, яку складають невропатія, демієлінізуюче захворювання периферичної нервової системи, периферична невропатія, первинний прогресуючий розсіяний склероз (MS), вторинний прогресуючий розсіяний склероз (MS), хронічний запальний розсіяний склероз, демієлінізуюча поліневропатія (CIDP) та синдром Гійєна-Барре (GBS), причому згадана нуклеїновокислотна молекула містить нуклеїновокислотну ПОСЛІДОВНІСТЬ № 6 або нуклеїновокислотну послідовність, яка кодує поліпептид, який містить амінокислотну послідовність, вибрану з групи, яку складають: a) поліпептид, який містить амінокислоти послідовності № 1; b) поліпептид, який містить амінокислоти послідовності № 4; c) поліпептид, який містить амінокислоти послідовності № 7; d) поліпептид (а)-(с), який додатково містить сигнальну послідовність, за варіантом, якому віддається перевага, амінокислоти послідовності № 5; е) мутеїн будь-якого з поліпептидів (a)-(d), де амінокислотна послідовність має щонайменше 80% або 90% ідентичність із щонайменше однією з послідовностей від (а) до (с), причому цей мутеїн зв'язується з рецептором CXCR4; f) мутеїн будь-якого з поліпептидів (a)-(d), який кодується послідовністю ДНК, яка гібридизується з комплементом нативної послідовності ДНК, яка кодує будь-який з поліпептидів (а)-(с) за умов підвищеної жорсткості, причому цей мутеїн зв'язується з рецептором CXCR4; g) мутеїн будь-якого з поліпептидів (a)-(d), де всі зміни в амінокислотній послідовності є консервативними амінокислотними замінами в амінокислотних послідовностях будь-якого з поліпептидів (а)-(с); h) сіль або ізоформа, гібридний білок, функціональна похідна або активна фракція будьякого з поліпептидів (a)-(d), що зв'язується з рецептором CXCR4. 10. Застосування за п. 9, причому нуклеїновокислотна молекула додатково містить послідовність експресійного вектора. 11. Застосування за будь-яким із пп. 9-10 для генотерапії. 12. Застосування вектора для спричинення та/або посилення ендогенного продукування SDF-1 у клітині при виготовленні лікарського засобу для лікування та/або профілактики неврологічного захворювання, вибраного з групи, яку складають невропатія, демієлінізуюче захворювання периферичної нервової системи, периферична невропатія, первинний прогресуючий розсіяний склероз (MS), вторинний прогресуючий розсіяний склероз (MS), хронічний запальний розсіяний склероз, демієлінізуюча поліневропатія (CIDP) та синдром Гійєна-Барре (GBS), причому SDF-1 вибраний з групи, яку складають: a) поліпептид, який містить амінокислоти послідовності № 1; 96926 4 b) поліпептид (а), який додатково містить сигнальну послідовність, за варіантом, якому віддається перевага, амінокислоти послідовності № 5; c) мутеїн будь-якого з поліпептидів (a)-(b), де амінокислотна послідовність має щонайменше 80% або 90% ідентичність із послідовністю (а), причому цей мутеїн зв'язується з рецептором CXCR4; d) мутеїн будь-якого з поліпептидів (a)-(b), який кодується послідовністю ДНК, яка гібридизується з комплементом нативної послідовності ДНК, яка кодує поліпептид (а) за умов підвищеної жорсткості, причому цей мутеїн зв'язується з рецептором CXCR4; e) мутеїн будь-якого з поліпептидів (a)-(b), де всі зміни в амінокислотній послідовності є консервативними амінокислотними замінами в амінокислотних послідовностях поліпептиду (а). 13. Застосування за п. 12 для генотерапії. 14. Застосування клітини, яка зазнала генетичної модифікації, для продукування SDF-1 при виготовленні лікарського засобу для лікування та/або профілактики неврологічного захворювання, вибраного з групи, яку складають невропатія, демієлінізуюче захворювання периферичної нервової системи, периферична невропатія, первинний прогресуючий розсіяний склероз (MS), вторинний прогресуючий розсіяний склероз (MS), хронічний запальний розсіяний склероз, демієлінізуюча поліневропатія (CIDP) та синдром Гійєна-Барре (GBS), причому SDF-1 вибраний з групи, яку складають: a) поліпептид, який містить амінокислоти послідовності № 1; b) поліпептид, який містить амінокислоти послідовності № 4; c) поліпептид, який містить амінокислоти послідовності № 7; d) поліпептид (а)-(с), який додатково містить сигнальну послідовність, за варіантом, якому віддається перевага, амінокислоти послідовності № 5; е) мутеїн будь-якого з поліпептидів (a)-(d), де амінокислотна послідовність має щонайменше 80% або 90% ідентичність із щонайменше однією з послідовностей від (а) до (с), причому цей мутеїн зв'язується з рецептором CXCR4; f) мутеїн будь-якого з поліпептидів (a)-(d), який кодується послідовністю ДНК, яка гібридизується з комплементом нативної послідовності ДНК, яка кодує будь-який з поліпептидів (а)-(с) за умов підвищеної жорсткості, причому цей мутеїн зв'язується з рецептором CXCR4; g) мутеїн будь-якого з поліпептидів (a)-(d), де всі зміни в амінокислотній послідовності є консервативними амінокислотними замінами в амінокислотних послідовностях будь-якого з поліпептидів (а)-(с); h) сіль або ізоформа, гібридний білок, функціональна похідна або активна фракція будьякого з поліпептидів (a)-(d), що зв'язується з рецептором CXCR4. 15. Фармацевтична композиція, яка містить SDF-1 та інтерферон, факультативно разом з одним або декількома фармацевтично прийнятними напов 5 нювачами, для лікування та/або профілактики неврологічного захворювання, вибраного з групи, яку складають невропатія, демієлінізуюче захворювання периферичної нервової системи, периферична невропатія, первинний прогресуючий розсіяний склероз (MS), вторинний прогресуючий розсіяний склероз (MS), хронічний запальний розсіяний склероз, демієлінізуюча поліневропатія (CIDP) та синдром Гійєна-Барре (GBS), причому SDF-1 вибраний з групи, яку складають: a) поліпептид, який містить амінокислоти послідовності № 1; b) поліпептид, який містить амінокислоти послідовності № 4; c) поліпептид, який містить амінокислоти послідовності № 7; d) поліпептид (а)-(с), який додатково містить сигнальну послідовність, за варіантом, якому віддається перевага, амінокислоти послідовності № 5; е) мутеїн будь-якого з поліпептидів (a)-(d), де амінокислотна послідовність має щонайменше 80% або 90% ідентичність із щонайменше однією з послідовностей від (а) до (с), причому цей мутеїн зв'язується з рецептором CXCR4; f) мутеїн будь-якого з поліпептидів (a)-(d), який кодується послідовністю ДНК, яка гібридизується з комплементом нативної послідовності ДНК, яка кодує будь-який з поліпептидів (а)-(с) за умов підвищеної жорсткості, причому цей мутеїн зв'язується з рецептором CXCR4; g) мутеїн будь-якого з поліпептидів (a)-(d), де всі зміни в амінокислотній послідовності є консервативними амінокислотними замінами в амінокислотних послідовностях будь-якого з поліпептидів (а)-(с); h) сіль або ізоформа, гібридний білок, функціональна похідна або активна фракція будьякого з поліпептидів (a)-(d), що зв'язується з рецептором CXCR4. 16. Фармацевтична композиція, яка містить SDF-1 та остеопонтин, факультативно разом з одним або декількома фармацевтично прийнятними наповнювачами, для лікування та/або профілактики неврологічного захворювання, вибраного з групи, яку складають невропатія, демієлінізуюче захворювання периферичної нервової системи, периферична невропатія, первинний прогресуючий розсіяний склероз (MS), вторинний прогресуючий розсіяний склероз (MS), хронічний запальний розсіяний склероз, демієлінізуюча поліневропатія (CIDP) та синдром Гійєна-Барре (GBS), причому SDF-1 вибраний з групи, яку складають: a) поліпептид, який містить амінокислоти послідовності № 1; b) поліпептид, який містить амінокислоти послідовності № 4; c) поліпептид, який містить амінокислоти послідовності № 7; d) поліпептид (а)-(с), який додатково містить сигнальну послідовність, за варіантом, якому віддається перевага, амінокислоти послідовності № 5; 96926 6 е) мутеїн будь-якого з поліпептидів (a)-(d), де амінокислотна послідовність має щонайменше 80% або 90% ідентичність із щонайменше однією з послідовностей від (а) до (с), причому цей мутеїн зв'язується з рецептором CXCR4; f) мутеїн будь-якого з поліпептидів (a)-(d), який кодується послідовністю ДНК, яка гібридизується з комплементом нативної послідовності ДНК, яка кодує будь-який з поліпептидів (а)-(с) за умов підвищеної жорсткості, причому цей мутеїн зв'язується з рецептором CXCR4; g) мутеїн будь-якого з поліпептидів (a)-(d), де всі зміни в амінокислотній послідовності є консервативними амінокислотними замінами в амінокислотних послідовностях будь-якого з поліпептидів (а)-(с); h) сіль або ізоформа, гібридний білок, функціональна похідна або активна фракція будьякого з поліпептидів (a)-(d), що зв'язується з рецептором CXCR4. 17. Фармацевтична композиція, яка містить SDF-1 та кластерин, факультативно разом з одним або декількома фармацевтично прийнятними наповнювачами, для лікування та/або профілактики захворювання, вибраного з групи, яку складають невропатія, демієлінізуюче захворювання периферичної нервової системи, периферична невропатія, первинний прогресуючий розсіяний склероз (MS), вторинний прогресуючий розсіяний склероз (MS), хронічний запальний розсіяний склероз, демієлінізуюча поліневропатія (CIDP) та синдром Гійєна-Барре (GBS), причому SDF-1 вибраний з групи, яку складають: a) поліпептид, який містить амінокислоти послідовності № 1; b) поліпептид, який містить амінокислоти послідовності № 4; c) поліпептид, який містить амінокислоти послідовності № 7; d) поліпептид (а)-(с), який додатково містить сигнальну послідовність, за варіантом, якому віддається перевага, амінокислоти послідовності № 5; е) мутеїн будь-якого з поліпептидів (a)-(d), де амінокислотна послідовність має щонайменше 80% або 90% ідентичність із щонайменше однією з послідовностей від (а) до (с), причому цей мутеїн зв'язується з рецептором CXCR4; f) мутеїн будь-якого з поліпептидів (a)-(d), який кодується послідовністю ДНК, яка гібридизується з комплементом нативної послідовності ДНК, яка кодує будь-який з поліпептидів (а)-(с) за умов підвищеної жорсткості, причому цей мутеїн зв'язується з рецептором CXCR4; g) мутеїн будь-якого з поліпептидів (a)-(d), де всі зміни в амінокислотній послідовності є консервативними амінокислотними замінами в амінокислотних послідовностях будь-якого з поліпептидів (а)-(с); h) сіль або ізоформа, гібридний білок, функціональна похідна або активна фракція будьякого з поліпептидів (a)-(d), що зв'язується з рецептором CXCR4. 7 Цей винахід, взагалі, належить до галузі неврологічних захворювань, пов'язаних із запаленням нервових волокон. Конкретніше, цей винахід має відношення до застосування SDF-1 для виготовлення лікарського засобу для лікування та/або профілактики неврологічного захворювання. Передумови створення винаходу Неврологічні захворювання, пов'язані із запаленням нервових волокон Запалення нервових волокон є загальною відмітною ознакою більшості неврологічних захворювань. Багато подразників ініціюють запалення нервових волокон, яке може буде спричинене ураженням нервових клітин або олігодендрогліоцитів чи бути наслідком травми, пошкодження нервів центральної нервової системи або периферичних нервів чи вірусної або бактеріальної інфекції. Головними наслідками запалення нервових волокон є і) секреція різних запальних хемокінів астроцитами, гліальними макрофагами; та іі) рекрутинг додаткових лейкоцитів, які будуть додатково стимулювати астроцити або мікроглію. У разі хронічних нейродегенеративних захворювань, наприклад, розсіяного склерозу (MS), хвороби Альцгеймера (AD) або бічного аміотрофічного склерозу (ALS), присутність стійкого запалення нервових волокон, як гадають, приймає участь у прогресуванні захворювання. Неврологічні захворювання, пов'язані із запаленням нервових волокон, можуть називатись також неврологічними запальними захворюваннями. Хронічні нейродегенеративні захворювання У разі хронічних нейродегенеративних захворювань, патологія пов'язується із запальною реакцією. Нещодавно одержані наукові дані дозволяють зробити припущення про те, що системне запалення може вливати на місцеве запалення хворого головного мозку, наслідком чого є надмірний синтез запальних цитокінів та інших медіаторів у головному мозку, що, у свою чергу, може впливати на поведінку (Перрі (Perry), 2004). До числа хронічних нейродегенеративних захворювань належать, разом з іншими, розсіяний склероз (MS), хвороба Альцгеймера (AD), хвороба Паркінсона (PD), хорея Гентингтона (HD), бічний аміотрофічний склероз (ALS), множинна системна атрофія (MSA), пріонні захворювання і синдром Дауна. Хвороба Альцгеймера (AD) являє собою розлад, який включає погіршення розумової діяльності унаслідок змін у тканинах головного мозку. Згадані зміни включають зморщування тканин головного мозку, яке не спричинюється розладами кровоносних судин, первинну дегенеративну деменцію і дифузну атрофію головного мозку. Хворобу Альцгеймера називають також старечим слабоумством альцгеймерівського типу (SDAT). Значний обсяг наукових даних, які були одержані впродовж минулого десятиріччя, підтримує висновок, суть якого полягає у тому, що запалення нервових волокон пов'язується з патологією хвороби Альцгеймера (AD) (Таппо (Тuрро), та Аріас (Arias), 2005). Хвороба Паркінсона (PD) являє собою розлад головного мозку, який характеризується тремтін 96926 8 ням та труднощами, які виникають під час ходіння, здійснення рухів та їх координації. Згадана хвороба пов'язується з пошкодженням частини головного мозку, яка контролює рух м'язів. її називають також паркінсоновим тремором або тремтливим паралічем. Зростаючий обсяг даних, які одержують при проведенні дослідів на людях і тваринах, дозволив висунути припущення про те, що запалення нервових волокон є важливим вкладником до загибелі нейронів у разі хвороби Паркінсона (Гао (Gao) та інші, 2003). Хорея Гентингтона (HD) являє собою спадкове, автосомно-домінантне неврологічне запальне захворювання. Клінічні ознаки цього захворювання з'являються, як правило, не раніше п'ятого десятиріччя життя, і його проявами є психіатричні порушення, розлад мимовільних рухів та погіршення розумової діяльності, пов'язані з невблаганним розвитком захворювання до смерті, яка настає, як правило, через 17 років після його початку. Бічний аміотрофічний склероз (ALS) являє собою розлад, який спричинює прогресуючу втрату регуляції нервовою системою довільно скоротних м'язів внаслідок руйнування нервових клітин у головному та спинному мозку. Бічний аміотрофічний склероз, який називають також хворобою Лу Геріга, являє собою розлад, який включає втрату спроможності застосування та контролювання м'язів. Нерви, які контролюють ці м'язи, зморщуються і зникають, наслідком чого є втрата м'язової тканини унаслідок відсутності нервової стимуляції. Хоча головна причина бічного аміотрофічного склерозу залишається невідомою, ключову роль у перебігу цього захворювання може відігравати запалення нервових волокон (Консілвіо (Consilvio) та інші, 2004). Множинна системна атрофія (MSA) являє собою спорадичне нейродегенеративне захворювання невідомої етіології, на яке хворіють дорослі. Згаданий стан можна вважати виключним серед хронічних нейродегенеративних захворювань завдяки провідній, якщо не головній, ролі, яку у патогенетичному процесі відіграють олігодендрогліоцити. Дані підтверджують роль генів, які мають відношення до запалення, у ризику виникнення бічного аміотрофічного склерозу (Інфант (Infante) та інші, 2005). Головна відмінність від хвороби Паркінсона полягає у тому, що хворі на бічний аміотрофічний склероз не реагують на лікування LДОФА. Розсіяний склероз (MS) являє собою запальне демієлінізуюче захворювання центральної нервової системи (ЦНС), яке набуває рецидивноремітуючого або прогресуючого перебігу. Розсіяний склероз не є єдиним демієлінізуючим захворюванням. Аналогом цього захворювання у периферичній нервовій системі (PNS) є хронічна запальна демієлінізуюча полірадикулоневропатія (CIDP). На додаток до цього, існують гострі монофазні розлади, наприклад, запальна демієлінізуюча полірадикулоневропатія, яку називають синдромом Гійєна-Барре (GBS), у периферичній нервовій системі, та гострий розсіяний енцефаломієліт (ADEM) у центральній нервовій системі. Як 9 розсіяний склероз, так і синдром Гійєна-Барре є гетерогенними синдромами. У разі розсіяного склерозу, унаслідок різноманітних зовнішніх причин разом із генетичними факторами, захворювання може набувати такого перебігу, яке, зрештою, задовольняє діагностичні критерії. У разі обох захворювань, пошкодження аксонів може додаватись до первинної демієлінізації і спричинювати постійні неврологічні розлади. Розсіяний склероз являє собою автоімунний розлад, у разі якого лейкоцити імунної системи чинять руйнівний вплив на білу речовину центральної нервової системи (ЦНС). Залучатись може також і сіра речовина. Незважаючи на те, що точна етіологія розсіяного склерозу є невідомою, сприятливі фактори можуть включати генетичну, бактеріальну та вірусну інфекцію. У разі свого класичного прояву (85% усіх випадків), розсіяний склероз характеризується переміжними рецидивно-ремітивними стадіями, які відповідають періодам порушення функціонування нервової системи, тривалість яких становить декілька тижнів, із подальшим значним або повним видужанням (Ноузворті (Noseworthy), 1999). Періоди ремісії із часом скорочуються. Після цього у багатьох хворих розпочинається кінцева стадія захворювання, яка характеризується поступовим зникненням функціонування нервової системи із частковим одужанням або без одужання. Цю стадію називають вторинним прогресуючим розсіяним склерозом. У невеликої частини (~15% усіх хворих на розсіяний склероз) спостерігається поступове і безперервне погіршення функціонування нервової системи з подальшим започаткуванням захворювання (первинний прогресуючий розсіяний склероз). Було показано, що пріонні захворювання і синдром Дауна також включають запалення нервових волокон (Ейкеленбум (Eikelenboom) та інші, 2002; Хантер (Hunter) та інші, 2004). Неврологічні запальні захворювання після інфекції Деякі невропатії, такі, наприклад, як гострий розсіяний енцефаломієліт, виникають, як правило, після вірусної інфекції або вакцинації вірусною вакциною (або, дуже рідко, вакцинації бактеріальною вакциною), що дозволяє припустити імунологічну причину згаданого захворювання. Гострі запальні периферичні невропатії, які виникають після вакцинації вірусною вакциною або синдрому Гійєна-Барре, є подібними демієлінізуючими розладами з однаковим гаданим імунопатогенезом, але вони уражають лише периферичні структури. Мієлопатія, пов'язана з вірусом людського Тклітинного лейкозу (HTLV), це повільно прогресуюче захворювання спинного мозку, пов'язане з інфікуванням людським Т-клітинним лімфотрофним вірусом, характеризується спастичною слабкістю обох ніг. Інфекції центральної нервової системи є надзвичайно серйозними інфекціями; менінгіт уражає оболонки, які оточують головний мозок, а енцефаліт спинного мозку уражує сам головний мозок. До числа вірусів, які інфікують центральну нервову систему (головний і спинний мозок) належать герпесвіруси, арбовіруси, віруси Коксакі, віруси ECHO 96926 10 та ентеровіруси. Деякі із цих інфекцій уражають, головним чином, м'які мозкові оболонки (тканини, які вкривають головний мозок), унаслідок чого виникає менінгіт; інші переважно уражають головний мозок, унаслідок чого виникає енцефаліт; багато з них уражають як м'які мозкові оболонки, так і головний мозок, наслідком чого є менінгоенцефаліт. Менінгіт є набагато поширенішим у дітей, аніж енцефаліт. Віруси уражають центральну нервову систему двома шляхами. Вони безпосередньо інфікують і знищують клітини під час гострого захворювання. Після видужання від інфекції, імунна реакція організму на згадану інфекцію подеколи спричинює вторинне пошкодження клітин, які знаходяться довкола нервів. Унаслідок цього вторинного пошкодження (постінфекційний енцефаломієліт) симптоми у дитини зберігаються впродовж декількох тижнів після одужання від гострого захворювання. Неврологічні захворювання після ушкоджень Ушкодження ЦНС, спричинені гострими ураженнями, у тому числі травмою, гіпоксією та ішемією, можуть впливати як на сіру, так і на білу речовину. Ушкодження ЦНС включає запалення нервових волокон. Наприклад, інфільтрація лейкоцитів до ЦНС після травми або запалення частково ініціюється активацією хемокіну МСР-1 (білок хемоатракції моноцитів) у астроцитах (Паненка (Panenka) та інші, 2001). Травма є ураженням або пошкодженням нерва. Це може бути травма спинного мозку, яка являє собою ушкодження спинного мозку, яке впливає на усі нервові функції, які контролюються на рівні і нижче рівня ушкодження, у тому числі регуляцію функціонування і чутливості м'язів, або мозкова травма, наприклад, травма, спричинена закритою травмою черепа. Гіпоксія півкуль головного мозку являє собою нестачу кисню, конкретно, для півкуль головного мозку, а більш типово цей термін вживають для означення нестачі кисню для головного мозку у цілому. У залежності від тяжкості гіпоксії, симптоми можуть коливатись у межах від сплутаності свідомості до незворотного ушкодження головного мозку, коматозного стану і смерті. Причиною інсульту є, як правило, зменшення кровопостачання (ішемія) головного мозку. Інсульт називають також хворобою судин головного мозку. Це група розладів головного мозку, які включають припинення функціонування головного мозку, яке відбувається у разі припинення кровопостачання до будь-якої частини головного мозку. Головний мозок потребує приблизно 20% крові, яка циркулює у організмі. Основне постачання головного мозку кров'ю здійснюється через 2 шийні артерії (сонні артерії), які у подальшому розгалужуються у межах головного мозку на численні артерії, кожна з яких постачає кров до конкретної ділянки головного мозку. Навіть короткочасне припинення кровотоку може викликати погіршення функціонування головного мозку (неврологічний розлад). Симптоми різняться у залежності від ураженої ділянки головного мозку і, як правило, включають такі проблеми, як зміни зору, зміни речі, погіршення рухів або чутливості частини тіла чи зміни рівня 11 свідомості. Якщо припинення кровотоку триває довше декількох секунд, клітини головного мозку на цій ділянці руйнуються (відмирають) зі спричиненням постійного пошкодження на цій ділянці головного мозку або навіть смерті. Травматичне ушкодження нервів може стосуватись як центральної, так і периферичної нервової системи. Травматичне ушкодження головного мозку, яке просто називають ушкодженням голови або закритою травмою черепу, означає травму з ушкодженням головного мозку унаслідок зовнішнього удару по голові. Це трапляється, головним чином, під час автомобільних аварій або нещасних випадків із велосипедистами, але може відбуватись також унаслідок короткочасного утоплення, серцевого нападу, інсульту та інфекцій. Травматичне ушкодження головного мозку цього типу є, як правило, наслідком нестачі кисню або браку кровопостачання головного мозку і, унаслідок цього, може називатись "ушкодженням від аноксії". Ушкодження головного мозку або закрита травма черепу трапляється у разі удару по голові, наприклад, у разі дорожньо-транспортної пригоди або падіння. Негайно після травми може спостерігатись непритомний стан, тривалість якого може становити хвилини, тижні або місяці. Головне ушкодження головного мозку відбувається під час травми, головним чином, на місцях удару, зокрема, у разі присутності перелому черепа. Значні контузії можуть пов'язуватись із внутрішньомозковим крововиливом або супроводжуватись розривами кори головного мозку. Розсіяні пошкодження аксонів виникають унаслідок зсувних зусиль і відносного подовження нейронних відростків, які спричинюються ротаційними рухами головного мозку усередині черепу. Можуть спостерігатись ураження унаслідок крововиливів або розсіяні ушкодження аксонів, які можуть виявлятись лише у разі мікроскопічного дослідження. Вторинні ушкодження головного мозку з'являються унаслідок ускладнень, які розвиваються після моменту травмування. До їх числа належить внутрішньочерепний крововилив, травматичне ушкодження екстрацеребральних артерій, утворення черепної грижі, ушкодження головного мозку унаслідок гіпоксії або менінгіт. Травмами спинного мозку пояснюється більшість випадків госпіталізації з приводу параплегії та тетраплегії. Більше 80% з них є наслідком дорожньо-транспортного травматизму. Клінічно визнаними є травми двох головних груп: відкриті травми та закриті травми. Відкриті травми є причиною безпосереднього ушкодження спинного мозку та нервових корінців. Наскрізні травми можуть спричинювати широкі розриви і кровотечу. Закритими травмами пояснюється більшість ушкоджень спинного мозку, і вони, як правило, пов'язуються з переломами/зміщеннями хребетного стовпа, що, як правило, демонструється рентгенологічним шляхом. Ушкодження спинного мозку залежить від ступеня ушкодження кісток і може розглядатись на двох головних стадіях: первинне ушкодження, яким є контузії, розсікання нервового волокна і геморагічний некроз, і вторинне 96926 12 ушкодження, яким є екстрадуральна гематома, відмирання, інфекція і набряк. Травма є найпоширенішою причиною локалізованого ушкодження одиночного нерва. Інтенсивна м'язова діяльність або примусове надмірне розтягнення суглобу може викликати вогнищеву невропатію, як і повторні невеликі травми (наприклад, щільне стискання невеликих знарядь, надмірна вібрація пневматичних відбійних молотків). Параліч від здавлення нерва, як правило, уражає поверхневі нерви (ліктьовий, променевий, перонеальний) на виступах кісток (наприклад, під час глибокого сну або під час анестезії у худих або виснажених людей і, часто, у алкоголіків) або у вузьких каналах (наприклад, у разі синдрому каналу зап'ястя). Параліч від здавлення нерва може також бути наслідком пухлин, кісткового гіперостозу, гіпсових пов'язок (шин), милиць або тривалого знаходження у незручній позі (наприклад, під час садового-городніх робіт). Травматичні пошкодження можуть також траплятись під час хірургічних процедур. Периферична невропатія Периферична невропатія є синдромом втрати чутливості, слабкості та атрофії м'язів, ослаблення глибоких сухожильних рефлексів і вазомоторних симптомів, самостійно або у будь-якій комбінації. Периферична невропатія пов'язується з дегенерацією аксонів, із процесом, який називають також валлерівським переродженням. Запалення нервових волокон відіграє роль у валлерівському переродженні (Штолль (Stoll) та інші, 2002). Згадане захворювання може уражати одиночний нерв (мононевропатія), два або декілька нервів на окремих ділянках (множинна мононевропатія) або багато нервів одночасно (поліневропатія). Уражатись може, головним чином, аксон (наприклад, у разі цукрового діабету, хвороби Ліма, уремії або токсичними агентами) або мієлінова оболонка чи шванівська клітина (наприклад, у разі гострої або хронічної запальної поліневропатії, лейкодистрофій або синдрому Гійєна-Барре). Наслідком ушкодження немієлінізованих та мієлінізованих волокон є, головним чином, втрата відчуття температури і болю; наслідком ушкодження великих мієлінізованих волокон є порушення рухової активності або пропріоцепції. Деякі невропатії (наприклад, спричинені токсичністю свинцю, застосуванням дапсону, хворобою Ліма (яка викликається укусом кліща), порфірією або синдромом ГійєнаБарре) уражають, головним чином, рухові нервові волокна, інші (наприклад, спричинені раковими гангліонітами задніх корінців спинного мозку, проказою, СНІД, цукровим діабетом або хронічною інтоксикацією піридоксином) уражають, головним чином, ганглії задніх корінців спинного мозку або сенсорні нервові волокна з наслідковими сенсорними симптомами. Подеколи залучаються також черепні нерви (наприклад, у разі синдрому ГійєнаБарре, хвороби Ліма, цукрового діабету і дифтерії). Встановлення залучених способів впливу допомагає визначити причину. Множинна мононевропатія є, як правило, вторинною відносно дифузної хвороби сполучної тканини судин (наприклад, нодозний поліартеріїт, 13 системний червоний вовчак, синдром ГужероШегрена, ревматоїдний артрит), саркоїдозу, хвороб обміну речовин (наприклад, діабет, амілоїдоз) або інфекційних захворювань (наприклад, хвороба Ліма, ВІЛ-інфекція). Мікроорганізми можуть викликати множинну мононевропатію шляхом прямого проникнення до нерва (наприклад, у разі прокази). Поліневропатія, спричинена гострими лихоманковими захворюваннями, може бути наслідком дії токсину (наприклад, у разі дифтерії) або автоімунної реакції (наприклад, у разі синдрому ГійєнаБарре); поліневропатія, яка іноді виникає після імунізації, ймовірно, також є автоімунною. Токсичні агенти, як правило, викликають поліневропатію, але подеколи мононевропатію. До їх числа належить еметин, гексобарбітал, барбітал, хлорбутанол, сульфонаміди, фенітоїн, нітрофурантоїн, алкалоїди барвинку, важкі метали, монооксид вуглецю, триортокрезилфосфат, ортодинітрофенол, багато розчинників, інші промислові отрути і певні лікарські засоби проти СНІД (наприклад, зальцитабін, діданозин). Невропатія, спричинена хіміотерапевтичними засобами, є явно вираженим і серйозним побічним ефектом декількох широко застосовуваних хіміотерапевтичних засобів, у тому числі алкалоїдів барвинку (вінбластин, вінкристин та віндезин), платиновмісних лікарських засобів (цисплатин) та таксанів (паклітаксел). Спричинення периферичної невропатії є поширеним фактором обмеження лікування із застосуванням хіміотерапевтичних лікарських засобів. Поліневропатія може бути наслідком дефіцитів поживних речовин та розладів обміну речовин. Причиною часто є В-вітамінна недостатність (наприклад, у разі алкоголізму, бері-бері, злоякісної анемії, дефіциту піридоксину, спричиненого ізоніазидом, синдрому мальабсорбції і невтримного блювання вагітних). Поліневропатія також спостерігається у разі гіпотиреозу, порфірії, саркоїдозу, амілоїдозу і уремії. Цукровий діабет може спричинити поліневропатію дистальних сенсорно-рухових нервів (найпоширенішу), множинну мононевропатію і вогнищеву мононевропатію (наприклад, окорухових або відвідних черепних нервів). Поліневропатія унаслідок розладів обміну речовин (наприклад, цукровий діабет) або ниркової недостатності розвивається повільно, часто впродовж місяців або років. Вона часто розпочинається сенсорними порушеннями у нижніх кінцівках, які є часто більш тяжкими на дистальних, аніж на проксимальних сегментах кінцівок. Часто найбільш вираженим є відчуття поколювання на периферичних ділянках, оніміння, пекучий біль або порушення суглобової пропріоцепції і відчуття вібрації. Біль часто погіршується у нічний час і може загострюватись у разі торкання ураженої ділянки або змінами температури. У тяжких випадках, існують об'єктивні ознаки втрати чутливості, як правило, з локалізацією на кінцевих ділянках кінцівок. Рефлекс п'яткового сухожилля та інші глибокі сухожильні рефлекси є ослабленими або відсутніми. У разі глибокої втрати чутливості можуть розвиватись безболісні виразки або суглоби Шарко. Сенсорні або пропріоцептивні розлади можуть викли 96926 14 кати порушення ходи. Наслідком залучення рухових нервових волокон може бути слабкість і атрофія дистальних м'язів. Додатково або вибірно може залучатись вегетативна нервова система, наслідком чого є нічна діарея, нетримання сечі або калу, імпотенція або ортостатична гіпотензія. Вазомоторні симптоми різняться. Шкіра може бути блідшою і сухішою за нормальну, подеколи зі зміною забарвлення на смагляве; потовиділення може бути надмірним. У тяжких, тривалих випадках поширеними є трофічні зміни (гладенька і блискуча шкіра, нігті із заглибленнями або виступами, остеопороз). Трофічна поліневропатія є звичайним явищем серед алкоголіків та людей з порушенням або недостатністю харчування. Первинна аксонопатія може привести до вторинної демієлінізації і руйнування аксонів найдовших і найбільших нервів. Невідомо, чи є причиною недостатність тіаміну або іншого вітаміну (наприклад, піридоксину, пантотенової кислоти, фолієвої кислоти). Невропатія унаслідок піридоксинової недостатності спостерігається, як правило, лише у людей, які приймають ізоніазид із приводу туберкульозу; у дітей із недостатністю або залежністю від піридоксину можуть траплятись конвульсії. Виснаження і симетрична слабкість дистальних кінцівок розвивається, як правило, поступово, однак може швидко прогресувати, подеколи супроводжувана втратою чутливості, парестезією і болем. Тривалий, тупий біль, судоми, відчуття холоду, печії і оніміння у литках і стопах можуть погіршуватись у разі дотику. У разі невизначеної етіології можуть застосовуватись численні вітаміни, але вони не чинять доведеної сприятливої дії. Спадкові невропатії підрозділяються на сенсорно-рухові невропатії або сенсорні невропатії. Хвороба Шарко-Марі-Тута є найпоширенішою спадковою сенсорно-руховою невропатією. Менш поширені сенсорно-рухові невропатії розпочинаються при народженні і є причиною більш тяжкої інвалідності. У разі сенсорних невропатій, які є рідким явищем, втрата відчуття периферичного болю і температури є більш вираженою, аніж втрата відчуття вібрації і положення. Головною проблемою є каліцтва ступні унаслідок нечутливості до болю, з частими інфекціями і остеомієлітом. До числа спадкових невропатій належать також гіпертрофічна інтерстиціальна невропатія і синдром Дежеріна. Злоякісне новоутворення може також спричинити поліневропатію через моноклональну гаммапатію (множинна мієлома, лімфома), проникнення амілоїду або трофічні недостатності чи у формі паранеопластичного синдрому. Незважаючи на різну етіологію, наприклад, інфекційні патогени або автоімунні реакції, наслідком усіх неврологічних запальних захворювань є втрата неврологічних функцій і вони можуть привести до паралічу і смерті. Хоча для деяких неврологічних запальних захворювань є доступними нечисленні терапевтичні засоби, які ослаблюють запальні реакції, існує необхідність у розробці нових лікарських засобів, результатом застосування 15 яких могло б бути відновлення неврологічних функцій. SDF-1 (стромальний фактор-1) Хемокіни (хемотактичні цитокіни) утворюють надродину невеликих (8-10 кДа) цитокінів, які активують сім трансмембранних, зв'язаних з Gбілком рецепторів, залучених як до основної спрямованої міграції, так і до запальних реакцій, і відіграють роль, головним чином, хемоатрактантів і активаторів лейкоцитів. Стромальний фактор 1α, SDF-1α, та 2 його ізоформи (β,γ) представляють собою невеликі хемотактичні цитокіни, що належать до родини інтеркринів, члени якої активують лейкоцити і часто спричинюються передзапальними подразниками, наприклад, ліпополісахаридом, TNF (фактор некрозу пухлин) або IL-1 (інтерлейкін-1). Інтеркрини характеризуються присутністю 4 консервативних залишків цистеїну, які утворюють 2 дисульфідні зв'язки. їх можна підрозділити на 2 підродини. У підродини СС, яка включає бета-хемокін, залишки цистеїну є взаємоприлеглими. У підродини СХС, яка включає альфа-хемокін, вони відокремлені проміжною амінокислотою. Білки SDF-1 належать до останньої згаданої групи. SDF-1 є природним лігандом CXCR4 (LESTR/фузин) хемокінного рецептора. Альфа, бета і гамма ізоформи є наслідком альтернативного сплайсингу одного гена. Альфа-форма є похідною екзонів 1-3, у той час як бета-форма містить додаткову послідовність з екзону 4. Перші три екзони SDF-1γ є ідентичними екзонам SDF-1α та SDF-1β. Четвертий екзон SDF1γ розміщується через 3200 п.н. у 5'-3'-напрямку від третього екзону на локусі SDF-1 і знаходиться між третім і четвертим екзонами SDF-1β. Нещодавно були описані три нові ізоформи SDF-1, SDF-1 дельта, SDF-1 епсилон та SDF-1 фі (Ю (Yu) та інші, 2006). Ізоформа SDF-1δ є альтернативно сплайсованою на останньому кодоні відкритої рамки зчитування SDF-1α, результатом чого є одержання інтрону довжиною 731 п.н., де кінцевий екзон SDF-1α є розщепленим на дві частини. Перші три екзони SDF-1ε та SDF-1 є на 100% ідентичними екзонам ізоформ SDF-1β та SDF-1γ. Ген SDF-1 експресується повсюдно, за виключенням клітин крові; він чинить in vitro дію на лімфоцити і моноцити, але не на нейтрофіли, і є високоактивним хемоатрактантом для мононуклеарів in vivo. In vitro та in vivo SDF також відіграє роль хемоатрактанту для людських гемопоетичних клітин-попередників, що експресують CD34. SDF-1 та його рецептор CXCR4 відіграють важливу роль у системі кровотворення і нервовій системі, оскільки видалення ліганду або рецептора є смертельним для зародка унаслідок аномального розвитку ЦНС (Ма (Ма) та інші, 1998; Зу (Zou) та інші, 1998). SDF-1α, завдяки взаємодії із своїм рецептором CXCR4, може безпосередньо спричинювати загибель клітин шляхом апоптозу у людській нейронній клітинній лінії hNT, які нагадують незрілі постмітотичні холінергічні нейрони і мають ряд нейронних характеристик (Хессельгессер (Hesselgesser) та інші, 1998). 96926 16 Роль SDF-1 у розвитку і визріванні центральної нервової системи розглядається у роботі Лазаріні та інших (Лазаріні (Lazarini) та інші, 2003). Хемокіни безсумнівно залучені до запалення нервових волокон у ЦНС, але до числа їх активностей долучається також їхній вплив як біологічно важливих пептидів безпосередньо на нейроепітеліальні клітини (у тому числі нейрони, астроцити і олігодендроцити). Зокрема, хемокіни впливають на проліферацію попередників олігодендроцитів (OLP), що ілюструється GRO-α/CXCL1 (Робінсон (Robinson) та інші, 1998), на структуру тканинних базофільних гранулоцитів мозочка, у разі SDF-1α (Жу (Zhu) та інші, 2002) та активаційні стани мікроглії, прикладом чого є фракталкін/СХ3СL1 (Зуйовіч (Zujovic) та інші, 2000), окрім усього іншого. Таким чином, як у імунній, так і у нервовій системах, хемокіни можуть здійснювати цілий ряд подібних дій, у тому числі регуляцію проліферації, міграції, активації та диференціації. Багато хемокінів та рецепторів хемокінів експресуються у ЦНС конститутивним шляхом або стимулюються медіаторами запалення. Вони залучені до багатьох нейропатологічних процесів, у тому числі розсіяного склерозу (MS) (Байєтто (Bajetto) та інші, 2001; Соренсен (Sorensen) та інші, 2002). Було показано, що експресія SDF-1 у ендотеліальних клітинах головного мозку сприяє рекрутингу імунокомпетентних клітин до ішемічної ЦНС (Стамм (Stumm) та інші, 2002), що дозволяє припустити шкідливу роль SDF-1 у запаленні нервових волокон. У контексті деменції унаслідок СНІД, було описано, що SDF-1 стимулює нейротоксичність шляхом стимулювання продукування TNFα активованою мікроглією та виділення глутамату астроцитами у in vitro моделі запалення нервових волокон, спричиненого gp120 (Бецці (Bezzi) та інші, 2001; Соренсен (Sorensen) та інші, 2002). Нещодавня публікація описує експресію SDF-1α у астроцитах уражень, спричинених розсіяним склерозом (Амброзіні (Ambrosini) та інші, 2005). Спричинення експериментального алергічного енцефаломієліту (ЕАЕ) у пацюків супроводжувалась підвищеними рівнями різних рецепторів хемокінів, у тому числі CXCR4 (Жанг (Jiang) та інші, 1998). У WO 00/09152 говориться про те, що антагоністи CXCR4 є придатними для лікування автоімунного захворювання, лікування розсіяного склерозу, лікування раку та пригнічення ангіогенезу. WO 99/50461 розкриває способи лікування розладів, які включають проліферацію клітин, що відхиляється від норми або недостатню проліферацію шляхом введення сполук, які стимулюють або пригнічують активність CXCR4. Були заявлені інгібітори функції CXCR4 для лікування раків і було заявлено застосування агоністів згаданого рецептора для лікування розладів, у разі яких проліферація є недостатньою або бажаною. До числа розладів, у разі яких проліферація клітин є недостатньою, належать демієлінізуючі ураження нервової системи, унаслідок яких частина нервової системи знищується або пошкоджується демієлінізуючим захворюванням, у тому числі, напри 17 клад, розсіяним склерозом та ураженнями периферичної нервової системи. Було запропоновано також терапевтичне застосування антагоністів CXCR4/SDF-1 при неврологічних захворюваннях. У ЕР657468В1 пропонується застосування SDF-1 для лікування захворювань, пов'язаних із недостатньою або такою, що відхиляється від норми, проліферацією гемопоетичних клітин, стимулюванням або пригніченням нервових клітин, профілактикою або лікуванням пошкодження нервових клітин. У WO 03/062273 описують інгібітор шляхів передачі сигналу SDF-1 для лікування запалення. Розкриті варіанти терапевтичного застосування включають запалення, пов'язане з автоімунними захворюваннями, станами або розладами, де сприятливу роль зіграло б пригнічення імунної реакції та/або запалення у ЦНС або будь-якому іншому органі, наприклад, у разі хронічної невропатії або синдрому Гійєна-Барре. Глейхманн (Gleichmann) та інші повідомляють про незначне тимчасове підвищення експресії мРНК SDF-1-бета після ураження периферичних нервів. Вони дійшли висновку, що їхні дані вперше демонструють картину диференційної експресії ізоформ SDF-1 при різних фізіологічних станах, таких, наприклад, як розвиток і пошкодження нервової системи (Глайхманн (Gleichmann) та інші, 2000). SDF-1 може взаємодіяти з глікозаміногліканами (GAG), високоваріабельними розгалуженими цукровими групами, які додаються посттрансляційно до декількох білків, які у межах сполук цього самого роду називають протеогліканами (PG). Такі білки присутні на клітинній мембрані, у позаклітинному матриксі та у кровотоці, де можуть також бути присутні виділені GAG. Протеоглікани (PG), або виділені GAG, можуть утворювати комплексні сполуки з розчинними молекулами, можливо, для захисту цих молекул від протеолізу у позаклітинному середовищі. Було також висунуто припущення про те, що GAG можуть допомагати правильній презентації клітинних сигнальних молекул їх специфічному рецептору і, можливо, також модулюванню активації клітин-мішеней. У разі хемокінів, концентрація у іммобілізованих градієнтах на місці запалення і, у подальшому, взаємодія з клітинними рецепторами та стан їх активації, як видається, модулюються різними формами GAG (Хугеверф (Hoogewerf) та інші, 1997). Таким чином, було висунуто припущення, що модуляція таких взаємодій може являти собою терапевтичний підхід у разі запального захворювання (Шварц (Schwarz), Уеллс (Wells), 1999). Модифікований SDF-1α, SDF-1 3/6, одержали шляхом комбінованої заміни основного кластеру залишків Lys24, His25 та Lys27 на Ser (Амара (Amara) та інші, 1999). Цей мутант був нездатним до зв'язування сульфату гепарину, однак зберіг здатність до зв'язування та активації CXCR4. У іншому експерименті досліджували ефект одиночних мутацій у тому самому домені та визначали характеристики комплексу SDF-1α/гепарин (Садір (Sadir) та інші, 2001). Садір (Sadir) та інші припус 96926 18 тили також залучення залишків Arg41 та Lys43 до зв'язування глікозаміногліканів. Суть винаходу Мета цього винаходу полягає у наданні нових засобів для лікування та/або профілактики неврологічного захворювання. У рамках цього винаходу було встановлено, що введення SDF-1α, Met-SDF-1α або варіанта SDF-1α сприятливо впливає на in vivo тваринну модель периферичних неврологічних захворювань. Було показано також, що SDF-1α та його варіанти пригнічують TNF-α та IL-6 у тваринній моделі з індукованим ліпополісахаридом (LPS) виділенням TNF-α, яка являє собою модель запалення. Таким чином, експериментальні дані, наведені у цьому описі, надають нову можливість лікування неврологічних захворювань, зокрема, захворювань, пов'язаних із функціонуванням нервових і нейрогліальних клітин та запаленням нервових волокон. Таким чином, цей винахід має відношення до застосування SDF-1 або агоніста активності SDF-1 для виготовлення лікарського засобу для лікування та/або профілактики неврологічного захворювання. За цим винаходом, SDF-1 може також застосовуватись у комбінації з інтерфероном або остеопонтином чи кластерином для лікування та/або профілактики неврологічних захворювань. Цим винаходом передбачається також застосування нуклеїновокислотних молекул, експресійних векторів, що містять SDF-1 та клітин, що експресують SDF-1 для лікування та/або профілактики неврологічного захворювання. Цей винахід додатково пропонує фармацевтичні композиції, які містять SDF-1 та інтерферон або остеопонтин чи кластерін, факультативно разом з одним або декількома фармацевтично прийнятними наповнювачами. Стислий опис фігур На Фіг. 1 показано вміст TNF-α та IL-6 у пг/мл змішаних кортикальних культур, попередньо інкубованих на 14 день культивування клітин з 0,001 нг/мл, 0,1 нг/мл та 10 нг/мл SDF-1α (Фіг. 1.А) або варіанта SDF-1α (Фіг. 1.В) впродовж 3 год при температурі 37°С із подальшим доповненням 5 нг/мл LPS впродовж 48 год. Супернатанти збирали на 16 день, і рівні TNF-α та IL-6 визначали за допомогою специфічних ELISA (твердофазний імуноферментний аналіз). Як позитивні контролі, культури обробляли 25 пМ дексаметазону (Dexa), 10 нг/мл IL-10 або обробці не піддавали. Як негативний контроль, культури обробляли лише LPS. На Фіг. 2 показано середню загальну кількість 6 клітин ×10 ±s.e. (середня квадратична помилка), рекрутованих до очеревинної порожнини через 4 год після внутрішньоочеревинного введення 200 мкл розчину NaCl (0,9%, без LPS; вихідний рівень) або 4 мкг розчину SDF-1α або варіанта SDF-1α, розбавленого 200 мкл розчину NaCl (0,9%, без LPS). На Фіг. 3 показано вміст SDF-1α у пікограмах на мікрограм загального білка (пг/мг) екстрактів спинного мозку мишей, уражених ЕАЕ (хронічна 19 стадія), порівняно з мишами, яких обробці не піддавали (контроль). На Фіг. 4 показано реєстрацію електрофізіологічних показників мишей після роздавлювання сідничого нерва, яким вводили розчинник (фізіологічний розчин/0,02% розчин BSA (бичачий сироватковий альбумін)), 3 мкг/кг, 10 мкг/кг, 30 мкг/кг або 100 мкг/кг (підшкірно) SDF-1α та 30 мкг/кг еталонної (позитивної) контрольної сполуки (IL-6). Вихідний рівень: значення, зареєстровані на протилежному боці тварин, яким вводили розчинник. Реєстрацію здійснювали на 7 день, 15 день і 22 день після пошкодження (dpl). Фіг. 4.А показує амплітуду у мілівольтах (мВ) складного потенціалу дії м'яза. Фіг. 4.В показує латентність у мілісекундах (мс) складного потенціалу дії м'яза. На Фіг. 5 показано реєстрацію електрофізіологічних показників мишей після роздавлювання сідничого нерва, яким вводили розчинник (фізіологічний розчин/0,02% розчин BSA) або 30 мкг/кг (підшкірно) варіанта SDF-1α. Вихідний рівень: значення, зареєстровані на протилежному боці тварин, яким вводили розчинник. Реєстрацію здійснювали на 7 день і 22 день після пошкодження (dpl). Фіг. 5.А показує амплітуду у мілівольтах (мВ) складного потенціалу дії м'яза. Фіг. 5.В показує латентність у мілісекундах (мс) складного потенціалу дії м'яза. Фіг. 5.С показує тривалість у мілісекундах (мс) складного потенціалу дії м'яза. На Фіг. 6 показано реєстрацію електрофізіологічних показників мишей після роздавлювання сідничого нерва, яким вводили розчинник (фізіологічний розчин/0,02% розчин BSA) або 100 мкг/кг, 30 мкг/кг, 10 мкг/кг (підшкірно) Met-SDF-1α. Вихідний рівень: значення, зареєстровані на протилежному боці тварин, яким вводили розчинник. Реєстрацію здійснювали на 7 день і 14 день після пошкодження (dpl). Фіг. 6.А зображає латентність у мілісекундах (мс) складного потенціалу дії м'яза. На Фіг. 7 зображені результати введення 100 мкг/кг, 30 мкг/кг, 10 мкг/кг (підшкірно) SDF-1α тваринній стрептозотоциновій моделі діабетичної невропатії (STZ). Позитивною контрольною молекулою є IL-6 у дозі 10 мкг/кг підшкірно. Фіг. 7.А показує результати визначення маси тіла, яке здійснювали розпочинаючи з 11 дня до 40 дня. Фіг. 7.В показує рівні глікемії на 7 день після введення STZ. Фіг. 7.С показує латентність складного потенціалу дії м'яза, яку визначали на 24 день і 40 день після введення STZ. Фіг. 7.D показує ефект SDF-1α на швидкість провідності чутливого нерва. Фіг. 7.Ε показує відносну товщину мієліну на 40 день після введення STZ з/без введення SDF1α, яка виражається у вигляді відношення діаметр аксону/діаметр волокна. Фіг. 7.F показує кількість дегенерованих волокон сідничого нерва на 40 день після введення STZ. 96926 20 Фіг. 7.G показує густину інтраепідермальних нервових волокон на 40 день після введення STZ. На Фіг. 8 показані результати введення 100 мкг/кг, 30 мкг/кг, 10 мкг/кг (підшкірно) SDF-1α на показники механічної та термічної алодинії на стрептозотоциновій моделі діабетичної невропатії (STZ). Фіг. 8.А показує пороговий тиск, який визначали за допомогою випробування з волоконцями фон Фрея на 20 день після введення STZ. Фіг. 8.В показує результати визначення латентності за допомогою випробування на гарячій пластині при температурі 52°С на 40 день після введення STZ. На Фіг. 9 показана частота несправжніх виявлень, яка оцінювалась за кривою: сукупність італійців, хворих на первинний прогресуючий розсіяний склероз/кількість позитивних маркерів R при R
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of sdf-1 for the treatment and/or prevention of neurological diseases
Автори англійськоюBoschert Ursula, Proudfoot Amanda, Kadi Linda, Vitte Pierre Alain, Wojcik Jerome
Назва патенту російськоюПрименение sdf-1 для лечения и/или профилактики неврологических заболеваний
Автори російськоюБошерт Урсула, Праудфут Аманда, Кади Линда, Витт Пьер Ален, Вожсик Жером
МПК / Мітки
МПК: A61K 38/16, A61P 25/28, A61K 38/19, A61K 38/21
Мітки: захворювань, sdf-1, профілактики, лікування, застосування, неврологічних
Код посилання
<a href="https://ua.patents.su/46-96926-zastosuvannya-sdf-1-dlya-likuvannya-ta-abo-profilaktiki-nevrologichnikh-zakhvoryuvan.html" target="_blank" rel="follow" title="База патентів України">Застосування sdf-1 для лікування та/або профілактики неврологічних захворювань</a>
Попередній патент: Спосіб експериментального підтвердження характеристик режимів руху штатної головної частини балістичної ракети
Наступний патент: Спосіб виготовлення співрозмеленого матеріалу карбонату кальцію, співрозмелений матеріал карбонату кальцію (варіанти) та його застосування
Випадковий патент: Цанговий патрон