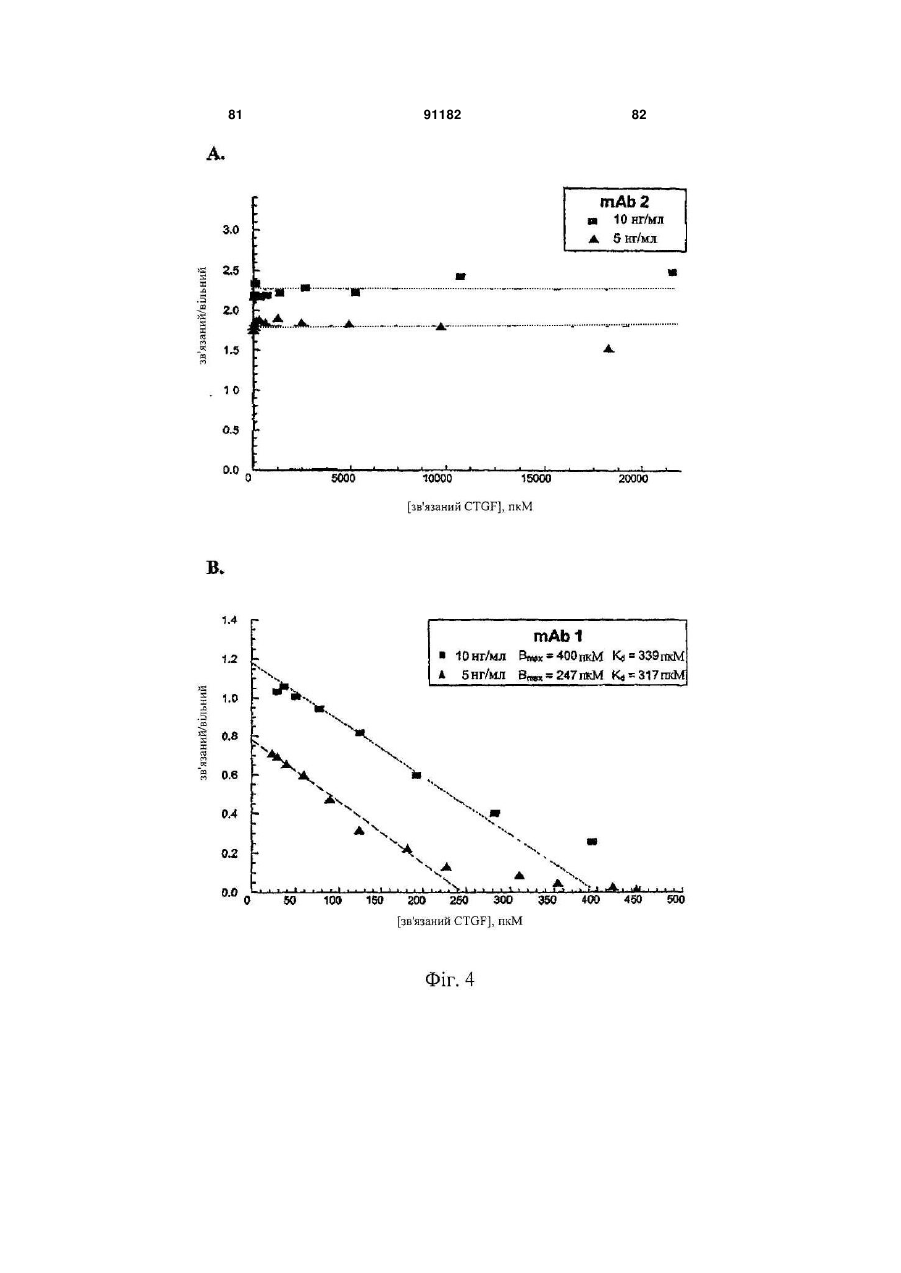
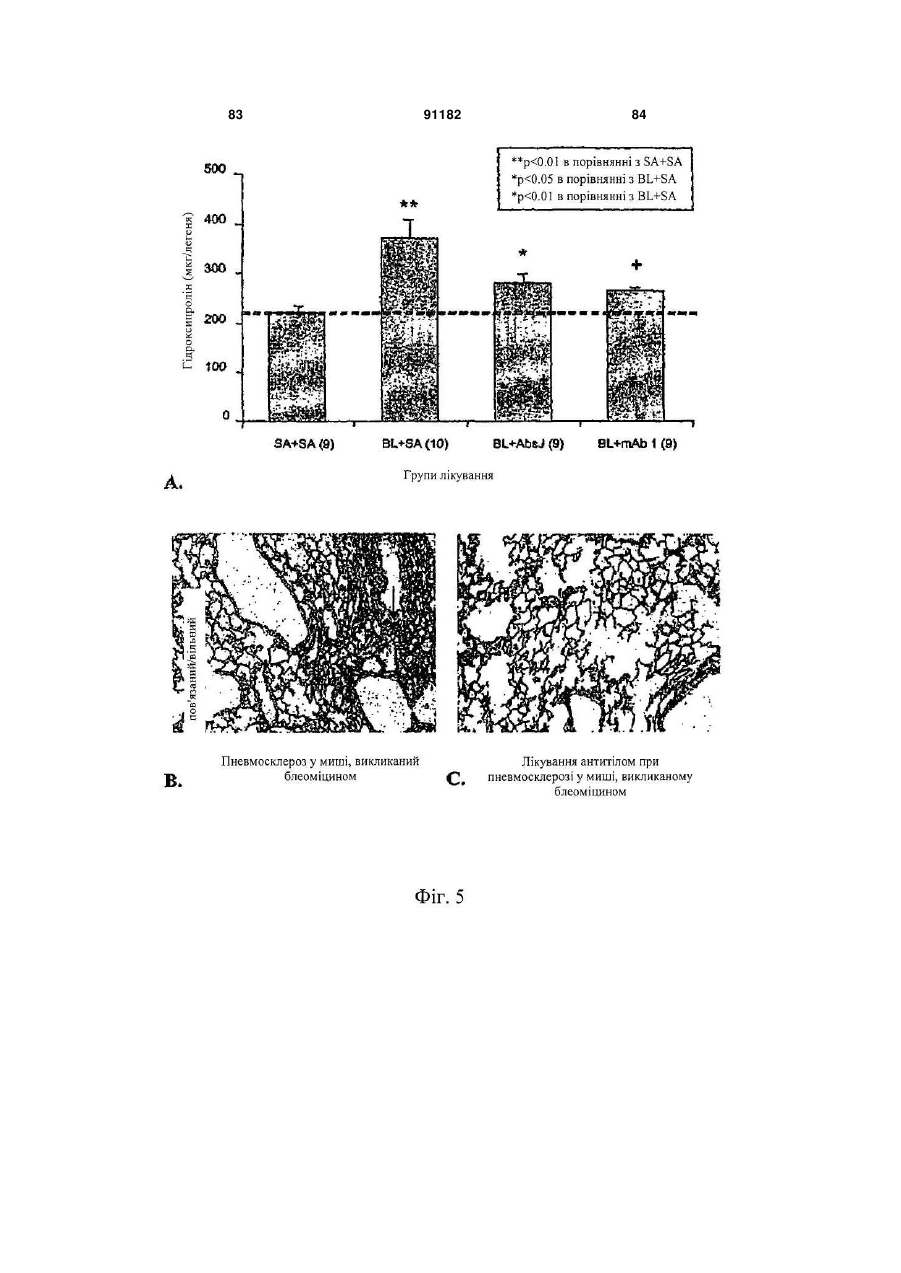
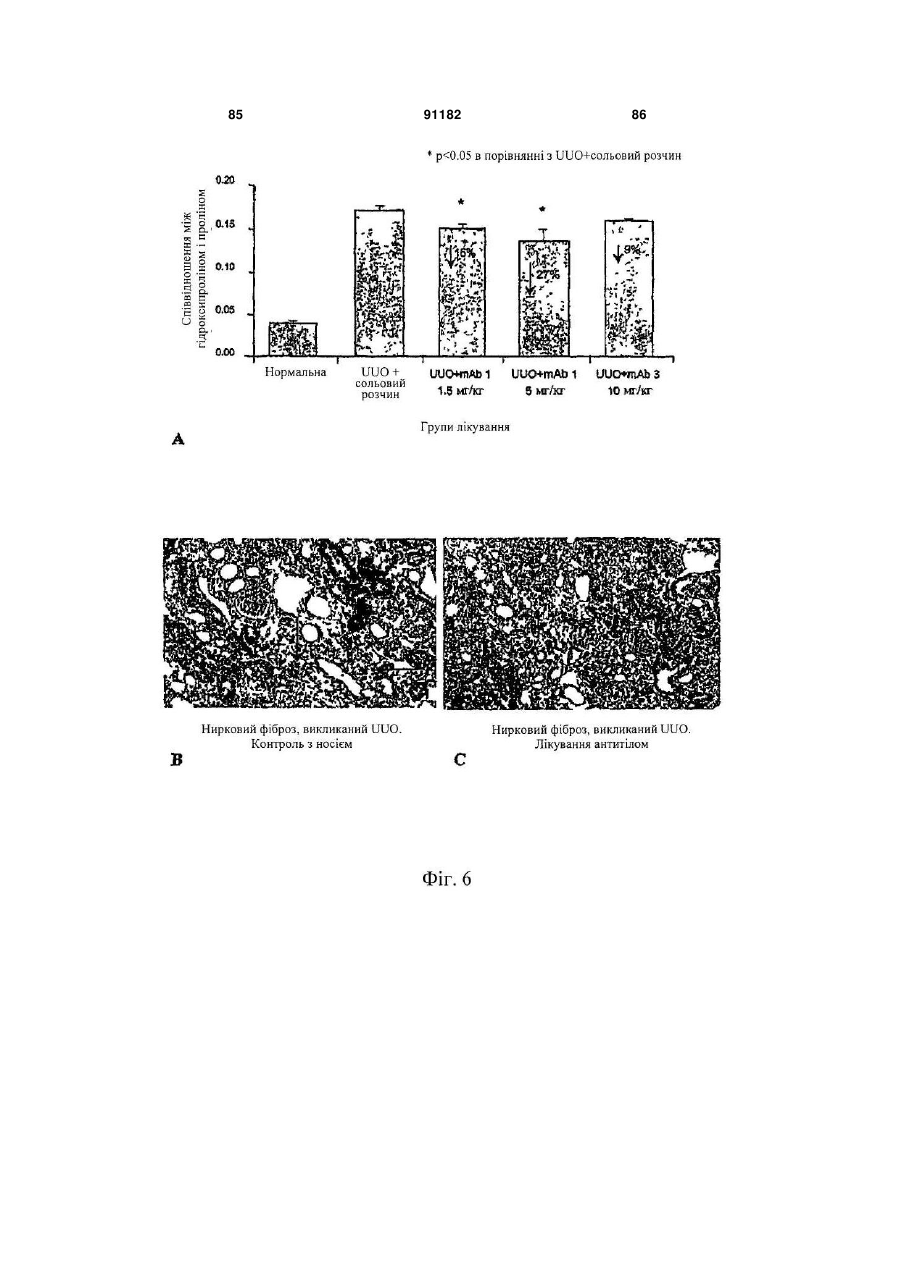
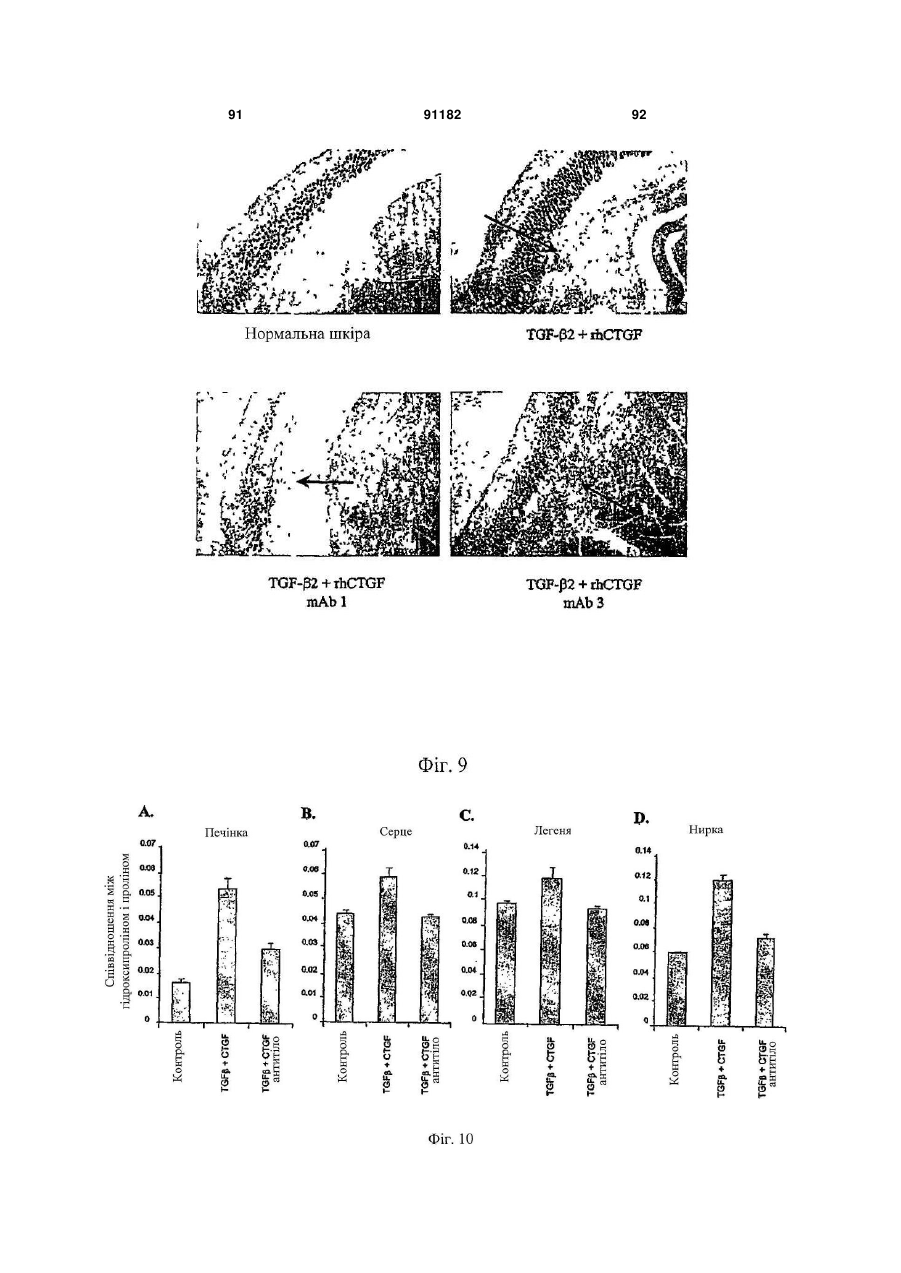
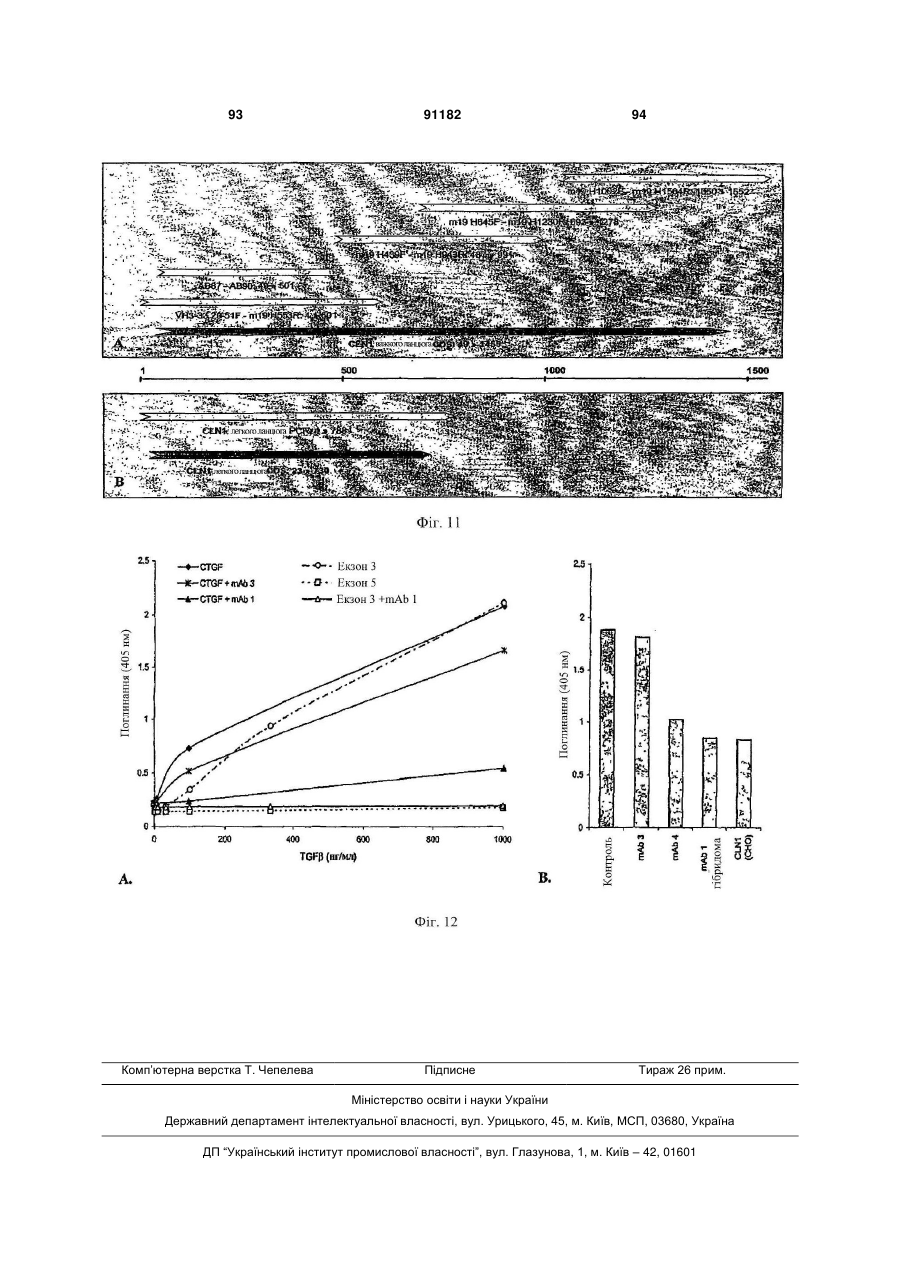
Антитіло, яке специфічно зв’язується з фактором росту з’єднувальної тканини (ctgf)
Номер патенту: 91182
Опубліковано: 12.07.2010
Автори: Ван Циньцзянь, Лін Ай Й., Нефф Томас Б., Юзінджер Уілльям Р., Йєовелл Девід А., Олівер Ноелінн А.
Формула / Реферат
1. Антитіло, де антитіло має амінокислотну послідовність, що продукується клітинною лінією, позначеною номером доступу РТА-6006 в АТСС (депонована 20 травня 2004 р.).
2. Клітинна лінія, позначена номером доступу РТА-6006 в АТСС, яка продукує моноклональне антитіло людини, що специфічно зв'язується з CTGF людини.
3. Виділене антитіло, що включає перший поліпептид, вибраний з групи, яка складається з:
(a) важкого ланцюга імуноглобуліну з послідовністю, вказаною в SEQ ID NО:14; або
(b) важкого ланцюга імуноглобуліну, що містить варіабельний домен SEQ ID NО:14;
і другий поліпептид, вибраний з групи, яка складається з:
(с) легкого ланцюга імуноглобуліну з послідовністю, вказаною в SEQ ID NО:20; або
(d) легкого ланцюга імуноглобуліну, що містить варіабельний домен SEQ ID NО:20.
4. Антитіло за п. 3, де варіабельний домен першого поліпептиду містить варіабельний домен важкого ланцюга імуноглобуліну, який відповідає амінокислотам 1-167 SEQ ID NО:14.
5. Антитіло за п. 3, де варіабельний домен другого поліпептиду містить варіабельний домен легкого ланцюга імуноглобуліну, який відповідає амінокислотам 1-136 SEQ ID NО:20.
6. Антитіло за п. 3, де антитіло здатне нейтралізувати біологічну активність поліпептиду CTGF.
7. Антитіло за п. 6, де біологічна активність включає продукцію позаклітинного матриксу клітиною.
8. Антитіло за п. 6, де біологічна активність включає стимуляцію клітинної міграції.
9. Антитіло за п. 7, де продукція позаклітинного матриксу відбувається in vivo.
10. Антитіло за п. 7, де продукція позаклітинного матриксу відбувається ex vivo.
11. Антитіло за п. 6, де антитіло модулює взаємодію між поліпептидом CTGF і клітинним рецептором, за допомогою цього нейтралізуючи біологічну активність.
12. Антитіло за п. 6, де антитіло модулює взаємодію між поліпептидом CTGF і секретованим або мембранним кофактором, за допомогою цього нейтралізуючи біологічну активність.
13. Антитіло за п. 12, де кофактором є член сімейства TGF-β.
14. Антитіло за п. 13, де кофактором є TGFβ-1.
15. Антитіло за п. 13, де кофактором є ВМР-4.
16. Антитіло за п. 3, де антитіло глікозильоване.
17. Антитіло за п. 3, де антитіло неглікозильоване.
18. Антитіло за п. 3, де антитіло кон'юговане з цитотоксичним агентом або ферментом.
19. Антитіло за п. 3, де антитіло є міченим і може бути виявлене.
20. Антитіло за п. 19, де мітка, що виявляється, являє собою фермент, флуоресцентну частину, хемілюмінесцентну частину, біотин, авідин або радіоізотоп.
21. Антитіло за п. 3, що містить важкий ланцюг імуноглобуліну з амінокислотною послідовністю, яка відповідає SEQ ID NО:14, і легкий ланцюг імуноглобуліну з амінокислотною послідовністю, яка відповідає SEQ ID NО:20.
22. Фармацевтична композиція, що містить ефективну кількість антитіла за будь-яким з попередніх пунктів в суміші з фармацевтично прийнятним носієм.
23. Фармацевтична композиція за п. 22, яка, крім того, містить другий лікарський засіб.
24. Спосіб нейтралізації біологічної активності CTGF, що передбачає контактування антитіла за будь-яким з пп. 1-21 із зразком в умовах, придатних для утворення комплексу, що включає антитіло і поліпептид CTGF, за допомогою цього нейтралізуючи біологічну активність поліпептиду CTGF.
25. Спосіб за п. 24, де біологічна активність включає продукцію позаклітинного матриксу.
26. Спосіб за п. 24, де антитіло модулює взаємодію між поліпептидом CTGF і клітинним рецептором.
27. Спосіб за п. 24, де антитіло модулює взаємодію між поліпептидом CTGF і секретованим або мембранним кофактором.
28. Спосіб за п. 27, де кофактором є член сімейства TGF-β.
29. Спосіб за п. 28, де кофактором є TGFβ-1.
30. Спосіб за п. 28, де кофактором є ВМР-4.
31. Спосіб за п. 28, де нейтралізація відбувається in vitro.
32. Спосіб за п. 24, де нейтралізація відбувається у індивідуума in vivo.
33. Спосіб за п. 32, де індивідуум схильний до розвитку або у якого діагностована гіпертонія, гіперглікемія, цукровий діабет, інфаркт міокарда, артрит і локальне або системне запалення.
34. Спосіб за п. 32, де індивідуум схильний до розвитку або у якого діагностований клітинний проліферативний розлад.
35. Спосіб за п. 34, де клітинний проліферативний розлад являє собою ангіогенез, атеросклероз, глаукому або рак.
36. Спосіб за п. 35, де вказаний рак являє собою гострий лімфобластичний лейкоз, дерматофіброми, рак молочної залози, десмоплазію карциноми молочної залози, ангіоліпому, ангіолейоміому, десмопластичний рак, рак передміхурової залози, рак яєчників, рак товстої і прямої кишки, рак підшлункової залози, рак шлунково-кишкового тракту або рак печінки.
37. Спосіб за п. 32, де індивідуум схильний до розвитку або у якого діагностований фібротичний розлад.
38. Спосіб за п. 37, де фібротичний розлад являє собою ідіопатичний пневмосклероз, діабетичну нефропатію, діабетичну ретинопатію, остеоартрит, склеродермію, хронічну серцеву недостатність або циротичну печінку.
39. Спосіб лікування або профілактики пов'язаного з CTGF розладу у суб'єкта, який його має або з ризиком його розвитку, що передбачає введення індивідууму антитіла за будь-яким з пп. 1-21.
40. Спосіб за п. 39, де розлад являє собою гіпертонію, гіперглікемію, цукровий діабет, інфаркт міокарда, артрит і локальне або системне запалення.
41. Спосіб за п. 39, де розлад являє собою клітинний проліферативний розлад.
42. Спосіб за п. 41, де клітинний проліферативний розлад являє собою ангіогенез, атеросклероз, глаукому або рак.
43. Спосіб за п. 42, де вказаний рак включає гострий лімфобластичний лейкоз, дерматофіброми, рак молочної залози, десмоплазію карциноми молочної залози, ангіоліпому, ангіолейоміому, десмопластичний рак, рак передміхурової залози, рак яєчників, рак товстої і прямої кишки, рак підшлункової залози, рак шлунково-кишкового тракту або рак печінки.
44. Спосіб за п. 39, де індивідуум схильний до розвитку або у якого діагностований фібротичний розлад.
45. Спосіб за п. 44, де фібротичний розлад являє собою ідіопатичний пневмосклероз, діабетичну нефропатію, діабетичну ретинопатію, остеоартрит, склеродермію, хронічну серцеву недостатність або циротичну печінку.
46. Антитіло за будь-яким з пп. 1-21, де антитіло або його частина кодується генетичним матеріалом, початково одержаним у людини.
47. Химерне антитіло, що містить варіабельну ділянку, одержану з варіабельної ділянки антитіла за будь-яким з пп. 1-21, і константну ділянку, одержану з іншого джерела.
48. Химерне антитіло за п. 47, де константна ділянка одержана з константної ділянки людського імуноглобуліну.
49. Лікарський засіб, що містить антитіло за будь-яким з пп. 1-21 для лікування індивідуума з розладом, вибраним з групи, що включає ідіопатичний пневмосклероз, діабетичну нефропатію, хронічну серцеву недостатність і циротичну печінку.
50. Лікарський засіб, що містить антитіло за будь-яким з пп. 1-21 для лікування індивідуума, схильного до розладу внаслідок стану, вибраного з групи, що включає гіпертонію, цукровий діабет, інфаркт міокарда, артрит і локальне або системне запалення.
51. Полінуклеотидна послідовність, що містить послідовність, вибрану з групи, яка складається з
(a) полінуклеотидної послідовності, що кодує важкий ланцюг імуноглобуліну SEQ ID NО:14;
(b) полінуклеотидної послідовності, що кодує варіабельний домен важкого ланцюга імуноглобуліну SEQ ID NО:14;
(с) SEQ ID NО:13;
(d) нуклеотиду 1-501 SEQ ID NО:13, або
полінуклеотидної послідовності, що містить послідовність, вибрану з групи, що включає
(а) полінуклеотидну послідовність, що кодує легкий ланцюг імуноглобуліну SEQ ID NО:20;
(b) полінуклеотидну послідовність, що кодує варіабельний домен легкого ланцюга імуноглобуліну, SEQ ID NО:20;
(с) SEQ ID NО:19; і
(d) нуклеотид 1-408 SEQ ID NО:19.
52. Рекомбінантний полінуклеотид, що містить полінуклеотидну послідовність за п. 51, операбельно зв'язану з векторною послідовністю, яка містить реплікаційну і транскрипційну контрольні послідовності.
53. Рекомбінантний полінуклеотид за п. 52, де полінуклеотид кодує амінокислотну послідовність SEQ ID NО:14 або SEQ ID NО:20.
54. Рекомбінантний полінуклеотид за п. 52, де полінуклеотид містить SEQ ID NО:13 або SEQ ID NО:19.
55. Клітина-хазяїн, трансфікована рекомбінантним полінуклеотидом за п. 54.
56. Клітина-хазяїн, що містить клітину, трансфіковану полінуклеотидом, що кодує SEQ ID NО:14 та SEQ ID NО:20.
Текст
1. Антитіло, де антитіло має амінокислотну послідовність, що продукується клітинною лінією, позначеною номером доступу РТА-6006 в АТСС (депонована 20 травня 2004 р.). 2. Клітинна лінія, позначена номером доступу РТА6006 в АТСС, яка продукує моноклональне антитіло людини, що специфічно зв'язується з CTGF людини. 3. Виділене антитіло, що включає перший поліпептид, вибраний з групи, яка складається з: 2 (19) 1 3 бути виявлене. 20. Антитіло за п.19, де мітка, що виявляється, являє собою фермент, флуоресцентну частину, хемілюмінесцентну частину, біотин, авідин або радіоізотоп. 21. Антитіло за п.3, що містить важкий ланцюг імуноглобуліну з амінокислотною послідовністю, яка відповідає SEQ ID NО:14, і легкий ланцюг імуноглобуліну з амінокислотною послідовністю, яка відповідає SEQ ID NО:20. 22. Фармацевтична композиція, що містить ефективну кількість антитіла за будь-яким з попередніх пунктів в суміші з фармацевтично прийнятним носієм. 23. Фармацевтична композиція за п.22, яка, крім того, містить другий лікарський засіб. 24. Спосіб нейтралізації біологічної активності CTGF, що передбачає контактування антитіла за будь-яким з пп.1-21 із зразком в умовах, придатних для утворення комплексу, що включає антитіло і поліпептид CTGF, за допомогою цього нейтралізуючи біологічну активність поліпептиду CTGF. 25. Спосіб за п.24, де біологічна активність включає продукцію позаклітинного матриксу. 26. Спосіб за п.24, де антитіло модулює взаємодію між поліпептидом CTGF і клітинним рецептором. 27. Спосіб за п.24, де антитіло модулює взаємодію між поліпептидом CTGF і секретованим або мембранним кофактором. 28. Спосіб за п.27, де кофактором є член сімейства TGF-β. 29. Спосіб за п.28, де кофактором є TGFβ-1. 30. Спосіб за п.28, де кофактором є ВМР-4. 31. Спосіб за п.28, де нейтралізація відбувається in vitro. 32. Спосіб за п.24, де нейтралізація відбувається у індивідуума in vivo. 33. Спосіб за п.32, де індивідуум схильний до розвитку або у якого діагностована гіпертонія, гіперглікемія, цукровий діабет, інфаркт міокарда, артрит і локальне або системне запалення. 34. Спосіб за п.32, де індивідуум схильний до розвитку або у якого діагностований клітинний проліферативний розлад. 35. Спосіб за п.34, де клітинний проліферативний розлад являє собою ангіогенез, атеросклероз, глаукому або рак. 36. Спосіб за п.35, де вказаний рак являє собою гострий лімфобластичний лейкоз, дерматофіброми, рак молочної залози, десмоплазію карциноми молочної залози, ангіоліпому, ангіолейоміому, десмопластичний рак, рак передміхурової залози, рак яєчників, рак товстої і прямої кишки, рак підшлункової залози, рак шлунково-кишкового тракту або рак печінки. 37. Спосіб за п.32, де індивідуум схильний до розвитку або у якого діагностований фібротичний розлад. 38. Спосіб за п.37, де фібротичний розлад являє собою ідіопатичний пневмосклероз, діабетичну нефропатію, діабетичну ретинопатію, остеоартрит, склеродермію, хронічну серцеву недостатність або циротичну печінку. 39. Спосіб лікування або профілактики пов'язаного з CTGF розладу у суб'єкта, який його має або з 91182 4 ризиком його розвитку, що передбачає введення індивідууму антитіла за будь-яким з пп.1-21. 40. Спосіб за п.39, де розлад являє собою гіпертонію, гіперглікемію, цукровий діабет, інфаркт міокарда, артрит і локальне або системне запалення. 41. Спосіб за п.39, де розлад являє собою клітинний проліферативний розлад. 42. Спосіб за п.41, де клітинний проліферативний розлад являє собою ангіогенез, атеросклероз, глаукому або рак. 43. Спосіб за п.42, де вказаний рак включає гострий лімфобластичний лейкоз, дерматофіброми, рак молочної залози, десмоплазію карциноми молочної залози, ангіоліпому, ангіолейоміому, десмопластичний рак, рак передміхурової залози, рак яєчників, рак товстої і прямої кишки, рак підшлункової залози, рак шлунково-кишкового тракту або рак печінки. 44. Спосіб за п.39, де індивідуум схильний до розвитку або у якого діагностований фібротичний розлад. 45. Спосіб за п.44, де фібротичний розлад являє собою ідіопатичний пневмосклероз, діабетичну нефропатію, діабетичну ретинопатію, остеоартрит, склеродермію, хронічну серцеву недостатність або циротичну печінку. 46. Антитіло за будь-яким з пп.1-21, де антитіло або його частина кодується генетичним матеріалом, початково одержаним у людини. 47. Химерне антитіло, що містить варіабельну ділянку, одержану з варіабельної ділянки антитіла за будь-яким з пп.1-21, і константну ділянку, одержану з іншого джерела. 48. Химерне антитіло за п.47, де константна ділянка одержана з константної ділянки людського імуноглобуліну. 49. Лікарський засіб, що містить антитіло за будьякимз пп.1-21 для лікування індивідуума з розладом, вибраним з групи, що включає ідіопатичний пневмосклероз, діабетичну нефропатію, хронічну серцеву недостатність і циротичну печінку. 50. Лікарський засіб, що містить антитіло за будьяким з пп.1-21 для лікування індивідуума, схильного до розладу внаслідок стану, вибраного з групи, що включає гіпертонію, цукровий діабет, інфаркт міокарда, артрит і локальне або системне запалення. 51. Полінуклеотидна послідовність, що містить послідовність, вибрану з групи, яка складається з (a) полінуклеотидної послідовності, що кодує важкий ланцюг імуноглобуліну SEQ ID NО:14; (b) полінуклеотидної послідовності, що кодує варіабельний домен важкого ланцюга імуноглобуліну SEQ ID NО:14; (с) SEQ ID NО:13; (d) нуклеотиду 1-501 SEQ ID NО:13, або полінуклеотидної послідовності, що містить послідовність, вибрану з групи, що включає (а) полінуклеотидну послідовність, що кодує легкий ланцюг імуноглобуліну SEQ ID NО:20; (b) полінуклеотидну послідовність, що кодує варіабельний домен легкого ланцюга імуноглобуліну, SEQ ID NО:20; (с) SEQ ID NО:19; і (d) нуклеотид 1-408 SEQ ID NО:19. 5 91182 6 52. Рекомбінантний полінуклеотид, що містить полінуклеотидну послідовність за п.51, операбельно зв'язану з векторною послідовністю, яка містить реплікаційну і транскрипційну контрольні послідовності. 53. Рекомбінантний полінуклеотид за п.52, де полінуклеотид кодує амінокислотну послідовність SEQ ID NО:14 або SEQ ID NО:20. 54. Рекомбінантний полінуклеотид за п.52, де полінуклеотид містить SEQ ID NО:13 або SEQ ID NО:19. 55. Клітина-хазяїн, трансфікована рекомбінантним полінуклеотидом за п.54. 56. Клітина-хазяїн, що містить клітину, трансфіковану полінуклеотидом, що кодує SEQ ID NО:14 та SEQ ID NО:20. За цією заявкою запитаний пріоритет попередньої заявки на патент США №60/475598, поданої 4 червня 2003p., наведеної тут як посилання в повному об'ємі. Даний винахід належить до антитіл, які зв'язуються з фактором росту з'єднувальної тканини (CTGF). Ці антитіла зокрема направлені на ділянки CTGF, залучені до біологічної активності, пов'язаної з різними захворюваннями. Фактор росту з'єднувальної тканини (CTGF) CTGF являє собою багатий на цистеїн, зв'язуючий гепарин, секретований глікопротеїд з молекулярною масою 36 кДа, спочатку виділений з культурального середовища ендотеліальних клітин пупкової вени людини (див., наприклад, Bradham et al. (1991) J Cell Biol 114:1285-1294; Grotendorst and Bradham, патент США №5408040). CTGF належить до сімейства білків CCN (CTGF, Суr61, Nov) (секретованих глікопротеїдів), до якого належить ранній генний продукт, що індукується сироваткою Сугбі, передбачуваний онкоген Nov, пов'язаний з ЕСМ білок FISP-12, src-індуцибельний ген CEF-10, Wnt-індуцибельний секретований білок WISP-3 і антипроліферативний білок HICP/rCOP (Brigstock (1999) Endocr. Rev. 20: 189-206; O'Brian et al. (1990) Моl. Cell Biol., 10: 3569-3577; Joliot et al. (1992) Моl. Cell Biol., 12: 10-21; Ryseck et al. (1990) Cell Growth and Diff., 2: 225-233; Simmons et al. (1989) Proc. Natl. Acad. Sci. USA, 86: 1178-1182; Pennica et al. (1998) Proc. Natl. Acad. Sci. USA, 95: 14717-14722; і Zhang et al. (1998) Моl. Cell Biol., 18: 6131-61416). Білки CCN відрізняються тим, що у них консервативні 38 цистеїнових залишків, які складають більше 10% загального вмісту амінокислот і забезпечують виникнення модулярної структури з N- і С-кінцевими доменами. Модулярна структура CTGF включає консервативні мотиви для білка, зв'язуючого подібний до інсуліну фактор росту (IGF-BP), і фактора фон Віллебранда (VWC) в N-кінцевому домені і тромбоспондин (TSP1) і мотив цистеїнового вузла в С-кінцевому домені. Експресія CTGF індукується членами суперсімейства трансформуючого фактора росту бета (TGFβ), яке включає TGFβ-1, -2 і -3, кістковий морфогенетичний білок (ВМР)-2 і активін, а також різними іншими регуляторними модуляторами, включаючи дексаметазон, тромбін, судинний ендотеліальний фактор росту (VEGF) і ангіотензин II; і стимулами навколишнього середовища, включаючи гіперглікемію і гіпертонію (див., наприклад, Franklin (1997) Int. J. Biochem. Cell Biol, 29: 79-89; Wunderlich (2000) Graefes Arch. Clin. Exp. Ophthalmol, 238: 910-915; Denton and Abraham (2001) Curr. Opin. Rheumatol, 13: 505-511 і Riewald (2001) Blood, 97: 3109-3116; Riser et al. (2000) J. Am. Soc. Nephrol, 11: 25-38 і міжнародну публікацію WO 00/13706). Стимуляція експресії CTGF під дією TGFβ є швидкою і тривалою і не вимагає тривалого застосування (Igarashi et al. (1993) Моl. Biol. Cell, 4: 637-645). Посилена експресія CTGF TGFβ включає транскрипційну активацію за допомогою регуляторних елементів ДНК, присутніх в промоторі CTGF (Grotendorst et al. (1996) Cell Growth Differ, 7: 469-480; Grotendorst and Bradham, патент США №6069006; Holmes et al. (2001) J. Biol. Chem., 276: 10594-10601). Було показано, що CTGF збільшує стаціонарну транскрипцію колагену α1 (I), інтегрину α5 і мРНК фібронектину, а також промотує клітинні процеси, включаючи проліферацію і хемотаксис різних типів клітин в культурі (див., наприклад, Frazier et al. (1996) J. Invest. DermatoL, 107: 406-411; Shi-wen et al. (2000) Exp. Cell Res., 259: 213-224; Klagsburn (1997) Exp. Cell Res., 105: 99-108; Gupta et al. (2000) J. Kidney Int., 58: 1389-1399; Wahab et al. (2001) Biochem. J., 359 (Pt 1): 77-87; Uzel et al (2001) J. Periodontol., 72: 921-931 і Riser and Cortes (2001) Ren. Fail., 23: 459-470). Підшкірна ін'єкція CTGF новонародженим мишам приводить до місцевого відкладення грануляційної тканини. Аналогічним чином, підшкірна ін'єкція TGFβ генерує формування грануляційної тканини і викликає високі рівні мРНК CTGF в місцевих фібробластах. Більше того, комбіноване або послідовне лікування TGFβ і CTGF приводить до розвитку більш стійкої гранульоми (Mori et al. (1999) J. Cell Physiol., 181: 153159). Таким чином, уявляється, що CTGF опосередковує підгрупу ефектів, що викликаються TGFβ, зокрема продукцію і відкладення позаклітинного матриксу (ЕСМ). Крім того, здатність реагувати на CTGF або міра реакції на CTGF може залежати від стимулу примування, який забезпечується обробкою TGFβ, що забезпечує можливість клітинної «компетентності» (Міжнародна публікація WO 96/08140). 7 Хоча була охарактеризована множина взаємодіючих факторів, які модулюють тканинну організацію, в цей час з'являється згода відносно ролі CTGF в регуляції розвитку скелета, загоєнні ран і перебудові позаклітинного матриксу (ЕСМ), фіброзі, розвитку пухлин і ангіогенезі. Наприклад, підвищена експресія CTGF спостерігалася в печінці при цирозі, при пневмосклерозі, запальних кишкових захворюваннях, в склеротичній шкірі і келоїдах, при десмоплазії і атеросклеротичних бляшках (Abraham et al. (2000) J. Biol. Chera., 275: 1522015225; Dammeier et al. (1998) Ind. J. Biochem. Cell Biol., 30: 909-922; diMola et al. (1999) Ann. Surg. 230(1): 63-71; Igarashi et al. (1996) J. Invest. Dermatol, 106: 729-733; Ito et al. (1998) Kidney Int., 53: 853-861; Williams et al. (2000) J. Hepatol, 32: 754-761; Clarkson et al (1999) Curr. Opin. Nephrol. Hypertens, 8: 543-548; Hinton et al. (2002) Eye, 16: 422-428; Gupta et al. (2000) Kidney Int., 58: 13891399; Riser et al. (2000) J. Am. Soc. Nephrol., 11: 2538). Стимулююча регуляція CTGF також відбувається при гломерулонефриті, нефропатії, викликаній IgA, осередковому і сегментарному гломерулосклерозі і діабетичній нефропатії (див., наприклад, Riser et al. (2000) J. Am. Soc. Nephrol., 11: 25-38). Збільшення кількості клітин, які експресують CTGF, також спостерігається в ділянках хронічного канальцево-інтерстиціального пошкодження, і рівні CTGF корелюють з мірою пошкодження (Ito et al. (1998) Kidney Int., 53: 853-861). Крім того, експресія CTGF збільшується в клубочках і інтерстиції канальців при різних ниркових захворюваннях в зв'язку з рубцюванням і склерозом ниркової паренхіми. Підвищені рівні CTGF також пов'язані з фіброзом печінки, інфарктом міокарда і пневмосклерозом. Наприклад, у пацієнтів з ідіопатичним пневмосклерозом (IFF) спостерігається сильна стимулююча регуляція CTGF в біопсіях і клітинах рідини бронхоальвеолярного лаважу (Ujike et al. (2000) Biochem. Biophys. Res. Commun., 277: 448-454; Abou-Shady et al. (2000) Liver, 20: 296-304; Williams et al. (2000) J. Hepatol., 32: 754-761; Ohnishi et al. (1998) J. Моl. Cell Cardiol., 30: 2411-22; Lasky et al. (1998) Am. J. Physiol., 275: L365-371; Pan et al. (2001) Eur. Respir. J., 17: 1220-1227 і Alien et al. (1999) Am. J. Respir. Cell Моl. Biol., 21: 693-700). Таким чином, CTGF є обгрунтованою мішенню при лікуванні розладів, таких як описані вище. Був встановлений зв'язок CTGF з різними аспектами цих розладів, і були описані способи лікування розладів за допомогою модуляції CTGF (див., наприклад, Grotendorst and Bradham, патент США №5783187; Міжнародна публікація №WO 00/13706; і Міжнародна публікація №WO 03/049773). Модуляцію факторів росту, цитокінів і рецепторів клітинної поверхні можна здійснити, використовуючи моноклональні антитіла, і декілька терапевтичних антитіл були дозволені до застосування або знаходяться в процесі розробки (див., наприклад, Infliximab (Remicade; Maini et al. (1998) Arthritis Rheum., 41: 1552-1563; Targan et al. (1997) N. Engl. J. Med., 337: 1029-1035); Basiliximab (Simulect) and Daclizumab (Zenapax) (Bumgardner et al. (2001) Transplantation, 72: 839-845; Kovarik et 91182 8 al. (1999) Transplantation, 68: 1288-1294); і Transtuzumab (Herceptin; Baselga (2001) Ann. Oncol, 12 Suppl. 1: S49-55)). Були генеровані антитіла проти CTGF, і вони виявилися ефективними in vivo, наприклад, інгібуючи ангіогенез (див., наприклад, Grotendorst and Bradham, патент США №5408040; міжнародна публікація WO 99/07407 і Shimo et al. (2001) Oncology 61: 315-322). Крім того, виявилося, що модулярна природа CTGF розрізнює домени, які беруть участь в специфічних видах біологічної активності. Наприклад, було показано, що N-кінцева половина CTGF стимулює клітинну диференціацію і продукцію ЕСМ, тоді як С-кінцева половина стимулює клітинну проліферацію (див., наприклад, Міжнародні публікації WO 00/35936 і WO 00/35939; Brigstock and Harding, патент США №587670). Це демонструє, що антитіла, направлені на різні ділянки молекули CTGF, виявляють різні ефекти відносно модулювання видів біологічної активності CTGF (див., наприклад, Міжнародні публікації WO 00/35936 і WO 00/35939). До теперішнього часу не було встановлено чіткої відмінності між антитілами проти CTGF, які продукують бажаний ефект, і антитілами, які або продукують множинні ефекти, або є ненейтралізуючими (див., наприклад, Міжнародну публікацію WO 99/33878). Існує явна необхідність в даній галузі в засобах, які ефективно нейтралізують активність CTGF при патології. Антитіла, зокрема моноклональні антитіла, забезпечують специфічність і фармакокінетичний профіль, придатний для терапевтичного засобу, і нейтралізуючі антитіла, націлені на конкретні види активності CTGF, задовольнили б потребу в даній галузі і могли б знайти застосування в терапевтичному лікуванні пов'язаних з CTGF розладів, включаючи легеневі розлади, такі як ідіопатичний пневмосклероз (IPF) і т.д.; ниркові розлади, такі як діабетична нефропатія, гломерулосклероз і т.д.; і очні розлади, такі як ретинопатія, дегенерація жовтої плями і т.д. Даний винахід належить до антитіл, зокрема до моноклональних антитіл, і їх частин, які специфічно зв'язуються з областю на N-кінцевому фрагменті поліпептиду CTGF. В одному з аспектів антитіло за винаходом специфічно зв'язується з областю людського CTGF (SEQ ID NO:2), що відповідає амінокислотам від приблизно 103 до приблизно 164 (SEQ ID NO:21), більш конкретно, від амінокислоти приблизно 135 до приблизно амінокислоти 157 (SEQ ID NO:22) і, ще більш конкретно, від приблизно амінокислоти 142 до приблизно амінокислоти 154 (SEQ ID NO:25); або ортологічною областю CTGF, отриманого від іншого виду. У певних варіантах здійснення винаходу антитіло має таку ж специфічність, що і антитіло, яке продукується клітинною лінією, позначеною номером доступу в АТСС (Американської колекції типових культур) РТА6006 (депонована в АТСС 20 травня 2004р.). У певних варіантах здійснення винаходу антитіло по суті ідентичне mAb1, як описано нижче. Переважніше, антитіло по суті аналогічне CLN1, як описано нижче. У ще одному варіанті здійснення антитіло 9 за винаходом конкурентно зв'язується з будь-ким з вказаних вище антитіл до поліпептиду CTGF. В одному варіанті здійснення даний винахід належить до моноклонального антитіла або його частини, що містить щонайменше один член групи, що складається з послідовності важкого ланцюга імуноглобуліну, що включає SEQ ID NO:14, послідовності важкого ланцюга імуноглобуліну, що включає варіабельний домен SEQ ID NO:14, послідовності легкого ланцюга імуноглобуліну, що включає SEQ ID NO:20, послідовності легкого ланцюга імуноглобуліну, що включає варіабельний домен SEQ ID NO:20, або їх консервативних варіантів. У певному варіанті здійснення антитіло містить варіабельний домен важкого ланцюга імуноглобуліну від амінокислотного залишку 1 до амінокислотного залишку 167 SEQ ID NO:14. В іншому певному варіанті здійснення антитіло містить варіабельний домен легкого ланцюга імуноглобуліну від амінокислотного залишку 1 до амінокислотного залишку 136 SEQ ID NO:20. У конкретному варіанті здійснення антитіло містить послідовність важкого ланцюга імуноглобуліну SEQ ID NO:14 і послідовність легкого ланцюга імуноглобуліну SEQ ID NO:20. У межах цього варіанта здійснення даний винахід, зокрема, належить до антитіла CLN1 або його частини, що містить щонайменше залишки зв'язуючої антиген області CLN1. У певних аспектах антитіло за винаходом являє собою поліклональне антитіло. В інших аспектах антитіло являє собою моноклональне антитіло. У певних варіантах здійснення винаходу антитіло являє собою гуманізоване моноклональне антитіло, більш переважно, людське моноклональне антитіло. Будь-яке з вказаних вище антитіл може додатково мати різну міру глікозилювання, що здійснюється клітиною, яка продукує антитіло, або застосовується і/або модифікується синтетично; або антитіло може бути позбавлене глікозилювання. Антитіло може бути необов'язково пегильоване і/або модифіковане аналогічним чином для збільшення періоду напіввиведення з плазми і т.д. В різних варіантах здійснення винахід належить до фрагментів антитіла, особливо, коли фрагмент являє собою фрагмент Fab, F(ab)2 або Fv. У певних аспектах антитіло або його частина продукується клонованою клітинною лінією. Клітинна лінія може бути отримана з будь-якої моделі на тваринах, що використовується для продукції моноклонального антитіла, включаючи, але не обмежуючись цим, мишей, кіз, курей і т.д. Зокрема, клітинна лінія може бути отримана у мишей. Миші можуть бути стандартними мишами, що використовуються для продукції антитіл, наприклад BALB/C, або модифікованої, наприклад трансгенної мишачої лінії, оптимізованої або розробленої для продукції специфічного ізотипу, ідіотипу або видоспецифічних моноклональних антитіл. В одному варіанті здійснення винаходу клітинна лінія є лінією клітин гібридоми, яка продукує і секретує mAb1. В інших варіантах здійснення лінія клітин продукує і секретує антитіло або його частину, які мають властивість, по суті еквівалентну mAb1. В інших варіантах здійснення лінія клітин продукує і 91182 10 секретує антитіло або його частину, які мають властивість, по суті еквівалентну CLN1. У конкретному варіанті здійснення винахід належить до лінії клітин, позначеної номером доступу в АТСС РТА6006 (депонована 20 травня 2004p.). Відповідно до іншого аспекту винаходу, антитіло або його частина отримані у трансгенної тварини, відмінної від людини, зокрема трансгенного ссавця, відмінного від людини, здатного продукувати людське антитіло. Тварина може бути будьякого виду, включаючи, але не обмежуючись цим, мишу, курку, корову, козу і т.д. Зокрема, тварина може являти собою мишу. Такі антитіла можуть бути отримані імунізацією трансгенного ссавця, відмінного від людини, фрагментом людського CTGF, наприклад. SEQ ID NO:21 або, більш конкретно, SEQ ID NO:22, або до ортологічної області CTGF, отриманого від видів, відмінних від людини. У певних варіантах здійснення винаходу антитіла отримують імунізацією трансгенного ссавця, відмінного від людини, фрагментом CTGF, вибраним з групи, що складається з послідовностей з SEQ ID NO:23 по SEQ ID NO:26, або до ортологічної області CTGF, отриманого від видів, відмінних від людини. У певних варіантах здійснення антитіла отримані імунізацією трансгенної миші будь-яким з вказаних вище фрагментів. В інших варіантах здійснення антитіла отримані імунізацією трансгенної миші функціональними еквівалентами будьякого з вказаних вище фрагментів CTGF. Термін «специфічно зв'язується з областю CTGF» має на увазі, що антитіла мають специфічність зв'язування до певної області CTGF, яка може бути визначена первинною амінокислотною послідовністю або третинною, тобто тривимірною, конформацією частини поліпептиду CTGF. Специфічність зв'язування означає, що афінність антитіл до частини CTGF по суті більше, ніж їх афінність до інших родинних поліпептидів. Під терміном «по суті більшою афінністю» заявники мають на увазі, що є вимірне збільшення афінності до частини CTGF, в порівнянні з афінністю до інших родинних поліпептидів. Переважно, афінність щонайменше в 1,5 рази, 2 рази, 5 разів, 10 разів, 100 разів, 103 рази, 104 рази, 105 разів, 106 разів більше по відношенню до певної частини CTGF, ніж до інших білків. Переважно, специфічність зв'язування визначається за допомогою афінної хроматографії, імунопреципітації або аналізу зв'язування in vitro, такого як радіоімуноаналіз (RIA) або імуноферментний аналіз (ELISA), або аналіз сортування клітин з активацією флуоресценції (FASC). Більш переважно, специфічність зв'язування визначається за допомогою RIA або афінної хроматографії, як описано нижче. У переважних варіантах здійснення винаходу антитіла мають афінність, яка дорівнює або більша, ніж афінність mAb1, описана нижче, як визначено, наприклад, аналізом Скетчарда Munson and Pollard (1980, Anal Biochem 107:220). Афінність антитіла визначається як сила всіх нековалентних взаємодій між одним антигензв'язувальним сайтом антитіла і одним епітопом антигену. Афінність розраховується шляхом вимірювання константи асоціації (Kа), так що 11 Ab Ag 1 Ab Ag K d де [Ab] являє собою концентрацію вільного антигензв'язувального сайта антитіла, [Ag] являє собою концентрацію вільного антигену, [Ab·Ag] являє собою концентрацію антигензв'язувального сайта антитіла, зайнятого антигеном, і Kd являє собою константу дисоціації комплексу антитілоантиген. Переважно, антитіла за винаходом мають афінність до CTGF, яка більше ніж Kd=10-8, переважно, більше ніж 10-9, переважно, більше ніж 1010 , особливо для терапевтичного застосування. Переважно, антитіло відповідно до винаходу має афінність, аналогічну або більшу, ніж афінність mAb1 (тобто Kd≤10-9). Однак, антитіла, що розділяють епітоп, який зв'язується з mAb1, але мають більш низьку афінність (тобто більш високе значення Kj), ніж mAb1, також входять в об'єм винаходу і можуть потенційно використовуватися в різних аналізах і діагностичних видах застосування, як описано в даному описі. Такі антитіла можуть додатково використовуватися в терапевтичних видах застосування, особливо якщо вони володіють високою авідністю до антигену, як описано нижче. Антитіла відповідно до винаходу можуть бути одновалентними, двовалентними або вони можуть бути багатовалентними. У певних варіантах здійснення винаходу переважно, щоб антитіла за винаходом були двовалентними або багатовалентними. Будь-якими антитілами за винаходом можна маніпулювати для поліпшення авідності, наприклад, об'єднанням зв'язуючих епітоп сайтів в один конструкт антитіла, наприклад тритіло, і т.д. Антитіла відповідно до винаходу можуть являти собою одноланцюжкові антитіла. У деяких випадках може бути корисно, щоб антитіла за винаходом виявляли відповідну афінність до CTGF від інших видів, наприклад, для лікування і запобігання розладам у цих видів. Наприклад, антитіло за винаходом, яке виявляє відповідну Kd до собачого CTGF, можна використати для лікування пов'язаного з CTGF розладу у собак. Антитіла за винаходом, які виявляють перехресно-видову афінність, такі як mAb1, також можна використати як інструменти дослідження для вивчення пов'язаних з CTGF розладів на різних моделях у тварин. В іншому аспекті антитіло або його частина кодується генетичним матеріалом, спочатку отриманим у людини. Антитіло може бути генеровано клітинами в культурі, наприклад, з використанням техніки фагового дисплея, або воно може продукуватися у тварини, наприклад трансгенної тварини, відмінної від людини, що містить гени імуноглобуліну, отримані у людини. Крім того, винахід належить до рекомбінантних конструктів, що містять частини будь-яких антитіл за винаходом, як описано вище, і білок, отриманий з іншого джерела. Конкретно передбачені варіанти здійснення, що охоплюють химерні антитіла, які містять варіабельну область, отриману з моноклонального антитіла, яке специфічно зв'язується з областю на N-кінцевому фрагменті CTGF, і константну область, отриману з іншого Афінність= Ka 91182 12 джерела. Варіабельна область може бути отримана з будь-якого антитіла, визначеного винаходом, і, зокрема, охоплюються антитіла, які зв'язуються з областю людського CTGF від приблизно амінокислоти 97 до приблизно амінокислоти 180 SEQ ID NO:2, або, більш конкретно, від приблизно амінокислоти 103 до приблизно амінокислоти 164 SEQ ID NO:2, або, більш конкретно, від приблизно амінокислоти 134 до приблизно амінокислоти 158 SEQ ID NO:2, або, ще більш конкретно, від приблизно амінокислоти 143 до приблизно амінокислоти 154 SEQ ID NO:2, або до ортологічної області CTGF, отриманого від іншого вигляду. Константна область може бути отримана з будь-якого джерела. У деяких варіантах здійснення константну область отримують з константної області людського імуноглобуліну. Даний винахід також належить до будь-якого з описаних вище антитіл, де антитіло додатково включає мітку, здатну забезпечити сигнал, що виявляється, одну або разом з іншими речовинами. Такі засоби, що здійснюють мічення, можуть бути вибрані з групи, що складається з ферменту, флуоресцентної речовини, хемілюмінесцентної речовини, біотину, авідину і радіоактивного ізотопу, але не обмежуються ними. Даний винахід також належить до будь-якого з описаних вище антитіл, де антитіло додатково включає цитотоксичний засіб або фермент. В інших варіантах здійснення винаходу описані вище антитіла за винаходом додатково нейтралізували щонайменше одну активність, пов'язану з CTGF. Такі види активності, пов'язані з CTGF, включають, але не обмежуються цим, стимуляцію клітинної міграції, продукцію позаклітинного матриксу клітиною in vivo або ex vivo і/або зменшення фіброзу в індивідуума. У конкретних варіантах здійснення біологічна активність вибрана з групи, що складається з клітинного росту, диференціації фібробластів і/або ендотеліальних клітин і індукції експресії білків, що беруть участь в формуванні і перебудові позаклітинного матриксу, включаючи, наприклад, колагени, що включають, але не обмежуються ними, типи І, II, III і IV, і фібронектин. У певних варіантах здійснення винаходу антитіла специфічно інгібують міграцію клітин в аналізах ex vivo. Переважно, антитіла інгібують стимульовану CTGF міграцію гладком'язових клітин в аналізі в камері Boyden. Наприклад, в аналізі міграції клітин, описаному нижче, антитіла за винаходом повторно і відновно інгібують викликану CTGF міграцію. У різних варіантах здійснення антитіла специфічно зменшують фіброз у випадку моделей на тваринах. Переважно, антитіла інгібують розвиток у випадку моделей на тваринах пневмосклерозу і фіброзу нирок. Наприклад, антитіла ослабляють викликаний блеоміцином пневмосклероз у мишей на 60-70%, як було визначено шляхом інгібування легеневого накопичення гідроксипроліну (колагену) і/або гістологічного дослідження препаратів тканини, описаного нижче. Крім того, антитіла зменшують накопичення колагену у випадку моделі залишку нирки щура (тобто після нефректомії на 5/6), і у мишей після односторонньої обструкції сечоводу (UUO), як описано нижче. 13 В інших варіантах здійснення антитіла за винаходом модулюють взаємодію між поліпептидом CTGF і секретованим або асоційованим з мембраною кофактором, нейтралізуючи, за допомогою цього, біологічну активність CTGF. Кофактор може являти собою будь-який білок, вуглеводень і/або ліпід; в певних варіантах здійснення кофактором є член сімейства ростових факторів TGF-β, ВМР-4 і т.д. В іншому аспекті антитіло зменшує фіброз у субстанції. У різних варіантах здійснення субстанція являє собою тканину або орган. В іншому варіанті здійснення субстанцією є тварина, переважно ссавець, найбільш переважно людина. Коли субстанція являє собою тканину, винахід, зокрема, передбачає як ендогенні тканини, так і тканини ex vivo, наприклад, тканини трансплантата, тканину, вирощену в культурі, і т.д. В різних варіантах здійснення тканина вибрана з групи, що складається з епітеліальної, ендотеліальної і з'єднувальної тканини. Коли субстанція являє собою орган, винахід, зокрема, передбачає органи, вибрані з групи, що включає нирку, легеню, печінку, око, серце і шкіру. У переважних варіантах здійснення субстанцією є тварина, зокрема тварина виду ссавців, включаючи вид щурів, кроликів, корів, вівців, свиней, мишей, коней і приматів. У найбільш переважному варіанті здійснення субстанцією є людина. У певних варіантах здійснення винаходу антитіло використовується для лікування або профілактики пов'язаного з CTGF розладу у суб'єкта, в якого є пов'язаний з CTGF розлад або ризик його розвитку. Такі розлади включають, але не обмежуються цим, різні види раку, включаючи гострий лімфобластичний лейкоз, дерматофіброми, рак молочної залози, гліому і гліобластому, рабдоміосаркому і фібросаркому, десмоплазію, ангіоліпому, ангіолейоміому, десмопластичні форми раку і ріст і метастази раку передміхурової залози, яєчників, товстої і прямої кишки, підшлункової залози, шлунково-кишкового тракту і печінки і інших пухлин. Пов'язані з CTGF розлади також включають різні фібротичні розлади, включаючи, але не обмежуючись цим, ідіопатичний пневмосклероз, фіброз нирок, гломерулосклероз, очний фіброз, остеоартрит, склеродермію, серцевий фіброз і фіброз печінки. Фіброз може виникнути в будь-якому органі або тканині, включаючи орган, вибраний з нирки, легені, печінки, серця і шкіри, але не обмежуючись ними; або в тканині, вибраній з епітеліальної, ендотеліальної і з'єднувальної тканини, але не обмежуючись ними. В інших варіантах здійснення пов'язаний з CTGF розлад може бути викликаний будь-яким ініціюючим фактором, включаючи, але не обмежуючись цим, контакт з хімічними речовинами або біологічними агентами, запальну реакцію, аутоімунну реакцію, травму, хірургічні процедури і т.д. Пов'язані з CTGF розлади також включають, але не обмежуються цим, розлади внаслідок гіперглікемії і гіпертонії. Такі розлади можуть виникнути, наприклад, внаслідок цукрового діабету, ожиріння і т.д., і включають діабетичну нефропатію, ретинопатію і серцево-судинні захворювання. 91182 14 Тому, в різних варіантах здійснення винахід належить до антитіл, які можуть використовуватися для лікування або профілактики пов'язаних з CTGF розладів у індивідуума. Даний винахід також належить до застосування таких антитіл при виготовленні лікарського засобу для лікування пов'язаних з CTGF розладів. В іншому аспекті винахід належить до способу нейтралізації активності, пов'язаної з CTGF, що включає контактування антитіла за винаходом і поліпептиду CTGF, нейтралізування, за допомогою цього, біологічної активності CTGF, такої як види активності, описані вище. Біологічна активність може являти собою будь-яку активність CTGF, включаючи, але не обмежуючись цим, стимуляцію міграції клітин і продукцію позаклітинного матриксу. В різних варіантах здійснення нейтралізація відбувається in vitro. В інших варіантах здійснення нейтралізація відбувається у індивідуума in vivo. У ще одному аспекті винахід належить до способів застосування антитіла, як описано вище, для лікування пов'язаного з CTGF розладу у пацієнта, який потребує цього, де спосіб включає введення антитіла або його фармацевтичної композиції пацієнту, здійснюючи, за допомогою цього, лікування розладу. Індивідуум може являти собою пацієнта з діагностованим або передбачуваним пов'язаним з CTGF розладом, включаючи, наприклад, розлад, що виникає внаслідок надмірної продукції позаклітинного матриксу. У певних аспектах пов'язаний з CTGF розлад вибраний з раку або фібротичного розладу. Види раку включають, але не обмежуються цим, гострий лімфобластичний лейкоз, дерматофіброми, рак молочної залози, карциному молочної залози, гліому і гліобластому, рабдоміосаркому і фібросаркому, десмоплазію, ангіоліпому, ангіолейоміому, десмопластичні форми раку і рак передміхурової залози, яєчників, товстої і прямої кишки, підшлункової залози, шлунково-кишкового тракту і печінки, і фібротичні розлади включають, але не обмежуються цим, ідіопатичний пневмосклероз, фіброз нирок, гломерулосклероз, очний фіброз, дегенерацію жовтої плями, остеоартрит, склеродермію, хронічну серцеву недостатність, серцевий фіброз і фіброз печінки. В інших варіантах здійснення пов'язаний з CTGF розлад може бути викликаний будь-яким ініціюючим фактором, включаючи, але не обмежуючись цим, контакт з хімічними речовинами або біологічними агентами, запальну реакцію, аутоімунну реакцію, травму, хірургічні процедури і т.д. Пов'язані з CTGF розлади також включають, але не обмежуються цим, розлади внаслідок гіперглікемії і гіпертонії. Такі розлади можуть виникнути, наприклад, внаслідок цукрового діабету, ожиріння і т.д., і включають діабетичну нефропатію, ретинопатію і серцевосудинні захворювання. В іншому аспекті даний винахід належить до композиції, що містить антитіло, як описано вище, і щонайменше один інший компонент. Компоненти можуть включати будь-яку сполуку, молекулу або речовину, включаючи, наприклад, білки, нуклеїнові кислоти, вуглеводні, ліпіди і т.д. Крім того, компоненти можуть включати різні розчинники, солі і інші носії і/або ексципієнти. У деяких варіантах здійс 15 нення композиція являє собою фармацевтичну композицію, що містить антитіло, як описано вище, і щонайменше один додатковий компонент, вибраний з розчинника, стабілізатора або ексципієнта. У певному варіанті здійснення фармацевтична композиція включає антитіло в суміші з фармацевтично прийнятним носієм. Фармацевтична композиція може додатково містити другий терапевтичний засіб, наприклад, інгібітор ангіотензинперетворюючого ферменту (АСЕ), засіб для розщеплення або інгібування кінцевого продукту глікування і т.д. Винахід, крім того, належить до лікарських засобів, що містять антитіло, як визначено вище, для лікування індивідуума, що має пов'язаний з CTGF розлад. Такі розлади включають, але не обмежуються цим, різні форми раку і фібротичні розлади; розлади, які виникають внаслідок таких станів як інфаркт міокарда, артрит і запалення; і розлади внаслідок цукрового діабету, ожиріння і ним подібні, які можуть включати діабетичну нефропатію, ретинопатію і серцево судинні захворювання. В іншому варіанті здійснення винахід належить до поліпептидної послідовності, вибраної з групи, що складається з SEQ ID NO:14, амінокислот 1-167 SEQ ID NO:14, SEQ ID NO:20, і амінокислот 1-136 SEQ ID NO:20. Винахід також охоплює консервативні варіанти поліпептидів. В іншому варіанті здійснення винахід належить до специфічних фрагментів CTGF людини, вибраних з групи, що складається з послідовностей від SEQ ID NO:21 до SEQ ID NO:26, і ортологічних фрагментів CTGF, отриманих від видів, відмінних від людини. Вказані вище поліпептиди можуть являти собою «змінені» поліпептиди, як визначено нижче. В іншому варіанті здійснення винахід належить до полінуклеотидної послідовності, що кодує антитіло за винаходом, або його частину. У певних варіантах здійснення винаходу полінуклеотидна послідовність вибрана з групи, що складається з полінуклеотидної послідовності, що кодує SEQ ID NO:14, полінуклеотидної послідовності, що кодує амінокислоти 1-167 SEQ ID NO:14, полінуклеотидної послідовності SEQ ID NO:13, і полінуклеотиду, що включає нуклеотиди 1-501 SEQ ID NO:13. В іншому варіанті здійснення полінуклеотидна послідовність вибрана з групи, що складається з полінуклеотидної послідовності, що кодує SEQ ID NO:20, полінуклеотидної послідовності, що кодує амінокислоти 1-136 SEQ ID NO:20, полінуклеотиду SEQ ID NO:19, і полінуклеотиду, що включає нуклеотиди 1-408 SEQ ID NO:19. Вказані вище полінуклеотиди можуть являти собою «змінені» полінуклеотиди, як визначено нижче. Винахід, крім того, належить до рекомбінантних полінуклеотидів, що містять будь-яку з полінуклеотидних послідовностей, описаних вище, операбельно пов'язаних з послідовністю вектора, яка містить послідовності регулювання реплікації і траскрипції. В одному з аспектів рекомбінантний полінуклеотид кодує амінокислотну послідовність SEQ ID NO:14 або варіабельний домен в ній. В іншому аспекті рекомбінантний полінуклеотид включає SEQ ID NO:13. У ще одному аспекті реко 91182 16 мбінантний полінуклеотид кодує амінокислотну послідовність SEQ ID NO:20 або варіабельний домен в ній. У ще одному аспекті рекомбінантний полінуклеотид включає SEQ ID NO:19. Винахід також належить до клітин-хазяїнів, трансфікованих щонайменше одним з описаних вище рекомбінантних полінуклеотидів. Клітинихазяї включають будь-яку прокаріотичну і еукаріотичну клітину-хазяїна, включаючи, наприклад, клоновані клітинні лінії, що підтримуються способами культивування, відомими фахівцям в даній галузі. Клітини-хазяї також включають трансгенні рослини і тварин, отриманих з трансформованих клітин, наприклад стовбурових клітин. В одному варіанті здійснення клітина-хазяїн включає клітину, спільно трансфіковану полінуклеотидом, що кодує SEQ ID NO:14, і полінуклеотидом, що кодує SEQ ID NO:20, і яка продукує функціональне антитіло з характеристиками, по суті такими ж як у mAb 1. У певних варіантах здійснення винаходу антитіло являє собою CLN1. В іншому конкретному варіанті здійснення клітина-хазяїн позначена номером доступу в АТСС РТА-6006 (депонована 20 травня 2004p.). Ці і інші варіанти здійснення даного винаходу будуть легко зрозумілі фахівцям в даній галузі в світлі представленого опису, і всі такі варіанти здійснення конкретно передбачені даним винаходом. На Фіг.1А і 1В показано, що структура і послідовності фактора росту з'єднувальної тканини зберігаються. На Фіг.1А показана модулярна структура домену CTGF, який включає консервативні мотиви для білка, зв'язуючого подібний до інсуліну фактор росту (IGF-BP), і фактор фон Віллебранда (VWC) в N-кінцевому фрагменті і мотив тромбоспондину (TSP1) і вузла цистеїну (СТ) в Скінцевому фрагменті. На Фіг.1В показане упорядкування множинних послідовностей між Nкінцевими фрагментами ортологів людського (hCTGF), коров'ячого (bCTGF), свинячого (pCTGF), щурячого (rCTGF) і мишачого (FIPS12)CTGF. Упорядкування було створене з використанням програми CLUSTAL W (версія 1.74; Thompson et al. (1994) Nucleic Acids Res., 22: 4673-4680) з використанням параметрів за умовчанням. На кресленні зірочка (*) показує повне збереження амінокислотного залишку серед представлених видів. На Фіг.2А і 2В показані графіки Скетчарда конкурентного зв'язування між міченим і неміченим людським CTGF відповідно з антитілами проти CTGF, mАb2 і mAb1. mAb1 являє собою ілюстративне антитіло згідно з даним винаходом. На Фіг.3А показаний фрагмент антитіла Fab (Mr 45кДа), отриманий після розщеплення папаїном відповідного IgG антитіла mAb1 і подальшої афінної хроматографії на білку А-сефарозі (смуга 2), що було показано за допомогою SDS-PAGE (електрофорезу в поліакриламідному гелі з додецилсульфатом натрію). На Фіг.ЗВ показано зв'язування фрагмента Fab і відповідного IgG з CTGF в залежності від концентрації хаотропного агента, що збільшується, (тіоціанату). На Фіг.4А і 4В показані графіки Скетчарда конкурентного зв'язування між міченим рекомбінантним людським CTGF і неміченим щурячим CTGF, 17 відповідно, з антитілами проти CTGF, mАb2 і mAb1. На Фіг.5А, 5В і 5С представлені терапевтичні сприятливі ефекти антитіла за винаходом у випадку моделі інтерстиціального фіброзу в легені. На Фіг.5А показаний ефект лікування антитілом у випадку викликаного блеоміцином збільшення вмісту гідроксипроліну в легенях мишей. Кількість тварин в кожній групі показана в дужках під кожним стовчиком, а групи лікування вказані по осі х. SA: сольовий розчин; BL: блеоміцин; AbsJ: пул з 3 моноклональних антитіл за винаходом; mAb1, ілюстративне антитіло за винаходом. Величини виражені у вигляді середньої величини ±SE (стандартна помилка). На Фіг.5В і 5С показані забарвлені гематоксиліном і еозином парафінові зрізи легеневих проксимальних ацинусів від мишей, підданих впливу блеоміцину при внутрішньотрахеальній ін'єкції, і подальшому лікуванню відповідно сольовим розчином або антитілами за винаходом. На Фіг.5В тонкі міжальвеолярні перегородки ацинусу мають патологічний зовнішній вигляд, і присутні запальні клітини і фіброз. На Фіг.5С паренхіма в основному нормальна, і є лише помірне потовщення міжальвеолярних перегородок. На Фіг.6А, 6В і 6С представлені терапевтичні сприятливі ефекти антитіла за винаходом у випадку моделі канальцієво-інтерстиціального фіброзу нирки. На Фіг.6А показане зменшення фіброзу, завдяки односторонній обструкції сечоводу (UUO) після лікування антитілом за винаходом, mAb1 або антитілом mАb3, направленим на С-кінець CTGF. Міра фіброзу виражена у вигляді співвідношення між гідроксипроліном і проліном в нирці з обструкцією, в порівнянні з ниркою без обструкції (середня величина ±SE). На Фіг.6В і 6С показані забарвлені трихромом парафінові зрізи нирки з обструкцією, у випадку лікування відповідно сольовим розчином або антитілом. На Фіг.7 А і 7В представлений терапевтичний сприятливий ефект антитіла за винаходом у випадку моделі клубочкового фіброзу в нирці. На Фіг.7А і 7В показані мікрофотографії забарвленої трихромом тканини залишку нирки після отримання лікування відповідно сольовим розчином абоантитілом. На Фіг.8А, 8В, 8С, 8D, 8Е, 8F і 8G показана індукція локалізованих підшкірних гранульом у новонароджених мишей. Зліва на Фіг.8А і 8В показане утворення гранульоми на ділянці підшкірної ін'єкції одного TGFβ або TGFβ і CTGF, відповідно. Праворуч на Фіг.8C-G показана гістологічна панель, що представляє систему бальної оцінки (від 0 [нормальна] до 4 [фібротична]), що використовується для оцінки терапевтичного сприятливого ефекту антитіла. На Фіг.9 показана міра фіброзу в моделі локалізованої підшкірної гранульоми з лікуванням антитілом проти CTGF і без нього. mAb1 являє собою ілюстративне антитіло за винаходом, тоді як mАb3 являє собою антитіло проти CTGF, яке специфічно зв'язується з С-кінцевим епітопом CTGF. На Фіг.10А, 10В, 10С і 10D представлений терапевтичний сприятливий ефект антитіла за винаходом при фіброзі органа у випадку використання 91182 18 моделі системного склерозу (склеродермії). На кожній панелі представлена зміна накопичення колагену у відповідних органах після лікування сольовим розчином (контроль), TGFβ і CTGF або лікування TGFβ і CTGF в поєднанні з лікуванням антитілом. На Фіг.11А і 11В показано графічне зображення клонування важкого і легкого ланцюгів імуноглобуліну ілюстративного антитіла за винаходом, mAb1. На Фіг.11А показано упорядкування фрагментів важкого ланцюга PCR (полімеразної реакції синтезу ланцюга), що використовуються для визначення кодуючої послідовності важкого ланцюга (CDS) mAb1. На Фіг.1 ЇВ показане упорядкування фрагментів легкого ланцюга PCR, що використовуються для визначення кодуючої послідовності легкого ланцюга (CDS) mAb1. На Фіг.12А і 12В представлені результати дослідження зв'язування між CTGF і TGFβ. На Фіг.12А показана міра зв'язування між TGFβ і або CTGF, фрагментом CTGF, що кодується екзоном 3 (Екзоном 3), або фрагментом CTGF, що кодується екзоном 5 (Екзоном 5), в присутності або за відсутності антитіла проти CTGF. На Фіг.12В показана міра, до якої антитіла проти CTGF інгібують взаємодію TGFβ і CTGF. На фігурі антитіла включають ілюстративні антитіла за винаходом, mAb1 і mAb4 і антитіло, яке специфічно зв'язується з С-кінцевим епітопом CTGF, mAb3. Перш ніж описувати дані композицій і способи, потрібно розуміти, що винахід не обмежується описаними конкретними методологіями, послідовностями операцій, лініями клітин, аналізами і реагентами, оскільки вони можуть варіюватися. Потрібно також розуміти, що термінологія, що використовується в даному описі призначена для опису конкретних варіантів здійснення даного винаходу і жодним чином не призначена для обмеження об'єму даного винаходу, як викладено в прикладеній формулі винаходу. Поки немає інших визначень, всі технічні і наукові терміни, що використовуються в даному описі, мають такі ж значення, які звичайно зрозумілі середньому фахівцеві в даній галузі, для якого призначений цей винахід. Хоча в практиці або тестуванні даного винаходу можна використати будь-які способи і матеріали, аналогічні або еквівалентні тим, які описані в даному винаході, тут описані переважні способи, пристрої і матеріали. Всі наведені в даному описі публікації приведені тут як посилання з метою опису і розкриття методологій, реагентів і інструментів, про які повідомлялося в публікаціях, які можуть використовуватися в зв'язку з винаходом. В даному описі ніщо не треба тлумачити як допущення того, що винахід не дає право передбачати таке розкриття на основі попереднього винаходу. За відсутності інших вказівок при здійсненні даного винаходу використовуються звичайні способи хімії, біохімії, молекулярної біології, клітинної біології, генетики, імунології і фармакології в межах навичок в даній галузі. Повне пояснення таких методик є в літературі (див., наприклад, Gennaro A.R., ed. (1990) Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing Co.; Colowinck 19 S. et al, Eds., Methods In Enzymology, Academic Press, Inc.; Handbook of Experimental Immunology, Vols.I-IV (D.M. Weir and C.C. Blackwell, eds., 1986, Blackwell Scientific Publications); Maniatis T. et al., eds. (1989) Molecular Cloning: A Laboratory Manual, 2nd edition, Vols. I-III, Cold Spring Harbor Laboratory Press; Ausubel F.M. et al., eds. (1999) Short Protocols on Molecular Biology, 4th edition, John Wiley & Sons; Ream et al., eds. (1998) Molecular Biology Techniques: An Intensive Laboratory Course, Academic Press); PCR (Introduction to Biotechniques Series), 2nd ed. (Newton & Graham eds., 1997, Springer Verlag). Визначення «Фактор росту з'єднувальної тканини» або «CTGF» належить до амінокислотних послідовностей по суті очищеного CTGF, отриманого у будьякого виду, зокрема, виду ссавців, включаючи щура, кролика, корову, вівцю, свиню, мишу, коня і людиноподібну мавпу, переважно у людини, і з будь-якого джерела, натурального, синтетичного, напівсинтетичного або рекомбінантного. Термін «N-кінцевий фрагмент» CTGF належить до будь-якого поліпептиду, що містить послідовності, отримані з амінокінцевої частини поліпептиду CTGF, або до будь-якого його варіанта або фрагментів. N-кінцеві фрагменти можуть не включати або включати весь CTGF або його частини від початкового метіонінового залишку до позбавленого цистеїну шарніра, як показано на Фіг.1А і 1В. Далі, N-кінцеві фрагменти можуть не включати або включати весь білковий мотив, зв'язуючий інсуліновий фактор росту, і/або домен фон Вілебранда типу С (SEQ ID NO:21) або їх частини, як показано на Фіг.1В. N-кінцеві фрагменти CTGF можуть також не включати або включати всю вільну від цистеїну область або її частини. Далі, Nкінцеві фрагменти CTGF можуть являти собою будь-які 15 або більше сусідніх амінокислот, що містяться в межах будь-якого визначеного вище попереднього N-кінцевого фрагмента. В одному аспекті «N-кінцевий фрагмент» CTGF належить до поліпептидних послідовностей, отриманих з амінокінцевої частини людського CTGF. Такі фрагменти можуть охоплювати всю область від аміноксилотного залишку 1 до приблизно амінокислотного залишку 198 SEQ ID NO:2 або від приблизно амінокислоти 23 до приблизно амінокислоти 198 SEQ ID NO:2. Кордон N-кінцевого фрагмента в межах шарніра може бути необов'язково визначений одним з декількох сайтів розщеплення протеази, визначених в SEQ ID NO:2, таких як сайти розщеплення хімотрипсину між залишками 179 і 180, між залишками 182 і 183 і між залишками 188 і 189; сайти розщеплення плазміну між залишками 183 і 184 і між залишками 196 і 197; і сайт розщеплення кісткового морфогенетичного білка-1 між залишками 169 і 170. Крім того, Nкінцеві фрагменти людського CTGF можуть не включати або включати всю або частини області амінокислот 27-97 SEQ ID NO:2, амінокислот 103166 SEQ ID NO:2 або амінокислот 167-198 SEQ ID NO:2. Далі, N-кінцеві фрагменти людського CTGF можуть являти собою будь-які 15 або більше сусідніх амінокислот, що містяться в межах будь-якого 91182 20 визначеного вище попереднього N-кінцевого фрагмента. У певних варіантах здійснення винаходу Nкінцеві фрагменти CTGF даного винаходу містять послідовності, вибрані з наступних областей людського CTGF (SEQ ID NO:2) і його ортологічних фрагментів, отриманих від різних видів, зокрема виду ссавців, включаючи щура, кролика, корову, вівцю, свиню, мишу, коня: амінокислотні залишки 23-96 (що кодуються екзоном 2); амінокислотні залишки 27-97 (мотив IGF-BP); амінокислотні залишки 97-180 (що кодуються екзоном 3); амінокислотні залишки 103-166 (домен VWC); амінокислотні залишки 167-198 (позбавлений цистеїну шарнір); амінокислотні залишки 23-180 (що кодуються екзонами 2 і 3); амінокислотні залишки 27166 (IGF-BP і VWC); і амінокислотні залишки 23198 (див. Фіг.1В). Термін «С-кінцевий фрагмент» CTGF належить до будь-якого поліпептиду, що містить послідовності, отримані з карбоксикінцевої частини амінокислотної поліпептидної послідовності CTGF, або до будь-яких його варіантів або фрагментів. Скінцеві фрагменти CTGF можуть не включати або включати всю або частини позбавленої цистеїну області поліпептиду CTGF (амінокислоти 167-198 SEQ ID NO:2). С-кінцеві фрагменти можуть не включати або включати всю або частини CTGF від позбавленого цистеїну шарніра до кінця білка. Далі, С-кінцеві фрагменти можуть не включати або включати всю або частини мотиву тромбоспондину і/або мотиву цистеїнового вузла. Далі, С-кінцеві фрагменти CTGF можуть являти собою будь-які 15 або більше сусідніх амінокислот, що містяться в межах будь-якого визначеного вище попереднього Скінцевого фрагмента. У деяких аспектах винаходу С-кінцеві фрагменти можуть охоплювати всю область від амінокислотного залишку 181 до приблизно амінокислотного залишку 349 SEQ ID NO:2. Кордон С-кінцевого фрагмента всередині шарніра може бути необов'язково визначений одним з декількох сайтів розщеплення протеази, визначених в SEQ ID NO:2, таких як визначені вище сайти розщеплення хімотрипсину, плазміну і кісткового морфогенетичного білка-1. Крім того, С-кінцеві фрагменти включають послідовності, вибрані з наступних областей людського CTGF (SEQ ID NO:2) і їх ортологічних фрагментів, отриманих у різних видів, зокрема видів ссавців, включаючи щура, кролика, корову, вівцю, свиню, мишу і коня: амінокислоти 201-242 SEQ ID NO:2, амінокислоти 247-349 SEQ ID NO:2, амінокислоти 248-349 SEQ ID NO:2 або амінокислоти 249-346 SEQ ID NO:2. Далі, С-кінцеві фрагменти людського CTGF можуть являти собою будь-які 15 або більше сусідніх амінокислот, що містяться всередині будь-якого визначеного вище попереднього С-кінцевого фрагмента. Терміни «позбавлена цистеїну область» або «шарнір» CTGF відносяться до будь-якого поліпептиду, що походить від приблизно амінокислотного залишку 167 до приблизно амінокислотного залишку 198 людського CTGF (SEQ ID NO:2), і його ортологічних фрагментів, отриманих від різних 21 видів, зокрема виду ссавців, включаючи щура, кролика, корову, вівцю, свиню, мишу, коня. Терміни «амінокислотна послідовність» або «поліпептид» або «поліпептиди», що використовуються в даному описі, відносяться до олігопептидних, пептидних, поліпептидних або білкових послідовностей і їх фрагментів і до природних або синтетичних молекул. Поліпептидний фрагмент або амінокислотний фрагмент являє собою частину поліпептиду, яка зберігає щонайменше одну структурну і/або функціональну характеристику поліпептиду. Фрагменти CTGF включають будьяку-частину поліпептидної послідовності CTGF, яка зберігає щонайменше одну структурну і/або функціональну характеристику CTGF. Коли «амінокислотна послідовність» вказується для позначення поліпептидної послідовності природної молекули білка, термін «амінокислотна послідовність» і подібні терміни не призначені для обмеження амінокислотної послідовності повною нативною послідовністю, пов'язаною з вказаною молекулою білка. Термін «імуногенність» належить до здатності речовини при введенні в організм стимулювати імунну відповідь і продукцію антитіла. Засіб, що виявляє властивість імуногенності, називається імуногенним. Імуногенні засоби можуть включати, але не обмежуються цим, різноманітні макромолекули, такі як, наприклад, білки, ліпопротеїди, полісахариди, нуклеїнові кислоти, бактерії і бактерійні компоненти і віруси і вірусні компоненти. Імуногенні засоби часто мають молекулярну масу більше ніж 10кДа. Антигенними фрагментами іменуються фрагменти поліпептиду CTGF, переважно, фрагменти довжиною приблизно від 5 до 15 амінокислот, які зберігають щонайменше один біологічний або імунологічний аспект активності поліпептиду CTGF. Термін «антитіло» належить до інтактних молекул, а також до їх фрагментів, таких як Fab, F(ab')2 і Fv, які здатні зв'язувати епітопну детермінанту, і включають поліклональні і моноклональні антитіла. Антитіла, які зв'язують CTGF або фрагменти CTGF, можна отримати з використанням інтактних поліпептидів або з використанням фрагментів, що містять дрібні цікавлячі пептиди як імунізуючий антиген. Поліпептид або олігопептид, що використовується для імунізації тварини (наприклад, миші, кролика, курки, індички, кози і т.д.), може бути отриманий внаслідок трансляції РНК або синтезований хімічно, і, за бажанням, він може бути кон'югований з білком-носієм. Носії, що звичайно використовуються, хімічно сполучені з пептидами, включають, наприклад, бичачий сироватковий альбумін, тиреоглобулін і гемоціанін лімфи равлика (KLH). Термін «моноклональне антитіло», що використовується в даному описі, належить по суті до однорідної популяції антитіл, тобто до окремих антитіл, що включають популяцію, яка є ідентичною по специфічності і афінності, за винятком можливих природних мутацій, які можуть бути присутні в невеликих кількостях. Потрібно зазначити, що композиція моноклонального антитіла може містити більше за одне моноклональне антитіло. 91182 22 Моноклональні антитіла, включені в межі об'єму винаходу, включають гібридні і рекомбінантні антитіла (наприклад «гуманізовані» антитіла), незалежно від видів походження або позначення класу або підкласу імуноглобуліну, а також фрагменти антитіл (наприклад, Fab, F(ab')2 і Fv), що мають щонайменше одну з визначених характеристик антитіл, описаних в даному описі. Переважні варіанти здійснення включають антитіла, здатні зв'язуватися по суті з тим же епітопом, що і епітоп, який розпізнається моноклональним антитілом mAb1, і/або мають афінність до цього епітопу, яка більше або дорівнює афінності mAb1. Термін «моноклональне» вказує на характер антитіла як по суті однорідної популяції антитіл і не повинен трактуватися як такий, що вимагає продукції антитіла яким-небудь певним способом. Наприклад, моноклональні антитіла за винаходом можуть бути виготовлені методом гібридоми, вперше описаним Kohler and Milstein (1975, Nature 256:495-497), або можуть бути виготовлені методами рекомбінантної ДНК (наприклад, див., Celltech Therapeutics Ltd., європейський патент ЕР0120694; Cabilly et al, патент США №4816567 або Mage and Lamoyi (1987; In: Monoclonal Antibody Production Techniques and Applications, Marcel Dekker, Inc., New York, pp.79-97). Термін «нейтралізуюче антитіло», що використовується в даному описі, належить до антитіла, переважно, моноклонального антитіла, яке здатне істотно інгібувати або усунути біологічну активність CTGF. Звичайно нейтралізуюче антитіло інгібує зв'язування CTGF з кофактором, таким як TGFβ з CTGF-специфічним рецептором, пов'язаним з клітиною-мішенню або з іншою біологічною мішенню. У певному варіанті здійснення нейтралізуюче антитіло інгібує біологічну активність CTGF в мірі, приблизно рівній або більшій, ніж mAb1, переважно, нейтралізуюче антитіло інгібує біологічну активність CTGF в мірі, приблизно рівній або більшій, ніж CLN1. Фраза «пов'язані з CTGF розлади», що використовується в даному описі, належить до станів і захворювань, пов'язаних з аномальною або зміненою експресією або активністю CTGF. Аномальна експресія CTGF пов'язана з клітинними проліферативними розладами, такими як розлади, викликані проліферацією ендотеліальних клітин; клітинна міграція, види росту, подібні до пухлинного росту; загальне рубцювання тканини і різні захворювання, що характеризується невідповідним відкладенням позаклітинного матриксу. Розлади, пов'язані з CTGF, включають, але не обмежуються цим, розлади, що залучають ангіогенез і інші процеси, які грають центральну роль при таких станах як проліферативна вітреоретинопатія, рак, включаючи гострий лімфобластичний лейкоз, дерматофіброми, рак молочної залози, карцинома молочної залози, гліома і гліобластома, рабдоміосаркома і фібросаркома, десмоплазія, ангіоліпома, ангіолейоміома, дермопластичні ракові пухлини, і рак передміхурової залози, яєчників, товстої і прямої кишки, підшлункової залози, шлунково-кишкового тракту і печінки; інший пухлинний рост і метастази і т.д. 23 Розлади, пов'язані з CTGF, також включають фібротичні розлади і пов'язані з ними стани, такі як надмірне рубцювання, що виникає в результаті локалізованого або системного фіброзу, хронічний або гострий фіброз органів, таких як нирка, легені, печінка, очі, серце, шкіра і т.д., або тканини, вибраної, але не обмежено цим, з епітеліальної, ендотеліальної і з'єднувальної тканини. Фіброз може також виникнути в очах і суглобах. Такі розлади, пов'язані з CTGF, включають, наприклад, серцевий фіброз, включаючи серцевий реактивний фіброз або серцева перебудова після інфаркту міокарда або застійної серцевої недостатності, легеневі розлади, включаючи інтерстиціальний легеневий фіброз і т.д.; фіброз, пов'язаний з діалізом, включаючи перитонеальний діаліз, наприклад, постійний амбулаторний перитонеальний діаліз (CAPD); перидуральний фіброз, нирковий фіброз, легеневий фіброз, інтерстиціальний фіброз, шкірний фіброз і фіброз, що виникає внаслідок гострих або повторних травм, включаючи хірургічні операції, хіміотерапію, променеве лікування, відторгнення алотрансплантата, хронічне і гостре відторгнення трансплантата (наприклад, нирки, печінки або іншого органа), облітеруючий бронхіоліт, наприклад, після трансплантації легенів, і запалення і інфекція, наприклад, внаслідок хвороби або пошкодження. Крім того, розлади, пов'язані з CTGF, включають, але не обмежуються цим, склеротичні стани, включаючи системний склероз, склеродермію, келоїди, гіпертрофічне рубцювання і інші дерматологічні захворювання і стани; атеросклероз, такий як стани, що включають атеросклеротичні бляшки. І атеросклероз, пов'язаний з цукровим діабетом, перитонеальним діалізом і т.д.; артрит, включаючи ревматоїдний артрит, остеоартрит і інші суглобові запальні стани і т.д.; інтерстиціальні захворювання, включаючи інтерстиціальний фіброз; хворобу Крона; запальне захворювання кишечнику; ретинопатії, включаючи, наприклад, проліферативну вітреоретинопатію, непроліферативну діабетичну ретинопатію, проліферативну діабетичну ретинопатію і дегенерацію жовтої плями, включаючи пов'язану з віком і ювенільну хворобу (Stargardt), і відшаровування пігментного епітелію; нефропатії, включаючи діабетичну нефропатію, нефропатію, пов'язану з IgA, нефропатію, пов'язану з токсичністю, вовчакове ниркове захворювання і т.д.; і стани, пов'язані з хімічною токсичною деструкцією канальців. Розлади, пов'язані з CTGF, також включають, але не обмежуються цим, розлади внаслідок гіперглікемії, гіпертонії, утворення кінцевого продукту глікування (AGE) і т.д. Такі розлади можуть виникнути, наприклад, внаслідок цукрового діабету, ожиріння і т.д. і включають діабетичну нефропатію, ретинопатію і серцево-судинні захворювання. Крім того, розлади, пов'язані з CTGF, можуть бути викликані будь-яким ініціюючим фактором, включаючи, але не обмежуючись цим, контакт з хімічними або біологічними речовинами, запальну реакцію, аутоімунну реакцію, травму, хірургічні процедури і т.д. В деяких варіантах здійснення використовуються способи для лікування пацієнта, 91182 24 що має схильність до розладу, пов'язаного з CTGF, внаслідок стану, що включає, але не обмежується цим, інфаркт міокарда, артрит і локальне або системне запалення. Вказані в даному описі «проліферативні» процеси і розлади включають патологічні стани, що характеризуються постійним розмноженням клітин, яке приводить до надмірного росту клітинної популяції в межах тканини. Клітинні популяції необов'язково являють собою трансформовані, викликаючі ріст пухлин або злоякісні клітини, але вони можуть також включати нормальні клітини. Наприклад, CTGF може брати участь патологічно при проліферативному ураженні шару інтими артеріальної стінки, приводячи до атеросклерозу, або стимуляції CuSO4 і 100мкМ ZuSO4, і через 4 дні середовище збирали і просвітляли центрифугуванням і фільтрацією, як вказано вище. CTGF, продукований будь-яким способом, описаним вище, очищали таким чином. 4л кондиціонованого середовища завантажували на гепаринову колонку ємністю 5мл НІ-TRAP (Amersham Biosciences Corp., Piscataway NJ), заздалегідь врівноважену 50мМ Tris (pH7,5), 150мМ NaCl. Колонку промивали 10 об'ємами колонки 350мМ NaCl, 50мМ Tris (pH7,5). CTGF елюювали з колонки із збільшенням градієнта солі NaCl. Проводили скринінг елюйованих фракцій за допомогою SDSPAGE, і об'єднували фракції, що містять CTGF. Очищений гепарином CTGF розбавляли до кінцевої провідності 5,7мС апірогенною двічі дистильованою водою і рН доводили до 8,0. Сильну аніонообмінну колонку Q-SEPHAROSE (Amersham Biosciences), що містить приблизно 23мл смоли, сполучену тандемом з карбометиловою полістироловою колонкою (CM) POROS (Applied Biosystems), що містить приблизно 7мл смоли, використовували для видалення ендотоксину і захоплення і елюювання очищеного rhCTGF. Перед завантаженням зразка тандемну колонку промивали 0,5Μ NaOH з подальшим промиванням 0,1Μ NaOH і, нарешті, врівноважуючим буфером. Завантажений зразок пропускали через тандемну колонку, колонку Q-Sepharose видаляли, і CTGF елюювали з колонки CM POROS (Applied Biosystems) із збільшенням градієнта від 350мМ до 1200мМ NaCl. Чистоту елюйованих фракцій, що містять CTGF, оцінювали за допомогою аналізу SDS-PAGE перед формуванням кінцевого пулу зразка. Приклад 2. Продукція N-кінцевого і С-кінцевого фрагмента CTGF N-кінцеві і С-кінцеві фрагменти CTGF отримували таким чином. Рекомбінантний людський CTGF, отриманий і очищений, як описано вище, розщеплювали при кімнатній температурі протягом 6год. шляхом обробки кульками хімотрипсину (Sigma Chemical Co., St.Louis, МО) при 1,5мг CTGF на одиницю хімотрипсину. Суміш центрифугували, кульки хімотрипсину видаляли, і супернатант, що містить ферментативно розщеплений CTGF, розводили 1:5 50мМ Tris, pH7,5. Розбавлений супернатант наносили на гепаринову колонку Ні-Тrар. Збирали утримуючі N-кінцеві фрагменти CTGF, що елююються. Гепаринову колонку промивали 25 350мМ NaCl, і пов'язані С-кінцеві фрагменти CTGF елюювали з лінійним градієнтом від 350мМ до 1200мМ NaCl, як описано вище. Фракції аналізували SDS-Page, і об'єднували фракції, що містять С-кінцеві фрагменти CTGF. Елюент з гепаринової колонки, який містив Nкінцеві фрагменти CTGF, доводили до 0,5Μ сульфату амонію/50мМ Tris при рН7,5 і потім завантажували на колонку фенілсефарози HP на 15мл (Amersham-Pharmacia), яка була заздалегідь урівноважена 0,5Μ сульфату амонію/50мМ Tris при рН7,5. Колонку промивали 15 колонковими об'ємами 0,5Μ сульфату амонію/50мМ Tris при рН7,5, і пов'язані N-кінцеві фрагменти CTGF елюювали з лінійним градієнтом від 0,5 до 0Μ сульфату амонію/50мМ Tris при рН7,5 приблизно 15 об'ємами колонки. Фракції аналізували SDS-PAGE, і об'єднували фракції, що містять N-кінцеві фрагменти CTGF. Об'єднаний розчин концентрували, і буфер обмінювали з 50мМ Tris, 400мМ NaCl (рН7,2), використовуючи ультрафільтраційну мембрану ULTRACEL AMICON YM10 (Millipore Corp., Bedford MA). Приклад 3. Продукція людських мококлональних антитіл проти CT6F Повністю людські моноклональні антитіла до людського CTGF отримували, використовуючи лінії НСо7, НСо12 і НСо7+НСо12 мишей HUMAB (Medarex, Inc., Princeton NJ). Мишей імунізували аж до 10 внутрішньочеревинними (IP) або підшкірними (Sc) ін'єкціями 25-50мг рекомбінантного людського CTGF в повному ад'юванті Фрейнда протягом періоду 2-4 тижнів. Імунну відповідь контролювали заочноямковими крововиливами. Скринінг плазми проводили за допомогою ELISA (як описано нижче), і мишей з достатніми титрами імуноглобуліну проти CTGF використовували для гібридизацій. Мишам внутрішньовенно повторно проводили імунізацію антигеном за 3 і 2 дні до уметвіння і видалення селезінки. Суспензії одиночних клітин селезінкових лімфоцитів від імунізованих мишей піддавали гібридизації з однією четвертою кількості не секретуючих клітин мієломи мишей P3X63-Ag8.653 (Американська колекція типових культур (АТСС), Manassas VA) в 50% PEG (Sigma, St.Louis МО). Клітини висівали в концентрації приблизно 1 105 клітин/ямка в титрувальний мікропланшет з плоским дном і інкубували протягом приблизно 2 тижнів в середовищі DMEM (модифікованому Дульбекко середовищі Ігла) з високим вмістом глюкози (Mediatech, Hemdon VA), що містить L-глутамін і піруват натрію, 10% фетальну телячу сироватку, 10% кондиціоноване середовище P388D1 (АТСС), 3-5% ориген (Igen International, Gaithersburg MD), 5мМ HEPES, 0,055мМ 2-меркаптоетанолу, 50мг/мл гентаміцину і 1х HAT (Sigma). Через 1-2 тижнів клітини культивували в середовищі, в якому HAT був заміщений НТ. Потім проводили скринінг окремих осередків ELISA (описаний нижче). Секретуючі антитіла гібридоми повторно висівали на планшети, знов проводили скринінг, і, якщо вони ще були позитивними то антитіла проти CTGF, субклонували щонайменше двічі при обмежуючому розведенні. Потім стійкі субклони культивували 91182 26 in vitro для генерування невеликих кількостей антитіла в середовищі для культури тканини, щоб охарактеризувати. Один клон від кожної гібридоми, яка зберігала реактивність материнських клітин, використовували для генерування банків клітин в 5-10 флакончиках, що зберігалися в рідкому азоті. Аналізи ELISA виконували, як описано Fishwild et al. (1996, Nature Biotech., 14:845-851). Коротко, титрувальні мікропланшети покривали 1-2 мкг/мл очищеного рекомбінантного CTGF в PBS (сироватці з фосфатним буфером) в концентрації 50мкл/ямка, інкубували при 4°С протягом ночі, потім блокували 200мкл/ямка 5% курячою сироваткою в PBS/Tween (0,05%). Розведення плазми від мишей, імунізованих CTGF, або супернатанти культури гібридоми, додавали в кожну ямку і інкубували 1-2год. при навколишній температурі. Планшети промивали PBS/Tween і потім інкубували з козячим поліклональним антитілом Fc проти людського IgG, кон'югованим з пероксидазою хрону (HRP) протягом 1год. при кімнатній температурі. Після промивання планшети виявляли 0,22мг/мл субстрату ABTS (Sigma) і аналізували з допомогою спектрофотометра при 415-495нм. Приклад 4: Характеристика антитіла Гібридоми, які продукували антитіла до людського CTGF, отримували, як описано в прикладі 3. Клоновані клітини гібридоми вирощували в модифікованому Дульбекко середовищі Ігла з високим вмістом глюкози/RPMI 1640 (50:50) з 8мМ Lглутаміну, ½х не незамінних амінокислот і 10% фетальною телячою сироваткою. Клітини, розмножені для отримання антитіла, вирощували в тому ж середовищі з 1,5% фетальною телячою сироваткою з низьким вмістом IgG протягом 4-9 днів при 37°С і 6% СО2. Отримане кондиціоноване середовище очищали від клітин і концентрували, використовуючи пристрій фільтрації в тангенціальному потоку/концентрування. Концентрат пропускали через колонку з білком А, і зв'язані моноклональні антитіла елюювали 100мМ гліцину, рН3. Елюат нейтралізували 1Μ Tris, рН8,0 і проводили діаліз проти PBS. 4.1 Картування епітопів Картування епітопів антитіл за допомогою експериментів конкурентного зв'язування добре відоме фахівцям в галузі імунології (див., наприклад, Van Der Geld et al. (1999) Clinical and Experimantal Immunology, 118:487-96). Кожну популяцію антитіл, виділену з клітин, що розмножилися з унікальної клітини клонованої гібридоми, картували і відносили до специфічного домену зв'язування людського CTGF, використовуючи стандартні експерименти зв'язування і блокування (див., наприклад, Antibodies: A Laboratory Manual (1988) Harlow and Lane (eds), Cold Spring Harbor Laboratory Press; Tietz Textbook of Clinical Chemistry, 2nd ed., (1994) Chapter 10 (Immunochemical Techniques), Saunders і Clinical Chemistry: Theory, Analysis, Correlation (1984) Chapter 10 (Immunochemical Techniques) і Chapter 11 (Competitive Binding Assays), C.V. Mosby, St. Louis). Незалежні домени зв'язування спочатку визначали за допомогою експериментів конкуренції антитіл, в яких 2 різних антитіла інку 27 бували в послідовному порядку на планшетах, покритих CTGF. Якщо стерична перешкода від першого антитіла заважала зв'язуванню другого антитіла з CTGF, то ці 2 антитіла відносили до одного і того ж домену зв'язування. Однак потрібно розуміти, що ці 2 антитіла можуть мати різні епітопи, але все ж настільки близькі по відношенню один до одного, щоб позначатися як члени одного і того ж домену зв'язування. Були ідентифіковані домени зв'язування, що охоплюють всі 4 екзони людського CTGF. Всі домени зв'язування конформаційно визначені, так що антитіла зв'язуються з CTGF в невідновлювальних умовах в аналізах вестерн-блотинга. Деякі антитіла також зв'язуються з CTGF у відновлювальних умовах в аналізах вестерн-блотинга, це передбачає, що кожне з цих антитіл зв'язується з лінійним епітопом білка CTGF. Також антитіла, що представляють піднабір доменів зв'язування, виявляють перехресну реактивність на мишачий CTGF в аналізах вестерн-блотинга. Антитіло з кожної групи, що має найвищу афінність до всього CTGF, використовували для подальшої характеристики і аналізу. Більш точне картування епітопів виконували за допомогою аналізу ELISA, використовуючи специфічні рекомбінантно експресовані фрагменти 91182 28 CTGF. Наприклад, антитіла, які розпізнають епітопи N-кінцевого домену CTGF, ідентифікували аналізом ELISA проти іммобілізованих фрагментів, отриманих внаслідок рекомбінантної експресії екзону 2 і/або екзону 3 гена CTGF. Таким чином, відбирали і проводили подальшу характеристику антитіл, які специфічно розпізнають N-кінцеві домени або N-кінцеві фрагменти CTGF. Також відбирали і проводили подальшу характеристику антитіл, які специфічно розпізнають С-кінцеві домени або С-кінцеві фрагменти CTGF. Група епітопів, визначена mAb1, зв'язується з лінійним епітопом N-кінцевого фрагмента CTGF, що кодується екзоном 3. Була генерована серія усічених синтетичних пептидів, що перекривають області, які кодуються полінуклеотидом екзону 3, і були проведені тести ELISA з використанням цих пептидів для подальшого визначення епітопу mAb1. Результати підсумовані в табл. 1; «+» вказує на зв'язування між пептидом і mAb1, тоді як «-» вказує на те, що mAb1 не зв'язується з пептидом. Представлена жирним шрифтом курсивом «С» вказує на залишок цистеїну в пептиді, який є істотним для зв'язування mAb1. Підкреслена «С» вказує на залишок цистеїну, доданий на кінці, і що не є частиною послідовності нативного CTGF. Таблиця 1 Пептид N-CTGF Экзон 3 Рер135 РС5444 РС5445 РЕР5 Р40340 Р40341 Р40342 10MER 10MER2 9MER 9MER2 8MER 8MER2 7MER 6MER 5MER Зв'язування mAb1 з серією усічених пептидів, кодованих екзоном 3 Послідовність Зв'язування mAb1 + + CPLCSMDVRLPS PDCPFPRRVKLP + PLSSMDVRLPSPDS RLPSPDSPFPRRVKLPGK + RLPSPDCPFPRRVKL + RLPSPDCPFPRRV + RLPSPDSPFPRRV LPSPDCPFPRRVKL + SPDSPFPRRV SPDCPFPRRV PDSPFPRRV CPFPRRVKL DSPFPRRV CPFPRRVKL CPRRVKL CRRVKL CRVKL Тому mAb1 є членом класу антитіл, які зв'язуються з N-кінцевою областю CTGF. Лінійний епітоп CTGF, необхідний і достатній для зв'язування mAb1, визначається амінокислотними залишками L143-V154 людського CTGF (SEQ ID NO:2). Додаткове підтвердження специфічності зв'язування mAb1 з цим пептидом було отримане з допомогою RIA і афінної хроматографії. Антитіла, які розділяють цей епітоп, частково або повністю, особливо включені в даний винахід. Крім того, антитіла, які конкурують з mAb1 за зв'язування з CTGF або його SEQ ID NO: фрагментом, також особливо включені в даний винахід. 4.2 Афінність антитіл до CTGF Афінність антитіл визначається як сила всіх нековалентних взаємодій між одним антигензв'язувальним сайтом антитіла, і одним епітопом антигену. Афінність розраховується за допомогою вимірювання константи асоціації (Kа), так що Ab Ag 1 Афінність= Ka Ab Ag K d де [Аb] являє собою концентрацію вільного антигензв'язувального сайта антитіла, [Ag] являє 29 91182 собою концентрацію вільного антигену, [Ab·Ag] являє собою концентрацію антигензв'язувального сайта антитіла, зайнятого антигеном, і Kd являє собою константу дисоціації комплексу антитілоантиген. Афінність кожної популяції антитіл, ідентифікованої картуванням епітопів, вимірювали, використовуючи RIA, де весь rhCTGF зв'язували з радіоактивним йодом і додавали в ямку, що містить іммобілізоване моноклональне антитіло, таким чином. Рекомбінантний людський CTGF мітили радіоактивним ізотопом 125І, використовуючи спосіб хлорамін-Т (див. Greenwood et al. (1963) Biochem. J., 89: 114-123). Звичайно, включалося щонайменше 60% 125І, і питома активність міченого CTGF складала щонайменше 1 105 імпульсів/хв./нг, хоча можна використати при радіоімуноаналізі мічений CTGF більш низької питомої активності. Козяче антитіло проти людського IgG, Fcспецифічне антитіло захоплення (Jackson ImmunoResearch) в DPBS, позбавленої Са2+ і Mg2+ (Mediatech, Herndon VA), додавали в ямки титрувального мікропланшета MAXISORP BREAKAPART (Nalge Nunc International, Rochester NY) і давали можливість зв'язуватися протягом ночі при 4°С. Потім ямки блокували 1% BSA (бичачим сироватковим альбуміном) в DPBS, позбавленій Са2+ і Mg2+, протягом щонайменше 4год. при 4°С. Блокуючий розчин видаляли, додавали 100мкл антитіла, що тестується, при 2-50нг/мл в DPBS, позбавленій Са2+ і Mg2+, і давали можливість зв'язуватися протягом ночі при 4°С. Суміші серійних розведень неміченого CTGF при постійній кількості [125I]rhCTGF додавали в ямки і інкубували при кімнатній температурі протягом 4-8год. Потім ямки промивали 4 рази 0,1% Tween 20 в PBS, позбавленій Са2+ і Mg2+ (Mediatech), і ямки титрувального мікропланшета відділяли і проводили підрахунок в гамма-лічильнику. Афінність оцінювали графічно за допомогою способу Скетчарда (1948, Ann. NY Acad. Sci., 51: 660-72). Загальну концентрацію міченого CTGF, нанесеного на планшет, розраховували як CTGF загальний cpm _ applied 1 cpm / fmol 0.1 _ мл CTGF охол.вих.розчин розведення де «cpm_applied» являють собою імпульси, отримані з контрольних флакончиків, які заповнені сумішами CTGF, паралельно з ямками титрувального мікропланшета; «cpm/fmol» являє собою питому активність [125I]CTGF, «[CTGF] охол. вих. розчин» являє собою концентрацію неміченого CTGF, доданого в кожну ямку, і «розведення» являє собою фактор розведення для неміченого CTGF. Концентрацію CTGF, зв'язаного з антитілом, розраховували по пропорції імпульсів, пов'язаних з ямками, і загальної концентрації CTGF, внесеного в лунки. CTGF зв' язаний (імп. / хв. _ зв' язаний контрольни й) CTGF загальний імп. / хв. _ зпгальний Концентрація вільного (незв'язаного) CTGF являє 30 собою різницю між загальною концентрацією нанесеного CTGF і концентрацією зв'язаного CTGF. CTGF вільний CTGF загальний CTGF зв' язаний Графіки Скетчарда визначення афінності для антитіл за винаходом показані на Фіг.2. На Фіг.2А показаний графік зв'язування антитіла за винаходом, mAb2, з [125І] rhCTGF в присутності концентрацій неміченого rhCTGF, що збільшуються. На Фіг.2В показаний графік зв'язування ілюстративного антитіла за винаходом, mAb1, з [125І] rhCTGF в присутності концентрацій неміченого rhCTGF, що збільшуються. Більшій масі відповідають точки з однаковим співвідношенням зв'язаного і незв'язаного CTGF, тому що ці точки мають кількість імпульсів зв'язаного CTGF, що перевищує контролі (отже, визначені в ямці імпульси зв'язаного фактора), але все ж істотно менші, ніж загальна кількість імпульсів нанесеного CTGF (отже, визначені в ямці імпульси вільного фактора). Максимальні зв'язування (Вmах) і Kd представлені у вигляді відрізків, що відсікаються на осі x і осі у, відповідно. Афінність (Kd) mAb1 до CTGF складає менше ніж 10-9Μ, звичайно виявлена афінність у комерційно успішних терапевтичних засобів антитіл (див., наприклад, Maini et al. (1998) Arthritis Rheum., 41: 1552-1563; Targan et al (1997) N. Engl. J. Med., 337: 1029-1035; Bumgardner et al. (2001) Transplantation, 72: 839-45 і Kovarik et al. (1999) Transplantation, 68: 1288-94). Таким чином, mAb1 є придатним кандидатом для терапевтичного застосування, і антитіла, які розділяють зв'язування епітопів з mAb1, як описано вище, і мають афінність до CTGF, яка аналогічна або більше афінності mAb1 (тобто Kd≤109), аналогічним чином є придатними кандидатами для терапевтичного застосування. Антитіла, що розділяють зв'язування епітопів з mAb1, але мають більш низьку афінність (тобто більш високе значення Kd), ніж mAb1, також здійснені в рамках даного винаходу і потенційно можуть використовуватися в різних аналізах і діагностиці, як описано в даному описі. Такі антитіла можна, крім того, підходять для терапевтичного застосування, особливо, якщо вони мають високу авідність до антигену, як описано нижче. 4.3 Авідність антитіл Для антитіл з більш ніж одним антигензв'язувальним сайтом (мультивалентність) афінність одного зв'язуючого сайта не завжди відображає істинну силу взаємодії антитіло-антиген. Коли мультивалентне антитіло зв'язується з антигеном, що має множинні повторювані епітопи, взаємодія одного антигену, взаємодіючого у одного зв'язуючого сайта антитіла, збільшує можливість взаємодії антигену з додатковими зв'язуючими сайтами. Авідність відображає силу функціонального об'єднання антитіла з антигеном, яка пов'язана як з афінністю взаємодії між епітопами і паратопами, так і валентністю антитіла і антигену. Таким чином, авідність забезпечує більш точну міру тенденції антитіла до дисоціації. Висока авідність може компенсувати низьку афінність. Наприклад, сайти зв'язування антигену IgM звичайно мають більш низьку афінність, ніж IgG, але мультивалентність IgM надає йому високу 31 авідність, даючи, таким чином, можливість ефективно зв'язувати антиген. Для визначення авідності антитіл за винаходом фрагмента спочатку Fab були отримані звичайним розщепленням папаїном відповідного імуноглобуліну. Потім іммобілізований білок А використовували для відділення фрагментів Fab від Fc і неперетравленого антитіла. Приблизно 1мл суспензії іммобілізованого папаїну, що містить 0,5мл затверділого гелю, 250мкг папаїну і 3,5 одиниць ВАЕЕ, промивали 3 1мл і 1 10мл буферу розщеплення (DB; 20мМ фосфату натрію, 10мМ EDTA (етилендіамін-тетраоцтової кислоти), 20мМ цистеїну, рН7,0). Потім суспензію ресуспендували в 0,3мл DB, змішували з 1,1мл антитіла (приблизно 5мг, рН7) і перемішували протягом ночі при 31°С. Потім продукт розщеплення антитіла відділяли від смоли, і фрагменти Fab відділяли від фрагментів Fc і неперетравленого антитіла за допомогою афінної хроматографії з використанням білка А. Чистоту фрагмента Fab контролювали з допомогою SDS-PAGE (Фіг.3А). Моновалентне зв'язування відрізняли від бівалентного зв'язування шляхом елюювання зв'язаних з антигеном антитіл тіоціанатом зі змінюваною концентрацією. При збільшенні концентрації хаотропного іону (тіоціанату) в розчині спочатку руйнуються асоціації з більш низької афінністю (наприклад, моновалентне зв'язування Fab з антигеном), тоді як асоціації з більш високою афінністю (наприклад, бівалентне зв'язування IgG з лігандом) залишаються незайманими. Таким чином, за допомогою збільшення концентрації тіоціаніну можна розрізнити 2 різних зв'язування. Планшети покривали 10мкг/мл CTGF або пептидів CTGF в 50мМ бікарбонатному буфері (рН8,5) при 4°С протягом ночі, блокували блокатором казеїном/TBS при 4°С протягом ночі, і потім інкубували зі 100мкг/мл антитіла або відповідного Fab в блокаторі казеїні/TBS при кімнатній температурі протягом ночі при перемішуванні. Потім планшети інкубували з розведенням (1:1) тіоціанату (0-7,6М) в 100мМ фосфатному буфері (рН6,0) протягом 15хв. при кімнатній температурі і перемішуванні з подальшою інкубацією з кон'югатом лужної фосфатази-мишачого антитіла проти людського антигену (Fab')2 (розведення 1:1000) при кімнатній температурі протягом 45хв. Додавали субстрат лужної фосфатази (1мг/мл; Sigma) в 1Μ діетаноламіні, 0,5мМ MgCl2 (рН9,8), планшети інкубували при кімнатній температурі, і визначали поглинання при 405 нм через 2, 10, 20 і 60хв. Показник афінності є концентрацією хаотропної речовини (тіоціанату), яка приводить до зниження первинного поглинання на 50%. Для ілюстративного антитіла за винаходом, mAb1, показник афінності для дисоціації Fab від CTGF становив 0,46М, тоді як показник афінності для дисоціації інтактного IgG від CTGF становив 1,8Μ (Фіг.3В). Таким чином, mAb1 зв'язується з антигеном переважно бівалентно (авідність) і дисоціюється від антигену набагато повільніше, ніж антитіло, яке зв'язується моновалентно. Додаткові антитіла за винаходом, які розділяють показники зв'язування епітопів з mAb1, можуть бути аналогічним чином 91182 32 бівалентними, або вони можуть бути моно- або мультивалентними. Будь-яким з антитіл за винаходом можна маніпулювати для поліпшення авідності, наприклад, комбінуванням сайтів зв'язування епітопів в один конструкт антитіла, наприклад, тритіло і т.д. (див., наприклад, Schoonjans et al. (2000) J. Immunol., 165: 7050-7057). 4.4 Перехресна реактивність Описаний вище радіоімуноаналіз (приклад 4.2) використали для визначення перехресної реактивності антитіл, за виключенням того, що немічений rhCTGF був замінений іншим неміченим конкурентом, щурячим CTGF, отриманим з клітин нирки нормального щура (NRK). Клітини NRK вирощували до їх злиття, і потім культуральне середовище міняли на безсироваткове середовище, що містить 2нг/мл TGF~β2, 50мкг/мл гепарину і 250мкг/мл BSA. Кондиціоноване середовище збирали через 2 дні культивування, центрифугували для видалення клітинних фрагментів і інкубували з гранулами гепарину-сефарози (1/100об./об. суспензії гранулхередовища) протягом 2год. при 4°С при перемішуванні. Потім суміш центрифугували; гранули збирали і промивали PBS і потім лізували в буфері SDS (додецилсульфату натрію). Графік Скетчарда зв'язування mAb2 з [125І] rhCTGF в присутності концентрацій, що збільшуються, неміченого щурячого CTGF, показаний на Фіг.4А; а графік Скетчарда зв'язування mAb1 з [125І] rhCTGF в присутності концентрацій, що збільшуються, неміченого щурячого CTGF, показаний на Фіг.4В. Як видно з фігури, mAb1 зв'язується як з людським, так і з щурячим CTGF, тоді як mAb2 зв'язується з людським, але не зв'язується з щурячим CTGF. Для mAb1 графіки Скетчарда у випадку конкуренції з щурячим CTGF (Фіг.4В) мають менший нахил, більш низьку видиму афінність і більш високу видиму величину Вmах, ніж графіки у випадку конкуренції з rhCTGF (Фіг.2В). Таким чином, хоча щурячий CTGF здатний конкурувати з людським CTGF за зв'язування з mAb1, антитіло має більш високу афінність до рекомбінантного людського CTGF, ніж до рекомбінантного щурячого CTGF. mAb1 також перехресно взаємодіє з мишачим і мавп'ячим CTGF (дані не показані). Антитіла, що виявляють придатну афінність до CTGF від інших видів, можна використати при лікуванні і запобіганні розладам у цих видів. Наприклад, антитіло за винаходом, яке виявляє відповідну Kd до собачого CTGF, можна використати для лікування розладу, пов'язаного з CTGF, у собак. Антитіла за винаходом, які виявляють перехресновидову афінність, такі як mAb1, можна також використовувати як інструменти дослідження для вивчення розладів, пов'язаних з CTGF, на різних моделях на тваринах. 4.5 Глікозилювання Описаний вище радіоімуноаналіз (приклад 4.2) використали для визначення ефекту глікозилювання антитіл на афінність зв'язування антигенів. Антитіло mAb1 обробляли протягом 8 днів при 37°С в PBS, 0,5Μ EDTA, рН8,0, пептидом Νглікозидазою F (PNGasa F), який відщеплює олігосахариди від N-зв'язаних глікопротеїдів. Після ін 33 кубації реакційний розчин або використовували безпосередньо, або фракціонували на колонці з білком A-SEPHAROSE FASTFLOW (Amersham Bioscience, Piscataway NJ) і елюювали 0,1Μ гліцином-HCl, рН2,5. Витягання антитіла після фракціонування становило приблизно 87%, і рівень ендотоксину становив 0,30 одиниць ентропії/мг. Деглікозилювання підтверджували SDS-PAGE. Активність зв'язування деглікозильованого антитіла з людським рекомбінантним CTGF була ідентична в межах експериментальної помилки активності зв'язування глікозильованої форми антитіла. Оскільки різні клітини продукують різні типи глікозилювання, продукція рекомбінантних білків, наприклад, антитіл, в культивованих клітинах або не гомологічних видах, може генерувати ненативне глікозилювання. Для активності деяких білків потрібне специфічне глікозилювання, і змінене глікозилювання знижує активність; наприклад, у випадку антитіл знижується афінність до антигену. Продукція білка в певних системах, наприклад, рослинах і курячих яйцях, може також продукувати типи глікозилювання, які є імуногеними, таким чином, знижуючи можливість використання білків при певних видах застосування. Здатність даних антитіл виявляти однакову активність в глікозильованій і неглікозильованій формі демонструє те, що винахід не обмежується присутністю глікозилювання, зокрема видоспецифічного глікозилювання. Приклад 5. Аналіз клітинної міграції Міграція клітин являє собою нормальне і важливе клітинне явище, наприклад, під час розвитку і загоєння ран. Міграція клітин також є фактором в патології розладів, таких як формування фібротичних уражень, і клітини, виділені з фібротичених уражень, більше реагують на хемотаксичні подразники, ніж клітини з відповідної нормальної тканини. Антитіла згідно з даним винаходом аналізували на їх здатність інгібувати стимульовану CTGF хемотаксичну міграцію гладком'язових клітин з використанням аналізу в камері Бойдена таким чином. Артеріальні гладком'язові клітини нгурів (ASMC) в середовищі, що містить 0,1% фетальну телячу сироватку (FCS), додавали у верхній відсік камери Бойдена, а середовище, що містить або 300нг/мл rhCTGF, 10% FCS, або тільки 0,1% FCS додавали в нижній відсік. Покритий колагеном фільтр, що має пори діаметром 8 мкм, відділяв верхню камеру від нижньої камери. Клітинам давали можливість протягом 2-3год. зчепитися з фільтром і мігрувати через нього. Потім фільтр видаляли, клітини на фільтрі фіксували і забарвлювали, і підраховували клітини, які мігрували через фільтр. Інкубація з 300нг/мл rhCTGF збільшувала кількість клітин, мігруючих через фільтр, приблизно в 5 разів відносно контролів 0,1% FCS. Збільшення міграції, стимульованої CTGF, становило приблизно 27% хемотаксичного ефекту, що спостерігався у випадку 10% FCS, яка містить множинні хемотаксичні фактори. Антитіла за винаходом випробовували на їх здатність інгібувати опосередковану CTGF клітинну міграцію, використовуючи описаний вище ана 91182 34 ліз, за винятком того, що або антитіла проти CTGF (в концентрації 30 і 300мг/мл), або об'єднаний людський IgG також додавали в нижню камеру. Підраховували 4 поля клітин кожного з 3 окремих фільтрів для кожного зразка в кожному аналізі. Результати показані в табл. 2. Таблиця 2 Інгібування опосередкованої CTGF клітинної міграції Антитіло MgG 7 (30мкг/мл) 19 (30мкг/мл) 19 (300мкг/мл) Клітинна міграція (%) Середня величи- Стандартне на відхилення 100 10 77 13 71 14 43 12 Як видно з табл. 2, антитіла, які зв'язуються з CTGF, в межах епітопу, визначеного mAb1, інгібують опосередковану CTGF клітинну міграцію залежним від дози чином. Антитіла групи цього епітопу являли собою єдині перевірені антитіла проти CTGF, які повторно і відновно інгібували викликану CTGF міграцію. Різні процеси, такі як ангіогенез, хондрогенез і онкогенез, вимагають зміни адгезії і міграції клітин. CTGF пов'язаний як з адгезією, так і з міграцією клітин, і здатність антитіл, направлених проти CTGF, диференціально впливати на одну активність, в порівнянні з іншою, надає різноманітний репертуар лікарських засобів для лікування станів, пов'язаних з CTGF. Антитіла, отримані в даному винаході, ясно демонструють диференціальну активність, що належить до нейтралізації активності CTGF. Як проілюстровано нижче, ці здатності надають унікальний терапевтичний потенціал в цьому класі антитіла проти CTGF. Приклад 6. Легеневі розлади Внутрішньотрахеальна (IT) інстиляція блеоміцину у мишей являє собою модельну систему, що широко використовується для вивчення пневмосклерозу і для скринінгу потенційно бажаних антифібротичних засобів. Антитіла за винаходом випробовували на їх здатність зменшувати викликаний блеоміцином пневмосклероз in vivo з використанням процедури, описаної Wang et al. (2000) Biochem. Pharmacol., 60: 1949-1958, таким чином. Самців мишей C57BL/6 методом випадкової вибірки ділили на 2 групи. Мишей наркотизували ізофлюраном і потім інтратрахеально ін'єктували або одну дозу блеоміцину в 0,9% сольовому розчині в дозі 0,1 одиниці/50мкл/миша, або один 0,9% сольовий розчин. Кожну групу ділили і лікували відразу і потім 1 раз через день, щоб загалом кількість доз, що вводяться внутрішньочеревинно (в/ч) або сольового розчину, або антитіла дорівнювала 7. Через 14 днів після внутрішньотрахеальної інстиляції мишей піддавали евтаназії кровопусканням з низхідної черевної аорти під наркозом і брали легеневу тканину. Вміст колагену в легенях аналізували, вимірюючи рівень гідроксипроліну і проліну, викорис 35 товуючи спосіб Palmerini et al. (1985; J. Chromatogr., 339: 285-292), за винятком того, що Lазетидин-2-карбонова кислота (Aldrich) була замінена на 3,4-дигідропролін як внутрішній стандарт. Коротко, зразки тканини гідролізували в 6н. НСl протягом 22год. при 105°С. Зразки піддавали передколонковій дериватизації о-фталальдегідом і потім 4-хлор-7-нітробензофураном (Aldrich) для утворення флуоресцентних аддуктів проліну і гідроксипроліну. Флюоресцентні аддукти відділяли ВЕРХ на оберненій фазі з подальшим флуорометричним виявленням. На Фіг.5 показане порівняння результату терапевтичного введення сольового розчину (SA), ілюстративного антитіла за винаходом, mAb1, і пулу антитіл, специфічних для CTGF (AbsJ) у випадку їх здатності придушувати пневмосклероз після обробки блеоміцином. Як видно на Фіг.5А, обробка блеоміцином (BL+SA) значно збільшувала вміст гідроксипроліну на 168%, в порівнянні з контрольною групою (SA+SA; 220±15мкг/легеня). Однак подальше лікування об'єднаними антитілами за винаходом (BL+AbsJ) показало зниження на 60% вмісту гідроксипроліну в легенях, в порівнянні з обробкою одним блеоміцином. Аналогічним чином, подальше лікування mAb1 (BL+mAb1) показало зниження вмісту гідроксипроліну в легенях на 70%, в порівнянні з одним блеоміцином. Гістологічне дослідження легенів мишей виявило нормальну легеневу паренхіматозну тканину в контрольній групі (не показана). Однак в легенях, оброблених блеоміцином, виразно спостерігалося збільшення ділянок фіброзу (Фіг.5В; стрілки). Терапевтичне введення антитіла за винаходом після обробки блеоміцином показало виразне зменшення фіброзу (Фіг.5С), хоча в деяких частках ще виявлялася легка міра інтерстиціального фіброзу. Таким чином, антитіла за винаходом є терапевтично вигідними при введенні пацієнтам з ризиком розвитку легеневого розладу, такого як ідіопатичний пневмосклероз (IPF). Приклад 7. Ниркові розлади 7.1. Ниркова недостатність Канальцево-інтерстиціальний фіброз являє собою основний компонент декількох ниркових захворювань, пов'язаних з прогресуванням кінцевої стадії ниркової недостатності (Sharma et al. (1993) Kidney Int., 44: 774-788). Одностороння обструкція сечоводу (UUO), що характеризується зниженою нирковою функцією і збільшеним інтерстиціальним фіброзом, використовувалася як експериментальна модель для індукції канальцевоінтерстиціального пошкодження і фіброзу (Fern et al.(1999) J. Clin. Invest, 103: 39-46). Мишей наркотизували ізофлюраном і потім виконували перев'язку лівого сечоводу, відповідно до способу, описаного Moriyama et al.(1998; Kidney Int., 54: 110-119). Мишей лікували відразу після операції і потім 1 раз через день для забезпечення усього семи доз або сольового розчину, або антитіла, що вводиться внутрішньочеревинно (в/ч). Через 14 днів після UUO тварин наркотизували і умертвляли кровопусканням з низхідної черевної аорти. І праву, і ліву нирки окремо декапсулювали і зважували. Половину кожної нирки фіксували в 91182 36 10% формаліні для гістологічного дослідження (фарбування трихромом), а іншу половину зважували і зберігали при -70°С для визначення вмісту гідроксипроліну. Вміст гідроксипроліну і проліну визначали, як описано вище. Як видно на Фіг.6А, у кожної миші в результаті UUO збільшувався вміст колагену в нирці приблизно в 4 рази, за даними вимірювання співвідношення між гідроксипроліном і проліном в лівій нирці, підданій обструкції, відносно не підданої обструкції правої нирки. Лікування антитілом за винаходом, mAb1, привело до статистично значущого залежного від дози зниження фіброзу підданої обструкції нирки (Фіг.6А). Однак антитіло, яке зв'язується з С-кінцевим епітопом на CTGF, mAb3, не виявило значущого ефекту. Фарбування трихромом нирки після UUO виявляє ділянки збільшеного накопичення колагену (Фіг.6В, стрілки), тоді як лікування антитілом за винаходом показує значне зменшення фарбування колагену в нирці, підданій обструкції (Фіг.6С). Альтернативно, фіброз нирок можна вивчати на моделі прогресуючої ниркової недостатності залишкової нирки щура. Модель, яка включає односторонню нефректомію на 2/3 в поєднанні з субтотальною резекцією другої нирки (нефректомія на 5/6), викликає дегенеративні паренхіматозні зміни з хронічною нирковою недостатністю в залишку нирки, і у тварин розвивається уремія і виявляється виражена альбумінурія, гломерулосклероз, інтерстиціальний фіброз і атрофія канальців (див., наприклад, Frazer et al. (2000) Vet. Pathol., 37: 328335; і Gandhi et al. (1998) Kidney Int., 54: 11571165). Нефректомію на 5/6 виконували за методом Frazier et al. (2000, Vet Pathol 37: 328-335). П'ятитижневих самців щурів Sprague-Dawley (Harlan, Indianapolis IN) з середньою масою тіла 120г наркотизували кетаміном і ксилазином і проводили розріз краніальної 1/3 і каудальної 1/3 лівої нирки. Накладали марлевий тампон короткочасно для забезпечення гемостазу, черевну порожнину промивали сольовим розчином, 0,2мл буторфенолу і операційну рану зашивали. Через 1 тиждень після первинної операції другу нирку повністю видаляли. Щурів ділили на групи лікування сольовим розчином і антитілом, причому лікування починали через 2 тижні після нефректомії на 5/6. Сольовий розчин або антитіло в дозуванні 5мг/кг вводили в/ч ін'єкцією (0,5мл кожна) 1 раз/3 дні протягом 15 днів (всього 5 ін'єкцій). Зразки крові і сечі брали щотижня у рандомізованих турів, підданих нефректомії, для стеження за розвитком ниркового захворювання і для кореляції функціональних ниркових порушень з гістологічними змінами. Результати аналізу ниркового фіброзу, аналізу сечі і аналізів хімічного складу сироватки порівнювали у груп через 18 і 28 днів після початку лікування. Нирковий фіброз оцінювався незалежно двома патологоанатомами сліпим методом; 3 гістологічних зрізи з кожної нирки досліджували, використовуючи З різних морфологічних барвника: гематоксилін/еозин, трихром Masson і пікринова кислота-сіріус червоний. Крім того, виконували імуногістохімічне дослідження на заморожених 37 91182 зрізах для оцінки типу відкладення колагену в кожній ділянці в нирці. Виконували кількісну оцінку колагену (співвідношення гідроксипролін/пролін), і ниркову функцію оцінювали, використовуючи і аналіз сечі, і хімічний аналіз сироватки зразків, взятих під час евтаназії. Гістологічно були відмічені помірні відмінності фіброзу в залишках нирок без лікування і після лікування антитілом (Фіг.7). Через 3 дні після лікування здійснювали сліпу суб'єктивну оцінку, що має своїм результатом величину середньої бальної оцінки фіброзу 12,6 в групі лікування сольовим розчином, в порівнянні з 10,7 в групі лікування антитілом (р
ДивитисяДодаткова інформація
Назва патенту англійськоюAntibody that specifically binds to connective tissue growth factor (ctgf)
Автори англійськоюLin Ai Y., Neff Thomas B., Oliver Noelynn A., Usinger William R., Wang Qingjian, Yeowell David A.
Назва патенту російськоюАнтитело, которое специфично связывается с фактором роста соединительной ткани (ctgf)
Автори російськоюЛин Ай Й., Нефф Томас Б., Оливер Ноэлинн А., Юзинджер Уилльям Р., Ван Циньцзянь, Йеовелл Девид А.
МПК / Мітки
МПК: A61K 39/395, C07K 16/22, A61P 35/00
Мітки: яке, зв'язується, антитіло, фактором, тканини, росту, специфічно, ctgf, з'єднувальної
Код посилання
<a href="https://ua.patents.su/47-91182-antitilo-yake-specifichno-zvyazuehtsya-z-faktorom-rostu-zehdnuvalno-tkanini-ctgf.html" target="_blank" rel="follow" title="База патентів України">Антитіло, яке специфічно зв’язується з фактором росту з’єднувальної тканини (ctgf)</a>
Попередній патент: Хінолінові похідні як антибактеріальні агенти
Наступний патент: Занурюваний вимірювальний зонд
Випадковий патент: Спосіб обробки шкури тварини