Нові похідні вітаміну d з циклічними субструктурами в бічних ланцюгах, спосіб і проміжні продукти для їхнього одержання та їхнє застосування для одержання лікарських засобів
Номер патенту: 82307
Опубліковано: 10.04.2008
Автори: Хабері Мартін, Фенріх Маріанне, Шварц Катіка, Гісен Клаудія, Штейнмейєр Андреас
Формула / Реферат
1. Похідні вітаміну D загальної формули І
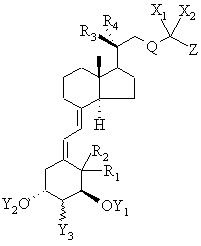 , I
, I
у якій
Y1 і Y2 кожен незалежно один від одного означає атом водню або групу -C(O)R5, a
Y3 означає атом водню або гідроксигрупу, атом галогену, групу -OC(O)R5 або групу -OR5,
де
R5 являє собою ароматичний радикал з 5-12 С-атомами або аліфатичний, прямоланцюговий або розгалужений, насичений або ненасичений С1-С12алкільний радикал, необов'язково перерваний 1-2 атомами кисню, 1-2 атомами сірки і/або 1-2 NH-групами, і/або необов'язково заміщений 1-2 гідроксигрупами, 1-2 аміногрупами, 1-2 SH-групами, 1-2 СООН-групами і/або 1-2 фенільними групами,
і група Y3 може бути представлена як у 2a-, так і в епімерній 2b-конфігурації,
R1 і R2 кожен означає атом водню або обидва разом являють собою екзоциклічну метиленову групу,
R3 і R4 кожен незалежно один від одного означає атом водню, атом фтору, хлору або брому, алкільну групу з 1-4 атомами вуглецю, обидва разом являють собою метиленову групу або разом із четвертинним атомом вуглецю 20 утворюють 3-7-членне, насичене або ненасичене карбоциклічне кільце,
Q означає прямоланцюгову алкіленову групу з 1-5 атомами вуглецю,
Х1 і Х2 разом означають кетокисневий атом із подвійним зв'язком або незалежно один від одного означають атом водню, гідроксигрупу, -OC(O)R5-гpyпy, атом фтору, хлору або брому, при цьому X1 і Х2 не повинні кожен одночасно означати гідроксигрупу або -OC(O)R5-гpyпy,
Z означає карбоциклічне або гетероциклічне, необов'язково ароматичне або гетероароматичне кільце з 5 або 6 членами або конденсованою циклічною системою, що складається з 5- і 6-членного кільця або ж двох 6-членних кілець, які можуть бути заміщені одним або декількома атомами фтору, хлору, брому або йоду, однією або декількома гідроксигрупами, однією або декількома СООR6-групами, однією або декількома С1-С5алкільними групами, які у свою чергу можуть бути заміщені одним або декількома атомами фтору, хлору, брому або йоду, С1-С6алкоксигрупами і/або СООR6-групами, при цьому
R6 являє собою С1-С6алкільну групу, бензильну групу або фенільну групу, а саме,
(7Е)-(1R,3R,24аR)-24а-(оксазол-4-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R,24аS)-24а-(оксазол-4-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(5Z,7E)-(1S,3R,24aR)-24a-(оксазол-4-іл)-24a-гoмо-9,10-ceкoxoлa-5,7,10(19)-триєн-1,3,24а-тріол,
(5Z,7E)-(1S,3R,24aS)-24a-(оксазол-4-іл)-24a-гoмо-9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол,
(7Е)-(1R,3R,24аR)-24а-(тіазол-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R,24аS)-24а-(тіазол-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R)-1,3-дигідрокси-24а-(тіазол-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-24а-он,
(5Z,7E)-(1S,3R,24аR)-24а-(тіазол-2-іл)-24а-гомо-9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол,
(5Z,7Е)-(1S,3R,24аS)-24а-(тіазол-2-іл)-24а-гомо-9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол,
(5Z,7E)-(1S,3R)-1,3-дигідрокси-24а-(тіазол-2-іл)-24а-гомо-9,10-секохола-5,7,10(19)-триєн-24а-он,
(7Е)-(1R,3R,24аR)-24а-(4-метилтіазол-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R,24аS)-24а-(4-метилтіазол-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R)-1,3-дигідрокси-24а-(4-метилтіазол-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-24а-он,
(5Z,7Е)-(1S,3R,24аR)-24а-(4-метилтіазол-2-іл)-24а-гомо-9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол,
(5Z,7Е)-(1S,3R,24аS)-24а-(4-метилтіазол-2-іл)-24а-гомо-9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол,
(5Z,7E)-(1S,3R)-1,3-дигідрокси-24а-(4-метилтіазол-2-іл)-24а-гомо-9,10-секохола-5,7,10(19)-триєн-24а-он,
(7Е)-(1R,3R,24aR)-24a-(тiєн-2-iл)-24a-гoмо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R,24аS)-24а-(тієн-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7E)-(1R,3R)-1,3-дигідрокси-24a-(тiєн-2-іл)-24a-гoмо-19-нop-9,10-ceкoxoлa-5,7-дієн-24а-он,
(5Z,7E)-(1S,3R,24aR)-24a-(тiєн-2-iл)-24a-гoмo-9,10-ceкoxoлa-5,7,10(19)-тpиєн-1,3,24а-тріол,
(5Z,7E)-(1S,3R,24aS)-24a-(тiєн-2-іл)-24a-гoмо-9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол,
(7E)-(1R,2S,3R,24aR)-24a-(тiєн-2-іл)-24a-гoмо-19-нop-9,10-ceкoxoлa-5,7-триєн-1,2,3,24-тетрол,
(7Е)-(1R,2S,3R,24аS)-24а-(тієн-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,2,3,24-тетрол,
(7E)-(1R,2S,3R)-24a-(тiєн-2-iл)-1,2,3-тpигiдpoкcи-24a-гoмo-9,10-ceкoxoлa-5,7-дієн-24а-он,
(7Е)-(1R,3R,24аR)-24а-(4-метилтієн-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R,24аS)-24а-(4-метилтієн-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7E)-(1R,3R)-1,3-дигідрокси-24а-(4-метилтієн-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-24а-он,
(5Z,7E)-(1S,3R,24аR)-24а-(4-метилтієн-2-іл)-24а-гомо-9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол,
(5Z,7E)-(1S,3R,24aS)-24a-(4-метилтієн-2-iл)-24a-гoмо-9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол,
(5Z,7E)-(1S,3R)-1,3-дигідрокси-24а-(4-метилтієн-2-іл)-24а-гомо-9,10-секохола-5,7,10(19)-триєн-24а-он,
(7E)-(1R,2S,3R,24aR)-24a-(4-мeтилтiєн-2-iл)-24a-гoмo-19-нop-9,10-ceкoxoлa-5,7-дієн-1,2,3,24-тетрол,
(7Е)-(1R,2S,3R24аS)-24а-(4-метилтієн-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,2,3,24-тетрол,
(7Е)-(1R,2S,3R)-24a-(4-метилтієн-2-іл)-1,2,3-тригідрокси-24а-гомо-19-нор-9,10-секохола-5,7-дієн-24а-он,
(7E)-(1R,3R,24aR)-24a-(5-eтилтiєн-2-iл)-24a-гoмo-19-нop-9,10-ceкoxoлa-5,7-дiєн-1,3,24а-тріол,
(7Е)-(1R,3R,24аS)-24а-(5-етилтієн-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7E)-(1R,3R,24aR)-24a-[5-(2-гiдpoкcieтил)-4-мeтилтiaзoл-2-iл]-24a-гoмo-19-нop-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R,24аS)-24а-[5-(2-гідроксіетил)-4-метилтіазол-2-іл]-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7E)-(1R,3R)-1,3-дигiдpoкcи-24a-[5-(2-гiдpoкcieтил)-4-мeтилтiaзoл-2-iл]-24a-гомо-19-нор-9,10-секохола-5,7-дієн-24а-он,
(7E)-(1R,3R,24aR)-24a-(бeнзoтiaзoл-2-iл)-24a-гoмo-19-нop-9,10-ceкoxoлa-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R,24аS)-24а-(бензотіазол-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R)-24a-(бензотіазол-2-іл)-1,3-дигідрокси-24а-гомо-19-нор-9,10-секохола-5,7-дієн-24а-он,
(7Е)-(1R,3R,24aR)-24a-(бензофуран-2-іл)-24a-гoмо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7E)-(1R,3R,24aS)-24a-(бензофуран-2-іл)-24a-гoмо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R)-24а-(бензофуран-2-іл)-1,3-дигідрокси-24а-гомо-19-нор-9,10-секохола-5,7-дієн-24а-он,
(7Е)-(1R,3R,24аR)-24а-(бензотіофен-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R,24аS)-24а-(бензотіофен-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R)-24а-(бензотіофен-2-іл)-1,3-дигідрокси-24а-гомо-19-нор-9,10-секохола-5,7-дієн-24а-он,
(7Е)-(1R,3R,24aR)-24a-(1-метилбензімідазол-2-іл)-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R,24аS)-24а-(1-метилбензімідазол-2-іл)-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R)-1,3-дигідрокси-24а-(1-метилбензімідазол-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-24а-он,
етиловий ефір
(7Е)-(1R,3R)-1-(1,3-дигідрокси-24а-гомо-19-нор-9,10-секохола-5,7-дієн-24а-іл)-3-[(4-метоксифеніл)метокси]-1Н-піразол-4-карбонової кислоти,
етиловий ефір
(7Е)-(1R,3R)-1-(1,3-дигідрокси-24а-гомо-19-нор-9,10-секохола-5,7-дієн-24а-іл)-3-гідрокси-1H-піразол-4-карбонової кислоти,
(7E)-(1R,3R,24aR)-24a-(4-мeтилфeнiл)-24a-гoмo-19-нop-9,10-ceкoxoлa-5,7-дiєн-1,3,24а-тріол,
(7Е)-(1R,3R,24аS)-24а-(4-метилфеніл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R)-1,3-дигідрокси-24а-(4-метилфеніл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-24а-он,
(7E)-(1R,2R,3R,24aR)-24a-(4-мeтилфeнiл)-24a-гoмo-19-нop-9,10-ceкoxoлa-5,7-дієн-1,2,3,24а-тетрол,
(7Е)-(1R,RS,3R,24аS)-24а-(4-метилфеніл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,2,3,24а-тетрол,
(7E)-(1R,3R,24aR)-24a-(4-тpифтopмeтилфeнiл)-19-нop-9,10-ceкoxoлa-5,7-дiєн-1,3,24а-тріол,
(7E)-(1R,3R,24аS)-24а-(4-трифторметилфеніл)-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R)-1,3-дигідрокси-24а-(4-трифторметилфеніл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-24а-он,
(7Е)-(1R,3R,24аR)-24а-(4-метоксифеніл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R,24аS)-24а-(4-метоксифеніл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R)-1,3-дигідрокси-24а-(4-метоксифеніл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-24а-он,
(7Е)-(1R,3R,20S,24аR)-24а-(тіазол-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R,20S,24аS)-24а-(тіазол-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R,20S)-1,3-дигідрокси-24а-(тіазол-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-24а-он,
(5Z,7Е)-(1S,3R,20S,24аS)-24а-(тіазол-2-іл)-24а-гомо-9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол,
(5Z,7Е)-(1S,3R,20S,24аR)-24а-(тіазол-2-іл)-24а-гомо-9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол,
(5Z,7E)-(1S,3R,20S)-1,3-дигідрокси-24а-(тіазол-2-іл)-24а-гомо-9,10-секохола-5,7,10(19)-триєн-24а-он,
(5Z,7E)-(1S,3R,24S)-24-(тіазол-2-іл)-9,10-секохола-5,7,10(19)-триєн-1,3,24-тріол,
(5Z,7E)-(1S,3R,24R)-24-(тіазол-2-іл)-9,10-секохола-5,7,10(19)-триєн-1,3,24-тріол,
(5Z,7E)-(1S,3R)-1,3-дигідрокси-24-(тіазол-2-іл)-9,10-секохола-5,7,10(19)-триєн-24-он,
(7Е)-(1R,3R,20S,24аR)-24а-(оксазол-4-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R,20S,24aS)-24a-(оксазол-4-іл)-24a-гoмо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R,20S)-1,3-дигідрокси-24а-(оксазол-4-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-24а-он,
(5Z,7E)-(1S,3R,20S,24аR)-24а-(оксазол-4-іл)-24а-гомо-9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол,
(5Z,7E)-(1S,3R,20S,24аS)-24а-(оксазол-4-іл)-24а-гомо-9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол,
(5Z,7E)-(1S,3R,20S)-1,3-дигідрокси-24а-(оксазол-4-іл)-24а-гомо-9,10-секохола-5,7,10(19)-триєн-24а-он,
(5Z,7E)-(1S,3R,24R)-24а-(оксазол-4-іл)-9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол,
(5Z,7E)-(1S,3R,24S)-24-(оксазол-4-іл)-9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол,
(5Z,7E)-(1S,3R)-1,3-дигідрокси-24-(оксазол-4-іл)-9,10-секохола-5,7,10(19)-триєн-24-он,
(7Е)-(1R,3R,20S,24aR)-24a-(4-метилтіазол-2-іл)-24a-гoмо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R,20S,24аS)-24а-(4-метилтіазол-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R,20S)-1,3-дигідрокси-24а-(4-метилтіазол-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-24а-он,
(5Z,7E)-(1S,3R,20S,24aR)-24a-(4-мeтилтiaзoл-2-iл)-24a-гoмo-9,10-ceкoxoлa-5,7,10(19)-триєн-1,3,24а-тріол,
(5Z,7E)-(1S,3R,20S,24аS)-24а-(4-метилтіазол-2-іл)-24а-гомо-9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол,
(5Z,7Е)-(1S,3R,20S)-1,3-дигідрокси-24а-(4-метилтіазол-2-іл)-24а-гомо-9,10-секохола-5,7,10(19)-триєн-24а-он,
(5Z,7E)-(1S,3R,24R)-24-(4-мeтилтiaзoл-2-iл)-9,10-ceкoxoлa-5,7,10(19)-тpиєн-1,3,24а-тріол,
(5Z,7Е)-(1S,3R,24S)-24-(4-метилтіазол-2-іл)-9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол,
(5Z,7E)-(1S,3R)-1,3-дигідрокси-24-(4-метилтіазол-2-іл)-9,10-секохола-5,7,10(19)-триєн-24-он,
(7E)-(1R,3R,20S,24aR)-24a-(4-мeтилтiєн-2-iл)-24a-гoмo-19-нop-9,10-ceкoxoлa-5,7-дієн-1,3,24а-тріол,
(7E)-(1R,3R,20S,24aS)-24a-(4-метилтієн-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R,20S)-1,3-дигідрокси-24а-(4-метилтієн-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-24а-он,
(5Z,7E)-(1S,3R,20S,24aR)-24a-(4-метилтієн-2-іл)-24a-гoмо-9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол,
(5Z,7Е)-(1S,3R,20S,24аS)-24а-(4-метилтієн-2-іл)-24а-гомо-9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол,
(5Z,7E)-(1S,3R,20S)-1,3-дигідрокси-24а-(4-метилтієн-2-іл)-24а-гомо-9,10-секохола-5,7,10(19)-триєн-24а-он,
(5Z,7E)-(1S,3R,24R)-24-(4-мeтилтiєн-2-iл)-9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол,
(5Z,7E)-(1S,3R,24S)-24-(4-метилтієн-2-іл)-9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол,
(5Z,7E)-(1S,3R)-1,3-дигідрокси-24-(4-метилтієн-2-іл)-9,10-секохола-5,7,10(19)-триєн-24-он,
(7E)-(1R,3R,20S,24aR)-24a-(тiєн-2-iл)-24a-гoмo-19-нop-9,10-ceкoxoлa-5,7-дiєн-1,3,24а-тріол,
(7Е)-(1R,3R,20S,24аS)-24а-(тієн-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R,20S)-1,3-дигідрокси-24а-(тієн-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-24а-он,
(5Z,7E)-(1S,3R,20S,24aR)-24a-(тієн-2-іл)-24a-гoмо-9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол,
(5Z,7E)-(1S,3R,20S,24aS)-24a-(тієн-2-іл)-24a-гoмо-9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол,
(5Z,7E)-(1S,3R,20S)-1,3-дигідрокси-24а-(тієн-2-іл)-24а-гомо-9,10-секохола-5,7,10(19)-триєн-24а-он,
(5Z,7E)-(1S,3R,24R)-24-(тiєн-2-iл)-9,10-ceкoxoлa-5,7,10(19)-тpиєн-l,3,24a-тpioл,
(5Z,7E)-(1S,3R,24S)-24-(тієн-2-іл)-9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол,
(5Z,7E)-(1S,3R)-1,3-дигiдpoкcи-24-(тiєн-2-iл)-9,10-ceкoxoлa-5,7,10(19)-тpиєн-24-он,
(5Z,7E)-(1S,3R,24S)-24-(4-метилтіазол-2-іл)-9,10-секохола-5,7,10(19)-триєн-1,3,24-тріол,
(5Z,7Е)-(1S,3R,24R)-24-(4-метилтіазол-2-іл)-9,10-секохола-5,7,10(19)-триєн-1,3,24-тріол,
(5Z,7E)-(1S,3R)-1,3-дигідрокси-24-(4-метилтіазол-2-іл)-9,10-секохола-5,7,10(19)-триєн-24-он,
(5Z,7Е)-(1S,3R,24S)-24-(тієн-2-іл)-9,10-секохола-5,7,10(19)-триєн-1,3,24-тріол,
(5Z,7E)-(1S,3R,24R)-24-(тієн-2-іл)-9,10-секохола-5,7,10(19)-триєн-1,3,24-тріол,
(5Z,7Е)-(1S,3R)-1,3-дигідрокси-24-(тієн-2-іл)-9,10-секохола-5,7,10(19)-триєн-24-он,
(5Z,7E)-(1S,3R,24S)-24-(4-метилтієн-2-іл)-9,10-секохола-5,7,10(19)-триєн-1,3,24-тріол,
(5Z,7E)-(1S,3R,24R)-24-(4-метилтієн-2-іл)-9,10-секохола-5,7,10(19)-триєн-1,3,24-тріол,
(5Z,7E)-(1S,3R)-1,3-дигідрокси-24-(4-метилтієн-2-іл)-9,10-секохола-5,7,10(19)-триєн-24-он,
(7Е)-(1R,3R,24aR)-24a-фтop-24a-(тiaзoл-2-iл)-24a-гoмo-19-нор-9,10-секохола-5,7-дієн-1,3-діол,
(7Е)-(1R,3R,24аS)-24а-фтор-24а-(тіазол-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3-діол,
(5Z,7E)-(1S,3R,24aR)-24a-фтop-24a-(тiaзoл-2-iл)-24a-гoмo-9,10-ceкoxoлa-5,7,10(19)-триєн-1,3-діол,
(5Z,7E)-(1S,3R,24аS)-24а-фтор-24а-(тіазол-2-іл)-24а-гомо-9,10-секохола-5,7,10(19)-триєн-1,3-діол,
(7E)-(1R,3R,24aR)-24a-(aцeтилoкcи)-24a-(тiaзoл-2-iл)-24a-гoмo-19-нop-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R,24аS)-24а-(ацетилокси)-24а-(тіазол-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7E)-(1R,3R,24aR)-24a-(2,2-димeтилпpoпaнoїлoкcи)-24a-(тiaзoл-2-iл)-24a-гoмo-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R,24аS)-24а-(2,2-диметилпропаноїлокси)-24а-(тіазол-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
(7Е)-(1R,3R)-2-бром-24а-(тіазол-2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол,
а також усі можливі епімери або діастереомери та їхні суміші.
2. Похідні вітаміну D загальної формули І за п. 1, у якій
R3 або R4 означає водень,
X1 і Х2 обидва разом означають карбонільну групу або Х1 означає гідроксильну групу або атом фтору, а Х2 означає атом водню, або X1 означає атом водню, а Х2 означає гідроксильну групу або атом фтору, або Х1 означає -OC(O)R5-гpyпy, а Х2 означає атом водню, або Х1 означає атом водню, а Х2 означає -OC(O)R5-гpyпy і
Z являє собою ароматичну циклічну систему.
3. Похідні вітаміну D загальної формули І за п. 1, у якій
R3 або R4 означає водень,
Х1 і Х2 обидва разом означають карбонільну групу або Х1 означає гідроксильну групу або атом фтору, а Х2 означає атом водню, або X1 означає атом водню, а Х2 означає гідроксильну групу або атом фтору, або Х1 означає -OC(O)R5-гpyпy, а Х2 означає атом водню, або X1 означає атом водню, а Х2 означає -OC(O)R5-гpyпy і
Z являє собою гетероароматичну циклічну систему.
4. Похідні вітаміну D загальної формули І за п. 1, де стереохімія в положенні 20 представлена в неприродній 20-епіконфігурації.
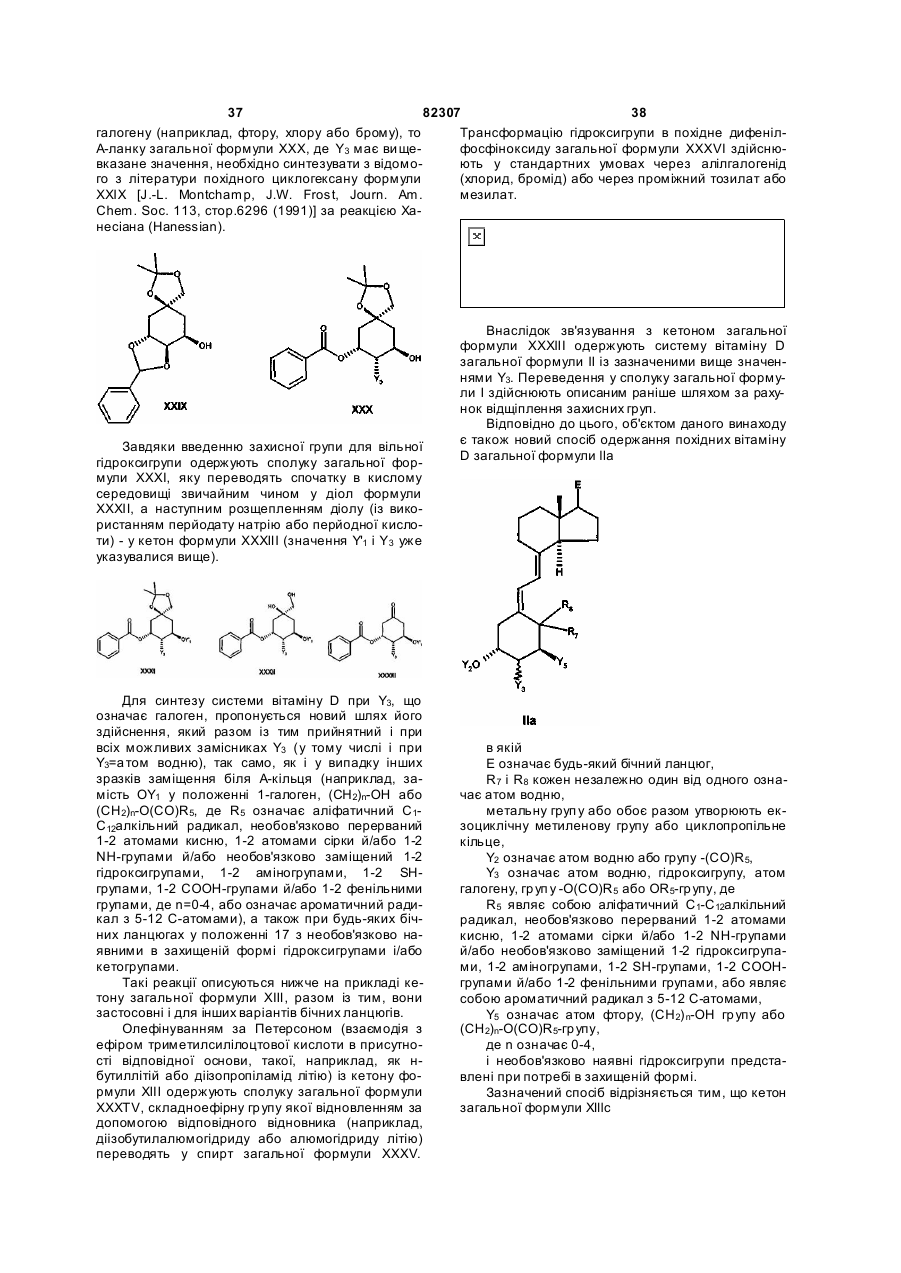
5. Спосіб одержання сполук загальної формули І за п. 1, де Q означає С2-С5алкіл, який відрізняється тим, що сполуку формули III
 ІІІ
ІІІ
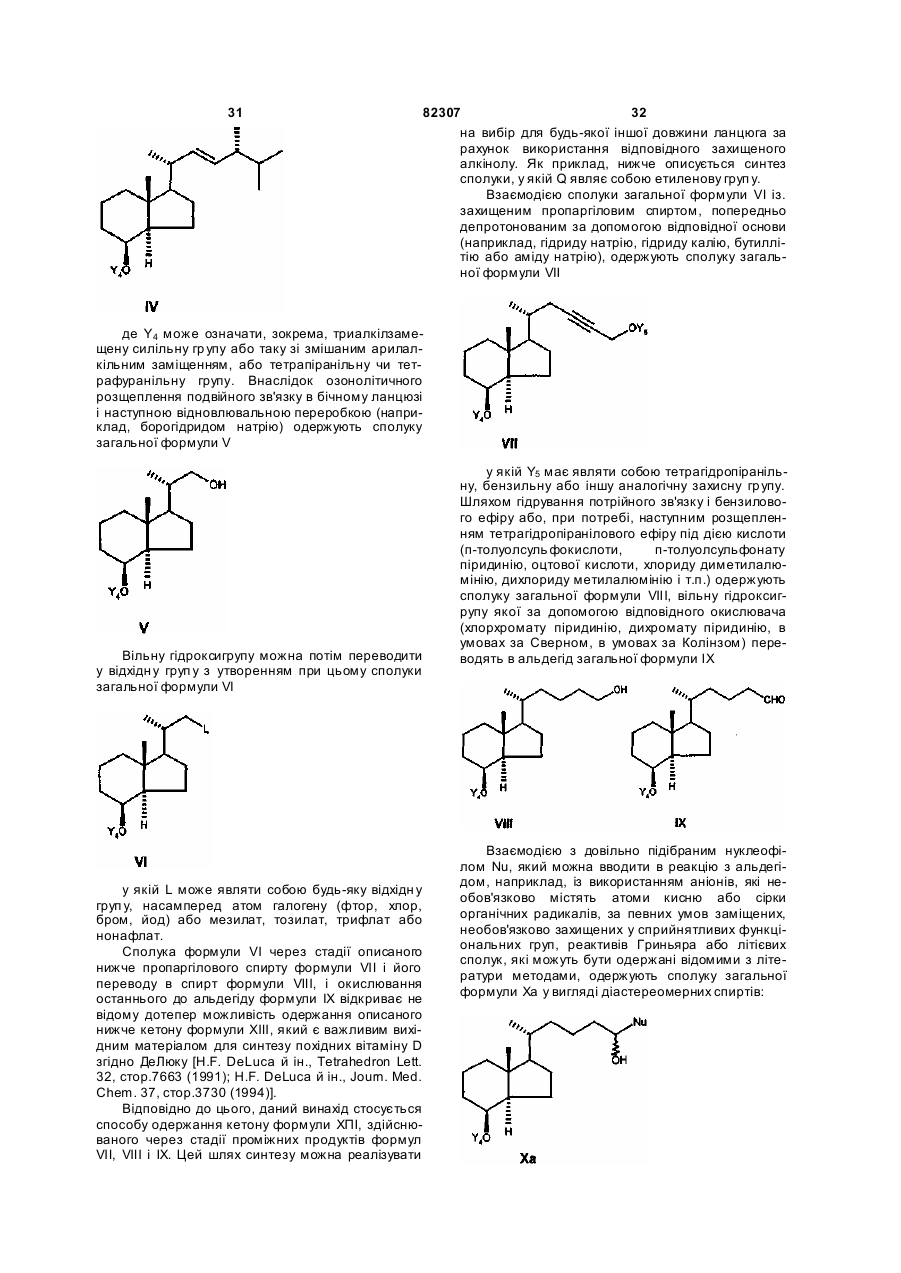
введенням захисної групи Y4 переводять у сполуку формули IV
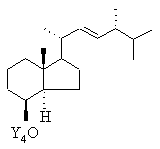 , IV
, IV
в якій Y4 означає триалкілсилільну захисну групу, силільну захисну групу зі змішаним арилалкільним заміщенням, тетрагідропіранільну або тетрагідрофуранільну захисну групу,
шляхом оксидативного розщеплення подвійного зв'язку переводять у сполуку загальної формули V
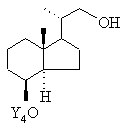 , V
, V
спирт за рахунок введення будь-якої відхідної групи L переводять у сполуку загальної формули VI
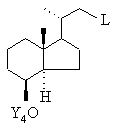 , VI
, VI
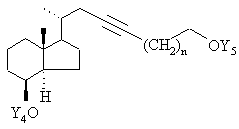
у якій L означає будь-яку відхідну групу, a Y4 означає триалкілсилільну захисну групу, силільну захисну групу зі змішаним арилалкільним заміщенням, тетрагідропіранільну або тетрагідрофуранільну захисну групу, піддають взаємодії з алкінолом формули
![]() ,
,
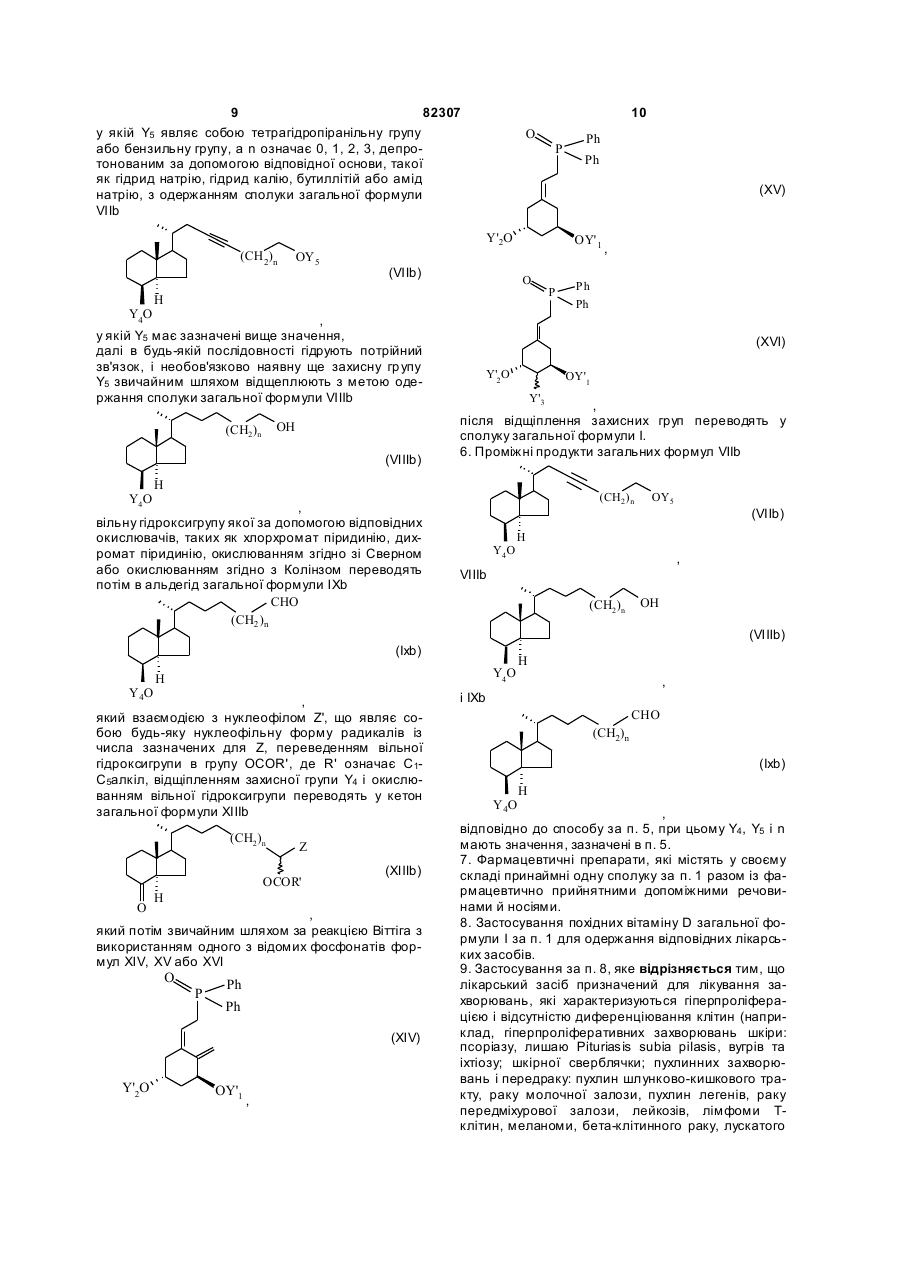
у якій Y5 являє собою тетрагідропіранільну групу або бензильну групу, а n означає 0, 1, 2, 3, депротонованим за допомогою відповідної основи, такої як гідрид натрію, гідрид калію, бутиллітій або амід натрію, з одержанням сполуки загальної формули VIIb
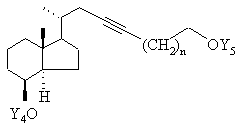 , VIIb
, VIIb
у якій Y5 має зазначені вище значення,
далі в будь-якій послідовності гідрують потрійний зв'язок, і необов'язково наявну ще захисну групу Y5 звичайним шляхом відщеплюють з метою одержання сполуки загальної формули VIIIb
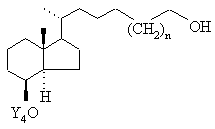 , VIIIb
, VIIIb
вільну гідроксигрупу якої за допомогою відповідних окислювачів, таких як хлорхромат піридинію, дихромат піридинію, окислюванням згідно зі Сверном або окислюванням згідно з Колінзом переводять потім в альдегід загальної формули ІХb
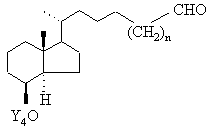 , IXb
, IXb
який взаємодією з нуклеофілом Z', що являє собою будь-яку нуклеофільну форму радикалів із числа зазначених для Z, переведенням вільної гідроксигрупи в групу OCOR', де R' означає С1-С5алкіл, відщіпленням захисної групи Y4 і окислюванням вільної гідроксигрупи переводять у кетон загальної формули ХIIIb
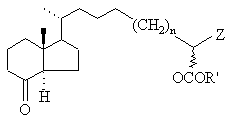 , XIIIb
, XIIIb
який потім звичайним шляхом за реакцією Віттіга з використанням одного з відомих фосфонатів формул XIV, XV або XVI
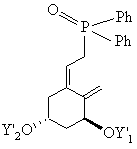 , XIV
, XIV
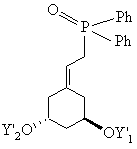 , XV
, XV
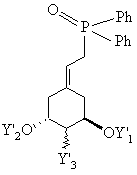 , XVI
, XVI
після відщіплення захисних груп переводять у сполуку загальної формули І.
6. Проміжні продукти загальних формул VIIb
 , VIIb
, VIIb
VIIIb
 , VIIIb
, VIIIb
і ІXb
 , IXb
, IXb
відповідно до способу за п. 5, при цьому Y4, Y5 і n мають значення, зазначені в п. 5.
7. Фармацевтичні препарати, які містять у своєму складі принаймні одну сполуку за п. 1 разом із фармацевтично прийнятними допоміжними речовинами й носіями.
8. Застосування похідних вітаміну D загальної формули І за п. 1 для одержання відповідних лікарських засобів.
9. Застосування за п. 8, яке відрізняється тим, що лікарський засіб призначений для лікування захворювань, які характеризуються гіперпроліферацією і відсутністю диференціювання клітин (наприклад, гіперпроліферативних захворювань шкіри: псоріазу, лишаю Pituriasis subia pilasis, вугрів та іхтіозу; шкірної сверблячки; пухлинних захворювань і передраку: пухлин шлунково-кишкового тракту, раку молочної залози, пухлин легенів, раку передміхурової залози, лейкозів, лімфоми Т-клітин, меланоми, бета-клітинного раку, лускатого раку, актинічного кератозу, шийної дисплазії, пухлин будь-якого типу, які дають метастази).
10. Застосування за п. 8, яке відрізняється тим, що лікарський засіб призначений для лікування й профілактики захворювань, які характеризуються порушенням рівноваги імунної системи (наприклад, екземи, атопічних захворювань і запальних захворювань: ревматоїдного артриту, захворювань дихальних шляхів, таких як астма, автоімунних захворювань, таких як розсіяний склероз, цукрового діабету типу І, важкої міастенії, червоного вовчаку, склеродермії, бульозних захворювань шкіри, таких як пемфігус, пемфігоїд, при реакціях відторгнення автологічних, алогенних або гетерологічних трансплантатів, а також СНІДу).
11. Застосування за п. 9, яке відрізняється тим, що лікарський засіб включає і інші засоби, які мають імуносупресорну дію, такі як циклоспорин A, FK 506, рапаміцин і антитіла до CD4.
12. Застосування за п. 8, яке відрізняється тим, що лікарський засіб призначений для терапії вторинного гіперпаратиреозу і ниркової остеодистрофії, а також цукрового діабету типу II.
13. Застосування за п. 8, яке відрізняється тим, що лікарський засіб призначений для локального введення для прискореного загоєння ран, а також для лікування старіння шкіри або індукованої медикаментами атрофії шкіри.
14. Застосування за п. 8, яке відрізняється тим, що лікарський засіб призначений для лікування захворювань, які супроводжуються порушенням росту волосся, з метою сприяння фізіологічному процесу росту волосся.
15. Застосування за п. 8, яке відрізняється тим, що лікарський засіб призначений для терапії та профілактики старечого остеопорозу, клімактеричного остеопорозу, індукованого стероїдами остеопорозу і для прискореного загоєння артропластики.
16. Застосування за п. 8, яке відрізняється тим, що лікарський засіб призначений для лікування дегенеративних захворювань периферичної й центральної нервової системи.
17. Застосування за п. 8, яке відрізняється тим, що лікарський засіб призначений для терапії й профілактики артеріосклерозу, для терапії гіперкальціємії, для контролю фертильності, при СНІДі, як імуностимуляторів, при гірсутизмі і гранулематозних захворюваннях.
18. Спосіб одержання сполук загальної формули IIа
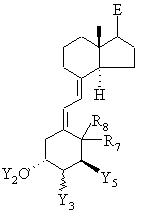 , ІІа
, ІІа
в якій Е означає будь-який бічний ланцюг,
R7 i R8 кожен незалежно один від одного означає атом водню, метильну групу або обидва разом утворюють екзоциклічну метиленову групу або циклопропільне кільце,
Y2 означає атом водню або групу -(CO)R5,
Y3 означає атом водню, гідроксигрупу, атом галогену, групу -O(CO)R5 або OR5-групу, де
R5 являє собою аліфатичний С1-С12алкільний радикал, необов'язково перерваний 1-2 атомами кисню, 1-2 атомами сірки і/або 1-2 NH-групами, і/або необов'язково заміщений 1-2 гідроксигрупами, 1-2 аміногрупами, 1-2 SH-групами, 1-2 СООН-групами і/або 1-2 фенільними групами, або являє собою ароматичний радикал з 5-12 С-атомами,
Y5 означає атом фтору, (СН2)n-ОН-групу або (CH2)n-O(CO)R5-гpyпy,
де n означає 0-4,
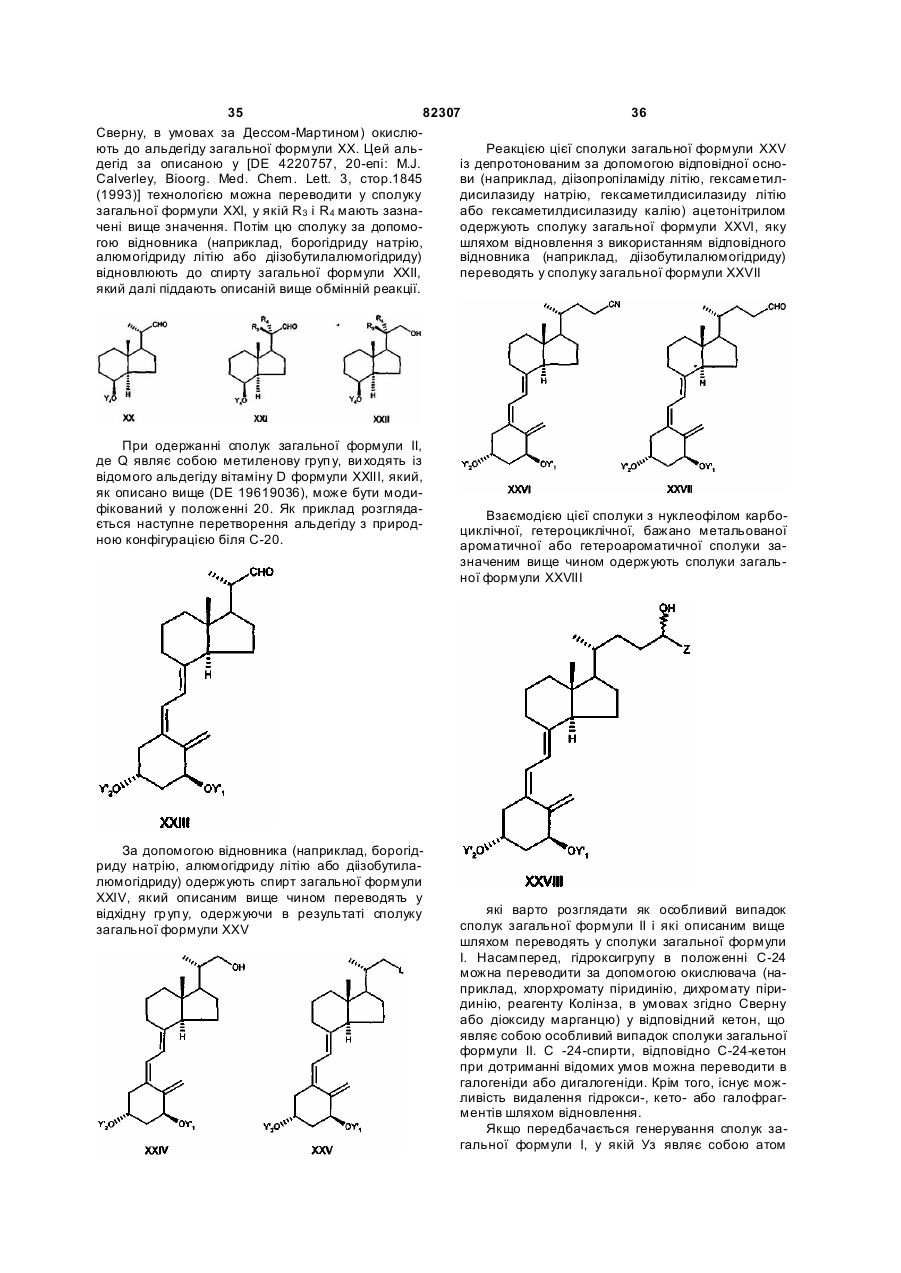
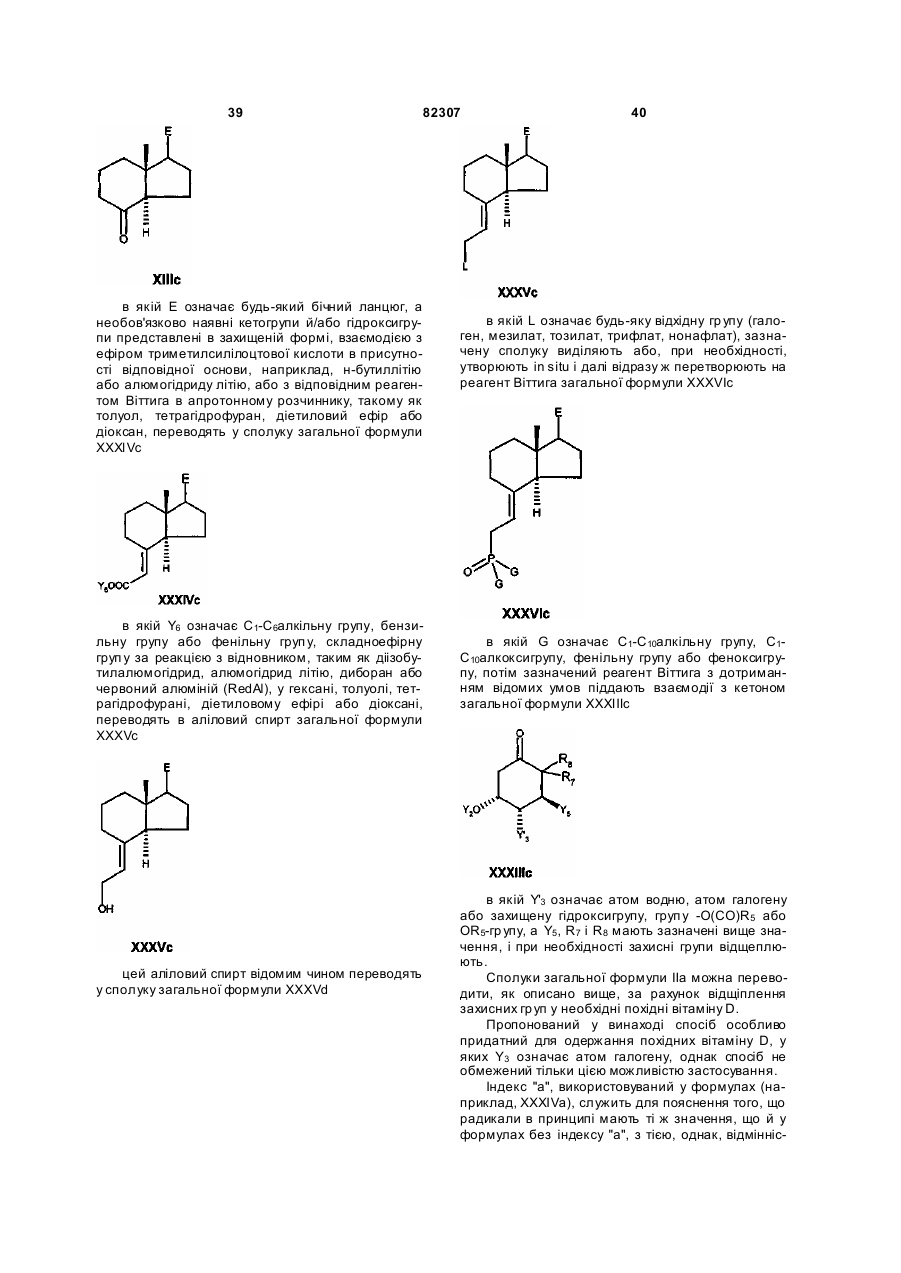
і необов'язково наявні гідроксигрупи, представлені при потребі в захищеній формі, який відрізняється тим, що кетон загальної формули ХІIIс
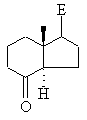 , ХІІІс
, ХІІІс
в якій Е означає будь-який бічний ланцюг, а необов'язково наявні кетогрупи і/або гідроксигрупи представлені в захищеній формі, взаємодією з ефіром триметилсилілоцтової кислоти в присутності відповідної основи, наприклад, н-бутиллітію або алюмогідриду літію, або з відповідним реагентом Віттіга в апротонному розчинникові, такому як толуол, тетрагідрофуран, діетиловий ефір або діоксан, переводять у сполуку загальної формули XXXIVc
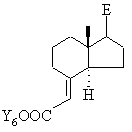 , ХХХІVc
, ХХХІVc
у якій Y6 означає С1-С6алкільну групу, бензильну групу або фенільну групу, складноефірну групу за реакцією з відновником, таким як діізобутилалюмогідрид, алюмогідрид літію, диборан або червоний алюміній (RedAl), у гексані, толуолі, тетрагідрофурані, діетиловому ефірі або діоксані, переводять в аліловий спирт загальної формули XXXVc
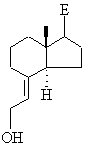 , ХХХVc
, ХХХVc
цей аліловий спирт відомим чином переводять у сполуку загальної формули XXXVd
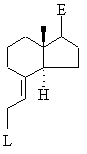 , XXXVd
, XXXVd
у якій L означає галоген, мезилат, тозилат, трифлат, нонафлат, зазначену сполуку виділяють або, при потребі, утворюють in situ і далі відразу ж перетворюють на реагент Віттіга загальної формули XXXVIc
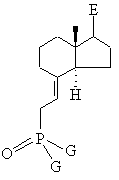 , XXXVIc
, XXXVIc
в якій G означає С1-С10алкільну групу, С1-С10алкоксигрупу, фенільну групу або феноксигрупу, потім зазначений реагент Віттіга при дотриманні відомих умов піддають взаємодії з кетоном загальної формули ХХХІІІс
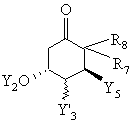 , ХХХІІІс
, ХХХІІІс
у який Y’3 означає атом водню, атом галогену або захищену гідроксигрупу, групу -O(CO)R5 або OR5-гpyпy, a Y5, R7 і R8 мають зазначені вище значення, і при потребі захисні групи відщеплюють.
Текст
, свинок удається індукувати посилене почервонін(5Z,7E)-(1S,3R,24aR)-24-(тiaзoл-2-iл)-9,10ня шкіри й збільшення товщини епідермісу. Посиceкoxoлa-5,7,10(19)-тpиєн-l,3,24a-тріол(217а). лене почервоніння шкіри визначають за підвищенням кількісного показника червоності, який виявляють за допомогою відповідного колориметККЗ СД (HL 60) СД (Са) ра. Цей показник червоності після триразового 16а 5 5 >30 введення речовин (доза 0,003%) за інтервали часу 20а 3 2 >50 по 24год. звичайно зростає в 1,5 раза. Збільшення 55b 5 8' >100 товщини епідермісу визначають на гістологічному 57 12 2 >350 препараті. Цей показник зростає звичайно в 2,5 217а 7 100 >300 рази. Кількість проліферуючих клітин епідермісу кальцитріол 1 1 1 (клітини в S-фазі клітинного циклу) виявляють методом проточної цитометрії, і це число збільшуЗазначені сполуки, поряд із вираженою споріється зазвичай у 6 разів. дненістю до рецептора вітаміну D, виявляють поЗазначені властивості пропонованих похідних мітну активність стосовно диференціонування клііз групи вітаміну D дозволяють із деякою мірою тин. Індукція ж гіперкальціємії спостерігається впевненості припустити можливість їхнього тералише при значно більш високих дозах у порівнянні певтичного застосування при атрофічній шкірі, яка з кальцитріолом. спостерігається при природному старінні шкіри Завдяки зниженій здатності викликати гіперкавнаслідок тривалого світлового впливу або індукольціємію, а також високій метаболічній стабільносваної медикаментами атрофії шкіри, зокрема, при ті речовини за даним винаходом можуть особливо лікуванні глюкокортикоїдами. успішно застосовуватися для одержання лікарсьЩе одна перевага нових сполук полягає в моких засобів, призначених для лікування захворюжливості їхнього локального застосування з метою вань, які характеризуються гіперпроліферацією й прискорення загоєння ран. відсутністю диференціонування клітин. До таких 27 82307 28 У клітинних популяціях волосяного фолікула, інтоксикації, викликаній кальцитріолом або речоякі відіграють вирішальну роль для росту волосся, винами, які мають дію, подібну до кальцитріолу, відповідно для регуляції циклу життя волосся, або ж при підвищеному екстраренальному синтезі вдалося знайти протеїни рецептора вітаміну D3 кальцитріолу при гранулематозних захворюваннях [W.E. Stumpf та ін. Cell Tissue Res. 238, стор.489 (саркоїдозі, туберкульозі). Сюди ж зараховують (1984); P. Milde та ін., Journ. Invest. Dermatol. 97, випадки паранеопластичної гіперкальціємії (настор.230 (1991)]. Крім того, дані досліджень in vitro приклад, при остеолітичних метастазах і пухлинах виділених кератиноцитів волосяного фолікула підіз підвищеним синтезом білка, спорідненого із патверджують, що 1,25-(ОН)2-D3 спричиняє вплив, ратгормоном), а також при паращитовидній гіперякий інгібує проліферацію і стимулює диференціокальціємії. нування. Ще одна можливість застосування антагоністів Клінічні спостереження, як відомо, показали, кальцитріолу полягає в контролі репродуктивної що стійкий до вітаміну D3 рахіт часто супроводжуздатності (фертильності). Рецептор вітаміну D ється алопецією, яка проявляється в ранньому експресується у репродуктивному тракті самок і дитячому віці. Експериментальні дані підтверджусамців тварин. Відомо, що в самок і самців тварин, ють той факт, що місце зв'язування вітаміну D 3 із що мають недолік вітаміну D, репродуктивна здатВДР при таких захворюваннях зазнає змін, тобто є ність знижена. За рахунок короткочасної заміни дефектним. [K. Kristjansson та ін., Journ. Clin. кальцитріолу цю здатність можна підвищити, тому Invest. 92, стор.12 (1993)]. Кератиноцити, виділені антагоністи кальцитріолу здатні впливати на жіноз волосяних фолікул пацієнтів, не реагують in vitro чу й чоловічу фертильність. на додавання 1,25-(ОН)2D3 [S. Arase та ін., Journ. Оскільки кальцитріол за певних умов виявляє Dermatol. Science 2, стор.353 (1991]. імуносупресорну ефективність, антагоністи рецепТаким чином, дані, які є на сьогоднішній день, тора кальцитріолу можуть застосовуватися також дозволяють зробити висновок про вирішальну у якості імуностимуляторів, наприклад, при послароль 1,25-(ОН)2D3 при регуляції росту волосся. бленій опірності інфекції і при СНІДі. Згідно з цим, зазначені аналоги особливо придатні Про кальцитріол відомо, що він може модулюдля одержання лікарських засобів, призначених вати ріст волосся, тому антагоністи кальцитріолу для лікування захворювань, що супроводжуються можуть знайти терапевтичне застосування при порушенням росту волосся (андрогенетична алонебажаному рості волосся, наприклад, при гірсупеція, колоподібне облисіння/загальне випадіння тизмі. волосся, алопеція, обумовлена хіміотерапією), або З давнього часу відома стимулювальна роль здатних додатково стимулювати фізіологічний вітаміну D, яку він відіграє при утворенні артеріоспроцес росту волосся, не викликаючи при цьому клеротичних бляшок. У таких уражених судинах побічних ефектів кальцитріолу (насамперед гіпервиявляється підвищений уміст регульованого кальціємію). кальцитріолом протеїну остеопонтину, якому приСтаречий і клімактеричний остеопороз харакписують певну роль при звапнінні судин [R. теризується, як відомо, підвищеною зміною кісткоEisenstein та ін., Arch. Path. 77, стор.27 (1964); L.A. вої тканини, що призводить врешті до негативних Fitzpatrick та ін., Journ. Clin. Invest. 94, стор.1597 наслідків. Атро фія кісткової тканини, насамперед (1994)]. Відповідно до цього, антагоністи кальциттрабекулярних кісток, є частою причиною перелоріолу придатні для застосування при терапії і промів. Завдяки стимулюючій дії кальцитріолу як на філактиці усіх форм прояву артеріосклерозу. кількість, так і на ефективність синтезу клітин, які На закінчення необхідно назвати ще одну моутворюють нову кісткову тканину (остеобластів), жливість застосування антагоністів кальцитріолу, пропоновані у винаході речовини можуть застосообумовлену властивістю останнього підсилювати вуватися для терапії і профілактики старечого й неспецифічні iмунореакції моноцитарних клітин, а клімактеричного остеопорозу [ЕР 0634173 А1], саме, для терапії запальних захворювань, насаміндукованого стероїдами остеопорозу, а також для перед, хронічного характеру, таких як ревматоїдприскореного загоєння артропластики, не виклиний артрит, хвороба Крона, виразковий коліт, і каючи при цьому побічних ефектів кальцитріолу гранулематозних захворювань, таких як саркоїдоз, (насамперед гіперкальціємію). При терапії різних а також інших реакцій організму на чужорідні тіла. форм остеопорозу їх можна успішно застосовуваДля всіх зазначених випадків терапевтичного ти у сполученні з естрадіолом або іншими модифізастосування сполук за винаходом справедливо каціями естрогенів. те, що при всіх названих картинах хвороб вони Далі було встановлено, що кальцитріол підсиздатні забезпечити необхідний терапевтичний лює синтез "ростової речовини" нервових клітин ефект, не викликаючи при цьому побічних дій (фактор росту нервів) [M.S. Saporito й ін., Brain кальцитріолу (насамперед гіперкальціємію). Res. 633, стор.189 (1994)]. Тому сполуки за даним Враховуючи ви щевикладене, даний винахід винаходом придатні також для лікування дегенестосується також фармацевтичних препаратів, які ративних захворювань периферичної й центральмістять у своєму складі щонайменше одну сполуку ної нервової системи, таких як хвороба Альцгейзагальної формули І разом із фармакологічно примера і бічний аміотрофічний склероз. йнятними носіями. Крім того, було встановлено, що деякі сполуки З пропонованих сполук можна приготовлювати загальної формули І несподіваним чином діють у розчини у фармацевтично прийнятних розчинниклітках HL 60 як антагоністи кальцитріолу. Такі ках або емульсії, суспензії або дисперсії у відповісполуки можуть застосовуватися при терапії гіпердних фармацевтичних розчинниках або носіях, або кальціємії, наприклад, при гіпервітамінозі D або 29 82307 30 же з них можна виготовляти пігулки, таблетки і етил, тетрагідрофураніл, тетрагідропіраніл), а такапсули, у яких містяться відомі тверді носії. кож ацетил, пропіоніл або півалоїл, у випадку Для локального застосування зі сполук бажано кетогруп маються на увазі кеталі (1,3-діоксолани, приготовлювати креми або мазі або інші аналогічні 1,3-діоксани, діалкоксикеталі) [див. T.W. Greene, лікарські форми, придатні для місцевого застосуP.G.M. Wuts "Protective Groups in Organic вання. Будь-яка композиція такого типу може місSynthesis", 2-е видання, вид-во John Wiley & Sons, тити у своєму складі й інші фармацевтично прийн1991]. ятні й нетоксичні допоміжні речовини, наприклад, За рахунок одночасного або послідовного відстабілізатори, антиоксиданти, зв'язувальники, бащеплення гідрокси- і кетозахисних груп і необов'ярвники, емульгатори або смакові добавки. зково за рахунок часткової, послідовної або повної Сполуки бажано застосовувати для ін'єкції, етерифікації вільних гідроксильних гр уп з утворенвнутрішньовенної інфузії у відповідних стерильних ням складного ефіру сполуку загальної формули II розчинах, вводити у вигляді аерозолів через бронпереводять у сполуку загальної формули І. хи й легені або пероральним шляхом у відповідУ випадку силільних захисних гр уп або трименому дозуванні через травний тракт або ж у виглятилсилілетоксиметильної групи для їхнього відщіді кремів, мазей, лосьйонів або відповідних плення використовують фторид тетрабутиламотрансдермальних пластирів, призначених для лонію, фтористоводневу кислоту або кального застосування, як це описано в [заявці ЕРфтористоводневу кислоту/піридин або кислі іоноА 0387077]. обмінники. У випадку груп простих ефірів (метокДобова доза складає від 0,1 до симетиловий, метоксіетоксиметиловий, етоксіети1000мкг/пацієнт/день, бажано від 1,0 до ловий, тетрагідропіраніловий ефір) і кеталей 500мкг/пацієнт/день. зазначені групи відщеплюють під каталітичною Спосіб одержання сполук за винаходом дією відповідної кислоти, такої, наприклад, як пПохідні вітаміну D загальної формули І одертолуолсульфокислота, п-толуолсульфонат пірижують за даним винаходом зі сполуки загальної динію, оцтова кислота, соляна кислота, фосфорна формули II кислота, або кислого іонообмінника. На відміну від цього, складноефірні групи гідролізують в основному середовищі (використовують карбонат натрію, карбонат калію, гідроксид натрію, гідроксид калію у воді, етанолі, метанолі або сумішах цих розчинників. Етерифікацію вільних гідроксигруп при потребі здійснюють звичайними методами за допомогою хлорангідридів, бромангідридів або ангідридів карбонової кислоти. Вихідні сполуки для загальної формули II, в яких Q означає принаймні етиленову гр упу, залежно, у кінцевому підсумку, від потрібного зразка заміщення в положенні 20, одержують, ви ходячи з різних вихідних сполук. Для сполук із природною конфігурацією біля С-20 як вихідний матеріал використовуть відомий CD-фрагмент формули III [Н.Н. Inhoffen, G. Quinkert, S. Schiitz, G. Friedrich, E. Tober, Chem. Ber. 91, стор.781-791 (1958)]. у якій Υ'1 і Y' 2 означають гідроксизахисні групи, а Y'3 являє собою атом водню, атом галогену або захищену гідроксигрупу. Х' 1, Х'2 і Ζ' відрізняються від Х1, Х2 і Ζ тим, що необов'язково наявні гідрокси- або кетогрупи можуть бути представлені в захищеній формі. Під захисними групами маються на увазі бажано алкільні, арильні силільні групи або такі зі змішаним алкіларильним заміщенням, наприклад триметилсиліл (ТМС), триетилсиліл (ТЕС), третбутилдиметилсиліл (ТБДМС), третбутилди фенілсиліл (ТБДФС) або триізопропілсиліл (ТІПС), або інші зазвичай використовувані в цих цілях гідроксизахисні групи (триметилсилілетоксиметил, метоксиметил, метоксіетоксиметил, етоксі Введенням захисної групи одержують сполуку загальної формули IV 31 82307 32 на вибір для будь-якої іншої довжини ланцюга за рахунок використання відповідного захищеного алкінолу. Як приклад, нижче описується синтез сполуки, у якій Q являє собою етиленову груп у. Взаємодією сполуки загальної формули VI із. захищеним пропаргіловим спиртом, попередньо депротонованим за допомогою відповідної основи (наприклад, гідриду натрію, гідриду калію, бутиллітію або аміду натрію), одержують сполуку загальної формули VII де Y4 може означати, зокрема, триалкілзамещену силільну гр упу або таку зі змішаним арилалкільним заміщенням, або тетрапіранільну чи тетрафуранільну групу. Внаслідок озонолітичного розщеплення подвійного зв'язку в бічному ланцюзі і наступною відновлювальною переробкою (наприклад, борогідридом натрію) одержують сполуку загальної формули V Вільну гідроксигрупу можна потім переводити у відхідн у груп у з утворенням при цьому сполуки загальної формули VI у якій L може являти собою будь-яку відхідн у груп у, насамперед атом галогену (фтор, хлор, бром, йод) або мезилат, тозилат, трифлат або нонафлат. Сполука формули VI через стадії описаного нижче пропаргілового спирту формули VII і його переводу в спирт формули VIII, і окислювання останнього до альдегіду формули IX відкриває не відому дотепер можливість одержання описаного нижче кетону формули ХІII, який є важливим вихідним матеріалом для синтезу похідних вітаміну D згідно ДеЛюку [H.F. DeLuca й ін., Tetrahedron Lett. 32, стор.7663 (1991); H.F. DeLuca й ін., Journ. Med. Chem. 37, стор.3730 (1994)]. Відповідно до цього, даний винахід стосується способу одержання кетону формули ХПІ, здійснюваного через стадії проміжних продуктів формул VII, VIII і IX. Цей шлях синтезу можна реалізувати у якій Y5 має являти собою тетрагідропіранільну, бензильну або іншу аналогічну захисну гр упу. Шляхом гідрування потрійного зв'язку і бензилового ефіру або, при потребі, наступним розщепленням тетрагідропіранілового ефіру під дією кислоти (п-толуолсуль фокислоти, п-толуолсульфонату піридинію, оцтової кислоти, хлориду диметилалюмінію, дихлориду метилалюмінію і т.п.) одержують сполуку загальної формули VIII, вільну гідроксигрупу якої за допомогою відповідного окислювача (хлорхромату піридинію, дихромату піридинію, в умовах за Сверном, в умовах за Колінзом) переводять в альдегід загальної формули IX Взаємодією з довільно підібраним нуклеофілом Nu, який можна вводити в реакцію з альдегідом, наприклад, із використанням аніонів, які необов'язково містять атоми кисню або сірки органічних радикалів, за певних умов заміщених, необов'язково захищених у сприйнятливих функціональних груп, реактивів Гриньяра або літієвих сполук, які можуть бути одержані відомими з літератури методами, одержують сполуку загальної формули Ха у вигляді діастереомерних спиртів: 33 82307 34 При синтезі сполук за винаходом взаємодією з нуклеофільною формою радикала Z, що позначається як Z', бажано з метальованою ароматичною або гетероароматичною сполукою, одержують сполуку загальної формули X Взаємодією кетону загальної формули XIII з одним із відомих фосфіноксидів формул XIV, XV або XVI [XIV: M.R. Uskokovic та ін., Tetrahedron Lett. 33, стор.7701 (1991), A. Mourino й ін., Tetrahedron Lett. 38, стор.4713 (1997); XV: H.F. DeLuca й ін., Tetrahedron Lett. 32, стор.7663 (1991); XVI: H.F. DeLuca й ін., Journ. Med. Chem. 37, стор.3730 (1994)] Z' може являти собою будь-який із зазначених для Ζ радикалів, бажано фуран, тіофен, оксазол, тіазол, імідазол, піразол, пірол, бензофуран, бензотіофен, бензоксазол, бензотіазол, бензімідазол, індол або феніл, при цьому кільця можуть нести один або декілька замісників у будь-яких положеннях. Як замісники можна розглядати атоми фтору, хлору, брому або йоду, одну або декілька гідроксигруп, одну або декілька COOR6-груп, одну або декілька С1-С5алкільних груп, що у свою чергу можуть бути заміщені одним або декількома атомами фтор у, хлор у, брому або йоду, С1С6алкоксигрупами й/або COOR6-групaми (R6 означає С1-С6алкільну групу, бензильну груп у або фенільну групу). Ароматичні сполуки за рахунок обміну водень-літій, ортометалювання, обміну галоген-літій (з використанням н-бутиллітiю, вторбутиллітію, трет- бутиллітію, метиллітію) або взаємодією галогеносполук із магнієм або цинком переводять у метальовані похідні. Приєднання до CD-фрагмента здійснюють у всіх випадках біля положення металювання, за винятком оксазольних кілець, які у результаті перегрупування і рециклювання виявляють активність стосовно положення 4 [G. Boche й ін., Chem. Ber./Receuil 130, стор.1213 (1997)]. Переведення вільної гідроксигрупи в ацетатні (R'=Me), пропіонатні (R' означає Et) або півалоатні (R' означає трет-Вu) групування дозволяє одержувати сполуки загальної формули XI, які за рахунок відщіплення циклогексанольних захисних гр уп Y4 переводять у сполуки загальної формули XII. Якщо Υ4 означає силільну гр упу, то відщеплювати цю груп у можна, наприклад, із використанням фториду те трабутиламонію, фтористого водню, комплексу фтористий водень/піридин, якщо ж Υ4 означає тетрагідропіранільну або тетрагідрофуранільну груп у, то таку гр упу можна відщеплювати у кислих умовах. Шля хом наступного окислювання вільної гідроксигрупи окислювачем (хлорхроматом піридинію, дихроматом піридинію, в умовах згідно Сверну або в умовах згідно Колінзу) одержують сполуку загальної формули XIII де Υ'1 і Υ'2 являють собою алкільні силільні групи або такі групи зі змішаним арилалкільним заміщенням (бажано трет-бутилдиметилсилільні, трет-бутилдифенілсилільні, триметилсилільні, триетилсилільні або триізопропілсилільні групи), а Y' 3 означає відповідне силілоксигрупування, одержують вітамін D-системи загальних формул XVII, XVIII і XIX Сполуки загальних формул XVII, XVIII і XIX являють собою особливі випадки сполук загальної формули II, і їх переводять описаним вище шляхом у сполуки загальної формули І. Насамперед, гідроксигрупу можна вивільняти в положенні С-24 і за допомогою окислювача (наприклад, хлорхромату піридинію, дихромату піридинію, реагенту Колінза, в умовах згідно Сверну або діоксиду марганцю) переводити у відповідний кетон, що являє собою також особливий випадок сполуки загальної формули II. С-24-спирти, відповідно С-24-кетон при дотриманні відомих умов можна переводити в галогеніди або дигалогеніди. Крім того, існує можливість видаляти гідрокси-, кето- або галофрагменти шляхом відновлення. Усі операції з функціональними групами в бічному ланцюзі можна проводити і на більш ранніх стадіях. Для одержання сполук загальної формули II із зміненим зразком заміщення біля С-20 спирт загальної формули V відповідним окислювачем (наприклад, хлорхроматом піридинію, дихроматом піридинію, реагентом Колінза, в умовах згідно 35 82307 36 Сверну, в умовах за Дессом-Мартином) окислюють до альдегіду загальної формули XX. Цей альРеакцією цієї сполуки загальної формули XXV дегід за описаною у [DE 4220757, 20-епі: M.J. із депротонованим за допомогою відповідної осноCalverley, Bioorg. Med. Chem. Lett. 3, стор.1845 ви (наприклад, діізопропіламіду літію, гексаметил(1993)] технологією можна переводити у сполуку дисилазиду натрію, гексаметилдисилазиду літію загальної формули XXI, у якій R3 і R4 мають зазнаабо гексаметилдисилазиду калію) ацетонітрилом чені вище значення. Потім цю сполуку за допомоодержують сполуку загальної формули XXVI, яку гою відновника (наприклад, борогідриду натрію, шляхом відновлення з використанням відповідного алюмогідриду літію або діізобутилалюмогідриду) відновника (наприклад, діізобутилалюмогідриду) відновлюють до спирту загальної формули XXII, переводять у сполуку загальної формули XXVII який далі піддають описаній вище обмінній реакції. При одержанні сполук загальної формули II, де Q являє собою метиленову груп у, ви ходять із відомого альдегіду вітаміну D формули XXIII, який, як описано вище (DE 19619036), може бути модифікований у положенні 20. Як приклад розглядається наступне перетворення альдегіду з природною конфігурацією біля С-20. За допомогою відновника (наприклад, борогідриду натрію, алюмогідриду літію або діізобутилалюмогідриду) одержують спирт загальної формули XXIV, який описаним вище чином переводять у відхідну гр уп у, одержуючи в результаті сполуку загальної формули XXV Взаємодією цієї сполуки з нуклеофілом карбоциклічної, гетероциклічної, бажано метальованої ароматичної або гетероароматичної сполуки зазначеним вище чином одержують сполуки загальної формули XXVIII які варто розглядати як особливий випадок сполук загальної формули II і які описаним вище шляхом переводять у сполуки загальної формули І. Насамперед, гідроксигрупу в положенні С-24 можна переводити за допомогою окислювача (наприклад, хлорхромату піридинію, дихромату піридинію, реагенту Колінза, в умовах згідно Сверну або діоксиду марганцю) у відповідний кетон, що являє собою особливий випадок сполуки загальної формули II. С -24-спирти, відповідно С-24-кетон при дотриманні відомих умов можна переводити в галогеніди або дигалогеніди. Крім того, існує можливість видалення гідрокси-, кето- або галофрагментів шляхом відновлення. Якщо передбачається генерування сполук загальної формули І, у якій Уз являє собою атом 37 82307 38 галогену (наприклад, фтору, хлору або брому), то Трансформацію гідроксигрупи в похідне дифенілΑ-ланку загальної формули XXX, де Y3 має ви щефосфіноксиду загальної формули XXXVI здійснювказане значення, необхідно синтезувати з відомоють у стандартних умовах через алілгалогенід го з літератури похідного циклогексану формули (хлорид, бромід) або через проміжний тозилат або XXIX [J.-L. Montchamp, J.W. Frost, Journ. Am. мезилат. Chem. Soc. 113, стор.6296 (1991)] за реакцією Ханесіана (Hanessian). Завдяки введенню захисної групи для вільної гідроксигрупи одержують сполуку загальної формули XXXI, яку переводять спочатку в кислому середовищі звичайним чином у діол формули XXXII, а наступним розщепленням діолу (із використанням перйодату натрію або перйодної кислоти) - у кетон формули XXXIII (значення Y'1 і Y3 уже указувалися вище). Для синтезу системи вітаміну D при Y3, що означає галоген, пропонується новий шлях його здійснення, який разом із тим прийнятний і при всіх можливих замісниках Y3 (у тому числі і при Y3=а том водню), так само, як і у випадку інших зразків заміщення біля Α-кільця (наприклад, замість ОY1 у положенні 1-галоген, (СH2)n-ОН або (CH2)n-O(CO)R5, де R5 означає аліфатичний С 1С12алкільний радикал, необов'язково перерваний 1-2 атомами кисню, 1-2 атомами сірки й/або 1-2 NH-групами й/або необов'язково заміщений 1-2 гідроксигрупами, 1-2 аміногрупами, 1-2 SHгрупами, 1-2 СООН-групами й/або 1-2 фенільними групами, де n=0-4, або означає ароматичний радикал з 5-12 С-атомами), а також при будь-яких бічних ланцюгах у положенні 17 з необов'язково наявними в захищеній формі гідроксигрупами і/або кетогрупами. Такі реакції описуються нижче на прикладі кетону загальної формули XIII, разом із тим, вони застосовні і для інших варіантів бічних ланцюгів. Олефінуванням за Петерсоном (взаємодія з ефіром триметилсилілоцтової кислоти в присутності відповідної основи, такої, наприклад, як нбутиллітій або діізопропіламід літію) із кетону формули XIII одержують сполуку загальної формули XXXTV, складноефірну гр упу якої відновленням за допомогою відповідного відновника (наприклад, діізобутилалюмогідриду або алюмогідриду літію) переводять у спирт загальної формули XXXV. Внаслідок зв'язування з кетоном загальної формули XXXIII одержують систему вітаміну D загальної формули II із зазначеними вище значеннями Y3. Переведення у сполуку загальної формули І здійснюють описаним раніше шляхом за рахунок відщіплення захисних груп. Відповідно до цього, об'єктом даного винаходу є також новий спосіб одержання похідних вітаміну D загальної формули llа в якій Ε означає будь-який бічний ланцюг, R7 і R8 кожен незалежно один від одного означає атом водню, метальну груп у або обоє разом утворюють екзоциклічну метиленову групу або циклопропільне кільце, Y2 означає атом водню або групу -(CO)R5, Y3 означає атом водню, гідроксигрупу, атом галогену, гр уп у -O(CO)R 5 або OR5-гр упу, де R5 являє собою аліфатичний С 1-С12алкільний радикал, необов'язково перерваний 1-2 атомами кисню, 1-2 атомами сірки й/або 1-2 NH-групами й/або необов'язково заміщений 1-2 гідроксигрупами, 1-2 аміногрупами, 1-2 SH-групами, 1-2 СООНгрупами й/або 1-2 фенільними групами, або являє собою ароматичний радикал з 5-12 С-атомами, Y5 означає атом фтору, (CH2) n-OH гр упу або (CH2)n-O(CO)R5-гр упу, де n означає 0-4, і необов'язково наявні гідроксигрупи представлені при потребі в захищеній формі. Зазначений спосіб відрізняється тим, що кетон загальної формули ХІllс 39 82307 в якій Ε означає будь-який бічний ланцюг, а необов'язково наявні кетогрупи й/або гідроксигрупи представлені в захищеній формі, взаємодією з ефіром триметилсилілоцтової кислоти в присутності відповідної основи, наприклад, н-бутиллітію або алюмогідриду літію, або з відповідним реагентом Віттига в апротонному розчиннику, такому як толуол, тетрагідрофуран, діетиловий ефір або діоксан, переводять у сполуку загальної формули XXXl Vc в якій Y6 означає С1-С6алкільну групу, бензильну групу або фенільну груп у, складноефірну груп у за реакцією з відновником, таким як діізобутилалюмогідрид, алюмогідрид літію, диборан або червоний алюміній (RedAl), у гексані, толуолі, тетрагідрофурані, діетиловому ефірі або діоксані, переводять в аліловий спирт загальної формули XXXVc цей аліловий спирт відомим чином переводять у сполуку загальної формули XXXVd 40 в якій L означає будь-яку відхідну гр упу (галоген, мезилат, тозилат, трифлат, нонафлат), зазначену сполуку виділяють або, при необхідності, утворюють in situ і далі відразу ж перетворюють на реагент Віттига загальної формули XXXVIc в якій G означає С1-С10алкільну групу, С1С10алкоксигрупу, фенільну групу або феноксигрупу, потім зазначений реагент Віттига з дотриманням відомих умов піддають взаємодії з кетоном загальної формули ХХХІІІс в якій Y'3 означає атом водню, атом галогену або захищену гідроксигрупу, груп у -O(CO)R5 або OR5-гр упу, a Y5 , R7 і R8 мають зазначені вище значення, і при необхідності захисні групи відщеплюють. Сполуки загальної формули IIа можна переводити, як описано вище, за рахунок відщіплення захисних гр уп у необхідні похідні вітаміну D. Пропонований у винаході спосіб особливо придатний для одержання похідних вітаміну D, у яких Y3 означає атом галогену, однак спосіб не обмежений тільки цією можливістю застосування. Індекс "а", використовуваний у формулах (наприклад, XXXIVa), служить для пояснення того, що радикали в принципі мають ті ж значення, що й у формулах без індексу "а", з тією, однак, відмінніс 41 82307 42 тю, що сприйнятливі до реакції групи представлені хом хроматографії на силікагелі з використанням в захищеній формі. суміші оцтовий ефір/гексан, одержуючи при цьому В іншому, альтернативному, варіанті синтезу 10,1г зазначеної у заголовку сполуки 3 у вигляді сполук загальної формули II, де Χ'1 і Х'2 означають безбарвної олії. 1 атоми водню, a Q являє собою етиленову гр упу, Н-ЯМР (CDCI3): d = 0,57част./млн (q, 6Н); 0,92 виходять зі спирту загальної формули VIII, гідро(s, 3Н); 0,96 (t, 9Н); 1,02 (d, 3Н); 3,38 (dd, 1Н); 3,63 ксигрупу якого переводять у відповідну відхідну (d, 1Н); 4,05 (m, 1H) груп у (наприклад, у хлорид, бромід, йодид, този3. [1R-[1a(S*),3ab,4a,7аa]]-2-[октагідро-7алат або мезилат) і піддають взаємодії з метальометил-4-[(триетилсиліл)окси]-1Н-інден-1-іл]пропілваними ароматичними або гетероароматичними (4-метилбензенсульфонат) 4 сполуками, одержуючи в результаті сполуки зага9,1г спирту 3 розчиняють у 135мл піридину, льної формули XXXVII, охолоджують до 0°С, а потім додають 7,8г толуолсульфонілхлориду. Реакційну суміш перемішують протягом ночі при 0°С, після чого обережно переривають реакцію за допомогою розчину гідрокарбонату натрію. Далі екстрагують оцтовим ефіром, промивають органічну фазу розчином хлориду натрію, сушать над сульфатом натрію і видаляють розчинник під вакуумом. Залишок очищають за допомогою хроматографії на силікагелі з використанням суміші оцтовий ефір/гексан, одержуючи при цьому 13,3г зазначеної у заголовку сполуки 4 у вигляді безбарвної олії. 1 Н-ЯМР (CDC3): d = 0,56част./млн (q, 6Н); 0,87 подальше перетворення яких може здійснюва(s, 3Н); 0,96 (t, 9Н); 0,97 (d, 3Н); 2,47 (s, 3Н); 3,80 тися аналогічно до описаних вище сполук. (dd, 1Н); 3,97 (d, Ш); 4,01 (m, 1H); 7,35 (d, 2H); 7,80 Нижче винахід більш докладно пояснюється (d, 2H) на прикладах. 4. [1R-[1a(R*),3ab,4a,7аa]]-октагідро-7а-метилПриклади 1-[5-[(тетрагідро-2Н-піран-2-іл)окси]-1-метил-3Синтез вихідних сполук (CD-альдегід) пентиніл-4-[(триетилсиліл)окси]-1Н-інден 5 1. [1R-[1a[1R*,4S*-(Е)],3ab,4а,7аa]]-октагідро15,4г пропаргіл-ТГП-ефіру поміщають у 350мл 7а-метил-4-[(триетилсиліл)окси]-1-(1,4,5-триметилдіоксану і при 10-15°С обережно краплями дода2-гексеніл)-1Н-інден 2 ють 43,8мл н-бутиллітію (2,5Μ в гексані). Через 12,95г [1R-[1a[1R*,4S*-(Е)],3ab,4а,7аa]]одну годину краплями додають 13,3г тозилату 4 у октагідро-7а-метил-1-(1,4,5-триметил-2-гексеніл)100мл діоксану і протягом 48 год. нагрівають до 1Н-інден-4-олу 1 поміщають у 220мл диметилфокипіння. Потім припиняють реакцію за допомогою рмаміду [Н.Н. Inhoffen та ін., Chem. Ber. 91, 781 розчину хлориду натрію і сушать над сульфатом (1958)], додають 5,33г імідазолу і 10,78мл хлортнатрію. Після видалення розчинника залишок риетилсилану і протягом 24год. перемішують при очищають за допомогою хроматографії на силікакімнатній температурі. Потім припиняють реакцію гелі з використанням суміші оцтовий ефір/гексан, за допомогою розчину хлориду натрію, екстрагуодержуючи при цьому 12,1г зазначеної у заголовку ють оцтовим ефіром, органічну фазу промивають сполуки 5 у вигляді безбарвної олії. 1 розчином хлориду натрію і сушать над сульфатом Н-ЯМР (CDCI3): d = 0,57част./млн (q, 6Н); 0,92 натрію. Після видалення розчинника залишок (s, 3Н); 0,96 (t, 9Н); 1,06 (d, 3Н); 3,56 (m, 1Н); 3,88 очищають за допомогою хроматографії на силіка(m, 1H); 4,04 (m, 1H); 4,29 (d, 2H); 4,83 (m, 1H) гелі з використанням суміші оцтовий ефір/гексан, 5. [1R-[1a(R*),3ab,4a,7aa]]-oктaгiдpo-7a-мeтилодержуючи при цьому 14,6г зазначеної у заголовку 1-[5-[(тeтpaгiдpo-2H-пίpaн-2-іл)окси]-1сполуки 2 у вигляді безбарвної олії. метилпентил-4-[(триетилсиліл)окси]-1Н-інден 6 1 Н-ЯМР (CDCI3): d = 0,58част./млн (q, 6Н); 0,82 12,6г алкіну 5 розчиняють у 250мл оцтового (d, 3Н); 0,84 (d, 3Н); 0,93 (t, 9H); 0,96 (d, 3Н); 0,97 ефіру, додають 2,2г паладію на активованому ву(s, 3Н); 0,98 (d, 3Н); 4,05 (m, 1Н); 5,19 (m, 2H) гіллі (10%) і 5,06г гідрокарбонату натрію і піддають 2. [1R-[1a(S*),3ab,4a,7аa]]-2-[октагідро-7агідруванню в гідраторі при нормальному тискові. метил-4-[(триетилсиліл)окси]-1Н-інден-1-іл]-1Реакцію проводять доти, доки не припиниться попропанол 3 глинання водню, після чого суміш фільтрують че14,6г силілового ефіру розчиняють у 300мл рез броунмілерит і концентрують. Залишок очидихлорметану і 150мл метанолу, додають 14,8мл щають за допомогою хроматографії на силікагелі з піридину і охолоджують до -78°С. При цій темпевикористанням суміші оцтовий ефір/гексан, одерратурі пропускають озон, який генерується озонажуючи при цьому 9,9г зазначеної у заголовку спотором, доти, доки колір розчину не стане блакитлуки 6 у вигляді безбарвної олії. 1 ним. Надлишкову кількість озону видаляють за Н-ЯМР (CDCI3): d = 0,56част./млн (q, 6Н); 0,91 допомогою потоку кисню, а потім додають 1,61г (s, 3Н); 0,95 (t, 9Н); 0,97 (d, 3Н); 3,38 (m, 1Н); 3,51 боронітриду натрію. Після цього реакційну суміш (m, 1H); 3,70 (m, 1H); 3,88 (m, 1H); 4,02 (d, 2H); 4,59 нагрівають до кімнатної температури і потім зли(m, 1H) вають у дихлорметан. Органічну фазу промивають розчином хлориду натрію, суша ть над сульфатом натрію і концентрують. Залишок очищають шля 43 82307 44 чну фазу промивають розчином гідрокарбонату 6. [1R-[1a(R*),3ab,4a,7aa]]-5-[oктaгiдpo-7aнатрію, а також розчином хлориду натрію, сушать мeтил-4-[(тpиeтилcилiл)oкcи]-1H-інден-1-іл]-1гексанол 7 над сульфатом натрію і концентрують. Залишок очищають за допомогою хроматографії на силіка11,4г ТГП-ефіру 6 поміщають у 500мл дихлоргелі з використанням суміші оцтовий ефір/гексан, метану і краплями додають 50мл розчину диметиодержуючи при цьому 296г [1Rлалюмохлориду. Через 2год. при кімнатній температурі припиняють реакцію за допомогою суміші [1a(R*),3ab,4a,7aa]]-5-[октагідро-7а-метил-4ізопропанол/вода (15:85), краплями додають толу[(триетилсиліл)окси]-1Н-інден-1-іл]-1-(оксазол-4ол і перемішують протягом ночі. Потім фільтрують іл)гексилацетату 10 у вигляді безбарвної олії. 1 через броунмілерит за допомогою вакуум-фільтра Н-ЯМР (CDCI3): d = 0,57част./млн (q, 6Н); і концентрують. Залишок очищають за допомогою 0,86/87 (d, 3Н); 0,90 (s, 3Н); 0,98 (t, 9H); 2,09 (s, хроматографії на силікагелі з використанням су3Н); 4,02 (m, 1Н); 5,80 (t, 1H); 7,62 (s, 1H); 7,86 (s, міші оцтовий ефір/гексан, одержуючи при цьому 1H) 6,2г зазначеної у заголовку сполуки 7 у вигляді 10. 281мг ацетату 10 поміщають у 10мл тетрабезбарвної олії. гідрофурану, додають 1мл комплексу фторово1 Н-ЯМР (CDCI3): d = 0,56част./млн (q, 6Н); 0,90 день-піридин і протягом ночі перемішують при кім(s, 3Н); 0,95 (t, 9Н); 0,96 (d, 3Н); 3,64 (m, 2H); 4,02 натній температурі. Потім припиняють реакцію за (m, 2H) допомогою розчину гідрокарбонату натрію, екстрагують оцтовим ефіром, промивають органічну фа7. [1R-[1a(R*),3ab,4a,7aa]]-5-[oктaгiдpo-7aзу розчином хлориду натрію, сушать над сульфамeтил-4-[(тpиeтилcилiл)oкcи]-1H-інден-1том натрію і видаляють розчинник. Залишок іл]гексанол 8 8,0г спирту 7 розчиняють у 300мл дихлормеочищають за допомогою хроматографії на силікагелі з використанням суміші оцтовий ефір/гексан, тану, після чого додають 6,5г піридинійхлорхромаодержуючи при цьому 193мг [1Rту. Далі суміш перемішують протягом 2год. при кімнатній температурі. Потім додають діетиловий [1a(R*),3ab,4a,7аa]]-1-[5-(ацетилокси)-1-метил-5ефір, фільтрують через броунмілерит і концент(оксазол-4-іл)пентил]октагідро-7а-метил-1Н-інденрують. Залишок очищають за допомогою хромато4-олу 11 у вигляді безбарвної олії. 1 графії на силікагелі з використанням суміші оцтоН-ЯМР (CDCI3): d = 0,88/0,89част./млн (d, 3Н); вий ефір/гексан, одержуючи при цьому 6,2г 0,91 (s, 3Н); 2,09 (s, 3Н); 4,07 (m, 1Н); 5,80 (t, 1H); зазначеної у заголовку сполуки 8 у вигляді безба7,61 (s, 1H); 7,85 (s, 1H) рвної олії. 11. 193мг спирту 11 поміщають у 8мл дихлор1 Н-ЯМР (CDCI3): d = 0,57част./млн (q, 6Н); 0,91 метану, додають 160мг піридинійхлорхромату і (s, 3Н); 0,95 (t, 9Н); 0,96 (d, 3Н); 4,02 (m, 1H); 9,75 перемішують протягом 1год. при кімнатній темпе(t, 1H) ратурі. Потім суміш розбавляють простим діетилоПриклад 1 вим ефіром, фільтрують через броунмілерит і ви(7Е)-(1R,3R,24а)-24а-(оксазол-4-іл)-24-гомодаляють розчинник. Залишок очищають за 19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол 16а і допомогою хроматографії на силікагелі з викорис(7E)-(1R,3R,24a)-24a-(оксазол-4-іл)-24a-гомо-19танням суміші оцтовий ефір/гексан, одержуючи нop-9,10-секохола-5,7-дієн-1,3,24а-трiол 16b при цьому 160мг [1R-[1a(R*),3ab,4a,7aa]]-1-[58. 939мг оксазолу поміщають у 20мг тетрагід(aцeтилoкcи)-1-мeтил-5-(oкcaзoл-4рофурану й охолоджують до -78°С. Після цього iл)пeнтил]oктaгiдpo-7a-метил-4Н-інден-4-ону 12 у краплями додають 5,44мл н-бутиллітію (2,5Μ в вигляді безбарвної олії. 1 гексані), перемішують протягом 20хв., а потім доН-ЯМР (CDCI3): d = 0,61част./млн (s, 3Н); дають 500мг альдегіду 8 у 5мл тетрагідрофурану. 0,91/0,92 (d, 3Н); 2,10 (s, 3Н); 4,07 (m, 1Н); 5,80 (t, Реакційну суміш далі перемішують протягом ночі, 1H); 7,62 (s, 1H); 7,85 (s, 1H) при цьому суміш нагрівається до кімнатної темпе12. 461мг [2-[(3R-транс)-3,5-бic[[1,1ратури, потім припиняють реакцію за допомогою диметилерозчину хлориду натрію. Після цього екстрагують тил)диметилсиліл]окси]циклогексиліден]етил]дифе оцтовим ефіром, органічну фазу промивають рознілфосфіноксиду 13 [H.F. DeLuca й ін., Tetrahedron чином хлориду натрію, сушать над сульфатом Lett. 32, 7663 (1991), A. Mourino й ін., Tetrahedron натрію і видаляють розчинник. Залишок очищають Lett. 38, 4713 (1997)] поміщають у 8мл тетрагідроза допомогою хроматографії на силікагелі з викофурану й охолоджують до -78°С. Далі при цій темристанням суміші оцтовий ефір/гексан, одержуючи пературі додають 0,39мл розчину н-бутиллітію при цьому 234мг [1R-[1a(R*),3ab,4a,7аa]]-а-[4(2,5Μ в гексані) і протягом 10хв. перемішують при [октагідро-7а-метил-4-[(триетилсиліл)окси]-1Н30°С. Після цього краплями додають 146мг кетону інден-1-іл]пентил]оксазол-4-метанолу 9 у вигляді 12 у 4мл тетрагідрофурану і перемішують протябезбарвної олії. гом 1год. Потім припиняють реакцію за допомогою 1 Н-ЯМР (CDCI3): d = 0,57част./млн (q, 6Н); 0,86 розчину хлориду натрію, екстрагують оцтовим (d, 3Н); 0,92 (s, 3Н); 0,99 (t, 9H); 4,02 (m, 1Н); 4,70 ефіром, промивають органічну фазу розчином (m, 1H); 7,60 (s, 1H); 7,90 (s, 1H) хлориду натрію, сушать над сульфатом натрію і 9. 361мг спирту 9 поміщають у 8мл дихлормеконцентрують. Залишок очищають за допомогою тану, додають 0,17мл триетиламіну, 0,12мл ангідхроматографії на силікагелі з використанням суриду оцтової кислоти і диметиламінопіридин на міші оцтовий ефір/гексан, одержуючи при цьому кінчику шпателя і протягом ночі перемішують при 180мг (7E)-(1R,3R)-24a-(aцeтилoкcи)-1,3-бic[[1,1кімнатній температурі. Потім додають розчин хлодиметилетил)диметилсиліл)окси]-24а-(оксазол-4риду натрію, екстрагують оцтовим ефіром, органі 45 82307 46 іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієну 14 у на силікагелі з використанням суміші оцтовий вигляді безбарвної пінної речовини. ефір/гексан, одержуючи при цьому 140мг (5Z,7E)1 (1S,3R)-24а-(ацетилокси)-1,3-біс[[1,1Н-ЯМР (CDCI3): d = 0,06част./млн (s, 12Н); диметилетил)диметилсиліл]окси]-24а-(оксазол-40,52 (s, 3Н); 0,89 (s, 18Н); 0,90 (d, 3Н); 2,09 (s, 3Н); іл)-24а-гомо-9,10-секохола-5,7,10(19)-триєну 18 у 4,08 (m, 2Н); 5,80 (t, 1H); 5,81 (d, 1H); 6,18 (d, 1H); вигляді безбарвної пінистої речовини. 7,61 (s, 1H); 7,87 (s, 1H) 1 13. 180мг ацетату 14 поміщають у 8 мл метаН-ЯМР (CDCI3): d = 0,06част./млн (s, 12Н); нолу, додають 140мг карбонату калію і протягом 0,52 (s, ЗН); 0,90 (s, 18Н); 0,90 (d, ЗН); 2,09 (s, ЗН); 1год. перемішують при кімнатній температурі. Піс4,19 (m, 1Н); 4,38 (m, 1Н); 4,88 (s, 1H); 5,19 (s, 1H); ля цього змішують із розчином хлориду натрію, 5,81 (t, 1H); 6,02 (d, 1H); 6,23 (d, 1H); 7,62 (s, 1H); екстрагують оцтовим ефіром, промивають органі7,87 (s, 1H) чну фаз у розчином хлориду натрію, сушать над 16. 140мг ацетату 18 піддають переробці анасульфатом натрію і видаляють розчинник. Залилогічно до 13 і одержують 120мг (5Z,7E)-(1S,3R)шок очищають за допомогою хроматографії на 1,3-бic[[1,1-димeтилeтил)димeтилcилiл]oкcи]-24aсилікагелі з використанням суміші оцтовий (oкcaзoл-4-iл)-24a-гoмo-9,10-секохола-5,7,10(19)ефір/гексан, одержуючи при цьому 144мг (7E)триєн-24а-олу 19 у вигляді безбарвної пінистої (1R,3R)-1,3-біс[[1,1речовини. 1 диметилетил)диметилсиліл]окси]-24а-оксазол-4Н-ЯМР (CDCI3): d = 0,07част./млн (s, 12Н); іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-24а-олу 0,52 (s, 3Н); 0,89 (s, 18Н); 0,90 (d, 3Н); 4,19 (m, 1Н); 15 у вигляді безбарвної пінистої речовини. 4,38 (m, 1H); 4,87 (s, 1H); 5,20 (s, 1H); 5,81 (t, 1H); 1 Н-ЯМР (CD2Cl2): d = 0,06част./млн (s, 12Н); 6,02 (d, 1H); 6,25 (d, 1H); 7,60 (s, 1H); 7,88 (s, 1H) 0,52 (s, 3Н); 0,84 (s, 18H); 0,91/0,92 (d, 3Н); 4,07 (m, 17. 120мг спирту 19 піддають переробці ана2Н); 4,62 (m, 1Н); 5,80 (d, 1Н); 6,14 (d, 1H); 7,55 (s, логічно до 14 і після розділення діастереомерів 1H); 7,82 (s, 1H) (відносно С-24) за допомогою РХВР одержують 14. 144мг спирту 15 поміщають у 10мл тетрагі14мг зазначеної у заголовку сполуки 20а й 18мг дрофурану, додають 467мг фториду тетрабутилазазначеної у заголовку сполуки 20b у вигляді безмонію (гідрат) і протягом 2год. перемішують при барвних пінистих речовин. 1 кімнатній температурі. Потім додають розчин гідН-ЯМР (CD2Ci2): рокарбонату натрію, екстрагують оцтовим ефіром, 20а: d = 0,53част./млн (s, 3Н); 0,91 (d, 3Н); 4,15 промивають органічну фазу розчином хлориду (m, 1H); 4,36 (m, 1Н); 4,63 (m, 1H); 4,94 (s, 1Н); 5,26 натрію, сушать над сульфатом натрію і концент(s, 1Н); 6,01 (d, 1H); 6,35 (d, 1H); 7,56 (s, 1H); 7,84 рують. Залишок очищають за допомогою хромато(s, 1H) графії на силікагелі з використанням суміші оцтова 20b: d = 0,53част./млн (s, 3Н); 0,90 (d, 3Н); 4,15 кислота/гексан, а потім розділяють діастереомери (m, 1H); 4,36 (m, 1H); 4,63 (m, 1H); 4,93 (s, 1Н); 5,26 за допомогою РХВР (відносно С-24а), одержуючи (s, 1Н); 6,01 (d, 1Н); 6,35 (d, 1H); 7,56 (s, 1H); 7,85 при цьому 25мг зазначеної у заголовку сполуки (s, 1H) 16а й 34мг зазначеної в заголовку сполуки 16b у Приклад 3 вигляді безбарвних пінистих речовин. (7Е)-(1R,3R,24aR)-24a-(тiaзoл-2-iл)-24a-гoмo1 Н-ЯМР (CD2Cl2): 19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол 27а і 16а: d = 0,52част./млн (s, 3Н); 0,89 (d, 3Н); 3,98 (7Е)-(1R,3R,24aS)-24а-(тіазол-2-іл)-24а-гомо-19(m, 1Н); 4,03 (m, 1Н); 4,62 (m, 1Н); 5,82 (d, 1Н); 6,28 нор-9,10-секохола-5,7-дієн-1,3,24а-тріол 27b (d, 1Н); 7,57 (s, 1Н); 7,84 (s, 1H) 18. 3,1мл 2-бромтіазолу поміщають у 40мл те16b: d = 0,52част./млн (s, 3Н); 0,90 (d, 3Н); 3,98 трагідрофурану і при -78°С додають 13,8мл розчи(m, 1H); 4,03 (m, 1H); 4,62 (m, 1H); 5,82 (d, 1Н); 6,28 ну н-бутиллітію (2,5Μ в гексані). Через 30хв. при (d, 1H); 7,57 (s, 1H); 7,83 (s, 1H) цій температурі краплями додають 2,52г альдегіду Приклад 2 8 у 10мл тетрагідрофурану і перемішують протя(5Z,7E)-(1S,3R,24aR)-24a-(оксазол-4-іл)-24aгом 1год. Потім припиняють реакцію за допомогою гомо-9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол розчину хлориду натрію, екстрагують оцтовим 20а і (5Z,7Е)-(1S,3R,24aR)-24а-(оксазол-4-іл)-24аефіром, органічну фазу промивають розчином гомо-9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол хлориду натрію і сушать над сульфа том натрію. 20b Розчинник видаляють, а залишок очищають за допомогою хроматографії на силікагелі з викорис15. 257мг [2-[[3S-(1Z,3a,5b)]-3,5-біс[[(1,1танням суміші оцтовий ефір/гексан, одержуючи диметилетил)диметилсиліл]окси]-2метиленциклогексиліден]дифенілфосфіноксиду 17 при цьому 2,6г [1R-[1a(1R*),3ab,4a,7аa]]-a-[4[M.R. Uskokovic та ін., Tetrahedron Let 33, 7701 [октагідро-7а-метил-4-[(триетилсиліл)окси]-1Н(1992)] поміщають у 6мл тетрагідрофурану й охоінден-1-іл]пентил]тіазол-2-метанолу 21 у вигляді лоджують до -78°С. При цій температурі додають безбарвної олії. 1 0,21мл розчину н-бутиллітію (2,5Μ в гексані) і при Н-ЯМР (CDCI3): d = 0,57част./млн (q, 6Н); 0,88 30°С перемішують протягом 10хв. Після цього (d, 3Н); 0,91 (s, 3Н); 0,97 (t, 9H); 4,02 (m, 1Н); 5,01 краплями додають 80мг кетону 12 у 4мл тетрагід(m, 1H); 7,30 (d, 1H); 7,71 (d, 1H) рофурану і перемішують протягом 2год. Потім 19. 948мг спирту 21 піддають переробці анаприпиняють реакцію за допомогою розчину хлорилогічно 9 і одержують при цьому 824мг [1Rду натрію, екстрагують оцтовим ефіром, промива[1a(1R*),3ab,4a,7aa]]-5-[oктaгiдpo-7a-мeтил-4ють органічну фазу розчином хлориду натрію, су[(тpиeтилcилiл)oкcи-1Н-інден-1-іл]-1-(тіазол-2шать над сульфатом натрію і концентрують. іл)гексилацетату 22 у вигляді безбарвної олії. Залишок очищають за допомогою хроматографії 47 82307 48 диметилетил)диметилсиліл]окси]-24а-(тіазол-2-іл)Н-ЯМР (CDCI3): d = 0,56 част./млн (q, 6Н); 24а-гомо-19-нор-9,10-секохола-5,7-дієн-24а-ону 28 0,87/0,88 (d, 3Н); 0,90 (s, 3Н); 0,96 (t, 9Н); 2,14 (s, 3Н); 4,02 (m, 1Н); 6,10 (t, 1Н); 7,31 (d, 1Н); 7,78 (d, у вигляді безбарвної пінистої речовини. 1 1H) Н-ЯМР (CD2CI2): d = 0,04част./млн (s, 12H); 20. 824мг ацетату 22 піддають переробці ана0,51 (s, 3Н); 0,84 (s, 18Н); 0,93 (d, 3Н); 4,05 (m, 2H); 5,80 (d, 1Н); 6,15 (d, 1Н); 7,66 (d, 1H); 7,97 (d, 1H) логічно 10 і одержують при цьому 583мг [1R-[1a 26. 78мг кетону 28 поміщають у 7мл суміші ме(1R*),3ab,4a,7аa]]-1-[5-(ацетилокси)-1-метил-5танол/дихлорметан (9:1), додають 780мг активо(тіазол-2-іл)пентил]октагідро-7а-метил-1Н-інден-4ваного іоніту Dowex і перемішують протягом 1год. олу 23 у ви гляді безбарвної олії. 1 при кімнатній температурі. Потім фільтрують через Н-ЯМР (CDCI3): d = 0,88/0,89част./млн (d, 3Н); броунмілерит, ретельно промивають дихломета0,93 (s, 3Н); 2,18 (s, 3Н); 4,07 (m, 1Н); 6,10 (t, 1Н); ном, видаляють розчинник і очищають залишок за 7,31 (d, 1H); 7,78 (d, 1H) допомогою хроматографії на силікагелі, одержую21. 583мг спирту 23 піддають переробці аначи при цьому 43мг зазначеної у заголовку сполуки логічно до 11 і одержують при цьому 514мг [1R29 у вигляді безбарвної пінистої речовини. [1a(1R*),3ab,4a,7аa]]-1-[5-(ацетилокси)-1-метил-51 Н-ЯМР (CD2C2): d = 0,51 част./млн (s, 3Н); (тіазол-2-іл)пентил]октагідро-7а-метил-1Н-інден-40,97 (d, 3Н); 3,97 (m, 1Н); 4,06 (m, 1Н); 5,81 (d, 1H); ону 24 у вигляді безбарвної олії. 1 6,27 (d, 1H); 7,68 (d, 1H); 7,97 (d, 1H) Н-ЯМР (CDCI3): d = 0,56част./млн (s, 3Н); Приклад 5 0,91/0,92 (d, 3Н); 2,12 (s, 3Н); 6,10 (t, 1Н); 7,31 (d, (5Z,7E)-(1S,3R,24aR)-24a-(тіазол-2-іл)-24a1H); 7,78 (d, 1Н) гомо-9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол 22. 1,39г фосфіноксиду, депротонованого за 32а і (5Z,7E)-(1S,3R,24aS)-24a-(тіазол-2-іл)-24aдопомогою 1,16мл розчину н-бутиллітію (2,5 Μ в гомо-9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол гексані), піддають взаємодії з 460мг кетону 24 32b аналогічно 12 і одержують при цьому 672мг (7E)27. 309мг фосфіноксиду 17, депротонованого (1R,3R)-24a-(aцeтилoкcи)-1,3-бic[[(1,1за допомогою 0,25мл розчину н-бутиллітію (2,5Μ в диметилетил)диметилсиліл]окси]-24а-(тіазол-2-іл)гексані), піддають взаємодії з 100мг кетону 24 24а-гомо-19-нор-9,10-секохола-5,7-дієну 25 у вианалогічно 15 і одержують при цьому 170мг гляді безбарвної пінистої речовини. 1 (5Z,7E)-(1S,3R)-24a-(ацетилокси)-1,3-біс[[(1,1Н-ЯМР (CDCI3): d = 0,07част./млн (s, 12Н); диметилетил)диметилсиліл]окси]-24а-(тіазол-2-іл)0,53 (s, 3Н); 0,89 (s, 18Н); 0,93 (d, 3Н); 2,18 (s, 3Н); 24а-гомо-9,10-секохола-5,7,10(19)-триєну 30 у ви4,09 (m, 2Н); 5,82 (d, 1Н); 6,10 (t, 1H); 6,18 (d, 1H); гляді безбарвної пінистої речовини. 7,31(d, 1H); 7,78 (d, 1H) 1 Н-ЯМР (CDCI3): d = 0,07част./млн (s, 12Н); 23. 672мг ацетату 25 піддають взаємодії ана0,52 (s, 3Н); 0,89 (s, 18Н); 0,90 (d, 3Н); 2,18 (s, 3Н); логічно до 13 і одержують при цьому 526мг (7Е)4,19 (m, 1Н); 4,38 (m, 1Н); 4,87 (s, 1Н); 5,19 (s, 1H); (1R,3R)-1,3-біс[[(1,16,01 (d, 1H); 6,10 (t, 1H); 6,23 (d, 1H); 7,31 (d, 1H); диметилетил)диметилсиліл]окси]-24а-(тіазол-2-іл)7,83 (d, 1H) 24а-гомо-19-нор-9,10-секохола-5,7-дієн-24а-олу 26 28. 170мг ацетату 30 піддають взаємодії анау вигляді безбарвної пінистої речовини. 1 логічно до 13 і одержують при цьому 149мг Н-ЯМР (CD2CI2): d = 0,04част./млн (s, 12Н); (5Z,7Е)-(1S,3R)-1,3-біс[[(1,10,51 (s, 3Н); 0,87 (s, 18H); 0,92 (d, 3Н); 4,07 (m, 2Н); диметилетил)диметилсиліл]окси]-24а-гомо-9,104,95 (m, 1Н); 5,81 (d, 1H); 6,15 (d, 1H); 7,31 (d, 1H); секохола-5,7,10(19)-триєн-24а-олу 31 у вигляді 7,70 (d, 1H) безбарвної пінистої речовини. 24. 426мг спирту 26 піддають переробці ана1 Н-ЯМР (CDCI3): d = 0,07част./млн (s, 12Н); логічно 14 і після розділення діастереомерів (від0,51 (s, 3Н); 0,89 (s, 18Н); 0,90 (d, 3Н); 2,18 (s, 3Н); носно С-24а) за допомогою РХВР одержують 4,18 (m, 1H); 4,38 (m, 1H); 4,87 (s, 1H); 5,02 (s, 1H); 134мг зазначеної у заголовку сполуки 27а й 149мг 5,19 (s, 1H); 6,01 (d, 1H); 6,23 (d, 1H); 7,31 (d, 1H); зазначеної у заголовку сполуки 27b у вигляді без7,74 (d, 1H) барвних пінистих речовин. 1 29. 101мг спирту ЗІ піддають переробці аналоН-ЯМР (CD2CI2 /CD3OD): гічно до 14 і після розділення діастереомерів (від27а: d = 0,50част./млн (s, 3Н); 0,88 (d, 3Н); 3,93 носно С-24) за допомогою РХВР одержують 24мг (m, 1Н); 4,01 (m, 1Н); 4,90 (t, 1H); 5,83 (d, 1H); 6,23 зазначеної у заголовку сполуки 32а й 29мг зазна(d, 1H); 7,29 (d, 1H); 7,67 (d, 1H) ченої у заголовку сполуки 32b у вигляді безбарв27b: d = 0,50част./млн (s, 3Н); 0,90 (d, 3Н); 3,93 них пінистих речовин. (m, 1H); 4,01 (m, 1H); 4,90 (t, 1H); 5,83 (d, 1Н); 6,23 1 Н-ЯМР (CD2C2/CD3 OD): (d, 1Н); 7,29 (d, 1Н); 7,67 (d, 1H) 32а: d = 0,50част./млн (s, 3Н); 0,90 (d, 3Н); 4,11 Приклад 4 (m, 1Н); 4,33 (m, 1H); 4,90 (t, 1H); 4,92 (s, 1H); 5,27 (7Е)-(1R,3R)-1,3-дигідрокси-24а-(тіазол-2-іл)(s, 1H); 6,00 (d, 1H); 6,32 (d, 1H); 7,29 (d, 1H); 7,68 24-а-гомо-19-нор-9,10-секохола-5,7-дієн-24а-он 29 (d, 1H) 25. 100мг спирту 26 поміщають у 6мл дихлор32b: d = 0,51част./млн (s, 3Н); 0,89 (d, 3Н); 4,11 метану і додають 378мг діоксиду марганцю. Реак(m, 1H); 4,33 (m, 1H); 4,90 (t, 1H); 4,92 (s, 1H); 5,27 ційну суміш перемішують при кімнатній темпера(s, 1H); 6,00 (d, 1H); 6,32 (d, 1H); 7,29 (d, 1H); 7,68 турі, потім фільтрують через броунмілерит, (d, 1H) видаляють розчинник і залишок очищають за доПриклад 6 помогою хроматографії на силікагелі, одержуючи при цьому 78мг (7E)-(1R,3R)-1,3-біс[[(1,11 49 82307 50 (5Z,7E)-(1S,3R)-1,3-дигiдpoкcи-24a-(тiaзoл-235. 360мг спирту 37 піддають переробці анаiл)-24a-гoмo-9,10-ceкoxoлa-5,7,10(19)-триєн-24а-он логічно до 11 і одержують при цьому 340мг [1R34 [1a(1R*),3ab,7аa]]-1-[5-(ацетилокси)-1-метил-5-(230. 149мг спирту 31 піддають переробці анаметилтіазол-2-іл)пентил]октагідро-7а-метил-4Нлогічно до 25 і одержують при цьому 127мг інден-4-ону 38 у вигляді безбарвної олії. 1 (5Z,7E)-(1S,3R)-1,3-біс[[(1,1Н-ЯМР (CDCI3): d = 0,61част./млн (s, 3Н); диметилетил)диметилсиліл]окси]-24а-(тіазол-2-іл)0,92/0,93 (d, 3Н); 2,13 (s, 3Н); 2,45 (s, 3Н); 6,05 (t, 24а-гомо-9,10-секохола-5,7,10(19)-триєн-24а-ону 1Н); 6,82 (s, 1Н) 33 у вигляді безбарвної пінистої речовини. 36. 329мг фосфіноксиду 13, депротонованого 1 Н-ЯМР (CDCI3): d = 0,07част./млн (s, 12Н); за допомогою 0,28мл розчину н-бутиллітію (2,5Μ в 0,53 (s, 3Н); 0,90 (s, 18Н); 0,97 (d, 3Н); 4,19 (m, 1Н); гексані), піддають взаємодії з 113мг кетону 38 4,38 (m, 1Н); 4,88 (s, 1Н); 5,19 (s, 1H); 6,02 (d, 1H); аналогічно до 12 і одержують при цьому 98мг (7E)6,24 (d, 1H); 7,68 (d, 1H); 8,00 (d, 1H) (1R,3R)-24a-(ацетилокси)-1,3-біс[[(1,131. 21мг кетону 33 піддають переробці аналодиметилетил)диметилсиліл]окси-24а-(4гічно до 8 і одержують при цьому 8мг зазначеної у метилтіазол-2-іл)-24а-гомо-19-нор-9,10-секохолазаголовку сполуки 34 у вигляді безбарвної пінистої 5,7-дієну 39 у вигляді безбарвної пінистої речовиречовини. ни. 1 1 Н-ЯМР (CD2CI2): d = 0,51част./млн (s, 3Н); Н-ЯМР (CDCI3): d = 0,07част./млн (s, 12Н); 0,94 (d, 3Н); 4,17 (m, 1Н); 4,34 (m, 1Н); 4,90 (s, 1Н); 0,53 (s, 3Н); 0,89 (s, 18Н); 0,90 (d, 3Н); 2,15 (s, 3Н); 5,26 (s, 1Н); 6,00 (d, 1H); 6,33 (d, 1H); 7,66 (d, 1H); 2,46 (s, 3Н); 4,09 (m, 2Н); 5,81 (d, 1Н); 6,04 (t, 1H); 7,97 (d, 1H) 6,18 (d, 1H); 6,83 (s, 1H) Приклад 7 37. 93мг ацетату 39 піддають перетворенню (7E)-(1R,3R,24aR)-24a-(4-мeтилтiaзoл-2-iл)аналогічно до 13 і одержують при цьому 72мг (7Е)24a-гoмo-19-нор-9,10-секохола-5,7-дієн-1,3,24а(R,3R)-1,3-біс[[(1,1тріол 41а і (7Е)-(1R,3R,24aS)-24а-(4-метилтіазол-2диметилетил)диметилсиліл]окси]-24а-(4іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24аметилтіазол-2-іл)-24а-гомо-19-нор-9,10-секохолатріол 41b 5,7-дієн-24а-олу 40 у вигляді безбарвної пінистої 32. 1,3мл 4-метилтіазолу поміщають у 25мл речовини. 1 тетрагідрофурану і при -78°С додають 5,78мл розН-ЯМР (CDCI3): d = 0,07част./млн (s, 3H); чину н-бутиллітію (2,5 Μ в гексані). Через 30хв. при 0,53(s, 3Н); 0,89 (s, 18Н); 0,93 (d, 3Н); 2,45 (s, 3Н); цій температурі краплями додають 1,06г альдегіду 4,08 (m, 2H); 4,95 (m, 1H); 5,82 (d, 1H); 6,18 (d, 1H); 8 у 5мл тетрагідрофурану і перемішують протягом 6,82 (s, 1H) 1год. Потім припиняють реакцію за допомогою 38. 72мг спирту 40 піддають переробці аналорозчину хлориду натрію, екстрагують оцтовим гічно до 14 і після розділення діастереоізомерів ефіром, промивають органічну фазу розчином (відносно 24а) за допомогою РХВР одержують хлориду натрію і сушать над сульфа том натрію. 15мг зазначеної у заголовку сполуки 41а й 21мг Після цього видаляють розчинник, а залишок очизазначеної у заголовку сполуки 41b у вигляді безщають за допомогою хроматографії на силікагелі з барвних пінистих речовин. 1 використанням суміші оцтовий ефір/гексан, одерН-ЯМР (CD2Cl2): жуючи при цьому 601мг [1R-[1a(R*),3ab,4a,7aa]]-a41а: d = 0,51част./млн (s, 3Н); 0,90 (d, 3Н); 2,36 [4-[oктaгiдpo-7a-мeтил-4-[(тpиeтилcилiл)oкcи]-1Н(s, 3Н); 3,94 (m, 1Н); 4,02 (m, 1Н); 4,88 (m, 1Н); 5,83 інден-1-іл]пентил]-4-метилтіазол-2-метанолу 35 у (d, 1H); 6,24 (d, 1H); 6,82 (s, 1H) вигляді безбарвної олії. 41b: d = 0,51част./млн (s, 3Н); 0,90 (d, 3Н); 2,36 1 Н-ЯМР (CDCI3): d = 0,56част./млн (q, 6Н); 0,88 (s, 3Н); 3,94 (m, 1Н); 4,02 (m, 1Н); 4,86 (m, 1Н); 5,83 (d, 3Н); 0,90 (s, 3Н); 0,97 (t, 9H); 2,41 (s, 3Н); 4,02 (d, 1Н); 6,24 (d, 1Н); 6,83 (s, 1Н) (m, 1Н); 4,94 (m, 1Н); 6,82 (s, 1H) Приклад 8 33. 601мг спирту 35 піддають переробці ана(7Е)-(1R,3R)-1,3-дигідрокси-24а-(4логічно до 9 і одержують при цьому 589мг [1R-[1a метилтіазол-2-іл)-24а-гомо-19-нор-9,10-секохола(R*),3ab,4a,7aa]]-5-[oктaгiдpo-7a-мeтил5,7-дієн-24а-он 43 4r[(тpиeтилcилiл)oкcи]-1H-iндeн-1-іл]-1-(439. 53мг спирту 40 піддають переробленню метилтіазол-2-іл)гексилацетату 36 у вигляді безаналогічно до 25 і одержують при цьому 42мг (7Е)барвної олії. (1R,3R)-1,3-біс[[1,11 диметилетил)диметилсиліл]окси]-24а-(4Н-ЯМР (CDCI3): d = 0,56част./млн (q, 6Н); метилтіазол-2-іл)-24а-гомо-19-нор-9,10-секохола0,85/0,86 (d, 3Н); 0,91 (s, 3Н); 0,96 (t, 9Н); 2,14 (s, 3Н); 2,45 (s, 3Н); 4,02 (m, 1Н); 6,02 (t, 1Н); 6,81 (s, 5,7-дієн-24а-ону 42 у вигляді безбарвної пінистої речовини. 1H) 1 34. 589мг ацетату 36 піддають переробці анаН-ЯМР (CDCI3): d = 0,07част./млн (s, 12Н); логічно до 10 і одержують при цьому 366мг [1R0,53 (s, 3Н); 0,89 (s, 18Н); 0,97 (d, 3Н); 2,54 (s, 3Н); 4,09 (m, 2Н); 5,81 (d, 1Н); 6,18 (d, 1Н); 7,23 (s, 1H) [1a(1R*),3ab,4a,7аa]]-1-[5-(ацетилокси)-1-метил-540. 42мг кетону 42 піддають переробленню (4-метилтіазол-2-іл)пентил]октагідро-7а-метил-1Наналогічно до 26 і одержують при цьому 13мг заінден-4-олу 37 у вигляді безбарвної олії. 1 значеної в заголовку сполуки 43 у ви гляді безбарН-ЯМР (CDCI3): d = 0,87/0,88част./млн (d, 3Н); вної пінистої речовини. 0,91 (s, 3Н); 2,17 (s, 3Н); 2,45 (s, 3Н); 4,07 (m, 1Н); 6,03 (t, 1Н); 6,81 (s, 1Н) 51 82307 52 значеної в заголовку сполуки 48 у ви гляді безбарН-ЯМР (CD2CI2/CD3 OD): d = 0,52част./млн (s, вної пінистої речовини. 3Н); 0,93 (d, 3Н); 2,48 (s, 3Н); 3,94 (m, 1Н); 4,03 (m, 1 1H); 5,82 (d, 1H); 6,23 (d, 1H); 7,23 (s, 1H) Н-ЯМР (CD2CI2): d = 0,53част./млн (s, 3Н); Приклад 9 0,95 (d, 3Н); 2,45 (s, 3Н); 4,15 (m, 1H); 4,36 (m, 1H); (5Z,7E)-(1S,3R,24aR)-24a-(4-мeтилтiaзoл-2-iл)4,95 (s, 1H); 5,27 (s, 1H); 6,00 (d, 1H); 6,35 (d, 1H); 24a-гoмo-9,10-секохола-5,7,10(19)-триєн-1,3,24а7,24 (s, 1H) тріол 46а і (5Z,7E)-(1S,3R,24aS)-24a-(4Приклад 11 мeтилтiaзoл-2-іл)-24a-гомо-9,10-секохола(7E)-(1R,3R,24aR)-24a-(тієн-2-іл)-24a-гомо-195,7,10(19)-триєн-1,3.24а-тріол 46b Hop-9,10-секохола-5,7-дієн-1,3,24a-тріол 55а і 41. 337мг фосфіноксиду 17, депротонованого (7Е)-(1R,3R,24aR)-24а-(тієн-2-іл)-24а-гомо-19-норза допомогою 0,28мл розчину н-бутиллітію (2,5Μ в 9,10-секохоло-5,7-дієн-1,3,24а-тріол 55b гексані), вводять у взаємодію з 113мг кетону 38 46. 0,65мг тіофену поміщають у 20мл тетрагіданалогічно до 15 і одержують при цьому 170мг рофурану і при -78°С додають 3,27мл розчину н(5Z,7E)-(1S,3R)-24a-(ацетилокси)-1,3-біс[[(1,1бутиллітію (2,5Μ в гексані). Через 30хв. при цій диметилетил)диметилсиліл]окси]-24а-(4температурі краплями додають 600мг альдегіду 8 метилтіазол-2-іл)-24а-гомо-9,10-секохолау 3мл тетрагідрофурану і перемішують протягом 5,7,10(19)-триєну 44 у вигляді безбарвної пінистої 1год. Після цього припиняють реакцію за допоморечовини. гою розчину хлориду натрію, екстрагують оцтовим 1 ефіром, промивають органічну фазу розчином Н-ЯМР (CDCI3): d = 0,07част./млн (s, 12Н); хлориду натрію і сушать над сульфа том натрію. 0,52 (s, 3Н); 0,89 (s, 18Н); 0,90 (d, 3Н); 2,14 (s, 3Н); Потім відганяють розчинник і залишок очищають 2,45 (s, 3Н); 4,19 (m, 1H); 4,38 (m, 1H); 4,88 (s, 1H); за допомогою хроматографії на силікагелі з вико5,19 (s, 1H); 6,02 (d, 1H); 6,03 (m, 1H); 6,23 (d, 1H); ристанням суміші оцтовий ефір/гексан, одержуючи 6,83 (s, 1H) 42. 170мг ацетату 44 піддають перетворенню при цьому 673мг [1R-[1a(1R*),3ab,4a,7aa]]-a-[4аналогічно до 13 і одержують при цьому 109мг [октагідро-7a-метил-4-[триетилсиліл)окси]-1Н(5Z,7Е)-1,3-біс[[(1,1інден-1-іл]пентил]тіофен-2-метанол 49 у вигляді диметилетил)диметилсиліл]окси]-24а-(4безбарвної олії. 1 метилтіазол-2-іл)-24а-гомо-9,10-секохолаН-ЯМР (CDCI3): d = 0,56част./млн (q, 6Н); 0,89 5,7,10(19)-триєн-24а-олу 45 у вигляді безбарвної (d, 3Н); 0,91 (s, 3Н); 0,97 (t, 9H); 4,03 (m, 1Н); 4,93 пінистої речовини. (m, 1H); 6,98 (m, 2H); 7,27 (m, 1H) 1 Н-ЯМР (CDCI3): d = 0,07част./млн (s, 12Н); 47. 673мг спирту 49 піддають переробленню 0,52 (s, 3Н); 0,90 (s, 18Н); 0,93 (d, 3Н); 2,45 (s, 3Н); аналогічно до 9 і одержують при цьому 712мг [1R4,19 (m, 1Н); 4,38 (m, 1Н); 4,88 (s, 1H); 4,95 (m, 1H); [1a(1R*),3ab,4a,7аa]]-5-[октагідро-7а-метил-45,19 (s, 1H); 6,02 (d, 1H); 6,23 (d, 1H); 6,83 (s, 1H) [триетилсиліл)окси]-1Н-інден-1-іл]-1-(тієн-243. 105мг спирту 45 піддають переробленню іл)гексилацетату 50 у вигляді безбарвної олії. 1 аналогічно до 14 і після розділення діастереомерів Н-ЯМР (CDCI3): d = 0,56част./млн (q, 6Н); (відносно С-24а) за допомогою РХВД одержують 0,87/0,88 (d, 3Н); 0,91 (s, 3Н); 0,97 (t, 9Н); 2,08 (s, 30мг зазначеної в заголовку сполуки 46а і 29мг 3Н); 4,02 (m, 1Н); 6,05 (t, 1Н); 6,98 (m, 1Н); 7,05 (m, зазначеної в заголовку сполуки 46b у вигляді без1H); 7,27 (m, 1H) барвних пінистих речовин. 48. 704мг ацетату 50 піддають переробленню 1 Н-ЯМР (CD2CI2): аналогічно до 10 і одержують при цьому 412мг 46а: d = 0,50част./млн (s, 3Н); 0,90 (d, 3Н); 2,38 [1R-[1a (1R*),3ab,4a,7аa]]-1-[5-(ацетилокси)-1(s, 3Н); 4,17 (m, 1Н); 4,36 (m, 1Н); 4,88 (dd, 1Н); метил-5-(тієн-2-іл)пентил]октагідро-7а-метил-1Н4,94 (s, 1Н); 5,27 (s, 1Н); 6,00 (d, 1Н); 6,36 (ά,ΙΉ); інден-4-олу 51 у вигляді безбарвної олії. 1 6,81 (s, 1Н) Н-ЯМР (CDCI3): d = 0,87/0,88част./млн (d, 3Н); 46b: d = 0,50част./млн (s, 3Н); 0,89 (d, 3Н); 2,38 0,92 (s, 3Н); 2,08 (s, 3Н); 4,07 (m, 1Н); 6,03 (t, 1H); (s, 3Н); 4,17 (m, 1Н); 4,36 (m, 1Н); 4,84 (dd, 1H); 6,97 (m, 1H); 7,07 (m, 1H); 7,28 (m, 1H) 4,94 (s, 1H); 5,27 (s, 1H); 6,00 (d, 1H); 6,35 (d, 1H); 49. 407мг спирту 51 піддають переробленню 6,81 (s, 1H) аналогічно до 11 і одержують при цьому 373мг Приклад 10 [1R-[1a(1R*),3ab,4a,7аa]]-1-[5-(ацетилокси)-1(5Z,7E)-(1S,3R)-1,3-дигідрокси-24а-(4метил-5-(тієн-2-іл)пентил]октагідро-7а-метил-4Нметилтіазол-2-іл)-24а-гомо-9,10-секохолаінден-4-ону 52 у вигляді безбарвної олії. 1 5,7,10(19)-триєн-24а-он 48 Н-ЯМР (CDCI3): d = 0,62част./млн (s, 3Н); 44. 48мг спирту 45 піддають переробленню 0,92/0,93 (d, 3Н); 2,08 (s, 3Н); 6,04 (t, 1Н); 6,98 (m, аналогічно до 25 і одержують при цьому 40мг 1H); 7,05 (m, 1H); 7,28 (m, 1H) (5Z,7E)-(1S,3R)-1,3-бic[[(1,150. 329мг фосфіноксиду 13, депротонованого димeтилeтил)димeтилcилiл]oкcи]-24a-(4за допомогою 0,28мл розчину н-бутиллітію (2,5Μ в метилтіазол-2-іл)-24а-гомо-9,10-секохолагексані), вводять у взаємодію з 109мг кетону 52 5,7,10(19)-триєн-24а-ону 47 у вигляді безбарвної аналогічно до 12 і одержують при цьому 183мг пінистої речовини. (7E)-(1R,3R)-24a-(aцeтилoкcи)-1,3-бic[[(1,11 Н-ЯМР (CDCI3): d = 0,07част./млн (s, 12Н); диметилетил)диметилсиліл]окси]-24а-(тієн-2-іл)0,52 (s, 3Н); 0,88 (s, 18Н); 0,95 (d, 3Н); 2,52 (s, 3Н); 24а-гомо-19-нор-9,10-секохола-5,7-дієну 53 у ви4,19 (m, 1Н); 4,37 (m, 1H); 4,84 (s, 1H); 5,18 (s, 1H); гляді безбарвної пінистої речовини. 1 6,00 (d, 1H); 6,23 (d, 1H); 7,21 (s, 1H) Н-ЯМР (CDCI3): d = 0,07част./млн (s, 12Н); 45. 39мг кетону 47 піддають переробленню 0,53 (s, 3Н); 0,90 (s, 18Н); 0,90 (d, 3Н); 2,07 (s, 3Н); аналогічно до 26 і одержують при цьому 11мг за1 53 82307 54 4,08 (m, 2Н); 5,81 (d, 1Н); 6,04 (t, 1Н); 6,18 (d, 1Н); диметилетил)диметилсиліл]окси]-24a-(тієн-2-іл)6,98 (m, 1H); 7,05 (m, 1H); 7,29 (m, 1H) 24а-гомо-9,10-секохола-5,7,10(19)-триєн-24а-олу 51. 178мг ацетату 53 піддають перетворенню 59 у вигляді безбарвної пінистої сполуки. 1 аналогічно до 13 і одержують при цьому 138мг Н-ЯМР (CDCI3): d = 0,07част./млн (s, 12Н); (7E)-(1R,3R)-1,3-бic[[(1,10,52 (s, 3Н); 0,88 (s, 18Н); 0,90 (d, 3Н); 4,18 (m, 1Н); димeтилeтил)димeтилcилiл]oкcи]-24a-(тiєн-2-iл)4,38 (m, 1H); 4,88 (s, 1H); 4,93 (m, 1H); 5,18 (s, 1H); 24а-гомо-19-нор-9,10-секохола-5,7-дієн-24а-олу 54 6,00 (d, 1H); 6,22 (d, 1H); 6,98 (m, 1H); 7,28 (m, 1H) у вигляді безбарвної пінистої речовини. 57. 78мг спирту 59 піддають переробленню 1 Н-ЯМР (CDCI3): d = 0,07част./млн (s, 12Н); аналогічно до 14 і після розділення діастереомерів 0,53 (s, 3Н); 0,89 (s, 18Н); 0,91 (d, 3Н); 4,09 (m, 2Н); (відносно С-24а) за допомогою РХВД одержують 4,94 (m, 1Н); 5,82 (d, 1Н); 6,18 (d, 1Н); 6,98 (m, 2Н); 21мг зазначеної в заголовку сполуки 60а і 24мг 7,28 (m, 1Н) зазначеної в заголовку сполуки 60b у вигляді без52. 97мг спирту 54 піддають переробленню барвних пінистих речовин. 1 аналогічно до 14 і після розділення діастереомерів Н-ЯМР (CD2CI2 /CD3OD): (відносно С-24а) за допомогою РХВД одержують 60a: d = 0,50част./млн (s, ЗН); 0,88 (d, 3Н); 4,10 19мг зазначеної в заголовку сполуки 55а і 24мг (m, 1Н); 4,32 (m, 1H); 4,86 (dd, 1H); 4,94 (s, 1H); зазначеної в заголовку сполуки 55b у вигляді без5,26 (s, 1H); 6,00 (d, 1H); 6,27 (d, 1H); 6,92 (m, 2H); барвних пінистих речовин. 7,20 (m, 1H) 1 Н-ЯМР (CD2Cl2): 60b: d = 0,50част./млн (s, 3Н); 0,86 (d, 3Н); 4,10 55а: d = 0,52част./млн (s, 3Н); 0,90 (d, 3Н); 3,95 (m, 1H); 4,31 (m, 1H); 4,83 (t, 1H); 4,94 (s, 1H); 5,26 (m, 1Н); 4,02 (m, 1Н); 4,87 (dd, 1Н); 5,84 (d, 1Н); (s, 1H); 6,00 (d, 1Н); 6,27 (d, 1H); 6,92 (m, 2H); 7,20 6,25 (d, 1Н); 6,98 (m, 2Н); 7,23 (m, 1Н) (m, 1H) 55b: d = 0,52част./млн (s, 3Н); 0,89 (d, 3Н); 3,95 Приклад 14 (m, 1Н); 4,02 (m, 1Н); 4,86 (t, 1H); 5,84 (d, 1Н); 6,25 (7E)-(1R,2S,24aR)-24a-тієн-2-іл-24a-гомо-9,10(d, 1Н); 6,97 (m, 2Н); 7,22 (m, 1Н) секохола-5,7-дієн-1,2,3,24-тетрол 64а і (7Е)Приклад 12 (1R,2S,24aS)-24a-тієн-2-іл-24a-гомо-9,10-секохола(7E)-(1R,3R)-1,3-дигідрокси-24a-(тієн-2-іл)-24a5,7-дієн-1,2,3,24-тетрол 64b гомо-19-нop-9,10-секохола-5,7-дієн-24а-он 57 58. 405мг [2-[[3R-(3R,4S,5R]-3,4,5-трис[[(1,153. 40мг спирту 54 піддають переробленню диметилеаналогічно до 25 і одержують при цьому 28мг (7E)тил)диметилсиліл]окси]циклогексиліден]етил]дифе (1R,3R)-1б3-біс[[(1,1нілфосфіноксиду 61a [H.F. DeLuca та ін., J. Med. диметилетил)диметилсиліл]окси]-24а-(тієн-2-іл)Chem. 37,3730 (1994)] поміщають у 6мл тетрагід24а-гомо-19-нор-9,10-секохола-5,7-дієн-24а-ону 56 рофурану і краплями при -78°С додають 0,28мл у вигляді безбарвної пінистої речовини. розчину н-бутиллітію (2,5Μ в гексані). Через 10хв. 1 при -30°С додають 109мг кетону 52 і перемішують Н-ЯМР (CDCI3): d = 0,07част./млн (s, 12Н); протягом години при цій температурі. Після цього 0,53 (s, 3Н); 0,88 (s, 18Н); 0,98 (d, 3Н); 4,09 (m, 2H); припиняють реакцію за допомогою розчину хлори5,81 (d, 1Н); 6,18 (d, 1H); 7,14 (dd, 1H); 7,62 (d, 1H); ду натрію, екстрагують оцтовим ефіром, промива7,72 (d, 1H) ють органічну фазу розчином хлориду натрію, су54. 27мг кетону 42 піддають переробленню шать над сульфатом натрію і видаляють аналогічно до 26 і одержують при цьому 13мг зарозчинник. Залишок очищають за допомогою хрозначеної в заголовку сполуки 57 у ви гляді безбарматографії на силікагелі з використанням суміші вної пінистої речовини. 1 оцтовий ефір/гексан і одержують при цьому 206мг Н-ЯМР (CD2Cl2): d = 0,52част./млн (s, 3Н); (7E)-(1R,2S,3R)-24a-(ацетилокси)-24a-(тієн-2-іл)0,92 (d, 3Н); 3,93 (m, 1Н); 4,03 (m, 1Н); 5,82 (d, 1H); 1,2,3-трис[[(1,1-диметилетил)диметилсиліл]окси]6,23 (d, 1H); 7,12 (dd, 1H); 7,60 (d, 1H); 7,67 (d, 1H) 24а-гомо-19-нор-9,10-секохола-5,7-дієну 62 у виПриклад 13 гляді безбарвної пінистої сполуки. (5Z,7E)-(1S,3R,24aR)-24a-(тієн-2-іл)-24a-гомо1 Н-ЯМР (CDCI3): d = 0,02-0,07част./млн (4 x s, 9,10-секохола-5,7,10(19)-триєн-1,3,24а-тріол 60а і 18Н); 0,53 (s, 3Н); 0,83 (s, 9H); 0,89 (s, 18Н); 0,90 (5Z,7Е)-(1S,3R,24аS)-24а-(тієн-2-іл)-24а-гомо-9,10(d, 3Н); 2,07 (s, 3Н); 3,64 (m, 1Н); 3,80 (m, 1Н); 3,85 секохола-5,7,10(19)-триєн-1,3,24а-тріол 60b 55. 350мг фосфіноксиду, депротонованого за (m, 1Н); 5,84 (d, 1H); 6,03 (t, 1H); 6,04 (d, 1H); 6,97 (m, 2H); 7,05 (m, 1H) допомогою 0,29мл розчину н-бутиллітію (2,5 Μ в 59. 205мг ацетату 62 піддають перетворенню гексані), вводять у взаємодію з 113мг кетону 52 аналогічно до 13 і одержують при цьому 180мг аналогічно до 15 і одержують при цьому 93мг (7E)-(1R,2S,3R)-(тієн-2-іл)-1,2,3-трис[[(1,1(5Z,7Е)-(1S,3R)-24а-(ацетилокси)-1,3-біс[[(1,1диметилетил)диметилсиліл]окси]-24а-(тієн-2-іл)диметилетил)диметилсиліл]окси]-24а-гомо-19-нор9,10-секохола-5,7-дієн-24а-олу 63 у вигляді безба24а-гомо-9,10-секохола-5,7,10(19)-триєну 58 у вирвної пінистої речовини. гляді безбарвної пінистої речовини. 1 1 Н-ЯМР (CDCI3): d = 0,02-0,07част./млн (4 x s, Н-ЯМР (CDCI3): d = 0,07част./млн (s, 12Н); 18H); 0,53 (s, 3Н); 0,83 (s, 9H); 0,89 (s, 18Н); 0,90 0,53 (s, 3Н); 0,90 (s, 18Н); 0,90 (d, 3Н); 2,07 (s, 3Н); (d, 3Н); 3,63 (m, 1Н); 3,79 (m, 1H); 3,83 (m, 1H); 4,93 4,19 (m, 1Н); 4,38 (m, 1Н); 4,88 (s, 1H); 5,20 (s, 1H); (m, 1H); 5,83 (d, 1H); 6,04 (d, 1H); 6,99 (m, 2H); 7,28 6,01 (d, 1H); 6,02 (t, 1H); 6,24 (d, 1H); 6,98 (m, 1H); (m, 1H) 7,06 (m, 1H); 7,28 (m, 1H) 60. 134мг спирту 63 піддають переробленню 56. 92мг ацетату 58 піддають перетворенню аналогічно до 14 і після розділення діастереомерів аналогічно до 13 і одержують при цьому 79мг (відносно С-24а) за допомогою РХВД одержують (5Z,7E)-(1S,3R)-1,3-біс[[диметил(1,1 55 82307 56 18мг зазначеної в заголовку сполуки 64а і 25мг 3Н); 2,25 (s, 3Н); 4,03 (m, 1Н); 5,98 (t, 1H); 6,83. (s, зазначеної в заголовку сполуки 64b у вигляді без1H); 6,85 (s, 1H) барвних пінистих речовин. 65. 682мг ацетату 68 піддають переробленню 1 Н-ЯМР (CD2Cl2): аналогічно до 10 і одержують при цьому 425мг 64а: d = 0,52част./млн (s, 3Н); 0,89 (d, 3Н); 3,44 [1R-[1a(1R*),3ab,4a,7аa]]-1-[5-(ацетилокси)-1(dd, 1Н); 3,72 (m, 1Н); 4,00 (m, 1Н); 4,87 (dd, 1Н); метил-5-(4-метилтієн-2-іл)пентил]октагідро-7а5,76 (d, 1Н); 6,28 (d, 1Н); 6,93 (m, 2Н); 7,22 (m, 1Н) метил-1Н-інден-4-олу 69 у вигляді безбарвної олії. 1 64b: d = 0,53част./млн (s, 3Н); 0,90 (d, 3Н); 3,46 Н-ЯМР (CDCI3): d = 0,87/0,88част./млн (d, 3Н); (dd, 1Н); 3,70 (m, 1Н); 4,00 (m, 1Н); 4,87 (t, 1Н); 5,77 0,92 (s, 3Н); 2,08 (s, 3Н); 2,23 (s, 3Н); 4,07 (m, 1Н); (d, 1Н); 6,28 (d, 1Н); 6,93 (m, 2Н); 7,22 (m, 1Н) 5,98 (t, 1Н); 6,82 (s, 1H); 6,85 (s, 1H) Приклад 15 66. 415мг спирту 69 піддають переробленню (7Е)-(1R,2S,3R)-24a-тієн-2-іл-1,2,3-тригідроксианалогічно до 11 і одержують при цьому 352мг 24а-гомо-9,10-секохола-5,7-дієн-24а-он 66 [1R-[1a(1R*),3ab,4a,7аa]]-1-[5-(ацетилокси)-161. 45мг спирту 63 піддають переробленню метил-5-(4-метилтієн-2-іл)пентил]октагідро-7ааналогічно до 25 і одержують при цьому 38мг (7E)метил-4Н-інден-4-ону 70 у вигляді безбарвної олії. 1 (1R,2S,3R)-24a-(тієн-2-іл)-1,2,3-трис[[(1,1Н-ЯМР (CDCI3): d = 0,62част./млн (s, 3Н); диметилетил)диметилсиліл]окси]-24а-гомо-19-нор0,92/0,93 (d, 3Н); 2,08 (s, 3Н); 2,25 (s, 3Н); 5,97 (t, 9,10-секохола-5,7-дієн-24а-ону 65 у вигляді безба1Н); 6,83 (s, 1Н); 6,84 (s, 1Н) рвної пінистої речовини. 67. 306мг фосфіноксиду 13, депротонованого 1 Н-ЯМР (CDCI3): d = 0,02-0,07част./млн (4 x s, за допомогою 0,26мл розчину н-бутиллітію, вво18Н); 0,53 (s, 3Н); 0,83 (s, 9H); 0,90 (s, 18Н); 0,97 дять у взаємодію з 105мг кетону (7E)-(1R,3R)-24a(d, 3Н); 3,62 (m, 1Н); 3,80 (m, 1H); 3,85 (m, 1H); 5,85 (ацетилокси)-1,3-біс[[(1,1(d, 1H); 6,06 (d, 1H); 7,12 (dd, 1H); 7,61 (d, 2H); 7,70 диметилетил)диметилсиліл]окси]-24а-(4(d, 1H) метилтієн-2-іл)-24а-гомо-19-нор-9,10-секохола-5,762. 38мг кетону 65 піддають переробленню дієну 70 аналогічно до 12 і одержують при цьому аналогічно до 26 і одержують при цьому 13мг за166мг 71 у вигляді безбарвної пінистої речовини. 1 значеної в заголовку сполуки 66 у ви гляді безбарН-ЯМР (CDCI3): d = 0,07част./млн (s, 12Н); вної пінистої речовини. 0,53 (s, 3Н); 0,90 (s, 18Н); 0,91 (d, 3Н); 2,07 (s, 3Н); 1 Н-ЯМР (CD2Cl2): d = 0,53част./млн (s, 3Н); 2,23 (s, 3Н); 4,09 (m, 2Н); 5,81 (d, 1Н); 5,97 (t, 1Н); 0,95 (d, 3Н); 3,48 (m, 1Н); 3,74 (m, 1Н); 4,03 (m, 1H); 6,18 (d, 1H); 6,82(s, 1H); 6,84 (s, 1H) 5,85 (d, 1H); 6,30 (d, 1H); 7,13 (dd, 1H); 7,61 (d, 1H); 68. 165мг ацетату 71 піддають перетворенню 7,69 (d, 1H) аналогічно до 13 і одержують при цьому 128мг Приклад 16 (7Е)-(1R,3R)-1,3-біс[[диметил(1,1(7E)-(1R,3R,24aR)-24a-(4-мeтилтiєн-2-iл)-24aдиметилетил)силіл]окси]-24а-(4-метилтієн-2-іл)гoмo-19-нop-9,10-ceкoxoлa-5,7-дiєн-1,3,24а-тріол 24а-гомо-19-нор-9,10-секохола-5,7-дієн-24а-олу 72 73а і (7E)-(1R,3R,24aS)-24a-(4-мeтилтiєн-2-iл)-24aу вигляді безбарвної пінистої речовини. 1 гомо-19-нop-9,10-секохола-5,7-дієн-1,3,24а-тріол Н-ЯМР (CDCI3): d = 0,07част./млн (s, 12Н); 73b 0,54 (s, 3Н); 0,89 (s, 18Н); 0,91 (d, 3Н); 2,25 (s, 3Н); 63. 0,79мг 3-метилтіофену поміщають у 20мл 4,09 (m, 2Н); 4,85 (m, 1Н); 5,82 (d, 1H); 6,18 (d, 1H); тетрагідрофурану і при -78°С додають 3,27мл роз6,80 (s, 1H); 6,82 (s, 1H) чину н-бутиллітію (2,5 Μ в гексані). Через 30хв. при 69. 91мг спирту 72 піддають переробленню цій температурі краплями додають 600мг альдегіаналогічно до 14 і після розділення діастереомерів ду 8 у 3мл тетрагідрофурані і перемішують протя(щодо С-24а) за допомогою РХВД одержують 16мг гом години. Після цього припиняють реакцію за зазначеної в заголовку сполуки 73а і 19мг зазнадопомогою розчину хлориду натрію, екстрагують ченої в заголовку сполуки 73b у вигляді безбарвоцтовим ефіром, промивають органічну фазу розних пінистих речовин. 1 чином хлориду натрію і сушать над сульфатом Н-ЯМР (CD2CI2 /CD3OD): натрію. Розчинник видаляють, а залишок очища73а: d = 0,51част./млн (s, 3Н); 0,91 (d, 3Н); 2,18 ють за допомогою хроматографії на силікагелі з (s, 3Н); 3,94 (m, 1Н); 4,02 (m, 1Н); 4,76 (t, 1H); 5,84 використанням суміші оцтовий ефір/гексан і одер(d, 1H); 6,25 (d, 1H); 6,75 (s, 1Н); 6,77 (s, 2H) жують при цьому 681мг [1R-[1a(R*),3ab,4a,7аa]]-a73b: d = 0,51част./млн (s, 3Н); 0,90 (d, 3Н); 2,18 [4-[октагідро-7а-метил-4-[(триетилсиліл)окси-1Н(s, 3H); 3,94 (m, 1Н); 4,02 (m, 1Н); 4,78 (t, 1H); 5,84 інден-1-іл]пентил]-4-метилтіофен-2-метанолу 67 у (d, 1H); 6,25 (d, 1H); 6,75 (s, 1H); 6,77 (s, 2H) вигляді безбарвної олії. Приклад 17 1 Н-ЯМР (CDCI3): d = 0,55част./млн (q, 6Н); 0,88 (7E)-(1R,3R)-1,3 -дигідрокси-24а-(4-метилтієн(d, 3Н); 0,90 (s, 3Н); 0,96 (t, 9H); 2,23 (s, 3Н); 4,03 2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-24а(m, 1Н); 4,83 (m, 1H); 6,80 (s, 1H); 6,82 (s, 1H) он 75 64. 671мг спирту 67 піддають переробленню 70. 36мг спирту 72 піддають переробленню аналогічно до 9 і одержують при цьому 692мг [1Rаналогічно до 25 і одержують при цьому 30мг (7E)[1a(1R*),3ab,4a,7аa]]-5-[октагідро-7а-метил-4(1R,3R)-1,3-бic[[димeтил(1,1[(триетилсиліл)окси]-1Н-інден-1-іл]-1-(4-метилтієндимeтилeтил)cилiл]oкcи]-24a-(4-мeтилтiєн-2-іл)2-іл)гексилацетату 68 у вигляді безбарвної олії. 24а-гомо-19-нор-9,10-секохола-5,7-дієн-24а-ону 74 1 Н-ЯМР (CDCI3): d = 0,56част./млн (q, 6Н); у вигляді безбарвної пінистої речовини. 1 0,87/0,88 (d, 3Н); 0,90 (s, 3Н); 0,96 (t, 9Н); 2,08 (s, Н-ЯМР (CDCI3): d = 0,07част./млн (s, 12Н); 0,54 (s, 3Н); 0,88 (s, 18Н); 0,98 (d, 3Н); 2,30 (s, 3Н); 57 82307 58 1 4,09 (m, 2Н); 5,82 (d, 1Н); 6,18 (d, 1H); 7,22 (s, 1Н); Н-ЯМР (CDCI3): d = 0,06част./млн (s, 12Н); 7,52 (s, 1H) 0,53 (s, 3Н); 0,88 (s, 18Н); 0,97 (d, 3Н); 2,29 (s, 3Н); 71. 29мг кетону 74 піддають переробленню 4,18 (m, 1Н); 4,38 (m, 1H); 4,96 (s, 1H); 5,18 (s, 1Н); аналогічно до 26 і одержують при цьому 13мг за6,00 (d, 1H); 6,23 (d, 1H); 7,22 (s, 1H); 7,52 (s, 1H) значеної в заголовку сполуки 75 у ви гляді безбар76. 19мг кетону 79 піддають переробленню вної пінистої речовини. аналогічно до 26 і одержують при цьому 9мг за1 Н-ЯМР (CD2CI2): d = 0,52част./млн (s, 3Н); значеної в заголовку сполуки 80 у ви гляді безбар0,94 (d, 3Н); 2,27 (s, 3Н); 3,95 (m, 1Н); 4,04 (m, 1H); вної пінистої речовини. 1 5,82 (d, 1H); 6,24 (d, 1H); 7,19 (s, 1H); 7,48 (s, 1H) Н-ЯМР (CD2CI2): d = 0,52част./млн (s, 3Н); Приклад 18 0,94 (d, 3Н); 2,27 (s, 3Н); 4,16 (m, 1Н); 4,36 (m, 1H); (5Z,7E)-(1S,3R,24aR)-24a-(4-метилтієн-2-іл)4,94 (s, 1H); 5,28 (s, 1H); 5,98 (d, 1H); 6,36 (d, 1H); 24a-гомо-9,10-секохола-5,7,10(19)-триєн-1,3,24а7,20 (s, 1H); 7,48 (s, 1H) тріол 78а і (5Z,7E)-(lS,3R,24aS)-24a-(4-MemnrrieH Приклад 20 метилтієн -2-in)-24a-гомо-9,10-секохола-5,7,10(19)(7E)-(1R,2S,3R,24aR)-24a-(4-мeтилтiєн-2-iл)триєн-1,3,24а-тріол 78b 24a-гoмo-19-нop-9,10-ceкoxoлa-5,7-дієн-1,2,3,2472. 316мг фосфіноксиду 17, депротонованого тетрол 83а і (7E)-(lR,2S,3R,24aS)-24a-(4за допомогою 0,26мл розчину н-бутиллітію (2,5Μ в MerairrieH-2-іл)-24a-гомо-19-нop-9,10-секохола-5,7гексані), вводять у взаємодію з 106мг кетону 70 дієн-1,2,3,24-тетрол83b аналогічно до 15 і одержують при цьому 177мг 77. 377мг фосфіноксиду 61а поміщають у 6мл (5Z,7E)-(1S,3R)-24a-(ацетилокси)-1,3-біс[[(1,1тетрагідрофурану і при -78°С краплями додають диметилетил)диметилсиліл]окси]-24а-(40,26мл розчину н-бутиллітію (2,5Μ в гексані). Чеметилтієн-2-іл)-24а-гомо-9,10-секохола-5,7,10(19)рез 10хв. при -30°С додають 105мг кетону 70 і петриєну 76 у вигляді безбарвної пінистої речовини. ремішують протягом години при цій температурі. 1 Н-ЯМР (CDCI3): d = 0,07част./млн (s, 12Н); Після цього припиняють реакцію за допомогою 0,53 (s, 3Н); 0,89 (s, 18Н); 0,90 (d, 3Н); 2,08 (s, 3Н); розчину хлориду натрію, екстрагують оцтовим 2,23 (s, 3Н); 4,19 (m, 1Н); 4,38 (m, 1Н); 4,88 (s, 1Н); ефіром, промивають органічну фазу розчином 5,20 (s, 1Н); 5,98 (t, 1Н); 6,01 (d, 1H); 6,23 (d, 1Н); хлориду натрію, сушать над сульфатом натрію і 6,83 (s, 1H); 6,85 (s, 1H) видаляють розчинник. Залишок очищають за до73. 176мг ацетату 76 піддають перетворенню помогою хроматографії на силікагелі з викорисаналогічно до 13 і одержують при цьому 149мг танням суміші оцтовий ефір/гексан і одержують (5Z,7E)-(1S,3R)-1,3-бic[[(1,1при цьому 174мг (7E)-(1R,2S,3R)-24aдимeтилeтил)димeтилcилiл]oкcи]-24a-(4(ацетилокси)-24a-(4-метилтієн-2-іл)-1,2,3метилтієн-2-іл)-24а-гомо-9,10-секохола-5,7,10(19)трис[[(1,1-диметилетил)диметилсиліл]окси]-24атриєн-24а-олу 77 у вигляді безбарвної пінистої гомо-19-нор-9,10-секохола-5,7-дієну 81 у вигляді речовини. безбарвної пінистої речовини. 1 1 Н-ЯМР (CDCI3): d = 0,07част./млн (s, 12Н); Н-ЯМР (CDCI3): d = 0,02-0,07част./млн (4 x s, 0,53 (s, 3Н); 0,89 (s, 18Н); 0,90 (d, 3Н); 2,23 (s, 3Н); 18Н); 0,53 (s, 3Н); 0,83 (s, 9Н); 0,89 (s, 18Н); 0,90 4,19 (m, 1Н); 4,38 (m, 1Н); 4,88 (s, 1H); 4,95 (m, 1H); (d, 3Н); 2,06 (s, 3Н); 2,22 (s, 3Н); 3,63 (m, 1Н); 3,80 5,19 (s, 1H); 6,02 (d, 1H); 6,25 (d, 1H); 6,80 (s, 1H); (m, 1H); 3,85 (m, 1H); 5,85 (d, 1H); 5,97 (t, 1H); 6,05 6,82 (s, 1H) (d, 1H); 6,82 (s, 2H); 6,84 (s, 1H) 74. 103мг спирту 77 піддають переробленню 78. 173мг ацетату 81 піддають перетворенню аналогічно до 14 і після розділення діастереомерів аналогічно до 13 і одержують при цьому 146мг (відносно С-24а) за допомогою РХВД одержують (7Е)-(1R,2S,3R)-24а-(4-металтієн-2-іл)-1,2,326мг зазначеної в заголовку сполуки 78а і 27мг трис[[(1,1-диметилетил)диметилсиліл]окси]-24азазначеної в заголовку сполуки 78b у вигляді безгомо-19-нор-9,10-секохола-5,7-дієн-24а-олу 82 у барвних пінистих речовин. вигляді безбарвної пінистої сполуки. 1 1 Н-ЯМР (CD2Cl2/CD3OD): Н-ЯМР (CDCI3): d = 0,02-0,07част./млн (4 x s, 78а: d = 0,50част./млн (s, 3Н); 0,88 (d, 3Н); 2,17 18Н); 0,53 (s, 3Н); 0,83 (s, 9H); 0,89 (s, 18Н); 0,90 (s, 3Н); 4,09 (m, 1Н); 4,30 (m, 1Н); 4,76 (t, 1H); 4,92 (d, 3Н); 2,22 (s, 3Н); 3,63 (m, 1Н); 3,79 (m, 1Н); 3,84 (s, 1H); 5,27 (s, 1H); 6,00 (d, 1H); 6,28 (d, 1H); 6,82 (m, 1Н); 4,93 (m, 1H); 5,83 (d, 1H); 6,04 (d, 1H); 6,78 (s, 1Н); 6,84 (s, 1H) (s, 1H); 6,80 (s, 1H) 79. 99мг спирту 82 піддають переробленню 78b: d = 0,50част./млн (s, 3Н); 0,89 (d, 3Н); 2,17 аналогічно до 14 і після розділення діастереомерів (s, 3Н); 4,09 (m, 1H); 4,30 (m, 1Н); 4,78 (t, 1Н); 4,92 (відносно С-24а) за допомогою РХВД одержують (s, 1Н); 5,27 (s, 1Н); 6,00 (d, 1Н); 6,28 (d, 1H); 6,82 19мг зазначеної в заголовку сполуки 83а і 23мг (s, 1H); 6,84 (s, 1H) Приклад 19 зазначеної в заголовку сполуки 83b у вигляді безбарвних пінистих речовин. (5Z,7E)-(1S,3R)-1,3-дигідрокси-24а-(41 Н-ЯМР (CD2Cl2): метилтієн-2-іл)-24а-гомо-9,10-секохола-5,7,10(19)триєн-24а-он 80 83а: d = 0,52част./млн (s, 3Н); 0,88 (d, 3Н); 2,18 75. 45мг спирту 77 піддають переробленню (s, 3Н); 3,45 (m, 1Н); 3,70 (m, 1Н); 4,00 (m, 1Н); 4,78 аналогічно до 25 і одержують при цьому 20мг (t, 1H); 5,77 (d, 1H); 6,28 (d, 1Н); 6,86 (s, 1H); 6,88 (5Z,7Е)-(1S,3R)-1,3-біс[[(1,1(s, 1H) диметилетил)диметилсиліл]окси]-24а-(483b: d = 0,52частУмлн (s, 3Н); 0,89 (d, 3Н); 2,18 метилтієн-2-іл)-24а-гомо-9,10-секохола-5,7,10(19)(s, 3Н); 3,45 (m, 1Н); 3,70 (m, 1Н); 4,00 (m, 1Н); 4,80 триєн-24а-ону 79 у вигляді безбарвної пінистої (t, 1Н); 5,77 (d, 1H); 6,28 (d, 1H); 6,86 (s, 1H); 6,89 речовини. (s, 1H) 59 82307 60 1 Приклад 21 Н-ЯМР (CDCI3): d = 0,87/0,88част./млн (d, 3Н); (7Е)-(1R,2S,3R)-24a-(4-метилтієн-2-іл)-1,2,30,92 (s, 3Н); 1,31 (t, 3Н); 2,08 (s, 3Н); 2,82 (q, 2Н); тригідрокси-24а-гомо-19-нор-9,10-секохола-5,74,07 (m, 1Н); 5,97 (t, 1Н); 6,63 (d, 1Н); 6,85 (d, 1H) дієн-24а-он 85 85. 142мг спирту 88 піддають переробленню 80. 46мг спирту 82 піддають переробленню аналогічно до 11 і одержують при цьому 123мг аналогічно до 25 і одержують при цьому 41мг (7Е)[1R-[1a(1R*),3ab,7аa]]-1-[5-(ацетилокси)-5-(5(1R,2S,3R)-24а-(4-метилтієн-2-іл)-1,2,3-трис[[(1,1етилтієн-2-іл)-1-метилпентил[октагідро-7а-метилдиметилетил)диметилсиліл]окси]-24а-гомо-19-нор4Н-інден-1-ону 89 у вигляді безбарвної олії. 1 9,10-секохола-5,7-дієн-24а-ону 84 у вигляді безбаН-ЯМР (CDCI3): d = 0,62част./млн (s, 3Н); рвної пінистої речовини. 0,92/0,93 (d, 3Н); 1,30 (t, 3Н); 2,07 (s, 3Н); 2,82 (q, 1 Н-ЯМР (CDCI3): d = 0,02-0,07част./млн (4 x s, 2Н); 5,97 (t, 1Н); 6,62 (d, 1Н); 6,86 (d, 1Н) 18Н); 0,53 (s, 3Н); 0,83 (s, 9H); 0,89 (s, 18Н); 0,97 86. 347мг фосфіноксиду 13, депротонованого (d, 3Н); 2,28 (s, 3Н); 3,63 (m, 1Н); 3,79 (m, 1H); 3,84 за допомогою 0,3мл розчину н-бутиллітію (2,5Μ в (m, 1H); 5,83 (d, 1H); 6,05 (d, 1H); 7,21 (s, 1H); 7,51 гексані), вводять у взаємодію з 123мг кетону 89 (s, 1H) аналогічно до 12 і одержують при цьому 129мг 81. 40мг кетону 84 піддають переробленню (7E)-(1R,3R)-24a-(aцeтилoкcи)-1,3-бic[[(1,1аналогічно до 26 і одержують при цьому 18мг задиметилетил)диметилсиліл]окси]-24а-(5-етилтієнзначеної в заголовку сполуки 85 у ви гляді безбар2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієну 90 у вної пінистої речовини. вигляді безбарвної пінистої речовини. 1 1 Н-ЯМР (CD2Cl2): d = 0,53част./млн (s, 3Н); Н-ЯМР (CDCI3): d = 0,07част./млн (s, 12Н); 0,95 (d, 3Н); 2,26 (s, 3Н); 3,47 (m, 1Н); 3,70 (m, 1Н); 0,53 (s, 3Н); 0,90 (s, 18Н); 0,91 (d, 3Н); 1,30 (t, 3Н); 4,01 (m, 1H); 5,77 (d, 1H); 6,30 (d, 1H); 7,20 (s, 1H); 2,07 (s, 3Н); 2,82 (q, 2Н); 4,09 (m, 2Н); 5,82 (d, 1Н); 7,50 (s, 1H) 5,96 (t, 1H); 6,18 (d, 1H); 6,62 (d, 1H); 6,86 (d, 1H) Приклад 22 87. 129мг ацетату 90 піддають перетворенню (7Е)-(1R,3R,24aR)-24a-(5-етилтієн-2-in)-24aаналогічно до 13 і одержують при цьому 98мг (7E)гомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол (lR,3R)-24a-(aцeтилoкcи)-1,3-біс[[(1,192а і (7Е)-(1R,3R,24aS)-24а-(5-етилтієн-2-іл)-24адиметилетил)диметилсиліл]окси]-24а-(5-етилтієнгомо-19-нор-9,10-секохола-5,7-дієн-1,3,24а-тріол 2-іл)-24а-гомо-19-нор-9,10-секохола-5,7-дієн-24а92b олу 91 у ви гляді безбарвної пінистої речовини. 1 82. 1,19мл 2-етилтіофену поміщають у 20мл Н-ЯМР (CDCI3): d = 0,07част./млн (s, 12Н); тетрагідрофурану і при -78°С додають 4,2мл роз0,54 (s, 3Н); 0,89 (s, 18Н); 0,91 (d, 3Н); 1,30 (t, 3Н); чину н-бутиллітію (2,5 Μ в гексані). Через 30хв. при 2,82 (q, 2H); 4,10 (m, 2H); 4,84 (m, 1H); 5,82 (d, 1H); цій температурі краплями додають 770мг альдегі6,18 (d, 1H); 6,63 (d, 1H); 6,80 (d, 1Н) ду 8 у 5мл тетрагідрофурану і перемішують протя88. 98мг спирту 91 піддають переробленню гом години. Після цього припиняють реакцію за аналогічно до 14 і після розділення діастереоізодопомогою розчину хлориду натрію, екстрагують мерів (відносно С-24а) за допомогою РХВД одероцтовим ефіром, промивають органічну фазу розжують 18мг зазначеної в заголовку сполуки 92а і чином хлориду натрію і сушать над сульфатом 19мг 92b у вигляді безбарвних пінистих речовин. 1 натрію. Розчинник видаляють, а залишок очищаН-ЯМР (CD2CI2 /CD3OD): ють за допомогою хроматографії на силікагелі з 92а: d = 0,51част./млн (s, 3Н); 0,89 (d, 3Н); 1,27 використанням суміші оцтовий ефір/гексан і одер(t, 3Н); 2,78 (q, 2H); 3,94 (m, 1H); 4,02 (m, 1Н); 4,75 жують при цьому 773мг [1R-[1a(1R*),3ab,4a,7aa]](t, 1Н); 5,84 (d, 1Н); 6,25 (d, 1Н); 6,59 (d, 1Н); 6,71 5-етил-a-[4-[октагідро-7а-метил-4(d, 1Н) [(триетилсиліл)окси]-1Н-інден-1-іл]пентил]тіофен92b: d = 0,51част./млн (s, 3Н); 0,90 (d, 3Н); 1,27 2-метанолу 86 у вигляді безбарвної олії. (t, 3Н); 2,78 (q, 2Н); 3,94 (m, 1Н); 4,02 (m, 1Н); 4,76 1 Н-ЯМР (CDCI3): d = 0,56част./млн (q, 6Н); 0,89 (t, 1Н); 5,84 (d, 1H); 6,25 (d, 1H); 6,59 (d, 1H); 6,71 (d, 3Н); 0,90 (s, 3Н); 0,97 (t, 9H); 1,31 (t, 3Н); 2,82 (q, (d, 1H) 2Н); 4,03 (m, 1Н); 4,81 (m, 1Н); 6,62 (d, 1H); 6,80 (d, Приклад 23 1H) (7Е)-(1R,3R,24aR)-24а-[5-(2-гідроксіетил)-483. 763мг спирту 86 піддають переробленню метилтіазол-2-іл]-24а-гомо-19-нор-9,10-секохолааналогічно до 9 і одержують при цьому 745мг [1R5,7-дієн-1,3,24а-тріол 102а і (7E)-(1R,3R,24aS)-24a[1a(1R*),3ab,4a,7аa]]-1-(5-етилтієн-2-іл)-5[5-(2-riflpoKcieran)-4-метилтіазол-2-іл]-24а-гомо-19[октагідро-7а-метил-4-[(триетилсиліл)окси]-1Ннор-9,10-секохола-5,7-дієн-1,3,24а-тріол 102b інден-1-іл]гексилацетату 87 у вигляді безбарвної 89. 2,09мл 5-(2-гідроксіетил)-4-метилтіазолу 93 олії. поміщають у 150мл дихлорметану, додають 7,8мл 1 Н-ЯМР (CDCI3): d = 0,55част./млн (q, 6Н); дигідропірану і 400мг п-толуолсульфонату піриди0,87/0,88 (d, 3Н); 0,90 (s, 3Н); 0,95 (t, 9Н); 1,30 (t, нію і перемішують протягом 5 годин при кімнатній 3Н); 2,07 (s, 3Н); 2,82 (q, 2Н); 4,03 (m, 1Н); 5,97 (t, температурі. Після цього додають розчин хлориду 1H); 6,62 (d, 1H); 6,87 (d, 1H) натрію, екстрагують оцтовим ефіром, промивають 84. 682мг ацетату 87 піддають переробленню органічну фазу розчином гідрокарбонату натрію і аналогічно до 10 і одержують при цьому 287мг розчином хлориду натрію, суша ть над сульфатом натрію і концентрують. Залишок очищають за до[1R-[1a(1R*),3ab,4a,7аa]]-1-[5-(ацетилокси)-5-(5помогою хроматографії на силікагелі з викорисетилтієн-2-іл)-1-метилпентил]октагідро-7а-метилтанням суміші оцтовий ефір/гексан і одержують 1Н-інден-4-олу 88 у вигляді безбарвної олії. при цьому 3,8м 5-[2-[(тетрагідро-2Н-піран-2
ДивитисяДодаткова інформація
Назва патенту англійськоюNew vitamin d derivatives with cyclic substructures in the side chains, method and intermediates for their production and their use in the preparation of medicaments
Автори англійськоюSteinmeyer Andreas, Schwarz Katica, Giesen Claudia, Haberey Martin, Faehnrich Marianne
Назва патенту російськоюНовые производные витамина d с циклическими субструктурами в боковых цепях, способ и промежуточные продукты для их получения и их применение для получения лекарственных средств
Автори російськоюШтейнмейер Андреас, Шварц Катика, Гисен Клаудия, Хабери Мартин, Фенрих Марианне
МПК / Мітки
МПК: C07D 333/00, A61P 35/00, C07C 69/608, C07D 263/32, C07F 7/18, C07C 33/00, C07D 231/14, C07D 277/00, A61P 3/00, C07C 401/00, A61P 9/10
Мітки: похідні, спосіб, ланцюгах, застосування, проміжні, одержання, їхнє, вітаміну, лікарських, їхнього, продукти, засобів, субструктурами, нові, бічних, циклічними
Код посилання
<a href="https://ua.patents.su/49-82307-novi-pokhidni-vitaminu-d-z-ciklichnimi-substrukturami-v-bichnikh-lancyugakh-sposib-i-promizhni-produkti-dlya-khnogo-oderzhannya-ta-khneh-zastosuvannya-dlya-oderzhannya-likarskikh-z.html" target="_blank" rel="follow" title="База патентів України">Нові похідні вітаміну d з циклічними субструктурами в бічних ланцюгах, спосіб і проміжні продукти для їхнього одержання та їхнє застосування для одержання лікарських засобів</a>
Попередній патент: Кумулятивна бойова частина
Наступний патент: Спосіб зміни гідравлічного опору амортизатора і амортизатор зі змінюваним гідравлічним опором
Випадковий патент: Спосіб доменної плавки