Спосіб отримання 1,5-бензоксатієпін-3-ону
Номер патенту: 110586
Опубліковано: 12.01.2016
Автори: Воловенко Юліан Михайлович, Шишкіна Олена Олегівна, Тарасюк Тарас Миколайович
Формула / Реферат
Спосіб отримання 1,5-бензоксатієпін-3-ону формули 1,
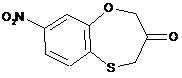 , 1
, 1
який відрізняється тим, що змішують 5-нітро-2-хлорофенол з естером а-хлорооцтової кислоти в присутності основи в органічному розчиннику, далі змішують метил-(5-нітро-2-хлорофеноксі)ацетат з естером тіогліколевої кислоти в присутності основи в органічному розчиннику, циклізують метил-{[2-(2-метоксі-2-оксоетокси)-4-нітрофеніл]тіо}ацетат в органічному розчиннику в присутності алкоголятів лужних металів, гідролізують метил-8-нітро-3-оксо-3,4-дигідро-2Н-1,5-бензоксатієпін-4-карбоксилат в суміші кислот та виділяють цільовий продукт шляхом висадження водою з органічного розчинниката наступним фільтруванням.
Текст
Реферат: Даний винахід стосується галузі органічної хімії, зокрема хімії гетероциклічних сполук, а саме синтезу 1,5-бензоксатієпін-3-ону для застосування в медицині як проміжної сполуки для одержання фізіологічно активних речовин. Технічний результат: комерційна доступність вихідних сполук; високий вихід цільових продуктів - 91 % та 85 %, відповідно; незначна тривалість проведення реакцій: мінімальний час протікання кожної стадії - 1 година, простота виділення продуктів реакцій, виділення чистих сполук, які не потребують додаткової очистки. UA 110586 C2 (12) UA 110586 C2 UA 110586 C2 Винахід стосується галузі органічної хімії, зокрема хімії гетероциклічних сполук, а саме способу отримання 1,5-бензоксатієпін-3-ону на прикладі формули 1: 5 10 ,1 1 яка може бути застосована як проміжна сполуки для отримання фізіологічно активних речовин в медицині [1-4]. Найбільш близьким до запропонованого винаходу є метод отримання 1,5-бензоксатієпін-3ону 1 [5], за яким процес відбувається в три стадії, виходячи з заміщених opтo-меркаптофенолів 2. На першій стадії відбувається алкілування метиловим естером бромоцтової кислоти з утворенням діестеру 3 (вихід 75-83 %), який циклізується за Дікманом в кетоестер 4 з виходом 71-77 %. За умов кислого гідролізу відбувається одночасне омилення та декарбоксилювання з утворенням кетону 5 з виходом 72-79 % (схема 1): OH R1 SH MeONa K2CO3, CH 3COCH 3 DMF N2 R1 3 2 H2SO4, H2O AcOH R R1 1 CO2Me R1; H,OMe 5 4 15 20 25 30 35 . Недоліком цього способу є: - використання інертної атмосфери та канцерогену ДМФА (Ν,Ν-диметилформамід); - трудомісткість процесу виділення продукту; - необхідність додаткової очистки продукту В основу винаходу поставлено задачу створити новий, більш зручний спосіб отримання 1,5бензоксатієпін-3-ону 1, підвищити вихід продуктів реакції, зменшити трудомісткість виділення продуктів, час проведення самої реакції та підвищити безпеку проведення синтезів. Поставлена задача вирішується при здійсненні способу отримання 1,5-бензоксатієпін-3-ону 1 в чотири стадії, виходячи з заміщеного фенолу 6. Взаємодією заміщеного фенолу 6 і метилового естеру -хлорооцтової кислоти в присутності основи в органічному розчиннику та наступною взаємодією одержаного метил-(5-нітро-2-хлорофенокси)ацетату (7) з метиловим естером тіогліколевої кислоти в органічному розчиннику в присутності основи з утворенням метил-{[2-(2-метоксі-2-оксоетокси)-4-нітрофеніл]тіо}ацетату (8) з подальшою його циклізацією в суміші органічних розчинників в присутності алкоголятів лужних металів в сполуку 9 та гідролізом з одночасним декарбоксилюванням в кислому середовищі за схемою 3. Першу стадію проводять в ацетонітрилі, реагенти беруть у стехіометричному співвідношенні (схема 2). Через 20 годин осад фільтрують. Фільтрат випаровують при зниженому тиску, заливають водою та фільтрують осад - сполуку 7. Другу стадію (утворення продукту 8) проводять в диметилсульфоксиді при температурі 70 °C, виливають в воду та фільтрують осад. Сполуку 8 циклізують в суміші метиловий спирт - тетрагідрофуран в присутності метилату натрію при температурі 0-70 °C (третя стадія). Кип'ятіння сполуки 9 в суміші кислот впродовж 1 години приводить до цільового 1,5-бензоксатієпін-3-ону 1. Схема 2 1 UA 110586 C2 O2N OH Cl Cl O2N CO2Me O2N CO2Me HS K2CO3, CH3CN Cl 6 CO2Me CO2Me CO2Me Et3N, ДМСО 8 7 O2N H2SO4, H2O MeONa / MeOH O2N AcOH ТГФ CO2Me 1 9 5 10 15 20 25 30 35 40 45 Одержаний продукт має достатню чистоту для подальшого використання. Однак, якщо є потреба у додатковій чистоті продукту, то одержаний за заявленим способом 1,5бензоксатієпін-3-он може бути очищений загальновідомими методами, такими як кристалізація. В результаті виділяють чистий 1,5-бензоксатієпін-3-он з 91 % виходом. Винахід підтверджується наступними прикладами, які ілюструють, але не обмежують об'єм даного винаходу. Методика синтезу 1,5-бензоксатієп-3-ону (1) Перша стадія: Метил-(5-нітро-2-хлорофенокси)ацетат (7) Суміш метил хлороацетату (0,27 моль), 5-нітро-2-хлорофенолу (6) (0,25 моль), K2СО3 (0,30 моль) і 500 мл CH3CN перемішують при 40 °C впродовж 20 годин. Неорганічний осад відфільтровують і промивають CH3CN. Фільтрат упарюють, а залишок заливають водою, 1 розтирають, фільтрують і сушать. Вихід - 93 %; Тпл. 98-99 °C (і-РrOН); ЯМР Н δ, м. ч.: 3,76 (с, 3Н, СН3), 5,07 (с, 2Н, СН2), 7,69 (д, J=8,4 Гц, 1Н, Н3), 7,86 (д, J=8,4 Гц, 1Н, H4), 7,89 (с, 1Н, Н6); 13 -1 ЯМР С δ, м. ч.: 52,2, 65,7, 108,7, 117,2, 129,0, 131,0, 147,1, 153,5, 168,5; ІЧ спектр ν, см : 1728 (С=О), 1525 (ΝΟ2), 1344 (ΝΟ2). Знайдено, %: С - 44,05, Η - 3,31, Ν - 5,74. Розраховано для C9H8ClNO5, %: С - 44,01, Η - 3,28, N-5,70. Друга стадія: Метил-{[2-(2-метоксі-2-оксоетокси)-4-нітрофеніл]тіо}ацетат (8) Суміш метилового естеру тіогліколевої кислоти (0,27 моль), естеру 7 (0,25 моль), Et 3N (0,37 моль) і 150 мл ДМСО перемішуютьпри 70 °C впродовж 3 годин. Реакційну суміш охолоджують до 20 °C і заливають водою. Осад фільтрують, промивають водою і сушать. Вихід - 95 %; Тпл. 1 131-132 °C (і-РrOН); ЯМР Н δ, м. ч.: 3,70 (с, 3Н, СН3), 3,78 (с, 3Н, СН3), 3,96 (с, 2Н, S-CH2), 4,99 (с, 2Н, О-СН2), 7,41 (д, J=8,4 Гц, 1Н, Н6), 7,68 (дд, J=2,0 Гц, 1Н, Н3), 7,83 (дд, J=2,0, 8,4 Гц, 1Н, 13 Н5); ЯМР С δ, м.ч.: 32,1, 52,1, 52,6, 65,6, 106,0, 117,1, 125,6, 135,5, 145,3, 153,4, 168,6, 169,2; -1 + 14 спектр ν, см : 1732 (С=О), 1519 (ΝΟ2), 1345 (ΝΟ2). Мас-спектр: m/z=316,0 [MH] . Знайдено, %: С - 45,75, Η - 4,14, Ν - 4,45. Розраховано для C12H13NO7S, %: С - 45,71, Η - 4,16, Ν - 4,44. Третя стадія: Метил-8-нітро-3-оксо-3,4-дигідро-2Н-1,5-бензоксатієпін-4-карбоксилат (9) При перемішуванні до охолодженого до 0 °C розчину діестеру 8 (0,15 моль) у 400 мл ТГФ, повільно прикапують розчин MeONa (0,18 моль) в МеОН (100 мл). Реакційну суміш перемішують при 0 °C впродовж 1 години і кип'ятять зі зворотнім холодильником впродовж 10 годин. Розчинник упарюють, заливають холодною водою і підкисляють соляною кислотою до рН = 6. Осад фільтрують, промивають водою і сушать. Вихід - 94 %; Тпл. 171-172 °C (CH3CN); ЯМР 1 Н δ, м. ч.: 3,74 (с, 3Н, СН3), 4,98 (с, 2Н, 2-СН2) 5,51 (с, 1Н, СН), 7,63 (д, J=8,4 Гц, 1H, Н6), 7,82 13 (д, 7=2,4 Гц, 1Н, Н9), 7,94 (дд, J=2,4, 8,4 Гц, 1Н, Н7); ЯМР С δ, м.ч.: 54,0, 54,2, 78,2, 118,4, -1 120,4, 129,2, 134,8, 146,1, 155,5, 165,8, 198,5; 14 спектр ν, см : 1728 (С=О), 1514 (ΝΟ2), 1351 + (ΝΟ2). Мас-спектр: m/z=283,8 [МН] . Знайдено, %: С - 46,65, Η - 3,21, Ν - 4,97. Розраховано для C11H9NO6S, %: С - 46,64, Η - 3,20, Ν - 4,94. Четверта стадія: 8-Нітро-2Н-1,5-бензоксатієпін-3(4Н)-он (1) Суміш кетоестеру 9 (0,1 моль), АсОН (200 мл), 98 % H2SO4 (35 мл) і води (35 мл) кип'ятять впродовж 1 години. Реакційну масу виливають на лід, осад фільтрують і сушать. Вихід - 91 %; 1 Тпл. 172-173 °C (CH3CN); ЯМР Н δ, м. ч.: 4,14 (с, 2Н, 4-СН2), 4,81 (с, 2Н, 2-СН2), 7,48 (д, J=8,4 13 Гц, 1Н, Н6), 7,82 (д, J=2,4 Гц, 1Н, Н9), 7,89 (дд, J=2,4, 8,4 Гц, 1Н, Н7); ЯМР С δ, м. ч.: 36,7, 78,2, -1 118,0, 119,6, 129,1, 136,1, 145,6, 155,9, 202,5; ІЧ спектр ν, см : 1718 (С=О), 1508 (ΝΟ2), 1335 (ΝΟ2). Мас-спектр: m/z=224,0 [М-Н] Знайдено, %: С - 48,03, Η - 3,15, Ν - 6,24. Розраховано для C9H7NO4S, %: С - 48,00, Η - 3,13, Ν - 6,22. Таким чином, результатом винаходу є спрощення синтезу 1,5-бензоксатієпін-3-ону формули 1 та підвищення виходу продукту за рахунок застосування нової методики. Технічним 2 UA 110586 C2 результатом є: комерційна доступність вихідних сполук; високий вихід цільового продукту 91 %; незначна тривалість проведення реакцій: мінімальний час протікання кожної стадії 1 година, простота виділення продуктів реакцій, виділення чистих сполук, які не потребують додаткової очистки. 5 10 15 20 Джерела інформації: 1. Pat. US 4672064 United States Patent. Int. СІ. А61К 31/495, C07D 411/06. 1,5-Benzoxathiepin derivatives, their production and use / Hirosada Sugihara, Minoru Hirata; Takeda Chemical Industries, Ltd. № 806.809; filed 10.12.1985; patented 09.06.1987. 2. Monica Diaz-Gavilan, Ana Conejo-Garcia, Olga Cruz-Lopez [et al.] / Synthesis and anticancer activity of (R, S)-9-(2,3-dihydro-1,4-benzoxathiin-3-ylmethyl)-9#-purines // ChemMedChem. - 2008. № 3. P. 127-135. 3. Maria Kimatrai, Ana Conejo-Garcia, Alberto Ramirez [et al.] / Synthesis and anticancer activity of the (R, S)-benzofused 1,5-oxathiepine moiety tethered to purines through alkylidenoxy linkers // ChemMedChem. - 2011. - № 6. - P. 1854-1859. 4. Pat. US 5538974 United States Patent. Int. СІ. А61К 31/495, A61K 31/39. Ophthalmic composition for lowering intraocular pressure / Takahiro Ogawa, Takaaki Deguchi; Senju Pharmaceutical Co., Ltd. - № 378.244; filed 24.01.1995; patented 23.07.1996. 5. Hirosada Sugihara, Hiroshi Mabuchi, Yutaka Kawamatsu / 1,5-Benzoxathiepin derivatives. I. Synthesis and reaction of 1,5-benzoxathiepin derivatives // Chem. Pharm. Bull. - 1987. - № 35. - P. 1919-1929. ФОРМУЛА ВИНАХОДУ 25 Спосіб отримання 1,5-бензоксатієпін-3-ону формули 1, O2N O O S 30 ,1 який відрізняється тим, що змішують 5-нітро-2-хлорофенол з естером а-хлорооцтової кислоти в присутності основи в органічному розчиннику, далі змішують метил-(5-нітро-2хлорофеноксі)ацетат з естером тіогліколевої кислоти в присутності основи в органічному розчиннику, циклізують метил-{[2-(2-метоксі-2-оксоетокси)-4-нітрофеніл]тіо}ацетат в органічному розчиннику в присутності алкоголятів лужних металів, гідролізують метил-8-нітро-3-оксо-3,4дигідро-2Н-1,5-бензоксатієпін-4-карбоксилат в суміші кислот та виділяють цільовий продукт шляхом висадження водою з органічного розчинника та наступним фільтруванням. 35 Комп’ютерна верстка О. Гергіль Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 3
ДивитисяДодаткова інформація
Автори англійськоюVolovenko Yulian Mykchaylovich
Автори російськоюВоловенко Юлиан Михайлович
МПК / Мітки
МПК: C07D 327/02, C07B 37/10
Мітки: 1,5-бензоксатієпін-3-ону, отримання, спосіб
Код посилання
<a href="https://ua.patents.su/5-110586-sposib-otrimannya-15-benzoksatiehpin-3-onu.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання 1,5-бензоксатієпін-3-ону</a>
Попередній патент: Спосіб отримання фторвмісного вуглецевого матеріалу
Наступний патент: Спосіб визначення параметрів рельєфу поверхні та пристрій для його реалізації
Випадковий патент: Спосіб термообробки кристалів германату вісмуту









