Спосіб одержання похідних тіофену та проміжна сполука
Номер патенту: 57810
Опубліковано: 15.07.2003
Автори: Февіг Томас Л., Лау Патрік Х., Філліпс Венделл Г.
Формула / Реферат
1. Спосіб одержання заміщеної тіофенової сполуки, що має формулу
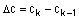 ,
,
де:
R1 і R2 незалежно вибирають з групи, що складається з Н, алкілу, арилу, заміщеного алкілу або арилу і кільця, що об'єднує R1 і R2;
R3 вибирають з групи, що складається з Н, алкілу, арилу і їх заміщених похідних;
Z являє собою CN або СО2R4, де R4 вибирають з групи, що складається з алкілу, арилу і їх заміщених похідних, Н, Na, Li, К і NH4+;
що включає
(а) (1) взаємодію меркаптокетону, що має формулу
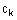 ,
,
де:
R1 і R2 мають значення, визначені вище,
з акриловою сполукою, що має формулу
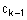 ,
,
де:
R3 визначений вище,
А вибирають з групи, що складається з алкокси, в присутності ефективної кількості основи як каталізатора;
(b) ароматизацію шляхом обробки кислотою; і
(c) виділення заміщеного тіофенового продукту.
2. Спосіб за п. 1, де меркаптокетон одержують шляхом:
(а) взаємодії галогенкетону, що має формулу
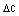 ,
,
де:
R1 і R2 мають значення, визначені в пункті 1,
Х являє собою відповідну відщеплювану групу, таку як галоген (Сl, Вr, І) або метансульфонілоксигрупу, з NaSH у водноорганічній двофазній системі розчинників; і
(b) виділенням меркаптокетону у вигляді розчину в органічному розчиннику.
3. Спосіб за п. 2, де органічний розчин меркаптокетону сушать шляхом азеотропної перегонки або шляхом контактування з осушником.
4. Спосіб за п. 1, де вказаний основний каталізатор є алкоголятом.
5. Спосіб за п. 4, де вказаний алкоголят вибирають з групи, що складається з метилату натрію, трет-амілату натрію, трет-амілату калію і трет-бутилату калію.
6. Спосіб за п. 1, де реакцію здійснюють в присутності вуглеводневого розчинника.
7. Спосіб за п. 1, де реакцію здійснюють при температурі в межах приблизно 0-50°С.
8. Спосіб за п. 1, де кількість вказаного основного каталізатора становить приблизно 0,025-0,2 еквівалента відносно кількості меркаптокетону.
9. Спосіб за п. 1, де стадія (b) включає додавання ефективної кількості водної кислоти до продукту реакції зі стадії (а) для перетворення будь-якого заміщеного тетрагідротіофену в еквівалентний заміщений тіофен;
і де стадія (с) включає стадії:
(с) (1) фазового відділення органічної частини суміші водної кислоти і продукту реакції зі стадії (b);
(с) (2) упарювання будь-якого присутнього вуглеводневого розчинника для одержання неочищеного тіофенового продукту; і
(с) (3) перегонки неочищеного тіофенового продукту зі стадії (с) (2) для одержання очищеного тіофенового продукту.
10. Спосіб за п. 1, де стадія (а) додатково включає стадії:
(а) (2) додання розбавленої сірчаної кислоти до продукту реакції (а) (1);
(а) (3) додання етилацетату до об'єднаних сірчаної кислоти і продукту реакції зі стадії (а) (2);
(а) (4) фазового відділення органічної частини суміші етилацетату, сірчаної кислоти і продукту реакції, отриманої на стадії (а) (3); і
(а) (5) промивання органічної фази, відділеної на стадії (а) (4), водним розсолом, висушування промитої органічної фази сульфатом натрію і упарювання етилацетату і будь-якого присутнього вуглеводневого розчинника для одержання суміші заміщеного тетрагідротіофену і заміщеного тіофену;
де стадія (b) включає обробку суміші заміщеного тетрагідротіофену і заміщеного тіофену, отриманої на стадії (а) (5), водною НСl для перетворення заміщеного тетрагідротіофену на заміщений тіофен;
і де стадія (с) включає стадії:
(с) (1) додавання води і етилацетату до суміші заміщеного тіофену і водної НСl зі стадії (b);
(с) (2) фазового відділення органічної частини суміші вода-етилацетат-НСl-тіофен зі стадії (с) (1); і
(с) (3) промивання органічної частини, відділеної на стадії (с) (2), насиченим водним NаНСО3, висушування Na2SO4 і упарювання етилацетату для одержання заміщеного тіофенового продукту.
11. Тетрагідротіофен, що має формулу
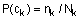 ,
,
де:
R1 і R2 незалежно вибирають з групи, що складається з Н, алкілу, арилу, заміщених алкілу або арилу і кільця, що об'єднує R1 і R2;
R3 вибирають з групи, що складається з Н, алкілу, арилу і їх заміщених похідних;
Z являє собою CN або СО2R4, де R4 вибирають з групи, що складається з алкілу, арилу і їх заміщених похідних, Н, Na, Li, К і NH4+; і
Аявляє собою алкоксигрупу.
Текст
1 Спосіб одержання заміщеної тюфенової сполуки, що має формулу R і F?2 незалежно вибирають з групи, що складається з Н, алкілу, арилу, заміщеного алкілу або арилу і кільця, що об'єднує Ri і F?2, R3 вибирають з групи, що складається з Н, алкілу, арилу і їх заміщених похідних, Z являє собою CN або CO2R4, де R4 вибирають з групи, що складається з алкілу, арилу і їх заміщених похідних, Н, Na, Li, K і N h V , що включає (а) (1) взаємодію меркаптокетону, що має формулу і R2 мають значення, визначені вище, з акриловою сполукою, що має формулу .Z Де R3 визначений вище, А вибирають з групи, що складається з алкокси, в присутності ефективної КІЛЬКОСТІ основи як каталізатора, (b) ароматизацію шляхом обробки кислотою, і (c) виділення заміщеного тюфенового продукту 2 Спосіб за п 1, де меркаптокетон одержують шляхом (а) взаємодії галогенкетону, що має формулу і R2 мають значення, визначені в пункті 1, X являє собою відповідну відщеплювану групу, таку як галоген (СІ, Вг, І) або метансульфонілоксигрупу, з NaSH у водноорганічній двофазній системі розчинників, і (b) виділенням меркаптокетону у вигляді розчину в органічному розчиннику 3 Спосіб за п 2, де органічний розчин меркаптокетону сушать шляхом азеотропної перегонки або шляхом контактування з осушником 4 Спосіб за п 1, де вказаний основний каталізатор є алкоголятом 5 Спосіб за п 4, де вказаний алкоголят вибирають з групи, що складається з метилату натрію, третамілату натрію, трет-амілату калію і трет-бутилату калію 6 Спосіб за п 1, де реакцію здійснюють в присутності вуглеводневого розчинника 7 Спосіб за п 1, де реакцію здійснюють при температурі в межах приблизно 0-50°С 8 Спосіб за п 1, де КІЛЬКІСТЬ вказаного основного каталізатора становить приблизно 0,025-0,2 еквівалента відносно КІЛЬКОСТІ меркаптокетону 9 Спосіб за п 1, де стадія (Ь) включає додавання ефективної КІЛЬКОСТІ водної кислоти до продукту реакції зі стадії (а) для перетворення будь-якого заміщеного тетрапдротюфену в еквівалентний заміщений тюфен, і де стадія (с) включає стадії (c) (1) фазового відділення органічної частини суміші водної кислоти і продукту реакції зі стадії (Ь), О о 0 0 ю 57810 (с) (2) упарювання будь-якого присутнього вуглеводневого розчинника для одержання неочищеного тюфенового продукту, і (с) (3) перегонки неочищеного тюфенового продукту зі стадії (с) (2) для одержання очищеного тюфенового продукту 10 Спосіб за п 1, де стадія (а) додатково включає стадії (а) (2) додання розбавленої сірчаної кислоти до продукту реакції (а) (1), (а) (3) додання етилацетату до об'єднаних сірчаної кислоти і продукту реакції зі стадії (а) (2), (а) (4) фазового відділення органічної частини суміші етилацетату, сірчаної кислоти і продукту реакції, отриманої на стадії (а) (3), і (а) (5) промивання органічної фази, відділеної на стадії (а) (4), водним розсолом, висушування промитої органічної фази сульфатом натрію і упарювання етилацетату і будь-якого присутнього вуглеводневого розчинника для одержання суміші заміщеного тетрапдротюфену і заміщеного тюфену, де стадія (Ь) включає обробку суміші заміщеного тетрапдротюфену і заміщеного тюфену, отриманої на стадії (а) (5), водною НСІ для перетворення заміщеного тетрапдротюфену на заміщений тюфен, Даний винахід відноситься, головним чином, до синтезу заміщених тюфенів і, зокрема, до 3карбометокси-4,5-диметилтюфену, який є проміжним продуктом для сімейства фунгіцидів В іншому аспекті, даний винахід відноситься до нової сполуки, яка є попередником тюфенових проміжних продуктів Одним фунгіцидом, який може бути отриманий з проміжного продукту, є 4,5-диметил-І\І-2пропеніл-2-(триметилсиліл)-3-тюфенкарбоксамід, який заявлений як нова сполука в патенті U S №5,486,621 Там наведені два способи отримання такої сполуки Інший спосіб описаний в патенті U S №5,498,630, який стосується у більш повному загальному вигляді боротьби з випріванням рослин шляхом застосування фунгіциду Один споріднений тюфеновий фунгіцид описаний в Прикладі 271, разом зі способом отримання такої сполуки Описаний ряд способів отримання тюфенових сполук Один спосіб, який стосується способу даного винаходу, описаний, наприклад, в SYNLETT, листопад 1995, стор 1143 G M Coppola, R E Damon і Н Yu Цей спосіб передбачає взаємодію альфа-меркаптокетону з фосфор-заміщеним акрилатом в присутності основи з утворенням заміщеного дипдротюфенового кільця, з якого може бути отримане відповідне ароматичне тюфенове кільце Вважалося, що присутність фосфорвміщуючого радикала в 2-положенні була необхідна для здійснення реакції циклоприєднання Виявлено, що це не потрібно, але коли 3-положення заміщене, можлива реакція в присутності певних основ Новий спосіб може бути використаний для отримання тюфенових кілець, що мають різні замісни і де стадія (с) включає стадії (с) (1) додавання води і етилацетату до суміші заміщеного тюфену і водної НСІ зі стадії (Ь), (с) (2) фазового відділення органічної частини суміші вода-етилацетат-НСІ-тюфен зі стадії (с) (1), і (с) (3) промивання органічної частини, відділеної на стадії (с) (2), насиченим водним ІЧаНСОз, висушування Na2SO4 і упарювання етилацетату для одержання заміщеного тюфенового продукту 11 Тетрапдротюфен, що має формулу 7 і F 2 незалежно вибирають з групи, що склада? ється з Н, алкілу, арилу, заміщених алкілу або арилу і кільця, що об'єднує Ri і F?2, R3 вибирають з групи, що складається з Н, алкілу, арилу і їх заміщених похідних, Z являє собою CN або CO2R4, де R4 вибирають з групи, що складається з алкілу, арилу і їх заміщених похідних, Н, Na, Li, К і NhV, і А являє собою алкоксигрупу ки, включаючи такі цільової сполуки, як показано в описі нижче У одному аспекті предметом даного винаходу є новий спосіб утворення заміщених тюфенових кілець і похідних, таких як фунгіциди патенту U S №5,486 621 Новий спосіб передбачає взаємодію альфа-меркаптокетону, такого як З-меркапто-2бутанон, отриманого in situ з а-галогенкетону, такого як З-хлор-2-бутанон, з акрилатом, таким як метил-3-мето кс і акр и лат, в присутності основного алкоголяту, такого як NaOMe, при розчиненні в апротонному розчиннику, наприклад, толуолі Продуктом реакції є заміщений тетрапдротюфен, який може бути перетворений в ароматичний тюфен шляхом обробки кислотою В основному реакція може бути записана таким чином де Ri і R2 незалежно вибрані з водню, алкілу, арилу, їх заміщених похідних і кільця, утвореного з Ri і R2, що містить 5 - 7 атомів, X представляє відповідну групу, яку відщеплюють, таку як галоген (С1, Вг, І) або метансульфонілокси, R3 представляє член групи водню, алкілу, арилу і їх заміщених похідних, Z представляє CN або CO2R4, де R4 вибраний з групи, що складається з алкілу і арилу і їх заміщених похідних, Н, Na, Li, К і NH4+, і А пред ставляє алкоксигрупу, переважно С-і-Сє лінійну або розгалужену алкоксигрупу В іншому аспекті предметом даного винаходу є спосіб отримання фунгіцидного 4,5-диметил-К-2пропеніл-2-(триметилсиліл)-3-тюфенкарбоксаміду і споріднених сполук, в яких пропенільна група замінена С2-С4 розгалуженим або ЛІНІЙНИМ алкільним ланцюгом У ще одному аспекті предметом даного винаходу с попередник тюфенового проміжного продукту, як показано на схематичній діаграмі реакції, наведеної вище Атом сірки в заміщену тюфенову сполуку потрапляє з меркаптокетоном, що має формулу 57810 тону для отримання заміщеного тюфену, є акрилова сполука формули SK де Ri і F 2 визначені вище ? Переважні сполуки будуть визначатися заміщеннями, які погрібні для тюфену в 4- і 5положеннях У свою чергу, вони можуть бути заміщеннями, бажаними в фунгіциді або ІНШІЙ сполуці, для яких тюфен є проміжним продуктом Альтернативно Ri і F 2 можуть бути вибрані для ? полегшення їх заміни замісниками, які бажані в кінцевому хімічному продукті У переважному втіленні, Ri і F 2 с метилом ? Приклади інших меркаптокетонів включають, але не обмежуються, сполуки о Меркаптокетони, такі, як використані в даному винаході, ВІДОМІ в літературі, їх звичайно отримують шляхом обробки ВІДПОВІДНИХ галоген кетон і в (Eur J Med Chem - Chim Ther 1986 - 21, №6, crop 461 R Dubief, Y Robbe, J P Fernandez, G Subra, A Terol, J P Chapat, H, SentenacRoumanou, і М Fatome) в розчинниках NaSH або іншими джерелами сірки, або з кетонів шляхом обробки аміаком і елементарною сірою (Liebigs Ann Chem 1957, Bd 610, crop 25 F Asmger, M, Thiel, і I Kalzendorf) У деяких випадках, таких, як з З-меркапто-2-бутаноном, вихід виділених меркаптанів низький внаслідок розкладання продуктів в процесі очищення Для цілей даного винаходу було знайдено, що меркаптокетони, такі, як 3меркапто-2-бутанон, можуть бути отримані з агалогенкетонів, таких, як З-хлор-2-бутанон, в двофазній системі розчинників, що містить воду і неполярний органічний розчинник, такий, як толуол або гептан, в присутності NaSH Цільовий меркаптокетон потім виділяють з високим виходом і чистотою у вигляді розчину в органічному розчиннику після розділення фаз, уникаючи при цьому розкладання, пов'язаного з очищенням Вода може бути видалена з розчину меркаптокетону різними способами, такими, як азеотропна перегонка або контактування розчину з осушувачами, такими, як молекулярні сита, хлорид кальцію або сульфат натрію, до взаємодії з акриловою сполукою Акр і лати Другою сполукою, яку додають до меркаптоке Rx де R3 і Z мають значення, визначені вище, А вибирають з групи, що складається з алкоксигруп Вважається, що в 2-положениі необхідний фосфоровміщуючий радикал, щоб забезпечити утворення тюфенового кільця Знайдено, однак, що реакція може бути проведена з хорошими виходами тюфенового кільця, якщо радикал А знаходиться в 3-положенні і як каталізатор використовується ефективна основа Прикладами реакційноздатних радикалів А с алкоксигрупи У переважному втіленні А є метоксигрупой Приклади реакційноздатних акрилових сполук включають, але не обмежуються 'CN CCkEt МсО МсО та £Ю Тетрапдротюфеновий попередник Продукт реакції меркаптокетону і акрилової сполуки, описаний вище, є заміщеним тюфеном R Z де R-і, R2, R31 Z мають значення, вказані вище При певних умовах, продукт, повністю або частково, може бути ВІДПОВІДНИМ тетрапдротюфепом,тобто ОН •Z R включаючи всі його стереоізомери Його вважають новою сполукою Він може бути перетворений в тюфен шляхом реакції з кислотою, як буде показано в обговоренні нижче Умови реакції Реакцію а-галогенкетону з NaSH проводять в двофазній водно/органічній системі розчинників Так, готують розчин 1 - 1,25 еквіваленти NaSH у воді (10-30 ваг %) і об'єднують його з органічним розчинником, таким, як толуол або гептан (2 - 4 еквіваленти) в інертній атмосфері при сильному перемішуванні При доданні а-галогенкетону температуру суміші підтримують між приблизно 0°С і приблизно 30°С Коли реакція закінчується (0,54год) фазам дають можливість розділитися, і нижню, водну фазу відкидають Верхню, органічну фазу потім сушать шляхом азеотропної перегонки (30-50°С, 100-бООмм рт ст) або шляхом контактування з осушувачем, таким як молекулярні сита, хлорид кальцію або сульфат натрію протягом достатнього часу (від 15ХВ ДО ЗГОД) Реакцію меркаптокетону і акрилової сполуки проводять в присутності основного каталізатора Прикладами основних каталізаторів є алкоголяти, такі, як метилат натрію, трет-амілат натрію, третамілат калію і трет-бутилат калію, сильні амінові 57810 основи, такі, як діазабіциклоундецен, гідрид натрію, і гідроксиди лужних металів Основа переважно є алкоголятом Звичайно КІЛЬКІСТЬ ОСНОВНОГО каталізатора становить приблизно 0,025-0,2 еквіваленти по відношенню до КІЛЬКОСТІ меркаптокетону Виявлено, що великі КІЛЬКОСТІ основного каталізатора дають тюфен, хоч виходи нижче У переважних умовах продукт містить значну частину тетрапдротюфену Хоч це і не обговорюється як істотне, реакція буде проводитися, якщо реагенти розчинені в розчиннику, переважно вуглеводневому розчиннику, такому, як толуол, або іншому апротонному розчиннику, такому, як хлорбензол, гептан або ксилол Реакція може бути проведена при температурах в межах приблизно 0-50°С Обробку продукту реакції кислотою для перетворення будь-якого тетрапдротюфену в тюфен переважно проводять при приблизно 0-50°С Виділення заміщеного тюфену з реакційної суміші може бути зроблене, щонайменше, двома способами По-перше, тетрагідротіофен виділяють шляхом відділення його від реакційної суміші і потім взаємодії його з кислотою для перетворення в тюфен За другим способом тетрагідротіофен реагує з кислотою in situ з подальшим виділенням продукту у вигляді тюфену Перший спосіб виділення буде включати, щонайменше, наступні стадії До реакційної суміші додають розбавлену сірчану кислоту, щоб нейтралізувати реакційну суміш Потім додають розчинник, такий, як етилацетат, і воду, і органічну фазу розділяють Органічну фазу, яка містить продукт реакції, промивають водним розсолом Після цього промиту органічну фазу сушать, наприклад, шляхом контактування з сульфатом натрію, і розчинник упарюють, отримуючи суміш заміщеного тетрапдротюфену і заміщеного тюфену Цю суміш обробляють водною кислотою, такою, як концентрована НСІ, 50%-ва H2SO4 або 50%-ва фосфорна кислота, або безводною кислотою, такою, як безводна метан сульфокислота, для перетворення тетрапдротюфену в тюфен Після цієї реакції стадії, описані вище, можуть бути повторювані для виділення тюфенового продукту За другим способом заміщений тетрагідротіофен, перетворюють in situ в тюфен до початку першого відділення Спочатку до реакційної суміші додають водну кислоту, таку, як концентрована НСІ або 50%-ва H2SO4 для перетворення тетрапдротюфену в тюфен Потім водну і органічну фази розділяють, і розчинник упарюють Нарешті, сирий продукт може бути перегнаний для отримання очищеного заміщеного тюфену Тюфенові проміжні продукти Продуктом даного винаходу є заміщений тюфен, який є проміжним продуктом для отримання сімейства, заснованого натюфені фунгіцидів, описаних в патенті U S №5,498,630 і, зокрема, 4,5диметил-І\І-2-пропеніл-2-(триметилсиліл)-3тюфенкарбоксаміду, описаного і заявленого в патенті U S №5,486,621 Зміст КОЖНОГО З ЦИХ патентів 5,498,630 і 5,486,621 даний тут як посилання Такі фунгіциди застосовні для боротьби з випріванням рослин, що викликається ґрунтовими гриб 8 ками Gaeumannomyces grammis Ці грибки заражають коріння певних рослин, зокрема, хлібних злаків, таких, як пшениця і ячмінь Тюфенові проміжні продукти представлені формулою R де R-і, R2, R3 1 Z мають значення, визначені вище У переважному фунгіциді Ri і R2 представляють метил, R3 представляє триметилсиліл (БіМез) І Z представляє СОЫН-СНгСН^СНг Це, як правило, вимагає, щоб R3, який в початковій акриловій сполуці переважно представляє водень, повинен бути замінений триметилсилільним радикалом або іншим бажаним замісником Це може бути досягнуте шляхом обробки вищезгаданого тюфенового проміжного продукту, де Z представляє СОгЦ сильною основою, з подальшою обробкою триметилсилілхлоридом Звичайно, Z може бути радикалом складного ефіру карбонової кислоти Таким чином, гідроліз радикала складного ефіру карбонової кислоти до відповідної LI-СОЛІ з подальшим силілуванням, як описано вище, і подальшим перетворенням в амід стандартними способами дають переважний фунгіцид Приклад 1 Водний NaSH (1,1 еквіваленти) розбавляли водою до утворення 23,5%-вого розчину за вагою Цей розчин об'єднували з 3 еквівалентами толуолу в інертній атмосфері при сильному перемішуванні і охолоджували до 5°С До суміші додавали один еквівалент З-хлор-2-бутанону з такою швидкістю, щоб підтримувати температуру нижче за 10°С Це вимагало 2год Після додання, суміш перемішували при 5-10°С доти, поки по даним ГХ суміші не було виявлене повне в споживання хлорбутанону (від 15ХВ ДО 1ГОД) Перемішування припиняли, і фазам давали можливість розділитися Після СТОЯННЯ протягом 15хв водну фазу зливали і обробляли вибілювачем для окислення і дезодорування сполук сірки Верхню, органічну фазу, що містить біля 25% за вагою З-меркапто-2-бутанону, сушили над активованим молекулярним ситом 4А (біля 35г/кг розчину) протягом 1год Розчин 3меркапто-2-бутанону потім декантирували з молекулярного сита в реакційну посудину для наступної стадії Приклад 2 Толуольний розчин З-меркапто-2-бутанону з попередньої стадії (613г приблизно 25%-вого розчину) вміщували в чистий сухий реактор разом з 15г метил-3-мето кс і а крил ату Суміш нагрівали до 25°С, сильно перемішували і відразу обробляли твердим метилатом натрію (8,5г, біля 0,1еквів) Метил-3-метоксіакрилат (151г), що залишився, додавали з такою швидкістю, щоб підтримувалася температура при або нижче за 35°С (2год) Отриману суміш залишали охолоджуватися до кімнатної температури і перемішували 21 год До суміші додавали концентровану соляну кислоту (88г) за ЗОхв, так, щоб температура не перевищувала 35°С Отриману суміш ретельно перемішували 2год, потім обробляли 73г води і перемішували ще 57810 10 толуолі і додавали 0,1 еквіваленти NaOMe як каталізатор Реакцію проводили при кімнатній температурі в атмосфері азоту 3 - 4 години Потім суміш виливали в розбавлену сірчану кислоту і екстрагували етилацетатом Органічну фазу промивали розсолом і потім сушили над сульфатом натрію, фільтрували і упарювали Продукт був тетрапдротюфеновим попередником, описаним вище, тобто 2-метокси-3-карбометокси-4-пдрокси4'-метил-5-метил-тетрапдротюфеном Тетрапдротюфеновий попередник обробляли концентрованою НСІ при кімнатній температурі при швидкому перемішуванні Через 5 хвилин суміш виливали у воду і екстрагували етилацетатом Органічну фазу промивали насиченим ЫаНСОз, сушили над NaSO4, фільтрували і упарювали при кімнатній температурі на роторному випарнику, виділяючи ароматичний тюфеновий продукт, 3Приклад З карбометокси-4,5-диметилтюфен По одному еквіваленту кожного з 3-меркапто2-бутанону і метил-3-мето кс і а крил ату розчиняли в Юхв Фази залишили розділятися Після стояння протягом Юхв водну фазу зливали з реаісгора, а верхню, утримуючу продую" фазу, промивали 100г 5%-вого розчину бікарбонату натрію Після перемішування протягом 15хв фазам дали розділитися Нижню водну фазу зливали з реактора, а верхню, утримуючу продукт фазу, переносили в перегінну колбу Толуол відганяли на 5-тарілковій ДИСТИЛЯЦІЙНІЙ колоні при 100мм рт ст Після відбору невеликої фракції, що містить толуол та ІНШІ низько киплячі домішки, продукт, 3-карбометокси4,5-диметилтюфен, був перегнаний через колону при 50мм рт ст Було відібрано всього 202,4г продукту з чистотою 98,8% за даними вагового %-вого аналізу Це відповідає виходу 77% з розрахунку на З-хлор-2-бутанон і 82% з розрахунку на метил-3метоксіакрилат Комп'ютерна верстка М Клюкш Підписано до друку 05 08 2003 Тираж39 прим Міністерство освіти і науки України Державний департамент інтелектуальної власності, Львівська площа, 8, м Київ, МСП, 04655, Україна ТОВ "Міжнародний науковий комітет", вул Артема, 77, м Київ, 04050, Україна
ДивитисяДодаткова інформація
Назва патенту англійськоюSynthesis of 3-carbomethoxy-4,5-dimethylthiophene
Назва патенту російськоюСинтез 3-карбометокси-4,5-диметилтиофена
МПК / Мітки
МПК: C07D 333/40, C07D 333/32, C07D 333/38
Мітки: одержання, сполука, похідних, тіофену, проміжна, спосіб
Код посилання
<a href="https://ua.patents.su/5-57810-sposib-oderzhannya-pokhidnikh-tiofenu-ta-promizhna-spoluka.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання похідних тіофену та проміжна сполука</a>
Попередній патент: Спосіб безтраншейної заміни трубопроводів і пристрій для безтраншейної заміни трубопроводів
Випадковий патент: Диметил-[3-(пропоксикарбоніламіно)пропіл]амоній о-етилфосфонат









