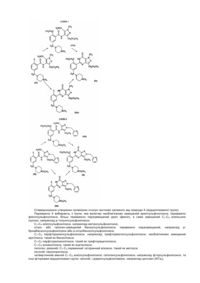
Спосіб одержання 1-[[3-(6,7-дигідро-1-метил-7-оксо-3-пропіл-1н-піразоло[4,3-d]піримідин-5-іл)-4-етоксифеніл]сульфоніл]-4-метилпіперазину та проміжні сполуки
Формула / Реферат
1. Спосіб одержання 1-[[3-(6,7-дигідро-1-метил-7-оксо-3-пропіл-1Н-піразоло[3,4-d]піримідин-5-іл)-4-етоксифеніл]сульфоніл]-4-метилпіперазину формули (ІА)
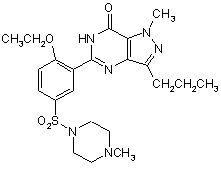 , (IA)
, (IA)
який включає взаємодію сполуки формули (IIА)
 (IIA)
(IIA)
з -OR, де R означає СН2СН3 і Х означає відщеплювану групу,
при умові, що Х не є етокси.
2. Спосіб згідно з п. 1, в якому Х вибирають з групи, яка включає арилсульфонілокси, С1-C4алкілсульфонілокси, нітро- або галогензаміщений бензолсульфонілокси, С1-С4перфторалкілсульфонілокси, необов'язково заміщений ароїлокси, С1-С4перфторалканоїлокси, С1-С4алканоїлокси, галоген, діазоній, С1-С4первинний і вторинний алкокси, оксоній, перхлорилокси, четвертинний амоній С1-С4алкілсульфонілокси, галогенсульфонілокси, галоній і діарилсульфоніламіно,
при умові, що Х не є етокси.
3. Спосіб згідно з п. 2, в якому Х означає галоген або метокси.
4. Спосіб згідно з п. 3, в якому Х означає фтор, хлор або метокси.
5. Спосіб згідно з п. 4, в якому Х означає фтор або хлор.
6. Спосіб згідно з будь-яким з попередніх пунктів, в якому -OR присутній разом з допоміжною основою.
7. Спосіб згідно з п. 6, в якому допоміжну основу вибирають з групи, яка включає стерично утруднені основи, солі металу 1-метилпіперазину (особливо переважні), 1-етилпіперазину, морфолін, гідрид металу, оксид металу, карбонат металу і бікарбонат металу.
8. Спосіб згідно з п. 7, в якому стерично утрудненою основою є сіль металу стерично утрудненого спирту або аміну.
9. Спосіб згідно з п. 8, в якому сіль металу стерично утрудненого спирту або аміну вибирають з групи, яка включає вторинний або третинний С4-С12алканол, С3-С12циклоалканол і вторинний або третинний (С3-С8циклоалкіл)С1-С6алканол, N-(вторинний або третинний С3-С6алкіл)-N-(первинний, вторинний або третинний С3-С6алкіл)амін, N-(С3-С8циклоалкіл)-N-(первинний, вторинний або третинний С3-С6алкіл)амін, ди(С3-С8циклоалкіл)амін або гексаметилдисилазан, 1,5-діазабіцикло[4.3.0]нон-5-ен, 1,8-діазабіцикло[5.4.0]ундец-7-ен і третинні аміни, такі як триетиламін.
10. Спосіб згідно з п. 9, в якому допоміжною основою є сіль металу третинного алканолу.
11. Спосіб згідно з будь-яким з попередніх пунктів, в якому реакцію проводять в інертному розчиннику або ROH, або в суміші обох.
12. Спосіб згідно з п. 11, в якому розчинник вибирають з групи, яка включає етанол, н-пропанол, вторинний або третинний С4-С12алканол, С3-С12циклоалканол, третинний С4-С12циклоалканол, вторинний або третинний (С3-С7циклоалкіл)С2-С6алканол, С3-С9алканон, 1,2-диметоксіетан, 1,2-діетоксіетан, диглім, тетрагідрофуран, 1,4-діоксан, толуол, ксилол, хлорбензол, 1,2-дихлорбензол, ацетонітрил, диметилсульфоксид, сульфолан, диметилформамід, N-метилпіролідин-2-он, піридин і їх суміші.
13. Спосіб згідно з п. 12, в якому розчинник вибирають з групи, яка включає етанол, н-пропанол, третинний С4-С12алканол, третинний С4-С12циклоалканол, третинний (С3-С7циклоалкіл)С2-С6алканол, С3-С9алканон, 1,2-диметоксіетан, 1,2-діетоксіетан, диглім, тетрагідрофуран, 1,4-діоксан, толуол, ксилол, хлорбензол, 1,2-дихлорбензол, ацетонітрил, сульфолан, диметилформамід, N-метилпіролідин-2-он, піридин і їх суміші.
14. Спосіб згідно з п. 13, в якому розчинником є етанол.
15. Спосіб одержання сполуки формули (ІА) згідно з будь-яким з попередніх пунктів, який включає реакцію сполуки формули (IIА) з ZOR або з ROH і допоміжною вищевказаною основою або з ZOR і допоміжною основою, де ZOR означає сіль OR, a Z означає катіон.
16. Спосіб згідно з п. 15, в якому сполуку (ІА) одержують реакцією сполуки (IIА):
а) з етанолом і допоміжною основою, необов'язково в інертному розчиннику; або
б) з ZOEt і допоміжною основою в етанолі або в інертному розчиннику або в обох; або
в) з ZOEt і етанолом або з інертним розчинником або з обома.
17. Спосіб згідно з будь-яким з попередніх пунктів, в якому сполуку формули (IIА) одержують за допомогою реакції конденсування сполуки формули (VIІА)
 (VIIA)
(VIIA)
із сполукою формули (ІХА)
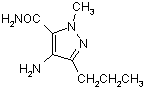 (IXA).
(IXA).
18. Спосіб згідно з п. 17, в якому сполуку формули (VIІА) одержують за допомогою реакції конденсування сполуки формули (VIA) з N-метилпіперазином
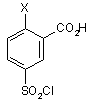 (VIA).
(VIA).
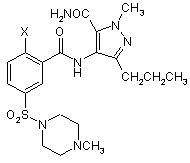
19. Сполука формули (IIА)
 , (IIA)
, (IIA)
де Х є таким як визначено в будь-якому з пунктів 1-5.
20. Сполука згідно з п. 19, в якій Х вибирають з групи, яка містить фтор, хлор і метокси.
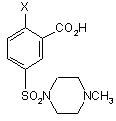
21. Сполука формули (IIІА)
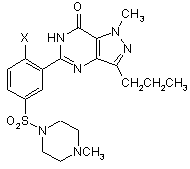 , (IIIA)
, (IIIA)
де Х є таким як визначено в будь-якому з пунктів 1-5.
22. Сполука згідно з п. 21, в якій Х вибирають з групи, яка містить фтор, хлор і метокси.
23. Сполука формули (VIIA)
 , (VIIA)
, (VIIA)
де Х є таким як визначено в будь-якому з пунктів 1 - 5.
24. Сполука згідно з п. 23, в якій Х вибирають з групи, яка містить фтор, хлор і метокси.
Текст
Винахід стосується способу одержання 1-[[3-(6,7-дигідро-1-метил-7-оксо-3-пропіл-1Н-піразоло[4,3d]піримідин-5-іл)-4-етоксифеніл]сульфоніл]-4-метилпіперазину (також відомого як силденафіл або Віагра™) та 1-етил-4-{3-[3-етил-6,7-дигідро-7-оксо-2-(2-піридилметил)-2Н-піразоло[4,3-d]піримідин-5-іл]-4пропоксифенілсульфоніл}піперазину і основних проміжних сполук для їх одержання. Було виявлено, що 1-[[3-(6,7-дигідро-1-метил-7-оксо-3-пропіл-1Н-піразоло[4,3-d]піримідин-5-іл)-4етоксифеніл]сульфоніл]-4-метилпіперазин (також відомий як силденафіл), між іншим, особливо придатний у лікуванні чоловічої еректильної дисфункції (WO-A-94/28907), і спосіб його одержання описаний у ЕР-АО463756 (приклад 12) та в Drugs of the Future 1997, 22(2): 138-143. Удосконалений спосіб одержання силденафілу (порівняно з описаним у ЕРО463756) описується в ЕР-А-0812845, він відрізняється кінцевою стадією, на якій здійснюють циклізацію в основних, нейтральних або кислих умовах з одержанням силденафілу. Спосіб одержання 1-етил-4-{3-[3-етил-6,7-дигідро-7-оксо-2-(2-піридилметил)-2Н-піразоло[4,3d]піримідин-5-іл]-4-пропоксифенілсульфоніл}піперазину описаний у WO 98/49166 (приклад 5В). Автори даного винаходу розробили спосіб одержання силденафілу та 1-етил-4-{3-[3-етил-6,7-дигідро-7оксо-2-(2-піридилметил)-2Н-піразоло[4,3-d]піримідин-5-іл]-4-пропоксифенілсульфоніл}піперазину, який має переваги порівняно з вищеназваними способами, відомими з рівня техніки. Даний винахід стосується способу одержання сполуки формули (ІА) і (IB) який включає взаємодію сполуки формули (llА) і, відповідно, (ІІВ) у присутності OR, де R у випадку утворення сполуки (ІА) означає СН2СН3, а у випадку утворення сполуки (IB) R означає СН2СН2СН3, де X означає відщеплювану групу: Особлива перевага запропонованого способу порівняно з відомими способами полягає у зменшенні кількості стадій завдяки проведенню реакцій заміщення та замикання кільця в одному реакційному об'ємі. Ще одним аспектом даного винаходу є проміжні сполуки загальної формули (llА) і (llВ). Було виявлено, що основна проміжна сполука загальної формули (ІІІА) і (lllB) (див. наведені далі схеми 1 і 2) бере участь у різних реакціях, і ці реакції принаймні частково проходять через циклізацію з наступним нуклеофільним заміщенням. Відповідно, ще одним аспектом даного винаходу є проміжні сполуки загальної формули (ІІІА) і (ІІІВ) (де X означає відщеплювану групу). Також була виявлена ще одна основна проміжна сполука формули IVA і IVB, при цьому зауважено, що у цьому випадку перед циклізацією також має місце нуклеофільне заміщення (і такі нові проміжні сполуки становлять ще один аспект даного винаходу). Таким чином, пропонуються такі схеми одерджання сполук (ІА) і (IB) Співвідношення утворених проміжних сполук частково залежить від природи X (відщеплюваної групи). Переважно X вибирають з групи, яка включає необов'язково заміщений арилсульфонілокси, переважно фенілсульфонілокси, більш переважно паразаміщений арил (феніл), а саме заміщений С1-С4 алкільною групою, наприклад р-толуолсульфонілокси; С1-С4 алкілсульфонілокси, наприклад метансульфонілокси; нітро- або галоген-заміщений бензолсульфонілокси, переважно паразаміщений, наприклад рбромбензолсульфонілокси або р-нітробензолсульфонілокси; С1-С4 перфторалкілсульфонілокси, наприклад трифторметилсульфонілокси; необов'язково заміщений ароїлокси, такий як бензоїлокси; С1-С4 перфторалканоїлокси, такий як трифторацетилокси; С1-С4 алканоїлокси, такий як ацетилокси; галоген; діазоній; С1-С4 первинний і вторинний алкокси, такий як метокси; оксоній; перхлорилокси; четвертинний амоній С1-С4 алкілсульфонілокси; галогенсульфонілокси, наприклад фторсульфонілокси, та інші фторовані відщеплювані групи; гапоній; і діарилсульфоніламіно, наприклад дитозил (NTs2). Переважно X означає галоген (фтор, хлор, бром або йод) або метокси, і найбільш переважно він означає фтор або хлор. Було виявлено, що останній дає змогу одержати особливо високий вихід продукту, при цьому можуть легко використовуватися недорогі комерційно доступні вихідні матеріали (хлор- і фторбензойна кислота). Для зручності -ОСН2СН3 і -OCH2CH2CH3 (описані для першого аспекту даного винаходу) згадуються у цьому описі як -OR. -OR може поводити себе як нуклеофіл (для заміщення відщеплюваної групи за механізмом нуклеофільного заміщення) і як основа (для зумовлення циклізації). OR може утворюватися у розчині із солі ZOR (де Ζ означає катіон), такої як сіль металу. Сіль -OR лужного (такого як натрій або калій) або лужноземельного металу у придатному розчиннику може давати особливе збільшення кількості іонів OR у розчині. Наприклад, етоксид натрію (Na+- OEt) у придатному розчиннику з проміжною сполукою (llА) утворюють силденафіл. У іншому варіанті -OR утворюється insitu з ROH плюс допоміжна основа (а саме, основа, інша, ніж -OR). Проте, в іншій реакційній системі може використовуватися ZOR з допоміжною основою. Кращими варіантами реалізації винаходу є такі: 1. синтез сполуки (ІА) реакцією сполуки (llА): a) з етанолом і допоміжною основою, необов'язково в інертному розчиннику; b) з ZOEt і допоміжною основою в етанолі або інертному розчиннику або в обох; c) з ZOEt і етанолом або з інертним розчинником або з обома, синтез сполуки (IB) реакцією сполуки (ІІВ): d) з пропанолом і допоміжною основою, необов'язково в інертному розчиннику; є) з ZOPr і допоміжною основою у пропанолі або інертному розчиннику або в обох; f) з ZOPr і пропанолом або з інертним розчинником або з обома. Зрозуміло, що розчинником, в якому проходить реакція, може бути ROH або інертний розчинник (або Їх суміш). Під інертним розчинником мається на увазі розчинник, в якому в реакційних умовах не утворюється нуклеофіл, або, якщо нуклеофіл утворюється, він достатньою мірою блокований, внаслідок чого практично не бере участі у реакції заміщення. Коли в якості джерела -OR використовують ROH, крайньої потреби в окремому розчиннику не існує, проте, в реакції в якості співрозчинника може використовуватися (допоміжний) інертний розчинник (а саме розчинник, відмінний від ROH). Придатними є такі розчинники: етанол (для ІА), пропанол (для IB) (n-пропанол), вторинний або третинний С4-С12 алканол, С3-С12 циклоалканол, третинний С4-С12 циклоалканол, вторинний або третинний (С3-С7 циклоалкіл)С2-С6 алканол, а С3-С9 алканон, 1,2-диметоксиетан, 1,2-діетоксиетан, диглім, тетрагідрофуран, 1,4-діоксан, толуол, ксилол, хлорбензол, 1,2-дихлорбензол, ацетонітрил, диметилсульфоксид, сульфолан, диметилформамід, Nметилпіролідин-2-он, піридин і їх суміші. У способі даного винаходу може застосовуватися ряд допоміжних основ. Як правило, основи не повинні конкурувати з -OR в реакціях нуклеофільного заміщення X (а саме вони є ненуклеофільними), так як вони відповідно стерично блоковані. Згідно з винаходом перевага надається основам, вибраним з групи, яка включає солі металів стерично блокованих спиртів або амінів, таких як вторинний або третинний С4-С12 алканол, С3-С12 циклоалканол і вторинний або третинний (С3-С8 циклоалкіл)С1-С6 алканол, N-(вторинний або третинний С3-С6 алкіл)-N-(первинний, вторинний або третинний С3-С6 алкіл)амін, N-(C3-C8 циклоалкіл)-N(первинний, вторинний або третинний С3-С6 апкіл)амін, ди(С3-С8 циклоалкіл)амін або гексаметилдисилазан; солі металів 1-метилпіперазину (особливо для сполуки ІА), 1-етил піперазину (особливо для сполуки IB) і морфоліну; 1,5-діазабіцикло[4,3,0]нон-5-ен і 1,8-діазабіцикло[5,4,0]ундец-7-ен; третинні аміни, такі як триетиламін; гідрид металу, оксид, карбонат, і бікарбонат. Переважно метал у солі ZOR і допоміжну основу незалежно вибирають з лужних металів (літій, натрій, калій, рубідій, цезій) або лужноземельних металів (берилій, магній, кальцій, стронцій, барій). Більш переважно таким металом є натрій або калій. Переважно допоміжну основу вибирають з групи, яка включає солі металів стерично блокованого спирту або аміну, такого як вторинний або третинний С4-С12 алканол, С3-С12 циклоалканол і вторинний або третинний (С3-С8 циклоалкіл)С1-С6 алканол, N-(вторинний або третинний С3-С6 алкіл)-N-(первинний, вторинний або третинний С3-C6 алкіл)амін, N-(С3-С8 циклоалкіл)-N-(первинний, вторинний або третинний С3-С8 алкіл)амін, ди(С3-С8 циклоалкіл)амін або гексаметилдисилазан; 1,5-діазабіцикло[4,3,0]нон-5-ен і 1,8-діазабіцикло[5,4,0]ундец-7-ен; гідрид, оксид, карбонат і бікарбонат металу. Ще більш переважно допоміжну основу вибирають із стерично блокованих основ, вказаних у попередньому абзаці (а саме із всіх вказаних, за винятком гідриду, оксиду, карбонату і бікарбонату металу). Найбільш переважно допоміжною основою є сіль металу третинного С4-С6 спирту, така як солі лужного або лужноземельного металу (наприклад, Na/K) t-бутанолу або t-амілового спирту. Відповідно до винаходу з метою максимального збільшення виходу продукту також бажано використовувати принаймні один молярний еквівалент (прийнятним є півтора еквіваленти) допоміжної основи і OR. Якщо -OR також функціонує як основа, переважним є використання двох еквівалентів (більш переважно трьох еквівалентів) -OR. Таким чином, наприклад, у вказаних вище варіантах реалізації винаходу, яким надається перевага, від (а) до (f), використовується переважно принаймні 2 еквіваленти допоміжної основи і принаймні один еквівалент EtOH або РrOН (відповідно а і d), переважно принаймні 1 еквівалент допоміжної основи і принаймні 1 еквівалент ZOEt або ZOPr (відповідно b і є) і переважно принаймні 2 еквіваленти ZOEt або ZOPr (відповідно с і f). Еквіваленти вказані відносно молярних кількостей ІІА або І IB. Природа відщеплюваної групи (X) може впливати на хід реакції. Наприклад, як показано на схемі 1 для сполуки (ІА), коли X=F, реакція головним чином проходить за участю проміжної сполуки, представленої формулою (IVA), але, коли X=СІ, відбувається зсув у ході реакції, головним чином у бік проміжної сполуки (ІІІА), і, коли X=ОСН3, проміжна сполука формули (ІІІА) утворюється у більшій кількості, ніж проміжна сполука формули (IVA). Однак, утворенню кінцевих сполук формул (ІА) і (IB) із проміжних сполук формул (ІІІА) і, відповідно, (ІІІВ) може сприяти забезпечення вищої температури та збільшення проміжку часу на утворення кінцевого продукту. Переважно основну реакцію проводять при температурі від 50°С до 170°С. Таким чином, коли X=F, температура реакції може становити приблизно від 50°С переважно до 60°С, при цьому кількість утворюваного кінцевого продукту буде дуже хорошою. У випадку, коли Х=СІ , вихід кінцевого продукту збільшиться завдяки температурі переважно від 60 до 170°С, більш переважно щонайменше 80°С, точніше (від 80°С до 110°С); і у випадку, коли Х=ОСН 3, вихід кінцевого продукту збільшиться завдяки температурі щонайменше 80°С, більш переважно щонайменше 110°С (а саме від 110°С до 140°С). Сполуки загальної формули (НА) і (ІІВ) можуть бути одержані з легко доступних вихідних матеріалів, наприклад, з допомогою способу, представленого на наведених далі схемах реакцій. Реакційна схема 3 ілюструє одержання сполуки (ІА), а схема 4 ілюструє одержання сполуки (IB). Як показано на схемі 3, проміжну сполуку формули (VIA) одержують із заміщеної (а саме, група X) похідної бензойної кислоти реакцією з хлорсульфокислотою. Після цього проміжну сполуку (VIA) вводять у взаємодію з N-метилпіперазином у присутності основи, такої як третинний амін, більш переважно триетиламін, і придатного розчинника, такого як ацетон або вода, з одержанням проміжної сполуки (VIIA). (llА) одержують реакцією проміжної сполуки (VIІ А) з 4-аміно-1-метил-3-пропіл-1Н-піразол-5-карбоксамідом (сполука ІХА) у присутності зв'язуючої речовини, такої як 1-(3-диметиламінопропіл)-3-етил карбодіімідгідрохлорид, і, за необхідності, також у присутності основи і/або каталізатора. У одному з прикладів систем взаємодії карбоксильну кислу функціональну групу сполуки (VIІ А) перш за все активують з використанням приблизно 5% надлишку реагенту, такого як Ν,Ν -карбонілдіімідазол (в якості зв'язуючої речовини) у придатному розчиннику, наприклад етилацетаті, при температурі приблизно від кімнатної до приблизно 80°С, з наступною реакцією проміжної сполуки імідазоліду з (ІХА) при температурі приблизно від 20 до приблизно 60°С. У іншому прикладі проміжна сполука (VIIA) може вступати в реакцію сполучення з піразолом (ІХА) у присутності 1-гідроксибензотриазолу, триетиламіну і 1-(3-диметиламінопропіл)-3-етилкарбодіімід гідрохлориду. Сполуку (ІХА) одержують відновленням 1-метил-4-нітро-3-пропіл-1Н-піразол-5 карбоксаміду (VIIA), а саме гідруванням у присутності of 5% паладію на вугіллі. Сполука (IB) (схема 4) може бути одержана аналогічним способом, описаним для сполуки (ІА). Більше того, проміжну сполуку (VIIB) одержують реакцією сполуки (VIA) з N-етилпіперазином; і проміжну сполуку (ІІВ) одержують реакцією сполучення проміжних сполук формул (VIІ В) і (ІХВ). Проміжні сполуки загальних формул (VIІА) і (VIІ В) є новими і становлять ще один аспект даного винаходу (де X має вказані вище значення) Далі винахід проілюстровано лише з посиланням на наведені нижче приклади. Приклад 1: (1а) 5-Хлорсульфоніл-2-фторбензойна кислота (Сполука VIA. X=F) До хлорсульфокислоти (320г) протягом 15 хвилин додавали комерційно доступну 2-фторбензойну кислоту (75г, 0.54моль), перемішували протягом 30 хвилин, після чого нагрівали до 90°С протягом 4,5 годин. Після того, як реакційна суміш охолоджувалась, її гасили льодом і водою (1.5кг/324мл) і гранулювали протягом 1 години. Продукт, що випадав в осад, фільтрували, промивали водою і сушили при 50°С у вакуумі з одержанням вказаної у заголовку сполуки (99.7г, 78.1%) у вигляді білої твердої речовини. (1b) 2-Фтор-5-(4-метил-1-піперазинілсульФоніл)бензойна кислота (Сполука VllА. X=F Розчин 5-хлорсульфоніл-2-фторбензойної кислоти (47.72г, 0.2моль) в ацетоні (250мл) додавали до суміші N-метилпіперазину (22.04г, 0.22моль) і триетиламіну (24.29г, 0.24моль), і реакційну суміш перемішували при температурі навколишнього середовища протягом трьох годин. Суміш фільтрували, одержану тверду речовину перекристалізовували з води з одержанням вказаної у заголовку сполуки (14.63г, 24.2%) у вигляді білої твердої речовини, d (DMSO): 2.30 (3Н, s), 2.58 (4Н, m), 2.95 (4Н, m), 7.52 (1Н, m), 7.90 (1Н, m), 8.10 m/z (знайдено: 303 [М+Н]+, 100%, Підраховано для C12H16FN2O4S: 303). (1с) 4-Аміно-1-метил-3-пропіл-1Н-піразол-5-карбоксамід Перемішувану суспензію 1-метил-4-нітро-3-пропіл-1Н-піразол-5-карбоксаміду (ЕР-А-0463756; 237.7г, 1.12моль) і 5% паладію на вугіллі (47.5г) в етилацетаті (2.02 1) гідрували при 344.7кПа (50псі) і 50°С протягом 4 годин, доки не припинялось поглинання водню. Холодну реакційну суміш фільтрували, після чого фільтр промивали етилацетатом, одержуючи таким чином з фільтрату і продуктів промивання розчин вказаної у заголовку сполуки в етилацетаті (ЕР-А-0463756), достатньо чистої для безпосереднього використання на наступних стадіях реакції. (1d) 4-[2-Фтор-5-(4-метил-1-піперазинілсульфоніл)бензамідо]-1-метил-3-пропіл-1Н-піразол-5-карбоксамід. (Сполука НА, X=F) 4-аміно-1-метил-3-пропіл-1Н-піразол-5-карбоксамід (1.27г, 6.94ммоль) додавали до суспензії 2-фтор-5-(4метил-1-піперазинілсульфоніл)бензойної кислоти (2.0г, 6.94ммоль), триетиламіну (0.70г, 6.92ммоль), 1-(3диметиламінопропіл)-3-етилкарбодіімід гідрохлориду (1.33г, 6.94ммоль) і 1-гідроксибензотриазолу (0.94г, 6.96ммоль) у суміші етилацетату (20мл) і дихлорметану (20мл). Реакційну суміш перемішували протягом 12 годин при температурі навколишнього середовища. Реакційну суміш упарювали до масла і очищали з допомогою колонкової хроматографії (на силікагелі, 30:70, метанол:етилацетат). Одержану вказану у заголовку сполуку далі очищали розчиненням її в дихлорметані і промиванням насиченим розчином бікарбонату натрію. Органічний розчин упарювали у вакуумі з одержанням твердої речовини, яку сушили (40°С) з одержанням вказаної у заголовку сполуки (2.1г, 64.8%) у вигляді білої твердої речовини. т. пл. 210-212°С. Знайдено: С.51.15; Н, 5.81; N, 17.90. Підраховано для C20H27FN6O4S: С, 51.49; Η, 5.83; Ν, 18.01. d (CDCI3): 0.95 (3Η, t), 1.62 (2H, m), 2.30 (3H, s), 2.50 (6H, m), 3.10 (4H, m), 4.10 (3H, s), 7.41 (1H, m), 8.00 (2H, m), 8.50 (1H, m). m/z (знайдено: 467.18909 ([M+H]+, 37%), Підраховано для C20H28N6O4SF: 467.1890). (1е) 1-[[3-(6,7-дигідро-1-метил-7-оксо-3-пропіл-1Н-піразоло[4.3-d]піримідин-5-іл)4-етоксифеніл]сульфонал]4-метилпіперазин. (Сполука ІА) До суспензії сполуки з прикладу (1d) (1.00г, 2.20ммоль) в етанолі (5мл) додавали трет.-бутоксид калію (0.74г, 6.60ммоль), і суміш кип'ятили зі зворотним холодильником протягом 48 годин. Реакційну суміш упарювали до масла і очищали розчиненням в дихлорметані і промиванням насиченим розчином бікарбонату натрію. До органічного розчину протягом 10 хвилин додавали гексан, випалий в осад твердий продукт фільтрували і сушили з одержанням вказаної у заголовку сполуки (1.1г, 100%) у вигляді білої твердої речовини. В результаті перекристалізації вказаної у заголовку сполуки з етилацетату одержують тверду речовину, що має т. пл. 184-186°С. Знайдено: С, 55.49; Н, 6.35; N, 17.72. Підраховано для C22H31N6O4S: С, 55.58; Н, 6.53; N, 17.68. d (DMSO) : 0.96 (3Н, t), 1.30 (3Н, t), 1.72 (2Н, m), 2.13 (3Н, s), 2.36 (4Н, m), 2.72 (2Н, t), 2.90 (4Н, m), 4.18 (5Н, m), 7.32 (1Н, d), 7.80 (2Н, m). m/z (знайдено: 475.214800 ([М+Н]+, 100%). Підраховано для C22H31N6O4S: 475.212751). Реакція майже повністю проходила за участю проміжної сполуки IVA, і завершилась менше ніж через 48 годин. Приклад 2: (2а) 2-Хлор-5-хлорсульфонілбензойна кислота (Сполука VIA. Х=Сl) До хлорсульфокислоти (320г) при інтенсивному перемішуванні порціями додавали комерційно доступну 2хлорбензойну кислоту (80.0г), (0.5моль). Реакційну суміш нагрівали до 95°С протягом 6 годин, після чого охолоджували протягом ночі до кімнатної температури. Розчин гасили льодом і водою (1.5кг/324мл) і перемішували протягом 15 хвилин. Продукт, що випадав в осад, фільтрували, промивали водою і сушили при 50°С у вакуумі з одержанням вказаної у заголовку сполуки (111.1г, 85.2%) у вигляді білої твердої речовини, що має т. пл. 140°С. d (CDCI3): 7.42 (1Н, m), 8.27 (1Н, m), 8.75 (1Н, m). (2b) 2-Хлор-5-(4-метил-1-піперазинілсульфоніл)бензойна кислота (Сполука VIIA, Х=СІ) Вищевказану сполуку одержували додаванням 2-хлор-5-хлорсульфонілбензойної кислоти до 1.25моль еквіваленту N-етилпіперазину у воді (3мл/г) в кислотних умовах. Після цього вказану у заголовку сполуку ізолювали у вигляді твердої речовини (81.7%). В результаті перекристалізації вказаної у заголовку сполуки із суміші ацетон: вода одержували тверду речовину, що має т. пл. 304-6°С і наступні характеристики: Знайдено: С, 45.16; Н, 4.71; N, 8.64. Підраховано для С12Н15СІN2O4S-дв: С, 45.21; Н, 4.71; N, 8.79. d (DMSO): 2.20 (3Н, s), 2.50 (4Н, m), 2.95 (4Н, m), 6.75 (2Н, m), 9.95 (1Н, s), m/z (знайдено: 319 [М+Н]+, 100% Підраховано для C12H16CIN2O4S: 319). (2с) 4-[2-Хлор-5-(4-метил-1-піперазинілсульооніл)бензамідо]-1-метил-3-пропіл-1Н-піразол-5-карбоксамід. (Сполука llА, Х=СІ) До суспензії 2-хлор-5-(4-метил-1-піперазинілсульфоніл)бензойної кислоти (5.0г, 15.68ммоль), триетиламіну (1.59г, 15.68ммоль), 1-(3-диметиламінопропіл)-3-етилкарбодіімід гідрохлориду (3.00г, 15.68ммоль) і 1-гідроксибензотриазолу (2.12г, 15.68ммоль) в дихлорметані (50мл) додавали 4-аміно-1-метил3-пропіл-1Н-піразол-5-карбоксамід (2.86г, 15.68ммоль) (приклад 1с). Реакційну суміш перемішували протягом 48 годин при температурі навколишнього середовища, додавали ще одну порцію 1-(3-диметиламінопропіл)-3етил карбодіімід гідрохлориду (1.00г, 5.2ммоль), і реакційну суміш перемішували протягом додаткових 48 годин при температурі навколишнього середовища. Реакційну суміш промивали насиченим розчином бікарбонату натрію, і до відокремленого органічного розчину протягом десяти хвилин додавали етилацетат. Суміш перемішували протягом десяти хвилин, а випалий в осад твердий продукт фільтрували і сушили з одержанням вказаної у заголовку сполуки (6.0г, 81%). т. пл. 105-107 °С. d (DMSO): 0.90 (3Н, t), 1.60 (2Н, m), 2.13 (3Н, s), 2.40 (4Н, m), 2.50 (2Н, m), 2.95 (4Н, m), 3.90 (3H, s), 7.30 (1Н, s), 7.82 (4Н, m), 10.0 (1Н, s). m/z (знайдено: 505.140303 ([M+Na]+, 28%). Підраховано для C20H27CIN6O4SNa: 505.140073). (2d) 1-[[3-(6,7-дигідро-1-метил-7-оксо-3-пропіл-1Н-піразоло[4.3-d]піриміаин-5-іл)-4етоксифеніл]сульфонал]-4-метилпіперазин. (Сполука ІА) До суспензії сполуки з прикладу 2(с) (2.00г, 4.25ммоль) в етанолі (20мл) додавали трет.-бутоксид калію (1.43г, 12.75ммоль), і суміш кип'ятили зі зворотним холодильником протягом 48 годин. Показник рН реакційної суміші доводили до 6 з допомогою 1N соляної кислоти, випалу в осад тверду речовину фільтрували і сушили з одержанням вказаної у заголовку сполуки. В результаті перекристалізації вказаної у заголовку сполуки з метилізобутилкетону одержували тверду речовину, що має т. пл. 188°С. d (CDCI3): 1.01 . (3Н, t), 1.62 (3Н, t), 1.88 (2Н, m), 2.30 (3Н, s), 2.50 (4Н, m), 2.95 (2Н, t), 3.13 (4Н, m), 4.30 (3Н, s), 4.39 (2Н, q) 7.15 (1Н, d), 7.82 (1Н, m), 8.82 (1Н, m). m/z (знайдено: 475.2127 ([М+Н]+, 100 %). Підраховано для C22H31N6CO4S: 475.212751). Проміжну сполуку формули IVA одержували відповідно до ЕР-А-0812845, а проміжну сполуку формули ІІІА, Х=СІ , одержували відповідно до наведеного далі прикладу 2(е). Після цього вказані проміжні сполуки використовували в якості маркерів для порівняння зразків ВЕРХ, одержаних з реакційної суміші на стадії 2(d), з метою прослідкування ходу реакції. Проміжні сполуки ІІІА (Х = СІ) і IVA були виявлені (з допомогою ВЕРХ), відповідно, у співвідношенні приблизно 20:80. 2(е): 1–[4-Хлор-3-(6.7-дигідро-1-метил-оксо-3-пропіл-1Н-піразоло[4.3-d]піримідин-5-іл)фенілсульфоніл]-4метилпіперазин, (Сполука ІІІА, Х=СІ) До суспензії сполуки з прикладу 2(с) (1.00г, 2.12ммоль) в трет.-бутанолі (5мл) додавали трет.-бутоксид калію (0.24г, 2.14ммоль), і суміш кип'ятили зі зворотним холодильником протягом 120 годин. Реакційну суміш охолоджували, і випалу в осад тверду речовину фільтрували і сушили з одержанням вказаної у заголовку сполуки (0.48г, 50%) у вигляді білої твердої речовини т. пл. 205-208°С. d (DMSO): 0.90 (3Н, t), 1.70 (2Н, m), 2.13 (3Н, s), 2.38 (4Н, m), 2.68 (2Н, t), 2.92 (4Н, m), 4.10 (3Н, s), 4.15 (1Н, s), 7.60 (1Н, m), 7.70 (1Н, d), 7.85 (1Н, m). m/z (знайдено: 465.1484 ([М+Н]+, 100%). Підраховано для C20H26CIN6O3S: 465.147564). Приклад 3: (3а) 5-Хлорсульфоніл-2-метоксибензойна кислота (Сполука VIA, Х=ОСН 3) До хлорсульфокислоти (52.43г) протягом 30 хвилин при охолодженні льодом порціями додавали комерційно доступну 2-метоксибензойну кислоту (15.2г, 0.1моль). Додавали тіонілхлорид (11.9г, 0.1моль), і реакційну суміш перемішували протягом ночі. Реакційну суміш гасили льодом і водою (250г/65мл), і продукт, що випадав в осад, гранулювали протягом 1 години, фільтрували, промивали водою і сушили в сушильній шафі з одержанням вказаної у заголовку сполуки (23.56г, 93.9%) у вигляді білої твердої речовини, що має т. пл. 138-140°С. d (CDCI3):4.18 (3Н, s),7.23 (1Н, d),8.21 (1Н, d), 8.78 (1Н, s). (3b) 2-Метокси-5-(4-метил-1-піперазинілсульфоніл)бензойна кислота Вищевказану сполуку одержували додаванням 5-хлорсульфоніл-2-метоксибензойної кислоти до 1.1моль еквіваленту N-метилпіперазину і 1.2моль еквіваленту триетиламіну в ацетоні (5мл/г). Вказану у заголовку сполуку після цього виділяли фільтруванням у вигляді твердої речовини (79.1%), що має наступні характеристики: Знайдено: С, 49.70; Н, 5.76; N, 8.75. Підраховано для С13Н18N2O5S: С, 49.68; Н, 5.73; N, 8.92. d (DMSO): 2.15 (3Н, s), 2.35 (4Н, m), 2.90 (4Н, m), 3.90 (3H, s), 7.25 (1Н, m), 7.10 (2Н, m), m/z (знайдено: 315 [M+H]+, 65% Підраховано для C13H19N2O5S: 315). (3с) 4-[2-Метокси-5-(4-метил-1-піперазинілсульфоніл)бензамідо]-1-метил-3-пропіл-1Н-піразол-5карбоксамід. (Сполука НА. Х=ОСН3) Суміш 2-метокси-5-(4-метил-1-піперазинілсульфоніл)бензойної кислоти (2.00г, 6.36ммоль) і карбонілдіімідазолу (1.03г, 6.35ммоль) в дихлорметані (20мл) перемішували протягом трьох годин при 30°С. До реакційної суміші додавали 4-аміно-1-метил-3-проліл-1Н-піразол-5-карбоксамід (1.16г, 6.37ммоль) і триетиламін (0.64г, 6.32ммоль) і перемішували протягом 48 годин при температурі навколишнього середовища. Реакційну суміш промивали насиченим розчином бікарбонату натрію, відокремлений органічний розчин упарювали у вакуумі з одержанням твердої речовини, яку сушили (40°С) з одержанням вказаної у заголовку сполуки (2.74г, 90%) у вигляді білої твердої речовини, т. пл. 182°С. 3Hайдено: С, 52.42; Н, 6.36; N, 17.31; Підраховано для C21H30N6O5S: С, 52.71; Η, 6.32; Ν, 17.56. d (DMSO): 0.90 (3H, t), 1.60 (2H, m), 2.12 (3H, s), 2.32 (4H, m), 2.42 (2H, t), 2.90 (4H, m), 3.90 (3H, s), 4.00 (3H, s), 7.32 (1H, s) 7.42 (1H, d), 7.80 (1H, s), 7.90 (2H, m), 9.70 (1H, s). m/z (знайдено: 479.2088 ([M+H]+, 52%). Підраховано для C21H31N6O5S: 479.207665). (3d) 1-[[3-(6.7-дигідро-1-метил-7-оксо-3-пропіл-1Н-піразоло[4.3-d]піримідин-5-іл)4-етоксифеніл]сульфоніл)4-метилпіперазин. (Сполука ΙΑ) До суспензії вказаної у заголовку сполуки із стадії 3с (200мг, 0.43ммоль) в етанолі (4мл) додавали трет.бутоксид калію (146мг,1.30ммоль), і суміш кип'ятили зі зворотним холодильником протягом 120 годин. Реакційну суміш охолоджували, і показник рН реакційної суміші доводили до 6 з допомогою розведеної соляної кислоти. Випалу в осад тверду речовину фільтрували і сушили з одержанням вказаної у заголовку сполуки (60мг, 29%) у вигляді не зовсім білої твердої речовини, яка має т. пл. 187°С. d (CDCI3): 1.00 (3H, t), 1.62 (3H, t), 1.90 (2Н, m), 2.22 (3H, s), 2.50 (4Н, m), 2.95 (2Н, t), 3.10 (4Н, m), 4.30 (3H, s), 4.38 (2Н, q), 7.15 (1Н, d), 7.82 (1Н, d), 8.82 (1Н, s), 10.85 (1Н, s). m/z (знайдено: 497.199635 [М+, 100%]. Підраховано для C22H30N6O4S: 497.194695). Наступну проміжну сполуку 3(е) одержували окремо і використовували в якості маркера для порівняння зразків ВЕРХ, одержаних з реакційної суміші на стадії 3(d). Проміжна сполука прикладу 3(е) (ІІІА, Х=ОСН3) і проміжна сполука IVA були виявлені з допомогою ВЕРХ у співвідношенні прибли3Hо 70:30. (3е) 1-[3-(6.7-Дигідро-1-мбтилоксо-3-пропіл-1Н-піразоло[4.3-d]піримідин-5-іл)4-метокси-фенілсульфонілі-4метилпіперазин (Сполука ІІІА. Х=ОСН3) До суспензії вказаної у заголовку сполуки із стадії 3с (0.75г, 1.57ммоль) в трет.-бутанолі (5мл) додавали трет.-бутоксид калію (0.176г, 1.57ммоль), і суміш кип'ятили зі зворотним холодильником протягом 96 годин. Реакційну суміш охолоджували, і випалу в осад тверду речовину фільтрували і сушили з одержанням вказаної у заголовку сполуки (0.33г, 45.6%) у вигляді білої твердої речовини т. пл. 182°С. d (CDCI3): 1.02 (3H, t), 1.88 (2Н, m), 2.30 (3H, s), 2.50 (4Н, m), 2.92 (2Н, t), 3.10 (4Н, m), 4.15 (3H, s), 4.30 (3H, s), 7.20 (1Н, m), 7.95 (1H,d), 8.10 (1H, m). Приклад 4: (4a) Етил 3-етил-1Н-піразол-5-карбоксилат До перемішуваного, охолоджуваного льодом розчину діетилоксапату (59.8мл, 0.44моль) в абсолютному етанолі (200мл) в атмосфері азоту по краплях додавали розчин етоксиду натрію в етанолі (21% w/w; 143мл, 0.39моль), і одержаний розчин перемішували протягом 15 хвилин. Після цього по краплях додавали бутан-2он (39мл, 0.44моль), охолоджувальну ванну видаляли, реакційну суміш перемішували протягом 18 годин при кімнатній температурі і після цього протягом 6 годин при 40°С, потім 3Hову вводили охолоджувальну ванну. На наступному етапі по краплях додавали крижану оцтову кислоту (25мл, 0.44моль), одержаний розчин перемішували протягом 30 хвилин при 0°С, по краплях додавали гідрат гідразину (20мл, 0.44моль), після цього реакційній суміші давали нагрітися до кімнатної температури і перед випаровуванням при зниженому тиску підтримували при такій температурі протягом 18 годин. Залишок розділяли між дихлорметаном (300мл) і водою (100мл), після чого органічну фазу відділяли, промивали водою (2х100мл), сушили (Na2SO4) і концентрували при 3Hиженому тиску з одержанням вказаної у заголовку сполуки (66.0г). d (CDCI3): 1.04 (3H, t), 1.16 (3H, t), 2.70 (2Н, q), 4.36 (2Н, q), 6.60 (1Н, s). LRMS: m/z 169 (M+1)+. (4b) 3-Етил-1 Н-піразол-5-карбонова кислота Водний розчин гідроксиду натрію (10М; 100мл, 1.0моль) додавали по краплях до перемішуваної суспензії сполуки з прикладу (4а) (66.0г, 0.39моль) в метанолі, і одержаний розчин кип'ятили зі зворотним холодильником протягом 4 годин. Холодну реакційну суміш концентрували при 3Hиженому тиску до кінцевого об'єму 200мл, розводили водою (200мл), і цю суміш промивали толуолом (3х100мл). Одержану водну фазу підкислювали концентрованою соляною кислотою до рН4, і білий осад збирали та сушили відсмоктуванням з одержанням вказаної у заголовку сполуки (34.1г). d (DMSOd6): 1.13 (3H, t), 2.56 (2Н, q), 6.42 (1Н, s). (4с) 3-Етил-4-нітро-1 Н-піразол-5-карбонова кислота До перемішуваної, охолоджуваної льодом насиченої азотної кислоти (16.0мл) по краплях додавали насичену сірчану кислоту (17.8мл), одержаний розчин нагрівали до 50°С, протягом 30 хвилин порціями додавали 3-етил-1Н-піразол-5-карбонову кислоту, при цьому підтримуючи температуру реакції на рівні нижче 60°С. Одержаний розчин нагрівали протягом 18 годин при 60°С, давали охолонути, після чого виливали на лід. Вказану у заголовку сполуку одержували у вигляді коричневої твердої речовини (64%). d (DMSOd6): 1.18 (3H, t), 2.84 (2Н, m), 13.72 (1Н, s). (4d) 3-Етил-4-нітро-1Н-піразол-5-карбоксамід Розчин сполуки з прикладу (4с) (15.4г, 0.077моль) в тіонілхлориді (75мл) кип'ятили зі зворотним холодильником протягом 3 годин, і після цього холодну реакційну суміш випаровували при зниженому тиску. Залишок азеотропували тетрагідрофураном (2х50мл) і після цього суспендували в тетрагідрофурані (50мл), після чого перемішувану суспензію охолоджували льодом і обробляли газоподібним аміаком 1 години. Додавали воду (50мл), і одержану суміш випаровували при 3Hиженому тиску з одержанням твердої речовини, з якої після розтирання у порошок з водою і висушування відсмоктуванням одержували вказану у заголовку сполуку у вигляді білої твердої речовини (90%). d (DMSOd6): 1.17 (3H, t), 2.87 (2Н, m), 7.40 (1Н, s), 7.60 (1Н, s),7.90 (1H, s). LRMS: m/z 185 (M+1)+. (4e) 5-Етил-4-нітро-1-(2-піридилметил)-1Н-піразол-3-карбоксамід. (Сполука VlllВ) До суспензії сполуки з прикладу (4d) (800г, 4.34моль) в ацетонітрилі (51) додавали карбонат цезію (1.414кг, 4.34моль), і суміш нагрівали до 60°С. Додавали 2-хлорметилпіридин (664.7г, 5.23моль), і реакційну суміш нагрівали при 70°С протягом 7 годин, після чого додавали воду (9.51), і реакційну суміш охолоджували до 10°С. В результаті гранулювання цієї суміші утворювався осад, який фільтрували і сушили з одержанням 3-етил-4-нітро-1(піридин-2-іл)метил-піразол-5-карбоксаміду (367г). До фільтрату додавали хлорид натрію (1.58кг), і розчин екстрагували етилацетатом (4x1.751). Об’єднані органічні екстракти дистилювали з метою видалення приблизно 10 л розчинника, до гарячого (69-76°С) розчину протягом 35 хвилин додавали толуол (5.6л), і суміші давали охолонути. Одержану суспензію гранулювали при температурі нижче 10°С протягом 30 хвилин, фільтрували, тверду речовину промивали сумішшю етилацетату з толуолом (50:50) (600мл) і сушили (60°С) з одержанням вказаної у заголовку сполуки (624г, 52%) у вигляді світло-коричневої твердої речовини, d (DMSOd6): 1.08 (3H, t), 3.02 (2Н, q), 5.53 (2Н, s), 7.34 (2Н, m), 7.65 (1Н, s), 7.82 (1Н, m), 7.93 (1Н, s), 8.52 (1Н, d). LRMS: m/z 276 (М+1)+. (4f) 4-Аміно-5-етил-1-(2-піридилметил)-1Н-піразол-3-карбоксамід. (Сполука ІХВ) Суміш каталізатора Ліндлара (Lindlar catalyst) (2г) і вказаної у заголовку сполуку прикладу (4е) (20г, 72.7ммоль) в етанолі (160мл) гідрували протягом 48 годин при 345кПа (50псі) і 50°С, після чого охолоджували і фільтрували. Фільтрат об'єднували з продуктом промивання фільтра IMS (50мл) і концентрували при зниженому тиску до об'єму 100мл. Решту етанолу видаляли дистилюванням і замінювали етилацетатом, доки не досягали верхньої межі температури 77°С. Охолоджену суміш гранулювали при 4°С, фільтрували і сушили з одержанням вказаної у заголовку сполуки (13.17г, 73%) у вигляді світло-коричневої твердої речовини, d (DMSOd6): 0.90 (3H, t), 2.54 (2Н, q), 4.48 (2Н, s), 5.31 (2Н, s), 6.89 (1Н, d), 6.95 (1Н, s), 7.11 (1 Η, s), 7.28 (1Н, m), 7.74 (1Н, m), 8.50 (1Н, d). LRMS: m/z246(M+1)+. (4g) 2-Хлор-5-(4-етил-1-піперазинілсульфоніл)бензойна кислота (Сполука VIIB. X=CI) 2-Хлор-5хлорсульфонілбензойну кислоту (51.02г, 0.2моль) з прикладу (2а) у воді охолоджували до 5°С. Пока3Hик рН реакційної суміші доводили до 2.2 з допомогою водного гідроксиду натрію (5М), додавали N-етилпіперазин , і показник рН доводили до 5.5. Реакційну суміш перемішували протягом 12 годин при температурі навколишнього середовища. Випалу в осад тверду речовину фільтрували з одержанням вказаної у заголовку сполуки. В результаті перекристалізації вказаної у заголовку сполуки із суміші ацетону з водою одержували тверду речовину, що має т. пл. 267-269°С. d (DMSO): 1.00 (3H, s). 2.50 (2Н, m), 2.60 (4К, m), 3.00 (4Н, m), 7.75 (2Н, s), 7.95 (1Н, s), m/z (знайдено: 333 [M+H]+, 100% Підраховано для C13H18CIN2O4S: 333). (4h) 4-[2-Хлор-5-(4-етил-1-піперазинілсульфоніл)бензамідо]-5-етил-1–(2-піридилметил)-1Н-піразол-3карбоксамід. (Сполука ІІВ. Х=СІ) До суспензії 2-хлор-5-(4-етил-1-піперазинілсульфоніл)бензойної кислоти (5.0г, 16.4ммоль), 1-(3диметиламінопропш)-3-етил карбодіімід гідрохлориду (3.15г, 16.4ммоль) і 1-гідроксибензотриазолу (2.22г, 16.4ммоль) в дихлорметані (50мл) додавали 4-аміно-5-етил-1-(2-піридилметил)-1Н-піразол-3-карбоксамід (сполука ІХВ) (4.02г, 16.4ммоль). Реакційну суміш перемішували протягом 48 годин при температурі навколишнього середовища. Реакційну суміш фільтрували і тверду речовину сушили з одержанням вказаної у заголовку сполуки (2.26г, 24.7%) у вигляді білої твердої речовини, т. пл. 185°С. 3Hайдено: С, 53.26; Н, 5.38; N,17.13. Підраховано для C25H30CIN7O4S: С, 53.61; Н, 5.40; Ν, 17.51. d (DMSO) : 0.90 (3Η, t), 1.20 (3Η, t), 2.30 (2H, q), 2.21 (4H, m), 2.70 (2H, q), 2.95 (4H, m), 5.50 (2H, s), 7.10 (1H, d), 7.20 (1H, m), 7.30 (2H, m), 7.85 (3H, m), 7.93 (1H, s), 8.55 (1H, d), 9.92 (1H, s). m/z (знайдено: 560.1835 ([M+H]+, 65 %). Підраховано для C25H31CIN7O4S: 560.184677). (4і) 1-Етил-4-{3-[3-етил-6.7-дигідро-7-оксо-2-(2-піридилметил)2Н-піразоло[4,3-d]пipимідин-5-iл]-4пpoпoкcифeнiлcvльфoнiл}пiпepaзин. (Сполука IB) До суспензії сполуки з прикладу 4(h) (1.5г, 2.68ммоль) в пропан-1-олі (10мл) додавали трет.-бутоксид калію (0.90г, 8.02ммоль), і суміш кип'ятили зі зворотним холодильником протягом 48 годин. Реакційну суміш охолоджували, і випалу в осад тверду речовину фільтрували і сушили з одержанням вказаної у заголовку сполуки (1.16г, 80%). В результаті перекристалізації вказаної у заголовку сполуки з метилізобутилкетону одержували тверду речовину, що має т. пл. 95°С. d (CDCI3): 1.00 (3H, t), 1.12 (3H, t), 1.30 (3H, t), 2.02 (2Н, m), 2.40 (2Н, q), 2.50 (4Н, m), 3.10 (6Н, m), 4.13 (2Н, t), 5.70 (2Н, s), 7.20 (3H, m), 7.60 (1Н, m), 7.80 (1Н, m), 8.55 (1Н, m), 8.80 (1Н, m), 10.60 (1Н, s). m/z (знайдено: 566.257068 ([M+H]+, 100 %). Підраховано для C28H36N7O4S: 566.257068). При відборі зразків із реакційної суміші з допомогою ВЕРХ результат показує, що в ході реакції головним чином задіяна проміжна сполука IVB. Таким чином, у даному винаході запропоновано прекрасний спосіб одержання сполук формули І, який є надійним (уникається потреба у застосуванні карциногенних алкілуючих реагентів), економічним за рахунок використання легкодоступних сировинних матеріалів, і який включає нову реакцію заміщення та замикання кільця в одному реакційному об'ємі.
ДивитисяДодаткова інформація
Назва патенту англійськоюA process for the preparation of 1-[[3-(6,7-dihydro-1-methyl-7-oxo-3-propyl-1н-pyrazolo[4,3-d]pyrimidine-5-yl)-4-ethoxyphenyl]sulfonyl]-4-methylpiperazine and intermediary compounds
Назва патенту російськоюСпособ получения 1-[[3-(6,7-дигидро-1-метил-7-оксо-3-пропил-1н-пиразоло[4,3-d]пиримидин-5-ил)-4-этоксифенил]сульфонил]-4-метилпиперазина и промежуточные соединения
МПК / Мітки
МПК: C07D 295/22, C07D 401/06, C07D 295/26, C07D 487/04, C07D 231/40, A61P 15/10, A61K 31/519
Мітки: проміжні, одержання, спосіб, сполуки, 1-[[3-(6,7-дигідро-1-метил-7-оксо-3-пропіл-1н-піразоло[4,3-d]піримідин-5-іл)-4-етоксифеніл]сульфоніл]-4-метилпіперазину
Код посилання
<a href="https://ua.patents.su/9-66787-sposib-oderzhannya-1-3-67-digidro-1-metil-7-okso-3-propil-1n-pirazolo43-dpirimidin-5-il-4-etoksifenilsulfonil-4-metilpiperazinu-ta-promizhni-spoluki.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 1-[[3-(6,7-дигідро-1-метил-7-оксо-3-пропіл-1н-піразоло[4,3-d]піримідин-5-іл)-4-етоксифеніл]сульфоніл]-4-метилпіперазину та проміжні сполуки</a>
Наступний патент: 1-арил-3-імінопіразоли, спосіб їх одержання (варіанти), пестицидна композиція та спосіб боротьби зі шкідниками
Випадковий патент: Вітродвигун