Спосіб одержання заміщених 3-r-3,4-дигідрокумарин-3-іл-4н-хромен-4-онів
Номер патенту: 65641
Опубліковано: 12.12.2011
Автори: Туриця Віктор Володимирович, Матійчук Василь Степанович, Обушак Микола Дмитрович
Формула / Реферат
Спосіб одержання заміщених 3-R-3,4-дигідрокумарин-3-іл-4H-хромен-4-онів загальної формули:
 ,
,
що включає діазотування метилантранілатів натрію нітритом у водному НВr та подальшу взаємодію одержаної арендіазонієвої солі з ненасиченою сполукою у присутності каталізатора CuBr, який відрізняється тим, що броміди 2-алкоксикарбоніларендіазонію вводять у реакцію з a-алкілметакрилатами і отримують заміщені 3-алкіл-3-метоксикарбоніл-3,4-дигідроізокумарини, які піддають лужному гідролізу, одержують 3-алкіл-3,4-дигідроізокумарин-3-карбонову кислоту, яку дією хлористого тіонілу в діоксані перетворюють у відповідний хлорангідрид і ацилюють ним орто-гідроксіацетофенони у присутності триетиламіну в діоксані з утворенням естерів 3-алкіл-3,4-дигідроізокумарин-3-карбонових кислот, після чого одержані сполуки перегруповують дією kОН у піридині до відповідних дикетонів, які циклізують дією каталітичної кількості H2SO4 в оцтовій кислоті.
Текст
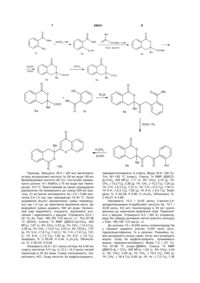
Спосіб одержання заміщених 3-R-3,4дигідрокумарин-3-іл-4H-хромен-4-онів загальної формули: O R 1 U O 2 O (13) R R що включає діазотування метилантранілатів натрію нітритом у водному НВr та подальшу взаємодію одержаної арендіазонієвої солі з ненасиченою сполукою у присутності каталізатора CuBr, який відрізняється тим, що броміди 2алкоксикарбоніларендіазонію вводять у реакцію з -алкілметакрилатами і отримують заміщені 3алкіл-3-метоксикарбоніл-3,4-дигідроізокумарини, які піддають лужному гідролізу, одержують 3алкіл-3,4-дигідроізокумарин-3-карбонову кислоту, яку дією хлористого тіонілу в діоксані перетворюють у відповідний хлорангідрид і ацилюють ним орто-гідроксіацетофенони у присутності триетиламіну в діоксані з утворенням естерів 3-алкіл-3,4дигідроізокумарин-3-карбонових кислот, після чого одержані сполуки перегруповують дією KОН у піридині до відповідних дикетонів, які циклізують дією каталітичної кількості H2SO4 в оцтовій кислоті. питання одержання 3,4-дигідроізокумаринів та флавонів природного походження і методи їх синтезу є актуальними в останні роки [Bovicelli P., Sanetti A., Bernini R., Lupattelli P. Oxifunctionalization of activated methylenes by dimethyldioxirane: an easy conversion of isochromans into isocoumarins // Tetrahedron - 1997. - Vol. 53, № 28. - P. 9755-9760; Bovicelli P., Lupattelli P., Crescenzi В., Sanetti A., Bernini R. Oxidation of 3arylisochromans by dimethyldioxirane. An easy route to substituted 3-arylisocoumarins // Tetrahedron 1999. - Vol. 55. - P. 14719-14728; Yoshikawa M., Shimada H., Yagi N., Murakami N., Shimoda H. Development of bioactive functions in Hydrangeae Dulcis Folium. VI. Syntheses of thunberginols A and F and their 3'-deoxy-derivatives using regiospecific (11) Корисна модель стосується органічної хімії, а саме корисних органічних сполук - похідних 3,4дигідроізокумарину та флавону, які можуть бути використані як реагенти для органічного і комбінаторного синтезу біологічно активних сполук. 3,4-Дигідроізокумарини та флавони є важливим класом природних сполук, які проявляють широкий спектр біологічної дії [Hill R.A. Naturally occurring isocoumarins // Forschr. Chem. Naturst. 1986. - Vol. 49. - P. 1-78; Rice-Evans С. Flavonoid Antioxidants // Curr. Med. Chem. - 2001. - Vol. 8, № 7. - P. 797-807; Göker H, Ayhan G., Tunçbilek M., Ertan R., Leoncini G., Garzoglio R., Mazzei M Synthesis and antiaggregator activity of some new derivatives of 4H-benzopyran-4-one // Eur. J. Med. Chem. - 1995. - Vol. 30, № 7-8. - P. 561-567]. Тому UA , (19) R=Alk; R1=H, Alk, Ar, Hal, R2=H, Alk, Hal 65641 O 3 65641 lactonization of stilbene carboxylic acid. Structures and inhibitory activity on histamine release of hydramacrophyllols A and В // Chem, Pharm. Bull. 1996. - Vol. 44, № 10. - P. 1890-1898; Huang W.-H, Chien P.-Y, Yang C.-H, Lee A.-R. Novel Synthesis of Flavonoids of Scutellaria baicalensis GEORGI // Chem. Pharm. Bull. - 2003. - Vol. 51, № 3. - P. 339340; Pietta P.-G. Flavonoids as Antioxidants // J. Nat. Prod. - 2000. - Vol. 63, № 7. - P. 1035-1042; Santos C.M.M., Silva A.M.S., Cavaleiro J.A.S. Synthesis of New Hydroxy-2-styrylchromones // Eur. J. Org. Chem. - 2003 - № 23. - P. 4575-4585; Pelzer L.E., Guardia Т., Juarez A.O., Guerreiro E. Acute and chronic antiinflammatory effects of plant flavonoids // Farmaco - 1998. - Vol. 53, №6. - P. 421-424]. Проте немає патентних чи літературних даних про синтез сполук, які об'єднали б у своїй структурі дигідроізокумариновий та флавоновий фрагменти 4 [Beilsteins Handbuch der organischen Chemie. West Berlin and Heidelberg: Springer-Verlag. Electronic version. - http://www.beilstein-institut.de/, SciFinderfor Academics http://www. cas.org/products/sfacad/index.html]. Відомий спосіб одержання 3,4дигідроізокумаринів з похідних гомофталевої кислоти, її ангідридів та естерів [Napolitano E. The synthesis of isocoumarins over the last decade. A review // Org. Prep. Proc. Int. - 1997. - Vol. 29 - P. 631-664], який є двостадійним. На першій стадії похідні гомофталевої кислоти конденсують з карбонільними сполуками у присутності сильних основ (натрій гідрид, трет-бутилат калію). На другій стадії отримані продукти конденсації циклізують під дією ацетату натрію в оцтовій кислоті чи мінеральної кислоти до похідних 3,4дигідроізокумарину за схемою: O O + COOR2 R 1 R 2 COOMe NaH (t-BuOK) COOMe O 1 2 1 R COOR2 R 2 COOR3 O O R R 1 R R 2 R1,R2 = алкіл, арил, аралкіл, гетарил, цикл; R3 =H, CH3 Недоліком способу є складність отримання вихідних реагентів (похідних гомофталевої кислоти), двостадійність і невисокий вихід кінцевих продуктів у розрахунку на комерційно доступні вихідні сполуки. Відомий спосіб одержання похідних 3,4дигідроізокумарину паладій-каталітичними реакціями opтo-галогенобензойних кислот з функціоналізованими олефінами або алкінами, одно- чи двостадійним синтезом [Larock R.C., Doty M.J., Han X. Synthesis of isocoumarins and -pyrones via palladium-catalyzed annulation of internal alkynes //J. Org. Chem. - 1999. - Vol. 64, № 24. - P. 8770-8779; Larock R.C., Harrison L.W. Mercury in organic chemistry. 26. Synthesis of heterocycles via intramolecular solvomercuration of aryl acetylenes // J. Am. Сhem. Soc. - 1984. - Vol. 106, № 15. - P. 4218-4227; Yao Т., Larock R.C. Synthesis of isocoumarins and -pyrones via electrophilic cyclization // J. Org. Chem. - 2003. - Vol. 68, № 15. P. 5936-5942]. За цим способом отримують 3заміщені ізокумарини, наприклад: 5 65641 6 O COOH R COOH Pd(PPh)4, Et3N, ZnCl2 + I O CH R R O O OEt Br COOH R O Pd(PPh)3Cl2, Et3N, Cul R R R=Hal, Alk, Ar Недоліком цього способу є застосування дорогих каталізаторів, органічних лігандів для Pdкаталізу, наприклад трифенілфосфину тощо. До того ж, за цим способом синтезують похідні ізокумарину, з яких відповідні 3,4-дигідроізокумарини можна одержувати додатковою процедурою відновлення. Найближчим до запропонованих - прототипом - є спосіб одержання 3,4-дигідроізокумарину [Пат. 23545 Україна, МПК: С07Д 311/76. Опубл. 10.07.2007, Бюл. № 10], який полягає у тому, що метиловий естер антранілової кислоти діазотують і одержаний 2-метоксикарбонілбензендіазоній бромід вводять в реакцію з ненасиченими сполуками у присутності каталізатора CuBr у водноацетоновому середовищі. Недоліком способу є варіативна обмеженість замісників у третьому положенні 3,4дигідроізокумарину. В основу корисної моделі поставлено задачу одержати 3,4-дигідроізокумарини з хроменоновими замісниками шляхом використання для синтезу ізокумаринової частини молекули реакції діазонієвої солі на основі метилових естерів антранілових кислот з -алкілметакрилатом, а для синтезу флавонової частини - перегрупування естерів за Бейкером-Венкатараманом з наступною циклізацією під дією мінеральних кислот, що забезпечить спрощення процесу та збільшить вихід цільового продукту. Поставлена задача вирішується так, що у способі одержання заміщених 3-R-3,4дигідроізокумарин-3-іл-4Н-хромен-4-онів загальної формули: O R R R 1 O 2 O O R=Alk; R1=H, Alk, Ar, Hal, R2=H, Alk, Hal , який включає діазотування метилантранілатів натріє нітритом у водному НВr та подальшу взаємодію одержаної арендіазонієвої солі з ненасиченою сполукою у присутності каталізатора CuBr, причому одержані броміди 2алкоксикарбонілбензендіазонію вводять у реакцію з -алкілметакрилатом, і отримують заміщені 3алкіл-3-метоксикарбоніл-3,4-дигідроізокумарини, які піддають лужному гідролізу і одержують 3алкіл-3,4-дигідроізокумарин-3-карбонову кислоту, яку дією хлористого тіонілу в діоксані перетворюють у відповідний хлорангідрид і ацилюють ним opтo-гідроксіацетофенони у присутності триетиламіну в діоксані з утворенням естерів 3-алкіл-3,4дигідроізокумарин-3-карбонових кислот, після чого одержані сполуки перегруповують дією KОН в піридині до відповідних дикетонів, які циклізують дією каталітичної кількості H2SO4 в оцтовій кислоті. Спосіб одержання алкіл 3-метил-3,4дигідроізокумарин-3-карбоксилатів можна проілюструвати наведеним прикладом: 7 65641 O O OMe 1a 2a O Me OMe NaNO2, HBr NH2 O COOMe, CuBr H2O, ацетон N2+Br 4a O NaOH 8 Me COOMe O SOCl2 O O EtOH 5a Me COOH Me 6a COCl O O HO O + Me COCl Me O Et3N O Me 6a O 7a Me 8a O KOH / Py O O Me O O H2SO4 AcOH O 10a O Приклад. Змішують 30,2 г (26 мл) метилового естеру антранілової кислоти 1a, 80 мл води і 80 мл бромоводневої кислоти (40 %) і поступово прикрапують розчин 14 г NaNO2 у 75 мл води при температурі -5-0 °С. Приготований за такою процедурою діазорозчин 2а прикрапують до суміші 200 мл ацетону, 21 мл метил метакрилату 3а і 3,5 г CuBr протягом 0,5-1,0 год. при температурі 15-30 °С. Після додавання всього діазорозчину суміш перемішують ще 1-2 год. до закінчення виділення азоту. До реакційної суміші додають 300 мл води. Органічний шар відділяють, осушують, відганяють розчинник і переганяють у вакуумі. Отримують 22,4 г (51 %) 4а. Ткип. 180-183 °С/2 мм рт. ст., Тпл 97-98 1 °С (ЕtOН). Спектр Н ЯМР (ДМСО-d6+ССl4, 400 МГц): 1,67 (с; 3Н, СН3), 3,32 (д; 1H, СН2, J 12,4 Гц), 3,38 (д; 1Н, СН2, J 12,4 Гц), 3,53 (с; 3Н, ОСН3), 7,37 (д; 1Н, 5-Н, J 7,6 Гц), 7,43 (т; 1Н, 7-Н, J 7,6 Гц), 7,61 (т; 1Н, 6-Н, J 7,2 Гц), 7,90 (д; 1Н, 8-Н, J 7,6 Гц). Знайдено, %: С 65,40; Н 5,44. С12Н12О4. Обчислено, %: С 65,45; Н 5,49. Нагрівають 22,5 г (0,1 моль) естеру 4а в 60 мл спирту протягом 3-5 год. із 12,3 г (0,3 моль) натрій гідроксиду в 25 мл води. Суміш охолоджують, підкислюють НСl. Осад кислоти 5а відфільтровують, 9a Me O O OH перекристалізовують зі спирту. Вихід 18,9 г (90 %). 1 Тпл 161-162 °С (спирт). Спектр Н ЯМР (ДМСОd6+ССl4, 400 МГц): 1,71 (с; 3Н, СН3), 3,19 (д; 1Н, СН2, J 15,2 Гц), 3,36 (д; 1Н, СН2, J 15,2 Гц), 7,24 (д; 1Н, 5-Н, J 6,3 Гц), 7,37 (т; 1Н, 7-Н, J 6,3 Гц), 7,50 (т; 1Н 6-Н, J 6,3 Гц), 7,95 (д; 1H 8-Н, J 6,3 Гц). Знайдено, %: С 64,38; Н 4,80. С11Н10O4. Обчислено, %: С 64,07; Н 4,89. Нагрівають 10,3 г (0,05 моль) 3-метил-3,4дигідроізокумарин-3-карбонової кислоти 5а, 10,7 г (0,09 моль, 6,6 мл) тіонілхлориду в 30 мл сухого діоксану до закінчення виділення газів. Переганяють у вакуумі. Отримують 8,3 г (80 %) хлорангідриду 6а (тверда речовина світло-жовтого кольору) з Ткип. 185-190 °С/2 мм рт. ст. До розчину 10 г (0,045 моль) хлорангідриду 6а у піридині додають розчин 0,045 моль opтoгідроксіацетофенону 7а в діоксані. Реакційну суміш витримують кілька годин, після чого розводять водою. Осад 8а відфільтровують, промивають водою, перекристалізовують. Вихід 7,4 г (51 %). 1 Тпл 97-98 °С (спирт-ДМФА). Спектр Н ЯМР (ДМСО-d6 + ССl4, 400 МГц): 1,92 (с, 3Н, СН3), 2,44 (с, 3Н, СН3), 3,46 (д, 1Н, СН2, J 16,4 Гц), 3,60 (д, 1H, СН2, J 16,4 Гц), 6,60 (д; 1Н, Аr, J 7,2 Гц), 7,36 9 (т; 1H, Аг, J 6,8 Гц), 7,44-7,51 (м; 3Н, Аr), 7,64 (т; 1Н, 6-Н, J 7,2 Гц), 7,86 (д; 1Н, Аr, J 8,0 Гц), 7,95 (д; 1Н, 8-Н, J 8,0 Гц). Знайдено, %: С 70,17; Н 4,92. С19Н16О5. Обчислено, %: С 70,36; Н 4,97. До розчину 2 г естеру 8а в 10 мл сухого піридину, нагрітого до 65 °С, додають 0,5 г сухого KОН і нагрівають при перемішуванні 15-30 хв. Реакційна суміш набуває жовтого забарвлення внаслідок утворення калієвої солі дикетону. Охолоджують, розводять водою, підкислюють оцтовою кислотою, осад 9а відфільтровують і перекристалізовують з етанолу. Вихід кількісний. 2-(3-Метил-1-оксо-3,4-дигідро-1H-ізохромен-3іл)-4H-хромен-4-он 10а. До 1 г 9а в 5 мл оцтової кислоти додають 1 мл концентрованої сульфатної кислоти, витримують 30 хв. Реакційну суміш вили Комп’ютерна верстка А. Крулевський 65641 10 вають на лід, осад 10а відфільтровують, промивають водою до повного вимивання залишків кислоти, перекристалізовують. Вихід 0,77 г (84 %). 1 Тпл 154-155 °С (спирт-ДМФА). Спектр Н ЯМР (ДМСО-d6, 400 МГц): 1,85 (с; 3Н, СН3), 3,51 (д; 1Н, СН2, J 16,4 Гц), 3,71 (д; 1Н, СН2, J 16,4 Гц), 6,30 (с; 1Н, CH), 7,42 (м; 3Н, Аr), 7,56 (м; 2Н, Аr), 7,75 (т; 1Н, 6-Н, J 7,2 Гц), 7,94 (д; 2Н, Ar, J 8,0 Гц). Знайдено, %: С 74,35; Н 4,66. С19Н14О4. Обчислено, %: С 74,50; Н 4,61. Запропонований спосіб дозволяє одержувати раніше невідомі 3-R-3,4-дигідроізокумарини з хроменоновими замісниками, використовуючи комерційно доступні вихідні речовини, що підтверджує передбачуваний технічний результат. Підписне Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of substituted 3-r-3,4-dihydrocoumarin-3-yl-4h-chromen-4-ones
Автори англійськоюObushak Mykola Dmytrovych, Turytsia Viktor Volodymyrovych, Matiichuk Vasyl Stepanovych
Назва патенту російськоюСпособ получения замещенных 3-r-3,4-дигидрокумарин-3-ил-4н-хромен-4-онов
Автори російськоюОбушак Николай Дмитриевич, Туриця Виктор Владимирович, Матийчук Василий Степанович
МПК / Мітки
МПК: C07D 311/30, C07D 311/76
Мітки: 3-r-3,4-дигідрокумарин-3-іл-4н-хромен-4-онів, спосіб, заміщених, одержання
Код посилання
<a href="https://ua.patents.su/5-65641-sposib-oderzhannya-zamishhenikh-3-r-34-digidrokumarin-3-il-4n-khromen-4-oniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання заміщених 3-r-3,4-дигідрокумарин-3-іл-4н-хромен-4-онів</a>
Попередній патент: Планетарна фрикційна передача
Наступний патент: Спосіб визначення величини критичного перерізу дросельно-регулювального клапана гідравлічного преса
Випадковий патент: Пристрій для кондиціонування рудникового повітря