Спосіб одержання 5-(4-фторфеніл)нікотинальдегіду
Номер патенту: 73973
Опубліковано: 17.10.2005
Автори: Бате Андре, Кнірімен Ральф, Кейл Томас, Бокел Хейнц, Мурманн Крістоф
Формула / Реферат
1. Спосіб одержання 5-(4-фторфеніл)нікотинальдегіду формули
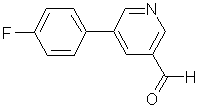
шляхом відновлення 5-(4-фторфеніл)нікотинової кислоти формули
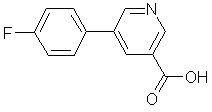
каталітичною гідрогенізацією за наявності триметилоцтового ангідриду або ангідриду ізомасляної кислоти, де каталізатором є паладієво-лігандний комплекс, причому молярне співвідношення паладію та ліганду становить від 1:5 до 1:15 у випадку монодентатних лігандів і від 1:2,5 до 1:7,5 у випадку бідентатних лігандів.
2. 5-(4-фторфеніл)нікотинальдегід формули
 .
.
3. 5-(4-фторфеніл)нікотинова кислота формули
 .
.
Текст
Винахід стосується способу одержання 5-арилнікотинальдегідів шляхом відновлення відповідних 5арилнікотинових кислот каталітичною гідрогенізацією за наявності карбоксильних ангідридів, в якій застосовуваний каталізатор являє собою паладієво-лігандний комплекс, який відрізняється тим, що молярне співвідношення паладію та ліганду становить від 1:5 до 1:15 у випадку моноденатних лігандів та від 1:2,5 до 1:7,5 у випадку біденатних лігандів. 5-арилнікотинальдегіди є важливими проміжними сполуками і кінцевими продуктами промислової органічної хімії. Певним чином заміщені похідні сполуки являють собою, зокрема, важливі проміжні сполуки для синтезу кінцевих продуктів високої переробки або самі є такими кінцевими продуктами, призначеними, зокрема, для захисту сільськогосподарських культур, наприклад, такими як фунгіциди, інсектициди, гербіциди або пестициди, або для одержання речовин, що мають високу фармацевтичну активність. Для виробництва 5-арилнікотинальдегідів у промислових масштабах необхідні високоекономічні й екологічно чисті технології. Виявлено, що 5-арилнікотинальдегіди вирізняються чутливістю до окислювання і диспропорціонування. Отже, описані в літературі способи одержання цих сполук шляхом хемоселективного відновлення ароматичних кислот чи їхніх складних е фірів або окислюванням ароматичних спиртів не можна достатньо широко застосовувати до відповідної 5-арилнікотинової кислоти або відповідного 5-арилнікотинового спирту. Способи відновлення нікотинової кислоти відомі. Так, наприклад, відновлення нікотинової кислоти гідрогенізацією з паладієвим каталізатором описане в Chemistry Letters 1998, 1143-1144. Описаний у цій роботі процес здійснюють за наявності триметилоцтового ангідриду (триметилоцтового ангідриду) і одержують, у випадку незаміщеної нікотинової кислоти, гарний вихід відповідного альдегіду. Проте якщо в цьому процесі застосовуються заміщені нікотинові кислоти і, зокрема, ароматичнозаміщені нікотинові кислоти, то ви хід продукту виявляється значно меншим. Крім того, застосування триметилоцтової кислоти пов'язане зі значними виробничими витратами, і отже, цей процес непридатний до промислового застосування. Предметом даного винаходу є спосіб одержання 5-арилнікотинальдегідів, який забезпечує можливість недорогого й екологічно чистого одержання навіть сполук цього класу і не має вищезгаданих недоліків. Був виявлений нетривіальний факт, що 5-арилнікотинальдегіди можуть бути отримані шляхом відновлення відповідних 5-арилнікотинових кислот каталітичним гідруванням за наявності карбоксильних ангідридів із каталізатором, що являє собою паладієво-лігандний комплекс, за умови, що молярне співвідношення паладію і ліганду становить від 1:5 до 1:15 у випадку моноденатних лігандів і від 1:2,5 до 1:7,5 у випадку біденатних лігандів. Спосіб за даним винаходом дозволяє також застосування інших карбоксильних ангідридів, дешевших за триметилоцтовий ангідрид і які за відсутності надлишку ліганду дозволяють одержати тільки низький вихід продукту. Даний винахід, таким чином, стосується способу одержання 5-арилнікотинальдегідів шляхом відновлення відповідних 5-арилнікотинових кислот каталітичним гідруванням за наявності карбоксильних ангідридів, у якому застосовуваний каталізатор являє собою паладієво-лігандний комплекс, який відрізняється тим, що молярне співвідношення паладію і ліганду становить від 1:5 до 1:15 у випадку моноденатних лігандів і від 1:2,5 до 1:7,5 у випадку біденатних лігандів. Даний винахід переважно стосується, зокрема, способу одержання 5-арилнікотинальдегідів формули І в якій А означає фенільний радикал або нафтильный радикал, кожний з яких може бути незаміщеним або монозаміщеним чи полізаміщеним групами R, F, СІ, Br, I, -CN, -NO2 , -CF3, -OCF3 , -OCHF2, -OCF2CF 3, OCHFCF3 або -OH і де, крім того, одна або більше груп СН можуть бути заміщені N, і R означає Н, алкільний радикал із нерозгалуженим або розгалуженим ланцюгом, що містить від 1 до 15 атомів вуглецю, монозаміщений групою -CF3 або принаймні монозаміщений фтором, і де, крім того, одна або більше груп СН 2 в цих радикалах можуть бути, незалежно одна від одної, заміщені групами -S-, -О-, -OCO-, CO-O- або -СН=СН- таким чином, що гетероатоми не розташовані безпосередньо поруч один з одним, відновленням відповідних 5-арилнікотинових кислот каталітичним гідруванням за наявності карбонових ангідридів, у якому застосовуваний каталізатор являє собою паладієво-лігандний комплекс, який відрізняється тим, що молярне співвідношення паладію та ліганду становить від 1:5 до 1:15 у випадку моноденатних лігандів і від 1:2,5 до 1:7,5 у випадку біденатних лігандів. Даний винахід, крім того, стосується застосування 5-арилнікотин-альдегидів для одержання Nалкілованих амінів за допомогою проведення реакції 5-арилнікотинальдегідів з первинними амінами, в результаті якої одержують відповідні іміни, і наступного відновлення цих продуктів. Реакцію альдегідів з амінами і також відновлення імінів можна здійснювати згідно з методиками, відомими самі по собі й описаними в літературі [наприклад, у класичних роботах типу Houben-Weyl, Methoden der organischen Chemie [Методи Ор ганічної Хімії], Georg-Thieme-Verlag, Stuttgart, або Organikum [Organic Chemistry], 17th Edition, VEB Deutscher Verlag der Wissenschaften, Berlin, 1988], за суворого дотримання умов, відомих та прийнятних для проведення вищезгаданих реакцій. Сполуки формули І є особливо придатними для одержання N-алкілованих амінів формули X: де R' і R'', незалежно один від одного, означають R або являють собою F, СІ, Br, I, -CN, -NO 2, -CF3, -OCF 3, OCHF2, -OCF 2CF3 , -OCHFCF 3 або -ОН, і А відповідає наведеному вище визначенню, за допомогою реакції відповідних амінів і відновленням отриманих у цій реакції імінів у звичайних процесах відновлення, особливо в реакції каталітичного гідрування або за допомогою боргідридів, таких як, наприклад, боргідрид натрію. Аналогічні сполуки вже відомі з ЕР 0707007. Перевагу віддають варіанту застосування альдегіду формули І, в якій А означає 4-фторфеніл, для одержання (R)-2-[5-(4-фторфеніл)-3-піридил-метиламінометил]хроману за допомогою реакції з Rхроманаміном і наступним відновленням іміну, отриманого в результаті цієї реакції. В кращих сполуках вище і нижче наведених формул R означає Н, алкіл або алкоксигрупу, що містить від 1 до 10 атомів вуглецю, або алкенільну груп у, що містить від 2 до 7 атомів вуглецю. А переважно являє собою фенільну груп у, фенільну груп у, монозаміщену або двозаміщену F, 4фтор фенільною групою, піримідилом, піридилом, піразилом або піридазиловою групою, особливо 4фтор фенільною групою. Перевагу віддають сполукам, що містять принаймні один з кращих радикалів. Якщо R являє собою алкільну групу, в якій, окрім того, одна група СН 2 (алкокси- або оксаалкіл) може бути заміщена атомом О, то вона може бути нерозгалуженою або розгалуженою. Переважно ця група включає 2, 3, 4, 5, 6, 7, 8, 9 або 12 атомів вуглецю і відповідно переважно являє собою етил, пропіл, бутил, пентил, гексил, гептил, октил, ноніл, децил, етоксигрупу, пропоксигрупу, бутоксигрупу, пентоксигрупу, гексилоксигрупу, гептилоксигрупу, октилоксигрупу, нонілоксигрупу або децилоксигрупу, крім того, також ундецил, додецил, ундецилоксигрупу, додецилоксигрупу, 2-оксапропіл (=2-метоксиметил), 2-оксабутил (=метоксіетил) або 3-оксабутил (=2-етоксиметил), 2-, 3- або 4-оксапентил, 2-, 3-, 4- або 5-оксагексил, або 2-, 3-, 4-, 5- або 6-оксагептил. Особливу перевагу віддають гексилу, пентилу, бутилу, n-бутилу, пропілу, іпропілу, метилу й етилу, особливо пропілу й пентилу; особливо бажані алкоксигрупи, як-от гексилоксигрупа, пентоксигрупа, n-бутоксигрупа, пропоксигрупа, і-пропоксигрупа, метоксигрупа й етоксигрупа, особливо етоксигрупа і n-бутоксигрупа. Сполуки вище й нижче згаданих формул, що мають розгалужені бічні групи R, можуть виявитися важливими. Розгалужені групи цього типу в основному містять не більше двох ланцюгів, що відгалужуються. R являє собою переважно нерозгалужену груп у або розгалужену груп у, що містить не більше одного ланцюга, що відгалужується. Кращі розгалужені радикали являють собою 2-бутил (=1-метилпропіл), ізобутил (=3-метилпропіл), третбутил, 2-метилбутил, ізопентил (=3-метил-бутил), 2-метилпентил, 3-метилпентил, 4-метилпентил, 2етилгексил, 5-метилгексил, 2-пропілпентил, 6-метилгептил, 7-метилоктил, ізопропоксигрупу, 2метилпропоксигрупу, 2-метилбутоксигрупу, 3-метилбутоксигрупу, 2-метилпентоксигрупу, 3метилпентоксигрупу, 2-етилгексилоксигрупу, 1-метилгексилоксигрупу, 1-метилгептилоксигрупу, 2-окса-3метилбутил і 3-окса-4-метилпентил. Радикал R також може бути оптично активним органічним радикалом, що містить один або більше асиметричних атомів вуглецю. Спосіб за даним винаходом є особливо придатним для одержання альдегідів формул від II до І10: в яких R1 і R2, незалежно один від одного, означають R і являють собою, зокрема, F, -CF3, -OCF 3, OCHF2 або Η, і особливо переважно F. Особливо бажані 5-арилнікотинальдегіди, які можуть бути отримані способом за даним винаходом і являють собою сполуки формул I1, І2, І9 і І10. 5-арилнікотинові кислоти, застосовувані як вихідні матеріали для способу за даним винаходом, або відомі, або можуть бути отримані згідно з відомими й описаними в літературі методиками [наприклад, у класичних роботах на кшталт Houben-Weyl, Methoden der organischen Chemie [Methods of Organic Chemistry], Georg-Thieme-Verlag, Stuttgart], за суворого дотримання умов, що самі по собі відомі й прийнятні для проведення вищезгаданих реакцій. Проте можуть застосовуватися також варіанти, що самі по собі відомі, але тут докладно не описані. 5-арилнікотинові кислоти переважно виготовляють у реакції спарювання Suzuki [N.Miyaura, A.Su zuki, Chem. Rev. 95, 2457 (1995)] шляхом проведення реакції 5-бромнікотинової кислоти, алкіл 5-бромнікотинату, 5-бром-нікотинілового спирту або складного ефіру алкілкарбонової кислоти з відповідними арилбороновими кислотами за відомих реакційних умов, у результаті якої одержують сполуку формул II, III, IV або V: в яких А відповідає наведеному вище визначенню, і R3 являє собою метил, етил, n-пропіл, ізопропіл, nбутил, сек-бутил або трет-бутил, з наступними гідролізацією складного ефіру формул III або V згідно зі звичайними методиками, в результаті якої одержують вільну кислоту формули II або спирт з формули IV, й окислюванням спирту формули IV згідно зі звичайними методиками, в результаті якого одержують кислоту формули II. Кислоти формули II, отримані за такою методикою, можуть бути застосовані безпосередньо для здійснення способу за даним винаходом. R3 переважно означає метил або етил, особливо метил. Сполуки формул І, II, III і IV, в яких А означає 4-фторфенільний радикал, особливо бажані. Даний винахід також стосується нових сполук формул І, II, III і IV. Реакцію, застосовувану в способі за даним винаходом для одержання 5-арилнікотинальдегідів, легко можна здійснити за допомогою 5-арилнікотинових кислот, які переважно можуть бути гідрогенізованими в органічних розчинниках, при температурі від 10 до 180°С, переважно в межах від 20 до 150°С і особливо бажано, в межах від 40 до 100°С, і під тиском від 1 до 150 бар, переважно від 1,5 до 120 бар і особливо від 2 до 100 бар, із додаванням карбонового ангідриду за наявності паладієво-лігандного комплексу. Розчинники, застосовувані для здійснення способу за даним винаходом, являють собою переважно ефіри, такі як, наприклад, діетиловий ефір або тетрагідрофуран; кетони, такі як, наприклад, ацетон; вуглеводні, такі як, наприклад, толуол, бензол, гексан або гептан; аміди, такі як, наприклад, диметилформамід або N-метилпіролідон, або кислотні ангідриди, такі як, наприклад, оцтовий ангідрид. Особливу перевагу віддають ефірам, зокрема тетрагідрофурану. Аналогічним чином можуть застосовуватися суміші вищезгаданих розчинників. Кількість розчинника не є вирішальною; для проведення реакції можна, переважно, додати від 10 до 500г розчинника на 1г сполуки формули II. Тривалість реакції залежить від обраних реакційних умов. У загальному випадку тривалість реакції становить від 0,5 години до 10 днів, переважно від 1 до 24 годин. У кращому здійсненні винаходу потрібний момент завершення реакції відновлення альдегіду визначають за допомогою прийнятних аналітичних методів, наприклад HPLC (рідинна хроматографія високої роздільної здатності), і реакцію відновлення переривають. Застосовуваний у реакції гідрогенізації каталізатор являє собою паладієво-лігандний комплекс. Використовувані ліганди являють собою фосфіни, бажано з трьома органічними радикалами, зокрема алкільними та арильними радикалами. Переважно застосовувані ліганди можуть бути монозубими або двозубими фосфінами. Бажаними монозубими фосфінами можуть бути, наприклад, (СН 3)3Р, (С2Н5) 3Р, (С3Н7)3Р, (С4Н9)3Р, (С5Н11) 3Р, (С6Н13)3Р, (С7Н15)3Р, (С8Н17)3Р, (С6Н11) 3Р, (С6Н5) 3Р, (СН3С6Н4)3Р, (С6Н5СН2) 3Р, (С4Н9)2(С6Н5)Р і (С4Н9) (С6Н5) 2Р. Ви щевказані емпіричні формули включають розгалужені та циклічні вуглеводневі радикали. Перевагу віддають n-пропілу, n-бутилу, сек-бутилу, трет-бутилу та циклогексилу в якості вуглеводневих радикалів. Бажані фосфіни з ідентичними радикалами. Прикладами придатних двозуби х лігандів є такі: де Су означає циклогексил та q дорівнює 1, 2 або 3, зокрема 1 або 3. Кращими лігандами є наступні: трифенілфосфін, ди феніл-фосфінофероцен, три-о-толілфосфін, 1,2біс(дифенілфосфіно)етан, 2,4-біс(дифенілфосфіно)пентан, біс(дифенілфосфіно)метан і трис(третбутил)фосфін. Можна також застосовувати суміші цих лігандів. Паладієві сполуки можуть застосовуватися в II стадії окислення, тобто як сіль, або в 0 стадії окислення, бажано в 0 стадії окислення і переважно комплексованими фосфінами. В загальному випадку паладій застосовують у вигляді паладієвої сполуки, з якої за допомогою додавання лігандів виготовляють відповідний каталізатор. Можна також застосовувати паладій у вигляді комплексу строго стехіометричного складу, до якого за даним винаходом додають таку кількість ліганду, щоб спостерігався саме такий надлишок ліганду, якого потребують за даним винаходом. Прийнятними сполуками паладію, що застосовуються при надлишку ліганду, переважно є такі: комплекси тетракис(трифенілфосфін)паладій(0), дибензиліденпаладій(0), паладій на вугіллі (переважно 5%), PdCl2dppf, комплекс ацетат паладію /три-О-толілфосфіну, Pd(O)*dppe, Pd(O)*dppp, Pd(0)*dppm, Pd(COD)Cl2, PdCl 2, Pd(OAc)2 і PdBr2. Особливу перевагу віддають комплексам тетракис(трифенілфосфін) паладію(О), дибензиліденпаладію(О), паладію на вугіллі (переважно 5%), PdCl 2dppf, комплекс ацетат паладію/три-Отолілфосфін у, Pd(O)*dppe, Pd(O)*dppp та Pd(0)*dppm. Молярне співвідношення паладію та гідрогенізованої кислоти становить, переважно, від 1:500 до 1:200, особливо від 1:50 до 1:100. Молярне співвідношення паладію та ліганду становить від 1:5 до 1:15, переважно від 1:5 до 1:10, особливо від 1:5 до 1:6 у випадку моноденатних лігандів і від 1:2,5 до 1:7,5, переважно від 1:2,5 до 1:5, зокрема від 1:2,5 до 1:3, у випадку біденатних лігандів. Нерозчинювальні ангідриди, застосовувані за даним способом, переважно являють собою триметилоцтовий ангідрид, оцтовий ангідрид, ізомасляний ангідрид, 5-норборнен-2,3-дикарбоновий ангідрид, 1,2,3,6-тетрагідрофталевий ангідрид і нафталін-1,8-дикарбоновий ангідрид. Молярне співвідношення карбонового ангідриду й 5-арилнікотинової кислоти становить, переважно, від 10:1 до 8:1, переважно від 7:1 до 6:1 і зокрема від 5:1 до 2:1. Після видалення розчинника сполуки формули І можуть бути отримані після проведення звичайної обробки, яка включає, наприклад, додавання до реакційної суміші води й екстракції. Це може бути корисно в плані подальшого очищення продукту наступною дистиляцією або кристалізацією. Сполуки формули І, які можуть бути отримані згідно зі способом за даним винаходом, являють собою важливі проміжні сполуки і кінцеві продукти промислової органічної хімії. Певним чином заміщені похідні сполуки являють собою, зокрема, важливі проміжні сполуки для синтезу кінцевих продуктів високої переробки або самі є такими кінцевими продуктами, призначеними для захисту сільськогосподарських культур, наприклад такими як фунгіциди, інсектициди, гербіциди або пестициди, або для одержання речовин, що мають високу фармацевтичну активність. Навіть без опису подальших здійснень даного винаходу передбачається, що фахівці мають можливість застосовувати наведений тут опис у найширши х межах. Тому кращі здійснення варто розглядати як ілюстративний опис, яким даний винахід жодним чином не обмежується. Нижче даний винахід ілюструється на прикладах, якими його застосування не обмежується. Якщо не обговорено особливо, то відсотки означають вагові відсотки. Всі температури наведені в градусах Цельсія. Приклад 1: Попередньо завантажують у реактор 13,2г 4-фторбензолбористої кислоти і 10,8г водневого карбонату натрію, потім, при перемішуванні в атмосфері захисного газу, додають суміш 16,1г 5-бромо-3гідроксиметилпіридину, 30мл води і 60мл толуолу. Далі додають 14мл води, 28мл толуолу і 0,5г тетракис(трифенілфосфін)паладію(0). Реакційну суміш нагрівають до дефлегмації і витримують при цій температурі протягом 2 годин. Після охолодження суміш піддають звичайній обробці й одержують 5-(4фтор феніл)нікотиніловий спирт. Далі спирт окисляють згідно зі звичайною методикою й одержують 5-(4фтор феніл)нікотинову кислоту. Приклад 2: 1,38кг 5-бромнікотинової кислоти, 1,10кг 4-фторбензолборонової кислоти і 0,40кг Pd на активованому вугіллі (5%) завантажують у 8,5 літри води. Чорну суспензію нейтралізують лугом за допомогою 1,39кг 32% розчину гідроокису натрію, і нагрівають до 100°С. Через 4 години суміш піддають звичайній обробці й одержують 5-(4-фторфеніл)нікотинову кислоту. Інтервал плавлення: від 198,5°С до 203°С. Приклад 3: 15,3г метил 5-(4-фторфеніл)нікотинат (що його можна одержати в реакції Suzuki, яка приводить до спарювання метил 5-бромпіридин-3-карбоксилату з 4-фторбензолбороновою кислотою, аналогічно до Прикладів 1 або 2) омилюють звичайними методами й одержують 5-(4-фторфеніл) нікотинову кислоту. Приклад 4: Реакцію 5-бром-3-ацетоксиметилпіридину з 4-фторбензолбороновою кислотою здійснюють за методикою, описаною в Прикладі 1. Отриманий 5-(4-фторфеніл)піридин-3-ілметилацетат омилюють звичайними методами і потім окисляють; у результаті одержують 5-(4-фторфеніл) нікотинову кислоту. Приклад 5: 5-(4-Фторфеніл) нікотинову кислоту розчиняють у тетрагідрофурані в автоклаві, додають три еквіваленти ангідриду відповідної кислоти, і суміш підтримують в інертному стані за допомогою повторних введень захисного газу. Розчини Pd(OAc)2 і PPh3 в тетрагідрофурані додають у протитечії захисного газу, далі реакційний розчин гідрогенізують при перемішуванні, при температурі 80°С і під тиском водню 8 бар. У результаті звичайної обробки одержують альдегід із виходом 98%.
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for producing 5-(4-fluorophenyl)nicotinaldehyde
Назва патенту російськоюСпособ получения 5-(4-фторфенил)никотинальдегида
МПК / Мітки
МПК: C07D 213/80, C07D 213/78, C07D 213/30, C07D 401/04, C07D 213/48, C07D 213/803, C07D 405/12
Мітки: 5-(4-фторфеніл)нікотинальдегіду, одержання, спосіб
Код посилання
<a href="https://ua.patents.su/5-73973-sposib-oderzhannya-5-4-ftorfenilnikotinaldegidu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 5-(4-фторфеніл)нікотинальдегіду</a>
Попередній патент: Спосіб приготування ароматичних карбонових кислот
Наступний патент: Спосіб формування колонки заряду вибухової речовини у свердловині
Випадковий патент: Застосування інгібітора il-18 для лікування захворювань периферичних судин (варіанти), застосування вектора (варіанти)









