R-(-)-1-[2-(7-хлорбензо[b]тіофеніл-3-ілметокси)-2-(2,4-дихлорфеніл)етил]-1н-імідазол
Номер патенту: 78010
Опубліковано: 15.02.2007
Автори: Англада Луїс, Фогет Рафаель, Раментоль Хорхе, Гугліетта Антоніо, Паласін Селія
Формула / Реферат
1. R-(-)-1-[2-(7-хлорбензо[b]тіофен-3-ілметокси)-2-(2,4-дихлорфеніл)етил]-1Н-імідазол формули (І):
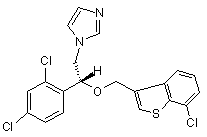 (I)
(I)
та його фармацевтично прийнятні солі.
2. Мононітрат R-(-)-1-[2-(7-хлорбензо[b]тіофен-3-ілметокси)-2-(2,4-дихлорфеніл)етил]-1Н-імідазолу.
3. Спосіб одержання сполуки згідно з пунктом 1 або пунктом 2, при якому проводять реакцію R-(-)-1-(2, 4-дихлорфеніл)-2-імідазол-1-ілетанолу формули ((R)- (-)-ІІІ):
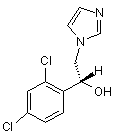 ((R)-(-)-III)
((R)-(-)-III)
з 3-галометил-7-хлорбензо[b]тіофеном формули (IV)
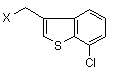 (IV),
(IV),
де Х являє собою галоген, та необов'язкову обробку одержаного R-(-)-1-[2-(7-хлорбензо[b]тіофен-3-ілметокси)-2-(2,4-дихлорфеніл)етил]-1Н-імідазолу кислотою, що утворює сіль.
4. Спосіб згідно з пунктом 3, в якому Х являє собою хлор або бром.
5. Спосіб згідно з пунктом 3 або пунктом 4, в якому сполука представляє собою мононітрат R-(-)-1-[2-(7-хлорбензо[b]тіофен-3-ілметокси)-2-(2,4-дихлорфеніл)етил]-1Н-імідазолу, а кислотою, що утворює сіль, є азотна кислота.
6. Спосіб згідно з будь-яким з пунктів 3 - 5, в якому R-(-)-1-(2,4-дихлорфеніл)-2-імідазол-1-ілетанол формули (R)-(-)-(III) одержують шляхом енантіоселективного відновлення 1-(2,4-дихлорфеніл)-2-імідазол-1-ілетанону за допомогою (-)-(β-хлордіізопінокамфенілборану.
7. Фармацевтична або сільськогосподарська композиція, що містить R-(-)-1-[2-(7-хлорбензо[b]тіофен-3-ілметокси)-2-(2,4-дихлорфеніл)етил]-1Н-імідазол або його сіль.
8. Фармацевтична або сільськогосподарська композиція, що містить мононітрат R-(-)-1-[2-(7-хлорбензо[b]тіофен-3-ілметокси)-2-(2,4-дихлорфеніл)етил]-1Н-імідазолу.
9. Застосування R-(-)-1-[2-(7-хлорбензо[b]тіофен-3-ілметокси)-2-(2,4-дихлорфеніл)етил]-1Н-імідазолу або його солі для одержання фармацевтичної композиції для лікування грибкових інфекцій у людини та тварин, або сільськогосподарської композиції для боротьби з хворобами рослин.
10. Застосування мононітрату R-(-)-1-[2-(7-хлорбензо[b]тіофен-3-ілметокси)-2-(2,4-дихлорфеніл)етил]-1Н-імідазолу для одержання фармацевтичної композиції для лікування грибкових інфекцій у людини та тварин, або сільськогосподарської композиції для боротьби з хворобами рослин.
Текст
1. R-(-)-1-[2-(7-хлорбензо[b]тіофен-3ілметокси)-2-(2,4-дихлорфеніл)етил]-1Н-імідазол формули (І): 2 3 78010 Даний винахід відноситься до R-(-)-1-[2-(7хлорбензо[b]тіофен-3-ілметокси)-2-(2,4дихлорфеніл)етил]-1Н-імідазолу (R-(-)сертаконазолу) та його солей, способу його одержання, композицій, які включають вказану сполуку, та їх застосування для лікування грибкових інфекцій та боротьби з захворюваннями сільськогосподарських культур. Рацемічний 1-[2-(7-хлорбензо[b]тіофен-3ілметокси)-2-(2,4-дихлорфеніл)етил]-1Н-імідазол представляє собою сполуку, що відома як сертаконазол (WHO, INN), він є корисним як протигрибковий агент для лікування захворювань, спричинених грибками та дріжджами у людини та у тварин. Спосіб його приготування та його мононітрати розкриті в європейському патенті №151.477. Даний винахід відноситься до R-(-)-1-[2-(7хлорбензо[b]тіофен-3-ілметокси)-2-(2,4дихлорфеніл)етил]-1Н-імідазолу формули (І): а також його фармацевтично прийнятних адитивних солей. R-(-)-енантіомер сертаконазолу володіє активністю приблизно у два рази вищою, ніж така для рацемічної суміші, як проти грибків, так і дріжджів (оскільки його афінність до цільових клітин є в два раза вищою), як представлено на Таблиці. Це відкриття дало можливість створити композиції R-(-)сертаконазолу у дозах, що в два рази менші від тих, що використовуються для рацемічного сертаконазолу, і, таким чином, знижується ризик виникнення побічних ефектів та здійснюється супресія неспецифічної токсичності завдяки небажаній фракції S-(+)-енантіомера. Мононітрат представляє собою бажану сіль R(-)-сертаконазолу. Даний винахід також відноситься до способу приготування R-(-)-енантіомера сертаконазолу та його фармацевтично прийнятних адитивних солей, при цьому такий процес включає реакцію R-(-)-1-(2, 4-дихлорфеніл)-2-імідазол-1ілетанолу формули ((R)-(-)-lll) з 3-галометил-7-хлорбензо[b]тіофеном фор 4 мули (IV): де X представляє собою галоген. Сполука може бути відновлена з реакційної суміші способом, який є відомим сам по собі. Якщо це є бажаним, то сировий продукт може бути далі очищений за допомогою способів, які добре відомі у даній галузі те хніки, наприклад, кристалізацією та/або хроматографією. Приготування S-(+)-енантіомера сертаконазолу можна здійснювати при використанні S-(+)-1(2,4-дихлорфеніл)-2-імідазол-1-ілетанолу, замість R-(-)-енантіомера. Необхідною умовою приготування енантіомерів сертаконазолу згідно з вказаним процесом є приготування прийнятних енантіомерів проміжної сполуки 1-(2,4-дихлорфеніл)-2-імідазол-1ілетанолу (III). Два енантіомери 1-(2,4-дихлорфеніл)-2імідазол-1-ілетанолу (III) можуть бути приготовлені шляхом розділення відповідної рацемічної суміші з оптично активних кислот, бажано L-винної кислоти, D-винної кислоти, дибензоїл-L-винної кислоти, дибензоїл-D-винної кислоти, та подібних, згідно зі способом, описаним у [патенті GB №1.244.530 та у Lammerhofer Μ. та Lindner W. (Chirality 6: 261-269, 1994)]. (R)-(-)-1-(2,4-дихлорфеніл)-2-імідазол-1ілетанол також одержують шляхом енантіомерноселективного відновлення 1-(2,4-дихлорфеніл)-2імідазол-1-ілетанону (II) при використанні (-)-bхлордифосфінокамфенілборану, [(-)-DIP хлорид], що веде до одержання (R)-(-)-1-(2,4-дихлорфеніл) 2-імідазол-1-ілетанолу ((R-(-)-lll), який має прийнятну оптичн у чистоту. Реакцію одного з енантіомерів формули (III) з 3-галометил-7-хлорбензо[b]тіофеном (IV) здійснюють для одержання відповідного енантіомера сертаконазолу у вигляді вільної основи. Серед них 3-галометил-7-хлорбензо[b]тіофени, 3-хлорметил7-хлорбензо[b]тіофен та 3-бромометил-7хлорбензо[b]тіофен є бажаними. Енантіомери сертаконазолу у вигляді вільних основ можуть бути перетворені у фармацевтично прийнятні солі способом, який відомий сам по собі. Бажано, коли мононітрати одержують шляхом обробки азотною кислотою. Етапи реакції для приготування енантіомерів сертаконазолу представлені на наступній схемі: 5 78010 6 тичні композиції, що їх містять, та підтвердження біологічної активності стосовно різноманітних мікроорганізмів. Приклад 1: R-(-)-1-(2, 4-дихлорфеніл)-2імідазол-1іл-етанол В одногорловій колбі на 50мл, оснащеній додатковою воронкою, охолоджувальною камерою, магнітною мішалкою та пристроєм для введення азоту, перемішували 3,14г (9,8ммол, 2,5екв.) (-)DIP хлориду та 9мл безводного етилового етеру (молекулярні сита 4Å). До одержаної суміші додавали по краплях при кімнатній температурі в атмосфері азоту розчин 1-(2,4-дихлорфеніл)-2імідазол-1-ілетанону в 10мл безводного тетрагідрофурану (молекулярні сита 4Å). Суміш перемішували протягом 24 годин при кімнатній температурі в атмосфері азоту. Додавали 0,4мл метанолу, перемішували протягом 10 хвилин, видаляли розчинники шляхом випарювання при зниженому тиску. До одержаного сирового продукту додавали 10мл н-гексану та 10мл води. Суміш підкислювали шляхом додання 1,5мл 6Μ соляної кислоти. Відокремлювали дві фази та видаляли органічний шар. Водну фазу нейтралізували за допомогою 3Μ NaOH до тих пір, поки рН не ставало рівним 10-11 у присутності 10мл етилового етеру. Розділяли дві фази, а органічний шар промивали за допомогою 10мл етилового етеру. Два шари етеру висушуваДаний винахід також відноситься до фармацели над безводним сульфатом натрію та випарювтичних композицій, що містять R-(-)-сертаконазол вали до осушення за допомогою дистиляції при та/або його сіль та до застосування R-(-)зниженому тиску. Одержували 1,27г сирового просертаконазолу та/або його солі для лікування індукту та піддавали кристалізації із суміші 5мл суфекцій, спричинених грибками та дріжджами, як у міші етанол/вода 1:1 об./об. для одержання 0,8г людини, так і у домашніх тварин, а також проти (R=80%) (R)-(-)-1-(2,4-дихлорфеніл)-2-імідазол-1захворювань сільськогосподарських рослин, сприілетанолу. чинених таким мікроорганізмами. Аналітичні дані: Сполуки згідно з даним винаходом, необов'язDSC: пік при температурі 107,4°С ково змішані з фармацевтично прийнятними носіІЧ спектр: підтверджує 1 ями, можуть вводитися людині або тваринам пеН-13С-ЯМР (ДМСО) спектр: підтверджує роральним шляхом у формі таблеток, капсул, [a]D20 (c=1%, МеОН) = -80. таблеток з покриттям, сиропів, розчинів, порошків, Приклад 1': R-(-)-1-(2, 4-дихлорфеніл)-2гранул, емульсій, оральних гелів, оральних паст, імідазол-1-ілетанол букофарингеальних розчинів, букофарингеальних Розчин 5г 1-(2, 4-дихлорфеніл)-2-імідазол-1суспензій, букофарингеальних гелів, букофарингеілетанолу в суміші ацетон/метанол (25мл/20мл) альних паст, то що, шля хом ін'єкцій, ректальним повільно додавали до D-винної кислоти (3,21г), шляхом та за допомогою вагінальнорозчиненої у суміші ацетон/метанол (25мл/10мл) внутрішньоматкового введення у формі вагінальпри кімнатній температурі. Коли додання було заної таблетки, вагінальної капсули, вагінального вершене, реакційну суміш перемішували протягом тампону, просоченого лікарським засобом, мазі, додаткових 30 хвилин при кімнатній температурі. крему, гелю, піни, розчину, емульсії, суспензії, маОдержану тверду речовину фільтрували та повтоткового кільця, примочки, тощо, при добовій дозі, рно кристалізували у метанолі. Вихід ізольованого що коливається від 50 до 400мг; та шляхом місцепродукту: 1,85г (37%), енантіомерна чистота: >98% вого застосування у формі крему, примочки, пасти, R-ізомера. суспензії, мазі, емульсії, піни, шампуні, порошка, Приклад 2: (R)-(-)-1-[2-(7-хлорбензо[b]тіофенгелю, то що при концентраціях від 0,5 до 3%. 3-ілметокси)-2-(2,4-дихлорфеніл)-етил]-1НКрім того, сполуки згідно з даним винаходом імідазол І необов'язково можуть змішуватися с розріджуваУ трьохгорлій колбі на 100мл, оснащеній звочем або носієм, коли використовуються проти заротним холодильником, імерсійним термометром, хворювань сільськогосподарських рослин, при додатковою воронкою, резервуаром для охолоцьому їх застосовують шля хом поливу, розпилендження, пристроєм для введення азоту, перемішуня, розбризкування, опудрювання, або у формі вали 10мл сухого Ν,Ν-диметилформаміду (молепорошку, крема, пасти, тощо при нормі 0,05-10кг кулярні сита 4Å) та 1,27г (11,3ммолів, 1,03екв.) на гектар грунту. трет-бутоксиду натрію. Одержану суміш перемішуНаступні приклади будуть ілюструвати приговали, охолоджували на водяній бані, по краплях тування енантіомерів сертаконазолу, фармацевдодавали розчин 2,83г (11ммолів) (R)-(-)-1-(2,4 7 78010 8 дихлорфеніл)-2-імідазол-1-ілетанолу в 15мл сухоDSC: пік при температурі 83,4°С го Ν,Ν-диметилформаміду. Після того, як додання ІЧ спектр: підтверджує 1 було закінчено, суміш перемішували протягом 45 Н-13С-ЯМР (ДМСО) спектр: підтверджує хвилин та додавали розчин 2,93г (11,2ммолів, [a]D20 (с=1%, МеОН) = +69,0 1,02екв.) 3-бромометил-7-хлорбензо[b]тіофену у Приклад 4: (R)-(-)-сертаконазол мононітрат 7мл сухого N,N-диметилформаміду. Реакційну (мононітрат (R)-(-)-1-[2-(7-хлорбензо[b]тіофен-3суміш перемішували протягом 4 годин при кімнатілметокси)-2-(2,4-дихлорфеніл)етил]-1Н-імідазолу) ній температурі. Випарювали розчинник шляхом 880мг (2,01ммолів) (R)-(-)-1-[2-(7дистиляції при зниженому тиску, а залишок обробхлорбензо[b]тіофен-3-ілметокси)-2-(2,4ляли за допомогою 50мл метиленхлориду. Одердихлорфеніл)етил]-1Н-імідазолу розчиняли у 5мл жаний розчин двічі промивали за допомогою 30мл 96% етанолу. Додавали 1мл води та підігрівали води, висушували над безводним сульфатом напри температурі від 35 до 37°С. До одержаного трію, фільтрували та випарювали до осушення за розчину додавали 0,23мл 60% азотної кислоти допомогою дистиляції при зниженому тиску для (3ммолів, 1,5екв.). Потім додавали 3мл води та одержання 4,62г сирового продукту охолоджували спочатку при кімнатній температурі, Одержаний сировий продукт очищали при а потім при температурі 10°С протягом 1 години. проведенні хроматографії через колонку, заповнеУтворену тверду речовину фільтр ували, двічі прону силікагелем, використовуючи градієнт метиленмивали за допомогою 4мл води та висушували у хлорид/метанол як елюант. Одержували смолу вакуумі протягом 24 годин для одержання 0,9г (2,0г), яку кристалізували з етилового етеру (R=89%) мононітрату (R)-(-)-1-[2-(7(10мл). Тверду речовину фільтрували та висушухлорбензо[b]тіофен-3-ілметокси)-2-(2,4вали для одержання 1,22г (R=25,1%) (R)-(-)-1-[2-(7дихлорфеніл)-етил]-1Н-імідазолу. хлорбензо[b]тіофен-3-ілметокси)-2-(2,4Аналітичні дані: дихлорфеніл)етил]-1Н-імідазолу. DSC: пік при температурі 116,87°С Аналітичні дані: ІЧ спектр: підтверджує 1 DSC: пік при температурі 74,5°С Н-13С-ЯМР (ДМСО) спектр: підтверджує ІЧ спектр: підтверджує [a]D20 (с=1%, МеОН) = -85,00. 1 Н-13С-ЯМР (ДМСО) спектр: підтверджує Приклад 4': [a]D20 (С=1%, МеОН) = -61,0 Мононітрат (R)-(-)-сертаконазолу (мононітрат Приклад 3: (S)-(+)-1-[2-(7-хлорбензо[b]тіофен(R)-(-)-1-[2-(7-хлорбензо[b]тіофен-3-ілметокси)-23-ілметокси)-2-(2,4-дихлорфеніл)етил]-1Н-імідазол (2,4-дихлорфеніл)етил]-1Н-імідазолу) У трьохгорлій колбі на 100мл, оснащеній звоУ колбі на 500мл, що оснащена механічною ротним холодильником, імерсійним термометром, мішалкою, вносили 15,72г (R)-(-)-1-(2,4додатковою воронкою, резервуаром для охолодихлорфеніл)-2-імідазол-1ілетанолу, 45мл толуодження, пристроєм для введення азоту, перемішулу, 1,05г гідросульфа ту тетрабутиламонію та 24,5г вали 16мл сухого Ν,Ν-диметилформаміду (моле18N водного розчину NaOH. Суміш підігрівали до кулярні сита 4Å) та 2,04г (18,43ммолів, 1,05екв.) температури 35-40°С та температур у підтримуватрет-бутоксиду натрію. До одержаної суміші, о холи на вказаному рівні протягом додаткових 15 лодженій на водяній бані, по краплях додавали хвилин. Потім додавали розчин 3-бромометил-7розчин 4,44г (17,2ммолів) (S)-(+)-1-(2,4хлорбензо[b]тіофен у 376мл толуолу протягом 30 дихлорфеніл)-2-імідазол-1-ілетанолу в 25мл сухохвилин. Температур у підтримували протягом 2,5 го Ν,N-диметилформаміду. Після того, як додання годин у межах від 37 до 40°С, а потім додавали було закінчено, суміш перемішували протягом 45 воду. Після концентрації при зниженому тиску сихвилин та додавали до розчину 4,61г ровий продукт розчиняли у 150мл абсолютного (17,62ммолів, 1,02екв.) 3-бромометил-7етанолу. Потім додавали суміш 9,1г 60% НNО3 та хлорбензо[b]тіофену у 13мл сухого Ν,N130мл води, після того, як додання було закінчене, диметилформаміду. Реакційну суміш перемішувареакційну суміш охолоджували до температури ли протягом 4 годин при кімнатній температурі. 0°С. Одержану тверду речовину фільтрували, поВипарювали розчинник шляхом дистиляції при вторно кристалізували у суміші ацетон/етанол та зниженому тиску, а залишок обробляли за доповисушували. Ви хід ізольованого продукту: 24,5г могою 80мл метиленхлориду. Одержаний розчин (80%). двічі промивали за допомогою 50мл води, висушуПриклад 5: (S)-(+)-сертаконазол мононітрат вали над безводним сульфатом натрію, фільтру(мононітрат (S)-(+)-1-[2(7-хлорбензо[b]тіофен-3вали та випарювали до осушення за допомогою ілметокси)-2-(2,4-дихлорфеніл)етил]-1Н-імідазолу) дистиляції при зниженому тиску для одержання 2,35мг (5,37ммолів) (S)-(+)-1-[2-(77,30г сирового продукту. хлорбензо[b]тіофен-3-ілметокси)-2-(2,4Одержаний сировий продукт очищали при дихлорфеніл)етил]-1Н-імідазол розчиняли у 17мл проведенні хроматографії через колонку, заповне96% етанолу. Додавали 3мл води та підігрівали ну силікагелем, використовуючи градієнт метиленпри температурі від 35 до 40°С. До одержаного хлорид/метанол як елюант. Одержували смолу розчину додавали 0,61мл 6С% азотної кислоти (3,78г), яку кристалізували з етилового етеру (8,06ммолів, 1, екв.). Потім додавали 13мл води та (18мл). Тверду речовину фільтрували та висушуохолоджували спочатку при кімнатній температурі, вали для одержання 2,61г (R=34,5%) (S)-(+)-1-[2а потім при температурі 10°С протягом 1 години. (7-хлорбензо[b]тіофен-3-ілметокси)-2-(2,4Утворену тверду речовину фільтр ували, двічі продихлорфеніл)етил]-1Н-імідазолу. мивали за допомогою 10мл води та висушували у Аналітичні дані: вакуумі протягом 24 годин для одержання 2,65г 9 78010 10 (R=98,5%) мононітрату (S)-(+)-1-[2-(7Приклад 8: Біологічні дані хлорбензо[b]тіофен-3-ілметокси)-2-(2,4Мінімальні інгібіторні концентрації (МІК) визнадихлорфеніл)-етил]-1Н-імідазолу. чали при використанні модифікації способу мікроАналітичні дані: розведень М27-А, що рекомендований НаціональDSC: пік при температурі 168,91°С ним Комітетом для клінічних лабораторних ІЧ спектр: підтверджує стандартів, у середовищі RPMI-1640 (Sigma), що 1 Н-13С-ЯМР (ДМСО) спектр: підтверджує додатково містить глюкозу до концентрації 2%, значення рН середовища доведене до 7,0 за до[a]D20 (с=1%, МеОН) = +89,00 помогою кислого буфера на основі 0,165Μ пропаПриклад 6: 1% композиція крему нсульфонового морфоліну (MOPS). Готували серійні двократні розведення у модифікованому Композиція для 100г середовищі RPMI-1640, що одержане з концентроМононітрат R-(-)-сертаконазолу 1,00г ваних розчинів. МІК визначали як найнижчі концеМоно- та дигліцерид пальмітинової та 6,00г нтрації лікарського замобу, що приводять до 50%стеаринової кислоти ного інгібування росту у порівнянні з таким для Кетостеариловий спирт з 20молями ети1,00г росту контролю. Мікробіологічні активності, вираленоксиду жені як геометричні значення R-(-)сертаконазолу у Дециловий естер олеїнової кислоти 5,00г порівнянні з S-(+)-енантіомером, який є менш акМоноетаноламін ундециленової кислоти 2,00г тивним, та з рацемічним сертаконазолом, як предКарбомер 1,00г ставлено у Таблиці. Кількість штамів, що викорисТриетаноламін 0,60г товувалися в експериментах, приведено у дужках Метилпарабен 0,15г після назви кожного мікроорганізму. Пропілпарабен 0,05г Дистильована вода до об'єму 100,00г Таблиця Приклад 7: 1% гелева композиція Композиція для 100г Мононітрат R-(-)-сертаконазолу Пропіленгліколь Карбомер Твін 20 Феноксіетанол ЕДТА динатрію Лимонна кислота 1N гідроксид натрію Триетаноламін Дистильована вода до об'єму Комп’ютерна в ерстка О. Гапоненко МІК (мкг/мл) нітрату сертаконазолу та його енантioмерів 1,00г 10,00г 1,00г 0,10г 0,35г 0,15г 0,25г 1,50г 1,55г 100,00г Мікроорганізм Candida spp (42) Dermatophytes (17) Filamentous fungi (11) Malassezia spp (11) Підписне R-(-)SРацемат енантіомер (+)енантіомер 0,125 0,256 3,217 0,04 0,08 0,17 0,64 1,37 10,96 Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюR-(-)-1-[2-(7-chloro-benzo[b]thiophen-3-yl-methoxy)-2-(2,4-dichloro-phenyl)-ethyl)-1h-imidazole
Автори англійськоюGuglietta Antonio, Anglada Luis
Назва патенту російськоюR-(-)-1-[2-(7-хлорбензо[b]тиофенил-3-илметокси)-2-(2,4-дихлорфенил)этил]-1н-имидазол
Автори російськоюГуглиєтта Антонио, Англада Луис
МПК / Мітки
МПК: A61K 31/4178, C07D 409/12, A01N 43/50, A61P 31/00, C07D 521/00, A61P 31/10
Мітки: r-(-)-1-[2-(7-хлорбензо[b]тіофеніл-3-ілметокси)-2-(2,4-дихлорфеніл)етил]-1н-імідазол
Код посилання
<a href="https://ua.patents.su/5-78010-r-1-2-7-khlorbenzobtiofenil-3-ilmetoksi-2-24-dikhlorfeniletil-1n-imidazol.html" target="_blank" rel="follow" title="База патентів України">R-(-)-1-[2-(7-хлорбензо[b]тіофеніл-3-ілметокси)-2-(2,4-дихлорфеніл)етил]-1н-імідазол</a>
Попередній патент: Спосіб нівелювання
Наступний патент: Багатоствольна установка імпульсного розпилення
Випадковий патент: Спосіб кріоконсервування еритроцитів









