Спосіб промислового синтезу периндоприлу і його фармацевтично прийнятних солей
Формула / Реферат
1. Спосіб промислового синтезу периндоприлу формули (I)
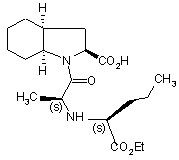 (І)
(І)
і його фармацевтично прийнятних солей, який відрізняється тим, що бензиловий ефір формули (IV):
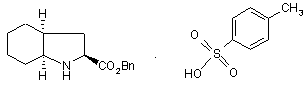 ,(IV)
,(IV)
де Вn представляє бензильну групу,
реагує зі сполукою формули (V):
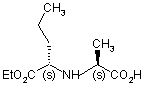 (V)
(V)
в етилацетаті,
у присутності кількості від 0,4 до 0,6 моля 1-гідроксибензотриазолу на моль використаної сполуки формули (IV) і в присутності кількості від 1 до 1,2 моля дициклогексилкарбодііміду на моль використаної сполуки формули (IV),
при температурі від 20 до 77°С,
з одержанням, після виділення, сполуки формули (VI):
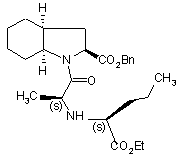 ,(VI)
,(VI)
де Вn представляє бензильну групу,
карбоксильну групу гетероциклу якої позбавляють захисту каталітичною гідрогенізацією з одержанням периндоприлу формули (І),
який перетворюють, якщо це бажано, на фармакологічно прийнятну сіль.
2. Спосіб синтезу за п. 1, який відрізняється тим, що периндоприл синтезують у формі його трет-бутиламінної солі.
3. Спосіб синтезу за п. 1, який відрізняється тим, що реакцію зв'язування проводять при відсутності триетиламіну.
4. Спосіб синтезу за п. 1, який відрізняється тим, що реакцію зв'язування проводять у присутності кількості триетиламіну, меншої або рівної 1 молю на моль використаної сполуки формули (IV).
5. Спосіб синтезу за п. 4, який відрізняється тим, що реакцію зв'язування проводять у присутності кількості триетиламіну, меншої або рівної 0,25 моля на моль використаної сполуки формули (IV).
6. Спосіб синтезу за будь-яким із пп. 1-5, який відрізняється тим, що сполука формули (VI) містить домішки сполук формул (VII) і (VIII), менш ніж 1,5%
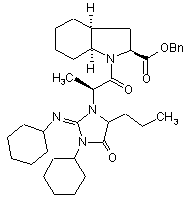 , (VII)
, (VII) 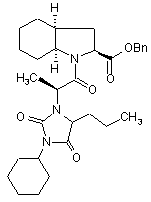 (VIII).
(VIII).
7. Спосіб синтезу за будь-яким із пп. 1-6, який відрізняється тим, що периндоприл містить домішки сполук формул (II) та (III), менш ніж 0,2% і 0,1% відповідно
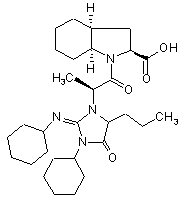 , (II)
, (II) 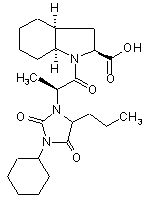 (III).
(III).
Текст
1. Спосіб промислового синтезу периндоприлу формули (I) H NH NH (s) CO2Et і його фармацевтично прийнятних солей, який відрізняється тим, що бензиловий ефір формули (IV): CH3 H O (IV) S H N H CO2Bn HO O , де Вn представляє бензильну групу, реагує зі сполукою формули (V): , де Вn представляє бензильну групу, карбоксильну групу гетероциклу якої позбавляють захисту каталітичною гідрогенізацією з одержанням периндоприлу формули (І), який перетворюють, якщо це бажано, на фармакологічно прийнятну сіль. 2. Спосіб синтезу за п. 1, який відрізняється тим, що периндоприл синтезують у формі його третбутиламінної солі. 3. Спосіб синтезу за п. 1, який відрізняється тим, що реакцію зв'язування проводять при відсутності триетиламіну. 4. Спосіб синтезу за п. 1, який відрізняється тим, що реакцію зв'язування проводять у присутності кількості триетиламіну, меншої або рівної 1 молю на моль використаної сполуки формули (IV). 5. Спосіб синтезу за п. 4, який відрізняється тим, що реакцію зв'язування проводять у присутності (11) (s) (І) CH3 O UA H3C CO2Et CO2H (19) N H 75070 (s) 3 75070 4 кількості триетиламіну, меншої або рівної 0,25 мосполук формул (II) та (III), менш ніж 0,2% і 0,1% ля на моль використаної сполуки формули (IV). відповідно 6. Спосіб синтезу за будь-яким із пп. 1-5, який відH різняється тим, що сполука формули (VI) містить домішки сполук формул (VII) і (VIII), менш ніж 1,5% OH H N H H3 C O OBn O N (II) N H N CH3 H3 C O O N (VII) N O N CH3 N O , H , H H3C H N O O H O CH3 O (III). N O (VIII) N O H3 C OBn OH N CH3 N O N O 7. Спосіб синтезу за будь-яким із пп. 1-6, який відрізняється тим, що периндоприл містить домішки Даний винахід відноситься до способу для промислового синтезу периндоприлу формули (І): і його фармацевтично прийнятних солей, Периндоприл, а також його фармацевтично прийнятні солі, і особливо його трет-бутиламінна сіль, володіють цінними фармакологічними властивостями. їхня основна властивість полягає в інгібуванні ферменту, що перетворює ангіотензин І (або кініназу II), яка уможливлює, з одного боку, запобігання перетворенню декапептиду ангіотензину І на октапептид ангіотензин II (судинозвужувальний засіб) і, з іншого боку, запобігання розщепленню брадикініну (судинорозширювального засобу) до неактивного пептиду. Ці дві дії сприяють позитивному впливу периндоприлу при серцево-судинних захворюваннях, особливо артеріальній гіпертензії і серцевій недостатності. Периндоприл, його приготування і його терапевтичне застосування були описані у європейському патентному описі ЕР 0049658. Враховуючи фармацевтичну зацікавленість у цій сполуці, важливо зуміти отримати її шляхом ефективного промислового способу синтезу, який легко може бути застосований у промисловому масштабі, даючи периндоприл із хорошим виходом і, головним чином, із відмінним ступенем чистоти. Патентний опис ЕР 0308341 характеризує промисловий синтез периндоприлу шляхом зв'язування (2S,3aS,7аS)-октагідроіндол-2-карбонової 5 75070 6 кислоти бензилового ефіру з N-[(S)-1допомогою цього способу, не є задовільною, і поткарбоксибутил]-(S)-алан1н етиловим ефіром, суребує стадії очищення для того, щоб одержати проводжуваного видаленням захисту карбоксильпериндоприл такої якості, яка могла б дозволити ної групи гетероциклу каталітичною гідрогенізайого використання як фармацевтичного активного цією. інгредієнта. Цей спосіб має перевагу одержання периндоДійсно, за умов, вказаних у цьому патентному прилу з хорошим виходом із вихідних матеріалів, описі, одержаний периндоприл забруднений значдля яких промисловий синтез уже був описаний. ними кількостями домішок формул (II) і (III): Однак чистота периндоприлу, одержаного за в етилацетаті, у присутності кількості від 0,4 до 0,6молів 1гідроксибензотриазолу на моль використаної сполуки формули (IV) і в присутності кількості від 1 до 1,2молів дициклогексилкарбодііміду на моль використаної сполуки формули (IV), при відсутності триетиламіну або у присутності кількості триетиламіну, меншої або рівної 1молю на моль використаної сполуки формули (IV), переважно меншої або рівної 0,25моля на моль використаної сполуки формули (IV), при температурі від 20 до 77°С, з одержанням, після виділення, сполуки формули (VI): У даний час заявник розробив новий промисловий спосіб синтезу, що дає вихід периндоприлу із ступенем чистоти, який сумісний з його використанням як фармацевтичного активного інгредієнта, із рівнями домішок формул (II) та (III), меншими ніж 0,2% і 0,1% відповідно. Більш конкретно, даний винахід відноситься до способу для промислового синтезу периндоприлу, який характеризується тим, що бензиловий ефір формули (IV): де Вn представляє бензильну групу, реагує зі сполукою формули (V): де Вn представляє бензильну групу, карбоксильну групу гетероциклу якої позбавляють захисту каталітичною гідрогенізацією з одержанням периндоприлу формули (І), який перетворюють, якщо це бажано, на фармакологічно прийнятну сіль, таку як третбутиламінна сіль. Даний спосіб становить особливий інтерес через такі причини: Зв'язування у лужному середовищі бензилового ефіру формули (IV) із сполукою формули (V) було описане у патентному описі ЕР 0308341, але за вказаних умов (використання 3молів сполуки формули (V), 3молів триетиламіну, 3,8молів 1гідроксибензотриазолу і 2,9молів дициклогексилкарбодііміду на моль використаної сполуки формули (IV)) утворюються численні вторинні продукти. Зокрема, одержана сполука формули (VI) міс 7 75070 8 тить у значних кількостях (від 5% до 15%) домішки лсульфонату, 0,06кг триетиламіну, 4,6л етилацеформул (VII) і (VIII), які, при проведенні дебензитату і потім, після перемішування протягом 10 лування, перетворюються на домішки формул (II) і хвилин при температурі навколишнього середо(III) вища, 0,52кг N-[(S)-етоксикарбоніл-1-бутил]-(S)аланіну, 0,15кг 1-гідроксибензотриазолу і 0,5кг дициклогексилкарбодііміду. Далі цю гетерогенну суміш доводять до 30°С протягом 3 годин при ретельному перемішуванні, після чого охолоджують до 0°С і фільтрують. Фільтрат далі промивають і потім упарюють до сухого залишку, одержуючи очікуваний продукт із виходом 92%. Приклад 2: (2S,3аS,7аS)-1-{(2S)-2-[(1S)-1(Етоксикарбоніл)-бутиламіно]-пропіоніл}-октагідро1H-індол-2-карбонова кислота Залишок, отриманий на попередній стадії (1кг), розчиняють у 1л метилциклогексану, і розчин переносять у гідрогенізатор; потім туди ж додають 0,13кг 5% паладію-на-вугіллі, суспендованого у - Заявник несподівано виявив, що зменшення 0,4л метилциклогексану, після чого додають 3,2л кількості або навіть відсутність триетиламіну на води. стадії зв'язування зробило можливим обмеження Далі суміш гідрогенізують під тиском 0,5бар рівнів домішок формул (VII) і (VIII) у сполуці форпри температурі від 15 до 30°С доти, поки буде мули (VI) до менше ніж 1,5%. поглинута теоретична кількість водню. - Каталітична гідрогенізація сполуки формули Після видалення каталізатора шляхом фільт(VI), таким чином, давала вихід периндоприлу знарування водну фазу фільтрату промивають метично кращої чистоти, і, зокрема, із рівнями домішок лциклогексаном і потім ліофілізують, одержуючи формул (II) і (III), меншими ніж 0,2% і 0,1% відповіочікуваний продукт із виходом 94%. дно. Приклад 3: (2S,3аS,7аS)-1-{(2S)-2-[(1S)-1- Крім того, зменшення, на стадії зв'язування, (етоксикарбоніл)-бутиламіно]-пропіоніл}-октагідрокількості сполуки формули (V), 11Н-індол-2-карбонової кислоти трет-бутиламінна гідроксибензотриазолу та дициклогексилкарбодіісіль міду уможливлює одержання сполуки формули Ліофілізат, отриманий на попередній стадії (VI) із виходом, який є таким же хорошим, як вихід, (1кг), розчиняють у 14л етилацетату; потім додаодержаний при використанні більших кількостей ють 0,2кг трет-бутиламіну і 2л етилацетату. реагентів, таким чином роблячи цей спосіб набаОдержану суспензію далі нагрівають із зворогато вигіднішим у промисловому масштабі. тним холодильником до досягнення повного розНижченаведені приклади ілюструють даний чинення, після чого отриманий у результаті розчин винахід, жодним чином не обмежуючи його. фільтрують гарячим, і охолоджують, при переміПриклад 1: Бензил (2S,3аS,7аS)-1-{(2S)-2шуванні, до температури 15-20°С. [(1S)-1-(етоксикарбоніл)-бутил-аміно]-пропіоніл}Потім одержаний осад відфільтровують, знову октагідро-1H-індол-2-карбоксилат перетворюють на пасту за допомогою етилацетаУ реакційний апарат поміщають, при переміту, висушують і далі подрібнюють, одержуючи очішуванні, 1кг (2S,3aS,7aS)-октагідроіндол-2куваний продукт із виходом 95%. карбонової кислоти бензилового ефіру паратолуо Комп’ютерна верстка Л. Купенко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for synthesis of perindopril and its pharmaceutically acceptable salts
Автори англійськоюLanglois Pascal
Назва патенту російськоюСпособ промышленного синтеза периндоприла и его фармацевтически приемлемых солей
Автори російськоюЛанглуа Паскаль
МПК / Мітки
МПК: C07K 5/06, C07D 209/42
Мітки: периндоприлу, промислового, синтезу, фармацевтично, спосіб, прийнятних, солей
Код посилання
<a href="https://ua.patents.su/4-75070-sposib-promislovogo-sintezu-perindoprilu-i-jjogo-farmacevtichno-prijjnyatnikh-solejj.html" target="_blank" rel="follow" title="База патентів України">Спосіб промислового синтезу периндоприлу і його фармацевтично прийнятних солей</a>
Попередній патент: Вузол нерухомої лопатки, розділений на сектори, для компресора турбоагрегату
Наступний патент: Спосіб пневматичного в’язання килимарського вузла
Випадковий патент: Спосіб вирівнювання споруд