Композиція для ін’єкцій на основі таксоїдів
Формула / Реферат
1. Композиція для ін'єкцій в формі емульсії, яка містить похідні класу таксанів, що складається з емульсії на основі фармацевтично прийнятної олії у воді і лецитинової композиції, в якій розчинений таксан, що відповідає наступній загальній формулі (І) або (II):
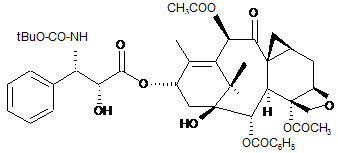 , (I)
, (I)
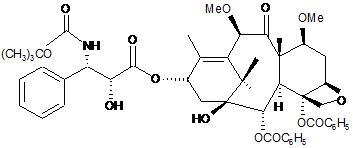 , (II)
, (II)
яка відрізняється тим, що вона містить додатково аніонну поверхнево-активну речовину.
2. Композиція за п. 1, яка відрізняється тим, що фармацевтично прийнятні олії вибрані з сумішей соєвої олії і тригліцеридів з ланцюгами середньої довжини.
3. Композиція за п. 1, яка відрізняється тим, що лецитин являє собою природний лецитин, вибираний з яєчного або соєвого лецетину, або напівсинтетичний лецитин, вибираний з фосфатидилхолінів.
4. Композиція за п. 1, яка відрізняється тим, що аніонною поверхнево-активною речовиною є фосфатидилгліцерин або фосфатидинова кислота.
5. Композиція за п. 4, яка відрізняється тим, що фосфатидилгліцерин вибраний з дилауроїлфосфатидилгліцерину (DLPG), диміристоїлфосфатидилгліцерину (DMPG) або дипальмітоїлфосфатидилгліцерину (DPPG).
6. Композиція за п. 4, яка відрізняється тим, що фосфатидинова кислота вибрана з натрієвих солей дилауроїлгліцерофосфатидинової кислоти (DLPA), диміристоїлгліцерофосфатидинової кислоти (DMPA) або дипальмітоїлгліцерофосфатидинової кислоти (DPPA).
7. Композиція за п. 1, яка відрізняється тим, що масове співвідношення між фосфатидилхоліном або лецитином і фосфатидилгліцерином або фосфатидиновою кислотою становить, переважно, величину від 500 до 3.
8. Композиція за п. 7, яка відрізняється тим, що масове співвідношення переважно становить величину від 100 до 10.
9. Композиція за п. 1, яка відрізняється тим, що рН складу доводять до величини 3-7 шляхом додавання кислоти.
10. Композиція за п. 9, яка відрізняється тим, що кислота вибрана з соляної, лимонної або аскорбінової кислоти.
11. Композиція за п. 1, яка відрізняється тим, що додають гістидиновий буфер.
12. Композиція за п. 1, яка відрізняється тим, що ізотонічність розчину досягається шляхом додавання гліцерину.
13. Композиція за п. 1, яка відрізняється тим, що масовий склад композиції знаходиться в наступних межах, %:
масляна фаза
10-30
лецитин або фосфатидилхолін
0,6-5
фосфатидилгліцерин
0,01-0,2
гліцерин
0-2,5
етанол
0-2
вода
до 100.
14. Композиція за будь-яким з пп. 1-13, яка відрізняється тим, що її вводять шляхом внутрішньовенної ін'єкції у вигляді болюсу.
15. Композиція за будь-яким з пп. 1-14, яка відрізняється тим, що частинки мають розмір від 100 нм до 1 мкм.
16. Спосіб одержання композиції за будь-яким з пп. 1-15, який відрізняється тим, що емульсію отримують за допомогою апарата мікрофлюїдизації або гомогенізатора високого тиску.
Текст
1. Композиція для ін'єкцій в формі емульсії, яка містить похідні класу таксанів, що складається з емульсії на основі фармацевтично прийнятної олії у воді і лецитинової композиції, в якій розчинений таксан, що відповідає наступній загальній формулі (І) або (II): C2 2 (19) 1 3 97418 4 14. Композиція за будь-яким з пп. 1-13, яка відрізняється тим, що її вводять шляхом внутрішньовенної ін'єкції у вигляді болюсу. 15. Композиція за будь-яким з пп. 1-14, яка відрізняється тим, що частинки мають розмір від 100 нм до 1 мкм. 16. Спосіб одержання композиції за будь-яким з пп. 1-15, який відрізняється тим, що емульсію отримують за допомогою апарата мікрофлюїдизації або гомогенізатора високого тиску. Даний винахід стосується нової фармацевтичної форми на основі терапевтичного агента, що має протипухлинну і протилейкемічну активність. Більш конкретно, він стосується нової форми для ін'єкцій, яка містить похідне наступної загальної формули (І): - 50 % об. етанолу - 50 % об. поліоксіетильованої касторової олії (наприклад Cremophor EL). Згідно з цією ж публікацією, для досягнення заданих концентрацій (між 0,3 і 1 мг/мл) необхідно ін'єкцювати розчини, які містять, нарівні з активною основою, певні концентрації кожної із сполук, таких як етанол і, особливо, Cremophor, в кількості близько 8 г на 100 перфузійного розчина. Оскільки лікування часто вимагає введення високих доз активної основи, а концентрація активної основи в розчині невелика, то в процесі лікування високооб'ємні вливання приводять, крім анафілактичних виявів, до явищ етилізму. Згідно з європейським патентом ЕР 0 593 601 з'ясувалося, що використання різних фармацевтичних форм дозволяє або значно знизити концентрації етанолу, або повністю виключити Cremophor і етанол з перфузійних розчинів. Для цього готували маточний розчин, який містить активна основа в суміші розчинників, що складається з етанолу, який вважається найкращим біосумісним розчинником активних основ класу таксанів, і поверхнево-активної речовини, вибраної з полісорбатів, що випускаються, зокрема, під найменуваннями Tween і Montanox, або складного/простого ефіру етиленоксиду і гліцеридів жирних кислот (гідрована або не гідрована касторова олія) що випускаються, наприклад під найменуванням Cremophor або Emulphor. Маточний розчин з низьким вмістом етанолу містить, переважно, менше 5 % етанолу, більш переважно, менше 2 % етанолу. Цей розчин є стабільним і тому може містити до 200 мг/мл, переважно, до 80 мг/мл активної основи в гюверхневоактивній речовині. Згідно з цим винаходом маточний розчин паклітакселу має концентрацію 6-20 мг/мл активної основи в поверхнево-активній речовині. Маточний розчин доцетакселу має концентрацію 20-80 мг/мл активної основи в поверхнево-активній речовині. Ці розчини в поверхнево-активній речовині, які необов'язково містять невеликі кількості етанолу, можуть бути розчинені в перфузійному розчині, але при умові дуже сильного перемішування, наприклад за допомогою апарату типу Vortex. Винахід, описаний в патенті ЕР 0 671 912, дозволяє вирішити задачі, не вирішені у вказаному вище патенті, і полягає він в приготуванні розчину, що є проміжним між розчином похідних класу таксанів в поверхнево-активній речовині і водним розчином, що містить добавку, сприяючу надалі розчиненню вказаного проміжного розчину в перфузійному розчині. або похідне наступної формули (II): Сполука формули (І) більш відома під загальним міжнародним найменуванням ларотаксел, в цей час вона проходить клінічні випробування і відома під абревіатурою XRP9881. Сполука загальної формули (II) також в цей час проходить клінічні випробування і відома під найменуванням XRP6258. Ці продукти виявляють високу активність in vivo по відношенню до злоякісних пухлин, що дозволяє їх дослідити при захворюваннях, резистентних до інших протиракових методів лікування. На жаль, цей вигляд продукту, зокрема, доцетаксел або паклітаксел, має настільки низьку розчинність у воді, що склад для ін'єкцій доводиться готувати на основі поверхнево-активної речовини і етанолу. Етанол є найкращим розчинником для молекул, які відповідають як формулі (І), так і формулі (II). Такі склади описані, наприклад в патенті ЕР 0 593 656 або в публікації, про яку говориться нижче. Наприклад згідно з публікацією Rowinsky, Lorraine, Cazenave et Donehower, надрукованою в National Cancer Institute, vol.82, No 15, ст.12471259, 1-го серпня 1990 року, і що стосується Таксолу, що має схожу розчинність із сполуками формули (І) або (II), готують перший розчин, званий "маточний розчин", що містить близько 6 мг/мл таксолу в розчинювальній суміші, що складається з: 5 Ці добавки вибирають з числа тих, які здатні роздрібнити або усунути утворення гелеподібної фази, яка утвориться між емульгатором, що містить похідне класу таксанів, і водою. Серед добавок, здатних роздрібнити або усувати утворення цієї гелеподібної фази, прикладами були підтверджені: - етанол - глюкоза - гліцерин - пропіленгліколь - гліцин - сорбіт - маніт - бензиловий спирт - поліетиленгліколи. Перфузійні розчини доцетакселу або паклітакселу вводили людям з швидкістю, яку попередньо визначали в залежності від кількості активної основи, необхідної для ін'єкційного введення. При використанні всіх складів відомого рівня техніки спостерігалися явища анафілактичного шоку, виражені більш або менш помірно, але ці явища завжди попереджалися введенням перед перфузією антигістамінного агента і/або кортикоїдів. Серед розчинів, розроблених останнім часом, здатних усувати ці анафілактичні вияви, з'явилися склади, в яких таксоїд взятий в капсулу на основі альбуміну. Цей розчин усуває появу анафілактичного шоку і, отже, усуває необхідність попереднього введення антигістамінних агентів і/або кортикоїдів і дозволяє вводити більш високі дози активної речовини при зниженні побічних ефектів в порівнянні з розчинами відомого рівня техніки. Такий склад описаний, наприклад в патенті US 6 537 579. Заявка на патент US2003/0099674 стосується ліофілізованих композицій, що складаються з таксоїду, солюбілізованого в краплі олії, інкапсульованої поверхнево-активною речовиною. Цей ліофілізований склад не колапсує і не руйнується під час зберігання. Вказана олія містить тригліцериди з ланцюгами середньої довжини (Miglyol 812N або МСТ) і соєву олію в числі багатьох інших олій. На стор. 7 [0072] написано, що ці ліофілізати менш схильні до втрат відносно стійкості і руйнування, ніж рідкі емульсії. Також вказується [0089], що емульсію в процесі її одержання необхідно піддавати ліофілізації протягом деяких годин або хвилин, і на відновлення ліофілізату також потрібно затратити години або хвилини. Серед прикладів в таблиці 2 описані розчини паклітакселу в олії з лецитином, ці розчини показали хорошу стійкість при ТА (кімнатній температурі) протягом одного місяця при використанні олії Miglyol і соєвої олії. Описаний також розчин, що містить воду з кунжутною олією. З розчинів, одержаних розчиненням ліофілізату, описані тільки ті, які виявили стабільність при 20 °C протягом 1 місяця. Ці умови стабільності не дають ніяких переваг перед розчинами, описаними в перших названих патентах з точки зору їх стабільності, оскільки метою даного винаходу є одержання складів, готових до вживання і стабільних 97418 6 протягом принаймні одного року при кімнатній температурі. На сьогоднішній день продовжуються пошуки складів, що дозволяють вводити задовільні дози агентів класу таксоїдів і одночасно виключити використання поверхнево-активних речовин типу поліоксіетильованої касторової олії або полісорбатів, але в яких таксоїди були б стабільними при кімнатній температурі і знаходилися в рідкій формі, що дозволяє їх змішування з перфузійним розчином без вияву фізичного явища, ведучого до розділення фаз, тобто або до осадження, або до відділення рідкої фази. Крім того, потрібні склади, які вводилися б в вигляді болюсу, не вдаючись до перфузій. Крім того, склади, що розробляються повинні забезпечити стабільність продукту при кімнатній температурі протягом часу і не повинні допускати руйнування таксоїду, наприклад під дією гідролізу. Даний винахід дозволяє досягнути вказаних цілей і стосується таксоїдвмісної емульсії на основі фармацевтично прийнятної олії у воді, що включає лецитин або напівсинтетичний фосфоліпід. Серед фармацевтично прийнятних олій можна назвати соєву олію, та, що використовується індивідуально, або тригліцериди з ланцюгом середньої тм тм довжини (С8-С10), такі як Miglyol або МСТ , що використовуються індивідуально, або ж, переважно, можна використовувати суміш соєвої олії і МСТ. Зокрема, масове співвідношення соєвої олії і тригліцериду становить 1:1. Емульсію створюють введенням соєвого або яєчного лецитину, переважно, яєчного лецитину, такого як лецитин, що випускається в продаж під найменуванням Lipoid E80, або переважним введенням фосфатиділхоліну, який являє собою цвітеріонний поверхнево-активний агент. Емульсія має прекрасну фізичну стабільність, якщо лецитин або фосфатиділхолін асоційований з аніонним фосфоліпідом, вибраним, зокрема, з фосфатиділгліцеринів або фосфатидінових кислот. Серед фосфатиділгліцеринів можна назвати дилауроїлфосфатиділгліцерин (DLPG), диміристоїлфосфатиділгліцерин (DMPG) або ж дипальмітоїлфосфатиділгліцерин (DPPG). Серед фосфатидінових кислот можна назвати натрієві солі дилауроїлгліцерофосфатидінової кислоти (DLPA), диміристоїлгліцерофосфатидінової кислоти (DMPA) або дипальмітоїлгліцерофосфатидінової кислоти (DPPA). Масове співвідношення між, відповідно, ліцитином або фосфатиділхоліном і фосфатиділгліцерином або фосфатидіновою кислотою становить, переважно, величину від 500 до 3, більш переважно, від 100 до 10. З всіх аніонних фосфоліпідів надають перевагу дилауроїлфосфатиділгліцерин. Величина рН складу може знаходитися в діапазоні від 3 до 7 і регулюється додаванням кислоти. Переважно, використовують буфер для підтримки рН у вказаному діапазоні, в який введена або не введена кислота. Буфером переважно є гістидиновий буфер. Вважають за краще використовувати від 5 до 50 мМ гістидину в розчині. Кис 7 лоту вибирають, переважно, з соляної, лимонної або аскорбінової кислоти. Ізотонічність розчину може досягатися додаванням гліцерину. Для полегшення застосування препарату можна використовувати 0-2 % етанолу. Переважно, масовий склад композиції може знаходитися в наступних межах: - масляна фаза 10-30 % - лецитин або фосфатиділхолін 0,6-5 % - фосфатиділгліцерин 0,01-0,2 % - гліцерин 0-2,5 % - етанол 0-2 % - вода до 100 % Одержання емульсії здійснюють, переважно, за допомогою апарату для мікрофлюїдизації або гомогенізатора високого тиску для того, щоб одержати краплини розміром від 100 нм до 1 мкм, переважно, від 100 до 500 нм. Більш конкретно, віддають перевагу складам, в яких середній розмір краплин становить 150-350 нм. Створюють інертне середовище в кінцевому складі, переважно, за допомогою азоту або інертного газу, що не містить кисень. Концентрації активної основи формули (І) або формули (II) становлять менше 10 мг/мл, зокрема, використовуються концентрації від 0,5 до 6 мг/мл, переважно, близько 4 мг/мл. Більш детально винахід буде описаний за допомогою прикладів, які не обмежують винахід. Приклад 1: 1 г DPPC і 0,03 г DLPG солюбілізують при 60 °C в суміші МСТ (10 г), соєвої олії (10 г) і етанолу (0,4 г). 0,4 г сполуки формули (І) розчиняють в одержаному вище прозорому розчині. 2,5 г гліцерину додають при перемішуванні до 75,7 г 10 мМ гістидинового водного буфера до одержання гомогенної суміші. До масляної фази додають водну фазу і суміш гомогенізують в подрібнювані (Ultraturrax), а потім в мікрофлюїдизаторі (11 циклів при 11000 пси). Одержаний розмір краплин становить близько 250 нм. Приклад 2: 1 г DPPC і 0,03 г DLPG солюбілізують при 60 °C в суміші МСТ (10 г), соєвої олії (10 г) і етанолу (2 г). 0,4 г сполуки формули (І) розчиняють в одержаному вище прозорому розчині. 2,5 г гліцерину додають при перемішуванні до 75,7 г 10 мМ гістидинового водного буфера з рН, доведеним до 6 (НСl), до одержання гомогенної суміші. До масляної фази додають водну фазу і суміш гомогенізують в подрібнювачі (Ultraturrax), а потім в мікрофлюїдизаторі (11 циклів при 11000 пси). Одержаний розмір краплин становить близько 280 нм. Приклад 3: 1,2 г Lipoid E80 і 0,03 г DLPG солюбілізують при 60 °C в суміші МСТ (10 г) і соєвої олії (10 г). 0,4 г сполуки формули (І XRP9881) розчиняють в одержаному вище прозорому розчині. 97418 8 2,5 г гліцерину додають при перемішуванні до 75,7 г 10 мМ гістидинового водного буфера до одержання гомогенної суміші. До масляної фази додають водну фазу і суміш гомогенізують в подрібнювачі (Ultraturrax), а потім в мікрофлюїдизаторі (11 циклів при 11000 пси). Одержаний розмір краплин становить близько 140 нм (Dv [діаметр візикул] 50). Фізична стабільність розчину 1 місяць при 60 °C: розмір частинок не змінився (Dv 50 і Dv 90). Приклад 4: 1,2 г Lipoid E80 і 0,03 г DLPG солюбілізують при 60 °C в суміші МСТ (10 г) і соєвої олії (10 г). 0,4 г сполуки формули (І XRP9881) розчиняють в одержаному вище прозорому розчині. 2,5 г гліцерину додають при перемішуванні до 75,7 г 10 мМ гістидинового водного буфера з рН, доведеним до 6 (НСl), до одержання гомогенної суміші. До масляної фази додають водну фазу і суміш гомогенізують в подрібнювані (Ultraturrax), а потім в мікрофлюїдизаторі (11 циклів при 11000 пси). Одержаний розмір краплин становить близько 140 нм (Dv 50). Фізична стабільність розчину 1 місяць при 60 °C: розмір частинок не змінився (Dv 50 і Dv 90). Приклад 5: 1 г DPPC і 0,03 г DLPG солюбілізують при 60 °C в суміші МСТ (10 г), соєвої олії (10 г) і етанолу (0,4 г). 0,4 г сполуки формули (І XRP9881) розчиняють в одержаному вище прозорому розчині. 2,5 г гліцерину додають при перемішуванні до 75,7 г 10 мМ гістидинового водного буфера з рН, доведеним до 6 (НСl), до одержання гомогенної суміші. До масляної фази додають водну фазу і суміш гомогенізують в подрібнювачі (Ultraturrax), а потім в мікрофлюїдизаторі (11 циклів при 11000 пси). Одержаний розмір краплин становить близько 280 нм (Dv 50). Фізична стабільність розчину 1 місяць при 60 °C: розмір частинок не змінився (Dv 50 і Dv 90). Приклад 6: 1,2 г Lipoid E80 і 0,03 г DLPG солюбілізують при 60 °C в суміші МСТ (10 г) і соєвої олії (10 г). 0,4 г сполуки формули (І XRP9881) розчиняють в одержаному вище прозорому розчині. 2,5 г гліцерину додають при перемішуванні до 75,7 г води РРІ до одержання гомогенної суміші. До масляної фази додають водну фазу і суміш гомогенізують в подрібнювачі (Ultraturrax), а потім в мікрофлюїдизаторі (11 циклів при 11000 пси). Середній розмір одержаних краплин становить близько 140 нм (Dv 50). Фізична стабільність розчину 1 місяць при 60 °C: розмір частинок не змінився (Dv 50 і Dv 90). Приклад 7: 1,2 г Lipoid E80 і 0,03 г DPPA солюбілізують при 60 °C в суміші МСТ (10 г) і соєвої олії (10 г). 0,4 г сполуки формули (І XRP9881) розчиняють в одержаному вище прозорому розчині. 2,5 г гліцерину додають при перемішуванні до 75,7 г води РРІ до одержання гомогенної суміші. 9 До масляної фази додають водну фазу і суміш гомогенізують в подрібнювачі (Ultraturrax), а потім в мікрофлюїдизаторі (11 циклів при 11000 пси). Середній розмір одержаних краплин становить близько 140 нм (Dv 50). Фізична стабільність розчину 1 місяць при 60 °C: розмір частинок не змінився (Dv 50 і Dv 90). Приклад 8: 1 г DPPC і 0,03 г DLPG солюбілізують при 60 °C в суміші МСТ (10 г), соєвої олії (10 г) і етанолу (0,4 г). 0,4 г сполуки формули (II XRP6258) розчиняють в одержаному вище прозорому розчині. 2,5 г гліцерину додають при перемішуванні до 75,7 г 10 мМ гістидинового водного буфера з рН, доведеним до 6 (НСl), до одержання гомогенної суміші. До масляної фази додають водну фазу і суміш гомогенізують в подрібнювачі (Ultraturrax), а потім в мікрофлюїдизаторі (11 циклів при 11000 пси). Склад XRP9881* Miglyol 812 Lipoid E80 Очищена вода Кріопротектор Разом Висота шару ліофілізату 97418 10 Одержаний розмір краплин становить близько 260 нм. Порівняльний приклад Наступний приклад був здійснений для порівняння із заявкою US 2003/0099674 з метою довести, що ліофілізація є прийомом, який не може бути застосований до складів згідно з винаходом, оскільки він приводить до збільшення розміру ліпідних частинок згідно з винаходом. 1. Матеріал і методи 1.1. Матеріал Lipoid E80 - партія 1031471-7/906: постачальник: LIPOID KG. Miglyol812 Мальтоза моногідрат. Сахароза. 1.2. Склад % 0,340 17,0 1,0 66,6 15,0 100 Одинична доза (г) 0,002 0,007 0,085 0,340 0,005 0,020 0,333 1,333 0,075 0,300 0,5 2 1 мм 6 мм * чистий продукт без розчинника 1.3. Спосіб одержання емульсій 1) Солюбілізація активної основи в олії. 2) Попереднє диспергування в Ultra-turrax масляної фази у воді + лецитин. 3) Гомогенізація в мікрофлюїдизаторі при 11000 Пси (11 циклів). 4) Розділення емульсії на 2 фракції - Додавання 15 % мальтози або сахарози. 5) Розподіл по висоті шару QS 1 мм і 6 мм. 6) Ліофілізація: використовувалися умови, описані нижче; Заморожування: температура на полиці -45 °C, температура продукту -39 °C. Сублімація: температура на полиці -25 °C, тиск 50 мікробар. Повторне висушування при 30 °C. 2 Результат 2.1 Перед ліофілізацією Перед додаванням кріопротекторів розмір частинок становив 250 нм (Coulter N4+, метод вимірювання: псевдоеластичне розсіяння світла). Комп’ютерна верстка А. Крижанівський Не сталося зміни розміру частинок після додавання кріопротекторів (перед ліофілізацією). 2.1 Після ліофілізації 2.2.1. Зовнішній вигляд і відновлення Зовнішній вигляд ліофілізату: не спостерігається ні колапсу, ні зменшення розміру → зовнішній вигляд коректний. Відновлення водою РРІ: відновлення миттєве, одержана емульсія має вигляд гомогенного продукту. 2.2.2. Розмір частинок після відновлення Наявність везикул з розміром між 300 нм і 10 мкм (метастабільна система). Відсутність видимих або відмінностей, що вимірюються ні між мальтозою і сахарозою, ні між висотою шару ліофілізату 1 і 6 мм. Підписне Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюTaxoid-based compositions for injections
Автори англійськоюRortais, Patricia, Gachon, Carine
Назва патенту російськоюКомпозиция для инъекций на основе таксоидов
Автори російськоюРорте Патрисия, Гашон Карин
МПК / Мітки
МПК: A61K 47/44, A61K 31/337, A61K 47/24, A61K 9/107
Мітки: основі, таксоїдів, ін'єкцій, композиція
Код посилання
<a href="https://ua.patents.su/5-97418-kompoziciya-dlya-inehkcijj-na-osnovi-taksodiv.html" target="_blank" rel="follow" title="База патентів України">Композиція для ін’єкцій на основі таксоїдів</a>
Попередній патент: Плівки з посиленими краями і кромками
Наступний патент: Льодогенератор, що використовує холодне повітря навколишнього середовища
Випадковий патент: Групування пілот-сигналів і маршрутні протоколи в системах зв'язку на багатьох несучих









