Піролопіримідини як індуктори інтерферону людини
Формула / Реферат
1. Сполука формули (І) або її сіль:
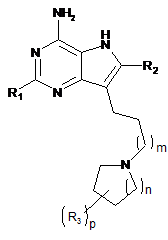 , (I)
, (I)
в якій:
R1 - н-С4-6алкіл або С1-2алкоксіС1-2алкіл-;
R2 - гідроген або метил;
кожне R3 - гідроксил, галоген або н-С1-3алкіл;
m - ціле число, яке має значення 2-4;
n - ціле число, яке має значення 0-3;
р - ціле число, яке має значення 0-2.
2. Сполука за п. 1 або її сіль, в якій R1 - н-бутил.
3. Сполука за п. 1 або її сіль, в якій R1 - етоксиметил.
4. Сполука за п. 1 або її сіль, в якій R1 - 2-метоксіетил.
5. Сполука за будь-яким з пп. 1-4 або її сіль, в якій R2 - гідроген.
6. Сполука за будь-яким з пп. 1-4 або її сіль, в якій R2 - метил.
7. Сполука за будь-яким з пп. 1-6 або її сіль, в якій m - ціле число, яке має значення 2, 3 або 4.
8. Сполука за будь-яким з пп. 1-7 або її сіль, в якій n - ціле число, яке має значення 1 або 2.
9. Сполука за будь-яким з пп. 1-8 або її сіль, в якій р є 0.
10. Сполука за будь-яким з пп. 1-8 або її сіль, в якій R3 - гідроксил або галоген.
11. Сполука за будь-яким з пп. 1-8 або її сіль, де р є 1 та R3 - гідроксил або флуоро.
12. Сполука за будь-яким з пп. 1-8 або її сіль, де р є 2 та R3 - флуоро.
13. Сполука за п. 1 або її сіль, яка вибрана з групи, що складається з:
2-бутил-7-(6-(піперидин-1-іл)гексил)-5Н-піроло[3,2-d]піримідин-4-аміну;
2-бутил-7-(5-(піперидин-1-іл)пентил)-5Н-піроло[3,2-d]піримідин-4-аміну;
2-бутил-7-(4-(піперидин-1-іл)бутил)-5Н-піроло[3,2-d]піримідин-4-аміну;
2-(етоксиметил)-7-(6-(піперидин-1-іл)гексил)-5Н-піроло[3,2-d]піримідин-4-аміну;
2-(2-метоксіетил)-7-(6-(піперидин-1-іл)гексил)-5Н-піроло[3,2-d]піримідин-4-аміну;
2-бутил-6-метил-7-(6-(піперидин-1-іл)гексил)-5Н-піроло[3,2-d]піримідин-4-аміну;
2-бутил-6-метил-7-(5-(піперидин-1-іл)пентил)-5Н-піроло[3,2-d]піримідин-4-аміну;
2-бутил-6-метил-7-(4-(піперидин-1-іл)бутил)-5Н-піроло[3,2-d]піримідин-4-аміну;
2-бутил-7-(5-(піролідин-1-іл)пентил)-5Н-піроло[3,2-d]піримідин-4-аміну;
2-бутил-7-(6-(піролідин-1-іл)гексил)-5Н-піроло[3,2-d]піримідин-4-аміну;
2-пентил-7-(6-(піперидин-1-іл)гексил)-5Н-піроло[3,2-d]піримідин-4-аміну;
7-(5-(азепан-1-іл)пентил)-2-бутил-5Н-піроло[3,2-d]піримідин-4-аміну;
7-(4-(азепан-1-іл)бутил)-2-бутил-6-метил-5Н-піроло[3,2-d]піримідин-4-аміну;
2-бутил-6-метил-7-(6-(піролідин-1-іл)гексил)-5Н-піроло[3,2-d]піримідин-4-аміну;
7-(6-(азетидин-1-іл)гексил)-2-бутил-6-метил-5Н-піроло[3,2-d]піримідин-4-аміну;
2-бутил-6-метил-7-(5-(піролідин-1-іл)пентил)-5Н-піроло[3,2-d]піримідин-4-аміну;
7-(5-(азетидин-1-іл)пентил)-2-бутил-5Н-піроло[3,2-d]піримідин-4-аміну;
7-(5-(азетидин-1-іл)пентил)-2-бутил-6-метил-5Н-піроло[3,2-d]піримідин-4-аміну;
2-бутил-6-метил-7-(4-(піролідин-1-іл)бутил)-5Н-піроло[3,2-d]піримідин-4-аміну;
2-бутил-7-(5-(4,4-дифлуоропіперидин-1-іл)пентил)-5Н-піроло[3,2-d]піримідин-4-аміну;
2-бутил-7-(5-(4-флуоропіперидин-1-іл)пентил)-5Н-піроло[3,2-d]піримідин-4-аміну;
7-(5-(4-флуоропіперидин-1-іл)пентил)-2-(2-метоксіетил)-5Н-піроло[3,2-d]піримідин-4-аміну;
1-(5-(4-аміно-2-бутил-5Н-піроло[3,2-d]піримідин-7-іл)пентил)піперидин-4-олу;
(R)-2-бутил-7-(5-(3-флуоропіролідин-1-іл)пентил)-5Н-піроло[3,2-d]піримідин-4-аміну;
(S)-2-бутил-7-(5-(3-флуоропіролідин-1-іл)пентил)-5Н-піроло[3,2-d]піримідин-4-аміну;
(R)-7-(5-(3-флуоропіролідин-1-іл)пентил)-2-(2-метоксіетил)-5Н-піроло[3,2-d]піримідин-4-аміну;
(S)-7-(5-(3-флуоропіролідин-1-іл)пентил)-2-(2-метоксіетил)-5Н-піроло[3,2-d]піримідин-4-аміну;
(S)-1-(5-(4-аміно-2-бутил-5Н-піроло[3,2-d]піримідин-7-іл)пентил)піролідин-3-олу;
1-(5-(4-аміно-2-бутил-5Н-піроло[3,2-d]піримідин-7-іл)пентил)азетидин-3-олу;
7-(6-(азепан-1-іл)гексил)-2-(2-метоксіетил)-5Н-піроло[3,2-d]піримідин-4-аміну;
2-бутил-7-(6-(4-флуоропіперидин-1-іл)гексил)-5Н-піроло[3,2-d]піримідин-4-аміну;
(R)-2-бутил-7-(6-(3-флуоропіролідин-1-іл)гексил)-5Н-піроло[3,2-d]піримідин-4-аміну;
(S)-2-бутил-7-(6-(3-флуоропіролідин-1-іл)гексил)-5Н-піроло[3,2-d]піримідин-4-аміну;
(S)-2-бутил-7-(5-(2-метилпіролідин-1-іл)пентил)-5Н-піроло[3,2-d]піримідин-4-аміну;
(R)-2-бутил-7-(5-(2-метилпіролідин-1-іл)пентил)-5Н-піроло[3,2-d]піримідин-4-аміну;
2-бутил-7-(5-(3-метилазетидин-1-іл)пентил)-5Н-піроло[3,2-d]піримідин-4-аміну;
2-бутил-7-(5-(3-флуороазетидин-1-іл)пентил)-5Н-піроло[3,2-d]піримідин-4-аміну;
2-бутил-6-метил-7-(6-(піролідин-1-іл)гексил)-5Н-піроло[3,2-d]піримідин-4-аміну;
2-бутил-7-(5-(4-флуоропіперидин-1-іл)пентил)-6-метил-5Н-піроло[3,2-d]піримідин-4-аміну;
(S)-2-бутил-7-(5-(3-флуоропіролідин-1-іл)пентил)-6-метил-5Н-піроло[3,2-d]піримідин-4-аміну;
(R)-2-бутил-7-(5-(3-флуоропіролідин-1-іл)пентил)-6-метил-5Н-піроло[3,2-d]піримідин-4-аміну;
2-бутил-7-(5-(3-флуороазетидин-1-іл)пентил)-6-метил-5Н-піроло[3,2-d]піримідин-4-аміну
та
2-(2-метоксіетил)-7-(5-(піролідин-1-іл)пентил)-5Н-піроло[3,2-d]піримідин-4-аміну.
14. Сполука за п. 1 або її сіль, яка є 2-бутил-7-(5-(піролідин-1-іл)пентил)-5Н-піроло[3,2-d]піримідин-4-аміном:
 .
.
15. Сполука за будь-яким з пп. 1-14, яка є у формі фармацевтично прийнятної солі.
16. Сполука за будь-яким з пп. 1-14, яка є у формі вільної основи.
17. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-14 або її фармацевтично прийнятну сіль та один або більше фармацевтично прийнятних наповнювачів.
18. Вакцинна композиція, яка містить сполуку за будь-яким з пп. 1-14 або її фармацевтично прийнятну сіль та антиген або антигенну композицію.
19. Сполука за будь-яким з пп. 1-14 або її фармацевтично прийнятна сіль для застосування в терапії.
20. Сполука за будь-яким з пп. 1-14 або її фармацевтично прийнятна сіль для застосування в лікуванні алергічних хвороб та інших запальних станів, інфекційних хвороб та раку.
21. Сполука за будь-яким з пп. 1-14 або її фармацевтично прийнятна сіль для застосування в лікуванні алергічного риніту.
22. Сполука за будь-яким з пп. 1-14 або її фармацевтично прийнятна сіль для застосування в лікуванні астми.
23. Застосування сполуки за будь-яким з пп. 1-14 або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування алергічних хвороб та інших запальних станів, інфекційних хвороб та раку.
Текст
Реферат: Сполуки формули (І) та їх солі: NH2 H N N R1 R2 N m N n R3 p , (I) в якій: R1 - н-С4-6алкіл або С1-2алкоксіС1-2алкіл-; R2 - гідроген або метил; кожне R3 - гідроксил, галоген або н-С1-3алкіл; m - ціле число, яке має значення 2-4; н - ціле число, яке має значення 0-3; р - ціле число, яке має значення 0-2, є індукторами інтерферону людини. Сполуки, які UA 114645 C2 (12) UA 114645 C2 індукують інтерферон людини, можуть бути корисними в лікуванні різних розладів, наприклад у лікуванні алергічних хвороб та інших запальних станів, наприклад алергічних ринітів та астми, інфекційних хвороб та раку та можуть бути корисними як ад'юванти вакцини. UA 114645 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід стосується сполук, способів їх отримання, композицій, які їх містять, їх застосування в лікування різних розладів, зокрема, алергічних хвороб та інших запальних станів, наприклад, алергічних ринітів та астми, інфекційних хвороб та раку, та як ад'юванти вакцин. Хребетні тварини постійно знаходяться під загрозою інвазії мікроорганізмами та мають розвивати механізми імунного захисту для усунення інфекційних патогенів. У ссавців ця імунна система має дві вида: уроджений імунітет та набутий імунітет. Перша лінія захисту організму хазяїна – це уроджена імунна система, котра опосередкована макрофагами та ддендритними клітинами. Набутий імунітет залучає усунення патогенів на пізній стадії інфекції і також дозволяє утворення імунологічної пам'яті. Набутий імунітет є дуже специфічним внаслідок широкого складу лімфоцитів зі специфічними щодо антигену рецепторами, які зазнали генного перетворення. Механізми, що викликають індукцію інтерферонів та інших цитокінів, які діють на клітини, через що виникають деякі ефекти, - є центральними механізмами, щодо утворення в ссавців ефективного природного імунного відгуку. У людини інтерферони типу I − це сімейство пов'язаних білків, кодованих генами на хромосомі 9, та кодування, принаймні, 13 ізоформ інтерферону альфа (IFNα), та одної ізоформи інтерферону бета (IFNβ). Інтерферон було вперше описано як речовину, що може захищати клітини від вірусного інфекції (Isaacs & Lindemann, J. Virus Interference. Proc. R. Soc. ion. Ser. B. Biol. Sci. 1957: 147, 258-267). Рекомбинантний IFNα було вперше визнано біологічним терапевтичним засобом, і він став важливою частиною терапії вірусних інфекцій та раку. Також щодо прямої противірусної активності на клітини, інтерферони є відомими як сильнодіючі модулятори імунного відгуку при дії на клітини імунної системи (Gonzalez-Navajas J.M. et al Nature Reviews Immunology, 2012; 2, 125-35). Toll-подібні рецептори (TLRs) – це сімейство десяти рецепторів розпізнавання образів, описаних стосовно людини {Gay, N.J. etal, Annu. Rev. Biochem., 2007: 46, 141-165). TLRs виражені переважно природними імунними клітинами, де їх роль − контролювати навколишнє середовище для контролювання інфекції та активувати, залучати механізми захисту, спрямовані на усунення вторгнення патогенів. Ранні природні імунні відгуки, запущені TLRs, обмежують розповсюдження інфекції, тоді як прозапальні цитокіни та хемокіни, яких вони збуджують, призводять до відновлення та активування клітин, що виявляють антиген, B-клітин, та T-клітин. TLRs можуть модулювати природу адаптивних імунних відгуків, надаючи відповідний захист шляхом активації дендритних клітин та вивільнення цитокіну (Akira S. et al, Nat. Immunol., 2001: 2, 675-680). Профіль відгуку видно із залежностей різних агоністів TLR на активованому типі клітини. TLR7 – це член підгрупи TLRs (TLRs 3, 7, 8 та 9), локалізованої на ендосомальних компартментах клітин, котрі стають спеціалізованими щодо захисту не самих нуклеїнових кислот. TLR7 грає головну роль у противірусному захисті шляхом розпізнавання олРНК (ssRNA) (DieboldS.S. etal, Science, 2004: 303, 1529-1531; та Lund J. M. etal, PNAS, 2004: 101, 5598-5603). TLR7 має обмежений профіль експресії людини та є експресованим переважно клітинами B та плазмоцитоідними дендритними клітинами (pDC), та в меншому ступені − моноцитами. Плазмоцитоідні дендритні клітини (pDC) – це унікальна популяція лімфоїдних похідних дендритних клітин (0,2-0,8 % мононуклеарних клітин периферійної крові (PBMCs)), котрі є клітинами первинного типу I, які продукують інтерферон, які секретують високі рівні інтерферону-альфа (IFNα) та інтерферону-бета (IFNβ) у відгук на вірусні інфекції (Liu Y-J, Annu. Rev. Immunol., 2005: 23, 275-306). Застосування сполуки малої молекули, котра могла б стимулювати імунний відгук, охоплюючи активацію інтерферонів типу I та інших цитокінів шляхом Toll-подібних рецепторів, могло б стати важливою стратегією лікування або попередження хвороб людей Описано агоністи малих молекул TLR7, котрі можуть індукувати інтерферон-альфа у тварин та людей (Takeda K. etal, Annu. Rev. Immunol., 2003: 21, 335-76). Агоністи TLR7 містять сполуки імідазохіноліну, як-то іміхімод та резіхімод, аналоги оксоаденіну й також аналоги нуклеозиду, якто локсорибін та 7-тіа-8-оксохінозин, котрі довгий час відомі для індукції інтерферону-альфа (Czarniecki. M., J. Med, Chem., 2008: 51, 6621-6626; HedayatM. etal, Medicinal Research Reviews, 2012: 32, 294-325). Цей тип імуномодуляторної стратегії має здатність ідентифікувати сполуки, котрі можуть бути корисними в лікування алергічних хвороб (Moisan J. etal, Am. J. Physiol. Lung Cell Mol. Physiol, 2006: 290, L987-995), вірусних інфекцій (Horcroft N.J. et al, J. Antimicrob. Chemther, 2012: 67, 789-801), раку (Krieg A., Curr. Oncol. Rep., 2004: 6(2), 88-95), інших запальних станів, як-то хвороба подразненої товстої кишки (Rakoff-Nahoum S., Cell, 2004, 23, 118(2): 229-41), та як ад'юванти вакцини (Persing et al. Trends Microbiol. 2002: 10(10 Suppl), S327). 1 UA 114645 C2 5 10 15 20 25 30 35 40 45 Конкретніше, алергічні хвороби асоційовано з Th2-базованим імунним відгуком щодо алерген. Відгуки Th2 асоційовано з підвищеними рівнями IgE, котрі шляхом дій на гладкі клітини активізують гіперчутливість до алергенів, що призводить до симптомів, які видно, наприклад, при астмі та алергічному риніті. У здорових індивідуумів імунний відгук на алергени більше збалансовано зі змішаним Th2/Th1 та регуляторним відгуком T-клітини. Показано, що ліганди TLR7 зменшують цитокін Th2 та збільшують вивільнення цитокіну Th1 in vitro, та поліпшують запальні відгуки Th2-типу в алергічних легеневих моделях in vivo (Duechs M.J., Pulmonary Pharmacology & Therapeutics, 2011: 24, 203-214; Filі L et al, J. All. Clin. Immunol., 2006: 118, 511517; Tao et al, Chin. Med. 1, 2006: 119, 640-648; Van LP. Eur. J. Immunol., 2011: 41, 1992-1999). Отже, ліганди TLR7 мають потенціал перенастроювати імунний відгук у алергічних індивідів та призводити до видозміни хвороби. Останні клінічні дослідження щодо агоністу TLR7 показали повторне інтраназальне стимулювання TLR7, що надає тривале зниження швидкості реагування на алерген у пацієнтів з алергічними ринітами та алергічною астмою (GreifTL. Respiratory Research, 2012: 13, 53; Leaker B.R. et al, Am. J. Respir. Crit. Care Med., 2012: 185, A4184). У пошуку нових малих молекул індукторів інтерферону IFNα людини слід розвивати стратегію дослідження, щоб охарактеризувати малу молекулу (незалежно від механізму), котра базована на стимулюванні сполук первинних донорних клітин людини або цільної крові, та розкрита тут. Згідно з першим аспектом винахід стосується сполук формули (I) та їх солей: де: R1 − н-С4-6алкіл або C1-2алкоксиС1-2алкіл-; R2 − гідроген або метил; кожне R3 − гідроксил, галоген або н-С1-3алкіл; m − ціле число, яке дорівнює 2 − 4; n − ціле число, яке дорівнює 0 − 3; p − ціле число, яке дорівнює 0 − 2. Показано, що деякі сполуки винаходу, індуктори інтерферону людини, можуть володіти бажаною здатністю до розвитку профілю в порівнянні з відомими індукторами інтерферону людини. Крім того, деякі сполуки винаходу можуть виявляти селективність для IFNα стосовно TNFα. Сполуки, які індукують інтерферон людини, можуть бути корисними в лікуванні різних розладів, наприклад, лікуванні алергічних хвороб та інших запальних станів, наприклад, алергічних ринітів та астми, лікуванні інфекційних хвороб та раку. Відповідно винахід далі стосується фармацевтичних композицій, які містять сполуку формули (I), або її фармацевтично прийнятну сіль. Заявлений винахід у подальшому стосується способів лікування розладів, асоційованих, крім того, із застосуванням сполуки формули (I) або її фармацевтично прийнятної солі, або фармацевтичної композиції, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль. Сполуки винаходу також можуть мати застосування як ад'юванти вакцин. Отже, заявлений винахід у подальшому стосується вакцинної композиції, яка містить сполуку формули (I), або її фармацевтично прийнятну сіль та антиген або композицію антигену. Деякі сполуки винаходу є сильнодіючими імуномодуляторами, та відповідно слід виявляти турботу при їх застосуванні. Згідно з першим аспектом заявлений винахід стосується сполук формули (I) та їх солей: 2 UA 114645 C2 5 10 15 20 25 30 35 40 45 де: R1 − н-С4-6алкіл або C1-2алкоксиС1-2алкіл-; R2 − гідроген або метил; кожне R3 − гідроксил, галоген або н-С1-3алкіл; m − ціле число, яке дорівнює 2 − 4; n − ціле число, яке дорівнює 0 − 3; p − ціле число, яке дорівнює 0 − 2. Згідно з іншим аспектом винаходу R1 − н-бутил. Згідно з іншим аспектом винаходу R1 − етоксиметил. Згідно з іншим аспектом винаходу R1 − 2-етоксиетил. Згідно з іншим аспектом винаходу R2 - гідроген. Згідно з іншим аспектом винаходу R2 − метил. Згідно з іншим аспектом винаходу m − ціле число, яке дорівнює 2, 3 або 4. Згідно з іншим аспектом винаходу n − ціле число, яке дорівнює 1 або 2. Згідно з іншим аспектом винаходу p дорівнює 0. Згідно з іншим аспектом винаходу R3 − гідроксил або галоген. Згідно з іншим аспектом винаходу p є 1 та R3 − гідроксил або флуоро. Згідно з іншим аспектом винаходу p дорівнює 2 та R3 − флуоро. Приклади сполук формули (I) передбачено в наступних групах та утворюють наступний аспект винаходу: 2-Бутил-7-(6-(піперидин-1-іл)гексил)-5Н-піроло[3,2-d]піримідин-4-амін; 2-Бутил-7-(5-(піперидин-1-іл)пентил)-5Н-піроло[3,2-d]піримідин-4-амін; 2-Бутил-7-(4-(піперидин-1-іл)бутил)-5Н-піроло[3,2-d]піримідин-4-амін; 2-(Етоксиметил)-7-(6-(піперидин-1-іл)гексил)-5Н-піроло[3,2-d]піримідин-4-амін; 2-(2-Метоксиетил)-7-(6-(піперидин-1-іл)гексил)-5Н-піроло[3,2-d]піримідин-4-амін; 2-Бутил-6-метил-7-(6-(піперидин-1-іл)гексил)-5Н-піроло[3,2-d]піримідин-4-амін; 2-Бутил-6-метил-7-(5-(піперидин-1-іл)пентил)-5Н-піроло[3,2-d]піримідин-4-амін; 2-Бутил-6-метил-7-(4-(піперидин-1-іл)бутил)-5Н-піроло[3,2-d]піримідин-4-амін; 2-Бутил-7-(5-(піролідин-1-іл)пентил)-5Н-піроло[3,2-d]піримідин-4-амін; 2-Бутил-7-(6-(піролідин-1-іл)гексил)-5Н-піроло[3,2-d]піримідин-4-амін; 2-Пентил-7-(6-(піперидин-1-іл)гексил)-5Н-піроло[3,2-d]піримідин-4-амін; 7-(5-(Азепан-1-іл)пентил)-2-бутил-5H-піроло[3,2-d]піримідин-4-амін; 7-(4-(Азепан-1-іл)бутил)-2-бутил-6-метил-5Н-піроло[3,2-d]піримідин-4-амін; 2-Бутил-6-метил-7-(6-(піролідин-1-іл)гексил)-5Н-піроло[3,2-d]піримідин-4-амін; 7-(6-(Азетидин-1-іл)гексил)-2-бутил-6-метил-5H-піроло[3,2-d]піримідин-4-амін; 2-Бутил-6-метил-7-(5-(піролідин-1-іл)пентил)-5Н-піроло[3,2-d]піримідин-4-амін; 7-(5-(Азетидин-1-іл)пентил)-2-бутил-5Н-піроло[3,2-d]піримідин-4-амін; 7-(5-(Азетидин-1-іл)пентил)-2-бутил-6-метил-5H-піроло[3,2-d]піримідин-4-амін; 2-Бутил-6-метил-7-(4-(піролідин-1-іл)бутил)-5Н-піроло[3,2-d]піримідин-4-амін; 2-Бутил-7-(5-(4,4-дифлуоропіперидин-1-іл)пентил)-5H-піроло[3,2-d]піримідин-4-амін; 2-Бутил-7-(5-(4-флуоропіперидин-1-іл)пентил)-5Н-піроло[3,2-d]піримідин-4-амін; 7-(5-(4-Флуоропіперидин-1-іл)пентил)-2-(2-метоксиетил)-5Н-піроло[3,2-d]піримідин-4-амін; 1-(5-(4-Аміно-2-бутил-5H-піроло[3,2-d]піримідин-7-іл)пентил)піперидин-4-ол; (R)-2-Бутил-7-(5-(3-флуоропіролідин-1-іл)пентил)-5Н-піроло[3,2-d]піримідин-4-амін; (S)-2-Бутил-7-(5-(3-флуоропіролідин-1-іл)пентил)-5Н-піроло[3,2-d]піримідин-4-амін; (R)-7-(5-(3-Флуоропіролідин-1-іл)пентил)-2-(2-метоксиетил)-5Н-піроло[3,2-d]піримідин-4-амін; (S)-7-(5-(3-Флуоропіролідин-1-іл)пентил)-2-(2-метоксиетил)-5H-піроло[3,2-d]піримідин-4-амін; (S)-1-(5-(4-Аміно-2-бутил-5Н-піроло[3,2-d]піримідин-7-іл)пентил)піролідин-3-ол; та 3 UA 114645 C2 5 10 15 20 25 30 35 40 45 50 55 60 1- (5-(4-Аміно-2-бутил-5H-піроло[3,2-d]піримідин-7-іл)пентил)азетидин-3-ол; 7-(6-(Азепан-1-іл)гексил)-2-(2-метоксиетил)-5Н-піроло[3,2-d]піримідин-4-амін; 2- Бутил-7-(6-(4-флуоропіперидин-1-іл)гексил)-5Н-піроло[3,2-d]піримідин-4-амін; (R)-2-Бутил-7-(6-(3-флуоропіролідин-1-іл)гексил)-5Н-піроло[3,2-d]піримідин-4-амін; (S)-2-Бутил-7-(6-(3-флуоропіролідин-1-іл)гексил)-5Н-піроло[3,2-d]піримідин-4-амін; (S)-2-Бутил-7-(5-(2-метилпіролідин-1-іл)пентил)-5H-pyrrolo[3,2-d]піримідин-4-амін; (R)-2-Бутил-7-(5-(2-метилпіролідин-1-іл)пентил)-5Н-піроло[3,2-d]піримідин-4-амін; 2-Бутил-7-(5-(3-метилазетидин-1-іл)пентил)-5Н-піроло[3,2-d]піримідин-4-амін; 2-Бутил-7-(5-(3-флуороазетидин-1-іл)пентил)-5H-піроло[3,2-d]піримідин-4-амін; 2-Бутил-6-метил-7-(6-(піролідин-1-іл)гексил)-5Н-піроло[3,2-d]піримідин-4-амін; 2-Бутил-7-(5-(4-флуоропіперидин-1-іл)пентил)-6-метил-5Н-піроло[3,2-d]піримідин-4-амін (S)-2-Бутил-7-(5-(3-флуоропіролідин-1-іл)пентил)-6-метил-5Н-піроло[3,2-d]піримідин-4-амін; (R)-2-Бутил-7-(5-(3-флуоропіролідин-1-іл)пентил)-6-метил-5H-піроло[3,2-d]піримідин-4-амін; 2-Бутил-7-(5-(3-флуороазетидин-1-іл)пентил)-6-метил-5Н-піроло[3,2-d]піримідин-4-амін; 2-(2-метоксиетил)-7-(5-(піролідин-1-іл)пентил)-5Н-піроло[3,2-d]піримідин-4-амін, та їх солі. Як тут застосовано, термін "алкіл" стосується насиченого, прямоланцюгового вуглеводню, який має конкретне число атомів. Наприклад, н-С4-6 алкіл стосується насиченого, прямоланцюгового вуглеводню, який має 4 − 6 атомів карбону. Якщо не встановлено інакше, групи алкілу є незаміщеними. Термін "алкіл" охоплює, але без обмеження, н-бутил. Як тут застосовано, термін "алкоксил" стосується насиченого, прямоланцюгового вуглеводню, який має конкретне число атомів, зв'язаних одинарним зв'язком з атомом оксигену. Наприклад, C1-2алкоксил стосується групи алкоксилу, яка має 1 або 2 атоми карбону, котрі відповідно стосуються метоксилу або етоксилу. Як тут застосовано, термін "галоген" стосується флуоро, хлоро, бромо та іодо. Зрозуміло, що посилання тут на сполуки винаходу означають сполуку формули (I) як вільну основу, або як сіль, наприклад, фармацевтично прийнятну сіль. Згідно з одним аспектом винаходу сполука формули (I) є у формі вільної основи. Солі сполук формули (I) охоплюють фармацевтично прийнятні солі та солі, які не можуть бути фармацевтично прийнятними, але можуть бути корисними для отримання сполук формули (I) та їх фармацевтично прийнятних солей. Згідно з одним аспектом винаходу сполука формули (I) є у формі фармацевтично прийнятної солі. Солі можна отримувати з відповідних неорганічних або органічних кислот. Приклади солей − фармацевтично прийнятних солей. Фармацевтично прийнятні солі охоплюють кислотно-адитивні солі. Для огляду придатних солей дивись Berge et al., J. Pharm. Sci., 66:1-19 (1977). Приклади фармацевтично прийнятних кислотно-адитивних солей сполуки формули (I) охоплюють неорганічні кислоти, як-то, наприклад, хлоридна кислота, броміддна кислота, ортофосфатна кислота, азотна кислота, фосфатна кислота або сульфатна кислота, або з органічними кислотами як-то, наприклад, метансульфонова кислота, етансульфонова кислота, п-толуолсульфонова кислота, оцтова кислота, пропіонова кислота, молочна кислота, лимонна кислота, фумарова кислота, яблучна кислота, бурштинова кислота, саліцилова кислота, малеінова кислота, гліцерофосфатна кислота, винна, бензойна, глутамінова, аспарагінова, бензолсульфонова, нафталін сульфонова, як-то 2-нафталінсульфонова, капроєва кислота або ацетилсаліцилова кислота. У межах винаходу охоплено всі можливі стехіометричні та нестехіометричні форми солей сполук формули (I). Наприклад, дималеатна або гемі-сукцинатна сіль сполуки формули (I). Солі можна отримувати, застосовуючи способи, добре відомі в рівні техніки, наприклад, осадженням із розчину з подальшим фільтруванням, або випаровуванням розчинника. Типово фармацевтично прийнятна кислотно-адитивна сіль може утворюватися реакцією сполуки формули (I) із придатною кислотою (як-то бромідна, хлоридна, сульфатна, малеінова, 7-толуолсульфонова, метансульфонова, нафталінсульфонова або бурштинова кислоти), необов'язково в придатному розчиннику, як-то органічний розчинник, що дає сіль, яку звичайно виділяють, наприклад, кристалізацією та фільтруванням. Слід брати до уваги, що багато органічних сполук можуть утворювати комплекси з розчинниками, у яких вони реагують, або з яких їх осаджено або кристалізовано. Ці комплекси відомі як "сольвати". Наприклад, комплекс із водою відомий як "гідрат". Розчинники з високими точками кипіння та/або розчинники з високою схильністю до створення гідрогенових зв'язків, якто вода, етанол, ізопропіловий спирт та N-метилпіролідин, можна застосовувати для створення сольватів. Способи ідентифікації охоплюють, але без обмеження, ЯМР та мікроаналізи. 4 UA 114645 C2 5 10 15 20 25 30 35 40 Сольвати сполук формули (I) є в межах винаходу. Як тут застосовано, термін сольват охоплює сольвати сполуки вільної основи а також її солі. Деякі сполуки винаходу можуть містити хіральні атоми та/або багаторазові зв'язки, та, отже, можуть існувати в одній або більше стереоізомерних формах. Заявлений винахід охоплює всі стереоізомери сполук винаходу, охоплюючи оптичні ізомери як індивідуальні стереоізомери або як їх суміші, охоплюючи рацемічні модифікації. Будь-який стереоізомер може містити менше ніж 10 % за масою, наприклад, менше ніж 5 % за масою, або менше ніж 0,5 % за масою будь-якого іншого стереоізомеру. Наприклад, будь-як оптичний ізомер може містити менше ніж 10 % за масою, наприклад, менше ніж 5 % за масою, або менше ніж 0,5 % за масою його антиподу. Деякі сполуки винаходу можуть існувати в таутометричних формах. Зрозуміло, що заявлений винахід охоплює всі таутомери сполук винаходу, як індивідуальні таутомери або як їх суміші. Сполуки винаходу можуть бути в кристалічній або аморфній формі. Крім того, деякі кристалічні форми сполук винаходу можуть існувати як поліморфи, усіх охоплено в межах заявленого винаходу. Особливо цікавими є найбільш термодинамічно стабільна поліморфна форма або форми сполук винаходу. Поліморфні форми сполук винаходу можна описати та розпізнати, застосовуючи ряд звичайних аналітичних способів, охоплюючи, але без обмеження, наступне: рентгенівська дифракція на порошку (XRPD), інфрачервона спектроскопія (IR), раманівська спектроскопія, диференціальна сканувальна калориметрія (DSC), термогравіметричний аналіз (TGA) та solidstate ядерний магнітний резонанс твердого стану (тсЯМР). Винахід також охоплює всі придатні ізотопічні варіації сполуки формули (I) або її фармацевтично прийнятної солі. Ізотопічні варіації сполуки формули (I) або її фармацевтично прийнятної солі визначено як такі, де, принаймні, один атом заміщено атомом, який має той самий атомний номер, але атомна маса − відмінна від звичайної природної атомної маси. Приклади ізотопів, які можна вводити в сполуки винаходу, охоплюють наступні ізотопи: гідроген, 2 3 13 14 15 17 18 18 36 карбон, нітроген, оксиген, флуор та хлор, як-то H, H, C, C, N, 0, 0, F та CI, відповідно. Певні ізотопні варіації сполуки формули (I) або їїсолі, або сольвату, наприклад, у які 3 14 введено радіоактивний ізотоп, як-то H або C, є корисними в медикаменті та/або в 3 дослідженнях розподілу субстрату тканини. Мічені тритієм ізотопи, тобто, H, та карбон-14, 14 тобто, C, є конкретно кращими внаслідок легкого отримання та здатності до визначення. Крім 2 того, заміщені ізотопами, як-то дейтерій, тобто, H, можуть надавати деяку терапевтичну перевагу внаслідок більшої метаболічної стабільності, наприклад, збільшеного напівперіоду розпаду in vivo або зменшених потреб дозування, та отже, можуть бути кращими при деяких обставинах. Ізотонічні варіанти сполуки формули (I) або її фармацевтичної солі звичайно можна отримувати звичайними способами, як-то ілюстрованими способами або способами отримання, описаними далі в прикладах, застосовуючи придатні варіанти ізотопів придатних реагентів. З вищезазначеного зрозуміло, що в межах винаходу охоплено сольвати, гідрати, ізомери та поліморфні форми сполук формули (I) та їх солі й сольвати. Отримання сполуки Відповідно, передбачено спосіб отримання сполуки формули (I), який полягає в зняття захисту зі сполуки формули (II): 5 UA 114645 C2 5 10 15 20 25 30 (ІІ) де R1, R2, R3, m, n та p − такі, як визначено вище для сполуки формули (I), та PG − захисна група, як-то бензилоксиметил (BOM), 2-(триметилсиліл)етоксиметил (SEM) або птолуолсуфоніл, та відповідно, якщо потрібно, отримання солі сформованої так сполуки. Наприклад, сполуку формули (II), де PG рівнозначне BOM, розчиняли в придатному розчиннику, наприклад, метанолі або етанолі, та пропускали через придатний каталізатор, наприклад, 10 % паладій на карбоні в присутності водню, при придатній температурі, наприклад, 20-60 °C, в апараті, як-то Thales H-cube™. Продукт (I) відокремлювали видаленням розчинника та очищали, якщо потрібно. Наприклад, сполуку формули (II), де PG є SEM, розчиняли в придатному розчиннику, наприклад, тетрагідрофурані, та піддавали реакції з тетрабутиламоній флуоридом та етилендіаміном при придатній температурі, наприклад, 70 °C. Продукт (I) відокремлювали видаленням розчинника та очищали, якщо потрібно. Сполуку формули (II) можна отримувати реакцією сполуки формули (III): де R1, R2, R3, m, n та p − такі, як визначено вище для сполуки формули (I), з воднем у присутності каталізатора. Наприклад, сполуку формули (III) розчиняли в придатному розчиннику, наприклад, метиловому спирті або етиловому спирті, та пропускали через придатний каталізатор, наприклад, 10 % паладій на карбоні, у присутності водню при придатній температурі, наприклад, 20-60 °C, у придатному апараті для гідрогенізації в потоці, як-то Thales H-Cube™. Продукт (II) відокремлювали видаленням розчинника та очищали, якщо потрібно. Кола захисна група − бензилоксиметил (BOM), реакцію відновлення ацетилену може завершуватися при одночасному видаленням захисної групи, що дає безпосередньо сполуки формули (I). Сполуку формули (III) можна отримувати реакцією сполуки формули (IV): де R1 та R2 − такі, як визначено вище для сполуки формули (I), та Y − група, яка видаляється, наприклад, галоген, як-то іод або бром або алкілсульфонат, як-то трифлуорометансульфонат, зі сполукою формули (V): де R3, m, n та p визначено для сполуки формули (I). Наприклад, сполуку формули (IV), сполуку формули (V) розчиняли в придатному розчиннику, наприклад, Ν,Ν-диметилформаміді, в присутності купрум(І) йодиду, придатного 6 UA 114645 C2 5 каталізатора, наприклад, біс(трифенілфосфін)паладій(II) дихлориду та придатної основи, наприклад, триетиламіну, та нагрівали при придатній температурі, наприклад, 20-55 °C, протягом придатного періоду часу, наприклад, 0,5-17 годин. Продукт (III) виділяли після водної обробки та очищення. Сполуку формули (V) можна отримувати реакцією сполуки формули (VI): де m визначено для сполуки формули (I), та X − група, яка видаляється, як-то галоген, наприклад, хлор, бром або іод, або алкілсульфонат, наприклад, п-толуолсульфонат, зі сполукою формули (VII): 10 15 20 25 30 35 40 де R3, n та p − такі, як визначено для сполуки формули (I). Наприклад, сполуку формули (VI), сполуку формули (VII) та придатну основу, наприклад, натрій гідрогенкарбонат, розчиняли в придатному розчиннику, наприклад, Ν,Νдиметилформаміді, та нагрівали при придатній температурі, наприклад, 80-100 °C, протягом придатного періоду часу, наприклад, 16-18 годин. Продукт (V) виділяли після водної обробки та очищення, наприклад, видаленням придатної кристалічної солі, наприклад, оксалатної солі. Сполука формули (VI) та формули (VII) є в продажу або можна отримувати способами, описаними в літературі. Альтернативно сполука формули (III) можна отримувати реакцією сполуки формули (VIIIA) або формули (VIIIB): де R1, R2 та m − такі, як визначено вище для сполуки формули (I) та X − група, яка видаляється, як визначено для сполук формули (VI) зі сполукою формули (VII). Наприклад, сполуку формули (VIIIA), сполуку формули (VII) та придатну основу, наприклад, триетиламін, розчиняли в придатному розчиннику, наприклад, ацетонітрилі, та нагрівали при придатній температурі, наприклад, 60-80 °C протягом придатного періоду часу, наприклад, 1626 годин. Продукт (III) виділяли після водної обробки та очищення. Наприклад, придатний відновлювальний засіб, наприклад, натрій триацетокси борогідрид, додавали до суміші сполуки формули (VIIIB), сполуки формули (VII) та засобу висушування, наприклад, 4Ǻ молекулярних сит, у придатному розчиннику, наприклад, дихлорометані, та перемішували при придатній температурі, наприклад, 20 °C, протягом придатного періоду часу, наприклад, 1-2 години. Продукт (III) виділяли після водної обробки та очищення. Сполуки формули (VIIIA) можна отримувати реакцією сполук формули (IV) зі сполуками формули (VI). Наприклад, сполуку формули (IV), сполуку формули (VI) розчиняли в придатному розчиннику, наприклад, N, N-диметилформаміді, у присутності купрум(І) йодиду, придатного каталізатора, наприклад, біс(трифенілфосфін)паладій(II) дихлориду та придатної основи, наприклад, триетиламіну, та нагрівали при придатній температурі, наприклад, 20 °C протягом придатного періоду часу, наприклад, 18-20 годин. Продукт (VIIIA) виділяли після водної обробки та очищення. Сполуки формули (VIIIB) можна отримувати реакцією сполук формули (IX): 7 UA 114645 C2 5 10 15 20 25 30 35 де R2 та m − такі, як визначено вище для сполуки формули (I), з окиснювальним засобом, наприклад, тетрапропіламоній перрутенатом у присутності 4-метилморфолін N-оксиду. Наприклад, сполуку формули (IX), придатний окисник, наприклад, тетрапропіл амоній перрутенат у присутності 4-метилморфолін N-оксиду, у придатному розчиннику, наприклад, суміші дихлорометану та ацетонітрилу, перемішували при придатній температурі, наприклад, 20 °C, протягом придатного періоду часу, наприклад, 2 години. Реакційну суміш фільтрували, та продукт (VIIIB) відокремлювали видаленням розчинника та очищенням, якщо потрібно. Сполуки формули (IX) можна отримувати реакцією сполуки формули (IV) із придатними алкін-1-олами. Наприклад, сполуку формули (IV), алкін-1-ол розчиняли в придатному розчиннику, наприклад, Ν,Ν-диметилформаміді, в присутності купрум(І) йодиду, придатного каталізатора, наприклад, біс(трифенілфосфін)паладій(II) дихлориду та придатної основи, наприклад, триетиламіну, та нагрівали при придатній температурі, наприклад, 20 °C протягом придатного періоду часу, наприклад, 18-20 годин. Продукт (IX) виділяли після водної обробки та очищення. Альтернативно сполуки формули (II) можна отримувати реакцією сполук формули (X): де R1, R2 та m − такі, як визначено вище для сполуки формули (I) Наприклад, придатний відновлювальний засіб, наприклад, натрій триацетоксиборогідрид, додавали до суміші сполуки формули (X), сполуки формули (VII) та засобу висушування, наприклад, 4A молекулярних сит, у придатному розчиннику, наприклад, дихлорометані, та перемішували при придатній температурі, наприклад, 20 °C, протягом придатного періоду часу, наприклад, 1-2 години. Продукт (II) виділяли після водної обробки та очищення. Сполуки формули (X) можна отримувати реакцією сполук формули (XI): де R1, R2 та m − такі, як визначено вище для сполуки формули (I) Наприклад, сполуку формули (XI), придатний окисник, наприклад, тетрапропіламоній перрутенат, у присутності 4-метилморфолін N-оксиду, у придатному розчиннику, наприклад, суміші дихлорометану та ацетонітрилу, перемішували при придатній температурі, наприклад, 20 °C, протягом придатного періоду часу, наприклад, 2 години. Продукт (X) відокремлювали видаленням розчинника, та очищали, якщо потрібно. Сполуки формули (XI) можна отримувати реакцією сполук формули (IX) з воднем у присутності каталізатора. Наприклад, сполуку формули (IX) розчиняли в придатному розчиннику, наприклад, етанолі, та пропускали через придатний каталізатор, наприклад, 10 % паладій на карбоні в присутності водню, при придатній температурі, наприклад, 20-60 °C, в апараті, як-то Thales H-cube™. Продукт (XI) відокремлювали видаленням розчинника та очищали, якщо потрібно. Сполуки формули (IV) можна отримувати реакцією сполук формули (XII): 8 UA 114645 C2 5 10 15 20 25 30 35 (XII) де R1 та R2 − такі, як визначено вище для сполуки формули (I), та Y визначено для сполуки формули (IV), з розчином аміаку. Наприклад, розчин водного аміаку (0,88) додавали до розчину сполуки формули (XII) у придатному розчиннику, наприклад, ізопропіловому спирті. Тоді отриману суміш нагрівали в мікрохвильовому нагрівачі при придатній температурі, наприклад, 120-150 °C, протягом придатного періоду часу, наприклад, 1-2 годин. Продукт (IV) виділяли після водної обробки та очищення. Сполуки формули (XII) можна отримувати реакцією сполук формули (XIII): де R1 та R2 − такі, як визначено вище для сполуки формули (I) зі сполукою формули (XIV): де сполука формули (XIV) − придатний попередник для захисної групи PG, наприклад, бензил хлорометил−етер або (2-(хлорометокси)етил)триметилсилан. Наприклад, сполуку формули (XIII) у придатному розчиннику, наприклад, N, Nдиметилформаміді або тетрагідрофурані, обробляли придатною основою, наприклад, суспензією натрій гідриду в олії. Додавали сполуку формули (XIV), наприклад, бензил хлорометил-етер або (2-(хлорометокси)етил)триметилсилан, та реакційну суміш перемішували при придатній температурі, наприклад, 20 °C, протягом придатного періоду часу, наприклад, 1-4 години. Продукт (XII) виділяли після водної обробки та очищення. Сполуки формули (XIII) можна отримувати реакцією сполук формули (XV): де R1 та R2 − такі, як визначено вище для сполуки формули (I), з реагентом галогенування, наприклад, N-іодосукцинімідом. Наприклад, сполуку формули (XV) розчиняли в придатному розчиннику, наприклад, тетрагідрофурані, піддавали реакції з N-іодосукцинімідом при придатній температурі, наприклад, 20 °C, протягом придатного періоду часу, наприклад, 1-2 години. Продукт (XIII) виділяли після водної обробки та очищення. Сполуки формули (XV) можна отримувати реакцією сполук формули (XVI): де R1 та R2 − такі, як визначено вище для сполуки формули (I), з реагентом хлорування, наприклад, фосфор оксихлоридом. Наприклад, сполуку формули (XVI) суспендували у фосфор оксихлориді та нагрівали при придатній температурі, наприклад, 120 °C, протягом придатного періоду часу, наприклад, 3-4 години. Надлишок фосфор оксихлориду можна видаляти у вакуумі, потім залишок заливали на лід та pH суміші регулювали до 7-9. Тоді продукт екстрагували в придатний органічний розчинник, наприклад, етилацетат. Продукт (XV) відокремлювали видаленням розчинника та очищали, якщо потрібно. Сполуки формули (XVI) можна отримувати реакцією сполук формули (XVII): 9 UA 114645 C2 5 10 15 20 25 30 35 40 45 де R1 та R2 − такі, як визначено вище для сполуки формули (I), з придатною основою, наприклад, натрій гідроксидом. Наприклад, розчин сполуки формули (XVII) у придатному розчиннику, наприклад, етиловому спирті, обробляли водним розчином натрій гідроксиду, та реакційну суміш перемішували при придатній температурі, наприклад, 80-100 °C, протягом придатного періоду часу, наприклад, 418 годин. Продукт (XVI) виділяли після водної обробки та очищення. Сполуки формули (XVII) можна отримувати реакцією сполук формули (XVIII): (XVIII) зі сполуками формули формули (XIX): де R1 та R2 − такі, як визначено вище для сполуки формули (I). Наприклад, суспензію сполуки формули (XVIII) у сполуці формули (XIX) обробляли розчином гідрогенхлориду в придатному розчиннику, наприклад, розчином гідрогенхлориду в 1,4-діоксані, та нагрівали при придатній температурі 50-70 °C протягом придатного періоду часу, наприклад, 16-18 годин. Продукт (XVIII) відокремлювали фільтруванням після додавання придатного розчинника, наприклад, трет-бутил метил-етеру. Альтернативно сполуку формули (XVI) можна отримувати реакцією сполуки формули (XVIII) зі сполуками формули (XX): де R1 є таким, як визначено вище для сполуки формули (I). Наприклад, суміш сполуки формули (XVIII) та сполуки формули (XX) нагрівали в придатному розчиннику, наприклад, o-ксилені, при придатній температурі, наприклад, при дефлегмації, протягом придатного періоду часу, наприклад, 3 доби. Після охолодження до температури навколишнього середовища продукт (XVI) відокремлювали після фільтрування. Сполуки формул (VI), (VII), (XIV), (XVIII), (XIX) та (XX) відомі в літературі або є в продажу, наприклад, від Sigma-Aldrich, UK, або їх можна отримувати аналогічно відомим процедурам, наприклад, описаним у звичайних посиланнях на методологію синтезу, як-то J. March, Advanced Organic Chemistry, 6th Edition (2007), WHeyBlackwell, або Comprehensive Organic Synthesis (Trost B.M. та Fleming I., (Eds.), Pergamon Press, 1991), кожне охоплено тут посиланнями, які стосуються таких процедур. Приклади інших захисних груп, які можна застосовувати в описаних тут способах синтезу, та способів їх видалення можна знайти в T. W. Greene Protective Groups в Organic Synthesis, ' 4th Edition, J. Wiley та Sons, 2006, що охоплено тут посиланнями, які стосуються таких процедур. У будь-яких описаних вище реакціях або процесах можна застосовувати звичайні способи нагрівання та охолодження, наприклад, масляну баню з регульованою температурою або теплі блоки з регульованою температурою, та льодяні/соляні бані або сухі льодяні/ацетонові бані, відповідно. Можна застосовувати звичайні способи відокремлення, наприклад, екстракцію з або у водні або неводні розчинники. Можна застосовувати звичайні способи висушування органічних розчинників, розчинів, або екстрактів, як-то струшування з безводним магній сульфатом, або безводним натрій сульфатом, або пропускання через гідрофобну фриту, . Якщо потрібно, можна застосовувати звичайні способи очищення, наприклад, кристалізацію та хроматографію, наприклад, хроматографію на діоксиді силіцію або реверсно-фазову хроматографію. Кристалізацію можна робити, застосовуючи звичайні розчинники, як-то етилацетат, метанол, етанол або бутанол, або їх водні суміші. Слід брати до уваги, що температури періодів конкретної реакції типово можна визначати способами контролю реакції, наприклад, тонкошаровою хроматографією та РХ-МС. 10 UA 114645 C2 5 10 15 20 25 30 35 40 45 50 55 Придатні індивідуальні ізомерні форми сполук винаходу можна отримувати як індивідуальні ізомери, застосовуючи звичайні процедури, як-то фракційна кристалізація діастереоізомерних похідних або хіральна високоефективна рідинна хроматографія (хіральна ВЕРХ). Абсолютну стереохімію сполук можна визначати, застосовуючи звичайні способи, як-то рентгенівська кристалографія. Способи застосування Приклади хворобливих станів, при яких сполуки формули (I) та їх фармацевтично прийнятні солі мають потенційно цілющі дії, охоплюють алергічні хвороби та інші запальні стани, наприклад, алергічні риніти та астму, інфекційні хвороби, та рак. Як модулятори імунного відгуку сполуки формули (I) та їх фармацевтично прийнятні солі також можуть бути корисними в лікування та/або попередженні імунно-опосередкованих розладів, охоплюючи, але без обмеження, запальні або алергічні хвороби, як-то астма, алергічні риніти та ринокон'юктивіт, харчова алергія, хвороби легеневої гіперчутливості, еозинофільний пневмоніт, розлади гіперчутливості вповільненого типу, атеросклероз, панкреатит, гастрит, коліт, остеоартрит, псоріаз, саркоідоз, пневмофіброз, синдром дихальної недостатності, бронхіоліт, хронічна обструктивна легенева хвороба, синусит, кістознмй фіброз, старечий кератоз, дисплазія шкіри, хронічна кропів'янка, екзема та всі типи дерматитів. Сполуки формули (I) та їх фармацевтично прийнятні солі також можуть бути корисними в лікування та/або попередження реакцій проти респіраторних інфекцій, охоплюючи, але без обмеження, вірусне подразнення дихальних шляхів та тонзиліт. Сполуки також можуть бути корисними в лікування та/або попередженні автоімунних хвороб, охоплюючи, але без обмеження, рематоідний артрит, псоріатичний артрит, системний червоний вовчак, хворобу Сьогрена, анкилозувальний спондиліт, склеродерма, дерматоміозит, діабет, відторгнення трансплантата, охоплюючи хворобу трансплантат проти хазяїна, запальні хвороби кишечнику, але без обмеження, хворобу Крона та виразковий коліт. Сполуки формули (I) та їх фармацевтично прийнятні солі також можуть бути корисними в лікування інфекційних хвороб, охоплюючи, але без обмеження, спричинених наступним: віруси гепатиту (наприклад, як-то вірус гепатиту B, вірус гепатиту C), вірус імунодефіциту людини, вірус папіломи, вірус герпесу, респіраторні віруси (наприклад, віруси грипу, респіраторний синцитіальний вірус, риновірус, метапневмонічний вірус, вірус парагрипу, SARS) та вірус західного Нілу. Сполуки формули (I) та їх фармацевтично прийнятні солі також можуть бути корисними в лікування мікробних інфекцій, спричинених, наприклад, бактерією, грибком або протозоа. Вони охоплюють, але без обмеження, наступне: туберкульоз, бактеріальна пневмонія, аспергильоз, гістоплазмоз, кандидомікоз, пневмоцистоз, лепра, хламідія, криптококова хвороба, криптоспоридоз, токсоплазмоз, лейшманія, малярія та трипаносомоз. Сполуки формули (I) та їх фармацевтично прийнятні солі також можуть бути корисними в лікування різних раків, зокрема, лікування раків, які відомі як реакція на імунотерапію, охоплюючи, але без обмеження, наступне: нирково-клітинна карцинома, рак легенів, рак молочної залози, колоректальний рак, рак сечового міхура, меланома, лейкемія, лімфоми та оваріальний рак. Спеціалісту в рівні техніки слід розуміти, що посилання тут на лікування або терапію залежно від стану можуть поширюватися на профілактику й також на лікування встановлених станів. Отже, як ще один аспект винаходу запропоновано сполуку формули (I) або її фармацевтично прийнятну сіль для застосування в терапії. Слід розуміти, коли сполуку формули (I) або її фармацевтично прийнятну сіль застосовано в терапії, її застосовано як активний терапевтичний засіб. Отже, також запропоновано сполуку формули (I) або її фармацевтично прийнятну сіль для застосування в лікування алергічних хвороб та інших запальних станів, інфекційних хвороб та раку. Отже, також запропоновано сполуку формули (I) або її фармацевтично прийнятну сіль для застосування в лікування алергічного риніту. Отже, також запропоновано сполуку формули (I) або її фармацевтично прийнятну сіль для застосування в лікування астми. Крім того, запропоновано застосування сполуки формули (I) або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування алергічних хвороб та інших запальних станів, інфекційних хвороб та раку. Крім того, запропоновано застосування сполуки формули (I) або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування алергічного риніту. 11 UA 114645 C2 5 10 15 20 25 30 35 40 45 50 55 60 Крім того, запропоновано застосування сполуки формули (I) або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування астми. Крім того, запропоновано спосіб лікування алергічних хвороб та інших запальних станів, інфекційних хвороб та раку, який полягає в застосування до людини, яка цього потребує, , терапевтично ефективної сполуки формули (I) або її фармацевтично прийнятної солі. Крім того, запропоновано спосіб лікування алергічного риніту, який полягає в застосування до людини, яка цього потребує, терапевтично ефективної сполуки формули (I) або її фармацевтично прийнятної солі. Крім того, запропоновано спосіб лікування астми, який полягає в застосування до людини, яка цього потребує, терапевтично ефективної сполуки формули (I) або її фармацевтично прийнятної солі. Також сполуки формули (I) та їх фармацевтично прийнятні солі потенційно застосовують як ад'юванти вакцин. Отже, запропоновано як ще один аспект винаходу вакцинну композицію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль та антиген, або антигенну композицію для застосування в терапії. Отже, запропоновано як ще один аспект винаходу застосування сполуки формули (I) або її фармацевтично прийнятної солі та антигену або антигенової композиції у виготовленні медикаменту для застосування в терапії. Крім того, запропоновано спосіб лікування або попередження хвороби, який полягає в застосуванні до людини, яка потерпає від хвороби, або сприйнятлива до хвороби, вакцинної композиції, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль та антиген або антигенну композицію. Композиції Сполуки формули (I) та їх фармацевтично прийнятні солі звичайно, але не обов'язково, перед застосуванням до пацієнта формують у фармацевтичні композиції. Відповідно, згідно із ще одним аспектом винаходу запропоновано фармацевтичну композицію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль та один або більше фармацевтично прийнятних наповнювачів. Сполуки формули (I) та їх фармацевтично прийнятні солі можна сформувати для застосування будь-яким придатним шляхом. Сполуки формули (I) та їх фармацевтично прийнятні солі, наприклад, можна сформувати для перорального, місцевого, дихального, інтраназального, букального, парентерального (наприклад, внутрішньовенного, підшкірного, інтрадермального або внутрішньом'язового) або ректального застосування. Згідно з одним аспектом сполуки формули (I) та їх фармацевтично прийнятні солі сформовано для перорального застосування. Згідно з іншим аспектом винаходу сполуки формули (I) та їх фармацевтично прийнятні солі сформовано для місцевого застосування, наприклад, інтраназального або дихального застосування. Таблетки та капсули для перорального застосування можуть містити звичайні наповнювачі, як-то зв'язувальний засіб, наприклад, сироп, акація, желатин, сорбіт, трагакант, слизовий клей крохмалю, целюлози або полівінілпіролідону; наповнювачі, наприклад, лактоза, мікрокристалічна целюлоза, цукор, кукурудзяний крохмаль, кальцій фосфат або сорбіт; змащувачі, наприклад, магній стеарат, стеаринова кислота, тальк, поліетиленгліколь або діоксид силіцію; дезінтегранти, наприклад, картопляний крохмаль, натрій кроскармелоза або натрій крохмаль-гліколат; або зволожувальні засоби, як-то натрій лаурил-сульфат. Таблетки можна покривати згідно зі способами, добре відомими в рівні техніки. Пероральні рідинні препарати можуть бути у формі, наприклад, водних або олійних суспензій, розчинів, емульсій, сиропів або еліксирів, або можуть бути наданими як сухий продукт для поєднанням перед застосуванням із водою або іншим придатним носієм. Такі рідинні препарати можуть містити звичайні допоміжні речовини, як-то суспендувальні засоби, наприклад, сорбітовий сироп, метилцелюлоза, сироп глюкози/цукру, желатин, гідроксиметилцелюлоза, карбоксиметилцелюлоза, гель алюміній стеарату або гідрогенізовані харчові жири; емульсувальні засоби, наприклад, лецитин, сорбітан моно-олеат або акація; неводні носії (які можуть охоплювати харчові олії), наприклад, мигдалева олія, фракціонована кокосова олія, олійні естери, або етиловий спирт; або консерванти, наприклад, метил або пропіл 7-гідроксибензоати або сорбинова кислота. Препарати також можуть містити придатні буферні солі, ароматизатори, барвники та/або підсолоджувачі (наприклад, манітол). Композиції для інтраназального застосування охоплюють водні композиції, застосовані як краплі до носа або з насосу під тиском. Придатні композиції містять воду як розріджувач або носій для цієї мети. Композиції для застосування до легенів або носа можуть містити один або 12 UA 114645 C2 5 10 15 20 25 30 35 40 45 50 55 60 більше наповнювачів, наприклад, один або більше суспендувальних засобів, один або більше консервантів, одну або більше поверхнево-активних речовин, один або більше засобів регулювання тонусу, один або більше співрозчинників, та можуть містити складові для контролю pH композиції, наприклад, буферну систему. Крім того, композиції можуть містити інші наповнювачі, як-то антиоксиданти, наприклад, натрій метабісульфіт, засоби маскування смаку. Композиції також можна застосовувати розпилюванням до носа або інших місць респіраторного трату. Інтраназальні композиції можуть дозволяти постачати сполуки формули (I) або (a) їх фармацевтично прийнятні солі до всіх місць носової порожнини (цільової тканини) та крім того, можуть дозволяти контакт сполук формули (I) або (a) їх фармацевтично прийнятних солей із цільовою тканиною для тривалішого періоду часу. Придатному режиму дозування інтраназальної композиції для пацієнта слід бути таким, щоб повільно постачати через ніс до чистої носової порожнини. Протягом інгаляції композицію слід застосовувати до однієї ніздрі, у той час як інша вручну стиснуто. Цю процедуру потім слід повторити до іншої ніздрі. Типово, слід застосовувати до ніздрі одне або два розпилювання за вказаною вище процедурою один, два або три рази кожної доби, ідеально − один раз на добу. Винятково цікаві − інтраназальні композиції, придатні для застосування один раз на добу. Якщо залучено суспендувальні засоби, типово вони присутні в кількості 0,1 − 5 % (масова частка), як-то 1,5 % − 2,4 % (масова частка), базованій на загальній масі композиції. Приклади фармацевтично прийнятних суспендувальних засобів охоплюють, але без обмеження, наступне: Avicel® (мікрокристалічна целюлоза та натрій карбоксиметилцелюлоза), натрій карбоксиметилцелюлоза, вігум, трагакант, бентоніт, метилцелюлоза, смола евкаліпту, карбопол та поліетиленгліколі. Композиції для застосування до легенів або носу можуть містити один або більше наповнювачів, можуть бути захищеними від мікробного або грибкового забруднення та зростанням уведення одного або більше консервантів. Приклади фармацевтично прийнятних протимікробних засобів або консервантів охоплюють, але без обмеження, четвертинні амонійні сполуки (наприклад, бензалконіум хлорид, бензетоніум хлорид, цетавлон, цетилпіридініум хлорид, лауралконіум хлорид та міристил піколініум хлорид), ртутні засоби (наприклад, фенілмеркурій нітрат, фенілмеркурій ацетат та тімеросал), спиртові засоби (наприклад, хлоробутанол, фенілетиловий спирт та бензиловий спирт), антибактеріальні естери (наприклад, естери пара-гідроксибензойна кислота), халатні засоби, як-то двонатрієвий едетат (ЕДТА) та інші протимікробні засоби, як-то хлоргексидин, хлорокрезол, сорбинова кислота та її солі (як-то калій сорбат) та поліміксин. Приклади фармацевтично прийнятних протигрибкових засобів або консервантів охоплюють, але без обмеження, наступне: натрій бензоат, сорбинова кислота, натрій пропіонат, метилпарабен, етилпарабен, пропілпарабен та бутилпарабен. Консерванти, якщо їх уведено до складу, можуть бути присутніми в кількості 0,001 − 1 % (масова частка), як-то 0,015 % − 0,5 % (масова частка), що базовано на загальній масі композиції. Композиції (наприклад, такі, де, принаймні, одна сполука є в суспензії) можуть охоплювати одну або більше поверхнево-активних речовин, котрі призначені для полегшення розчинення часточок медикаменту у воднофазовій композиції. Наприклад, поверхнево-активну речовину застосовують у кількості, яка не спричиняє створення піни протягом змішування. Приклади фармацевтично прийнятних поверхнево-активних речовин охоплюють спирти жирного ряду, естери та етери, як-то поліоксиетилен (20) сорбіт моноолеат (Полісорбат 80), макрогол-етери та поліоксамери. Поверхнево-активна речовина може бути присутньою в кількості, приблизно, 0,01 − 10 % (масова частка), як-то 0,01 − 0,75 % (масова частка), наприклад, приблизно, 0,5 % (масова частка), що базовано на загальній масі композиції. Можна вводити один або більше засобів регулювання тонусу для досягнення тонічності з рідинами організму, наприклад, рідини порожнини носа, що призводить до зменшення рівнів подразнення. Приклади фармацевтично прийнятних засобів регулювання тонусу охоплюють, але без обмеження, наступне: натрій хлорид, декстроза, ксилітол, кальцій хлорид, глюкоза, гліцерин та сорбіт. Засіб регулювання тонусу, якщо він присутній, можна вводити в кількості 0,1 − 10 % (масова частка), як-то frm 4,5 − 5,5 % (масова частка), наприклад, приблизно, 5,0 % (масова частка), що базовано на загальній масі композиції. Композиції винаходу можна буферувати додаванням придатних буферувальних засобів, якто натрій цитрат, лимонна кислота, трометанол, фосфати, як-то двонатрій фосфат (наприклад, додекагідрат, гептагідрат, дигідрат та безводні форми), або натрій фосфат та їх суміші. Буферувальний засіб, якщо він присутній, можна вводити в кількості 0,1 − 5 % (масова частка), наприклад, 1 − 3 % (масова частка), що базовано на загальній масі композиції. 13 UA 114645 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклади засобів маскування смаку охоплюють наступне: цукралоза, цукроза, сахарин або їх сіль, фруктоза, декстроза, гліцерин, кукурудзяний сироп, аспартам, ацесульфам-K, ксилітол, сорбіт, еритритол, амоній гліциризинат, тауматин, неотам, манітол, ментол, евкаліптова олія, камфора, природний ароматизатор, штучний ароматизатор та їх комбінації. Один або більше співрозчинників можна вводити для розчинності сполук медикаменту та/або інших наповнювачів. Приклади фармацевтично прийнятних співрозчинників охоплюють, але без обмеження, наступне: пропіленгліколь, дипропіленгліколь, етиленгліколь, гліцерин, етанол, поліетиленгліколі (наприклад, PEG300 або PEG400) та метанол. В одному втіленні співрозчинник − пропіленгліколь. Співрозчинники, якщо вони присутні, можна вводити в кількості 0,05 − 30 % (масова частка), як-то 1 − 25 % (масова частка), наприклад, 1 − 10 % (масова частка), що базовано на загальній масі композиції. Композиції для дихального застосування охоплюють водні, органічні або водні/органічні суміші, сухий порошок або кристалічні композиції, застосовані до респіраторного тракту насосом під тиском або інгалятором, наприклад, інгалятори з резервуаром сухого порошку, однодозові інгалятори сухого порошку, багатодозові інгалятори сухого порошку з виміряною дозою, назальні інгалятори або аерозолеві інгалятори підвищеного тиску, розпилювачі або інсуфлятори. Придатні композиції містять як розріджувач воду або носій для цієї мети, та їх можна забезпечувати звичайними наповнювачами, як-то буферувальні засоби, засоби регулювання тонусу та подібне. Водні композиції також можна застосовувати розпилюванням до носа та інших місць респіраторного тракту. Такі композиції можуть бути водними розчинами або суспензіями, або аерозолями, які постачають із герметизованих пакетів, як-то інгалятор із виміряною дозою, із застосування придатного розрідженого газу-носія. Композиції для місцевого застосування до носу (наприклад, для лікування ринітів) або легенів, охоплюють аерозолеві композиції під тиском та водні композиції для постачання до носових порожнин насосом під тиском. Композиції, які не є під тиском та є придатними для місцевого застосування до порожнини носа, є особливо цікавими. Придатні композиції містять воду як розріджувач або носій для цієї мети. Водні композиції для застосування до легенів або носа можна надавати зі звичайними наповнювачами, як-то буферувальні засоби, засоби регулювання тонусу та подібне. Водні композиції також можна застосовувати до носа розпилюванням. Рідинний розпилювач типово можна застосовувати для постачання рідинної композиції до носових порожнин. Рідинна композиція може бути водною або неводною, але типово − водна. Сполуку формули (I) або її фармацевтично прийнятну сіль можна формувати як суспензію або розчин. Такий рідинний розпилювач може мати насадку для розподілу або отвір для розподілу, через який виміряну дозу рідинної композиції розподілено після застосування сили користувача до механізму насосу рідинного розпилювача. Такі рідинні розпилювачі звичайно забезпечено резервуаром багаторазових виміряних доз рідинної композиції, доза розпилювалась після послідовних запусків насосу. Альтернативно, рідинний розпилювач для постачання рідинної композиції до носових порожнин може призначатися для обмеженої дози, наприклад, застосування розпилювача одиничної дози, яка містить одну дозу. Насадку для розподілу або отвір можна формувати для введення в ніздрю споживача для надання спрію в порожнину носа. Рідинний розпилювач згаданого вище типу описано та ілюстровано в публікації в Міжнародній заявці на патент номер WO 2005/044354 (Glaxo Group Limited). Розпилювач має футляр, який уміщує пристрій випуску рідини, який має компресор, вмонтований у контейнер для вмісту рідинної композиції. Футляр має, принаймні, один відкритий для пальця важіль, який є рухливим усередині стосовно футляру, щоб рухати контейнер угору у футлярі за допомогою шаблону для стискання насосу та випуску виміряної дози композиції через назальну насадку футляру. В одному втіленні рідинний розпилювач − загальний тип, ілюстрований у фігурах 30-40 у WO 2005/044354. Водні композиції, які містять сполуку формули (I) або її фармацевтично прийнятну сіль, також можна постачати насосом, як розкрито в Міжнародній заявці на патент, номер публікації WO2007/138084 (Glaxo Group Limited), наприклад, який розкрито там у посиланні на фігурах 2246, або який розкрито в Міжнародній заявці на патент Великобританії номер GB0723418,0 (Glaxo Group Limited), наприклад, як розкрито там посиланнями на фігурах 7-32. Насос можна запускати приводом, який розкрито у фігурах 1-6 у GB0723418,0. Композиції сухого порошку для місцевого постачання до легенів, наприклад, можна надавати в капсулах та ампулах, наприклад, з желатину, або блістерах, наприклад, з ламінованої алюмінієвої фольги, для застосування в інгаляторі або інсуфляторі. Порошкові змішані композиції звичайно містять для інгаляції порошкову суміш сполуки формули (I) або її 14 UA 114645 C2 5 10 15 20 25 30 35 40 45 50 55 60 фармацевтично прийнятної солі та придатну порошкову основу (носій/розріджувач/наповнювач), як-то моно-, ди- або полісахариди (наприклад, лактозу або крохмаль). Сухі порошкові композиції також можуть крім ліків та носія містити наповнювач (наприклад, потрійний засіб, як-то цукор-естер, наприклад, целобіоза октаацетат, кальцій стеарат або магній стеарат. В одному втіленні придатну для дихального застосування композицію можна вводити в численні герметизовані дозові контейнери, передбачені для медикаментозних пакетів, умонтованих у середину придатного інгаляційного апарату. Контейнери можуть бути здатними до розриву, легкого розшаровування, або заданими послідовно до розкриття іншим способом, та дози сухої порошкової композиції, застосовано інгаляцією на інгаляційному апараті із загубником, який відомий у рівні техніки. Медикаментозний пакет може мати ряд різних форм, наприклад, форму диску або подовженої смужки. Характерні інгаляційні апарати − апарати DISKHALER™ та DISKUS™, у продажу від GlaxoSmithKline. Суху порошкову дихальну композицію також можна перебачити як запас об'єму в інгаляційному апараті, тоді апарат забезпечено механізмом для вимірювання дози композиції з резервуару до інгаляційного каналу, де виміряну дозу здатен вдихати пацієнт через загубник апарату. Характерні апарати цього типу, які є в продажу, − TURBUHALER™ (AstraZeneca), TWISTHALER™ (Schering) та CLICKHALER™ (Innovata.) Існує ще один спосіб постачання сухої порошкової дихальної композиції для виміряних доз композиції, уведених у капсули (одна доза на капсулу), які потім завантажують в інгаляційний апарат, типово коли є потреба в пацієнта. Апарат має способи розриву, проколу або інше відкриття капсули, внаслідок чого доза здатна завантажуватися в легені пацієнта, коли він вдихає через загубник апарату. Як приклади, де такі апарати є в продажу, можна згадати ROTAHALER™ (GlaxoSmithKline) та HANDIHALER™ (Boehringer Ingelheim.) Герметизовані аерозолеві композиції, придатні для інгаляції, можуть бути суспензією або розчином, та можуть містити сполуку формули (I) або її фармацевтично прийнятну сіль та придатний газ-витискувач, як-то флуорокарбон або хлорофлуорокарбон, який містить гідроген, або їх суміші, конкретно − гідрофлуороалкани, зокрема, 1,1,1,2-тетрафлуороетан, 1,1,1,2,3,3,3гептафлуоро-н-пропан або їх суміш. Аерозолева композиція необов'язково може містити додаткові наповнювачі композиції, добре відомі в рівні техніки, як-то поверхнево-активні речовини, наприклад, олеінова кислота, лецитин або олігомолочна кислота або її похідне, наприклад, як описано в WO 94/21229 та WO 98/34596 (Minnesota Mining та Manufacturing Company), та співрозчинники наприклад, етанол. Герметизовані композиції звичайно слід утримувати в каністрі (наприклад, алюмінієвій каністрі), закритій клапаном (наприклад, дозувальним клапаном), та із вмонтованим у пускач, забезпечений загубником. Мазі, креми та гелі, наприклад, можна формувати з водною або олійною основою з додаванням придатного загущувального та/або засобу створення гелю, та/або розчинників. Отже, такі основи, наприклад, можуть охоплювати воду та/або олію, як-то рідинний парафін або рослинна олія, як-то арахісова олія або касторова олія, або розчинник, як-то поліетиленгліколь. Загущувальні засоби та засоби створення гелю, які можна застосовувати згідно із природою основи, охоплюють м'який парафін, алюміній стеарат, цетостеариловий спирт, поліетиленгліколі, ланолін, бджолиний віск, карбоксиполіметилен та похідні целюлози, та/або гліцерилмоностеарат та/або нейонні емульсувальні засоби. Лосьйони можна формувати з водною або олійною основою, та взагалі їм також слід містити один або більше емульсувальних засобів, стабілізазувальних засобів, диспергувальних засобів, суспендувальних засобів або загущувальних засобів. Порошки для зовнішнього застосування можна формувати з будь-якою придатною порошковою основою, наприклад, тальком, лактозою або крохмалем. Краплі можна формувати з водною або неводною основою, яка також містить один або більше диспергувальних засобів, засобів для розчинності, суспендувальних засобів або консервантів. Сполуки формули (I) та їх фармацевтично прийнятні солі, наприклад, можна формувати для трансдермального постачання композицією в пластирах або інших способах (наприклад, апаратах із газом підвищеного тиску), котрі постачають активний компонент до шкіри. Для букального застосування композиції можуть мати форму таблеток або коржів, створених звичайним способом. Сполуки формули (I) та їх фармацевтично прийнятні солі також можна формувати як супозиторії, наприклад, які містять звичайні основи супозиторію, як-то масло какао або інші гліцериди. Сполуки формули (I) та їх фармацевтично прийнятні солі також можна формувати для парентерального застосування болюсним вливанням або подовженою інфузією, та їх можна 15 UA 114645 C2 5 10 15 20 25 30 35 40 45 50 55 60 надавати в однодозовій формі, наприклад, як ампули, флакони, настої малого об'єму або попередньо наповнені шприці, або в багатодозовій ємності з доданим консервантом. Композиції можуть мати такі форми як розчини, суспензії або емульсії у водних або неводних носіях, та можуть містити засоби розробки рецептури, як-то антиоксиданти, буфери, антимікробні засоби та/або засоби регулювання тонусу. Альтернативно, активний інгредієнт може бути у вигляді порошку для складу перед застосуванням із придатним носієм, наприклад, стерильною апірогенною водою. Сухе тверде постачання можна отримувати наповненням стерильного порошку асептично в індивідуальні стерильні контейнери або наповненням стерильного розчину асептично в кожний контейнер та висушуванням виморожуванням. Сполуки формули (I) та їх фармацевтично прийнятні солі також можна формувати з вакцинами як ад'ювантами для модулювання їх активності. Такі композиції можуть містити антитіла або фрагменти антитіла, або антигенний компонент, охоплюючи, але без обмеження, білок, ДНК, живу або мертву бактерії та/або віруси, або вірусоподібні часточки разом з одним або більше компонентами з активністю ад'юванта, охоплюючи, але без обмеження, солі алюмінію, олійні та водні емульсії, білки теплового шоку, препарати ліпіду A та похідні, глюколіпіди, інші агоністи TLR, як-то CpG ДНК або подібні засоби, цитокіни, як-то GM-CSF або IL-12, або подібні засоби. Згідно із ще одним аспектом винаходу запропоновано вакцинний ад'ювант, який містить сполуку формули (I) або її фармацевтично прийнятну сіль. Крім того, запропоновано вакцинну композицію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль та антиген або антигенну композицію. Сполуки формули (I) та їх фармацевтично прийнятні солі можна застосовувати як такі або в комбінації з іншими терапевтично активними засобами. Згідно з іншим аспектом винаходу запропоновано комбінацію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль разом з, принаймні, одним іншим терапевтично активним засобом. Сполуки формули (I) та їх фармацевтично прийнятні солі та інші терапевтично активні засоби можна застосовувати разом або окремо, та при окремому застосуванні його можна надавати одночасно або послідовно, у будь-якій послідовності. Кількості сполук формули (I) або (a) їх фармацевтично прийнятних солей та інших терапевтично активних засобів та вибір відносних часів застосування слід вибирати, щоб досягати бажаної комбінованої терапевтичної дії. Застосування комбінації сполуки формули (I) або її фармацевтично прийнятної солі з іншими засобами лікування може бути супутнім застосуванням в одиничній фармацевтичній композиції, охоплюючи обидві сполуки, або в окремих фармацевтичних композиціях, кожна з яких охоплює одну зі сполук. Альтернативно, комбінацію можна застосовувати окремо послідовним способом, де один засіб лікування застосовано першим, а інший − другим, або навпаки. Таке послідовне застосування може бути близьким у часі або віддаленим у часі. Сполуки формули (I) та їх фармацевтично прийнятні солі можна застосовувати в комбінації з одним або більше корисними засобами для попередження або лікування вірусних інфекцій. Приклади таких засобів охоплюють, без обмеження; інгібітори полімерази, як-то розкриті в міжнародному патенті WO 2004/037818-A1, також розкриті в міжнародних патентах WO 2004/037818 та WO 2006/045613; JTK-003, JTK-019, NM-283, HCV-796, R-803, R1728, R1626, також розкриті в міжнародних патентах WO 2006/018725, WO 2004/074270, WO 2003/095441, US2005/0176701, WO 2006/020082, WO 2005/080388, WO 2004/064925, WO 2004/065367, WO 2003/007945, WO 02/04425, WO 2005/014543, WO 2003/000254, EP 1065213, WO 01/47883, WO 2002/057287, WO 2002/057245 та подібні засоби; інгібітори репликації, як-то ацикловір, фамцикловір, ганцикловір, цидофовір, лімівудин та подібні засоби; інгібітори протеази, як-то інгібітори ВІЧ-протеази саквінавір, ритонавір, індинавір, нелфінавір, ампренавір, фозампренавір, бреканавір, атазанавір, типранавір, палінавір, лазинавір, та інгібітори HCVпротеази (HCV – вірус гепатиту С) BILN2061, VX-950, SCH503034; та подібні засоби; нуклеозид та інгібітори нклеотид-реверсной транскриптази, як-то зидовудин, диданозин, ламівудин, залцитабін, абакавір, ставідин, адефовір, адефовір дипівоксил, фозивідин, тодоксил, емтрицитабін, аловудин, амдоксовір, елвуцитабін та подібні засоби; інгібітори ненуклеозидреверсної транскриптази (охоплюючи засіб, який має антиоксидантну активнсіть, як-то імунологічна, олтіпраз т.д.), як-то невірапин, делавіридин, ефавіренз, ловірид, імунокал, олтіпраз, каправірин, TMC-278, TMC-125, етравірин та подібні засоби; інгібітори вхідних ворот інфекції, як-то енфувіритид (T-20), T-1249, PRO-542, PRO-140, TNX-355, BMS-806, 5-Helix та подібні засоби; інгібітори інтегрази, як-то L-870,180 та подібні засоби; інгібітори брунькування, як-то PA-344 та PA-457 та подібні засоби; інгібітори рецептору хемокіну, як-то вікривірок (Sch-C), Sch-D, TAK779, маравірок (UK-427,857), TAK449, також це розкрито в міжнародних патентах WO 02/74769, WO 2004/054974, WO 2004/055012, WO 2004/055010, WO 2004/055016, WO 16 UA 114645 C2 5 10 15 20 25 30 35 40 45 50 55 60 2004/055011 та WO 2004/054581, та подібні засоби; інгібітори нейрамінідази, як-то CS-8958, занамівір, оселтамівір, перамівір та подібні засоби; блокатори іонного каналу, як-то амантадин або римантадин та подібні засоби; та інтерферирувальна РНК й антисенсові олігонуклеотиди та, як-то ISIS-14803 і подібні засоби; антивірусні засоби невизначеного механізму дії, наприклад, розкриті в WO 2005/105761, WO 2003/085375, WO 2006/122011, рибавірин, та подібні засоби. Сполуки формули (I) та їх фармацевтично прийнятні солі також можна застосовувати в комбінації з одним або більше іншими засобами, які можуть бути корисними в попередженні або лікуванні вірусних інфекцій, наприклад, імунних терапій (наприклад, інтерферон або інші цитокіни/хемокіни, модулятори рецептору цитокіну/хемокіну, агоністи або антагоністи цитокіну та подібні засоби); та терапевтичні вакцини, антифіброзні засоби, протизапальні засоби, як-то кортикостероїди або NSAIDs (нестероідні протизапальні засоби) та подібні засоби. Сполуки формули (I) та їх фармацевтично прийнятні солі можна застосовувати в комбінації з одним або більше іншими засобами, які можуть бути корисними в попередженні або лікуванні, наприклад, наступного: алергічна хвороба, запальна хвороба, автоімунна хвороба; антигенна імунотерапія − антигістаміни, стероїди, NSAIDs, бронходилататори (наприклад, бета 2 агоністи, адренергічні агоністи, антихолінергічні засоби, амінофілін), метотрексат, модулятори лейкотриєну та подібні засоби; моноклональна антитілова терапія, як-то anti-IgE, anti-TNF, antiIL-5, anti-IL-6, anti-IL-12, anti-IL-1 та подібні засоби; рецепторні терапії, наприклад, етанерцепт та подібні засоби; антигенові неспецифічні імунотерапіїi (наприклад, інтерферон або інші цитокіни/хемокіни, модулятори рецептору цитокіну/хемокіну, агоністи або антагоністи цитокіну, агоністи TLR та подібні засоби). Сполуки формули (I) та їх фармацевтично прийнятні солі можна застосовувати в комбінації з одним або більше іншими засобами, які можуть бути корисними в попередженні або лікуванні раку, наприклад, хіміотерапевтичними засобами, як-то алкілувальні засоби, інгібітори топоізомерази, антиметаболити, антимітотичні засоби, інгібітори кінази та подібні засоби; моноклональна антитілова терапія, як-то трастузумаб, гемтузумаб та інші подібні засоби; та гормональна терапія, як-то тамоксифен, госерелін та подібні засоби. Фармацевтичні композиції згідно з винаходом також можна застосовувати як такі або в комбінації з, принаймні, одним іншим терапевтичним засобом в інших терапевтичних областях, наприклад, шлунково-кишковій хворобі. Композиції згідно з винаходом також можна застосовувати в комбінації з генною замісною терапією. Згідно із ще одним аспектом винаходу охоплено комбінацію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль разом з, принаймні, одним іншим терапевтично активним засобом. Указані вище комбінації можна легко надавати для застосування у формі фармацевтичної композиції, та отже, фармацевтичні композиції, які містять визначену вище комбінацію разом з, принаймні, одним фармацевтично прийнятним розріджувачем або носієм, представляють ще один аспект винаходу. Кількості терапевтично ефективної сполуки формули (I) або її фармацевтично прийнятної солі слід залежати від ряду факторів. Наприклад, тип, вік та маса одержувача, точний стан, який потребує лікування, та його тяжкість, природа композиції, та шлях застосування − всі ці фактори слід брати до уваги. Зрештою, терапевтично ефективну кількість надають по розсуду лікаря. Незалежно, ефективній кількості сполуки заявленого винаходу для лікування людей, які потерпають від хвороби, звичайно слід бути в діапазоні 0,0001 − 100 мг/кг маси тіла одержувача на добу. Краще ефективній кількості слід бути в діапазоні 0,001 − 10 мг/кг маси тіла на добу. Отже, для дорослого масою 70 кг один приклад фактичної кількості на добу звичайно дорівнює 7 − 700 мг. Для інтраназального та дихального шляхів застосування типовим дозам для дорослого масою 70 кг слід бути в діапазоні 0,1 мікрограмів − 1 мг на добу, наприклад, 1 мкг, 10 мкг або 100 мкг. Цю кількість можна надавати у в одній дозі на добу або в кількох (як-то дві, три, чотири, п'ять або більше) субдоз на добу, щоб загальна добова доза була тією самою. Ефективну кількість фармацевтично прийнятної солі сполуки формули (I) можна визначати безпосередньо як пропорцію ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі. Подібним дозуванням слід бути придатними для лікування інших розглянутих тут станів. Сполуки формули (I) та їх фармацевтично прийнятні солі також можна застосовувати з будьякою придатною частотою, наприклад, 1-7 разів на тиждень. Чіткому режиму дозування звичайно слід залежати від факторів, як-то терапевтичні показання, вік та стан пацієнта, та вибраний конкретний шлях застосування. Згідно з одним аспектом винаходу сполуку формули (I) або її фармацевтично прийнятну сіль можна застосовувати один раз щотижнево протягом періоду 4 − 8 тижнів, наприклад, 4, 5, 6, 7 або 8 тижнів. 17 UA 114645 C2 5 10 15 20 25 30 35 Фармацевтичні композиції можна надавати в однодозових формах, які містять заздалегідь визначену кількість активного інгредієнта на одиничну дозу. Така одиниця може містити, але без обмеження, 0,5 мг − 1 г сполуки формули (I) або її фармацевтично прийнятної солі залежно від стану, який лікують, шляху застосування та віку, маси та стану пацієнта. Кращі однодозові композиції містять добову дозу або субдозу, як розглянута тут вище, або придатну її фракцію активного інгредієнту. Такі фармацевтичні композиції можна отримувати будь-якими способами, які добре відомі в рівні фармацевтичної техніки. Також тут запропоновано спосіб отримання такої фармацевтичної композиції, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль, змішані з одним або більше фармацевтично прийнятними наповнювачами. Сполуки формули (I) та їх солі можна отримувати методологією, описаною нижче, яка складає подальші аспекти цього винаходу. Аспекти винаходу ілюстровано, але без обмеження, наступними прикладами. Аналітична методологія 1 Η ЯМР 1 Спектр Н ЯМР реєстрували в CDCI3 або ДМСО-d6 на спектрометрі Bruker DPX 400 або Bruker Avance DRX, Varian Unity 400 або JEOL Delta, усі працювали при 400 МГц. Застосований внутрішній стандарт − тетраaметилсилан або остаточний протонований розчинник при 7,25 млн 1 -1 для CDCI3 або 2,50 млн для ДМСО- d6 РХМС Система A Колонка: 50 мм x 2,1 мм ID, 1,7 мкм Acquity UPLC BEH C18 Швидкість потоку: 1мл/хвил. Температура: 40 °C Діапазоні УФ-визначення: 210 − 350 нм Мас-спектр: На мас-спектрометрі зареєстровано застосування позитивного та негативного способу електронорозпилюванної іонізації Розчинники: A: 0,1 % об'ємна частка мурашиної кислоти у воді B: 0,1 % об'ємна частка мурашиної кислоти в ацетонітрилі Градієнт: Час A% B% (хвил) 0 97 3 1,5 0 100 1,9 0 100 2,0 97 3 Система B Колонка: 50 мм x 2,1 мм ID, 1,7 мкм Acquity UPLC BEH C18 Швидкість потоку: 1мл/хвил. Температура: 40 °C Діапазоні визначення УФ: 210 − 350нм Мас-спектр: На мас-спектрометрі зареєстровано застосування позитивного та негативного способу електронорозпилюванної іонізації Розчинники: A: 10 мМ амоній гідрогенкарбонату у воді регулювали до pH 10 розчином аміаку B: ацетонітрил Градієнт: Час (хвил) 0 1,5 1,9 2,0 40 45 A% B% 99 3 3 0 1 97 97 100 Мас-спрямована автопрепаративна ВЕРХ (MDAP) Мас-спрямовану автопрепаративну ВЕРХ робили під надані нижче стани. Реєстрували усереднений УФ-сигнал від довжини хвилі 210нм − 350нм, та мас-спектр реєстрували на масспектрометрі, застосовуючи позитивний та негативний спосіб електронорозпилюванної іонізації. Спосіб A Спосіб A робили на колонці Sunfire Ci8 column (типово 150 мм x 30 мм в.д. 5мкм діаметр колонки) при температурі навколишнього середовища. Розчинники, які застосовували: 18 UA 114645 C2 5 10 15 20 25 30 35 40 A=0,1 % об'ємна частка розчину мурашиної кислоти у воді B=0,1 % об'ємна частка розчину мурашиної кислоти в ацетонітрилі. Спосіб B Спосіб B робили на колонці XBridge Cie column (типово 100 мм x 30 мм в.д. 5мкм діаметр колонки) при температурі навколишнього середовища. Розчинники, які застосовували: A=10 мМ водний амоній гідрогенкарбонат регулювали до pH 10 розчином аміаку. B = ацетонітрил. Спосіб C Спосіб C робили на колонці Sunfire Cie column (типово 150 мм x 30 мм в.д. 5 мкм діаметр колонки) при температурі навколишнього середовища. Розчинники, які застосовували: A=0,1 % об'ємна частка розчину трифлуорооцтової кислоти у воді B=0,1 % об'ємна частка розчину трифлуорооцтової кислоти в ацетонітрилі. Скорочення Наступник перелік надає певні скорочення, які тут застосовано. Слід брати до уваги, що перелік не є вичерпним, але значення цих скорочень, які тут нижче не визначено, відомі спеціалісту в рівні техніки. ДХМ Дихлорометан ДМФ N, N -Диметилформамід ДМСО Диметилсульфоксид ТГФ Тетрагідрофуран EtOAc Етилацетат MeOH Метанол EtOH Етанол MeCN Ацетонітрил HCI Хлоридна кислота ВЕРХ Високоефективна рідинна хроматографія MDAP Мас-спрямована автопрепаративна ВЕРХ SPE Твердофазова екстракція MeOH Метанол TBME трет-Бутил метил-етер TFA Трифлуорооцтова кислота DIPEA N, N-Діізопропілетиламін Інтермедіати реакційної суміші Інтермедіат 1: Етил 3-пентанімідоамідо-1H-пірол-2-карбоксилат гідрогенхлорид Розчин гідрогенхлориду в діоксані (12 мл, 4M, 48 ммол) додавали краплями до суспензії етил 3-аміно-1Н-пірол-2-карбоксилату гідрогенхлориду (2,04 г, 10,7 ммол) (J. Org. Chem. 1999, 64(22), 8411) у валеронітрилі (30 мл). Отриману суміш нагрівали при 50 °C протягом 18 годин. Реакційну суміш охолоджували до кімнатної температури та твердий матеріал збирали фільтруванням та промивали TBME. Бажану сполуку отримували як не зовсім білу тверду речовину (2,19 г). До фільтрату додавали наступну порцію TBME, та суміш знов фільтрували, осад промивали TBME та сушили, що дало додаткову порцію заголовної сполуки (0,275 г). 1 -1 H ЯМР (400 МГц, ДМСО- 6) δ млн 12,22 (br. s., 1 H) 10,88 (s, 1 H) 9,39 (br. s, 1 H) 8,25 (br. s, 1 H) 7,09 (t, 7=2,9 Гц, 1 H) 6,19 (t, 7=2,5 Гц, 1 H) 4,23 (q, 7=7,0 Гц, 2 H) 2,52-2,60 (m, 2 H) 1,63-1,77 (m, 2 H) 1,34-1,47 (m, 2 H) 1,27 (t, 7=7,2 Гц, 3 H) 0,94 (t, 7=7,4 Гц, 3 H) Інтермедіат 2: 2-Бутил-3Н-піроло[3,2-d]піримідин-4(5H)-он Розчин натрій гідроксиду (1,44 г, 35,9 ммол) у воді (7 мл) додавали до розчину етил 3пентанімідамідо-1H-пірол-2-карбоксилату гідрогенхлориду (2,46 г, 8,99 ммол) в етанолі (30 мл). Отриману суміш нагрівали при дефлегмації протягом загальних 4 годин. Реакційну суміш охолоджували до кімнатної температури, та pH регулювали до pH 6,5 водною лимонною кислотою. Отриману суміш екстрагували етилацетатом (2×50 мл). Комбіновані органічні фази промивали насиченим водним розчином натрій хлориду, сушили (Na 2SО4), фільтрували та випаровували, що дало бажану сполуку як бліду коричневу тверду речовину (1,69 г). + РХМС (Система B): tRET=0,66 хвил; MH 192 Інтермедіат 3: 2-Бутил-4-хлоро-5Н-піроло[3,2-d]піримідин Фосфор оксихлорид (20 мл, 21,46 ммол) додавали до 2-бутил-3Н-піроло[3,2-d]піримідин4(5Н)-он (1,69 г). Отриману суміш нагрівали при 100 °C. Після 4 годин реакційну суміш охолоджували до кімнатної температури потім заливали на лід. Водну фазу обробляли водним розчином натрій гідроксиду (5M) до pH 7. Отриману суміш екстрагували етилацетатом (2 × 150 19 UA 114645 C2 5 10 15 20 25 30 35 40 45 50 55 60 мл). Комбіновану органічну фазу промивали розсолом, сушили (Na 2SО4), фільтрували та випаровували, що дало бажану сполуку (1,69 г). + РХМС (Система B): tRET=0,90 хвил; MH 210, 212 Інтермедіат 4: 2-Бутил-4-хлоро-7-іодо-5Н-піроло[3,2d]піримідин N-Іодосукцинімід (2,09 г, 9,29 ммол) додавали поміркованими порціями до перемішуваного розчину 2-бутил-4-хлоро-5Н-піроло[3,2-d]піримідин (1,69 г, 8,06 ммол) у ТГФ (35 мл). Отриману суміш перемішували при кімнатній температурі протягом 1 години. Реакційну суміш розбавляти TBME (50 мл), потім промивали водним розчином натрій тіосульфату (50 мл), потім − насиченим водним розчином натрій хлориду (20 мл). Органічну фазу сушили (Na 2SО4), фільтрували та випаровували. Зразок розчиняли в дихлорометані та очищали хроматографією на діоксиді силіцію, застосовуючи градієнт 0-100 % дихлорометану-циклогексану протягом 30 хвилин, а потім − градієнт 0-100 % TBME-циклогексану, а потім − 0-20 % метанолом протягом 15 хвилин. Придатні фракції ідентифікували РХ-МС, потім комбінували та випаровували у вакуумі, що дало бажану сполуку як жовту тверду речовину (2,2 г). + РХМС (Система B): tRET=1,14 хвил; MH 336, 338 Інтермедіат 5: 5-((Бензилокси)метил)-2-бутил-4-хлоро-7-іодо-5-піроло[3,2-d] піримідин Натрій гідрид (0,338 г, 60 % в олії, 14,08 ммол) додавали поміркованими порціями до перемішуваного розчину 4-хлоро-7-іодо-2-бутил-5Н-піроло[3,2-d]піримідину (2,19 г, 6,53 ммол) у ДМФ (30 мл), охолодженому в льодяній бані. Після 30 хвилин додавали бензил хлорометилетер (1,13 мл, 1,278 г, 8,16 ммол), та реакційну суміш перемішували при кімнатній температурі. Реакційну суміш гасили водою, та отриману суміш розподіляли між етилацетатом (150 мл) та водою (150 мл). Органічну фазу промивали водою, а потім − насиченим водним розчином натрій хлориду, сушили (Na2SО4), фільтрували та випаровували. Зразок розчиняли в дихлорометані та очищали хроматографією на діоксиді силіцію (100 г), застосовуючи градієнт 0100 % етилацетату-циклогексану протягом 30 хвилин. Придатні фракції комбінували та випаровували у вакуумі, що дало бажану сполуку як жовту олію (2,82 г). + РХМС (Система B): tRET=1,49 хвил; MH 456, 458 Інтермедіат 6: 5-((Бензилокси)метил)-2-бутил-7-іодо-5Н-піроло[3,2-d]піримідин-4-амін 5-((Бензилокси)метил)-2-бутил-4-хлоро-7-іодо-5Н-піроло[3,2-d]піримідин (1 г, 2,2 ммол) суспендували в 2-пропанолі (5 мл) та 35 % (0,88) розчині аміаку (4 мл). Реакційну суміш перемішували при 120 °C протягом 90 хвилин у мікрохвильовому генераторі Biotage Initiator microwave. Ще додавали до реакційної суміші 1 мл 35 % (0,88) розчину аміаку. Реакційну суміш перемішували при 120 °C протягом 90 хвилин у мікрохвильовому генераторі Biotage Initiator microwave. Реакційну суміш випаровували у вакуумі, що дало бліду жовту олію. Олію розчиняли в мінімальному об'ємі 20 % метанолу в дихлорометані та очищали хроматографією на діоксиді силіцію, застосовуючи градієнт 0-100 % етилацетату в циклогексану протягом 80 хвилин. Фракції комбінували та випаровували у вакуумі, що дало бажану сполуку як безбарвну олію (768 мг). + РХМС (Система B): tRET=1,19 хвил; MH 437 Інтермедіат 7: 2-(Етоксиметил)-3Н-піроло[3,2]піримідин-4(5H)-он Перемішувану суміш 3-аміно-2-етоксикарбонілпіролу гідрогенхлориду (2,23 г, 11,70 ммол) та 2-етоксиацетімідаміду (2,086 г, 15,21 ммол) в o-ксилені (20 мл) нагрівали при дефлегмації протягом 23 год. Реакційну суміш концентрували у вакуумі до видалення найбільшої кількості oксилену та отримували зразок, який містив бажану сполуку (3,8 г). + РХМС (Система B): tRET=0,52 хвил; MH 194 Інтермедіат 8: 4-Хлоро-2-(етоксиметил)-5Н-піроло[3,2-d]піримідин Фосфор оксихлорид (21,81 мл, 234 ммол) додавали до сирого зразку 2-(етоксиметил)-3Hпіроло[3,2-d]піримідин-4(5Н)-ону (2,26 г). Отриману суміш нагрівали при 100 °C протягом 3 годин. Реакційну суміш охолоджували до кімнатної температури, потім обережно заливали на лід. Суміш обробляли водним розчином натрій гідроксиду (5M) до pH 7. Отриману суміш екстрагували етилацетатом (2 × 200 мл). Комбіновані органічні екстракти промивали розсолом, сушили, застосовуючи гідрофобну фриту, та концентрували у вакуумі, що дало 920 мг помаранчевої олії. Сирий продукт очищали хроматографією на колонці (100 г Si-колонка), застосовуючи градієнт 0-100 % EtOAc/циклогексану протягом 60 хвилин. Фракції, які містять бажаний продукт, комбінували та концентрували у вакуумі, що дало бажану сполуку як жовту тверду речовину (501 мг). + РХМС (Система B): tRET=0,67 хвил; MH 212, 214 Інтермедіат 9: 4-Хлоро-2-(етоксиметил)-7-іодо-5-піроло[3,2]піримідин Отримували подібно інтермедіату 4 із 4-хлоро-2-(етоксиметил)-5H-піроло[3,2-d]піримідину. + РХМС (Система B): tRET=0,85 хвил; MH 338, 340 20 UA 114645 C2 5 10 15 20 25 30 35 40 45 50 55 60 Інтермедіат 10: 5-((Бензилокси)метил)-4-хлоро-2-(етоксиметил)-7-іодо-5Н-піроло [3,2d]піримідин Отримували подібно інтермедіату 5 із 4-хлоро-2-(етоксиметил)-7-іодо-5Н-піроло[3,2d]піримідин. + РХМС (Система B): tRET=1,27 хвил; MH 458, 460 Інтермедіат 11: 5-((Бензилокси)метил)-2-(етоксиметил)-7-іодо-5Н-піроло[3,2-d]піримідин-4амін 5-((Бензилокси)метил)-2-бутил-4-хлоро-7-іодо-6-метил-5H-піроло[3,2-d]піримідин (1,2 г, 2,55 ммол) суспендували в ізопропанолі (4 мл) та додавали 0,88 аміак (4,24 мл, 77 ммол). Реакційну суміш перемішували та нагрівали при 120 °C протягом 2 год. у мікрохвильовому генераторі Biotage Initiator microwave. Додавали наступну порцію 0,88 аміаку (4,24 мл, 77 ммол), та реакційну суміш перемішували при 120 °C протягом 2 год. у мікрохвильовому генераторі Biotage Initiator microwave. Додавали до реакційної суміші наступну порцію 0,88 аміаку (4,24 мл, 77 ммол), та реакційну суміш перемішували при 120 °C протягом 2 годин у мікрохвильовому генераторі Biotage Initiator microwave. Реакційну суміш випаровували у вакуумі, та сирий продукт очищали хроматографією на колонці (100 г Si-колонка), застосовуючи градієнт 0-50 % EtOAc/циклогексану протягом 60 хвилин. Придатні фракції комбінували та концентрували у вакуумі, що дало бажану сполуку як білу тверду речовину (634 мг). + РХМС (Система B): tRET=1,24 хвил; MH 451 Інтермедіат 12: Етил 3-(3-метоксипропанімідамідо)-1Н-пірол-2-карбоксилат гідроген хлорид Отримували подібно інтермедіату 1 з етил 3-аміно-1Н-пірол-2-карбоксилату гідрогенхлориду та 3-метоксипропаннітрилу. -1 H ЯМР (400 МГц, ДМСО-d6) δ млн 12,23 (br. s, 1 H) 10,99 (br. s, 1 H) 9,48 (br. s, 1 H) 8,35 (br. s, 1 H) 7,05-7,13 (m, 1 H) 6,15-6,20 (m, 1 H) 4,23 (q, J=7,0 Гц, 2 H) 3,73 (t, J=6,3 Гц, 2 H) 3,32 (s, 3 H) 2,84 (t, J=6,27 Гц, 2 H) 1,27 (t, J=7,2 Гц, 3 H) Інтермедіат 13: 2-(2-метоксиетил)-3Н-піроло[3,2]піримідин-4(5H)-он Отримували подібно інтермедіату 2 з етил 3-(3-метоксипропанімідамідо)-1H-пірол-2карбоксилат гідрогенхлорид. + РХМС (Система B): tRET=0,48 хвил; MH 194 Інтермедіат 14: 4-Хлоро-2-(2-метоксиетил)-5Н-піроло[3,2-d]піримідин Отримували подібно інтермедіату 3 з 2-(2-метоксиетил)-3Н-піроло[3,2-d]піримідин-4(5)-он. + РХМС (Система B): tRET=0,62 хвил; MH 212, 214 Інтермедіат 15: 4-Хлоро-7-іодо-2-(2-метоксиетил)-5Н-піроло[3,2-d]піримідин N-іодосукцинімід (892 мг, 3,97 ммол) додавали поміркованими порціями до перемішуваного розчину 4-хлоро-2-(2-метоксиетил)-5Н-піроло[3,2-d]піримідину (730 мг, 3,45 ммол) у тетрагідрофурані (ТГФ) (30 мл). Отриману суміш перемішували при кімнатній температурі протягом 1 години. Реакційну суміш розбавляти TBME (50 мл) потім промивали водним розчином натрій тіосульфату (50 мл), потім − насиченим водним розчином натрій хлориду (20 мл). Органічну фазу сушили та фільтрували, застосовуючи гідрофобну фриту, та випаровували, що дало бажану сполуку (1,17 г). + РХМС (Система B): tRET=0,81 хвил; MH 338, 340 ' Інтермедіат 16: 5-((Бензилокси )метил-4-хлоро-7-іодо-2-(2-метоксиетил-5Н-піроло [3,2d]піримідин До перемішуваної суспензії натрій гідриду 60 мас. %. у мінеральній олії (0,180 г, 4,51 ммол) у безводному тетрагідрофурані (8 мл) при 0 °C додавали краплями протягом 5 хвилин розчин 4хлоро-7-іодо-2-(2-метоксиетил)-5Н-піроло[3,2-d]піримідину (1,17 г, 3,47 ммол) у тетрагідрофурані (8 мл). Отриману суміш перемішували при 0 °C протягом 15 хвилин перед додаванням краплями протягом 5 хвил. розчину бензилхлорометил-етеру (0,504 мл, 3,64 ммол) у тетрагідрофурані (5 мл). Реакційну суміш перемішували протягом двох годин. Реакційну суміш розподіляли між етилацетатом (200 мл) та водою (200 мл). Органічний шар відокремлювали та промивали розсолом (200 мл), сушили, фільтрували та концентрували у вакуумі, що дало сиру сполуку (1,57 г). Зразок розчиняли в дихлорометані та очищали хроматографією на діоксиді силіцію (70 г), застосовуючи градієнт 0-50 % етилацетату-циклогексану протягом 60 хвилин. Придатні фракції комбінували та випаровували у вакуумі, що дало бажану сполуку як тверду речовину (985 мг). + РХМС (Система B): tRET=1,23 хвил; MH 458, 460 Інтермедіат 17: 5-((Бензилокси)метил)-7-іодо-2-(2-метоксиетил)-5Н-піроло[3,2-d] піримідин-4амін До твердої речовини 5-((бензилокси)метил)-4-хлоро-7-іодо-2-(2-метоксиетил)-5Н-піроло[3,2d]піримідину (555 мг, 1,213 ммол) додавали ізопропанол (3 мл) та аміак 880 (0,75 мл, 13,56 21 UA 114645 C2 5 10 15 20 25 30 35 40 45 50 55 60 ммол). Реакційну посудину герметизували та нагрівали в Biotage Initiator, застосовуючи дуже високу початкову абсорбцію до 150 °C протягом 1 год. До реакційної суміші потім додавали аміак 880 (0,75 мл, 13,56 ммол), та реакційну посудину герметизували та нагрівали в Biotage Initiator, застосовуючи дуже високу початкову абсорбцію до 150 °C протягом 1 год. Реакційну суміш концентрували у вакуумі та суміш розподіляли між етилацетатом (50 мл) та водою (50 мл), та відокремлений водний шар знов екстрагували етилацетатом (25 мл), та комбіновані органічні фази промивали розсолом (25 мл), сушили, застосовуючи гідрофобну фриту, та концентрували у вакуумі, що дало коричневу смолу. Зразок розчиняли в дихлорометані та очищали хроматографією на діоксиді силіцію (Si) (50 г), застосовуючи градієнт 0-100 % етилацетату-дихлорометану протягом 40 хвилин. Придатні фракції комбінували та випаровували у вакуумі, що дало бажану сполуку як жовту смолу (349 мг). + (Система B): tRET=0,99 хвил; MH 439 Інтермедіат 18: Етил S-метил-3-пентанімідоамідо-1H-пірол-2-карбоксилатгідроген хлорид Гідроген хлорид у діоксані (4M, 308 мл, 1,2 мол) додавали краплями до етил 3-аміно-5метил-1Н-пірол-2-карбоксилату (38,3 г, 228 ммол) (J. Med. Chem. 2008, 51, 68) у валеронітрилі (383 мл). Отриману суміш нагрівали при 50 °C протягом ночі Додавали додаткову порцію кислоти (160 мл, 0,64 мол) та суміш нагрівали при 55 °C протягом ночі Реакційну суміш охолоджували до кімнатної температури, фільтрували, та фільтрат випаровували. Залишок перемішували TBME (1200 мл) протягом 30 хвилин тоді тверду речовину відфільтровували та промивали TMBE і сушили. Бажану сполуку отримували як коричневу тверду речовину (58,9 г). 1 -1 H ЯМР (400 МГц, ДМСО-d6) δ млн охоплює 11,90 (br. s, 1 H) 11,09 (s, 1 H) 9,52 (br. s, 1 H) 8,14 (br. s, 1 H) 5,82 (br. s, 1 H) 4,12 (q, 7=7,1 Гц, 2 H) 3,48 (br. s., 1 H) 2,14 (s, 3 H) 1,51-1,70 (m, 2 H) 1,05-1,40 (m, 6 H) 0,84 (t, 7=7,1 Гц, 3 H) Інтермедіат 19: 2-Бутил-6-метил-3Н-піроло[3,2]піримідин-4(5Н)-он Водний розчин натрій гідроксиду (6M, 138 мл) додавали краплями до розчину етил 5-метил3-пентанімідамідо-1Н-пірол-2-карбоксилату (58,9 г, 0,2 мол) в етанолі (550 мл), охолодженому в льодяній бані. Реакційну суміш нагрівали при дефлегмації протягом 2,5 годин, потім охолоджували до кімнатної температури. Додавали воду (700 мл) та pH регулювали до pH 6,5, застосовуючи водну лимонну кислоту (2M). Отриману суміш перемішували протягом 45 хвилин, потім фільтрували та твердий матеріал промивали водою. Матеріал сушили у вакуумній печі при 50 °C, що дало бажану сполуку. 1 -1 H ЯМР (400 МГц, ДМСО- 6) δ млн охоплює 11,60 (s, 1 H) 11,53 (s, 1 H) 5,91 (s, 1 H) 2,332,50 (m, 2 H) 2,19 (s, 3 H) 1,45-1,60 (m, 2 H) 1,10-1,26 (m, 2 H) 0,70-0,84 (m, 3 H) Інтермедіат 20: 2-Бутил-4-хлоро-6-метил-5-піроло[3,2]піримідин Фосфор оксихлорид (42,8 мл, 70,4 г, 0,459 мол) додавали краплями до розчину 2-бутил-6метил-3Н-піроло[3,2-d]піримідин-4(5Н)-ону (37,5 г, 0,183 мол) в ацетонітрилі (750 мл) під атмосферою азоту. Реакційну суміш нагрівали при дефлегмації протягом ночі Після охолодження до кімнатної температури додавали краплями додаткову порцію фосфор оксихлориду (42,8 мл, 70,4 г, 0,459 мол) та нагрівання продовжували протягом подальших 3,5 годин. Реакційну суміш знов охолоджували до кімнатної температури, та додавали краплями наступну порцію фосфор оксихлориду (42,8 мл, 70,4 г, 0,459 мол), та нагрівання продовжували протягом 3 годин. Реакційній суміші дозволяли стояти при кімнатній температурі протягом ночі, потім нагрівали при дефлегмації протягом 3,5 годин. Реакційну суміш охолоджували, потім концентрували. Залишок охолоджували в льодяній бані та обережно додавали охолоджену льодом воду (650 мл). Регулювали pH до 8, застосовуючи водний розчин калій гідроксиду, та потім суміш перемішували протягом 45 хвилин. Суміш розподіляли між дихлорометаном (1000 мл) та водою (1000 мл). Водний шар та твердий матеріал реекстрагували дихлорометаном (2×500 мл). Комбіновані органічні шари сушили (Na 2SО4) та фільтрували через a корж нейтрального глинозему. Фільтрат концентрували до жовтої олії, додавали затравку та гексан. Твердий матеріал фільтрували, промивали гексаном та сушили, що дало бажану сполуку як не зовсім білу тверду речовину (15,5 г). + РХМС (Система A): tRET=0,81 хвил; MH 224 / 226 Інтермедіат 21: 2-Бутил-4-хлоро-7-іодо-6-метил-5Н-піроло[3,2-d]піримідин Отримували подібно інтермедіату 4 із 2-бутил-4-хлоро-6-метил-5H-піроло[3,2-d] піримідину. + РХМС (Система B): tRET=1,20 хвил; MH 350, 352 Інтермедіат 22: 5-((Бензилокси)метил)-2-бутил-4-хлоро-7-іодо-6-метил-5-піроло[3,2d]піримідин Отримували подібно інтермедіату 5 із 2-бутил-4-хлоро-7-іодо-6-метил-5H-піроло [3,2d]піримідину. + РХМС (Система B): tRET=1,54 хвил; MH 470, 472 22 UA 114645 C2 5 10 15 20 25 30 35 40 45 50 55 Інтермедіат 23: 5-((Бензилокси)метил)-2-бутил-7-іодо-6-метил-5Н-піроло[3,2-d] піримідин-4амін Отримували подібно інтермедіату 6 з 5-((бензилокси)метил)-2-бутил-4-хлоро-7-іодо-6-метил5Н-піроло[3,2-d]піримідин. + РХМС (Система B): tRET=1,24 хвил; MH 451 Інтермедіат 24: 2-Бутил-4-хлоро-7-іодо-5-((2-(триметилсиліл)етоксил)метил)-5Н-піроло[3,2d]піримідин До перемішуваної суспензії натрій гідриду 60 мас. % у мінеральній олії (0,248 г, 6,20 ммол) у безводному ТГФ (20 мл) при 0 °C додавали краплями протягом 5 хвил розчин 2-бутил-4-хлоро7-іодо-5H-піроло[3,2-d]піримідину (1,3 г, 3,87 ммол) в ТГФ (20 мл). Отриману суміш перемішували при 0 °C протягом 15 хвилин перед додаванням краплями протягом 5 хвил розчину (2-(хлорометокси)етил)триметилсилану (0,720 мл, 4,07 ммол) у ТГФ (10 мл). Реакційну суміш перемішували протягом 2 годин, потім гасили водою. Реакційну суміш розподіляли між етилацетатом (100 мл) та водою (100 мл). Органічну фазу відокремлювали та промивали розсолом (100 мл), сушили, фільтрували та концентрували у вакуумі, що дало бажану сполуку (1,86 г) як червону олію. + РХМС (Система B): tRET=1,65 хвил; MH 466 Інтермедіат 25: 2-Бутил-7-іодо-5-((2-(триметилсиліл)етоксил)метил)-5Н-піроло[3,2d]піримідин-4-амін Отримували подібно інтермедіату 17 з 2-бутил-4-хлоро-7-іодо-5-((2-(три метил силіл)етоксил)метил)-5Н-піроло[3,2-d]піримідину. + РХМС (Система B): tRET=1,38 хвил; MH 447 Інтермедіат 26: 1-(Гекс-5-ин-1-іл)піперидин Розчин 6-хлорогекс-1-ину (5 мл, 41,3 ммол), піперидину (4,08 мл, 41,3 ммол) та натрій гідроген карбонату (4,16 г, 49,5 ммол) у ДМФ (50 мл) нагрівали під зворотним холодильником протягом 16 год. Реакційну суміш концентрували у вакуумі та залишок розподіляли між етером (150 мл) та водою (150 мл). Органічну фазу відокремлювали та водне екстрагували діетилетером (50 мл). Комбіновані органічні фази промивали розсолом (150 мл), сушили (MgSО4), фільтрували та концентрували у вакуумі, що дало сирий зразок заголовної сполуки (3,74 г). До сирого продукту додавали щавлеву кислоту (2,161 г, 24 ммол). Отриману тверду речовину рекристалізували з етанолу, збирали фільтруванням та сушили у вакуумі, що дало 1(гекс-5-ин-1-іл)піперидин щавлевої кислоти сіль (4,66 г). Тверду речовину розподіляли між діетилетером (150 мл) та насиченим водним натрій гідрогенкарбонатом (150 мл). Органічну фазу відокремлювали та сушили (MgSО4), фільтрували та концентрували у вакуумі, що дало бажану сполуку як жовту олію (1,93 г). 1 -1 H ЯМР (400 МГц, CDCI3) δ млн 2,31-2,52 (m, 6 H) 2,18-2,26 (m, 2 H) 1,92-1,96 (m, 1 H) 1,401,72 (m, 10 H) Інтермедіат 27:1-(Пент-4-ін-1-іл)піперидин Суміш піперидину (11,6 мл, 117 ммол), 5-хлоро-1-пентину (13,8 мл, 129 ммол) та натрій гідроген карбонату (11,84 г, 141 ммол) у ДМФ (100 мл) нагрівали під аргоном при 80 °C протягом 18 годин. Реакційну суміш розбавляти льодяною водою, потім екстрагували етилацетатом. Фази відокремлювали, та органічну фазу промивали водою (100 мл), насиченим розсолом (25 мл), сушили над натрій сульфатом та випаровували у вакуумі, що дало сирий продукт як помаранчеву рідину. Сирий продукт очищали хроматографією на діоксиді силіцію, елюючи 10 % метанолом у ДХМ. Бажану сполуку отримували як червону рідину (5,05 г). 1 -1 H ЯМР (400 МГц, CDCI3) δ млн 2,30-2,50 (m, 6 H) 2,15-2,30 (m, 2 H) 1,90-1,99 (m, 1 H), 1,651,78 (m, 2 H), 1,50-1,63 (m, 4 H) 1,33-1,48 (m, 2 H) Інтермедіат 28: 5-((Бензилокси)метил)-2-бутил-7-(6-(піперидин-1-іл)гекс-1-ин-1-іл)-5Нпіроло[3,2-d]піримідин-4-амін До дегазованого розчину 5-((бензилокси)метил)-2-бутил-7-іодо-5Н-піроло[3,2-d]піримідин-4аміну (217 мг, 0,497 ммол) у безводному N, N-диметилформаміді (3,5 мл) під атмосферою азоту при кімнатній температурі додавали купрум(I) іодид (19 мг, 0,1 ммол), біс(трифенілфосфін)паладій(II)дихлорид (38,4 мг, 0,055 ммол) та зрештою − триетиламін (0,124 мл, 0,895 ммол). Суміш перемішували при кімнатній температурі під атмосферою азоту протягом 10 хвилин та потім додавали розчин 1-(гекс-5-ин-1-іл)піперидину (132 мг, 0,796 ммол) у безводному дегазованому N, N-диметилформаміді (0,5 мл). Реакційну суміш перемішували при 55 °C протягом 40 хвилин. Реакційну суміш випаровували у вакуумі, що дало темну червону олію. Олію розподіляли між водою та дихлорометаном. Органічний шар відокремлювали та водний знов екстрагували дихлорометаном. Комбіновані органічні екстракти пропускали через 23 UA 114645 C2 5 10 15 20 25 30 35 40 45 50 55 гідрофобну фриту та випаровували у вакуумі, що дало темну червону олію. Олію розчиняли в MeOH:ДМСО (1: 1) (5 × 1 мл), очищали MDAP (Спосіб B). Придатні фракції комбінували та випаровували у вакуумі, що дало бажану сполуку як жовту олію (161 мг). + РХМС (Система B): tRET=1,26 хвил; MH 474 Інтермедіат 29: 2-Бутил-7-(6-(піперидин-1-іл)гекс-1-ин-1-іл)-5-((2-(триметилсиліл) етоксил)метил)-5Н-піроло[3,2-d]піримідин-4-амін До дегазованого перемішуваного розчину 2-бутил-7-іодо-5-((2-(триметилсиліл) етоксил)метил)-5Н-піроло[3,2-d]піримідин-4-аміну (400 мг, 0,896 ммол), купрум (I) іодиду (34 мг, 0,179 ммол) та біс(трифенілфосфін)паладій(II)дихлориду (63 мг, 0,090 ммол) у безводному N, Nдиметилформаміді (6 мл) додавали краплями протягом 5 хвилин розчин 1-(гекс-5-ин-1іл)піперидину (193 мг, 1,165 ммол) та триетиламіну (0,186 мл, 1,344 ммол) у безводному N, Nдиметилформаміді (3 мл). Реакційну суміш перемішували при температурі навколишнього середовища під атмосферою азоту протягом 20 годин. Реакційну суміш концентрували у вакуумі та залишок розподіляли між етилацетатом (50 мл) та водою (50 мл). Органічну фазу відокремлювали, та водну знов екстрагували етилацетатом (50 мл). Комбіновані органічні фази промивали розсолом (50 мл), сушили (MgSО 4), фільтрували та концентрували у вакуумі, що дало помаранчеву смолу. Зразок розчиняли в дихлорометані та очищали на діоксиді силіцію (Si), картридж (50 г), застосовуючи градієнт 0-10% метанолу-дихлорометану протягом 40 хвилин. Придатні фракції комбінували та випаровували у вакуумі, що дало бажану сполуку як жовту піну (87 мг). + РХМС (Система A): tRET=0,71 хвил; MH 484 Інтермедіат 30: 2-Бутил-7-(6-(піперидин-1-іл)гексил)-5-((2-(триметилсиліл)етоксил) метил)5Н-піроло[3,2-d]піримідин-4-амін Розчин 2-бутил-7-(6-(піперидин-1-іл)гекс-1-ин-1-іл)-5-((2- (триметилсиліл)етоксил) метил)-5Нпіроло[3,2-d]піримідин-4-аміну (87 мг, 0,180 ммол) в етанолі (8 мл) та оцтовій кислоті (1 мл) гідрогенізували, застосовуючи H-куб (настановні параметри: 60 °C, повний H2, швидкість потоку 1 мл/хвил) та 10 % Pd/C CatCart 30 як каталізатор. Реакційну суміш концентрували у вакуумі, та залишок розподіляли між ДХМ (20 мл) та 2N водним натрій гідроксидом (20 мл). Органічний шар відокремлювали та сушили, застосовуючи гідрофобну фриту перед концентруванням у вакуумі, що дало бажану сполуку (50 мг). + РХМС (Система A): tRET=0,86 хвил; MH 488 Інтермедіат 31: 5-((Бензилокси)метил)-2-бутил-7-(5-(піперидин-1-іл)пент-1-ин-1-іл)-5Нпіроло[3,2-d]піримідин-4-амін До дегазованого розчину 5-((бензилокси)метил)-2-бутил-7-іодо-5Н-піроло[3,2-d]піримідин-4аміну (175 мг, 0,401 ммол) у безводному Ν,Ν-диметилформаміді (3 мл) під атмосферою азоту при кімнатній температурі додавали купрум(I) іодид (15 мг, 0,079 ммол), біс(трифенілфосфін)паладій(II)дихлорид (31 мг, 0,044 ммол) та зрештою − триетиламін (0,1 мл, 0,722 ммол). Суміш перемішували при кімнатній температурі під атмосферою азоту протягом 10 хвилин, та потім додавали розчин 1-(пент-4-ін-1-іл)піперидину (97 мг, 0,642 ммол) у безводному дегазованому N, N-диметилформаміді (0,5 мл). Реакційну суміш перемішували при 55 °C протягом 40 хвилин. Реакційну суміш випаровували у вакуумі, що дало темну жовту олію. Олію розподіляли між водою та дихлорометаном. Органічний шар відокремлювали та водний знов екстрагували дихлорометаном. Комбіновані органічні екстракти пропускали через гідрофобну фриту та випаровували у вакуумі, що дало темну жовту олію. Олію розчиняли в MeOH:ДМСО (1: 1) (4×1 мл) та очищали MDAP (Спосіб B). Придатні фракції комбінували та випаровували у вакуумі, що дало бажану сполуку як бліду жовту тверду речовину (73 мг). + РХМС (Система B): tRET=1,26 хвил; MH 460 Інтермедіат 32: 5-((Бензилокси)метил)-2-бутил-7-(4-(піперидин-1-іл)бут-1-ин-1-іл)-5Нпіроло[3,2-d]піримідин-4-амін Отримували подібно інтермедіату 26 з 5-((бензилокси)метил)-2-бутил-7-іодо-5Н-піроло[3,2d]піримідин-4-амін та 1-(бут-3-ін-1-іл)піперидину (Eur J. Med. Chem. 2009, 44(10), 4098). + РХМС (Система B): tRET=1,11 хвил; MH 446 Інтермедіат 33: 5-((Бензилокси)метил)-2-(етоксиметил)-7-(6-(піперидин-1-іл)гекс-1-ин-1-іл)5Н-піроло[3,2-d]піримідин-4-амін Отримували подібно інтермедіату 26 з 5-((бензилокси)метил)-4-хлоро-7-іодо-2-(2метоксиетил)-5Н-піроло[3,2-d]піримідину та 1-(гекс-5-ин-1-іл)піперидину. + РХМС (Система B): tRET=1,16 хвил; MH 476 24 UA 114645 C2 5 10 15 20 25 30 35 40 45 50 55 Інтермедіат 34: 5-((Бензилокси)метил)-2-(2-метоксиетил)-7-(6-(піперидин-1-іл)гекс-1-ин-1-іл)5Н-піроло[3,2-d]піримідин-4-амін До дегазованого розчину 5-((бензилокси)метил)-7-іодо-2-(2-метоксиетил)-5H-піроло [3,2d]піримідин-4-аміну (264 мг, 0,602 ммол) у безводному N, N-диметилформаміді (7 мл) під атмосферою азоту при кімнатній температурі додавали купрум (I) іодид (22,94 мг, 0,120 ммол), біс(трифенілфосфін)паладій(II)дихлорид (42,3 мг, 0,060 ммол) та зрештою − триетиламін (0,125 мл, 0,904 ммол). Суміш перемішували при кімнатній температурі під атмосферою азоту протягом 10 хвилин, та потім додавали розчин 1-(гекс-5-ин-1-іл)піперидину (129 мг, 0,783 ммол) у безводному дегазованому Ν,Ν-диметилформаміді (1 мл). Реакційну суміш перемішували при кімнатній температурі протягом 16 годин. Додавали 1-(гекс-5-ин-1-іл)піперидин (129 мг, 0,783 ммол), та суміш перемішували при кімнатній температурі протягом 1 години. Реакційну суміш випаровували у вакуумі, що дало коричневу олію. Олію розподіляли між водою (25 мл) та дихлорометаном (25 мл). Органічний шар відокремлювали та водний знов екстрагували дихлорометаном (20 мл). Комбіновані органічні екстракти пропускали через гідрофобну фриту та випаровували у вакуумі, що дало помаранчеву олію. Зразок розчиняли в дихлорометані та очищали хроматографією на діоксиді силіцію (50 г), застосовуючи градієнт 0-100 % етилацетату в циклогексані протягом 60 хвилин. Придатні фракції комбінували та випаровували у вакуумі, що дало бажану сполуку як олію (102 мг). + РХМС (Система B): tRET=1,08 хвил; MH 476 Інтермедіат 35: 5-((Бензилокси)метил)-2-бутил-6-метил-7-(6-(піперидин-1-іл)гекс-1-ин-1-іл)5Н-піроло[3,2d]піримідин-4-амін До дегазованого розчину 5-((бензилокси)метил)-2-бутил-7-іодо-6-метил-5Н-піроло [3,2d]піримідин-4-аміну (215 мг, 0,477 ммол) у безводному N, N-диметилформаміді (4 мл) під атмосферою азоту при кімнатній температурі додавали купрум (I) іодид (19 мг, 0,100 ммол), біс(трифенілфосфін)паладій(II)дихлорид (36,9 мг, 0,053 ммол) та зрештою − триетиламін (0,119 мл, 0,859 ммол). Суміш перемішували при кімнатній температурі під атмосферою азоту протягом 10 хвилин, та потім додавали розчин 1-(гекс-5-ин-1-іл)піперидину (126 мг, 0,764 ммол) у безводному дегазованому N, N-диметилформаміді (2 мл). Реакційну суміш перемішували при 55 °C протягом 1,5 години. Додавали купрум (I) іодид (19 мг, 0,100 ммол), біс(трифенілфосфін)паладій(II)дихлорид (36,9 мг, 0,053 ммол) та 1-(гекс-5-ин-1-іл)піперидин (126 мг, 0,764 ммол), та реакційну суміш залишали перемішуватися при 55 °C протягом 1,5 години. Реакційну суміш випаровували у вакуумі, що дало темну червону олію. Олію розподіляли між водою та дихлорометаном. Органічний шар відокремлювали та водний знов екстрагували дихлорометаном. Комбіновані органічні екстракти пропускали через гідрофобну фриту та випаровували у вакуумі, що дало темну червону олію. Сирий продукт очищали MDAP (Спосіб B). Фракції, які містять продукт, концентрували, що дало бажану сполуку як жовту олію (134 мг). + РХМС (Система B): tRET=1,33 хвил; MH 488 Інтермедіат 36: 5-((Бензилокси)метил)-2-бутил-6-метил-7-(4-(піперидин-1-іл)бут-1-ин -1-іл)5Н-піроло[3,2d]піримідин-4-амін Отримували подібно інтермедіату 28 з 5-((бензилокси)метил)-2-бутил-7-іодо-6-метил-5Нпіроло[3,2-d]піримідин-4-аміну та 1-(бут-3-ін-1-іл)піперидину. + РХМС (Система B): tRET=1,29 хвил; MH 460 Інтермедіат 37: 5-((Бензилокси)метил)-2-бутил-7-(5-хлоропент-1-ин-1-іл)-5Н-піроло [3,2d]піримідин-4-амін До дегазованої суспензії 5-((бензилокси)метил)-2-бутил-7-іодо-5Н-піроло[3,2-d] піримідин-4аміну (2,768 г, 6,34 ммол), купрум (I) іодиду (0,242 г, 1,269 ммол), та біс(трифенілфосфін)паладій(II)дихлориду (0,445 г, 0,634 ммол) у безводному N, Nдиметилформаміді (40 мл) додавали краплями протягом 2 хвилин розчин 5-хлоропент-1-ину (0,781 г, 7,61 ммол) та триетиламіну (1,231 мл, 8,88 ммол) у безводному N, Nдиметилформаміді (20 мл). Реакційну суміш перемішували при температурі навколишнього середовища протягом 17 годин. Реакційну суміш концентрували у вакуумі, та отриману коричневу олію розподіляли між водою (500 мл) та етилацетатом (500 мл). Органічну фазу відокремлювали та водну знов екстрагували етилацетатом (250 мл). Комбіновані органічні фази промивали розсолом (400 мл), сушили (MgSО4), фільтрували та концентрували у вакуумі. Зразок розчиняли в дихлорометані та очищали хроматографією на діоксиді силіцію (Si) (2 × 100 г), застосовуючи градієнт 0-100 % етилацетату-циклогексану протягом 60 хвилин. Придатні фракції комбінували та випаровували у вакуумі, що дало червону олію. Зразок розчиняли в дихлорометані та очищали хроматографією на діоксиді силіцію, застосовуючи градієнт 0-100 % 25 UA 114645 C2 5 10 15 20 25 30 35 40 45 50 55 60 етилацетату-циклогексану протягом 80 хвилин. Придатні фракції комбінували та випаровували у вакуумі, що дало бажану сполуку як жовту тверду речовину. (1,13 г) + РХМС (Система B): tRET=1,29 хвил; MH 411, 413 Інтермедіат 38: 5-((Бензилокси)метил)-2-бутил-7-(5-(піролідин-1-іл)пент-1-ин-1-іл)-5Нпіроло[3,2-d]піримідин-4-амін До перемішуваного розчину 5-((бензилокси)метил)-2-бутил-7-(5-хлоропент-1-ин-1-іл)-5Нпіроло[3,2-d]піримідин-4-аміну (150 мг, 0,365 ммол) та триетиламіну (0,061 мл, 0,438 ммол) у безводному ацетонітрилі (3 мл) при температурі навколишнього середовища додавали піролідин (0,033 мл, 0,402 ммол)в одному завантаженні. Реакційну суміш перемішували при температурі навколишнього середовища протягом 1,5 години, потім − при 60 °C протягом 2,5 години. Нагрівання при 80 °C продовжували протягом 16 год. Потім додавали піролідин (0,033 мл, 0,402 ммол) та триетиламін (0,061 мл, 0,438 ммол) і нагрівання при 80 °C продовжували протягом 10 годин. Реакційну суміш концентрували у вакуумі, та залишок розподіляли між дихлорометаном (10 мл) та водою (10 мл). Органічну фазу відокремлювали та сушили (гідрофобна фрита) перед концентруванням у вакуумі. Зразок розчиняли в дихлорометані та очищали хроматографією на амінопропіл (NH 2) діоксиді силіцію, застосовуючи градієнт 0-100 % етилацетату-дихлорометану протягом 20 хвилин. Придатні фракції комбінували та випаровували у вакуумі, що дало бажану сполуку як не зовсім білу тверду речовину (95 мг). + РХМС (Система B): tRET=1,23 хвил; MH 446 Інтермедіат 39: 6-(4-Аміно-5-((бензилокси)метил)-2-бутил-5Н-піроло[3,2]піримідин-7-іл)гекс5-ин-1-ол До твердої речовини 5-((бензилокси)метил)-2-бутил-7-іодо-5Н-піроло[3,2-d] піримідин-4аміну (1,2 г, 2,75 ммол) в N, N-диметилформаміді (20 мл) додавали біс(трифенілфосфін)паладій(II)дихлорид (0,193 г, 0,275 ммол) та купрум(I) іодид (0,105 г, 0,550 ммол). Розчин перемішували та дегазували азотом протягом 5 хвилин, потім реакційну суміш розміщували під атмосферою азоту. Додавали краплями протягом 5 хвилин розчин гекс-5-ин-1олу (0,405 г, 4,13 ммол) та триетиламіну (0,575 мл, 4,13 ммол) в N, N-диметилформаміді (5 мл). Реакційну суміш перемішували при температурі навколишнього середовища протягом 24 год. Додавали краплями протягом 5 хвилин додаткові гекс-5-ин-1-ол (0,1 г, 1,02 ммол) та триетиламін (0,15 мл, 1,08 ммол) в N, N-диметилформаміді (3 мл), та реакційну суміш перемішували при температурі навколишнього середовища протягом подальших 5 годин. Реакційну суміш концентрували у вакуумі при 60 °C, та залишок розподіляли між етилацетатом (100 мл) та водою (100 мл). Органічний шар відокремлювали, та водний шар екстрагували етилацетатом (3 × 50 мл). Комбіновані органічні фази промивали розсолом, сушили (гідрофобна фрита) та концентрували у вакуумі до в'язкої коричневої олії (2,00 г). Зразок розчиняли в дихлорометані та очищали хроматографією на амінопропіл діоксиді силіцію (110 г), застосовуючи градієнт 0-100 % етилацетату-циклогексану, а потім − градієнт 0-20 % метанолуетилацетату протягом 40 хвилин. Придатні фракції комбінували, випаровували у вакуумі, потім азеотропували діетилетером та сушили, що дало липку не зовсім білу тверду речовину (699 мг). Зразок завантажували в дихлорометані та знов очищали хроматографією на діоксиді силіцію (Si) (50 г), застосовуючи градієнт 0-100 % етилацетату-дихлорометану протягом 40 хвилин. Придатні фракції комбінували та випаровували у вакуумі, що дало бажану сполуку як білу тверду речовину (505 мг). + РХМС (Система B): tRET=1,04 хвил; MH 407 Інтермедіат 40: 6-(4-Аміно-5-((бензилокси)метил)-2-бутил-5Н-піроло[3,2-d]піримідин-7іл)гекс-5-инал Суміш 6-(4-аміно-5-((бензилокси)метил)-2-бутил-5H-піроло[3,2-d]піримідин-7-іл)гекс-5-ин-1олу (505 мг, 1,242 ммол), N-метилморфолін N-оксиду (218 мг, 1,863 ммол), порошкоподібних 4A молекулярних сит та тетрапропіламоній перрутенату (21,83 мг, 0,062 ммол) розміщували під азотом та додавали безводний дихлорометан (18 мл) та безводний ацетонітрил (2 мл). Реакційну суміш перемішували при температурі навколишнього середовища протягом 2 годин. Реакційну суміш концентрували у вакуумі при 60 °C. Залишок розчиняли в дихлорометані, фільтрували через корж целіту та концентрували у вакуумі, що дало темну смолу (678 мг). Зразок розчиняли в дихлорометані та очищали хроматографією на діоксиді силіцію (50 г), застосовуючи градієнт 0-10 % метанолу-дихлорометану протягом 40 хвилин. Придатні фракції комбінували та випаровували у вакуумі, що дало жовту смолу зі знебарвленням темного (399 мг). Зразок розчиняли в дихлорометані та знов очищали на діоксиді силіцію (50 г), застосовуючи градієнт 0-10 % метанолу-дихлорометану протягом 40 хвилин. Придатні фракції комбінували та випаровували у вакуумі, що дало бажану сполуку як жовту смолу (227 мг). + РХМС (Система B): tRET=1,11 хвил; MH 405 26 UA 114645 C2 5 10 15 20 25 30 35 40 45 50 55 60 Інтермедіат 41: 5-((Бензилокси)метил)-2-бутил-7-(6-(піролідин-1-іл)гекс-1-ин-1-іл)-5Н піроло[3,2-d]піримідин-4-амін Суспензію 6-(4-аміно-5-((бензилокси)метил)-2-бутил-5H-піроло[3,2-d]піримідин-7-іл) гекс-5иналу (117 мг, 0,289 ммол) та 4A молекулярних сит у безводному дихлорометані (7 мл) розміщували під азотом та додавали піролідин (0,048 мл, 0,578 ммол). Реакційну суміш перемішували при температурі навколишнього середовища протягом 1 хвилини, потім додавали натрій триацетоксиборогідрид (61,3 мг, 0,289 ммол), та реакційну суміш перемішували протягом подальшої 1 години. Додавали додатковий піролідин (0,025 мл, 0,301 ммол) та натрій триацетоксиборогідрид (80 мг, 0,377 ммол), та реакційну суміш перемішували протягом подальших 30 хвилин Реакційну суміш фільтрували через целіт та корж промивали ДХМ. Розчинник видаляли у вакуумі та залишок знов розчиняли ДХМ (20 мл). Органічний шар промивали насиченим розчином натрій гідроген карбонату (20 мл), шари відокремлювали, та водний шар знов екстрагували ДХМ (20 мл). Комбіновані органічні фази сушили через гідрофобну фриту та концентрували у вакуумі, що дало жовту смолу. Зразок розчиняли в дихлорометані та очищали на амінопропіл діоксиді силіцію (10 г), застосовуючи градієнт 0100 % етилацетату-циклогексану, а потім − 0-20 % метанол протягом 40 хвилин. Придатні фракції комбінували та випаровували у вакуумі, що дало бажану сполуку як білу тверду речовину (55 мг). + РХМС (Система B): tRET=1,17 хвил; MH 460 Інтермедіат 42: 2-Пентил-3Н-піроло[3,2]піримідин-4(5Н)-он Суспензію етил 3-аміно-1H-пірол-2-карбоксилату гідрогенхлориду (3 г, 15,74 ммол), гексаннітрилу (30 г, 309 ммол) та 4M хлоридної кислоти в діоксані (20 мл, 80 ммол) перемішували при 50 °C протягом 20 годин. Реакційній суміші дозволяли охолоджуватися до температури навколишнього середовища, після охолодження створено осад. До реакційної суміші ще додавали 4M хлоридну кислоту в діоксані (10 мл), та реакційну суміш нагрівали при 50 °C протягом подальших 4 годин. Реакційній суміші дозволяли охолоджуватися до температури навколишнього середовища, потім розбавляти TBME (300 мл), та отриману суспензію фільтрували. Твердий корж промивали TBME (150 мл) та діетилетером (150 мл) і сушили у вакуумі, що дало липку бежеву тверду речовину (4,4 г). Тверду речовину розчиняли в етанолі (45 мл) та обробляли розчином натрій гідроксиду (2,52 г, 62,9 ммол) у воді (10 мл), потім суміш нагрівали до 80 °C протягом 4 годин. Розчинник реакційної суміші видаляли у вакуумі. Залишок суспендували у воді (200 мл) та pH регулювали до 4 твердою лимонною кислотою та екстрагували етилацетатом (2×200 мл). Комбіновані органічні екстракти сушили (MgSО 4), фільтрували та концентрували у вакуумі, що дало липку бежеву тверду речовину. Тверду речовину обробляли діетилетером, та отриману суспензію фільтрували та сушили у вакуумі, що дало бажану сполуку як не зовсім білу тверду речовину (1,884 г). + РХМС (Система B): tRET=0,72 хвил; MH 206 Інтермедіат 43: 4-Хлоро-2-пентил-5Н-піроло[3,2d]піримідин Перемішувану суспензію 2-пентил-3Н-піроло[3,2-d]піримідин-4(5H)-ону (1,88 г, 9,16 ммол) у фосфор(V) оксихлориді (20 мл, 215 ммол) нагрівали до 100 °C протягом 3 годин. Реакційну суміш концентрували у вакуумі та азеотропували толуолом. Отриману смолу розчиняли в ДХМ (100 мл) та промивали водою (100 мл) і сушили (гідрофобна фрита) перед концентруванням у вакуумі, що дало коричневу тверду речовину. Зразок розчиняли в дихлорометані та очищали хроматографією на діоксиді силіцію (50 г), застосовуючи градієнт 0-25 % MeOH:TBME протягом 40 хвилин. Придатні фракції комбінували та випаровували у вакуумі, що дало коричневу тверду речовину, це обробляли діетилетером (приблизно, 100 мл), отриману суспензію фільтрували та тверду речовину сушили у вакуумі, що дало бажану сполуку як бліду коричневу тверду речовину (1,04 г). + РХМС (Система B): tRET=0,99 хвил; MH 224, 226 Інтермедіат 44: 4-Хлоро-7-іодо-2-пентил-5Н-піроло[3,2d]піримідин Отримували подібно інтермедіату 15 із 4-хлоро-2-пентил-5Н-піроло[3,2-d]піримідину + РХМС (Система B): tRET=1,21 хвил; MH 350, 352 Інтермедіат 45: 5-((Бензилокси)метил-4-хлоро-7-іодо-2-пентил--5Н-піроло[3,2-d] піримідин До перемішуваної суспензії натрій гідриду 60 мас. %. у мінеральній олії (0,167 г, 4,17 ммол) у безводному ТГФ (15 мл) при 0 °C під атмосферою азоту краплями протягом 10 хвилин, додавали розчин 4-хлоро-7-іодо-2-пентил-5Н-піроло[3,2-d]піримідину (1,268 г, 3,63 ммол) у безводному ТГФ (10 мл). Реакційну суміш перемішували при 0 °C протягом подальших 30 хвилин перед додаванням краплями протягом 10 хвилин розчину ((хлорометокси)метил)бензолу (0,653 г, 4,17 ммол) у безводному ТГФ (10 мл). Потім реакційній суміші дозволяли нагріватися до температури навколишнього середовища та перемішували 27 UA 114645 C2 5 10 15 20 25 30 35 40 45 50 55 60 протягом подальших 60 хвилин. До реакційної суміші потім додавали натрій гідрид 60 мас. %. у мінеральній олії (30 мг, 0,75 ммол) та продовжували перемішування при температурі навколишнього середовища протягом 16 годин. Реакційну суміш розподіляли між водою (120 мл) та етилацетатом (120 мл). Органічну фазу відокремлювали, та водний шар екстрагували етилацетатом (50 мл). Комбіновані органічні екстракти промивали розсолом (100 мл), сушили (MgSО4), фільтрували та концентрували у вакуумі, що дало помаранчеву олію. Зразок розчиняли в дихлоро метані та очищали хроматографією на діоксиді силіцію (100 г), застосовуючи градієнт 0-50 % етилацетату-циклогексану протягом 60 хвилин. Придатні фракції комбінували та випаровували у вакуумі, що дало бажану сполуку як жовту олію (1,478 г). + РХМС (Система B): tRET=1,51 хвил; MH 470, 472 Інтермедіат 46: 5-((Бензилокси)метил)-7-іодо-2-пентил-5-піроло[3,2]піримідин-4-амін Отримували подібно інтермедіату 17 з 5-((бензилокси)метил)-4-хлоро-7-іодо-2-пентил-5Нпіроло[3,2-d]піримідину + РХМС (Система B): tRET=1,26 хвил; MH 451 Інтермедіат 47: 5-((Бензилокси)метил)-2-пентил-7-(6-(піперидин-1-іл)гекс-1-ин-1-іл)-5Нпіроло[3,2-d]піримідин-4-амін Отримували подібно інтермедіату 29 з 5-((бензилокси)метил)-7-іодо-2-пентил-5Н-піроло[3,2d]піримідин-4-аміну та 1-(гекс-5-ин-1-іл)піперидину + РХМС (Система B): tRET=1,30 хвил; MH 488 ' Інтермедіат 48: 7-(5-(Азепан-1-іл )пент-1-ин-1-іл)-5-((бензилокси)метил)-2-бутил-5Нпіроло[3,2-d]піримідин-4-амін Отримували подібно інтермедіату 38 з 5-((бензилокси)метил)-2-бутил-7-(5-хлоропент-1-ин-1іл)-5Н-піроло[3,2-d]піримідин-4-аміну та азепану. + РХМС (Система B): tRET=1,27 хвил; MH 474 Інтермедіат 49: 4-(4-Аміно-5-((бензилокси)метил-2-бутил-6-метил-5Н-піроло[3,2-d]піримідин7-іл)бут-3-ін-1-ол Отримували подібно інтермедіату 39 з 5-((бензилокси)метил)-2-(етоксиметил)-7-іодо-5Нпіроло[3,2-d]піримідин-4-аміну та бут-3-ін-1-олу. + РХМС (Система B): tRET=1,07 хвил; MH 393 Інтермедіат 50: 4-(4-Аміно-5-((бензилокси)метил)-2-бутил-6-метил-5Н-піроло[3,2-d] піримідин-7-іл)бутан-1-ол Фільтрований розчин 4-(4-аміно-5-((бензилокси)метил)-2-бутил-6-метил-5H-піроло[3,2d]піримідин-7-іл)бут-3-ін-1-олу (853 мг, 2,173 ммол) в етанолі (80 мл) гідрогенізували, застосовуючи H-куб (настановні параметри: 20 °C, повний H2, швидкість потоку 1 мл/хвил) та 10 % Pd/C CatCart 30 як каталізатор. Розчин регідрогенізували, застосовуючи H-куб (настановні параметри: 20 °C, повний H2, швидкість потоку 1 мл/хвил) та новий 10 % Pd/C CatCart 30 як каталізатор. Реакційну суміш концентрували у вакуумі, та залишок розчиняли в дихлорометані та очищали хроматографією на діоксиді силіцію (100 г), застосовуючи градієнт 0-25 % метанолу-дихлорометану протягом 60 хвилин. Придатні фракції комбінували та випаровували у вакуумі, що дало бажану сполуку як не зовсім білу тверду речовину (543 мг). + РХМС (Система B): tRET=0,83 хвил; MH 397 Інтермедіат 51: 4-(4-Аміно-5-((бензилокси)метил)-2-бутил-6-метил-5Н-піроло[3,2-d] піримідин-7-іл)бутанол До перемішуваної суспензії 4-(4-аміно-5-((бензилокси)метил)-2-бутил-6-метил-5Н-піроло[3,2d]піримідин-7-іл)бутан-1-олу (230 мг, 0,580 ммол), 4-метилморфолін N-оксиду (82 мг, 0,696 ммол) та порошкоподібних 4A молекулярних сит у суміш безводного дихлорометану (10 мл) та безводного ацетонітрилу (1 мл) при температурі навколишнього середовища додавали тетрапропіламоній перрутенат (22 мг, 0,063 ммол), та реакційну суміш перемішували при температурі навколишнього середовища протягом 2 год. Реакційну суміш концентрували у вакуумі (водяна баня, 20 °C). Отриманий залишок змішували із ДХМ (10 мл) та фільтрували через прокладку целіту. Отриманий розчин концентрували у вакуумі та перерозчиняли в дихлорометані й очищали хроматографією на діоксиді силіцію (20 г), застосовуючи градієнт 010 % метанолу-дихлорометану протягом 40 хвилин. Придатні фракції комбінували та випаровували у вакуумі, що дало бажану сполуку як жовту смолу (114 мг). + РХМС (Система B): tRET=1,13 хвил; MH 395 Інтермедіат 52: 7-(4-(Азепан-1-іл)бутил)-5-((бензилокси)метил)-2-бутил-6-метил-5Нпіроло[3,2-d]піримідин-4-амін Суспензію 4-(4-аміно-5-((бензилокси)метил)-2-бутил-6-метил-5Н-піроло[3,2-d] піримідин-7іл)бутанолу (68 мг, 0,172 ммол) та 4A молекулярні сита в безводному дихлорометані (5 мл) розміщували під азотом та додавали азепан (0,039 мл, 0,345 ммол). Реакційну суміш 28
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel compounds
Автори англійськоюCoe, Diane Mary, Smith, Stephen Allan
Автори російськоюКоу Даян Мэри, Смит Стивэн Эллан
МПК / Мітки
МПК: A61K 31/519
Мітки: людини, піролопіримідини, індуктори, інтерферону
Код посилання
<a href="https://ua.patents.su/50-114645-pirolopirimidini-yak-induktori-interferonu-lyudini.html" target="_blank" rel="follow" title="База патентів України">Піролопіримідини як індуктори інтерферону людини</a>
Попередній патент: Похідні 1,2,4-триазину для лікування вірусних інфекцій
Наступний патент: Зручна у використанні вапняно-магнезіальна суспензія
Випадковий патент: Будівельна суміш дрібнозернистого великопористого бетону для тротуарної плитки і подібних виробів






















































