Похідне хінолону та фармацевтична композиція
Номер патенту: 98789
Опубліковано: 25.06.2012
Автори: Накаі Масамі, Оті Юдзі, Оцубо Кендзі, Морі Ацусі
Формула / Реферат
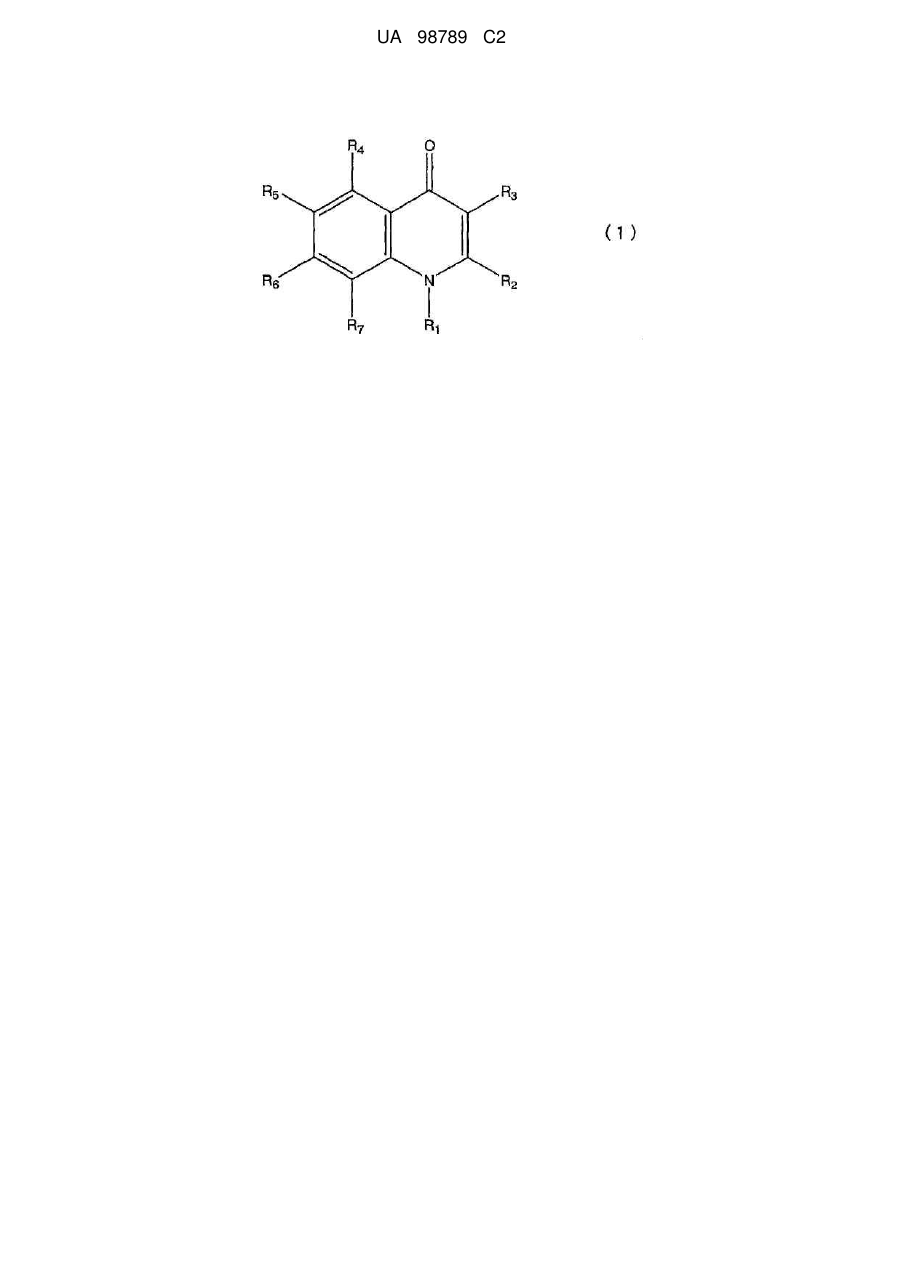
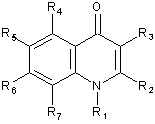
1. Похідне хінолону, представлене загальною формулою (1)
 ,
,
або його сіль,
у якій R1 представляє атом водню, нижчу алкільну групу, цикло-С3-8-алкілнижчу алкільну групу або нижчу алкоксинижчу алкільну групу;
R2 представляє атом водню, нижчу алкільну групу або галогензаміщену нижчу алкільну групу;
R3 представляє фенільну групу, фурильну групу, тієнільну групу або піридильну групу, при цьому кожна із цих груп необов'язково заміщена однією або більше групами, вибраними із групи, що складається з наступних з (1) по (16) в ароматичному або гетероциклічному кільці, представленому вищевказаним R3:
(1) нижчі алкільні групи,
(2) нижчі алкоксигрупи,
(3) галогензаміщені нижчі алкоксигрупи;
(4) феноксигрупа,
(5) нижчі алкілтіогрупи,
(6) гідроксигрупа,
(7) гідроксинижчі алкільні групи,
(8) атоми галогену,
(9) нижчі алканоїльні групи,
(10) нижчі алкоксикарбонільні групи,
(11) аміногрупи, необов'язково заміщені однією або більше нижчими алкільними групами,
(12) карбамоїльні групи, необов'язково заміщені однією або більше нижчими алкільними групами,
(13) цикло-С3-8-алкілнижчі алкоксигрупи,
(14) піролідинілкарбонільні групи,
(15) морфолінілкарбонільні групи, й
(16) карбоксильна група;
R4 представляє атом галогену;
R5 представляє атом водню або атом галогену;
R6 представляє атом водню; і
R7 представляє будь-яку з наведених нижче груп з (1) по (15):
(1) гідроксигрупа,
(2) атом галогену,
(3) нижча алкоксигрупа,
(4) галогензаміщена нижча алкоксигрупа,
(5) гідроксинижча алкоксигрупа,
(6) нижча алкоксинижча алкоксигрупа,
(7) аміногрупа, необов'язково заміщена одним або більше членами, вибраними із групи, що складається з нижчих алкільних груп, нижчих алкоксинижчих алкільних груп і цикло-С3-8-алкільних груп,
(8) аміно нижча алкоксигрупа, необов'язково заміщена по аміногрупі одним або більше членами, вибраними із групи, що складається з нижчих алкільних груп, нижчих алканоїльних груп, нижчих алкілсульфонільних груп і карбамоїльних груп, необов'язково заміщених однією або більше нижчими алкільними групами,
(9) цикло-С3-8-алкоксигрупа,
(10) цикло-С3-8-алкілнижча алкоксигрупа,
(11) тетрагідрофурилнижча алкоксигрупа,
(12) нижча алкілтіогрупа,
(13) гетероциклічна група, вибрана із групи, що складається з морфолінільних груп, піролідинільних груп, фурильних груп, тієнільних груп і бензотієнільних груп,
(14) феніл нижча алкоксинижча алкоксигрупа, й
(15) піролідинілкарбонільна група.
2. Похідне хінолону загальної формули (1) або його сіль за п. 1, де R1 представляє атом водню або нижчу алкільну групу;
R2 представляє атом водню або нижчу алкільну групу;
R3 представляє фенільну групу або піридильну групу, при цьому кожна із цих груп необов'язково заміщена однією або двома групами, вибраними із групи, що складається з наступних з (1), (2), (6) і (8) в ароматичному або гетероциклічному кільці, представленому вищевказаним R3:
(1) нижчі алкільні групи,
(2) нижчі алкоксигрупи,
(6) гідроксигрупа, і
(8) атоми галогену;
R4 представляє атом галогену;
R5 представляє атом водню;
R6 представляє атом водню; і
R7 представляє будь-яку з наведених нижче груп (3), (4) і (7):
(3) нижча алкоксигрупа,
(4) галогензаміщена нижча алкоксигрупа, і
(7) аміногрупа, необов'язково заміщена однією або двома нижчими алкільними групами.
3. Похідне хінолону загальної формули (1) або його сіль за п. 2, вибране із групи, що складається з:
5-фтор-3-(4-метоксифеніл)-2-метил-8-пропокси-1Н-хінолін-4-он,
5-фтор-3-(4-метоксифеніл)-1-метил-8-пропокси-1Н-хінолін-4-он,
3-(2,4-диметоксифеніл)-5-фтор-8-пропокси-1H-хінолін-4-он,
5-фтор-8-ізопропокси-3-(4-метоксифеніл)-1Н-хінолін-4-он,
3-(2,4-дихлорфеніл)-5-фтор-8-пропокси-1Н-хінолін-4-он,
8-етокси-5-фтор-3-(4-метоксифеніл)-1Н-хінолін-4-он,
5-фтор-3-(4-метокси-2-метилфеніл)-8-пропокси-1Н-хінолін-4-он,
5-фтор-3-(4-метоксифеніл)-8-пропокси-1Н-хінолін-4-он,
5-фтор-3-(2-фтор-4-метоксифеніл)-8-пропокси-1Н-хінолін-4-он,
5-фтор-3-(4-гідроксифеніл)-8-пропокси-1Н-хінолін-4-он,
8-циклопропілметокси-5-фтор-3-(4-метоксифеніл)-1Н-хінолін-4-он,
5-фтор-8-пропокси-3-піридин-4-іл-1Н-хінолін-4-он,
5-фтор-3-(4-метоксифеніл)-8-(N-метил-N-пропіламіно)-1Н-хінолін-4-он, і
5-фтор-3-(4-метоксифеніл)-8-(4,4,4-трифторбутокси)-1Н-хінолін-4-он.
4. Фармацевтична композиція, що містить похідне хінолону загальної формули (1) або його сіль за п. 1 як активний інгредієнт і фармацевтично прийнятний носій.
5. Профілактичний й/або терапевтичний засіб для нейродегенеративних захворювань, захворювань, викликаних неврологічною дисфункцією, або захворювань, викликаних погіршенням функції мітохондрії, що містить як активний інгредієнт похідне хінолону загальної формули (1) або його сіль за п. 1.
6. Профілактичний й/або терапевтичний засіб за п. 5, де нейродегенеративне захворювання вибирають із групи, що складається із хвороби Паркінсона, синдрому Паркінсона, юнацького паркінсонізму, стріатонігральної дегенерації, прогресуючого супрануклеарного паралічу, справжньої акінезії, хвороби Альцгеймера, хвороби Піка, пріонної хвороби, кортикобазальної дегенерації, хвороби дифузійних тілець Леві, хвороби Хантінгтона, хореї-акантоцитозу, доброякісної спадкової хореї, пароксизмального хореоатетозу, есенціального тремору, есенціального міоклонусу, синдрому Туретта, синдрому Ретта, дегенеративного тремтіння, лордотичної дисбазії, атетозу, спастичної кривошиї, синдрому Мейжа, церебрального паралічу, хвороби Вільсона, синдрому Сегаві, синдрому Халлервордена-Шпатца, нейроаксональної дистрофії, палідумальної атрофії, спіноцеребелярної дегенерації сітківки, атрофії кори головного мозку, церебелярної атрофії Холмса, олівопонтоцеребелярної атрофії, спадкової олівопонтоцеребелярної атрофії, хвороби Джозефа, дентаторубропалідолюїсової атрофії, хвороби Герстманна-Штраусслера-Шейнкера, атаксії Фрідрейха, синдрому Руссі-Леві, синдрому Мея-Уайта, уродженої церебелярної атаксії, спадкової епізодичної атаксії, атаксії-телеангієктазії, бічного аміотрофічного склерозу, прогресуючого бульбарного паралічу, спінальної прогресуючої м'язової атрофії, спінобульбарної м'язової атрофії, хвороби Вердніга-Хоффмана, хвороби Кугельберга-Веландер, спадкового спастичного парапарезу, сирингомієлії, сирингобульбії, синдрому Арнольда-Кіарі, синдрому м'язової скутості, синдрому Кліппель-Фейля, синдрому Фаціо-Лонде, нижчої мієлопатії, синдрому Денді-Уолкера, розщеплення хребта, синдрому Сегрена-Ларссона, радіаційної мієлопатії, вікової дегенерації жовтої плями й апоплексії мозку, вибраної із групи, що складається з ішемічного інсульту й крововиливу в мозок.
7. Профілактичний й/або терапевтичний засіб за п. 5, де захворювання, викликане неврологічною дисфункцією, вибирають із групи, що складається із травми спинного мозку, викликаної хіміотерапією невропатії, діабетичної невропатії, радіаційного ураження й демієлінізуючих захворювань, вибраних із групи, що складається з розсіяного склерозу, гострого дисемінованого енцефаломієліту, поперечного мієліту, прогресуючої багатофокальної лейкоенцефалопатії, підгострого склерозуючого паненцефаліту, хронічної запальної демієлінізуючої поліневропатії й синдрому Гіллена-Барре.
8. Профілактичний й/або терапевтичний засіб за п. 5, де захворювання, викликане погіршенням функції мітохондрії, вибирають із групи, що складається із синдрому Пірсона, діабету, глухоти, мігрені злоякісного перебігу, хвороби Лебера, MELAS, MERRF, синдрому перехлесту MERRF/MELAS, NARP, справжньої міопатії, мітохондріальної кардіоміопатії, міопатії, слабоумства, шлунково-кишкової атаксії, сидеробластної набутої анемії, викликаної аміноглікозидами втрати слуху, недостатності комплексу III внаслідок спадкових варіантів цитохрому b, множинного симетричного ліпоматозу, атаксії, міоклонусу, ретинопатії, MNGIE, хвороби ANT1, хвороби Твінкла, хвороби POLG, рецидивуючої міоглобінурії, SANDO, ARCO, недостатності комплексу І, недостатності комплексу II, атрофії зорового нерва, фатальної дитячої недостатності комплексу IV, недостатності мітохондріальної ДНК, синдрому недостатності мітохондріальної ДНК, енцефаломієлопатії Лі, синдрому хронічної прогресуючої зовнішньої офтальмоплегії (СРЕО), синдрому Керна-Сайра, енцефалопатії, лактацидемії, міоглобінурії, викликаних лікарськими препаратами мітохондріальних захворювань, шизофренії, великого депресивного розладу, І біполярного розладу, II біполярного розладу, змішаного нападу, дистимічних розладів, атипічної депресії, сезонних афективних розладів, післяпологової депресії, малої депресії, рецидивуючого короткого депресивного розладу, стійкої депресії/хронічної депресії, подвійної депресії й гострої ниркової недостатності.
9. Застосування похідного хінолону загальної формули (1) або його солі за п. 1 як лікарського засобу.
10. Спосіб лікування або попередження нейродегенеративних захворювань, захворювань, викликаних неврологічною дисфункцією, або захворювань, викликаних погіршенням функції мітохондрії, що включає введення людині або тварині похідного хінолону загальної формули (1) або його солі за п. 1.
11. Спосіб одержання похідного хінолону загальної формули (1)
 (1)
(1)
або його солі, у якій кожний з R1, R2, R3, R4, R5, R6 і R7 визначений вище в п. 1,
в якому здійснюють взаємодію сполуки, представленої загальною формулою (4)
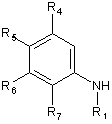 , (4)
, (4)
у якій кожний з R1, R4, R5, R6 і R7 визначений вище в п. 1,
зі сполукою, представленою загальною формулою (5)
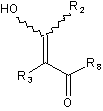 , (5)
, (5)
у якій кожний з R2 і R3 визначений вище в п. 1, і R8 представляє нижчу алкоксигрупу, з одержанням при цьому проміжної сполуки, представленої загальною формулою (6)
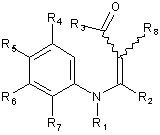 , (6)
, (6)
у якій кожний з R1, R2, R3, R4, R5, R6, R7 і R8 визначений вище;
і піддання одержаної сполуки реакції циклізації.
Текст
Реферат: Даний винахід стосується похідного хінолону, представленого загальною формулою (1), або його солі, у яких R1 представляє атом водню й так далі; R2 представляє атом водню й так далі; R3 представляє фенільну групу, необов'язково заміщену одним або більше замісниками, і так далі; R4 представляє атом галогену; R5 представляє атом водню або атом галогену; R6 представляє атом водню; і R7 представляє гідроксильну групу й так далі. Дане похідне хінолону має функціональний поліпшуючий ефект, що заглушує прогресування неврологічної дисфункції за рахунок інгібування хронічного прогресування хвороби Паркінсона або захисту дофамінових нейронів від хвороби даної етіології, збільшуючи, таким чином, тривалість проміжку часу до початку першого введення. UA 98789 C2 (12) UA 98789 C2 UA 98789 C2 5 10 15 20 25 30 35 40 45 50 Даний винахід стосується похідного хінолону й фармацевтичної композиції. Хвороба Паркінсона являє собою хронічне, прогресуюче нейродегенеративне захворювання, що звичайно розвивається після середнього віку. Первинні симптоми включають однобічний тремор у стані спокою, акінезію й ригідність. Тремор, акінезію й ригідність називають трьома основними ознаками хвороби Паркінсона, і причиною кожної з них є селективна загибель дофамінергічних нейронів, що проектують із чорної субстанції в страітум. Етіологія даної хвороби дотепер невідома, однак, зібрані дані дозволяють припустити, що нейродегенеративний розлад запускається ослабленою енергогенеруючою системою вкупі з аномальною мітохондріальною функцією нігростріарних дофамінергічних нейронів. Передбачається, що мітохондріальна дисфункція згодом викликає окисний стрес і недостатність кальцієвого гомеостазу, приводячи, таким чином, до нейродегенерації (Ann. N. Y. Acad. Sci. 991:111-119 (2003)). Способи лікування хвороби Паркінсона приблизно підрозділяють на лікувальну тактику (лікарська терапія) і хірургічну тактику (стереотаксична операція). З їх числа лікарська терапія є сталою терапією й вважається основним видом лікування. У лікарській терапії для компенсування нігростріарної дофамінергічної нейрональної функції, зміненою хворобою Паркінсона, використовується симптоматичний терапевтичний агент. Найбільш чудові терапевтичні властивості проявляє леводопа. Говорять, що жоден агент не перевершує леводопу по ефективності. У цей час леводопа використовується разом з інгібітором дофадекарбоксилази для запобігання її метаболізму на периферії, і були одержані бажані клінічні ефекти. Однак одним з недоліків лікування леводопою є те, що після декількох років лікування зниження тривалості й стабільності ефективності даного лікарського засобу приводить до рецидиву рухових порушень, таких як дискінезія й добові флуктуації. Крім того, причиною занепокоєння були побічні ефекти з боку травної системи, такі як нудота й блювання, викликані надлишковим вивільненням дофаміну, проблеми із кровопостачанням органів, такі як ортостатична гіпотензія, тахікардія й аритмія, і неврологічні прояви, такі як галюцинації, марення й відволікуваність. Таким чином, з метою зниження дозувань препарату леводопа й, за рахунок цього, зменшення його побічної дії, застосовують комбіновану лікарську терапію, у якій використовується сполучення агоністів дофамінових рецепторів, інгібіторів ферменту метаболізму дофаміну, релізеру дофаміну, антихолінергічних агентів центральної дії й так далі. Подібні терапевтичні досягнення разюче поліпшують прогнози, однак, навіть у цей час відсутні фундаментальні способи лікування хвороби Паркінсона й інших нейродегенеративних захворювань. Лікарські препарати необхідно приймати протягом всього життя, що залишилося, пацієнта, а згадані вище недоліки - знижена ефективність протягом довгострокового введення, побічні дії й неконтрольоване прогресування хвороби - можуть відбуватися через монотерапії леводопою. Крім того, навіть при використанні комбінованої лікарської терапії важко очікувати вражаючих результатів. Ціль даного винаходу полягає в наданні нової сполуки, що має функціональний поліпшуючий ефект і придушує неврологічну дисфункцію за рахунок інгібування хронічного прогресування хвороби Паркінсона або захисту дофамінових нейронів від хвороби цієї етіології, збільшуючи, таким чином, тривалість проміжку часу перед початком першого введення леводопи. Авторами даного винаходу було проведено ретельне дослідження для досягнення вищезгаданої мети й, у результаті, їм удалося одержати сполуку, представлену наступною загальною формулою (1), що включає захист і поліпшення мітохондріальної функціональної активності, і захист і відмовлення активності нейронів. Даний винахід був завершений на підставі згаданих вище одержаних даних. У даному винаході надане похідне хінолону, фармацевтична композиція, що містить зазначену сполуку, використання зазначеної сполуки, спосіб лікування або попередження розладу, і спосіб одержання зазначеної сполуки, описані в наведені нижче пунктах з 1 по 11. Пункт 1. Похідне хінолону, представлене загальною формулою (1) 1 UA 98789 C2 5 10 15 20 25 30 35 40 45 або його сіль, у якій R1 представляє атом водню, нижчу алкільну групу, цикло-С3-8-алкілнижчу алкільну групу або нижчу алкоксинижчу алкільну групу; R2 представляє атом водню, нижчу алкільну групу або галогензаміщену нижчу алкільну групу; R3 представляє фенільну групу, фурильну групу, тієнільну групу або піридильну групу, при цьому кожна із цих груп необов'язково заміщена однією або більше групами, вибраними із групи, що складається з наступних з (1) по (16) в ароматичному або гетероциклічному кільці, представленому вищевказаним R3; (1) нижчі алкільні групи, (2) нижчі алкоксигрупи, (3) галогензаміщені нижчі алкоксигрупи; (4) феноксигрупа, (5) нижчі алкілтіогрупи, (6) гідроксигрупа, (7) гідроксинижчі алкільні групи, (8) атоми галогену, (9) нижчі алканоїльні групи, (10) нижчі алкоксикарбонільні групи, (11) аміногрупи, необов'язково заміщені однією або більше нижчими алкільними групами, (12) карбамоїльні групи, необов'язково заміщені однією або більше нижчими алкільними групами, (13) цикл о С3-8 алкілнижчі алкоксигрупи, (14) піролідинілкарбонільні групи, (15) морфолінілкарбонільні групи й (16) карбоксильна група; R4 представляє атом галогену; R5 представляє атом водню або атом галогену; R6 представляє атом водню; і R7 представляє будь-яку з наведених нижче груп з (1) по (15): (1) гідроксигрупа, (2) атом галогену, (3) нижча алкоксигрупа, (4) галогензаміщена нижча алкоксигрупа, (5) гідроксинижча алкоксигрупа, (6) нижча алкоксинижча алкоксигрупа, (7) аміногрупа, необов'язково заміщена одним або більше членами, вибраними із групи, що складається з нижчих алкільних груп, нижчих алкоксинижчих алкільних груп і цикло С 3-8 алкільних груп, (8) аміно нижча алкоксигрупа, необов'язково заміщена по аміногрупі одним або більше членами, вибраними із групи, що складається з нижчих алкільних груп, нижчих алканоїльних груп, нижчих алкілсульфонільних груп і карбамоїльних груп, необов'язково заміщених однією або більше нижчими алкільними групами, (9) цикло С3-8 алкоксигрупа, (10) цикло С3-8 алкілнижча алкоксигрупа, (11) тетрагідрофурилнижча алкоксигрупа, 2 UA 98789 C2 5 10 15 20 25 30 35 40 45 50 55 60 (12) нижча алкілтіогрупа, (13) гетероциклічна група, обрана із групи, що складає з морфолінільних груп, піролідинільних груп, фурильних груп, тієнільних груп і бензотієнільних груп, (14) феніл нижча алкоксинижча алкоксигрупа й (15) піролідинілкарбонільна група. Пункт 2. Похідне хінолону загальної формули (1) або його сіль за п. 1, у якому R1 представляє атом водню або нижчу алкільну групу; R2 представляє атом водню або нижчу алкільну групу; R3 представляє фенільну групу або піридильну групу, при цьому кожна з даних груп необов'язково заміщена однією або двома групами, вибраними із групи, що складається з наступних з (1), (2), (6) і (8) в ароматичному або гетероциклічному кільці, представленому вищевказаним R3: (1) нижчі алкільні групи, (2) нижчі алкоксигрупи, (6) гідроксигрупа, і (8) атоми галогену, R4 представляє атом галогену; R5 представляє атом водню; R6 представляє атом водню; і R7 представляє будь-яку з наведених нижче груп (3), (4) і (7): (3) нижча алкоксигрупа, (4) галогензаміщена нижча алкоксигрупа, і (7) аміногрупа, необов'язково заміщена однією або двома нижчими алкільними групами. Пункт 3. Похідне хінолону загальної формули (1) або його сіль за п. 2, вибране із групи, що складається з: 5-фтор-3-(4-метоксифеніл)-2-метил-8-пропокси-1Н-хінолін-4-он, 5-фтор-3-(4-метоксифеніл)-1-метил-8-пропокси-1Н-хінолін-4-он, 3-(2,4-диметоксифеніл)-5-фтор-8-пропокси-1Н-хінолін-4-он, 5-фтор-8-ізопропокси-3-(4-метоксифеніл)-1Н-хінолін-4-он, 3-(2,4-дихлорфеніл)-5-фтор-8-пропокси-1Н-хінолін-4-он, 8-етокси-5-фтор-3-(4-метоксифеніл)-1Н-хінолін-4-он, 5-фтор-3-(4-метокси-2-метилфеніл)-8-пропокси-1H-хінолін-4-он, 5-фтор-3-(4-метоксифеніл)-8-пропокси-1Н-хінолін-4-он, 5-фтор-3-(2-фтор-4-метоксифеніл)-8-пропокси-1H-хінолін-4-он, 5-фтор-3-(4-гідроксифеніл)-8-пропокси-1H-хінолін-4-он, 8-циклопропілметокси-5-фтор-3-(4-метоксифеніл)-1Н-хінолін-4-он, 5-фтор-8-пропокси-3-піридин-4-іл-1Н-хінолін-4-он, 5-фтор-3-(4-метоксифеніл)-8-(N-метил-N-пропіламіно)-1Н-хінолін-4-он і 5-фтор-3-(4-метоксифеніл)-8-(4,4,4-трифторбутокси)-1Н-хінолін-4-он. Пункт 4. Фармацевтична композиція, що включає похідне хінолону загальної формули (1) або його сіль за п. 1, як активний інгредієнт, і фармацевтично прийнятний носій. Пункт 5. Профілактичний й/або терапевтичний засіб для нейродегенеративних захворювань, захворювань, викликаних неврологічної дисфункцією, або захворювань, викликаних погіршенням функції мітохондрії, що включає як активний інгредієнт похідне хінолону загальної формули (1) або його сіль за п. 1. Пункт 6. Профілактичний й/або терапевтичний засіб за п. 5, де нейродегенеративне захворювання вибирають із групи, що складається із хвороби Паркінсона, синдрому Паркінсона, юнацького паркінсонізму, стріатонігральної дегенерації, прогресуючого супрануклеарного паралічу, справжньої акінезії, хвороби Альцгеймера, хвороби Піка, пріонної хвороби, кортикобазальної дегенерації, хвороби дифузійних тілець Леві, хвороби Хантінгтона, хореїакантоцитозу, доброякісної спадкової хореї, пароксизмального хореоатетозу, есенціального тремору, есенціального міоклонусу, синдрому Туретта, синдрому Ретта, дегенеративного тремтіння, лордотичної дисбазії, атетозу, спастичної кривошиї, синдрому Мейжа, церебрального паралічу, хвороби Вільсона, синдрому Сегаві, синдрому Халервордена-Шпатца, нейроаксональної дистрофії, палідумальної атрофії, спіноцеребелярної дегенерації сітківки, атрофії кори головного мозку, церебелярної атрофії Холмса, олівопонтоцеребелярної атрофії, спадкової олівопонтоцеребелярної атрофії, хвороби Джозефа, дентаторубро-палідолюїсової атрофії, хвороби Герстмана-Штраусслера-Шейнкера, атаксії Фридрейха, синдрому Руссі-Леві, синдрому Мея-Уайта, уродженої церебелярної атаксії, спадкової епізодичної атаксії, атаксіїтелеангіектазії, бічного аміотрофічного склерозу, прогресуючого бульбарного паралічу, спінальної прогресуючої м'язової атрофії, спінобульбарної м'язової атрофії, хвороби Вердніга 3 UA 98789 C2 5 10 15 20 25 30 35 Хоффмана, хвороби Кугельберга-Веландер, спадкового спастичного парапарезу, сирингомієлії, сирингобульбії, синдрому Арнольда-Кіарі, синдрому м'язової скутості, синдрому КліппельФейля, синдрому Фаціо-Лонде, нижчої мієлопатії, синдрому Денді-Уолкера, розщеплення хребта, синдрому С'єгрена-Ларссона, радіаційної мієлопатії, вікової дегенерації жовтої плями й апоплексії мозку, вибраної із групи, що складається з ішемічного інсульту й крововиливу в мозок. Пункт 7. Профілактичний й/або терапевтичний засіб за п. 5, де захворювання, викликане неврологічною дисфункцією, вибирають із групи, що складається із травми спинного мозку, викликаної хіміотерапією невропатії, діабетичної невропатії, радіаційного ураження й демієлінізуючих захворювань, вибраних із групи, що складається з розсіяного склерозу, гострого диссемінованого енцефаломієліту, поперечного мієліту, прогресуючої багатофокальної лейкоенцефалопатії, підгострого склерозуючого паненцефаліту, хронічної запальної демієлінізуючої поліневропатії й синдрому Гілена-Барре. Пункт 8. Профілактичний й/або терапевтичний засіб за п. 5, де захворювання, викликане погіршенням функції мітохондрії, вибирають із групи, що складається із синдрому Пірсона, діабету, глухоти, мігрені злоякісного перебігу, хвороби Лебера, MELAS, MERRF, синдрому перехлесту MERRF/MELAS, NARP, справжньої міопатії, мітохондріальної кардіоміопатії, міопатії, слабоумства, шлунково-кишкової атаксії, сидеробластної набутої анемії, викликаної аміноглікозидами втрати слуху, недостатності комплексу III внаслідок спадкових варіантів цитохрому b, множинного симетричного ліпоматозу, атаксії, міоклонусу, ретинопатії, MNGIE, хвороби ANT1, хвороби Твінкла, хвороби POLG, рецидивуючої міоглобінурії, SANDO, ARCO, недостатності комплексу І, недостатності комплексу II, атрофії зорового нерва, фатальної дитячої недостатності комплексу IV, недостатності мітохондріальної ДНК, синдрому недостатності мітохондріальної ДНК, енцефаломієлопатії, синдрому хронічної прогресуючої зовнішньої офтальмоплегії (СРЕО), синдрому Керна-Сайра, енцефалопатії, лактацидемії, міоглобінурії, викликаних лікарськими препаратами мітохондріальних захворювань, шизофренії, великого депресивного розладу, І біполярного розладу, II біполярного розладу, змішаного нападу, дистимічних розладів, атипічної депресії, сезонних афективних розладів, післяпологової депресії, малої депресії, рецидивуючого короткого депресивного розладу, стійкої депресії/хронічної депресії, подвійній депресії й гострої ниркової недостатності. Пункт 9. Застосування похідного хінолону загальної формули (1) або його солі за п. 1 як лікарського засобу. Пункт 10. Спосіб лікування або попередження нейродегенеративних захворювань, захворювань, викликаних неврологічною дисфункцією, або захворювань, викликаних погіршенням функції мітохондрії, що включає введення людині або тварині похідного хінолону загальної формули (1) або його солі за п. 1. Пункт 11. Спосіб одержання похідного хінолону загальної формули (1) 40 або його солі, у якій кожний з R1, R2, R3, R4, R5, R6 і R7 визначений вище в п.1, що включає взаємодію сполуки, представленої загальною формулою (4) 4 UA 98789 C2 у якій кожний з R1, R4, R5, R6 і R7 визначений вище в п.1, зі сполукою, представленою загальною формулою (5) 5 у якій кожний з R2 і R3 визначений вище в п.1, і R8 представляє нижчу алкоксигрупу, з одержанням при цьому проміжної сполуки, представленої загальною формулою (6) 10 15 20 25 30 35 у якій кожний з R1, R2, R3, R4, R5, R6, R7 і R8 визначений вище; і піддаючи одержану сполуку реакції циклізації. Конкретні приклади груп у загальній формулі (1) є наступними. Приклади нижчих алкільних груп включають лінійні або розгалужені С 1-6 (переважно С1-4) алкільні групи, такі як метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, трет-бутил, вторбутил, н-пентил, 1-етилпропіл, ізопентил, неопентил, н-гексил, 1,2, 2-триметилпропіл, 3,3диметилбутил, 2-етилбутил, ізогексил, 3-метилпентил і так далі. Приклади С3-8 циклоалкільних груп включають циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил і так далі. Приклади цикло-С3-8-алкілнижчих алкільних груп включають нижчі алкільні групи, заміщені однією-трьома (переважно, однією) описаною вище цикло-С3-8-алкільною групою(групами). Приклади нижчих алкоксигруп включають лінійні або розгалужені С1-6 (переважно С1-4) алкоксигрупи, такі як метокси, етокси, н-пропокси, ізопропокси, н-бутокси, ізобутокси, третбутокси, вторбутокси, н-пентокси, ізопентокси, неопентокси, н-гексилокси, ізогексилокси, 3метилпентокси й так далі. Приклади нижчих алкоксинижчих алкільних груп включають нижчі алкільні групи, заміщені однією-трьома (переважно, однією) описаною вище нижчою алкоксигрупою(групами). Приклади атомів галогену включають фтор, хлор, бром і йод. Приклади галогензаміщених нижчих алкільних груп включають нижчі алкільні групи, заміщені одним-сімома атомом(атомами) галогену, переважно одним-трьома атомом(атомами) галогену. Їх приклади включають фторметил, дифторметил, трифторметил, хлорметил, дихлорметил, трихлорметил, бромметил, дибромметил, дихлорфторметил, 2,2-дифторетил, 2,2,2-трифторетил, пентафторетил, 2-фторетил, 2-хлоретил, 3,3,3-трифторпропіл, гептафторпропіл, 2,2,3,3,3-пентафторпропіл, гептафторізопропіл, 3-хлорпропіл, 2-хлорпропіл, 3 5 UA 98789 C2 5 10 15 20 25 30 35 40 45 50 55 60 трибромпропіл, 4,4,4-трифторбутил, 4,4,4,3,3,4,4-бромбутил, 2-хлорбутил, 5,5,5-трифторпентил, 5-хлорпентил, 6,6,6-трифторгексил, 6-хлоргексил, перфторгексил і так далі. Приклади галогензаміщених нижчих алкоксигруп включають нижчі алкоксигрупи, заміщені одним-сімома атомом(атомами) галогену, переважно одним-трьома атомом(атомами) галогену. Їх приклади включають фторметокси, дифторметокси, трифторметокси, хлорметокси, дихлорметокси, трихлорметокси, бромметокси, дибромметокси, дихлорфторметокси, 2,2,2трифторетокси, пентафторетокси, 2-хлоретокси, 3,3,3-трифторпропокси, гептафторпропокси, гептафторізопропокси, 3-хлорпропокси, 2-хлорпропокси, 3-бромпропокси, 4,4,4-трифторбутокси, 4,4,4,3,3-пентафторбутокси, 4-хлорбутокси, 4-бромбутокси, 2,5,5,5,5,6,6,6-трифторгексилокси, 6-хлоргексилокси й так далі. Приклади нижчих алкілтіогруп включають алкілтіогрупи, у яких алкільний фрагмент представляє згадану вище нижчу алкільну групу. Приклади гідроксинижчих алкільних груп включають згадані вище нижчі алкільні групи, заміщені однією-трьома (переважно однією) гідроксильною групою(групами). Приклади нижчих алканоїльних груп включають лінійні або розгалужені С 1-6, (переважно С1-4) алканоїльні групи, такі як форміл, ацетил, пропіоніл, бутирил, ізобутирил, пентаноїл, третбутилкарбоніл, гексаноїл і так далі. Приклади нижчих алкоксикарбонільних груп включають алкоксикарбонільні групи, у яких алкоксильний фрагмент представляє згадану вище нижчу алкоксигрупу. Приклади аміногруп, необов'язково заміщених однією або більше нижчими алкільними групами, включають аміногрупи, необов'язково заміщені однією або двома нижчою алкільною групою(групами), описаними вище. Приклади карбамоїльних груп, необов'язково заміщених однією або більше нижчими алкільними групами, включають карбамоїльні групи, необов'язково заміщені однією або двома нижчою алкільною групою(групами), описаними вище. Приклади цикло-С3-8-алкілнижчих алкільних груп включають згадані вище нижчі алкільні групи, заміщені однією-трьома (переважно однією) цикло-С3-8-алкільною групою(групами), описаними вище. Приклади гідроксинижчих алкоксигруп включають згадані вище нижчі алкоксигрупи, заміщені однією-трьома (переважно, однією) гідроксильною групою(групами). Приклади нижчих алкоксинижчих алкоксигруп включають згадані вище нижчі алкоксигрупи, заміщені однією-трьома (переважно, однією) нижчою алкоксигрупою(групами), описаними вище. Приклади аміногруп, необов'язково заміщених одним або більше членами, вибраними із групи, що складається з нижчих алкільних груп, нижчих алкоксинижчих алкільних групи і циклоС3-8-алкільних груп, включають аміногрупи, необов'язково заміщені одним або двома членами, вибраними із групи, що складається зі згаданих вище нижчих алкільних груп, згаданих вище нижчих алкоксинижчих алкільних груп і згаданих вище цикло-С3-8-алкільних груп. Приклади нижчих алкілсульфонільних груп включають алкілсульфонільні групи, у яких алкільний фрагмент представляє згадану вище нижчу алкільну групу. Приклади аміно нижчих алкоксигруп, необов'язково заміщених по аміногрупі одним або більше членами, вибраними із групи, що складається з нижчих алкільних груп, нижчих алканоїльних груп, нижчих алкілсульфонільних груп і карбамоїльних груп, необов'язково заміщених однією або більше нижчими алкільними групами, включають нижчі алкоксигрупи, заміщені однією-трьома (переважно однією) аміногрупою(групами). У даному описі аміно нижча алкоксигрупа необов'язково заміщена по аміногрупі одним або двома членами, вибраними із групи, що складається зі згаданих вище нижчих алкільних груп, згаданих вище нижчих алканоїльних груп, згаданих вище нижчих алкілсульфонільних груп, карбамоїльних груп, необов'язково заміщених однією або більше нижчими алкільними групами, згаданими вище. Приклади цикло С3-8 алкоксигруп включають групи, у яких цикло-С3-8-алкільна група й атом кисню зв'язані між собою. Приклади тетрагідрофурильних нижчих алкоксигруп включають згадані вище нижчі алкоксигрупи, заміщені однією-трьома (переважно однією) тетрагідрофурильною групою(групами). Приклади нижчих алкілтіогруп включають алкілтіогрупи, у яких алкільний фрагмент представляє згадану вище нижчу алкільну групу. Приклади фенільних нижчих алкоксигруп включають згадані вище нижчі алкоксигрупи, заміщені однією-трьома (переважно однією) фенільною групою(групами). Приклади фенільних нижчих алкоксинижчих алкоксигруп включають згадані вище нижчі алкоксигрупи, заміщені однією-трьома (переважно однією) фенільною нижчою алкоксигрупою(групами). 6 UA 98789 C2 Спосіб одержання сполуки даного винаходу докладно описаний нижче. Похідне хінолону, представлене загальною формулою (1) (надалі називане також сполукою (1)), можна одержати різними способами; наприклад, способом за наступною схемою реакції 1 або 2. 5 10 15 20 25 30 35 40 45 у якій R1, R2, R3, R4, R5, R6 і R7 аналогічні визначеним вище, і Х1 представляє атом галогену. Приклади атомів галогену, представлених Х1, включають фтор, хлор, бром і йод. Переважно, відхідні групи в даній реакції включають галоген. З їх числа особливо переважний йод. Сполуку (1) можна одержати, уводячи у взаємодію сполуку загальної формули (2) і сполуку загальної формули (3) в інертному розчиннику або без використання яких-небудь розчинників, у присутності або під час відсутності основної сполуки, у присутності паладієвого каталізатора. Приклади інертних розчинників включають воду, розчинники на основі простих ефірів, такі як діоксан, тетрагідрофуран, діетиловий ефір, 1,2-диметоксіетан, диметиловий ефір діетиленгліколю й диметиловий ефір етиленгліколю; розчинники на основі ароматичних вуглеводнів, такі як бензол, толуол і ксилол; розчинники на основі нижчих спиртів, такі як метанол, етанол і ізопропанол; розчинники на основі кетонів, такі як ацетон і метилетилкетон; і полярні розчинники, такі як N, N-диметилформамід (ДМФА), диметилсульфоксид (ДМСО), гексаметилфосфортриамід і ацетонітрил. Дані інертні розчинники можна використовувати окремо або у вигляді сполучення двох або більше з них. Використовувані в даній реакції сполуки паладію особливо не обмежені, але включають, наприклад, каталізатори на основі чотиривалентного паладію, такі як тетрагідрат гексахлорпаладату(ІV) натрію й гексахлорпаладат(ІV) калію, каталізатори на основі двовалентного паладію, такі як хлорид паладію(II), бромід паладію(II), ацетат паладію(ІІ), ацетилацетонат паладію(ІІ), дихлорбіс(бензонітрил)паладію(II), дихлорбіс(ацетонітрил)паладій(ІІ), дихлорбіс(трифенілфосфін)паладію(II), дихлортетраамін паладію(II), дихлорбіс(циклоокта-1,5-дієн)паладію(ІІ), трифторацетат паладію(II) і комплекс 1,1'біс(дифенілфосфіно)фероцен дихлорпаладія(II) з дихлорметаном, каталізатори на основі нульвалентного паладію, такі як трис(дибензиліденацетон)2паладію(0), комплекс трис(дибензиліденацетон)2паладію(0) із хлороформом і тетракіс(трифенілфосфін)паладію(0) і так далі. Дані паладієві каталізатори можна використовувати окремо або у вигляді сполучення двох або більше з них. У даній реакції кількість паладієвого каталізатора особливо не обмежено, але звичайно воно перебуває в інтервалі від 0,000001 до 20 моль із розрахунку на паладій відносно 1 моль сполуки (2). Кількість паладієвого каталізатора переважно перебуває в інтервалі від 0,0001 до 5 моль із розрахунку на паладій відносно 1 моль сполуки (2). Дана реакція протікає переважно в присутності підходящого ліганду. Приклади лігандів паладієвого каталізатора включають, наприклад, 2,2'-біс(дифенілфосфіно)-1,1'-бінафтил (BINAP), три-о-толілфосфін, біс(дифенілфосфіно)фероцен, трифенілфосфін, три-третбутилфосфін і 9, диметил-4, 5-біс(дифенілфосфіно)ксантен (XANTPHOS). Дані ліганди використовують окремо або у вигляді сполучення двох або більше з них. Співвідношення паладієвого каталізатора й ліганду особливо не обмежено. Кількість ліганду становить від близько 0,1 до близько 100 моль на моль паладієвого каталізатора, і переважно від близько 0,5 до близько 15 моль на моль паладієвого каталізатора. Як основні сполуки можна використовувати різні відомі неорганічні й органічні основи. 7 UA 98789 C2 5 10 15 20 25 30 Неорганічні основи включають, наприклад, гідроксиди лужних металів, такі як гідроксид натрію, гідроксид калію, гідроксид цезію й гідроксид літію, карбонати лужних металів, такі як карбонат натрію, карбонат калію, карбонат цезію й карбонат літію; гідрокарбонати лужних металів, такі як гідрокарбонат літію, гідрокарбонат натрію й гідрокарбонат калію; лужні метали, такі як натрій і калій; фосфати, такі як фосфат натрію й фосфат калію; аміди, такі як амід натрію, і гідриди лужних металів, такі як гідрид натрію й гідрид калію. Органічні основи включають, наприклад, нижчі алкоголяти лужних металів, такі як метилат натрію, етилат натрію, трет-бутилат натрію, метилат калію, етилат калію й трет-бутилат калію, і аміни, такі як триетиламін, трипропіламін, піридин, хінолін, піперидин, імідазол, NЕтилдіізопропіламін, диметиламінопіридин, триметиламін, диметиланілін, N-Метилморфолін, 1, 5-діазабіцикло[4.3.0] нон-5-ен (DBN), 1, 8-діазабіцикло[5.4.0] ундец-5-ен (DBU), 1, 4діазабіцикло[2.2.2]октан (DABCO) і так далі. Подібні основні сполуки можна використовувати окремо або у вигляді сполучення двох або більше з них. Більш переважні основні сполуки, використовувані в даній реакції, включають карбонати лужних металів, такі як карбонат натрію, карбонат калію, карбонат цезію й карбонат літію. Основну сполуку звичайно використовують у кількості від 0,5 до 10 моль на моль сполуки (2), і переважно від 0,5 до 6 моль на моль сполуки (2). Сполука (3) звичайно використовують у кількості щонайменше близько 1 моль на моль сполуки (2), і переважно від близько 1 до близько 5 моль на моль сполуки (2). Дану реакцію можна проводити при нормальному тиску в атмосфері інертного газу, включаючи азот, аргон і так далі, або при підвищеному тиску. Реакція звичайно протікає при температурі від кімнатної до 200 °C, і переважно при температурі від кімнатної до 150 °C, і звичайно завершується протягом від близько 1 до близько 30 годин. Реакцію також доводять до кінця нагріванням при температурі від 100 до 200 °C протягом від 5 хвилин до 1 години з використанням реактора з мікрохвильовим випромінюванням. Сполука, представлена загальною формулою (3), використовуване як вихідну сполуку в схемі реакції 1, представляє легкодоступну описану сполуку. Сполука, представлена загальною формулою (2), включає нова сполука, і дану сполуку одержують по представленій нижче схемі реакції 6. 8 UA 98789 C2 5 10 15 20 25 30 35 40 45 у якій R1, R2, R3, R4, R5, R6 і R7 аналогічні визначеним вище, і R8 представляє нижчу алкоксигрупу. Нижча алкоксигрупа, представлена R8 у загальній формулі (5), має визначення, аналогічне описаному вище. Сполуки, представлені загальними формулами (4) і (5), уводять у взаємодію в інертному розчиннику або без використання яких-небудь розчинників, у присутності або під час відсутності кислого каталізатора, одержуючи в результаті проміжну сполуку, представлену загальною формулою (6). Після цього одержану сполуку циклізують, одержуючи сполуку, представлену загальною формулою (1). Приклади інертних розчинників включають воду; розчинники на основі простих ефірів, такі як діоксан, тетрагідрофуран, діетиловий ефір, 1, 2-диметоксіетан, диметиловий ефір діетиленгліколю й диметиловий ефір етиленгліколю; розчинники на основі ароматичних вуглеводнів, такі як бензол, толуол і ксилол; розчинники на основі нижчих спиртів, такі як метанол, етанол і ізопропанол; і полярні розчинники, такі як N, N-Диметилформамід (ДМФА), диметилсульфоксид (ДМСО), гексаметилфосфортриамід і ацетонітрил. Дані інертні розчинники можна використовувати окремо або у вигляді сполучення двох або більше з них. Можна використовувати будь-які типи відомих кислих каталізаторів, включаючи толуолсульфокислоту, метансульфокислоту, ксилолсульфокислоту, сірчану кислоту, крижану оцтову кислоту, трифтористий бор, кислотні іонообмінні смоли й так далі. Дані кислі каталізатори можна використовувати окремо або у вигляді сполучення двох або більше з них. Із числа подібних кислот переважно використовують кислотні іонообмінні смоли. Приклади кислотних іонообмінних смол включають наявні в продажі полімерні катіонообмінні смоли, такі як Lewatit S100, Zeo-karb 225, Dowex 50, Amberlit IR120 або Amberlyst 15 і подібні полімери стирол сульфокислот; Lewatit PN, Zeo-karb 215 або 315 і подібні конденсати полісульфокислот; Lewatit CNO, Duolit CS100 і подібні смоли на основі м-фенолкарбонових кислот; або Permutit C, Zeo-karb 226 або Amberlite IRC 50 і подібні поліакрилати. З їхнього числа особливо переважний Amberlyst 15. Оксидний каталізатор звичайно використовують у кількості від 0,0001 до 100 моль на моль сполуки (4), і переважно від 0,5 до 6 моль на моль сполуки (4). У схемі реакції 2 сполука (5) звичайно використовують у кількості щонайменше близько 1 моль на сполуки (4), і переважно від близько 1 до близько 5 моль на моль сполуки (4). Дану реакцію можна проводити при нормальному тиску в атмосфері інертного газу, включаючи азот, аргон і так далі, або при підвищеному тиску. Реакція звичайно протікає при температурі від кімнатної до 200 °C, і переважно при температурі від кімнатної до 150 °C. У ході реакції проводять азеотропний відгін води доти, поки виділення води в ході реакції не припиниться. Реакція звичайно завершується протягом від близько 1 до близько 30 годин. Спосіб одержання сполуки загальної формули (1) реакцією циклізації проміжної сполуки, представленої загальною формулою (6), можна застосовувати, нагріваючи дану сполуку в розчиннику, такому як дифеніловий ефір, або нагріваючи дану сполуку під час відсутності розчинника. Реакцію проводять при температурі від 150 до 300 °C протягом від 5 хвилин до 2 годин. Сполука, представлена загальною формулою (4), використовувана як вихідна речовина в описаній вище схемі реакції 2, представляє відому сполуку або може бути легко одержана з відомої сполуки. Сполука, представлена загальною формулою (5), включає нову сполуку, і дану сполуку одержують, наприклад, у відповідності зі способами, представленими на описані вище схемі реакції 4 і схемі реакції 5. 9 UA 98789 C2 5 10 15 20 25 30 35 40 45 у якій R2, R3, R4, R5, R6 і R7 аналогічні визначеним вище, і R1' представляє групу, представлену R1, що відрізняється від водню, і Х2 представляє групу, що піддасться тій ж реакції заміщення, що й реакція заміщення галогену, або атома галогену. Галогени, представлені Х2 у загальній формулі (1а), включають описаний вище атом галогену. Групи, які піддаються тієї ж реакції заміщення, що й реакція заміщення атомів галогену, представлених Х2, включають нижчі алкілсульфонілоксигрупи, арилсульфонілоксигрупи, аралкілсульфонілоксигрупи й так далі. Приклади нижчих алкілсульфонілоксигруп включають лінійні або розгалужені С1-6 алкілсульфонілоксигрупи, такі як метансульфонілокси, етансульфонілокси, нпропансульфонілокси, ізопропансульфонілокси, н-бутансульфонілокси, третбутансульфонілокси, н-пентансульфонілокси й н-гексансульфонілокси. Приклади арилсульфонілоксигруп включають нафтилсульфонілокси й фенілсульфонілокси, що необов'язково містять у фенільному кільці як замісник від однієї до трьох груп, вибраних із групи, що складається з лінійних або розгалужених С1-6 алкільних груп, лінійних або розгалужених С1-6 алкоксигруп, нітрогруп і атомів галогену. Приклади фенілсульфонілоксигруп, необов'язково заміщених згаданим вище замісником(ами), включають фенілсульфонілокси, 4метилфенілсульфонілокси, 2-метилфенілсульфонілокси, 4-нітрофенілсульфонілокси, 4метоксифенілсульфонілокси, 2-нітрофенілсульфонілокси, 3-хлорфенілсульфонілокси й так далі. Приклади нафтилсульфонілоксигруп включають (-нафтилсульфонілокси, (нафтилсульфонілокси й так далі. Приклади аралкілсульфонілоксигруп включають фенілзаміщені лінійні або розгалужені С1-6 алкілсульфонілоксигрупи, які можуть містити у фенільном кільці як замісник від одного до трьох замісників, вибраних із групи, що включає лінійні або розгалужені С1-6 алкільні групи, лінійні або розгалужені С1-6 алкоксигрупи, нітрогрупу й атоми галогену, або нафтилзаміщені лінійні або розгалужені С1-6 алкілсульфонілоксигрупи. Приклади алкілсульфонілоксигруп, заміщених згаданою вище фенільною групою(групами), включають бензилсульфонілокси, 2фенілетилсульфонілокси, 4-фенілбутилсульфонілокси, 4-метилбензилсульфонілокси, 2метилбензилсульфонілокси, 4-нітробензилсульфонілокси, 4-метоксибензилсульфонілокси, 3хлорбензилсульфонілокси й так далі. Приклади алкілсульфонілоксигруп, заміщених згаданою вище нафтильною групою(групами), включають (-нафтилметилсульфонілокси, (нафтилметилсульфонілокси й так далі. Сполука, представлена загальною формулою (1b), можна одержати взаємодією сполуки, представленої загальною формулою (1а), зі сполукою, представленою загальною формулою (7), в інертному розчиннику або без використання яких-небудь розчинників, у присутності або під час відсутності основної сполуки. Приклади інертних розчинників включають воду; розчинники на основі простих ефірів, такі як діоксан, тетрагідрофуран, діетиловий ефір, 1, 2-диметоксіетан, диметиловий ефір діетиленгліколю й диметиловий ефір етиленгліколю; розчинники на основі ароматичних вуглеводнів, такі як бензол, толуол і ксилол; розчинники на основі нижчих спиртів, такі як метанол, етанол і ізопропанол; розчинники на основі кетонів, такі як ацетон і метилетилкетон; і полярні розчинники, такі як N, N-Диметилформамід (ДМФА), диметилсульфоксид (ДМСО), гексаметилфосфортриамід і ацетонітрил. Дані інертні розчинники можна використовувати окремо або у вигляді сполучення двох або більше з них. Як основні сполуки можна використовувати різні відомі неорганічні основи й органічні основи. Неорганічні основи включають, наприклад, гідроксиди лужних металів, такі як гідроксид натрію, гідроксид калію, гідроксид цезію й гідроксид літію, карбонати лужних металів, такі як 10 UA 98789 C2 5 10 15 20 25 30 35 40 45 карбонат натрію, карбонат калію, карбонат цезію й карбонат літію; гідрокарбонати лужних металів, такі як гідрокарбонат літію, гідрокарбонат натрію й гідрокарбонат калію; лужні метали, такі як натрій і калій; аміди, такі як амід натрію, і гідриди лужних металів, такі як гідрид натрію й гідрид калію. Органічні основи включають, наприклад, нижчі алкоголяти лужних металів, такі як метилат натрію, етилат натрію, трет-бутилат натрію, метилат калію, етилат калію й трет-бутилат калію, і аміни, такі як триетиламін, трипропіламін, піридин, хінолін, піперидин, імідазол, NЕтилдіізопропіламін, диметиламінопіридин, триметиламін, диметиланілін, N-Метилморфолін, 1, 5-діазабіцикло[4.3.0] нон-5-ен (DBN), 1, 8-діазабіцикло[5.4.0] ундец-5-ен (DBU), 1, 4діазабіцикло[2.2.2]октан (DABCO) і так далі. Подібні основні сполуки можна використовувати окремо або у вигляді сполучення двох або більше з них. Більш переважні основні сполуки, використовувані в даній реакції, включають неорганічні основи, такі як гідрид натрію й гідрид калію. Основну сполуку звичайно використовують у кількості від 0,5 до 10 моль на моль сполуки (1а), і переважно від 0,5 до 6 моль на моль сполуки (1а). У схемі реакції 1 сполука (7) звичайно використовують у кількості щонайменше близько 1 моль на сполуки (1а), і переважно від близько 1 до близько 5 моль на моль сполуки (1а). Дану реакцію можна проводити при нормальному тиску в атмосфері інертного газу, включаючи азот, аргон і так далі, або при підвищеному тиску. Реакція звичайно протікає при температурі від 0 °C до 200 °C, і переважно при температурі від кімнатної до 150 °C, і звичайно завершується протягом від близько 1 до близько 30 годин. Сполука, представлена загальною формулою (7), що використовують як вихідну речовину в описаній вище схемі реакції 3, представляє легкодоступну відому сполуку. Сполука (5) і сполука (2), що є вихідними речовинами для сполуки винаходу, включають нові сполуки, і можуть бути одержані різними способами, наприклад, способами у відповідності з наступними схемами реакцій з 4 по 6. у якій R2, R3 і R8 аналогічні визначеним вище, a R9 представляє нижчу алкоксигрупу. Нижча алкоксигрупа, представлена R9 у загальній формулі (9), має визначення, аналогічне описаному вище. Сполука, представлена загальною формулою (5), можна одержати взаємодією сполуки, представленої загальною формулою (8), зі сполукою, представленою загальною формулою (9), в інертному розчиннику або без використання яких-небудь розчинників, у присутності або під час відсутності основної сполуки. Приклади інертних розчинників включають воду; розчинники на основі простих ефірів, такі як діоксан, тетрагідрофуран, діетиловий ефір, 1, 2-диметоксіетан, диметиловий ефір діетиленгліколю й диметиловий ефір етиленгліколю; розчинники на основі ароматичних вуглеводнів, такі як бензол. толуол і ксилол; розчинники на основі нижчих спиртів, такі як метанол, етанол і ізопропанол; розчинники на основі кетонів, такі як ацетон і метилетилкетон; і полярні розчинники, такі як N, N-Диметилформамід (ДМФА), диметилсульфоксид (ДМСО), гексаметилфосфортриамід і ацетонітрил. Дані інертні розчинники можна використовувати окремо або у вигляді сполучення двох або більше з них. Як основна сполука можна використовувати різні відомі неорганічні основи й органічні основи. Неорганічні основи включають, наприклад, гідроксиди лужних металів, такі як гідроксид натрію, гідроксид калію, гідроксид цезію й гідроксид літію, карбонати лужних металів, такі як карбонат натрію, карбонат калію, карбонат цезію й карбонат літію, гідрокарбонати лужних 11 UA 98789 C2 5 10 15 20 металів, такі як гідрокарбонат літію, гідрокарбонат натрію й гідрокарбонат калію; лужні метали, такі як натрій і калій, аміди, такі як амід натрію, і неорганічні основи на основі гідридів лужних металів, таких як гідрид натрію й гідрид калію. Органічні основи включають, наприклад, нижчі алкоголяти лужних металів, такі як метилат натрію, етилат натрію, трет-бутилат натрію, метилат калію, етилат калію й трет-бутилат калію, і аміни, такі як триетиламін, трипропіламін, піридин, хінолін, піперидин, імідазол, NЕтилдіізопропіламін, диметиламінопіридин, триметиламін., диметиланілін, N-Метилморфолін, 1, 5-діазабіцикло[4.3.0] нон-5-ен (DBN), 1, 8-діазабіцикло[5.4.0] ундец-5-ен (DBU), 1, 4діазабіцикло[2.2.2]октан (DABCO) і так далі. Подібні основні сполуки можна використовувати окремо або у вигляді сполучення двох або більше з них. Більш переважні основні сполуки, використовувані в даній реакції, включають неорганічні основи, такі як гідрид натрію й гідрид калію. Основну сполуку звичайно використовують у кількості від близько 1 до близько 10 моль на моль сполуки (8), і переважно від близько 1 до близько 6 моль на моль сполуки (8). У схемі реакції 4 сполука (9) звичайно використовують у кількості щонайменше близько 1 моль на сполуки (8), і переважно від близько 1 до близько 5 моль на моль сполуки (8). Дану реакцію можна проводити при нормальному тиску в атмосфері інертного газу, включаючи азот, аргон і так далі, або при підвищеному тиску. Реакція звичайно протікає при температурі від кімнатної до 200 °C, і переважно при температурі від кімнатної до 150 °C і звичайно завершується протягом від близько 1 до близько 30 годин. Сполуки, представлені загальними формулами (8) і (9), які використовують як вихідні речовини в схемі реакції 4, представляють легкодоступні відомі сполуки. 25 30 35 40 45 у якій R2, R3 і R8 аналогічні визначеним вище, і Х3 представляє атом галогену. Атом галогену, представлений Х3 у загальній формулі (9'), має визначення, аналогічне описаному вище. Сполука, представлена загальною формулою (5), можна одержати взаємодією сполуки, представленої загальною формулою (8'), зі сполукою, представленою загальною формулою (9'), в інертному розчиннику або без використання яких-небудь розчинників, у присутності основної сполуки, такого як карбонат цезію, і мідного каталізатора, такого як йодид міді. Приклади інертних розчинників включають полярні розчинники, такі як N, NДиметилформамід (ДМФА), диметилсульфоксид (ДМСО), гексаметилфосфортриамід і ацетонітрил. Дані інертні розчинники можна використовувати окремо або у вигляді сполучення двох або більше з них. Дану реакцію можна проводити в присутності амінокислот, таких як L-Пролін. Дану реакцію можна проводити при нормальному тиску в атмосфері інертного газу, включаючи азот, аргон і так далі, або при підвищеному тиску. Реакція звичайно протікає при температурі від кімнатної до 200 °C, і переважно при температурі від кімнатної до 150 °C, і звичайно завершується протягом від близько 1 до близько 30 годин. Зазначена вище реакція спеціально наведена в представленому нижче стандартному прикладі 58. 12 UA 98789 C2 Сполуки, представлені загальними формулами (8') і (9'), які використовують як вихідні речовини в описаній вище схемі реакції 5, представляють відомі сполуки або легко можуть бути одержані з відомих сполук. 5 10 15 20 25 30 у якій R4, R5, R6 і R7 аналогічні визначеним вище, і Х1а представляє атом галогену. R10 представляє нижчу алкільну групу. Нижча алкільна група, представлена R10, і атом галогену, представлений Х1а, мають визначення, аналогічні описаним вище. Сполука, представлена загальною формулою (12), можна одержати реакцією конденсації сполук, представлених загальними формулами (4), (10) і (11), в інертному розчиннику або без використання яких-небудь розчинників. Приклади інертних розчинників включають воду; розчинники на основі простих ефірів, такі як діоксан, тетрагідрофуран, діетиловий ефір, 1, 2-диметоксіетан, диметиловий ефір діетиленгліколю й диметиловий ефір етиленгліколю; розчинники на основі галогензаміщених вуглеводнів, такі як дихлорметан, хлороформ, 1, 2-дихлоретан і чотирихлористий вуглець; розчинники на основі ароматичних вуглеводнів, такі як бензол, толуол і ксилол; розчинники на основі нижчих спиртів, такі як метанол, етанол і ізопропанол; і полярні розчинники, такі як N, NДиметилформамід (ДМФА), диметилсульфоксид (ДМСО), гексаметилфосфортриамід і ацетонітрил. Замість згаданих вище розчинників як розчинник можна використовувати сполуку, представлену загальною формулою (11). Дані інертні розчинники можна використовувати окремо або у вигляді сполучення двох або більше з них. У схемі реакції 6 сполука (10) звичайно використовують у кількості щонайменше близько 1 моль на сполуки (4), і переважно від близько 1 до близько 5 моль на моль сполуки (4). Стосовно сполуки (10) використовують надлишок сполуки (11). Дану реакцію можна проводити при нормальному тиску в атмосфері інертного газу, включаючи азот, аргон і так далі, або при підвищеному тиску. Реакція звичайно протікає при температурі від кімнатної до 200 °C, і переважно при температурі від кімнатної до 150 °C, і звичайно завершується протягом від близько 1 до близько 30 годин. 13 UA 98789 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сполука, представлена загальною формулою (13), можна одержати реакцією анелування сполуки, представленої загальною формулою (12), в інертному розчиннику або без використання яких-небудь розчинників. Приклади інертних розчинників включають розчинники на основі простих ефірів, такі як дифеніловий ефір. Дану реакцію можна проводити при нормальному тиску в атмосфері інертного газу, включаючи азот, аргон і так далі, або при підвищеному тиску. Реакція звичайно протікає при температурі від кімнатної до 300 °C, і переважно при температурі від 150 °C до 300 °C, і звичайно завершується протягом від близько 1 до близько 30 годин. Сполука, представлена загальною формулою (2а), можна одержати реакцією сполуки, представленої загальною формулою (13), зі сполукою, представленою загальною формулою (14), в інертному розчиннику або без використання яких-небудь розчинників, у присутності або під час відсутності основної сполуки. Приклади інертних розчинників включають воду; розчинники на основі простих ефірів, такі як діоксан, тетрагідрофуран, діетиловий ефір, 1, 2-диметоксіетан, диметиловий ефір діетиленгліколю й диметиловий ефір етиленгліколю; розчинники на основі ароматичних вуглеводнів, такі як бензол, толуол і ксилол; розчинники на основі нижчих спиртів, такі як метанол, етанол і ізопропанол; розчинники на основі кетонів, такі як ацетон і метилетилкетон; полярні розчинники, такі як N, N-Диметилформамід (ДМФА), диметилсульфоксид (ДМСО), гексаметилфосфортриамід і ацетонітрил. Дані інертні розчинники можна використовувати окремо або у вигляді сполучення двох або більше з них. Як основна сполука можна використовувати різні відомі неорганічні основи й органічні основи. Неорганічні основи включають, наприклад, гідроксиди лужних металів, такі як гідроксид натрію, гідроксид калію, гідроксид цезію й гідроксид літію, карбонати лужних металів, такі як карбонат натрію, карбонат калію, карбонат цезію й карбонат літію, гідрокарбонати лужних металів, такі як гідрокарбонат літію, гідрокарбонат натрію й гідрокарбонат калію; лужні метали, такі як натрій і калій; аміди, такі як амід натрію, і неорганічні основи на основі гідридів лужних металів, таких як гідрид натрію й гідрид калію. Органічні основи включають, наприклад, розчинники на основі нижчих алкоголятів лужних металів, такі як метилат натрію, етилат натрію, трет-бутилат натрію, метилат калію, етилат калію й трет-бутилат калію, і аміни, такі як триетиламін, трипропіламін, піридин, хінолін, піперидин, імідазол, N-Етилдіізопропіламін, диметиламінопіридин, триметиламін, диметиланілін, N-Метилморфолін, 1, 5-діазабіцикло[4.3.0] нон-5-ен (DBN), 1, 8діазабіцикло[5.4.0] ундец-5-ен (DBU), 1, 4-діазабіцикло[2.2.2]октан (DABCO) і так далі. Подібні основні сполуки можна використовувати окремо або у вигляді сполучення двох або більше з них. Більше кращі основні сполуки, використовувані в даній реакції, включають карбонати лужних металів, такі як карбонат натрію, карбонат калію, карбонат цезію й карбонат літію й так далі. Основну сполуку звичайно використовують у кількості від близько 0,5 до близько 10 моль на моль сполуки (13), і переважно від близько 0,5 до близько 6 моль на моль сполуки (13). У схемі реакції 6 сполука (14) звичайно використовують у кількості щонайменше 0,5 моль на сполуки (13), і переважно від близько 0,5 до близько 5 моль на моль сполуки (13). Дану реакцію можна проводити при нормальному тиску в атмосфері інертного газу, включаючи азот, аргон і так далі, або при підвищеному тиску. Реакція звичайно протікає при температурі від кімнатної до 200 °C, і переважно при температурі від кімнатної до 150 °C, і звичайно завершується протягом від близько 1 до близько 30 годин. Сполуки, представлені загальними формулами (10), (11) і (14), які використовують як вихідні речовини в схемі реакції 6, представляють легко доступні відомі сполуки. Сирі вихідні сполуки, використовувані в кожній з описаних вище схем реакцій, можуть включати підходящі солі, і цільові сполуки, одержані в результаті кожної з даних реакцій, можуть утворювати підходящі солі. Такі переважні солі включають наступні переважні солі сполуки (1). Придатні солі сполуки (1) представляють фармакологічно припустимі солі, включаючи солі металів, такі як солі лужних металів (наприклад, солі натрію, солі калію й так далі), солі лужноземельних металів (наприклад, солі кальцію, солі магнію й так далі), солі амонію, солі неорганічних основ, таких як карбонати лужних металів (наприклад, карбонат літію, карбонат калію, карбонат натрію, карбонат цезію й так далі), гідрокарбонати лужних металів (наприклад, гідрокарбонат літію, гідрокарбонат натрію, гідрокарбонат калію й так далі), гідроксиди лужних 14 UA 98789 C2 5 10 15 20 металів (наприклад, гідроксид літію, гідроксид натрію, гідроксид калію, гідроксид цезію й так далі), солі органічних основ, таких як три(нижчий)апкіламін (наприклад, триметиламін, триетиламін, N-Етилдіізопропіламін і так далі), піридин, хінолін, піперидин, імідазол, пиколин, диметиламінопіридин, диметиланілін, N-(нижчий)алкілморфолін (наприклад, N-Метилморфолін і так далі), 1, 5-діазабіцикло[4.3.0] нон-5-ен (DBN), 1, 8-діазабіцикло[5.4.0] ундец-5-ен (DBU) і 1, 4діазабіцикло[2.2.2]октан (DABCO); солі неорганічних кислот, такі як гідрохлорид, гідробромід, гідройодид, сульфат, нітрат і фосфат; і солі органічних кислот, такі як форміат, ацетат, пропионат, оксалат, малонат, сукцинат, фумарат, малеат, лактат, малат, цитрат, тартрат, карбонат, пикрат, метансульфонат, етансульфонат, п-толуолсульфонат і глутамат. Крім того, у кожну із загальних формул включені сполуки у формі, у якій додавали сольват (наприклад, гідрат, етанолят і так далі) у вихідні сполуки й цільову сполуку, представлені на кожній зі схем реакцій. Переважні сольвати включають гідрат. Кожна із цільових сполук, одержаних відповідно до наведених вище схем реакцій, можна виділити й очистити з реакційної суміші, наприклад, після охолодження реакційної суміші, здійснення процедури виділення, такої як фільтрування, концентрування, екстракція й так далі, для виділення сирого продукту реакції, а потім піддаючи даний сирий продукт реакції звичайному способу очищення, такому як колоночна хроматографія, перекристалізація й так далі. Сполука формули (1) згідно із даним винаходу, природно, включає геометричні ізомери, стереоізомери, оптичні ізомери й тому подібні ізомери. У відношенні наведеної вище сполуки загальної формули (1) слід зазначити наступні моменти. У тому випадку, коли R1 у загальній формулі (1) представляє атом водню, сполука включає таутомер хінолонового циклу. Тобто, коли R 1 у представляє атом водню (1') у сполуці хінолону загальної формули (1) 25 у якій R2, R3, R4, R5, R6 і R7 аналогічні визначеним вище, сполука даного таутомера можна представити формулою (1'') 30 у якій R2, R3, R4, R5, R6 і R7 аналогічні визначеним вище. Тобто обоє сполуки, представлених формулами (1') і (1"), перебувають у стані таутомерного рівноваги, представленого наступною формулою рівноваги. 35 15 UA 98789 C2 5 10 15 20 25 30 35 40 45 у якій R2, R3, R4, R5, R6 і R7 аналогічні визначеним вище. Подібна таутомерія між сполукою 4-хінолону й сполукою 4-гідроксихіноліну технічно відома, і для фахівця в даній галузі очевидно, що обоє описаних вище таутомера перебувають у стані рівноваги й взаємного перетворення. Таким чином, сполука (1), природно, включає згадані вище таутомери. В описі структурна формула сполуки 4-хінолону придатним чином використовується як структурна формула цільової або вихідної речовини, включаючи сполуки подібних таутомерів. Сполука загальної формули (1) і його сіль використовують у вигляді загальних фармацевтичних препаратів. Дані препарати одержують із використанням звичайно застосовуваних розріджувачів або ексципієнтів, таких як наповнювачі, сухі розріджувачі, зв'язувальні речовини, змочувальні речовини, розпушувачі, поверхнево-активні речовини, що змазують речовини й так далі. Форму подібних фармацевтичних препаратів можна вибрати відповідно до мети терапії. Типові приклади включають таблетки, пігулки, порошки, розчини, суспензії, емульсії, гранули, капсули, супозиторії, ін'єкції (розчини, суспензії й так далі) тощо. Для одержання таблеток можна використовувати кожний з різних носіїв, загальновідомих у даній галузі. Їх приклади включають лактозу, білий цукор, хлорид натрію, глюкозу, сечовину, крохмаль, карбонат кальцію, каолін, кристалічну целюлозу, кремнієву кислоту й інші ексципієнти; воду, етанол, пропанол, цукровий сироп, розчини глюкози, розчини крохмалю, розчини желатину, карбоксиметилцелюлозу, шелак, метилцелюлозу, фосфат калію, поливинилпіролідон і інші зв'язувальні речовини; сухий крохмаль, альгінат натрію, порошок агар-агару, ламінариновий порошок, гідрокарбонат натрію, карбонат кальцію, поліоксіетиленовий ефір сорбіту й жирної кислоти, лаурилсульфат натрію, моногліцериди стеаринової кислоти, крохмаль, лактозу й інші розпушувачі; білий цукор, стеарин, олія какао, гідровані масла й інші інгібітори розпушення; четвертинні амонієві основи, лаурилсульфат натрію й інші промотори абсорбції; гліцерин, крохмаль і інші змочувальні речовини; крохмаль, лактозу, каолін, бентоніт, колоїдну кремнієву кислоту й інші адсорбенти; очищений тальк, стеарати, порошкоподібну борну кислоту, поліетиленгліколь і інші змазувальні речовини, і так далі. Крім того, при необхідності на подібні таблетки може бути нанесене покриття зі звичайних покриваючих речовин, наприклад, для одержання таблеток із цукровим покриттям, таблеток з желатиновим покриттям, таблеток з кишково-розчинним покриттям, таблеток із плівковим покриттям, таблеток з подвійним або багатошаровим покриттям і так далі. Для одержання пігулок можна використовувати кожний з різних носіїв, загальновідомих у даній галузі. Їхні приклади включають глюкозу, лактозу, крохмаль, олію какао, гідровані рослинні масла, каолін, тальк і інші ексципієнти; порошкоподібний гуміарабік, порошкоподібну трагакантову камедь, желатин, етанол і інші зв'язувальні речовини; ламінарин, агар-агар і інші розпушувачі й так далі. Для одержання супозиторіїв можна використовувати будь-які різні носії, загальновідомі в даній галузі. Їхні приклади включають поліетиленгліколь, олію какао, вищі спирти, складні ефіри вищих спиртів, желатин, напівсинтетичні гліцериди й так далі. Капсули можна одержати, змішуючи активну основну сполуку зі згаданими вище носіями для висновку першого у тверду желатинову капсулу, м'яку желатинову капсулу, або тому подібне. Для одержання препарату для ін'єкцій розчин, емульсію або суспензію стерилізують і, переважно, роблять її ізотонічною до крові. Для одержання препарату для ін'єкцій можна застосовувати будь-які розріджувачі, широко використовувані для подібних форм у даній галузі. Приклади таких розріджувачів включають воду, етиловий спирт, макрогол, пропіленгліколь, етоксилований ізостеариловий спирт, поліоксилований ізостеариловий спирт, поліоксіетиленові ефіри сорбіту й жирної кислоти й так далі. 16 UA 98789 C2 5 10 15 20 25 30 35 40 45 50 55 У цьому випадку фармацевтичний препарат може містити хлорид натрію, глюкозу або гліцерин у кількості, достатньому для готування ізотонічного розчину, і може містити звичайні солюбілізатори, буферні агенти, анальгезуючі засоби й так далі. Крім того, при необхідності фармацевтичний препарат може містити барвники, консерванти, смакові добавки, підсолоджувачі й так далі, і/або інші лікарські засоби. Кількість сполуки, представленої загальною формулою (1) і її солі, що входять у фармацевтичну композицію даного винаходу, не обмежені й можуть бути придатним чином обрані із широкого інтервалу. Ця частка звичайно становить від близько 0,1 до близько 70 мас. %, переважно від близько 0,1 до близько 30 мас. % фармацевтичного препарату. Спосіб введення фармацевтичного препарату даного винаходу особливо не обмежений, і препарат уводять способом, придатним для форми препарату, віку пацієнта, статі й інших, умов, і стану хвороби. Наприклад, таблетки, пігулки, розчини, суспензії, емульсії, гранули й капсули вводять перорально. Препарати для ін'єкцій уводять внутрівенно окремо або в суміші зі звичайними ін'єкційними уливанням, такими як розчини глюкози, розчини амінокислот, або тому подібне, або окремо вводять внітрішньом'язово, внутрішньошкірно, підшкірно або внутрішньочеревинно, при необхідності. Супозиторії вводять внутрішньоректально. Дозування фармацевтичного препарату даного винаходу вибирають придатним чином у відповідності зі способом застосування, віком пацієнта, статтю й іншими умовами, і тяжкістю захворювання. Кількість активної основної сполуки звичайно становить від близько 0,1 до близько 10 мг/кг маси тіла/день. Крім того, бажано, щоб фармацевтичний препарат у кожній дозі форми введення утримувався в кількості від близько 1 до близько 200 мг. При застосуванні сполуки даного винаходу в комбінації із препаратами леводопу, агоністами дофамінових рецепторів, інгібіторами ферменту метаболізму дофаміну, препаратами, що підвищують швидкість вивільнення дофаміну, антихолінергічними агентами центральної дії й тому подібним можна досягти таких ефектів, як зниження дози, поліпшення побічних ефектів, підвищення терапевтичної ефективності й так далі, які не досягаються в результаті звичайних видів терапії. Сполука даного винаходу має захисну й поліпшуючу активність у відношенні мітохондріальної функції й захисною й відновлюючою нейтронною активністю, і так далі, і, таким чином, ефективно для лікування й попередження нейродегенеративних захворювань, захворювань, що належать до нейродегенеративного розладу, і захворювань, що належать до мітохондріальної дисфункції. Нейродегенеративні захворювання вибирають із групи, що складається з хвороби Паркінсона, синдрому Паркінсона, юнацького паркінсонізму, стріатонігральної дегенерації, прогресуючого супрануклеарного паралічу, справжньої акінезії, хвороби Альцгеймера, хвороби Піка, пріонної хвороби, кортикобазальної дегенерації, хвороби дифузійних тілець Леві, хвороби Хантінгтона, хореї-акантоцитозу, доброякісної спадкової хореї, пароксизмального хореоатетозу, есенціального тремору, есенціального міоклонусу, синдрому Туретта, синдрому Ретта, дегенеративного тремтіння, лордотичної дисбазії, атетозу, спастичної кривошиї, синдрому Мейжа, церебрального паралічу, хвороби Вільсона, синдрому Сегаві, синдрому Халлервордена-Шпатца, нейроаксональної дистрофії, палідумальної атрофії, спіноцеребелярної дегенерації сітківки, атрофії кори головного мозку, церебелярної атрофії Холмса, олівопонтоцеребелярної атрофії, спадкової олівопонтоцеребелярної атрофії, хвороби Джозефа, дентаторубропалідолюїсової атрофії, хвороби Герстманна-Штраусслера-Шейнкера, атаксії Фрідрейха, синдрому Руссі-Леві, синдрому Мея-Уайта, уродженої церебелярної атаксії, спадкової епізодичної атаксії, атаксії-телеангієктазії, бічного аміотрофічного склерозу, прогресуючого бульбарного паралічу, спінальної прогресуючої м'язової атрофії, спінобульбарної м'язової атрофії, хвороби Вердніга-Хоффмана, хвороби КугельбергаВеландер, спадкового спастичного парапарезу, сирингомієлії, сирингобульбії, синдрому Арнольда-Кіарі, синдрому м'язової скутості, синдрому Кліппель-Фейля, синдрому Фаціо-Лонде, нижчої мієлопатії, синдрому Денді-Уолкера, розщеплення хребта, синдрому СьегренаЛарссона, радіаційної мієлопатії, вікової дегенерації жовтої плями й апоплексії мозку, вибраної із групи, що складається з ішемічного інсульту й крововиливу в мозок. Захворювання, викликані неврологічної дисфункцією, включають травму спинного мозку, викликану хіміотерапією невропатію, дрифтер невропатію, радіаційне ураження й демієлінізуючі захворювання (наприклад, розсіяний склероз, гострий диссемінований енцефаломієліт, поперечний мієліт, прогресуючу багатофокальну лейкоенцефалопатію, подострий склерозирующий паненцефалит, хронічну запальну демієлінізуючу поліневропатію, синдром Гіллена-Барре й так далі). 17 UA 98789 C2 5 10 15 20 25 30 35 40 45 50 55 60 Захворювання, викликані погіршенням функції мітохондрію, вибирають з групи, що складається з синдрому Пірсона, діабету, глухоти, мігрені злоякісного перебігу, хвороби Лебера, MELAS, MERRF, синдрому перехлесту MERRF/MELAS, NARP, справжньої міопатії, мітохондріальної кардіоміопатії, міопатії, слабоумства, шлунково-кишкової атаксії,сидеробластної набутої анемії, викликаної аміноглікозидами втрати слуху, недостатності комплексу III внаслідок спадкових варіантів цитохрому b, множинного симетричного ліпоматозу, атаксії, міоклонусу, ретинопатії, MNGIE, хвороби ANT1, хвороби Твінкла, хвороби POLG, рецидивуючої міоглобінурії, SANDO, ARCO, недостатності комплексу І, недостатності комплексу II, атрофії зорового нерва, фатальної дитячої недостатності комплексу IV, недостатності мітохондріальної ДНК, синдрому недостатності мітохондріальної ДНК, енцефаломієлопатії Лі, синдрому хронічної прогресуючої зовнішньої офтальмоплегії (СРЕО), синдрому Керна-Сайра, енцефалопатії, лактацидемії, міоглобінурії, викликаних лікарськими препаратами мітохондріальних захворювань, шизофренії, великого депресивного розладу, І біполярного розладу, II біполярного розладу, змішаного нападу, дистимічних розладів, атипічної депресії, сезонних афективних розладів, післяпологової депресії, малої депресії, рецидивуючого короткого депресивного розладу, стійкої депресії/хронічної депресії, подвійній депресії й гострої ниркової недостатності. Надалі даний винахід описаний більш докладно з посиланням на довідкові приклади, приклади й фармакологічні тестові приклади. Довідковий приклад 1 N-Циклогексил-4-фтор-2-нітро-N-метиланілін До розчину 2, 5-дифторнітробензола (5,0 г, 31,4 ммоль) в N-Метилпіролідоні (NMP) (20 мл) додавали карбонат калію (6,0 г, 43,5 ммоль) і N-Метилциклогексиламін (4,6 г, 40,6 ммоль), і перемішували при 100 °C протягом 3 годин. Реакційну суміш охолоджували до кімнатної температури, додавали воду й екстрагували одержану суміш етилацетатом. Органічний шар промивали водою, і потім сушили над безводним сульфатом магнію. Одержаний сухий продукт концентрували при зниженому тиску, одержуючи при цьому 7,0 г олієподібного N-циклогексил-4фтор-2-нітро-N-метиланіліну жовтого кольору (вихід: 89 %). 1 Н ЯМР (CDCl3) dppm: 1,12-1,80 (10Н, м), 2,67 (3Н, с), 3,00-3,09 (1Н, м), 7,07-7,20 (2Н, м), 7,42-7,47 (1H, м). Сполуки наступних довідкових прикладів з 2-5 одержували способом, аналогічним наведеному вище довідковому прикладу 1, з використанням відповідних вихідних речовин. Довідковий приклад 2 4-Фтор-N-(2-метоксіетил)-N-метил-2-нітроанілін 1 Н ЯМР (CDCl3) dppm: 2,85 (3Н, с), 3,25-3,31 (5Н, м), 3,52 (2Н, т, J=5,6 Гц), 7,16-7,20 (2Н, м), 7,43-7,47 (1Н, м). Довідковий приклад 3 4-Фтор-N-ізобутил-N-метил-2-нітроанілін 1 Н ЯМР (CDCl3) dppm: 0,89 (3Н, с), 0,91 (3Н, с), 1,89-1,98 (1H, м), 2,81 (3Н, с), 2,92 (2Н, д, J=7,5 Гц), 7,15-7,20 (2Н, м), 7,42-7,46 (1Н, м). Довідковий приклад 4 4-Фтор-N-ізопропіл-N-метил-2-нітроанілін 1 Н ЯМР (CDCl3) dppm: 1,16 (3Н, с), 1,19 (3Н, с), 2,67 (3Н, с), 3,50-3,61 (1Н, м), 7,15-7,20 (2Н, м), 7,43-7,46 (1H, м). Довідковий приклад 5 4-Фтор-N-метил-2-нітро-N-пропіланілін 1 Н ЯМР (CDCl3) dppm: 0,84 (3Н, т, J=7,5 Гц), 1,51-1,66 (2Н, м), 2,77 (3Н, с), 3,00 (2Н, т, J=7,5 Гц), 7,05-7,20 (2Н, м), 7,44 (1H, дд, J=2,75 Гц, J=8,0 Гц). Довідковий приклад 6 4-Фтор-2-нітро-1-пропіилсульфанілбензол До розчину 2, 5-дифторнітробензолу (5,0 г, 31,4 ммоль) в N-Метилпіролідоні (NMP) (15 мл) додавали карбонат калію (5,0 г, 36,2 ммоль) і 1-пропантіол (2,7 г, 35,5 ммоль), і перемішували одержану суміш при 90 °C протягом 2 годин. Після охолодження реакційної суміші до кімнатної температури додавали воду (50 мл) і екстрагували продукт реакції етилацетатом (100 мл). Органічний шар промивали водою, і потім сушили над безводним сульфатом магнію. Одержаний сухий продукт концентрували при зниженому тиску, одержуючи при цьому 6,7 г порошкоподібного 4-фтор-2-нітро-1-пропілсульфанілбензолу жовтого кольору (вихід: 99 %). 1 H ЯМР (CDCl3) dppm: 1,06 (3Н, т, J=7,5 Гц), 1,68-1,83 (2Н, м), 2,89 (2H, т, 7,5 Гц), 7,27-7,42 (2Н, м), 7,89 (2Н, дд, J=2,75 Гц, J=8,5 Гц). Довідковий приклад 7 18 UA 98789 C2 5 10 15 20 25 30 35 40 45 50 55 60 1-трет-Бутокси-4-фтор-2-нітробензол Розчин трет-бутилату калію (3,55 г, 31,6 ммоль) у тетрагідрофурані (ТГФ) (20 мл) охолоджували на метанольно-крижаній бані, і потім додавали 4,2 г 2, 5-дифторнітробензолу (26,4 ммоль). Суміш нагрівали до кімнатної температури, перемішували протягом 96 годин і перемішували ще при 60 °C протягом 1 години. До реакційної суміші додавали воду (2 мл) і 2н хлористоводневу кислоту (2 мл) при охолодженні на бані із крижаною водою, і потім додавали воду. Одержану суміш екстрагували етилацетатом. Органічний шар концентрували при зниженому тиску, і залишок потім очищали колоночною хроматографією на силікагелі (нгексан:етилацетат=19:1). Очищений продукт концентрували при зниженому тиску, одержуючи при цьому 4,5 г олієподібного 1-трет-бутокси-4-фтор-2-нітробензолу жовтогарячого кольору (вихід: 80 %). 1 Н ЯМР (CDCl3) dppm: 1,38 (9Н, с), 7,18-7,20 (2Н, м), 7,47 (1H, д, J=1,1 Гц). Довідковий приклад 8 4-Фтор-2-нітро-1-пропоксибензол Розчин карбонату калію (3,48 г, 25,2 ммоль) і 1-йодпропану (3,95 г, 23,2 ммоль) в N, NДиметилформаміді (ДМФА) (3 мл) додавали до розчину 2-нітрофеноли (3,3 г, 21,0 ммоль) у ДМФА (7 мл). Суміш перемішували при кімнатній температурі протягом 48 годин. До реакційної суміші додавали воду й екстрагували одержану суміш етилацетатом. Органічний шар двічі промивали насиченим розчином хлориду натрію й концентрували при зниженому тиску. Залишок очищали колоночною хроматографією на силікагелі (н-гексан:етилацетат=9:1). Очищений продукт концентрували при зниженому тиску, одержуючи при цьому 4,03 г олієподібного 4-фтор-2-нітро-1-пропоксибензолу жовтого кольору (вихід: 96 %). 1 Н ЯМР (CDCl3) dppm: 1,06 (3Н, т, J=7,4 Гц), 1,78-1,92 (2Н, м), 4,04 (2Н, т, J=6,4 Гц), 7,04 (1Н, дд, J=4,3 Гц, J=9,2 Гц), 7,21-7,29 (1Н, м), 7,58 (1Н, дд, J=3,1 Гц, J=7,8 Гц). Сполуки наступних довідкових прикладів з 9 по 16 одержували способом, аналогічним наведеним вище довідковим прикладам з 7 по 8, з використанням відповідних вихідних речовин. Довідковий приклад 9 4-Фтор-1-ізопропокси-2-нітробензол 1 Н ЯМР (CDCl3) dppm: 1,36 (3Н, с), 4,54-4,63 (H, м), 7,02-7,05 (1H м). 7,18-7,26 (1H, м), 7,49 (1H, дд, J=3,0 Гц, J=7,5 Гц). Довідковий приклад 10 1-етокси-4-фтор-2-нітробензол 1 Н ЯМР (CDCl3) dppm: 1,44 (3Н, т, J=7,0 Гц), 4,08 (2Н, кВ, J=7,0 Гц), 7,02 (1Н, дд, J=4,25 Гц, J=9,25 Гц), 7,22-7,30 (1Н, м), 7,56 (1H, дд, J=3,25 Гц, J=7,75 Гц). Довідковий приклад 11 1-Циклопропілметокси-4-фтор-2-нітробензол 1 Н ЯМР (CDCl3) dppm: 0,36-0,41 (2Н, м), 0,61-0,69 (2Н, м), 1,22-1,28 (1Н, м), 3,95 (2Н, д, J=6,8 Гц), 7,04 (1H, дд, J=4,4 Гц, J=9,2 Гц), 7,20-7,27 (1Н, м), 7,57 (1Н, дд, )=3,1 Гц, J=7,8 Гц). Довідковий приклад 12 4-Фтор-2-нітро-1-(4,4,4-трифторбутокси)бензол 1 Н ЯМР (CDCl3) dppm: 2,04-2,16 (2Н, м), 2,31-2,44 (2H, м), 4,14 (2H, т, J=5,9 Гц), 7,04 (1Н, дд, J=4,3 Гц, J=9,2 Гц), 7,24-7,32 (1Н, м), 7,61 (1H, дд, J=3,2 Гц, J=7,8 Гц). Довідковий приклад 13 4-Фтор-1-(2-метоксіетокси)-2-нітробензол 1 Н ЯМР (CDCl3) dppm: 3,45 (3Н, с), 3,78 (2Н, т, J=4,8 Гц), 4,24 (2H, т, J=4,8 Гц), 7,12 (1Н, дд, J=4,4 Гц, J=9,2 Гц), 7,23-7,30 (1Н, м), 7,59 (1H, дд, J=3,1 Гц, J=7,8 Гц). Довідковий приклад 14 1-Циклопентокси-4-фтор-2-нітробензол 1 Н ЯМР (CDCl3) dppm: 1,62-1,66 (2Н, м), 1,83-1,94 (6Н, м), 4,82-4,86 (1Н, м), 7,04 (1Н, дд, J=4,4 Гц, J=9,3 Гц), 7,19-7,27 (1H, м), 7,54 (1Н, дд, J=3,2 Гц, J=7,8 Гц). Довідковий приклад 15 2-(1-Циклобутилметокси-4-фтор-2-нітробензол 1 Н ЯМР (CDCl3) dppm: 1,90-2,02 (4Н, м), 2,08-2,15 (2Н, м), 2,77-2,81 (1Н, м), 4,03 (2Н, д, J=6,2 Гц), 7,04 (1H, дд, J=4,3 Гц, J=9,2 Гц), 7,21-7,28 (1Н, м), 7,58 (1Н, дд, J=3,1 Гц J=7,8 Гц). Довідковий приклад 16 2-(4-Фтор-2-нітрофеноксиметил)тетрагідрофуран 1 Н ЯМР (CDCl3) dppm: 1,88-2,12 (4Н, м), 3,80-3,94 (2Н, м), 4,11 (2H, д, J=4,0 Гц), 4,27-4,32 (1H, м), 7,10 (1H, дд, J=4,4 Гц, J=9,3 Гц), 7,22-7,30 (1Н, м), 7,59 (1H, дд, J=3,1 Гц J=7,8 Гц). Довідковий приклад 17 2-[3-(4-Фтор-2-нітрофенокси)пропіл]ізоіндол-1,3-діон 19 UA 98789 C2 5 10 15 20 25 30 35 40 45 50 55 60 Карбонат калію (10,8 г, 78,1 ммоль) і N-(3-бромпропіл)фталімід (12,1 г, 45,1 ммоль) додавали до розчину 4-фтор-2-нітрофенолу (6,0 г, 38,2 ммоль) в N, N-Диметилформаміді (ДМФА) (80 мл) і перемішували суміш при 60 °C протягом 4 годин. Після охолодження реакційної суміші до кімнатної температури додавали воду (200 мл), і потім охолоджували реакційну суміш льодом. Нерозчинну речовину, що випала, виділяли фільтруванням. Після промивання водою (50 мл (3) речовина, що залишилася на фільтрі, сушили на повітрі, одержуючи 13,2 г порошкоподібного 2-[3-(2-нітрофенокси)пропіл]ізоиндол-1,3-діону блідожовтого кольору (вихід: 100 %). 1 Н ЯМР (CDCl3) dppm: 2,18-2,28 (2Н, м), 3,93 (2Н, т, J=6,5 Гц), 4,15 (2Н, т, J=6,0 Гц), 7,04 (1H, дд, J=4,3 Гц, J=9,2 Гц), 7,23-7,28 (1Н, м), 7,58 (1H, дд, J=3,1 Гц, J=7,8 Гц), 7,69-7,74 (2Н, м), 7,817,85 (2Н, м). Довідковий приклад 18 3-(4-Фтор-2-нітрофенокси)пропіламін 6,5 г 2-[3-(4-фтор-2-нітрофенокси)пропіл]ізоіндол-1,3-діону суспендували в етанолі (140 мл) і додавали до одержаної суспензії гідразингідрат (3,0 мл). Суміш перемішували протягом 3,5 годин при кип'ятінні зі зворотним холодильником. Реакційну суміш охолоджували до кімнатної температури й концентрували при зниженому тиску. До залишку додавали 13 мл 5н водного розчину гідроксиду натрію й екстрагували одержану суміш дихлорметаном. Органічний шар промивали насиченим розчином хлориду натрію, і потім сушили над безводним сульфатом магнію. Одержаний сухий продукт концентрували при зниженому тиску, одержуючи при цьому 4,03 г олієподібного 3-(4-фтор-2-нітрофенокси)пропіламіну червоно-жовтогарячого кольору (вихід: 100 %). 1 Н ЯМР (CDCl3) dppm: 1,92-2,02 (2Н, м), 2,94 (2H, т, J=6,5 Гц), 4,19 (2Н, т, J=5,9 Гц), 7,07 (1H, дд, J=4,3 Гц, J=9,2 Гц), 7,22-7,30 (1H, м), 7,59 (1Н, дд, J=3,1 Гц, J=7,8 Гц). Довідковий приклад 19 N-[3-(4-фтор-2-нітрофенокси)пропіл]ацетамід До розчину 3-(4-фтор-2-нітрофенокси)пропіламіну (2,0 г, 9,33 ммоль) у дихлорметані додавали піридин (1,5 мл, 18,6 ммоль) і оцтовий ангідрид (0,97 г, 10,3 ммоль) при охолодженні льодом, і потім додавали ще дихлорметан (4 мл). Одержану суміш перемішували при кімнатній температурі протягом 15 годин. До реакційної суміші додавали 2н хлористоводневу кислоту (9,5 мл) і переміщували дану суміш. До суміші додавали воду й екстрагували одержану суміш дихлорметаном. Після промивання насиченим водним розчином хлориду натрію органічний шар концентрували при зниженому тиску. Після цього залишок очищали колоночною хроматографією на силікагелі (дихлорметан: метанол=30:1→20:1). Очищений продукт концентрували при зниженому тиску, одержуючи при цьому 2,13 г олієподібного N-[3-(4-фтор-2нітрофенокси)пропіл]ацетаміду жовтого кольору (вихід: 89 %). 1 Н ЯМР (CDCl3) dppm: 2,04 (3Н, с), 2,03-2,12 (2Н, м), 3,48-3,55 (2Н, м), 4,20 (2Н, т, J=5,5 Гц), 6,56 (1Н, ушир.с), 7,08 (1Н, дд, J=4,3 Гц, J=9,3 Гц), 7,26-7,36 (1H, м), 7,70 (1Н, дд, J=3,2 Гц, J=7,8 Гц). Довідковий приклад 20 N-[3-(4-Фтор-2-нітрофенокси)пропіл]метансульфонамід До розчину 3-(4-фтор-2-нітрофенокси)пропіламіну (2,0 г, 9,33 ммоль) у дихлорметані додавали, при охолодженні льодом, піридин (1,5 мл, 18,6 ммоль) і метансульфонілхлорид (0,8 мл, 10,3 ммоль) і додавали ще метилхлорид (4 мл). Одержану суміш перемішували при кімнатній температурі протягом 24 годин і додатково додавали до неї метансульфонілхлорид (0,12 мл, 1,5 ммоль), і потім суміш перемішували при кімнатній температурі протягом 15 годин. До реакційної суміші додавали 2н хлористоводневу кислоту (9,5 мл) і екстрагували суміш дихлорметаном. Після промивання насиченим водним розчином хлориду натрію органічний шар концентрували при зниженому тиску, і залишок потім очищали колоночною хроматографією на силікагелі (н-гексан: етилацетат=4:1→1:1). Очищений продукт концентрували при зниженому тиску, одержуючи при цьому 1,2 г олієподібного N-[3-(4-фтор-2нітрофенокси)пропіл]метансульфонаміду жовто-жовтогарячого кольору (вихід: 44 %). 1 Н ЯМР (CDCl3) dppm: 2,09-2,18 (2Н, м), 3,00 (3Н, с), 3,39-3,46 (2Н, м), 4,23 (2Н, т, J=5,6 Гц), 5,00 (1H, ушир.с), 7,09 (1Н, дд, J=4,3 Гц, J=9,2 Гц), 7,26-7,35 (1Н, м), 7,66 (1Н, дд, J=3,1 Гц, J=7,8 Гц). Довідковий приклад 21 Феніл[3-(4-фтор-2-нітрофенокси)пропіл]карбамат До розчину 3-(4-фтор-2-нітрофенокси)пропіламіну (4,03 г, 18,8 ммоль) у діоксані (43 мл) додавали триетиламін (2,90 мл, 21,4 ммоль) і фенілхлоркарбонат (2,52 мл, 20,0 мл) при охолодженні льодом, і перемішували суміш при кімнатній температурі протягом 0,5 години. 20 UA 98789 C2 5 10 15 20 25 30 35 40 45 50 55 60 Реакційну суміш концентрували при зниженому тиску, і залишок потім очищали колоночною хроматографією на силікагелі (дихлорметан:етилацетат=30:1). Очищений продукт концентрували досуха при зниженому тиску, одержуючи при цьому 5,92 г порошкоподібного феніл[3-(4-фтор-2-нітрофенокси)пропіл]карбамату жовтого кольору (вихід: 94 %). 1 H ЯМР (CDCl3) dppm: 2,09-2,18 (2Н, м), 3,48-3,56 (2Н, м), 4,21 (2Н, т, J=5,7 Гц), 5,69 (1H, ушир.с), 7,05-7,20 (4Н, м), 7,26-7,37 (3Н, м), 7,65 (1H, дд, J=3,1 Гц, J=7,8 Гц). Довідковий приклад 22 3-[3-(4-Фтор-2-нітрофенокси)пропіл]-1,1-диметилсечовина До розчину феніл[3-(4-фтор-2-нітрофенокси)пропіл]карбамату (5,89 г, 17,6 ммоль) у ДМФА (25 мл) додавали 50 %-ний водний розчин диметиламіну (2,5 мл) і перемішували суміш при кімнатній температурі протягом 24 годин. До реакційної суміші додавали воду й екстрагували одержану суміш етилацетатом. Органічний шар двічі промивали насиченим водним розчином хлориду натрію й концентрували при зниженому тиску. Після цього залишок очищали колоночною хроматографією на силікагелі (дихлорметан:етилацетат=19:1→4:1(2:1). Очищений продукт концентрували досуха при зниженому тиску, одержуючи при цьому 4,10 г олієподібної 3-[3-(4-фтор-2-нітрофенокси)пропіл]-1,1-диметилсечовини блідо-жовтого кольору (вихід: 82 %). 1 Н ЯМР (CDCl3) dppm: 2,03-2,12 (2Н, м), 2,89 (6Н, с), 3,42-3,49 (2H, м), 4,17 (2Н, т, J=5,8 Гц), 4,85 (1Н, ушир.с), 7,09 (1H, дд, J=4,3 Гц, J=9,3 Гц), 7,24-7,32 (1Н, м), 7,61 (1H, дд, J=3,2 Гц, J=7,8 Гц). Довідковий приклад 23 1-[3-(4-Фтор-2-нітрофенокси)пропіл1-1,3,3-триметилсечовина До розчину 2,0 г -[3-(4-фтор-2-нітрофенокси)пропіл]-1,1-диметилсечовини (7,0 ммоль) у ДМФА (9 мл) додавали гідрид натрію (55 % у маслі) (396 мг, 9,1 ммоль), при охолодженні льодом, і перемішували суміш при кімнатній температурі протягом 5 хвилин. До суміші додавали йодистий метил (0,735 мл, 11,8 ммоль) і перемішували одержану суміш при кімнатній температурі протягом 48 годин. До реакційної суміші додавали воду й проводили екстракцію етилацетатом. Після промивання насиченим водним розчином хлориду натрію органічний шар концентрували при зниженому тиску. Залишок очищали колоночною хроматографією на силікагелі (дихлорметан:етилацетат=9:1→6:1). Очищений продукт концентрували при зниженому тиску, одержуючи при цьому 0,83 г олієподібної 1-[3-(4-фтор-2-нітрофенокси)пропіл]1,3,3-триметилсечовини блідо-жовтого кольору (вихід: 40 %). 1 Н ЯМР (CDCl3) dppm: 2,04-2,14 (2Н, м), 2,76 (6Н, с), 2,83 (3Н, с), 3,38 (2Н, т, J=6,9 Гц), 4,09 (2Н, т, J=5,9 Гц), 7,04 (1H, дд, J=4,3 Гц, J=9,3 Гц), 7,22-7,30 (1Н, м), 7,60 (1Н, дд, J=3,1 Гц, J=7,7 Гц). Довідковий приклад 24 5-Фтор-2-пропоксіанілін 4-Фтор-2-нітро-1-пропоксибензол (2,0 г, 10,0 ммоль) і 5 % паладію на вугіллі (750 мг) додавали до етанолу (30 мл). Каталітичну реакцію проводили при кімнатній температурі й атмосферному тиску (нормальному тиску). Каталізатор видаляли фільтруванням через метил, а фільтрат концентрували при зниженому тиску. Залишок розчиняли в дихлорметані й сушили над безводним сульфатом магнію. Одержаний сухий продукт концентрували при зниженому тиску, одержуючи при цьому 1,45 г олієподібного 5-фтор-2-пропоксіаніліну червоножовтогарячого кольору (вихід: 86 %). 1 Н ЯМР (CDCl3) dppm: 1,04 (3Н, т, J=7,4 Гц), 1,74-1,88 (2Н, м), 3,89 (2Н, ушир.с), 3,90 (2Н, т, J=6,5 Гц), 6,31-6,46 (2Н, м), 6,66 (1H, дд, J=5,1 Гц, J=8,7 Гц). Сполуки наступних довідкових прикладів з 25 по 42 одержували способом, аналогічним описаному вище способу довідкового прикладу 24, при використанні відповідних вихідних сполук. Довідковий приклад 25 5-Фтор-2-ізопропоксіанілін 1 Н ЯМР (CDCl3) dppm: 1,32 (3Н, с), 1,35 (3Н, с), 3,88 (2Н, ушир.с), 4,38-4,48 (1Н, м), 6,31-6,46 (2Н, м), 6,68-6,73 (1Н, м). Довідковий приклад 26 2-етокси-5-фторанілін 1 Н ЯМР (CDCl3) dppm: 1,39 (3Н, т, J=7,0 Гц), 3,90 (2Н, ушир.с), 3,97 (2Н, кВ, J=7,0 Гц), 6,316,46 (2Н, м), 6,63-6,68 (1Н, м). Довідковий приклад 27 5-Фтор-2-морфолін-4-іланілін 1 H ЯМР (CDCl3) dppm: 2,83 (4Н, т, J=4,6 Гц), 3,81 (4Н, т, J=4,6 Гц), 4,13 (2Н, ушир.с), 6,386,45 (2Н, м), 6,93-6,97 (1Н, м). 21 UA 98789 C2 5 10 15 20 25 30 35 40 45 50 55 60 Довідковий приклад 28 5-Фтор-2-піролідин-1-іланілін 1 Н ЯМР (CDCl3) dppm: 1,88-1,94 (4Н, м), 2,94-3,00 (4Н, м), 4,03 (2Н, ушир.с), 6,35-6,46 (2Н, м), 6,90-6,95 (1Н, м). Довідковий приклад 29 2-Циклопропілметокси-5-фторанілін 1 Н ЯМР (CDCl3) dppm: 0,29-0,35 (2Н, м), 0,58-0,65 (2Н, м), 1,22-1,29 (1Н, м), 3,77 (2Н, д, J=6,9 Гц), 3,94 (2Н, ушир.с), 6,29-6,46 (2Н, м), 6,64 (1H, дд, J=5,1 Гц, J=8,8 Гц). Довідковий приклад 30 1 1 N -Циклогексил-4-фтор-N -метилбензол-1,2-діамін 1 Н ЯМР (CDCl3) dppm: 1,11-1,31 (4Н, м), 1,55-1,82 (6Н, м), 2,57-2,68 (4H, м), 4,18 (2Н, ушир.с), 6,33-6,44 (2Н, м), 6,92-6,98 (1H, м). Довідковий приклад 31 1 1 4-Фтор-N -(2-метоксіетил)-N -метилбензол-1,2-діамін 1 Н ЯМР (CDCl3) dppm: 2,70 (3Н, с), 2,96 (2Н, т, J=5,4 Гц), 3,39 (3Н, с), 3,45 (2Н, т, J=5,4 Гц), 4,38 (2Н, ушир.с), 6,33-6,43 (2Н, м), 6,93-6,99 (1Н, м). Довідковий приклад 32 1 1 4-Фтор-N -ізобутил-N -метилбензол-1,2-діамін ` Н ЯМР (CDCl3) dppm: 0,92 (3Н, с), 0,94 (3Н, с), 1,62-1,83 (1Н, м), 2,54-2,60 (5Н, м), 6,30-6,49 (2Н, м), 6,82-6,93 (1Н, м). Довідковий приклад 33 1 1 4-Фтор-N -ізопропіл-N -метилбензол-1,2-діамін 1 H ЯМР (CDCl3) dppm: 1,05 (3Н, с), 1,07 (3Н, с), 2,55 (3Н, с), 3,06-3,17 (1Н, м), 4,16 (2Н, ушир.с), 6,34-6,45 (2Н, м), 6,91-6,97 (1H, м). Довідковий приклад 34 1 1 4-Фтор-N -метил-N -пропілбензол-1,2:діамін 1 Н ЯМР (CDCl3) dppm: 0,86 (3Н, т, J=7,4 Гц), 1,41-1,56 (2Н, м), 2,57 (3Н, с), 2,72 (2Н, т, J=7,25 Гц), 4,18 (2Н, ушир.с), 6,35-6,44 (2Н, м), 6,91-6,97 (1Н, м). Довідковий приклад 35 N-[3-(2-Аміно-4-фторфенокси)пропіл]ацетамід 1 Н ЯМР (CDCl3) dppm: 1,95-2,05 (2Н, м), 1,97 (3Н, с), 3,42-3,50 (2Н, м), 3,92 (2Н, ушир.с), 4,02 (2Н, т, J=5,9 Гц), 5,83 (1Н, ушир.с), 6,32-6,47 (2H, м), 6,68 (1H, дд, J=5,0 Гц, J=8,8 Гц). Довідковий приклад 36 N-[3-(2-Аміно-4-фторфенокси)пропіл]метансульфонамід 1 Н ЯМР (CDCl3) dppm: 2,02-2,11 (2Н, м), 2,94 (3Н, с), 3,33-3,40 (2Н, м), 3,91 (2Н, ушир.с), 4,07 (2Н, т, J=5,7 Гц), 4,76 (1Н, ушир.с), 6,32-6,46 (2Н, м), 6,68 (1H, дд, J=5,0 Гц, J=8,8 Гц). Довідковий приклад 37 5-Фтор-2-(4,4,4-трифторбутокси)анілін 1 Н ЯМР (CDCl3) dppm: 2,01-2,12 (2Н, м), 2,22-2,41 (2Н, м), 3,87 (2Н, ушир.с), 4,01 (2Н, т, J=6,0 Гц), 6,32-6,47 (2Н, м), 6,65 (1Н, дд, J=5,0 Гц, J=8,8 Гц). Довідковий приклад 38 1-[3-(2-Аміно-4-фторфенокси)пропіл1-1,3,3-триметилсечовина 1 Н ЯМР (CDCl3) dppm: 1,99-2,10 (2Н, м), 2,78 (6Н, с), 2,84 (3Н, с), 3,37 (2Н, т, J=6,9 Гц), 3,94 (2Н, ушир.с), 3,97 (2Н, т, J=6,1 Гц), 6,30-6,45 (2Н, м), 6,65 (1Н, дд, J=5,1 Гц, J=8,8 Гц). Довідковий приклад 39 5-Фтор-2-(2-метоксіетоксі)анілін 1 Н ЯМР (CDCl3) dppm: 3,43 (3Н, с), 3,70-3,73 (2Н, м), 3,99 (2Н, ушир.с), 4,07-4,10 (2Н, м), 6,30-6,45 (2Н, м), 6,72 (1H, дд, J=5,1 Гц, J=8,7 Гц). Довідковий приклад 40 2-Циклопентокси-5-фторанілін 1 Н ЯМР (CDCl3) dppm: 1,56-1,66 (2Н, м), 1,75-1,87 (6Н, м), 3,85 (2H, ушир.с), 4,69-4,72 (1Н, м), 6,30-6,45 (2Н, м), 6,66 (1Н, дд, J=5,1 Гц, J=8,8 Гц). Довідковий приклад 41 2-Циклобутилметокси-5-фторанілін 1 Н ЯМР (CDCl3) dppm: 1,86-1,96 (4Н, м), 2,08-2,16 (2Н, м), 2,74-2,80 (1Н, м), 3,90 (2Н, ушир.с), 3,91 (2Н, д, J=6,7 Гц), 6,31-6,45 (2Н, м), 6,66 (1Н, дд, J=5,1 Гц, J=8,8 Гц). Довідковий приклад 42 2-Третбутокси-5-фторанілін 1 Н ЯМР (CDCl3) dppm: 1,37 (9Н, с), 3,87 (2Н, ушир.с), 6,27-6,45 (2Н, м), 6,85 (1Н, дд, J=5,6 Гц, J=8,8 Гц). 22 UA 98789 C2 5 10 15 20 25 30 35 40 45 50 55 Довідковий приклад 43 5-Фтор-2-пропілсульфаніланілін 4-Фтор-2-нітро-1-пропілсульфанілбензол (6,7 г, 31,1 ммоль) розчиняли в суміші розчинників етанолу (40 мл) і води (4 мл). До одержаної суміші додавали хлорид амонію (17 г, 0,32 моль), і потроху додавали порошкоподібний цинк (20 г, 0,31 моль). Після цього одержану суміш перемішували при кімнатній температурі протягом 1 години. Нерозчинну речовину видаляли фільтруванням, і фільтрат концентрували при зниженому тиску, одержуючи при цьому 5,8 г олієподібного 5-фтор-2-пропілсульфаніланіліну коричневого кольору (вихід: 93 %). 1 Н ЯМР (CDCl3) dppm: 0,96 (3Н, т, J=7,3 Гц), 1,49-1,64 (2Н, м), 2,62 (2Н, т, J=7,4 Гц), 4,51 (2H, ушир.с), 6,35-6,47 (2Н, м), 7,32-7,38 (1Н, м). Довідковий приклад 44 4,5-Дифтор-2-пропоксіанілін До розчину 1-бром-4,5-дифтор-2-пропоксибензола (3,0 г, 11,9 ммоль) у толуолі (60 мл) додавали розчин бензофеноніміну (2,38 г, 13,1 ммоль), трис(дибензиліденацетон)дипаладію (275 мг, 0,3 ммоль), 9,9-диметил-4,5-біс(дифенілфосфіно)ксантену (XANTPHOS) (347 мг, 0,6 ммоль) і карбонату цезію (5,83 г, 17,9 ммоль) у толуолі (20 мл). Суміш перемішували в атмосфері азоту при 100 °C протягом 23 годин. Після охолодження реакційної суміші до кімнатної температури додавали воду й насичений водний розчин хлориду амонію. Одержанусуміш екстрагували етилацетатом. Органічний шар сушили над безводним сульфатом магнію, і потім концентрували при зниженому тиску. Залишок розчиняли в діетиловому ефірі (60 мл) і додавали концентровану хлористоводневу кислоту (10 мл) до одержаного розчину, що після цього перемішували протягом 2 годин. До реакційної суміші додавали 5н водний розчин гідроксиду натрію (24 мл) для одержання рн=11 і концентрували при зниженому тиску. Залишок розчиняли в дихлорметані й промивали насиченим водним розчином хлориду натрію. Органічний шар концентрували при зниженому тиску. Після цього залишок очищали колоночною хроматографією на силікагелі (н-гексан:етилацетат=9:1). Очищений продукт концентрували при зниженому тиску, одержуючи при цьому 850 мг олієподібного 4,5-дифтор-2пропоксіаніліну темно-коричневого кольору (вихід: 38 %). 1 Н ЯМR (CDCl3) dppm: 1,04 (3Н, т, J=7,4 Гц), 1,75-1,86 (2Н, м), 3,71 (2Н, ушир.с), 3,88 (2Н, т, J=6,5 Гц), 6,51 (1Н, дд, J=8,0 Гц, 11,5 Гц), 6,60 (1Н, дд, J=7,3 Гц, J=11,8 Гц). Довідковий приклад 45 1-(2-Аміно-4-фторбензоїл)піролідин До розчину 4-фторантранілової кислоти (2,0 г, 12,8 ммоль) у ДМФА (4 мл) додавали розчин піролідину (1,93 г, 27,1 ммоль) у ДМФА (4 мл), розчин триетиламіну (3,79 г, 37,5 ммоль) у ДМФА (4 мл), 1-гідроксибензотриазол (HOBt) (3,11 г, 23,0 ммоль) і гідрохлорид 1-(3диметиламінопропіл)-3-етилкарбодіїміду (WSC) (3,91 г, 20,4 ммоль) у даному порядку. Суміш перемішували при кімнатній температурі протягом 14 годин. До реакційної суміші додавали воду й екстрагували одержану суміш етилацетатом. Органічний шар промивали насиченим водним розчином хлориду натрію, і потім концентрували при зниженому тиску. Після цього залишок очищали колоночною хроматографією на силікагелі (дихлорметан:метанол=30:1). Очищений продукт концентрували при зниженому тиску, одержуючи при цьому 1,65 г олієподібного 1-(2-аміно-4-фторбензоїл)піролідину жовтогарячого кольору (вихід: 62 %). 1 Н ЯМР (CDCl3) dppm: 1,75-2,00 (4Н, м), 3,40-3,75 (4Н, м), 4,85 (2Н, ушир.с), 6,33-6,40 (2Н, м), 7,14-7,21 (1H, м). Довідковий приклад 46 Етил α-(гідроксиметилен)-4-метоксифенілацетат До розчину етил 4-метоксифенілацетату (2,0 г, 10,3 ммоль) у бензолі (10 мл) додавали гідрид натрію (60 % у маслі) (467 мг, 11,7 ммоль) при охолодженні льодом. Суміш перемішували при кімнатній температурі протягом 5 хвилин. Суміш, що перемішується, знову охолоджували льодом; додавали до неї етилформіат (1,02 мл, 12,6 ммоль) і перемішували при кімнатній температурі протягом 3 годин. При охолодженні льодом додавали до реакційної суміші воду й етилацетат, і потім додавали 2н хлористоводневу кислоту (6 мл) для поділу реакційної суміші на два шари. Органічний шар концентрували при зниженому тиску, і залишок потім очищали колоночною хроматографією на силікагелі (н-гексан:етилацетат=4:1). Очищений продукт концентрували при зниженому тиску, одержуючи при цьому 1,97 г олієподібного α(гідроксиметилен)-4-метоксифенілацетату злегка червоно-коричневого кольору (вихід: 86 %). Одержана сполука піддається заміщенню азоту й зберігалася в морозилці. 1 Н ЯМР (CDCl3) dppm: 1,28 (3Н, т, J=7,1 Гц), 3,81 (3Н, с), 4,28 (2Н, кВ, J=7,1 Гц), 6,87 (2Н, д, J=8,8 Гц), 7,16-7,26 (3Н, м), 12,02 (1Н, д, J=12,5 Гц). 23 UA 98789 C2 5 10 15 20 25 30 35 40 45 50 55 Сполуки наступних довідкових прикладів з 47 по 57 одержували способом, аналогічним описаному вище способу довідкового прикладу 46, при використанні відповідних вихідних сполук. Довідковий приклад 47 Етил 2,4-диметокси- -(гідроксиметилен)фетлацетат 1 Н ЯМР (CDCl3) dppm: 1,21 (3Н, т, J=7,1 Гц), 3,76 (3Н, с), 3,81 (3Н, с), 4,22 (2H, кВ, J=7,1 Гц), 6,43-6,49 (2Н, м), 7,00 (1Н, д, J=8,9 Гц), 7,12 (1Н, д, J=12,6 Гц), 11,89 (1Н, д, J=12,6 Гц). Довідковий приклад 48 Етил 2,4-дихлор- -(гідроксиметилен)фенілацетат 1 Н ЯМР (CDCl3) dppm: 1,15 (3Н, т, J=7,2 Гц), 4,22 (2Н, кВ, J=7,2 Гц), 7,11-7,26 (3Н, м), 7,407,43 (1Н, м), 12,00 (1Н, д, J=12,2 Гц). Довідковий приклад 49 Етил -(гідроксиметилен)-2-метоксифенілацетат 1 Н ЯМР (CDCl3) dppm: 1,19 (3Н, т, J=7,1 Гц), 3,79 (3Н, с), 4,21 (2Н, кВ, J=7,1 Гц), 6,86-7,68 (5Н, м), 11,91 (1H, д, J=12,3 Гц). Довідковий приклад 50 Етил -(гідроксиметилен)-2-ізопропокси-4-метоксифенілацетат 1 Н ЯМР (CDCl3) dppm: 1,20-1,31 (9Н, м), 3,80 (3Н, с), 4,17 (2Н, кВ, J=7,1 Гц), 4,43-4,47 (1Н, м), 6,42-6,46 (2Н, м), 6,90-7,12 (2Н, м), 11,85 (1Н, д, J=12,6 Гц). Довідковий приклад 51 Етил -(гідроксиметилен)-4-метокси-2-метилфенілацетат 1 Н ЯМР (CDCl3) dppm: 1,20 (3Н, т, J=7,2 Гц), 2,19 (3Н, с), 3,80 (3Н, с), 4,22 (2Н, кВ, J=1,2 Гц), 6,54-6,75 (2Н, м), 7,02-7,26 (2Н, м), 11,94 (1Н, д, J=12,7 Гц). Довідковий приклад 52 Етил 2-фтор- -(гідроксиметилен)-4-метоксифенілацетат 1 Н ЯМР (CDCl3) dppm: 1,22 (3Н, т, J=7,1 Гц), 3,80 (3Н, с), 4,21 (2Н, кВ, J=7,1 Гц), 6,61-6,69 (2Н, м), 7,03-7,26 (2Н, м), 12,05 (1Н, д, J=12,3 Гц). Довідковий приклад 53 Етил 4-етокси- -(гідроксиметилен)-2-метоксифенілацетат 1 Н ЯМР (CDCl3) dppm: 1,19-1,45 (6Н, м), 3,75 (3Н, с), 4,00-4,26 (4Н, м), 6,42-6,48 (2Н, м), 6,977,26 (2Н, м), 11,86 (1Н, д, J=12,3 Гц). Довідковий приклад 54 Етил -(гідроксиметилен)-4-ізоітропокси-2-метоксифенілацегат 1 Н ЯМР (CDCl3) dppm: 1,20-1,31 (9Н, м), 3,75 (3Н, с), 4,16 (2Н, кВ, J=7,2 Гц), 4,43-4,47 (1Н, м), 6,43-6,48 (2Н, м), 6,99-7,22 (2Н, м), 11,87 (1Н, д, J=12,3 Гц). Довідковий приклад 55 Етил 4-циклопропілметокси- -(гідроксиметилен)фенілацетат 1 Н ЯМР (CDCl3) dppm: 0,35-0,37 (4Н, м), 1,24 (3Н, т, J=7,1 Гц), 3,81-3,83 (2Н, м), 4,25 (2Н, кВ, J=1,1 Гц), 6,85-6,91 (2Н, м), 7,16-7,27 (3Н, м), 12,02 (1H, д, J=12,5 Гц). Довідковий приклад 56 Етил -(гідроксиметилен)-4-метилсульфанилфенілацетат 1 Н ЯМР (CDCl3) dppm: 1,22 (3Н, т, J=7,1 Гц), 2,47 (3Н, с), 4,09 (2Н, кВ, J=7,1 Гц), 6,85-6,94 (2Н, м), 7,16-7,26 (3Н, м), 11,99 (1H, д, J=12,3 Гц). Довідковий приклад 57 Етил 4-етокси- -(гідроксиметилен)фенілацетат 1 Н ЯМР (CDCl3) dppm: 1,23-1,47 (6Н, м), 4,00-4,32 (4Н, м), 6,85-6,88 (2H, м), 7,15-7,27 (3Н, м), 12,00 (1H, д, J=12,5 Гц). Довідковий приклад 58 Етил 4-метокси- -пропіонилфенілацетат До розчину етилпропіонілацетату (3,8 г, 26,3 ммоль) і 4-йоданізолу (5,0 г, 21,3 ммоль) у диметилсульфоксиді (ДМСО) (40 мл) додавали L-Пролін (980 мг, 8,52 ммоль), йодид міді(І) (810 мг, 4,26 ммоль) і карбонат цезію (27,7 г, 85,2 ммоль) у даному порядку. Суміш перемішували в атмосфері азоту при температурі від 40 до 45 °C протягом 27 годин. Реакційну суміш охолоджували до кімнатної температури, і потім додавали воду й водний розчин хлориду амонію. Одержану суміш екстрагували етилацетатом. Органічний шар двічі промивали насиченим водним розчином хлориду натрію й концентрували при зниженому тиску. Після цього залишок очищали колоночною хроматографією на силікагелі (н-гексан:етилацетат=19:1→8:1). Очищений продукт концентрували при зниженому тиску, одержуючи при цьому 2,97 г олієподібного 4-метокси- -пропіонілфенілацетату жовтого кольору (вихід: 56 %). 24 UA 98789 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 Н ЯМР (CDCl3) dppm: 1,01-1,11 (3Н, м), 1,18-1,31 (3Н, м), 2,52-2,61 (2Н, м), 3,80 і 3,82 (3Н, с), 4,15-4,24 (2Н, м), 4,65 (0,6Н, с), 6,84-7,28 (4Н, м), 13,13 (0,4Н, с). Сполуку наступного довідкового прикладу 59 одержували способом, аналогічним описаному вище способу довідкового прикладу 58, при використанні відповідних вихідних сполук. Довідковий приклад 59 Етил -ацетил-4-метоксифенілацетат 1 Н ЯМР (CDCl3) dppm: 1,16-1,29 (3Н, м), 1,85 (1,4H, с), 2,17 (1,6Н, с), 3,80 і 3,82 (1,4 і 1,6Н, с), 4,13-4,25 (2Н, м), 4,62 (0,6Н, с), 6,85-7,28 (4Н, м), 13,09 (0,4Н, с). Довідковий приклад 60 5-[(5-Фтор-2-пропоксифеніламіно)метилен]-2,2-диметил[1,3]діоксан-4,6-діон До метилортоформіату (31 мл) додавали кислоту Мелдрума (5,29 г, 36,7 ммоль) і перемішували суміш протягом 2 годин при кип'ятінні зі зворотним холодильником. Одержану суміш охолоджували до 50 °C і додавали до неї 5-фтор-2-пропоксіанілін (4,28 г, 25,3 ммоль) і метилортоформіат (3 мл). Одержану суміш перемішували протягом 6 годин при кип'ятінні зі зворотним холодильником. Після цього одержану реакційну суміш охолоджували до кімнатної температури й концентрували при зниженому тиску. Залишок перекристалізували з метанолу, одержуючи при цьому 7,61 г порошкоподібного 5-[(5-фтор-2-пропоксифеніламіно)метилен]-2,2диметил[1,3]діоксан-4,6-діону блідо-коричневого кольору (вихід: 93 %). 1 Н ЯМР (CDCl3) dppm: 1,12 (3Н, т, J=7,4 Гц), 1,75 (6Н, с), 1,85-1,98 (2Н, м), 4,02 (2Н, т, J=6,3 Гц), 6,86-6,91 (2Н, м), 7,06-7,10 (1Н, м), 8,60 (1Н, д, J=14,6 Гц), 11,68 (1Н, д, J=14,8 Гц). Сполуку наступного довідкового прикладу 61 одержували способом, аналогічним описаному вище способу довідкового прикладу 60, при використанні відповідних вихідних сполук. Довідковий приклад 61 5-[(2-Циклопропілметокси-5-фторфеніламіно)метилен]-2,2-диметил[1,3]діоксан-4,6-діон 1 Н ЯМР (CDCl3) dppm: 0,39-0,43 (2Н, м), 0,65-0,73 (2Н, м), 1,31-1,37 (1H, м), 1,75 (6Н, с), 3,92 (2Н, д, J=6,9 Гц), 6,86-6,91 (2Н, м), 7,07-7,11 (1H, м), 8,60 (1H, д, J=14,5 Гц), 11,69 (1H, д, J=14,3 Гц). Довідковий приклад 62 5-Фтор-8-пропокси-1H-хінолін-4-он 5-[(5-Фтор-2-пропоксифеніламіно)метилен]-2,2-диметил-[1,3]-діоксан-4,6-діон (7,6 г, 23,5 ммоль) додавали до дифенілового ефіру (15 мл) і нагрівали суміш за допомогою колбонагрівача, і потім залишали при кипінні зі зворотним холодильником на 2 години. Після охолодження реакційної суміші до кімнатної температури додавали етилацетат (5 мл) і н-гексан (10 мл). Одержану суміш перемішували й виділяли одержану нерозчинну речовину фільтруванням. Фільтрат перекристалізовували із суміші розчинників етилацетат-н-гексан, одержуючи при цьому 3,15 г порошкоподібного 5-фтор-8-пропокси-1Н-хінолін-4-ону темнокоричневого кольору (вихід: 61 %). 1 Н ЯМР (ДМСО-d6) dppm: 1,03 (3Н, т, J=7,3 Гц), 1,74-1,88 (2Н, м), 4,07 (2Н, т, J=6,4 Гц), 5,97 (1Н, д, J=7,4 Гц), 6,87 (1Н, дд, J=8,8 Гц, 11,9 Гц), 7,13 (1Н, дд, J=4,0 Гц, J=8,8 Гц), 7,70 (1Н, т, J=1,2 Гц), 11,07 (1Н, ушир.с). Сполуку наступного довідкового прикладу 63 одержували способом, аналогічним описаному вище способу довідкового прикладу 62, при використанні відповідних вихідних сполук. Довідковий приклад 63 8-Циклопропілметокси-5-фтор-1Н-хінолін-4-он 1 Н ЯМР (ДМСО-d6) dppm: 0,34-0,40 (2Н, м), 0,55-0,61 (2Н, м), 1,27-1,33 (1Н, м), 3,98 (2Н, д, J=7,0 Гц), 5,97 (1Н, д, J=7,4 Гц), 6,86 (1Н, дд, J=8,8 Гц, J=11,9 Гц), 7,13 (1Н, дд, J=4,0 Гц, J=8,8 Гц), 7,71 (1Н, т, J=7,4 Гц), 11,10 (1Н, ушир.с). Довідковий приклад 64 5-Фтор-2-метил-8-пропокси-1Н-хінолін-4-он До розчину 5-фтор-2-пропоксіаніліну (10 г, 59 ммоль) і етилацетоацетату (7,7 г, 59 ммоль) у бензолі (200 мл) додавали Amberlyst 15 (1,0 г, продукт Sigma Aldrich Corp.). Суміш перемішували при кип'ятінні зі зворотним холодильником протягом 6 годин і використанні насадки Діна-Старка. Реакційну суміш охолоджували до кімнатної температури, смолу видаляли фільтруванням, і фільтрат концентрували при зниженому тиску. До залишку додавали дифеніловий ефір (20 мл). Суміш нагрівали за допомогою колбонагрівача й перемішували при кипінні зі зворотним холодильником протягом 2 годин. Після охолодження реакційної суміші до кімнатної температури нерозчинну речовину, одержана в результаті додавання суміші н-гексанетилацетат (2:1), виділяли фільтруванням, речовина, Що Залишилася на фільтрі, промивали сумішшю н-гексан-етилацетат (2:1) і сушили, одержуючи при цьому 6,0 г порошкоподібного 5фтор-2-метил-8-пропокси-1Н-хінолін-4-ону блідо-жовтого кольору (вихід: 43 %). 25 UA 98789 C2 1 5 10 15 20 25 30 35 40 45 50 55 Н ЯМР (ДМСО-d6) dppm: 0,97 (3Н, т, J=7,3 Гц), 1,77-1,87 (2Н, м), 2,34 (3Н, с), 4,08 (2H, т, J=6,4 Гц), 5,84 (1Н, с), 6,79-6,88 (1Н, м), 7,10-7,14 (1Н, м), 10,58 (1Н, у шир. с). Довідковий приклад 65 5-Фтор-3-йод-8-пропокси-1Н-хінолін-4-он 5-Фтор-8-пропокси-1Н-хінолін-4-он (1,0 г, 4,52 ммоль) суспендували в ДМФА (11 мл) і додавали до суспензії карбонат калію (0,7 г, 5,06 ммоль) і йод (1,27 г, 5,00 ммоль). Одержану суміш перемішували при кімнатній температурі протягом 3 годин. Реакційну суміш виливали у водний розчин тіосульфату натрію (3,94 г, 25 ммоль) (45 мл). Суміш перемішували протягом 5 хвилин. До одержаної реакційної суміші додавали етилацетат і перемішували, виділяючи при цьому нерозчинну речовину фільтруванням. Фільтрат відокремлювали й промивали органічний шар насиченим водним розчином хлориду натрію, і потім концентрували при зниженому тиску. Залишок і виділену нерозчинну речовину поєднували, і потім очищали колоночною хроматографією на силікагелі (дихлорметан:метанол=50:1→40:1). Очищений продукт концентрували досуха при зниженому тиску, одержуючи при цьому 1,25 г порошкоподібного 5фтор-3-йод-8-пропокси-1Н-хінолін-4-ону блідого темно-коричневого кольору (вихід: 80 %). 1 Н ЯМР (ДМСО-d6) dppm: 1,02 (3Н, т, J=7,4 Гц), 1,78-1,86 (2Н, м), 4,09 (2Н, т, J=6,5 Гц), 6,97 (1Н, дд, J=8,8 Гц, J=11,9 Гц), 7,19 (1Н, дд, J=4,0 Гц, J=8,8 Гц), 8,19 (1Н, с), 11,44 (1Н, ушир.с). Сполуки наступних довідкових прикладів 66 і 67 одержували способом, аналогічним описаному вище способу довідкового прикладу 65, при використанні відповідних вихідних сполук. Довідковий приклад 66 5-Фтор-3-йод-2-метил-8-пропокси-1Н-хінолін-4-он 1 H ЯМР (CDCl3) dppm: 0,97 (3Н, т, J=7,4 Гц), 1,78-1,88 (2H, м), 2,70 (3Н, с), 6,92-7,00 (1Н, м), 7,17-7,22 (1Н, м). Довідковий приклад 67 8-Циклопропілметокси-5-фтор-3-йод-1Н-хінолін-4-он 1 Н ЯМР (ДМСО-d6) dppm: 0,36-0,40 (2Н, м), 0,56-0,63 (2Н, м), 1,28-1,31 (1Н, м), 3,99 (2Н, д, J=7,0 Гц), 6,97 (1Н, дд, J=8,8 Гц, J=11,9 Гц), 7,19 (1Н, дд, J=4,0 Гц, J=8,8 Гц), 8,19 (1Н, с), 11,48 (1Н, ушир.с). Довідковий приклад 68 8-Циклопропілметокси-1-етил-5-фтор-3-йод-1Н-хінолін-4-он До розчину 8-циклопропілметокси-5-фтор-3-йод-1H-хінолін-4-ону (910 мг, 2,53 ммоль) у ДМФА (5 мл) додавали карбонат калію (450 мг, 3,26 ммоль). Суміш перемішували протягом 15 хвилин при кімнатній температурі. Додавали до неї йодистий етил (0,31 мл, 3,87 ммоль) і перемішували одержану суміш при 60 °C протягом 2 годин. Після охолодження реакційної суміші до кімнатної температури додавали воду й екстрагували одержану суміш етилацетатом. Органічний шар концентрували при зниженому тиску, а залишок потім очищали колоночною хроматографією на силікагелі (дихлорметан:етилацетат=40:1→15:1). Очищений продукт концентрували досуха при зниженому тиску, одержуючи при цьому 750 мг порошкоподібний 8циклопропілметокси-1-етил-5-фтор-3-йод-1Н-хінолін-4-ону блідо-темно-коричневого кольору (вихід: 77 %). 1 Н ЯМР (ДМСО-d6) dppm: 0,34-0,38 (2Н, м), 0,57-0,64 (2Н, м), 1,26-1,36 (4H, м), 3,93 (2Н, д, J=7,3 Гц), 4,56 (2Н, кВ, J=7,0 Гц), 7,05 (1H, дд, J=8,9 Гц, J=11,4 Гц), 7,24 (1H, дд, J=4,6 Гц, J=9,0 Гц), 8,45 (1Н, с). Довідковий приклад 69 2,2,2-Трифтор-N-(5-фтор-2-пропоксифеніл)ацетамід Розчин 5-фтор-2-пропоксіаніліну (10,0 г, 59,1 ммоль) у дихлорметані (60 мл) охолоджували льодом і додавали до нього триетиламін (16,5 мл). Потім додавали ангідрид трифтороцтової кислоти (14,8 г, 70,5 ммоль) і перемішували одержану суміш при кімнатній температурі протягом 1 години. До реакційної суміші додавали воду й екстрагували одержану суміш дихлорметаном. Органічний шар промивали водою й сушили над безводним сульфатом натрію. Одержаний сухий продукт концентрували при зниженому тиску, і залишок потім очищали колоночною хроматографією на силікагелі (н-гексан:етилацетат=10:1). Очищений продукт концентрували досуха при зниженому тиску, одержуючи при цьому 15,83 г порошкоподібного 2,2,2-трифтор-N(5-фтор-2-пропоксифеніл)ацетаміду білого кольору (вихід: 99 %). 1 Н ЯМР (CDCl3) dppm: 1,03 (3Н, т, J=7,5 Гц), 1,79-1,93 (2Н, м), 3,98 (2Н, т, J=6,5 Гц), 6,80-6,86 (2Н,м), 8,10-8,12 (1Н, м), 8,64 (1Н, ушир.с). Довідковий приклад 70 Етиловий ефір 4,4,4-трифтор-3-(5-фтор-2-пропоксифеніламіно)бута-2-енової кислоти 26 UA 98789 C2 5 10 15 20 25 30 35 40 45 50 55 До розчину 2,2,2-трифтор-N-(5-фтор-2-пропоксифеніл)ацетаміду (15,83 г, 59,1 ммоль) у толуолі (100 мл) додавали карбоетоксиметилентрифенілфосфоран (41,52 г, 119,2 ммоль). Суміш перемішували в атмосфері азоту при кип'ятінні зі зворотним холодильником протягом 4 годин. Реакційну суміш охолоджували до кімнатної температури, концентрували при зниженому тиску, і залишок потім очищали колоночною хроматографією на силікагелі (нгексан:етилацетат=10:1). Очищений продукт концентрували при зниженому тиску, одержуючи при цьому 19,7 г олієподібного етилового ефіру 4,4,4-трифтор-3-(5-фтор-2пропоксифеніламіно)бута-2-енової кислоти жовтого кольору (вихід: 99 %). 1 Н ЯМР (CDCl3) dppm: 1,02 (3Н, т, J=7,5 Гц), 1,28 (3Н, т, 7,0 Гц), 1,74-1,88 (2Н, м), 3,85 (2Н, т, J=6,5 Гц), 4,17 (2Н, кВ, J=7,0 Гц), 5,41 (1Н, с), 6,77-6,97 (3Н, м), 9,77 (1Н, ушир.с). Довідковий приклад 71 5-Фтор-8-пропокси-2-трифторметил-1Н-хінолін-4-он До етилового ефіру 4,4,4-трифтор-3-(5-фтор-2-пропоксифеніламіно)бута-2-енової кислоти (19,7 г, 59,0 ммоль) додавали дифеніловий ефір (15 мл) і перемішували суміш протягом 1,5 годин при кип'ятінні зі зворотним холодильником. Реакційну суміш охолоджували до кімнатної температури, додавали н-гексан і виділяли осад, що випав, фільтруванням. Речовина, що залишилися на фільтрі, промивали н-гексаном і сушили, одержуючи при цьому 16,2 г порошкоподібного 5-фтор-8-пропокси-2-трифторметил-1Н-хінолін-4-ону білого кольору (вихід: 94 %). 1 Н ЯМР (ДМСО-d6) dppm: 1,00 (3Н, т, J=7,5 Гц), 1,76-1,90 (2Н, м), 4,07 (2Н, т, J=6,5 Гц), 7,187,32 (3Н, м), 12,26 (1Н, ушир.с). Довідковий приклад 72 5-Фтор-3-йод-8-пропокси-2-трифторметил-1Н-хінолін-4-он До розчину 5-фтор-8-пропокси-2-трифторметил-1Н-хінолін-4-ону (6,0 г, 20,7 ммоль) у ДМФА (20 мл) додавали карбонат калію (3,73 г, 27 ммоль) і йод (6,85 г, 27 ммоль) у даному порядку, і перемішували суміш при кімнатній температурі протягом 1,5 годин. До реакційної суміші додавали насичений водний розчин сульфіту натрію (20 мл) і етилацетат, і виділяли осад, що випав, фільтруванням. Фільтрат промивали водою, і потім сушили над безводним сульфатом натрію. Висушений фільтрат концентрували при зниженому тиску. Залишок і речовину, виділену попереднім фільтруванням, поєднували й розчиняли в етанолі, і потім концентрували. Залишок перекристалізовували із суміші розчинників етилацетат-н-гексан, одержуючи при цьому 4,7 г порошкоподібного 5-фтор-3-йод-8-пропокси-2-трифторметил-1Н-хінолін-4-ону білого кольору (вихід: 55 %). 1 Н ЯМР (ДМСО-d6) dppm: 0,96 (3Н, т, J=7,5 Гц), 1,70-1,80 (2Н, м), 3,95 (2Н, т, J=6,5 Гц), 6,646,85 (2Н, м), 12,02 (1H, ушир.с). Довідковий приклад 73 1-(5-Бром-2-циклопентилоксифеніл)етанон До розчину 5'-бром-2'-гідроксіацетофенону (8,5 г, 39,5 ммоль) у ДМФА (10 мл) додавали карбонат калію (6,55 г, 47,4 ммоль), циклопентилбромід (8,25 г, 55,3 ммоль) і ДМФА (5 мл), і перемішували одержану суміш при 60 °C протягом 4,5 годин. До одержаної суміші додавали карбонат калію (3,0 г, 21,7 ммоль) і циклопентилбромід (2,0 г, 13,4 ммоль), і перемішували при 60 °C протягом 9 годин. Після охолодження реакційної суміші до кімнатної температури додавали воду й екстрагували одержану суміш етилацетатом. Органічний шар промивали насиченим водним розчином хлориду натрію, і потім концентрували при зниженому тиску. Після цього залишок очищали колоночною хроматографією на силікагелі (н-гексан:етилацетат=9:1). Очищений продукт концентрували при зниженому тиску, одержуючи при цьому 11,3 г олієподібного 1-(5-бром-2-циклопентилоксифеніл)етанону блідо-жовтого кольору (вихід: 100 %). 1 Н ЯМР (CDCl3) dppm: 1,68-1,95 (8Н, м), 2,58 (3Н, с), 4,83-4,87 (1H, м), 6,83 (1Н, д, J=8,9 Гц), 7,49 (1H, дд, J=2,6 Гц, 8,9 Гц), 7,82 (1Н, д, J=2,6 Гц). Довідковий приклад 74 Оксим 1-(5-бром-2-циклопентилоксифеніл)етанону 1-(5-Бром-2-циклопентилоксифеніл)етанон (5,0 г, 17,65 ммоль) розчиняли в суміші розчинників хлороформу (18 мл) і метанолу (70 мл). До одержаного розчину додавали гідрохлорид гідроксиламіну (1,88 г, 27,0 ммоль) і піридин (4,36 мл, 54,1 ммоль), і перемішували суміш протягом 6 годин при кипінні зі зворотним холодильником. Реакційну суміш охолоджували до кімнатної температури, і потім концентрували при зниженому тиску. До залишку додавали 2н хлористоводневу кислоту (13,9 мл), і екстрагували одержану суміш дихлорметаном. Органічний шар промивали насиченим водним розчином хлориду натрію, сушили над сульфатом магнію й концентрували досуха при зниженому тиску. Залишок промивали н-гексаном і сушили, 27 UA 98789 C2 5 10 15 20 25 30 35 40 45 50 55 одержуючи при цьому 4,6 г порошкоподібного оксиму 1-(5-бром-2циклопентилоксифеніл)етанону білого кольору (вихід: 87 %). 1 Н ЯМР (CDCl3) dppm: 1,65-1,90 (8Н, м), 2,17 (3Н, с), 4,72-4,76 (1Н, м), 6,76 (1Н, д, J=8,4 Гц), 7,35-7,41 (2Н, м), 7,99 (1Н, ушир.с). Довідковий приклад 75 N-(5-Бром-2-циклопентилоксифеніл)ацетамід Оксим 1-(5-бром-2-циклопентилоксифеніл)етанону (4,56 г, 15,3 ммоль) суспендували в ацетонітрилі (100 мл). Додавали до нього хлорид індію(III) (507 мг, 2,29 ммоль) і нагрівали одержану суміш при кипінні зі зворотним холодильником протягом 2 годин в атмосфері азоту. Реакційну суміш охолоджували до кімнатної температури, і потім концентрували при зниженому тиску. Залишок екстрагували дихлорметаном. Органічний шар промивали насиченим водним розчином хлориду натрію, і потім концентрували при зниженому тиску. Після цього залишок очищали колоночного хроматографією на силікагелі (н-гексан:етилацетат=8:1→4:1). Очищений продукт концентрували при зниженому тиску, одержуючи при цьому 3,41 г олієподібного N-(5бром-2-циклопентилоксифеніл)ацетаміду блідо-жовтого кольору (вихід: 75 %). 1 Н ЯМР (CDCl3) dppm: 1,67-1,94 (8Н, м), 2,18 (3Н, с), 4,75-4,81 (1H, м), 6,72 (1Н, д, J=8,7 Гц), 7,10 (1H, дд, J=2,3 Гц, 8,7 Гц), 7,67 (1Н, ушир.с), 8,55 (1H, д, J=2,3 Гц). Довідковий приклад 76 5-Бром-2-циклопентилоксіанілін До розчину N-(5-бром-2-циклопентилоксифеніл)ацетаміду (3,4 г, 11,4 ммоль) в етанолі (100 мл) додавали концентровану хлористоводневу кислоту (5,8 мл) і перемішували одержану суміш протягом 3 годин при кипінні зі зворотним холодильником. Після охолодження реакційної суміші до кімнатної температури додавали 5н розчин гідроксиду натрію (14,2 мл) для одержання рн 11. Після цього екстрагували одержану суміш дихлорметаном. Органічний шар промивали насиченим водним розчином хлориду натрію, і потім концентрували при зниженому тиску. Після цього залишок очищали колоночною хроматографією на силікагелі (н-гексан:етилацетат=4:1). Очищений продукт концентрували при зниженому тиску, одержуючи при цьому 2,97 г олієподібного 5-бром-2-циклопентилоксіаніліну блідо-жовтого кольору (вихід: 100 %). 1 Н ЯМР (CDCl3) dppm: 1,62-1,89 (8Н, м), 3,80 (2Н, ушир.с), 4,71-4,75 (1Н, м), 6,61 (1H, д, J=8,4 Гц), 6,75-6,81 (2Н, м). Приклад 1 5-Фтор-3-фуран-3-іл-8-пропокси-1Н-хінолін-4-он 5-Фтор-3-йод-8-пропокси-1Н-хінолін-4-он (780 мг, 2,24 ммоль) суспендували в суміші розчинників толуолу (10 мл) і метанолу (1,6 мл), і додавали туди фуран-3-боронову кислоту (752 мг), тетракіс(трифенілфосфін)паладію (130 мг, 0,11 ммоль) і 2н водний розчин карбонату натрію (2,25 мл) у даному порядку. Суміш перемішували в атмосфері азоту при 110 °C протягом 20 годин. Після охолодження реакційної суміші до кімнатної температури додавали воду й екстрагували одержану суміш дихлорметаном. Органічний шар концентрували при зниженому тиску, після цього залишок очищали колоночною хроматографією на силікагелі (дихлорметан:метанол=60:1→50:1). Очищений продукт концентрували при зниженому тиску й перекристалізовували з етанолу, одержуючи при цьому 180 мг порошкоподібного 5-фтор-3фуран-3-іл-8-пропокси-1Н-хінолін-4-ону блідо-жовтого кольору (вихід: 58 %). Температура плавлення 214-215 °C. 1 Н ЯМР (ДМСО-d6) dppm: 1,02 (3Н, J=7,3 Гц), 1,78-1,87 (2Н, м), 4,09 (2Н, т, J=6,4 Гц), 6,876,95 (2Н, м), 7,13 (1Н, дд, J=3,8 Гц, J=8,8 Гц), 7,67 (1H, с), 8,11 (1Н, с), 8,51 (1Н, с), 11,50 (1H, ушир.с). Сполуки наступних прикладів з 2 по 5 одержували способом, аналогічним способу описаного вище прикладу 1, з використанням відповідних вихідних сполук. Приклад 2 5-Фтор-3-(3-фтор-4-метоксифеніл)-8-пропокси-1Н-хінолін-4-он Сірий порошок (етанол). Температура плавлення 194-195 °C. 1 Н ЯМР (ДМСО-d6) dppm: 1,03 (3Н, т, J=7,3 Гц), 1,79-1,87 (2Н, м), 3,84 (3Н, с), 4,09 (2Н, т, J=6,4 Гц), 6,90 (1H, дд, J=8,7 Гц, J=12,1 Гц), 7,12-7,19 (2Н, м), 7,35-7,39 (1Н, м), 7,56 (1Н, дд, J=2,0 Гц, J=13,5 Гц), 7,87 (1H, с), 11,40 (1Н, ушир.с). Приклад 3 5-Фтор-8-пропокси-3-тіофен-3-іл-1Н-хінолін-4-он Блідо-коричневий порошок (етанол). Температура плавлення 208-210 °C. 28
ДивитисяДодаткова інформація
Назва патенту англійськоюQuinolone compound and pharmaceutical composition
Автори англійськоюOtsubo, Kenji, Ochi, Yuji, Nakai, Masami, Mori, Atsushi
Назва патенту російськоюПроизводное хинолона и фармацевтическая композиция
Автори російськоюОцубо Кэндзи, Оти Юдзи, Накаи Масами, Мори Ацуси
МПК / Мітки
МПК: C07D 215/233, C07D 409/04, C07D 407/04
Мітки: композиція, фармацевтична, похідне, хінолону
Код посилання
<a href="https://ua.patents.su/50-98789-pokhidne-khinolonu-ta-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Похідне хінолону та фармацевтична композиція</a>
Попередній патент: Стенд для обробки головок блоків циліндрів
Наступний патент: Газофазний спосіб виготовлення композитів
Випадковий патент: Цистерна для затвердіваючих продуктів