Спосіб одержання похідних 2-аміно-5-ціанобензойної кислоти
Формула / Реферат
1. Спосіб отримання сполуки Формули 1
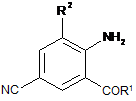 , 1
, 1
де
R1 являє собою NHR3;
R2 являє собою СН3 або Сl; і
R3 являє собою Н, С1-С4 алкіл, циклопропіл, циклопропілциклопропіл, циклопропілметил або метилциклопропіл;
який включає етап, на якому вводять у контакт (1) сполуку Формули 2
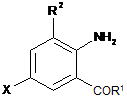 , 2
, 2
де X являє собою Вr або Сl;
з (2) реагентом ціаніду металу, що містить одну або більше сполук, вибраних із групи, що містить ціаніди лужних металів і ціанід міді(І), (3) реагентом солі міді(І), (4) реагентом солі йодистоводневої кислоти і (5) щонайменше однією сполукою Формули 3
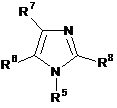 , 3
, 3
де
R5 являє собою Η, феніл або бензил; або С1-С12 алкіл, необов'язково заміщений NR9R10;
кожний R6, R7 і R8 являє собою незалежно Н, С1-С12 алкіл, феніл або бензил; або
R6 і R7 взяті разом як -СН=СН-СН=СН-; і
R9 і R10 взяті разом як -CH=N-CH=CH-, що необов'язково має до 3 замісників, незалежно вибраних з С1-С12 алкілу;
за умови, що коли X являє собою Сl, то R2 являє собою метил.
2. Спосіб за п. 1, де реагент солі міді(І) і реагент солі йодистоводневої кислоти містять йодид міді(І).
3. Спосіб за п. 1, де щонайменше одна сполука Формули 3 містить одну або більше сполук, вибраних із групи, що містить 1-метил-1Н-імідазол, 1-етил-1Н-імідазол, 1-пропіл-1Н-імідазол, 1-бутил-1Н-імідазол, 1-пентил-1Н-імідазол, 1-гексил-1Н-імідазол, 4-метилімідазол, 1,1'-(1,4-бутандіїл)біс-1Н-імідазол, 1,1'-(1,5-пентандіїл)біс-1Н-імідазол і 1,1'-(1,6-гександіїл)біс-1Н-імідазол.
4. Спосіб за п. 3, де щонайменше одна сполука Формули 3 містить одну або більше сполук, вибраних із групи, що містить 1-метил-1Н-імідазол, 1-бутил-1Н-імідазол, 4-метилімідазол і 1,1'-(1,6-гександіїл)біс-1Н-імідазол.
5. Спосіб за п. 4, де щонайменше одна сполука Формули 3 містить 1-метил-1Н-імідазол або 1-бутил-1Н-імідазол.
6. Спосіб за п. 1, де сполуку Формули 2 вводять у контакт із придатним органічним розчинником для утворення суміші і потім реагент ціаніду металу, реагент солі міді(І), реагент солі йодистоводневої кислоти і щонайменше одну сполуку Формули 3 послідовно додають до суміші.
7. Спосіб за п. 6, де придатний органічний розчинник містить один або більше розчинників, вибраних із групи, що містить ксилоли, толуол, хлорбензол, метоксибензол, 1,2,4-триметилбензол, 1,3,5-триметилбензол, етилбензол, (1-метилетил)бензол, C1-С3 алкілзаміщені нафталіни, ShellSol A100 і ShellSol A150.
8. Спосіб за п. 7, де придатний органічний розчинник містить один або більше розчинників, вибраних із групи, що містить ксилоли, толуол, 1,2,4-триметилбензол, 1,3,5-триметилбензол і 1-метилнафталін.
9. Спосіб за п. 1, де реагент ціаніду металу містить одну або більше сполук, вибраних із групи, що містить ціанід натрію і ціанід калію.
10. Спосіб за п. 9, де реагент ціаніду металу містить ціанід натрію.
11. Спосіб за п. 1, де X являє собою Вr, і сполуку Формули 1 одержують у вигляді твердого продукту, при цьому спосіб включає етап, на якому: вводять у контакт сполуку Формули 2 із придатним органічним розчинником для утворення суміші, і потім послідовно додають реагент ціаніду металу, реагент солі міді(І), реагент солі йодистоводневої кислоти і сполуку або сполуки Формули 3, підтримують температуру суміші від близько 145 ºдо 180 °C протягом від близько 5 до близько 8 годин, охолоджують суміш до близько 0-50 °C, додають воду до суміші, необов'язково перемішують протягом від близько 1 до близько 24 годин, і потім виділяють сполуку Формули 1 у вигляді твердого продукту із суміші.
12. Спосіб за п. 11, де сполука Формули 1 являє собою 2-аміно-5-ціано-N,3-диметилбензамід.
13. Спосіб за п. 1, де X являє собою Сl, і сполуку Формули 1 одержують у вигляді твердого продукту, при цьому спосіб включає етап, на якому: вводять у контакт сполуку Формули 2 із придатним органічним розчинником з утворенням суміші і потім послідовно додають реагент ціаніду металу, реагент солі міді(І), реагент солі йодистоводневої кислоти і сполуку або сполуки Формули 3, підтримують температуру суміші від близько 150 º до 200 °C протягом від близько 5 до близько 24 годин, охолоджують суміш до близько 0-50 °C, додають воду до суміші, необов'язково перемішують протягом від близько 1 до близько 24 годин, і потім виділяють сполуку Формули 1 у вигляді твердого продукту із суміші.
14. Спосіб за п. 13, де сполука Формули 1 являє собою 2-аміно-5-ціано-N,3-диметилбензамід.
Текст
Реферат: Розкрито спосіб отримання сполуки Формули (1), що включає контакт сполуки Формули (2) з реагентом ціаніду металу, реагентом солі міді (І), реагентом солі йодистоводневої кислоти і l 3 2 щонайменше однією сполукою Формули (3), де R являє собою NHR ; R являє собою СН3 або 3 Сl; R являє собою Н, С1-С4 алкіл, циклопропіл, циклопропілциклопропіл, циклопропілметил або 5 6 7 8 метилциклопропіл; X являє собою Br або Сl; і R , R , R і R є такими, як визначено в описі. 11 12 13 Також розкривається спосіб отримання сполуки Формули (4), де R , R , R і Z є такими, як визначено в описі, з використанням сполуки Формули (1), що характеризується отриманням сполуки Формули (1) способом, розкритим вище або використанням сполуки Формули (1), отриманої способом, розкритим вище R 2 R NH2 R 2 N NH2 R NC COR1 , 1, X COR1 7 , 2, 6 R N R 8 5 , 3, UA 105173 C2 (12) UA 105173 C2 R R 2 11 N O N R NH 12 Z NC C(O)NHR3 R 13 4. UA 105173 C2 5 10 ГАЛУЗЬ ВИНАХОДУ Даний винахід стосується способу отримання 3- заміщених 2-аміно-5-ціанобензойних кислот і похідних. ПЕРЕДУМОВИ ВИНАХОДУ Було розкрите отримання певних 2-аміно-5-ціанобензойних кислот і їхнє застосування як проміжних речовин для отримання відповідних інсектицидних ціаноамінобензойних діамідів (дивися, наприклад, Схему 9 у PCT Патентній Публікації WO 2004/067528; Схему 9 і Приклад 2, Етап A у PCT Патентній Публікації WO 2006/068669; і Схему 15 і Приклад 6, Етап B у PCT Патентній Публікації WO 2006/062978). Проте, продовжує існувати необхідність у нових або удосконалених способах, придатних для того, щоб швидко і економічно надати 2-аміно-5-ціанобензойні кислоти і похідні. КОРОТКИЙ ОПИС ВИНАХОДУ Даний винахід спрямований на спосіб отримання сполуки Формули 1 R2 NH2 COR1 NC 1 15 20 , де 1 3 4 R являє собою NHR або OR ; 2 R являє собою CH3 або Cl; 3 R являє собою H, C1-C4 алкіл, циклопропіл, циклопропілциклопропіл, циклопропілметил або метилциклопропіл; і 4 R являє собою H або C1-C4 алкіл; який включає контакт (1) сполуки Формули 2 R2 NH2 COR1 X 2 25 , де X являє собою Br або Cl; з (2) реагентом ціаніду металу, (3) реагентом солі міді(I), (4) реагентом солі йодистоводневої кислоти і (5), щонайменше, однією сполукою Формули 3 R7 N R6 N R8 R5 3 30 , де 5 9 10 R являє собою H, феніл або бензил; або C1-C12 алкіл, необов'язково заміщений NR R ; 6 7 8 кожний R , R і R являє собою незалежно H, C1-C12 алкіл, феніл або бензил; або 6 7 R і R взяті разом як -CH=CH-CH=CH-; і 9 10 R і R взяті разом як -CH=N-CH=CH-, що необов'язково має до 3 замісників, незалежно вибраних з C1-C12 алкілу; 2 за умови, що коли X являє собою Cl, то R являє собою метил. Цей винахід також забезпечує спосіб отримання сполуки Формули 4 1 UA 105173 C2 R11 R2 N O N R12 NH Z NC C(O)NHR3 R13 4 5 10 15 20 25 30 35 40 45 , де 2 R являє собою CH3 або Cl; 3 R являє собою H, C1-C4 алкіл, циклопропіл, циклопропілциклопропіл, циклопропілметил або метилциклопропіл; 14 Z являє собою CR або N; 11 R являє собою Cl, Br, CF3, OCF2H або OCH2CF3; 12 R являє собою F, Cl або Br; 13 R являє собою H, F або Cl; і 14 R являє собою H, F, Cl або Br; використовуючи сполуку Формули 1. Спосіб характеризується (a) отриманням сполуки Формули 1 зі сполуки Формули 2 способом, розкритим вище, або (b) використанням як зазначеної сполуки Формули 1 сполуки Формули 1, отриманої способом, розкритим вище. ДЕТАЛЬНИЙ ОПИС ВИНАХОДУ Як використовується в даному документі, вирази "містить", "що містить", "включає", "що включає", "має", "що має" або будь-яка інша їхня варіація, призначені для того, щоб охопити невиняткове включення. Наприклад, композиція, процес, спосіб, виріб або пристрій, що містить перелік елементів, не обов'язково обмежений тільки цими елементами, але може включати інші елементи, не спеціально перераховані або властиві такій композиції, процесу, способу, виробу або пристрою. Крім того, якщо точно не заявлене протилежне, "або" відноситься до або, що включає, а не до або, що виключає. Наприклад, умова A або B задовольняє кожному з наступного: A є вірним (або присутнє), і B є помилковим (або не присутнє), A є помилковим (або не присутнє), і B є вірним (або присутнє), і обоє A і B є вірними (або присутні). Також мається на увазі, що форми однини, що передують елементу або компоненту даного винаходу, є не обмежуючими щодо числа прикладів (тобто екземплярів) елемента або компонента. Тим самим, форми однини варто розуміти, як що включають один або, щонайменше, один, і форма однини елемента або компонента також включає множину, якщо тільки, безсумнівно, не мається на увазі, що число є одниною. Як використовується тут, наступні позначення варто застосовувати, якщо не зазначено протилежне. Вираз "необов'язково заміщений" використовується взаємозамінно з фразою "заміщений або незаміщений" або з виразом “(не)заміщений". Якщо не зазначено інше, коли присутні більш одного замісника на групі, кожне заміщення є незалежним від іншого. Також група, позначена як необов'язково заміщена замісником, є заміщеною нулем або одним прикладом зазначеного замісника, якщо тільки не зазначена верхня межа. У деяких випадках тут співвідношення перелічуються як окремі числа, що відносяться до числа 1; наприклад, співвідношення 4 означає 4:1. Як використовується тут, вираз "еквівалент ціаніду" і зв'язані вирази, такі як "еквівалентне співвідношення ціаніду", коли воно відноситься до сполуки, що включає одну або більше ціанідних груп, відноситься до кількості іонів ціаніду (CN ) на моль ціанід-утримуючої сполуки. Зокрема, "еквівалент(и) ціаніду" позначає число молів іона ціаніду, що може бути забезпечене молем ціанід-утримуючої сполуки (тобто джерела ціаніду) для перетворення сполуки Формули 2 на сполуку Формули 1 відповідно до даного способу. Наприклад, реагент гексаціаноферат(II) має шість молів іонів ціаніду на моль гексаціаноферату(II); тому, якщо еквівалентне співвідношення ціаніду реагенту гексаціаноферату(II) щодо іншого реагенту (наприклад, сполуки Формули 2) складає 1:1, то мольне співвідношення буде 0,167: 1. Більш того, спосіб даного винаходу включає застосування реагенту (2) (тобто реагенту ціаніду металу), що може включати одну або більше ціанід-утримуючих сполук (наприклад, один або більше ціанідів металу). У випадках, де реагент (2) містить більше ніж одну ціанід-утримуючу сполуку, 2 UA 105173 C2 5 10 15 20 25 30 35 40 45 50 55 60 "еквіваленти ціаніду", забезпечені реагентом (2), являють собою суму кількостей еквівалентів – ціаніду (тобто молей CN ), забезпечених кожною з ціанід-утримуючих сполук у реагенті (2). Наприклад, для конкретної реакції, реагент (2) може складатися з комбінації ціаніду натрію (NaCN) і ціаніду міді(I) (CuCN); тому еквівалентне співвідношення ціаніду щодо іншого реагенту (наприклад, сполуки Формули 2) являє собою суму числа еквівалентів ціаніду, забезпечених ціанідом натрію і ціанідом міді(I) щодо числа молів іншого реагенту. Тому що і ціанід натрію, і ціанід міді(I) містять один моль іона ціаніду на моль (тобто молекулярна вага за формулою сполуки) сполуки, то еквівалентне співвідношення ціаніду щодо іншого реагенту являє собою також суму числа молей ціаніду натрію і ціаніду міді(I) щодо числа молів іншого реагенту. У вищевикладених перерахуваннях вираз "алкіл" включає нерозгалужений або розгалужений алкіл, такий як, метил, етил, n- пропіл, i- пропіл, або різні ізомери бутила, пентила або гексила. Вираз "циклопропілциклопропіл" позначає заміщення циклопропіла на інше кільце циклопропіла. Приклади "циклопропілциклопропіла" включають 1,1'-біциклопропіл-1-іл, 1,1'біциклопропіл-2-іл і різні цис- і транс-ізомери циклопропілциклопропіла, такі як (1R, 2S)-1,1'біциклопропіл-2-іл і (1R, 2R)-1,1'-біциклопропіл-2-іл. Як використовується тут, вираз "ліганд" відноситься до органічної молекули, що включає, щонайменше, одну пару електронів, доступну для координації з атомом металу (у даному випадку атомом міді). Вираз "бідентатний ліганд" відноситься до органічної молекули, що містить, щонайменше, дві пари електронів, що доступні для координації з атомом металу (наприклад, атомом міді). Радикал на основі вуглецю відноситься до одновалентного молекулярного компонента, що включає атом вуглецю, що з'єднує радикал із залишком хімічної структури за допомогою одинарного зв'язку. Радикали на основі вуглецю можуть необов'язково містити насичені, ненасичені та ароматичні групи, ланцюги, кільця і системи кілець, і гетероатоми. Хоча радикали на основі вуглецю не піддаються якому-небудь конкретному обмеженню в розмірі, у контексті даного винаходу вони звичайно містять від 1 до 16 атомів вуглецю і від 0 до 3 гетероатомів. Слід зазначити радикали на основі вуглецю, обрані з C1-C4 алкілу, C1-C2 галоалкілу і фенілу, необов'язково заміщені 1-3 замісниками, обраними з C1-C3 алкілу, галогену і нітро. Спосіб даного винаходу включає реагент (2) (тобто реагент ціаніду металу), реагент (3) (тобто реагент солі міді(I)) і реагент (4) (тобто реагент солі йодистоводневої кислоти). Реагент (2) альтернативно та еквівалентно описується як, щонайменше, один ціанід металу, тому що реагент ціаніду металу містить один або більше ціанідів металу. Реагент (3) альтернативно та еквівалентно описується як, щонайменше, одна сіль міді(I), тому що реагент солі міді(I) містить одну або кілька солей міді(I). Реагент (4) альтернативно та еквівалентно описується як, щонайменше, одна сіль йодистоводневої кислоти, тому що реагент солі йодистоводневої кислоти містить одну або кілька солей йодистоводневої кислоти. Більш того, число молів реагенту ціаніду металу відноситься до числа молів ціаніду, що міститься в реагенті (як описано вище). Число молів реагенту солі міді(I) відноситься до числа молів міді(I), що міститься в реагенті. Число молів реагенту солі йодистоводневої кислоти відноситься до числа молів йодиду, що міститься в реагенті. Відповідно до викладеного в даному описі, вираз "карбонова кислота" позначає органічну хімічну сполуку, що включає, щонайменше, одну функціональну групу карбонової кислоти (тобто -C(O)OH). Вираз "карбонова кислота" не включає сполуку вугільної кислоти (тобто HOC(O)OH). Карбонові кислоти включають, наприклад, мурашину кислоту, оцтову кислоту, пропіонову кислоту, хлороцтову кислоту, бензойну кислоту, малеїнову кислоту і лимонну кислоту. Вираз "ефективний pKa" відноситься до pKa функціональної групи карбонової кислоти, або якщо сполука має більше ніж одну функціональну групу карбонової кислоти, то "ефективний pKa" відноситься до pKa найбільш кислої функціональної групи карбонової кислоти. Відповідно до викладеного в даному описі "ефективний pН" неводної речовини або суміші, такої як реакційна суміш, визначається змішуванням аліквоти речовини або суміші з близько 5-20 об'ємами води і потім виміром pН отриманої водної суміші (наприклад, за допомогою pH-метра). Відповідно до викладеного в даному описі "по суті безводна" речовина означає, що речовина містить не більше ніж близько 1 % води за вагою. Хімічна назва "ізатоєвий ангідрид" – це інша назва, що відповідає діючій назві по Хімічній реферативній службі "2H-3,1-бензоксазин-2,4(1H)діон". Варіанти здійснення даного винаходу включають: Варіант здійснення A1. Спосіб, описаний у Короткому описі винаходу для отримання сполуки Формули 1, що включає контакт реагенту (1) (тобто сполуки Формули 2) з реагентом (2) (тобто реагентом ціаніду металу), реагентом (3) (тобто реагентом солі міді(I)), реагентом (4) (тобто 3 UA 105173 C2 5 10 15 20 25 30 35 40 45 50 55 60 реагентом солі йодистоводневої кислоти) і реагентом (5) (тобто, щонайменше, однією сполукою Формули 3). 1 3 Варіант здійснення A2. Спосіб Варіанта здійснення A1, де R являє собою NHR . 3 Варіант здійснення A3. Спосіб Варіанта здійснення A1 або A2, де R являє собою C1-C4 алкіл, циклопропіл, циклопропілциклопропіл, циклопропілметил або метилциклопропіл. 3 Варіант здійснення A4. Спосіб Варіанта здійснення A3, де R являє собою C1-C4 або алкіл циклопропілметил. 3 Варіант здійснення A5. Спосіб Варіанта здійснення A4, де R являє собою метил. 2 Варіант здійснення A6. Спосіб кожного з Варіантів здійснення A1-A5, де R являє собою метил. Варіант здійснення A7. Спосіб кожного з Варіантів здійснення A1-A6, де X являє собою Br. Варіант здійснення A8. Спосіб кожного з Варіантів здійснення A1-A7, де реагент (1) містить 2-аміно-5-бром-N, 3-диметилбензамід. Варіант здійснення A9. Спосіб кожного з Варіантів здійснення A1-A8, де реагент (2) містить один або більше ціанідів металів, вибраних із групи, що містить ціаніди лужних металів, гексаціаноферати(II) лужних металів і ціанід міді(I). Варіант здійснення A10. Спосіб Варіанта здійснення A9, де реагент (2) містить один або більше ціанідів, вибраних із групи, що містить ціаніди лужних металів і гексаціаноферати(II) лужних металів. Варіант здійснення A11. Спосіб Варіанта здійснення A10, де реагент (2) містить один або більше ціанідів металів, вибраних із групи, що містить ціанід натрію, ціанід калію, гексаціаноферат(II) калію і гексаціаноферат(II) натрію. Варіант здійснення A12. Спосіб Варіанта здійснення A11, де реагент (2) містить один або більше ціанідів металів, вибраних із групи, що містить ціанід натрію, ціанід калію і гексаціаноферат(II) калію. Варіант здійснення A13. Спосіб Варіанта здійснення A12, де реагент (2) містить ціанід натрію або гексаціаноферат(II) калію. Варіант здійснення A14. Спосіб Варіанта здійснення A13, де реагент (2) містить ціанід натрію. Варіант здійснення A15. Спосіб кожного з Варіантів здійснення A1-A14, де еквівалентне співвідношення ціаніду реагенту (2) до реагенту (1) складає, щонайменше, близько 1. Варіант здійснення A16. Спосіб Варіанта здійснення A15, де еквівалентне співвідношення ціаніду реагенту (2) до реагенту (1) складає, щонайменше, близько 1,15. Варіант здійснення A17. Спосіб Варіанта здійснення A16, де еквівалентне співвідношення ціаніду реагенту (2) до реагенту (1) складає, щонайменше, близько 1,25. Варіант здійснення A17a. Спосіб Варіанта здійснення A17, де еквівалентне співвідношення ціаніду реагенту (2) до реагенту (1) складає, щонайменше, близько 1,4. Варіант здійснення A18. Спосіб кожного з Варіантів здійснення A1-A17a, де еквівалентне співвідношення ціаніду реагенту (2) до реагенту (1) складає не більше ніж близько 2,1. Варіант здійснення A19. Спосіб Варіанта здійснення A19, де еквівалентне співвідношення ціаніду реагенту (2) до реагенту (1) складає не більше ніж близько 1,55. Варіант здійснення A19a. Спосіб Варіанта здійснення A19, де еквівалентне співвідношення ціаніду реагенту (2) до реагенту (1) складає не більше ніж близько 1,5. Варіант здійснення A20. Спосіб Варіанта здійснення A19a, де еквівалентне співвідношення ціаніду реагенту (2) до реагенту (1) складає не більше ніж близько 1,4. 5 Варіант здійснення A21. Спосіб кожного з Варіантів здійснення A1-A20, де R являє собою H; 9 10 або C1-C6 алкіл, необов'язково заміщений NR R . 5 Варіант здійснення A22. Спосіб Варіанта здійснення 21, де R являє собою H, метил, етил, 9 10 n-пропіл або n-бутил; або C1-C6 алкіл, заміщений NR R . 5 Варіант здійснення A23. Спосіб Варіанта здійснення A22, де R являє собою метил або nбутил. 9 10 Варіант здійснення A24. Спосіб кожного з Варіантів здійснення A1-A22, де R і R взяті разом як -CH=N-CH=CH-. 6 7 8 Варіант здійснення A25. Спосіб кожного з Варіантів здійснення A1-A24, де кожний R , R і R , 6 7 коли взятий окремо (тобто R і R не взяті разом), являє собою незалежно H або C1-C3 алкіл. 6 7 8 Варіант здійснення A26. Спосіб Варіанта здійснення A25, де кожний R , R і R , коли взятий окремо, являє собою незалежно H або метил. 6 7 8 Варіант здійснення A27. Спосіб Варіанта здійснення A26, де кожний R , R і R , коли взятий окремо, являє собою H. 6 7 Варіант здійснення A27a. Спосіб кожного з Варіантів здійснення A1-A27, де кожний R , R і 4 UA 105173 C2 8 5 10 15 20 25 30 35 40 45 50 55 60 R взяті окремо. Варіант здійснення A28. Спосіб кожного з Варіантів здійснення A1-A27a, де реагент (5) містить одну або більше сполук, вибраних із групи, що містить 1-метил-1H-імідазол, 1-етил-1Hімідазол, 1-пропіл-1H-імідазол, 1-бутил-1H-імідазол, 1-пентил-1H-імідазол, 1-гексил-1H-імідазол, 4-метилімідазол, 1,1'-(1,4-бутандііл)біс-1H-імідазол, 1,1'-(1,5-пентандііл)біс-1H-імідазол і 1,1'(1,6-гександііл)біс-1H-імідазол. Варіант здійснення A28a. Спосіб Варіанта здійснення A28, де реагент (5) містить одну або більше сполук, вибраних із групи, що містить 1-метил-1H-імідазол, 1-етил-1H-імідазол, 1-пропіл1H-імідазол, 1-бутил-1H-імідазол, 4-метилімідазол, 1,1'-(1,4-бутандііл)біс-1H-імідазол і 1,1'-(1,6гександііл)біс-1H-імідазол. Варіант здійснення A28b. Спосіб Варіанта здійснення A28a, де реагент (5) містить одну або більше сполук, вибраних із групи, що містить 1-метил-1H-імідазол, 1-бутил-1H-імідазол, 4метилімідазол і 1,1'-(1,6-гександііл)біс-1H-імідазол. Варіант здійснення A29. Спосіб кожного з Варіантів здійснення A1-A28b, де реагент (5) містить одну або більше сполук, вибраних із групи, що містить 1-метил-1H-імідазол, 1-етил-1Hімідазол, 1-пропіл-1H-імідазол, 1-бутил-1H-імідазол, 1-пентил-1H-імідазол, 1-гексил-1H-імідазол, 1,1'-(1,4-бутандііл)біс-1H-імідазол, 1,1'-(1,5-пентандііл)біс-1H-імідазол і 1,1'-(1,6-гександііл)біс1H-імідазол. Варіант здійснення A30. Спосіб Варіанта здійснення A29, де реагент (5) містить одну або більше сполук, вибраних із групи, що містить 1-метил-1H-імідазол, 1-етил-1H-імідазол, 1-бутил1H-імідазол і 1,1'-(1,4-бутандііл)біс-1H-імідазол. Варіант здійснення A31. Спосіб Варіанта здійснення A28b або A30, де реагент (5) містить 1метил-1H-імідазол або 1-бутил-1H-імідазол. Варіант здійснення A32. Спосіб Варіанта здійснення A31, де реагент (5) містить 1-метил-1Hімідазол. Варіант здійснення A33. Спосіб Варіанта здійснення A31, де реагент (5) містить 1-бутил-1Hімідазол. Варіант здійснення A34. Спосіб кожного з Варіантів здійснення A1-A33, де мольне співвідношення реагенту (5) до реагенту (3) (на основі вмісту міді(I)) складає, щонайменше, близько 1. Варіант здійснення A34a. Спосіб Варіанта здійснення A34, де мольне співвідношення реагенту (5) до реагенту (3) (на основі вмісту міді(I)) складає, щонайменше, близько 1,5. Варіант здійснення A35. Спосіб Варіанта здійснення A34a, де мольне співвідношення реагенту (5) до реагенту (3) складає, щонайменше, близько 2. Варіант здійснення A36. Спосіб Варіанта здійснення A35, де мольне співвідношення реагенту (5) до реагенту (3) складає, щонайменше, близько 2,5. Варіант здійснення A37. Спосіб Варіанта здійснення A36, де мольне співвідношення реагенту (5) до реагенту (3) складає, щонайменше, близько 3. Варіант здійснення A38. Спосіб Варіанта здійснення A37, де мольне співвідношення реагенту (5) до реагенту (3) складає, щонайменше, близько 4. Варіант здійснення A39. Спосіб кожного з Варіантів здійснення A1-A38, де мольне співвідношення реагенту (5) до реагенту (3) (на основі вмісту міді(I)) складає не більше ніж близько 10. Варіант здійснення A40. Спосіб Варіанта здійснення A39, де мольне співвідношення реагенту (5) до реагенту (3) складає не більше ніж близько 6. Варіант здійснення A41. Спосіб Варіанта здійснення A40, де мольне співвідношення реагенту (5) до реагенту (3) складає не більше ніж близько 5,5. Варіант здійснення A42. Спосіб Варіанта здійснення A41, де мольне співвідношення реагенту (5) до реагенту (3) складає не більше ніж близько 5. Варіант здійснення A43. Спосіб кожного з Варіантів здійснення A1-A42, де мольне співвідношення реагенту (3) (на основі вмісту міді(I)) до реагенту (1) складає, щонайменше, близько 0,01. Варіант здійснення A44. Спосіб Варіанта здійснення A43, де мольне співвідношення реагенту (3) до реагенту (1) складає, щонайменше, близько 0,1. Варіант здійснення A45. Спосіб Варіанта здійснення A44, де мольне співвідношення реагенту (3) до реагенту (1) складає, щонайменше, близько 0,15. Варіант здійснення A45a. Спосіб Варіанта здійснення A45, де мольне співвідношення реагенту (3) до реагенту (1) складає, щонайменше, близько 0,3, коли X являє собою Cl. Варіант здійснення A46. Спосіб кожного з Варіантів здійснення A1-A45a, де мольне співвідношення реагенту (3) (на основі вмісту міді(I)) до реагенту (1) складає менше ніж близько 5 UA 105173 C2 1. 5 10 15 20 25 30 35 40 45 50 55 60 Варіант здійснення A47. Спосіб кожного з Варіантів здійснення A1-A46, де мольне співвідношення реагенту (3) (на основі вмісту міді(I)) до реагенту (1) складає не більше ніж близько 0,99. Варіант здійснення A48. Спосіб Варіанта здійснення A47, де мольне співвідношення реагенту (3) до реагенту (1) складає не більше ніж близько 0,5. Варіант здійснення A49. Спосіб Варіанта здійснення A48, де мольне співвідношення реагенту (3) до реагенту (1) складає не більше ніж близько 0,4. Варіант здійснення A50. Спосіб Варіанта здійснення A49, де мольне співвідношення реагенту (3) до реагенту (1) складає не більше ніж близько 0,3. Варіант здійснення A51. Спосіб Варіанта здійснення A50, де мольне співвідношення реагенту (3) до реагенту (1) складає не більше ніж близько 0,25, коли X являє собою Br. Варіант здійснення A52. Спосіб Варіанта здійснення A51, де мольне співвідношення реагенту (3) до реагенту (1) складає не більше ніж близько 0,2, коли X являє собою Br. Варіант здійснення A53. Спосіб кожного з Варіантів здійснення A1-A52, де мольне співвідношення реагенту (4) до реагенту (1) складає, щонайменше, близько 0,001. Варіант здійснення A54. Спосіб Варіанта здійснення A53, де мольне співвідношення реагенту (4) до реагенту (1) складає, щонайменше, близько 0,05. Варіант здійснення A55. Спосіб Варіанта здійснення A54, де мольне співвідношення реагенту (4) до реагенту (1) складає, щонайменше, близько 0,1. Варіант здійснення A56. Спосіб Варіанта здійснення A55, де мольне співвідношення реагенту (4) до реагенту (1) складає, щонайменше, близько 0,15. Варіант здійснення A57. Спосіб кожного з Варіантів здійснення A1-A56, де мольне співвідношення реагенту (4) до реагенту (1) складає менше ніж близько 1. Варіант здійснення A58. Спосіб кожного з Варіантів здійснення A1-A57, де мольне співвідношення реагенту (4) до реагенту (1) складає не більше ніж близько 0,5. Варіант здійснення A59. Спосіб Варіанта здійснення A58, де мольне співвідношення реагенту (4) до реагенту (1) складає не більше ніж близько 0,4. Варіант здійснення A60. Спосіб Варіанта здійснення A59, де мольне співвідношення реагенту (4) до реагенту (1) складає не більше ніж близько 0,3. Варіант здійснення A61. Спосіб Варіанта здійснення 60, де мольне співвідношення реагенту (4) до реагенту (1) складає не більше ніж близько 0,2. Варіант здійснення A62. Спосіб кожного з Варіантів здійснення A1-A61, де реагент (3) і реагент (4) містить йодид міді(I). Варіант здійснення A63. Спосіб кожного з Варіантів здійснення A1-A62, де реагент (1), реагент (2), реагент (3), реагент (4) і реагент (5) вводять у контакт у присутності придатного органічного розчинника. Варіант здійснення A64. Спосіб кожного з Варіантів здійснення A1-A63, де реагент (1) вводять у контакт із придатним органічним розчинником для утворення суміші, і потім реагент (2), реагент (3), реагент (4) і реагент (5) послідовно додають у суміш. Варіант здійснення A65. Спосіб кожного з Варіантів здійснення A63 і A64, де придатний органічний розчинник містить один або більше розчинників, вибраних із групи, що включає галогеновані і негалогеновані аліфатичні та ароматичні вуглеводні. Варіант здійснення A66. Спосіб Варіанта здійснення A65, де придатний органічний розчинник містить один або більше розчинників, вибраних із групи, що включає ксилоли, толуол, хлорбензол, метоксибензол (також відомий як анізол), 1,2,4-триметилбензол, 1,3,5триметилбензол (також відомий як мезитилен), етилбензол, (1-метилетил)бензол (також відомий як кумол), C1-C3 алкіл-заміщені нафталіни (наприклад, 1-метилнафталін, 2метилнафталін, 1,5-диметилнафталін, 2,6-диметилнафталін і 1,3-диметилнафталін), ShellSol A100 (суміш C9-C10 ароматичних вуглеводнів) і ShellSol A150 (суміш C 10-C11 ароматичних вуглеводнів). Варіант здійснення A67. Спосіб Варіанта здійснення A66, де придатний органічний розчинник містить один або більше розчинників, вибраних із групи, що включає ксилоли, толуол, хлорбензол, анізол, 1,2,4-триметилбензол, мезитилен, 1-метилнафталін, ShellSol A100 і ShellSol A150. Варіант здійснення A67a. Спосіб Варіанта здійснення A66, де придатний органічний розчинник містить один або більше розчинників, вибраних із групи, що містить ксилоли, толуол, 1,2,4-триметилбензол, мезитилен і 1-метилнафталін. Варіант здійснення A68. Спосіб Варіанта здійснення A67 або A67a, де придатний органічний розчинник містить ксилоли, толуол, 1-метилнафталін або мезитилен. 6 UA 105173 C2 5 10 15 20 25 30 35 40 45 50 55 60 Варіант здійснення A69. Спосіб Варіанта здійснення A68, де придатний органічний розчинник містить ксилоли, толуол або мезитилен. Варіант здійснення A69a. Спосіб Варіанта здійснення A68, де придатний органічний розчинник містить 1-метилнафталін або мезитилен. Варіант здійснення A70. Спосіб Варіанта здійснення A69, де придатний органічний розчинник містить ксилоли. Варіант здійснення A71. Спосіб Варіанта здійснення A69, де придатний органічний розчинник містить толуол. Варіант здійснення A72. Спосіб кожного з Варіантів здійснення A69 і A69a, де придатний органічний розчинник містить мезитилен. Варіант здійснення A73. Спосіб кожного з Варіантів здійснення A63-A72, де співвідношення об'єму придатного органічного розчинника до ваги реагенту (1) складає, щонайменше, близько 2 мл/г. Варіант здійснення A74. Спосіб Варіанта здійснення A73, де співвідношення об'єму придатного органічного розчинника до ваги реагенту (1) складає, щонайменше, близько 3 мл/г. Варіант здійснення A75. Спосіб Варіанта здійснення A74, де співвідношення об'єму придатного органічного розчинника до ваги реагенту (1) складає, щонайменше, близько 4 мл/г. Варіант здійснення A76. Спосіб кожного з Варіантів здійснення A63-A75, де співвідношення об'єму придатного органічного розчинника до реагенту (1) складає не більше ніж близько 10 мл/г. Варіант здійснення A77. Спосіб Варіанта здійснення A76, де співвідношення об'єму придатного органічного розчинника до ваги реагенту (1) складає не більше ніж близько 6 мл/г. Варіант здійснення A78. Спосіб Варіанта здійснення A77, де співвідношення об'єму придатного органічного розчинника до ваги реагенту (1) складає не більше ніж близько 5 мл/г. Варіант здійснення A79. Спосіб кожного з Варіантів здійснення A1-A78, де реагент (1), реагент (2), реагент (3), реагент (4) і реагент (5) вводять у контакт у присутності придатного органічного розчинника для утворення суміші, тиск над сумішшю збільшують вище атмосферного тиску і температуру суміші збільшують вище нормальної точки кипіння 2 розчинника (тобто точки кипіння при тиску 100 кПa або 14,5 фунт/дюйм (абс.)). Варіант здійснення A80. Спосіб Варіанта здійснення A79, де придатний органічний розчинник містить ксилоли, толуол або анізол. Варіант здійснення A81a. Спосіб Варіанта здійснення A80, де придатний органічний розчинник містить ксилоли або толуол. Варіант здійснення A82. Спосіб кожного з Варіантів здійснення A1-A81a, де реагент (1), реагент (2), реагент (3), реагент (4) і реагент (5) вводять у контакт із придатним органічним розчинником при температурі не більше ніж близько 200 °C. Варіант здійснення A83. Спосіб Варіанта здійснення A82, де реагент (1), реагент (2), реагент (3), реагент (4) і реагент (5) вводять у контакт із придатним органічним розчинником при температурі не більше ніж близько 180 °C. Варіант здійснення A84. Спосіб Варіанта здійснення A83, де реагент (1), реагент (2), реагент (3), реагент (4) і реагент (5) вводять у контакт із придатним органічним розчинником при температурі не більше ніж близько 170 °C. Варіант здійснення A85. Спосіб Варіанта здійснення A84, де реагент (1), реагент (2), реагент (3), реагент (4) і реагент (5) вводять у контакт із придатним органічним розчинником при температурі не більше ніж близько 165 °C. Варіант здійснення A86. Спосіб кожного з Варіантів здійснення A1-A85, де реагент (1), реагент (2), реагент (3), реагент (4) і реагент (5) вводять у контакт із придатним органічним розчинником при температурі більше ніж близько 115 °C. Варіант здійснення A87. Спосіб Варіанта здійснення A86, де реагент (1), реагент (2), реагент (3), реагент (4) і реагент (5) вводять у контакт із придатним органічним розчинником при температурі більше ніж близько 145 °C. Варіант здійснення A88. Спосіб Варіанта здійснення A87, де реагент (1), реагент (2), реагент (3), реагент (4) і реагент (5) вводять у контакт із придатним органічним розчинником при температурі більше ніж близько 155 °C. Варіант здійсненняA89. Спосіб Варіанта здійснення A88, де реагент (1), реагент (2), реагент (3), реагент (4) і реагент (5) вводять у контакт із придатним органічним розчинником при температурі більше ніж близько 160 °C. Варіант здійснення A90. Спосіб Варіанта здійснення A1, де X являє собою Br, і сполуку Формули 1 одержують у вигляді твердого продукту, що включає контакт реагенту (1) із придатним органічним розчинником для утворення суміші, і потім послідовне додавання 7 UA 105173 C2 5 10 15 20 25 30 35 40 45 50 реагенту (2), реагенту (3), реагенту (4) і реагенту (5) до суміші, підтримку температури суміші від близько 145 до 180 °C протягом від близько 5 до близько 8 годин, охолодження суміші до близько 0-50 °C, додавання води до суміші, необов'язкове додавання мідь-координуючого засобу до суміші, необов'язкове перемішування протягом від близько 1 до близько 24 годин, і потім відновлення сполуки Формули 1 у вигляді твердого продукту із суміші. Варіант здійснення A91. Спосіб Варіанта здійснення A1, де X являє собою Cl, і сполуку Формули 1 одержують у вигляді твердого продукту, що включає контакт реагенту (1) із придатним органічним розчинником для утворення суміші, і потім послідовне додавання реагенту (2), реагенту (3), реагенту (4) і реагенту (5) до суміші, підтримку температури суміші від близько 150 до 200 °C протягом від близько 5 до близько 24 годин, охолодження суміші до близько 0-50 °C, додавання води до суміші, необов'язкове додавання мідь-координуючого засобу до суміші, необов'язкове перемішування протягом від близько 1 до близько 24 годин, і потім відновлення сполуки Формули 1 у вигляді твердого продукту із суміші. Варіант здійснення B1. Спосіб, описаний у Короткому описі винаходу для отримання сполуки Формули 4, що використовує сполуку Формули 1, отриману зі сполуки Формули 2. Варіант здійснення B2. Спосіб Варіанта здійснення B1, де сполуку Формули 1 одержують зі сполуки Формули 2 способом за кожним з Варіантів здійснення A1-A91. Варіант здійснення B3. Спосіб Варіанта здійснення B1 або B2, де Z являє собою N. Варіант здійснення B4. Спосіб Варіанта здійснення B1 або B2, де Z являє собою CH. 3 Варіант здійснення B5. Спосіб кожного з Варіантів здійснення B1-B4, де R являє собою C1C4 алкіл, циклопропіл, циклопропілциклопропіл, циклопропілметил або метилциклопропіл. 3 Варіант здійснення B6. Спосіб Варіанта здійснення B5, де R являє собою C1-C4 алкіл або циклопропілметил. 3 Варіант здійснення B7. Спосіб Варіанта здійснення B6, де R являє собою метил. 2 Варіант здійснення B8. Спосіб кожного з Варіантів здійснення B1-B7, де R являє собою метил. 11 Варіант здійснення B9. Спосіб кожного з Варіантів здійснення B1-B8, де R являє собою Br. 12 Варіант здійснення B10. Спосіб кожного з Варіантів здійснення B1-B9, де R являє собою Cl. 13 Варіант здійснення B11. Спосіб кожного з Варіантів здійснення B1-B10, де R являє собою H. Варіант здійснення B12. Спосіб кожного з Варіантів здійснення A1-A91 або B1-B11, де сполука Формули 1 являє собою 2-аміно-5-ціано-N,3-диметилбензамід. Варіант здійснення C1. Спосіб, описаний у Короткому описі винаходу, або за кожним з 5 Варіантів здійснення A1-A91 або B1-B12, де R являє собою H; або C1-C12 алкіл, необов'язково 9 10 заміщений NR R , якщо не дане більш точне визначення. Варіант здійснення C2. Спосіб, описаний у Короткому описі винаходу, або за кожним з 6 7 8 Варіантів здійснення A1-A91, B1-B12 або C1, де кожний R , R і R являє собою незалежно H або C1-C12 алкіл, якщо не дане більш точне визначення. Варіанти здійснення даного винаходу можуть комбінуватися будь-яким способом. Слід зазначити спосіб кожного з Варіантів здійснення A1-A90 або B1-B12, де X являє собою Br. Також слід зазначити спосіб кожного з Варіантів здійснення A1-A89, A91 або B1-B12, де X являє собою Cl. 1 2 3 4 5 6 7 8 11 12 13 У наступних Схемах 1-8 позначення R , R , R , R , R , R , R , R , R , R , R , X і Z у сполуці Формул 1-10 є такими, як визначені вище в Короткому описі винаходу та описі Варіантів здійснення, якщо не зазначено інше. Формули 1a, 1b і 1c є підкласом Формули 1. Формула 2a є підкласом Формули 2. Як показано на Схемі 1, у способі даного винаходу сполуку Формули 1 одержують шляхом контакту сполуки Формули 2 з, щонайменше, одним ціанідом металу (тобто реагентом ціаніду металу), щонайменше, однією сіллю міді(I) (тобто реагентом солі міді(I)), щонайменше, однією сіллю йодистоводневої кислоти (тобто реагентом солі йодистоводневої кислоти) і, щонайменше, однією сполукою Формули 3. 8 UA 105173 C2 Схема 1 5 10 15 20 25 30 35 40 У даному способі реагент ціаніду металу, зокрема, містить, щонайменше, одну сполуку, обрану з групи, що складається з ціанідів лужних металів і гексаціанофератів(II) лужних металів 1 1 і ціаніду міді(I). Придатні ціаніди лужних металів включають сполуки формули M CN, де M - це лужний метал, такий як натрій або калій. Придатні гексаціаноферати(II) лужних металів включають, наприклад, гексаціаноферат(II) калію і гексаціаноферат(II) натрію, обидва з який є комерційно доступними за низькою ціною, є нетоксичними, зручними в застосуванні, і мають шість іонів ціаніду, доступних для переносу на сполуки Формули 2. Найвищі виходи сполук Формули 1 звичайно досягаються, коли використовується реагент ціаніду металу, що включає ціанід натрію. Типово еквівалентне співвідношення ціаніду реагенту ціаніду металу щодо сполуки Формули 2 складає від близько 1 до близько 2,1, і більш типово від близько 1,15 до близько 1,55. Проте, використання більших кількостей реагенту ціаніду металу може бути переважним для видалення міді в ході виділення сполук Формули 1. Ціаніди лужних металів, такі як ціанід натрію, є особливо придатними як мідь-координуючі засоби для полегшення видалення міді в ході виділення сполук Формули 1. Коли додаткові кількості реагенту ціаніду металу, що включає ціанід лужного металу (наприклад, ціанід натрію), включені в реакційну суміш для полегшення наступного видалення міді, еквівалентне співвідношення реагенту ціаніду металу щодо сполуки Формули 2 складає типово від близько 1,4 до близько 2,1 або навіть вище. Коли використовується ціанід лужного металу, то може бути корисним зниження розміру частки ціаніду лужного металу за допомогою стандартних способів, таких як розтирання або розмел, до додавання ціаніду лужного металу до реакційної суміші. Типово ціанід лужного металу, що був розтертий або розмелений, є особливо переважним, коли використовується тільки стехіометрична кількість або ненабагато більше ціаніду лужного металу. Навпроти, коли ціанід лужного металу використовується у великому надлишку, такому як кількість, достатня не тільки для етапу ціанування, але також і для наступного видалення міді з реакційної суміші (тобто близько 1,4-2,1 щодо Формули 2), розтирання або розмел ціаніду лужного металу може забезпечувати невелику перевагу, у порівнянні з використанням ціаніду лужного металу, не розтертого або розмеленого до додавання до реакційної суміші. У способі Схеми 1 реагент солі міді(I), як вважають, діє як джерело хімічних видів, що каталізують перетворення сполук Формули 2 у Формулу 1. Придатні реагенти солі міді(I) включають одну або більше сполук, вибраних із групи, що включає солі міді(I), таких як йодид міді(I), бромід міді(I), хлорид міді(I), ціанід міді(I) і трифлат міді(I) (CuOSO 2CF3). Мольне співвідношення реагенту солі міді(I) (на основі Cu(I)) до сполуки Формули 2 складає від близько 0,01 до близько 1, і типово від близько 0,01 до близько 0,99, і більш типово від близько 0,1 до близько 0,4. Коли X являє собою Br, то оптимальні результати типово одержують від мольних співвідношень від близько 0,1 до близько 0,3 реагенту солі міді(I) до сполуки Формули 2. Оскільки сполуки Формули 2, де X являє собою Cl, загалом, менш реакційноздатні, ніж відповідні сполуки Формули 2, у реакції Схеми 1 типово використовують великі кількості міді(I) для того, щоб викликати реакцію, коли X являє собою Cl. Тим самим, коли X являє собою Cl, типово використовують мольні співвідношення від близько 0,3 до близько 0,4 реагенту солі 9 UA 105173 C2 5 10 15 20 25 30 35 40 45 50 55 60 міді(I) до сполуки Формули 2. Поза зв'язком з якою-небудь конкретною теорією, вважають, що в умовах даного способу 5бром або -хлор похідне Формули 2, щонайменше, частково перетворюється у відповідне 5-йод похідне в присутності солі йодистоводневої кислоти. Придатні реагенти солі йодистоводневої кислоти включають одну або більше сполук, вибраних із групи, що включає солі йодистоводневої кислоти четвертинного амонію, лужних і лужноземельних металів, таких як йодид міді(I), йодид натрію, йодид калію, йодид цинку, йодид літію, йодид кальцію, йодид тетрабутиламонію і йодид тетраметиламонію. Мольне співвідношення солі йодистоводневої кислоти до сполуки Формули 2 складає від близько 0,001 до близько 1, і більш типово від близько 0,05 до близько 0,4, і найбільше типово від близько 0,1 до близько 0,4. У способі Схеми 1 найвищі виходи сполук Формули 1 з оптимальними швидкостями реакції найчастіше одержували, коли йодид міді(I) (CuI) використовували як джерело реагенту солі міді(I) і реагенту солі йодистоводневої кислоти. Коли йодид міді(I) (CuI) використовували в даному способі, типово мольне співвідношення складало від близько 0,1 до близько 0,4 щодо сполуки Формули 2. У деяких випадках може бути корисно використовувати йодид міді(I) у комбінації з іншим реагентом солі йодистоводневої кислоти, таким як йодид натрію, йодид калію, йодид цинку, йодид тетрабутиламонію або йодид тетраметиламонію. Користь комбінування йодиду міді(I) з іншим реагентом солі йодистоводневої кислоти залежить від специфічних умов реакції і субстрату. Типово оптимальні виходи сполук Формули 1 можуть бути отримані з даного способу просто з використанням йодиду міді(I) як єдине джерело реагенту солі йодистоводневої кислоти. Сполуки Формули 3 діють як ліганди в способі Схеми 1. Можуть використовуватися як монодентатні хелатуючі ліганди, що включають необов'язково заміщене імідазольне кільце, так і бідентатні хелатуючі ліганди, що включають 2 необов'язково заміщених імідазольних кільця. Виявлено, що ці ліганди прискорюють швидкість перетворення сполук Формули 2 у Формулу 1. Поза зв'язком з якою-небудь конкретною теорією, вважають, що ліганди полегшують реакцію шляхом збільшення розчинності, реактивності і/чи стабільності активних каталітичних видів міді(I) за допомогою утворення комплексу мідь-ліганд. Сполуки Формули 3, що включають імідазол і широке розмаїття імідазол- заміщених похідних, придатні в якості лігандів у даному 5 6 7 8 способі. Типово ліганди Формули 3 включають сполуки, де R , R , R і R являють собою незалежно H або C1-C4 алкіл, такий як 1-метил-1H-імідазол, 1-етил-1H-імідазол, 1-пропіл-1Hімідазол, 1-бутил-1H-імідазол, 1-пентил-1H-імідазол, 1-гексил-1H-імідазол і 4-метилімідазол. 5 Також придатними є біс(імідазоліл)алкани (тобто, де R являє собою C1-C12 алкіл, заміщений 9 10 NR R ), такі як 1,1'-(1,4-бутандііл)біс-1H-імідазол, 1,1'-(1,5-пентандііл)біс-1H-імідазол і 1,1'-(1,6гександііл)біс-1H-імідазол. У способі Схеми 1 типово найвищі виходи сполук Формули 1 і найбільш сприятливі швидкості реакції досягалися з використанням одного або декількох з наступних комерційно доступних лігандів: 1-метил-1H-імідазол, 1-бутил-1H-імідазол, 4метилімідазол і 1,1'-(1,6-гександііл)біс-1H-імідазол. Мольне співвідношення сполук Формули 3 до реагенту солі міді(I) складає типово від близько 1 до близько 10. Тому що мольні співвідношення більше ніж 1 можуть найчастіше прискорювати реакцію, тоді як співвідношення вище 6 у цілому дають невелику додаткову користь при зростаючих витратах, то переважним є співвідношення від близько 1,5 до близько 6. Реакцію Схеми 1 типово проводять у придатному органічному розчиннику. Можуть використовуватися різноманітні розчинники для утворення придатного розчинника для цього способу. Типово, спосіб найбільш задовільно проводять, використовуючи розчинники, у яких сполуки Формули 2 переважно або цілком, щонайменше, значно розчиняються, і реагент ціаніду металу має низьку розчинність в об'ємі використовуваних розчинників і при температурах реакції. Приклади придатних розчинників включають галогеновані і негалогеновані аліфатичні та ароматичні вуглеводні, такі як ксилоли, толуол, хлорбензол, метоксибензол (також відомий як анізол), 1,2,4-триметилбензол, 1,3,5-триметилбензол (також відомий як мезитилен), етилбензол, (1-метилетил)бензол (також відомий як кумол), C 1-C3 алкіл-заміщені нафталіни (наприклад, 1-метилнафталін, 2-метилнафталін, 1,5-диметилнафталін, 2,6-диметилнафталін і 1,3-диметилнафталін) і суміші ароматичних розчинників, що є твердими, наприклад, від Shell Chemical під торговою назвою ShellSol, зокрема, ShellSol A100 (суміш C 9-C10 ароматичних вуглеводнів) і ShellSol A150 (суміш C10-C11 ароматичних вуглеводнів), включаючи суміші вищезгаданих розчинників. Спосіб найбільш задовільно проводять, використовуючи розчинник, що передбачає температури реакції від близько 150 до 180 °C. Цього можна досягти використанням розчинника з нормальною точкою кипіння (тобто точкою кипіння при тиску 100 кПа) у межах або вище цього діапазону, або шляхом роботи при підвищеному тиску з низькокиплячим розчинником, таким як ксилоли або толуол. Розчинники ксилоли або толуол є 10 UA 105173 C2 5 10 15 20 25 30 35 40 45 50 55 60 придатними розчинниками, тому що високі виходи сполук Формули 1 типово одержують, коли використовують ці розчинники, особливо коли даний спосіб проходить при підвищеному тиску. При використанні ксилолів як розчинника може бути використаний окремий ізомер (тобто oксилол, m-ксилол або p-ксилол), але використання суміші ізомерів ксилолів є комерційно переважним, тому що це забезпечує в однаковій мірі гарні результати при більш низькій вартості. Спосіб також традиційно проводять, використовуючи розчинник з нормальною точкою кипіння в діапазоні від близько 150 до 180 °C, такий як 1,3,5-триметилбензол, 1-метилнафталін, суміші C9-C11 ароматичних розчинників або їхньої суміші. Зокрема, виявлено, що застосування розчинника (тобто з нормальною точкою кипіння в діапазоні від близько 150 до 180 °C), що включає 1-метилнафталін або 1,3,5-триметилбензол, приводить до високих виходів сполук Формули 1. Об'єм органічного розчинника щодо ваги сполуки Формули 2 складає типово від близько 2 мл/г до близько 10 мл/г. Кількості розчинника більше ніж 2 мл/г можуть полегшувати перемішування реакційної суміші, але великі кількості розчинника можуть уповільнювати реакцію, а також збільшувати вартість; тому типово об'єм розчинника до ваги сполуки Формули 2 складає від близько 2 мл/г до близько 5 мл/г, і більш типово від близько 2 мл/г до 4 мл/г. Розчинник може бути доданий різними способами та у різні проміжки часу в ході реакції, а саме: в одній партії на початку послідовності реакцій, або порціями у ході послідовності реакцій, або періодично в процесі додавання одного або більше реагентів. Наприклад, один або кілька реагентів можуть бути дисперговані, розчинені або частково розчинені в придатному органічному розчиннику і потім додані до суміші, що включає інші реагенти і додаткову кількість придатного органічного розчинника. У даному способі порядок, у якому комбінують реагенти, не є критичним для результату реакції. Один порядок комбінації, наприклад, включає комбінування сполуки Формули 2 із придатним органічним розчинником для утворення суміші, і потім послідовне додавання реагенту ціаніду металу, реагенту солі міді(I), реагенту солі йодистоводневої кислоти і, щонайменше, однієї сполуки Формули 3 до суміші. Альтернативно, у деяких випадках переважним є розчинення, щонайменше, однієї сполуки Формули 3 і реагенту солі міді(I) у придатному органічному розчиннику і додавання цього розчину до суміші, що включає сполуку Формули 2, реагент ціаніду металу, реагент солі йодистоводневої кислоти і придатний органічний розчинник. Або альтернативно, щонайменше, одна сполука Формули 3 може бути розчинена в придатному органічному розчиннику і додана до суміші, що включає сполуку Формули 2, реагент ціаніду металу, реагент солі міді(I), реагент солі йодистоводневої кислоти і придатний органічний розчинник. Для цього способу додавання типово придатний органічний розчинник (тобто сполука, що розчиняє, або суміш сполук, що розчиняють), що застосовують для розчинення сполук(и) Формули 3 і реагенту солі міді(I), є тим же придатним органічним розчинником, що застосовують для утворення суміші, що включає компоненти реакції. Розмаїття інших порядків додавання також є придатним для даного способу. Спосіб Схеми 1 переважно проводять у безкисневому середовищі, хоча це не є істотним для успішного результату реакції. Виявили, що зниження присутності атмосферного кисню в реакційній посудині до та у процесі додавання реагентів і підтримка безкисневого середовища в ході протікання реакції є переважним. Можуть використовуватися стандартні методики для отримання безкисневого середовища, включаючи, наприклад, створення вакууму в реакційній посудині з використанням вакуумного насоса, і потім підкачування заново до атмосферного тиску інертним газом (наприклад, азотом або аргоном). Цей спосіб можуть повторювати два або більше разів для подальшого зниження присутності кисню в реакційній посудині. Альтернативно реакційна посудина може продуватися інертним газом, і потім позитивний тиск інертного газу може підтримуватися протягом реакції. Реакцію Схеми 1 відповідно до даного способу типово проводять при температурах від близько 115 до 200 °C і більш типово від близько 145 до 200 °C. Температури від близько 150 до 180° найчастіше приводять до найвищого виходу і чистоти з найбільш сприятливими швидкостями реакції; наприклад, у більшості випадків сполуки Формули 1 одержують з виходами більше ніж 95 % або більше за від близько 5 до близько 8 годин. Продукт Формули 1 можна виділити стандартними методиками, відомими з рівня техніки, включаючи фільтрацію, екстракцію, випарювання і кристалізацію. Наприклад, реакційне середовище можна розвести від близько 2 до 8 частинами за вагою води щодо сполуки Формули 2 для розчинення неорганічних солей, що присутні в реакційному середовищі. Оскільки сполуки Формули 1 є типово твердими речовинами при температурі навколишнього середовища та загалом важко розчинні в розчиннику реакції, то вони найбільш легко виділяються за допомогою фільтрації з наступним відмиванням водою і необов'язково органічним розчинником (наприклад, ксилолами, толуолом, 1,3,5-триметилбензолом). Якщо 11 UA 105173 C2 5 10 15 20 25 30 35 сполуки Формули 1 розчинні в розчиннику реакції, то вони найбільш традиційно виділяються за допомогою розведення реакційного середовища водою для розчинення неорганічних солей, потім відділення органічної фази, необов'язково з наступним відмиванням водою, для видалення залишкових кількостей солей і/або ціанідів металів, і потім видалення розчинника дистиляцією або випарюванням при зниженому тиску. У деяких випадках може бути переважним додавання водорозчинного мідь-координуючого засобу для оптимізації видалення міді до виділення сполук Формули 1. Придатні мідь-координуючі засоби включають, наприклад, 2,2'- тіодіетанол, етилeндіамін, N, N'-диметилетилендіамін, N, N,N',N'-тетраметилетилендіамін і ціаніди лужних металів. Особливо придатними для видалення міді є етилендіамін і ціаніди лужних металів. Якщо ціанід лужного металу (наприклад, ціанід натрію) використовується в даному способі як мідь-координуючий засіб, типово від близько 0,3 до близько 0,6 молей щодо сполук Формули 2 є придатними для зниження кількості залишкової міді в сполуках Формули 1. Ця кількість ціаніду натрію може бути додана, коли доданий реагент ціаніду металу (тобто в процесі реакції ціанування, як обговорюється вище) або по завершенню реакції і до виділення сполук Формули 1. Для першого способу додавання ціанід лужного металу додають у безводній формі, а для другого способу він додається або в безводній формі, або у вигляді водного розчину. Сполуки Формули 1 можуть далі бути очищені за допомогою рекристалізації з прийнятного органічного розчинника. Приклади прийнятних розчинників включають метанол, етанол, i-пропанол, n-пропанол, толуол, ксилоли і хлорбензол. Спосіб Схеми 1 проілюстрований у Прикладах 1-21 нижче. Приклади 3 і 4 ілюструють спосіб Схеми 1, включаючи обробку реакційної суміші етилендіаміном до виділення сполуки Формули 1. Особливості даного способу забезпечують ефективні методи, використовуючи недорогі реагенти для виробництва похідних 3-заміщеної 2-аміно-5-ціанобензойної кислоти Формули 1 з високими виходами (типово 95 % або більше на основі молів використовуваної сполуки Формули 2) за від близько 5 до 8 годин. Слід особливо зазначити, що даний спосіб може використовуватися для забезпечення надзвичайно високих виходів сполук Формули 1 з винятковою чистотою, незважаючи на те, що ці сполуки, також як і вихідні сполуки Формули 2, містять аміно-замісники та у деяких випадках амідні замісники, що можуть потенційно брати участь у побічних реакціях. Вихідні сполуки Формули 2 можуть бути отримані за допомогою ряду способів, відомих з галузі техніки. Як показано на Схемі 2, відповідно до одного способу сполуки Формули 2 можуть бути отримані шляхом галогенування сполуки Формули 5 з використанням різних реагентів, відомих у літературі, включаючи бром, хлор, сульфурилхлорид, N-хлорсукцинімід (NCS), Nбромсукцинімід (NBS) і галогенуючі реагенти, такі як суміші, що включають перекис водню і гідрогалогенід. Для вказівки на посилання, що описують ці способи, дивися PCT Патентні Публікації WO 1998/16503 (Схема 4 і Приклад 132), WO 2006/068669 (Схема 11), WO 2003/015519 (Схема 4 і Приклад 1, Етап A) і WO 2006/062978 (Схема 15; Приклад 4, Етап B і Приклад 5, Етап B). Схема 2 40 1 45 Інший спосіб для отримання сполуки Формули 2, де X являє собою Br і R являє собою 3 NHR , включає бромування сполук Формули 5 шляхом обробки газом, що містить бром, як проілюстровано за допомогою процедури Довідкового приклада 1 (Довідковий Приклад 1 також показаний у PCT Патентній Публікації WO 2008/082502). 1 3 Сполуки Формули 2a (Формули 2, де R являє собою NHR ) також можуть бути отримані шляхом контакту ізатоєвого ангідриду Формули 6 з алкіламіном Формули 7 у присутності карбонової кислоти, як показано на Схемі 3. 50 12 UA 105173 C2 Схема 3 5 10 15 20 25 30 35 40 45 50 Оскільки аміни, такі як сполука Формули 7, є основами, то при відсутності карбонової кислоти, суміш сполук Формул 6 і 7 буде основною (тобто ефективний pН > 7). Карбонова кислота діє як буфер для зменшення ефективного pН реакційної суміші. Широке розмаїття карбонових кислот є придатним, тому що єдиною вимогою, щонайменше, для однієї групи карбонової кислоти є забезпечення кислотності. Можуть бути присутні інші функціональні групи, і більше ніж одна група карбонової кислоти може бути присутня на молекулі карбонової кислоти. Типово карбонова кислота має ефективний pKa у діапазоні від близько 2 до близько 5. Карбонові кислоти включають, наприклад, мурашину кислоту, оцтову кислоту, пропіонову кислоту, хлороцтову кислоту, бензойну кислоту, фталеву кислоту, малеїнову кислоту, винну кислоту і лимонну кислоту. Через вартість, недорогі карбонові кислоти, такі як мурашина кислота, оцтова кислота, пропіонова кислота і бензойна кислота, є переважними. Оцтова кислота, що комерційно доступна за низькою ціною в її безводній формі (відомій як "крижана оцтова кислота") є особливо переважною. Комбінація карбонової кислоти з основним аміном Формули 7 утворює амінну сіль карбонової кислоти. Ця амінна сіль може бути отримана до додавання ізатоєвого ангідриду сполуки Формули 6, або амінна сіль може бути утворена in situ шляхом дозування аміну Формули 7 у суміш сполуки Формули 6 і карбонової кислоти. Для кожного зі способів додавання підтримка ефективного pН суміші в ході реакції від близько 3 до близько 7 є загалом оптимальним. Оскільки ефективний pН суміші є результатом буферного ефекту карбонової кислоти в комбінації з аміном Формули 7, то ефективний pН може бути відрегульований відповідно до ефективного pKa карбонової кислоти шляхом регулювання молярного співвідношення карбонової кислоти до аміну Формули 7. Типово молярні кількості аміну Формули 7 до карбонової кислоти знаходяться в діапазоні від близько 0,8 до близько 3. Більш конкретно, коли спосіб комбінації включає дозування аміну Формули 7 у суміш ізатоєвого ангідриду сполуки Формули 6 і карбонової кислоти, то молярне співвідношення аміну Формули 7 до карбонової кислоти складає переважно від близько 0,95 до близько 3. Коли спосіб комбінації включає утворення амінної солі до додавання сполуки Формули 6, то молярне співвідношення аміну Формули 7 до карбонової кислоти складає переважно від близько 0,8 до близько 1,05; оскільки використовується майже еквімолярне співвідношення (наприклад, від близько 0,95 до близько 1,05) аміну Формули 7 до карбонової кислоти, то амінна сіль, що утворюється таким чином, типово використовується в співвідношенні від близько 1,1 до близько 5 молярних еквівалентів щодо сполуки Формули 6. Для оптимальних перетворень молярне співвідношення аміну Формули 7 до ізатоєвого ангідриду сполуки Формули 6 повинне бути, щонайменше, 1,0, хоча переважно, щоб молярне співвідношення складало від близько 1,1 до близько 1,5 з метою ефективності та економічності, незалежно від того, як змішують компоненти. Молярна кількість аміну Формули 7 щодо сполуки Формули 6 може бути значно більше ніж 1,5, особливо коли використовується майже еквімолярне співвідношення (наприклад, від близько 0,95 до близько 1,05) аміну до кислоти. Найвищий вихід продукту і чистота досягалися, коли реакційне середовище було істотно безводним. Реакційне середовище, таким чином, утворюється з істотно безводної сполуки Формул 6 і 7 і карбонової кислоти. Переважно реакційне середовище та утворюючі матеріали містять близько 5 % або менше, більш переважно близько 1 % або менше, і найбільше переважно близько 0,1 % води або менше (за вагою). Якщо карбонова кислота являє собою оцтову кислоту, то переважно у формі крижаної оцтової кислоти. Реакцію Схеми 3 типово проводять у рідкій фазі. У багатьох випадках реакцію можна 13 UA 105173 C2 5 10 15 20 25 30 провести без розчинника, відмінного від сполук Формул 2a, 6 і 7 і карбонової кислоти. Але краща процедура включає використання розчинника, що може суспендувати і, щонайменше, частково розчиняти реагенти. Переважними розчинниками є ті, що є нереактивними з компонентами реакції і мають діелектричну постійну, рівну близько 5 або більше, такі як нітрили алкілів, складні ефіри, прості ефіри і кетони. Переважно розчинник повинний бути істотно безводним для того, щоб полегшити отримання істотно безводного реакційного середовища. Вага розчинника до сполуки Формули 6 складає типово від близько 1 до близько 20 і переважно близько 5 з метою ефективності та економічності. Двоокис вуглецю утворюється як побічний продукт реакції Схеми 3. Основна частина утвореного двоокису вуглецю виділяється з реакційного середовища у вигляді газу. Додавання сполуки Формули 6 у реакційне середовище, що містить амін Формули 7, або додавання аміну Формули 7 у реакційне середовище, що містить сполуку Формули 6, переважно проводять при такій швидкості і температурах, щоб полегшити контроль виділення двоокису вуглецю. Температура реакційного середовища складає типово від близько 5 до 75 °C, більш типово від близько 35 до 55 °C. Продукт Формули 2a може бути виділений стандартними методиками, відомими з рівня техніки, включаючи pН регулювання, екстракцію, випарювання, кристалізацію і хроматографію. Наприклад, реакційне середовище можуть розводити від близько 3 до 15 частинами за вагою води щодо вихідної сполуки Формули 6, pН можуть необов'язково регулювати або кислотою, або основою для оптимізації видалення або кислотних, або основних домішок, водну фазу можуть необов'язково відокремлювати, і основну частину органічного розчинника можуть видаляти шляхом дистиляції або випарювання при зниженому тиску. Оскільки сполуки Формули 2a є типово кристалічними твердими речовинами при температурі навколишнього середовища, то їх, загалом, найбільш просто виділити за допомогою фільтрації, необов'язково з наступним відмиванням водою і потім висушуванням. Як показано на Схемі 4, ізатоєві ангідриди Формули 6 можна одержати з антранілових 1 4 4 кислот Формули 2b (Формули 2, де R являє собою OR і R являє собою H, що можуть бути отримані способом Схеми 2) шляхом реакції циклізації, включаючи обробку антранілових кислот фосгеном або еквівалентом фосгену, таким як трифосген або алкіл хлорформат (наприклад, метил хлорформат) у придатному розчиннику, такому як толуол або тетрагідрофуран. Спосіб описаний у PCT Патентній Публікації WO 2006/068669, включаючи специфічний приклад, що відноситься до Схеми 4. Також дивися Coppola, Synthesis 1980, 505 і Fabis et al., Tetrahedron 1998, 10789. Схема 4 35 40 45 50 Сполуки Формули 3 є комерційно доступними, і Джерела інформації: по синтезу описує безліч загальних способів утворення імідазолів; дивися, наприклад, Grimmett, Science of Synthesis 2002, 12, 325-528 і посилання, процитовані там. Біс(імідазоліл)алкани Формули 3, такі як 1,1'-(1,4-бутандііл)біс-1H-імідазол, 1,1'-(1,5пентандііл)біс-1H-імідазол, 1,1'-(1,6-гександііл)біс-1H-імідазол і подібне можуть бути отримані за допомогою реакції відповідного дигалоалкану (наприклад, 1,4-дибромбутану, 1,5дибромпентану, 1,6-дибромгексану) з 2 еквівалентами необов'язково заміщеного імідазолу в присутності основи, відповідно до загальних процедур, описаних Diez-Barra et al., Heterocycles 1992, 34(7), 1365-1373, Torres et al., Journal of Heterocyclic Chemistry 1988, 25(3), 771-782, Sato, et al., Heterocycles 2003, 60(4), 779-784, і Luo et al., Heterocycles 1995, 41(7), 1421-1424. В іншому аспекті даного винаходу сполуки Формули 1, отримані способом Схеми 1, придатні як проміжні сполуки для отримання сполук Формули 4. Сполуки Формули 4 придатні як інсектициди, як описано, наприклад, у PCT Патентних Публікаціях WO 2003/015518 і WO 2006/055922. 14 UA 105173 C2 R11 R2 N O N R12 NH Z NC C(O)NHR3 R13 4 5 10 15 20 25 де 2 R являє собою CH3 або Cl; 3 R являє собою H, C1-C4 алкіл, циклопропіл, циклопропілциклопропіл, циклопропілметил або метилциклопропіл; 14 Z являє собою CR або N; 11 R являє собою Cl, Br, CF3, OCF2H або OCH2CF3; 12 R являє собою F, Cl або Br; 13 R являє собою H, F або Cl; і 14 R являє собою H, F, Cl або Br; Різні способи можливі для отримання сполуки Формули 4 зі сполуки Формули 1. Як показано 1 на Схемі 5, один такий спосіб включає приєднання сполуки Формули 1a (Формула 1, де R являє 4 4 собою OR і R являє собою H) до піразол-5-карбонової кислоти Формули 8 з отриманням у результаті ціанобензоксазинону Формули 9. Наступна реакція ціанобензоксазинону з аміном Формули 7 забезпечує сполуку Формули 4. Умови для цього першого етапу включають послідовне додавання метансульфонілхлориду в присутності третинного аміну, такого як триетиламін або піридин, до піразолу Формули 8, з наступним додаванням сполуки Формули 1a, з наступним другим додаванням третинного аміну і метансульфонілхлориду. Реакція може проходити в чистому вигляді або в різних придатних розчинниках, включаючи тетрагідрофуран, діетиловий ефір, діоксан, толуол, дихлорметан або хлороформ з оптимальними температурами, що лежать у діапазоні від кімнатної температури до температури флегми розчинника. Другий етап, реакція бензоксазинонів з амінами для отримання антраніламідів, добре описаний у хімічній літературі. Для загального огляду хімії бензоксазинону дивись Jakobsen et al., Biоrganic and Medicinal Chemistry 2000, 8, 2095–2103 і посилання, процитовані там, і G. M. Coppola, J. Heterocyclic Chemistry 1999, 36, 563–588. Дивися також PCT Патентну Заявку WO 2004/067528, що повідомляє про загальний спосіб, показаний на Схемі 5, включаючи експериментальні приклади, що відносяться до Схеми 5. 15 UA 105173 C2 Схема 5 5 10 15 Інший спосіб отримання сполук Формули 4 показаний на Схемі 6. У цьому способі сполуку 1 Формули 4 одержують шляхом комбінування сполуки Формули 1b (Формула 1, де R являє 3 собою NHR ), піразолу Формули 8 і сульфонілхлорида відповідно до загального способу, про який повідомляється в PCT Патентній Публікації WO 2006/062978, що тим самим включена в даний опис у своїй повноті шляхом посилання. Схема 6 Як описано в WO 2006/062978, для цього перетворення можливі різні умови реакції. Типово сульфонілхлорид додають до суміші сполук Формул 1b і 8 у присутності розчинника і основи. Сульфонілхлориди загалом мають Формулу RS(O) 2Cl, де R являє собою радикал на основі вуглецю. Звичайно для цього способу R являє собою C 1-C4 алкіл, C1-C2 галоалкіл або феніл, необов'язково заміщений 1-3 замісниками, незалежно обраними з групи, що складається з галогену, C1-C3 алкілу і нітро. Комерційно доступні сульфонілхлориди включають 16 UA 105173 C2 5 10 15 20 25 30 35 40 45 метансульфонілхлорид (R являє собою CH 3), пропансульфонілхлорид (R являє собою (CH2)2CH3), бензолсульфонілхлорид (R являє собою феніл) і p-толуолсульфонілхлорид (R являє собою 4-метилфеніл). Метансульфонілхлорид слід особливо зазначити з погляду більш низької вартості, простоти додавання і/або меншої кількості відходів. Щонайменше, один молярний еквівалент сульфонілхлориду на моль сполуки Формули 8 стехіометрично необхідний для завершення перетворення. Типово молярне співвідношення сульфонілхлориду до сполуки Формули 8 складає не більше ніж близько 2,5, більш типово не більше ніж близько 1,4. Сполука Формули 4 утворюється, коли вихідні сполуки Формул 1b, 8 і сульфонілхлорид вводять у контакт один з одним у комбінованій рідкій фазі, у якій кожний є, щонайменше, частково розчинним. Оскільки вихідні матеріали Формул 1b і 8 є типово твердими речовинами при середніх температурах навколишнього середовища, то спосіб найбільш задовільно проводять, використовуючи розчинник, у якому вихідні сполуки мають значну розчинність. Таким чином, типово спосіб проводять у рідкій фазі, що включає розчинник. У деяких випадках карбонова кислота Формули 8 може мати тільки слабку розчинність, але її сіль з доданою основою може мати більшу розчинність у розчиннику. Придатні розчинники для цього способу включають нітрили, такі як ацетонітрил і пропіонітрил; складні ефіри, такі як метилацетат, етилацетат і бутилацетат; кетони, такі як ацетон, метил етиловий кетон (MEK), і метил бутиловий кетон; галоалкани, такі як дихлорметан і трихлорметан; прості ефіри, такі як етиловий ефір, метил трет-бутиловий ефір, тетрагідрофуран (ТГФ) і p-діоксан; ароматичні вуглеводні, такі як бензол, толуол, хлорбензол і дихлорбензол; третинні аміни, такі як триалкіламіни, діалкіланіліни, і необов'язково заміщені піридини; і суміші перерахованого вище. Розчинники, які слід зазначити, включають ацетонітрил, пропіонітрил, етилацетат, ацетон, MEK, дихлорметан, метил трет-бутиловий ефір, ТГФ, p-діоксан, толуол і хлорбензол. Розчинником, який слід зазначити особливо, є ацетонітрил, тому що він найчастіше забезпечує продукти в чудовому виході і/або чистоті. Оскільки реакція за даним способом утворює хлорид водню як побічний продукт, що може іншим способом зв'язуватися з основними центрами сполук Формул 1b, 4 і 8, то спосіб найбільш задовільно проводять у присутності, щонайменше, однієї додаткової основи. Основа може також полегшувати структурну взаємодію карбонової кислоти зі сполукою сульфонілхлориду та антраніламідом. Реакція доданої основи з карбоновою кислотою Формули 8 утворює сіль, що має більшу розчинність, ніж карбонова кислота в реакційному середовищі. Хоча основа може бути додана в той же час, за чергою або навіть після додавання сульфонілхлориду, основу типово додають до додавання сульфонілхлориду. Деякі розчинники, такі як третинні аміни, також служать як основи, і коли вони використовуються як розчинники, то вони будуть у великому стехіометричному надлишку як основи. Коли основа не використовується як розчинник, то номінальне мольне співвідношення основи до сульфонілхлориду складає типово від близько 2,0 до близько 2,2, і складає переважно від близько 2,1 до близько 2,2. Кращі основи являють собою третинні аміни, включаючи заміщені піридини. Більш переважні основи включають 2-піколін, 3-піколін, 2,6-лутидин і піридин. Як основу слід особливо зазначити 3піколін, тому що його солі з карбоновими кислотами Формули 8 є найчастіше високо розчинними в розчинниках, таких як ацетонітрил. Спосіб Схеми 6 проілюстрований у Прикладі 22 нижче. Сполуки Формули 4 можуть бути виділені з реакційних сумішей способами, відомими фахівцям у даній галузі техніки, включаючи кристалізацію, фільтрацію та екстракцію. Як розкривається в WO 2006/062978, у деяких випадках при умовах реакції приєднання Схеми 6 сполуки Формули 4 можуть частково циклізуватися з утворенням похідних імінобензоксазину Формули 10, як показано нижче на Схемі 7. Схема 7 17 UA 105173 C2 5 10 15 20 25 30 35 40 45 50 55 60 Як обговорюється в WO 2006/062978, у цих випадках часто переважним є перетворення сполук імінобензоксазину Формули 10 назад в аміди Формули 4 до виділення. Це перетворення може здійснюватися шляхом обробки реакційної суміші водним розчином кислоти (наприклад, водним розчином соляної кислоти); або шляхом виділення суміші сполук Формули 10 і Формули 4, і потім обробки суміші водним розчином кислоти, необов'язково в присутності придатного органічного розчинника (наприклад, ацетонітрилу). WO 2006/062978 розкриває специфічні приклади, що відносяться до способу Схеми 6, включаючи приклади, що ілюструють обробку реакційної суміші водним розчином кислоти до виділення сполук Формули 4. Приклад 22 нижче ілюструє спосіб Схеми 6, включаючи обробку реакційної суміші водним розчином соляної кислоти до виділення сполуки Формули 4. Альтернативно сполуки Формули 10 можуть перетворюватися назад у сполуки Формули 4 до виділення шляхом контакту реакційної суміші з водою і нагрівання. Типово перетворення сполук Формули 10 у сполуки Формули 4 може досягатися шляхом додавання води від близько 2 до 6 частин за вагою щодо ваги вихідної сполуки Формули 1 і потім нагрівання до від близько 45 до близько 65 °C. Перетворення сполуки Формули 10 у сполуку Формули 4 звичайно завершують за 1 годину або менше. Довідковий Приклад 2 нижче ілюструє спосіб Схеми 6, включаючи обробку реакційної суміші водою і нагрівання до виділення сполуки Формули 4. Піразол-5-карбонові кислоти Формули 8 можуть бути отримані з 5-оксо-3піразолідинкарбоксилатів шляхом обробки галогенуючим засобом для отримання 3-гало-4,5дигідро-1H-піразол-5-карбоксилатів, що можуть бути згодом оброблені засобом, що окисляє, щоб забезпечити складні ефіри Формули 8. Складні ефіри можуть потім перетворюватися в кислоти (тобто Формула 8). Галогенуючі засоби, що можуть використовуватися, включають, наприклад, оксигалогеніди фосфору, тригалогеніди фосфору, пентагалогеніди фосфору, тіонил хлорид, дигалотриалкілфосфорани, дигалодифенілфосфорани, оксаліл хлорид і фосген. Засобами, що окисляють, можуть бути, наприклад, перекис водню, органічні пероксиди, персульфат калію, персульфат натрію, персульфат амонію, моноперсульфат калію (наприклад, Oxone®) або перманганат калію. Дивися PCT Патентні Публікації WO 2003/016283, WO 2004/087689 і WO 2004/011453 для опису способів галогенування та окислювання, і процедури отримання вихідних 5-оксо-3-піразолідинкарбоксилатів. Для перетворення складних ефірів у карбонові кислоти можуть бути використані різні способи, описані в хімічній літературі, включаючи нуклеофільне відщіплення в безводних умовах або гідроліз, що включає застосування або кислот, або основ (дивися T. W. Greene і P. G. M. Wuts, Protective Groups in Оrganic Synthesis, 2-е вид., John Wiley & Sons, Inc., Н`ю Йорк, 1991, с. 224-269 для огляду способів). Гідролітичні способи, що каталізуються основою, є переважними для отримання карбонових кислот Формули 8 з відповідних складних ефірів. Придатні основи включають гідроксиди лужних металів (такі як гідроксиди літію, натрію або калію). Наприклад, складні ефіри можуть бути розчиненими в суміші води і спирту, такого як метанол. При обробці гідроксидом натрію або гідроксидом калію, складні ефіри омилюються для забезпечення солі карбонової кислоти натрію або калію. Закислення сильною кислотою, такою як соляна кислота або сірчана кислота, дає карбонові кислоти. PCT Патентна Публікація WO 2003/016283 забезпечує відповідний експериментальний приклад, що ілюструє спосіб гідролізу, що каталізується основою, для перетворення складного ефіру в кислоту. Альтернативно піразол-5-карбонові кислоти Формули 8 можуть бути отримані з 4,5-дигідро5-гідрокси-1H-піразол-5-карбоксилатів за допомогою реакції дегідратації, що каталізується кислотою, для отримання складних ефірів, що потім можна перетворити в кислоти Формули 8. Типові умови реакції включають обробку 4,5-дигідро-5-гідрокси-1H-піразол-5-карбоксилатів кислотою, наприклад, соляною кислотою, в органічному розчиннику, такому як оцтова кислота, при температурах від близько 0 до 100 °C. Спосіб описаний у PCT Патентній Публікації WO 2003/016282. Перетворення складних ефірів у кислоти може бути виконане з використанням способів, описаних вище. Також WO2003/016282 забезпечує відповідний експериментальний приклад для перетворення складного ефіру в кислоту. Антранілові аміди Формули 1a можуть також бути отримані з відповідних кислот або 1 4 4 складних ефірів Формули 1c (Формула 1, де R являє собою OR і R являє собою H або C1-C4 алкіл) як показано нижче на Схемі 8. Утворення амідів з карбонових кислот типово включає додавання сполучного засобу (наприклад, тетрахлориду кремнію, або, альтернативно, дициклогексилкарбодііміду, або 1-етил-3-(3-диметиламінопропіл) карбодііміду, часто в присутності 1-гідрокси-бензотриазолу). Отримання антранілових амідів з антранілових кислот розкрите в M. J. Kornet, Journal of Heterocyclic Chemistry 1992, 29(1), 103-5; PCT Публікації WO 01/66519-A2; T. Asano et al., Bioorganic & Medicinal Chemistry Letters 2004, 14(9), 2299-2302; H. L. Birch et al., Bioorganic & Medicinal Chemistry Letters 2005, 15(23), 5335-5339; і D. Kim et al., 18 UA 105173 C2 5 10 Bioorganic & Medicinal Chemistry Letters 2005, 15(8), 2129-2134. Також T. Asano et al. повідомляють про отримання антранілового аміду з антранілової кислоти через проміжну сполуку N-захищений анілін або через проміжну сполуку 4H-3,1-бензоксазин-2,4(1H)-діон (ізатоєвий ангідрид). Утворення амідів зі складних ефірів часто включає нагрівання складного ефіру з відповідним аміном у полярному розчиннику, такому як етиленгліколь. Процедура, придатна для перетворення антранілових складних ефірів в антранілові аміди, описана в PCT Патентній Публікації WO 2006/062978. Також E. B. Skibo et al., Journal of Medicinal Chemistry 2002, 45(25), 5543–5555 розкриває отримання антранілового аміду з відповідного антранілового складного ефіру з використанням каталізатора ціаніду натрію. Схема 8 R2 R2 NH2 NH2 3 R NH2 COOR4 NC 7 1c 15 20 25 30 35 40 45 50 C(O)NHR3 NC 1a Способи Схем 5 і 6 є ілюстративними тільки для двох з багатьох способів перетворення сполуки Формули 1 у карбоксамід сполуки Формули 4. У даній галузі техніки відоме широке розмаїття загальних способів для отримання карбоксамідів з карбонових кислот і амінів. Для загального огляду дивися M. North, Contemporary Org. Synth. 1995, 2, 269–287. Конкретні способи включають контакт сполуки Формули 1b зі сполукою Формули 8 у присутності дегідратуючого сполучного засобу, такого як 1,1'-карбонілдіімідазол, біс(2-оксо-3оксазолидиніл)фосфіновий хлорид, або бензотриазол-1-ілокситрис(диметиламіно)фосфонію гексафторфосфат, або зв'язаний з полімером аналогічний реагент, такий як зв'язаний з полімером дициклогексилкарбодіімід, типово в інертному розчиннику, такому як дихлорметан або N, N-диметилформамід, як загалом розкрито в PCT Патентній Публікації WO 2003/15518. Також у WO 2003/15518 розкривається спосіб отримання хлорангідридного еквівалента сполуки Формули 8, такий як шляхом контакту з тіоніл хлоридом або оксаліл хлоридом у присутності каталітичної кількості N, N-диметилформаміду, а потім контакту отриманого хлорангідриду зі сполукою Формули 1b у присутності кислотного акцептора, такого як амінова основа (наприклад, триетиламін, N, N-діізопропілетиламін, піридин і аналоги на полімерній підкладці), або гідроксид, або карбонат (наприклад, NaOH, KOH, Na 2CO3, K2CO3), типово в інертному розчиннику, такому як тетрагідрофуран, 1,4-діоксан, етиловий ефір або дихлорметан. Сполукипродукти Формули 4 можуть бути виділені з реакційних сумішей способами, відомими фахівцям у даній галузі техніки, включаючи кристалізацію, фільтрацію та екстракцію. Без подальшого уточнення, вважають, що фахівець у даній галузі техніки, використовуючи вищевикладений опис, може застосовувати даний винахід у його повному об'ємі. Наступні Приклади, тому, розцінюються тільки як ілюстративні і не обмежуючі яким-небудь чином розкриття. Наступні Приклади ілюструють процедури синтезу, і вихідний матеріал для кожного Прикладу може не обов'язково бути отриманий за допомогою конкретного попереднього досвіду, чия процедура описана в інших Прикладах. У Прикладах 13-16 реакційні суміші аналізують за допомогою звотротньо-фазової ВЕРХ (високо ефективна рідинна хроматографія) (HP Zorbax® Eclipse XDB-C8, виробництва Agilent Technologies, 3,5 мкм, 4,6 мм × 75 мм). Система розчинників являла собою розчинник A: вода з pН, доведеним до 2,5 шляхом додавання фосфорної кислоти, і розчинник B: ацетонітрил (градієнт, що починається на 0 хвилинах з 81 % розчинника A і 19 % розчинника B, і розчинник B підвищувався до 87 % у межах 27 хвилин; потік складав 1,5 мл/хв.). У Прикладах 17-21 реакційні суміші аналізували за допомогою зворотньо-фазової ВЕРХ (HP Zorbax® SB-Phenyl, виробництва Agilent Technologies, 3,5 мкм, 4,6 мм × 15 мм). Система розчинників являла собою розчинник A: вода з pН, доведеним до 3,0 шляхом додавання фосфорної кислоти, і розчинник B: ацетонітрил (градієнт, що починається на 0 хвилинах з 83 % розчинника A і 17 % розчинника B, і розчинник B підвищувався до 95 % у межах 15 хвилин; потік складав 1,5 мл/хв.). Спектри 1H ЯМР (ядерномагнітний резонанс) реєструвалися в мільйонних частках (ppm) зрушення від тетраметилсилану; s означає синглет, d означає дублет, m означає мультиплет, br s означає широкий синглет, і br d означає широкий дублет. 19 UA 105173 C2 5 10 15 20 25 30 35 40 45 50 55 60 ДОВІДКОВИЙ ПРИКЛАД 1 Отримання 2-аміно-5-бром-N, 3-диметилбензаміду (сполука Формули 2) 1000-мл колбу, оснащену механічною мішалкою, термопарою, конденсатором і фторполімерною трубкою Teflon (1/16" (0,16) см внутрішній діаметр x 1/8" (0,32 см) зовнішній діаметр) (розташованої так, що кінець трубки занурений нижче поверхні реакційної суміші), наповнювали оцтовою кислотою (226 мл). Розчин водного гідроксиду натрію (50 %, 25 г) у воді (85 г) додавали протягом 15 хвилин, і потім додавали 2-аміно-N, 3-диметил-бензамід (50 г, 0,305 моль) (дивися PCT Патентну Публікацію WO 2006/062978 для способу отримання) і суміш нагрівали при 55 °C. Двугорлу 200-мл колбу, на одне горлечко якої насаджували заглибну трубку Teflon, наповнювали рідким бромом (50,1 г), а інше горлечко з'єднували з трубкою Teflon на 1000-мл колбі. Газ азот потім пропускали через заглибну трубку нижче поверхні 3 рідкого брому зі швидкістю близько 0,012 м (0,4 куб. фут) на годину протягом 2,5 годин, протягом яких весь бром випаровувався, і пари брому, захоплені газом азотом, стікали з двугорлої 200-мл колби і попадали в реакційну суміш через трубку Teflon . Температуру реакції підтримували при близько 55 °C у ході додавання пари брому, і протягом 30 хвилин після цього, а потім охолоджували до 45 °C і перемішували протягом ночі. Розчин водного гідроксиду натрію (50 %, 52 г) у воді (88 мл) додавали до реакційної суміші зі швидкістю 0,8 мл/хв. Після того, як було додано близько 10 % від загального об'єму розчину гідроксиду натрію, додавання припиняли і реакційну суміш перемішували протягом 1 години при 45 °C. Через 1 годину розчин гідроксиду натрію, що залишився, додавали зі швидкістю 0,8 мл/хв. Після того, як додавання завершували, реакційну суміш перемішували протягом 30 хвилин при 45 °C, і потім охолоджували до 10 °C і перемішували протягом 1 години. Суміш фільтрували, зібраний твердий продукт відмивали метанолом (130 мл) і водою (260 мл), а потім висушували до постійної ваги у вакуумній печі при 45 °C для отримання зазначеної сполуки у вигляді твердого продукту (67 г, 99,4 площі піка % чистоти за допомогою ВЕРХ, 90 % вихід), що плавиться при 133-135 °C. 1H ЯМР (ДМСО (диметисульфоксид)-d6) δ 8,30 (m, 1H), 7,49 (d, 1H), 7,22 (d, 1H), 6,35 (br s, 2H), 2,70 (d, 3H), 2,06 (s, 3H). ПРИКЛАД 1 Отримання 2-аміно-5-ціано-N, 3-диметилбензаміду (сполука Формули 1) 100-мл тригорлу колбу, оснащену механічною мішалкою, термометром і конденсатором, наповнювали 2-аміно-5-бром-N, 3-диметилбензамідом (отриманим способом Довідкового Прикладу 1) (99,1 % чистота, 5,0 г, 0,02 моль) і 1-метилнафталіном (20 г), підтримуючи потік азоту через газоприймальну лінію, з'єднану з конденсатором. Реакційну суміш перемішували при кімнатній температурі і додавали ціанід натрію (здрібнений у порошок безпосередньо перед використанням) (1,25 г, 0,024 моль, допускаючи 95 % чистоту), йодид міді(I) (0,57 г, 0,003 моль, 98 % чистоти) і 1-бутил-1H-імідазол (2,15 г, 0,017 моль, 98 % чистоти). Суміш нагрівали до 158167 °C протягом 5 годин і охолоджували протягом ночі. Воду (20 мл) додавали по краплях до реакційної суміші протягом 5 хвилин при перемішуванні. Після перемішування протягом додаткової 1 години, реакційну суміш фільтрували, і зібраний твердий продукт відмивали водою (3 × 10 мл), ксилолами (10 мл) і висушували до постійної ваги у вакуумній печі при 80 °C для отримання зазначеної сполуки у вигляді твердого продукту світло-коричневого кольору (3,4 г). 1H ЯМР (ДМСО-d6) δ 8,40 (br s, 1H), 7,79 (br s, 1H), 7,41 (br s, 1H), 7,18 (br s, 2H), 2,72 (d, 3H), 2,08 (s, 3H). ПРИКЛАД 2 Друге отримання 2-аміно-5-ціано-N, 3-диметилбензаміду 100-мл тригорлу колбу, оснащену механічною мішалкою, термометром і конденсатором, наповнювали 2-аміно-5-бром-N, 3-диметилбензамідом (отриманим способом Довідкового Прикладу 1) (5,0 г, 0,020 моль, 99,1 % чистоти) і 1-метилнафталіном (20 г), підтримуючи потік азоту через газоприймальну лінію, з'єднану з конденсатором. Реакційну суміш перемішували при кімнатній температурі і додавали ціанід натрію (здрібнений у порошок безпосередньо перед використанням) (1,25 г, 0,024 моль, допускаючи 95 % чистоту), йодид міді(I) (0,57 г, 0,0030 моль, 98 % чистоти) і 1-метил-1H-імідазол (1,40 г, 0,017 моль, 99 %). Суміш нагрівали до 160-165 °C протягом 6 годин і потім переносили в 200-мл колбу і охолоджували протягом ночі. Воду (20 мл) додавали по краплях до реакційної суміші протягом 5 хвилин при перемішуванні. Після перемішування протягом додаткових 2 годин реакційну суміш фільтрували, і зібраний твердий продукт відмивали водою (3 × 10 мл) і ксилолами (10 мл) і висушували до постійної ваги у вакуумній печі при 80 °C для отримання зазначеної сполуки у вигляді твердого продукту світлокоричневого кольору (3,85 г). 1H ЯМР (ДМСО-d6) δ 8,40 (br s, 1H), 7,80 (br s, 1H), 7,40 (br s, 1H), 7,15 (br s, 2H), 2,72 (d, 20 UA 105173 C2 5 10 15 20 25 30 35 40 45 50 55 3H), 2,07 (s, 3H). ПРИКЛАД 3 Третє отримання 2-аміно-5-ціано-N, 3-диметилбензаміду 500-мл чотиригорлу колбу, оснащену магнітною мішалкою, термопарою і конденсатором, бічною краплинною лійкою і скрубером з гідроксидом натрію/гіпохлоритом натрію, наповнювали 2-аміно-5-бром-N, 3-диметилбензамідом (отриманим способом Довідкового Прикладу 1) (24,6 г, 0,10 моль, 99 % чистоти) і мезитиленом (100 г), підтримуючи атмосферу азоту через газоприймальну лінію, з'єднану з конденсатором. Реакційну суміш перемішували при кімнатній температурі і додавали ціанід натрію (здрібнений у порошок безпосередньо перед використанням) (6,2 г, 0,121 моль, допускаючи 95 % чистоти), йодид міді(I) (2,9 г, 0,015 моль, 98 % чистоти) і 1-бутил-1H-імідазол (10,8 г, 0,085 моль, 98 % чистоти), після чого приймальну лінію для азоту прикріплювали безпосередньо до реакційної колби. Реакційну суміш нагрівали зі зворотним холодильником (близько 166-170 °C) протягом 7 годин, пропускаючи через скрубер. Після охолодження протягом ночі додавали воду (100 мл) до реакційної суміші і перемішування продовжували протягом 1 години. Етилендіамін (0,09 г, близько 0,015 моль, 99 % чистоти) додавали до суміші, і перемішування продовжували протягом додаткових 15 хвилин. Суміш фільтрували, і зібраний твердий продукт відмивали водою (3 × 50 мл), мезитиленом (50 г) і висушували до постійної ваги у вакуумній печі при 55 °C для отримання зазначеної сполуки у вигляді твердого продукту світло-коричневого кольору (18,3 г). 1H ЯМР (ДМСО-d6) δ 8,44 (br d, 1H), 7,82 (d, 1H), 7,44 (br s, 1H), 7,17 (br s, 2H), 2,75 (d, 3H), 2,10 (s, 3H). ПРИКЛАД 4 Четверте отримання 2-аміно-5-ціано-N, 3-диметилбензаміду 500-мл чотиригорлу колбу, оснащену магнітною мішалкою, термопарою і конденсатором, бічною краплинною лійкою і скрубером з гідроксидом натрію/гіпохлоритом натрію наповнювали 2-аміно-5-бром-N, 3-диметилбензамідом (отриманим способом Довідкового Прикладу 1) (24,6 г, 0,10 моль, 99 % чистоти) і мезитиленом (100 г), підтримуючи атмосферу азоту через газоприймальну лінію, з'єднану з конденсатором. Реакційну суміш перемішували при кімнатній температурі і додавали ціанід натрію (здрібнений у порошок безпосередньо перед використанням) (6,2 г, 0,121 моль, допускаючи, 95 % чистоти), йодид міді(I) (2,9 г, 0,015 моль, 98 % чистоти) і 1-бутил-1H-імідазол (5,4 г, 0,0425 моль, 98 % чистоти), після чого приймальну лінію для азоту прикріплювали безпосередньо до реакційної колби. Реакційну суміш нагрівали зі зворотним холодильником (близько 166-170 °C) протягом 6 годин, пропускаючи через скрубер. Після охолодження протягом ночі, до реакційної суміші додавали воду (100 мл) і перемішування продовжували протягом 1 години. До реакційної суміші додавали етилендіамін (0,09 г, близько 0,015 моль, 99 % чистоти), і перемішування продовжували протягом додаткових 3,5 годин. Суміш фільтрували, і зібраний твердий продукт відмивали водою (3 × 50 мл), мезитиленом (50 г) і висушували до постійної ваги у вакуумній печі при 55 °C для отримання зазначеної сполуки у вигляді твердого продукту світло-коричневого кольору (19,0 г). 1H ЯМР (ДМСО-d6) δ 8,44 (br d, 1H), 7,83 (d, 1H), 7,44 (br s, 1H), 7,19 (br s, 2H), 2,74 (d, 3H), 2,10 (s, 3H). ПРИКЛАД 5 П'яте отримання 2-аміно-5-ціано-N, 3-диметилбензаміду 500-мл чотиригорлу колбу, оснащену магнітною мішалкою, термопарою і конденсатором, бічною краплинною лійкою і скрубером з гідроксидом натрію/гіпохлоритом натрію, наповняли 2аміно-5-бром-N, 3-диметилбензамідом (отриманим способом Довідкового Прикладу 1) (24,6 г, 0,10 моль, 99 % чистоти) і мезитиленом (100 г), підтримуючи атмосферу азоту через газоприймальну лінію, з'єднану з конденсатором. Реакційну суміш перемішували при кімнатній температурі і додавали ціанід натрію (здрібнений у порошок безпосередньо перед використанням) (7,7 г, 0,15 моль, допускаючи 95 % чистоти), йодид міді(I) (2,9 г, 0,015 моль, 98 % чистоти) і 1-бутил-1H-імідазол (10,8 г, 0,085 моль, 98 % чистоти), після чого приймальну лінію для азоту прикріплювали безпосередньо до реакційної колби. Реакційну суміш нагрівали зі зворотним холодильником (близько 166-170 °C) протягом 7 годин, пропускаючи через скрубер. Після охолодження протягом ночі, до реакційної суміші додавали воду (100 мл) і перемішування продовжували протягом 1 години. Суміш фільтрували, і зібраний твердий продукт відмивали водою (3 × 50 мл), мезитиленом (50 г) і висушували до постійної ваги у вакуумній печі при 55 °C для отримання зазначеної сполуки у вигляді твердого продукту світло-жовтого кольору (16,9 г). 1H ЯМР (ДМСО-d6) δ 8,44 (br d, 1H), 7,82 (d, 1H), 7,44 (br s, 1H), 7,19 (br s, 2H), 2,74 (d, 3H), 2,10 (s, 3H). 60 21 UA 105173 C2 5 10 15 20 25 30 35 40 45 50 55 60 ПРИКЛАД 6 Шосте отримання 2-аміно-5-ціано-N, 3-диметилбензаміду 500-мл чотиригорлу колбу, оснащену магнітною мішалкою, термопарою і конденсатором, бічною краплинною лійкою і скрубером з гідроксидом натрію/гіпохлоритом натрію, наповнювали 2-аміно-5-бром-N, 3-диметилбензамідом (отриманим способом Довідкового Прикладу 1) (24,6 г, 0,10 моль, 99 % чистоти) і мезитиленом (100 г), підтримуючи атмосферу азоту через газоприймальну лінію, з'єднану з конденсатором. Суміш перемішували при кімнатній температурі і додавали ціанід натрію (здрібнений у порошок безпосередньо перед використанням) (7,7 г, 0,15 моль, допускаючи 95 % чистоти), йодид міді(I) (2,9 г, 0,015 моль, 98 % чистоти) і 1-бутил-1H-імідазол (7,6 г, 0,06 моль, 98 % чистоти), після чого приймальну лінію для азоту прикріплювали безпосередньо до реакційної колби. Реакційну суміш нагрівали зі зворотним холодильником (близько 166-170 °C) протягом 6,75 годин, пропускаючи через скрубер. Після охолодження до 25 °C до реакційної суміші додавали воду (100 мл) і перемішування продовжували протягом 1 години. Суміш фільтрували, і зібраний твердий продукт відмивали водою (3 × 50 мл), мезитиленом (50 г) і висушували до постійної ваги у вакуумній печі при 55 °C для отримання зазначеної сполуки у вигляді твердого продукту світложовтого кольору (17,7 г). 1H ЯМР (ДМСО-d6) δ 8,44 (br d, 1H), 7,82 (d, 1H), 7,44 (br s, 1H), 7,19 (br s, 2H), 2,74 (d, 3H), 2,10 (s, 3H). ПРИКЛАД 7 Сьоме отримання 2-аміно-5-ціано-N, 3-диметилбензаміду 500-мл чотиригорлу колбу, оснащену магнітною мішалкою, термопарою і конденсатором, бічною краплинною лійкою і скрубером з гідроксидом натрію/гіпохлоритом натрію, наповнювали 2-аміно-5-бром-N, 3-диметилбензамідом (отриманим способом Довідкового Прикладу 1) (24,6 г, 0,10 моль, 99 % чистоти) і мезитиленом (100 г), підтримуючи атмосферу азоту через газоприймальну лінію, з'єднану з конденсатором. Суміш перемішували при кімнатній температурі і додавали ціанід натрію (здрібнений у порошок безпосередньо перед використанням) (7,7 г, 0,15 моль, допускаючи 95 % чистоти) і йодид міді(I) (2,9 г, 0,015 моль, 98 % чистоти) і 1-етил-1H-імідазол (5,9 г, 0,06 моль, 98 % чистоти), після чого приймальну лінію для азоту прикріплювали безпосередньо до реакційної колби. Реакційну суміш нагрівали зі зворотним холодильником (близько 166-170 °C) протягом 8 годин, пропускаючи через скрубер. Після охолодження протягом ночі додавали воду (100 мл), і перемішування продовжували протягом 1 години. Суміш фільтрували, і зібраний твердий продукт відмивали водою (3 × 50 мл), мезитиленом (50 г) і висушували до постійної ваги у вакуумній печі при 55 °C для отримання зазначеної сполуки у вигляді твердого продукту світло-жовтого кольору (18,0 г). 1H ЯМР (ДМСО-d6) δ 8,44 (br d, 1H), 7,82 (d, 1H), 7,44 (br s, 1H), 7,19 (br s, 2H), 2,74 (d, 3H), 2,11 (s, 3H). ПРИКЛАД 8 Восьме отримання 2-аміно-5-ціано-N, 3-диметилбензаміду 500-мл чотиригорлу колбу, оснащену магнітною мішалкою, термопарою і конденсатором, бічною краплинною лійкою і скрубером з гідроксидом натрію/гіпохлоритом натрію, наповнювали 2-аміно-5-бром-N, 3-диметилбензамідом (отриманим способом Довідкового Прикладу 1) (24,6 г, 0,10 моль, 99 % чистоти) і мезитиленом (100 г), підтримуючи атмосферу азоту через газоприймальну лінію, з'єднану з конденсатором. Суміш перемішували при кімнатній температурі і додавали ціанід натрію (здрібнений у порошок безпосередньо перед використанням) (7,7 г, 0,15 моль, допускаючи 95 % чистоти), йодид міді(I) (2,9 г, 0,015 моль, 98 % чистоти) і 1-бутил-1H-імідазол (9,5 г, 0,075 моль, 98 % чистоти), після чого приймальну лінію для азоту прикріплювали безпосередньо до реакційної колби. Реакційну суміш нагрівали зі зворотним холодильником (близько 166-170 °C) протягом 6 годин, пропускаючи через скрубер. Після охолодження протягом ночі до реакційної суміші додавали воду (100 мл), і перемішування продовжували протягом 1 години. Суміш фільтрували, і зібраний твердий продукт відмивали водою (3 × 50 мл), мезитиленом (50 г) і висушували до постійної ваги у вакуумній печі при 55 °C для отримання зазначеної сполуки у вигляді твердого продукту світло-жовтого кольору (17,0 г). ПРИКЛАД 9 Дев'яте отримання 2-аміно-5-ціано-N, 3-диметилбензаміду 500-мл чотиригорлу колбу, оснащену магнітною мішалкою, термопарою і конденсатором, бічною краплинною лійкою і скрубером з гідроксидом натрію/гіпохлоритом натрію, наповнювали 2-аміно-5-бром-N, 3-диметилбензамідом (отриманим способом Довідкового Прикладу 1) (24,6 г, 0,10 моль, 99 % чистоти) і мезитиленом (100 г), підтримуючи атмосферу азоту через газоприймальну лінію, з'єднану з конденсатором. Реакційну суміш перемішували при кімнатній 22 UA 105173 C2 5 10 15 20 25 30 35 40 45 50 55 60 температурі, і гранульований ціанід натрію (Alfa Aesar®, 7,7 г, 0,15 моль, допускаючи 95 % чистоту), йодид міді(I) (2,9 г, 0,015 моль, 98 % чистоти) і 1-бутил-1H-імідазол (10,8 г, 0,085 моль, 98 % чистоти) додавали до реакційної суміші, після чого приймальну лінію для азоту прикріплювали безпосередньо до реакційної колби. Реакційну суміш нагрівали зі зворотним холодильником (близько 166-170 °C) протягом 6 годин, пропускаючи через скрубер, і потім охолоджували протягом ночі. До реакційної суміші додавали воду (100 мл) і перемішування продовжували протягом 45 хвилин. Більше води (25 мл) додавали до реакційної суміші і перемішування продовжували протягом додаткових 15 хвилин. Суміш фільтрували, і зібраний твердий продукт відмивали водою (3 × 50 мл), мезитиленом (50 г) і висушували до постійної ваги у вакуумній печі при 55 °C для отримання зазначеної сполуки у вигляді твердого продукту світло-жовтого кольору (16,8 г). 1H ЯМР (ДМСО-d6) δ 8,44 (br d, 1H), 7,82 (d, 1H), 7,44 (br s, 1H), 7,18 (br s, 2H), 2,74 (d, 3H), 2,10 (s, 3H). ПРИКЛАД 10 Десяте отримання 2-аміно-5-ціано-N, 3-диметилбензаміду 100-мл тригорлу колбу, оснащену магнітною мішалкою, термометром і конденсатором, наповнювали 2-аміно-5-бром-N, 3-диметилбензамідом (отриманим способом Довідкового Прикладу 1) (99 % чистоти, 5,0 г, 0,02 моль) і мезитиленом (20 г), підтримуючи потік азоту через газоприймальну лінію, з'єднану з конденсатором. Реакційну суміш перемішували при кімнатній температурі, і додавали порошок ціаніду натрію (CyPlus®, 1,40 г, 0,027 моль, допускаючи 95 % чистоти), ціанід міді(I) (0,27 г, 0,003 моль, 99 % чистоти), йодид натрію (0,45 г, 0,003 моль, 99 % чистоти) і 1-бутил-1H-імідазол (1,9 г, 0,015 моль, 98 % чистоти). Суміш нагрівали зі зворотним холодильником (близько 167-168 °C) протягом 6 годин і потім охолоджували протягом ночі. Воду (20 мл) додавали по краплях до реакційної суміші в межах 5 хвилин при перемішуванні. Після перемішування протягом додаткової 1 години реакційну суміш фільтрували, і зібраний твердий продукт відмивали послідовно водою (3 × 10 мл), мезитиленом (10 мл) і висушували до постійної ваги у вакуумній печі при 55 °C для отримання зазначеної сполуки у вигляді твердого продукту світло-жовтого кольору (3,4 г). 1H ЯМР (ДМСО-d6) δ 8,44 (br s, 1H), 7,82 (br s, 1H), 7,44 (br s, 1H), 7,18 (br s, 2H), 2,74 (d, 3H), 2,10 (s, 3H). ПРИКЛАД 11 Одинадцяте отримання 2-аміно-5-ціано-N, 3-диметилбензаміду 100 мл реактор (HP реакторна установка високого тиску, розроблена Hastelloy® C і зроблена HEL, Inc., Lawrenceville, Н`ю Джерсі) оснащений механічною мішалкою (розробленою Hastelloy® C) з подвійною турбінною мішалкою (приключена турбіна, що накачує, і предвключена турбіна, що відкачує). Реактор продували азотом, потім витримували в атмосфері азоту і заповнювали послідовно 2-аміно-5-бром-N, 3-диметилбензамідом (отриманим способом Довідкового Прикладу 1) (99 % чистоти, 7,4 г, 0,03 моль), порошком ціаніду натрію (CyPlus®, 2,3 г, 0,045 моль, допускаючи 95 % чистоту), йодидом міді(I) (98 % чистоти, 0,87 г, 0,0045 моль), ксилолами (30 г) і 1-бутил-1H-імідазолом (3,2 г, 0,0255 моль, 98 % чистоти). Реактор накачували до 345 кПа азотом і потім випускали газ. Процедуру нагнітання/випускання азоту повторювали п'ять разів. Перемішування починали при 300 об/хв., і реактор потім випробовували на герметичність шляхом нагнітання до 690 кПа протягом 20 хвилин. З реактора випускали газ, випускний отвір закривали, і реакційну суміш нагрівали при 170 °C протягом 6 годин. Реакційну суміш охолоджували до 20-25 °C і з реактора випускали газ і відстоювали протягом вихідних. Реакційну суміш переносили в 250-мл колбу Ерленмейєра і додавали воду (30 г). Після перемішування протягом 1 години, реакційну суміш фільтрували, і зібраний твердий продукт відмивали послідовно водою (3 × 15 мл) і ксилолами (15 мл), і висушували до постійної ваги у вакуумній печі при 55 °C для отримання зазначеної сполуки у вигляді твердого продукту світло-жовтого кольору (5,2 г). 1H ЯМР (ДМСО-d6) δ 8,44 (br s, 1H), 7,82 (br s, 1H), 7,44 (br s, 1H), 7,18 (br s, 2H), 2,74 (d, 3H), 2,10 (s, 3H). ПРИКЛАД 12 Дванадцяте отримання 2-аміно-5-ціано-N, 3-диметилбензаміду 100 мл реактор (HP реакторна установка високого тиску, розроблена Hastelloy® C і зроблена HEL, Inc.) оснащений механічною мішалкою (розробленою Hastelloy® C) з подвійною турбінною мішалкою (приключена турбіна, що накачує, і предвключена турбіна, що відкачує). Реактор продували азотом, потім витримували в атмосфері азоту і заповнювали послідовно 2аміно-5-бром-N, 3-диметилбензамідом (отриманим способом Довідкового Прикладу 1) (99 % чистоти, 7,4 г, 0,03 моль), порошком ціаніду натрію (CyPlus®, 2,3 г, 0,045 моль, допускаючи 95 % 23 UA 105173 C2 5 10 15 20 25 30 35 40 45 50 55 60 чистоту), йодидом міді(I) (98 % чистоти, 0,87 г, 0,0045 моль), толуолом (30 г) і 1-бутил-1Hімідазолом (3,2 г, 0,0255 моль, 98 % чистоти). Реактор накачували до 345 кПа азотом і потім випускали газ. Процедуру нагнітання/випускання азоту повторювали п'ять разів. Перемішування починали при 300 об/хв., і реактор потім випробували на герметичність шляхом нагнітання до 690 кПа протягом 20 хвилин. З реактора випускали газ, випускний отвір закривали, і реакційну суміш нагрівали при 170 °C протягом 6 годин. Реакційну суміш охолоджували до 20-25 °C, і з реактора випускали газ і відстоювали протягом вихідних. Потім реакційну суміш переносили в 250- мл колбу Ерленмейєра і додавали воду (30 г). Після перемішування протягом 1 години реакційну суміш фільтрували, і зібраний твердий продукт відмивали послідовно водою (3 × 15 мл) і толуолом (15 мл), і висушували до постійної ваги у вакуумній печі при 55 °C для отримання зазначеної сполуки у вигляді твердого продукту світло-жовтого кольору (5,0 г). 1H ЯМР (ДМСО-d6) δ 8,44 (br s, 1H), 7,83 (br s, 1H), 7,44 (br s, 1H), 7,19 (br s, 2H), 2,75 (d, 3H), 2,11 (s, 3H). ПРИКЛАД 13 Тринадцяте отримання 2-аміно-5-ціано-N, 3-диметилбензаміду 100 мл реактор (HP реакторна установка високого тиску, розроблена Hastelloy® C і зроблена HEL, Inc.) оснащений механічною мішалкою (розробленою Hastelloy® C) з подвійною турбінною мішалкою (приключена турбіна, що накачує, і предвключена турбіна, що відкачує). Реактор продували азотом, потім витримували в атмосфері азоту і заповнювали послідовно 2аміно-5-бром-N, 3-диметилбензамідом (отриманим способом Довідкового Прикладу 1) (99 % чистоти, 7,4 г, 0,03 моль), порошком ціаніду натрію (CyPlus®, 2,3 г, 0,045 моль, допускаючи 95 % чистоту), йодидом міді(I) (98 % чистоти, 0,87 г, 0,0045 моль) і ксилолами (20 г). Реактор накачували до 345 кПа азотом і потім випускали газ. Процедуру нагнітання/випускання азоту повторювали два рази. Перемішування починали при 300 об/хв., і реактор потім випробували на герметичність шляхом нагнітання до 690 кПа протягом 20 хвилин. З реактора випускали газ до атмосферного тиску, і розчин 1-метилімідазолу (1,86 г, 0,0255 моль, 99 % чистоти) у ксилолах (10 мл) додавали до реакційної суміші. Реактор накачували до 345 кПа азотом і потім випускали газ. Процедуру нагнітання/випускання азоту повторювали два рази. Випускний отвір реактора закривали, і суміш нагрівали при 170 °C протягом 8 годин. Потім реакційну суміш охолоджували до 20-25 °C, і з реактора випускали газ і відстоювали протягом ночі. Потім реакційну суміш розводили N, N-диметилформамідом (DMF) (загальна вага реакційної суміші після розведення DMF складала 100 г) і аналізували за допомогою ВЕРХ, що показала 98 % перетворення 2аміно-5-бром-N, 3-диметилбензаміду, причому 2-аміно-5-ціано-N, 3-диметилбензамід був основним продуктом. ПРИКЛАД 14 Чотирнадцяте отримання 2-аміно-5-ціано-N, 3-диметилбензаміду 100 мл реактор (HP реакторна установка високого тиску, розроблена Hastelloy® C і зроблена HEL, Inc.) оснащений механічною мішалкою (розробленою Hastelloy® C) з подвійною турбінною мішалкою (приключена турбіна, що накачує, і предвключена турбіна, що відкачує). Реактор продували азотом, потім витримували в атмосфері азоту і заповнювали послідовно 2аміно-5-бром-N, 3-диметилбензамідом (отриманим способом Довідкового Прикладу 1) (99 % чистоти, 7,4 г, 0,03 моль), порошком ціаніду натрію (CyPlus®, 2,3 г, 0,045 моль, допускаючи 95 % чистоту), йодидом міді(I) (98 % чистоти, 0,87 г, 0,0045 моль) і толуолом (20 г). Реактор накачували до 345 кПа азотом і потім випускали газ. Процедуру нагнітання/випускання азоту повторювали два рази. Перемішування починали при 300 об/хв., і реактор потім випробували на герметичність шляхом нагнітання до 690 кПа протягом 20 хвилин. З реактора випускали газ до атмосферного тиску, і розчин 1-метилімідазолу (1,86 г, 0,0255 моль, 99 % чистоти) у толуолі (10 мл) додавали до реакційної суміші. Реактор накачували до 345 кПа азотом і потім випускали газ. Процедуру нагнітання/випускання азоту повторювали два рази. Випускний отвір реактора закривали, і суміш нагрівали при 170 °C протягом 8 годин. Реакційну суміш охолоджували до 2025 °C, і з реактора випускали газ і відстоювали протягом ночі. Потім реакційну суміш розводили DMF (загальна вага реакційної суміші після розведення DMF складала 100 г) і аналізували за допомогою ВЕРХ, що показала 99 % перетворення 2-аміно-5-бром-N, 3-диметилбензаміду, причому 2-аміно-5-ціано-N, 3-диметилбензамід був основним продуктом. ПРИКЛАД 15 П'ятнадцяте отримання 2-аміно-5-ціано-N, 3-диметилбензаміду 100 мл реактор (HP реакторна установка високого тиску, розроблена Hastelloy® C і зроблена HEL, Inc.) оснащений механічною мішалкою (розробленою Hastelloy® C) з подвійною турбінною мішалкою (приключена турбіна, що накачує, і предвключена турбіна, що відкачує). Реактор продували азотом, потім витримували в атмосфері азоту і заповнювали послідовно 2 24 UA 105173 C2 5 10 15 20 25 30 35 40 45 50 55 60 аміно-5-бром-N, 3-диметилбензамідом (отриманим способом Довідкового Прикладу 1) (99 % чистоти, 7,4 г, 0,03 моль), порошком ціаніду натрію (CyPlus®, 2,3 г, 0,045 моль, допускаючи 95 % чистоту), йодидом міді(I) (98 % чистоти, 0,87 г, 0,0045 моль) і ксилолами (20 г). Реактор накачували до 345 кПа азотом і потім випускали газ. Процедуру нагнітання/випускання азоту повторювали два рази. Перемішування починали при 300 об/хв., і реактор потім випробували на герметичність шляхом нагнітання до 690 кПа протягом 20 хвилин. З реактора випускали газ до атмосферного тиску, і розчин 4-метилімідазолу (1,86 г, 0,0255 моль, 98 % чистоти) у ксилолах (10 мл) додавали до реакційної суміші. Реактор накачували до 345 кПа азотом і потім випускали газ. Процедуру нагнітання/випускання азоту повторювали два рази. Випускний отвір реактора закривали, і суміш нагрівали при 170 °C протягом 12 годин. Реакційну суміш охолоджували до 20-25 °C, і з реактора випускали газ і відстоювали протягом ночі. Потім реакційну суміш розводили DMF (загальна вага реакційної суміші після розведення DMF складала 100 г) і аналізували за допомогою ВЕРХ, що показала 88 % перетворення 2-аміно-5-бром-N, 3диметилбензаміду, причому 2-аміно-5-ціано-N,3-диметилбензамід був основним продуктом. ПРИКЛАД 16 Шістнадцяте отримання 2-аміно-5-ціано-N, 3-диметилбензаміду 100 мл реактор (HP реакторна установка високого тиску, розроблена Hastelloy® C і зроблена HEL, Inc.) оснащений механічною мішалкою (розробленою Hastelloy® C) з подвійною турбінною мішалкою (приключена турбіна, що накачує, і предвключена турбіна, що відкачує). Реактор продували азотом, потім витримували в атмосфері азоту і заповнювали послідовно 2аміно-5-бром-N, 3-диметилбензамідом (отриманим способом Довідкового Прикладу 1) (99 % чистоти, 7,4 г, 0,03 моль), порошком ціаніду натрію (CyPlus®, 2,3 г, 0,045 моль, допускаючи 95 % чистоту), йодидом міді(I) (98 % чистоти, 0,87 г, 0,0045 моль), 1,6-біс(імідазол-1-іл)гексаном (2,5 г, 0,011 моль) і ксилолами (30 г). Реактор накачували до 345 кПа азотом і потім випускали газ. Процедуру нагнітання/випускання азоту повторювали два рази. Перемішування починали при 300 об/хв., і реактор потім випробували на герметичність шляхом нагнітання до 690 кПа протягом 20 хвилин. З реактора випускали газ до атмосферного тиску, випускний отвір закривають, і реакційну суміш нагрівали при 170 °C протягом 12 годин. Реакційну суміш охолоджували до 20-25 °C, і з реактора випускали газ і відстоювали протягом ночі. Потім реакційну суміш розводили DMF (загальна вага реакційної суміші після розведення DMF складала 100 г) і аналізували за допомогою ВЕРХ, що показала 93 % перетворення 2-аміно-5бром-N, 3-диметилбензаміду, причому 2-аміно-5-ціано-N, 3-диметилбензамід був основним продуктом. ПРИКЛАД 17 Сімнадцяте отримання 2-аміно-5-ціано-N, 3-диметилбензаміду 125-мл реактор (Advantage Series® 3400 Process Chemistry Workstation, що продається Biotage) оснащений механічною мішалкою (вісь сконструйована Hastelloy® C з поліефірефіркетоновим (PEEK) вкладишем мішалки і PEEK турбінним змішувачем), температурним датчиком (розробленим Hastelloy® C) і дефлегматором. Реактор наповняли 2аміно-5-бром-N, 3-диметилбензамідом (отриманим способом Довідкового Прикладу 1) (99 % чистоти, 9,8 г, 0,04 моль), йодидом міді(I) (98 % чистоти, 1,17 г, 0,006 моль) і гранульованим ціанідом натрію (Alfa Aesar®, 3,09 г, 0,060 моль, допускаючи 95 % чистоту). Реактор продували азотом через газоприймальну лінію, з'єднану з конденсатором, потім розчин 1-бутил-1Hімідазолу (0,76 г, 0,006 моль, 98 % чистоти) у мезитилені (40 г) додавали до реакційної суміші. Змішувач вмикали при 300 об/хв., і суміш нагрівали до дефлегмації протягом 6 годин. Реакційну суміш охолоджували до 20 °C і відстоювали протягом ночі. Потім реакційну суміш розводили DMF (загальна вага реакційної суміші після розведення DMF складала 130 г) і аналізували за допомогою ВЕРХ, що показала 97 % перетворення 2-аміно-5-бром-N, 3-диметилбензаміду, причому 2-аміно-5-ціано-N, 3-диметилбензамід був основним продуктом. ПРИКЛАД 18 Вісімнадцяте отримання 2-аміно-5-ціано-N, 3-диметилбензаміду Зазначену сполуку одержували за допомогою процедури Прикладу 17, використовуючи відмінну кількість 1-бутил-1H-імідазолу (1,52 г, 0,012 моль). Аналіз реакційної суміші за допомогою ВЕРХ показав 97 % перетворення 2-аміно-5-бром-N, 3-диметилбензаміду, причому 2-аміно-5-ціано-N, 3-диметилбензамід був основним продуктом. ПРИКЛАД 19 Дев'ятнадцяте отримання 2-аміно-5-ціано-N, 3-диметилбензаміду Зазначену сполуку одержували за допомогою процедури Прикладу 17, використовуючи відмінну кількість 1-бутил-1H-імідазолу (2,27 г, 0,018 моль). Аналіз реакційної суміші за допомогою ВЕРХ показав 97 % перетворення 2-аміно-5-бром-N, 3-диметилбензаміду, причому 25 UA 105173 C2 5 10 15 20 25 30 35 40 45 50 2-аміно-5-ціано-N, 3-диметилбензамід був основним продуктом. ПРИКЛАД 20 Двадцяте отримання 2-аміно-5-ціано-N, 3-диметилбензаміду Зазначену сполуку одержували за допомогою процедури Прикладу 17, використовуючи відмінну кількість 1-бутил-1H-імідазолу (3,03 г, 0,024 моль). Аналіз реакційної суміші за допомогою ВЕРХ показав 99 % перетворення 2-аміно-5-бром-N, 3-диметилбензаміду, причому 2-аміно-5-ціано-N, 3-диметилбензамід був основним продуктом. ПРИКЛАД 21 Двадцять перше отримання 2-аміно-5-ціано-N, 3-диметилбензаміду Зазначену сполуку одержували за допомогою процедури Прикладу 17, використовуючи відмінну кількість 1-бутил-1H-імідазолу (3,82 г, 0,030 моль). Аналіз реакційної суміші за допомогою ВЕРХ показав 98 % перетворення 2-аміно-5-бром-N, 3-диметилбензаміду, причому 2-аміно-5-ціано-N, 3-диметилбензамід був основним продуктом. ПРИКЛАД 22 Отримання 3-бром-1-(3-хлор-2-піридиніл)-N-[4-ціано-2-метил-6[(метиламіно)карбоніл]феніл]-1H-піразол-5-карбоксаміду До суміші 3-бром-1-(3-хлор-2-піридиніл)-1H-піразол-5-карбонової кислоти (дивися PCT Патентну Публікацію WO 2003/015519 для способу отримання) (3,02 г, 0,010 моль) і 2-аміно-5ціано-N, 3-диметилбензаміду (отриманого способом Прикладу 9, за винятком того, що 2-аміно5-бром-N, 3-диметилбензамід одержували з комерційного джерела і використовували порошок ціаніду натрію від CyPlus®) (1,99 г, 0,0105 моль) в ацетонітрилі (16 мл) додавали 3-піколін (2,92 мол, 0,030 моль). Реакційну суміш охолоджували до 15-20 °C, і потім метансульфонілхлорид (8,2 г, 0,071 моль) додавали по краплях. Після перемішування протягом 2 годин при 20 °C, воду (7,5 мл) додавали по краплях до реакційної суміші, підтримуючи температуру при 20-25 °C. Через 15 хвилин додавали концентровану соляну кислоту (0,50 мл), і реакційну суміш перемішували протягом 1 години при 20 °C. Суміш фільтрували, і зібрані тверді продукти відмивали ацетонітрилом-водою (3:1 суміш, 2 × 2 мл) і водою (2 × 2 мл), і висушували в азоті для отримання зазначеної сполуки (4,86 г) у вигляді твердого продукту грязно-білого кольору, що плавиться при 206-208 °C. 1H ЯМР (ДМСО-d6) δ 10,52 (br s, 1H), 8,50 (dd, 1H), 8,36 (m, 1H), 8,17 (dd, 1H), 7,88 (d, 1H), 7,76 (d, 1H), 7,62 (m, 1H), 7,41 (s, 1H), 2,66 (d, 3H), 2,21 (s, 3H). ДОВІДКОВИЙ ПРИКЛАД 2 Отримання 3-бром-1-(3-хлор-2-піридиніл)-N-[4-ціано-2-метил-6[(метиламіно)карбоніл]феніл]-1H-піразол-5-карбоксаміду (сполука Формули 4) До суміші 3-бром-1-(3-хлор-2-піридиніл)-1H-піразол-5-карбонової кислоти (дивися PCT Патентну Публікацію WO 2003/015519 для способу отримання) (15 г, 0,049 моль, 97,4 % чистоти) і 2-аміно-5-ціано-N, 3-диметилбензаміду (дивися PCT Патентну Публікацію WO 2006/62978 для способу отримання) (10,0 г, 0,0525 моль) в ацетонітрилі (80 мл) додавали 3піколін (13,9 г, 0,148 моль). Реакційну суміш охолоджували до 15-20 °C, і потім метансульфонілхлорид (8,2 г, 0,071 моль) додавали по краплях. Через 1 годину воду (37,3 г) додавали по краплях до реакційної суміші, підтримуючи температуру при 15-20 °C. Суміш нагрівали при 45-50 °C протягом 30 хвилин і потім охолоджували до 15-25 °C протягом 1 години. Суміш фільтрували, і зібрані тверді продукти відмивали ацетонітрилом-водою (сумішшю приблизно 5:1, 2 × 10 мл) і ацетонітрилом (2 × 10 мл), і потім висушували в азоті для отримання зазначеної сполуки (24,0 г, 93,6 % скоректований вихід на основі аналізу 91,6 %) у вигляді твердого продукту грязно-білого кольору. 1H ЯМР (ДМСО-d6) δ 10,53 (br s, 1H), 8,49 (dd, 1H), 8,36 (m, 1H), 8,16 (dd, 1H), 7,87 (d, 1H), 7,76 (d, 1H), 7,60 (m, 1H), 7,41 (s, 1H), 2,67 (d, 3H), 2,21 (s, 3H). Таблиця 1 ілюструє конкретні перетворення для отримання сполук Формули 1 відповідно до способу даного винаходу. Для цих перетворень реагент солі міді(I) і реагент солі йодистоводневої кислоти являють собою йодид міді(I). У Таблиці 1 і наступних таблицях: t означає третинний, s означає вторинний, n означає нормальний, i означає ізо, c означає цикло, Me означає метил, Et означає етил, Pr означає пропіл, і Bu означає бутил. Об'єднання груп скорочуються подібним чином; наприклад, "c-PrCH2" означає циклопропілметил. 55 26 UA 105173 C2 ТАБЛИЦЯ 1 1 3 R являє собою NHR , X являє собою Br, і ціанід металу являє собою ціанід натрію. 2 R Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me 3 R H Me Et n-Pr i-Pr n-Bu i-Bu s-Bu t-Bu c-Pr c-PrCH2 1-CH3-c-Pr 2-CH3-c-Pr 1,1'-біциклопропіл-2-іл 1,1'-біциклопропіл-1-іл (1R, 2S)-1,1'-біциклопропіл-2-іл 1 5 R Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me R H H H H H H H H H H H H H H H H 6 R H H H H H H H H H H H H H H H H 7 R H H H H H H H H H H H H H H H H 8 3 R являє собою NHR , X являє собою Br, і ціанід металу являє собою ціанід калію. 2 R Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me 3 R H Me Et n-Pr i-Pr n-Bu i-Bu s-Bu t-Bu c-Pr c-PrCH2 1-CH3-c-Pr 2-CH3-c-Pr 1,1'-біциклопропіл-2-іл 1,1'-біциклопропіл-1-іл (1R, 2S)-1,1'-біциклопропіл-2-іл 1 5 R Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me R H H H H H H H H H H H H H H H H 6 R H H H H H H H H H H H H H H H H 7 R H H H H H H H H H H H H H H H H 8 3 R являє собою NHR , X являє собою Br, і ціанід металу являє собою гексаціаноферат(II) калію. 2 R Me R H 3 5 R Me 27 R H 6 R H 7 R H 8 UA 105173 C2 1 3 R являє собою NHR , X являє собою Br, і ціанід металу являє собою гексаціаноферат(II) калію. 2 R Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me 3 R Me Et n-Pr i-Pr n-Bu i-Bu s-Bu t-Bu c-Pr c-PrCH2 1-CH3-c-Pr 2-CH3-c-Pr 1,1'-біциклопропіл-2-іл 1,1'-біциклопропіл-1-іл (1R, 2S)-1,1'-біциклопропіл-2-іл 1 5 R Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me R H H H H H H H H H H H H H H H 6 R H H H H H H H H H H H H H H H 7 R H H H H H H H H H H H H H H H 8 3 R являє собою NHR , X являє собою Br, і ціанід металу являє собою ціанід натрію. 2 R Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me 3 R H Me Et n-Pr i-Pr n-Bu i-Bu s-Bu t-Bu c-Pr c-PrCH2 1-CH3-c-Pr 2-CH3-c-Pr 1,1'-біциклопропіл-2-іл 1,1'-біциклопропіл-1-іл (1R, 2S)-1,1'-біциклопропіл-2-іл 1 5 R n-Bu n-Bu n-Bu n-Bu n-Bu n-Bu n-Bu n-Bu n-Bu n-Bu n-Bu n-Bu n-Bu n-Bu n-Bu n-Bu R H H H H H H H H H H H H H H H H 6 R H H H H H H H H H H H H H H H H 7 R H H H H H H H H H H H H H H H H 8 3 R являє собою NHR , X являє собою Br, і ціанід металу являє собою ціанід калію. 2 R Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me 3 R H Me Et n-Pr i-Pr n-Bu i-Bu s-Bu t-Bu c-Pr c-PrCH2 1-CH3-c-Pr 2-CH3-c-Pr 1,1'-біциклопропіл-2-іл 1,1'-біциклопропіл-1-іл (1R, 2S)-1,1'-біциклопропіл-2-іл 28 5 R n-Bu n-Bu n-Bu n-Bu n-Bu n-Bu n-Bu n-Bu n-Bu n-Bu n-Bu n-Bu n-Bu n-Bu n-Bu n-Bu R H H H H H H H H H H H H H H H H 6 R H H H H H H H H H H H H H H H H 7 R H H H H H H H H H H H H H H H H 8
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparing 2-amino-5-cyanobenzoic acid derivatives
Автори російськоюDumas, Donald, J.
МПК / Мітки
МПК: C07C 255/58, C07D 231/16, C07C 253/14
Мітки: кислоти, одержання, похідних, спосіб, 2-аміно-5-ціанобензойної
Код посилання
<a href="https://ua.patents.su/51-105173-sposib-oderzhannya-pokhidnikh-2-amino-5-cianobenzojjno-kisloti.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання похідних 2-аміно-5-ціанобензойної кислоти</a>