Фармацевтична композиція на основі твердої дисперсії n-[2,4-біс(1,1-диметилетил)-5-гідроксифеніл]-1,4-дигідро-4-оксохінолін-3-карбоксаміду
Номер патенту: 102261
Опубліковано: 25.06.2013
Автори: Хертер Патрісія, Янг Крістофер, Вервейс Марінус Якобус, Роу Уілльям, Дайнхарт Кірк, Ботфілд Мартін, Оверхофф Кірк, Гроссі Альфредо, Гротенхейс Петер Д. Й.
Формула / Реферат
1. Фармацевтична композиція, яка містить:
a) приблизно 34,1 мас. % твердої дисперсії на масу композиції, де дисперсія містить приблизно 80 мас. % по суті аморфного N-[2,4-біс(1,1-диметилетил)-5-гідроксифеніл]-1,4-дигідро-4-оксохінолін-3-карбоксаміду (сполука 1)
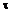
на масу дисперсії, приблизно 19,5 мас. % HPMCAS на масу дисперсії і приблизно 0,5 мас. % SLS на масу дисперсії;
b) приблизно 30,5 мас. % мікрокристалічної целюлози на масу композиції;
c) приблизно 30,4 мас. % лактози на масу композиції;
d) приблизно 3 мас. % кроскармелози натрію на масу композиції;
е) приблизно 0,5 мас. % SLS на масу композиції;
f) приблизно 0,5 мас. % колоїдного діоксиду кремнію на масу композиції, і
g) приблизно 1,0 мас. % стеарату магнію на масу композиції.
2. Фармацевтична композиція за п. 1, де композиція представлена в формі таблетки, що містить покриття.
3. Фармацевтична композиція за п. 2, де покриття містить барвник.
4. Фармацевтична композиція за п. 3, де покриття додатково містить воскове покриття.
5. Фармацевтична композиція за п. 1, де композиція сформована в таблетку, де таблетка має твердість принаймні 10 Кф ±20 %.
6. Фармацевтична композиція за п. 1, де композиція сформована в таблетку і таблетка містить приблизно 150 мг сполуки 1.
7. Фармацевтична композиція за п. 1, де композиція сформована в таблетку і таблетка містить приблизно 100 мг сполуки 1.
Текст
Реферат: Даний винахід стосується фармацевтичних композицій, що містять тверду дисперсію N-[2,4бic(1,1-диметилетил)-5-гідроксифеніл]-1,4-дигідро-4-оксохінолін-3-карбоксаміду. UA 102261 C2 (12) UA 102261 C2 UA 102261 C2 5 10 15 20 25 30 35 40 45 50 55 60 Перехресні посилання та спорідненні заявки У даній заявці заявлений пріоритет за USSN 61/088704, поданою 13 серпня 2008 року, USSN 61/088801, поданою 14 серпня 2008 року, USSN 61/090096, поданою 19 серпня 2008 року, USSN 61/146163, поданою 21 січня 2009 року, USSN 61/181527, поданою 27 травня 2009 року, і USSN 61/183345, поданою 2 червня, 2009 року, кожна з який включена сюди як посилання цілком. Галузь техніки Даний винахід стосується фармацевтичних композицій, що включають тверду дисперсію N[2,4-біс(1,1-диметилетил)-5-гідроксифеніл]-1,4-дигідро-4-оксохінолін-3-карбоксаміду, і способів одержання і введення фармацевтичних композицій, що містять N-[2,4-біс(1,1-диметилетил)-5гідроксифеніл]-1,4-дигідро-4-оксохінолін-3-карбоксамід. Рівень техніки Кістозний фіброз (CF) є рецесивним генетичним захворюванням, що уражає приблизно 30000 дітей і дорослих у Сполучених Штатах, і приблизно 30000 дітей і дорослих у Європі. Незважаючи на прогрес у лікуванні CF, дотепер не знайдений метод лікування. CF викликається мутаціями в гені регулятора трансмембранної провідності кістозного фіброзу (CFTR), що кодує епітеліальний хлоридний іонний канал, відповідальний за сприяння в регулюванні абсорбції солі і води і секреції в різних тканинах. Низькомолекулярні лікарські засоби, відомі потенціюючі засоби, що підвищують імовірність відкриття каналу CFTR, представляють одну з потенційних терапевтичних стратегій для лікування CF. Більш конкретно, CFTR є cAMP/ATP-опосередкованим каналом, що експресується в безлічі типів клітин, включаючи абсорбуючі і секреторні епітеліальні клітини, де він регулює аніонний потік через мембрану, а також активність інших іонних каналів і білків. В епітеліальних клітинах нормальне функціонування CFTR є критичним для підтримки транспорту електролітів в організмі, включаючи респіраторну і травну тканини. CFTR складається з приблизно 1480 амінокислот, що кодують білок у складі тандемного повтору трансмембранних доменів, кожний з який містить шість трансмембранних спіралей і нуклеотидний зв'язувальний домен. Два трансмембранних домени зв'язані великим полярним регулюючим (R)-доменом з множиною місць фосфорилування, що регулює активність каналу і спрямовану міграцію клітин. Ген, що кодує CFTR, ідентифікований і відсеквенований (Див. Gregory, R. J. et al. (1990) Nature 347:382-386; Rich, D. P. et al. (1990) Nature 347:358-362), (Riordan, J. R. et al. (1989) Science 245: 1066-1073). Дефект цього гену викликає мутації в CFTR, що приводять до кістозного фіброзу ("CF"), найбільш розповсюдженого фатального генетичного захворювання в людини. Кістозний фіброз уражає, приблизно, одного з кожних 2500 дітей у Сполучених Штатах. В усьому населенні Сполучених Штатів, аж до 10 мільйонів людей мають одну копію дефектного гену без очевидних ознак захворювання. Навпаки, люди з двома копіями CFасоційованого гену страждають від виснаження і фатальної дії CF, включаючи хронічні захворювання легень. У пацієнтів з CF, мутації в CFTR ендогенно експресуються в епітелій дихальних шляхів, що приводить до зниження апікальної секреції аніонів, що викликають дисбаланс у транспорті іонів і рідини. Отримане зниження транспорту аніонів бере участь у посиленні акумулювання слизу в легенях і супутніх мікробних інфекціях, що, у кінцевому рахунку, приводять до смерті пацієнта з CF. Крім респіраторних захворювань, пацієнти з CF звичайно страждають шлунково-кишковими проблемами і недостатністю підшлункової залози, що, залишаючись нелікованими, приводять до смерті. Крім того, більшість чоловіків з кістозним фіброзом є безплідними, і фертильність знижена в жінок з кістозним фіброзом. На відміну від важкої дії двох копій CF-зв'язаного гену, пацієнти з однією копією CF-зв'язаного гена демонструють підвищену стійкість до холери і до зневоднення внаслідок діареї - що, імовірно, пояснює відносно високу частоту CF гену в населення. Аналіз послідовності CFTR гену CF хромосом виявив безліч мутацій, що викликають захворювання (Cutting, G. R. et al. (1990) Nature 346:366-369; Dean, M. et al. (1990) Cell 61:863:870; і Kerem, B-S. et. al. (1989) Science 245:1073-1080; Kerem, B-S et al. (1990) Proc. Natl. Acad. Sci. USA 87:8447-8451). В даний час було ідентифіковано більше 1000 мутацій у CF гені, що викликають захворювання (http://www.genet.sickkids.on.ca/cftr/). Найбільш переважною мутацією є делеція фенілаланіну в положенні 508 послідовності амінокислот CFTR, і звичайно називається F508-CFTR. Ця мутація має місце приблизно в 70 % випадків кістозного фіброзу і зв'язана з важким захворюванням. Делеція залишку 508 у F508-CFTR перешкоджає правильному складанню білка, що з'являється. Це приводить до нездатності мутантного білка виходити з ER і переноситися в мембрану плазми. У результаті кількість каналів, що присутні у мембрані, стає набагато 1 UA 102261 C2 5 10 15 20 25 30 35 40 45 50 55 60 меншою, ніж спостерігається в клітинах, які експресують дикий тип CFTR. У доповненню до погіршеної спрямованої міграції, мутація викликає дефекти у воротному механізмі іонних каналів. Разом, знижене число каналів у мембрані і дефекти у воротному механізмі іонних каналів приводять до зниженої міграції аніонів через епітелій, що приводить до дефектів міграції іонів і рідини. (Quinton, P. M. (1990), FASEB J. 4: 2709-2727). Дослідження показали, однак, що знижена кількість F508-CFTR у мембрані є функціональною, хоч і меншою, ніж у дикому типі CFTR. (Dalemans et al. (1991), Nature Lond. 354: 526-528; Denning et al., вище; Pasyk and Foskett (1995), J. Cell. Biochem. 270: 12347-50). На додаток до ΔF508-CFTR, інші, мутації в CFTR, що зумовлюють хворобу, які викликають дефектну міграцію, синтез і/або воротний механізм іонних каналів, можуть бути активовані або пригнічені для зміни секреції аніону і модифікації розвитку захворювання і/або ваги. Хоча CFTR переносить безліч молекул на додаток до аніонів, мабуть, що ця його роль (перенос аніонів) представляє один з елементів у важливому механізмі переносу іонів і води + + - + через епітелій. Інші елементи включають епітеліальний Na канал, ENa, Na /2Cl /K ко+ + + транспортер, Na -K -ATPаза помпу і K канали базолатеральної мембрани, що відповідають за поглинання хлориду в клітину. Ці елементи працюють разом для досягнення спрямованого переносу через епітелій за допомогою їхньої селективної експресії і локалізації в клітині. Абсорбція хлориду відбувається + + при координованій дії ENa і CFTR, що є присутніми на верхівковій мембрані, і Na -K -ATPазної помпи і Cl іонних каналів, що експресуються на базолатеральній поверхні клітини. Вторинний активний перенос хлориду з люмінального боку приводить до акумулювання внутрішньоклітинного хлориду, що потім може пасивно залишати клітину через Cl канали, що + - + + + дає векторний транспорт. Розташування Na /2Cl /K ко-транспортеру, Na -K -ATPазної помпи і + K каналів базолатеральної мембрани на базолатеральній поверхні і CFTR на люмінальному боці координує виділення хлориду через CFTR на люмінальному боці. Тому що вода ймовірно ніколи не транспортується активно сама по собі, її потік через епітелій залежить від малесеньких трансепітеліальних осмотичних градієнтів, що генеруються об'ємним потоком натрію і хлориду. Як описано вище, думають, що делеція залишку 508 у F508-CFTR перешкоджає правильному складанню білка, що з'являється, що приводить до нездатності цього мутантного білка виходити з ER і переноситися в мембрану плазми. У результаті, недостатні кількості зрілого білка присутні в мембрані плазми, і перенос хлориду в епітеліальних тканинах значно знижений. Фактично було показано, що цей клітинний феномен дефектної обробки ER ABC транспортерами через апарат ER є основним не тільки для захворювання CF, але і для широкого спектру інших виділених і успадкованих захворювань. N-[2,4-біс(1,1-диметилетил)-5-гідроксифеніл]-1,4-дигідро-4-оксохінолін-3-карбоксамід є могутнім і селективним потенціюючим засобом для CFTR дикого типу і мутантних (включаючи, наприклад, F508, R117H і G551D) форм людського CFTR. N-[2,4-біс(1,1-диметилетил)-5гідроксифеніл]-1,4-дигідро-4-оксохінолін-3-карбоксамід застосовують для лікування дорослих пацієнтів з кістозним фіброзом і щонайменше одним алелем G551D-CFTR. Отже, існує необхідність у стабільних доступних фармацевтичних композиціях N-[2,4-біс(1,1диметилетил)-5-гідроксифеніл]-1,4-дигідро-4-оксохінолін-3-карбоксаміду, застосовуваних для лікування пацієнтів, що страждають на CF, і способах введення такої композиції. Суть винаходу Загалом даний винахід стосується фармацевтичних композицій, що містять тверду дисперсію N-[2,4-біс(1,1-диметилетил)-5-гідроксифеніл]-1,4-дигідро-4-оксохінолін-3карбоксаміду ("сполука 1"). Фармацевтичні композиції також можуть включати один або більше з наступних наповнювачів: наповнювач, розпушувач, глідант, змащувальний агент, зв'язувальний агент і поверхнево-активна речовина. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію аморфної сполуки 1, де тверда дисперсія містить приблизно 25 мг аморфної сполуки 1. У певних варіантах тверда дисперсія містить приблизно 25 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію аморфної сполуки 1, де тверда дисперсія містить приблизно 50 мг аморфної сполуки 1. У певних варіантах тверда дисперсія містить приблизно 50 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію аморфної сполуки 1, де тверда дисперсія містить приблизно 75 мг аморфної сполуки 1. У певних варіантах тверда дисперсія містить приблизно 75 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію аморфної сполуки 1, де тверда дисперсія містить приблизно 100 мг аморфної 2 UA 102261 C2 5 10 15 20 25 30 35 40 45 50 55 60 сполуки 1. У певних варіантах тверда дисперсія містить приблизно 100 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію аморфної сполуки 1, де тверда дисперсія містить приблизно 150 мг аморфної сполуки 1. У певних варіантах тверда дисперсія містить приблизно 150 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію аморфної сполуки 1, де тверда дисперсія містить приблизно 250 мг аморфної сполуки 1. У певних варіантах тверда дисперсія містить приблизно 250 мг по суті аморфної сполуки 1. В одному аспекті твердою формою сполуки 1 у фармацевтичній композиції є тверда дисперсія, що містить по суті аморфну або аморфну сполуку 1 і полімер, такий як гідроксипропілметилцелюлоза (HPMC), сукцинат ацетату гідроксипропілметилцелюлози (HPMCAS), співполімер вінілпіролідону/вінілацетату (PVP/VA), полівінілпіролідон (PVP), співполімери метакрилової кислоти/метакрилату, гідроксипропілцелюлоза (HPC) або будь-яке їхнє поєднання. Варіанти цього аспекту включають один або більше з наступних: тверда дисперсія є порошком із середнім розміром частинок більше приблизно 5 мкм або тверда 3 дисперсія має об'ємну густину приблизно 0,10 г/см або більше. У деяких випадках тверда дисперсія має концентрацію щонайменше 20 мас. % сполуки 1 на масу твердої дисперсії. В іншому випадку тверда дисперсія містить 80 мас. % або менше HPMCAS або PVP/VA. Деякі тверді дисперсії містять від приблизно 40 до приблизно 60 мас. % по суті аморфної або аморфної сполуки 1 на масу твердої дисперсії і від приблизно 60 до приблизно 40 мас. % полімеру на масу твердої дисперсії. Інші тверді дисперсії містять від приблизно 65 до приблизно 95 мас. % по суті аморфної або аморфної сполуки 1 на масу твердої дисперсії і від приблизно 45 до приблизно 5 мас. % полімеру на масу твердої дисперсії. Тверді дисперсії також можуть необов'язково містити добавки, такі як поверхнево-активна речовина (наприклад, лаурилсульфат натрію (SLS)), що може бути присутнім у концентрації менше 10 мас. % поверхнево-активної речовини на масу твердої дисперсії. Інші тверді дисперсії містять від приблизно 45 до приблизно 85 мас. % по суті аморфної або аморфної сполуки 1, від приблизно 0,45 до приблизно 0,55 мас. % SLS і від приблизно 14,45 до приблизно 55,55 мас. % HPMCAS або PVP/VA на масу твердої дисперсії. В інших варіантах фармацевтичні композиції також містять наповнювач (наприклад, лактозу, сорбіт, целюлози, фосфати кальцію, крохмалі, цукри (наприклад, маніт, сахарозу або подібні) або будь-яке їхнє поєднання) у концентраціях щонайменше приблизно 10 мас. % на масу композиції; розпушувач (наприклад, кроскармелозу натрію, натрію гліколят крохмалю або їхнє поєднання) у концентраціях приблизно 10 мас. % або менше на масу композиції; поверхневоактивну речовину (наприклад, лаурилсульфат натрію, стеарилфумарат натрію (SSF), моноолеат сорбітану поліоксіетилену 20 або будь-яке їхнє поєднання) у концентраціях приблизно 10 мас. % або менше на масу композиції; зв'язувальний агент (наприклад, мікрокристалічну целюлозу, двоосновний фосфат кальцію, сахарозу, кукурудзяний (маїсовий) крохмаль, модифіковану целюлозу (наприклад, гідроксиметилцелюлозу) або будь-яке їхнє поєднання) у концентраціях щонайменше приблизно 1 мас. % на масу композиції; глідант (наприклад, колоїдний діоксид кремнію, тальк або їхнє поєднання) у концентрації приблизно 2 мас. % або менше на масу композиції; і змащувальний агент (наприклад, стеарат магнію, стеаринова кислота, гідроване масло, стеарилфумарат натрію або будь-яке їхнє поєднання) у концентраціях приблизно 2 мас. % або менше на масу композиції. Такі фармацевтичні композиції можуть необов'язково містити один або більше барвників, віддушок і/або смакових добавок для поліпшення зовнішнього вигляду, смаку і запаху. Інший аспект даного винаходу стосується фармацевтичної композиції, що складає таблетку, що містить тверду дисперсію, наповнювач, розпушувач, поверхнево-активний агент, зв'язувальний агент, глідант і змащувальний агент, де таблетка розчиняється щонайменше на 50 % протягом приблизно 30 хвилин, і тверда дисперсія містить по суті аморфну сполуку 1. Як відзначено нижче, розчинення вимірюють на стандартному апараті USP Type II, у якому застосовується середовище для розчинення з 0,6 % лаурилсульфату натрію, розчиненого в 900 мл DI води (або об'єм середовища, що має те саме відношення SLS до DI води) при температурі приблизно 37C. Одну експериментальну таблетку тестують у кожній посудині для тестування апарату. Розчинення також може бути виміряне із застосуванням стандартного апарату USP Type II, у якому застосовується середовище для розчинення 0,7 % лаурилсульфату натрію в 900 мл 50 мм буфера на основі фосфату натрію (pН 6,8) при температурі приблизно 37C. Розчинення також може бути виміряне на стандартному апараті 3 UA 102261 C2 5 10 15 20 25 30 35 40 45 50 55 60 USP Type II, у якому застосовується середовище для розчинення з 0,5 % лаурилсульфату натрію, розчиненого в 900 мл 50 мм буфера на основі фосфату натрію (pН 6,8) при температурі приблизно 37C. Одну експериментальну таблетку тестують у кожній посудині для тестування апарату. Інший аспект даного винаходу стосується фармацевтичної композиції, що складає таблетку, що містить тверду дисперсію, що містить аморфну або по суті аморфну сполуку 1 і HPMCAS або PVP/VA; і наповнювач, розпушувач, поверхнево-активну речовину, зв'язувальну речовину, глідант змащувальну речовину, де таблетка має твердість щонайменше приблизно 5 Кф. У ще одному аспекті описані тут таблетки мають оболонку. В іншому аспекті таблетки в оболонці, описані тут, пофарбовані. У ще одному аспекті пофарбовані таблетки в оболонці включають текст або зображення. Наприклад, текст або зображення може бути надруковане на пофарбованій таблетці в оболонці. В інших аспектах пофарбована таблетка в оболонці включають приблизно 3 мас. % плівкового покриття, що містить синій барвник, такий як OPADRY® II. У деяких варіантах пофарбовані таблетки можуть бути позначені логотипом і текстом, що вказує концентрацію активного інгредієнта в таблетці із застосуванням чорного чорнила, таких як Opacode® WB або Opacode® S-1-17823. В інших варіантах пофарбовані таблетки в оболонці покриті барвником, воском, потім на них нанесений логотип, інше зображення і/або текст із застосуванням придатного чорнила. У деяких варіантах таблетки покриті приблизно 3 мас. % барвника і покриті порошком Карнаубського воску в кількості приблизно 0,01 % мас./мас. на вихідну масу середньої частини таблетки. Покриті воском таблетки можуть бути позначені логотипом і текстом, що вказує концентрації активного інгредієнта в таблетці, із застосуванням придатного чорнила. Інший аспект даного винаходу стосується способу одержання фармацевтичної композиції, що включає стадії одержання суміші твердої дисперсії аморфної сполуки 1, зв'язувального агента, гліданту, поверхнево-активної речовини, змащувального агента, розпушувача і наповнювача, і пресування суміші в таблетки, що мають розчинення щонайменше 50 % за приблизно 30 хвилин. В одному прикладі суміш пресують до твердості щонайменше приблизно 5 Кф. Інший аспект даного винаходу стосується способу одержання фармацевтичної композиції, що містять стадії одержання суміші твердої дисперсії аморфної сполуки 1, зв'язувального агента, гліданту, поверхнево-активної речовини, змащувального агента, розпушувача і наповнювача, і пресування суміші у таблетку, що має розчинення щонайменше 70 % за приблизно 30 хвилин. Інший аспект даного винаходу стосується способу введення фармацевтичної композиції перорально пацієнту щонайменше один раз на добу щонайменше однієї таблетки, що містить тверду дисперсію по суті аморфної або аморфної сполуки 1, наповнювач, зв'язувальний агент, глідант, розпушувач, поверхнево-активну речовину й змащувальний агент, де тверда дисперсія містить щонайменше приблизно 25 мг по суті аморфної або аморфної сполуки 1. У деяких сполуках таблетку перорально вводять пацієнту один раз на добу. Інші таблетки, застосовувані в даному способі, містять тверду дисперсію, що містить щонайменше приблизно 50 мг по суті аморфної або аморфної сполуки 1. Деякі таблетки, застосовувані в даному способі, містять тверду дисперсію, що містить щонайменше приблизно 75 мг по суті аморфної або аморфної сполуки 1. Інші таблетки, застосовувані в даному способі, містять тверду дисперсію, що містить щонайменше приблизно 100 мг по суті аморфної або аморфної сполуки 1. Інші таблетки, застосовувані в даному способі, містять тверду дисперсію, що містить щонайменше приблизно 150 мг по суті аморфної або аморфної сполуки 1. В іншому способі введення включає пероральне введення пацієнту щонайменше один раз на добу щонайменше однієї таблетки, що містить тверду дисперсію по суті аморфної або аморфної сполуки 1, наповнювач, зв'язувальний агент, глідант, розпушувач, поверхнево-активну речовину, змащувальний агент, де тверда дисперсія містить щонайменше приблизно 250 мг по суті аморфної або аморфної сполуки 1. У деяких варіантах даний винахід стосується способу перорального введення фармацевтичних композицій, описаних тут щонайменше один раз на добу. В інших варіантах даний винахід стосується способу перорального введення фармацевтичних композицій, описаних тут, один раз на добу. У деяких варіантах даний винахід стосується способу перорального введення фармацевтичних композицій, описаних тут, два рази на добу. В одному аспекті в даному винаході також представлений спосіб лікування або зменшення тяжкості захворювання в пацієнта, що включає введення зазначеному пацієнту однієї з визначених тут композицій, де зазначене захворювання вибирають з кістозного фіброзу, астми, COPD, викликаного палінням, хронічного бронхіту, риносинуситу, запору, панкреатиту, 4 UA 102261 C2 5 10 15 20 25 30 35 40 45 недостатності підшлункової залози, чоловічої безплідності, викликаної вродженою двосторонньою відсутністю сім'явиносних протоків (CBAVD), легкого легеневого захворювання, ідіопатичного панкреатиту, алергійного бронхо-легеневого аспергільозу (ABPA), хвороби печінки, спадкової емфіземи, спадкового гемохроматозу, недостатності коагуляції/фібринолізу, такої як недостатність білка С, спадкового набряку Квінке 1 типу, недостатності обробки ліпідів, такого як сімейна гіперхолестеринемія, хіломікронемії 1 типу, акантоцитозу, лізосомної хвороби накопичення, такої як хвороба I-клітин/псевдо-Харлер, мукополісахаридоз, Сендхоф/Тай-Саш, Кріглер-Наджар II типу, поліендокринопатії/гіперінсулінемії, цукрового діабету, карликовості Ларона, недостатності мієлопероксидази, первинного гіпопаратиреозу, меланоми, гліканозу CDG типу 1, вродженого гіпертиреозу, недосконалого остеогенезу, спадкової гіпофібриногенемії, недостатності ACT, нецукрового діабету (DI), нейрофізеального DI, непрогенного DI, зубного синдрому Шарко-Марі-Тута, хвороби Перлізауса-Мерзбахера, нейродегенеративних захворювань, таких як хвороба Альцгеймера, хвороба Паркінсона, аміотрофичного латерального склерозу, наростаючої над'ядерної плазії, хвороби Піка, декількох поліглутамінових неврологічних розладів, таких як Хантінгтон, спінальноцеребелярної атаксії I типу, спінальної і бульбарної м'язової атрофії, дентаторубральної палідолюїсовой атрофії і міотонічної дистрофії, а також губчатих енцефалопатій, таких як спадкова хвороба Крейтцфельда-Якоба (через дефект обробки білка пріону), хвороби Фабрі, синдрому Страусслера-Шейнкера, COPD, сухості очей, хвороби Шегрена, остеопорозу, остеопенії, синдрому Горана, хлоридних каналопатій, таких як вроджена міотонія (форми Томсона і Бекера), синдрому Барттера III типу, хвороби Дента, гіперекплексії, епілепсії, гіперекплексії, лізосомної хвороби накопичення, синдрому Ангельмана і первинної циліарної дискінезії (PCD), термін для спадкових розладів структури і/або функції війок, включаючи PCD із дзеркальним розташуванням органів (також відому як синдром Картагенера), PCD без дзеркального розташування органів і циліарної аплазії. Короткий опис малюнків На фіг. 1 представлена графічна ілюстрація профілів розчинення прикладів таблеток згідно з даним винаходом. Ця фігура представлена як приклад і не обмежує даний винахід. Докладний опис Даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію N-[2,4біс(1,1-диметилетил)-5-гідроксифеніл]-1,4-дигідро-4-оксохінолін-3-карбоксаміду, способу одержання фармацевтичної композиції, що містить N-[2,4-біс(1,1-диметилетил)-5гідроксифеніл]-1,4-дигідро-4-оксохінолін-3-карбоксамід, і способу введення фармацевтичної композиції, що містить тверду форму N-[2,4-біс(1,1-диметилетил)-5-гідроксифеніл]-1,4-дигідро4-оксохінолін-3-карбоксаміду. I. Визначення У даному описі термін "активний фармацевтичний інгредієнт" або "API" стосується біологічно активної сполуки. Приклади API включають CF потенціюючий агент, (наприклад, N[2,4-біс(1,1-диметилетил)-5-гідроксифеніл]-1,4-дигідро-4-оксохінолін-3-карбоксамід). У даному описі термін "сполука 1" застосовують взаємозамінно з "N-[2,4-біс(1,1диметилетил)-5-гідроксифеніл]-1,4-дигідро-4-оксохінолін-3-карбоксамідом", що має наступну структуру: . "Сполука 1" також означає таутомерні форми, такі як: . У даному описі термін "аморфне" означає твердий матеріал, що не має вищого порядку в розташуванні його молекул. Аморфні тверді речовини звичайно є переохолодженими рідинами, у яких молекули розташовані довільно, так що відсутнє добре обумовлене розташування, 5 UA 102261 C2 5 10 15 20 25 30 35 40 45 50 55 наприклад, молекулярне упакування, і структури вищого порядку. Аморфні тверді речовини звичайно є ізотропними, тобто демонструють схожі властивості у всіх напрямках і не мають визначених температур плавлення. Наприклад, аморфний матеріал є твердим матеріалом, що не має чіткого характеристичного піку кристалізації в порошковій рентгенограмі (XRPD) (тобто не є кристалічним по XRPD). Замість цього, на XRPD з'являються один або декілька широких піків (наприклад, ореоли). Широкі піки є характерними для аморфної твердої речовини. Див. US 2004/0006237 для порівняння XRPD аморфного матеріалу і кристалічного матеріалу. У даному описі термін "по суті аморфне" стосується твердого матеріалу, що не має або має незначну упорядкованість у положенні молекул. Наприклад, власне аморфні матеріали мають менше приблизно 15 % кристалічності (наприклад, менше приблизно 10 % кристалічності або менше приблизно 5 % кристалічності). Також відзначено, що термін "по суті аморфне" включає опис "аморфне", що стосується матеріалів, що не мають (0 %) кристалічності. У даному описі термін "дисперсія" стосується дисперсної системи, у якій одна речовина, диспергована фаза, розподілена, окремими одиницями, у другій речовині (безперервна фаза або носій). Розмір диспергованої фази може значно варіюватися (наприклад, окремі молекули, колоїдні частинки нанорозмірів, множинні мікрони по розмірі). Загалом дисперговані фази можуть бути твердими речовинами, рідинами або газами. У випадку твердої дисперсії диспергована і безперервна фази, обидві є твердими речовинами. У фармацевтичних галузях застосування тверда дисперсія може включати: аморфний лікарський засіб в аморфному полімері; аморфний лікарський засіб у кристалічному полімері; кристалічний лікарський засіб в аморфному полімері; або кристалічний лікарський засіб у кристалічному полімері. У даному винаході тверда дисперсія може включати аморфний лікарський засіб в аморфному полімері або аморфний лікарський засіб у кристалічному полімері. У деяких варіантах тверда дисперсія включає полімер, що складає дисперговану фазу, і лікарський засіб, що складає безперервну фазу. Або тверда дисперсія включає лікарський засіб, що складає дисперговану фазу, і полімер, що складає безперервну фазу. У даному описі термін "тверда дисперсія" звичайно стосується твердої дисперсії двох або більше компонентів, звичайно одного або більше лікарських засобів (наприклад, одного лікарського засобу (наприклад, сполуки 1)) і полімеру, але може також містити інші компоненти, такі як поверхнево-активні речовини або інші фармацевтичні наповнювачі, де лікарський засіб (наприклад, сполука 1) є по суті аморфним (наприклад, має приблизно 15 % або менше (наприклад, приблизно 10 % або менше, або приблизно 5 % або менше) кристалічності) лікарським засобом (наприклад, N-[2,4-біс(1,1-диметилетил)-5-гідроксифеніл]-1,4-дигідро-4оксохінолін-3-карбоксамідом) або аморфним (наприклад, не містить кристалічний лікарський засіб), і фізична стабільність і/або розчинення і/або розчинність по суті аморфного або аморфного лікарського засобу поліпшується іншими компонентами. Тверді дисперсії звичайно включають сполуку, дисперговану в придатному носії, такому як твердий носій. Наприклад, носій містить полімер (наприклад, розчинний у воді полімер або частково розчинний у воді полімер) і може включати необов'язкові наповнювачі, такі як функціональні наповнювачі (наприклад, одна або більше поверхнево-активних речовин) або нефункціональні наповнювачі (наприклад, один або більше наповнювачів). Інші приклади твердих дисперсій включають спільно осаджені чи спільно розплавлені N-[2,4-біс(1,1-диметилетил)-5-гідроксифеніл]-1,4дигідро-4-оксохінолін-3-карбоксамід і щонайменше один полімер. "Спільний осад" є продуктом після розчинення лікарського засобу і полімеру в розчиннику або суміші розчинників з наступним видаленням розчинника або суміші розчинників. Іноді полімер може бути суспендований у розчиннику або суміші розчинників. Розчинник або суміш розчинників включає органічні розчинники і надкритичні рідини. "Спільний розплав" є продуктом після нагрівання лікарського засобу і полімеру до плавлення, необов'язково в присутності розчинника або суміші розчинників, з наступним змішуванням, видаленням щонайменше частини розчинника, якщо можливо, і охолодженням до кімнатної температури з обраною швидкістю. У даному описі "кристалічність" стосується ступеня структурного порядку твердої речовини. Наприклад, сполука 1, що є по суті аморфною, має менше приблизно 15 % кристалічності, або його тверда структура має менше приблизно 15 % кристалічності. В іншому прикладі сполука 1, що є аморфною, має нульову (0 %) кристалічність. У даному описі "CF потенціюючий засіб, " стосується сполуки, що має біологічну дію, яка характеризується підвищеною синхронізуючою функціональністю мутантного CFTR білка, що присутні на поверхні клітини до приблизних рівнів дикого типу. 6 UA 102261 C2 5 10 15 20 25 30 У даному описі "наповнювач" є неактивним інгредієнтом у фармацевтичній композиції. Приклади наповнювачів включають наповнювачі і розріджувачі, поверхнево-активні речовини, зв'язувальні агенти, гліданти, змащувальні агенти, розпушувачі і подібні. У даному описі "розпушувач" є наповнювачем, що гідрує фармацевтичну композицію і допомагає диспергувати таблетку. Приклади розпушувачів включають кроскармелозу натрію і/або натрію гліколят крохмалю. У даному описі "розріджувач" або "наповнювач" є наповнювачем, що надає об'єму фармацевтичній композиції. Приклади наповнювачів включають лактозу, сорбіт, целюлози, фосфати кальцію, крохмалі, цукри (наприклад, маніт, сахарозу або подібні) або будь-яке їхнє поєднання. У даному описі "поверхнево-активна речовина" є наповнювачем, що надає фармацевтичним композиціям поліпшеної розчинності і/або змочуваності. Приклади поверхнево-активних речовин включають лаурилсульфат натрію (SLS), стеарилфумарат натрію (SSF), моноолеат сорбітану поліоксиетилену 20 (наприклад, Tween™) або будь-яке їхнє поєднання. У даному описі "зв'язувальний агент" є наповнювачем, що надає фармацевтичній композиції поліпшеної когезії або міцності на розрив (наприклад, твердості). Приклади зв'язувальних агентів включають двоосновний фосфат кальцію, сахарозу, кукурудзяний (маїсовий) крохмаль, мікрокристалічну целюлозу і модифіковану целюлозу (наприклад, гідроксиметилцелюлозу). У даному описі "глідант" є наповнювачем, що надає фармацевтичним композиціям поліпшених властивостей текучості. Приклади глідантів включають колоїдний діоксид кремнію і/або тальк. У даному описі "барвник" є наповнювачем, що надає фармацевтичній композиції бажаного кольору. Приклади барвників включають комерційно доступні пігменти, такі як FD&C Blue # 1 Aluminum Lake, FD&C Blue #2, інші барвники FD&C Blue, діоксид титану, оксид заліза і/або їхнє поєднання. У даному описі "змащувальний агент" є наповнювачем, що додають до фармацевтичних композицій, що пресують у таблетки. Змащувальний агент сприяє пресуванню гранул у таблетки і вийманню таблетки з фармацевтичною композицією з преса. Приклади змащувальних агентів включають стеарат магнію, стеаринову кислоту (стеарин), гідроване масло, стеарилфумарат натрію або будь-яке їхнє поєднання. У даному описі "міцність таблеток на стирання" стосується властивості таблетки залишатися цілою і зберігати свою форму, незважаючи на зовнішні сили тиску. Міцність таблеток на стирання може бути оцінена із застосуванням математичного виразу, представленого в рівнянні 1: 35 % міцності таблеток на стирання 100 40 45 50 55 W0 Wf W0 (1) , де W 0 є вихідною масою таблетки і W f є кінцевою масою таблетки після пропускання через фріабілятор. Міцність таблеток на стирання вимірюють із застосуванням стандартного апарату для тестування USP, що мне експериментальні таблетки при 100 обертах. Деякі таблетки згідно з даним винаходом мають міцність на стирання менше приблизно 1 % (наприклад, менше приблизно 0,75 %, менше приблизно 0,50 % або менше приблизно 0,30 %). У даному описі "середній діаметр частинок" є середнім діаметром частинок, вимірюваним із застосуванням таких методик, як розсіяне лазерне випромінювання, аналіз зображення або гранулометричний аналіз. У даному описі "об'ємна густина" дорівнює масі частинок, ділених на загальний об'єм, зайнятий частинками. Загальний об'єм включає об'єм частинок, об'єм порожнеч навколо частинок і внутрішній об'єм пір. Об'ємна густина не є характеристичною властивістю матеріалу; вона може змінюватися в залежності від того, як оброблений матеріал. II. Фармацевтична композіція В одному аспекті даний винахід стосується фармацевтичної композиції, що містить CF потенціюючий агент, API (наприклад, тверду дисперсію сполуки 1). В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію по суті аморфної сполуки 1, де тверда дисперсія містить приблизно 25 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію по суті аморфної сполуки 1, де тверда дисперсія містить приблизно 50 мг по суті аморфної сполуки 1. 7 UA 102261 C2 5 10 15 20 25 30 35 40 45 50 55 В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію по суті аморфної сполуки 1, де тверда дисперсія містить приблизно 75 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію по суті аморфної сполуки 1, де тверда дисперсія містить приблизно 100 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію по суті аморфної сполуки 1, де тверда дисперсія містить приблизно 150 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію по суті аморфної сполуки 1, де тверда дисперсія містить приблизно 250 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію аморфної сполуки 1, де тверда дисперсія містить приблизно 25 мг аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію аморфної сполуки 1, де тверда дисперсія містить приблизно 50 мг аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію аморфної сполуки 1, де тверда дисперсія містить приблизно 75 мг аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію аморфної сполуки 1, де тверда дисперсія містить приблизно 100 мг аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію аморфної сполуки 1, де тверда дисперсія містить приблизно 150 мг аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію аморфної сполуки 1, де тверда дисперсія містить приблизно 250 мг аморфної сполуки 1. Інший аспект даного винаходу стосується фармацевтичної композиції, що містить тверду дисперсію сполуки 1, у якій тверда дисперсія містить полімер. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію по суті аморфної сполуки 1 і HPMCAS, де тверда дисперсія містить приблизно 25 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію по суті аморфної сполуки 1 і HPMCAS, де тверда дисперсія містить приблизно 50 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію по суті аморфної сполуки 1 і HPMCAS, де тверда дисперсія містить приблизно 75 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію по суті аморфної сполуки 1 і HPMCAS, де тверда дисперсія містить приблизно 100 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію по суті аморфної сполуки 1 і HPMCAS, де тверда дисперсія містить приблизно 150 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію по суті аморфної сполуки 1 і HPMCAS, де тверда дисперсія містить приблизно 250 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію аморфної сполуки 1 і HPMCAS, де тверда дисперсія містить приблизно 25 мг аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію аморфної сполуки 1 і HPMCAS, де тверда дисперсія містить приблизно 50 мг аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію аморфної сполуки 1 і HPMCAS, де тверда дисперсія містить приблизно 75 мг аморфної сполуки 1. 8 UA 102261 C2 5 10 15 20 25 30 35 40 45 50 55 60 В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію аморфної сполуки 1 і HPMCAS, де тверда дисперсія містить приблизно 100 мг аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію аморфної сполуки 1 і HPMCAS, де тверда дисперсія містить приблизно 150 мг аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію аморфної сполуки 1 і HPMCAS, де тверда дисперсія містить приблизно 250 мг аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію по суті аморфної сполуки 1 і PVP/VA, де тверда дисперсія містить приблизно 25 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію по суті аморфної сполуки 1 і PVP/VA, де тверда дисперсія містить приблизно 50 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію по суті аморфної сполуки 1 і PVP/VA, де тверда дисперсія містить приблизно 75 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію по суті аморфної сполуки 1 і PVP/VA, де тверда дисперсія містить приблизно 100 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію по суті аморфної сполуки 1 і PVP/VA, де тверда дисперсія містить приблизно 150 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію по суті аморфної сполуки 1 і PVP/VA, де тверда дисперсія містить приблизно 250 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію аморфної сполуки 1 і PVP/VA, де тверда дисперсія містить приблизно 25 мг аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію аморфної сполуки 1 і PVP/VA, де тверда дисперсія містить приблизно 50 мг аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію аморфної сполуки 1 і PVP/VA, де тверда дисперсія містить приблизно 75 мг аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію аморфної сполуки 1 і PVP/VA, де тверда дисперсія містить приблизно 100 мг аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію аморфної сполуки 1 і PVP/VA, де тверда дисперсія містить приблизно 150 мг аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить тверду дисперсію аморфної сполуки 1 і PVP/VA, де тверда дисперсія містить приблизно 250 мг аморфної сполуки 1. В одному аспекті даний винахід стосується фармацевтичної композиції, що містить CF потенціюючий агент, API (наприклад, тверду дисперсію сполуки 1) і інші наповнювачі (наприклад, наповнювач, розпушувач, поверхнево-активна речовина, зв'язувальний агент, глідант, барвник, змащувальний агент або будь-яке їхнє поєднання). В одному варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію по суті аморфної сполуки 1 і полімер; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 25 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію по суті аморфної сполуки 1 і полімер; 9 UA 102261 C2 5 10 15 20 25 30 35 40 45 50 55 60 b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 50 мг по суті аморфної сполуки 1. В іншому варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію по суті аморфної сполуки 1 і полімер; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 75 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію по суті аморфної сполуки 1 і полімер; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 100 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію по суті аморфної сполуки 1 і полімер; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 150 мг по суті аморфної сполуки 1. В іншому варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію по суті аморфної сполуки 1 і полімер; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 250 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію аморфної сполуки 1 і полімер; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 25 мг аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію аморфної сполуки 1 і полімер; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, 10 UA 102261 C2 5 10 15 20 25 30 35 40 45 50 55 60 де тверда дисперсія містить приблизно 50 мг аморфної сполуки 1. В іншому варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію аморфної сполуки 1 і полімер; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 75 мг аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію аморфної сполуки 1 і полімер; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 100 мг аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію аморфної сполуки 1 і полімер; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 150 мг аморфної сполуки 1. В іншому варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію аморфної сполуки 1 і полімер; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 250 мг аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію по суті аморфної сполуки 1 і PVP/VA; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 25 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію по суті аморфної сполуки 1 і PVP/VA; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 50 мг по суті аморфної сполуки 1. В іншому варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію по суті аморфної сполуки 1 і PVP/VA; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; 11 UA 102261 C2 5 10 15 20 25 30 35 40 45 50 55 60 e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 75 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію по суті аморфної сполуки 1 і PVP/VA; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 100 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію по суті аморфної сполуки 1 і PVP/VA; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 150 мг по суті аморфної сполуки 1. В іншому варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію по суті аморфної сполуки 1 і PVP/VA; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 250 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію аморфної сполуки 1 і PVP/VA; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 25 мг аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію аморфної сполуки 1 і PVP/VA; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 50 мг аморфної сполуки 1. В іншому варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію аморфної сполуки 1 і PVP/VA; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 75 мг аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію аморфної сполуки 1 і PVP/VA; 12 UA 102261 C2 5 10 15 20 25 30 35 40 45 50 55 60 b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 100 мг аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію аморфної сполуки 1 і PVP/VA; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 150 мг аморфної сполуки 1. В іншому варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію аморфної сполуки 1 і PVP/VA; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 250 мг аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію по суті аморфної сполуки 1 і HPMCAS; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. звязувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 25 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію по суті аморфної сполуки 1 і HPMCAS; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 50 мг по суті аморфної сполуки 1. В іншому варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію по суті аморфної сполуки 1 і HPMCAS; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 75 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію по суті аморфної сполуки 1 і HPMCAS; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, 13 UA 102261 C2 5 10 15 20 25 30 35 40 45 50 55 60 де тверда дисперсія містить приблизно 100 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію по суті аморфної сполуки 1 і HPMCAS; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 150 мг по суті аморфної сполуки 1. В іншому варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію по суті аморфної сполуки 1 і HPMCAS; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 250 мг по суті аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію аморфної сполуки 1 і HPMCAS; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 25 мг аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію аморфної сполуки 1 і HPMCAS; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 50 мг аморфної сполуки 1. В іншому варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію аморфної сполуки 1 і HPMCAS; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 75 мг аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію аморфної сполуки 1 і HPMCAS; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 100 мг аморфної сполуки 1. В одному варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію аморфної сполуки 1 і HPMCAS; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; 14 UA 102261 C2 5 10 15 20 25 30 35 40 45 50 55 60 e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 150 мг аморфної сполуки 1. В іншому варіанті даний винахід стосується фармацевтичної композиції, що містить: a. тверду дисперсію аморфної сполуки 1 і HPMCAS; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент, де тверда дисперсія містить приблизно 250 мг аморфної сполуки 1. В одному варіанті фармацевтична композиція містить тверду дисперсію, наповнювач, розпушувач, поверхнево-активну речовину, зв'язувальний агент, глідант і змащувальний агент, де тверда дисперсія містить сполуку 1 і полімер. В інших варіантах фармацевтична композиція містить тверду дисперсію, наповнювач, розпушувач, поверхнево-активну речовину, зв'язувальний агент, глідант і змащувальний агент, де тверда дисперсія містить від приблизно 45 до приблизно 65 мас. % (наприклад, приблизно 50 мас. %) сполуки 1 на масу дисперсії, і полімер. У деяких варіантах фармацевтична композиція містить тверду дисперсію, наповнювач, розпушувач, поверхнево-активну речовину, зв'язувальний агент, глідант і змащувальний агент, де тверда дисперсія містить від приблизно 75 до приблизно 95 мас. % (наприклад, приблизно 80 мас. %) сполуки 1 на масу дисперсії, і полімер. Придатні тверді дисперсії сполуки 1, тобто N-[2,4-біс(1,1-диметилетил)-5-гідроксифеніл]-1,4дигідро-4-оксохінолін-3-карбоксаміду, включають, без обмежень, дисперсії, описані в публікації PCT № WO 2007/079139, що включена сюди як посилання цілком. В одному варіанті фармацевтична композиція згідно з даним винаходом містить тверду дисперсію сполуки 1. Наприклад, тверда дисперсія містить по суті аморфну сполуку 1, де сполука 1 має менше приблизно 15 % (наприклад, менше приблизно 10 % або менше приблизно 5 %) кристалічність, і щонайменше один полімер. В іншому прикладі тверда дисперсія містить аморфну сполуку 1, тобто сполуку 1, що має приблизно 0 % кристалічність. Концентрація сполуки 1 у твердій дисперсії залежить від декількох факторів, таких як кількість фармацевтичної композиції, необхідної для одержання бажаної кількості сполуки 1 і бажаного профілю розчинення фармацевтичної композиції. Полімери, застосовувані в таких твердих дисперсіях, є інертними, фармацевтично прийнятними полімерами, що щонайменше частково розчинні в воді або біологічних рідинах. Полімери можуть включати гомополімери (наприклад, полісахариди) або співполімери (наприклад, блок-співполімери). В одному прикладі тверда дисперсія містить по суті аморфний або аморфний N-[2,4-біс(1,1-диметилетил)-5-гідроксифеніл]-1,4-дигідро-4-оксохінолін-3карбоксамід і щонайменше один полімер, незалежно вибраний з гідроксипропілметилцелюлози (HPMC), сукцинату ацетату гідроксипропілметилцелюлози (HPMCAS), співполімеру вінілпіролідону/вінілацетату (PVP/VA), полівінілпіролідону (PVP), співполімерів метакрилової кислоти/метакрилату, гідроксипропілцелюлози (HPC) або будь-яких їхніх поєднань. В іншому прикладі тверда дисперсія містить по суті аморфний або аморфний N-[2,4-біс(1,1-диметилетил)5-гідроксифеніл]-1,4-дигідро-4-оксохінолін-3-карбоксамід і HPMCAS або PVP/VA. В іншому варіанті фармацевтична композиція включає тверду дисперсію, що містить по суті аморфну сполуку 1 і HPMCAS або PVP/VA, де тверда дисперсія має середній діаметр частинок, вимірюваний методом світлорозсіювання (наприклад, із застосуванням Malvern Mastersizer від Malvern Instruments in England) більше приблизно 5 мкм (наприклад, більше приблизно 6, більше приблизно 7, більше приблизно 8 або більше приблизно 10 мкм). Наприклад, фармацевтична композиція містить тверду дисперсію, що містить аморфну сполуку 1 і HPMCAS або PVP/VA, де тверда дисперсія має середній діаметр частинок, вимірюваний методом світлорозсіювання, більше приблизно 5 мкм (наприклад, більше приблизно 6, більше приблизно 7, більше приблизно 8 або більше приблизно 10 мкм). В іншому прикладі фармацевтична композиція містить тверду дисперсію, що містить по суті аморфну сполуку 1 і HPMCAS, де тверда дисперсія має середній діаметр частинок, вимірюваний методом світлорозсіювання, від приблизно 7 до приблизно 25 мкм. Наприклад, фармацевтична композиція містить тверду дисперсію, що містить по суті аморфну сполуку 1 і HPMCAS, де тверда дисперсія має середній діаметр частинок, вимірюваний методом світлорозсіювання, від приблизно 7 до приблизно 25 15 UA 102261 C2 5 10 15 20 25 30 35 40 45 50 55 60 мкм. У ще одному прикладі фармацевтична композиція містить тверду дисперсію, що містить по суті аморфну сполуку 1 і HPMCAS, де тверда дисперсія має середній діаметр частинок, вимірюваний методом світлорозсіювання, від приблизно 10 до приблизно 35 мкм. Наприклад, фармацевтична композиція містить тверду дисперсію, що містить по суті аморфну сполуку 1 і HPMCAS, де тверда дисперсія має середній діаметр частинок, вимірюваний методом світлорозсіювання, від приблизно 10 до приблизно 35 мкм. В іншому прикладі фармацевтична композиція містить тверду дисперсію, що містить по суті аморфну сполуку 1 і HPMCAS або 3 PVP/VA, де тверда дисперсія має об'ємну густину приблизно 0,10 г/см або більше (наприклад, 3 3 0,15 г/см або більше, 0,17 г/см або більше). Наприклад, фармацевтична композиція містить тверду дисперсію, що містить аморфну сполуку 1 і HPMCAS або PVP/VA, де тверда дисперсія 3 3 має об'ємну густину приблизно 0,10 г/см або більше (наприклад, 0,15 г/см або більше, 0,17 3 г/см або більше). В іншому випадку фармацевтична композиція містить тверду дисперсію, що містить по суті аморфну сполуку 1 і HPMCAS або PVP/VA, де тверда дисперсія має об'ємну 3 густину від приблизно 0,10 до приблизно 0,45 г/см (наприклад, від приблизно 0,15 до 3 3 приблизно 0,42 г/см або від приблизно 0,17 до приблизно 0,40 г/см ). В іншому випадку фармацевтична композиція містить тверду дисперсію, що містить аморфну сполуку 1 і HPMCAS або PVP/VA, де тверда дисперсія має об'ємну густину від приблизно 0,10 до приблизно 0,45 3 3 г/см (наприклад, від приблизно 0,15 до приблизно 0,42 г/см або від приблизно 0,17 до 3 приблизно 0,40 г/см ). В іншому прикладі фармацевтична композиція містить тверду дисперсію, що містить по суті аморфну сполуку 1 і HPMCAS, де тверда дисперсія має об'ємну густину від 3 3 приблизно 0,10 до приблизно 0,45 г/см (наприклад, від приблизно 0,15 до приблизно 0,42 г/см 3 або від приблизно 0,17 до приблизно 0,40 г/см ). Наприклад, фармацевтична композиція містить тверду дисперсію, що містить аморфну сполуку 1 і HPMCAS, де тверда дисперсія має об'ємну 3 густину від приблизно 0,10 до приблизно 0,45 г/см (наприклад, від приблизно 0,15 до 3 3 приблизно 0,42 г/см або від приблизно 0,17 до приблизно 0,40 г/см ). Альтернативно тверді дисперсії містять по суті аморфну або аморфну сполуку 1 і HPMCAS або PVP/VA, де по суті аморфна сполука 1 або аморфна сполука 1 присутня у кількості щонайменше 20 мас. % (наприклад щонайменше 40 щонайменше 45 щонайменше 49 або щонайменше 50 мас. %) на масу твердої дисперсії. У деяких варіантах тверда дисперсія містить HPMCAS або PVP/VA і від приблизно 20 до приблизно 99 мас. % (наприклад, від приблизно 40 до приблизно 90 мас. %, від приблизно 42 до приблизно 88 мас. %, від приблизно 45 до приблизно 85 мас. % або від приблизно 50 до приблизно 80 мас. %) по суті аморфної або аморфної сполуки 1 на масу твердої дисперсії. Наприклад, тверда дисперсія містить HPMCAS або PVP/VA і від приблизно 40 до приблизно 60 мас. % (наприклад, від приблизно 42 до приблизно 57 мас. %, від приблизно 45 до приблизно 55 мас. % або від приблизно 47 до приблизно 53 мас. %) по суті аморфної або аморфної сполуки 1 на масу твердої дисперсії. В іншому прикладі тверда дисперсія містить HPMCAS або PVP/VA і від приблизно 65 до приблизно 95 мас. % (наприклад, від приблизно 67 до приблизно 92 мас. %, від приблизно 70 до приблизно 90 мас. % або від приблизно 72 до приблизно 88 мас. %) по суті аморфної сполуки 1 або аморфної сполуки 1 на масу твердої дисперсії. В інших варіантах тверда дисперсія містить 80 мас. % або менше (наприклад, 60 мас. % або менше, 55 мас. % або менше, або 50 мас. % або менше) полімеру (наприклад, HPMCAS, PVP/VA, PVP, співполімеру метакрилової кислоти/метакрилату, HPC або будь-якого їхнього поєднання) на масу твердої дисперсії. У деяких варіантах тверда дисперсія містить від приблизно 1 до приблизно 80 мас. % (наприклад, від приблизно 10 до приблизно 60 мас. %) полімеру (наприклад, HPMCAS, PVP/VA, PVP, співполімеру метакрилової кислоти/метакрилату, HPC або будь-якого їхнього поєднання). Деякі тверді дисперсії містять від приблизно 40 до приблизно 60 мас. % (наприклад, від приблизно 42 до приблизно 57 мас. %, від приблизно 45 до приблизно 55 мас. % або від приблизно 47 до приблизно 53 мас. %) по суті аморфної сполуки 1 на масу твердої дисперсії і від приблизно 60 до приблизно 40 мас. % полімеру (наприклад, HPMCAS, PVP/VA, PVP, співполімеру метакрилової кислоти/метакрилату, HPC або будь-якого їхнього поєднання). Альтернативні тверді дисперсії містять від приблизно 40 до приблизно 60 мас. % (наприклад, від приблизно 42 до приблизно 57 мас. %, від приблизно 45 до приблизно 55 мас. % або від приблизно 47 до приблизно 53 мас. %) аморфної сполуки 1 на масу твердої дисперсії і від приблизно 60 до приблизно 40 мас. % полімеру (наприклад, HPMCAS, PVP/VA, PVP, співполімеру метакрилової кислоти/метакрилату, HPC або будь-якого їхнього поєднання). Інші тверді дисперсії містять від приблизно 65 до приблизно 95 мас. % (наприклад, від приблизно 67 до приблизно 92 мас. %, від приблизно 70 до приблизно 90 мас. % або від приблизно 72 до приблизно 88 мас. %) по суті аморфної сполуки 1 на масу твердої дисперсії і 16 UA 102261 C2 5 10 15 20 25 30 35 40 45 50 55 60 від приблизно 45 до приблизно 5 мас. % полімеру (наприклад, HPMCAS, PVP/VA, PVP, співполімеру метакрилової кислоти/метакрилату, HPC або будь-якого їхнього поєднання). Наприклад, тверда дисперсія містить від приблизно 65 до приблизно 95 мас. % (наприклад, від приблизно 67 до приблизно 92 мас. %, від приблизно 70 до приблизно 90 мас. % або від приблизно 72 до приблизно 88 мас. %) аморфної сполуки 1 на масу твердої дисперсії і від приблизно 45 до приблизно 5 мас. % полімеру (наприклад, HPMCAS, PVP/VA, PVP, співполімеру метакрилової кислоти/метакрилату, HPC або будь-якого їхнього поєднання). Тверді дисперсії, застосовувані у варіантах даного винаходу, необов'язково можуть містити поверхнево-активну речовину. Придатні поверхнево-активні речовини включають лаурилсульфат натрію (SLS), стеарилфумарат натрію (SSF), моноолеат сорбітану поліоксіетилену 20 (наприклад, Tween™), будь-яке їхнє поєднання або подібні. В одному прикладі тверда дисперсія містить менше 5 мас. % (менше 3,0, менше 1,5 або менше 1,0 мас. %) поверхнево-активної речовини на масу твердої дисперсії. В іншому прикладі тверда дисперсія містить від приблизно 0,30 до приблизно 0,80 мас. % (наприклад, від приблизно 0,35 до приблизно 0,70 мас. %, від приблизно 0,40 до приблизно 0,60 мас. % або від приблизно 0,45 до приблизно 0,55 мас. %) поверхнево-активної речовини на масу твердої дисперсії. В альтернативних варіантах тверда дисперсія містить від приблизно 45 до приблизно 85 мас. % по суті аморфної або аморфної сполуки 1, від приблизно 0,45 до приблизно 0,55 мас. % SLS і від приблизно 14,45 до приблизно 55,55 мас. % HPMCAS або PVP/VA на масу твердої дисперсії. Один приклад твердої дисперсії містить приблизно 50 мас. % по суті аморфної або аморфної сполуки 1, приблизно 49,5 мас. % HPMCAS або PVP/VA і приблизно 0,5 мас. % SLS на масу твердої дисперсії. Інший приклад твердої дисперсії містить приблизно 80 мас. % по суті аморфної або аморфної сполуки 1, приблизно 19,5 мас. % HPMCAS або PVP/VA і приблизно 0,5 мас. % SLS. В альтернативних варіантах тверда дисперсія містить від приблизно 45 до приблизно 85 мас. % по суті аморфної або аморфної сполуки 1, від приблизно 0,45 до приблизно 0,55 мас. % SLS і від приблизно 14,45 до приблизно 55,55 мас. % HPMCAS на масу твердої дисперсії. Один приклад твердої дисперсії містить приблизно 50 мас. % по суті аморфної або аморфної сполуки 1, приблизно 49,5 мас. % HPMCAS і приблизно 0,5 мас. % SLS на масу твердої дисперсії. Інша типова тверда дисперсія містить приблизно 80 мас. % по суті аморфної або аморфної сполуки 1, приблизно 19,5 мас. % HPMCAS або PVP/VA і приблизно 0,5 мас. % SLS. На додаток до твердої дисперсії сполуки 1, фармацевтичні композиції згідно з даним винаходом також містять один або більше наповнювачів, такі як наповнювачі, розпушувачі, поверхнево-активні речовини, сполучні агенти, гліданти, зв'язувальні агенти, барвники або віддушки. Наповнювачі, що підходять згідно з даним винаходом, сумісні з інгредієнтами фармацевтичної композиції, тобто вони не повинні значно знижувати розчинність, твердість, хімічну стабільність, фізичну стабільність або біологічну активність фармацевтичної композиції. Приклади наповнювачів включають лактозу, сорбіт, целюлози, фосфати кальцію, крохмалі, цукри (наприклад, маніт, сахарозу або подібні) або будь-яке їхнє поєднання. В одному варіанті фармацевтична композиція містить щонайменше один наповнювач у кількості щонайменше приблизно 10 мас. % (наприклад щонайменше приблизно 20 щонайменше приблизно 25 або щонайменше приблизно 27 мас. %) на масу композиції. Наприклад, фармацевтична композиція містить від приблизно 10 до приблизно 60 мас. % (наприклад, від приблизно 20 до приблизно 55 мас. %, від приблизно 25 до приблизно 50 мас. % або від приблизно 27 до приблизно 45 мас. %) наповнювача на масу композиції. В іншому прикладі фармацевтична композиція містить щонайменше приблизно 20 мас. % (наприклад щонайменше 25 мас. % або щонайменше 27 мас. %) лактози на масу композиції. У ще одному прикладі фармацевтична композиція містить від приблизно 20 до приблизно 60 мас. % (наприклад, від приблизно 25 до приблизно 55 мас. % або від приблизно 27 до приблизно 45 мас. %) лактози на масу композиції. Розпушувачі, що підходять згідно з даним винаходом, поліпшують диспергованість фармацевтичної композиції і сумісні з інгредієнтами фармацевтичної композиції, тобто вони не знижують хімічну стабільність, фізичну стабільність, твердість або біологічну активність фармацевтичної композиції. Приклади розпушувачів включають кроскармелозу натрію, гліколят крохмалю натрію або їхнє поєднання. В одному варіанті фармацевтична композиція містить розпушувач у кількості приблизно 10 мас. % або менше (наприклад, приблизно 7 мас. % або менше, приблизно 6 мас. % або менше, або приблизно 5 мас. % або менше) на масу композиції. Наприклад, фармацевтична композиція містить від приблизно 1 до приблизно 10 мас. % (наприклад, від приблизно 1,5 до приблизно 7,5 мас. % або від приблизно 2,5 до приблизно 6 мас. %) розпушувача на масу композиції. В іншому прикладі фармацевтична композиція містить 17 UA 102261 C2 5 10 15 20 25 30 35 40 45 50 55 60 приблизно 10 мас. % або менше (наприклад, 7 мас. % або менше, 6 мас. % або менше, або 5 мас. % або менше) кроскармелози натрію на масу композиції. У ще одному прикладі фармацевтична композиція містить від приблизно 1 до приблизно 10 мас. % (наприклад, від приблизно 1,5 до приблизно 7,5 мас. % або від приблизно 2,5 до приблизно 6 мас. %) кроскармелози натрію на масу композиції. У деяких прикладах фармацевтична композиція містить від приблизно 0,1 % до приблизно 10 мас. % (наприклад, від приблизно 0,5 до приблизно 7,5 мас. % або від приблизно 1,5 до приблизно 6 мас. %) розпушувача на масу композиції. В інших прикладах фармацевтична композиція містить від приблизно 0,5 % до приблизно 10 мас. % (наприклад, від приблизно 1,5 до приблизно 7,5 мас. % або від приблизно 2,5 до приблизно 6 мас. %) розпушувача на масу композиції. Поверхнево-активні речовини, що підходять згідно з даним винаходом, поліпшують розчинність фармацевтичної композиції і сумісні з інгредієнтами фармацевтичної композиції, тобто вони не знижують хімічну стабільність, фізичну стабільність, твердість або біологічну активність фармацевтичної композиції. Приклади поверхнево-активних речовин включають лаурилсульфат натрію (SLS), стеарилфумарат натрію (SSF), моноолеат сорбітану поліоксіетилену 20 (наприклад, Tween™), будь-яке з поєднань або подібні. В одному варіанті фармацевтична композиція містить поверхнево-активну речовину в кількості приблизно 10 мас. % або менше (наприклад, приблизно 5 мас. % або менше, приблизно 2 мас. % або менше, приблизно 1 мас. % або менше, приблизно 0,8 мас. % або менше, або приблизно 0,6 мас. % або менше) на масу композиції. Наприклад, фармацевтична композиція містить від приблизно 10 до приблизно 0,1 мас. % (наприклад, від приблизно 5 до приблизно 0,2 мас. % або від приблизно 2 до приблизно 0,3 мас. %) поверхнево-активної речовини на масу композиції. В іншому прикладі фармацевтична композиція містить 10 мас. % або менше (наприклад, приблизно 5 мас. % або менше, приблизно 2 мас. % або менше, приблизно 1 мас. % або менше, приблизно 0,8 мас. % або менше, або приблизно 0,6 мас. % або менше) лаурилсульфату натрію на масу композиції. У ще одному прикладі фармацевтична композиція містить від приблизно 10 до приблизно 0,1 мас. % (наприклад, від приблизно 5 до приблизно 0,2 мас. % або від приблизно 2 до приблизно 0,3 мас. %) лаурилсульфату натрію на масу композиції. Зв'язувальні агенти, що підходять згідно з даним винаходом, поліпшують міцність таблетки фармацевтичної композиції і сумісні з інгредієнтами фармацевтичної композиції, тобто вони не знижують хімічну стабільність, фізичну стабільність або біологічну активність фармацевтичної композиції. Приклади зв'язувальних агентів включають мікрокристалічну целюлозу, двоосновний фосфат кальцію, сахарозу, кукурудзяний (маїсовий) крохмаль, модифіковану целюлозу (наприклад, гідроксиметилцелюлозу) або будь-яке їхнє поєднання. В одному варіанті фармацевтична композиція містить зв'язувальний агент у кількості щонайменше приблизно 1 мас. % (наприклад щонайменше приблизно 10 щонайменше приблизно 15 щонайменше приблизно 20 або щонайменше приблизно 22 мас. %) на масу композиції. Наприклад, фармацевтична композиція містить від приблизно 5 до приблизно 50 мас. % (наприклад, від приблизно 10 до приблизно 45 мас. % або від приблизно 20 до приблизно 45 мас. %) зв'язувального агента на масу композиції. В іншому прикладі фармацевтична композиція містить щонайменше приблизно 1 мас. % (наприклад щонайменше приблизно 10 щонайменше приблизно 15 щонайменше приблизно 20 або щонайменше приблизно 22 мас. %) мікрокристалічної целюлози на масу композиції. У ще одному прикладі фармацевтична композиція містить від приблизно 5 до приблизно 50 мас. % (наприклад, від приблизно 10 до приблизно 45 мас. % або від приблизно 20 до приблизно 45 мас. %) мікрокристалічної целюлози на масу композиції. Гліданти, що підходять згідно з даним винаходом, поліпшують властивості текучості фармацевтичної композиції і сумісні з інгредієнтами фармацевтичної композиції, тобто вони не знижують розчинність, твердість, хімічну стабільність, фізичну стабільність або біологічну активність фармацевтичної композиції. Приклади глідантів включають колоїдний діоксид кремнію, тальк або їхнє поєднання. В одному варіанті фармацевтична композиція містить глідант у кількості 2 мас. % або менше (наприклад, 1,75 мас. %, 1,25 мас. % або менше, або 1,00 мас. % або менше) на масу композиції. Наприклад, фармацевтична композиція містить від приблизно 2 до приблизно 0,05 мас. % (наприклад, від приблизно 1,5 до приблизно 0,07 мас. % або від приблизно 1,0 до приблизно 0,09 мас. %) гліданту на масу композиції. В іншому прикладі фармацевтична композиція містить 2 мас. % або менше (наприклад, 1,75 мас. %, 1,25 мас. % або менше, або 1,00 мас. % або менше) колоїдного діоксиду кремнію на масу композиції. У ще одному прикладі фармацевтична композиція містить від приблизно 2 до приблизно 0,05 мас. % (наприклад, від приблизно 1,5 до приблизно 0,07 мас. % або від приблизно 1,0 до приблизно 0,09 мас. %) колоїдного діоксиду кремнію на масу композиції. 18 UA 102261 C2 5 10 15 20 25 30 35 40 45 50 55 60 Змащувальні агенти, придатні згідно з даним винаходом, поліпшують пресування і виймання пресованої фармацевтичної композиції з пресу і сумісні з інгредієнтами фармацевтичної композиції, тобто вони не знижують розчинність, твердість або біологічну активність фармацевтичної композиції. Приклади змащувальних агентів, включають стеарат магнію, стеаринову кислоту (стеарин), гідроване масло, стеарилфумарат натрію або будь-яке їхнє поєднання. В одному варіанті фармацевтична композиція містить змащувальний агент, у кількості 2 мас. % або менше (наприклад, 1,75 мас. %, 1,25 мас. % або менше, або 1,00 мас. % або менше) на масу композиції. Наприклад, фармацевтична композиція містить від приблизно 2 до приблизно 0,10 мас. % (наприклад, від приблизно 1,5 до приблизно 0,15 мас. % або від приблизно 1,3 до приблизно 0,30 мас. %) змащувального агента на масу композиції. В іншому прикладі фармацевтична композиція містить 2 мас. % або менше (наприклад, 1,75 мас. %, 1,25 мас. % або менше, або 1,00 мас. % або менш) стеарату магнію на масу композиції. У ще одному прикладі фармацевтична композиція містить від приблизно 2 до приблизно 0,10 мас. % (наприклад, від приблизно 1,5 до приблизно 0,15 мас. % або від приблизно 1,3 до приблизно 0,30 мас. %) стеарату магнію на масу композиції. Фармацевтичні композиції згідно з даним винаходом можуть необов'язково містити один або більше барвників, смакових добавок і/або віддушок для поліпшення зовнішнього вигляду, смаку і/або запаху композиції. Придатні барвники, смакові добавки або віддушки сумісні з інгредієнтами фармацевтичної композиції, тобто вони не знижують розчинність, хімічну стабільність, фізичну стабільність, твердість або біологічну активність фармацевтичної композиції. В одному варіанті фармацевтична композиція містить барвник, смакову добавку і/або віддушку. Наприклад, фармацевтична композиція містить менше приблизно 1 мас. % (наприклад, менше приблизно 0,75 мас. % або менше приблизно 0,5 мас. %) кожного необов'язкового інгредієнта, тобто барвника, смакової добавки і/або віддушки на масу композиції. В іншому прикладі фармацевтична композиція містить менше приблизно 1 мас. % (наприклад, менше приблизно 0,75 мас. % або менше приблизно 0,5 мас. %) барвника. У ще одному прикладі фармацевтична композиція містить менше приблизно 1 мас. % (наприклад, менше приблизно 0,75 мас. % або менше приблизно 0,5 мас. %) синього барвника (наприклад, FD&C Blue #1 і/або FD&C Blue #2 Aluminum Lake, комерційно доступного від Colorcon, Inc. of West Point, PA.) У деяких варіантах фармацевтична композиція може бути отримана у вигляді таблеток, і таблетки можуть бути покриті барвником і необов'язково позначені логотипом, іншим зображенням і/або текстом із застосуванням придатного чорнила. В інших варіантах фармацевтична композиція може бути отримана у вигляді таблеток, і таблетки можуть бути покриті барвником, воском і необов'язково позначені логотипом, іншим зображенням і/або текстом із застосуванням придатного чорнила. Придатні барвники і чорнило сумісні з інгредієнтами фармацевтичної композиції, тобто вони не знижують розчинність, хімічну стабільність, фізичну стабільність, твердість або біологічну активність фармацевтичної композиції. Придатні барвники і чорнило можуть мати будь-який колір, і зроблені на основі води або розчинника. В одному варіанті таблетки роблять з фармацевтичної композиції і покривають барвником, потім наносять логотип, інше зображення і/або текст із застосуванням придатного чорнила. Наприклад, таблетки, що містять фармацевтичну композицію, описану тут, можуть бути покриті приблизно 3 мас. % (наприклад, менше приблизно 6 або менше приблизно 4 мас. %) плівкового покриття, що містить барвник. Таблетки в оболонці можуть бути позначені логотипом і текстом, що вказує концентрацію активного інгредієнта в таблетці, із застосуванням придатного чорнила. В іншому прикладі таблетки, що містять фармацевтичну композицію, описану тут, можуть бути покриті приблизно 3 мас. % (наприклад, менше приблизно 6 або менше приблизно 4 мас. %) плівкового покриття, що містить синій барвник (наприклад, OPADRY® II, комерційно доступний від Colorcon, Inc. of West Point, PA.). Пофарбовані таблетки можуть бути позначені логотипом і текстом, що вказує концентрацію активного інгредієнта в таблетці, із застосуванням чорного чорнила (наприклад, Opacode® WB, комерційно доступний від Colorcon, Inc. of West Point, PA.). В іншому варіанті таблетки, що містять фармацевтичну композицію, описану тут, можуть бути покриті барвником, воском і потім позначені логотипом, іншим зображенням і/або текстом із застосуванням придатного чорнила. Наприклад, таблетки, що містять фармацевтичну композицію, описану тут, можуть бути покриті приблизно 3 мас. % (наприклад, менше приблизно 6 або менше приблизно 4 мас. %) плівкового покриття, що містить барвник. Пофарбовані таблетки можуть бути покриті воском, таким як Карнаубський віск, у кількості приблизно 0,01 % мас./мас. від вихідної маси оболонки таблетки. Покриті воском таблетки можуть бути позначені логотипом і текстом, що вказує концентрацію активного інгредієнта в таблетці, із застосуванням придатного чорнила. В іншому прикладі таблетки, що 19 UA 102261 C2 5 10 15 20 25 30 35 40 45 50 55 містять фармацевтичну композицію, описану тут, можуть бути покриті приблизно 3 мас. % (наприклад, менше приблизно 6 або менше приблизно 4 мас. %) плівкового покриття, що містить синій барвник (наприклад, OPADRY® II, комерційно доступний від Colorcon, Inc. of West Point, PA.). Пофарбовані таблетки можуть бути покриті воском, таким як Карнаубський віск, у кількості приблизно 0,01 % мас./мас. від вихідної маси оболонки таблетки. Покриті воском таблетки можуть бути позначені логотипом і текстом, що вказує концентрацію активного інгредієнта в таблетці, із застосуванням чорного чорнила (наприклад, Opacode® S-1-17823 чорнила на основі розчинника, комерційно доступні від Colorcon, Inc. of West Point, PA.). Одна типова фармацевтична композиція містить від приблизно 5 до приблизно 50 мас. % (наприклад, від приблизно 5 до приблизно 25 мас. %, від приблизно 15 до приблизно 40 мас. % або від приблизно 30 до приблизно 50 мас. %) твердої дисперсії на масу композиції, що містить від приблизно 40 до приблизно 60 мас. % по суті аморфної сполуки 1 на масу дисперсії, і від приблизно 60 до приблизно 40 мас. % полімеру на масу дисперсії; від приблизно 25 до приблизно 50 мас. % наповнювача; від приблизно 1 до приблизно 10 мас. % розпушувача; від приблизно 2 до приблизно 0,3 мас. % поверхнево-активної речовини; від приблизно 5 до приблизно 50 мас. % зв'язувального агента; від приблизно 2 до приблизно 0,05 мас. % гліданту; і від приблизно 2 до приблизно 0,1 мас. % змащувального агента. Або фармацевтична композиція містить від приблизно 5 до приблизно 50 мас. % (наприклад, від приблизно 5 до приблизно 25 мас. %, від приблизно 15 до приблизно 40 мас. % або від приблизно 30 до приблизно 50 мас. %) твердої дисперсії на масу композиції, що містить від приблизно 40 до приблизно 60 мас. % аморфної сполуки 1 на масу дисперсії, і від приблизно 60 до приблизно 40 мас. % полімеру на масу дисперсії; від приблизно 25 до приблизно 50 мас. % наповнювача; від приблизно 1 до приблизно 10 мас. % розпушувача; від приблизно 2 до приблизно 0,3 мас. % поверхнево-активної речовини; від приблизно 5 до приблизно 50 мас. % зв'язувального агента; від приблизно 2 до приблизно 0,05 мас. % гліданту; і від приблизно 2 до приблизно 0,1 мас. % змащувального агента. Інші типові фармацевтичні композиції містять від приблизно 5 до приблизно 50 мас. % (наприклад, від приблизно 5 до приблизно 25 мас. %, від приблизно 15 до приблизно 40 мас. % або від приблизно 30 до приблизно 50 мас. %) твердої дисперсії на масу композиції, що містить від приблизно 70 до приблизно 90 мас. % по суті аморфної сполуки 1 на масу дисперсії, і від приблизно 30 до приблизно 10 мас. % полімеру на масу дисперсії; від приблизно 25 до приблизно 50 мас. % наповнювача; від приблизно 1 до приблизно 10 мас. % розпушувача; від приблизно 2 до приблизно 0,3 мас. % поверхнево-активної речовини; від приблизно 5 до приблизно 50 мас. % зв'язувального агента; від приблизно 2 до приблизно 0,05 мас. % гліданту; і від приблизно 2 до приблизно 0,1 мас. % змащувального агента. Або фармацевтична композиція містить від приблизно 5 до приблизно 50 мас. % (наприклад, від приблизно 5 до приблизно 25 мас. %, від приблизно 15 до приблизно 40 мас. % або від приблизно 30 до приблизно 50 мас. %) твердої дисперсії на масу композиції, що містить від приблизно 70 до приблизно 90 мас. % аморфної сполуки 1 на масу дисперсії, і від приблизно 30 до приблизно 10 мас. % полімеру на масу дисперсії; від приблизно 25 до приблизно 50 мас. % наповнювача; від приблизно 1 до приблизно 10 мас. % розпушувача; від приблизно 2 до приблизно 0,3 мас. % поверхнево-активної речовини; від приблизно 5 до приблизно 50 мас. % зв'язувального агента; від приблизно 2 до приблизно 0,05 мас. % гліданту; і від приблизно 2 до приблизно 0,1 мас. % змащувального агента. Одна з фармацевтичних композицій згідно з даним винаходом містить приблизно 15 мас. % твердої дисперсії на масу композиції, де дисперсія містить приблизно 50 мас. % по суті аморфної сполуки 1 на масу дисперсії, приблизно 49,5 мас. % HPMCAS на масу дисперсії і приблизно 0,5 мас. % SLS на масу дисперсії; приблизно 35 мас. % мікрокристалічної целюлози на масу композиції; приблизно 43 мас. % лактози на масу композиції; приблизно 5 мас. % кроскармелози натрію на масу композиції; приблизно 0,5 мас. % SLS на масу композиції; приблизно 0,125 мас. % колоїдного діоксиду кремнію на масу композиції; і приблизно 0,5 мас. % стеарату магнію на масу композиції. Або фармацевтична композиція згідно з даним винаходом містить приблизно 15 мас. % твердої дисперсії на масу композиції, де дисперсія містить приблизно 50 мас. % аморфної сполуки 1 на масу дисперсії, приблизно 49,5 мас. % HPMCAS на масу дисперсії і приблизно 0,5 мас. % SLS на масу дисперсії; приблизно 35 мас. % мікрокристалічної целюлози на масу композиції; приблизно 43 мас. % лактози на масу композиції; приблизно 5 мас. % кроскармелози натрію на масу композиції; приблизно 0,5 мас. % SLS на масу композиції; приблизно 0,125 мас. % колоїдного діоксиду кремнію на масу композиції; і приблизно 0,5 мас. % стеарату магнію на масу композиції. 20 UA 102261 C2 5 10 15 20 25 30 35 40 45 50 55 60 Інша фармацевтична композиція згідно з даним винаходом містить приблизно 31 мас. % твердої дисперсії на масу композиції, де дисперсія містить приблизно 50 мас. % по суті аморфної сполуки 1 на масу дисперсії, приблизно 49,5 мас. % HPMCAS на масу дисперсії і приблизно 0,5 мас. % SLS на масу дисперсії; приблизно 25 мас. % мікрокристалічної целюлози на масу композиції; приблизно 38 мас. % лактози на масу композиції; приблизно 5 мас. % кроскармелози натрію на масу композиції; приблизно 0,5 мас. % SLS на масу композиції; приблизно 0,125 мас. % колоїдного діоксиду кремнію на масу композиції; і приблизно 0,5 мас. % стеарату магнію на масу композиції. Або фармацевтична композиція згідно з даним винаходом містить приблизно 31 мас. % твердої дисперсії на масу композиції, де дисперсія містить приблизно 50 мас. % аморфної сполуки 1 на масу дисперсії, приблизно 49,5 мас. % HPMCAS на масу дисперсії і приблизно 0,5 мас. % SLS на масу дисперсії; приблизно 25 мас. % мікрокристалічної целюлози на масу композиції; приблизно 38 мас. % лактози на масу композиції; приблизно 5 мас. % кроскармелози натрію на масу композиції; приблизно 0,5 мас. % SLS на масу композиції; приблизно 0,125 мас. % колоїдного діоксиду кремнію на масу композиції; і приблизно 0,5 мас. % стеарату магнію на масу композиції. Інша фармацевтична композиція згідно з даним винаходом містить приблизно 40 мас. % твердої дисперсії на масу композиції, де дисперсія містить приблизно 80 мас. % по суті аморфної сполуки 1 на масу дисперсії, приблизно 19,5 мас. % PVP/VA на масу дисперсії і приблизно 0,5 мас. % SLS на масу дисперсії; приблизно 27 мас. % мікрокристалічної целюлози на масу композиції; приблизно 27 мас. % лактози на масу композиції; приблизно 3 мас. % кроскармелози натрію на масу композиції; приблизно 0,5 мас. % SLS на масу композиції; приблизно 1 мас. % колоїдного діоксиду кремнію на масу композиції; приблизно 1 мас. % стеарату магнію на масу композиції, і приблизно 0,4 мас. % барвника на масу композиції. Або фармацевтична композиція згідно з даним винаходом містить приблизно 40 мас. % твердої дисперсії на масу композиції, де дисперсія містить приблизно 80 мас. % аморфної сполуки 1 на масу дисперсії, приблизно 19,5 мас. % PVP/VA на масу дисперсії і приблизно 0,5 мас. % SLS на масу дисперсії; приблизно 27 мас. % мікрокристалічної целюлози на масу композиції; приблизно 27 мас. % лактози на масу композиції; приблизно 3 мас. % кроскармелози натрію на масу композиції; приблизно 0,5 мас. % SLS на масу композиції; приблизно 1 мас. % колоїдного діоксиду кремнію на масу композиції; приблизно 1 мас. % стеарату магнію на масу композиції, і приблизно 0,4 мас. % барвника на масу композиції. Інша фармацевтична композиція згідно з даним винаходом містить приблизно 40 мас. % твердої дисперсії на масу композиції, де дисперсія містить приблизно 80 мас. % по суті аморфної сполуки 1 на масу дисперсії, приблизно 19,5 мас. % HPMCAS на масу дисперсії і приблизно 0,5 мас. % SLS на масу дисперсії; приблизно 27 мас. % мікрокристалічної целюлози на масу композиції; приблизно 27 мас. % лактози на масу композиції; приблизно 3 мас. % кроскармелози натрію на масу композиції; приблизно 0,5 мас. % SLS на масу композиції; приблизно 1 мас. % колоїдного діоксиду кремнію на масу композиції; приблизно 1 мас. % стеарату магнію на масу композиції, і приблизно 0,4 мас. % барвника на масу композиції. Або фармацевтична композиція згідно з даним винаходом містить приблизно 40 мас. % твердої дисперсії на масу композиції, де дисперсія містить приблизно 80 мас. % аморфної сполуки 1 на масу дисперсії, приблизно 19,5 мас. % HPMCAS на масу дисперсії і приблизно 0,5 мас. % SLS на масу дисперсії; приблизно 27 мас. % мікрокристалічної целюлози на масу композиції; приблизно 27 мас. % лактози на масу композиції; приблизно 3 мас. % кроскармелози натрію на масу композиції; приблизно 0,5 мас. % SLS на масу композиції; приблизно 1 мас. % колоїдного діоксиду кремнію на масу композиції; приблизно 1 мас. % стеарату магнію на масу композиції, і приблизно 0,4 мас. % барвника на масу композиції. Ще одна фармацевтична композиція згідно з даним винаходом містить приблизно 34,5 мас. % твердої дисперсії на масу композиції, де дисперсія містить приблизно 80 мас. % по суті аморфної сполуки 1 на масу дисперсії, приблизно 19,5 мас. % HPMCAS на масу дисперсії і приблизно 0,5 мас. % SLS на масу дисперсії; приблизно 30 мас. % мікрокристалічної целюлози на масу композиції; приблизно 30 мас. % лактози на масу композиції; приблизно 3 мас. % кроскармелози натрію на масу композиції; приблизно 0,5 мас. % SLS на масу композиції; приблизно 1 мас. % колоїдного діоксиду кремнію на масу композиції; приблизно 1 мас. % стеарату магнію на масу композиції. У ще одному варіанті фармацевтичної композиції згідно з даним винаходом, фармацевтична композиція у вигляді таблетки у формі каплети, що має твердість 9,5 Кф ±15 %, містить приблизно 34 мас. % твердої дисперсії на масу композиції, де дисперсія містить приблизно 80 мас. % по суті аморфної сполуки 1 на масу дисперсії, приблизно 19,5 мас. % HPMCAS на масу дисперсії і приблизно 0,5 мас. % SLS на масу дисперсії; приблизно 30 мас. % мікрокристалічної 21 UA 102261 C2 5 10 15 20 25 30 35 40 45 50 55 60 целюлози на масу композиції; приблизно 30 мас. % лактози на масу композиції; приблизно 3 мас. % кроскармелози натрію на масу композиції; приблизно 0,5 мас. % SLS на масу композиції; приблизно 1 мас. % колоїдного діоксиду кремнію на масу композиції; і приблизно 1 мас. % стеарату магнію на масу композиції. У певних варіантах фармацевтична таблетка у вигляді каплети містить 150 мг сполуки 1. У певних варіантах фармацевтична таблетка у вигляді каплети містить 100 мг сполуки 1. У ще одному варіанті фармацевтичної композиції згідно з даним винаходом, фармацевтична композиція у вигляді таблетки у формі каплети, що має вихідну твердість 11 Кф ±20 %, містить приблизно 40 мас. % твердої дисперсії на масу композиції, де дисперсія містить приблизно 80 мас. % по суті аморфної сполуки 1 на масу дисперсії, приблизно 19,5 мас. % HPMCAS на масу дисперсії і приблизно 0,5 мас. % SLS на масу дисперсії; приблизно 30 мас. % мікрокристалічної целюлози на масу композиції; приблизно 30 мас. % лактози на масу композиції; приблизно 3 мас. % кроскармелози натрію на масу композиції; приблизно 0,5 мас. % SLS на масу композиції; приблизно 1 мас. % колоїдного діоксиду кремнію на масу композиції; і приблизно 1 мас. % стеарату магнію на масу композиції. У певних варіантах фармацевтична таблетка у вигляді каплети містить 150 мг сполуки 1. У ще одному варіанті фармацевтичної композиції згідно з даним винаходом, фармацевтична композиція у вигляді таблетки у формі каплети, що має вихідну твердість 11 Кф ±20 %, містить приблизно 34,1 мас. % твердої дисперсії на масу композиції, де дисперсія містить приблизно 80 мас. % по суті аморфної сполуки 1 на масу дисперсії, приблизно 19,5 мас. % HPMCAS на масу дисперсії і приблизно 0,5 мас. % SLS на масу дисперсії; приблизно 30 мас. % мікрокристалічної целюлози на масу композиції; приблизно 30,4 мас. % лактози на масу композиції; приблизно 3 мас. % кроскармелози натрію на масу композиції; приблизно 0,5 мас. % SLS на масу композиції; приблизно 1 мас. % колоїдного діоксиду кремнію на масу композиції; і приблизно 1 мас. % стеарату магнію на масу композиції. У деяких аспектах фармацевтична таблетка у вигляді каплети містить 100 мг сполуки 1. В інших аспектах фармацевтична таблетка у вигляді каплети містить кольорову оболонку і надрукований логотип або текст. У деяких варіантах цього аспекту фармацевтична таблетка у вигляді каплети містить синє покриття OPADRY® II і логотип або текст, нанесений чорнилом на основі води або розчинника. У певних варіантах фармацевтична таблетка у вигляді каплети містить 150 мг сполуки 1. В іншій фармацевтичній композиції згідно з даним винаходом, фармацевтична композиція у вигляді таблетки у формі каплети, що має вихідну твердість від приблизно від 6 до 16 Кф, містить приблизно 34,1 мас. % твердої дисперсії на масу композиції, де дисперсія містить приблизно 80 мас. % по суті аморфної сполуки 1 на масу дисперсії, приблизно 19,5 мас. % HPMCAS на масу дисперсії і приблизно 0,5 мас. % SLS на масу дисперсії; приблизно 30,5 мас. % мікрокристалічної целюлози на масу композиції; приблизно 30,4 мас. % лактози на масу композиції; приблизно 3 мас. % кроскармелози натрію на масу композиції; приблизно 0,5 мас. % SLS на масу композиції; приблизно 0,5 мас. % колоїдного діоксиду кремнію на масу композиції; і приблизно 1 мас. % стеарату магнію на масу композиції. У деяких аспектах фармацевтична таблетка у вигляді каплети містить 100 мг сполуки 1. В інших аспектах фармацевтична таблетка у вигляді каплети містить кольорову оболонку, воскове покриття і надрукований логотип або текст. У деяких варіантах цього аспекту фармацевтична таблетка у вигляді каплети містить синє покриття OPADRY® II і логотип або текст, нанесений чорнилом на основі води або розчинника. У деяких випадках кольоровим покриттям є синій OPADRY® II. У деяких випадках воскове покриття містить Карнаубський віск. У деяких аспектах чорнилом для друку логотипу або тексту є чорнило на основі розчинника. У деяких аспектах фармацевтична таблетка у вигляді каплети містить 150 мг сполуки 1. У ще одній фармацевтичній композиції згідно з даним винаходом, фармацевтична композиція у вигляді таблетки у формі каплети, що має вихідну твердість приблизно від 9 до 21 Кф, містить приблизно 34,1 мас. % твердої дисперсії на масу композиції, де дисперсія містить приблизно 80 мас. % по суті аморфної сполуки 1 на масу дисперсії, приблизно 19,5 мас. % HPMCAS на масу дисперсії, і приблизно 0,5 мас. % SLS на масу дисперсії; приблизно 30,5 мас. % мікрокристалічної целюлози на масу композиції; приблизно 30,4 мас. % лактози на масу композиції; приблизно 3 мас. % кроскармелози натрію на масу композиції; приблизно 0,5 мас. % SLS на масу композиції; приблизно 0,5 мас. % колоїдного діоксиду кремнію на масу композиції; і приблизно 1 мас. % стеарату магнію на масу композиції. У деяких варіантах фармацевтична таблетка у вигляді каплети містить 150 мг сполуки 1. У деяких аспектах фармацевтична таблетка у вигляді каплети також містить кольорову оболонку, воскове покриття і надрукований логотип або текст. У деяких випадках таблетка містить синє покриття OPADRY® II і логотип або текст, нанесений чорнилом на основі води або розчинника. В інших випадках воскове покриття 22 UA 102261 C2 5 10 15 20 25 30 35 40 45 50 55 60 містить Карнаубський віск. У деяких варіантах чорнилом для друку логотипу або тексту є чорнило на основі розчинника. У деяких аспектах фармацевтична таблетка у вигляді каплети містить 100 мг сполуки 1. В інших фармацевтичних композиціях згідно з даним винаходом, фармацевтична композиція містить приблизно 34 мас. % твердої дисперсії на масу композиції, де дисперсія містить приблизно 80 мас. % по суті аморфної сполуки 1 на масу дисперсії, приблизно 19,5 мас. % HPMCAS на масу дисперсії і приблизно 0,5 мас. % SLS на масу дисперсії; приблизно 30 мас. % мікрокристалічної целюлози на масу композиції; приблизно 30 мас. % лактози на масу композиції; приблизно 3 мас. % кроскармелози натрію на масу композиції; приблизно 0,5 мас. % SLS на масу композиції; приблизно 1 мас. % колоїдного діоксиду кремнію на масу композиції; і приблизно 1 мас. % стеарату магнію на масу композиції. У певних варіантах фармацевтична композиція містить 150 мг сполуки 1. В інших варіантах фармацевтична композиція містить 100 мг сполуки 1. В іншій фармацевтичній композиції згідно з даним винаходом, фармацевтична композиція містить приблизно 40 мас. % твердої дисперсії на масу композиції, де дисперсія містить приблизно 80 мас. % по суті аморфної сполуки 1 на масу дисперсії, приблизно 19,5 мас. % HPMCAS на масу дисперсії, і приблизно 0,5 мас. % SLS на масу дисперсії; приблизно 30 мас. % мікрокристалічної целюлози на масу композиції; приблизно 30 мас. % лактози на масу композиції; приблизно 3 мас. % кроскармелози натрію на масу композиції; приблизно 0,5 мас. % SLS на масу композиції; приблизно 1 мас. % колоїдного діоксиду кремнію на масу композиції; і приблизно 1 мас. % стеарату магнію на масу композиції. У певних варіантах фармацевтична композиція містить 150 мг сполуки 1. В інших варіантах фармацевтична композиція містить 100 мг сполуки 1. У ще одній фармацевтичній композиції згідно з даним винаходом, фармацевтична композиція містить приблизно 34,1 мас. % твердої дисперсії на масу композиції, де дисперсія містить приблизно 80 мас. % по суті аморфної сполуки 1 на масу дисперсії, приблизно 19,5 мас. % HPMCAS на масу дисперсії і приблизно 0,5 мас. % SLS на масу дисперсії; приблизно 30 мас. % мікрокристалічної целюлози на масу композиції; приблизно 30,4 мас. % лактози на масу композиції; приблизно 3 мас. % кроскармелози натрію на масу композиції; приблизно 0,5 мас. % SLS на масу композиції; приблизно 1 мас. % колоїдного діоксиду кремнію на масу композиції; і приблизно 1 мас. % стеарату магнію на масу композиції. У деяких аспектах фармацевтична композиція містить 100 мг сполуки 1. В інших варіантах фармацевтична композиція містить 150 мг сполуки 1. В інших аспектах фармацевтичну композицію формують у вигляді таблетки, що включає кольорове покриття і надрукований логотип або текст. У деяких варіантах цього аспекту фармацевтична таблетка містить синє покриття OPADRY® II і логотип або текст, нанесений чорнилом на основі води або розчинника. В іншій фармацевтичній композиції згідно з даним винаходом, фармацевтична композиція містить приблизно 34,1 мас. % твердої дисперсії на масу композиції, де дисперсія містить приблизно 80 мас. % по суті аморфної сполуки 1 на масу дисперсії, приблизно 19,5 мас. % HPMCAS на масу дисперсії і приблизно 0,5 мас. % SLS на масу дисперсії; приблизно 30,5 мас. % мікрокристалічної целюлози на масу композиції; приблизно 30,4 мас. % лактози на масу композиції; приблизно 3 мас. % кроскармелози натрію на масу композиції; приблизно 0,5 мас. % SLS на масу композиції; приблизно 0,5 мас. % колоїдного діоксиду кремнію на масу композиції; і приблизно 1 мас. % стеарату магнію на масу композиції. У деяких аспектах фармацевтична таблетка містить 100 мг сполуки 1. В інших варіантах фармацевтична композиція містить 150 мг сполуки 1. У деяких інших аспектах фармацевтична композиція сформована у вигляді таблетки і містить кольорове покриття, воскове покриття і надрукований логотип або текст. У деяких варіантах цього аспекту фармацевтична таблетка містить синє покриття OPADRY® II і логотип або текст, нанесений чорнилом на основі води або розчинника. У деяких випадках кольоровим покриттям є синій OPADRY® II. У деяких випадках воскове покриття містить Карнаубський віск. У певних аспектах чорнилом для друку логотипу або тексту є чорнило на основі розчинника. Також відзначено, що фармацевтична композиція згідно з даним винаходом може бути сформована у вигляді таблетки, капсули або суспензії, що підходить для перорального введення або може бути відновлена у водному розчиннику (наприклад, DI воді або фізіологічному розчині) для перорального, ВВ введення або інгаляцій (наприклад, через небулайзер). Інший аспект даного винаходу стосується фармацевтичної композиції у вигляді таблетки, що містить CF потенціюючий агент, API (наприклад, тверду дисперсію N-[2,4-біс(1,1-диметилетил)5-гідроксифеніл]-1,4-дигідро-4-оксохінолін-3-карбоксаміду) і інші наповнювачі (наприклад, наповнювач, розпушувач, поверхнево-активну речовину, зв'язувальний агент, глідант, барвник, 23 UA 102261 C2 5 10 15 20 25 30 35 40 45 50 55 60 змащувальний агент або будь-яке їхнє поєднання), кожний з яких описаний вище й у прикладах нижче, де таблетка має значення розчинення щонайменше приблизно 50 % (наприклад щонайменше приблизно 60 щонайменше приблизно 70 щонайменше приблизно 80 щонайменше приблизно 90 або щонайменше приблизно 99 %) протягом приблизно 30 хвилин. В одному прикладі фармацевтична композиція є таблеткою, що включає CF потенціюючий агент, API (наприклад, тверду дисперсію сполуки 1) і інші наповнювачі, (наприклад, наповнювач, розпушувач, поверхнево-активну речовину, зв'язувальний агент, глідант, барвник, змащувальний агент або будь-яке їхнє поєднання), кожний з який описаний вище й у прикладах нижче, де таблетка має значення розчинення від приблизно 50 до приблизно 100 % (наприклад, від приблизно 55 до приблизно 95 % або від приблизно 60 до приблизно 90 %) протягом приблизно 30 хвилин. В іншому прикладі фармацевтична композиція є таблеткою, що містить тверду дисперсію по суті аморфної або аморфної сполуки 1 і HPMCAS або PVP/VA; і наповнювач, розпушувач, поверхнево-активну речовину, зв'язувальний агент, глідант і змащувальний агент, де таблетка має значення розчинення щонайменше приблизно 50 % (наприклад щонайменше приблизно 60 щонайменше приблизно 70 щонайменше приблизно 80 щонайменше приблизно 90 або щонайменше приблизно 99 %) протягом приблизно 30 хвилин. У ще одному прикладі фармацевтична композиція є таблеткою, що містить тверду дисперсію по суті аморфної або аморфної сполуки 1 і HPMCAS або PVP/VA; і наповнювач, розпушувач, поверхнево-активну речовину, зв'язувальний агент, глідант і змащувальний агент, де таблетка має значення розчинення від приблизно 50 до приблизно 100 % (наприклад, від приблизно 55 до приблизно 95 % або від приблизно 60 до приблизно 90 %) протягом приблизно 30 хвилин. В одному варіанті таблетка містить тверду дисперсію, що містить щонайменше приблизно 25 мг (наприклад щонайменше приблизно 30 щонайменше приблизно 40 чи щонайменше приблизно 50 мг) по суті аморфної або аморфної сполуки 1; і PVP/VA і SLS. В іншому варіанті таблетка містить тверду дисперсію, що містить щонайменше приблизно 25 мг (наприклад щонайменше приблизно 30 щонайменше приблизно 40 щонайменше приблизно 50 щонайменше приблизно 100 або щонайменше 150 мг) по суті аморфної або аморфної сполуки 1; і HPMCAS і SLS. Розчинення може бути виміряне із застосуванням стандартного апарату USP Type II, у якому застосовується середовище для розчинення з 0,6 % лаурилсульфату натрію, розчиненого в 900 мл DI води, при перемішуванні при приблизно 50-75 об./хв. при температурі приблизно 37C. Одну експериментальну таблетку тестують у кожній посудині для тестування апарату. Розчинення також може бути виміряне із застосуванням стандартного апарату USP Type II, у якому застосовується середовище для розчинення з 0,7 % лаурилсульфату натрію, розчиненого в 900 мл 50 мм буфера на основі фосфату натрію (pН 6,8), при перемішуванні при приблизно 65 об./хв. при температурі приблизно 37C. Одну експериментальну таблетку тестують у кожній посудині для тестування апарату. Розчинення також може бути виміряне із застосуванням стандартного апарату USP Type II, у якому застосовується середовище для розчинення з 0,5 % лаурилсульфату натрію, розчиненого в 900 мл 50 мм буфера на основі фосфату натрію (pН 6,8), при перемішуванні при приблизно 65 об./хв. при температурі приблизно 37C. Одну експериментальну таблетку тестують у кожній посудині для тестування апарату. Інший аспект даного винаходу стосується фармацевтичної композиції, що складає таблетку, що містить CF потенціюючий агент, API (наприклад, тверду дисперсію сполуки 1) і інші наповнювачі (наприклад, наповнювач, розпушувач, поверхнево-активну речовину, зв'язувальний агент, глідант, барвник, змащувальний агент або будь-яке їхнє поєднання), кожний з який описаний вище й у прикладах нижче, де таблетка має твердість щонайменше приблизно 5 Кф. В одному прикладі фармацевтична композиція складає таблетку, що містить CF потенціюючий агент, API (наприклад, тверду дисперсію сполуки 1) і інші наповнювачі (наприклад, наповнювач, розпушувач, поверхнево-активну речовину, зв'язувальний агент, глідант, барвник, змащувальний агент або будь-яке їхнє поєднання), кожний з який описаний вище й у прикладах нижче, де таблетка має твердість щонайменше приблизно 5 Кф (наприклад, приблизно 5,5 щонайменше приблизно 6 або щонайменше приблизно 7 Кф). III. Спосіб одержання фармацевтичної композиції Інший аспект даного винаходу стосується способу одержання фармацевтичної композиції, що включає одержання суміші твердої дисперсії по суті аморфного або аморфного N-[2,4біс(1,1-диметилетил)-5-гідроксифеніл]-1,4-дигідро-4-оксохінолін-3-карбоксаміду, зв'язувального агента, гліданту, поверхнево-активної речовини, змащувального агента, розпушувача і наповнювача, і пресування суміші в таблетку, що має значення розчинення щонайменше приблизно 50 % за приблизно 30 хвилин. 24 UA 102261 C2 5 10 15 20 25 30 35 40 45 50 55 60 Кожний з інгредієнтів суміші описаний вище й у прикладах нижче. Більш того, суміш може містити необов'язкові добавки, такі як один або більше барвників, одну або більше смакових добавок, і/або одну або більше віддушок, описаних вище й у прикладах нижче. А відносні концентрації (наприклад, мас. %) кожного з цих інгредієнтів (і будь-яких додаткових добавок) у суміші також представлені вище й у прикладах нижче. Інгредієнти, що складають суміш, можуть додаватися послідовно або в будь-якому сполученні добавок; і інгредієнти або поєднання інгредієнтів можуть додаватися в будь-якому порядку. В одному варіанті змащувальний агент, є останнім компонентом, що додається в суміш. В одному варіанті суміш містить тверду дисперсію по суті аморфної сполуки 1, зв'язувальний агент, глідант, поверхнево-активну речовину, змащувальний агент, розпушувач і наповнювач, де кожний з цих інгредієнтів представлений у формі порошку (наприклад, представлений у вигляді частинок, що мають середній діаметр, вимірюваний світлорозсіюванням, 250 мкм або менше (наприклад, 150 мкм або менше, 100 мкм або менше, 50 мкм або менше, 45 мкм або менше, 40 мкм або менше, або 35 мкм або менше)). Наприклад, суміш містить тверду дисперсію аморфної сполуки 1, зв'язувальний агент, глідант, поверхневоактивну речовину, змащувальний агент, розпушувач і наповнювач, де кожний з цих інгредієнтів представлений у формі порошку (наприклад, представлений у вигляді частинок, що мають середній діаметр, вимірюваний світлорозсіюванням, 250 мкм або менше (наприклад, 150 мкм або менше, 100 мкм або менше, 50 мкм або менше, 45 мкм або менше, 40 мкм або менше, або 35 мкм або менше)). В іншому варіанті суміш містить тверду дисперсію по суті аморфної сполуки 1, зв'язувальний агент, глідант, поверхнево-активну речовину, змащувальний агент, розпушувач і наповнювач, де кожний з цих інгредієнтів по суті не містить води. Кожний з інгредієнтів містить менше 5 мас. % (наприклад, менше 2, менше 1, менше 0,75, менше 0,5 або менше 0,25 мас. %) води на масу інгредієнта. Наприклад, суміш містить тверду дисперсію аморфної сполуки 1, зв'язувальний агент, глідант, поверхнево-активну речовину, змащувальний агент, розпушувач і наповнювач, де кожний з цих інгредієнтів по суті не містить води. Кожний з інгредієнтів містить менше 5 мас. % (наприклад, менше 2, менше 1, менше 0,75, менше 0,5 або менше 0,25 мас. %) води на масу інгредієнта. В іншому варіанті пресування суміші в таблетку здійснюється наповненням форми (наприклад, прес-форми) сумішшю і застосуванням до суміші тиску. Це може здійснюватися із застосуванням штампувального пресу або інших подібних пристроїв. Також необхідно відзначити, що застосування тиску до суміші у формі може повторюватися із застосуванням того самого тиску під час кожного циклу або пресування із застосуванням різного тиску під час кожного циклу пресування. В іншому прикладі суміш пресують із застосуванням штампувального пресу, у якому застосовується достатній тиск для стискання таблетки, що має показник розчинення приблизно 50 % або більше за приблизно 30 хвилин (наприклад, приблизно 55 % або більше за приблизно 30 хвилин або приблизно 60 % або більше за приблизно 30 хвилин). Наприклад, суміші пресують із застосуванням штампувального пресу із одержанням таблеток твердістю щонайменше приблизно 5 Кф (щонайменше, приблизно 5,5 щонайменше приблизно 6 щонайменше приблизно 7 щонайменше приблизно 11 або щонайменше 21 Кф). У деяких випадках суміш пресують з одержанням таблетки твердістю приблизно від 6 до 21 Кф. У деяких варіантах таблетки, що містять фармацевтичну композицію, описану тут, можуть бути приблизно покриті 3,0 мас. % плівкового покриття, що містить барвник, на масу таблетки. У певних випадках суспензія або розчин барвника, застосовуваний для покриття таблетки, містить приблизно 20 % мас./мас. твердих речовин на масу суспензії або розчину барвника. В інших випадках таблетки з покриттям можуть бути позначені логотипом, іншим зображенням або текстом. В іншому варіанті спосіб одержання фармацевтичної композиції включає одержання суміші твердої дисперсії по суті аморфної сполуки 1, зв'язувального агента, гліданту, поверхневоактивної речовини, змащувального агента, розпушувача і наповнювача; змішування суміші до по суті гомогенного стану і пресування суміші в таблетку як описано вище або в прикладах нижче. Або спосіб одержання фармацевтичної композиції включає одержання суміші твердої дисперсії аморфної сполуки 1, зв'язувального агента, гліданту, поверхнево-активної речовини, змащувального агента, розпушувача і наповнювача; змішування суміші до по суті гомогенного стану і пресування суміші в таблетку як описано вище або в прикладах нижче. Наприклад, суміш змішують перемішуванням, меланжуванням, струшуванням або подібними методами, із застосуванням ручного змішування, змішувача, блендера, будь-якого їхнього поєднання, або подібних. Якщо інгредієнти або поєднання інгредієнтів додають послідовно, змішування може 25 UA 102261 C2 5 10 15 20 25 30 35 40 45 50 55 проводитися між послідовними додаваннями, безупинно в процесі додавання інгредієнтів, після додавання всіх інгредієнтів або поєднань інгредієнтів, або будь-якого їхнього поєднання. Суміш змішують доти, поки вона не стане по суті гомогенною композицією. IV. Введення фармацевтичної композиції В іншому аспекті у винаході також представлений спосіб лікування або зниження тяжкості захворювання в пацієнта, що включає введення зазначеному пацієнту однієї з описаних тут композицій, і де зазначене захворювання вибирають з кістозного фіброзу, астми, COPD, викликаного палінням, хронічного бронхіту, риносинуситу, запору, панкреатиту, недостатності підшлункової залози, чоловічого безпліддя, викликаного вродженою двосторонньою відсутністю сім'явиносних протоків (CBAVD), легкого легеневого захворювання, ідіопатичного панкреатиту, алергійного бронхо-легеневого аспергільозу (ABPA), захворювання печінки, спадкової емфіземи, спадкового гемохроматозу, недостатності коагуляції/фібринолізу, такого як недостатність білка С, спадкового набряку Квінке 1 типу, недостатності обробки ліпідів, такої як сімейна гіперхолестеринемія, хіломікронемії 1 типу, акантоцитозу, лізосомної хвороби накопичення, такої як хвороба I-клітин/псевдо-харлер, мукополісахаридоз, Сендхоф/Тай-Саш, Криглер-Наджар II типу, поліендокринопатії/гіперінсулінемії, цукрового діабету, карликовості Ларона, недостатності мілеопероксидази, первинного гіпопаратиреозу, меланоми, гліканозу CDG типу 1, вродженого гіпертиреозу, недосконалого остеогенезу, спадкової гіпофібриногенемії, недостатності ACT, нецукрового діабету (DI), нейрофізеального DI, непрогенного DI, зубного синдрому Шарко-Марі, хвороби Перлізауса-Мерзбахера, нейродегенеративних захворювань, таких як хвороба Альцгеймера, хвороба Паркінсона, аміотрофічного латерального склерозу, наростаючої над'ядерної плазії, хвороби Піка, декількох поліглутамінових неврологічних розладів, таких як Хантингтон, спінально-церебелярної атаксії I типу, спінальної і бульбарної м'язової атрофії, дентаторубальної палідолюїсової атрофії і міотонічної дистрофії, а також губчатих енцефалопатій, таких як спадкова хвороба Крейтцфельда-Якоба (через дефект обробки білка пріону), хвороби Фабрі, синдрому Страуслера-Шейнкера, COPD, сухості очей, хвороби Шегрена, остеопорозу, остеопенії, синдрому Горана, хлоридних каналопатий, таких як вроджена міотонія (форми Томсона і Бекера), синдрому Барттера III типу, хвороби Дента, гіперекплексії, епілепсії, гіперекплексії, лізосомної хвороби накопичення, синдрому Ангельмана і первинної циліарної дискінезії (PCD), термін для спадкових розладів структури і/або функції війок, включаючи PCD із дзеркальним розташуванням органів (також відомий як синдром Картагенера), PCD без дзеркального розташування органів і циліарної аплазії. Інший аспект даного винаходу стосується способу введення фармацевтичної композиції перорально пацієнту щонайменше один раз на добу, де композиція містить тверду дисперсію по суті аморфної або аморфної сполуки 1, у якій тверда дисперсія містить щонайменше приблизно 25 мг по суті аморфної або аморфної сполуки 1. Інший аспект даного винаходу стосується способу введення фармацевтичної композиції перорально пацієнту щонайменше один раз на добу, де композиція містить тверду дисперсію по суті аморфної або аморфної сполуки 1, у якій тверда дисперсія містить щонайменше приблизно 50 мг по суті аморфної або аморфної сполуки 1. Інший аспект даного винаходу стосується способу введення фармацевтичної композиції перорально пацієнту щонайменше один раз на добу, де композиція містить тверду дисперсію по суті аморфної або аморфної сполуки 1, у якій тверда дисперсія містить щонайменше приблизно 75 мг по суті аморфної або аморфної сполуки 1. Інший аспект даного винаходу стосується способу введення фармацевтичної композиції перорально пацієнту щонайменше один раз на добу, де композиція містить тверду дисперсію по суті аморфної або аморфної сполуки 1, у якій тверда дисперсія містить щонайменше приблизно 100 мг по суті аморфної або аморфної сполуки 1. Інший аспект даного винаходу стосується способу введення фармацевтичної композиції перорально пацієнту щонайменше один раз на добу, де композиція містить тверду дисперсію по суті аморфної або аморфної сполуки 1, у якій тверда дисперсія містить щонайменше приблизно 150 мг по суті аморфної або аморфної сполуки 1. Інший аспект даного винаходу стосується способу введення фармацевтичної композиції перорально пацієнту щонайменше один раз на добу, де композиція містить тверду дисперсію по суті аморфної або аморфної сполуки 1, у якій тверда дисперсія містить щонайменше приблизно 250 мг по суті аморфної або аморфної сполуки 1. Інший аспект даного винаходу стосується способу введення фармацевтичної композиції перорально пацієнту щонайменше два рази на добу, де композиція містить тверду дисперсію по 26 UA 102261 C2 5 10 15 20 25 30 35 40 45 50 55 60 суті аморфної або аморфної сполуки 1, у якій тверда дисперсія містить щонайменше приблизно 25 мг по суті аморфної або аморфної сполуки 1. Інший аспект даного винаходу стосується способу введення фармацевтичної композиції перорально пацієнту щонайменше два рази на добу, де композиція містить тверду дисперсію по суті аморфної або аморфної сполуки 1, у якій тверда дисперсія містить щонайменше приблизно 50 мг по суті аморфної або аморфної сполуки 1. Інший аспект даного винаходу стосується способу введення фармацевтичної композиції перорально пацієнту щонайменше два рази на добу, де композиція містить тверду дисперсію по суті аморфної або аморфної сполуки 1, у якій тверда дисперсія містить щонайменше приблизно 75 мг по суті аморфної або аморфної сполуки 1. Інший аспект даного винаходу стосується способу введення фармацевтичної композиції перорально пацієнту щонайменше два рази на добу, де композиція містить тверду дисперсію по суті аморфної або аморфної сполуки 1, у якій тверда дисперсія містить щонайменше приблизно 100 мг по суті аморфної або аморфної сполуки 1. Інший аспект даного винаходу стосується способу введення фармацевтичної композиції перорально пацієнту щонайменше два рази на добу, де композиція містить тверду дисперсію по суті аморфної або аморфної сполуки 1, у якій тверда дисперсія містить щонайменше приблизно 150 мг по суті аморфної або аморфної сполуки 1. Інший аспект даного винаходу стосується способу введення фармацевтичної композиції перорально пацієнту щонайменше два рази на добу, де композиція містить тверду дисперсію по суті аморфної або аморфної сполуки 1, у якій тверда дисперсія містить щонайменше приблизно 250 мг по суті аморфної або аморфної сполуки 1. Інший аспект даного винаходу стосується способу введення фармацевтичної композиції перорально пацієнту щонайменше один раз кожні 12 годин. Композиція містить тверду дисперсію по суті аморфної або аморфної сполуки 1, у якій тверда дисперсія містить щонайменше приблизно 25 мг по суті аморфної або аморфної сполуки 1. Інший аспект даного винаходу стосується способу введення фармацевтичної композиції перорально пацієнту щонайменше один раз кожні 12 годин. Композиція містить тверду дисперсію по суті аморфної або аморфної сполуки 1, у якій тверда дисперсія містить щонайменше приблизно 50 мг по суті аморфної або аморфної сполуки 1. Інший аспект даного винаходу стосується способу введення фармацевтичної композиції перорально пацієнту щонайменше один раз кожні 12 годин. Композиція містить тверду дисперсію по суті аморфної або аморфної сполуки 1, у якій тверда дисперсія містить щонайменше приблизно 75 мг по суті аморфної або аморфної сполуки 1. Інший аспект даного винаходу стосується способу введення фармацевтичної композиції перорально пацієнту щонайменше один раз кожні 12 годин. Композиція містить тверду дисперсію по суті аморфної або аморфної сполуки 1, у якій тверда дисперсія містить щонайменше приблизно 100 мг по суті аморфної або аморфної сполуки 1. Інший аспект даного винаходу стосується способу введення фармацевтичної композиції перорально пацієнту щонайменше один раз кожні 12 годин. Композиція містить тверду дисперсію по суті аморфної або аморфної сполуки 1, у якій тверда дисперсія містить щонайменше приблизно 150 мг по суті аморфної або аморфної сполуки 1. Інший аспект даного винаходу стосується способу введення фармацевтичної композиції перорально пацієнту щонайменше один раз кожні 12 годин. Композиція містить тверду дисперсію по суті аморфної або аморфної сполуки 1, у якій тверда дисперсія містить щонайменше приблизно 250 мг по суті аморфної або аморфної сполуки 1. В інших аспектах даного винаходу описану тут фармацевтичну композицію перорально вводять пацієнту кожні 24 години. Інший аспект даного винаходу стосується способу введення фармацевтичної композиції перорально пацієнту один раз на добу, де композиція містить тверду дисперсію по суті аморфної або аморфної сполуки 1, у якій тверда дисперсія містить щонайменше приблизно 25 мг по суті аморфної або аморфної сполуки 1. Інший аспект даного винаходу стосується способу введення фармацевтичної композиції перорально пацієнту один раз на добу, де композиція містить тверду дисперсію по суті аморфної або аморфної сполуки 1, у якій тверда дисперсія містить щонайменше приблизно 50 мг по суті аморфної або аморфної сполуки 1. Інший аспект даного винаходу стосується способу введення фармацевтичної композиції перорально пацієнту один раз на добу, де композиція містить тверду дисперсію по суті аморфної або аморфної сполуки 1, у якій тверда дисперсія містить щонайменше приблизно 75 мг по суті аморфної або аморфної сполуки 1. 27 UA 102261 C2 5 10 15 20 25 30 35 40 45 50 55 60 Інший аспект даного винаходу стосується способу введення фармацевтичної композиції перорально пацієнту один раз на добу, де композиція містить тверду дисперсію по суті аморфної або аморфної сполуки 1, у якій тверда дисперсія містить щонайменше приблизно 100 мг по суті аморфної або аморфної сполуки 1. Інший аспект даного винаходу стосується способу введення фармацевтичної композиції перорально пацієнту один раз на добу, де композиція містить тверду дисперсію по суті аморфної або аморфної сполуки 1, у якій тверда дисперсія містить щонайменше приблизно 150 мг по суті аморфної або аморфної сполуки 1. Інший аспект даного винаходу стосується способу введення фармацевтичної композиції перорально пацієнту один раз на добу, де композиція містить тверду дисперсію по суті аморфної або аморфної сполуки 1, у якій тверда дисперсія містить щонайменше приблизно 250 мг по суті аморфної або аморфної сполуки 1. Інший аспект даного винаходу стосується способу введення фармацевтичної композиції, що включає пероральне введення пацієнту щонайменше один раз на добу щонайменше однієї таблетки, що включає фармацевтичну композицію, що містить тверду дисперсію по суті аморфної сполуки 1, наповнювач, зв'язувальний агент, глідант, розпушувач, поверхневоактивну речовину й змащувальний агент, кожний з який описаний вище й у прикладах нижче, де тверда дисперсія містить щонайменше 25 мг (наприклад щонайменше 35 щонайменше 40 або щонайменше 45 мг) по суті аморфної сполуки 1. У деяких варіантах даний винахід стосується способу введення фармацевтичної композиції, що включає пероральне введення пацієнту щонайменше однієї таблетки, що містить: a. тверду дисперсію, що містить приблизно 25 мг по суті аморфної або аморфної сполуки 1; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент. У деяких варіантах даний винахід стосується способу введення фармацевтичної композиції, що включає пероральне введення пацієнту щонайменше однієї таблетки, що містить: a. тверду дисперсію, що містить приблизно 50 мг по суті аморфної або аморфної сполуки 1; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент. У деяких варіантах даний винахід стосується способу введення фармацевтичної композиції, що включає пероральне введення пацієнту щонайменше однієї таблетки, що містить: a. тверду дисперсію, що містить приблизно 75 мг по суті аморфної або аморфної сполуки 1; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент. У деяких варіантах даний винахід стосується способу введення фармацевтичної композиції, що включає пероральне введення пацієнту щонайменше однієї таблетки, що містить: a. тверду дисперсію, що містить приблизно 100 мг по суті аморфної або аморфної сполуки 1; b. наповнювач; c. розпушувач; d. поверхнево-активну речовину; e. зв'язувальний агент; f. глідант; і g. змащувальний агент. У деяких варіантах даний винахід стосується способу введення фармацевтичної композиції, що включає пероральне введення пацієнту щонайменше однієї таблетки, що містить: a. тверду дисперсію, що містить приблизно 150 мг по суті аморфної або аморфної сполуки 1; b. наповнювач; c. розпушувач; 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical compositions comprising a solid dispersion of n-[2,4-bis(1,1-dimethylethyl)-5-hydroxyphenyl]-1,4-dihydro-4-oxoquinoline-3-carboxamide
Автори англійськоюRowe, William, Hurter, Patricia, Young, Christopher, Dinehart, Kirk, Verwijs, Marinus, Jacobus, Overhoff, Kirk, Grootenhuis, Peter, D., J., Botfield, Martyn, Grossi, Alfredo
Назва патенту російськоюФармацевтические композиция на основе твердой дисперсии n-[2,4-бис(1,1-диметилэтил)-5-гидроксифенил]-1,4-дигидро-4-оксохинолин-3-карбоксамида
Автори російськоюРоу Уилльям, Хертер Патрисия, Янг Кристофер, Дайнхарт Кирк, Вервейс Маринус Якобус, Оверхофф Кирк, Гротенхейс Петер Д. Й., Ботфилд Мартин, Гросси Альфредо
МПК / Мітки
МПК: A61K 31/47, A61P 19/04, A61K 9/20
Мітки: n-[2,4-біс(1,1-диметилетил)-5-гідроксифеніл]-1,4-дигідро-4-оксохінолін-3-карбоксаміду, композиція, твердої, основі, фармацевтична, дисперсії
Код посилання
<a href="https://ua.patents.su/52-102261-farmacevtichna-kompoziciya-na-osnovi-tverdo-dispersi-n-24-bis11-dimetiletil-5-gidroksifenil-14-digidro-4-oksokhinolin-3-karboksamidu.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція на основі твердої дисперсії n-[2,4-біс(1,1-диметилетил)-5-гідроксифеніл]-1,4-дигідро-4-оксохінолін-3-карбоксаміду</a>
Попередній патент: Модуль лобової частини транспортного засобу для закріплення на передньому краї рейкового транспортного засобу, зокрема залізничного транспортного засобу
Наступний патент: Циліндричний замок з корпусом циліндра і ключ англійського замка для циліндричного замка
Випадковий патент: Пристрій для виміру висоти рейкових стиків залізничної і трамвайної колій












