Біциклозаміщені піразолоназопохідні, спосіб їх одержання та фармацевтичне застосування
Номер патенту: 101172
Опубліковано: 11.03.2013
Автори: Танг Пенг Чо, Ванг Шенглан, Женг Хао, Лю Хеджун, Чен Їкян, Фей Хонгбо, Ванг Лі
Формула / Реферат
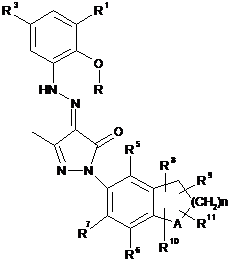
1. Сполука формули (І) або її фармацевтично прийнятна сіль, гідрат або сольват:
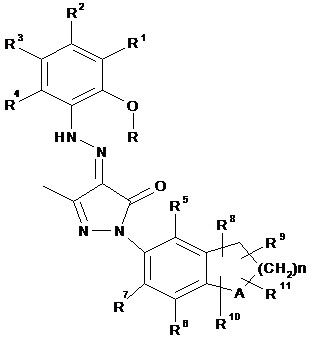 , (I)
, (I)
де:
А вибирають з групи, яка складається з вуглецю та кисню;
R вибирають з групи, яка складається з водню та алкілу;
R1, R2, R3 та R4 кожен незалежно вибирають з групи, яка складається з водню, алкілу, алкокси, галогену, арилу та гетероарилу, де арил або гетероарил кожен незалежно є або незаміщеним, або заміщеним однією або кількома групами, незалежно вибраними з групи, яка складається з алкілу, галогену, гідроксилу, тетразолілу, імідазолілу, дигідроімідазолілу, карбонової кислота та естеру карбонової кислоти;
R5, R6 та R7 кожен незалежно вибирають з групи, яка складається з водню, алкілу, алкокси, галогену, гідроксилу, аміно, нітро, ціано, карбонової кислоти та естеру карбонової кислоти;
R8, R9, R10 та R11 кожен незалежно вибирають з групи, яка складається з водню та алкілу; де R8, R9, R10 та R11 можуть заміщати будь-яку вільну валентність кільця, до якого вони приєднані; та
n дорівнює 0, 1 або 2.
2. Сполука або її фармацевтично прийнятна сіль, гідрат або сольват за п. 1, де:
А вибирають з групи, яка складається з вуглецю та кисню;
R вибирають з групи, яка складається з водню та алкілу;
R1 вибирають з групи, яка складається з арилу та гетероарилу, де арил або гетероарил кожен незалежно є або незаміщеним або заміщеним однією або кількома групами, незалежно вибраними з групи, яка складається з алкілу, галогену, гідроксилу, тетразолілу, імідазолілу, дигідроімідазолілу, карбонової кислоти та естеру карбонової кислоти;
R2, R3 та R4 кожен незалежно вибирають з групи, яка складається з водню, алкілу, алкокси та галогену;
R5, R6 та R7 кожен незалежно вибирають з групи, яка складається з водню, алкілу, алкокси, галогену, гідроксилу, аміно, нітро, ціано, карбонової кислоти та естеру карбонової кислоти;
R8, R9, R10 та R11 кожен незалежно вибирають з групи, яка складається з водню та алкілу; де R8, R9, R10 та R11 можуть заміщати будь-яку вільну валентність кільця, до якого вони приєднані; та
n дорівнює 0, 1 або 2.
3. Сполука або її фармацевтично прийнятна сіль, гідрат або сольват за п. 1, де R1 означає -СООR12 заміщений арил або -СООR12 заміщений гетероарил, де R12 є воднем або алкілом.
4. Сполука або її фармацевтично прийнятна сіль, гідрат або сольват за п. 3, де R1 вибирають з групи, яка складається з:
 ,
,  ,
,  ,
, 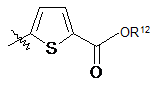 та
та 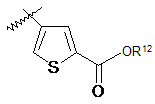 .
.
5. Сполука або її фармацевтично прийнятна сіль, гідрат або сольват за п. 1 формули (ІІ):
 (ІІ).
(ІІ).
6. Сполука або її фармацевтично прийнятна сіль, гідрат або сольват за п. 1 або п. 2, де сполуку вибирають з групи, яка складається з:
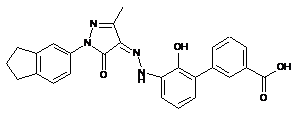 ,
, 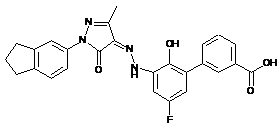 ,
,
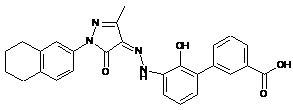 ,
, 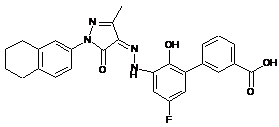 ,
,
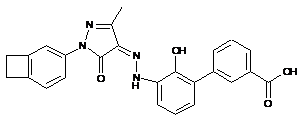 ,
,  ,
,
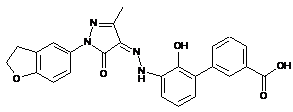 ,
, 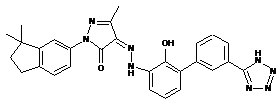 ,
,
 ,
,  ,
,
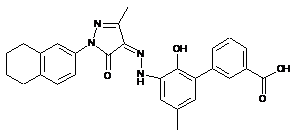 ,
,  ,
,
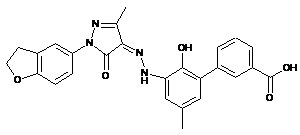 ,
, 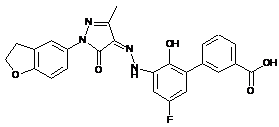 ,
,
 ,
, 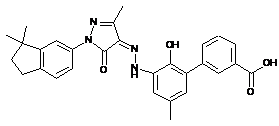 ,
,
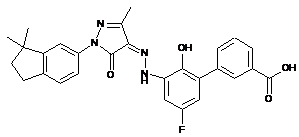 ,
, 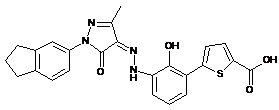 ,
,
 ,
, 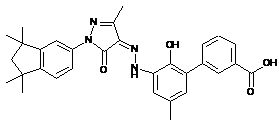 ,
,
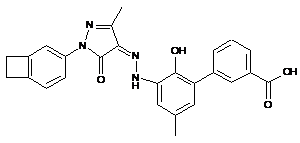 ,
, 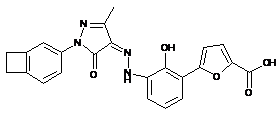 ,
,
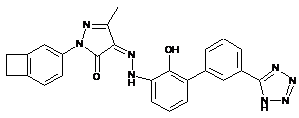 ,
, 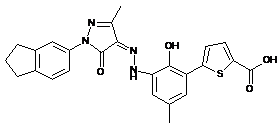 ,
,
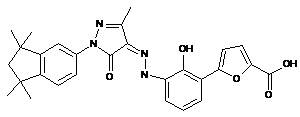 , ,
, ,
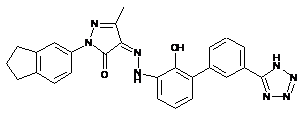 ,
,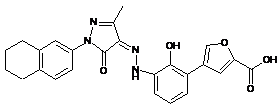 ,
,
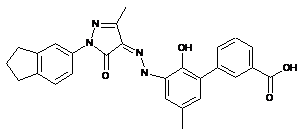 ,
,  ,
,
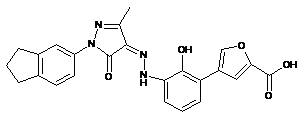 ,
, 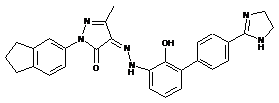 ,
,
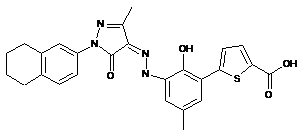 ,
, 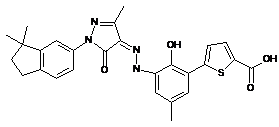 ,
,
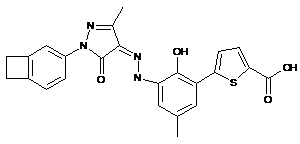 ,
,  ,
,
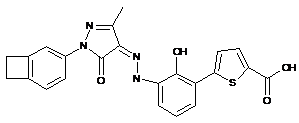 ,
,  ,
,
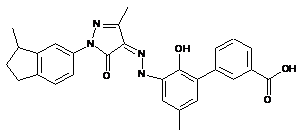 ,
,  ,
,
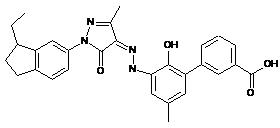 ,
,  ,
,
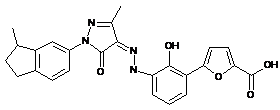 ,
, 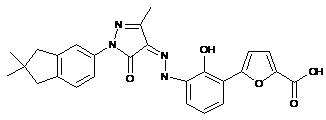 ,
,
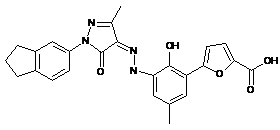 ,
, 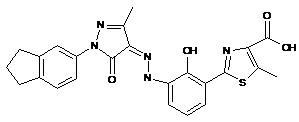 ,
,
 ,
, 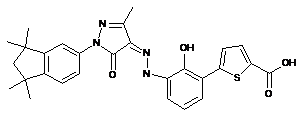 ,
,
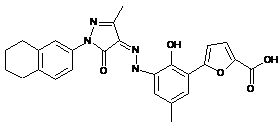 ,
,  ,
,
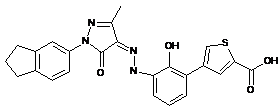 ,
, 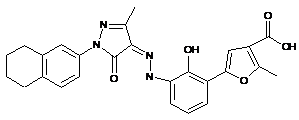 ,
,
 ,
,  ,
,
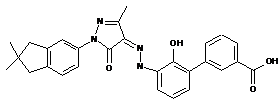 ,
,  та
та 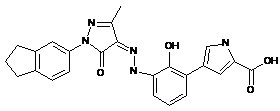 .
.
7. Сполука формули (ΙΑ)
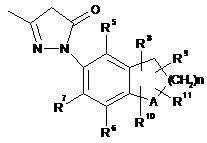 , (ΙΑ)
, (ΙΑ)
де:
А вибирають з групи, яка складається з вуглецю та кисню;
R5, R6 та R7 кожен незалежно вибирають з групи, яка складається з водню, алкілу, алкокси, галогену, гідроксилу, аміно, нітро, ціано, карбонової кислоти та естеру карбонової кислоти;
R8, R9, R10 та R11 кожен незалежно вибирають з групи, яка складається з водню та алкілу; де R8, R9, R10 та R11 можуть заміщати будь-яку вільну валентність кільця, до якого вони приєднані; та
n дорівнює 0, 1 або 2.
8. Сполука за п. 7, де сполуку вибирають з групи, яка складається з:
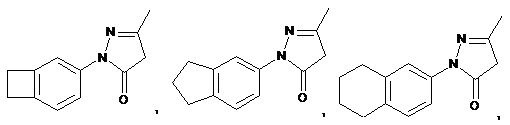
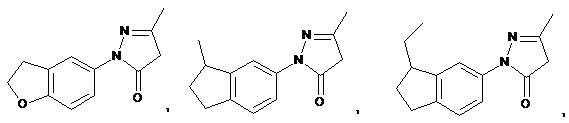
 та
та  .
.
9. Спосіб одержання сполуки формули (ІА) за п. 7, в якому:
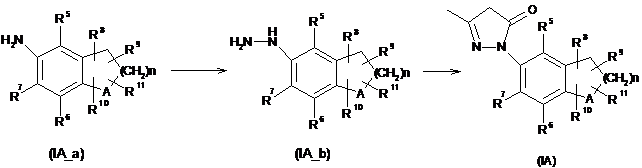 амінозаміщений бензоцикл формули (ІА_а) перетворюють на відповідний діазозаміщений бензоцикл;
амінозаміщений бензоцикл формули (ІА_а) перетворюють на відповідний діазозаміщений бензоцикл;
діазозаміщений бензоцикл відновлюють з отриманням гідразину формули (ІА_b); та
гідразин формули (ІА_b) конденсують з карбонільною сполукою з отриманням сполуки формули (ІА);
де A, R5, R6, R7, R8, R9, R10, R11 і n є такими, як визначено в пункті 7.
10. Спосіб одержання сполуки формули (І) за п. 1, в якому:
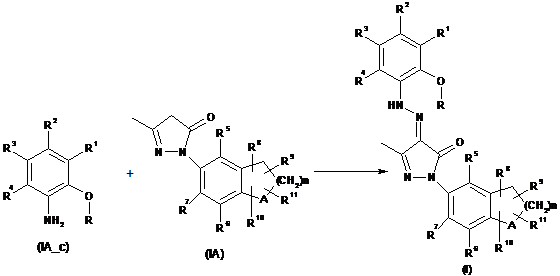
заміщений анілін формули (ІА_с) перетворюють на відповідну діазозаміщену сполуку; та
діазозаміщену сполуку піддають взаємодії із сполукою формули (ІА) з утворенням сполуки формули (І),
де A, R5, R6, R7, R8, R9, R10, R11 і n є такими, як визначено в пункті 1.
11. Застосування сполуки або її фармацевтично прийнятної солі, гідрату або сольвату за п. 1 для виготовлення агоніста рецептора тромбопоетину (ТРО).
12. Застосування сполуки або її фармацевтично прийнятної солі, гідрату або сольвату за п. 1 для виготовлення лікарського засобу для лікування тромбоцитопенії.
13. Спосіб лікування тромбоцитопенії, в якому пацієнту вводять сполуку або її фармацевтично прийнятну сіль, гідрат або сольват за п. 1.
14. Спосіб за п. 13, де сполуку або її фармацевтично прийнятну сіль, гідрат або сольват за п. 1 вводять разом із лікарським засобом, вибраним з групи, яка складається з колонієстимулюючого фактора, цитокіну, хемокіну, інтерлейкіну або агоніста або антагоніста рецептора цитокіну, розчинного рецептора, агоніста або антагоніста рецептора антитіла або одного або кількох пептидів або низькомолекулярних сполук з однаковим механізмом дії.
15. Фармацевтична композиція, яка містить терапевтично ефективну кількість сполуки або її фармацевтично прийнятної солі, гідрату або сольвату за п. 1 та фармацевтично прийнятний носій.
16. Фармацевтична композиція за п. 15, де композиція необов’язково містить лікарський засіб, вибраний з групи, яка складається з колонієстимулюючого фактора, цитокіну, хемокіну, інтерлейкіну або агоніста рецептора цитокіну.
17. Застосування фармацевтичної композиції за п. 15 для виготовлення лікарського засобу для лікування тромбоцитопенії.
Текст
Реферат: Описані біциклозаміщені піразолоназопохідні формули (І) або їх фармацевтично прийнятні солі, гідрати або сольвати, способи їх отримання, фармацевтичні композиції, які їх містять, та їх застосування як терапевтичного агента, особливо як міметиків тромбопоетину (ТРО), та їх застосування як агоністів рецептора тромбопоетину. UA 101172 C2 (12) UA 101172 C2 Значення замісників у формулі (І) є таким, як визначено у описі. R 2 R 3 R R 4 1 O HN R N O R N 5 R N 8 R 9 (CH2)n R 7 R R A 10 R 11 6 (I) R R R 2 3 R 4 HN N 1 O R O R 5 R 8 R N N R 7 A R 6 (I) R 10 9 (CH 2)n R 11 UA 101172 C2 5 10 15 20 25 30 35 40 45 50 55 60 Біцикло-заміщені піразолон-азопохідні, спосіб їх одержання та фармацевтичне застосування Галузь винаходу Цей опис стосується нових біцикло-заміщених піразолoн-азопохідних, представлених формулою (I), способів їх одержання, фармацевтичних композицій, які їх містять, та їх застосування як терапевтичних агентів, зокрема, як міметиків тромбопоетину (TPO), та їх застосування як агоністів рецептора тромбопоетину. Передумови винаходу Тромбопоетин (TPO), який також називають фактором росту та розвитку мегакаріоцитів (MGDF), фактором стимулювання тромбоцитопоезу (TSF), лігандом c-мієлопрофіліративної лейкемії (c-Mpl), mpl лігандом або мегапоетином, є глікопротеїном, яки приймає участь у виробленні тромбоцитів. Дивитись Wendling, F., et. al., Biotherapy 10(4): 269-77 (1998); Kuter D.l. et al., The Oncologist, 1: 98-106 (1996); Metcalf, Nature 369: 519-520 (1994). При певних обставинах, активність TPO залежить від зв'язування TPO з TPO рецептором (який також називають MPL). TPO рецептор клонували та була описана його амінокислотна послідовність. Дивитись Vigon et al., Proc. Nat. Acad. Sci., 89: 5640-5644 (1992). TPO є 332-амінокислотним глікозильованим поліпептидом, який відіграє ключову роль у регулюванні мегакаріоцитопоезу, та у процесі, де тромбоцити виробляються мегакаріоцитами мозкової речовини. Дивитись Kuter et al., Proc. Natl. Acad. Sci. USA 91: 11104-11108 (1994); Barley et al., Cell 77:1117-1124 (1994); Kaushansky et al., Nature 369:568-571 (1994); Wendling et al., Nature 369: 571-574 (1994); та Sauvage et al., Nature 369: 533-538 (1994). TPO виробляється у печінці, проте функціонує переважно у мозковій речовині, де він стимулює диференціацію стовбурних клітин у попередників мегакаріоцитів, та стимулює проліферацію мегакаріоцитів, поліплоїдизацію та, нарешті, входить у циркуляцію тромбоцитів у тілі. TPO також є первинним регулятором у ситуаціях, які викликають тромбоцитопенію та у багатьох дослідженнях, включаючи, підвищення кількості тромбоцитів, розміру тромбоцитів та включення ізотопів у тромбоцити тварини реципієнта. Дивитись, Metcalf Nature 369: 519-520 (1994). Відомо, що, TPO впливає на мегакаріоцитопоез кількома шляхами: (1) викликає збільшення розміру та кількості мегакаріоцитів; (2) збільшує вміст ДНК, форм поліплоідії та кількості мегакаріоцитів; (3) прискорює ендомітоз мегакаріоцитів; (4) збільшує кількість зрілих мегакаріоцитів; (5) збільшує процент клітин попередників, кількість невеликих клітин позитивних на ацетилхолінестеразу, кількість клітин мозкової речовини. Тромбоцити є необхідними для коагуляції крові. При дуже низькому рівні тромбоцитів у пацієнта виникає ризик загибелі від катастрофічного крововиливу. Таким чином, TPO використовують як для діагностики, так і для лікування різноманітних гематологічних розладів, наприклад, хвороб викликаних головним чином пошкодженням тромбоцитів. Окрім цього, TPO також застосовують для лікування тромбоцитопенії, особливо, станів викликаних хіміотерапією, опроміненням або пересадкою кісткового мозку при лікуванні раку або лімфоми. Повільне відновлення тромбоцитів у пацієнтів, які страждають на тромбоцитопенію, є дуже тяжкою проблемою, тому необхідно отримати сполуку для лікування тромбоцитопенії, яка діє як міметик TPO. Декілька років тому, розробку пептидних міметиків TPO описували у (WO96/40750, WO98/25965). Ці пептиди розробили так, щоб вони зв'язували та активували TPO рецептор (TPO-R), проте не містили гомології послідовностей з природним TPO. Нещодавно, описали кілька низькомолекулярних міметиків TPO, включаючи 1,4-бензодіазепін-2-они (JP11001477), комплекси металів похідні від лігандів шиффових основ (WO99/11262), похідні циклічного поліаміну (WO00/28987), тіазол-2-іл-бензаміди (WO01/07423, WO01/53267), похідні азо-арилу (WO00/35446, WO01/17349), 2-арил-нафтімідазоли (WO01/39773, WO01/53267), та похідні семікарбазону (WO01/34585). У системах клітин всі ці молекули здатні активувати шлях сигнальної трансдукції, який залежить від наявності TPO рецептора на клітинній мембрані. Певні типи сполук здатні впливати безпосередньо на TPO рецептор. Описано, що певні похідні заміщеного тосемікабазолу є ефективними агоністами TPO рецептора. Деякі з найбільш придатних сполук цієї серії стимулюють проліферацію та диференціацію TPO-чутливих ліній клітин та TPO у культурах кісткового мозку людини при концентрації нижче 100 нМ. Декілька патентів, права на які передані GlaxoSmithKline, описують аналог тромбопоетину, елтромбопаг (WO00/189457, WO01/089457, WO2006/064957), який проявляє високу активність. Резюме винаходу Даний опис описує сполуки, які є агоністами рецептора TPO та TPO міметиками. З метою доповнити попередній рівень техніки, даний винахід забезпечує сполуками біциклозаміщених піразолoн-азопохідних формули (I) та їх таутомерами, енантіомерами, діастереомерами, рацематами, фармацевтично прийнятними солями, гідратами або сольватами, а також їх метаболітами, метаболічними попередниками або проліками. 1 UA 101172 C2 2 R 1 3 R R 4 R HN O R N O 5 R 8 R 9 R N N 7 A R 6 R 10 R (CH2)n 11 R (I) 5 10 15 20 25 де: A вибирають з групи, яка складається з вуглецю та кисню; R вибирають з групи, яка складається з водню та алкілу; 1 2 3 4 R , R , R та R кожен незалежно вибрано з групи, яка складається з водню, алкілу, алкокси, галогену, арилу та гетероарилу, де арил або гетероарил кожен є необов'язково заміщеним однією або кількома групами вибраними з групи, яка складається з алкілу, галогену, гідроксилу, тетразолілу, імідазолілу, дигідроімідазолілу, карбонова кислота та естеру карбонової кислоти; 5 6 7 R , R та R кожен незалежно вибрано з групи, яка складається з водню, алкіл, алкокси, галоген, гідроксил, аміно, нітро, ціано, карбонова кислота та естеру карбонової кислоти; 8 9 10 11 R , R , R та R кожен незалежно вибрано з групи, яка складається з водню та алкілу; та n дорівнює 0, 1 або 2, У деяких переважних варіантах здійснення даного винаходу: A вибирають з групи, яка складається з вуглецю та кисню; R вибирають з групи, яка складається з водню та алкілу; 1 R вибирають з групи, яка складається з арилу та гетероарилу, де арил або гетероарил кожен є необов'язково заміщеним однією або кількома групами, вибраними з групи, яка складається з алкілу, галогену, гідроксилу, тетразолілу, імідазолілу, дигідроімідазолілу, карбонової кислоти та естеру карбонової кислоти; 2 3 4 R , R та R кожен незалежно вибрано з групи, яка складається з водню, алкілу, алкокси та галогену; 5 6 7 R , R та R кожен незалежно вибрано з групи, яка складається з водню, алкілу, алкокси, галогену, гідроксилу, аміно, нітро, ціано, карбонової кислоти та естеру карбонової кислоти; 8 9 10 11 R , R , R та R кожен незалежно вибрано з групи, яка складається з водню та алкілу; та n дорівнює 0, 1 або 2, Сполуки формули (I) даного опису бажано включають, проте не обмежуються наступними сполуками: Приклад № 1 Структурна формула N N O N N H Назва OH OH O N N 2'-Гідрокси-3'-[N'-(1-індан-5-іл-3-метил-5оксо-1,5-дигідро-піразол-4-іліден)-гідразино]біфеніл-3-карбонова кислота O N N H OH O 2 5'-Фтор-2'-гідрокси-3'-[N'-(1-індан-5-іл-3метил-5-оксо-1,5-дигідро-піразол-4-іліден)гідразино]-біфеніл-3-карбонова кислота OH O 2'-Гідрокси-3'-{N'-[3-метил-5-оксо-1-(5,6,7,8тетрагідро-нафтален-2-іл)-1,5-дигідропіразол-4-іліден]-гідразино}-біфеніл-3карбонова кислота OH F 3 N N O N N H OH 2 UA 101172 C2 N N N O HN 4 OH OH O 5'-Фтор-2'-гідрокси-3'-{N'-[3-метил-5-оксо-1(5,6,7,8-тетрагідро-нафтален-2-іл)-1,5дигідро-піразол-4-іліден]-гідразино}-біфеніл3-карбонова кислота F N N N O HN 5 OH OH O O O N N O N N H 6 N N 7 O 5-(2-Гідрокси-3-{N'-[3-метил-5-оксо-1(5,6,7,8-тетрагідро-нафтален-2-іл)-1,5дигідро-піразол-4-іліден]-гідразино}-феніл)1,2,4-триметил-1H-пірол-3-карбонової кислоти етиловий естер O N N OH N OH OH O N N N O HN OH N O HN OH 8 N N 9 H N N N N OH O O N N N O HN 10 N N 3'-[N'-(1-Біцикло[4,2,0]окта-1(6),2,4-триєн-3іл-3-метил-5-оксо-1,5-дигідро-піразол-4іліден)-гідразино]-2'-гідрокси-біфеніл-3карбонова кислота OH H N N N N 3'-{N'-[1-(2,3-Дигідро-бензофуран-5-іл)-3метил-5-оксо-1,5-дигідро-піразол-4-іліден]гідразино}-2'-гідрокси-біфеніл-3-карбонова кислота 2-(3,3-Диметил-індан-5-іл)-4-{[2-гідрокси-3'(1H-тетразол-5-іл)-біфеніл-3-іл]-гідразоно}-5метил-2,4-дигідро-піразол-3-он 5-{2-Гідрокси-3-[N'-(1-індан-5-іл-3-метил-5оксо-1,5-дигідро-піразол-4-іліден)-гідразино]феніл}-фуран-2-карбонова кислота 4-{[2-Гідрокси-3'-(1H-тетразол-5-іл)-біфеніл3-іл]-гідразоно}-5-метил-2-(5,6,7,8тетрагідро-нафтален-2-іл)-2,4-дигідропіразол-3-он O 11 N N N O HN 12 N N 13 O O N N H 2'-Гідрокси-5'-метил-3'-{N'-[3-метил-5-оксо-1(5,6,7,8-тетрагідро-нафтален-2-іл)-1,5дигідро-піразол-4-іліден]-гідразино}-біфеніл3-карбонова кислота O N O HN 5-(3-{N'-[1-(3,3-Диметил-індан-5-іл)-3-метил5-оксо-1,5-дигідро-піразол-4-іліден]гідразино}-2-гідрокси-феніл)-тіофен-2карбонова кислота OH OH OH OH S OH OH O N N 14 O O N N H OH OH O F 3 3'-{N'-[1-(2,3-Дигідро-бензофуран-5-іл)-3метил-5-оксо-1,5-дигідро-піразол-4-іліден]гідразино}-2'-гідрокси-5'-метил-біфеніл-3карбонова кислота 3'-{N'-[1-(2,3-Дигідро-бензофуран-5-іл)-3метил-5-оксо-1,5-дигідро-піразол-4-іліден]гідразино}-5'-фтор-2'-гідрокси-біфеніл-3карбонова кислота UA 101172 C2 N N N O HN 15 OH OH O O N N 5-(2-Гідрокси-3-{N'-[3-метил-5-оксо-1(5,6,7,8-тетрагідро-нафтален-2-іл)-1,5дигідро-піразол-4-іліден]-гідразино}-феніл)фуран-2-карбонова кислота N N N O HN 17 3'-{N'-[1-(3,3-Диметил-індан-5-іл)-3-метил-5оксо-1,5-дигідро-піразол-4-іліден]-гідразино}2'-гідрокси-5'-метил-біфеніл-3-карбонова кислота OH O 16 OH O N O HN 3'-{N'-[1-(3,3-Диметил-індан-5-іл)-3-метил-5оксо-1,5-дигідро-піразол-4-іліден]-гідразино}5'-фтор-2'-гідрокси-біфеніл-3-карбонова кислота OH OH F N N N O HN 18 OH OH S 5-{2-Гідрокси-3-[N'-(1-індан-5-іл-3-метил-5оксо-1,5-дигідро-піразол-4-іліден)-гідразино]феніл}-тіофен-2-карбонова кислота O O 19 N N N O HN 20 N N 21 N O HN N N N O HN 22 OH 2'-Гідрокси-5'-метил-3'-{N'-[3-метил-5-оксо-1(1,1,3,3-тетраметил-індан-5-іл)-1,5-дигідропіразол-4-іліден]-гідразино}-біфеніл-3карбонова кислота OH O N O HN 2'-Гідрокси-3'-{N'-[3-метил-5-оксо-1-(1,1,3,3тетраметил-індан-5-іл)-1,5-дигідро-піразол4-іліден]-гідразино}-біфеніл-3-карбонова кислота O N N 3'-[N'-(1-Біцикло[4,2,0]окта-1(6),2,4-триєн-3іл-3-метил-5-оксо-1,5-дигідро-піразол-4іліден)-гідразино]-2'-гідрокси-5'-метилбіфеніл-3-карбонова кислота OH OH OH OH OH OH O O N N 23 N O HN N N 24 N O HN OH N N N N H OH OH S O 4 5-{3-[N'-(1-Біцикло[4,2,0]окта-1(6),2,4-триєн3-іл-3-метил-5-оксо-1,5-дигідро-піразол-4іліден)-гідразино]-2-гідрокси-феніл}-фуран-2карбонова кислота 2-Біцикло[4,2,0]окта-1(6),2,4-триєн-3-іл-4-{[2гідрокси-3'-(1H-тетразол-5-іл)-біфеніл-3-іл]гідразоно}-5-метил-2,4-дигідро-піразол-3-он 5-{2-Гідрокси-3-[N'-(1-індан-5-іл-3-метил-5оксо-1,5-дигідро-піразол-4-іліден)-гідразино]5-метил-феніл}-тіофен-2-карбонова кислота UA 101172 C2 O 25 O OH N N N N 26 N O HN 5-(2-Гідрокси-3-{N'-[3-метил-5-оксо-1(1,1,3,3-тетраметил-індан-5-іл)-1,5-дигідропіразол-4-іліден]-гідразино}-феніл)-фуран-2карбонова кислота O N N 3'-[N'-(1-Біцикло[4,2,0]окта-1(6),2,4-trien-3-іл3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)гідразино]-5'-фтор-2'-гідрокси-біфеніл-3карбонова кислота N 4-{[2-Гідрокси-3'-(1H-тетразол-5-іл)-біфеніл3-іл]-гідразоно}-2-індан-5-іл-5-метил-2,4дигідро-піразол-3-он OH 4-(2-Гідрокси-3-{N'-[3-метил-5-оксо-1(5,6,7,8-тетрагідро-нафтален-2-іл)-1,5дигідро-піразол-4-іліден]-гідразино}-феніл)фуран-2-карбонова кислота OH 2'-Гідрокси-3'-[N'-(1-індан-5-іл-3-метил-5оксо-1,5-дигідро-піразол-4-іліден)-гідразино]5'-метил-біфеніл-3-карбонова кислота OH OH O OH F 27 N N N N OH N O HN OH O N N 28 N N N O O N N 29 O N N OH O 30 N N O N N OH OH O N N N O HN 31 O OH OH O 32 N N O N N N N N OH OH OH S O N N 34 4-{2-Гідрокси-3-[N'-(1-індан-5-іл-3-метил-5оксо-1,5-дигідро-піразол-4-іліден)-гідразино]феніл}-фуран-2-карбонова кислота N N N O 33 3'-{N'-[1-(3,3-Диметил-індан-5-іл)-3-метил-5оксо-1,5-дигідро-піразол-4-іліден]-гідразино}2'-гідрокси-біфеніл-3-карбонова кислота O N N OH OH S O 5 4-{[4'-(4,5-Дигідро-1H-імідазол-2-іл)-2гідрокси-біфеніл-3-іл]-гідразоно}-2-індан-5іл-5-метил-2,4-дигідро-піразол-3-он 5-(2-Гідрокси-5-метил-3-{N'-[3-метил-5-оксо1-(5,6,7,8-тетрагідро-нафтален-2-іл)-1,5дигідро-піразол-4-іліден]-гідразино}-феніл)тіофен-2-карбонова кислота 5-(3-{N'-[1-(3,3-Диметил-індан-5-іл)-3-метил5-оксо-1,5-дигідро-піразол-4-іліден]гідразино}-2-гідрокси-5-метил-феніл)тіофен-2-карбонова кислота UA 101172 C2 N N O N N 36 O N N 37 N N O N N 38 N N N N O 5-(2-Гідрокси-3-{N'-[3-метил-5-оксо-1(5,6,7,8-тетрагідро-нафтален-2-іл)-1,5дигідро-піразол-4-іліден]-гідразино}-феніл)тіофен-2-карбонова кислота O O 5-{3-[N'-(1-Біцикло[4,2,0]окта-1(6),2,4-триєн3-іл-3-метил-5-оксо-1,5-дигідро-піразол-4іліден)-гідразино]-2-гідрокси-5-метил-феніл}тіофен-2-карбонова кислота O 35 N N 5-{3-[N'-(1-Біцикло[4,2,0]окта-1(6),2,4-триєн3-іл-3-метил-5-оксо-1,5-дигідро-піразол-4іліден)-гідразино]-2-гідрокси-феніл}-тіофен2-карбонова кислота OH OH S OH OH S OH OH S 2'-Гідрокси-3'-{N'-[3-метил-1-(3метил-індан-5-іл)-5-оксо-1,5дигідро-піразол-4-іліден]гідразино}-біфеніл-3-карбонова кислота OH OH O N N O O N N 40 O N N 41 O N N 2'-Гідрокси-5'-метил-3'-{N'-[3-метил-1-(3метил-індан-5-іл)-5-оксо-1,5-дигідро-піразол4-іліден]-гідразино}-біфеніл-3-карбонова кислота O 39 N N 5-(2-Гідрокси-3-{N'-[3-метил-1-(3-метиліндан-5-іл)-5-оксо-1,5-дигідро-піразол-4іліден]-гідразино}-феніл)-тіофен-2карбонова кислота OH OH OH OH S OH N N OH 3'-{N'-[1-(3-Етил-індан-5-іл)-3-метил-5-оксо1,5-дигідро-піразол-4-іліден]-гідразино}-2'гідрокси-біфеніл-3-карбонова кислота O N N 42 O OH N N OH O N N 43 O N N OH OH O O N N 44 O N N OH OH O O 6 3'-{N'-[1-(3-Етил-індан-5-іл)-3-метил-5-оксо1,5-дигідро-піразол-4-іліден]-гідразино}-2'гідрокси-5'-метил-біфеніл-3-карбонова кислота 5-(3-{N'-[1-(3,3-Диметил-індан-5-іл)-3-метил5-оксо-1,5-дигідро-піразол-4-іліден]гідразино}-2-гідрокси-феніл)-фуран-2карбонова кислота 5-(2-Гідрокси-3-{N'-[3-метил-1-(3-метиліндан-5-іл)-5-оксо-1,5-дигідро-піразол-4іліден]-гідразино}-феніл)-фуран-2-карбонова кислота UA 101172 C2 N N 45 N N O OH OH O O N N 46 N N O OH OH O O O OH N N OH N S O N N 48 O 49 O OH N N N OH OH S O N N 50 O N N OH OH O O N N 51 O N N OH S OH O N N O N N OH S OH O N N 53 O N N 54 O O N N N N OH OH O OH O O O N N 55 O N N 2-{2-Гідрокси-3-[N'-(1-індан-5-іл-3-метил-5оксо-1,5-дигідро-піразол-4-іліден)-гідразино]феніл}-5-метил-тіазол-4-карбонова кислота 5-{2-Гідрокси-3-[N'-(1-індан-5-іл-3-метил-5оксо-1,5-дигідро-піразол-4-іліден)-гідразино]феніл}-1,2,4-триметил-1H-пірол-3карбонової кислоти етиловий естер O N N N N 52 5-{2-Гідрокси-3-[N'-(1-індан-5-іл-3-метил-5оксо-1,5-дигідро-піразол-4-іліден)-гідразино]5-метил-феніл}-фуран-2-карбонова кислота O N N 47 5-(3-{N'-[1-(2,2-Диметил-індан-5-іл)-3-метил5-оксо-1,5-дигідро-піразол-4-іліден]гідразино}-2-гідрокси-феніл)-фуран-2карбонова кислота OH O O O 7 5-(2-Гідрокси-3-{N'-[3-метил-5-оксо-1(1,1,3,3-тетраметил-індан-5-іл)-1,5-дигідропіразол-4-іліден]-гідразино}-феніл)-тіофен-2карбонова кислота 5-(2-Гідрокси-5-метил-3-{N'-[3-метил-5-оксо1-(5,6,7,8-тетрагідро-нафтален-2-іл)-1,5дигідро-піразол-4-іліден]-гідразино}-феніл)фуран-2-карбонова кислота 4-(2-Гідрокси-3-{N'-[3-метил-5-оксо-1(5,6,7,8-тетрагідро-нафтален-2-іл)-1,5дигідро-піразол-4-іліден]-гідразино}-феніл)тіофен-2-карбонова кислота 4-{2-Гідрокси-3-[N'-(1-індан-5-іл-3-метил-5оксо-1,5-дигідро-піразол-4-іліден)-гідразино]феніл}-тіофен-2-карбонова кислота 5-(2-Гідрокси-3-{N'-[3-метил-5-оксо-1(5,6,7,8-тетрагідро-нафтален-2-іл)-1,5дигідро-піразол-4-іліден]-гідразино}-феніл)2-метил-фуран-3-карбонова кислота 5-(2-Гідрокси-3-{N'-[3-метил-5-оксо-1(5,6,7,8-тетрагідро-нафтален-2-іл)-1,5дигідро-піразол-4-іліден]-гідразино}-феніл)фуран-2-карбонової кислоти метиловий естер 5-{2-Гідрокси-3-[N'-(1-індан-5-іл-3-метил-5оксо-1,5-дигідро-піразол-4-іліден)-гідразино]феніл}-фуран-2-карбонової кислоти метиловий естер UA 101172 C2 N N 56 O N N OH OH 3'-{N'-[1-(2,2-Диметил-індан-5-іл)-3-метил-5оксо-1,5-дигідро-піразол-4-іліден]-гідразино}2'-гідрокси-біфеніл-3-карбонова кислота O N N 57 O N N OH N OH O N N 58 O N N OH N OH 4-(2-Гідрокси-3-{N'-[3-метил-5-оксо-1(5,6,7,8-тетрагідро-нафтален-2-іл)-1,5дигідро-піразол-4-іліден]-гідразино}-феніл)1H-пірол-2-карбонова кислота 4-{2-Гідрокси-3-[N'-(1-індан-5-іл-3-метил-5оксо-1,5-дигідро-піразол-4-іліден)-гідразино]феніл}-1H-пірол-2-карбонова кислота O або їх фармацевтично прийнятними солями, гідратами або сольватами. Даний опис також стосується сполуки формули (IA), як проміжної сполуки у синтезі сполук формули (I): O 5 8 R R 9 R N N (CH2)n 7 A 11 R R 10 6 R R 5 10 (IA) де: A вибирають з групи, яка складається з вуглецю та кисню; 5 6 7 R , R та R кожен незалежно вибрано з групи, яка складається з водню, алкілу, алкокси, галогену, гідроксилу, аміно, нітро, ціано, карбонової кислоти та естеру карбонової кислоти; 8 9 10 11 R , R , R та R кожен незалежно вибрано з групи, яка складається з водню та алкілу; та n дорівнює 0, 1 або 2, Сполуки формули (IA) даного опису бажано включають, проте не обмежуються наступними: № Структурна формула N N 1 Назва 2-Біцикло[4,2,0]окта-1(6),2,4-триєн-3-іл-5-метил-2,4дигідро-піразол-3-он O N N 2 2-Індан-5-іл-5-метил-2,4-дигідро-піразол-3-он O N N 3 5-Метил-2-(5,6,7,8-тетрагідро-нафтален-2-іл)-2,4-дигідропіразол-3-он O N N 4 O 5 2-(2,3-Дигідро-бензофуран-5-іл)-5-метил-2,4-дигідропіразол-3-он O N N 5-Метил-2-(3-метил-індан-5-іл)-2,4-дигідро-піразол-3-он O 8 UA 101172 C2 N N 6 2-(3-Етил-індан-5-іл)-5-метил-2,4-дигідро-піразол-3-он O N N 7 2-(3,3-Диметил-індан-5-іл)-5-метил-2,4-дигідро-піразол-3он O N N 8 2-(2,2-Диметил-індан-5-іл)-5-метил-2,4-дигідро-піразол-3он O N N 9 5-Метил-2-(1,1,3,3-тетраметил-індан-5-іл)-2,4-дигідропіразол-3-он O У іншому варіанті здійснення, даний опис стосується способу отримання сполуки формули (IA), який включає наступні стадії: R5 R8 H2N R7 R9 (CH2)n1.NaNO2 A R6 R10 R11 2.SnCl2 H H2N N R5 R8 O R9 R7 R6 R10 R11 15 20 R9 (CH2)n (CH2)n A 5 10 R5 R8 N N R7 A R6 R10 R11 (IA) взаємодія амінозаміщеного бензоциклу та нітриту натрію у кислому розчині за допомогою діазо-реакції; відновлення отриманої проміжної сполуки дихлоридом олова для отримання гідразину; нагрівання гідразину та електрофільної карбонільної сполуки, такої як етилацетоацетат, у придатному розчиннику, такому як оцтова кислота, етанол тощо, за допомогою реакції конденсування для отримання сполуки формули (IA). У іншому варіанті здійснення, даний опис стосується способу отримання сполуки формули (I), який включає наступні стадії: взаємодія заміщеного аніліну та нітриту натрію у придатній кислоті, такій як азотна кислота, сірчана кислота, хлорводнева кислота, за допомогою діазо-реакції; взаємодія отриманої проміжної сполуки та сполуки формули (IA) у придатній основі, такій як бікарбонат натрію, гідрокарбонат калію, за допомогою реакції конденсування для отримання сполуки формули (I). Даний опис стосується застосування сполуки формули (I) та формули (IA) у виготовленні агоністів рецептора TPO. Даний опис стосується застосування сполуки формули (I) та формули (IA) у виготовленні лікарського засобу для лікування тромбоцитопенії. Також, вказаний лікарський засіб можна 9 UA 101172 C2 5 10 15 20 25 30 35 40 45 50 55 вводити разом з терапевтично ефективною кількістю одного або кількох лікарських засобів, вибраних з групи, яка складається з фактору, що стимулює колонієутворення, цитокіну, хемокіну, інтерлейкіну або агоніста абоантагоніста рецептора цитокіну, рецептора розчинника, агоніста або антагоніста рецептора антитіла, або одним або кількома пептидами або низькомолекулярними сполуками з однаковим з цими ліками механізмом дії. Даний опис стосується фармацевтичної композиції, яка містить терапевтично ефективну кількість сполуки формули (I) та формули (IA), або їх фармацевтично прийнятні солі, гідрати або сольвати. Також, вказану композицію можна вводити разом з терапевтично ефективною кількістю одного або кількох лікарських засобів, вибраних з групи, яка складається з фактору, що стимулює колонієутворення, цитокіну, хемокіну, інтерлейкіну або агоніста рецептора цитокіну. Даний опис також стосується застосування вказаної фармацевтичної композиції у виготовленні лікарського засобу для лікування тромбоцитопенії. Термін "спів-введення" означає або одночасне введення або окреме послідовне введення сполук даного опису. Даний опис стосується способу отримання фармацевтичної композиції, яка містить фармацевтично прийнятні носій або розчинник та терапевтично ефективну кількість сполуки формули (I) та формули (IA), а також їх фармацевтично прийнятні солі, гідрати або сольвати, де спосіб включає змішування сполуки формули (I) та формули (IA) з носієм та розчинниками. Детальний опис бажаних варіантів здійснення Доки не вказано протилежне, наступні терміни, використані у описі та формулі винаходу, мають нижченаведені значення. Термін "алкіл" стосується насиченого аліфатичного радикалу, включаючи вуглеводневий радикал з прямим або розгалуженим ланцюгом, яки містить від 1 дo 20 атомів вуглецю. Алкільна група бажано означає алкіл, який містить від 1 дo 10 атомів вуглецю, такий як метил, етил, пропіл, 2-пропіл, н-бутил, ізо-бутил, трет-бутил або пентил тощо. Алкільна група більш бажано означає нижчий алкіл, який містить від 1 дo 4 атомів вуглецю, такий як метил, етил, пропіл, 2-пропіл, н-бутил, ізо-бутил або трет-бутил тощо. Алкільна група може бути заміщеною або незаміщеною. Коли вона є заміщеною, замісником бажано є одна або кілька груп, незалежно вибраних з групи, яка складається з алкілу, алкокси, галогену, гідроксилу, аміно, нітро, ціано, арилу, гетероарилу, карбонової кислоти або естеру карбонової кислоти. Термін "арил" стосується радикалу, який містить щонайменше одне ароматичне кільце, тобто, має спарену систему pi-електронів, включаючи вуглецевий циклічний арил, гетероарил та біарил. Арильна група може бути заміщеною або незаміщеною. Коли вона є заміщеною, замісником бажано є одна або кілька груп, незалежно вибраних з групи, яка складається з алкілу, алкокси, галогену, гідроксилу, аміно, нітро, ціано, арилу, гетероарилу, карбонової кислоти або естеру карбонової кислоти. Термін "гетероарил" стосується арилу, який містить від 1 дo 4 гетероатомів, вибраних з групи, яка складається з N, O, та S як атомів кільця, інші атоми кільця є C. Вказане кільце є 5або 6-членним. Приклади гетероарильних груп включають фурил, тіеніл, піридил, піроліл, Nалкілпіроліл, піримідиніл, піразиніл, імідазоліл, тетразоліл, тощо. Гетероарильна група може бути заміщеною або незаміщеною. Коли вона є заміщеною, замісником бажано є одна або кілька груп, незалежно вибраних з групи, яка складається з алкілу, алкокси, галогену, гідроксилу, аміно, нітро, ціано, арилу, гетероарилу, карбонової кислоти або естеру карбонової кислоти. Термін "гідрокси" стосується -OH радикалу. Термін "алкоксил" стосується -O-(алкільного) та -O-(незаміщеного циклоалкільного) радикалів. Зразкові приклади включають, проте не обмежуються наступними, метокси, етокси, пропокси, бутокси, циклопропілокси, циклобутилокси, циклопентилокси, циклогексилокси, тощо. Алкоксильна па може бути заміщеною або незаміщеною. Коли вона є заміщеною, замісником бажано є одна або кілька груп, незалежно вибраних з групи, яка складається з алкілу, алкокси, галогену, гідроксилу, аміно, нітро, ціано, арилу, гетероарилу, карбонової кислоти або естеру карбонової кислоти. Термін "галоген" стосується фтору, хлору, брому або йоду. Термін "аміно" стосується -NH2 радикалу. Термін "ціано" стосується -CN радикалу. Термін "нітро" стосується -NO2 радикалу. Термін "алкоксил" стосується -O-(алкілу). Термін "карбонова кислота" стосується (алкіл) C(=O)OH радикалу. Термін "естеру карбонової кислоти" стосується (алкіл) C(=O)O (алкіл). 10 UA 101172 C2 5 10 15 20 Термін "фармацевтична композиція" стосується суміші однієї або кількох сполук описаних у даному документі, або їх фізиологічно/фармацевтично прийнятних солей або проліків, з іншими хімічними компонентами, такими як фізиологічно/фармацевтично прийнятні носії та наповнювачі. Призначенням фармацевтичної композиції є полегшати введення сполуки у організм. Способи синтезу описаних сполук Взаємодія аміно заміщеного бензоциклу та нітриту натрію у кислому розчині за допомогою діазо-реакції; відновлення отриманої проміжної сполуки дихлориду олова для отримання гідразину; нагрівання гідразину та електрофільної карбонільної сполуки, такої як етил ацетоацетат, у придатному розчиннику, такому як оцтова кислота, етанол тощо, за допомогою реакції конденсування для отримання сполуки формули (IA). Нітрування заміщеного 2-бромфенолу нітритом натрію для отримання нітрофенолу, який перетворюють на гідроксил захищений нітрофенол за допомогою реакції алкілування при придатній температурі, у присутності галоалкілу, такого як метил йодид; взаємодія гідроксил захищеного нітрофенолу та заміщеної арилборонової кислоти за допомогою реакції конденсації Сузукі у присутності каталізатору тетракіс(трифенілфосфін)паладію; або взаємодія гідроксил захищеного нітрофенолу та похідної боронової кислоти для отримання сполуки арилборонової кислоти, яка взаємодіє з галогенованою сполукою R1X за допомогою реакції конденсації Сузукі для отримання R1 заміщеного арилу; відновлення R1 заміщеного арилу паладієм на вугіллі в атмосфері водню для отримання ариланіліну; видалення алкільної захисної групи у присутності бромводневої кислоти для отримання незахищеного аніліну; або видалення алкільної захисної 11 UA 101172 C2 5 10 15 20 25 30 35 групи заміщеного арилу у присутності бромводневої кислоти для отримання нітросполуки, яку відновлюють паладієм на вугіллі в атмосфері водню для отримання незахищеного ариланіліну. Взаємодія заміщеного аніліну та нітриту натрію у придатній кислоті, такій як азотна кислота, сірчана кислота, хлорводнева кислота, за допомогою діазо-реакції; взаємодія отриманої проміжної сполуки та сполуки формули (IA) у придатній основі, такій як бікарбонат натрію, гідрокарбонат калію, за допомогою реакції конденсування для отримання сполуки формули (I). Даний опис також описується наступними прикладами, які не обмежують об'єм винаходу. Приклади 1 Структури всіх сполук ідентифікували за допомогою ядерно-магшнітного резонансу ( H 1 -6 1 ЯМР) або мас-спектрометрії (МС). H ЯМР хімічні зсуви записували у м.ч. (10 ). H ЯМР здійснювали на спектрометрі Bruker AVANCE-400. Придатними розчинниками були дейтерований-метанол (CD3OD), дейтерований-хлороформ (CDCl3) та дейтерованийдиметилсульфоксид (ДМСO-d6) з тетраметилсиланом (TМС) як внутрішній стандарт та хімічні -6 зсуви записували у ppm (10 ). МС визначали на мас-спектрометрі FINNIGAN LCQ Ad (ЕСІ) (Thermo, Model: Finnigan LCQ advantage MAX). IC50 визначали за допомогою NovoStar ELIASA (BMG Co. German). Тонкошаровим силікагелем був Yantai Huanghai HSGF254 або Qingdao GF254. Для колон очної хроматографії загалом використовували Yantai Huanghai 200~300 силікагель як носій. ВЕРХ вимірювали на високоефективному рідинному хроматографі Agilent 1200DAD high pressure liquid chromatography spectrometer (хроматографічна колонка Sunfire C18 1504,6 мм) та хроматографі Waters 2695-2996 high pressure liquid chromatography spectrometer (хроматографічна колонка Gimini C18 1504,6 мм). Реакції гідрування під тиском здійснювали за допомогою спектрометру Pau 3916EKX та QL hydrogen generator. Ультразвукові реакції здійснювали у реакторі CEM Discover-S 908860 microwave reactor. Доки не вказано протилежне, наступні реакції здійснювали в атмосфері азоту. Термін "атмосфера азоту" стосується стану, коли реакційна колба обладнана балоном з азотом об'ємом приблизно 1 л. Термін "атмосфера водню" стосується стану, коли реакційна колба обладнана балоном з воднем об'ємом приблизно 1 л. Доки не вказано протилежне, розчин, який використовують у наступних реакціях є водним розчином. Термін "ТШХ" стосується тонкошарової хроматографії. Приклад 1 2'-Гідрокси-3'-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]біфеніл-3-карбонова кислота N N OH N N H O OH O 1 40 OH Br Br Br стадія 1 OH O стадія 2 NO2 O 1g стадія 6 1h N N OH OH 1i O OH 8 12 OH OH O 1 1f 1f N N H O стадія OH H2N стадія 5 1e O + H2N 7 OH H2N 1d N N NH стадія стадія 4 O 1c H2N NH2 OH O2N NO2 1b 1a стадія 3 O O O HBr UA 101172 C2 5 10 15 20 25 30 35 40 45 50 55 60 Стадія 1 2-Бром-6-нітро-фенол Розчин об'ємом 60 мл концентрованої сірчаної кислоти, розведеної 186 мл води, охолоджували до кімнатної температури. Нітрат натрію (79,2 г, 0,932 моль) додавали до розчину. 2-Бром-фенол 1a (60 мл, 0,516 моль) краплями додавали на такому рівні, що температуру реакції підтримували на рівні нижче 25 °C. Реакційна суміш реагувала при кімнатній температурі протягом 2 годин та її контролювали за допомогою тонко шарової хроматографії (ТШХ) до зникнення вихідних матеріалів. Осад розчиняли у 320 мл етилацетату. Суміш промивали насиченим сольовим розчином, висушували над безводним сульфатом магнію, фільтрували та концентрували при пониженому тиску. Отриманий залишок очищали колонковою хроматографією на силікагелі для отримання вказаної у заголовку сполуки 2-бром6-нітро-фенолу 1b (48,2 г, вихід 42,8 %) як жовтої твердої речовини. МС m/z (ЕСІ): 218 [M+1] 1 H ЯМР (400 МГц, CDCl3): 6,88~7,02 (м, 1H), 7,89~7,91 (д, J=8 Гц, 1H), 8,12~8,15 (м, 1H), 11,18 (с, 1H) Стадія 2 1-Бром-2-метокси-3-нітро-бензол 2-Бром-6-нітро-фенол 1b (46,55 г, 0,214 моль) розчиняли у 500 мл ацетону після чого додавали карбонат калію (35,36 г, 0,256 моль) та йодометан (20,1 мл, 0,32 моль). Реакційну суміш кип'ятили зі зворотним холодильником при 70 °C протягом 40 годин. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Реакційну суміш концентрували при пониженому тиску та розводили 1300 мл етилацетату та 500 мл води. Водний шар екстрагували етилацетатом (300 мл2). Об'єднані органічні екстракти промивали 4 N хлорводневою кислотою та насиченим водним бікарбонатом натрію та потім висушували над безводним сульфатом магнію, фільтрували та концентрували при пониженому тиску. Отриманий залишок очищали колонковою хроматографією на силікагелі для отримання вказаної у заголовку сполуки 1-бром-2-метокси-3-нітро-бензол 1c (44,59 г, вихід 90,0 %) як коричневу тверду речовину. МС m/z (ЕСІ): 234 [M+1] Стадія 3 2'-Mетокси-3'-нітро-біфеніл-3-карбонова кислота 1-Бром-2-метокси-3-нітро-бензол 1c (23,25 г, 0,10 моль), 3-карбоксифенілборонову кислоту (19,5 г, 0,117 моль) та тетракіс(трифенілфосфін)паладію (8,86 г, 7,7 моль) розчиняли у суміші розчинників з 100 мл 2 N водного карбонату натрію та 500 мл 1,4-діоксану. Реакційну суміш кип'ятили зі зворотним холодильником при 105 °C протягом 43 годин. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш концентрували при пониженому тиску та після цього додавали 300 мл 6 N хлорводневої кислоти та 400 мл етилацетату. Водний шар екстрагували етилацетатом (200 мл2). Об'єднані органічні екстракти висушували над безводним сульфатом магнію, фільтрували та концентрували при пониженому тиску для отримання вказаної у заголовку сполуки 2'-метокси-3'-нітро-біфеніл-3-карбонової кислоти 1d (53,93 г) як світло-жовтої твердої речовини. МС m/z (ЕСІ): 272 [M-1] 1 H ЯМР (400 МГц, CDCl3): 3,44~3,46 (д, J=8 Гц, 3H), 7,42~7,46 (м, 1H), 7,63~7,67 (м, 1H), 7,21~7,75 (м, 1H), 7,82~7,84 (м, 1H), 7,90~7,92 (м, 1H), 8,01~8,03 (д, J=8 Гц, 1H), 8,11 (с, 1H) Стадія 4 2'-Mетокси-3'-аміно-біфеніл-3-карбонова кислота 2'-Mетокси-3'-нітро-біфеніл-3-карбонову кислоту 1d (0,48 г, 1,74 ммоль) розчиняли у 60 мл етанолу, після чого додавали 0,5 г паладію на вугіллі та форміату амонію (1,1 г, 17,4 ммоль). Реакційну суміш кип'ятили зі зворотним холодильником при 80 °C протягом 20 хв. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш фільтрували та фільтрат концентрували при пониженому тиску та висушували для отримання вказаної у заголовку сполуки 2'-метокси-3'-аміно-біфеніл-3-карбонової кислоти 1e (0,42 г, вихід 93,3 %) як білої твердої речовини. МС m/z (ЕСІ): 242 [M-1] Стадія 5 Гідробромід 3'-аміно-2'-гідрокси-біфеніл-3-карбонової кислоти 2'-Mетокси-3'-аміно-біфеніл-3-карбонову кислоту 1e (2,5 г, 10,3 ммоль) розчиняли у 100 мл бромводневої кислоти (40 %). Реакційну суміш кип'ятили зі зворотним холодильником при 120 °C протягом ночі, та реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш концентрували при пониженому тиску та отриманий залишок очищали 13 UA 101172 C2 5 10 15 20 25 30 35 40 45 50 колонковою хроматографією на силікагелі для отримання вказаної у заголовку сполуки гідроброміду 3'-аміно-2'-гідрокси-біфеніл-3-карбонової кислоти 1f (2,4 г, 88,8 %) як тверду речовину кольору хакі. МС m/z (ЕСІ): 230 [M+1] [Посилання: WO01/89457] Стадія 6 Індан-5-іл-гідразин Індан-5-іламін 1g (3,59 г, 27,0 ммоль) розчиняли у 20 мл концентрованої хлорводневої кислоти охолоджуючи на бані з льодом та суміш перемішували протягом 10 хв. 10 мл водного нітриту натрію (1,86 г, 27,0 ммоль) краплями додавали та суміш перемішували протягом ще 15 хв. та використовували у наступній реакції. Охолоджуючи на бані лід-сіль, дигідрат хлориду олова (24,4 г, 108,0 ммоль) розчиняли у 10 мл концентрованій хлорводневій кислоті, після чого додавали вищезгадану суміш. Реакційну суміш нагрівали до кімнатної температури та реакція тривала протягом 1,5 годин. Після цього рН суміші встановлювали на рівні 9 40 % водним розчином гідроксиду натрію, охолоджуючи на бані з льодом. Суміш екстрагували 400 мл етилацетату та комбіновані органічні екстракти концентрували при пониженому тиску та висушували для отримання вказаної у заголовку сполуки індан-5-іл-гідразин 1h (2,05 г, вихід 51,3 %) як червоно-коричневу тверду речовину. МС m/z (ЕСІ): 149 [M+1] Стадія 7 2-Індан-5-іл-5-метил-2,4-дигідро-піразол-3-он Індан-5-іл-гідразин 1h (2,05 г, 13,8 ммоль) розчиняли у 50 мл оцтової кислоти, після чого додавали етилацетоацетат (1,76 мл, 13,8 ммоль). Реакційну суміш was heated at 100 °C протягом ночі та реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш концентрували при пониженому тиску та отриманий залишок очищали колонковою хроматографією на силікагелі для отримання вказаної у заголовку сполуки 2-індан-5-іл-5-метил2,4-дигідро-піразол-3-он 1i (1,84 г, вихід 62,3 %) як жовтої твердої речовини. МС m/z (ЕСІ): 215 [M+1] 1 H ЯМР (400 МГц, CDCl3): 7,69 (с, 1H), 7,60 (д, J=8,0 Гц, 1H), 7,24 (д, J=8 Гц, 1H), 3,44 (с, 2H), 2,90~2,97 (м, 4H), 3,21 (с, 3H), 2,07~2,14 (м, 2H) Стадія 8 2'-Гідрокси-3'-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]біфеніл-3-карбонова кислота Охолоджуючи на бані лід-сіль, гідробромід 3'-аміно-2'-гідрокси-біфеніл-3-карбонової кислоти 1f (267 мг, 1,16 ммоль) розчиняли у 10 мл хлорводневої кислоти (1 N), після чого додавали 10 мл водного нітриту натрію (88 мг, 1,28 ммоль) та 2-індан-5-іл-5-метил-2,4-дигідро-піразол-3-он 1i (249 мг, 1,16 ммоль). рН суміші встановлювали на рівні 8 насиченим водним бікарбонатом натрію, після чого додавали 10 мл етанолу. Реакційну суміш нагрівали до кімнатної температури протягом ночі. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш фільтрували, висушували та перекристалізували з метанолу для отримання вказаної у заголовку сполуки 2'-гідрокси-3'-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4іліден)-гідразино]-біфеніл-3-карбонової кислоти 1 (60 мг, вихід 11,4 %) як жовтої твердої речовини. МС m/z (ЕСІ): 453 [M-1] 1 H ЯМР (400 МГц, ДМСO-d6): 2,03~2,10 (м, 2H), 2,34 (с, 3H), 2,86~2,93 (м, 4H), 7,13~7,17 (м, 2H), 7,28~7,30 (д, J=8,1 Гц, 1H), 7,60-7,82 (м, 5H), 7,96~7,98 (д, J=8,1 Гц, 1H), 8,13 (с, 1H), 9,66 (с, 1H), 13,03 (с, 1H), 13,76 (с, 1H) Приклад 2 5'-Фтор-2'-гідрокси-3'-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]біфеніл-3-карбонова кислота N N O OH N N H OH O F 2 14 UA 101172 C2 F Br F OH стадія 1 OH стадія 2 2b 5 10 15 20 25 30 35 40 45 стадія 4 OH O2 N OH 2d 2e N N O + OH 2f O N N OH H2N O OH 3 O2 N 2c O 5 стадія NO2 F стадія O O NO2 2a F Br F Br F стадія O 6 OH N N H OH O 1i 2 F Стадія 1 2-Бром-4-фтор-6-нітро-фенол 2-Бром-4-фтор-фенол 2a (8,0 г, 41,9 ммоль) розчиняли у 10 мл сірчаної кислоти (50 %), після чого додавали розчин нітрату натрію (7,1 г, 83,5 ммоль) у 24 мл сірчаної кислоти (25 %), охолоджуючи на бані з льодом. Реакційна суміш реагувала при кімнатній температурі протягом 1,5 годин, та реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш розводили 50 мл води та екстрагували етилацетатом (50 мл2). Об'єднані органічні екстракти промивали водою та насиченим водним бікарбонат натрію, та висушували над безводним сульфатом магнію, фільтрували та концентрували при пониженому тиску для отримання вказаної у заголовку сполуки 2-бром-4-фтор-6-нітро-фенолу 2b (8,0 г, вихід 80,8 %) як червоної твердої речовини, яку безпосередньо використовували на наступній стадії. Стадія 2 1-Бром-5-фтор-2-метокси-3-нітро-бензол 2-Бром-4-фтор-6-нітро-фенол 2b (24,7 г, 104,7 ммоль) та карбонат калію (17,34 г, 125,6 ммоль) розчиняли у 300 мл ацетону, після чого додавали йодометан (9,8 мл, 157,1 ммоль). Реакційну суміш кип'ятили зі зворотним холодильником при 80 °C протягом 22 годин. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш концентрували при пониженому тиску та розводили 200 мл етилацетату та 200 мл води. Водний шар екстрагували етилацетатом (100 мл2). Об'єднані органічні екстракти промивали 4 N хлорводневою кислотою та насиченим водним бікарбонатом натрію та висушували над безводним сульфатом магнію, фільтрували та концентрували при пониженому тиску. Отриманий залишок очищали колонковою хроматографією на силікагелі для отримання вказаної у заголовку сполуки 1-бром5-фтор-2-метокси-3-нітро-бензол 2c (16,18 г, вихід 61,8 %) як білої твердої речовини. МС m/z (ЕСІ): 252 [M+1] 1 H ЯМР (CDCl3): δ 3,99 (с, 3H), 7,81 (д, J=8,0 Гц, 1H), 7,28 (к, J=8,0 Гц, 4,0 Гц, 1H), 7,89 (к, J=8,0 Гц, 4,0 Гц, 1H) Стадія 3 5'-Фтор-2'-метокси-3'-нітро-біфеніл-3-карбонова кислота 1-Бром-5-фтор-2-метокси-3-нітро-бензол 2c (16,18 г, 64,7 ммоль), 3-карбоксифенілборонову кислоту (13,88 г, 77,7 ммоль) та тетракіс(трифенілфосфін)паладію (3,73 г, 3,2 ммоль) розчиняли у суміші розчинників 65 мл водного карбонату натрію (2 N) та 300 мл 1,4-діоксану. Реакційну суміш кип'ятили зі зворотним холодильником при 120 °C протягом 24 годин. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш концентрували при пониженому тиску та розводили 150 мл хлорводневої кислоти (6 N) та 200 мл етилацетату. Водний шар екстрагували етилацетатом (100 мл ×2). Об'єднані органічні екстракти висушували над безводним сульфатом магнію, фільтрували та концентрували при пониженому тиску для отримання вказаної у заголовку сполуки 5'-фтор-2'-метокси-3'-нітро-біфеніл-3-карбонової кислоти 2d (7,86 г, вихід 41,7 %) як жовтої твердої речовини. МС m/z (ЕСІ): 290 [M-1] Стадія 4 3'-Нітро-5'-фтор-2'-гідрокси- біфеніл-3-карбонова кислота 5'-Фтор-2'-метокси-3'-нітро-біфеніл-3-карбонова кислота 2d (2,91 г, 10,0 ммоль) розчиняли у 10 мл бромводневої кислоти (40 %). Реакційну суміш кип'ятили зі зворотним холодильником при 120 °C протягом ночі. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш концентрували при пониженому тиску та отриманий залишок очищали колонковою хроматографією на силікагелі для отримання вказаної у заголовку сполуки 3'-нітро 15 UA 101172 C2 5 10 15 20 25 30 5'-фтор-2'-гідрокси-біфеніл-3-карбонова кислота 2e (2,38 г, вихід 85,7 %) як жовтої твердої речовини, яку безпосередньо використовували на наступній стадії. МС m/z (ЕСІ): 277 [M-1] Стадія 5 3'-Аміно-5'-фтор-2'-гідрокси-біфеніл-3-карбонова кислота 3'-Нітро-5'-фтор-2'-гідрокси-біфеніл-3-карбонова кислота гідробромід 2e (417 мг, 1,5 ммоль) розчиняли у 60 мл етанолу після чого додавали 0,5 г паладію на вугіллі та форміату амонію (0,95 г, 1,5 ммоль). Реакційну суміш кип'ятили зі зворотним холодильником при 80 °C протягом 20 хв. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш фільтрували та фільтрат концентрували при пониженому тиску та висушували для отримання вказаної у заголовку сполуки 3'-аміно-5'-фтор-2'-гідрокси-біфеніл-3-карбонової кислоти 2f (339 мг, вихід 91,5 %) як пурпурної твердої речовини. МС m/z (ЕСІ): 246 [M-1] Стадія 6 5'-Фтор-2'-гідрокси-3'-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]біфеніл-3-карбонова кислота Охолоджуючи на бані з льодом, 3'-аміно-5'-фтор-2'-гідрокси-біфеніл-3-карбонова кислота 2f (296 мг, 1,20 ммоль) розчиняли у 10 мл хлорводневої кислоти (1 N) після чого додавали 10 мл водного нітриту натрію (91 мг, 1,32 ммоль) та 2-індан-5-іл-5-метил-2,4-дигідро-піразол-3-ону 1i (257 мг, 1,20 ммоль). рН суміші встановлювали на рівні 8 насиченим водним бікарбонатом натрію, після чого додавали 10 мл етанолу. Суміш нагрівали до кімнатної температури протягом ночі. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш фільтрували, висушували та перекристалізували з метанолу для отримання вказаної у заголовку сполуки 5'-фтор-2'-гідрокси-3'-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4іліден)-гідразино]-біфеніл-3-карбонової кислоти 2 (87 мг, вихід 14,1 %) як червоної твердої речовини. МС m/z (ЕСІ): 471 [M-1] 1 H ЯМР (400 МГц, ДМСO-d6): 2,02 (м, 2H), 2,34 (с, 3H), 2,87 (м, 4H), 7,03 (дд, J 1=9,2 Гц, J2=2,8 Гц, 1H), 7,28 (д, J=8,0 Гц, 1H), 7,48 (м, 1H), 7,61 (м, 2H), 7,76 (с, 1H), 7,83 (д, J=7,6 Гц, 1H), 7,98 (д, J=8,0 Гц, 1H), 8,17 (с, 1H), 9,59 (с, 1H), 13,03 (с, 1H), 13,62 (с, 1H) Приклад 3 2'-Гідрокси-3'-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафтален-2-іл)-1,5-дигідро-піразол-4іліден]-гідразино}-біфеніл-3-карбонова кислота N N OH N N H O OH O 3 H2N N N NH NH2 O стадія1 стадія + HN 2 2 N N O OH OH стадія 3 O OH N N H OH O . HBr 35 40 45 3g 3h 3i 1f 3 Стадія 1 (5,6,7,8-Тетрагідро-нафтален-2-іл)-гідразин 5,6,7,8-Тетрагідро-нафтален-2-іламін 3g (3,68 г, 25,0 ммоль) розчиняли у 20 мл концентрованої хлорводневої кислоти та суміш перемішували протягом 10 хв. охолоджуючи на бані з льодом. 10 мл водного нітриту натрію (1,72 г, 25,0 ммоль) краплями додавали та суміш перемішували протягом ще 15 хв. та використовували у наступній реакції. Охолоджуючи на бані лід-сіль, дигідрат хлориду олова (22,6 г, 100 ммоль) розчиняли у 10 мл концентрованої хлорводневої кислоти, після чого додавали вищезгадану суміш. Реакційну суміш нагрівали до кімнатної температури та дозволяли реагувати протягом 1,5 годин. Після цього pH суміші встановлювали на рівні 9 40 % водним розчином гідроксиду натрію. Суміш екстрагували 400 мл етилацетату, та комбіновані органічні екстракти концентрували при пониженому тиску та висушували для отримання вказаної у заголовку сполуки (5,6,7,8тетрагідро-нафтален-2-іл)-гідразину 3h (2,19 г, вихід 53,7 %) як жовтої олії. 16 UA 101172 C2 5 10 15 20 25 30 МС m/z (ЕСІ): 163 [M+1] Стадія 2 5-Метил-2-(5,6,7,8-тетрагідро-нафтален-2-іл)-2,4-дигідро-піразол-3-он (5,6,7,8-Тетрагідро-нафтален-2-іл)-гідразин 3h (2,0 г, 12,3 ммоль) розчиняли у 50 мл оцтової кислоти, після чого додавали етилацетоацетат (1,57 мл, 12,3 ммоль). Реакційну суміш нагрівали до 100 °C протягом ночі. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш концентрували при пониженому тиску, та отриманий залишок очищали колонковою хроматографією на силікагелі для отримання вказаної у заголовку сполуки 5-метил2-(5,6,7,8-тетрагідро-нафтален-2-іл)-2,4-дигідро-піразол-3-ону 3i (1,58 г, вихід 56,2 %) як безбарвної олії. МС m/z (ЕСІ): 457 [2M+1] 1 H ЯМР (400 МГц CDCl3): 7,54~7,58 (м, 2H), 7,08~7,10 (д, J=8 Гц, 1H), 3,43 (с, 2H), δ 2,77~2,81(м, 4H), 2,21 (с, 3H), 1,80~1,83 (м, 4H). Стадія 3 2'-Гідрокси-3'-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафтален-2-іл)-1,5-дигідро-піразол-4іліден]-гідразино}-біфеніл-3-карбонова кислота Охолоджуючи на бані з льодом, гідробромід 3'-аміно-2'-гідрокси-біфеніл-3-карбонової кислоти 1f (250 мг, 1,09 ммоль) розчиняли у 10 мл хлорводневої кислоти (1 N), після чого додавали 10 мл водного нітриту натрію (82 мг, 1,2 ммоль) та 5-метил-2-(5,6,7,8-тетрагідронафтален-2-іл)-2,4-дигідро-піразол-3-он 3i (249 мг, 1,09 ммоль). Після цього pH суміші встановлювали на рівні 8 насиченим водним бікарбонатом натрію, після чого додавали 10 мл етанолу. Реакцію нагрівали до кімнатної температури протягом ночі. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш фільтрували, висушували та перекристалізували з метанолом для отримання вказаної у заголовку сполуки 2'-гідрокси-3'-{N'[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафтален-2-іл)-1,5-дигідро-піразол-4-іліден]-гідразино}біфеніл-3-карбонової кислоти 3 (59 мг, вихід 11,6 %) як жовтої твердої речовини. МС m/z (ЕСІ): 467 [M-1] 1 H ЯМР (400 МГц, ДМСO-d6): 1,75(м, 4H), 2,33 (с, 3H), 2,70 (м, 4H), 7,13 (м, 3H), 7,36 (м, 1H), 7,60 (м, 2H), 7,71 (м, 1H), 7,75 (м, 1H), 7,97 (д, J=7,6 Гц, 1H), 8,14 (с, 1H), 9,66 (с, 1H), 13,03 (ш, 1H), 13,76 (с, 1H) Приклад 4 5'-Фтор-2'-гідрокси-3'-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафтален-2-іл)-1,5-дигідропіразол-4-іліден]-гідразино}-біфеніл-3-карбонова кислота N N N O HN OH OH O F 4 N N F N N O O + N O HN OH H2 N OH OH OH 35 40 45 3i O 2f 4 F Охолоджуючи на бані з льодом, 3'-аміно-5'-фтор-2'-гідрокси-біфеніл-3-карбонову кислоту 2f (250 мг, 1,01 ммоль) розчиняли у 10 мл хлорводневої кислоти (1 N), після чого додавали 10 мл водного нітриту натрію (77 мг, 1,12 ммоль) та 5-метил-2-(5,6,7,8-тетрагідро-нафтален-2-іл)-2,4дигідро-піразол-3-он 4i (230 мг, 1,01 ммоль). рН суміші встановлювали на рівні 8 насиченим водним бікарбонат натрію, після чого додавали 10 мл етанолу. Реакцію нагрівали до кімнатної температури протягом ночі та контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш фільтрували, висушували та перекристалізували з метанолом для отримання вказаної у заголовку сполуки 5'-фтор-2'-гідрокси-3'-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідронафтален-2-іл)-1,5-дигідро-піразол-4-іліден]-гідразино}-біфеніл-3-карбонової кислоти 4 (64 мг, вихід 13,1 %) як червоної твердої речовини. 17 UA 101172 C2 5 МС m/z (ЕСІ): 485 [M-1] 1 H ЯМР (400 МГц, ДМСO-d6): 1,74 (м, 4H), 2,33 (с, 1H), 2,73 (м, 4H), 7,02 (дд, J 1=9,2 Гц, J2=2,0 Гц, 1H), 7,11 (д, d=8,0 Гц, 1H), 7,47 (м, 1H), 7,63 (м, 3H), 7,82 (д, J=7,6 Гц, 1H), 7,98 (д, J=7,6 Гц, 1H), 8,18 (с, 1H), 9,58 (с, 1H), 13,05 (с, 1H), 13,62 (с, 1H) Приклад 5 3'-[N'-(1-Біцикло[4,2,0]окта-1(6),2,4-триєн-3-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)гідразино]-2'-гідрокси-біфеніл-3-карбонова кислота N N N O HN OH OH O 5 O O Br H N N O 5a 10 15 20 25 30 35 40 45 стадія стадія 2 5b 5c N O HN O O стадія 1 N N N N 3 стадія 5d OH OH O 4 5 Стадія 1 3-Бром-біцикло[4,2,0]окта-1(6),2,4-триєн Біцикло[4,2,0]окта-1(6),2,4-триєн 5a (7,9 г, 76 ммоль) розчиняли у 80 мл води при кімнатній температурі. Охолоджуючи на бані з льодом, 3,9 мл брому краплями додавали. При завершенні додавання, баню з льодом видалили та реакційну суміш нагрівали до кімнатної температури та перемішували протягом ночі. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш розводили 50 мл н-гексану та додавали сульфіт натрію (3 г, 23,8 ммоль). При закінченні додавання, суміш перемішували при кімнатній температурі протягом 30 хв. Потім відділений органічний шар висушували над безводним сульфатом натрію, фільтрували для видалення висушуючого агента та концентрували при пониженому тиску для отримання вказаної у заголовку сполуки 3-бром-біцикло[4,2,0]окта-1(6),2,4-триєн 5b (13,53 г) як безбарвної олії, яку безпосередньо використовували на наступній стадії. МС m/z (ЕСІ): 181,8 [M-1] Стадія 2 N-(біцикло[4,2,0]окта-1(6),2,4-триеніл-3-іл)-N'-(трет-бутоксикарбоніл-гідразино)-трет-бутилкарбонат 3-Бром-біцикло[4,2,0]окта-1(6),2,4-триєн 5b (13,5 г, 73,8 ммоль) розчиняли у 100 мл сухого тетрагідрофурану. Суміш охолоджували до -78 °C на сухій бані лід-етанол, та після цього додавали н-бутиллітію (66 мл, 165 ммоль). Розчин ди-трет-бутил азодикарбоксилату (20,1 г, 87,4 ммоль) у 80 мл сухого тетрагідрофурану краплями додавали перемішуючи при тій самій температурі. При закінченні додавання, суху баню лід-етанол видаляли, та суміш нагрівали до кімнатної температури та перемішували протягом ночі. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Реакцію гасили 100 мл води та шари розділяли. Водний шар екстрагували етилацетатом (100 мл2). Об'єднані органічні екстракти промивали насиченим сольовим розчином (150 мл1), висушували над безводним сульфатом натрію та фільтрували для видалення осушника. Фільтрат очищали колонковою хроматографією на силікагелі для отримання вказаної у заголовку сполуки N-(біцикло[4,2,0]окта-1(6),2,4-триеніл-3іл)-N'-(трет-бутоксикарбоніл-гідразино)-трет-бутил-карбонату 5c (4,07 г, 16,5 %) як жовтої олії. Стадія 3 2-Біцикло[4,2,0]окта-1(6),2,4-триеніл-3-іл-5-метил-2,4-дигідро-піразол-3-он N-(біцикло[4,2,0]окта-1(6),2,4-триеніл-3-іл)-N'-(трет-бутоксикарбоніл-гідразино)-трет-бутилкарбонат 5c (4,0 г, 12 ммоль) розчиняли у 30 мл оцтової кислоти, після чого додавали 30 мл трифтороцтової кислоти та суміш перемішували при кімнатній температурі протягом 30 хв., після чого додавали метиловий естер 3-оксо-бутанової кислоти (1,6 мл, 15 ммоль). Реакційну суміш перемішували при 100 °C протягом 1,5 годин, нагріваючи на олійній бані. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Розчинник випаровували при пониженому тиску до сухості. Потім групою додавали 100 мл води, 60 мл етилацетату та карбонату натрію (3 г). При закінченні додавання, шари розділяли. Водний шар екстрагували 18 UA 101172 C2 5 10 15 20 25 етилацетатом (40 мл2). Об'єднані органічні екстракти промивали насиченим сольовим розчином (100 мл1), висушували над безводним сульфатом натрію, фільтрували для видалення осушника та концентрували при пониженому тиску. Залишок очищали колонковою хроматографією на силікагелі для отримання вказаної у заголовку сполуки 2-біцикло[4,2,0]окта1(6),2,4-триеніл-3-іл-5-метил-2,4-дигідро-піразол-3-ону 5d (910 мг, 37,9 %) як жовтої твердої речовини. МС m/z (ЕСІ): 201,2 [M+1] Стадія 4 3'-[N'-(1-Біцикло[4,2,0]окта-1(6),2,4-триєн-3-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)гідразино]-2'-гідрокси-біфеніл-3-карбонова кислота Гідробромід 3'-аміно-2'-гідрокси-біфеніл-3-карбонову кислоту 1f (258 мг, 0,83 ммоль) розчиняли у 10 мл хлорводневої кислоти (1 N), після чого додавали 10 мл водного нітриту натрію (63 мг, 0,92 ммоль) та 2-біцикло[4,2,0]окта-1(6),2,4-триеніл-3-іл-5-метил-2,4-дигідропіразол-3-ону 5d (150 мг, 0,75 ммоль) охолоджуючи на бані з льодом. рН суміші встановлювали на рівні 8 насиченим водним бікарбонату натрію, після чого додавали 10 мл етанолу. Реакційну суміш нагрівали до кімнатної температури протягом ночі та контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш фільтрували та залишок на фільтрі розчиняли у 30 мл води та pH встановлювали на рівні приблизно 3~4 концентрованою хлорводневою кислотою. Після цього суміш фільтрували та залишок на фільтрі промивали дихлорметаном (8 мл). Залишок висушували для отримання вказаної у заголовку сполуки 3'-[N'-(1-біцикло[4,2,0]окта1(6),2,4-триєн-3-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]-2'-гідрокси-біфеніл-3карбонової кислоти 5 (198 мг, 60 %) як червоної твердої речовини. МС m/z (ЕСІ): 439,5 [M-1] 1 H ЯМР (400 МГц, ДМСO-d6): 2,33 (с, 3H), 3,16 (м, 4H), 7,14 (м, 3H), 7,64 (м, 2H), 7,79 (м, 2H), 7,80 (м, 1H), 7,98 (м, 1H), 8,18 (с, 1H), 9,61 (с, 1H), 12,93 (ш, 1H), 13,75 (ш, 1H) Приклад 6 Етиловий естер 5-(2-гідрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафтален-2-іл)-1,5дигідро-піразол-4-іліден]-гідразино}-феніл)-1,2,4-триметил-1H-пірол-3-карбонової кислоти O N N O N O HN OH N 6 Br O B O O стадія 1 NO2 NO2 1c O 6a O O O стадія N H O O O O HO 2 O стадія N H 6b 3 O N 6g 30 35 I N H 6d O 6 O стадія 6c стадія 7 OH N O I . HBr O 6a стадія 5 O2 N O N стадія 8 N O 6f O N N H2 N O 4 6e O H2 N стадія O O O N O HN OH N 6h 6 Стадія 1 2-(2-Mетокси-3-нітро-феніл)-4,4,5,5-тетраметил-[1,3,2]діоксаборолан 1-Бром-2-метокси-3-нітро-бензол 1c (67 г, 0,289 моль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-бі1,3,2-діоксаборолан (110 г, 0,433 моль), тетракіс(трифенілфосфін)паладію (11,80 г, 14,44 ммоль) та ацетат калію (71 г, 0,724 моль) розчиняли у 600 мл диметилового етеру етиленгліколю. Суміш кип'ятили зі зворотним холодильником протягом 17 годин. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш концентрували при пониженому тиску та залишок очищали колонковою хроматографією на силікагелі для 19 UA 101172 C2 5 10 15 20 25 30 35 40 45 50 55 60 отримання вказаної у заголовку сполуки 2-(2-метокси-3-нітро-феніл)-4,4,5,5-тетраметил[1,3,2]діоксаборолану 6a (50,5 г, 61,9 %) як жовтих кристалів. Стадія 2 4-Етиловий естер 3,5-диметил-1H-пірол-2,4-дикарбонової кислоти 3,5-Диметил-1H-пірол-2,4-дикарбонова кислота 2-трет-бутиловий естер 4-етиловий естер 6b (5,34 г, 20 ммоль) розчиняли у трифтороцтовій кислоті (7,4 мл, 100 ммоль) та суміш перемішували протягом 2 годин. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Потім додавали 40 мл води. Суміш фільтрували та залишок на фільтрі промивали дихлорметаном та висушували для отримання вказаної у заголовку сполуки 4етиловий естер 3,5-диметил-1H-пірол-2,4-дикарбонової кислоти 6c (3,65 г, вихід 86,5 %) як рожевої твердої речовини. МС m/z (ЕСІ): 209,8 [M-1] Стадія 3 Етиловий естер 5-йод-2,4-диметил-1H-пірол-3-карбонової кислоти 4-Етиловий естер 3,5-диметил-1H-пірол-2,4-дикарбонової кислоти 6c (3,65 г, 17,3 ммоль) розчиняли у суміші розчинників з 100 мл дихлорметану та 10 мл води після чого додавали йодид калію (11,5 г, 69,2 ммоль) та йод (4,39 г, 17,3 ммоль). При закінченні додавання, реакційну суміш кип'ятили зі зворотним холодильником протягом 2 годин. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш охолоджували до кімнатної температури та після цього додавали 20 мл води та 10 мл тіосульфату натрію (2 M). Суміш екстрагували дихлорметаном (30 мл3). Об'єднані органічні екстракти промивали насиченим сольовим розчином, висушували над безводним сульфатом магнію, фільтрували для видалення осушника та концентрували при пониженому тиску для отримання вказаної у заголовку сполуки етилового естеру 5-йод-2,4-диметил-1H-пірол-3-карбонової кислоти 6d (4,1 г, вихід 80,8 %) як оранжевої твердої речовини. Стадія 4 Етиловий естер 5-йод-1,2,4-триметил-1H-пірол-3-карбонової кислоти Етиловий естер 5-йод-2,4-диметил-1H-пірол-3-карбонової кислоти 6d (4,1 г, 13,99 ммоль) розчиняли у 80 мл тетрагідрофурану, після чого додавали метиловий естер 4-метилбензолсульфонової кислоти (2,73 г, 14,69 ммоль) та трет-бутоксид натрію (2,02 г, 20,99 ммоль). При закінченні додавання, реакційну суміш перемішували протягом 0,5 годин та контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш фільтрували та залишок на фільтрі промивали тетрагідрофураном. Фільтрат концентрували при пониженому тиску для отримання вказаної у заголовку сполуки етилового естеру 5-йод-1,2,4-триметил-1H-пірол-3-карбонової кислоти 6e (3,8 г, вихід 88,6 %) як сірої твердої речовини. МС m/z (ЕСІ): 308,1 [M+1] 1 H ЯМР (400 МГц, CDCl3): 4,287~4,340 (к, 2H), 3,561 (с, 3H), 2,618 (с, 3H), 2,888 (с, 3H), 1,369-1,405 (т, 3H) Стадія 5 Етиловий естер 5-(3-Нітро-2-метокси-феніл)-1,2,4-триметил-1H-пірол-3-карбонової кислоти Етиловий естер 5-йод-1,2,4-триметил-1H-пірол-3-карбонової кислоти 6e (2,88 г, 9,38 ммоль) розчиняли у 25 мл 1,4-діоксану, після чого додавали 2-(2-метокси-3-нітро-феніл)-4,4,5,5тетраметил-[1,3,2]діоксаборолан 6a (3,6 г, 10,3 ммоль), тетракіс(трифенілфосфін)паладію (270 мг, 0,234 ммоль), карбонат натрію (1,99 г, 18,77 ммоль) та 10 мл води. При закінченні додавання, реакційну суміш кип'ятили зі зворотним холодильником протягом 3 годин. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш охолоджували до кімнатної температури після чого додавали 30 мл води та екстрагували етилацетатом (30 мл3). Об'єднані органічні екстракти промивали насиченим сольовим розчином, висушували над безводним сульфатом магнію, фільтрували для видалення осушника та концентрували при пониженому тиску для отримання вказаної у заголовку сполуки етилового естеру 5-(3-нітро-2метокси-феніл)-1,2,4-триметил-1H-пірол-3-карбонової кислоти 6f (1,25 г, вихід 40,4 %) як жовтої олії. МС m/z (ЕСІ): 333,2 [M+1] 1 H ЯМР (400 МГц, CDCl3): 7,817~7,841 (м, 1H), 7,457~7,476 (м, 1H), 7,284~7,324 (м, 1H), 4,322~4,375 (к, 2H), 3,521 (с, 3H), 3,316 (с, 3H), 2,625 (с, 3H), 2,177 (с, 3H), 1,398~1,434 (т, 3H) Стадія 6 Етиловий естер 5-(3-аміно-2-метокси-феніл)-1,2,4-триметил-1H-пірол-3-карбонової кислоти Етиловий естер 5-(3-Нітро-2-метокси-феніл)-1,2,4-триметил-1H-пірол-3-карбонової кислоти 6f (300 мг, 0,9 ммоль) розчиняли у 5 мл етилацетату після чого додавали формамід (227 мг, 1,61 ммоль) та 60 мг паладію на вугіллі. Реакційну суміш кип'ятили зі зворотним холодильником 20 UA 101172 C2 5 10 15 20 25 30 35 40 45 протягом години. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш фільтрували та залишок на фільтрі промивали етилацетатом. Фільтрат концентрували при пониженому тиску для отримання вказаної у заголовку сполуки етилового естеру 5-(3-аміно2-метокси-феніл)-1,2,4-триметил-1H-пірол-3-карбонової кислоти 6g (234 мг, вихід 86 %) як білої твердої речовини. МС m/z (ЕСІ): 303,4 [M+1] 1 H ЯМР (400 МГц, CDCl3): 6,968~7,006 (м, 1H), 6,817~6,840 (м, 1H), 6,595~6,618 (м, 1H), 4,311~4,364 (к, 2H), 3,381 (с, 3H), 3,315 (с, 3H), 2,615 (с, 3H), 2,181 (с, 3H), 1,391~1,426 (т, 3H) Стадія 7 Гідробромід етилового естеру 5-(3-Аміно-2-гідрокси-феніл)-1,2,4-триметил-1H-пірол-3карбонової кислоти Етиловий естер 5-(3-аміно-2-метокси-феніл)-1,2,4-триметил-1H-пірол-3-карбонової кислоти 6g (210 мг, 0,69 ммоль) розчиняли у 5 мл дихлорметану, після чого додавали трибромід бору (1,39 мл, 2,78 ммоль). Реакційна суміш реагувала при кімнатній температурі протягом 0,5 годин та контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Реакцію гасили метанол, та суміш концентрували при пониженому тиску після чого додавали 50 мл етилацетату та 15 мл насиченого водного бікарбонату натрію. Суміш добре перемішували та шари розділяли. Органічний шар промивали насиченим сольовим розчином, висушували над безводним сульфатом магнію, фільтрували для видалення осушника та концентрували при пониженому тиску для отримання вказаної у заголовку сполуки гідроброміду етилового естеру 5-(3-аміно-2-гідрокси-феніл)-1,2,4-триметил-1H-пірол-3-карбонової кислоти 6h (165 мг, вихід 82,5 %) як білої твердої речовини. МС m/z (ЕСІ): 289,3 [M+1] 1 H ЯМР (400 МГц, ДМСO-d6): 7,313~7,396 (м, 1H), 7,098~7,117 (м, 1H), 6,993~7,032 (м, 1H), 4,173~4,227 (к, 2H), 3,221 (с, 3H), 1,979 (с, 3H), 1,242~1,295 (т, 3H) Стадія 8 Етиловий естер 5-(2-Гідрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафтален-2-іл)-1,5дигідро-піразол-4-іліден]-гідразино}-феніл)-1,2,4-триметил-1H-пірол-3-карбонової кислоти Гідробромід етилового естеру 5-(3-Аміно-2-гідрокси-феніл)-1,2,4-триметил-1H-пірол-3карбонової кислоти 6h (140 мг, 0,51 ммоль) розчиняли у 1,76 мл хлорводневої кислоти (1 N), після чого додавали 1 мл водного нітриту натрію (39 мг, 0,56 ммоль) та суміш перемішували протягом 20 хв., охолоджуючи на бані з льодом. Потім додавали 5-метил-2-(5,6,7,8-тетрагідронафтален-2-іл)-2,4-дигідро-піразол-3-он 3i (105 мг, 0,46 ммоль). рН суміші встановлювали на рівні 8 насиченим водним бікарбонатом натрію, після чого додавали 1 мл етанолу. Реакцію нагрівали до кімнатної температури протягом ночі. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш фільтрували та залишок на фільтрі висушували та після цього розчиняли у дихлорметані. Після цього суміш промивали насиченим сольовим розчином та органічний шар концентрували при пониженому тиску. Залишок очищали колонковою хроматографією на силікагелі для отримання вказаної у заголовку сполуки етилового естеру 5-(2-гідрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафтален-2-іл)-1,5дигідро-піразол-4-іліден]-гідразино}-феніл)-1,2,4-триметил-1H-пірол-3-карбонової кислоти 6 (120 мг, 50,8 %) як червоної твердої речовини. МС m/z (ЕСІ): 514,1 [M+1] 1 H ЯМР (400 МГц, ДМСO-d6): 1,84 (м, 4H), 2,14 (с, 3H), 2,41 (с, 3H), 2,57 (с, 3H), 2,80 (м, 4H), 3,34 (с, 3H), 3,87 (с, 3H), 6,51 (м, 1H), 7,00 (д, J=7,6 Гц, 1H), 7,11 (м, 2H), 7,71 (м, 2H), 13,82 (ш, 1H) Приклад 7 3'-{N'-[1-(2,3-Дигідро-бензофуран-5-іл)-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден]гідразино}-2'-гідрокси-біфеніл-3-карбонова кислота N N O O N N H OH OH O 50 7 21 UA 101172 C2 Cl Cl Cl O HN N O O Cl Cl Cl N N O O стадія1 O стадія O 2 OH + H2N OH O стадія HBr 7a 5 10 15 20 25 30 35 40 45 7b 7c N N O O O N N H OH OH O 3 7 1f Стадія 1 Біс(2,2,2-трихлоретил) 1-(2,3-дигідробензофуран-5-іл)гідразин-1,2-дикарбоксилат 2,3дигідро-бензофуран 7a (0,6 мл, 5,32 ммоль), біс(2,2,2-трихлоретил) гідразин-1,2-дикарбоксилат (1,96 г, 5,15 ммоль) та хлорид цинку (920 мг, 6,76 ммоль) розчиняли у 40 мл дихлорметану. Реакція тривала протягом ночі при кімнатній температурі та її контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Після цього суміш очищали колонковою хроматографією на силікагелі для отримання вказаної у заголовку сполуки біс(2,2,2-трихлоретил) 1-(2,3дигідробензофуран-5-іл)гідразин-1,2-дикарбоксилат 7b (2,5 г, вихід 96,6 %) як білої твердої речовини. Стадія 2 2-(2,3-Дигідро-бензофуран-5-іл)-5-метил-2,4-дигідро-піразол-3-он Біс(2,2,2-трихлоретил) 1-(2,3-дигідробензофуран-5-іл)гідразин-1,2-дикарбоксилат 7b (2,9 г, 5,8 ммоль) розчиняли у 50 мл етанолу та 5 мл метанолу після чого додавали цинковий пил (10,8 г, 166 ммоль) та водний розчин ацетату амонію (15 мл, 1 моль/л) та суміш реагувала при кімнатній температурі протягом години. Потім краплями додавали етилацетоацетат (0,75 мл, 5,9 ммоль). Реакційну суміш кип'ятили зі зворотним холодильником протягом 2 годин. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Реакцію охолоджували до кімнатної температури та фільтрували. Фільтрат концентрували при пониженому тиску та залишок очищали колонковою хроматографією на силікагелі для отримання вказаної у заголовку сполуки 2-(2,3-дигідро-бензофуран-5-іл)-5-метил-2,4-дигідро-піразол-3-ону 7c (706 мг, вихід 56,5 %) як жовтої твердої речовини. МС m/z (ЕСІ): 217 [M+1] 1 H ЯМР (400 МГц, CDCl3): 7,63 (с, 1H), 7,51 (д, J=1,2 Гц, 1H), 6,78 (д, J=8,8 Гц, 1H), 4,57 (т, J=8,8 Гц, 2H), 3,39 (с, 2H), 3,22 (т, J=8,4 Гц, 2H), 2,16 (с, 3H) Стадія 3 3'-{N'-[1-(2,3-Дигідро-бензофуран-5-іл)-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден]гідразино}-2'-гідрокси-біфеніл-3-карбонова кислота Гідробромід 3'-аміно-2'-гідрокси-біфеніл-3-карбонової кислоти 1f (155 мг, 0,5 ммоль) розчиняли у 1,7 мл хлорводневої кислоти (1 N), після чого краплями додавали 0,6 мл водного нітриту натрію (36 мг, 0,53 ммоль) та суміш перемішували протягом 10 хв. охолоджуючи на бані з льодом. Потім додавали 2-(2,3-дигідро-бензофуран-5-іл)-5-метил-2,4-дигідро-піразол-3-он 7c (97 мг, 0,45 ммоль). рН суміші встановлювали на рівні 7 поступовим додаванням насиченого водного бікарбонату натрію (630 мг, 7,5 ммоль). Реакційну суміш нагрівали до кімнатної температури протягом ночі. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. рН суміші встановлювали на рівні < 5 концентруваної хлорводневої кислоти. Суміш фільтрували та висушували для отримання вказаної у заголовку сполуки 3'-{N'-[1-(2,3-дигідробензофуран-5-іл)-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден]-гідразино}-2'-гідрокси-біфеніл-3карбонової кислоти 7 (131 мг, вихід 63,9 %) як коричневу тверду речовину. МС m/z (ЕСІ): 455 [M-1] 1 H ЯМР (400 МГц, ДМСO-d6): 2,33 (с, 3H), 3,24 (т, J=8,4 Гц, 2H), 4,56 (т, J=8,4 Гц, 2H), 6,82 (д, J=8,4 Гц, 1H), 7,16 (м, 2H), 7,61 (м, 2H), 7,72 (м, 2H), 7,80 (д, J=8,0 Гц, 1H), 7,96 (д, J=8,0 Гц, 1H), 8,13 (д, J=1,6 Гц, 1H), 9,64 (с, 1H), 13,01 (с, 1H), 13,75 (с, 1H) Приклад 8 2-(3,3-Диметил-індан-5-іл)-4-{[2-гідрокси-3'-(1H-тетразол-5-іл)-біфеніл-3-іл]-гідразоно}-5метил-2,4-дигідро-піразол-3-он 22 UA 101172 C2 N N N O HN OH H N N N N 8 N N N Br стадія 8a 2 N H O 8b N N N N N H стадія 1 N N N N N Br стадія 3 OH OH 4 8d 8c N H O2N стадія N N N N H стадія N 5 N H H2N OH 8e HCl 8f O HN N Br O O N N O 8g 5 10 15 20 25 30 35 40 6 стадія 8h 7 + 8i N O HN N N H H2N стадія N N N N O OH 8f стадія . HCl OH H N N N N 8 8 Стадія 1 5-(3-Бром-феніл)-1H-тетразол 3-Бром-бензонітрил 8a (18,2 г, 0,1 моль) та хлорид амонію (5,9 г, 0,11 моль) розчиняли у 80 мл N, N'-диметилформаміду, після чого додавали азид натрію (7,16 г, 0,11 моль) в атмосфері аргону. Реакційну суміш нагрівали до 100 °C та залишали реагувати протягом ночі. Після цього суміш охолоджували до 60 °C та концентрували при пониженому тиску щоб видалити N, N'диметилформамід. Залишок розводили 100 мл води та 4 мл концентрованої хлорводневої кислоти та перемішували протягом години. Суміш фільтрували та висушували для отримання вказаної у заголовку сполуки 5-(3-бром-феніл)-1H-тетразол 8b (23 g) як білої твердої речовини. Стадія 2 5-(2'-Mетокси-біфеніл-3-іл)-1H-тетразол 5-(3-Бром-феніл)-1H-тетразол 8b (20 г, 89 ммоль) та 2-метоксибензолборонову кислоту (14,2 г, 93,3 ммоль) розчиняли у 530 мл 1,4-діоксану після чого додавали тетракіс(трифенілфосфін)паладію (1,84 г) та карбонату натрію (18,9 г, 178 ммоль) в атмосфері аргону. Реакційну суміш кип'ятили зі зворотним холодильником протягом ночі. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш концентрували при пониженому тиску щоб видалити 1,4-діоксан, та після цього додавали хлорводневу кислоту (200 мл, 6 моль/л). Суміш охолоджували протягом 2 годин та шари розділяли. Органічний шар збирали та концентрували. Залишок розчиняли у 500 мл етилацетату та промивали 250 мл води. Суміш висушували над безводним сульфатом натрію та концентрували при пониженому тиску. Залишок розчиняли у 25 мл етилацетату та залишали стояти протягом ночі. Суміш фільтрували для отримання вказаної у заголовку сполуки 5-(2'-метокси-біфеніл-3-іл)-1Hтетразолу 8c (15 г, вихід 68,2 %) як світло-жовтої твердої речовини. Стадія 3 3'-(1H-Тетразол-5-іл)-біфеніл-2-oл 5-(2'-Mетокси-біфеніл-3-іл)-1H-тетразол 8c (15,5 г, 61,5 моль) розчиняли у 195 мл оцтової кислоти, після чого додавали 195 мл бромводневої кислоти в атмосфері аргону. Реакційну суміш кип'ятили зі зворотним холодильником протягом 5 годин. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш охолоджували до кімнатної температури протягом ночі. Суміш фільтрували та залишок на фільтрі розчиняли у 500 мл етилацетату. Суміш промивали водою (500 мл×2), висушували над безводним сульфатом натрію, фільтрували та концентрували при пониженому тиску. Залишок перекристалізували з 100 мл етилацетату для отримання вказаної у заголовку сполуки 3'-(1H-тетразол-5-іл)-біфеніл2-oлу 8d (12 г, вихід 82,8 %) як білої твердої речовини. Стадія 4 3-Нітро-3'-(1H-тетразол-5-іл)-біфеніл-2-oл 3'-(1H-Тетразол-5-іл)-біфеніл-2-oл 8d (3,5 г, 14,7 ммоль) розчиняли у 145 мл етанолу в атмосфері аргону. Азотну кислоту, що димить (0,565 мл, 13,2 ммоль) краплями додавали при 35 °C. Після того як реакційна суміш реагувала при кімнатній температурі протягом години, додавали 150 мл води. Після відстоювання протягом ночі, суміш фільтрували. Осад на фільтрі 23 UA 101172 C2 5 10 15 20 25 30 35 40 45 50 55 промивали 100 мл води та розчиняли у 500 мл етилацетату та 250 мл води. Окремий органічний шар промивали насиченим сольовим розчином та висушували над безводним сульфатом магнію. Суміш очищали колонковою хроматографією на силікагелі для отримання вказаної у заголовку сполуки 3-нітро-3'-(1H-тетразол-5-іл)- біфеніл-2-oлу 8e (1 г, вихід 27,0 %) як жовтої твердої речовини. МС m/z (ЕСІ): 282 [M-1] Стадія 5 Гідрохлорид 3-аміно-3'-(1H-тетразол-5-іл)-біфеніл-2-oлу 3-Нітро-3'-(1H-тетразол-5-іл)-біфеніл-2-oл 8e (2,5 г, 8,83 ммоль) розчиняли у 118 мл етанолу та 78,6 мл води, після чого додавали водний гідроксид натрію (2,95 мл, 3 моль/л) та 313 мг паладію на вугіллі. Суміш гідрували протягом 3 годин у реакторі для гідрування при 3 атм. водню. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш фільтрували та після цього до фільтрату додавали хлорводневу кислоту (60 мл, 3 моль/л). Фільтрат концентрували при пониженому тиску. Залишок розводили невеликою кількістю води та фільтрували. Осад на фільтрі промивали водою та н-гексаном та висушували для отримання вказаної у заголовку сполуки 3-аміно-3'-(1H-тетразол-5-іл)-біфеніл-2-oл гідрохлориду 8f (2,33 g) як коричневу тверду речовину. МС m/z (ЕСІ): 252 [M+1] Стадія 6 Ди-трет-бутил 1-(3,3-диметил-2,3-дигідро-1Н-інден-5-іл)гідразин-1,2-дикарбоксилат 6-Бром-1,1-диметил-індан (WO2005066115) 8g (4,32 г, 19,27 ммоль) розчиняли у 40 мл тетрагідрофурану та після цього бутиллітію (15,67 мл, 1,6моль/л, 25,05 ммоль) краплями додавали при -78 °C. Після того як реакційна суміш реагувала протягом 40 хв., додавали розчин ди-трет-бутил азодикарбоксилату (5,32 г, 23,12 ммоль) у 30 мл тетрагідрофурану. Реакційна суміш реагувала протягом ще 3 годин при -78 °C. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів та гасили 5 мл метанолу. Суміш нагрівали до кімнатної температури та фільтрували на силікагелі. Фільтрат концентрували при пониженому тиску та залишок очищали колонковою хроматографією на силікагелі для отримання вказаної у заголовку сполуки ди-трет-бутил 1-(3,3-диметил-2,3-дигідро-1Н-інден-5-іл)гідразин-1,2дикарбоксилату 8h (2,70 г, вихід 37,2 %) як жовтої твердої речовини. Стадія 7 2-(3,3-Диметил-індан-5-іл)-5-метил-2,4-дигідро-піразол-3-он Ди-трет-бутил 1-(3,3-диметил-2,3-дигідро-1H-інден-5-іл)гідразин-1,2-дикарбоксилат 8h (2,70 г, 7,18 ммоль) розчиняли у 100 мл оцтової кислоти, після чого додавали 20 мл трифтороцтової кислоти. Після того як суміш реагувала при кімнатній температурі протягом 2 годин, додавали етилацетоацетат (0,98 г, 7,54 ммоль). Після цього суміш нагрівали до 100 °C та вона реагувала протягом 2 годин. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш охолоджували до кімнатної температури та концентрували при пониженому тиску щоб видалити оцтову кислоту. Реакційну суміш нейтралізували насиченим водним бікарбонатом натрію. Після цього суміш екстрагували етилацетатом. Об'єднані органічні екстракти промивали насиченим сольовим розчином, висушували над безводним сульфатом натрію, фільтрували та концентрували при пониженому тиску. Отриманий залишок очищали колонковою хроматографією на силікагелі для отримання вказаної у заголовку сполуки 2-(3,3диметил-індан-5-іл)-5-метил-2,4-дигідро-піразол-3-ону 8i (1,0 г, вихід 47,7 %) як світлокоричневої твердої речовини. МС m/z (ЕСІ): 243 [M+1] Стадія 8 2-(3,3-Диметил-індан-5-іл)-4-{[2-гідрокси-3'-(1H-тетразол-5-іл)-біфеніл-3-іл]-гідразоно}-5метил-2,4-дигідро-піразол-3-он 3-Аміно-3'-(1H-тетразол-5-іл)-біфеніл-2-oл гідрохлорид 8f (290 мг, 1,0 ммоль) розчиняли у хлорводневій кислоті (3,4 мл, 1 моль/л), після чого краплями додавали 1,2 мл водний нітрит натрію (73 мг, 1,05 ммоль) охолоджуючи на бані з льодом. Після того як суміш реагувала при кімнатній температурі протягом 10 хв., посдіовно додавали 2-(3,3-диметил-індан-5-іл)-5-метил2,4-дигідро-піразол-3-он 8i (218 мг, 0,9 ммоль), бікарбонат натрію (1,26 г, 15 ммоль) та 4,4 мл етанол. Потім реакційну суміш реагувала протягом 10 годин. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш фільтрували та залишок на фільтрі промивали 20 мл води та після цього розчиняли у 20 мл води. Охолоджуючи на бані з льодом, pH суміші встановлювали на рівні < 5 концентрованою хлорводневою кислотою. Суміш фільтрували та висушували для отримання вказаної у заголовку сполуки 2-(3,3-диметил-індан 24 UA 101172 C2 5 5-іл)-4-{[2-гідрокси-3'-(1H-тетразол-5-іл)-біфеніл-3-іл]-гідразоно}-5-метил-2,4-дигідро-піразол-3ону 8 (336 мг, вихід 73,8 %) як жовтої твердої речовини. МС m/z (ЕСІ): 505 [M-1] 1 H ЯМР (400 МГц, ДМСO-d6): 1,24 (м, 6H), 1,92 (т, J=7,2 Гц, 2H), 2,36 (с, 3H), 2,87 (т, J=7,2 Гц, 2H), 7,21 (м, 3H), 7,73 (м, 5H), 8,08 (д, J=7,6 Гц, 1H), 8,25 (с, 1H), 9,77 (с, 1H), 13,80 (с, 1H) Приклад 9 5-{2-Гідрокси-3-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]феніл}-фуран-2-карбонова кислота N N N O HN OH OH O O 9 O B O O Step 1 O2 N NO2 OH Step 2 O OH . HBr OH 20 25 30 35 9c + OH O Step 3 O H2 N 9c N N N O HN Step 4 OH . HBr OH 9b O O H2 N 15 H2 N N N O 10 O 9a 6a O O O O OH OH O O 1i 9 Стадія 1 5-(2-Mетокси-3-нітро-феніл)фуран-2-карбонова кислота 2-(2-Mетокси-3-нітро-феніл)-4,4,5,5-тетраметил-[1,3,2]діоксаборолан 6a (10 г, 35,85 ммоль), 5-бромфуран-2-карбонова кислота (5,47 г, 28,66 ммоль), тетракіс(трифенілфосфін)паладію (2,07 г, 1,79 ммоль) та карбонату натрію (7,60 г, 71,66 ммоль) розчиняли у суміші розчинників 200 мл 1,4-діоксану та 30 мл води. Реакційну суміш кип'ятили зі зворотним холодильником протягом 2,5 годин. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш фільтрували та фільтрат концентрували при пониженому тиску. Залишок розводили 150 мл води та pH встановлювали на рівні 3 1 N хлорводневою кислотою. Після цього суміш фільтрували та залишок на фільтрі промивали 50 мл суміші розчинників з нгексану/етилацетату (V/V=1:1). Залишок висушували для отримання вказаної у заголовку сполуки 5-(2-метокси-3-нітро-феніл)фуран-2-карбонової кислоти 9a (4,23 г, вихід 56,1 %) як сірої твердої речовини. МС m/z (ЕСІ): 262 [M-1] Стадія 2 5-(3-Аміно-2-метокси-феніл)-фуран-2-карбонова кислота 5-(2-метокси-3-нітро-феніл)фуран-2-карбонова кислота 9a (4,23 г, 16,09 ммоль) розчиняли у 125 мл етилацетату після чого додавали 423 мг паладію на вугіллі та форміат амонію (4,054 г, 64,35 ммоль). Реакційну суміш кип'ятили зі зворотним холодильником протягом 3,5 годин. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш концентрували при пониженому тиску та отриманий залишок очищали колонковою хроматографією на силікагелі для отримання вказаної у заголовку сполуки 5-(3-аміно-2-метоксифеніл)-фуран-2-карбонової кислоти 9b (2,79 г, вихід 74,4 %) як світло-зеленої твердої речовини. МС m/z (ЕСІ): 232 [M-1] Стадія 3 Гідробромід 5-(3-Аміно-2-гідрокси-феніл)-фуран-2-карбонової кислоти 5-(3-Аміно-2-метокси-феніл)-фуран-2-карбонова кислота 9b (2,79 г, 11,97 ммоль) розчиняли у 25 мл дихлорметану, після чого краплями додавали трибромід бору (23,9 мл, 2,0 моль/л). Реакційна суміш реагувала при кімнатній температурі протягом години. Реакцію контролювали 25 UA 101172 C2 5 10 15 20 25 за допомогою ТШХ до зникнення вихідних матеріалів. Суміш концентрували при пониженому тиску після додавання 5 мл метанолу. Залишок розводили 100 мл етилацетату та перемішували протягом години. Після цього суміш фільтрували та залишок на фільтрі was висушували для отримання вказаної у заголовку сполуки гідроброміду 5-(3-аміно-2-гідрокси-феніл)-фуран-2карбонової кислоти 9c (1,24 г, вихід 47,2 %) як жовтої твердої речовини. МС m/z (ЕСІ): 218 [M-1] Стадія 4 Гідробромід 5-(3-аміно-2-гідрокси-феніл)-фуран-2-карбонової кислоти 9c (300 мг, 1,0 ммоль) розчиняли у хлорводневій кислоті (3,4 мл, 1 моль/л) після чого краплями додавали 1,2 мл водного нітриту натрію (73 мг, 1,05 ммоль) охолоджуючи на бані з льодом. Після того як суміш реагувала протягом 10 хв., послідовно додавали 2-індан-5-іл-5-метил-2,4-дигідро-піразол-3-он 1i (193 мг, 0,9 ммоль), бікарбонат натрію (1,26 г, 15 ммоль) та 4,4 мл етанолу. Суміш реагувала при кімнатній температурі протягом 24 годин. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш фільтрували та залишок на фільтрі промивали 20 мл води та після цього розчиняли у 20 мл води. Охолоджуючи на бані з льодом, суміш встановлювали на рівні pH < 5 концентрованою хлорводневою кислотою, фільтрували та висушували для отримання вказаної у заголовку сполуки 5-{2-гідрокси-3-[N’-(1-індан-5-іл-3метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]-феніл}-фуран-2-карбонової кислоти 9 (287 мг, вихід 71,8 %) як жовтої твердої речовини. МС m/z (ЕСІ): 443 [M-1] 1 H ЯМР (400 МГц, ДМСO-d6): 2,03 (м, 2H), 2,32 (с, 3H), 2,89 (м, 4H), 7,15 (м, 1H), 7,22 (т, J=8,0 Гц, 1H), 7,29 (д, J=8,0 Гц, 1H), 7,36 (д, J=3,6 Гц, 1H), 7,57 (м, 1H), 7,70 (м, 2H), 7,78 (с, 1H), 9,97 (с, 1H), 13,73 (с, 1H) Приклад 10 4-{[2-Гідрокси-3'-(1H-тетразол-5-іл)-біфеніл-3-іл]-гідразоно}-5-метил-2-(5,6,7,8-тетрагідронафтален-2-іл)-2,4-дигідро-піразол-3-он N N N O HN OH H N N N N 10 N N N N H H2N OH . 8f 30 35 40 45 N N N N O N O HN + £« OH H N N N N HCl 10 3i Гідрохлорид 3-аміно-3'-(1H-тетразол-5-іл)-біфеніл-2-oлу 8f (340 мг, 1,34 ммоль) розчиняли у 3 мл 1 N хлорводневої кислоти, після чого краплями додавали 3 мл водного нітриту натрію (98 мг, 1,41 ммоль) охолоджуючи на бані з льодом. Після того як суміш реагувала протягом 10 хв., послідовно додавали 5-метил-2-(5,6,7,8-тетрагідро-нафтален-2-іл)-2,4-дигідро-піразол-3-он 3i (276 мг, 1,21 ммоль), бікарбонат натрію (1,69 г, 20 ммоль) та 3 мл етанол. Реакційна суміш реагувала при кімнатній температурі протягом 18 годин. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш фільтрували та залишок на фільтрі промивали 20 мл води та після цього розчиняли у 20 мл води. Охолоджуючи на бані з льодом, суміш встановлювали на рівні pH 3~4 концентрованою хлорводневою кислотою. Після цього суміш фільтрували та висушували для отримання вказаної у заголовку сполуки 4-{[2-гідрокси-3'-(1Hтетразол-5-іл)-біфеніл-3-іл]-гідразоно}-5-метил-2-(5,6,7,8-тетрагідро-нафтален-2-іл)-2,4-дигідропіразол-3-ону 10 (208 мг, 31,6 %) як жовтої твердої речовини. МС m/z (ЕСІ): 491 [M-1] 1 H ЯМР (400 МГц, ДМСO-d6): 8,19 (1H, с), 7,99 (1H, с), 7,69 (2H, т, J=8,8), 7,49 (2H, д, J=7,6), 7,15 (3H, м), 2,75 (4H, м), 2,39 (3H, с), 1,75 (4H, м) Приклад 11 2'-Гідрокси-5'-метил-3'-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафтален-2-іл)-1,5-дигідро 26 UA 101172 C2 піразол-4-іліден]-гідразино}-біфеніл-3-карбонова кислота N N N O HN OH OH O 11 O Br Step 1 Step 2 O N Br 2 O2 N OH 11a 11c 11b OH 5 10 15 20 25 30 35 N O HN O Step 6 . HCl 11f 11e N N OH + H2 N OH OH 11d N N O Step 5 O O OH O OH Step 4 O N 2 Br Step 3 O2 N OH OH O 11 3i Стадія 1 2-Бром-4-метил-6-нітро-фенол Нітрат натрію (28 г, 0,33 ммоль) розчиняли у суміші розчинників з 70 мл концентрованої сірчаної кислоти та 210 мл води при -5 °C, після чого краплями повільно додавали 2-бром-4метил-фенол 11a (30,8 г, 0,165 моль). Реакційна суміш реагувала протягом 2 годин охолоджуючи на бані з льодом. Суміш нагрівали до кімнатної температури та вона реагувала протягом ще 1 години. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш екстрагували 200 мл етилацетату. Об'єднані органічні екстракти промивали водою (100 мл×5), висушували над безводним сульфатом натрію, фільтрували та концентрували при пониженому тиску. Залишок очищали колонковою хроматографією на силікагелі для отримання вказаної у заголовку сполуки 2-бром-4-метил-6-нітро-фенолу 11b (22,24 г, вихід 58,1 %) як жовтої твердої речовини. 1 H ЯМР (400 МГц, ДМСO-d6): δ 2,29 (с, 3H), 7,81 (м, 2H), 10,76 (с, 1H) Стадія 2 1-Бром-2-метокси-5-метил-3-нітро-бензол 2-Бром-4-метил-6-нітро-фенол 11b (22,24 г, 95,9 ммоль) розчиняли у 150 мл ацетону, після чого додавали карбонат калію (15,9 г, 115 ммоль) та йодометан (13,7 мл, 220,6 ммоль). Реакційну суміш кип'ятили зі зворотним холодильником протягом ночі. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш фільтрували та фільтрат концентрували при пониженому тиску. Залишок розводили 100 мл етилацетату та фільтрували. Суміш концентрували при пониженому тиску для отримання вказаної у заголовку сполуки 1бром-2-метокси-5-метил-3-нітро-бензолу 11c (23,1 г, вихід 97,9 %) як оранжевої твердої речовини. Стадія 3 2'-Mетокси-5'-метил-3-нітро-біфеніл-3-карбонова кислота 1-Бром-2-метокси-5-метил-3-нітро-бензол 11c (15,0 г, 61 ммоль) та 3карбоксифенілборонову кислоту (11,6 г, 70,1 ммоль) розчиняли у 200 мл 1,4-діоксану, після чого додавали тетракіс(трифенілфосфін)паладію (2,8 г, 2,44 ммоль) та 61 мл водного карбонату натрію (12,9 г, 122 ммоль). Реакційну суміш кип'ятили зі зворотним холодильником протягом ночі. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш концентрували при пониженому тиску та залишок розводили 500 мл води. Суміш промивали сумішшю розчинників з 150 мл н-гексану та 150 мл етилацетату, після чого етилацетатом (300 мл2). pH водного шару встановлювали на рівні 1~2 концентрованою хлорводневою кислотою. Суміш фільтрували та залишок на фільтрі висушували для отримання вказаної у заголовку сполуки 2'-метокси-5'-метил-3-нітро-біфеніл-3-карбонової кислоти 11d (15,4 г, 88,1 %) як жовтої твердої речовини. 27 UA 101172 C2 H ЯМР (400 МГц, ДМСO-d6): 2,40 (с, 3H), 3,42 (с, 3H), 7,58 (с, 1H), 7,58~7,75 (м, 1H), 7,75 (д, J=1,6 Гц, 1H), 7,82~7,84 (м, 1H), 8,02 (д, J=8 Гц, 1H), 8,11 (д, J=1,6 Гц, 1H), 13,12 (с, 1H) Стадія 4 2'-Гідрокси -5'-метил-3'-нітро-біфеніл-3-карбонова кислота 2'-Mетокси-5'-метил-3'-нітро-біфеніл-3-карбонова кислота 11d (11,2 г, 39,0 ммоль) розчиняли у бромводневої кислоти (250 мл, 40 %). Реакційну суміш кип'ятили зі зворотним холодильником протягом ночі. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш охолоджували до кімнатної температури та фільтрували. Осад на фільтрі промивали водою та н-гексаном та висушували для отримання вказаної у заголовку сполуки 2'-гідрокси-5'метил-3'-нітро-біфеніл-3-карбонова кислота 11e (9,15 г, вихід 85,9 %) як жовтої твердої речовини. МС m/z (ЕСІ): 272 [M-1] 1 H ЯМР (400 МГц, ДМСO-d6): 2,36 (с, 3H), 7,60 (м, 2H), 7,78 (д, J=8 Гц, 1H), 7,88 (д, J=1,2 Гц, 1H), 7,97 (д, J=8 Гц, 1H), 8,11 (с, 1H), 10,44 (с, 1H), 13,06 (с, 1H) Стадія 5 Гідрохлорид 3'-аміно-2'-гідрокси-5'-метил-біфеніл-3-карбонової кислоти 2'-Гідрокси-5'-метил-3'-нітро-біфеніл-3-карбонову кислоту 11e (9,15 г, 33,5 ммоль) розчиняли у 200 мл етилацетату, після чого додавали 2 g паладію на вугіллі та форміат амонію (8,45 г, 134 ммоль). Реакційну суміш кип'ятили зі зворотним холодильником протягом 30 хв. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш фільтрували та фільтрат підкислювали хлорводневою кислотою. Суміш фільтрували та висушували для отримання вказаної у заголовку сполуки гідрохлориду 3'-аміно-2'-гідрокси-5'-метил-біфеніл-3карбонової кислоти 11f (6,65 г, вихід 71,0 %) як білої твердої речовини. МС m/z (ЕСІ): 242 [M-1] 1 H ЯМР (400 МГц, ДМСO-d6): δ 2,29 (с, 3H), 7,09 (д, J=1,6 Гц, 1H), 7,14 (д, J=1,6 Гц, 1H), 7,59 (т, J=8 Гц, 1H), 7,74 (дд, J1=6,4 Гц, J2=1,6 Гц, 1H), 7,94 (дд, J1=6,4 Гц, J2=1,6 Гц, 1H), 8,07 (с, 1H) Стадія 6 2'-Гідрокси-5'-метил-3'-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафтален-2-іл)-1,5-дигідропіразол-4-іліден]-гідразино}-біфеніл-3-карбонова кислота 3'-Аміно-2'-гідрокси-5'-метил-біфеніл-3-карбонова кислота гідрохлорид 11f (272 мг, 0,97 ммоль) розчиняли у хлорводневій кислоті (3,3 мл, 1 моль/л), після чого краплями додавали 1,3 мл водного нітриту натрію (74 мг, 1,07 ммоль) охолоджуючи на бані з льодом. Після того як суміш реагувала протягом 20 хв., послідовно додавали 5-метил-2-(5,6,7,8-тетрагідро-нафтален2-іл)-2,4-дигідро-піразол-3-он 3i (200 мг, 0,88 ммоль), бікарбонат натрію (1,22 г, 14,6 ммоль) та 2,1 мл етанолу. Реакційна суміш реагувала при кімнатній температурі протягом 4 годин. Реакцію контролювали за допомогою ТШХ до зникнення вихідних матеріалів. Суміш фільтрували та залишок на фільтрі промивали 20 мл води та після цього розчиняли у 20 мл води. Охолоджуючи на бані з льодом, pH суміші встановлювали на рівні < 5 концентрованою хлорводневою кислотою, фільтрували та висушували для отримання вказаної у заголовку сполуки 2'-гідрокси5'-метил-3'-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафтален-2-іл)-1,5-дигідро-піразол-4-іліден]гідразино}-біфеніл-3-карбонової кислоти 11 (170 мг, вихід 40,2 %) як червоної твердої речовини. МС m/z (ЕСІ): 481 [M-1] 1 H ЯМР (400 МГц, ДМСO-d6): 1,75 (м, 4H), 2,30 (с, 3H), 2,34 (с, 3H), 2,74 (м, 4H), 7,00 (д, J=1,2 Гц, 1H), 7,11 (д, J=8,0 Гц, 1H), 7,53 (с, 1H), 7,62 (м, 3H), 7,80 (д, J=7,6 Гц, 1H), 7,95 (д, J=7,6 Гц, 1H), 8,14 (с, 1H), 9,39 (с, 1H), 13,03 (с, 1H), 13,77 (с, 1H) Приклад 12 5-(3-{N'-[1-(3,3-Диметил-індан-5-іл)-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден]-гідразино}-2гідрокси-феніл)-тіофен-2-карбонова кислота 1 5 10 15 20 25 30 35 40 45 N N N O HN OH OH S O 12 28
ДивитисяДодаткова інформація
Назва патенту англійськоюBicyclo-substituted pyrazolon azo derivatives, preparation process and pharmaceutical use thereof
Автори англійськоюTang, Peng Cho, Lu, Hejun, Zheng, Hao, Chen, Yiqian, Fei, Hongbo, Wang, Shenglan, Wang, Li
Назва патенту російськоюБициклозамещенные пиразолоназопроизводные, способ их получения и фармацевтическое применение
Автори російськоюТанг Пенг Чо, Лю Хеджун, Женг Хао, Чен Икян, Фей Хонгбо, Ванг Шенглан, Ванг Ли
МПК / Мітки
МПК: C07D 231/20, A61K 31/343, C07D 311/04, A61K 31/352, A61K 31/655, A61K 31/4152, C07D 307/79, A61P 7/00
Мітки: спосіб, одержання, біциклозаміщені, застосування, фармацевтичне, піразолоназопохідні
Код посилання
<a href="https://ua.patents.su/84-101172-biciklozamishheni-pirazolonazopokhidni-sposib-kh-oderzhannya-ta-farmacevtichne-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Біциклозаміщені піразолоназопохідні, спосіб їх одержання та фармацевтичне застосування</a>
Попередній патент: Вирівнювальний пристрій та спосіб завантаження камери коксування коксової печі
Наступний патент: Пристрій для замикання і відмикання потоку текучого середовища
Випадковий патент: Пристрій для змазування елементів редуктора