Похідна піролідин-3-ілоцтової кислоти
Номер патенту: 112873
Опубліковано: 10.11.2016
Автори: Ватанабе Нобухіса, Онізава Юджі, Харада Хітоші, Йошіда Ічіро, Охаші Йошіакі, Мацумото Ясунобу, Окабе Тадаші
Формула / Реферат
1. Сполука, представлена формулою (1), або її фармацевтично
прийнятна сіль
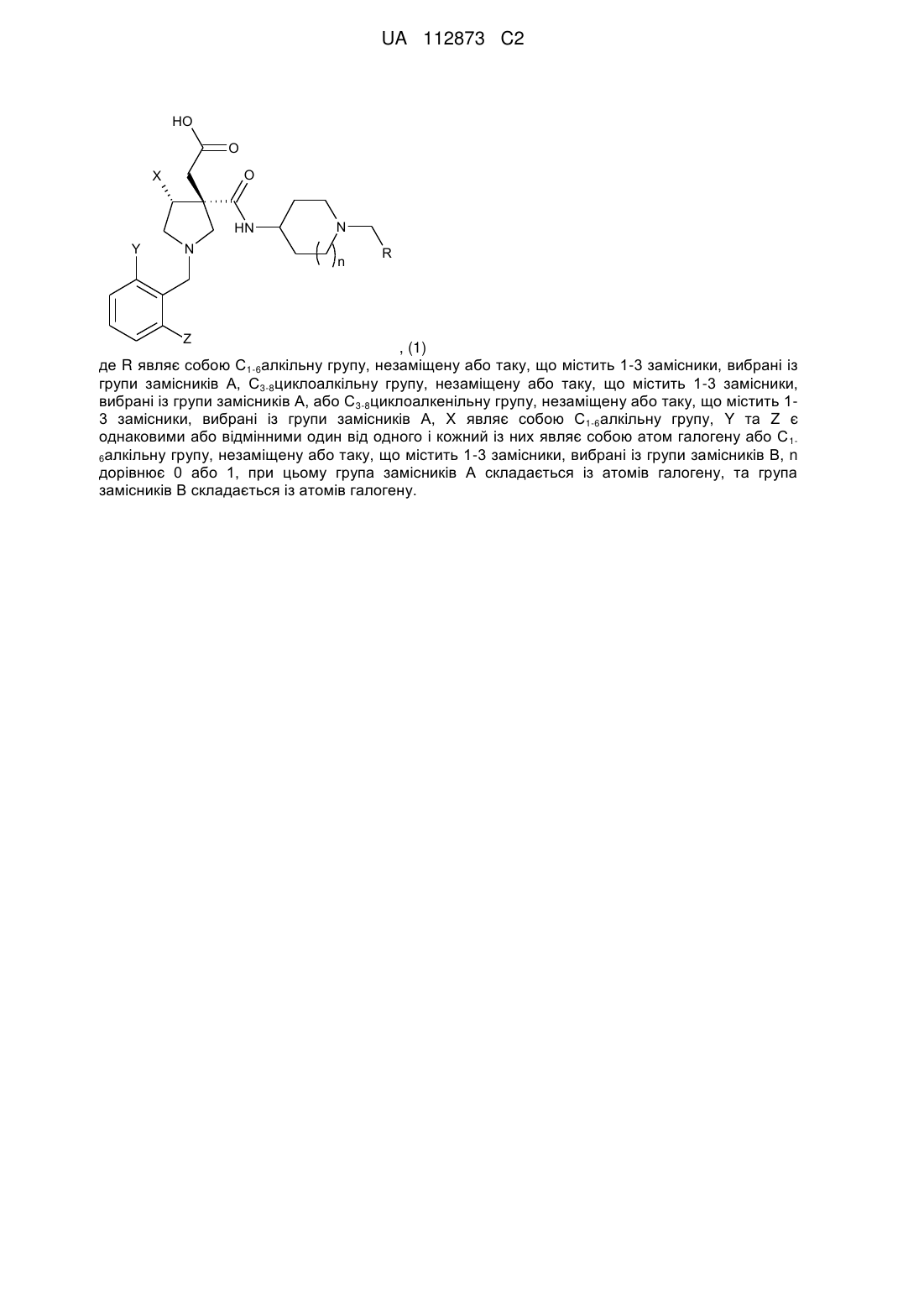
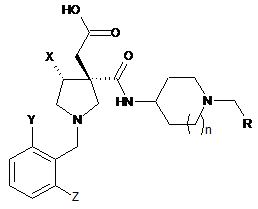 , (1)
, (1)
де R являє собою С1-6алкільну групу, незаміщену або таку, що містить 1-3 замісники, вибрані із атомів галогену, С3-8циклоалкільну групу, незаміщену або таку, що містить 1-3 замісники, вибрані із атомів галогену, або С3-8циклоалкенільну групу, незаміщену або таку, що містить 1-3 замісники, вибрані із атомів галогену,
X являє собою C1-6алкільну групу,
Y та Z є однаковими або відмінними один від одного та кожний із них являє собою атом галогену або С1-6алкільну групу, незаміщену або таку, що містить 1-3 замісники, вибрані із атомів галогену,
n дорівнює 0 або 1.
2. Сполука або її фармацевтично прийнятна сіль за п. 1, де R є фторбутильною групою, пентильною групою, циклогексильною групою, дифторциклогексильною групою, циклопентенільною групою або циклогексенільною групою.
3. Сполука або її фармацевтично прийнятна сіль за п. 1 або п. 2, де X є метильною групою.
4. Сполука або її фармацевтично прийнятна сіль за будь-яким із пп. 1-3, де Y є атомом хлору.
5. Сполука або її фармацевтично прийнятна сіль за будь-яким із пп. 1-4, де Z є атомом хлору, метильною групою, дифторметильною групою або трифторметильною групою.
6. Сполука або її фармацевтично прийнятна сіль за будь-яким із пп. 1-5, де n дорівнює 1.
7. Сполука, вибрана із групи, що складається із
2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)феніл]метил}-3-{[1-(2-фторпентил)піперидин-4-іл]карбамоїл}-4-метилпіролідин-3-іл]оцтової кислоти,
2-[(3S,4R)-1-[(2,6-дихлорфеніл)метил]-3-({1-[(4,4-дифторциклогексил)метил]піперидин-4-іл}карбамоїл)-4-метилпіролідин-3-іл] оцтової кислоти,
2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)феніл]метил}-3-{[1-(циклогекс-1-ен-1-ілметил)піперидин-4-іл]карбамоїл}-4-метилпіролідин-3-іл]оцтової кислоти,
2-[(3S,4R)-1-[(2-хлор-6-метилфеніл)метил]-3-{[1-(циклогекс-1-eн-1-ілметил)піперидин-4-іл]карбамоїл}-4-метилпіролідин-3-іл]оцтової кислоти,
2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)феніл]метил}-3-{[1-(циклопент-1-ен-1-ілметил)піперидин-4-іл]карбамоїл}-4-метилпіролідин-3-іл]оцтової кислоти,
2-[(3S,4R)-1-[(2-хлор-6-метилфеніл)метил]-3-{[(1-циклопент-1-ен-1-ілметил)піперидин-4-іл]карбамоїл}-4-метилпіролідин-3-іл]оцтової кислоти,
2-[(3S,4R)-3-{[(3S)-1-(циклогекс-1-ен-1-ілметил)піролідин-3-іл]карбамоїл}-1-[(2,6-дихлорфеніл)метил]-4-метилпіролідин-3-іл]оцтової кислоти,
2-[(3S,4R)-1-{[2-хлор-6-(дифторметил)феніл]метил}-3-[(1-гексилпіперидин-4-іл)карбамоїл]-4-метилпіролідин-3-іл]оцтової кислоти,
2-[(3S,4R)-3-{[(1-циклогекс-1-eн-1-ілметил)піперидин-4-іл]карбамоїл}-1-[(2,6-дихлорфеніл)метил]-4-метилпіролідин-3-іл]оцтової кислоти,
2-[(3S,4R)-1-{[2-хлор-6-(дифторметил)феніл]метил}-3-{[1-(циклогекс-1-eн-1-ілметил)піперидин-4-іл]карбамоїл}-4-метилпіролідин-3-іл]оцтової кислоти,
2-[(3S,4R)-1-{[2-хлор-6-(дифторметил)феніл]метил}-3-{[1-(циклопент-1-ен-1-ілметил)піперидин-4-іл]карбамоїл}-4-метилпіролідин-3-іл]оцтової кислоти та
2-[(3S,4R)-1-{[2-хлор-6-(дифторметил)феніл]метил}-3-{[1-(циклогексилметил)піперидин-4-іл]карбамоїл}-4-метилпіролідин-3-іл]оцтової кислоти,
або її фармацевтично прийнятна сіль.
8. 2-[(3S,4R)-1-[(2,6-дихлорфеніл)метил]-3-({1-[(4,4-дифторциклогексил)метил]піперидин-4-іл}карбамоїл)-4-метилпіролідин-3-іл]оцтова кислота або її фармацевтично прийнятна сіль:
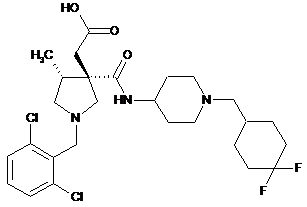 .
.
9. 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)феніл]метил}-3-{[1-(циклогекс-1-ен-1-ілметил)піперидин-4-іл]карбамоїл}-4-метилпіролідин-3-іл]оцтова кислота або її фармацевтично прийнятна сіль:
 .
.
10. 2-[(3S,4R)-1-[(2-хлор-6-метилфеніл)метил]-3-{[1-(циклогекс-1-ен-1-ілметил)піперидин-4-іл]карбамоїл}-4-метилпіролідин-3-іл]оцтова кислота або її фармацевтично прийнятна сіль:
 .
.
11. 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)феніл]метил}-3-{[1-(циклопент-1-ен-1-ілметил)піперидин-4-іл]карбамоїл}-4-метилпіролідин-3-іл]оцтова кислота або її фармацевтично прийнятна сіль:
 .
.
12. 2-[(3S,4R)-1-[(2-хлор-6-метилфеніл)метил]-3-{[(1-циклопент-1-ен-1-ілметил)піперидин-4-іл]карбамоїл}-4-метилпіролідин-3-іл]оцтова кислота або її фармацевтично прийнятна сіль:
 .
.
13. 2-[(3S,4R)-3-{[(3S)-1-(циклогекс-1-ен-1-ілметил)піролідин-3-іл]карбамоїл}-1-[(2,6-дихлорфеніл)метил]-4-метилпіролідин-3-іл]оцтова кислота або її фармацевтично прийнятна сіль:
 .
.
14. 2-[(3S,4R)-3-{[(1-циклогекс-1-eн-1-ілметил)піперидин-4-іл]карбамоїл}-1-[(2,6-дихлорфеніл)метил]-4-метилпіролідин-3-іл]оцтова кислота або її фармацевтично прийнятна сіль:
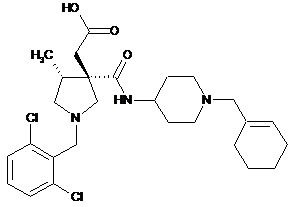 .
.
15. Лікарський засіб, що містить сполуку або її фармацевтично прийнятну сіль за будь-яким із пп. 1-14 як активний інгредієнт.
16. Терапевтичний засіб для лікування запального захворювання кишечнику, що містить сполуку або її фармацевтично прийнятну сіль за будь-яким із пп. 1-14 як активний інгредієнт.
17. Терапевтичний засіб за п. 16, який відрізняється тим, що запальне захворювання кишечнику є виразковим колітом або хворобою Крона.
18. Інгібітор шляху фракталкін-CX3CR1, який містить сполуку або її фармацевтично прийнятну сіль за будь-яким із пп. 1-14 як активний інгредієнт, для лікування запального захворювання кишечнику.
19. Інгібітор фракталкіну, який містить сполуку або її фармацевтично прийнятну сіль за будь-яким із пп. 1-14 як активний інгредієнт, для лікування запального захворювання кишечнику.
20. Інгібітор CX3CR1, який містить сполуку або її фармацевтично прийнятну сіль за будь-яким із пп. 1-14 як активний інгредієнт, для лікування запального захворювання кишечнику.
Текст
Реферат: Сполука, представлена формулою (1), або її фармацевтично прийнятна сіль виявляє інгібуючий ефект на шлях фракталкін-CX3CR1, UA 112873 C2 (12) UA 112873 C2 HO O O X HN Y N Z N n R , (1) де R являє собою С1-6алкільну групу, незаміщену або таку, що містить 1-3 замісники, вибрані із групи замісників А, С3-8циклоалкільну групу, незаміщену або таку, що містить 1-3 замісники, вибрані із групи замісників А, або С 3-8циклоалкенільну групу, незаміщену або таку, що містить 13 замісники, вибрані із групи замісників А, X являє собою С1-6алкільну групу, Y та Z є однаковими або відмінними один від одного і кожний із них являє собою атом галогену або С 16алкільну групу, незаміщену або таку, що містить 1-3 замісники, вибрані із групи замісників В, n дорівнює 0 або 1, при цьому група замісників А складається із атомів галогену, та група замісників В складається із атомів галогену. UA 112873 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки [0001] Даний винахід відноситься до похідної піролідин-3-ілоцтової кислоти. Конкретніше, даний винахід відноситься до похідної піролідин-3-ілоцтової кислоти, яка є придатною у якості терапевтичного засобу від запального захворювання кишечника. Попередній рівень техніки [0002] Хемокіни є головними факторами міграції клітин і регулюють інфільтрацію лімфоцитів у тканини за допомогою посилення пересування клітин та активації молекул адгезії. Хемокіни класифікують на чотири підродини CC, CXC, C та CX3C виходячи з їхніх послідовностей із першими двома залишками цистеїну. [0003] Фракталкін є єдиним представником сімейства хемокінів CX3C і має відмінні особливості в структурі та функціях, які не виявлені в інших хемокінів. Фракталкін зв'язується з рецептором, CX3CR1, який може опосередковувати сильну адгезію без участі в цьому опосередкуванні селектину або інтегрину навіть у присутності фізіологічного кровотоку. Це означає, що система фракталкін-CX3CR1 забезпечує опосередкування багатоступінчастого механізму інфільтрації, а за участю селектину або інтегрину тільки одноступінчасту реакцію. [0004] Експресію фракталкіну на ендотеліальних клітинах судин індукують запальні цитокіни TNF та IL-1. У той же час CX3CR1 експресується на моноцитах, практично всіх NK-клітинах та деяких T-клітинах, але не експресується на нейтрофілах. Таким чином, уважається, що система фракталкін-CX3CR1 є досить ефективним механізмом мобілізації імунних клітин поблизу від ендотеліальних клітин ушкоджених тканин або в тканинах. [0005] Беручи до уваги взаємозв'язок між системою фракталкін-CX3CR1 і патологічними процесами, припустили, що система фракталкін-CX3CR1 залучена до розвитку та патологічних процесів аутоімунних захворювань, таких як ревматоїдний артрит, запальне захворювання кишечника, вовчаковий нефрит та розсіяний склероз (непатентне літературне джерело 1). Зокрема, що стосується запального захворювання кишечника, повідомляється, що експресія фракталкіну підвищується у запалених ділянках тканин товстої кишки пацієнтів, і що CX3CR1 відіграє важливу роль в інфільтрації імунних клітин у тканину товстої кишки (непатентне літературне джерело 2). [0006] Антитіла, описані в патентному літературному джерелі 1, та низькомолекулярні сполуки, описані в патентних літературних джерелах 2-6, раніше були відомі як інгібітори фракталкіну. [0007] Крім того, описано, що сполуки, описані в патентному літературному джерелі 7, є придатними в якості антагоністів хемокінового рецептора CCR2, але відрізняються від подібних інгібіторів із сімейства речовин, що діють на хемокіни. Список згаданих документів Патентне літературне джерело [0008] Патентне літературне джерело 1: викладена публікація заявки на патент Японії № 2002345454 Патентне літературне джерело 2: WO 2006/107257 Патентне літературне джерело 3: WO 2006/107258 Патентне літературне джерело 4: WO 2008/039138 Патентне літературне джерело 5: WO 2008/039139 Патентне літературне джерело 6: WO 2009/120140 Патентне літературне джерело 7: викладена публікація заявки на патент США № 2010/0210633 Непатентне літературне джерело [0009] Непатентне літературне джерело 1: Umehara et al., "Fractalkine in Vascular Biology", Arterioscler. Thromb. Vasc. Biol., Vol. 24, pp. 34-40, 2004 Непатентне літературне джерело 2: Kobayashi et al., "Exclusive Increase of CX3CR1_CD28_CD4_ T Cells in Inflammatory Bowel Disease and Their Recruitment as Intraepithelial Lymphocytes ", Inflamm. Bowel. Dis., Vol. 13, pp. 837-846, 2007 Короткий опис винаходу Технічна задача [0010] Метою даного винаходу є забезпечення сполуки із інгібуючим ефектом на шлях фракталкін-CX3CR1. Вирішення задачі [0011] У результаті інтенсивних досліджень автори даного винаходу здійснили даний винахід. Конкретно, даний винахід відноситься до 1 UA 112873 C2 [1] сполуки, представленої формулою (1), або її фармацевтично прийнятної солі, [Хімічна формула 1] 5 10 15 20 25 30 35 40 45 50 , де R являє собою C1-6алкільну групу, незаміщену або таку, що містить 1-3 замісники, вибрані із групи замісників A, C3-8циклоалкільну групу, незаміщену або таку, що містить 1-3 замісники, вибрані із групи замісників A, або C3-8циклоалкенільну групу, незаміщену або таку, що містить 13 замісники, вибрані із групи замісників A, X являє собою C1-6алкільну групу, Y і Z є однаковими або відмінними один від одного, і кожний із них являє собою атом галогену або C1-6алкільну групу, незаміщену або таку, що містить 1-3 замісники, вибрані із групи замісників B, n дорівнює 0 або 1, група замісників A складається із атомів галогену, і група замісників B складається із атомів галогену; [2] сполуки або її фармацевтично прийнятної солі згідно [1], де R є фторбутильною групою, пентильною групою, циклогексильною групою, дифторциклогексильною групою, циклопентенільною групою або циклогексенільною групою; [3] сполуки або її фармацевтично прийнятної солі згідно [1] або [2], де X є метильною групою; [4] сполуки або її фармацевтично прийнятної солі згідно із будь-яким із [1]-[3], де Y є атомом хлору; [5] сполуки або її фармацевтично прийнятної солі згідно із будь-яким із [1]-[4], де Z є атомом хлору, метильною групою, дифторметильною групою або трифторметильною групою; [6] сполуки або її фармацевтично прийнятної солі згідно із будь-яким із [1]-[5], де n дорівнює 1; [7] сполуки, вибраної із групи, що складається із 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)феніл] метил}-3-{[1-(2-фторпентил)піперидин-4-іл] карбамоїл}-4-метилпіролідин-3-іл] оцтової кислоти, 2-[(3S,4R)-1-[(2,6-дихлорфеніл)метил]-3-({1-[(4,4-дифторциклогексил)метил] піперидин-4іл}карбамоїл)-4-метилпіролідин-3-іл] оцтової кислоти, 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)феніл] метил}-3-{[1-(циклогекс-1-ен-1ілметил)піперидин-4-іл] карбамоїл}-4-метилпіролідин-3-іл] оцтової кислоти, 2-[(3S,4R)-1-[(2-хлор-6-метилфеніл)метил]-3-{[1-(циклогекс-1-ен-1-ілметил)піперидин-4-іл] карбамоїл}-4-метилпіролідин-3-іл] оцтової кислоти, 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)феніл] метил}-3-{[1-(циклопент-1-ен-1ілметил)піперидин-4-іл] карбамоїл}-4-метилпіролідин-3-іл] оцтової кислоти, 2-[(3S,4R)-1-[(2-хлор-6-метилфеніл)метил]-3-{[(1-циклопент-1-ен-1-ілметил)піперидин-4-іл] карбамоїл}-4-метилпіролідин-3-іл] оцтової кислоти, 2-[(3S,4R)-(3-{[(3S)-1-(циклогекс-1-ен-1-ілметил)піролідин-3-іл] карбамоїл}-1-[(2,6дихлорфеніл)метил]-4-метилпіролідин-3-іл] оцтової кислоти, 2-[(3S,4R)-1-{[2-хлор-6-(дифторметил)феніл] метил}-3-[(1-гексилпіперидин-4-іл)карбамоїл]-4метилпіролідин-3-іл] оцтової кислоти, 2-[(3S,4R)-3-{[(1-циклогекс-1-ен-1-ілметил)піперидин-4-іл] карбамоїл}-1-[(2,6дихлорфеніл)метил]-4-метилпіролідин-3-іл] оцтової кислоти, 2-[(3S,4R)-1-{[2-хлор-6-(дифторметил)феніл] метил}-3-{[1-(циклогекс-1-ен-1ілметил)піперидин-4-іл] карбамоїл}-4-метилпіролідин-3-іл] оцтової кислоти, 2-[(3S,4R)-1-{[2-хлор-6-(дифторметил)феніл] метил}-3-{[1-(циклопент-1-ен-1ілметил)піперидин-4-іл] карбамоїл}-4-метилпіролідин-3-іл] оцтової кислоти та 2-[(3S,4R)-1-{[2-хлор-6-(дифторметил)феніл] метил}-3-{[1-(циклогексилметил)піперидин-4-іл] карбамоїл}-4-метилпіролідин-3-іл] оцтової кислоти, або її фармацевтично прийнятної солі; [8] лікарського засобу, що містить сполуку або її фармацевтично прийнятну сіль згідно із будь-яким із [1]-[7] у якості активного інгредієнта; 2 UA 112873 C2 5 10 15 20 25 30 35 40 45 50 55 60 [9] терапевтичного засобу від запального захворювання кишечника, що містить сполуку або її фармацевтично прийнятну сіль згідно із будь-яким із [1]-[7] у якості активного інгредієнта; [10] терапевтичного засобу згідно [9], де запальне захворювання кишечника є виразковим колітом або хворобою Крона; [11] інгібітору шляху фракталкін-CX3CR1, що містить сполуку або її фармацевтично прийнятну сіль згідно із будь-яким із [1]-[7] у якості активного інгредієнта; [12] інгібітору фракталкіну, що містить сполуку або її фармацевтично прийнятну сіль згідно із будь-яким із [1]-[7] у якості активного інгредієнта; [13] інгібітору CX3CR1, що містить сполуку або її фармацевтично прийнятну сіль згідно із будь-яким із [1]-[7] у якості активного інгредієнта; [14] способу лікування запального захворювання кишечника, що включає введення пацієнтові сполуки або її фармацевтично прийнятної солі згідно із будь-яким із [1]-[7] ; [15] способу згідно [14], де запальне захворювання кишечника є виразковим колітом або хворобою Крона; [16] способу інгібування шляху фракталкін-CX3CR1, що включає введення пацієнтові сполуки або її фармацевтично прийнятної солі згідно із будь-яким із [1]-[7] ; [17] способу інгібування фракталкіну, що включає введення пацієнтові сполуки або її фармацевтично прийнятної солі згідно із будь-яким із [1]-[7] ; [18] способу інгібування CX3CR1, що включає введення пацієнтові сполуки або її фармацевтично прийнятної солі згідно із будь-яким із [1]-[7] ; [19] сполуки або її фармацевтично прийнятної солі згідно із будь-яким із [1]-[7], яку застосовують для лікування запального захворювання кишечника; [20] сполуки або її фармацевтично прийнятної солі згідно [19], де запальне захворювання кишечника є виразковим колітом або хворобою Крона; [21] сполуки або її фармацевтично прийнятної солі згідно із будь-яким із [1]-[7], яку застосовують для інгібування шляху фракталкін-CX3CR1; [22] сполуки або її фармацевтично прийнятної солі згідно із будь-яким із [1]-[7], яку застосовують для інгібування фракталкіну; [23] сполуки або її фармацевтично прийнятної солі згідно із будь-яким із [1]-[7], яку застосовують для інгібування CX3CR1; [24] застосування сполуки або її фармацевтично прийнятної солі згідно із будь-яким із [1]-[7] при одержанні терапевтичного засобу від запального захворювання кишечника; [25] застосування згідно [24], де запальне захворювання кишечника є виразковим колітом або хворобою Крона; [26] застосування сполуки або її фармацевтично прийнятної солі згідно із будь-яким із [1]-[7] при одержанні інгібітору шляху фракталкін-CX3CR1; [27] застосування сполуки або її фармацевтично прийнятної солі згідно із будь-яким із [1]-[7] при одержанні інгібітору фракталкіну та [28] застосування сполуки або її фармацевтично прийнятної солі згідно із будь-яким із [1]-[7] при одержанні інгібітору CX3CR1. Корисні ефекти винаходу [0012] Згідно із результатами описаних нижче тестів сполуки згідно із даним винаходом виявляють інгібуючий ефект на шлях фракталкін-CX3CR1. Таким чином, сполуки згідно із даним винаходом є придатними в якості терапевтичних засобів від запального захворювання кишечника. Короткий опис графічних матеріалів [0013] На Фіг. 1 показаний графік, що демонструє результати тестового прикладу 2 для сполук із прикладів 3, 6 та 11; на Фіг. 2 показаний графік, що демонструє результати тестового прикладу 2 для сполук із прикладів 2, 7 та 8; на Фіг. 3 показаний графік, що демонструє результати тестового прикладу 2 для сполук із прикладів 1, 9 та 10; і на Фіг. 4 показаний графік, що демонструє результати тестового прикладу 2 для сполук із прикладів 12, 13 та 14. Опис варіантів здійснення [0014] Даний винахід буде докладно описаний нижче. [0015] У даному описі даний винахід не обмежений конкретною кристалічною формою, а може передбачати будь-яку із кристалічних форм або їх сумішей, хоча можуть існувати кристалічні поліморфи. Даний винахід також передбачає аморфні форми, і при цьому сполуки згідно із даним винаходом передбачають ангідриди, гідрати та сольвати. 3 UA 112873 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0016] Далі в даному документі будуть описані значення виразів, символів і т.п., описаних у даному описі, і даний винахід буде докладно описаний. [0017] Вираз "C1-6алкільна група" у даному описі означає лінійну або розгалужену алкільну групу, що містить 1-6 атомів вуглецю, та приклади включають метильну групу, етильну групу, 1пропільну групу, 2-пропільну групу, 2-метил-1-пропільну групу, 2-метил-2-пропільну групу, 1бутильну групу, 2-бутильну групу, 1-пентильну групу, 2-пентильну групу, 3-пентильну групу, 1гексильну групу, 2-гексильну групу та 3-гексильну групу. [0018] Вираз "C3-8циклоалкільна група" у даному описі означає моноциклічну насичену аліфатичну вуглеводневу групу, що містить 3-8 атомів вуглецю, та приклади включають циклопропільну групу, циклобутильну групу, циклопентильну групу, циклогексильну групу, циклогептильну групу та циклооктильну групу. [0019] Вираз "C3-8циклоалкенільна група" у даному описі означає моноциклічну аліфатичну вуглеводневу групу, що містить 3-8 атомів вуглецю та містить 1-4 подвійні зв'язки в кільці, та приклади включають циклопропенільну групу, циклобутенільну групу, циклопентенільну групу, циклогексенільну групу, циклогептенільну групу та циклооктенільну групу. [0020] Вираз "атом галогену" у даному описі означає атом фтору, атом хлору, атом брому або атом йоду. [0021] R у сполуці, представленій формулою (1), являє собою C 1- 6алкільну групу, незаміщену або таку, що містить 1-3 замісники, вибрані із групи замісників A, C3-8циклоалкільну групу, незаміщену або таку, що містить 1-3 замісники, вибрані із групи замісників A, або C 38циклоалкенільну групу, незаміщену або таку, що містить 1-3 замісники, вибрані із групи замісників A. Переважно R являє собою фторбутильну групу, пентильну групу, циклогексильну групу, дифторциклогексильну групу, циклопентенільну групу або циклогексенільну групу. [0022] X у сполуці, представленій формулою (1), являє собою C 1-6алкільну групу. Переважно X являє собою метильну групу. [0023] Y і Z у сполуці, представленій формулою (1), є однаковими або відмінними один від одного, і кожний із них являє собою атом галогену або C 1-6алкільну групу, незаміщену або таку, що містить 1-3 замісники, вибрані із групи замісників B. Переважно Y являє собою атом хлору. Переважно Z являє собою атом хлору, метильну групу, дифторметильну групу або трифторметильну групу. [0024] У сполуці, представленій формулою (1), n дорівнює 0 або 1 та переважно дорівнює 1. [0025] Група замісників A складається із атомів галогену та переважно є атомом фтору. [0026] Група замісників B складається із атомів галогену та переважно є атомом фтору, атомом хлору або атомом брому, більш переважно атомом фтору. [0027] Вираз "фармацевтично прийнятна сіль" у даному описі не обмежений особливим чином, оскільки утворюється сіль зі сполукою, представленою формулою (1), і вона є фармацевтично прийнятною, і приклади включають неорганічні кислі солі, органічні кислі солі, неорганічні основні солі, органічні основні солі та кислотні або основні солі амінокислот. [0028] Переважні приклади неорганічних кислих солей включають гідрохлориди, гідроброміди, сульфати, нітрати та фосфати, і переважні приклади органічних кислих солей включають ацетати, сукцинати, фумарати, малеати, тартрати, цитрати, лактати, стеарати, бензоати, солі мигдальної кислоти, метансульфонати, етансульфонати, p-толуолсульфонати та бензолсульфонати. [0029] Переважні приклади неорганічних основних солей включають солі лужних металів, такі як солі натрію та солі калію, солі лужноземельних металів, такі як солі кальцію та солі магнію, солі алюмінію та солі амонію, і переважні приклади органічних основних солей включають солі диетиламіну, солі діетаноламіну, солі меглуміну та солі N,N'дибензилетилендіаміну. [0030] Переважні приклади кислотних солей амінокислот включають аспартати та глутамати, та переважні приклади основних солей амінокислот включають солі аргініну, солі лізину та солі орнітину. [0031] Сполуку, представлену формулою (1), можна одержувати описаним нижче способом і також можна одержувати за допомогою вдосконалення способу, описаного нижче, фахівцями в даній галузі техніки виходячи із базових знань. Однак, спосіб одержання сполуки, представленої формулою (1), не обмежений цими способами. [0032] Сполуку, представлену формулою (1) (що далі в даному документі також називається сполукою (1)), можна одержувати за допомогою процесу А, процесу B і процесу C, докладно описаних нижче, із використанням проміжного продукту, представленого формулою (2), у якості вихідного матеріалу. [Хімічна формула 2] 4 UA 112873 C2 5 10 15 20 25 30 [На схемі R, X, Y, Z та n є такими, як визначено вище.] [0033] При необхідності послідовність відповідних процесів можна змінити виходячи із базових знань фахівців у даній галузі техніки. За кожним процесом можуть іти способи очищення, відомі фахівцеві в даній галузі техніки, або можна перейти до здійснення наступного процесу без виділення та очищення. [0034] (Процес А) Амідування [Хімічна формула 3] [де X, R та n є такими, як визначено вище.] [0035] Даний процес є процесом одержання сполуки (4) шляхом піддання карбоксильної групи сполуки (2) та аміногрупи сполуки (3) дегідратаційній конденсації в інертному розчиннику в присутності конденсуючого засобу і основи із утворенням амідного зв'язку. [0036] Застосовуваний розчинник не обмежений особливим чином у тій мірі, у якій він до певної міри розчиняє вихідний матеріал та не інгібує реакцію, і приклади включають аміди, такі як N,N-диметилформамід, N,N-диметилацетамід та 1-метилпіролідинон, ефіри, такі як тетрагідрофуран, і сульфоксиди, такі як диметилсульфоксид, при цьому N,N-диметилформамід є переважним. [0037] Приклади застосовуваних конденсуючих засобів включають гексафторфосфат бензотриазол-1-ілокситрис(піролідино)фосфонію (що далі в даному документі називається PyBOP), біс(2-оксо-3-оксазолідиніл)фосфіновий хлорид (що далі в даному документі називається BOP-Cl), гексафторфосфат бензотриазол-1-ілокситрис(диметиламіно)фосфонію, гексафторфосфат 2-(бензотриазол-1-іл)-1,1,3,3-тетраметилуронію та діетилціанофосфат, при цьому PyBOP або BOP-Cl є переважними та PyBOP є найбільш переважним. [0038] Приклади застосовуваної основи включають триетиламін та діізопропілетиламін, при цьому триетиламін є переважним. [0039] Температура реакції варіює залежно від вихідного матеріалу, розчинника, конденсуючого засобу та основи, але зазвичай складає від -20°C до 100°C, переважно від 0°C до 60°C. [0040] Час реакції варіює залежно від вихідного матеріалу, розчинника, конденсуючого засобу та основи, але зазвичайскладає від 30 хвилин до п'яти днів, переважно від однієї години до трьох днів. [0041] (Процес B) Арилметилювання [Хімічна формула 4] 5 UA 112873 C2 1 5 10 15 20 25 30 35 [де R, X, Y, Z та n є такими, як визначено вище, і W являє собою атом галогену, алкілсульфонілоксі групу або арилсульфонілоксі групу.] [0042] Даний процес є процесом одержання сполуки (6) шляхом реакції сполуки (4) зі сполукою (5) в інертному розчиннику в присутності основи. [0043] Застосовуваний розчинник не обмежений особливим чином у тій мірі, у якій він до певної міри розчиняє вихідний матеріал та не інгібує реакцію, і приклади включають аміди, такі як N,N-диметилформамід, N,N-диметилацетамід та 1-метилпіролідинон, та сульфоксиди, такі як диметилсульфоксид, при цьому N,N-диметилформамід є переважним. [0044] Приклади застосовуваної основи включають неорганічні основи, такі як карбонат натрію та карбонат калію, при цьому карбонат калію є переважним. [0045] Температура реакції варіює залежно від вихідного матеріалу, розчинника та основи, але зазвичай складає від -20°C до 100°C, переважно від 0°C до 60°C. [0046] Час реакції варіює залежно від вихідного матеріалу, розчинника та основи, але зазвичай складає від 30 хвилин до п'яти днів, переважно від 1 до 24 годин. [0047] (Процес C) Видалення трет-бутильної групи [Хімічна формула 5] [де R, X, Y, Z та n є такими, як визначено вище.] [0048] Даний процес є процесом одержання сполуки (1) шляхом реакції сполуки (6) з кислотою у відсутності розчинника або в інертному розчиннику. [0049] Застосовуваний розчинник не обмежений особливим чином у тій мірі, у якій він до певної міри розчиняє вихідний матеріал та не інгібує реакцію, і приклади включають галогензаміщені вуглеводні, такі як дихлорметан та хлороформ, толуол, діоксан, воду та змішаний розчинник із діоксану та води, при цьому дихлорметан є переважним. [0050] Приклади застосовуваної кислоти включають карбонові кислоти, такі як трифтороцтова кислота, та неорганічні кислоти, такі як соляна кислота, при цьому трифтороцтова кислота є переважною. [0051] Температура реакції варіює залежно від вихідного матеріалу, розчинника та кислоти, але зазвичай складає від -20°C до 100°C, переважно від 0°C до 40°C. [0052] Час реакції варіює залежно від вихідного матеріалу, розчинника та кислоти, але зазвичай складає від 30 хвилин до одного дня, переважно від 1 до 12 годин. [0053] Спосіб одержання за допомогою процесу D та процесу F також можна застосовувати в якості іншого способу одержання сполуки (1). [0054] (Процес D) Відновне амінування [Хімічна формула 6] 6 UA 112873 C2 5 10 15 20 25 30 35 [де X, Y та Z є такими, як визначено вище.] [0055] Даний процес є процесом одержання сполуки (8) шляхом реакції сполуки (2) зі сполукою (7) і відновником в інертному розчиннику в присутності або відсутності кислоти. [0056] Застосовуваний розчинник не обмежений особливим чином у тій мірі, у якій він до певної міри розчиняє вихідний матеріал та не інгібує реакцію, і приклади включають ефіри, такі як тетрагідрофуран, та спирти, такі як метанол та етанол, при цьому тетрагідрофуран або метанол є переважними. [0057] Приклади застосовуваного відновника включають боргідридні сполуки, такі як триацетоксиборогідрид натрію, ціаноборогідрид натрію та борогідрид натрію, при цьому триацетоксиборогідрид натрію є переважним. [0058] У даному процесі можна застосовувати або не застосовувати кислоту, і якщо застосовують, то застосовувана кислота не обмежена особливим чином у тій мірі, у якій вона не інгібує реакцію, і переважно є оцтовою кислотою. [0059] Температура реакції варіює залежно від вихідного матеріалу, розчинника, відновника та кислоти, але зазвичай складає від -20°C до 100°C, переважно від 0°C до 60°C. [0060] Час реакції варіює залежно від вихідного матеріалу, розчинника, відновника та кислоти, але зазвичай складає від 30 хвилин до п'яти днів, переважно від 1 до 48 годин. [0061] Навіть якщо сполука (2), будучи вихідним матеріалом, утворює сіль, подальше протікання реакції можна забезпечити шляхом додавання органічного аміну, такого як триетиламін, у кількості одного або декількох еквівалентів щодо кількості карбонової кислоти, що утворює сіль. [0062] (Процес E) Гідрування Сполуку (4), у якій арилметильна група видалена, можна одержувати шляхом піддання сполуки (6), одержаної при вищеописаному процесі B, реакції гідрування. Сполука (4) далі може бути перетворена за допомогою процесу B у сполуку (6), до якої додана арилметильна група, що містить різні замісники. [Хімічна формула 7] 1 2 [де R, Z та n є такими, як визначено вище, Y та Y мають таке ж значення, як і 1 2 вищевказаний Y, і Z , і Z мають таке ж значення, як і вищевказаний Z.] [0063] Даний процес є процесом одержання сполуки (4) шляхом реакції сполуки (6) із воднем в інертному розчиннику в присутності відновного каталізатора із видаленням арилметильної групи. [0064] Застосовуваний розчинник не обмежений особливим чином у тій мірі, у якій він до певної міри розчиняє вихідний матеріал та не інгібує реакцію, і приклади включають спирти, такі 7 UA 112873 C2 5 10 15 20 25 30 35 як метанол та етанол, ефіри, такі як тетрагідрофуран, діоксан та диметилоксіетан, і складні ефіри органічних кислот, такі як етилацетат, при цьому ефіри, спирти, складні ефіри органічних кислот або змішані розчинники із них є переважними, та метанол або етанол є найбільш переважними. [0065] Приклади застосовуваних відновних каталізаторів включають Pd/C, гідроксид паладію, нікель Ренея, оксид платини та платинову чернь, при цьому Pd/C або гідроксид паладію є переважним. [0066] Температура реакції варіює залежно від вихідного матеріалу та розчинника, але зазвичай складає від 0°C до 70°C, переважно від 10°C до 50°C. [0067] Час реакції варіює залежно від вихідного матеріалу, розчинника та температури реакції, але зазвичай складає від 30 хвилин до п'яти днів, переважно від одного до трьох днів. [0068] У випадку застосування відновного каталізатора тиск водню в ході реакції зазвичай складає від 0,5 до 10 атмосфер, переважно від 1 до 5 атмосфер. [0069] Як правило, сполуку, одержану в даному процесі, можна використовувати в наступному процесі тільки після відфільтровування каталізатора. [0070] (Процес F) Сполуку (1) також можна одержувати за допомогою процесу F. [Хімічна формула 8] [де R, X, Y, Z та n є такими, як визначено вище.] [0071] (Процес F-1) Амідування Даний процес є процесом одержання сполуки (11) шляхом піддання карбоксильної групи сполуки (8) та аміногрупи сполуки (10) дегідратаційній конденсації, та його можна здійснювати за допомогою способу, подібного до такого процесу А. [0072] (Процес F-2) Видалення трет-бутильної групи та трет-бутилоксикарбонільної групи Даний процес є процесом одержання сполуки (12) шляхом реакції сполуки (11) з кислотою, та його можна здійснювати за допомогою способу, подібного до такого процесу C. [0073] (Процес F-3) Відновне амінування Даний процес є процесом одержання сполуки (1) шляхом реакції сполуки (12) з альдегідною сполукою (13) у присутності відновника, та його можна здійснювати за допомогою способу, подібного до такого процесу D. [0074] Сполуки (10) та (13) можуть бути доступні в якості комерційно доступних сполук, або їх можна легко одержати із комерційно доступних сполук за допомогою способів, зазвичай здійснюваних фахівцями в даній галузі техніки. [0075] (Процес G) 8 UA 112873 C2 Сполуку (2) також можна одержувати за допомогою нижчеописаного процесу G. [Хімічна формула 9] 5 10 15 20 25 , 2 [де X є таким, як визначено вище, V являє собою атом водню або метоксигрупу, та W являє собою атом галогену.] [0076] (Процес G-1) Етерифікація Даний процес є процесом одержання сполуки (16) шляхом реакції сполуки (14) зі сполукою (15) в інертному розчиннику в присутності основи. Даний процес можна здійснювати згідно із процесом B. [0077] (Процес G-2) Циклоприєднання Даний процес є процесом одержання сполуки (17) шляхом реакції сполуки (16) з N(метоксиметил)-N-(триметилсилілметил)бензиламіном в інертному розчиннику в присутності кислоти. [0078] Застосовуваний розчинник не обмежений особливим чином у тій мірі, у якій він до певної міри розчиняє вихідний матеріал та не інгібує реакцію, і приклади включають ефіри, такі як тетрагідрофуран, галогензаміщені вуглеводні, такі як дихлорметан та хлороформ, та ароматичні вуглеводні, такі як бензол та толуол, при цьому дихлорметан, та толуол, та змішаний розчинник із них є переважними. [0079] Застосовувана кислота може бути будь-якою кислотою, зазвичай використовуваною фахівцями в даній галузі техніки, і переважно є трифтороцтовою кислотою. [0080] Температура реакції варіює залежно від вихідного матеріалу, розчинника, відновника та кислоти, але зазвичай складає від -20°C до 60°C, переважно від 10°C до 40°C. [0081] Час реакції варіює залежно від вихідного матеріалу, розчинника, відновника та кислоти, але зазвичай складає від 30 хвилин до п'яти днів, переважно від 1 до 24 годин. [0082] Реакція може бути екзотермічною, переважно додавати по краплях N-(метоксиметил) 9 UA 112873 C2 5 10 15 20 25 30 35 40 45 50 N-(триметилсилілметил)бензиламін після змішування сполуки (16), розчинника та кислоти, у той же час слід виявляти обережність щодо виділення тепла. [0083] (Процес G-3) Алкілування Даний процес є процесом одержання сполуки (18) шляхом впливу основою на сполуку (17) в інертному розчиннику та потім реакції із трет-бутилбромацетатом. [0084] Застосовуваний розчинник не обмежений особливим чином у тій мірі, у якій він до певної міри розчиняє вихідний матеріал та не інгібує реакцію, і приклади включають ефіри, такі як тетрагідрофуран та діетиловий ефір, аліфатичні вуглеводні, такі як гексан, ароматичні вуглеводні, такі як толуол, та змішані розчинники із них, при цьому тетрагідрофуран і змішаний розчинник із тетрагідрофурану та гексану є переважними. [0085] Переважні приклади застосовуваної основи включають літієві солі органічних амінів, такі як діізопропіламід літію та біс(триметилсиліл)амід літію, при цьому діізопропіламід літію та біс(триметилсиліл)амід літію є більш переважними. [0086] Температура реакції варіює залежно від вихідного матеріалу, розчинника та основи, але зазвичай складає від -100°C до 50°C, переважно від -80°C до -40°C, найбільш переважно від -80°C до -70°C. [0087] Час реакції варіює залежно від вихідного матеріалу, розчинника та основи, але зазвичай складає від 30 хвилин до п'яти днів, переважно від 1 до 24 годин, найбільш переважно від 2 до 5 годин. [0088] (Процес G-4) Реакція гідрування Даний процес є процесом, у якому здійснюють реакцію сполуки (18) із воднем в інертному розчиннику в присутності відновного каталізатора із видаленням бензильної групи. [0089] Даний процес можна здійснювати згідно із вищеописаним процесом E. [0090] (Процес G-5) Хіральне розділення Даний процес є процесом одержання сполуки (2) шляхом піддання рацемату сполуки (2) хіральному розділенню. [0091] Застосовуваний розчинник для рухливої фази або завантаження зразка при розділенні не обмежений особливим чином у тій мірі, у якій він до певної міри розчиняє вихідний матеріал та не виявляє несприятливих ефектів на колонки або зразки, і приклади включають воду, водні сольові розчини, спирти, такі як метанол, етанол та 2-пропанол, гексан, ацетонітрил, тетрагідрофуран, трифтороцтову кислоту, діетиламін або змішані розчинники із них, при цьому ацетонітрил, етанол або змішаний розчинник із етанолу та гексану є переважними. [0092] Приклади застосовуваної колонки для розділення включають різні комерційно доступні колонки для оптичного розділення, при цьому CHIRALPAK AD-H, CHIRALPAK IA та CHIRALCEL OZ-H, виготовлені Daicel Chemical Industries, Ltd., є переважними. [0093] Температура колонки в ході розділення переважно складає від 10°C до 45°C. [0094] (Процес H) Сполуку (3), застосовувану в процесі А або подібному, також можна одержувати за допомогою нижчеописаного процесу H. [Хімічна формула 10] [де R та n є такими, як визначено вище.] [0095] (Процес H-1) Відновне амінування Даний процес є процесом одержання сполуки (20) шляхом реакції сполуки (19) зі сполукою (13) у присутності відновника в інертному розчиннику в присутності або відсутності кислоти, та його можна здійснювати згідно із процесом D. [0096] (Процес H-2) Видалення трет-бутилоксикарбонільної групи Даний процес є процесом одержання сполуки (3) шляхом реакції сполуки (20) з кислотою у відсутності розчинника або в інертному розчиннику із видаленням трет-бутилоксикарбонільної групи, та його можна здійснювати згідно із процесом C. [0097] (Процес I) 10 UA 112873 C2 Сполуку (2) також можна одержувати за допомогою нижчеописаного процесу I з використанням рацемату сполуки (2) у якості вихідного матеріалу. [Хімічна формула 11] 5 10 15 20 25 30 35 [де X та V є такими, як визначено вище.] [0098] (Процес I-1) Введення бензилоксикарбонільної групи Даний процес є процесом, у якому здійснюють реакцію рацемату сполуки (2) з бензилхлорформіатом в інертному розчиннику в присутності основи із уведенням бензилоксикарбонільної групи. [0099] Застосовуваний розчинник не обмежений особливим чином у тій мірі, у якій він до певної міри розчиняє вихідний матеріал та не інгібує реакцію, і приклади включають ефіри, такі як тетрагідрофуран та 1,4-діоксан, воду, N,N-диметилформамід, дихлорметан, ацетон та змішані розчинники із них, при цьому змішаний розчинник із води та ацетону є переважним. [0100] Приклади застосовуваної основи включають неорганічні основи, такі як гідроксид натрію, гідроксид калію, бікарбонат натрію, карбонат натрію та карбонат калію, та органічні аміни, такі як триетиламін та діізопропілетиламін, при цьому гідроксид натрію є переважним. [0101] Температура реакції варіює залежно від вихідного матеріалу, розчинника та основи, але зазвичай складає від -30°C до 20°C, переважно від -10°C до 15°C. [0102] Час реакції варіює залежно від вихідного матеріалу, розчинника та основи, але зазвичай складає від 30 хвилин до п'яти днів, переважно від 1 до 24 годин. [0103] (Процес I-2) Реакція етерифікації Даний процес є процесом одержання сполуки (22) шляхом реакції сполуки (21) з галоїдним бензилом в інертному розчиннику в присутності основи. Даний процес можна здійснювати згідно із процесом B. [0104] (Процес I-3) Хіральне розділення Даний процес є процесом одержання хіральної форми сполуки (22) шляхом піддання сполуки (22) хіральному розділенню. Даний процес можна здійснювати згідно із процесом G-5. [0105] (Процес I-4) Реакція гідрування Даний процес є процесом одержання сполуки (2) шляхом реакції хіральної форми сполуки (22) із воднем в інертному розчиннику в присутності відновного каталізатора. Даний процес можна здійснювати згідно із процесом E. [0106] (Процес J) Сполуку (2) також можна одержувати за допомогою нижчеописаного процесу J із використанням сполуки (18) у якості вихідного матеріалу. [Хімічна формула 12] 11 UA 112873 C2 5 10 15 20 25 30 35 [де X та V мають таке ж значення, як зазначено вище.] [0107] (Процес J-1) Введення бензилоксикарбонільної групи Даний процес є процесом одержання сполуки (22) шляхом реакції сполуки (18) із бензилхлорформіатом в інертному розчиннику із заміщенням бензильної групи бензилоксикарбонільною групою. [0108] Застосовуваний розчинник не обмежений особливим чином у тій мірі, у якій він до певної міри розчиняє вихідний матеріал та не інгібує реакцію, і приклади включають тетрагідрофуран, толуол, дихлорметан, хлороформ та змішані розчинники із них, при цьому дихлорметан є переважним. [0109] Температура реакції варіює залежно від вихідного матеріалу та розчинника, але зазвичай складає від -20°C до 60°C, переважно від 0°C до 40°C. [0110] Час реакції варіює залежно від вихідного матеріалу та розчинника, але зазвичай складає від 30 хвилин до п'яти днів, переважно від 1 до 24 годин. [0111] (Процес J-2) Хіральне розділення Даний процес є процесом одержання хіральної форми сполуки (22) шляхом піддання сполуки (22) хіральному розділенню. Даний процес можна здійснювати згідно із процесом G-5. [0112] (Процес J-3) Реакція гідрування Даний процес є процесом одержання сполуки (2) шляхом реакції хіральної форми сполуки (22) із воднем в інертному розчиннику в присутності відновного каталізатора. Даний процес можна здійснювати згідно із процесом E. [0113] Після завершення реакції в кожному процесі кожного способу, описаного вище, цільову сполуку в кожному процесі можна зібрати із реакційної суміші згідно зі звичайним способом. [0114] Наприклад, якщо вся реакційна суміш являє собою рідину, реакційну суміш охолоджують до кімнатної температури або, при необхідності, охолоджують льодом та нейтралізують, у відповідних випадках, кислотою, лугом, окисником або відновником, додають органічний розчинник, що не змішується із водою та не реагує із цільовою сполукою, такий як етилацетат, та відокремлюють шар, що містить цільову сполуку. Далі додають розчинник, що не змішується із одержаним у результаті шаром та не реагує із цільовою сполукою, промивають шар, що містить цільову сполуку, та відокремлюють шар. Більш того, якщо шар є органічним шаром, цільову сполуку можна зібрати шляхом висушування за допомогою осушника, такого як безводний сульфат магнію або безводний сульфат натрію, та відгону розчинника. Якщо шар є водним шаром, цільову сполуку можна зібрати шляхом електричного знесолення та потім ліофілізації шару. [0115] До того ж, якщо вся реакційна суміш являє собою рідину та, якщо можливо, цільову сполуку можна зібрати тільки шляхом відгону речовин, відмінних від цільової сполуки (таких як розчинник або реагент), при нормальному тиску або зниженому тиску. [0116] Далі, якщо тільки цільову сполуку осаджують у вигляді твердої речовини, або якщо 12 UA 112873 C2 5 10 15 20 25 30 35 40 45 50 55 60 вся реакційна суміш, описана вище, являє собою рідину та у ході збору осаджують тільки цільову сполуку, цільову сполуку далі можна зібрати шляхом збору цільової сполуки за допомогою спочатку фільтрації, промивання цільової сполуки, зібраної за допомогою фільтрації, відповідним органічним або неорганічним розчинником та висушування, так що маточний розчин обробляють способом, подібним до такого у випадку, коли уся реакційна суміш, описана вище, являє собою рідину. [0117] Більше того, якщо тільки реагент або каталізатор присутні у вигляді твердої речовини, або вся реакційна суміш, описана вище, являє собою рідину, та в ході збору тільки реагент або каталізатор осаджують у вигляді твердої речовини, і цільова сполука розчинена в розчині, цільову сполуку можна зібрати за допомогою спочатку відфільтровування реагенту або каталізатора, промивання відфільтрованого реагенту або каталізатора відповідним органічним або неорганічним розчинником, об'єднання одержаних у результаті промивних вод із маточним розчином і обробки одержаної в результаті суміші способом, подібним до такого у випадку, коли вся реакційна суміш, описана вище, являє собою рідину. [0118] Зокрема, якщо речовини, відмінні від цільової сполуки, які містяться в реакційній суміші, не інгібують реакцію на наступному етапі, реакційну суміш також можна використовувати на наступному етапі як є, без виділення цільової сполуки яким-небудь особливим чином. [0119] При необхідності рекристалізацію, різні хроматографічні способи та перегонку можна здійснювати для того, щоб підвищити ступінь чистоти цільової сполуки, зібраної вищеописаним способом. [0120] Як правило, якщо зібрана цільова сполука є твердою речовиною, ступінь чистоти цільової сполуки можна підвищити шляхом рекристалізації. При рекристалізації можна застосовувати один розчинник або суміш декількох розчинників, що не реагують із цільовою сполукою. Зокрема, цільову сполуку спочатку розчиняють в одному або декількох розчинниках, що не реагують із цільовою сполукою при кімнатній температурі або при нагріванні. Одержану в результаті суміш охолоджують крижаною водою або подібним чином, або перемішують, або витримують при кімнатній температурі, так що цільова сполука може кристалізуватися із суміші. [0121] Ступінь чистоти зібраної цільової сполуки можна підвищити шляхом різних хроматографічних способів. Загалом, можливо застосовувати слабкі кислотні силікагелі, такі як силікагель 60, виготовлений Merck KGaA (70-230 меш або 340-400 меш), і BW-300, виготовлений Fuji Silysia Chemical Ltd. (300 меш). У тих випадках, якщо цільова сполука є основною та адсорбується на вищеописаних силікагелях занадто сильно, також можливо використовувати NH-силікагелі, такі як силікагель, покритий пропіламіном, виготовлений Fuji Silysia Chemical Ltd. (200-350 меш), і одноразову попередньо заповнену колонку для препаративної хроматографії при середньому тиску, виготовлену Yamazen Corporation (Hi-Flash Amino). У тих випадках, якщо цільова сполука є біполярною або повинна бути елюйована за допомогою більш полярного розчинника, такого як метанол, наприклад, також можливо використовувати NAM-200H або NAM-300H, виготовлений NAM Laboratory, або YMC GEL ODSA, виготовлений YMC Co. Ltd. Також можливо використовувати одноразові попередньо заповнені колонки для препаративної хроматографії при середньому тиску, як описано вище, які попередньо заповнені наповнювачами та виготовлені Yamazen Corporation, Wako Pure Chemical Industries, Ltd., Biotage AB або W. R. Grace & Co. (Hi-Flash Amino). Цільову сполуку, ступінь чистоти якої підвищують, можна одержувати шляхом елюювання цільової сполуки одним або декількома розчинниками, що не реагують із цільовою сполукою, із використанням цих силікагелів та відгону розчинника(розчинників). [0122] У тих випадках, якщо зібрана цільова сполука являє собою рідину, ступінь чистоти цільової сполуки також можна підвищити шляхом перегонки. При перегонці цільову сполуку можна відігнати шляхом піддання цільової сполуки зниженому тиску при кімнатній температурі або при нагріванні. [0123] Типові приклади способу одержання сполуки (1) були описані вище. При одержанні сполуки (1) сировинні сполуки та різні реагенти можуть утворювати солі або сольвати, такі як гідрати, причому усі з них варіюють залежно від вихідного матеріалу, застосовуваного розчинника або подібного та не обмежені особливим чином у тій мірі, у якій вони не інгібують реакцію. Крім того, застосовуваний розчинник варіює залежно від вихідного матеріалу, реагенту або подібного та, зрозуміло, не обмежений особливим чином у тій мірі, у якій він не інгібує реакцію та розчиняє вихідний матеріал до певної міри. Якщо сполуки (1) одержують у вигляді вільних форм, вони можуть бути перетворені в солі, які можуть бути утворені сполуками (1), або сольватами сполук, або солями, за допомогою звичайних способів. [0124] Якщо сполуки (1) одержують у вигляді солей або сольватів, вони можуть бути перетворені у вільні форми сполук (1) за допомогою звичайних способів. 13 UA 112873 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0125] Різні ізомери, одержані для сполук (1) (такі як геометричні ізомери, оптичні ізомери, ротамери, стереоізомери та таутомери), можна очистити та виділити з використанням загальних способів розділення, наприклад, рекристалізації, утворення діастереомерної солі, ферментативного розділення та різних хроматографічних способів (таких як тонкошарова хроматографія, колонкова хроматографія та газова хроматографія). [0126] Сполуки (1) або їх фармацевтично прийнятні солі можна скласти за допомогою звичайних способів, і приклади лікарських форм включають пероральні склади (такі як таблетки, гранули, порошки, капсули та сиропи), склади для ін'єкцій (для внутрішньовенного введення, внутрішньом'язового введення, підшкірного введення та інтраперитонеального введення) і склади для зовнішнього застосування (такі як сполуки для усмоктування через шкіру (такі як мазі та пластирі), офтальмологічні препарати, назальні препарати та супозиторії). [0127] Ці тверді склади, такі як таблетки, капсули, гранули та порошки можуть містити, як правило, від 0,001 до 99,5 ваг. %, переважно від 0,01 до 90 ваг. % або т.п. сполук (1) або їх фармацевтично прийнятних солей. [0128] При виробництві пероральних твердих складів таблетки, гранули, порошки та капсули можна одержувати шляхом додавання, при необхідності, розріджувачів, зв'язуючих речовин, розпушувачів, змащувальних речовин, барвників або т.п. до сполук (1) або їх фармацевтично прийнятних солей та обробки за допомогою звичайних способів. При необхідності таблетки, гранули, порошки, капсули та т.п. також можна покрити оболонкою. [0129] Приклади розріджувачів включають лактозу, кукурудзяний крохмаль та мікрокристалічну целюлозу, приклади зв’язуючих речовин включають гідроксипропілцелюлозу та гідроксипропілметилцелюлозу, і приклади розпушувачів включають кальційкарбоксиметилцелюлозу та кроскармелозу натрію. [0130] Приклади змащувальних речовин включають стеарат магнію та стеарат кальцію, і приклади барвників включають оксид титану. [0131] Приклади речовин, що входять до складу плівкової оболонки, включають гідроксипропілцелюлозу, гідроксипропілметилцелюлозу та метилцелюлозу. [0132] Зрозуміло, що будь-які допоміжні речовини, описані вище, не обмежені цими прикладами. [0133] При одержанні сполук для ін'єкцій (для внутрішньовенного введення, внутрішньом'язового введення, підшкірного введення та інтраперитонеального введення), їх можна одержати шляхом додавання, при необхідності, регуляторів pH, буферів, суспендуючих засобів, солюбілізуючих компонентів, антиоксидантів, консервантів (антисептиків), речовин, що регулюють тонічність, або т.п. до сполук (1) або їх фармацевтично прийнятних солей та обробки за допомогою звичайних способів. Ліофілізовані сполуки, які необхідно розчинити перед застосуванням, також можна одержати шляхом ліофілізації. Ці сполуки для ін'єкцій можна вводити внутрішньовенно, підшкірно та внутрішньом'язово, наприклад. [0134] Приклади регуляторів pH та буферів включають органічні кислоти або неорганічні кислоти та/або їх солі, приклади суспендуючих засобів включають метилцелюлозу, полісорбат 80 та натрій-карбоксиметилцелюлозу, приклади солюбілізуючих компонентів включають полісорбат 80 та поліоксіетиленсорбітанмонолаурат, приклади антиоксидантів включають токоферол, приклади консервантів включають метилпарагідроксибензоат та етилпарагідроксибензоат, і приклади речовин, що регулюють тонічність, включають глюкозу, хлорид натрію та маніт; проте, зрозуміло, що допоміжні речовини не обмежені цими прикладами. [0135] Ці сполуки для ін'єкцій можуть містити, як правило, від 0,000001 до 99,5 ваг. %, переважно від 0,00001 до 90 ваг. % або т.п. сполук (1) або їх фармацевтично прийнятних солей. [0136] При одержанні складів для зовнішнього застосування склади для усмоктування через шкіру (такі як мазі та пластирі), очні краплі, краплі для носа, супозиторії та т.п. можна одержати шляхом додавання основних речовин та, при необхідності, емульгаторів, консервантів, регуляторів pH, барвників і т.п., описаних вище, до сполук (1) або їх фармацевтично прийнятних солей та обробки за допомогою звичайних способів. [0137] Різні сировинні матеріали, традиційно застосовувані для фармацевтичних препаратів, препаратів загального впливу, косметичних засобів і т.п. можна використовувати в якості основних речовин, і приклади включають сировинні матеріали, такі як тваринні та рослинні масла, мінеральні масла, складноефірні синтетичні масла, воски, вищі спирти та очищену воду. [0138] Ці склади для зовнішнього застосування можуть містити, як правило, від 0,000001 до 99,5 ваг. %, переважно від 0,00001 до 90 ваг. % або т.п. сполук (1) або їх фармацевтично прийнятних солей. [0139] Доза лікарського засобу згідно із даним винаходом зазвичай варіює залежно від 14 UA 112873 C2 5 10 15 20 25 30 35 40 45 50 55 60 симптому, віку, статі, ваги або т.п., але є припустимою, якщо вона є дозою, достатньою для одержання необхідного ефекту. Наприклад, для дорослої людини дозу від приблизно 0,1 до 5000 мг (переважно 0,5-1000 мг, більш переважно 1-600 мг) у день уводять за допомогою одного введення протягом одного або декількох днів або вводять дозу, розділену на 2-6 введень, протягом одного дня. [0140] Даний винахід також передбачає ізотопно-мічені сполуки (1), і такі сполуки є такими ж, як і сполуки (1), за винятком того, що один або декілька атомів заміщені атомом(атомами) з атомною масою або масовим числом, відмінним від атомної маси або масового числа, що зазвичай виявляється в природі. Ізотопи, які можуть бути включені в сполуки (1), є ізотопами 2 3 водню, вуглецю, азоту, кисню, фосфору, фтору, йоду та хлору, наприклад, та включають H, H, 11 14 13 15 18 32 35 123 125 C, C, N, O, F, P, S, I та I. [0141] Сполуки (1), що містять вищеописані ізотопи та/або інші ізотопи, або їх фармацевтично прийнятні похідні (такі як солі), перебувають у межах формули винаходу даного опису. Ізотопно-мічені сполуки за даним винаходом, наприклад, сполуки, у які включені 3 14 радіоактивні ізотопи, такі як H та/або C, є придатними для аналізів розподілення в тканинах 3 14 відносно лікарських засобів та/або субстратів. Вважається, що H та C є придатними через 11 18 легкість їх одержання та виявлення. Вважається, що ізотопи C та F є придатними для PET 125 (позитронно-емісійної томографії), вважається, що ізотоп I є придатним для SPECT (однофотонної емісійної комп'ютерної томографії), та всі ці ізотопи є придатними для томографії 2 головного мозку. Заміщення більш важкими ізотопами, такими як H, дає певні терапевтичні переваги, такі як збільшення періоду напіввиведення in vivo завдяки більш високій метаболічній стабільності або зниження необхідної дози, і, таким чином, за певних умов його вважають придатним. Ізотопно-мічені сполуки (1) можна постійно одержувати шляхом здійснення методик, розкритих у наступних схемах та/або прикладах, із використанням легко доступних ізотопномічених реагентів замість реагентів, що не є ізотопно-міченими. [0142] Сполуки (1) можна застосовувати в якості хімічних зондів, для того щоб уловлювати цільові білки серед біологічно активних низькомолекулярних сполук. Зокрема, сполуку (1) можна перетворити на зонд для афінної хроматографії, фотоафінний зонд або т.п. шляхом уведення групи-мітки, лінкеру або т.п. у фрагмент, що відрізняється від структурного фрагмента, необхідного для виявлення активності сполуки, за допомогою методики, описаної в J. Mass Spectrum. Soc. Jpn., Vol. 51, No. 5, 2003, pp. 492-498, або патентному документі WO 2007/139149, або т.п. [0143] Приклади груп-міток, лінкерів або т.п., використовуваних для хімічних зондів, включають групи, показані в групі, що складається з (1) - (5) нижче: (1) групи для мічення білків, такі як групи для фотоафінного мічення (такі як бензоїльна група, бензофенонова група, азидогрупа, карбонілазидогрупа, діазиридинова група, група енону, діазогрупа та нітрогрупа) та групи, що мають хімічну спорідненість (такі як кетонова група, у якій -вуглецевий атом заміщений атомом галогену, карбамоїльна група, складноефірна група, алкілтіогрупа, акцептори Міхаеля, такі як ,-ненасичені кетони та складні ефіри, та епоксидна група), (2) розщеплювані лінкери, такі як -S-S-, -O-Si-O-, моносахариди (такі як група глюкози та група галактози) або дисахариди (такі як лактоза) та олігопептидні лінкери, які розщеплюються шляхом ферментативної реакції, (3) маркерні групи для фішингу, такі як біотин та 3-(4,4-дифтор-5,7-диметил-4H-3a,4а-діаза4-бора-s-індацен-3-іл)пропіонільна група, 125 32 3 (4) маркери, що виявляються, такі як мічені радіоактивним ізотопом групи, такі як I, P, H 14 та C; флуоресцентні групи-мітки, такі як флуоресцеїн, родамін, дансил, умбеліферон, 7нітрофуразанільна та 3-(4,4-дифтор-5,7-диметил-4H-3a,4а-діаза-4-бора-s-індацен-3іл)пропіонільна група; хемілюмінесцентні групи, такі як люциферин та люмінол; та іони важких металів, такі як іони металів-лантаноїдів та іони радію; або (5) групи, зв'язані із твердофазними носіями, такими як скляні кульки, скляні пластини, титраційні мікропланшети, агарозні гранули, агарозні шари, полістирольні гранули, полістирольні шари, поліамідні гранули та поліамідні шари. Зонди, одержані шляхом уведення груп-міток або т.п., вибраних із групи, що складається з (1) - (5) вище, у сполуки (1) згідно зі способом, описаним у вищезгаданих документах, або т.п., можна застосовувати в якості хімічних зондів для визначення мічених білків, які є застосовними, наприклад, для пошуку нових мішеней для лікарської речовини. Приклади [0144] Сполуки (1) можна одержувати за допомогою способів, описаних у прикладах нижче, наприклад, та ефекти сполук (1) можна підтверджувати за допомогою способів, описаних нижче 15 UA 112873 C2 5 10 15 20 25 30 35 40 45 50 55 60 в тестових прикладах. Однак, ці способи є ілюстративними, і даний винахід так або інакше не обмежений наступними конкретними прикладами. [0145] У тих випадках, коли оксид дейтерію застосовували в якості розчинника, 1 використовуваного для вимірювання в H-ЯМР для підтвердження структур сполук, хімічний зсув спектра кожної сполуки показаний у вигляді значення, скоректованого стосовно хімічного зсуву залишкового піка розчинника в оксиді дейтерію як 4,79. [0146] (Приклад 1) Хіральна форма 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)феніл] метил}-3{[1-(2-фторпентил)піперидин-4-іл] карбамоїл}-4-метилпіролідин-3-іл] оцтової кислоти [0147] (Приклад 1a) Трет-бутил-4-{[(бензилокси)карбоніл] аміно}піперидин-1-карбоксилат Трет-бутил-4-амінопіперидин-1-карбоксилат (10 г, 49,9 ммоль), N,N-діізопропілетиламін (26 мл, 149 ммоль), бензилхлорформіат (8,5 мл, 59,5 ммоль) та дихлорметан (дегідратований) (300 мл) змішували при охолодженні льодом. Одержану в результаті суміш перемішували при кімнатній температурі протягом однієї години. Водний насичений розчин бікарбонату натрію додавали до реакційної суміші, яку три рази екстрагували дихлорметаном. Органічний шар промивали сольовим розчином, та висушували над безводним сульфатом натрію, та відганяли розчинник. Залишок очищували за допомогою колонкової хроматографії на силікагелі (силікагель, розчинник для елюювання: етилацетат/гептан) із одержанням титульної сполуки (13,1 г, вихід 78,5%). 1 H-ЯМР (400 МГц, CDCl3) ppm; 1,24-1,38 (2H, m), 1,45 (9H, s), 1,88-2,00 (2H, br), 2,80-2,94 (2H, br), 3,60-3,72 (1H, br), 3,92-4,10 (2H, br), 4,63-4,75 (1H, m), 5,09 (2H, s), 7,26-7,40 (5H, m). [0148] (Приклад 1b) Бензил-N-(піперидин-4-іл)карбамат Суміш трет-бутил-4-{[(бензилокси)карбоніл] аміно}піперидин-1-карбоксилату, одержаного в прикладі 1a (13,1 г, 39,2 ммоль), 5 N водного розчину соляної кислоти (40 мл, 200 ммоль) та метанолу (40 мл) перемішували при кімнатній температурі протягом 23 годин. 5 N водний розчин гідроксиду натрію (40 мл) додавали до реакційної суміші при охолодженні льодом. Воду та розчинник відганяли із реакційної суміші, у той час як суміш азеотропно переганяли із етанолом. Етанол додавали до залишку, нерозчинну речовину видаляли за допомогою фільтрації та фільтрат концентрували із одержанням титульної сполуки (9,10 г, вихід 99,1%). 1 H-ЯМР (400 МГц, CDCl3) ppm; 1,31-1,42 (2H, m), 1,92-2,04 (2H, br), 2,70 (2H, d, J=12 Гц), 3,10 (2H, d, J=12 Гц), 3,56-3,68 (1H, br), 4,72-4,81 (1H, br), 5,09 (2H, s), 7,26-7,40 (5H, m). [0149] (Приклад 1c) Хіральна форма бензил-N-[1-(2-фторпентил)піперидин-4-іл] карбамату (5S)-(-)-2,2,3-Триметил-5-бензил-4-імідазолідинондихлороцтову кислоту (90 мг, 0,259 ммоль), N-фторбензолсульфонімід (484 мг, 1,53 ммоль), 2-пропанол (0,4 мл) та тетрагідрофуран (дегідратований) (3,6 мл) змішували при кімнатній температурі. Реакційну суміш охолоджували до -10°C та потім додавали пентаналь (0,175 мл, 1,67 ммоль) із наступним перемішуванням протягом трьох годин та 20 хвилин, у той же час вона природним чином нагрівалася від -10°C до кімнатної температури. Бензил-N-(піперидин-4-іл)карбамат, одержаний у прикладі 1b (304 мг, 1,3 ммоль), та триацетоксиборогідрид натрію (600 мг, 2,83 ммоль) додавали до реакційної суміші, яку перемішували при кімнатній температурі протягом 15 годин та 40 хвилин. Воду та водний розчин бікарбонату натрію додавали до реакційної суміші, нерозчинну речовину видаляли за допомогою фільтрації та одержаний у результаті фільтрат двічі екстрагували етилацетатом. Органічний шар промивали сольовим розчином, та висушували над безводним сульфатом натрію, та відганяли розчинник. Залишок очищували за допомогою колонкової хроматографії на силікагелі (силікагель, розчинник для елюювання: етилацетат/гептан) із одержанням суміші хіральних форм титульної сполуки (44 мг, вихід 10,5%). 1 H-ЯМР (400 МГц, CDCl3) ppm; 0,94 (3H, t, J=7 Гц), 1,38-1,70 (6H, m), 1,85-2,00 (2H, br), 2,14-2,24 (2H, m), 2,35-2,48 (1H, m), 2,55-2,64 (1H, m), 2,80-3,00 (2H, m), 3,48-3,60 (1H, m), 4,594,72 (2H, m), 5,09 (2H, s), 7,26-7,37 (5H, m). Розділення оптичних ізомерів за допомогою HPLC (Умови аналізу) Колонка: CHIRALPAK AD-H (виготовлена Daicel Chemical Industries, Ltd.) (0,46 см у діаметрі × 15 см), елюент: гексан/етанол = 9/1 (об./об.), швидкість потоку: 1 мл/хв., виявлення: UV (210 нм). (Результат аналізу) Одержану в результаті суміш хіральних форм аналізували при вищевказаних умовах аналізу та спостерігали пік при часі втримання, що складає 7,30 хвилини (енантіомерний надлишок: 80% ee), та пік при часі втримання, що складає 8,28 хвилини. Далі одержували дві партії суміші хіральних форм за допомогою способу, подібного до вищеописаного способу. Загалом три партії суміші хіральних форм (451 мг, 1,4 ммоль) розчиняли в етанолі (18 мл), та декілька разів розділяли на оптичні ізомери при наступних умовах фракціонування, та пік з більш коротким часом утримання розділяли на фракції із 16 UA 112873 C2 5 10 15 20 25 30 35 40 45 50 55 60 одержанням титульної сполуки (318 мг). (Умови фракціонування) Колонка: CHIRALPAK AD-H (виготовлена Daicel Chemical Industries, Ltd.) (2 см у діаметрі × 25 см), елюент: гексан/етанол = 9/1 (об./об.), швидкість потоку: 10 мл/хв., виявлення: UV (220 нм). 1 H-ЯМР (400 МГц, CDCl3) ppm; 0,94 (3H, t, J=7 Гц), 1,38-1,70 (6H, m), 1,85-2,00 (2H, br), 2,14-2,24 (2H, m), 2,35-2,48 (1H, m), 2,55-2,64 (1H, m), 2,80-3,00 (2H, m), 3,48-3,60 (1H, m), 4,594,72 (2H, m), 5,09 (2H, s), 7,26-7,37 (5H, m). Одержану в результаті титульну сполуку аналізували при вищевказаних умовах аналізу із виявленням того, що час утримання складав 7,41 хвилини, та енантіомерний надлишок складав >99% ee. [0150] (Приклад 1d) Хіральна форма 1-(2-фторпентил)піперидин-4-аміну Суміш хіральної форми (з більш коротким часом утримання) бензил-N-[1-(2фторпентил)піперидин-4-іл] карбамату, одержаної в прикладі 1c (318 мг, 0,986 ммоль), 10% Pd/C (100 мг) та метанолу (7 мл) перемішували при кімнатній температурі протягом двох годин в атмосфері водню. Атмосферу в реакційній посудині заміняли азотом, відфільтровували 10% Pd/C та розчинник відганяли із одержанням титульної сполуки (249 мг). 1 H-ЯМР (400 МГц, CDCl3) ppm; 0,95 (3H, t, J=7 Гц), 1,35-1,70 (4H, m), 1,92-2,10 (2H, br), 2,20-2,32 (2H, br), 2,48-2,62 (2H, br), 2,65-2,91 (2H, m), 3,18-3,30 (2H, br), 3,31-3,42 (1H, br), 4,724,93 (1H, m). [0151] (Приклад 1e) Бензил-(2E)-бут-2-еноат Кротонову кислоту (70 г, 812 ммоль) розчиняли в N,N-диметилформаміді (467 мл), який охолоджували на льодяній бані в атмосфері азоту, та додавали карбонат калію (61,6 г, 447 ммоль). Бромистий бензил (91,7 мл, 772 ммоль) додавали по краплях до реакційної суміші протягом 20 хвилин. Реакційну суміш перемішували при кімнатній температурі протягом 18 годин. Етилацетат додавали до реакційної суміші, яку фільтрували через целіт. Профільтрований розчин етилацетату промивали водою, насиченим водним розчином бікарбонату натрію та насиченим водним розчином хлориду натрію. Органічний шар висушували над сульфатом магнію, фільтрували та концентрували при зниженому тиску із одержанням титульної сполуки (142 г, вихід: 99,4%). 1 H-ЯМР (400 МГц, CDCl3) ppm; 1,87-1,90 (3H, m), 5,17 (2H, s), 5,87-5,92 (1H, m), 6,98-7,07 (1H, m), 7,26-7,39 (5H, m). [0152] (Приклад 1f) Бензил-(3RS,4SR)-1-бензил-4-метилпіролідин-3-карбоксилат Бензил-(2E)-бут-2-еноат, одержаний у прикладі 1e (20,5 г, 116 ммоль), розчиняли в дихлорметані (5 мл), і суміш охолоджували на льодяній бані із перемішуванням. Додавали трифтороцтову кислоту (257 мкл, 3,47 ммоль) та N-(метоксиметил)-N(триметилсилілметил)бензиламін (33,1 г, 139 ммоль) додавали по краплях до реакційної рідини протягом 15 хвилин, так що внутрішня температура не перевищувала 62°C, у той же час здійснювали промивання дихлорметаном (25 мл). Реакційну рідину витримували, поки вона не досягала кімнатної температури, і перемішували протягом 15 годин. Реакційну рідину концентрували та очищували за допомогою колонкової хроматографії на силікагелі (розчинник для елюювання: етилацетат/гептан) із одержанням титульної сполуки (38 г). 1 H-ЯМР (400 МГц, CDCl3) ppm; 1,14 (3H, d, J=6 Гц), 2,18-2,22 (1H, m), 2,48-2,65 (2H, m), 2,75-2,85 (2H, m), 2,90-2,94 (1H, m), 3,54-3,66 (2H, m), 5,13 (2H, s), 7,20-7,40 (10H, m). [0153] (Приклад 1g) Бензил-(3RS,4SR)-1-бензил-3-[2-(трет-бутоксі)-2-оксоетил]-4метилпіролідин-3-карбоксилат Бензил-(3RS,4SR)-1-бензил-4-метилпіролідин-3-карбоксилат, одержаний у прикладі 1f (30 г, 97,4 ммоль), розчиняли в тетрагідрофурані (300 мл), який охолоджували до -70°C із перемішуванням в атмосфері азоту. 1,11 M розчин діізопропіламіду літію/н-гексантетрагідрофурану (105 мл, 116 ммоль) додавали по краплях протягом 20 хвилин, так що внутрішня температура не перевищувала -64,3°C. Суміш перемішували при -70°C протягом 1 години та потім по краплях додавали тетрагідрофуран (30 мл) та трет-бутил-бромацетат (26,6 г, 136 ммоль) протягом 10 хвилин, так що внутрішня температура не перевищувала -60°C. Реакційну суміш перемішували при -70°C протягом додаткової однієї години та потім до реакційної суміші додавали насичений водний розчин хлориду амонію. Відразу після цього реакційну суміш розводили водою та додавали етилацетат. Органічний шар промивали сольовим розчином та 5 N водним розчином соляної кислоти та потім висушували над сульфатом магнію, фільтрували та концентрували. Залишок очищували за допомогою колонкової хроматографії на силікагелі (розчинник для елюювання: етилацетат/гептан). Залишок додатково очищували за допомогою колонкової хроматографії на NH-силікагелі (розчинник для елюювання: гептан/етилацетат = 98/2) із одержанням титульної сполуки (6 г, 17 UA 112873 C2 5 10 15 20 25 30 35 40 45 50 55 60 вихід: 14,5%). 1 H-ЯМР (400 МГц, CDCl3) ppm; 0,86 (3H, d, J=6 Гц), 1,34 (9H, s), 2,05-2,15 (2H, m), 2,53 (1H, d, J=17 Гц), 2,91-3,00 (3H, m), 3,28 (1H, d, J=10 Гц), 3,59-3,72 (2H, m), 5,08-5,16 (2H, m), 7,19-7,39 (10H, m). За допомогою подібного способу одержували 18,1 г титульної сполуки. [0154] (Приклад 1h) 1,3-Дибензил-(3RS,4SR)-3-[2-(трет-бутоксі)-2-оксоетил]-4метилпіролідин-1,3-дикарбоксилат Бензил-(3RS,4SR)-бензил-3-[2-(трет-бутоксі)-2-оксоетил]-4-метилпіролідин-3-карбоксилат, одержаний способом, подібним до такого у прикладі 1g (11,7 г, 27,6 ммоль), розчиняли в дихлорметані (117 мл) та бензилхлорформіат (23,7 мл, 166 ммоль) додавали по краплях до реакційної рідини протягом 20 хвилин, так що внутрішня температура не перевищувала 22°C. Суміш перемішували при кімнатній температурі протягом 12 годин та потім відганяли розчинник. Залишок очищували за допомогою колонкової хроматографії на NH-силікагелі (розчинник для елюювання: етилацетат/гептан) із одержанням титульної сполуки (9,1 г, вихід: 70,5%). 1 H-ЯМР (400 МГц, CDCl3) ppm; 0,84-0,90 (3H, m), 1,32-1,46 (9H, m), 2,09-2,16 (1H, m), 2,212,27 (1H, m), 3,04-3,14 (2H, m), 3,33-3,38 (1H, m), 3,60-3,68 (1H, m), 4,32 (1H, t, J=12 Гц), 5,075,20 (4H, m), 7,26-7,36 (10H, m). Аналіз за допомогою HPLC (Умови аналізу 1) Колонка: CHIRALPAK AD-H (виготовлена Daicel Chemical Industries, Ltd.) (0,46 см у діаметрі 15 см), елюент: гексан/етанол = 95/5 (об./об.), швидкість потоку: 1 мл/хв., виявлення: UV (210 нм). (Результат аналізу) Одержану в результаті титульну сполуку аналізували при вищевказаних умовах аналізу 1 та спостерігали пік при часі втримання, що складав 8,56 хвилини, та пік при часі втримання, що складав 10,85 хвилини. Титульну сполуку, одержану окремо, аналізували на хіральній колонці, відмінній від вищеописаної колонки. (Умови аналізу 2) Колонка: CHIRALPAK IA (виготовлена Daicel Chemical Industries, Ltd.) (0,46 см у діаметрі 15 см), елюент: гексан/етанол = 95/5 (об./об.), швидкість потоку: 1 мл/хв., виявлення: UV (210 нм) (Результат аналізу) Одержану в результаті титульну сполуку аналізували при вищеописаних умовах аналізу 2 та спостерігали пік при часі втримання, що складав 6,78 хвилини, та пік при часі втримання, що складав 8,20 хвилини. [0155] (Приклад 1i) (3S,4R)-3-[2-(Трет-бутоксі)-2-оксоетил]-4-метилпіролідин-3-карбонова кислота 1,3-Дибензил-(3RS,4SR)-3-[2-(трет-бутоксі)-2-оксоетил]-4-метилпіролідин-1,3-дикарбоксилат, одержаний у прикладі 1h (9,1 г), декілька разів розділяли на оптичні ізомери при наступних двох типах умов A або B. Розділення оптичних ізомерів за допомогою HPLC (Умови фракціонування A) Колонка: CHIRALPAK AD-H (виготовлена Daicel Chemical Industries, Ltd.) (2 см у діаметрі × 25 см), елюент: гексан/етанол = 85/15 (об./об.), швидкість потоку: 8-10 мл/хв. (Умови фракціонування B) Колонка: CHIRALPAK IA (виготовлена Daicel Chemical Industries, Ltd.) (3 см у діаметрі × 25 см), елюент: гексан/етанол = 95/5 (об./об.), швидкість потоку: 22 мл/хв. Пік з більш коротким часом утримання розділяли на фракції та одержані в результаті три партії потім аналізували при наступних умовах аналізу. Аналіз за допомогою HPLC (Умови аналізу) Колонка: CHIRALPAK AD-H (виготовлена Daicel Chemical Industries, Ltd.) (0,46 см у діаметрі × 15 см), елюент: гексан/етанол = 95/5 (об./об.), швидкість потоку: 1 мл/хв., виявлення: UV (210 нм). (Результат аналізу) Час утримання складав від 9,0 хвилини до 9,3 хвилини, та енантіомерний надлишок складав >99% ee для всіх партій. Об’єднували три партії, одержану в результаті хіральну форму (4,04 г) розчиняли в метанолі (121 мл), додавали 10% Pd/C (0,77 г) та атмосферу заміняли газоподібним воднем. Суміш перемішували при кімнатній температурі протягом 13 годин, та потім перемішували із додаванням теплої води (від 30 до 40°C, 122 мл), та розчиняли осаджену тверду речовину. Після того, як відфільтровували Pd/C, розчинник концентрували та висушували із одержанням титульної сполуки (2,1 г). 1 H-ЯМР (400 МГц, D2O) ppm; 0,97 (3H, d, J=7 Гц), 1,42 (9H, s), 2,15-2,22 (1H, m), 2,30 (1H, d, J=17 Гц), 2,93 (1H, d, J=17 Гц), 3,04 (1H, t, J=12 Гц), 3,18 (1H, d, J=12 Гц), 3,49 (1H, dd, J=8, 12 Гц), 4,03 (1H, d, J=12 Гц). 18 UA 112873 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0156] (Приклад 1j) (3S,4R)-1-бензил-3-[2-(трет-бутоксі)-2-оксоетил]-4-метилпіролідин-3карбонова кислота Суміш (3S,4R)-3-[2-(трет-бутоксі)-2-оксоетил]-4-метилпіролідин-3-карбонової кислоти, одержаної в прикладі 1i (1,8 г, 7,4 ммоль), бензальдегіду (1,51 мл, 14,8 ммоль), оцтової кислоти (0,635 мл, 11,1 ммоль), триацетоксиборогідриду натрію (3,14 г, 14,8 ммоль) та метанолу (35 мл) нагрівали при 40°C протягом 38 годин та 30 хвилин. Реакційну суміш концентрували та одержаний у результаті залишок очищували за допомогою колонкової хроматографії на силікагелі (ODS-силікагель, розчинник для елюювання: вода/метанол) із одержанням титульної сполуки у вигляді партії A (584 мг) та партії B (708 мг). 1 H-ЯМР (400 МГц, CDCl3) для партії A ppm; 1,02 (3H, d, J=7 Гц), 1,38 (9H, s), 2,14 (1H, d, J=17 Гц), 2,15-2,28 (1H, br), 2,97 (1H, d, J=17 Гц), 3,10-3,42 (3H, m), 4,00-4,10 (1H, m), 4,30-4,40 (1H, br), 4,46 (1H, d, J=12 Гц), 7,45-7,53 (5H, m). 1 H-ЯМР для партії B: такий же, як ЯМР для партії A. [0157] (Приклад 1k) Хіральна форма трет-бутил-2-[(3S,4R)-1-бензил-3-{[1-(2фторпентил)піперидин-4-іл] карбамоїл}-4-метилпіролідин-3-іл] ацетату Суміш (3S,4R)-1-бензил-3-[2-(трет-бутоксі)-2-оксоетил]-4-метилпіролідин-3-карбонової кислоти, одержаної в прикладі 1j (300 мг, 0,9 ммоль), хіральної форми 1-(2фторпентил)піперидин-4-аміну, одержаної в прикладі 1d (182 мг, 0,967 ммоль), триетиламіну (0,376 мл, 2,7 ммоль), PyBOP (656 мг, 1,26 ммоль) і N,N-диметилформаміду (4,5 мл) перемішували при кімнатній температурі протягом 61 години та 30 хвилин. Триетиламін (0,207 мл, 1,49 ммоль) та PyBOP (360 мг, 0,69 ммоль) потім додавали із наступним перемішуванням протягом чотирьох годин та 30 хвилин. Воду додавали до реакційної суміші, яку двічі екстрагували етилацетатом. Органічний шар промивали насиченим водним розчином хлориду амонію, та висушували над безводним сульфатом магнію, та відганяли розчинник. Залишок очищували за допомогою колонкової хроматографії на силікагелі (NH-силікагель, розчинник для елюювання: етилацетат/гептан) із одержанням титульної сполуки (161 мг, вихід 35,5%). 1 H-ЯМР (400 МГц, CDCl3) ppm; 0,92 (3H, d, J=7 Гц), 0,96 (3H, t, J=7 Гц), 1,40 (9H, s), 1,401,60 (6H, m), 1,82-2,09 (4H, m), 2,16-2,28 (2H, m), 2,36 (1H, d, J=10 Гц), 2,35-2,50 (1H, m), 2,562,67 (3H, m), 2,80-2,90 (2H, br), 3,09 (1H, d, J=16 Гц), 3,58-3,79 (4H, m), 4,59-4,80 (1H, m), 7,257,40 (5H, m), 8,58 (1H, d, J=8 Гц). [0158] (Приклад 1l) Хіральна форма трет-бутил-2-[(3S,4R)-1-{[2-хлор-6(трифторметил)феніл] метил}-3-{[1-(2-фторпентил)піперидин-4-іл] карбамоїл}-4-метилпіролідин3-іл] ацетату Суміш хіральної форми трет-бутил-2-[(3S,4R)-1-бензил-3-{[1-(2-фторпентил)піперидин-4-іл] карбамоїл}-4-метилпіролідин-3-іл] ацетату, одержаної в прикладі 1k (161 мг, 0,32 ммоль), 20% гідроксиду паладію (135 мг) та метанолу (5 мл) перемішували при кімнатній температурі протягом 15 годин в атмосфері водню. Атмосферу в реакційній посудині заміняли азотом, відфільтровували 20% гідроксид паладію та відганяли розчинник. 2-(Бромметил)-1-хлор-3(трифторметил)бензол (159 мг, 0,581 ммоль), карбонат калію (97 мг, 0,702 ммоль) та N,Nдиметилформамід (2 мл) додавали до одержаного в результаті залишку, який нагрівали при 45°C протягом трьох годин та 15 хвилин. Воду додавали до реакційної суміші, яку двічі екстрагували етилацетатом. Органічний шар промивали насиченим водним розчином хлориду амонію, та висушували над безводним сульфатом магнію, та відганяли розчинник. Залишок очищували за допомогою колонкової хроматографії на силікагелі (NH-силікагель, розчинник для елюювання: етилацетат/гептан) із одержанням титульної сполуки (153 мг, вихід 78,9%). 1 H-ЯМР (400 МГц, CDCl3) ppm; 0,91 (3H, d, J=7 Гц), 0,95 (3H, t, J=7 Гц), 1,38-1,70 (7H, m), 1,39 (9H, s), 1,82-1,90 (1H, br), 1,97 (1H, d, J=16 Гц), 2,00-2,20 (3H, m), 2,31-2,45 (1H, m), 2,502,68 (3H, m), 2,80-2,92 (3H, m), 3,12 (1H, d, J=16 Гц), 3,57 (1H, d, J=10 Гц), 3,60-3,72 (1H, m), 3,92 (1H, d, J=13 Гц), 3,98 (1H, d, J=13 Гц), 4,56-4,74 (1H, m), 7,37 (1H, t, J=8 Гц), 7,61-7,68 (2H, m), 7,85 (1H, d, J=8 Гц). [0159] (Приклад 1m) Хіральна форма 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)феніл] метил}3-{[1-(2-фторпентил)піперидин-4-іл] карбамоїл}-4-метилпіролідин-3-іл] оцтової кислоти Суміш хіральної форми трет-бутил-2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)феніл] метил}-3{[1-(2-фторпентил)піперидин-4-іл] карбамоїл}-4-метилпіролідин-3-іл] ацетату, одержаної в прикладі 1l (153 мг, 0,252 ммоль), трифтороцтової кислоти (2 мл, 26,9 ммоль) та дихлорметану (дегідратованого) (2 мл) перемішували при кімнатній температурі протягом двох годин та 35 хвилин. Реакційну суміш концентрували та одержаний у результаті залишок очищували за допомогою колонкової хроматографії на силікагелі (ODS-силікагель, розчинник для елюювання: вода/метанол) із одержанням титульної сполуки (122 мг, вихід 88%). 19 UA 112873 C2 H-ЯМР (400 МГц, CDCl3) ppm; 0,94-1,02 (6H, m), 1,32-1,70 (5H, m), 1,82-1,90 (1H, br), 2,072,20 (3H, m), 2,35-2,75 (8H, m), 2,81-3,05 (3H, m), 3,19 (1H, d, J=10 Гц), 3,63-3,75 (1H, m), 3,89 (1H, d, J=13 Гц), 4,00 (1H, d, J=13 Гц), 4,56-4,76 (1H, m), 7,40 (1H, t, J=8 Гц), 7,62-7,70 (2H, m), 8,52 (1H, d, J=7 Гц). [0160] (Приклад 2) 2-[(3S,4R)-1-[(2,6-дихлорфеніл)метил]-3-({1-[(4,4дифторциклогексил)метил] піперидин-4-іл}карбамоїл)-4-метилпіролідин-3-іл] оцтова кислота [0161] (Приклад 2a) 4,4-Дифтор-N-метоксі-N-метилциклогексан-1-карбоксамід Суміш етил-4,4-дифторциклогексан-1-карбоксилату (1,9 г, 9,88 ммоль) та тетрагідрофурану (60 мл) охолоджували до -70°C і додавали гідрохлорид N,O-диметилгідроксіаміну (1,44 г, 14,8 ммоль). Далі 1,05 M н-пропілмагнію броміду (24,2 мл, 25,2 ммоль) додавали по краплях до реакційної суміші при -55°C протягом п'яти хвилин, так що внутрішня температура не перевищувала -35°C, і реакційну суміш перемішували при 0°C протягом 30 хвилин. Насичений водний розчин хлориду амонію додавали до реакційної суміші, яку екстрагували етилацетатом. Органічний шар висушували над сульфатом магнію та відганяли розчинник. Залишок очищували за допомогою колонкової хроматографії на силікагелі (розчинник для елюювання: етилацетат/гептан) із одержанням титульної сполуки (1,7 г, вихід 83%). 1 H-ЯМР (400 МГц, CDCl3) ppm; 1,65-1,95 (6H, br), 2,13-2,30 (2H, br), 2,70-2,82 (1H, br), 3,20 (3H, s), 3,70 (3H, s). [0162] (Приклад 2b) 4,4-Дифторциклогексан-1-карбальдегід Суміш 4,4-дифтор-N-метоксі-N-метилциклогексан-1-карбоксаміду, одержаного в прикладі 2a (1,7 г, 8,21 ммоль), та тетрагідрофурану (60 мл) охолоджували до -70°C, додавали 1,0 M розчин гідриду діізобутилалюміню/толуолу (9,85 мл, 9,85 ммоль) та реакційну суміш перемішували при -60°C протягом 35 хвилин. Далі додавали 1,0 M розчин гідриду діізобутилалюмінію/толуолу (5 мл, 5 ммоль) при -65°C та реакційну суміш перемішували при -70°C протягом двох годин. 2 N водний розчин соляної кислоти додавали до реакційної суміші, яку екстрагували етилацетатом. Органічний шар висушували над сульфатом магнію та відганяли розчинник із одержанням неочищеного продукту на основі титульної сполуки (1,4 г). 1 H-ЯМР (400 МГц, CDCl3) ppm; 1,72-1,92 (4H, br), 1,95-2,18 (4H, br), 2,30-2,40 (1H, br), 9,68 (1H, s). [0163] (Приклад 2c) Трет-бутил-N-{1-[(4,4-дифторциклогексил)метил] піперидин-4іл}карбамат Суміш неочищеного продукту на основі 4,4-дифторциклогексан-1-карбальдегіду, одержаного в прикладі 2b (1,4 г), та тетрагідрофурану (100 мл) охолоджували до 0°C, до неї додавали третбутил-N-(піперидин-4-іл)карбамат (2,27 г, 11,3 ммоль) із наступним перемішуванням протягом 20 хвилин. Триацетоксиборогідрид натрію (2,2 г, 10,4 ммоль) потім додавали до реакційної суміші, яку перемішували при кімнатній температурі протягом восьми годин. Сольовий розчин додавали до реакційної суміші, яку екстрагували етилацетатом. Органічний шар висушували над сульфатом магнію та відганяли розчинник. Залишок очищували за допомогою колонкової хроматографії на силікагелі (розчинник для елюювання: етилацетат/гептан). Одержаний у результаті залишок розчиняли в етилацетаті та промивали насиченим водним розчином бікарбонату натрію, і потім відганяли розчинник із одержанням титульної сполуки (650 мг, вихід 20,7%). 1 H-ЯМР (400 МГц, CDCl3) ppm; 1,15-2,20 (17H, m), 1,44 (9H, s), 2,70-2,85 (2H, br), 3,38-3,53 (1H, br), 4,37-4,50 (1H, br). [0164] (Приклад 2d) 1-[(4,4-Дифторциклогексил)метил] піперидин-4-амін 4 N розчин хлороводню/1,4-діоксану (11 мл, 43 ммоль) додавали до суміші трет-бутил-N-{1[(4,4-дифторциклогексил)метил] піперидин-4-іл}карбамату, одержаного в прикладі 2c (650 мг, 1,96 ммоль), та метанолу (11 мл) із наступним перемішуванням при кімнатній температурі протягом трьох годин. Після концентрування реакційної рідини залишок розчиняли в етилацетаті, додавали 1 N водний розчин гідроксиду натрію та відокремлювали органічний шар. Далі водний шар двічі екстрагували етилацетатом, органічні шари висушували над сульфатом натрію та потім відганяли розчинник із одержанням титульної сполуки (419 мг, вихід 92%). 1 H-ЯМР (400 МГц, CDCl3) ppm; 1,16-1,42 (7H, m), 1,59-2,16 (12H, m), 2,58-2,68 (1H, m), 2,742,82 (2H, m). [0165] (Приклад 2e) (4-Метоксифеніл)метил-(2E)-бут-2-еноат Кротонову кислоту (17,2 г, 200 ммоль) розчиняли в N,N-диметилформаміді (100 мл) із охолодженням на льодяній бані в атмосфері азоту та додавали порошкоподібний карбонат калію (15,2 г, 110 ммоль). Суміш перемішували протягом 30 хвилин і потім додавали по краплях 4-метоксибензилхлорид (29,8 г, 190 ммоль) протягом 15 хвилин. Реакційну суміш перемішували при кімнатній температурі протягом чотирьох годин та при 45°C протягом 14 годин. До 1 5 10 15 20 25 30 35 40 45 50 55 60 20 UA 112873 C2 5 10 15 20 25 30 35 40 45 50 55 60 реакційної рідини додавали етилацетат (500 мл) та воду (200 мл). Відокремлений органічний шар промивали водою (100 мл × 2) і сольовим розчином (100 мл). Водний шар екстрагували етилацетатом (100 мл). Органічні шари об’єднували, висушували над сульфатом магнію, фільтрували та концентрували при зниженому тиску із одержанням неочищеного продукту на основі титульної сполуки (40,51 г, вихід: 98,2%). 1 H-ЯМР (400 МГц, CDCl3) ppm; 1,87 (3H, dd, J=2, 7 Гц), 3,81 (3H, s), 5,10 (2H, s), 5,87 (1H, dq, J=2, 16 Гц), 6,86-6,92 (2H, m), 7,00 (1H, dq, J=7, 16 Гц), 7,28-7,34 (2H, m). [0166] (Приклад 2f) (4-Метоксифеніл)метил-(3RS,4SR)-1-бензил-4-метилпіролідин-3карбоксилат Титульну сполуку (57,86 г, вихід: 86,5%) одержували із (4-метоксифеніл)метил-(2E)-бут-2еноату, одержаного в прикладі 2e (40,6 г, 197 ммоль), за допомогою способу, подібного до способу, описаного в прикладі 1f. 1 H-ЯМР (400 МГц, CDCl3) ppm; 1,12 (3H, d, J=7 Гц), 2,17-2,24 (1H, m), 2,46-2,62 (2H, m), 2,73-2,86 (2H, m), 2,87-2,93 (1H, m), 3,55 (1H, d, J=13 Гц), 3,63 (1H, d, J=13 Гц), 3,81 (3H, s), 5,035,10 (2H, m), 6,86-6,92 (2H, m), 7,21-7,35 (7H, m). [0167] (Приклад 2g) (4-Метоксифеніл)метил-(3RS,4SR)-1-бензил-3-[2-(трет-бутоксі)-2оксоетил]-4-метилпіролідин-3-карбоксилат Титульну сполуку (60,3 г, вихід: 80,1%) одержували із (4-метоксифеніл)метил-(3RS,4SR)-1бензил-4-метилпіролідин-3-карбоксилату, одержаного в прикладі 2f (56,7 г, 166 ммоль), за допомогою способу, подібного до способу, описаного в прикладі 1g. 1 H-ЯМР (400 МГц, CDCl3) ppm; 0,83 (3H, d, J=7 Гц), 1,35 (9H, s), 2,05-2,14 (2H, m), 2,51 (1H, d, J=17 Гц), 2,90-2,98 (2H, m), 3,60 (1H, d, J=13 Гц), 3,70 (1H, d, J=13 Гц), 3,81 (3H, s), 5,04 (1H, d, J=12 Гц), 5,07 (1H, d, J=12 Гц), 6,85-6,91 (2H, m), 7,19-7,34 (7H, m). [0168] (Приклад 2h) 1-Бензил-3-(4-метоксифеніл)метил-(3RS,4SR)-3-[2-(трет-бутоксі)-2оксоетил]-4-метилпіролідин-1,3-дикарбоксилат Титульну сполуку (15 г, вихід: 65,1%) одержували із (4-метоксифеніл)метил-(3RS,4SR)-1бензил-3-[2-(трет-бутоксі)-2-оксоетил]-4-метипіролидин-3-карбоксилату, одержаного в прикладі 2g (21 г, 46,3 ммоль), за допомогою способу, подібного до способу, описаного в прикладі 1h. 1 H-ЯМР (400 МГц, CDCl3) ppm; 0,80-0,88 (3H, m), 1,38 (9H, d, J=5 Гц), 2,04-2,15 (1H, m), 2,22 (1H, dd, J=3, 7 Гц), 3,00-3,12 (2H, m), 3,30-3,36 (1H, m), 3,57-3,67 (1H, m), 3,79 (3H, d, J=4 Гц), 4,30 (1H, t, J=12 Гц), 5,00-5,16 (4H, m), 6,82-6,86 (2H, m), 7,23-7,39 (7H, m). Аналіз за допомогою HPLC (Умови аналізу) Колонка: CHIRALPAK AD-H (виготовлена Daicel Chemical Industries, Ltd.) (0,46 см у діаметрі 15 см), 40°C, елюент: гексан/етанол = 9/1 (об./об.), швидкість потоку: 1 мл/хв., виявлення: UV (210 нм). (Результат аналізу) Одержану в результаті титульну сполуку аналізували при вищеописаних умовах аналізу та спостерігали пік при часі втримання, що складав 7,14 хвилини, і пік при часі втримання, що складав 9,06 хвилини. [0169] (Приклад 2i) 1-Бензил-3-(4-метоксифеніл)метил-(3S,4R)-3-[2-(трет-бутоксі)-2оксоетил]-4-метилпіролідин-1,3-дикарбоксилат 1-Бензил-3-(4-метоксифеніл)метил-(3RS,4SR)-3-[2-(трет-бутоксі)-2-оксоетил]-4метилпіролідин-1,3-дикарбоксилат, одержаний у прикладі 2h (7,2 г, 14,5 ммоль), декілька разів розділяли на оптичні ізомери за допомогою HPLC (CHIRALPAK AD-H (2 см у діаметрі 25 см), причому розчинник для елюювання: гексан/етанол = 85/15, швидкість потоку: 8-10 мл/хв.), із одержанням хіральної форми, що відповідає піку з більш коротким часом утримання (2,92 г, вихід: 40,5%). Аналіз за допомогою HPLC (Умови аналізу) Колонка: CHIRALPAK AD-H (виготовлена Daicel Chemical Industries, Ltd.) (0,46 см у діаметрі 15 см), 40°C, елюент: гексан/етанол = 9/1 (об./об.), швидкість потоку: 1 мл/хв., виявлення: UV (210 нм). (Результат аналізу) Одержану в результаті хіральну форму аналізували при вищеописаних умовах аналізу із виявленням того, що час утримання складав 7,18 хвилини та енантіомерний надлишок складав >99% ee. [0170] (Приклад 2j) (3S,4R)-3-[2-(Трет-бутоксі)-2-оксоетил]-4-метилпіролідин-3-карбонова кислота Етанол (50 мл) та 10% Pd/C (500 мг) додавали до 1-бензил-3-(4-метоксифеніл)метил(3S,4R)-3-[2-(трет-бутоксі)-2-оксоетил]-4-метилпіролідин-1,3-дикарбоксилату, одержаного в прикладі 2i (2,92 г, 5,87 ммоль), із наступним перемішуванням при кімнатній температурі протягом 38 годин та п'яти хвилин в атмосфері водню. Воду (100 мл) додавали до реакційної рідини, яку перемішували та фільтрували. Фільтрат концентрували із одержанням титульної 21 UA 112873 C2 5 10 15 20 25 30 35 40 45 50 55 60 сполуки (1,37 г, вихід: 95,9%). 1 H-ЯМР (400 МГц, D2O) ppm; 1,00 (3H, d, J=7 Гц), 1,45 (9H, s), 2,16-2,37 (1H, m), 2,33 (1H, d, J=17 Гц), 2,96 (1H, d, J=17 Гц), 3,05-3,11 (1H, m), 3,22 (1H, d, J=12 Гц), 3,50-3,56 (1H, m), 4,07 (1H, d, J=12 Гц). [0171] (Приклад 2k) (3S,4R)-3-[2-(Трет-бутоксі)-2-оксоетил]-1-[(2,6-дихлорфеніл)метил]-4метилпіролідин-3-карбонова кислота 2,6-Дихлорбензальдегід (646 мг, 3,7 ммоль) та триацетоксиборогідрид натрію (782 мг, 3,7 ммоль) додавали до суміші (3S,4R)-3-[2-(трет-бутоксі)-2-оксоетил]-4-метилпіролідин-3карбонової кислоти, одержаної за допомогою способу із прикладу 2j (600 мг, 2,47 ммоль), оцтової кислоти (0,14 мл, 2,47 ммоль) і метанолу (10 мл), і реакційну суміш перемішували при кімнатній температурі протягом двох годин. Потім додавали 2,6-дихлорбензальдегід (430 мг, 2,5 ммоль) та триацетоксиборогідрид натрію (522 мг, 2,5 ммоль) із наступним перемішуванням при температурі навколишнього середовища 40°C протягом 10,5 години. Воду додавали до реакційної суміші, яку п'ять раз екстрагували дихлорметаном, і концентрували органічний шар. Залишок очищували за допомогою колонкової хроматографії на силікагелі (розчинник для елюювання: етилацетат/метанол) із одержанням партії A (32 мг) і партії B (551 мг) титульної сполуки. Хімічний зсув для партії A показаний нижче. Партія B є об'єднанням трьох фракцій, одержаних при очищенні на колонці, та їх об’єднували після підтвердження, що хімічний зсув для кожної фракції є подібним до хімічного зсуву для партії A. 1 H-ЯМР (400 МГц, CDCl3) ppm; 1,01 (3H, d, J=7 Гц), 1,42 (9H, s), 2,05-2,11 (1H, m), 2,16-2,22 (1H, m), 2,65-2,69 (2H, m), 2,97-3,04 (2H, m), 3,70 (1H, d, J=10 Гц), 4,07-4,15 (2H, m), 7,22 (1H, dd, J=8, 9 Гц), 7,35 (2H, d, J=8 Гц). [0172] (Приклад 2l) Трет-бутил-2-[(3S,4R)-1-[(2,6-дихлорфеніл)метил]-3-({1-[(4,4дифторциклогексил)метил] піперидин-4-іл}карбамоїл)-4-метилпіролідин-3-іл] ацетат Титульну сполуку (409 мг, вихід: 92%) одержували із 1-[(4,4-дифторциклогексил)метил] піперидин-4-аміну, одержаного в прикладі 2d (201 мг, 0,87 ммоль), та (3S,4R)-3-[2-(трет-бутоксі)2-оксоетил]-1-[(2,6-дихлорфеніл)метил]-4-метилпіролідин-3-карбонової кислоти, одержаної в прикладі 2k (290 мг, 0,72 ммоль), за допомогою способу, подібного до способу, описаного в прикладі 1k. 1 H-ЯМР (400 МГц, CDCl3) ppm; 0,85-0,93 (3H, m), 1,15-2,14 (19H, m), 1,41 (9H, s), 2,57-2,71 (4H, m), 2,92 (1H, t, J=10 Гц), 3,12 (1H, d, J=16 Гц), 3,59-3,72 (2H, m), 3,96 (2H, s), 7,18 (1H, t, J=8 Гц), 7,33 (2H, d, J=8 Гц), 8,11 (1H, d, J=8 Гц). [0173] (Приклад 2m) 2-[(3S,4R)-1-[(2,6-Дихлорфеніл)метил]-3-({1-[(4,4дифторциклогексил)метил] піперидин-4-іл}карбамоїл)-4-метилпіролідин-3-іл] оцтова кислота Титульну сполуку (242 мг, вихід: 66%) одержували із трет-бутил-2-[(3S,4R)-1-[(2,6дихлорфеніл)метил]-3-({1-[(4,4-дифторциклогексил)метил] піперидин-4-іл}карбамоїл)-4метилпіролідин-3-іл] ацетату, одержаного в прикладі 2l (409 мг, 0,66 ммоль), за допомогою способу, подібного до способу, описаного в прикладі 1m. 1 H-ЯМР (400 МГц, CD3OD) ppm; 0,87-0,93 (3H, m), 1,20-2,38 (19H, m), 2,62-2,71 (2H, m), 2,86-3,12 (4H, m), 3,61-3,73 (2H, m), 4,01-4,09 (2H, m), 7,29 (1H, dd, J=8,9 Гц), 7,43 (2H, d, J=8 Гц). [0174] (Приклад 3) 2-[(3S,4R)-1-{[2-Хлор-6-(трифторметил)феніл] метил}-3-{[1-(циклогекс-1ен-1-ілметил)піперидин-4-іл] карбамоїл}-4-метилпіролідин-3-іл] оцтова кислота [0175] (Приклад 3a) Трет-бутил-4-[(3S,4R)-1-бензил-3-[2-(трет-бутоксі)-2-оксоетил]-4метилпіролідин-3-амідо] піперидин-1-карбоксилат Трет-бутил-4-амінопіперидин-1-карбоксилат (849 мг, 4,24 ммоль), триетиламін (1,18 мл, 8,48 ммоль) та PyBOP (2,21 г, 4,24 ммоль) додавали до розчину (3S,4R)-1-бензил-3-[2-(трет-бутоксі)2-оксоетил]-4-метилпіролідин-3-карбонової кислоти, одержаної за допомогою способу, подібного до такого із прикладу 1j (942 мг, 2,83 ммоль), в N,N-диметилформаміді (20 мл) із наступним перемішуванням при кімнатній температурі протягом ночі. Етилацетат додавали до реакційної рідини, яку промивали 1 N водним розчином гідроксиду натрію та сольовим розчином. Це висушували над безводним сульфатом магнію та концентрували. Залишок очищували за допомогою колонкової хроматографії на силікагелі (розчинник для елюювання: гептан/етилацетат) із одержанням титульної сполуки (1,33 г, вихід: 91,1%). 1 H-ЯМР (400 МГц, CDCl3) ppm; 0,92 (3H, d, J=7 Гц), 1,20-1,40 (2H, m), 1,40 (9H, s), 1,48 (9H, s), 1,78-1,88 (1H, m), 1,92-1,98 (1H, br), 1,96 (1H, d, J=16 Гц), 2,03-2,09 (1H, m), 2,36 (1H, d, J=10 Гц), 2,58-2,68 (2H, m), 2,89-2,95 (2H, m), 3,10 (1H, d, J=16 Гц), 3,59 (1H, d, J=10 Гц), 3,66 (2H, s), 3,83-4,00 (3H, m), 7,23-7,35 (5H, m), 8,65 (1H, d, J=7 Гц). + MS (ESI) m/z: 538,2 (M+Na) . [0176] (Приклад 3b) Трет-бутил-4-[(3S,4R)-3-[2-(трет-бутоксі)-2-оксоетил]-4-метилпіролідин 22 UA 112873 C2 5 10 15 20 25 30 35 40 45 50 55 60 3-амідо] піперидин-1-карбоксилат 20% гідроксид паладію (724 мг) додавали до розчину трет-бутил-4-[(3S,4R)-1-бензил-3-[2(трет-бутоксі)-2-оксоетил]-4-метилпіролідин-3-амідо] піперидин-1-карбоксилату, одержаного в прикладі 3a (1,33 г, 2,58 ммоль), у метанолі (30 мл), який перемішували в атмосфері водню протягом ночі. Реакційну рідину фільтрували та концентрували при зниженому тиску із одержанням титульної сполуки (1,04 г, вихід: 94,7%). 1 H-ЯМР (400 МГц, CDCl3) ppm; 0,92 (3H, d, J=7 Гц), 1,20-1,52 (2H, m), 1,41 (9H, s), 1,43 (9H, s), 1,80-2,10 (5H, m), 2,00 (1H, d, J=16 Гц), 2,55-2,61 (1H, m), 2,80-3,06 (2H, m), 2,92 (1H, d, J=10 Гц), 3,12 (1H, d, J=16 Гц), 3,35 (1H, d, J=9 Гц), 3,70 (1H, d, J=10 Гц), 3,80-4,00 (3H, m), 8,30 (1H, d, J=7 Гц). + MS (ESI) m/z: 426,1 (M+H) . [0177] (Приклад 3c) Трет-бутил-4-[(3S,4R)-3-[2-(трет-бутоксі)-2-оксоетил]-1-{[2-хлор-6(трифторметил)феніл] метил}-4-метилпіролідин-3-амідо] піперидин-1-карбоксилат 2-(Бромметил)-1-хлор-3-(трифторметил)бензол (443 мг, 1,62 ммоль) і карбонат калію (244 мг) додавали до розчину трет-бутил-4-[(3S,4R)-3-[2-(трет-бутоксі)-2-оксоетил]-4-метилпіролідин3-амідо] піперидин-1-карбоксилату, одержаного в прикладі 3b (345 мг, 0,811 ммоль), в N,Nдиметилформаміді (дегідратованому) (10 мл), який перемішували при 45°C протягом шести годин і при 40°C протягом двох днів. Етилацетат додавали до реакційної рідини, яку промивали 1 N водним розчином гідроксиду натрію та сольовим розчином. Це висушували над безводним сульфатом магнію та концентрували. Залишок очищували за допомогою колонкової хроматографії на силікагелі (розчинник для елюювання: гептан/етилацетат) із одержанням титульної сполуки (320 мг, вихід: 63,8%). 1 H-ЯМР (400 МГц, CDCl3) ppm; 0,92 (3H, d, J=7 Гц), 1,13-1,18 (2H, m), 1,39 (9H, s), 1,49 (9H, s), 1,53-1,65 (1H, m), 1,76-1,86 (1H, m), 1,98 (1H, d, J=16 Гц), 2,02-2,10 (1H, m), 2,51 (1H, d, J=10 Гц), 2,60-2,80 (3H, m), 2,88 (1H, t, J=10 Гц), 3,12 (1H, d, J=16 Гц), 3,53 (1H, d, J=10 Гц), 4,09-4,25 (5H, m), 7,38 (1H, t, J=8 Гц), 7,63 (2H, d, J=8 Гц), 7,96 (1H, d, J=8 Гц). + MS (ESI) m/z: 640,2 (M+Na) . [0178] (Приклад 3d) 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)феніл] метил}-4-метил-3[(піперидин-4-іл)карбамоїл] піролідин-3-іл] оцтова кислота Трифтороцтову кислоту (8 мл) додавали до розчину трет-бутил-4-[(3S,4R)-3-[2-(третбутоксі)-2-оксоетил]-1-{[2-хлор-6-(трифторметил)феніл] метил}-4-метилпіролідин-3-амідо] піперидин-1-карбоксилату, одержаного в прикладі 3c (320 мг, 0,518 ммоль), у дихлорметані (дегідратованому) (8 мл) при охолодженні льодом із наступним перемішуванням при кімнатній температурі протягом 2,5 години. Реакційну рідину концентрували при зниженому тиску та залишок очищували за допомогою ODS колонкової хроматографії (розчинник для елюювання: вода/метанол) із одержанням суміші, що містить титульну сполуку (344 мг). 1 H-ЯМР (400 МГц, CD3OD) ppm; 0,83 (3H, d, J=5 Гц), 1,43-1,63 (2H, m), 1,76-1,89 (1H, m), 1,92-2,00 (1H, m), 2,03-2,19 (2H, m), 2,55-2,68 (2H, m), 2,91-3,10 (4H, m), 3,25-3,36 (2H, m), 3,453,59 (1H, m), 3,75-4,18 (3H, m), 7,41-7,76 (3H, m). + MS (ESI) m/z: 462,3 (M+H) [0179] (Приклад 3e) 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)феніл] метил}-3-{[1-(циклогекс-1ен-1-ілметил)піперидин-4-іл] карбамоїл}-4-метилпіролідин-3-іл] оцтова кислота Циклогекс-1-ен-1-карбальдегід (423 мкл, 3,73 ммоль), оцтову кислоту (300 мкл) та триацетоксиборогідрид натрію (789 мг, 3,73 ммоль) додавали до розчину суміші 2-[(3S,4R)-1-{[2хлор-6-(трифторметил)феніл] метил}-4-метил-3-[(піперидин-4-іл)карбамоїл] піролідин-3-іл] оцтової кислоти, одержаної за допомогою способу із прикладу 3d (344 мг, 0,745 ммоль), у тетрагідрофурані (дегідратованому) (10 мл) із наступним перемішуванням протягом ночі. Воду та метанол додавали до реакційної рідини, яку концентрували при зниженому тиску, і залишок очищували за допомогою ODS колонкової хроматографії (розчинник для елюювання: вода/метанол). Очищений продукт розчиняли в дихлорметані, суспендували шляхом додавання гексану та концентрували із одержанням титульної сполуки (180 мг, вихід: 43,4%). 1 H-ЯМР (400 МГц, CD3OD) ppm; 0,89 (3H, d, J=7 Гц), 1,23-1,38 (2H, m), 1,44-1,82 (6H, m), 1,82-1,96 (1H, m), 1,96-2,25 (5H, m), 2,30-2,45 (2H, m), 2,55-2,68 (2H, m), 2,92-3,20 (5H, m), 3,54 (1H, d, J=10 Гц), 3,64-3,78 (1H, m), 3,95 (1H, d, J=10 Гц), 4,05 (1H, d, J=10 Гц), 5,76 (1H, s), 7,477,52 (1H, m), 7,72 (1H, d, J=7 Гц), 7,77 (1H, d, J=8 Гц). + MS (ESI) m/z: 578,3 (M+Na) [0180] (Приклад 4. Інший спосіб для сполуки із прикладу 3) 2-[(3S,4R)-1-{[2-хлор-6(трифторметил)феніл] метил}-3-{[1-(циклогекс-1-ен-1-ілметил) піперидин-4-іл] карбамоїл}-4метилпіролидин-3-іл] оцтова кислота [0181] (Приклад 4a) Трет-бутил-N-[1-(циклогек-1-ен-1-ілметил)піперидин-4-іл] карбамат 23 UA 112873 C2 5 10 15 20 25 30 35 40 45 50 55 60 Суміш трет-бутил-N-(піперидин-4-іл)карбамату (5,3 г, 26,5 ммоль), 1-циклогексен-1карбоксальдегіду (3,5 г, 31,8 ммоль), триацетоксиборогідриду натрію (7,29 г, 34,4 ммоль), оцтової кислоти (0,5 мл) та тетрагідрофурану (дегідратованого) (80 мл) перемішували при кімнатній температурі протягом 85 годин та 30 хвилин. Воду та бікарбонат натрію додавали до реакційної суміші, яку перемішували та потім двічі екстрагували етилацетатом. Органічний шар промивали сольовим розчином, та висушували над безводним сульфатом натрію, та відганяли розчинник. Залишок очищували за допомогою колонкової хроматографії на силікагелі (NHсилікагель, розчинник для елюювання: етилацетат/гептан) із одержанням титульної сполуки (7,47 г, вихід: 95,7%). 1 H-ЯМР (400 МГц, CDCl3) ppm; 1,35-1,50 (2H, m), 1,44 (9H, s), 1,51-1,65 (4H, m), 1,84-2,03 (8H, m), 2,68-2,80 (4H, m), 3,39-3,50 (1H, m), 4,38-4,48 (1H, m), 5,54 (1H, s). [0182] (Приклад 4b) 1-(Циклогекс-1-ен-1-ілметил)піперидин-4-амін Суміш трет-бутил-N-[1-(циклогекс-1-ен-1-ілметил)піперидин-4-іл] карбамату, одержаного в прикладі 4a (7,47 г, 25,4 ммоль), 5 N водного розчину соляної кислоти (25 мл, 125 ммоль) і метанолу (100 мл) перемішували при 70°C протягом 1,5 години. Реакційну суміш охолоджували льодом, додавали 5 N водний розчин гідроксиду натрію (25 мл, 125 ммоль) та відганяли розчинник. Воду додавали до залишку, який двічі екстрагували етилацетатом. Органічний шар промивали сольовим розчином, та висушували над безводним сульфатом натрію, та відганяли розчинник із одержанням титульної сполуки (4,73 г, вихід: 95,8%). 1 H-ЯМР (400 МГц, CDCl3) ppm; 1,30-1,50 (4H, m), 1,51-1,70 (4H, m), 1,75-2,08 (8H, m), 2,592,68 (1H, m), 2,72-2,88 (4H, m), 5,55 (1H, s). [0183] (Приклад 4c) 1-Бензил-3-(4-метоксифеніл)метил-(3RS,4SR)-3-[2-(трет-бутоксі)-2оксоетил]-4-метилпіролідин-1,3-дикарбоксилат Розчин (4-метоксифеніл)метил-(3RS,4SR)-1-бензил-3-[2-(трет-бутоксі)-2-оксоетил]-4метилпіролідин-3-карбоксилату, одержаного в прикладі 2g (18 г, 39,7 ммоль), у дихлорметані (85,7 мл) доводили до внутрішньої температури 10-20°C та до нього додавали бензилхлорформіат (11,9 мл, 79,4 ммоль). Після повернення до кімнатної температури та перемішування протягом 0,5 години реакційну суміш негайно концентрували. Одержаний у результаті неочищений продукт очищували за допомогою колонкової хроматографії (силікагель, розчинник для елюювання: етилацетат/гептан) із одержанням титульної сполуки (12,89 г, вихід: 65,3%). 1 H-ЯМР (400 МГц, CDCl3) ppm; 0,80-0,88 (3H, m), 1,38 (9H, d, J=5 Гц), 2,04-2,15 (1H, m), 2,22 (1H, dd, J=3, 17 Гц), 3,00-3,12 (2H, m), 3,62 (1H, m), 3,79 (3H, d, J=4 Гц), 4,30 (1H, t, J=12 Гц), 5,00-5,16 (4H, m), 6,82-6,86 (2H, m), 7,23-7,39 (8H, m). [0184] (Приклад 4d) 1-Бензил-3-(4-метоксифеніл)метил-(3S,4R)-3-[2-(трет-бутоксі)-2оксоетил]-4-метилпіролідин-1,3-дикарбоксилат 1-Бензил-3-(4-метоксифеніл)метил-(3RS,4SR)-3-[2-(трет-бутоксі)-2-оксоетил]-4метилпіролідин-1,3-дикарбоксилат, одержаний у прикладі 4c (12,7 г, 26 ммоль), декілька разів розділяли на оптичні ізомери за допомогою HPLC (CHIRALPAK AD-H (2 см у діаметрі × 25 см), розчинник для елюювання: гексан/етанол = 85/15, швидкість потоку: 8-10 мл/хв.) із одержанням хіральної форми, що відповідає піку з більш коротким часом утримання (5,7 г, вихід: 44,9%). Потім дві порції одержаної в результаті хіральної форми (5,3 г) очищували за допомогою колонкової хроматографії на силікагелі (розчинник для елюювання; гептан/етилацетат) із одержанням 5,2 г титульної сполуки. 1 H-ЯМР (400 МГц, CDCl3) ppm; 0,81-0,88 (3H, m), 3,37-3,38 (9H, m), 2,04-2,16 (1H, m), 2,192,25 (1H, m), 3,00-3,12 (2H, m), 3,30-3,36 (1H, m), 3,56-3,67 (1H, m), 3,75-3,79 (3H, m), 4,26-4,33 (1H, m), 5,00-5,16 (4H, m), 6,82-6,86 (2H, m), 7,27-7,37 (7H, m). Аналіз за допомогою HPLC (Умови аналізу) Колонка: CHIRALPAK AD-H (виготовлена Daicel Chemical Industries, Ltd.) (0,46 см у діаметрі 15 см), 40°C, елюент: гексан/етанол = 9/1 (об./об.), швидкість потоку: 1 мл/хв., виявлення: UV (210 нм). (Результат аналізу) Очищену хіральну форму аналізували при вищеописаних умовах аналізу із виявленням, що час утримання складав 7,15 хвилини та енантіомерний надлишок складав >99% ee. [0185] (Приклад 4e) 1-Бензил-3-(4-метоксифеніл)метил-(3S,4R)-3-[2-(трет-бутоксі)-2оксоетил]-4-метилпіролідин-1,3-дикарбоксилат 1-Бензил-3-(4-метоксифеніл)метил-(3RS,4SR)-3-[2-(трет-бутоксі)-2-оксоетил]-4метилпіролідин-1,3-дикарбоксилат, одержаний за допомогою способу, подібного до такого із прикладу 4c (7,8 г, 16,5 ммоль), декілька разів розділяли на оптичні ізомери за допомогою HPLC (CHIRALPAK AD-H, розчинник для елюювання: гексан/етанол = 85/15) із одержанням хіральної 24 UA 112873 C2 5 10 15 20 25 30 35 40 45 50 55 60 форми із більш коротким часом утримання (3,3 г, вихід: 42,3%). [0186] (Приклад 4f) (3S,4R)-3-[2-(Трет-бутоксі)-2-оксоетил]-4-метилпіролідин-3-карбонова кислота Метанол (70 мл) та 10% Pd/C (600 мг) додавали до 1-бензил-3-(4-метоксифеніл)метил(3S,4R)-3-[2-(трет-бутоксі)-2-оксоетил]-4-метилпіролідин-1,3-дикарбоксилату, одержаного за допомогою способу із прикладу 4e (3,3 г, 6,63 ммоль), із наступним перемішуванням при кімнатній температурі протягом трьох днів в атмосфері водню. Воду (70 мл) додавали до реакційної рідини, яку перемішували та фільтрували. Фільтрат концентрували із одержанням титульної сполуки (1,15 г, вихід: 71,3%). 1 H-ЯМР (400 МГц, D2O) був таким же, що і ЯМР для сполуки, одержаної в прикладі 2j. [0187] (Приклад 4g) (3S,4R)-3-[2-(Трет-бутоксі)-2-оксоетил]-4-метилпіролідин-3-карбонова кислота Метанол (3 мл) та 10% Pd/C (30 мг) додавали до 1-бензил-3-(4-метоксифеніл)метил-(3S,4R)3-[2-(трет-бутоксі)-2-оксоетил]-4-метилпіролідин-1,3-дикарбоксилату, який одержували в прикладі 4d та який використовували без очищення за допомогою колонкової хроматографії на силікагелі (104 мг, 0,21 ммоль), із наступним перемішуванням при кімнатній температурі протягом ночі в атмосфері водню. Воду додавали до реакційної рідини, яку перемішували та фільтрували. Фільтрат концентрували із одержанням титульної сполуки (48,7 мг, вихід: 95,3%). 1 H-ЯМР (400 МГц, D2O) був таким же, що і ЯМР для сполуки, одержаної в прикладі 2j. [0188] (Приклад 4h) (3S,4R)-3-[2-(Трет-бутоксі)-2-оксоетил]-4-метилпіролідин-3-карбонова кислота Метанол (100 мл) та 10% Pd/C (559 мг) додавали до 1-бензил-3-(4-метоксифеніл)метил(3S,4R)-3-[2-(трет-бутоксі)-2-оксоетил]-4-метилпіролідин-1,3-дикарбоксилату, одержаного в прикладі 4d (5,2 г, 10,5 ммоль), із наступним перемішуванням при кімнатній температурі протягом восьми годин та 15 хвилин в атмосфері водню. Воду (100 мл) додавали до реакційної рідини, яку перемішували протягом однієї години та фільтрували. Фільтрат концентрували. Комбінацію (3,2 г, 13,2 ммоль) залишку та (3S,4R)-3-[2-(трет-бутоксі)-2-оксоетил]-4метилпіролідин-3-карбонової кислоти, одержаної в прикладах 2j, 4f та 4g, суспендували шляхом додавання метанолу (25 мл) та перемішували при кімнатній температурі протягом 30 хвилин, та при цьому збирання за допомогою фільтрації дало 3,02 г титульної сполуки. 1 H-ЯМР (400 МГц, D2O) ppm; 0,98 (3H, d, J=7 Гц), 1,43 (9H, s), 2,14-2,24 (1H, m), 2,31 (1H, d, J=17 Гц), 2,94 (1H, d, J=17 Гц), 3,06 (1H, t, J=11 Гц), 3,20 (1H, d, J=12 Гц), 3,51 (1H, dd, J=8, 12 Гц), 4,05 (1H, d, J=12 Гц). [0189] (Приклад 4i) Трет-бутил-2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)феніл] метил}-3-{[1(циклогекс-1-ен-1-ілметил)піперидин-4-іл] карбамоїл}-4-метилпіролідин-3-іл] ацетат 1-(Циклогекс-1-ен-1-ілметил)піперидин-4-амін, одержаний у прикладі 4b (240 мг, 1,24 ммоль), N,N-диметилформамід (3 мл), триетиламін (344 мкл, 2,47 ммоль) і PyBOP (856 мг, 1,64 ммоль) додавали до (3S,4R)-3-[2-(трет-бутоксі)-2-оксоетил]-4-метилпіролідин-3-карбонової кислоти, одержаної в прикладі 4h (200 мг, 0,822 ммоль), із наступним перемішуванням із нагріванням на масляній бані при 45°C протягом 1,5 години. Воду додавали до реакційної суміші, яку екстрагували етилацетатом. Органічний шар висушували над сульфатом магнію та концентрували. До нього додавали 2-(бромметил)-1-хлор-3-(трифторметил)бензол (247 мг, 0,903 ммоль), карбонат калію (170 мг, 1,23 ммоль) та N,N-диметилформамід (1 мл) із наступним нагріванням із перемішуванням на масляній бані при 45°C протягом трьох годин. Воду додавали до реакційної суміші, яку екстрагували етилацетатом. Органічний шар промивали водою та сольовим розчином та потім висушували над сульфатом магнію. Одержаний у результаті неочищений продукт двічі очищували за допомогою колонкової хроматографії (NH-силікагель, розчинник для елюювання: етилацетат/гептан та силікагель, розчинник для елюювання: етилацетат/гептан) із одержанням титульної сполуки (353 мг, вихід 70,1%). 1 H-ЯМР (400 МГц, CDCl3) ppm; 0,91 (3H, d, J=7 Гц), 1,31-1,42 (2H, m), 1,39 (9H, s), 1,54-1,66 (5H, m), 1,81-2,09 (9H, m), 2,53 (1H, d, J=10 Гц), 2,63-2,77 (5H, m), 2,88 (1H, t, J=10 Гц), 3,11 (1H, d, J=16 Гц), 3,56 (1H, d, J=10 Гц), 3,61-3,72 (1H, m), 3,92 (1H, d, J=13 Гц), 3,98 (1H, d, J=13 Гц), 5,54 (1H, s), 7,36 (1H, t, J=8 Гц), 7,62 (1H, d, J=4 Гц), 7,64 (1H, d, J=4 Гц), 7,83 (1H, d, J=8 Гц). [0190] (Приклад 4j) 2-[(3S,4R)-1-{[2-Хлор-6-(трифторметил)феніл] метил}-3-{[1-(циклогекс-1ен-1-ілметил)піперидин-4-іл] карбамоїл}-4-метилпіролідин-3-іл] оцтова кислота Трифтороцтову кислоту (1,5 мл, 20,3 ммоль) додавали до розчину трет-бутил-2-[(3S,4R)-1{[2-хлор-6-(трифторметил)феніл] метил}-3-{[1-(циклогекс-1-ен-1-ілметил)піперидин-4-іл] карбамоїл}-3-іл] ацетату, одержаного в прикладі 4i (353 мг, 0,577 ммоль), у дихлорметані (400 мкл), який перемішували при кімнатній температурі протягом двох годин. Реакційну суміш концентрували при зниженому тиску та очищували за допомогою ODS колонкової хроматографії 25 UA 112873 C2 5 10 15 20 25 30 35 40 45 50 55 60 (розчинник для елюювання: метанол/вода) із одержанням титульної сполуки (215 мг, вихід 67%). 1 H-ЯМР (400 МГц, CDCl3) ppm; 1,01 (3H, d, J=7 Гц), 1,22-1,34 (2H, m), 1,42-1,68 (7H, m), 1,79-2,07 (6H, m), 2,38-2,46 (1H, m), 2,49 (1H, d, J=10 Гц), 2,56 (1H, d, J=14 Гц), 2,67-2,82 (6H, m), 3,00 (1H, t, J=10 Гц), 3,16 (1H, d, J=10 Гц), 3,63-3,76 (1H, m), 3,88 (1H, d, J=14 Гц), 4,01 (1H, d, J=14 Гц), 5,55 (1H, s), 7,40 (1H, t, J=8 Гц), 7,64 (1H, d, J=4 Гц), 7,66 (1H, d, J=4 Гц), 8,56 (1H, d, J=8 Гц). 29 Питоме обертання: [] D + 37,1 (c 0,11, MeOH). [0191] (Приклад 5. Інший спосіб для сполуки із прикладу 3.) 2-[(3S,4R)-1-{[2-Хлор-6(трифторметил)феніл] метил}-3-{[1-(циклогекс-1-ен-1-ілметил)піперидин-4-іл] карбамоїл}-4метилпіролідин-3-іл] оцтова кислота [0192] (Приклад 5a) Трет-бутил-4-[(3RS,4SR)-3-[2-(трет-бутоксі)-2-оксоетил]-1-[(2,6дихлорфеніл)метил]-4-метилпіролідин-3-амідо] піперидин-1-карбоксилат 20% гідроксид паладію (300 мг) додавали до розчину бензил-(3RS,4SR)-1-бензил-3-[2-(третбутоксі)-2-оксоетил]-4-метилпіролідин-3-карбоксилату, одержаного за допомогою способу, подібного до такого із прикладу 1g (3 г, 7,08 ммоль), у метанолі (200 мл) із наступним перемішуванням при кімнатній температурі протягом ночі в атмосфері водню. Реакційну рідину фільтрували та промивали метанолом. Теплу воду при приблизно 40°C додавали до продукту, зібраного за допомогою фільтрації, для розчинення твердої речовини з наступною фільтрацією. Фільтрат концентрували разом із першим фільтратом з одержанням незахищеної форми (1,7 г). Метанол (44 мл), 2,6-дихлорбензальдегід (4,83 г, 27,6 ммоль) та оцтову кислоту (1,1 мл, 18,4 ммоль) додавали до незахищеної форми, одержаної за допомогою способу, подібного до вищеописаного способу (4,47 г, 18,4 ммоль), із наступним перемішуванням при кімнатній температурі протягом 15 хвилин та додавали триацетоксиборогідрид натрію (6,16 г, 27,6 ммоль) із наступним нагріванням із перемішуванням при 40°C протягом ночі. До реакційної рідини додавали нейтральний буфер [приготований із дигідрогенфосфату калію (13,65 г), додекагідрату гідрогенфосфату динатрію (71,6 г) та води (1,5 л)], додавали етилацетат та гептан і суміш фільтрували. Фільтрат екстрагували етилацетатом, органічний шар висушували над сульфатом натрію та концентрували, та одержаний у результаті неочищений продукт потім очищували за допомогою колонкової хроматографії (силікагель, розчинник для елюювання: метанол/етилацетат), та об’єднували із продуктом, зібраним за допомогою фільтрації, із одержанням (3RS,4SR)-3-[2-(трет-бутоксі)-2-оксоетил]-1-[(2,6-дихлорфеніл)метил]-4метилпіролідин-3-карбонової кислоти (3,9 г). Трет-бутил-4-амінопіперидин-1-карбоксилат (974 мг, 4,89 ммоль), N,N-диметилформамід (10 мл), триетиламін (1,14 мл, 8,13 ммоль) та PyBOP (2,54 г, 4,89 ммоль) додавали до цієї сполуки (1,64 г, 4,07 ммоль) із наступним перемішуванням при кімнатній температурі протягом ночі. Воду додавали до реакційної рідини, яку екстрагували етилацетатом, та органічний шар потім промивали водою та сольовим розчином, та висушували над сульфатом магнію. Неочищений продукт, одержаний шляхом концентрування, очищували за допомогою колонкової хроматографії (NH-силікагель, розчинник для елюювання: етилацетат/гептан) із одержанням титульної сполуки (2,10 г, вихід: 88,1%). 1 H-ЯМР (400 МГц, CDCl3) ppm; 0,91 (3H, d, J=7 Гц), 1,15-1,34 (2H, m), 1,40 (9H, s), 1,49 (9H, s), 1,58-1,70 (2H, m), 1,76-1,84 (1H, br), 1,98 (1H, d, J=16 Гц), 2,03-2,13 (1H, m), 2,54-2,65 (2H, m), 2,66-2,88 (2H, br), 2,92 (1H, t, J=10 Гц), 3,11 (1H, d, J=16 Гц), 3,59 (1H, d, J=10 Гц), 3,81-3,90 (1H, m), 3,95 (2H, s), 3,90-4,07 (2H, br), 7,18 (1H, dd, J=7, 8 Гц), 7,33 (1H, d, J=8 Гц), 8,23 (1H, d, J=8 Гц). Аналіз за допомогою HPLC (Умови аналізу) Колонка: CHIRALPAK IA (виготовлена Daicel Chemical Industries, Ltd.) (0,46 см у діаметрі 15 см), 40°C, елюент: гексан/етанол = 95/5 (об./об.), швидкість потоку: 1 мл/хв., виявлення: UV (210 нм). (Результат аналізу) Одержану в результаті титульну сполуку аналізували при вищеописаних умовах аналізу та спостерігали пік при часі втримання, що складав 3,46 хвилини, та пік при часі втримання, що складав 6,04 хвилини. [0193] (Приклад 5b) Трет-бутил-4-[(3S,4R)-3-[2-(трет-бутоксі)-2-оксоетил]-1-[(2,6дихлорфеніл)метил]-4-метилпіролідин-3-амідо] піперидин-1-карбоксилат Трет-бутил-4-[(3RS,4SR)-3-[2-(трет-бутоксі)-2-оксоетил]-1-[(2,6-дихлорфеніл)метил]-4метилпіролідин-3-амідо] піперидин-1-карбоксилат, одержаний у прикладі 5a (2,04 г, 3,49 ммоль), декілька разів розділяли на оптичні ізомери за допомогою HPLC (CHIRALPAK IA (3 см у діаметрі 25 см), розчинник для елюювання: гексан/етанол = 94/6, швидкість потоку: 22 мл/хв.) із одержанням титульної сполуки (хіральної форми, що відповідає піку з більш коротким часом утримання) (859 мг, 42,1%) і оптичного ізомеру (хіральної форми, що відповідає піку з більш 26 UA 112873 C2 5 10 15 20 25 30 35 40 45 50 55 60 тривалим часом утримання) (817 мг, 40%), відповідно. 1 Хіральна форма, що відповідає піку з більш коротким часом утримання; H-ЯМР (400 МГц, CDCl3) ppm; 0,91 (3H, d, J=7 Гц), 1,15-1,33 (2H, m), 1,40 (9H, s), 1,49 (9H, s), 1,76-1,84 (1H, m), 1,98 (1H, d, J=16 Гц), 2,01-2,11 (1H, m), 2,57 (1H, d, J=10 Гц), 2,57-2,64 (1H, m), 2,69-2,82 (2H, m), 2,92 (1H, t, J=10 Гц), 3,11 (1H, d, J=16 Гц), 3,59 (1H, d, J=10 Гц), 3,80-4,09 (2H, m), 3,95 (2H, s), 7,18 (1H, t, J=8 Гц), 7,33 (2H, d, J=8 Гц), 8,23 (1H, d, J=8 Гц). Аналіз за допомогою HPLC (Умови аналізу) Колонка: CHIRALPAK IA (виготовлена Daicel Chemical Industries, Ltd.) (0,46 см у діаметрі 15 см), 40°C, елюент: гексан/етанол = 95/5 (об./об.), швидкість потоку: 1 мл/хв., виявлення: UV (210 нм). (Результат аналізу) Одержану в результаті хіральну форму, що відповідає піку з більш коротким часом утримання, аналізували при вищеописаних умовах аналізу із виявленням того, що час утримання складав 3,44 хвилини, та енантіомерний надлишок складав >99% ee. [0194] (Приклад 5c) Трет-бутил-4-[(3S,4R)-3-[2-(трет-бутоксі)-2-оксоетил]-1-{[2-хлор-6(трифторметил)феніл] метил}-4-метилпіролідин-3-амідо] піперидин-1-карбоксилат 20% гідроксид паладію (75,8 мг) додавали до розчину трет-бутил-4-[(3S,4R)-3-[2-(третбутоксі)-2-оксоетил]-1-[(2,6-дихлорфеніл)метил]-4-метилпіролідин-3-амідо] піперидин-1карбоксилату, одержаного в прикладі 5b (758 мг, 1,29 ммоль), у метанолі (20 мл) із наступним перемішуванням при 40°C протягом трьох годин в атмосфері водню. Реакційну рідину фільтрували та фільтрат концентрували із одержанням неочищеного продукту (501 мг). 2(Бромметил)-1-хлор-3-(трифторметил)бензол (145 мг, 0,532 ммоль) та карбонат калію (53,2 мг) додавали до розчину цього неочищеного продукту (174 мг) в N,N-диметилформаміді (дегідратованому) (6 мл) із наступним перемішуванням протягом ночі. Потім додавали 2(бромметил)-1-хлор-3-(трифторметил)бензол (145 мг, 0,532 ммоль) та карбонат калію (106 мг) із наступним перемішуванням протягом чотирьох годин. Етилацетат додавали до реакційної рідини, яку промивали 1 N водним розчином гідроксиду натрію та сольовим розчином. Це висушували над безводним сульфатом магнію та концентрували. Залишок очищували за допомогою колонкової хроматографії на силікагелі (розчинник для елюювання: гептан/етилацетат) із одержанням титульної сполуки (82 мг, вихід: 32,4%). 1 H-ЯМР (400 МГц, CDCl3) ppm; 0,92 (3H, d, J=7 Гц), 1,12-1,18 (2H, m), 1,39 (9H, s), 1,49 (9H, s), 1,53-1,65 (1H, m), 1,76-1,86 (1H, m), 1,98 (1H, d, J=16 Гц), 2,02-2,10 (1H, m), 2,51 (1H, d, J=10 Гц), 2,61-2,81 (3H, m), 2,89 (1H, t, J=10 Гц), 3,12 (1H, d, J=16 Гц), 3,53 (1H, d, J=10 Гц), 3,80-4,10 (5H, m), 7,38 (1H, t, J=8 Гц), 7,63 (2H, d, J=8 Гц), 7,96 (1H, d, J=8 Гц). + MS (ESI) m/z: 618,1 (M+H) . [0195] (Приклад 5d) 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)феніл] метил}-4-метил-3[(піперидин-4-іл)карбамоїл] піролідин-3-іл] оцтова кислота Трифтороцтову кислоту (3 мл) додавали до розчину трет-бутил-4-[(3S,4R)-3-[2-(третбутоксі)-2-оксоетил]-1-{[2-хлор-6-(трифторметил)феніл] метил}-4-метилпіролідин-3-амідо] піперидин-1-карбоксилату, одержаного в прикладі 5c (82 мг, 0,133 ммоль), у дихлорметані (дегідратованому) (3 мл) при охолодженні льодом із наступним перемішуванням при кімнатній температурі протягом 2,5 години. Реакційну рідину концентрували при зниженому тиску та залишок очищували за допомогою ODS колонкової хроматографії (розчинник для елюювання: вода/метанол) із одержанням титульної сполуки (72 мг, вихід: кількісн.). 1 H-ЯМР (400 МГц, CD3OD) ppm; 0,90 (3H, d, J=5 Гц), 1,51-1,70 (2H, m), 1,82-1,91 (1H, m), 1,99-2,08 (1H, m), 2,12-2,23 (2H, m), 2,61 (1H, d, J=9 Гц), 2,60-2,70 (2H, m), 2,95-3,12 (4H, m), 3,25-3,36 (2H, m), 3,53 (1H, d, J=9 Гц), 3,83-3,92 (1H, m), 3,97 (1H, d, J=13 Гц), 4,07 (1H, d, J=13 Гц), 7,51 (1H, t, J=8 Гц), 7,73 (1H, d, J=8 Гц), 7,78 (1H, d, J=8 Гц). + MS (ESI) m/z: 462,2 (M+H) . [0196] (Приклад 5e) 2-[(3S,4R)-1-{[2-Хлор-6-(трифторметил)феніл] метил}-3-{[1-(циклогекс-1ен-1-ілметил)піперидин-4-іл] карбамоїл}-4-метилпіролідин-3-іл] оцтова кислота Циклогекс-1-ен-1-карбальдегід (25,9 мкл, 0,227 ммоль), оцтову кислоту (30 мкл) та триацетоксиборогідрид натрію (68,8 мг, 0,325 ммоль) додавали до розчину 2-[(3S,4R)-1-{[2-хлор6-(трифторметил)феніл] метил}-4-метил-3-[(піперидин-4-іл)карбамоїл] піролідин-3-іл] оцтової кислоти, одержаної за допомогою способу із прикладу 5d (15 мг, 0,0325 ммоль), у тетрагідрофурані (дегідратованому) (2 мл) із наступним перемішуванням протягом ночі. Воду та метанол додавали до реакційної рідини, яку концентрували при зниженому тиску, та залишок очищували за допомогою ODS колонкової хроматографії (розчинник для елюювання: вода/метанол) із одержанням титульної сполуки (12,8 мг, вихід: 70,8%). 1 H-ЯМР (400 МГц, CD3OD) ppm; 0,89 (3H, d, J=7 Гц), 1,50-1,90 (2H, m), 1,83-1,95 (1H, m), 2,00-2,22 (5H, m), 2,30-2,45 (2H, m), 2,57-2,68 (2H, m), 2,92-3,14 (5H, m), 3,54 (1H, d, J=10 Гц), 27 UA 112873 C2 5 10 15 20 25 30 35 40 45 50 55 60 3,64-3,78 (1H, m), 3,95 (1H, d, J=13 Гц), 4,05 (1H, d, J=13 Гц), 5,76 (1H, s), 7,49 (1H, t, J=8 Гц), 7,72 (1H, d, J=8 Гц), 7,77 (1H, d, J=8 Гц). + MS (ESI) m/z: 556,3 (M+H) . [0197] (Приклад 6) 2-[(3S,4R)-1-[(2-Хлор-6-метилфеніл)метил]-3-{[1-(циклогекс-1-ен-1ілметил)піперидин-4-іл] карбамоїл}-4-метилпіролідин-3-іл] оцтова кислота [0198] (Приклад 6a) (3S,4R)-3-[2-(Трет-бутоксі)-2-оксоетил]-1-[(2-хлор-6-метилфеніл)метил]4-метилпіролідин-3-карбонова кислота Титульну сполуку (154 мг, вихід 27,2%) одержували із (3S,4R)-3-[2-(трет-бутоксі)-2-оксоетил]4-метилпіролідин-3-карбонової кислоти, одержаної за допомогою способу, подібного до такого із прикладу 1i (360 мг, 1,48 ммоль), та 2-хлор-6-метилбензальдегіду (416 мг, 2,69 ммоль), одержаного за допомогою способу, подібного до способу, описаного в прикладі 1j. 1 H-ЯМР (400 МГц, CDCl3) ppm; 1,01 (3H, d, J=7 Гц), 1,41 (9H, s), 2,10 (1H, d, J=17 Гц), 2,152,23 (1H, m), 2,42 (3H, s), 2,63-2,69 (2H, m), 2,97 (1H, t, J=10 Гц), 3,01 (1H, d, J=17 Гц), 3,68 (1H, d, J=9 Гц), 4,00 (2H, s), 7,09-7,26 (3H, m). [0199] (Приклад 6b) Трет-бутил-2-[(3S,4R)-1-[(2-хлор-6-метилфеніл)метил]-3-{[1-(циклогекс1-ен-1-ілметил)піперидин-4-іл] карбамоїл}-4-метилпіролідин-3-іл] ацетат Титульну сполуку (212 мг, вихід 94,2%) одержували із (3S,4R)-3-[2-(трет-бутоксі)-2-оксоетил]1-[(2-хлор-6-метилфеніл)метил]-4-метилпіролідин-3-карбонової кислоти, одержаної в прикладі 6a (154 мг, 0,403 ммоль), та 1-(циклогекс-1-ен-1-ілметил)піперидин-4-аміну, одержаного в прикладі 4b (110 мг, 0,564 ммоль), за допомогою способу, подібного до способу, описаного в прикладі 1k. 1 H-ЯМР (400 МГц, CDCl3) ppm; 0,92 (3H, d, J=7 Гц), 1,21-1,39 (3H, m), 1,40 (9H, s), 1,52-1,69 (5H, m), 1,81-2,12 (8H, m), 1,99 (1H, d, J=16 Гц), 2,44 (3H, s), 2,52 (1H, d, J=10 Гц), 2,61 (1H, dd, J=6, 9 Гц), 2,68 (2H, br d, J=9 Гц), 2,75 (2H, s), 2,86 (1H, t, J=10 Гц), 3,10 (1H, d, J=16 Гц), 3,58 (1H, d, J=10 Гц), 3,60-3,70 (1H, m), 3,79 (1H, d, J=13 Гц), 3,84 (1H, d, J=13 Гц), 5,54 (1H, s), 7,08-7,14 (2H, m), 7,23-7,26 (1H, m), 8,00 (1H, d, J=8 Гц). [0200] (Приклад 6c) 2-[(3S,4R)-1-[(2-Хлор-6-метилфеніл)метил]-3-{[1-(циклогекс-1-ен-1ілметил)піперидин-4-іл] карбамоїл}-4-метилпіролідин-3-іл] оцтова кислота Титульну сполуку (140 мг, вихід 73,4%) одержували із трет-бутил-2-[(3S,4R)-1-[(2-хлор-6метилфеніл)метил]-3-{[1-(циклогекс-1-ен-1-ілметил) піперидин-4-іл] карбамоїл}-4метилпіролідин-3-іл] ацетату, одержаного в прикладі 6b (212 мг, 0,38 ммоль), за допомогою способу, подібного до способу, описаного в прикладі 1m. 1 H-ЯМР (400 МГц, CD3OD) ppm; 0,93 (3H, d, J=7 Гц), 1,57-1,80 (6H, m), 1,90-2,39 (8H, m), 2,49 (3H, s), 2,61-3,38 (8H, m), 3,59-4,20 (4H, m), 5,95 (1H, s), 7,18-7,39 (3H, m). [0201] (Приклад 7) 2-[(3S,4R)-1-{[2-Хлор-6-(трифторметил)феніл] метил}-3-{[1-(циклопент-1ен-1-ілметил)піперидин-4-іл] карбамоїл}-4-метилпіролідин-3-іл] оцтова кислота [0202] (Приклад 7a) Циклопент-1-ен-1-карбальдегід Суміш перйодату натрію (28,6 г, 134 ммоль) та води (250 мл) додавали до суміші 1,2циклогександіолу (12 г, 103 ммоль) та діетилового ефіру (150 мл), яку перемішували при кімнатній температурі протягом 35 хвилин. 20% водний розчин гідроксиду калію (40 мл, 206 ммоль) додавали до реакційної суміші, яку перемішували при кімнатній температурі протягом двох годин. Реакційну суміш двічі екстрагували діетиловим ефіром. Органічний шар висушували над безводним сульфатом магнію та відганяли розчинник із одержанням титульної сполуки (6,1 г, вихід 61,6%). 1 H-ЯМР (400 МГц, CDCl3) ppm; 1,96-2,04 (2H, m), 2,50-2,57 (2H, m), 2,58-2,66 (2H, m), 6,876,90 (1H, m), 9,80 (1H, s). [0203] (Приклад 7b) 2-[(3S,4R)-1-{[2-Хлор-6-(трифторметил)феніл] метил}-3-{[1-(циклопент-1ен-1-ілметил)піперидин-4-іл] карбамоїл}-4-метилпіролідин-3-іл] оцтова кислота Титульну сполуку (288 мг, вихід: 73,5%) одержували із 2-[(3S,4R)-1-{[2-хлор-6(трифторметил)феніл] метил}-4-метил-3-[(піперидин-4-іл)карбамоїл] піролідин-3-іл] оцтової кислоти, одержаної в прикладі 3d (334 мг, 0,723 ммоль), циклопент-1-ен-1-карбальдегіду, одержаного в прикладі 7a (209 мг, 2,17 ммоль), оцтової кислоти (300 мкл) та триацетоксиборогідриду натрію (460 мг, 2,17 ммоль) за допомогою способу, подібного до способу, описаного в прикладі 3e. 1 H-ЯМР (400 МГц, CD3OD) ppm; 0,89 (3H, d, J=7 Гц), 1,24-1,35 (2H, m), 1,50-1,66 (2H, m), 1,70-1,78 (1H, m), 1,85-1,99 (3H, m), 2,11-2,22 (2H, m), 2,29-2,42 (4H, m), 2,61 (1H, d, J=10 Гц), 2,60-2,68 (1H, m), 2,91-3,02 (2H, m), 3,07 (1H, d, J=16 Гц), 3,54 (1H, d, J=10 Гц), 3,64-3,78 (1H, m), 3,95 (1H, d, J=14 Гц), 4,05 (1H, d, J=14 Гц), 5,74 (1H, s), 7,50 (1H, t, J=8 Гц), 7,71 (1H, d, J=8 Гц), 7,78 (1H, d, J=8 Гц). + MS (ESI) m/z: 564,3 (M+Na) . 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPyrrolidine-3-ylacetic acid derivative
Автори англійськоюYoshida Ichiro, Okabe Tadashi, Matsumoto Yasunobu, Watanabe Nobuhisa, Ohashi Yoshiaki, Onizawa Yuji, Harada Hitoshi
Автори російськоюЙошида Ичиро, Окабэ Тадаши, Мацумото Ясунобу, Ватанабэ Нобухиса, Охаши Йошиаки, Онизава Юджи, Харада Хитоши
МПК / Мітки
МПК: A61K 31/454, C07D 401/12
Мітки: піролідин-3-ілоцтової, похідна, кислоти
Код посилання
<a href="https://ua.patents.su/52-112873-pokhidna-pirolidin-3-iloctovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Похідна піролідин-3-ілоцтової кислоти</a>
Попередній патент: Рідке поживне середовище
Наступний патент: Перетворювач енергії “двожильний”
Випадковий патент: 2-оксо-1,2-дигідрохінолінові модулятори імунної функції