Похідні карбамат/сечовини
Номер патенту: 113876
Опубліковано: 27.03.2017
Автори: Ван Сяоян, Курці Марко, Ван Тєлінь, Трокслер Томас Дж., Джаффреда Стефано Лука, Брага Даріо, Чжан Сюечунь, Оберсон Ів, Бок Марк Гері, Карпінскі Піотр, Цзян Хайян, Додд Стефані Кей
Формула / Реферат
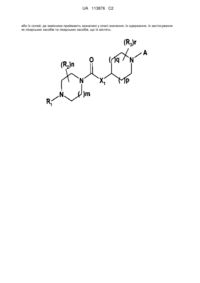
1. Сполука формули І
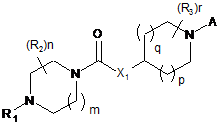 (I)
(I)
або її сіль,
у якій
R1 являє собою ізопропіл або циклобутил;
m приймає значення 1;
n приймає значення 0, 1 або 2;
де кожен R2 незалежно являє собою галоген, С1-4алкіл, С1-4галогеналкіл, С1-4алкоксигрупу, С1-4галогеналкоксигрупу або С3-4циклоалкіл; або два R2 на одному і тому ж атомі вуглецю утворюють разом із зазначеним атомом вуглецю С3-4циклоалкіл;
Х1 являє собою кисень;
р приймає значення 1, та q приймає значення 1;
r приймає значення 0, 1 або 2;
де кожен R3 незалежно являє собою галоген, С1-4алкіл, С1-4галогеналкіл, С1-4алкоксигрупу, С1-4галогеналкоксигрупу або С3-4циклоалкіл; або два R3 на одному і тому ж атомі вуглецю разом із зазначеним атомом вуглецю утворюють С3-4циклоалкіл;
А вибраний з A3 та А4
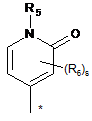 , (A3)
, (A3) 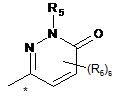 , (A4)
, (A4)
де зв'язок, відмічений зірочкою, приєднаний до атома азоту;
R5 являє собою водень або метил;
s приймає значення 0, 1 або 2; та
кожен R6 незалежно являє собою галоген, С1-4алкіл, С1-4галогеналкіл, С1-4алкоксигрупу, С1-4галогеналкоксигрупу або С3-4циклоалкіл.
2. Сполука, вибрана з групи, яка складається з
1-(6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл 4-циклобутилпіперазин-1-карбоксилату;
1-(1-метил-6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл 4-ізопропілпіперазин-1-карбоксилату;
1-(6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл 4-ізопропілпіперазин-1-карбоксилату;
1-(6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл 4-циклопропілпіперазин-1-карбоксилату;
1-(1-метил-6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл 4-циклобутилпіперазин-1-карбоксилату;
1-(1-етил-6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл 4-ізопропілпіперазин-1-карбоксилату;
1-(1-метил-2-оксо-1,2-дигідропіридин-4-іл)піперидин-4-іл 4-ізопропілпіперазин-1-карбоксилату;
1-(2-оксо-1,2-дигідропіридин-4-іл)піперидин-4-іл 4-циклобутилпіперазин-1-карбоксилату;
1-(2-оксо-1,2-дигідропіридин-4-іл)піперидин-4-іл 4-ізопропілпіперазин-1-карбоксилату та
1-(6-оксо-1,6-дигідропіридин-3-іл)піперидин-4-іл 4-ізопропілпіперазин-1-карбоксилату
або солей зазначених сполук.
3. Сполука формули І за п. 1, яка являє собою 1-(6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл 4-циклобутилпіперазин-1-карбоксилат, що має наступну формулу
 ,
,
або її сіль.
4. Сполука формули І за п. 1, яка являє собою 1-(1-метил-6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл 4-ізопропілпіперазин-1-карбоксилат, що має наступну формулу
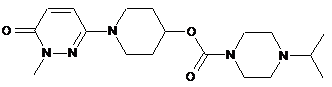 ,
,
або її сіль.
5. Сполука формули І за п. 1, яка являє собою 1-(6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл 4-ізопропілпіперазин-1-карбоксилат, що має наступну формулу
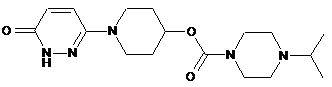 ,
,
або її сіль.
6. Сполука формули І за п. 1, яка являє собою 1-(1-метил-6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл 4-циклобутилпіперазин-1-карбоксилат, що має наступну формулу
 ,
,
або її сіль.
7. Сполука формули І за п. 1, яка являє собою вільну форму 1-(1-метил-6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл 4-циклобутилпіперазин-1-карбоксилату у твердій формі або сіль 1-(1-метил-6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл 4-циклобутилпіперазин-1-карбоксилату у твердій формі, де зазначена сіль являє собою цитрат, гідрохлорид, фумарат, адипат, малеат або себацинат 1-(1-метил-6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл 4-циклобутилпіперазин-1-карбоксилату.
8. Сполука за будь-яким з пп. 1-7 або її сіль для застосування як лікарського засобу.
9. Сполука формули II-1
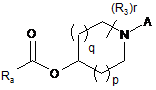 (II-1)
(II-1)
або її сіль; де р, q, r, R3 та А приймають зазначені для формули І значення; та Ra являє собою відхідну групу.
10. Фармацевтична композиція, яка включає терапевтично ефективну кількість сполуки за будь-яким з пп. 1-7 або її солі та один або більше з фармацевтично прийнятних носіїв.
11. Комбінація, яка включає терапевтично ефективну кількість сполуки за будь-яким з пп. 1-7 або її солі та один або більше терапевтичних агентів, активних для лікування у суб'єкта порушення або захворювання, опосередкованого рецепторами Н3.
12. Спосіб лікування порушення або захворювання, опосередкованого рецепторами Н3, що включає введення суб'єкту, який цього потребує, терапевтично ефективної кількості сполуки за будь-яким з пп. 1-7 або її солі або фармацевтичної композиції за п. 10.
13. Спосіб за п. 12, у якому порушення або захворювання вибране з групи, яка включає ожиріння, епілепсію, порушення сну та безсоння з надлишковою денною сонливістю, порушення, пов'язані з посиленою втомлюваністю або гіперсомнолентністю, або порушення, пов'язані з порушенням когнітивних функцій.
14. Спосіб за п. 12, у якому захворювання являє собою нарколепсію.
15. Спосіб за будь-яким з пп. 12-14, у якому сполуку вводять у комбінації з одним або більше іншими терапевтичними агентами, активними для лікування у суб'єкта порушення або захворювання, опосередкованого рецепторами Н3.
16. Застосування сполуки за будь-яким з пп. 1-7 або її солі або фармацевтичної композиції за п. 10 для виготовлення лікарського засобу для лікування порушення або захворювання, опосередкованого рецепторами Н3.
17. Застосування за п. 16, у якому порушення або захворювання вибране з групи, яка включає ожиріння, епілепсію, порушення сну та безсоння з надлишковою денною сонливістю, порушення, пов'язані з посиленою втомлюваністю або гіперсомнолентністю, або порушення, пов'язані з порушенням когнітивних функцій.
18. Застосування за п. 16, у якому захворювання являє собою нарколепсію.
19. Застосування за будь-яким з пп. 16-18, у якому сполука представлена у комбінації з одним або більше іншими терапевтичними агентами, активними для лікування у суб'єкта порушення або захворювання, опосередкованого рецепторами Н3.
Текст
Реферат: Даний винахід стосується сполук формули (І) (R3)r O (R2)n q X1 N R1 N N A p m (I) (72) Винахідник(и): Оберсон Ів (CH), Бок Марк Гері (US), Брага Даріо (IT), Курці Марко (IT), Додд Стефані Кей (US), Джаффреда Стефано Лука (IT), Цзян Хайян (CN), Карпінскі Піотр (US), Трокслер Томас Дж. (CH), Ван Тєлінь (US/CN), Ван Сяоян (CN), Чжан Сюечунь (CN) (73) Власник(и): НОВАРТІС АГ, Lichtstrasse 35, CH-4056 Basel, Switzerland (CH) (74) Представник: Ошарова Iрина Олександрiвна, реєстр. №9 (56) Перелік документів, взятих до уваги експертизою: US 2007/049571 A1 (XIE LINGHONG [US] ET AL.), 01.03.2007 LAZEWSKA D. ET AL., "Recent advances in histamine H3 receptor antagonists/inverse agonists", EXPERT OPINION ON THERAPEUTIC PATENTS, INFORMA HEALTHCARE, GB, (20100901), vol. 20, no. 9, doi:10.1517/13543776.2010.509346, ISSN 1354-3776, pages 1147-1169 UA 113876 C2 (12) UA 113876 C2 або їх солей, де замісники приймають зазначені у описі значення; їх одержання, їх застосування як лікарських засобів та лікарських засобів, що їх містять. UA 113876 C2 5 10 15 20 25 30 35 40 45 50 Даний винахід відноситься до похідних карбамат/сечовини, до їх твердих форм, до їх одержання, до їх застосування як лікарські засоби та до лікарських засобів, що містять їх. I. Похідні карбамат/сечовини Гістамін являє собою поліфункціональний хімічний медіатор, який передає сигнали через специфічні, пов'язані з G-білком рецептори клітинної поверхні (GPCR). До даного часу ідентифіковані чотири підтипи гістамінових рецепторів: H1, H2, H3 та H4. H3 рецептор являє собою пресинаптичний GPCR, який виявлений переважно у центральній нервовій системі, хоча його низькі рівні також знайдені у периферичній нервовій системі. Повідомлялось, що гени, що кодують H3 рецептори, виявлені у різних організмах, включаючи людей, та альтернативний сплайсинг зазначених генів, здається, приводить до утворення множини ізоформ. H3 рецептор являє собою ауто- та гетерорецептор, активація якого приводить до зменшення виділення нейромедіаторів (включаючи гістамін, ацетилхолін, норепінефрин, допамін та глутамат) з нейронів мозку та приймає участь у регулюванні процесів, таких як сон та неспання, харчування та пам'ять. У центральних системах H3 рецептор може бути конститутивно активним. Антагоністи H3 рецептору підвищують виділення церебрального гістаміну та інших нейромедіаторів, які, у свою чергу, викликають тривале неспання, покращення когнітивних процесів, зменшення споживання їжі та нормалізацію вестибулярних рефлексів. Антагоністи H3 рецептора розкриті, наприклад, у Lazewska and Kiec-Kononowicz, Expert Opin Ther Patents, 2010, 20(9), 1147-1169; Raddatz et al, Current Topics in Medicinal Chemistry, 2010, 10, 153-169; WO2007052124; WO2007016496 та WO2004101546. Так як метаболічні шляхи гістаміну приймають участь у широкому колі порушень, зокрема, порушень сну та неспання з надлишковим денним сном, наприклад, нарколепсії, вважають, що антагоністи H3 рецепторів можна застосовувати у фармакотерапії зазначених порушень. Існує необхідність у створенні нових антагоністів H3 рецепторів, які були б гарними кандидатами на лікарські засоби. Зокрема, кращі сполуки повинні ефективно зв'язуватися з H3 рецепторами, при цьому проявляючи невелику спорідненість до інших рецепторів, наприклад, рецепторів, що опосередкують значні побічні ефекти, таких як hERG канальці, які можуть викликати побічні ефекти у відношенні серцево-судинної системи. Вони повинні добре абсорбуватися з шлунково-кишкового тракту, бути достатньо метаболічно стабільними, мати сприятливі фармакокінетичні властивості, достатньо захоплюватися мозком, швидкий початок дії та достатньо тривалу дію. Наприклад, при лікуванні нарколепсії фармакокінетичні властивості сполук повинні приводити до кращого неспання у денний час, але при цьому одночасно приводити до мінімального впливу на нічний сон. Кандидати у лікарські засоби повинні бути нетоксичними та проявляти незначні побічні ефекти. Крім того, кандидати на ідеальні лікарські засоби повинні бути здатні існувати у такій фізичній формі, яка стабільна, негігроскопічна та легко формулюється. Сполуки даного винаходу являють собою антагоністи H3 рецепторів та тому потенційно корисні при лікуванні широкого кола порушень, особливо нарколепсії. У першому аспекті даний винахід відноситься до сполуки формули I (І), або до її солі, де R1 являє собою C1-6алкіл, C2-6алкеніл, C2-6алкініл, C3-6циклоалкіл, C5-6циклоалкеніл або C36циклоалкіл-C1-4алкіл; де зазначені C1-6алкіл, C2-6алкеніл, C2-6алкініл або C3-6циклоалкіл-C1-4алкіл можуть бути заміщені одним або більше з галогенів; та де зазначені C 3-6циклоалкіл або C56циклоалкеніл можуть бути заміщені одним або більше з галогенів, C 1-4алкілів або C14галогеналкілів; m являє собою 1 або 2; n являє собою 0, 1, 2, 3 або 4; кожен R2 незалежно являє собою галоген, гідроксил, аміно групу, ціаногрупу, нітро групу, C 1алкіл, C1-6галогеналкіл, C1-6гідроксиалкіл, C1-4алкокси-C1-6алкіл, аміно-C1-6алкіл, C1-4алкіл-аміно6 C1-6алкіл, ди(C1-4алкіл)аміно-C1-6алкіл, C1-6алкокси групу, C1-6галогеналкокси групу, C1 1 UA 113876 C2 6алкіламіно групу, ди(C1-6алкіл)аміно групу, C2-6алкеніл, C2-6галогеналкеніл, C2-6алкініл або C2 6галогеналкініл; 5 10 15 20 25 30 35 40 45 50 або C3-6циклоалкіл, де один атом вуглецю може бути замінений атомом кисню, де зазначений C3-6циклоалкіл може бути приєднаний до метилену безпосередньо або через C 12алкілен, та де C3-6циклоалкіл може бути заміщений одним або більше з галогенів; або два R2 біля одного і того ж атому вуглецю утворюють разом із зазначеним атомом вуглецю C3-6циклоалкіл; X1 являє собою кисень або -N(R4)-; R4 являє собою водень, C1-6алкіл, C3-6циклоалкіл або C3-6циклоалкіл-C1-2алкіл, p являє собою 1, та q являє собою 1; p являє собою 0, та q являє собою 1; або p являє собою 0, та q являє собою 0; r являє собою 0, 1, 2, 3 або 4; кожен R3 незалежно являє собою галоген, гідроксил, аміно групу, ціано групу, нітро групу, C 16алкіл, C1-6галогеналкіл, C1-6гідроксиалкіл, C1-4алкокси-C1-6алкіл, аміно-C1-6алкіл, C1-4алкіл-аміноC1-6алкіл, ди(C1-4алкіл)аміно-C1-6алкіл, C1-6алкокси групу, C1-6галогеналкокси групу, C16алкіламіно групу, ди(C1-6алкіл)аміно групу, C 2-6алкеніл, C2-6галогеналкеніл, C2-6алкініл або C26галогеналкініл; або C3-6циклоалкіл, де один атом вуглецю може бути замінений атомом кисню, де C3циклоалкіл може бути приєднаний до метилену безпосередньо або через C 1-2алкілен, та де C36 6циклоалкіл може бути заміщений одним або більше з галогенів; або два R3 біля одного і того ж атому вуглецю разом із зазначеним атомом вуглецю утворюють C3-6циклоалкіл; A являє собою , де зв'язок, відмічений зірочкою, приєднаний до атому азоту; R5 являє собою водень, C1-6алкіл, C2-6алкеніл, C2-6алкініл, C3-6циклоалкіл, C5-6циклоалкеніл або C3-6циклоалкіл-C1-4алкіл; де зазначені C1-6алкіл, C2-6алкеніл, C2-6алкініл або C3-6циклоалкілC1-4алкіл можуть бути заміщені одним або більше з галогенів, гідроксилів або C 1-6алкокси груп; та де зазначені C3-6циклоалкіл або C5-6циклоалкеніл можуть бути заміщені одним або більше з галогенів, C1-4алкілів або C1-4галогеналкілів; X2 являє собою азот або вуглець; s являє собою 0, 1, 2 або 3; кожен R6 незалежно являє собою галоген, гідроксил, аміно групу, ціано групу, нітро групу, C 1алкіл, C1-6галогеналкіл, C1-6гідроксиалкіл, C1-4алкокси-C1-6алкіл, аміно-C1-6алкіл C1-4алкіл-аміно6 C1-6алкіл, ди(C1-4алкіл)аміно-C1-6алкіл, C1-6алкокси групу, C1-6галогеналкокси групу, C16алкіламіно групу, ди(C1-6алкіл)аміно групу, C 2-6алкеніл, C2-6галогеналкеніл, C2-6алкініл або C26галогеналкініл; або C3-6циклоалкіл, де один атом вуглецю може бути замінений атомом кисню, де зазначений C3-6циклоалкіл може бути приєднаний до метилену безпосередньо або через C 12алкілен, та де зазначений C3-6циклоалкіл може бути заміщений одним або більше з галогенів. Якщо не зазначено інакше, термін "сполуки даного винаходу" відноситься до сполук формули (I) та до їх підформул (наприклад, сполуки формули (I-1)); до їх пролікарських засобів; твердих форм вільних форм або до солей зазначених сполук, наприклад, твердих форм даного винаходу, та/або до пролікарських засобів; гідратів або сольватів зазначених сполук, їх солей та/або пролікарських засобів; також як до всіх стереоізомерів (включаючи діaстереоізомери та енантіомери), таутомерів та мічених ізотопами сполук (включаючи заміщення дейтерієм); також як до природно утворених фрагментів (наприклад, поліморфів, сольватів та/або гідратів). Якщо не зазначено інакше, вирази, використані у описі, що розглядається, мають наступні значення: "Алкіл" являє собою нерозгалужену або розгалужену алкільну групу та, наприклад, може являти собою метил, етил, н- або ізопропіл, н-, ізо-, втор- або трет-бутил, н-пентил, н-гексил; C16алкіл переважно являє собою нерозгалужений або розгалужений C 1-4алкіл, причому особливо кращі метил, етил, н-пропіл, ізо-пропіл та трет-бутил. 2 UA 113876 C2 5 10 15 20 25 30 35 40 45 50 55 60 Кожна алкільна частина "алкокси", "галогеналкілу" і т.д. повинна мати значення, зазначені для зазначених вище визначень для "алкілу", особливо у відношенні лінійності та переважного розміру. "C3-6циклоалкіл" являє собою насичений аліциклічний фрагмент, що містить від трьох до шести атомів вуглецю. Зазначений термін відноситься до таких груп, як циклопропіл, циклобутил, циклопентил та циклогексил. Замісник, який заміщений "один або більше разів", наприклад, як визначено у відношенні R 1, переважно заміщений одним - трьома замісниками. Галоген звичайно являє собою фтор, хлор, бром або йод; переважно фтор, хлор або бром. Групи галогеналкілів переважно мають довгий ланцюг з 1-4 атомів вуглецю та являють собою, наприклад, фторметил, дифторметил, трифторметил, хлорметил, дихлорметил, трихлорметил, 2,2,2-трифторетил, 2-фторетил, 2-хлоретил, пентафторетил, 1,1-дифтор- 2,2,2-трихлоретил, 2,2,2-трихлоретил, 1,1,2,2-тетрафторетил, 2,2,3,3-тетрафторпропіл, 2,2,3,3,3-пентафторпропіл або 2,2,3,4,4,4-гексафторбутил. У тих випадках, коли X2 являє собою вуглець, зазначений вуглець може бути незаміщеним, може бути заміщений R6 або може бути використаний для приєднання A до азоту сусіднього піперидин/піролідин/азетидинового фрагменту. Сполуки формули I можуть існувати у оптично активній формі або у формі сумішей оптичних ізомерів, наприклад, у формі рацемічних сумішей або діастереоізомерних сумішей. Зокрема, асиметричний атом(атоми) вуглецю можуть бути присутніми у сполуках формули I та їх солях. Якщо у описі не зазначено інакше, всі оптичні ізомери та їх суміші, включаючи рацемічні суміші, включені у винахід, що розглядається. У тому розумінні, як тут використаний, термін "ізомери" відноситься до різних сполук, які мають однакові молекулярні формули, але відрізняються розташуванням та конфігурацією атомів. Також у тому розумінні, як тут використаний, термін "оптичний ізомер" або "стереоізомер" відноситься до будь-якої з різних стереоізомерних конфігурацій, які можуть існувати для конкретної сполуки даного винаходу, та включають геометричні ізомери. Слід розуміти, що замісник може бути приєднаний до хірального центру атому вуглецю. Термін "хіральний" відноситься до молекул, які не мають властивість сумісності при взаємному накладенні своїх дзеркальних зображень, тоді як термін "ахіральний" відноситься до молекул, у яких суміщаються їх дзеркальні зображення. Тому даний винахід включає енантіомери, діастереоізомери або рацемічні сполуки. "Енантіомери" являють собою пари стереоізомерів, які не є дзеркальними зображеннями один одного, що суміщаються. Суміш 1:1 пари енантіомерів являє собою "рацемічну" суміш. Термін використовують за необхідності для позначення рацемічної суміші. "Діастереоізомери" являють собою стереоізомери, у яких є щонайменше два асиметричні атоми, але які не є дзеркальними зображеннями один іншого. Абсолютну стереохімію визначають у відповідності з системою Кана-Інгольда-Прелога R-S. Якщо сполука являє собою чистий енантіомер, стереохімію біля кожного хірального вуглецю можна визначити або як R або як S. Розділені сполуки, абсолютна конфігурація яких невідома, можна позначати як (+) або (-) залежно від напрямку (право- або лівообертання), у якому вони обертають площину поляризації світла на довжині хвилі D лінії натрію. Розкриті у описі сполуки можуть містити один або більше з асиметричних центрів та тому можуть мати енантіомери, діастереоізомери та інші стереоізомерні форми, які можна розділити у термінах абсолютної стереохімії як (R)- або (S)-. Якщо не зазначено інакше, мається на увазі, що даний винахід включає всі можливі ізомери, включаючи рацемічні суміші, оптично чисті форми та проміжні суміші. Оптично активні (R)- та (S)- ізомери можна одержати, використовуючи хіральні синтони або хіральні реагенти, або розділити, використовуючи звичайні методики. Якщо сполука містить подвійний зв'язок, замісник може існувати у E або Z конфігурації. Якщо сполука містить дизаміщений циклоалкіл, такий циклоалкільний замісник може існувати у цис- або транс-конфігурації. Будь-який асиметричний атом (наприклад, вуглець або т.п.) сполуки (сполук) даного винаходу може бути у рацемічній або енантіомерно збагаченій, наприклад, (R)-, (S)- або (R, S)конфігурації. У деяких варіантах кожен асиметричний атом має щонайменше 50 % енантіомерний надлишок, щонайменше 60 % енантіомерний надлишок, щонайменше 70 % енантіомерний надлишок, щонайменше 80 % енантіомерний надлишок, щонайменше 90 % енантіомерний надлишок, щонайменше 95 % енантіомерний надлишок, або щонайменше 99 % енантіомерний надлишок у (R)- або (S)- конфігурації. Замісники у атомів з ненасиченими зв'язками можуть, якщо це можливо, бути присутніми у цис- (Z) - або транс- (E)- формі. Відповідно, у тому розумінні, як тут використано, сполука даного винаходу може бути у формі одного з можливих ізомерів, ротамерів, атропізомерів, таутомерів або їх сумішей, 3 UA 113876 C2 5 10 15 20 25 30 35 40 45 50 55 60 наприклад, у вигляді практично чистих геометричних (цис або транс) ізомерів, диастереоізомерів, оптичних ізомерів (антиподів), рацематів або їх сумішей. Будь-які отримані суміші ізомерів можна розділити, використовуючи фізико-хімічні відмінності складових, на чисті або практично чисті геометричні або оптичні ізомери, діастереоізомери, рацемати, наприклад, за допомогою хроматографії та/або фракційної кристалізації. Будь-які отримані рацемати кінцевих продуктів або проміжних сполук можна розділити на оптичні антиподи за відомими способами, наприклад, розділенням їх діастереоізомерних солей, отриманих з оптично активними кислотами або основами, та виділяючи оптично активні кислотні або основні сполуки. Зокрема, основні фрагменти можна використовувати для розділення сполук даного винаходу на їхні оптичні антиподи, наприклад, шляхом фракційної кристалізації солей, утворених з оптично активними кислотами, наприклад, винною кислотою, дибензоїлвинною кислотою, діацетилвинною кислотою, ди-O, O'-п-толуоїлвинною кислотою, мигдальною кислотою, яблучною кислотою або камфор-10-сульфоновою кислотою. Рацемічні продукти можна також розділити, використовуючи хіральну хроматографію, наприклад, високоефективну рідинну хроматографію (ВЕРХ), використовуючи хіральний адсорбент. Залежно від визначення замісники, сполуки формули I можуть існувати у різних таутомерних формах. Усі таутомерні форми сполук формули I включені у обсяг даного винаходу. У тому розумінні, як тут використано, терміни "сіль" або "солі" відносяться до солей приєднання кислот або до солей приєднання основ, що відповідає сполуці, наприклад, сполуці даного винаходу або сполуці формули II-1. "Солі" включають, зокрема, "фармацевтично прийнятні солі". Термін "фармацевтично прийнятні солі" відноситься до солей, які зберігають біологічну ефективність та властивості сполук даного винаходу та не є біологічно або якимнебудь іншим чином небажаними. Сполуки даного винаходу можуть бути здатні утворювати кислі та/або основні солі за рахунок присутності аміно та/або карбоксильних груп або аналогічних їм груп. Фармацевтично прийнятні солі приєднання кислот можна отримати з неорганічними кислотами та з органічними кислотами, наприклад, такі солі як ацетат, аспартат, бензоат, безилат, бромід/гідробромід, бікарбонат/карбонат, бісульфат/сульфат, камфорсульфонат, хлорид/гідрохлорид, cхлортеофілонат, цитрат, етандисульфонат, фумарат, глуцептат, глюконат, глюкуронат, гіпурат, гідройодид/йодид, ізетіонат, лактат, лактобіонат, лаурилсульфат, малат, малеат, малонат, манделат, мезилат, метилсульфат, нафтоат, напсилат, нікотинат, нітрат, октадеканоат, олеат, оксалат, пальмітат, памоат, фосфат/гідрофосфат/дигідрофосфат, полігалактуронат, пропіонат, стеарат, сукцинат, сульфосаліцилат, тартрат, тозилат та трифторацетат. Неорганічні кислоти, з якими можна утворювати солі, включають, наприклад, хлористоводневу кислоту, бромистоводневу кислоту, сірчану кислоту, азотну кислоту, фосфорну кислоту тощо. Органічні кислоти, з якими можна отримати солі, включають, наприклад, оцтову кислоту, пропіонову кислоту, гліколеву кислоту, щавлеву кислоту, яблучну кислоту, малонову кислоту, янтарну кислоту, фумарову кислоту, винну кислоту, лимонну кислоту, бензойну кислоту, мигдальну кислоту, метансульфонову кислоту, етансульфонову кислоту, толуолсульфонову кислоту, сульфосаліцилову кислоту та т.п. Фармацевтично прийнятні солі приєднання основ можна отримати з неорганічними та органічними основами. Неорганічні основи, з якими можна отримати солі, включають, наприклад, солі амонію та солі металів I-XII груп періодичної таблиці елементів. У деяких варіантах, такі солі отримують, використовуючи натрій, калій, амоній, кальцій, магній, залізо, срібло, цинк та мідь; особливо кращі солі включають солі амонію, калію, натрію, кальцію та магнію. Органічні основи, з якими можна отримати солі, включають, наприклад, первинні, вторинні та третинні аміни, заміщені аміни, включаючи природні заміщені аміни, циклічні аміни, основні іонообмінні смоли та т.п. Деякі органічні аміни включають ізопропіламін, бензатин, холінат, діетаноламін, діетиламін, лізин, меглумін, піперазин та трометамін. Фармацевтично прийнятні солі даного винаходу можна синтезувати з основних або кислотних фрагментів за звичайними хімічними способами. Звичайно такі солі можна одержати, здійснюючи реакцію вільних кислотних форм зазначених сполук із стехіометричною кількістю відповідних основ (таких як гідроксиди, карбонати, бікарбонати або т.п. Na, Ca, Mg, або K), або здійснюючи взаємодію форми вільних основ зазначених сполук із стехіометричною кількістю відповідної кислоти. Такі реакції звичайно проводять у воді, або у органічному розчиннику, або у суміші обох. Звичайно, переважне використання неводних середовищ, таких як простий ефір, етилацетат, етанол, ізопропанол або ацетонітрил, якщо це можливо. Списки додаткових 4 UA 113876 C2 5 10 15 20 25 30 35 40 45 50 55 60 підходящих солей можна знайти, наприклад, у "Remington's Pharmaceutical Sciences", 20th ed., Mack Publishing Company, Easton, Pa., (1985); та в "Handbook of Pharmaceutical Salts: Propeктies, Selection, and Use" by Stahl and Wermuth (Wiley-vch, Weinheim, Germany, 2002). Якщо основна група та кислотна група обидві присутні у одній і тій же молекулі, сполуки даного винаходу можуть також утворювати внутрішні солі, наприклад, цвіттеріонні молекули. Будь-які представлені у описі формули представляють також немічені форми, також як мічені ізотопами форми розглянутих сполук. Мічені ізотопами сполуки мають структури, зображені представленими формулами, за винятком того, що один або більше з атомів замінений атомом з обраною атомною масою або масовим числом. Приклади ізотопів, які можуть бути включені у сполуки даного винаходу, включають ізотопи водню, вуглецю, азоту, 2 3 11 13 14 15 18 31 32 35 36 125 кисню, фосфору, фтору та хлору, такі як H, H, C, C, C, N, F, P, P, S, Cl, I, відповідно. Даний винахід включає різні мічені ізотопами сполуки, як визначено у описі, 3 14 наприклад такі, у яких присутні радіоактивні ізотопи, такі як H та C, або такі, у яких присутні 2 13 нерадіоактивні ізотопи, такі як H та C. Такі мічені ізотопами сполуки можна застосовувати при 14 2 3 дослідженнях метаболізму (з C), при дослідженнях кінетики реакцій (наприклад, з H або H), у методах детектування або одержання зображень, таких як позитронна емісійна томографія (PET) або однопроточна емісійна комп'ютерна томографія (SPECT), включаючи аналізи розподілу лікарських засобів або субстратів у тканинах, або при радіоактивному лікуванні 18 18 пацієнтів. Зокрема, F або сполуки, мічені F, можуть особливо знадобитися для PET або SPECT досліджень. Мічені ізотопами сполуки формули (I) взагалі можна одержати за звичайними способами, добре відомими спеціалістам у даній галузі, або за способами, аналогічними способам, розкритим у прикладених розділах Приклади та Одержання, використовуючи відповідні мічені ізотопами реагенти замість немічених реагентів, що використовувалися раніше. 2 Крім того, заміщення більш важкими ізотопами, особливо дейтерієм (тобто H або D), може забезпечити деякі терапевтичні переваги через більш високу метаболічну стабільність, наприклад, підвищений строк in vivo напіврозпаду, або зменшення доз, або поліпшення терапевтичного індексу. Слід розуміти, що дейтерій у даному контексті розглядається як замісник сполуки формули (I). Концентрації таких важких ізотопів, особливо дейтерію, можна визначити за коефіцієнтом ізотопного збагачення. Термін "коефіцієнт ізотопного збагачення" у тому розумінні, як тут використаний, означає відношення між концентрацією ізотопу та природною концентрацією зазначеного ізотопу. Якщо замісник у сполуці даного винаходу зазначений як дейтерій, така сполука має фактор ізотопного збагачення для кожного зазначеного атому дейтерію щонайменше 3500 (52,5 % включення дейтерію у кожен зазначений атом дейтерію), щонайменше 4000 (60 % включення дейтерію), щонайменше 4500 (67,5 % включення дейтерію), щонайменше 5000 (75 % включення дейтерію), щонайменше 5500 (82,5 % включення дейтерію), щонайменше 6000 (90 % включення дейтерію), щонайменше 6333,3 (95 % включення дейтерію), щонайменше 6466,7 (97 % включення дейтерію), щонайменше 6600 (99 % включення дейтерію), або щонайменше 6633,3 (99,5 % включення дейтерію). Фармацевтично прийнятні сольвати у відповідності з даним винаходом включають такі, у яких розчинник кристалізації може бути ізотопно заміщеним, наприклад, D 2O, d6-ацетон, d6ДМСО. Сполуки даного винаходу, які містять групи, здатні діяти як донори та/або акцептори для водневих зв'язків, можуть утворювати cпів-кристали з підходящими cпів-кристалічними утворювачами. Такі cпів-кристали можна одержати зі сполук формули (I) за відомими способами утворення спів-кристалів. Такі способи включають здрібнювання, нагрівання, сумісну сублімацію, спільне плавлення або контактування у розчині сполуки формули I із ізкристалічним утворювачем в умовах кристалізації, та виділення спів-кристалів, що утворювалися таким чином. Підходящі спів-кристалічні утворювачі включають ті, що розкриті у WO 2004/078163. Отже, у даному винаході крім того запропоновані cпів-кристали, що включають сполуки формули (I). У даному винаході також запропоновані пролікарські засоби сполук даного винаходу, які перетворюються in vivo у сполуки даного винаходу. Пролікарський засіб являє собою активну або неактивну сполуку, яка модифікується хімічно у результаті in vivo фізіологічної дії, такої як гідроліз, метаболізм та т.п., сполуки даного винаходу після введення суб'єкту пролікарського засобу. Придатність та способи, залучені у створення та застосування про-лікарських засобів добре відомі спеціалістам у даній галузі. Див. The Practice of Medicinal Chemistry, Ch. 31-32 (Ed. Wermuth, Academic Press, San Diego, Calif., 2001). Крім того, сполуки даного винаходу, включаючи їх солі, також можна одержати у формі їх гідратів, або із включенням інших розчинників, використовуваних для їх кристалізації. Сполуки 5 UA 113876 C2 50 даного винаходу можуть природно або за рахунок синтезу утворювати сольвати з фармацевтично прийнятними розчинниками (включаючи воду); тому, даний винахід включає і сольвати і несольватовані форми. Термін "сольват" відноситься до молекулярних комплексів сполук даного винаходу (включаючи їх фармацевтично прийнятні солі) з однією або більше з молекул розчиннику. Такі молекули розчинників являють собою звичайно використовувані у галузі фармацевтики, які, як відомо, нешкідливі для реципієнта, наприклад, вода, етанол та т.п. Термін "гідрат" відноситься до комплексів, у яких молекули розчиннику є водою. Сполуки даного винаходу, включаючи їх солі, гідрати та сольвати, можуть природно або у результаті створення утворювати поліморфи. Кращі замісники, кращі інтервали чисельних значень, або краще коло радикалів, що присутні у сполуках формули I, та відповідні проміжні сполуки визначені далі. Визначення замісників застосовні до кінцевих продуктів також як і до відповідних проміжних сполук. Визначення замісників можна об'єднати при бажанні, наприклад, із кращими замісниками A та особливо кращими замісниками R1. У одному варіанті у даному винаході запропонована сполука формули I, де R 1 являє собою C1-6алкіл, C3-6циклоалкіл, C3-6циклоалкіл-C1-2алкіл. У одному варіанті у даному винаході запропонована сполука формули I, де R 1 являє собою C3-4алкіл або C3-5циклоалкіл. У одному варіанті у даному винаході запропонована сполука формули I, де R 1 являє собою ізопропіл, циклопропіл, циклобутил або циклопентил. У одному варіанті у даному винаході запропонована сполука формули I, де R1 являє собою ізопропіл. У одному варіанті у даному винаході запропонована сполука формули I, де R 1 являє собою циклобутил. У одному варіанті у даному винаході запропонована сполука формули I, де m являє собою 1. У одному варіанті у даному винаході запропонована сполука формули I, де m являє собою 2. У одному варіанті у даному винаході запропонована сполука формули I, де n являє собою 0, 1 або 2, та де кожен R2 незалежно являє собою галоген, C1-4алкіл, C1-4галогеналкіл, C1-4алкокси групу, C1-4галогеналкокси групу або C3-4циклоалкіл; або два R2 біля одного і того ж атому вуглецю утворюють разом із зазначеним атомом вуглецю C3-4циклоалкіл. У одному варіанті у даному винаході запропонована сполука формули I, де n являє собою 0. У одному варіанті у даному винаході запропонована сполука формули I, де X 1 являє собою кисень. У одному варіанті у даному винаході запропонована сполука формули I, де X 1 являє собою -N(R4)-, та R4 являє собою водень, C1-6алкіл, C3-6циклоалкіл, або C3-6циклоалкіл-C1-2алкіл. У одному варіанті у даному винаході запропонована сполука формули I, де X 1 являє собою N(R4)-, та R4 являє собою водень. У одному варіанті у даному винаході запропонована сполука формули I, де p являє собою 1, та q являє собою 1. У одному варіанті у даному винаході запропонована сполука формули I, де p являє собою 0, та q являє собою 1. У одному варіанті у даному винаході запропонована сполука формули I, де p являє собою 0, та q являє собою 0. У одному варіанті у даному винаході запропонована сполука формули I, де r являє собою 0, 1 або 2, та де кожен R3 незалежно являє собою галоген, C1-4алкіл, C1-4галогеналкіл, C1-4алкокси групу, C1-4галогеналкокси групу або C 3-4циклоалкіл; або два R3 біля одного і того ж атому вуглецю утворюють разом із зазначеним атомом вуглецю C3-4циклоалкіл. У одному варіанті у даному винаході запропонована сполука формули I, де r являє собою 0. У одному варіанті у даному винаході запропонована сполука формули I, де A являє собою A1 55 (А1); де зв'язок, відмічений зірочкою, приєднаний до атому азоту. У одному варіанті у даному винаході запропонована сполука формули I, де A являє собою A1; R5 являє собою водень, C1-4алкіл, C1-4галогеналкіл або C3-4циклоалкіл; s являє собою 0, 1 або 2; та 5 10 15 20 25 30 35 40 45 6 UA 113876 C2 кожен R6 незалежно являє собою галоген, C 1-4алкіл, C1-4галогеналкіл, C1-4алкокси групу, C1групу або C3-4циклоалкіл. У одному варіанті у даному винаході запропонована сполука формули I, де A являє собою A1, R5 являє собою водень або метил, та s являє собою 0. У одному варіанті у даному винаході запропонована сполука формули I, де A являє собою A2 4галогеналкокси5 (А2); де зв'язок, відмічений зірочкою, приєднаний до атому азоту; та s являє собою 0, 1 або 2. У одному варіанті у даному винаході запропонована сполука формули I, де A являє собою 10 A2; 15 20 R5 являє собою водень, C1-4алкіл, C1-4галогеналкіл або C3-4циклоалкіл; s являє собою 0, 1 або 2; та кожен R6 незалежно являє собою галоген, C 1-4алкіл, C1-4галогеналкіл, C1-4алкокси групу, C14галогеналкокси групу або C3-4циклоалкіл. У одному варіанті у даному винаході запропонована сполука формули I, де A являє собою A2, R5 являє собою водень або метил, та s являє собою 0. У одному варіанті у даному винаході запропонована сполука формули I, де A являє собою A3 (А3); де зв'язок, відмічений зірочкою, приєднаний до атому азоту. У одному варіанті у даному винаході запропонована сполука формули I, де A являє собою 25 30 A3; R5 являє собою водень, C1-4алкіл, C1-4галогеналкіл або C3-4циклоалкіл; s являє собою 0, 1 або 2; та кожен R6 незалежно являє собою галоген, C1-4алкіл, C1-4галогеналкіл, C1-4алкокси групу, C1галогеналкокси групу або C3-4циклоалкіл. 4 У одному варіанті у даному винаході запропонована сполука формули I, де A являє собою A3, R5 являє собою водень або метил, та s являє собою 0. У одному варіанті у даному винаході запропонована сполука формули I, де A являє собою A4 (А4); де зв'язок, відмічений зірочкою, приєднаний до атому азоту; та s являє собою 0, 1 або 2. У одному варіанті у даному винаході запропонована сполука формули I, де A являє собою 35 A4; 40 R5 являє собою водень, C1-4алкіл, C1-4галогеналкіл або C3-4циклоалкіл; s являє собою 0, 1 або 2; та кожен R6 незалежно являє собою галоген, C1-4алкіл, C1-4галогеналкіл, C1-4алкокси групу, C14галогеналкокси групу або C3-4циклоалкіл. 7 UA 113876 C2 5 10 15 20 25 30 35 40 У одному варіанті у даному винаході запропонована сполука формули I, де A являє собою A4, R6 являє собою водень або метил, та s являє собою 0. У одному варіанті у даному винаході запропонована сполука формули I, де R 1 являє собою ізопропіл або циклобутил; m являє собою 1; n являє собою 0, 1 або 2; кожен R2 незалежно являє собою галоген, C1-4алкіл, C1-4галогеналкіл, C1-4алкокси групу, C1-4галогеналкокси групу або C3-4циклоалкіл; або два R2 біля одного і того ж атому вуглецю утворюють разом із зазначеним атомом вуглецю C3-4циклоалкіл; X1 являє собою кисень; p являє собою 1, та q являє собою 1; r являє собою 0, 1 або 2; де кожен R3 незалежно являє собою галоген, C 1-4алкіл, C1-4галогеналкіл, C1-4алкокси групу, C1-4галогеналкокси групу або C3-4циклоалкіл; або два R3 біля одного і того ж атому вуглецю утворюють разом із зазначеним атомом вуглецю C3-4циклоалкіл; A вибирають з A3 та A4 (А3); (А4); де зв'язок, відмічений зірочкою, приєднаний до атому азоту; R5 являє собою водень або метил; s являє собою 0, 1 або 2; та кожен R6 незалежно являє собою галоген, C 1-4алкіл, C1-4галогеналкіл, C1-4алкокси групу, C14галогеналкокси групу або C3-4циклоалкіл; У одному варіанті у даному винаході запропонована сполука формули I, де R1 являє собою ізопропіл або циклобутил; m являє собою 1, та n являє собою 0; X1 являє собою кисень; p являє собою 1, та q являє собою 1; r являє собою 0; та A вибирають з A3 та A4 (А3); (А4); де зв'язок, відмічений зірочкою, приєднаний до атому азоту; та R5 являє собою водень або метил; та s являє собою 0. У одному варіанті у даному винаході запропонована сполука формули I, де R 1 являє собою C1-6алкіл або C3-6циклоалкіл; m являє собою 1 та n являє собою 0; X1 являє собою кисень; p являє собою 1, та q являє собою 1; r являє собою 0; та A являє собою ; де зв'язок, відмічений зірочкою, приєднаний до атому азоту; X2 являє собою азот або вуглець; R5 являє собою водень або C1-6алкіл; та s являє собою 0. 8 UA 113876 C2 5 10 15 20 25 30 35 40 У одному варіанті у даному винаході запропонована сполука формули I, де R 1 являє собою C1-6алкіл або C3-6циклоалкіл; m являє собою 1, та n являє собою 0; X1 являє собою кисень; p являє собою 1, та q являє собою 1; r являє собою 0; та A вибирають з A3 та A4 (А3); (А4); де зв'язок, відмічений зірочкою, приєднаний до атому азоту; R5 являє собою водень або C1-6алкіл; та s являє собою 0. У одному варіанті у даному винаході запропонована сполука формули I, де R1 являє собою ізопропіл, циклопропіл або циклобутил; m являє собою 1, та n являє собою 0; X1 являє собою кисень; p являє собою 1, та q являє собою 1; r являє собою 0; та A являє собою ; де зв'язок, відмічений зірочкою, приєднаний до атому азоту; X2 являє собою азот або вуглець; R5 являє собою водень, метил або етил; та s являє собою 0. У одному варіанті у даному винаході запропонована сполука формули I, де R1 являє собою ізопропіл, циклопропіл або циклобутил; m являє собою 1, та n являє собою 0; X1 являє собою кисень; p являє собою 1, та q являє собою 1; r являє собою 0; та A вибирають з A3 та A4 (А3); (А4); де зв'язок, відмічений зірочкою, приєднаний до атому азоту; R5 являє собою водень, метил або етил; та s являє собою 0. У кращих варіантах даний винахід відноситься до однієї або більше зі сполук формули I, перерахованих далі у розділі приклади, або до їх солей. Крім того, приклади підходящих сполук даного винаходу являють собою сполуки, вибрані з наступної групи P. Група P: підходящі сполуки даного винаходу: 1-(6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл 4-циклобутилпіперазин-1-карбоксилат; 1-(1-метил-6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл 4-ізопропіл-піперазин-1карбоксилат; 1-(6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл 4-ізопропілпіперазин-1-карбоксилат; 1-(6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл 4-циклопропілпіперазин-1-карбоксилат; 9 UA 113876 C2 5 10 15 20 25 30 35 1-(1-метил-6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл 4-циклобутил-піперазин-1карбоксилат; 1-(1-етил-6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл 4-ізопропілпіперазин-1карбоксилат; 1-(1-метил-2-оксо-1,2-дигідропіридин-4-іл)піперидин-4-іл 4-ізопропілпіперазин-1карбоксилат; 1-(2-оксо-1,2-дигідропіридин-4-іл)піперидин-4-іл 4-циклобутилпіперазин-1-карбоксилат; 1-(2-оксо-1,2-дигідропіридин-4-іл)піперидин-4-іл 4-ізопропілпіперазин-1-карбоксилат; або 1-(6-оксо-1,6-дигідропіридин-3-іл)піперидин-4-іл 4-ізопропілпіперазин-1-карбоксилат; або солі зазначених сполук. У наступному аспекті у даному винаході запропонований спосіб одержання сполук формули I-1. Сполуки формули I-1 можна отримати за наступним способом, як розкрито на схемі 1: Схема 1: Сполуки формули I-1, у яких A, R1, R2, R3, m, n, p, q та r приймають зазначені для формули I значення, можна отримати, здійснюючи взаємодію сполук формули II-1, у яких A, R3, p, q та r приймають зазначені для формули I значення, та Ra являє собою відхідну групу, наприклад, галоген, такий як хлор, або 4-нітрофенілокси (переважно, якщо R a являє собою 4нітрофенілокси), зі сполукою формули III, у якому R 1, R2, m та n приймають зазначені для формули I значення, у присутності підходящої основи, наприклад, діізопропілетиламіну, у присутності підходящого розчиннику, наприклад, піридину. У наступному аспекті у даному винаході також запропонований спосіб одержання сполук формули I-2. Сполуки формули I-2 можна отримати у відповідності з наступним способом, як розкрито на схемі 2: Схема 2: Сполуки формули I-2, у яких A, R1, R2, R3, m, n, p, q та r приймають зазначені для формули I значення, можна отримати, здійснюючи взаємодію сполук формули II-2, у яких A, R3, p, q та r приймають зазначені для формули I значення, зі сполукою формули III, у якій R1, R2, m та n приймають зазначені для формули I значення, у присутності карбонілдіімідазолу, підходящої основи, наприклад, діізопропілетиламіну, та підходящого розчиннику, наприклад, диметилформаміду. Крім того сполуки формули I або їх попередники можна отримати зі сполук формул I-1 або I2, отриманих у відповідності зі схемами 1 або 2, або їх попередників (наприклад, сполук формул II-1, II-2 та/або III), шляхом відновлення, окислення та/або інших способів функціоналізації отриманих сполук та/або шляхом видалення необов'язково присутніх захисних груп, та виділення отриманих таким чином сполук формули I. 10 UA 113876 C2 5 10 15 20 25 30 35 40 Сполуки формули I можна також отримати за звичайними способами, наприклад, такими, які розкриті у розділі приклади, причому зазначені способи, крім того, являють собою аспекти даного винаходу. Даний винахід також має на увазі, що сполуки формули (I) можна отримати у результаті in vivo біотрансформацій з про-лікарських засобів. Зазначені реакції можна здійснювати за звичайними способами, наприклад, як розкрито у розділі приклади. Обробку реакційних сумішей та очищення отриманих таким чином сполук можна здійснювати у відповідності з відомими способами. Солі приєднання кислот можна отримати з вільних основ за відомими способами, та навпаки. Вихідні матеріали, наприклад, сполуки формул II-1, II-2 та III, можуть бути відомими, або їх можна отримати за звичайними способами, виходячи з відомих сполук, наприклад, як розкрито у розділі приклади. У наступному аспекті у даному винаході також запропонований спосіб одержання сполук формули II-1. Сполуки формули II-1 можна отримати у відповідності з наступним способом, як розкрито на схемі 3: Схема 3: Стадія 3.1: Сполуки формул V-1, у яких A, R3, p, q та r приймають зазначені для формули I значення, можна отримати, здійснюючи взаємодію сполук формули VII-1, у яких R3, p, q та r приймають зазначені для формули I значення, зі сполуками формули VI, у яких A приймає зазначені раніше для формули I значення, та R b являє собою галоген, наприклад хлор, у присутності підходящої основи, наприклад, діізопропілетиламіну, та необов'язково у присутності підходящого розчиннику. Стадія 3.2: Сполуки формули II-1, у яких A, R1, R2, R3, m, n, p, q та r приймають зазначені для формули I значення, можна отримати, здійснюючи взаємодію сполук V-1 зі сполуками формули IV, у яких Rc являє собою галоген, наприклад хлор, та Ra являє собою відхідну групу, наприклад, галоген або 4-нітрофенілокси (переважно Ra являє собою 4-нітрофенілокси), у присутності підходящої основи, наприклад, діізопропілетиламіну, та у присутності підходящого розчиннику, наприклад, піридину. У наступному аспекті у даному винаході також запропоновані нові сполуки формули II-1 (ІІ-1); або їх солі; у яких p, q, r, R3 та A приймають зазначені для формули I значення; Ra являє собою відхідну групу, наприклад, галоген, такий як хлор, або групу, вибрану з ; де зв'язок, відмічений зірочкою, приєднаний до карбонільної групи; де R' являє собою водень або нітро групу; переважно Ra являє собою 4-нітрофенілокси групу. У одному варіанті зазначеного наступного аспекту у даному винаході запропонована сполука формули II-1, де p являє собою 1, та q являє собою 1; p являє собою 0, та q являє собою 1; або 11 UA 113876 C2 5 10 15 20 25 30 35 40 45 50 55 p являє собою 0, та q являє собою 0; r являє собою 0, 1 або 2, та де кожен R2 незалежно являє собою галоген, C1-4алкіл, C1-4 галогеналкіл, C1-4алкокси групу, C1-4галогеналкокси групу або C3-4циклоалкіл, або два R2 біля одного і того ж атому вуглецю утворюють разом із зазначеним атомом вуглецю C3-4циклоалкіл; та A являє собою A4 або A5. У одному варіанті зазначеного далі аспекту, у даному винаході запропонована сполука формули II-1, де R1 являє собою ізопропіл; m являє собою 1; X1 являє собою кисень; p являє собою 1, та q являє собою 1; n являє собою 0; p являє собою 1, та q являє собою 1; A являє собою A4 або A5; та R5 являє собою водень або метил. У одному варіанті зазначеного далі аспекту, у даному винаході запропонована сполука формули II-1, де R1 являє собою циклобутил; m являє собою 1; X1 являє собою кисень; p являє собою 1, та q являє собою 1; n являє собою 0; p являє собою 1, та q являє собою 1; A являє собою A4 або A5; та R5 являє собою водень або метил. У іншому аспекті у даному винаході запропоновані фармацевтичні композиції, що включають сполуку даного винаходу та фармацевтично прийнятний носій. Зазначені фармацевтичні композиції можна створити для конкретного способу введення, такого як пероральне введення, парентеральне введення та ректальне введення, і т.д. Крім того фармацевтичні композиції даного винаходу можна приготувати у твердій формі, включаючи капсули, таблетки, пігулки, гранули, порошок або супозиторії, або у рідкій формі, включаючи розчини, суспензії або емульсії. Такі фармацевтичні композиції можна піддавати звичайним фармацевтичним операціям, таким як стерилізація, та/або вони можуть містити звичайні інертні розріджувачі, змащуючі агенти або буферні агенти, також як ад'юванти, такі як консерванти, стабілізатори, змочуючі агенти, емульгатори та буфери і т.д. Звичайно, фармацевтичні композиції являють собою таблетки та желатинові капсули, що включають активний інгредієнт разом з a) розріджувачами, наприклад, лактозою, декстрозою, сахарозою, манітом, сорбітом, целюлозою та/або гліцином; b) змащуючими агентами, наприклад, двоокисом кремнію, тальком, стеариновою кислотою, їх магнієвими або кальцієвими солями, та/або поліетиленгліколями; для таблеток також c) зв'язуючими, наприклад, магнійалюмінійсилікатом, пастою крохмалю, желатином, трагакантом, метилцелюлозою, натрійкарбоксиметилцелюлозою та/або полівінілпіролідоном; та при бажанні d) розпушувачами, наприклад, крохмалями, агаром, альгіновою кислотою або її натрієвою сіллю, або шипучими сумішами; та/або e) абсорбентами, барвниками, віддушками та підсолоджувачами. Таблетки можуть бути покриті або плівкою або кишковорозчинним покриттям за способами, відомими спеціалістам. Підходящі композиції для перорального введення включають ефективну кількість сполуки даного винаходу у формі таблеток, пастилок, водних або масляних суспензій, диспергуємих порошків або гранул, емульсій, твердих або м'яких капсул, сиропів або еліксирів. Композиції, призначені для перорального застосування, одержують за будь-яким зі способів, добре відомих спеціалістам у галузі виготовлення фармацевтичних композицій, та такі композиції можуть містити один або більше з агентів, вибраних з групи, що складається з підсолоджуючих агентів, смакових агентів, барвників та консервантів, щоб одержати фармацевтично елегантні та із приємним смаком препарати. Таблетки містять активний інгредієнт у суміші з нетоксичними фармацевтично прийнятними ексципієтами, які придатні для виготовлення таблеток. Зазначені ексципієти являють собою, наприклад, інертні розріджувачі, такі як карбонат кальцію, карбонат натрію, лактоза, фосфат кальцію або фосфат натрію; агенти, що сприяють здрібнюванню, та розпушувачі, наприклад, кукурудзяний крохмаль або альгінова кислота; сполучні агенти, наприклад, крохмаль, желатин або смола акації; та змащуючі агенти, наприклад стеарат магнію, стеаринова кислота або тальк. Такі таблетки можуть бути без оболонки або у оболонці, нанесеній за відомими спеціалістам у даній галузі способами, щоб затримати розпад та абсорбцію у шлунково-кишковому тракті, та тим самим забезпечити уповільнену дію впродовж тривалого проміжку часу. Наприклад, можна застосовувати уповільнюючі матеріали, такі як моностеарат гліцерину або дистеарат гліцерину. Лікарські композиції для перорального застосування поможуть бути у вигляді твердих желатинових капсул, у яких активний інгредієнт змішаний з інертним твердим розріджувачем, наприклад, карбонатом кальцію, фосфатом кальцію або каоліном, або у вигляді м'яких желатинових капсули, у яких активний інгредієнт 12 UA 113876 C2 5 10 15 20 25 30 35 40 45 50 55 60 змішаний з водою або масляним середовищем, наприклад, арахісовим маслом, рідким парафіном або оливковим маслом. Деякі композиції для ін'єкцій являють собою водні ізотонічні розчини або суспензії, та супозиторії, які переважно, одержують із жирних емульсій або суспензій. Зазначені композиції можна стерилізувати та/або вони можуть містити ад'юванти, такі як консерванти, стабілізуючі, змочуючі або емульгуючі агенти, промотори розчинення, солі для регулювання осмотичного тиску та/або буфери. Крім того, вони можуть також містити інші терапевтично цінні речовини. Зазначені композиції одержують, використовуючи звичайні способи змішування, гранулювання, нанесення покриттів, відповідно, та вони містять близько 0,1-75 %, або містять близько 1-50 %, активного інгредієнту. Підходящі композиції для трансдермального застосування включають ефективну кількість сполуки даного винаходу з носієм. Носії включають абсорбуємі фармакологічно прийнятні розчинники, які сприяють проникненню через шкіру хазяїна. Наприклад, трансдермальні пристрої можуть бути у формі бандажів, що включають опорний елемент, резервуар, що містить зазначену сполуку, необов'язково з носієм, необов'язково контролюючий швидкість бар'єр для доставки сполуки через шкіру хазяїна з контрольованою та заздалегідь визначеною швидкістю впродовж тривалого проміжку часу, та засобу для фіксації обладнання на шкірі. Підходящі композиції для зовнішнього застосування, наприклад, для шкіри та для очей, включають водні розчини, суспензії, мазі, креми, гелі або розпорошувальні композиції, наприклад, для доставки за допомогою аерозолів або т.п. Такі системи для зовнішньої доставки особливо підходять для нанесення на шкіру, наприклад, для лікування від раку шкіри, наприклад, для профілактичного використання у сонцезахисних кремах, лосьйонах, спреях і т.п. Вони також особливо придатні для використання у засобах для зовнішнього застосування, включаючи косметичні засоби, добре відомі спеціалістам. Такі засоби можуть містити солюбілізатори, стабілізатори, агенти, що підвищують тонічність, буфери та консерванти. У тому розумінні, як тут використаний, термін зовнішнє застосування може також відноситися до інгаляції або до інтраназального введення. Препарати звичайно поставляють у формі сухого порошку (або окремо або у вигляді суміші, наприклад сухої суміші з лактозою, або у вигляді змішаних часток, наприклад з фосфоліпідами) із сухих порошкових інгаляторів або у вигляді аерозольних спреїв, що надходять із контейнерів під тиском, помпи, спрею, атомайзеру або небулайзеру, з використанням підходящого пропеленту або без нього. У даному винаході, крім того, запропоновані безводні фармацевтичні композиції та дозовані форми, що містять сполуки даного винаходу як активні інгредієнти, тому що вода може полегшити розкладання деяких сполук. Безводні фармацевтичні композиції та дозовані форми даного винаходу можна отримати, використовуючи безводні або з низьким вмістом вологи інгредієнти в умовах низького вмісту вологи або низької вологості. Безводні фармацевтичні композиції можна отримати та зберігати таким чином, щоб зберігалася їхня безводна природа. Відповідно, безводні композиції, переважно, упаковують, використовуючи матеріали, які, як відомо, оберігають від контактування з водою, та звичайно вони включені у підходящі формуляторні набори. Приклади підходящих упакувань включають, але ними не обмежуються, герметично закриту фольгу, пластики, одиничні дозовані контейнери (наприклад, ампули), блістерні упакування та стрічкові упакування. У даному винаході, крім того, запропоновані фармацевтичні композиції та дозовані форми, які включають один або більше з агентів, які зменшують швидкість, з якою сполука даного винаходу розкладається як активний інгредієнт. Такі агенти, які у даному описі називають "стабілізаторами", включають, але ними не обмежуються, антиоксиданти, такі як аскорбінова кислота, pН буфери, або сольові буфери, тощо. У тому розумінні, як тут використаний, термін "фармацевтично прийнятний носій" включає будь-який та всі розчинники, дисперсійні середовища, покриття, поверхнево-активні агенти, антиоксиданти, консерванти (наприклад, антибактеріальні агенти, протигрибкові агенти), ізотонічні агенти, уповільнюючі абсорбцію агенти, солі, консерванти, лікарські засоби, стабілізатори лікарських засобів, зв'язуючі засоби, ексципієти, розпушуючі агенти, змащуючі агенти, підсолоджувачі, смакові агенти, барвники, такі подібні матеріали та їх комбінації, які відомі спеціалістам у даній галузі (див., наприклад, Remington's Pharmaceutical Sciences, 18th Ed. Mack Printing Company, 1990, pp. 1289-1329). За винятком випадків, коли будь-який звичайний носій несумісний з активним інгредієнтом, його використання у терапевтичних або фармацевтичних композиціях неприпустиме. Сполуки формули I або їх фармацевтично прийнятні солі демонструють цінні фармакологічні властивості та тому можуть використовуватися як лікарські засоби. 13 UA 113876 C2 5 10 15 20 25 30 35 40 45 50 55 60 Крім того, сполуки формули I можуть бути корисні для дослідження H3 рецепторів, наприклад, як інструментальні сполуки. Зокрема, сполуки формули I проявляють антагоністичну дію у відношенні людських H3 рецепторів. У тому розумінні, як тут використаний, термін "антагоніст Ή3 рецептору" включає зворотні антагоністи H3 рецепторів та нейтральні агоністи H3 рецепторів. Антагоністичну дію у відношенні H3 рецепторів можна визначити in vitro, наприклад, у відношенні рекомбінантних людських H3 рецепторів, використовуючи різні процедури, такі як, наприклад, вимірювання інгібування викликаного агоністом підвищення внутрішньоклітинної cAMP концентрації, наприклад, як розкрито у описі. Тому сполуки даного винаходу можуть бути корисні для профілактики, лікування або уповільнення розвитку порушень, опосередкованих H3 рецепторами. Порушення, опосередковані H3 рецепторами, можуть являти собою такі як, наприклад, i) порушення сну та неспання з надлишковою денною сонливістю; такі як нарколепсія, наприклад, нарколепсія з каталепсією або без неї; вторинні нарколептичні синдроми; апное сну центрального походження; або обструктивний синдром апное сну; ii) порушення або стани, пов'язані із зростаючою тучністю або гіперсомнолентністю; такі як ожиріння, пов'язане з аутоімунними захворюваннями, наприклад, розсіяним склерозом або ревматоїдним артритом; тучність, пов'язана з нейродегенеративними порушеннями, наприклад, такими як хвороба Паркінсона, полісистемна атрофія, синдром Ши-Драгера або синдром прогресуючого супраядерного паралічу; тучність, зв'язана з іншими медичними станами або їх лікуванням, такими як депресія, синдром емоційного вигоряння, або порушення адаптації; зв'язані зі стресом порушення із супутньою тучністю, наприклад, гострі стресові порушення або посттравматичні стресові порушення; пов'язана з раком тучність; пов'язана з хіміотерапією тучність; тучність, пов'язана з позмінною роботою; зі зміною годинних поясів; хронічний синдром тучності; фіброміалгія; післяінфекційна тучність; післяопераційна тучність або запаморочення; iii) порушення або стани з порушеннями свідомості; такі як хвороба Альцгеймера; помірний когнітивний розлад; деменція з тельцями Леві; судинна деменція; хвороба Хантінгтона; хвороба Вільсона; фронтотемпоральна деменція; інші форми органічної деменції або органічні когнітивні порушення; розсіяний склероз; шизофренія; шизоафективні порушення; біполярно-афективний розлад; iv) порушення, пов'язані зі зловживанням або залежністю від речовин; такі як залежність від алкоголю, кокаїну, опіоїдів, канабіноїдів, нікотину або інших речовин при зловживанні або потенційній залежності; v) нематеріальні стани зловживання; такі як патологічна залежність від азартних ігор; vi) порушення, пов'язані з дисфункціональними порушеннями харчування та/або метаболічним синдромом; такі як збільшення ваги, пов'язане з антипсихотичними лікарськими засобами; синдром Прадера-Уіллі (Prader-Willi-Sndrome); синдром Мун-Бардет-Бідла (MoonBardet-Biedl Syndrome); тучність; атипова депресія; нейрогенна булімія; або компульсивне переїдання; vii) порушення з підвищеним занепокоєнням; такі як загальне занепокоєння; соціальне занепокоєння; або панічне занепокоєння; viii) інші нейропсихіатричні або невропатологічні порушення; такі як синдром Туретта; первинний тик; вторинний тик; розлад дефіциту уваги, пов'язаний з гіперактивністю; обсцесивно-компульсивні порушення; головний біль, наприклад, епізодична мігрень, хронічна мігрень, кластерний головний біль, або головний біль напруги; гострі порушення, пов'язані з втратою нейронів, наприклад, ударом; порушення повторного сну; синдром неспокійних ніг; або епілепсія; ix) інші медичні стани або порушення; такі як порушення уваги; вертиго; хвороба Мен'єра; короста; сверблячка; біль при запаленнях; нейропатичний біль; цукровий діабет; рак; атеросклероз; алергії; або алергійний риніт. Особливу важливість являє собою лікування нарколепсії; тучності, пов'язаної з розсіяним склерозом; стомлюваності, пов'язаної із хворобою Паркінсона; порушення когнітивних функцій, пов'язаного із шизофренією; порушення когнітивних функцій, пов'язаного із хворобою Альцгеймера; помірних когнітивних порушень; синдрому Туретта; або розладів дефіциту уваги, пов'язаних з гіперактивністю. При вищеописаних показаннях (станах та порушеннях) підходящі дози можуть мінятися в залежність від, наприклад, застосовуваної сполуки, хазяїна, способу введення та природи та важкості підлягаючого лікуванню стану. Однак, звичайно задовільні результати для тварин досягаються при денних дозах від близько 0,001 до близько 500 мг/кг маси тіла, переважно від близько 0,1 до близько 10 мг/кг маси тіла, наприклад, 1 мг/кг для великих тварин, наприклад, 14 UA 113876 C2 5 10 15 20 25 30 35 40 45 50 55 60 людей, показана денна доза знаходиться у інтервалі від близько 0,1 до близько 1000 мг, переважно від близько 0,1 до близько 400 мг, найбільше переважно від близько 0,1 до близько 100 мг сполуки даного винаходу, що вводиться звичайно, наприклад, у роздільних дозах аж до чотирьох разів на день. Для застосування у відповідності з даним винаходом сполуку даного винаходу можна вводити як єдиний активний агент або у комбінації з іншими активними агентами, будь-яким звичайним способом, наприклад, перорально, наприклад, у формі таблеток або капсул, або парентерально, наприклад, у формі розчинів для ін'єкцій або суспензій. Комбінація, яка включає сполуку даного винаходу та один або більше з інших терапевтично активних агентів іменується як "комбінація даного винаходу". У випадку нарколепсії, сполуку даного винаходу можна об'єднати із щонайменше одним активним агентом, вибраним із групи, що складається з інгібітору повторного захоплення норадреналін-допаміну, такого як модафініл або армодафініл; три- або тетрациклічного антидепресанту, такого як кломіпрамін; інгібітору повторного захоплення серотонін-норадреналіну, такого як венлафаксин або дулоксетин; селективного інгібітору повторного захоплення серотоніну, такого як пароксетин; інгібітору повторного захоплення норадреналіну, такого як ребоксетин або атомоксетин; інгібітору MAO-B, такого як селегілін; гама-гідрокси-бутирату; та психостимулятору, такого як метилфенідат. Зазначені комбінації даного винаходу можна застосовувати для лікування нарколепсії. У випадку втомлюваності, зв'язаної з розсіяним склерозом, сполуки даного винаходу можна об'єднати з щонайменше одним активним агентом, вибраним з групи, що складається з аналогу сфінгозин-1-фосфату, такого як фінголімод; та іншим імунодепресивним агентом, таким як преднізолон або метотрексат. У випадку втомлюваності, зв'язаної з хворобою Паркінсона, сполуку даного винаходу можна об'єднати з щонайменше одним активним агентом, вибраним з групи, що складається з L-Dopa з інгібітором декарбоксилази або без нього, такого як бензеразид або карбідопа, та/або з інгібітором катехол-O-метилтрансферази або без нього, такого як ентакапон або толкапон; агоністом рецептору допаміну, таким як ропінірол або перголід; та інгібітору MAO-B, такого як селегілін. У випадку порушення когнітивних функцій, зв'язаного з шизофренією, сполуку даного винаходу можна об'єднати з щонайменше одним антипсихотичним агентом, таким як галоперидол, оланзапін; рисперидон; кветіапін; амісульпірид; або арипіразол. У випадку порушення когнітивних функцій, зв'язаного з хворобою Альцгеймера, сполуку даного винаходу можна об'єднати з щонайменше одним активним агентом, вибраним з групи, що складається з холінергічних агентів, таких як інгібітор ацетилхолінестерази, наприклад, донепезилу, ривастигміну або галантаміну; та антиглутаматергічних агентів, таких як мемантин, селфотел або мідафотел. У випадку порушення когнітивних функцій, зв'язаного з хворобою Альцгеймера, сполуку даного винаходу можна об'єднати з щонайменше одним активним агентом, вибраним з групи, що складається з холінергічного агенту, такого як інгібітор ацетилхолінестерази, наприклад, інгібітор ацетилхолінестерази, наприклад, донперсилу, ривастигміну або галантаміну; та антиглутаматичного агенту, такого як мемантин. У випадку синдрому Туретта, сполуку даного винаходу можна об'єднати з щонайменше одним активним агентом, вибраним з групи, що складається з агоністу альфа-рецептору, такого як клонідин; антипсихотичного агенту, такого як флуфеназин, галоперидол, пімозид, арипіразол або рісперидон; та вичерпуючого допамін агенту, такого як тетрабеназин. У випадку розладу дефіциту уваги, зв'язаного з гіперактивністю, сполуку даного винаходу можна об'єднати з щонайменше одним активним агентом, вибраним з групи, що складається з інгібітору повторного захоплення норадреналін-допаміну, такого як модафініл або армодафініл; три- або тетрациклічного антидепресанта, такого як кломіпрамін; психостимулятору, такого як метилфенідат; 15 UA 113876 C2 5 10 15 20 25 30 35 40 45 50 55 інгібітору повторного захоплення норадреналін-серотоніну, такого як венлафаксин або дулоксетин; селективного інгібітору повторного захоплення серотоніну, такого як пароксетин; та інгібітору повторного захоплення норадреналіну, такого як ребоксетин або томоксетин. Сполуки даного винаходу можуть бути корисні для профілактики згаданих вище станів та порушень. Сполуки даного винаходу можуть бути корисні для лікування згаданих вище станів та порушень. Сполуки даного винаходу можуть бути корисні для затримки розвитку згаданих вище станів та порушень. Ефективність сполук даного винаходу при лікуванні згаданих вище порушень можна підтвердити у різних стандартних тестах, включаючи перераховані далі: In vivo активність сполук даного винаходу можна оцінити, вимірюючи ефекти у відношенні виділення гістаміну мозку (кількісно визначаючи метаболіт гістаміну теле-метилгістамін) та/або тестуючи ефекти у відношенні неспання щурів з EEG електродами. Сполуки даного винаходу можуть бути особливо корисні при лікуванні показань, вибраних з: нарколепсії; втомлюваності, зв'язаної з розсіяним склерозом; втомлюваності, зв'язаної з хворобою Паркінсона; порушення когнітивних функцій, зв'язаного з шизофренією; порушення когнітивних функцій, зв'язаного з хворобою Альцгеймера; помірних когнітивних порушень; синдрому Туретта; та розладу дефіциту уваги, зв'язаного з гіперактивністю; та особливо нарколепсії. Таким чином, крім зазначених варіантів, у даному винаході запропоноване застосування сполуки формули (I) або її фармацевтично прийнятної солі як лікарський засіб. Так, крім зазначених варіантів, у даному винаході запропоноване застосування сполуки формули (I) або її фармацевтично прийнятної солі у терапії. У іншому варіанті терапію вибирають з захворювань, які можна полегшити шляхом інгібування дії H3 рецепторів. У іншому варіанті захворювання вибирають із згаданого вище переліку, наприклад, вибирають з нарколепсії; втомлюваності, зв'язаної з розсіяним склерозом; втомлюваності, зв'язаної з хворобою Паркінсона; порушення когнітивних функцій, зв'язаного з шизофренією; порушення когнітивних функцій, зв'язаного з хворобою Альцгеймера; помірного когнітивного порушення; синдрому Туретта; та розладу дефіциту уваги, зв'язаного з гіперактивністю; та особливо нарколепсії. У іншому варіанті у даному винаході запропонований спосіб лікування захворювання, яке полегшується за рахунок інгібування H3 рецепторів, що включає введення терапевтично прийнятної кількості сполуки формули (I) або її фармацевтично прийнятної солі. У іншому варіанті захворювання вибирають із згаданого вище переліку, наприклад, вибирають з нарколепсії; втомлюваності, зв'язаної з розсіяним склерозом; втомлюваності, зв'язаної з хворобою Паркінсона; порушення когнітивних функцій, зв'язаного з шизофренією; порушення когнітивних функцій, зв'язаного з хворобою Альцгеймера; помірного когнітивного порушення; синдрому Туретта; та розладу дефіциту уваги, зв'язаного з гіперактивністю; та особливо нарколепсії. Термін "терапевтично ефективна кількість" сполуки даного винаходу відноситься до такої кількості сполуки даного винаходу, яка викликає біологічну або медичну реакцію суб'єкта, наприклад, зменшення або інгібування активності ферменту або білку, або полегшення симптомів, покращення станів, уповільнення або затримку розвитку хвороби або профілактику хвороби і т.д. У одному нелімітуючому варіанті термін "терапевтично ефективна кількість" відноситься до такої кількості сполуки даного винаходу, яка, при введенні суб'єкту є ефективною у відношенні (1) щонайменше часткового ослаблення, інгібування, попередження та/або полегшення стану, або порушення або захворювання (i) опосередкованого H3 рецепторами, або (ii) зв'язаного з активністю H3 рецепторів, або (iii) що характеризується ненормальною активністю H3 рецепторів; або (2) зниження або інгібування активності H3 рецепторів; або (3) зменшення або інгібування експресії H3 рецепторів. У іншому нелімітуючому варіанті термін "терапевтично ефективна кількість" відноситься до такої кількості сполуки даного винаходу, яка, при введенні у клітину, або тканину, або неклітинний біологічний матеріал, або середовище, є ефективною у щонайменше частковому зниженні або інгібуванні активності H3 рецепторів; або щонайменше частковому зменшенні або інгібуванні експресії H3 рецепторів. У тому розумінні, як тут використаний, термін "суб'єкт" відноситься до тварин. Переважно, якщо твариною є ссавець. Термін суб'єкт також відноситься, наприклад, до приматів 16 UA 113876 C2 5 10 15 20 25 30 35 40 45 50 55 60 (наприклад, людей), корів, овець, кіз, коней, собак, кішок, кроликів, щурів, мишей, риб, птахів тощо. У переважному варіанті суб'єктом є людина. У тому розумінні, як тут використаний, термін "інгібування" або "інгібуючий" відноситься до зменшення або до пригнічення конкретного стану, симптому або порушення, або захворювання, або до значного зниження базової активності біологічної активності або процесу. У тому розумінні, як тут використаний, термін "обробка" або "лікування" будь-якого захворювання або порушення відноситься у одному варіанті до полегшення порушення або захворювання (тобто уповільнення або зупинки або зменшення розвитку захворювання, або щонайменше одного з його клінічних симптомів). У іншому варіанті "обробка" або "лікування" відноситься до полегшення та зменшення щонайменше одного фізичного параметру, включаючи ті, які пацієнт може не відчувати. У ще одному варіанті термін "обробка" або "лікування" відноситься до модулювання захворювання або порушення або фізично (наприклад, шляхом стабілізації непомітного для пацієнту симптому), фізіологічно (наприклад, шляхом стабілізації фізичних параметрів) або і того і іншого. У ще одному варіанті термін "обробка" або "лікування" відноситься до профілактики або затримки настання та розвитку або прогресу захворювання або порушення. Фармацевтичні композиції або комбінації даного винаходу можуть бути у одиничній дозі близько 1-1000 мг активного інгредієнту (інгредієнтів) для суб'єктів масою близько 50-70 кг, або близько 1-500 мг або близько 1-250 мг або близько 1-150 мг або близько 0,5-100 мг, або близько 1-50 мг активних інгредієнтів. Терапевтично ефективні дози сполук, фармацевтичних композицій або їх комбінацій залежать від виду суб'єкта, маси тіла, віку та індивідуального стану, що підлягає лікуванню порушення або захворювання або їх важкості. Лікарі, клініцисти або ветеринари, спеціалісти у даній галузі можуть легко визначити ефективну кількість кожного з активних інгредієнтів, необхідну для профілактики, лікування або інгібування розвитку конкретного порушення або захворювання. Властивості зазначених вище дозувань можна продемонструвати у in vitro та in vivo тестах, використовуючи переважно ссавців, наприклад, мишей, щурів, собак, мавп або ізольовані органі, тканини та їх одержання. Сполуки даного винаходу можна застосовувати in vitro у формі розчинів, наприклад, переважно водних розчинів, та in vivo або ентерально або парентерально, переважно, внутрішньовенно, наприклад, у вигляді суспензії або у водному розчині. Доза in vitro -3 -9 може становити між близько 10 та 10 молярних концентрацій. Терапевтично ефективна кількість in vivo може становити залежно від способу введення, між, наприклад, близько 0,001500 мг/кг, або між наприклад, близько 0,1-100 мг/кг. Активність сполуки даного винаходу можна оцінити in vitro та in vivo розкритими у описі способами. Сполуку даного винаходу можна вводити або одночасно з або до або після щонайменше одного іншого терапевтичного агенту. Сполуку даного винаходу можна вводити окремо, тим же або відмінним шляхом введення, або разом у одній фармацевтичній композиції. Наступні приклади ілюструють даний винахід, але не обмежують його. Скорочення: BINAP (+/-)-2,2'-біс(дифенілфосфіно)-1,1'-бінафтил Boc ди(трет-бутил)карбонат BTC трифосген DCM дихлорметан DIPEA N-етил-N-ізопропілпропан-2-амін(діізопропілетиламін) DMAP 4-диметиламінпіридин EA етилацетат год. година(години) HPLC високоефективна рідинна хроматографія РХМС рідинна хроматографія/мас-спектроскопія MeOH метанол хвил. хвилина(хвилини) ЯМР спектроскопія ядерного магнітного резонансу prep-HPLC препаративна високоефективна рідинна хроматографія Pd2(dba)3 тріс(дибензиліденацетон)дипаладій(0) Rt час утримання кт кімнатна температура t-BuOK трет-бутанолат калію TEA триетиламін TFA трифтороцтова кислота 17 UA 113876 C2 5 10 15 20 25 THF тетрагідрофуран (ТГФ) РХМС умови (% = об'ємний відсоток): Agilent 1200 ВЕРХ/система 6110 SQ; Рухома фаза: A: вода (10 мМ NH4HCO3) B: ацетонітрил; градієнт: 5 % B впродовж 0,2 хвил., збільшення до 95 %B за 1,2 хвил.; 95 %B впродовж 1,5 хвил., повернення до 5 %B за 0,01 хвил.; швидкість потоку: 1,8 мл/хвил.; Колонка: XBridge C18, 4,650 мм, 3,5 мкм; температура нагрівача: 50C. 1 H ЯМР прилади: Bruker AVANCE III (500 МГц), Bruker AVANCE III (400 МГц) Приклади: Приклад 1.1: 1-(6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл 4-циклобутил-піперазин-1карбоксилат (Спосіб A) a) трет-бутил 4-циклобутилпіперазин-1-карбоксилат До розчину сполуки трет-бутил піперазин-1-карбоксилату (37,2 г, 200 ммоль) у ClCH 2CH2Cl (500 мл) додають циклобутанон (21 г, 300 ммоль) та NaBH(OAc) 3 (84,8 г, 400 ммоль). Реакційну суміш перемішують при кімнатній температурі впродовж 16 годин, гасять насиченим водним розчином Na2CO3 (500 мл) та екстрагують DCM (3500 мл). Об'єднані органічні шари промивають сольовим розчином (50 мл), сушать, фільтрують та концентрують при зниженому тиску, отримуючи цільову сполуку, трет-бутил 4-циклобутилпіперазин-1-карбоксилат (48 г, + 100 %) [РХМС: Rt=1,67 хвил., m/z 241,2 (M+H) ]. b) гідрохлорид 1-циклобутилпіперазину До суміші трет-бутил 4-циклобутилпіперазин-1-карбоксилату (48 г, 200 ммоль) у MeOH (100 мл) обережно додають 2,0н HCl у MeOH (400 мл) при 0C. Суміш перемішують при кімнатній температурі впродовж 5 годин, концентрують при зниженому тиску, отримуючи цільову сполуку + гідрохлорид 1-циклобутилпіперазину (35 г, 82 %) [РХМС: Rt=0,94 хвил., m/z 141,3 (M+H) ]. c) 6-(4-гідроксипіперидин-1-іл)піридазин-3(2H)-он 18 UA 113876 C2 5 10 15 20 25 30 До розчину 6-хлорпіридазин-3(2H)-ону (2,6 г, 20 ммоль) у DIPEA (30 мл) додають піперидин4-ол (2,4 г, 20 ммоль), та отриману суміш перемішують при 120C впродовж 8 годин. Реакційну суміш концентрують при зниженому тиску, отримуючи сирий продукт, який далі очищують, використовуючи хроматографічну обробку на силікагелі (DCM/MeOH=20/1), отримуючи зазначену у заголовку сполуку (3,9 г, 100 %) у вигляді твердої речовини жовтого кольору. + [РХМС: Rt=0,77 хвил., m/z 196,2 (M+H) ]. d) 4-нітрофеніл 1-(6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-ілкарбонат До розчину 6-(4-гідроксипіперидин-1-іл)піридазин-3(2H)-ону (3,9 г, 20 ммоль) у піридині (10 мл) додають DIPEA (3,87 г, 30,0 ммоль) та 4-нітрофеніл хлорформіат (6,03 г, 30 ммоль), та отриману суміш перемішують при 30C впродовж 2 годин. Отриману суміш концентрують при зниженому тиску та залишок очищують, використовуючи хроматографічну обробку на силікагелі (DCM до DCM/MeOH=20/1), отримуючи зазначену у заголовку сполуку (3,3 г, 46 %) у вигляді твердої речовини білого кольору. + [РХМС: Rt=1,47 хвил., m/z 361,1 (M+H) ]. e) 1-(6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл 4-циклобутилпіперазин-1-карбоксилат До розчину 4-нітрофеніл 1-(6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-ілкарбонату (440 мг, 1,22 ммоль) у DCM (20 мл) додають TEA (616 мг, 6,1 ммоль) та 1-циклобутилпіперазин (388 мг, 1,83 ммоль). Отриману суміш перемішують при 30C впродовж 2 годин перед тим, як її концентрують досуха. Зазначену у заголовку сполуку отримують у вигляді твердої речовини білого кольору після хроматографічної обробки на силікагелі (DCM/MeOH=50/1 до 5/1) (410 мг, 93 %). 1 H ЯМР (400 МГц, CDCl3) δ 11,20 (с, 1H), 7,20 (д, J=10 Гц, 1H), 6,87 (д, J=10 Гц, 1H), 4,87~4,92 (м, 1H), 3,45~3,50 (м, 6H), 3,16~3,23 (м, 2H), 2,68~2,76 (м, 1H), 2,29 (шир. 4H), + 1,72~2,07 (м, 10H); [РХМС: Rt=1,36 хвил., m/z 362,3 (M+H) ]. Приклад 1.2: 1-(1-метил-6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл 4 ізопропілпіперазин-1-карбоксилат а) 6-хлор-2-метилпіридазин-3(2H)-он 19 UA 113876 C2 5 10 15 20 25 30 35 40 До розчину 6-хлорпіридазин-3(2H)-ону (780 мг, 6 ммоль) у CH3CN (40 мл) додають Cs2CO3 (3,9 г, 12 ммоль) та CH3I (1 мл, 12 ммоль) та реакційну суміш перемішують при 70C впродовж ночі. Тверду частину видаляють шляхом фільтрування, та отриманий фільтрат концентрують при зниженому тиску. Залишок очищують, використовуючи хроматографічну обробку на силікагелі (гексан/EA=3/1), отримуючи зазначену у заголовку сполуку у вигляді масла помаранчевого кольору (6,5 г, 75 %). + [РХМС: Rt=1,43 хвил., m/z 145,1 (M+H) ]. b) 6-(4-гідроксипіперидин-1-іл)-2-метилпіридазин-3(2H)-он До суспензії 6-хлор-2-метилпіридазин-3(2H)-ону (1 г, 6,94 ммоль) у DIPEA (20 мл) додають піперидин-4-ол (0,84 г, 8,33 ммоль), та реакційну суміш перемішують при 120C впродовж ночі. Отриману суміш розводять водою (30 мл) та екстрагують DCM (330 мл) для видалення домішок. Водну фазу концентрують досуха, отримуючи зазначену у заголовку сполуку у вигляді твердої речовини жовтого кольору (1,2 г, 83 %). + [РХМС: Rt=1,07 хвил., m/z 210,1 (M+H) ]. c) 1-(1-метил-6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл 4-нітрофеніл-карбонат До розчину 6-(4-гідроксипіперидин-1-іл)-2-метилпіридазин-3(2H)-ону (1,46 г, 7 ммоль) у DCM (20 мл) додають 4-нітрофенілхлорформіат (2,11 г, 10,5 ммоль) та DIPEA (1,81 г, 14 ммоль) та отриману суміш перемішують при кімнатній температурі впродовж ночі. Суміш розводять DCM (20 мл), промивають водою (315 мл) та органічний шар концентрують, отримуючи зазначену у заголовку сполуку у вигляді твердої речовини жовтого кольору (1,2 г, 46 %). [РХМС: Rt=1,54 + хвил. m/z=375,1 (M+H) ]. d) 1-(1-метил-6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл 4-ізопропіл-піперазин-1карбоксилат До розчину 1-(1-метил-6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл 4нітрофенілкарбонату (1,2 г, 3,2 ммоль) у DCM (20 мл) додають 1-ізопропілпіперазин (0,6 г, 4,8 ммоль) та TEA (5 мл), та реакційну суміш перемішують при кімнатній температурі впродовж ночі. Суміш потім промивають насиченим розчином Na 2CO3 (330 мл), сушать та концентрують, отримуючи сирий продукт, який очищують, використовуючи хроматографічну обробку на силікагелі (PE/EA=1/1), отримуючи зазначену у заголовку сполуку у вигляді твердої речовини білого кольору (0,48 г, 41 %). 1 [ H ЯМР (CDCl3, 400 МГц): δ 7,13~7,10 (д, J=10, 1H), 6,86~6,84 (д, J=10, 1H), 4,92~4,88(м, 1H), 3,66 (с, 3H), 3,51~3,46 (шир. 6H); 3,22~3,16 (м, 2H); 2,74~2,70 (м, 1H), 2,49 (шир. 4H), 1,99 + (м, 2H), 1,75 (м, 2H), 1,04 (д, 6H); РХМС Rt=1,40 хвил., m/z 364,2 (M+H) ]. Приклад 1.5: 1-(1-метил-6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл 4циклобутилпіперазин-1-карбоксилат a) 1-(1-метил-6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл карбоксилат 20 4-циклобутил-піперазин-1 UA 113876 C2 5 10 15 20 25 30 До розчину 1-(1-метил-6-оксо-1,6-дигідропіридазин-3-іл)піперидин-4-іл 4нітрофенілкарбонату (101 мг, 0,27 ммоль) у 8 мл DCM, додають DIEA (105 мг, 0,81 ммоль) та 1циклобутилпіперазин (56 мг, 0,40 ммоль). Суміш перемішують при кімнатній температурі впродовж ночі перед тим, як її розводять 30 мл води, екстрагують DCM (325 мл). Об'єднану органічну фазу сушать над безводним Na2SO4, фільтрують та концентрують при зниженому тиску. Залишок очищують, використовуючи флеш-хроматографію (Biotage, колонка з оберненою фазою C-18, MeOH/H2O=5 %-95 %, 0,5 % NH4OH), отримуючи 20 мг потрібної сполуки у вигляді твердої речовини білого кольору. 1 [ H ЯМР (CDCl3, 400 МГц): δ 7,12 (д, J=10, 1H), 6,85 (д, J=10, 1H), 4,94-4,88 (м, 1H), 3,67 (с, 3H), 3,52-3,46 (м, 6H), 3,23-3,17 (м, 2H), 2,75-2,69 (м, 1H), 2,30 (шир. 4H), 2,08-1,97 (м, 4H), 1,93+ 1,86 (м, 2H), 1,82-1,68 (м, 4H); РХМС Rt=1,44 хвил., m/z 376,3(M+H) ]. Приклад 2: Синтез 1-(1-метил-6-оксо-1,6-дигідропіримідин-4-іл)піперидин-4-іл 4ізопропілпіперазин-1-карбоксилату (Спосіб B) a) трет-бутил 4-гідроксипіперидин-1-карбоксилат До розчину трет-бутил 4-оксопіперидин-1-карбоксилату (10 г, 50 ммоль) у CH3OH (100 мл) порціями обережно додають NaBHU (5,7 г, 150 ммоль) та суміш перемішують при кімнатній температурі впродовж 3 годин. Реакцію гасять, обережно виливаючи у суміш льоду та води (100 мл) та органічний розчинник видаляють при зниженому тиску. Водну фазу нейтралізують до pH=7, використовуючи 1н. HCl, та екстрагують DCM/MeOH (560 мл, об/об=10/1). Об'єднані органічні шари промивають сольовим розчином (30 мл), сушать над безводним Na 2SO4, фільтрують та концентрують при зниженому тиску, отримуючи сирий продукт (9,8 г, 97 %) у + вигляді твердої речовини білого кольору. [РХМС: Rt=1,36 хвил., m/z 146,1 (M-Bu+H) ]. a) 1-(трет-бутоксикарбоніл)піперидин-4-іл-ізопропілпіперазин-1-карбоксилат До розчину трет-бутил 4-гідроксипіперидин-1-карбоксилату (4,4 г, 21,9 ммоль) у DCM (100 мл) обережно порціями додають DMAP (5,3 г, 43,8 ммоль) та трифосген (3,2 г, 10,95 ммоль). Після перемішування при кімнатній температурі впродовж 2 годин додають 1-ізопропілпіперазин (3,3 г, 26 ммоль) та реакційну суміш перемішують при кімнатній температурі впродовж 5 годин. Реакцію гасять насиченим розчином NH4Cl (100 мл) та суміш екстрагують DCM (3100 мл). Об'єднані органічні шари промивають послідовно насиченим розчином NH 4Cl (2100 мл) та сольовим розчином (50 мл), сушать над безводним Na2SO4, фільтрують та концентрують при 21 UA 113876 C2 зниженому тиску, отримуючи зазначену у заголовку сполуку у вигляді твердої речовини білого + кольору (7,7 г, 99 %). [РХМС: Rt=1,67 хвил., m/z 356,3 (M+H) ]. b) піперидин-4-іл 4-ізопропілпіперазин-1-карбоксилат 5 10 15 20 25 30 35 До розчину 1-(трет-бутоксикарбоніл)піперидин-4-іл 4-ізопропілпіперазин-1-карбоксилату (7,7 г, 21,7 ммоль) у DCM (30 мл) додають TFA (10 мл) та реакційну суміш перемішують при кімнатній температурі впродовж 5 годин. Розчинник видаляють при зниженому тиску, та залишок знову розчиняють у DCM/MeOH (100 мл, об/об = 10/1). Потім додають порошок Na 2CO3 та суміш перемішують при кімнатній температурі впродовж 2 годин. Надлишок Na 2CO3 видаляють шляхом фільтрування, та фільтрувальний корж промивають DCM (2100 мл). Об'єднані фільтрати концентрують при зниженому тиску, отримуючи потрібну сполуку у вигляді + масла жовтого кольору (5,5 г, 100 %). [РХМС: Rt=1,12 хвил., m/z 256,2 (M+H) ]. c) 1-(2-оксо-1,2-дигідропіридин-4-іл)піперидин-4-іл 4-ізопропілпіперазин-1-карбоксилат До розчину 4-бромпіридин-2(1H)-ону (173 мг, 1,0 ммоль) у TEA (10 мл) додають піперидин-4іл 4-ізопропілпіперазин-1-карбоксилат (255 мг, 1,0 ммоль) та отриману суміш перемішують при 100C впродовж 16 годин. Після охолодження до кімнатної температури отриману суміш концентрують у вакуумі. Залишок розчиняють у DCM (50 мл) та отриману суміш промивають насиченим розчином NaHCO3 (230 мл). Органічний шар сушать та концентрують, отримуючи сирий продукт (348 мг, 100 %), який використовують безпосередньо на наступній стадії без подальшого очищення. + [РХМС: Rt=1,27 хвил., m/z 349,2 (M+H) ]. d) 1-(1-метил-6-оксо-1,6-дигідропіримідин-4-іл)піперидин-4-іл 4-ізопропіл-піперазин-1карбоксилат До розчину 1-{2-оксо-1,2-дигідропіридин-4-іл)піперидин-4-іл 4-ізопропілпіперазин-1карбоксилату (348 мг, 1,0 ммоль) у ТГФ (10 мл) порціями додають NaH (60 % у мінеральному маслі) (200 мг, 5,0 ммоль). Після перемішування при кімнатній температурі впродовж 1 години додають CH3I (213 мг, 1,5 ммоль), та реакційну суміш перемішують при кімнатній температурі впродовж 5 годин. Реакцію гасять водою (30 мл), екстрагують DCM (330 мл), сушать та концентрують, отримуючи сирий продукт, який далі очищують, використовуючи препаративну ВЕРХ, отримуючи зазначену у заголовку сполуку у вигляді твердої речовини білого кольору (110 мг, 30 %). 1 [ H ЯМР (500 МГц, CDCl3) δ 7,07 (д, J=8,0 Гц, 1H), 5,90 (дд, J=8,0, 2,5 Гц, 1H), 5,77 (д, J=2,5 Гц, 1H), 4,89~4,94 (м, 1H), 3,47~3,52 (м, 6H), 3,44 (с, 3H), 3,20~3,25 (м, 2H), 2,68~2,73 (м, 1H), 2,47 (шир. 4H), 1,92~1,98 (м, 2H), 1,69~1,76 (м, 2H), 1,04 (д, J=6,5 Гц, 6H); РХМС: Rt=1,31 хвил., + m/z 363,3 (M+H) ]. 22 UA 113876 C2 Приклад 3: 1-(6-оксо-1,6-дигідропіридин-3-іл)піперидин-4-іл карбоксилат (Спосіб C) 4-ізопропіл-піперазин-1 a) 2-(бензилокси)-5-бромпіридин 5 10 15 20 До розчину 5-бромпіридин-2(1H)-ону (1,28 г, 7,36 ммоль) та Ag2CO3 (3 г, 11,04 ммоль) у толуолі (50 мл) по краплям додають (бромметил)бензол (1,25 г, 7,36 ммоль), та реакційну суміш перемішують при 100C впродовж ночі. Реакційну суміш фільтрують через невеликий шар силікагелю та промивають DCM. Отриманий фільтрат концентрують, отримуючи зазначену у заголовку сполуку у вигляді масла світло-жовтого кольору (1,8 г, 95 %). b) 1-(6-(бензилокси)-піридин-3-іл)піперидин-4-іл 4-ізопропілпіперазин-1-карбоксилат До розчину 2-(бензилокси)-5-бромпіридину (1,5 г, 5,6 ммоль), піперидин-4-іл 4ізопропілпіперазин-1-карбоксилату (2,15 г, 8,4 ммоль) у толуолі (30 мл) додають Pd 2(dba)3 (1,57 г, 2,2 ммоль), BINAP (2,79 г, 4,4 ммоль) та t-BuOK (3,78 г, 33,8 ммоль). Реакційну суміш перемішують при мікрохвильовому опроміненні при 120C впродовж 20 хвил. Суміш розводять EA (100 мл) та промивають водою (350 мл). Органічну фазу виділяють, сушать та концентрують досуха. Залишок поміщають у розведену HCl (pH=1, 100 мл) та отриману суміш екстрагують DCM (3100 мл) для видалення домішок. Водну фазу підлужують (pH=9-10) твердим Na2CO3 та екстрагують DCM (3100 мл). Об'єднані органічні шари сушать, концентрують та очищують, використовуючи хроматографічну обробку на силікагелі (EA/MeOH=50/1), отримуючи зазначену у заголовку сполуку у вигляді твердої речовини білого + кольору (500 мг, 20 %). [РХМС: Rt=2,09 хвил., m/z 439,3 (M+H) ]. с) 1-(6-оксо-1,6-дигідропіридин-3-іл)піперидин-4-іл 4-ізопропілпіперазин-1-карбоксилат 23 UA 113876 C2 5 10 До суспензії 1-(6-(бензилокси)-піридин-3-іл)-піперидин-4-іл 4-ізопропілпіперазин-1карбоксилату (200 мг, 0,46 ммоль) у MeOH (10 мл) додають 10 % Pd/C (200 мг) та отриману суміш гідрують (балон з воднем) при кімнатній температурі впродовж 10 хвил. Каталізатор видаляють шляхом фільтрування через целіт®, та отриманий фільтрат концентрують у вакуумі. Потрібний продукт отримують у вигляді твердої речовини білого кольору після очищення за допомогою препаративної ВЕРХ (40 мг, 25 %). 1 [ H ЯМР (400 МГц, MeOD-d4) δ 7,50 (дд, J=10 Гц, J2=3,2 Гц, 1H), 6,81 (д, J=3,2 Гц, 1H), 6,41 (д, J=10 Гц, 1H), 4,68 (м, 1H), 3,45 (шир. 4H), 3,00 (м, 2H), 2,75 (м, 3H), 2,59 (м, 4H), 1,90 (м, 2H), + 1,70 (м, 2H), 1,02 (д, J=6,4 Гц, 6H); РХМС: Rt=1,37 хвил., m/z 349,2 (M+H) ]. У таблиці 1 приведені сполуки формули (I). Сполуки прикладів 1.1-1.6 синтезують у відповідності зі способом A; Сполуки прикладів 2.1-2.3 синтезують у відповідності зі способом B; Сполуку прикладу 3.1 синтезують у відповідності зі способом C. Таблиця 1 Назва РХМС спосіб Rt [хвил.] [M+H] 1.1 1-(6-оксо-1,6-дигідропіридазин3-іл)піперидин-4-іл 4циклобутилпіперазин-1карбоксилат 1,65(A) 362,2 1.2 1-(1-метил-6-оксо-1,6дигідропіридазин-3іл)піперидин-4-іл 4ізопропілпіперазин-1карбоксилат 1,4(A) 364,2 1.3 1-(6-оксо-1,6-дигідропіридазин3-іл)піперидин-4-іл 4ізопропілпіперазин-1карбоксилат 1,33(A) 350,2 1.4 1-(6-оксо-1,6-дигідропіридазин3-іл)піперидин-4-іл 4циклобутилпіперазин-1карбоксилат 1,05(A) 348,2 1.5 1-(1-метил-6-оксо-1,6дигідропіридазин-3іл)піперидин-4-іл 4циклобутилпіперазин-1карбоксилат 1,44(A) 376,3 1.6 1-(1-етил-6-оксо-1,6дигідропіридазин-3іл)піперидин-4-іл 4ізопропілпіперазин-1карбоксилат 0,87(A) 378,2 Пр. Структура 15 24 + UA 113876 C2 Продовження таблиці 1 2.1 20 25 30 35 1-(2-оксо-1,2-дигідропіридин-4іл)піперидин-4-іл 4ізопропілпіперазин-1карбоксилат 1,31(B) 361,2 1-(2-оксо-1,2-дигідропіридин-4іл)піперидин-4-іл 4ізопропілпіперазин-1карбоксилат 1,26(B) 349,2 3.1 15 363,3 2.3 10 1,31(B) 2.2 5 1-(1-метил-2-оксо-1,2дигідропіридин-4-іл)піперидин4-іл 4-ізопропілпіперазин-1карбоксилат 1-(6-оксо-1,6-дигідропіридин-3іл)піперидин-4-іл 4ізопропілпіперазин-1карбоксилат 1,37(C) 349,2 Біологічне тестування 1.1 In-vitro тестування A) Оцінка ефективності Ефективність сполук даного винаходу як антагоністів H3 рецепторів можна оцінити, вимірюючи блокаду (R)-альфа-метилгістамін-опосередковане cAMP продукування, використовуючи набір LANCE Ultra cAMP (PE #TRF0263) у CHO клітинах, що експресують людські H3 рецептори (GenBank: BC096840; Strausberg RL et al, Proc. Natl. Acad. Sci. U.S.A. 99(26), 16899-16903; 2002). Протокол: 1. Одержання стимулюючого буферу (30 мл): 29,4 мл HBSS (GIBCO #14025), 150 мкл 1 M HEPES (GIBCO #15630), 30 мкл 500 мМ IBMX (CALBIOCHEM #410957) та 400 мкл 7,5 % BSA (GIBCO #10438-026). 2. Одержання аналітичного планшету: Різні концентрації сполук даного винаходу (0,01-1000 нМ), H3 позитивні контролі та cAMP калібрувальні стандарти; 3 мМ Forskolin (CALBIOCHEM #344270); 5 мкМ (R)-альфа-метилгістамін (агоніст H3 рецептору); 1 % ДМСО (SIGMA #D2650); повний об'єм: 95 нл. 3. Одержання клітинного розчину: З'єднують клітини із стимулюючим буфером, кінцева щільність: 100000 клітин/мл. 4. Реакція: (a) перенос 10 мкл клітинного розчину на аналітичний планшет, (b) центрифугування при 600 об/хвил. впродовж 3 хвилин, та інкубування впродовж 50 хвилин при кімнатній температурі, (c) додавання до аналітичного планшету 5 мкл 4X Eu-cAMP індикаторного розчину (60 мкл Eu-cAMP вихідний індикаторний розчин +2,94 мл cAMP детектуючого буферу) та 5 мкл розчину 4X ULight™-анти-cAMP (20 мкл Eu-cAMP вихідного індикаторного розчину +2,98 мл cAMP детектуючого буферу). 5. Зчитування даних з планшету за допомогою En Vision: енергія спалаху: 100 %; збуджуючий фільтр: 111 UV2 320; емісійний фільтр: 203 (Eu 615) та 205 (APC 665); число лазерних спалахів: 20; вікно 100 псек; модуль лазерного дзеркала: 445 або 446; лазерний цикл: 16600 мксек. 6. Аналіз результатів за допомогою системи GraphPad Prism: залежність реакції від log (концентрації сполуки); змінюваний нахил. B) Оцінка спорідненості Спорідненість сполук даного винаходу до H3 рецептору можна оцінити, вимірюючи зміну зв'язування радіоліганду [3H]-N-α-метилгістамін (PerkinElmer, # NET1027250UC) з мембранами, який містить людські H3 рецептори (PerkinElmer, # ES-392-M400UA; GenBank: NM_007232.2; Hill SJ et al, International Union of Pharmacology XIII. Classification of histamine receptors, Pharmacol Rev, 49(3), 253-278, 1997). Протокол: 25 UA 113876 C2 5 10 15 20 25 30 1. Одержання зв'язуючого аналітичного буферу (500 мл): 25 мл 1 M Tris-HCl pH 7,5 (Invitrogen, # 15567-027), 2,5 мл 1 M MgCl2 (Sigma, # M1028-100МЛ), 472,5 мл ddH2O. 2. Серійні розведення сполук: розведення здійснюють, використовуючи BioTek Precision на планшеті для розведення сполук. Концентрації сполук починають з 5 або 10 мкМ, 10 точкова титрація доз при 3- або 5-разових серійних розведеннях. 3. Одержання 2× мембранного розчину (25 мл): 1,25 мл вихідного розчину людських гістамінових H3 рецепторів, 23,75 мл аналітичного буферу. 4. Одержання 2× розчину [3H]-N-α-метилгістаміну (25 мл): вихідний розчин 4,27 мкл [3Η]-Ν-αметилгістаміну, 25 мл аналітичного буферу. 5. Зборка реакції зв'язування: (a) перенос 1 мкл розчину сполуки, 1 мкл 100 % ДМСО та 1 мкл 1 M (R)(-)-α-метилгістаміну (Sigma, # H128) на реакційний планшет при кімнатній температурі, (b) перенос 50 мкл 2× білкового розчину на реакційний планшет, (c) перенос 49 мкл 2× розчину радіоліганду на реакційний планшет (Corning® 96 лунковий EIA/RIA планшет; Sigma, # CLS3797) 6. Покривають реакційний планшет плівкою TopSeal™-A (Perkin Elmer, #6005185) та інкубують при 28C впродовж 120 хвилин. Урівноважують знесолюючі планшети Zeba Spin (Thermo Scientific, # 89808) при кімнатній температурі впродовж 120 хвилин. 7. Видаляють герметизуючий матеріал знизу фільтрувального планшету. Поміщають планшет на промивний планшет. Центрифугують при 1000 g впродовж 2 хвилин для видалення буферу зберігання при кімнатній температурі. 8. Переносять 70 мкл реакційної суміші з реакційного планшету у фільтрувальні планшети. Розташовують фільтрувальні планшети поверх складальних планшетів. Центрифугують складальні планшети при 1000 g впродовж 2 хвилин для збору білку із зв'язаним радіолігандом. Додають 200 мкл Microscint-40 (PerkinElmer, # 6013641-1L) у кожну лунку складального планшету. Накривають планшети плівкою TopSeal™-A. 9. Зчитують з планшетів результати, використовуючи Wallac Microbeta Trilux 2450, параметри налаштування приладу: режим імпульсів: CPM, час імпульсів: 2 хвилини. 10. Аналіз результатів: Система GraphPad Prism: реакція в залежності від log(концентрації сполуки); перемінний нахил. Ki розраховують на основі рівняння Чанга та Прусоффа: Ki = ІЧ50/{1+([радіоліганд]/Kd)} У таблиці 2 представлені значення Ki для описаних вище оцінок ефективності/спорідненості сполук даного винаходу у відношенні людських H3 рецепторів. Таблиця 2 Приклад 1.1 1.2 1.3 1.4 1.5 35 40 45 50 Ефективність Ki(нМ) 1,3 2,4 1,2 2,3 1,1 Спорідненість Ki(нМ) 26 31 10 25 25 Приклад 1.6 2.1 2.2 2.3 3.1 Ефективність Ki(нМ) 2,9 3,1 0,5 0,9 1,6 Спорідненість Ki(нМ) 44 20 25 12 1,2 1.2 Тестування in-vivo A) Вплив на рівні теле-метилгістаміну мозку Сполуки даного винаходу розчиняють у 20 % 2-гідроксил-бета-циклодекстрані (HBC), та коротко обробляють ультразвуком, поки у отримуваному розчині зовсім не залишиться суспензії (або її залишається мало). Тваринам (самцям щурів штаму Sprague-Dawley у віці 8 тижнів) вводять перорально дози тестуємих сполук за 1 год. або інші більш тривалі проміжки часу перед тим, як їх умертвляють, використовуючи CO2. Відбір зразків крові: Здійснюють серцеву пункцію для відбору зразків крові з серцевої порожнини. Зібрану кров повільно змішують з EDTA-K2 20 мкл/мл, щоб уникнути згортання крові. Потім зразки крові у пробірках центрифугують (15 хвил., 6000 об/хвил.), та плазму переносять у нові пробірки та потім тимчасово зберігають у сухому льоді до зберігання у морозильній камері при -70C. Збір CSF: CSF зразки відбирають з великого потиличного отвору тварин (використовуючи #0,5 голку для внутрішньовенного введення), та отримані CSF зразки зберігають у сухому льоді. Відбір тканин мозку: Мозок щурів вилучають з черепа та промивають спочатку охолодженим льодом сольовим розчином. Лобну долю виділяють з решти частини мозку на лід, що міститься 26 UA 113876 C2 5 10 15 20 25 у чашці петрі. Визначають вологу масу лобної частини, відразу реєструють. Зразок лобної частини потім зберігають у сухому льоді до переносу у морозильник при -70C. Біоаналітичні методи дослідження теле-метилгістаміну та сполук: Прилад: Agilent 6410, мас-спектрометр з трьома квадрупольними лінзами Матрикс: щуряча плазма, гомогенат лобної частини та цереброспінальна рідина (CSF) Аналіт: H3 сполуки. Внутрішній стандарт: дексаметазон Умови ВЕРХ: Рухома фаза A: H2O-0,1 % ΝΗ3·Η2Ο: Рухома фаза B: MeOH-0,1 % ΝΗ3·Η2Ο Колонка: Ultimate XB-C 18 (2,150 мм, 5 мкм) Швидкість потоку: 0,45 мл/хвил., температура: 40C Умови МС: ESI (іонізація електророзпиленням): позитивні іони MRM (магнітна резонансна мікроскопія) детектування Дексаметазон: [M+H]+m/z 393,3→373,2; CE:4; Фрагментор:110 Одержання зразку: Лобна частина: зразок мозку гомогенізують впродовж 2 хвилин з 3 об'ємами (об/мас.) гомогенізаційного розчину (EtOH:PBS=85:15), та потім центрифугують при 12000 об/хвил. впродовж 5 хвилин. До 30 мкл надосадової рідини зразку гомогенату мозку додають 30 мкл внутрішнього стандарту (дексаметазон, 300 нг/мл) та потім 150 мкл ACN для осадження білку. Суміш обертають впродовж 2 хвилин та центрифугують при 12000 об/хвил. впродовж 5 хвилин. 5 мкл надосадової рідини вводять у РХ-МС/МС для аналізу. Плазма та CSF: У аліквоту у 30 мкл зразку додають 30 мкл внутрішнього стандарту (300 нг/мл дексаметазону) та потім 150 мкл ACN для осадження білку. Суміш обертають впродовж 2 хвилин та потім центрифугують при 12000 об/хвил. впродовж 5 хвилин. 5 мкл надосадової рідини вводять у РХ-МС/МС для аналізу. У таблиці 3 представлені результати вимірювань рівнів теле-метилгістаміну у мозку. Таблиця 3 Приклад 1.1 1.2 1.3 % зміни рівнів теле-метилгістаміну у мозку при 10 мг/кг впродовж 1 години 72 138 115 30 35 40 45 50 B) Ефекти у відношенні неспання Тварини: Самців щурів штаму Sprague-Dawly (280-320 г) використовують індивідуально при температурі довкілля 220,5C, відносній вологості 602 % та з автоматичним контролем циклу 12 годин світла та 12 годин темноти (світло включають у 07:00, інтенсивність освітлення = 100 люкс). Тварини мають вільний доступ до їжі та води. EEG режим запису, Polygraphic Recordings та Vigilance State аналіз: При анестезії фенобарбіталом (50 мг/кг, внутрішньочеревинно), щурам імплантують EEG та реєструють електроміограму (EMG) електродів для полісомнографічних записів (Huang et al, J. Neurosci, 23, 5975-5983, 2003). Два гвинта з нержавіючої сталі (1 мм діаметром) EEG електродів (перший гвинт: передньо-задній (AP), +2 мм; ліво-право (LR), -2 мм; та другий: AP, -2 мм; LR, -2 мм, AP від брегми, LR від лямбди) та порівняльний електрод (на протилежному боці від EEG гвинта, AP, +3 мм; LR, 3 мм) імплантують хірургічно та 3 гвинта з нержавіючої сталі для фіксації черепу. Два дроти з нержавіючої сталі з ізоляцією тефлоном білатерально поміщають у обидва трапецеїдальні м'язи, які слугують EMG електродами для щурів. Усі електроди приєднані до мікрорознімачів та зафіксовані на черепі зуболікувальним цементом. Реєстрацію EEG та EMG здійснюють за допомогою ковзкого кільця, сконструйованого таким чином, щоб поведінковий рух щурів не було обмежено. Після 8-денного періоду відновлення, щурів поміщають індивідуально у прозорих циліндрах та привчають до реєстраційних кабелів впродовж 3-4 днів до поліграфічних реєстрацій. Для вивчення циклів сон-неспання, кожну тварину реєструють впродовж 24 годин, починаючи з 19:00, періоду виключення світла. Потім тварин переміщають у фармакологічну фазу досліджень, у якій параметри сон-неспання реєструють впродовж 72 годин. Дані, отримані впродовж перших 24 годин, також слугують базовою лінією даних порівняння для другого дня експериментів. 27 UA 113876 C2 5 10 15 20 Кортикальні EEG та EMG сигнали посилюють, фільтрують (EEG, 0,5-30 Гц; EМG, 20-200 Гц), оцифровують при швидкості відбору 128 Гц, та записують, використовуючи SLEEPSIGN (Kissei Comtec, Nagano, Japan). Після завершення експерименту записи поліграфу автоматично оцінюють у режимі offline за 4-секундними інтервалам як неспання, REM, та NREM сон, використовуючи SLEEPSIGN, у відповідності зі стандартними критеріями (Huang et al, Nat Neurosci, 8, 858-859, 2005). Як фінальну стадію, певні стадії сон-неспання досліджують візуально та за необхідності вносять поправки. EEG криву питомої густини будують для кожної стадії впродовж 4 годин після введення лікарського засобу. Інтенсивність кожної позиції 0,25 Гц усереднюють для стадій сну або неспання та нормалізують для групи, розраховуючи відсоток кожної позиції з повної інтенсивності (0,25-25 Гц). Фармакологічні обробки: Тестуємі сполуки, кофеїн (позитивна порівняльна сполука) або сполуки даного винаходу готують як 20 % розчин 2-гідроксил-бета-циклодекстрану (HBC). У день обробки носієм, всім тваринам вводять носій у 9:00 ранку. У день обробки лікарським засобом тестуєму сполуку, кофеїн або носій вводять у 9:00 ранку. Після введення безперервні записи ведуть впродовж 3 днів. Об'єми вводять перорально або внутрішньочеревинно у дозі 2 мл/кг. Окремі групи щурів використовують для кожної дози (n=8 щурів у групі). Зміни з часом у кількостях сон-неспання, кількостях перехідних стадій сон-неспання, також як кількість та тривалість періодів сон/неспання у фазах світло/темнота аналізують, використовуючи парний t-критерій, де кожна тварина слугує власним контролем. Таблиця 4 являє собою результати вимірювань відсотку збільшення неспання у щурів. Результати представлені для перших 4 годин після перорального введення сполук. Таблиця 4 Приклад 1.1 1.2 1.3 % збільшення неспання при дозі 10 мг 42,1 48,8 19,1 * p
ДивитисяДодаткова інформація
Назва патенту англійськоюCarbamate-urea derivatives
Автори англійськоюAuberson, Yves, Bock, Mark Gary, Braga, Dario, Curzi, Marco, Dodd, Stephanie Kay, Giaffreda, Stefano Luca, Jiang, Haiyang, Karpinski, Piotr, Troxler, Thomas J., Wang, Tielin, Wang, Xiaoyang, Zhang, Xuechun
Автори російськоюОберсон Ив, Бок Марк Гэри, Брага Дарио, Курци Марко, Додд Стэфани Кэй, Джаффреда Стэфано Лука, Цзян Хайян, Карпински Пиотр, Трокслер Томас Дж., Ван Телинь, Ван сяоян, Чжан Сюечунь
МПК / Мітки
МПК: C07D 401/04, C07D 401/14, A61K 31/4545
Мітки: похідні
Код посилання
<a href="https://ua.patents.su/53-113876-pokhidni-karbamat-sechovini.html" target="_blank" rel="follow" title="База патентів України">Похідні карбамат/сечовини</a>
Попередній патент: Спосіб лікування стероїдзалежних дерматозів
Наступний патент: Установка локального біологічного очищення стічних вод
Випадковий патент: Спосіб очищення газів