Бензофуранові і бензотіофенові похідні для лікування гіперпроліферативних захворювань
Номер патенту: 79772
Опубліковано: 25.07.2007
Автори: Лі Уенді, Ладусер Гаетан, Чен Жі, Дюма Жак, Джоунс Бенджамін Д., Фан Джанмей, Жанг Ченгжі, Бурке Майкл, Хатум-Мокдад Холіа, Фан Донгпінг, Філліпс Бартон
Формула / Реферат
1. Сполука формули І
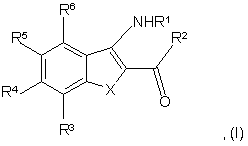
де Х вибраний із групи, що включає О і S;
R1 вибраний із групи, що включає Н, (С1-С6)алкіл, С(O)(С1-С6)алкіл і бензоїл;
R2 вибраний із групи, що включає феніл і нафтил, кожен з яких необов'язково містить 1, 2 або 3 замісники, кожен з яких незалежно вибраний із групи, що включає ОН, CN, NO2, (С1-С6)алкіл, (С1-С6)алкоксил, галоген, галоген(С1-С6)алкіл, галоген(С1-С6)алкоксил, C(O)RA, C(O)NRBRB, NRBRB, NH[(С1-С6)aлкiл]0-1S(O)2RB, NH(С1-С6)aлкiл]0-1C(O)RA та NH(С1-С6)aлкiл]0-1C(O)ORB, гетероцикл, вибраний із групи, що включає шестичленний гетероцикл, п'ятичленний гетероцикл і конденсований біциклічний гетероцикл, причому кожен гетероцикл необов'язково містить 1, 2 або 3 замісники, кожен з яких незалежно вибраний із групи, що включає ОН, CN, NO2, (С1-С6)алкіл, (С1-С6)алкоксил, галоген, галоген(С1-С6)алкіл, галоген(С1-С6)алкоксил, C(O)RA, C(O)NRBRB, NRBRB, NH[(С1-С6)aлкiл]0-1S(O)2RB, NH[(С1-С6)aлкiл]0-1C(O)RA і NH[(С1-С6)aлкiл]0-1C(O)ORB,
RA у кожному випадку незалежно вибраний із групи, що включає Н, (С1-С6)алкіл, (С1-С6)алкоксил, NRBRB або (С1-С6)алкіл, і зазначений алкіл необов'язково містить як замісники ОН, C(O)RB, галоген, (С1-С3)алкоксил та NRBRB;
RB у кожному випадку незалежно вибраний із групи, що включає Н, (С3-С6)циклоалкіл і (С1-С6)алкіл, і зазначений алкіл необов'язково містить як замісники ОН, =O, галоген, (С1-С6)алкоксил, NН(С1-С3)алкіл, N[(С1-С3)алкіл]2, та NС(O)(С1-С3)алкіл,
і де RB, коли він приєднаний до атома N, у кожному випадку означає (С1-С4)алкіл, тоді 2 групи (С1-С4)алкіл разом з атомом N, до якого вони приєднані, можуть бути з'єднані одна з одною з утворенням насиченого циклу,
і де RB і RB разом з атомом N, до якого вони приєднані, можуть утворювати морфолінільний цикл або піперазинільний цикл, який у наявного атома N необов'язково містить як замісник (С1-С6)алкіл, і зазначений алкіл необов'язково містить як замісники ОН, =O, NH2, (С1-С6)алкоксил, NН(С1-С3)алкіл або N[(С1-С3)алкіл]2, і за умови, що, якщо RB приєднаний до S(O) або до S(O)2, він не може означати Н;
R3 вибраний із групи, що включає Н, ОН, CN, (С1-С3)алкіл, (С1-С3)алкоксил, галоген, галоген(С1-С3)алкіл і галоген(С1-С3)алкоксил;
R4 вибраний із групи, що включає піпероніл, Y, де Y означає гетероцикл, що необов'язково містить 1, 2 або 3 замісники, кожен з яких незалежно вибраний із групи, що включає =O, N-оксид, Н, CN, NO2, галоген, галоген(С1-С6)алкіл, ОН, галоген(С1-С6)алкоксил, C(O)ORB, C(NH)NRBRB, NRBRB, S(O)0-2RB, S(O)2NRBRB, (С1-С6)алкоксил, причому зазначений алкоксил необов'язково містить 1 або 2 замісники, вибрані з групи, що включає ОН, NRBRB і (С1-С3)алкоксил, NRCRC, де RC вибраний із групи, що включає RB, С(O)RB і S(O)2RB, С(O)RD, де RD вибраний із групи, що включає RA, (С3-С6)циклоалкіл, Z та N[(С1-С3)алкіл]Z, де Z у кожному випадку означають гетероцикл, що необов'язково містить замісники, незалежно вибрані з групи, що включає CN, =O, ОН, N-оксид, NO2, галоген, (С1-С6)алкоксил, галоген (С1-С3)алкоксил, галоген (С1-С3)алкіл, S(O)2RB, S(O)2NRBRB, NRBRB, C(O)RA і (С1-С6)алкіл, і зазначений алкіл необов'язково містить як замісники ОН, C(O)RB, (С1-С3)алкоксил та NRBRB; NRBRE, де RE вибраний із групи, що включає C(O)RA, C(O)RB, S(O)2RB, S(O)2NRBRB і С(O)[(С1-С6)алкіл]Z, де Z необов'язково містить замісники, описані вище, (С1-С6)алкіл, і зазначений алкіл необов'язково містить як замісники CN, ОН, =O, галоген, (С1-С6)алкоксил, C(O)RA, NRBRB, NRCRC, NRBRE, C(NH)NRBRB, S(O)0-2RB, S(O)2NRBRB, C(O)RB, C(O)ORB, Z, C(O)Z i C(O)N[(С1-С3)алкіл]Z, де Z у кожному випадку необов'язково містить незалежно вибрані замісники, описані вище, феніл і нафтил, кожен з яких необов'язково містить 1, 2 або 3 замісники, кожен з яких незалежно вибраний із групи, що включає ОН, CN, NO2, галоген, галоген(С1-С6)алкіл, галоген(С1-С6)алкоксил, C(O)ORB, C(NH)NRBRB, NRBRB, S(O)0-2RB, S(O)2NRBRB, Z, C(O)Z, де Z у кожному випадку необов'язково містить замісники, описані вище, (С1-С6)алкоксил, зазначений алкоксил необов'язково містить 1 або 2 замісники, вибрані з групи, що включає ОН, NRBRB і (С1-С3)алкоксил, NRCRC, де RC вибраний із групи, що включає RB, C(O)RB і S(O)2RB, C(O)RD, де RD вибраний із групи, що включає RA (С3-С6)циклоалкіл та N[(С1-С3)алкіл]Z, де Z необов'язково містить замісники, описані вище, NRBRE, де RE вибраний із групи, що включає C(O)RA, C(O)RB, S(O)2RB, S(O)2NRBRB і С(O)[(С1-С6)алкіл]Z, де Z необов'язково містить замісники, описані вище, (С1-С6)алкіл, зазначений алкіл необов'язково містить як замісники CN, ОН, =O, галоген, (С1-С6)алкоксил, C(O)RA, NRBRB, NRBRE, C(NH)NRBRB, S(O)0-2RB, S(O)2NRBRB, C(O)RB C(O)ORB, Z, C(O)Z і C(O)N[(С1-С3)алкіл]Z, де Z у кожному випадку необов'язково містить незалежно вибрані замісники, описані вище;
R5 і R6 незалежно вибрані з групи, що включає Н, ОН, CN, (С1-С3)алкіл, (С1-С3)алкоксил, галоген, галоген(С1-С3)алкіл і галоген(С1-С3)алкоксил; або її фармацевтично прийнятна сіль або складний ефір.
2. Сполука за п. 1, в якій Х означає О.
3. Сполука за п. 1, в якій Х означає S.
4. Сполука за п. 2, в якій R2 вибраний із групи, що включає феніл, шестичленний гетероцикл і 5-членний гетероцикл, кожен з яких необов'язково містить замісники.
5. Сполука за п. 2, в якій R4 вибраний із групи, що включає Y і феніл, кожен з яких необов'язково містить замісники.
6. Сполука за п. 2, в якій R2 вибраний із групи, що включає феніл, шестичленний гетероцикл і 5-членний гетероцикл, кожен з яких необов'язково містить замісники, і R4 вибраний із групи, що включає Y і феніл, кожен з яких необов'язково містить замісники.
7. Сполука за п. 5, в якій R4 вибраний із групи, що включає феніл і Y, де Y вибраний із групи, що включає 5-членне гетероциклічне кільце і піридин, кожен циклічний фрагмент необов'язково містить замісники.
8. Сполука за п. 6, в якій R2 і R4 необов'язково містять незалежно вибрані замісники, і R3, R5 і R6 незалежно вибрані з групи, що включає Н, ОН, Сl, F, СN, СН3, ОСН3, СF3 і ОСF3.
9. Сполука за п. 8, в якій R1 вибраний із групи, що включає Н і (С1-С6)алкіл.
10. Сполука за п. 3, в якій R2 вибраний із групи, що включає феніл, шестичленний гетероцикл і 5-членний гетероцикл, кожен з яких необов'язково містить замісники.
11. Сполука за п. 3, в якій R4 вибраний із групи, що включає Y і феніл, кожен з яких необов'язково містить замісники.
12. Сполука за п. 3, в якій R2 вибраний із групи, що включає феніл, шестичленний гетероцикл і 5-членний гетероцикл, кожен з яких необов'язково містить замісники, і R4 вибраний із групи, що включає Y і феніл, кожен з яких необов'язково містить замісники.
13. Сполука за п. 11, в якій R4 вибраний із групи, що включає феніл і Y, де Y вибраний із групи, що включає 5-членне гетероциклічне кільце і піридин, і кожен циклічний фрагмент необов'язково містить замісники.
14. Сполука за п. 12, в якій R2 і R4 необов'язково містять незалежно вибрані замісники, і R3, R5 і R6 незалежно вибрані з групи, що включає Н, ОН, Сl, F, CN, СН3, ОСН3, СF3 і ОСF3.
15. Сполука за п. 14, в якій R1 вибраний із групи, що включає Н і (С1-С6)алкіл.
16. Сполука, вибрана з групи, що включає
(3-аміно-6-фенілбензофуран-2-іл)-(2,4-дихлорфеніл)-метанон,
(3-аміно-6-піридин-3-ілбензофуран-2-іл)-(2,4-дихлорфеніл)-метанон,
[3-аміно-6-(3-нітрофеніл)-бензофуран-2-іл]-(2,4-дихлорфеніл)-метанон,
[3-аміно-6-(3-амінофеніл)-бензофуран-2-іл]-(2,4-дихлорфеніл)-метанон,
3-[3-аміно-2-(2,4-дихлорбензоїл)-бензофуран-6-іл]-бензонітрил,
N-{3-[3-аміно-2-(2,4-дихлорбензоїл)-бензофуран-6-іл]-феніл}-метансульфонамід,
N-{3-[3-аміно-2-(2,4-дихлорбензоїл)-бензофуран-6-іл]-феніл}-ацетамід,
[3-аміно-6-(2-метилпіридин-3-іл)-бензофуран-2-іл]-(2,4-дихлорфеніл)-метанон,
5-[3-аміно-2-(2,4-дихлорбензоїл)-бензофуран-6-іл]-нікотинамід,
3-[3-аміно-2-(2,4-дихлорбензоїл)-бензофуран-6-іл]-бензолсульфонамід,
(3-аміно-5-фтор-6-піридин-3-ілбензофуран-2-іл)-(2,4-дихлорфеніл)-метанон,
{3-аміно-6-[3-((S)-2,3-дигідроксипропіламіно)-феніл]-бензофуран-2-іл}-(2,4-дихлорфеніл)-метанон,
3-[3-аміно-2-(2,4-дихлорбензоїл)-бензофуран-6-іл]-N-метилбензамід,
[3-аміно-6-(1-метил-1Н-імідазол-4-іл)-бензофуран-2-іл]-(2,4-дихлорфеніл)-метанон,
3-[3-аміно-2-(2-хлор-4-фторбензоїл)-бензофуран-6-іл]-бензамід,
2-{3-[3-аміно-2-(2,4-дихлорбензоїл)-бензофуран-6-іл]-феніл}-ацетамід,
[3-аміно-6-(2-метилтіазол-4-іл)-бензофуран-2-іл]-(2,4-дихлорфеніл)-метанон,
N-{3-[3-аміно-2-(2,4-дихлорбензоїл)-бензофуран-6-іл]-бензил}-метансульфонамід,
N-{3-[3-аміно-2-(2,4-дихлорбензоїл)-бензофуран-6-іл]-бензил}-ацетамід,
[3-аміно-6-(2-метилоксазол-4-іл)-бензофуран-2-іл]-(2-метоксифеніл)-метанон,
[3-аміно-6-(3-фтор-5-нітрофеніл)-бензофуран-2-іл]-(2,4-дихлорфеніл)-метанон,
[3-аміно-6-(3-метансульфонілфеніл)-бензофуран-2-іл]-(2,4-дихлорфеніл)-метанон,
[3-аміно-6-(2-фторпіридин-3-іл)-бензофуран-2-іл]-(2,4-дихлорфеніл)-метанон
і
[3-аміно-6-(2-метиламінопіридин-3-іл)-бензофуран-2-іл]-(2,4-дихлорфеніл)-метанон.
17. Композиція, яка містить як активну речовину сполуку формули І.
18. Композиція за п. 17, у якій Х означає О.
19. Композиція за п. 17, у якій Х означає S.
20. Композиція за п. 18, де R2 вибраний із групи, що включає феніл, шестичленний гетероцикл і 5-членний гетероцикл, кожен з яких необов'язково містить замісники, і R4 вибраний із групи, що включає Y і феніл, кожен з яких необов'язково містить замісники.
21. Композиція за п. 19, де R2 вибраний із групи, що включає феніл, шестичленний гетероцикл і 5-членний гетероцикл, кожен з яких необов'язково містить замісники, і R4 вибраний із групи, що включає Y і феніл, кожен з яких необов'язково містить замісники.
22. Спосіб лікування або запобігання гіперпроліферативному захворюванню, що включає введення пацієнту, який потребує цього, ефективної кількості сполуки формули І.
23. Спосіб за п. 22, в якому Х означає О.
24. Спосіб за п. 22, в якому Х означає S.
25. Спосіб за п. 23, де R2 вибраний із групи, що включає феніл, шестичленний гетероцикл і 5-членний гетероцикл, кожен з яких необов'язково містить замісники, і R4 вибраний із групи, що включає Y і феніл, кожен з яких необов'язково містить замісники.
26. Спосіб за п. 24, де R2 вибраний із групи, що включає феніл, шестичленний гетероцикл і 5-членний гетероцикл, кожен з яких необов'язково містить замісники, і R4 вибраний із групи, що включає Y і феніл, кожен з яких необов'язково містить замісники.
Текст
1. Сполука формули І 2 (19) 1 3 79772 і де RB, коли він приєднаний до атома N, у кожному випадку означає (С1-С4)алкіл, тоді 2 групи (С1С4)алкіл разом з атомом N, до якого вони приєднані, можуть бути з'єднані одна з одною з утворенням насиченого циклу, і де RB і RB разом з атомом N, до якого вони приєднані, можуть утворювати морфолінільний цикл або піперазинільний цикл, який у наявного атома N необов'язково містить як замісник (С1-С6)алкіл, і зазначений алкіл необов'язково містить як замісники ОН, =O, NH 2, (С1-С6)алкоксил, NН(С1-С3)алкіл або N[(С1-С3)алкіл]2, і за умови, що, якщо RB приєднаний до S(O) або до S(O)2, він не може означати Н; R3 вибраний із групи, що включає Н, ОН, CN, (С1С3)алкіл, (С1-С3)алкоксил, галоген, галоген(С 1С3)алкіл і галоген(С 1-С3)алкоксил; R4 вибраний із групи, що включає піпероніл, Y, де Y означає гетероцикл, що необов'язково містить 1, 2 або 3 замісники, кожен з яких незалежно вибраний із групи, що включає =O, N-оксид, Н, CN, NO2, галоген, галоген(С1-С6)алкіл, ОН, галоген(С 1С6)алкоксил, C(O)ORB, C(NH)NRBRB, NRBRB, S(O)0B B B 2R , S(O)2NR R , (С 1-С 6)алкоксил, причому зазначений алкоксил необов'язково містить 1 або 2 замісники, вибрані з групи, що включає ОН, NRBRB і (С1-С3)алкоксил, NRCRC, де RC вибраний із групи, що включає RB, С(O)RB і S(O)2RB, С(O)RD, де RD вибраний із групи, що включає RA, (С3С6)циклоалкіл, Z та N[(С1-С3)алкіл]Z, де Z у кожному випадку означають гетероцикл, що необов'язково містить замісники, незалежно вибрані з групи, що включає CN, =O, ОН, N-оксид, NO2, галоген, (С1-С6)алкоксил, галоген (С1-С3)алкоксил, галоген (С1-С3)алкіл, S(O)2RB, S(O)2NRBRB, NRBRB, C(O)R A і (С1-С6)алкіл, і зазначений алкіл необов'язково містить як замісники ОН, C(O)RB, (С1-С3)алкоксил та NRBRB; NRBRE, де RE вибраний із групи, що включає C(O)RA, C(O)RB, S(O) 2RB, S(O) 2NRBRB і С(O)[(С1-С6)алкіл]Z, де Z необов'язково містить замісники, описані вище, (С1-С6)алкіл, і зазначений алкіл необов'язково містить як замісники CN, ОН, =O, галоген, (С1-С6)алкоксил, C(O)RA, NRBRB, NRCRC, NRBRE, C(NH)NRBRB, S(O)0-2RB, S(O)2NRBRB, C(O)RB, C(O)OR B , Z, C(O)Z i C(O)N[(С1-С3)алкіл]Z, де Z у кожному випадку необов'язково містить незалежно вибрані замісники, описані вище, феніл і нафтил, кожен з яких необов'язково містить 1, 2 або 3 замісники, кожен з яких незалежно вибраний із групи, що включає ОН, CN, NO2, галоген, галоген(С1-С6)алкіл, галоген(С 1С6)алкоксил, C(O)ORB, C(NH)NRBRB, NRBRB, S(O)0B B B 2R , S(O)2NR R , Z, C(O)Z, де Z у кожному випадку необов'язково містить замісники, описані вище, (С1-С6)алкоксил, зазначений алкоксил необов'язково містить 1 або 2 замісники, вибрані з групи, що включає ОН, NRBRB і (С1-С3)алкоксил, NRCRC, де RC вибраний із групи, що включає RB, C(O)RB і S(O)2RB, C(O)RD, де RD вибраний із групи, що включає RA (С3-С6)циклоалкіл та N[(С1-С3)алкіл]Z, де Z необов'язково містить замісники, описані вище, NRBRE, де RE вибраний із групи, що включає C(O)RA, C(O)RB, S(O)2RB, S(O)2NRBRB і С(O)[(С1С6)алкіл]Z, де Z необов'язково містить замісники, описані вище, (С1-С6)алкіл, зазначений алкіл не 4 обов'язково містить як замісники CN, ОН, =O, галоген, (С1-С6)алкоксил, C(O)RA, NRBRB, NRBRE, C(NH)NRBRB, S(O)0-2RB , S(O) 2NRBRB, C(O)RB C(O)OR B, Z, C(O)Z і C(O)N[(С1-С3)алкіл]Z, де Z у кожному випадку необов'язково містить незалежно вибрані замісники, описані вище; R5 і R6 незалежно вибрані з групи, що включає Н, ОН, CN, (С1-С3)алкіл, (С1-С3)алкоксил, галоген, галоген(С1-С3)алкіл і галоген(С 1-С3)алкоксил; або її фармацевтично прийнятна сіль або складний ефір. 2. Сполука за п. 1, в якій Х означає О. 3. Сполука за п. 1, в якій Х означає S. 4. Сполука за п. 2, в якій R2 вибраний із групи, що включає феніл, шестичленний гетероцикл і 5членний гетероцикл, кожен з яких необов'язково містить замісники. 5. Сполука за п. 2, в якій R4 вибраний із групи, що включає Y і феніл, кожен з яких необов'язково містить замісники. 6. Сполука за п. 2, в якій R2 вибраний із групи, що включає феніл, шестичленний гетероцикл і 5членний гетероцикл, кожен з яких необов'язково містить замісники, і R4 вибраний із групи, що включає Y і феніл, кожен з яких необов'язково містить замісники. 7. Сполука за п. 5, в якій R4 вибраний із групи, що включає феніл і Y, де Y вибраний із групи, що включає 5-членне гетероциклічне кільце і піридин, кожен циклічний фрагмент необов'язково містить замісники. 8. Сполука за п. 6, в якій R2 і R4 необов'язково містять незалежно вибрані замісники, і R3, R5 і R6 незалежно вибрані з групи, що включає Н, ОН, Сl, F, СN, СН3, ОСН3, СF 3 і ОСF 3. 9. Сполука за п. 8, в якій R1 вибраний із групи, що включає Н і (С1-С6)алкіл. 10. Сполука за п. 3, в якій R 2 вибраний із групи, що включає феніл, шестичленний гетероцикл і 5членний гетероцикл, кожен з яких необов'язково містить замісники. 11. Сполука за п. 3, в якій R 4 вибраний із групи, що включає Y і феніл, кожен з яких необов'язково містить замісники. 12. Сполука за п. 3, в якій R 2 вибраний із групи, що включає феніл, шестичленний гетероцикл і 5членний гетероцикл, кожен з яких необов'язково містить замісники, і R4 вибраний із групи, що включає Y і феніл, кожен з яких необов'язково містить замісники. 13. Сполука за п. 11, в якій R4 вибраний із групи, що включає феніл і Y, де Y вибраний із групи, що включає 5-членне гетероциклічне кільце і піридин, і кожен циклічний фрагмент необов'язково містить замісники. 14. Сполука за п. 12, в якій R 2 і R4 необов'язково містять незалежно вибрані замісники, і R3, R5 і R6 незалежно вибрані з групи, що включає Н, ОН, Сl, F, CN, СН3, ОСН3, СF 3 і ОСF 3. 15. Сполука за п. 14, в якій R1 вибраний із групи, що включає Н і (С1-С6)алкіл. 16. Сполука, вибрана з групи, що включає (3-аміно-6-фенілбензофуран-2-іл)-(2,4дихлорфеніл)-метанон, 5 79772 6 (3-аміно-6-піридин-3-ілбензофуран-2-іл)-(2,4дихлорфеніл)-метанон, [3-аміно-6-(3-нітрофеніл)-бензофуран-2-іл]-(2,4дихлорфеніл)-метанон, [3-аміно-6-(3-амінофеніл)-бензофуран-2-іл]-(2,4дихлорфеніл)-метанон, 3-[3-аміно-2-(2,4-дихлорбензоїл)-бензофуран-6-іл]бензонітрил, N-{3-[3-аміно-2-(2,4-дихлорбензоїл)-бензофуран-6іл]-феніл}-метансульфонамід, N-{3-[3-аміно-2-(2,4-дихлорбензоїл)-бензофуран-6іл]-феніл}-ацетамід, [3-аміно-6-(2-метилпіридин-3-іл)-бензофуран-2-іл](2,4-дихлорфеніл)-метанон, 5-[3-аміно-2-(2,4-дихлорбензоїл)-бензофуран-6-іл]нікотинамід, 3-[3-аміно-2-(2,4-дихлорбензоїл)-бензофуран-6-іл]бензолсульфонамід, (3-аміно-5-фтор-6-піридин-3-ілбензофуран-2-іл)(2,4-дихлорфеніл)-метанон, {3-аміно-6-[3-((S)-2,3-дигідроксипропіламіно)феніл]-бензофуран-2-іл}-(2,4-дихлорфеніл)метанон, 3-[3-аміно-2-(2,4-дихлорбензоїл)-бензофуран-6-іл]N-метилбензамід, [3-аміно-6-(1-метил-1Н-імідазол-4-іл)-бензофуран2-іл]-(2,4-дихлорфеніл)-метанон, 3-[3-аміно-2-(2-хлор-4-фторбензоїл)-бензофуран6-іл]-бензамід, 2-{3-[3-аміно-2-(2,4-дихлорбензоїл)-бензофуран-6іл]-феніл}-ацетамід, [3-аміно-6-(2-метилтіазол-4-іл)-бензофуран-2-іл](2,4-дихлорфеніл)-метанон, N-{3-[3-аміно-2-(2,4-дихлорбензоїл)-бензофуран-6іл]-бензил}-метансульфонамід, N-{3-[3-аміно-2-(2,4-дихлорбензоїл)-бензофуран-6іл]-бензил}-ацетамід, [3-аміно-6-(2-метилоксазол-4-іл)-бензофуран-2-іл](2-метоксифеніл)-метанон, [3-аміно-6-(3-фтор-5-нітрофеніл)-бензофуран-2-іл](2,4-дихлорфеніл)-метанон, [3-аміно-6-(3-метансульфонілфеніл)-бензофуран2-іл]-(2,4-дихлорфеніл)-метанон, [3-аміно-6-(2-фторпіридин-3-іл)-бензофуран-2-іл](2,4-дихлорфеніл)-метанон і [3-аміно-6-(2-метиламінопіридин-3-іл)-бензофуран2-іл]-(2,4-дихлорфеніл)-метанон. 17. Композиція, яка містить як активну речовину сполуку формули І. 18. Композиція за п. 17, у якій Х означає О. 19. Композиція за п. 17, у якій Х означає S. 20. Композиція за п. 18, де R 2 вибраний із групи, що включає феніл, шестичленний гетероцикл і 5членний гетероцикл, кожен з яких необов'язково містить замісники, і R4 вибраний із групи, що включає Y і феніл, кожен з яких необов'язково містить замісники. 21. Композиція за п. 19, де R 2 вибраний із групи, що включає феніл, шестичленний гетероцикл і 5членний гетероцикл, кожен з яких необов'язково містить замісники, і R4 вибраний із групи, що включає Y і феніл, кожен з яких необов'язково містить замісники. 22. Спосіб лікування або запобігання гіперпроліферативному захворюванню, що включає введення пацієнту, який потребує цього, ефективної кількості сполуки формули І. 23. Спосіб за п. 22, в якому Х означає О. 24. Спосіб за п. 22, в якому Х означає S. 25. Спосіб за п. 23, де R 2 вибраний із групи, що включає феніл, шестичленний гетероцикл і 5членний гетероцикл, кожен з яких необов'язково містить замісники, і R4 вибраний із групи, що включає Y і феніл, кожен з яких необов'язково містить замісники. 26. Спосіб за п. 24, де R 2 вибраний із групи, що включає феніл, шестичленний гетероцикл і 5членний гетероцикл, кожен з яких необов'язково містить замісники, і R4 вибраний із групи, що включає Y і феніл, кожен з яких необов'язково містить замісники. Даний винахід стосується нових сполук бензофурану і бензотіофену, фармацевтичних композицій, що містять такі сполуки, та застосування цих сполук і/або композицій для лікування гіперпроліферативних захворювань. Сполуки, що відповідають даному винаходу Один варіант втілення даного винаходу стосується сполук формули (І) С6)алкіл, С(О)(С1-С6)алкіл і бензоїл; R2 вибраний із групи, що включає феніл і нафтил, кожен з яких необов'язково містить 1, 2 або 3 замісники, кожен з яких незалежно вибраний із групи, що включає ОН, CN, NО 2, (С1-С6)алкіл, (С1С6)алкоксил, галоген, галоген(С1-С6)алкіл, галоген(С 1-С6)алкоксил, C(O)RA, C(O)NRBRB, NRBRB, NH[(С1-С6)алкіл]0-1S(O)2RB, NH[(С1-С6)алкіл]0A та NH[(С1-С6)алкіл]0-1C(O)OR B, гетеро1C(O)R цикл, вибраний із групи, що включає шестичленний гетероцикл, п'ятичленний гетероцикл і конденсований біциклічний гетероцикл, і кожен гетероцикл необов'язково містить 1, 2 або 3 замісники, кожен з яких незалежно вибраний із групи, що включає ОН, CN, NO2, (С1-С6)алкіл, (С1С6)алкоксил, галоген, галоген(С1-С6)алкіл, галоген(С 1-С6)алкоксил, C(O)RA, C(O)NRBRB, NRBRB, NH[(С1-С6)алкіл]0-1S(O)2RB, NH[(С1-С6)алкіл]0A В 1C(O)R , та NH[(С 1-С 6)алкіл]0-1C(O)OR , де X вибраний із групи, що включає О і S; R1 вибраний із групи, що включає Н, (С1 7 79772 RA у кожному випадку незалежно вибраний із групи, що включає Н, (С1-С6)алкіл, (С1С6)алкоксил, NRBRB або (С1-С6)алкіл, зазначений алкіл необов'язково містить в якості замісників ОН, C(O)RB, галоген, (С1-С3)алкоксил та NRBRB; RB у кожному випадку незалежно вибраний із групи, що включає Н, (С3-С6)циклоалкіл, і (С1С6)алкіл, причому зазначений алкіл необов'язково містить в якості замісників ОН, =О, галоген, (С1С6)алкоксил, NН(С1-С3)алкіл, N[(С1-С3)алкіл]2, та NC(O)(С1-С3)алкіл, і де RB, коли він приєднаний до атома N, у кожному випадку означає (С1-С4)алкіл, тоді 2 групи (С1-С4)алкіл разом з атомом N, до якого вони приєднані, можуть бути з'єднані одна з одною з утворенням насиченого циклу, і де R B і RB разом з атомом N, до якого вони приєднані, можуть утворювати морфолінільний цикл або піперазинільний цикл, який у наявного атома N необов'язково містить в якості замісника (С1-С6)алкіл, зазначений алкіл необов'язково містить в якості замісників ОН, =О, NН2, (С1-С6)алкоксил, NН(С1С3)алкіл або M[(С1-С3)алкіл]2, і за умови, що, якщо RB приєднаний до S(O) або до S(O)2, він не може означати Н; R3 вибраний із групи, що включає Н, ОН, CN, (С1-С3)алкіл, (С1-С3)алкоксил, галоген, галоген(С1С3)алкіл, і галоген(С1-С3)алкоксил; R4 вибраний із групи, що включає піпероніл, Y, де Υ означає гетероцикл, що необов'язково містить 1, 2 або 3 замісники, кожен з яких незалежно вибраний із групи, що включає =О, N-оксид, Н, CN, NO2, галоген, галоген(С1-С6)алкіл, ОН, галоген(С 1С6)алкоксил, C(O)ORB, C(NH)NRBRB, NRBRB, S(O)0B B B 2R , S(O)2NR R , (С 1-С 6)алкоксил, причому зазначений алкоксил необов'язково містить 1 або 2 замісники, вибрані з групи, що включає ОН, NRBRB і (С1-С3)алкоксил, NRCRC, де RC вибраний із групи, що включає RB, C(O)RB , і S(O)2RB , C(O)RD, де RD вибраний із групи, що включає RA, (С3С6)циклоалкіл, Ζ та N[(С1-С3)алкіл]2, де Ζ у кожному випадку означає гетероцикл, що необов'язково містить замісники, незалежно вибрані з групи, що включає CN, =О, ОН, N-оксид, ΝΟ2, галоген, (С1С6)алкоксил, галоген(С 1-С3)алкоксил, галоген(С 1С3)алкіл, S(O)2RB, S(O)2NRBRB, NRBRB, C(O)RA , і (С1-С6)алкіл, зазначений алкіл необов'язково містить в якості замісників ОН, C(O)RB, (С1С3)алкоксил та NRBRB; NRBRE, де RE вибраний із групи, що включає C(O)RA, C(O)RB, S(O)2RB, S(O)2NRBRB і С(О)[(С1-С6)алкіл]Z, де Ζ необов'язково містить замісники, описані вище, (С1-С6)алкіл, зазначений алкіл необов'язково містить в якості замісників CN, ОН, =O, галоген, (С1-С6)алкоксил, C(O)RA, NRBRB, NRCRC, NRBRE, C(NH)NRBRB, S(O)0-2RB, S(O)2NRBRB, C(O)RB C(O)OR B, Z, C(O)Z, і С(О)N[(С1-С3)алкіл]Z, де Ζ у кожному випадку необов'язково містить незалежно вибрані замісники, описані вище, феніл і нафтил, кожен з яких необов'язково містить 1, 2 або 3 замісники, кожен з яких незалежно вибраний із групи, що включає ОН, CN, NO2, галоген, галоген(С1-С6)алкіл, галоген(С 1С6)алкоксил, C(O)ORB, C(NH)NRBRB, NRBRB, S(O)0B B B 2R , S(O) 2NR R Ζ, C(O)Z, де Ζ у кожному випадку необов'язково містить замісники, описані вище, (С1-С6)алкоксил, причому зазначений алкоксил 8 необов'язково містить 1 або 2 замісники, вибрані з групи, що включає ОН, NRBRB, і (С1-С3)алкоксил, NRCRC, де RC вибраний із групи, що включає RB, C(O)RB, і S(O) 2RB, C(O)R D, де RD вибраний із групи, що включає RA, (С3-С6)циклоалкіл, та N[(С1С3)алкіл]Z, де Ζ необов'язково містить замісники, описані вище, NRBRE, де RE вибраний із групи, що включає C(O)RA, C(O)RB, S(O)2RB, S(O)2NRBRB і С(О)[(С1-С6)алкіл]Z, де Ζ необов'язково містить замісники, описані вище, (С1-С6)алкіл, зазначений алкіл необов'язково містить в якості замісників CN, ОН, =O, галоген, (С1-С6)алкоксил, C(O)RA, NRBRB, NRBRE, C(NH)NRBRB, S(O)0-2RB, S(O)2NRBRB, C(O)RBC(O)OR B, Z, C(O)Z, і С(О)N[(С 1-С3)алкіл]Z, де Ζ у кожному випадку необов'язково містить незалежно вибрані замісники, описані вище; R5 і R6 незалежно вибрані з групи, що включає Н, ОН, CN, (С1-С3)алкіл, (С1-С3)алкоксил, галоген, галоген(С1-С3)алкіл, і галоген(С 1-С3)алкоксил; або її фармацевтично прийнятна сіль або складний ефір. Терміни, що вживалися вище, уданому винаході мають такі значення: Термін "який необов'язково містить замісники" означає, що модифікований у такий спосіб фрагмент може або не містити замісників, або містити їх у кількості до максимально зазначеної кількості замісників. Коли будь-який фрагмент містить два або більшу кількість замісників, кожен замісник визначається незалежно від будь-якого іншого замісника та відповідно до цього вони можуть бути однаковими чи різними. Термін "(С1-С6)алкіл, зазначений алкіл необов'язково містить замісники" означає алкільну гр упу, визначену нижче, у якій кожен атом С зв'язаний з 0, 1, 2 або 3 атомами Н, наскільки це є придатним, і будь-який або всі атоми Η можуть бути замінені названими замісниками за умови, що комбінація названих замісників приводить до хімічно стабільної сполуки. Терміни "(С1-С6)алкіл", "(С1-С4)алкіл" і "(С1С3)алкіл" означають лінійні або Термін "С3-С6 циклоалкіл" означає насичену моноциклічну алкільну гр упу, що містить від 3 до приблизно 8 атомів вуглецю, та включає такі групи, як циклопропільна, циклопентильна, циклогексильна тощо. Термін "галоген" означає атом, вибраний із групи, що включає СІ, Br, F і І, де СІ, Вr і F є більш прийнятними, і СІ та F є ще більш прийнятними. Терміни "галоген(С1-С6)алкіл" і "галоген(С 1С3)алкіл" означають лінійну або розгалужену насичену вуглецеву гр упу, що містить від близько 1 до близько 6 або 3 атоми С відповідно, яка містить не менше 1 замісника і може містити кількість замісників аж до пергалогенованої системи (тобто до 3 на атом С, наскільки це є придатним) - атоми СІ або F, у кожному випадку вибрані незалежно від будь-якого іншого атома СІ або F. Такі групи включають (без накладення обмежень) трифторметильну, трихлорметильну, пентафторетильну, фторбутильну, 6-хлоргексильну тощо. Терміни "галоген(С1-С6)алкоксил" і "галоген(С 1-С3)алкоксил" означають лінійну або розгалужену насичену вуглецеву гр упу, що містить від 9 79772 близько 1 до близько 6 або 3 атоми С відповідно, і зазначена вуглецева гр упа приєднана до атома О яка містить не менше 1 замісника та може містити кількість замісників аж до пергалогенованої системи (тобто до 3 на атом С, наскільки це є придатним) - атоми СІ або F, у кожному випадку вибрані незалежно від будь-якого іншого атома СІ або F. Такі групи включають (без накладення обмежень) трифторметоксильну, трихлорметоксильну, пентафторетоксильну, фторбутоксильну, 6хлоргексоксильну то що. Термін "шестичленний гетероцикл" означає ароматичний цикл, утворений 6 атомами, 1, 2 або 3 з яких є а томами N, а іншими є атоми С, причому гетероцикл приєднаний до ядра молекули по будьякому доступному атому С, і необов'язково містить названі замісники у будь-якого доступного атома С. Такі групи включають піридин, піримідин, піридазин і триазин у всіх їх можливих ізомерних формах. Термін "п'ятичленний гетероцикл" означає ароматичний цикл, який утворений 5 атомами та містить 1, 2 або 3 гетероатоми, кожен з яких незалежно вибраний із групи, що включає N, О і S, а іншими є атоми С, за умови, що в гетероциклі є не більш 2 атомів О та, якщо є 2 атоми О, то вони не повинні бути сусідніми. Цей гетероцикл приєднаний до ядра молекули через будь-який доступний атом С, і необов'язково містить названі замісники у будь-якого доступного атома С або N. Такі групи включають пірол, фуран, тіофен, імідазол, піразол, тіазол, оксазол, ізоксазол, ізотіазол, триазол, оксадіазол, тіадіазол і тетразол у всіх їх можливих ізомерних формах. Термін "конденсований біциклічний гетероцикл" означає групу, що містить від 9 до 12 атомів, розділених на 2 цикли, які сконденсовані один з одним по сусідніх атомах С, в якій 1, 2 або 3 з інших атомів є гетероатомами, кожен з яких незалежно вибраний із групи, що включає Ν, Ο і S. Гетероатоми можуть розташовува тися в будь-яких можливих положеннях конденсованого біциклічного фрагмента за умови, що в будь-якому конденсованому біциклічному гетероциклі є не більш 2 атомів О і, якщо є 2 атоми О, то вони не повинні бути сусідніми. Хоча б один із двох конденсованих циклів має бути ароматичним. Інший цикл, якщо він не сконденсований з ароматичним циклом, може бути ароматичним, частково насиченим або насиченим. Ароматичний цикл завжди приєднаний до ядра молекули через будь-який доступний атом С Конденсований біциклічний гетероцикл необов'язково містить названі замісники у будь-якого доступного атома С Такі групи включають конденсовані біциклічні системи складу 5-5, 5-6 і 6-6, у яких один з циклів являє собою один з гетероциклів, описаних ви ще, а інший цикл являє собою бензол або інший гетероцикл, включаючи (без накладення обмежень) хроман, хромен, бензофуран, бензотіофен, хінолін, ізохінолін, фталазин, нафтгідрин, хіноксалін, пурин, індол, індазол, ізоіндол, індолізин, цинолін, претидин, ізоіндол, тієнофуран, імідазотіазол, дитіанафталін, бензоксазин, піпероніл тощо. Термін "Y означає гетероцикл" означає наси 10 чений, частково ненасичений або ароматичний цикл, що містить приблизно 5 або 6 атомів, 1, 2 або 3 з яких незалежно вибрані з групи, що включає N, О і S, а іншими є атоми С, за умови, що в будь-якому гетероциклі є не більше 2 атомів О. Якщо в гетероциклі є 2 атоми О, то вони не повинні бути сусідніми. Цей гетероцикл приєднаний до ядра молекули через будь-який доступний атом С або, якщо цей гетероцикл не являє собою піридил, то через будь-який доступний атом N. Ці гетероцикли включають фуран, пірол, імідазол, піразол, ізоксазол, піридин, піразин, піримідин, піридазин, фуразан, піролідин, імідазолідин, імідазолін, піразолін, піперидин, морфолін, оксатіазин, оксазин, триазин, піперизин, діоксазол, оксазол, піран, дитіол тощо. Термін "Z означає гетероцикл" означає насичений, частково ненасичений або ароматичний цикл, що містить приблизно 5 або 6 атомів, 1, 2 або 3 з яких незалежно вибрані з групи, що включає N, О і S, а іншими є атоми С, за умови, що в будь-якому гетероциклі є не більше 2 атомів О. Якщо в гетероциклі є 2 атоми О, то вони не повинні бути сусідніми. Цей гетероцикл приєднаний до ядра молекули через будь-який доступний атом С або, якщо цей гетероцикл не являє собою піридил, то через будь-який доступний атом N. Ці гетероцикли включають фуран, пірол, імідазол, піразол, ізоксазол, піридин, піразин, піримідин, піридазин, фуразан, піролідин, імідазолідин, імідазолін, піразолін, піперидин, морфолін, оксатіазин, оксазин, триазин, піперизин, діоксазол, оксазол, піран, дитіол тощо. Термін "N-оксид" означає, що для гетероциклів, що містять не заміщений в інший спосіб атом N у конфігурації sp2, цей атом N може включати ковалентно приєднаний атом О, тобто -N(—>О). Приклади таких N-оксидно заміщених гетероциклів включають піридил-N-оксиди, піримідиніл-Nоксиди, піразиніл-N-оксиди і піразоліл-N-оксиди. Термін "піпероніл" означає метилендіоксифенільний цикл структури , місцем приєднання якого може бути будь-який доступний ароматичний атом С Репрезентативні сполуки формули І розкриті нижче у цьому винаході. Залежно від положення і природи різних необхідних замісників сполуки відповідно до цього винаходу можуть містити один чи більшу кількість асиметричних центрів. Асиметричні атоми вуглецю можуть знаходитися в (R)-або (S)-конфігурації, або в (R,S)-конфігурації. У деяких випадках асиметрія може виникати внаслідок загальмованого обертання навколо даного зв'язку, наприклад, центрального зв'язку, що з'єднує два ароматичні кільця заданих сполук. Замісники у кільця можуть знаходитися в цис- або транс-формі, а замісники у подвійного зв'язку можуть знаходитися в Z- або Еформі. Передбачається, що до обсягу даного винаходу включені всі такі конфігурації (включаючи енантіомери і діастереоізомери). Більш прийнятними є такі абсолютні конфігурації сполук відповідно до цього винаходу, що приводять до більшої біологічної активності. До обсягу даного винаходу 11 79772 також включені поділені, чисті або частково очищені ізомери чи рацемічні суміші сполук відповідно до цього винаходу. До обсягу даного винаходу також входить застосування фармацевтично прийнятних солей сполук відповідно до цього винаходу. Термін "фармацевтично прийнятна сіль" означає солі неорганічних або органічних кислот або основ сполук відповідно до цього винаходу, що мають характеристики, прийнятні для призначеного терапевтичного застосування. Наприклад, [див. S. М. Berge, et al. "Pharmaceutical Salts," J. Pharm. Sci. 1977, 66, 1-19]. Репрезентативні солі сполук відповідно до цього винаходу включають звичайні нетоксичні солі і четвертинні солі амонію, які одержують, наприклад, з неорганічних або органічних кислот чи основ у способи, добре відомі в цій галузі те хніки. Наприклад, такі молекулярні солі кислот включають ацетат, адипат, альгінат, аскорбат, аспартат, бензоат, бензолсульфонат, бісульфат, бутират, цитрат, камфорат, камфорсульфонат, цинамат, циклопентанпропіонат, глюконат, додецилсульфат, етансуль фонат, фумарат, глюкогептаноат, гліцерофосфат, гемісульфат, гептаноат, гексаноат, гідрохлорид, гідробромід, гідройодид, 2гідроксіетансульфонат, ітаконат, лактат, малеат, манделат, метансульфонат, 2нафталінсульфонат, нікотинат, нітрат, оксалат, пальмоат, пектинат, персульфат, 3фенілпропіонат, пікрат, півалат, пропіонат, сукцинат, сульфонат, тартрат, тіоціанат, тозилат і ундеканоат. Термін "молекулярні солі кислот" також включає гідрати і форми з приєднаним розчинником, що можуть утворювати сполуки відповідно до цього винаходу. Прикладами форм є, наприклад, гідрати, алкоголяти тощо. Основні солі включають, наприклад, солі лужних металів, такі як солі калію і натрію, лужноземельних металів, такі як солі кальцію і магнію, та солі амонію з органічними основами, такими як дициклогексиламін та N-метил-D-глюкамін. Крім того, основні групи, що містять азот, в сполученій основі можна перетворити на четвертинні сполуки за допомогою таких реагентів, як нижчі алкілгалогеніди, такі як метил-, етил-, пропіл- і бутилхлориди, -броміди і -йодиди; діалкілсульфати, включаючи диметил-, діетил- і дибутилсуль фат, і діамілсульфати, галогеніди з довгими ланцюгами, такі як децил-, лаурил-, міристил- і стеарилхлориди, -броміди та -йодиди, арилалкілгалогеніди, включаючи бензил- і фенетилброміди, та ін. Складні ефіри підхожих сполук відповідно до цього винаходу являють собою нетоксичні, фармацевтично прийнятні складні ефіри, такі як алкільні складні ефіри, включаючи метилові, етилові, пропілові, ізопропілові, бутилові, ізобутилові та пентилові складні ефіри тощо. Можна використовувати додаткові складні ефіри, такі як феніл-(С1С5)-алкілові, хоча більш прийнятним є метиловий складний ефір. Якщо контекст явно не вказує на протилежне, всюди при вживанні у цьому винаході терміна "сполуки відповідно до цього винаходу", "сполуки, що відповідають цьому винаходу" то що, мається 12 на увазі, що вони включають хімічно можливі фармацевтично прийнятні солі і/або складні ефіри, а також усі стереоізомерні форми названих сполук. Спосіб одержання сполук відповідно до цього винаходу Звичайно сполуки відповідно до цього винаходу одержують за стандартними методиками, відомими у цій галузі техніки, за аналогічними методиками, відомими у цій галузі техніки, і/або за методиками, розкритими нижче, з використанням вихідних речовин, що наявні у продажу, які отримують відповідно до стандартних звичайних хімічних методик або схем синтезу, описаних у цьому винаході. Конкретна методика, що підлягає застосуванню при одержанні сполуки відповідно до цього винаходу, залежить від конкретної необхідної сполуки. Такі фактори, як те, чи є амін заміщеним або ні, вибір конкретних замісників, можливих у різних положеннях, тощо, відіграють роль у використовуваному шляху одержання. Ці фактори легко визначаються фахівцем із загальною підготовкою у цій галузі техніки. Похідні бензофурану і бензотіофену формули (І) звичайно одержують (без накладення обмежень) у способи, описані нижче на Схемах реакцій 1 і 2. На Схемі реакцій 1, кінцевий продукт - бензофуран або бензотіофен формули (І), де R1 означає Н, можна синтезувати безпосередньо шляхом конденсації належним чином заміщеного 2ціанофенолу (формула (II), в якій X=О) або 2ціанотіофенолу (формула (II), у якій X=S) із придатним 1-арил-2-галогенетаноном формули (III). Протікання реакції як правило полегшують основи, такі як карбонат цезію, карбонат калію, карбонат натрію і DBU, у розчиннику, такому як DMF або MeCN, і при температурах від кімнатної температури до 100°С, що дає кінцевий продукт формули (І). Схема реакцій 1 Синтез вихідної речовини (II): Синтез вихідної речовини (III): Синтез (I) з (II) I (lll) 13 79772 Альтернативно, коли вихідний фенол або тіофенол не є легко доступним, можна використовувати методику, описану на Схемі реакцій 2, проміжні бензофурани і бензотіофени формул (IV) або (V) спочатку одержують в аналогічний спосіб, а потім перетворюють на кінцевий продукт (І) за допомогою реакцій сполучення Судзуки. Таким чином, галогенбензофуран або галогенбензотіофен (IV) або спочатку вводять у реакцію з боронатним складним ефіром формули (VI) у присутності Pd каталізатора і основи, або його перетворюють на боронатний складний ефір формули (V), а потім вводять у реакцію сполучення з галогенідною сполукою формули (VII) за аналогічних умов. Вихідні речовини (II), (III) (VI) і (VII) звичайно є у продажу або їх одержують за стандартними методиками, відомими у цій галузі техніки й описаними нижче в прикладах одержання. Схема реакцій 2 Сполуки формули (І), у якій R1 означає Н, отримані за Схемою реакцій 1 або Схемою реакцій 2, можна перетворити на інші сполуки формули (І), в яких R1 не означає Н, як це показано на Схемі реакцій 3. Наприклад, обробка основою й алкілувальним реагентом, таким як метилйодид або метилсульфа т, дає сполуки формули (І), в якій R1 означає алкіл. В аналогічний спосіб, обробка основою й ацилувальним реагентом, таким як ацетилхлорид або бензоїлхлорид, дає сполуки формули (І), у якій R1 означає ацетил або бензоїл. Схема реакцій 3 14 Слід розуміти, що для нестійких або реакційноздатних замісників, приєднаних до проміжних продуктів або сполук формули І, під час синтезів, описаних нижче, може знадобитися введення та відщеплення захисних груп. За хисні групи зазвичай можна ввести та вилучити звичайними способами, відомими у цій галузі техніки [див., наприклад, Т. W. Greene and P.G.M. Wuts, Protecti ve Groups in Organic Synthesis; Wiley: New York, (1999)]. Варіанти сполук відповідно до цього винаходу можна легко одержати за допомогою методик, описаних вище і наведених нижче, або стандартних хімічних методик, відомих у цій галузі техніки, шляхом використання придатних вихідних речовин або проміжних сполук, які є легко доступними і/або описані у цьому винаході. Звичайно необхідну сіль сполуки відповідно до цього винаходу можна одержати in situ при остаточному виділенні й очищенні сполуки за допомогою способів, відомих у цій галузі техніки. Наприклад, потрібну сіль можна одержати шляхом окремого введення очищеної сполуки у формі вільної основи або вільної кислоти в реакцію з придатною органічною або неорганічною кислотою або придатною органічною або неорганічною основою, відповідно, та виділити сіль, що утворилася в такий спосіб. Наприклад, у випадку основної сполуки вільну основу обробляють безводним НСІ у придатному розчиннику, такому як THF, і сіль виділяють у вигляді хлористоводневої солі. У випадку кислотних сполук солі можна одержати, наприклад, за допомогою обробки вільної кислоти безводним аміаком у придатному розчиннику, такому як ефір, і подальшого виділення солі амонію. Ці способи є стандартними і повинні бути легко доступними для фахівця у цій галузі техніки. Сполуки відповідно до цього винаходу можна етерифікувати за допомогою ряду стандартних процедур, включаючи введення у реакцію придатного ангідриду, карбонової кислоти або хлорангідриду кислоти зі спиртовою групою сполуки відповідно до цього винаходу. Придатний ангідрид вводять у реакцію зі спиртом у присутності основи, що полегшує ацилування, такої як 1,8-біс[диметиламіно]-нафталін або Ν,Νдиметиламінопіридин. Або ж придатну карбонову кислоту можна ввести в реакцію зі спиртом у присутності дегідратуючого реагенту, такого як дициклогексилкарбодіімід, 1-[3-диметиламінопропіл]-3етилкарбодіімід або інші дегідратуючі реагенти, що використовуються для проведення реакції шляхом вилучення води, і, необов'язково, каталізатора ацилування. Етерифікацію також можна здійснити з використанням придатної карбонової кислоти в присутності трифтороцтового ангідриду і, необов'язково, піридину, або в присутності Ν,Νкарбонілдіімідазолу з піридином. Реакцію хлорангідриду кислоти зі спиртом можна здійснити з використанням каталізатора ацилування, такого як 4DMAP або піридин. Фахівець у цій галузі техніки повинен добре знати, як успішно здійснити ці, а також інші відомі методики етерифікації спиртів. 15 79772 Очищення ізомерів і поділ сумішей ізомерів сполуки формули (І) можна здійснити за допомогою стандартних методик, відомих у цій галузі техніки. Наведені нижче приклади надані для додаткової ілюстрації сполук відповідно до цього винаходу і їх одержання, але їх не слід розглядати як такі, що будь-яким чином обмежують. Приклади одержання сполук відповідно до цього винаходу Спектри протонного (1Н) ядерного магнітного резонансу (ЯМР) знімають на спектрометрі General Electric G/V-Omega 300 (300МГц) з використанням як стандарту або Me4Si (d 0,00), або залишкового протонованого розчинника (СНСІ3 d 7,26; МеОН d 3,30; D MSO d 2,49). Вуглецеві (13С) спектри ЯМР знімають на спектрометрі General Electric GN-Omega 300 (75МГц) з використанням розчинника в якості стандарту (CDCI3 d 77,0; d3MeOD; d 49,0; d 6-DMSO d 39,5). Позначення в спектрах ЯМР: s - синглет, d дублет, m - мультиплет, t -триплет, q - квадруплет, b, br, broad - широкий. Поділ хіральних сполук здійснюють з використанням наявної в продажі колонки для ВЕРХ ChiracelÒ AD, елююючи в градієнтному режимі за допомогою ізопропанолу в гексані (від 1% до 15%) з додаванням 0,1% трифтороцтової кислоти. Абревіатури Коли у цьому винаході використовуються наведені нижче абревіатури, вони мають такі значення: ADDP - 1,1'-азодикарбоніл)-дипіперидин DBU -1,8-діазабіцикло[5.4.0]ундец-7-ен DMF - N,N-диметилформамід DMSO - диметилсульфоксид ЕА - елементний аналіз ЕР - електророзпилення Et - етил Et2O - діетиловий ефір EtOAc - е тил ацетат ГХ-МС газова хроматографія-масспектроскопія HEX - гексани РХ-МС рідинна хроматографія/масспектроскопія Me - метил MeCN - ацетонітрил MeOH - метанол РХСТ - рідинна хроматографія середнього тиску NCS - N-хлорсукцинімід ЯМР - спектроскопія ядерного магнітного резонансу Pd(dppf)2Cl2 [1,1'-біс(дифенілфосфіно)фероцен]дихлорпаладієвий(ІІ) комплекс Ph - феніл РуВОР бензотриазол-1-іл-окси-триспіролідинофосфонійгексафторфосфа т ЧУ - час утримування (ВЕРХ) Rf - коефіцієнт утримування для ТШХ THF - тетрагідрофуран ТШХ - тонкошарова хроматографія Одержання вихідних речовин і проміжних продуктів 16 Загальна методика А: 2-галоген-1-арилкетони (lll) Сполуки формули (III) або наявні у продажу, або їх можна одержати, як це показано на Схемі реакцій для загальної методики А і як це описано в одному або кількох наведених нижче Прикладів. Схема реакцій для загальної методики А Приклад 1 Методика А-1 Одержання трихлорфеніл)етанону 2-бром-1-(2,4,6 Суміш 1,3,5-трихлорбензолу (10,0г, 55,1ммоль), 2-бромацетилброміду (5,0мл, 57,8ммоль, 1,05екв.) і хлориду алюмінію (7,7г, 57,8ммоль, 1,05екв.) нагрівають у нерозбавленому вигляді при 80°С в атмосфері аргону протягом 17год, доки не утвориться чорний осад. Реакційну суміш охолоджують до кімнатної температури й отриману чорну масу розчиняють в етилацетаті (500мл). Повільно додають воду (200мл) при 0°С для припинення реакції і двофазні шари поділяють. Органічний шар потім промивають водою (2x150мл) та розсолом (1x150мл), сушать (МgSО4), фільтрують та випарюють у вакуумі. Перекристалізація з гексану дає 11,5г (69,3%) 2бром-1-(2,4,6-трихлорфеніл)етанону у вигляді пухоподібної білої твердої речовини. 1Н-ЯМР (DMSO-d6) d 7,86 (s, 2Н), 4,78 (s, 2H); Rf=0,28, 2% етилацетат - гексан. Приклад 2 Методика А-2а Одержання 2-бром-1-(2,5дихлорфеніл)етанону До 2,5-дихлорацетофенону (5,0г, 26,45ммоль) у безводному тетрагідрофурані (53мл) в атмосфері аргону додають фенілтриметиламонійбромід (9,94г, 26,45ммоль, 1,0екв.) при 0°С. Реакційну суміш перемішують при температурі навколишнього середовища протягом 16год, концентрують і повторно розчиняють в етилацетаті. Органічний шар промивають водою (2x250мл) та розсолом (1x150мл), сушать (МgSО 4) фільтрують та випарюють у вакуумі. Очищення за допомогою РХСТ 17 79772 хроматографії (колонка Biotage) дає 3,47г (52,5%) 2-бром-1-(2,5-дихлорфеніл)етанону у вигляді прозорого масла. 1Н-ЯМР (DMSO-d6) d 7,93 (dd, J=2,1Гц, 0,9Гц, 1Н), 7,61-7,60 (m, 2H), 4,86 (s, 2H). Приклад 3 Методика А-2b Одержання 2-бром-1-(2-бром-4фтор феніл)етанону Цю сполуку одержують з 1-(2-бром-4фтор феніл)-етанону (2,5г, 11,52ммоль) у спосіб, описаний для 2-бром-1-(2,5-дихлорфеніл)-етанону (Приклад А-2), і одержують 2,14г (63%) 2-бром-1(2-бром-4-фторфеніл)-етанону у вигляді прозорого масла. 1Н-ЯМР (CD2CI2) d 7,57 (dd, J=9,6Гц, 1Н), 7,44 (dd, J=8,2Гц, 1H), 7,21 (m, 7,21-7,14, 1Н), 4,51 (s, 2H); ТШХ Rf=0,38, 15 % етилацетат-гексани. Приклад 4 Методика А-3 Одержання 2-хлор-1-(4-метил-3піридиніл)етанонгідрохлориду Стадія 1: піридиніл)етанону Одержання 1-(4-метил-3 Розчин 3-ацетилпіридину (100г, 0,82моль), диметилсульфіду (400мл, 5,4моль) і йодиду міді(І) (7,94г, 0,041моль) у безводному THF (2л) перемішують при кімнатній температурі в атмосфері аргону. Потім додають фенілхлорформіат (0,4мл, 0,82моль) і одержують темно-коричневий осад. Через 30хв суміш о холоджують до температури нижче -21°С і протягом 50хв додають метилмагнійбромід (1,4Μ у суміші 3:1 толуол-THF, 586мл, 0,82моль), підтримуючи температуру реакційної суміші нижчою від -15°С. В міру розчинення суміші колір світлішає; незадовго до кінця додавання утворюється зелений вапняний осад, але він розчиняється по закінченні додавання. Суміш перемішують і їй дають повільно нагрітися; через 2год її нагрівають до 8,8°С. Додають насичений водний розчин хлориду амонію (500мл); після перемішування протягом 10хв суміш виливають у ділильну лійку з водою (500мл). Органічну фазу відділяють, промивають розсолом (500мл), сушать (Na2SO4), фільтрують, а потім концентрують у вакуумі. Залишок очищають за допомогою хроматографії на силікагелі з використанням суміші гексан-EtOAc у градієнтному режимі й одержують 134,3г (63,7 %) проміжного продукту - дигідропіридину. 18 Розчин проміжного продукту - дигідропіридину (0,52моль) у дихлорметані (100мл) при перемішуванні додають до суспензії сірки (16,67г, 0,52моль) у декаліні і повільно нагрівають зі зворотним холодильником, продуваючи аргоном. Після нагрівання зі зворотним холодильником протягом 1год суміші дають остудитися до кімнатної температури, потім її фільтр ують крізь шар силікагелю. Після елюювання декаліном з гексаном елюювання за допомогою системи гексан-діетиловий ефір у градієнтному режимі дає 49,4г (70,3%) шуканого 1-(4метил-3-піридиніл)етанону у вигляді червонува токоричневого масла: ТШХ Rf 0,19 (діетиловий ефір); ТШХ Rf 0,14 (1:1 гексан-EtOAc); 1Н ЯМР (CD2CI2) d 8,9 (s, 1Н), 8,5 (d, 1Н), 7,2 (dd, 1Н), 2,6 (s, 3Н), 2,51 (s, 3Н); ГХ МС 135 (М+). Стадія 2: Одержання 2-хлор-1-(4-метил-3піридиніл)етанонгідрохлориду У круглодонну колбу об'ємом 500мл приміщують 1-(4-метил-3-піридиніл)етанон (10,0г, 74,1ммоль) у 90мл Еt2О. До цього розчину при перемішуванні додають 88,9мл 1Μ HCI/Et2O (1,2екв., 88,9ммоль) та розчин перемішують протягом 1год при кімнатній температурі й у цей момент осад фільтрують та промивають за допомогою Еt2О. Тверду речовину потім сушать у вакуумі при температурі близько 60°С. Цю сіль НСІ (12г, 70,0ммоль) потім розчиняють у 70,0мл 1Μ НСІ/оцтова кислота, до якої додано 9,34г (1екв., 70,0ммоль) N-хлорсукциніміду (NCS), та реакційну суміш перемішують в а тмосфері аргону при кімнатній температурі протягом ночі. У цей момент додають 300мл Еt2О, що приводить до утворення майже білого осаду. Суміш перемішують протягом 1год, та в цей момент тверду речовину відфільтровують і промивають за допомогою Еt2О та одержують 12,0г (83%) шуканого 2-хлор-1-(4-метил-3піридиніл)етанонгідрохлориду. ГХ-МС ЧУ=6,60хв; 1 Н-ЯМР (D MSO-d6) d 2,51 (s, 3Н), 5,15 (s, 2H), 7,68 (d, 1H), 8,68 (d, 1H), 9,06 (s, 1H); [M]+ 169 (95%). Приклад 5 Методика А-4 Одержання 2-хлор-1-[4-(триФторметил)-3піридиніл]етанонгідрохлориду Стадія 1 До круглодонної колби об'ємом 250мл приміщують 3,0г 4-трифторнікотинової кислоти (15,7ммоль, 1екв.) у 100мл THF. До неї додають 5,3мл (3,8г, 37,7ммоль, 2,4екв.) триетиламіну і 9,8г (18,8ммоль, 1,2 екв.) РуВОР. С уміш перемішують протягом 10хв при кімнатній температурі і додають 2,7г кислоти Мельдрума (18,8ммоль, 1,2екв.) та реакційну суміш перемішують при кімнатній тем 19 79772 пературі протягом ночі (18год). У цей момент додають 30мл 1Μ НСІ (водний розчин) та реакційна суміш відразу ж перетворюється з жовтогарячої на пурпурну. Суміш потім нагрівають зі зворотним холодильником (100°С) протягом 18год, та вона поступово переходить з пурпурної в жовту. Реакційну суміш потім підлуговують за допомогою насиченого розчину MаНСО3 і екстрагують за допомогою EtOAc (3 x200мл). Об'єднані органічні шари сушать, фільтр ують та випарюють. Залишок очищають на колонці BIOTAGE (35% EtOAc/Нех) і одержують шуканий продукт, метил4-трифторметилнікотинат 1,84г (62 %) у вигляді безбарвного масла. ТШХ Rf=0,57 (50% EtOAc:He x). Стадія 2 До колби об'ємом 100мл приміщують 1,84г (9,7ммоль, 1екв.) метил-4трифторметилнікотинату в 25мл 1Μ НСІ у СН3СООН. До них потім додають 1,3г NCS (9,7ммоль, 1екв.) та реакційну суміш перемішують протягом ночі (18год). Суміш потім переносять у колбу Ерленмейера об'ємом 500мл і до неї при перемішуванні додають 300мл 2Μ НСІ у Et2 O. Це приводить до утворення білого осаду, який потім фільтрують і одержують 1,2г (49 %) шуканого 2хлор-1-[4-(трифторметил)-3-піридиніл]етанонгідрохлориду у вигляді білої твердої речовини. 1Н-ЯМР (DMSO-d6) d 9,21 (s, 1H), 9,02 (d, 1H), 7,94 (d, 1H), 5,19 (s, 2H). Приклад 6 Методика А-5 Одержання 1-бензо[1,3]діоксол-4-іл-2брометанону Стадія 1: Одержання вихідної речовини 1бензо[1,3]діоксол-4-іл-етанону Розчин MeMgBr у THF (1 М, 50мл, 50ммоль, 1,5екв.) розбавляють за допомогою 50мл THF і охолоджують до -10°С. Повільно додають розчин бензо[1,3]діоксол-4-карбоксальдегіду (5,0г, 33,3ммоль) у 50 мл THF та реакційну суміш перемішують протягом 1год. Потім реакцію зупиняють, виливаючи реакційну суміш у 500мл охолоджуваного льодом насиченого розчину хлориду амонію, та суміш екстрагують е фіром. Органічні шари сушать над сульфатом натрію і фільтрують крізь шар силікагелю, а потім концентрують у вакуумі, одержуючи 4,9г білої твердої речовини. Суміш цієї твердої речовини (2,0г, 12,0ммоль) і МnО2 (10,5г, 120,4ммоль, 10,0екв.) у 75мл діетилового ефіру енергійно перемішують протягом 48год. Реакційну суміш потім фільтрують спочатку крізь шар силікагелю, потім крізь пористий фільтр 0,46мкм, а потім концентрують у вакуумі й одержують 2,1г майже 20 білої твердої речовини. Очищення за допомогою РХСТ (колонка Biotage) з використанням системи гексан-етилацетат у градієнтному режимі дають 1,47г (74%) 1-бензо[1,3]діоксол-4-ілетанону у вигляді майже білої твердої речовини. 1Н-ЯМР (CDCI3) d 7,35 (d, J=8Гц, 1H), 6,97 (dm, J=8Гц, 1H), 6,87 (dd, J=8Гц, 1Н), 6,08 (s, 2Η), 2,59 (s, 3Н); ТШХ Rf=0,18, 25% етилацетат - гексани. Стадія 2: Одержання проміжного продукту: 1бензо[1,3]діоксол-4-іл-2-брометанону Цю сполуку одержують з 1-бензо[1,3]діоксол-4іл-етанону (2,15г, 13,1ммоль) у спосіб, описаний для 2-бром-1-(2,5-дихлорфеніл)етанону (Приклад І-2), і одержують 1,54г (48%) 1-бензо[1,3]діоксол-4іл-2-брометанону у вигляді майже білої твердої речовини. 1Н-ЯМР (CD2CI2) d; 7,41 (dd, J=8,1Гц, 1Н), 7,05 (dd, J=8,1Гц, 1Η), 6,94 (dd, J=8,8Гц, 1Н), 6,13 (s, 2H), 4,55 (s, 2H). ТШХ Rf=0,28, 15%, етилацетат - гексани. Приклад 7 Методика А-6 Одержання вихідної речовини 2-бром-1-[3(трет-бутил-дифеніл-силанілоксил)-феніл]етанону Стадія 1: Одержання 1-[3-(трет-бутилдифенілсиланілокси)феніл]етанону До 1-(3-гідрокси-феніл)-етанону (3,3г, 24,2ммоль) і трет-бутилхлордифенілсилану (7,3г, 26,7ммоль, 1,1екв.) у безводному дихлорметані (50мл) при 0°С додають диметиламінопіридин (296мг, 2,42ммоль, 0,1екв.) і триетиламін (2,69г, 26,7ммоль, 1,1екв.) та реакційну суміш перемішують при кімнатній температурі в атмосфері аргону протягом 16год. Реакційну суміш розбавляють етилацетатом та водою. Органічний шар промивають водою, розсолом і сушать над сульфатом магнію. Розчинник випарюють за пониженого тиску й одержують 8,7г (95,8%) неочищеного продукту. 1 Н-ЯМР (ацетон-d6) d 7,78 (m, 5H), 7,56-7,38 (m, 7H), 7,22 (m, 1H), 7,00 (m, 1Н), 2,38 (s, 3Н), 1,12 (s, 9Н); МС ЕР (МН+=375); Rf=0,90 (30% етилацетат 21 79772 гексан). Стадія 2: Одержання: 2-бром-1-[3-(трет-бутилдифеніл-силанілоксил)феніл]етанону Цю сполуку одержують з 1-[3-(трет-бутилдифеніл-силанілоксил)феніл]-етанону (8,7г, 23,23ммоль) у спосіб, описаний для 2-бром-1-(2,5дихлорфеніл)етанону, та отримують 10,2г (96,8%) прозорого масла. 1Н-ЯМР (ацетон-d6) d 7,78 (m, 4H), 7,60 (m, 1H), 7,50-7,40 (m, 7H), 7,22 (m, 1H), 7,05 (m, 1Н), 4,56 (s, 2Н), 1,13 (s, 9Н); Rf=0,92 (30% етилацетат - гексан). Цю речовину використовують із приєднаною захисною групою в отриманому в Прикладі 104 вигляді; десилілування відбувається на стадії утворення бензофурану. Загальна методика Н: Одержання проміжних продуктів (VI) і (VII) Арилгалогеніди (VII), арилборонові кислоти й арилборонати (VI), що використовуються для одержання сполук формули (І) відповідно до цього винаходу (див. нижче Методики В, С, D і G), або наявні у продажу, або їх одержують за допомогою однієї чи кількох методик, описаних у наведених нижче Прикладах. Арилгалогеніди (VII), отримані за методиками, описаними нижче, після цього можна використовувати безпосередньо як вихідні речовини для загальних методик В, С-1, D-1 і D-3, описаних нижче, або перетворити на відповідні боронати формули (VI) з використанням процедур, описаних на Стадії 1 Прикладів С-2 і D-2 та використовувати так, як це описано в Загальній методиці В, С-1, D-1 і D3. Приклад 8 Методика Н-1 Одержання 1-бром-3метилсульфанілметилбензолу Тіометоксид натрію (0,616г, 8,8ммоль) додають до DMF (8мл) і охолоджують до 0°С. До цього розчину додають 1-бром-3-бромметилбензол (2г, 8ммоль). Суміші дають нагрітися до кімнатної температури і її перемішують протягом 18год. Суміш потім виливають у холодну воду (50мл) та екстрагують за допомогою EtOAc (3X20мл). Органічні шари об'єднують і сушать над сульфатом натрію. Розчин концентрують у вакуумі й одержують неочищений продукт, який потім очищають за допомогою флеш-хроматографії (5% етилацетат - гек 22 сани) та одержують 1,3г (68,5%) 1-бром-3метилсульфанілметилбензолу у вигляді чистого продукту. 1Н-ЯМР (метиленхлориді) d 7,48-7,47 (m, 1Н), 7,392 (dt, J=7,9,1,5Гц, 1Н), 7,28-7,207 (m, 2H), 3,64 (s, 2H), 1,99 (s, 3Н); РХ-МС ЧУ: 3,70, [М+Н]+: 354,1. Приклад 9 Методика Н-2 Одержання алкіларилтіоефірів Одержання 1 -бром-3ізопропілсульфанілбензолу 3-Бромбензолтіол (1г, 5,3ммоль) додають до ацетону (25мл). Потім додають карбонат калію (1,46г, 10,58ммоль) і 2-йодпропан (1,17г, 6,88ммоль). Суміш кип'ятять зі зворотним холодильником протягом 5год. Реакційну суміш потім охолоджують до кімнатної температури і фільтрують крізь шар целіту. Органічний шар потім концентрують у вакуумі та розчиняють в ефірі, при цьому випадає білий осад. Органічний шар потім повторно фільтрують через той самий шар целіту і концентрують у вакуумі й одержують 1,14г (93,17%) 1-бром-3-ізопропілсульфанілбензолу у вигляді масла. 1Н-ЯМР (метиленхлорид-d2) d 7,54 (s, 1Н), 7,37-7,31 (m, 2Н), 7,18 (t, J=7,9Гц, 1Н), 3,503,36 (m, 1Н), 1,31 (d, J=6,1Гц, 6Н); РХ-МС ЧУ: 4,15, [М+Н]+: 233,2. Приклад 10 Методика Н-3 Одержання 1-бром-3-метилсульфонілбензолу Стадія 1: Одержання метансульфонілбензолу. 1-бром-3 3-Бромтіоанізол (0,5г, 2,46ммоль) додають до метиленхлориду (12мл) і охолоджують до 0°С. До нього додають 3-хлорпероксибензойну кислоту (0,467г, 2,71ммоль). m-СРВА повністю не розчиняється. Суміш перемішують протягом ночі. Реакцію зупиняють за допомогою насиченого розчину тіосульфату натрію (30мл). Продукт екстрагують за допомогою EtOAc (3X20мл). Органічні фракції об'єднують, промивають розсолом (20мл) і сушать над сульфатом натрію. Органічний шар потім концентрують і одержують 0,912г (81%) 1-бром-3метансульфінілбензолу. 1Н-Я МР (метиленхлориді) 23 79772 24 d 7,83 (t, J=2,0Гц, 1Н), 7,66 (d, J=7,6Гц, 1Н), 7,57 (d, J=8,3Гц, 1Н), 7,44 (t, J=7,9Гц, 1Н), 2,77 (s, 3Н); РХМС ЧУ: 1,28, [М+Н]+: 219,0. Стадія 2: Одержання 1-бром-3метансульФонілбензолу 3-Бромтіоанізол (8,7г, 43ммоль) додають до метиленхлориду (125мл) охолоджують до 0°С. До нього додають 3-хлорпероксибензойну кислоту (22,2г, 129ммоль). m-СРВА повністю не розчиняється. Суміш перемішують протягом ночі. Реакцію зупиняють за допомогою насиченого розчину тіосульфату натрію (150мл). Продукт екстрагують за допомогою EtOAc (3X100мл). Органічні фракції об'єднують, промивають розсолом (75мл) і сушать над сульфатом натрію. Органічний шар потім концентрують і одержують 9,89г (97%) 1-бром-3метансульфонілбензолу. 1Н-ЯМР (метиленхлоридd2) d 8,09 (s, 1H), 7,85 (dd, J=19,2, 7,8Гц, 2Н), 7,50 (t, J=8,2Гц, 1Н), 3,06 (s, 3Н); ГХ-МС ЧУ: 6,49, [М+Н]+: 236,0. Приклад 11 Методика Н-4 Одержання N-(3-йод-бензил)метансульфонаміду Суміш 3-йодбензиламіну (1,0г, 4,29ммоль) і метансульфонілхлориду (0,35мл, 4,51ммоль, 1,05екв.) у безводному піридині (2,1мл) перемішують при 50°С в атмосфері аргону протягом 3 днів. В охолодженій реакційній суміші реакцію зупиняють за допомогою 1н НСІ та розбавляють етилацетатом. Етилацетатний шар промивають водою, розсолом і сушать над сульфатом натрію. Розчинник вилучають за пониженого тиску і неочищений продукт очищають за допомогою РХСТ (колонка Biotage), елююючи за допомогою суміші 25% етилацетат - гексан. Перекристалізація з дихлорметан - ефір - гексан дає 1,307г (97,9%) продукту. 1НЯМР (DMSO-d6) d 7,68 (s, 1H), 7,60 (ddd, J=7,8Гц, 1,8Гц, 1,2Гц, 1Н), 7,55 (t, J=6,3Гц, 1Н), 7,32 (d, J=9,0Гц, 1Н), 7,80 (t, J=7,8Гц, 1Н), 4,09 (d, J=6,6Гц, 2Н), 2,85 (d, J=1,8Гц, 3Н); РХ-МС (ЕР МН+=264, ЧУ=2,39хв); Rf=0,48 (50% етилацетат - гексан). Приклад 12 Методика Н-5 Одержання 1-(3-йод-феніл )-3-метилсечовини Суміш 3-йоданіліну (1,0г, 4,57ммоль) і метилізоціанату (0,29мл, 5,02ммоль, 1,1екв.) у безводному N,N-диметилформаміді (3,0мл) перемішують при 100°С в атмосфері аргону протягом 16год. Реакційну суміш розбавляють етилацетатом і промивають водою, розсолом та сушать над сульфатом натрію. Розчинник вилучають за пониженого тиску і неочищене масло перекристалізують з ефір - гексан і одержують 732,5мг (58,1%) продукту. 1НЯМР (DMSO-d6) d 8,60 (s, 1Н), 7,93 (t, J=1,8Гц, 1Н), 7,25 (ddd, J=8,1Гц, 2,1Гц, 0,9Гц, 1Н), 7,20 (ddd, J=8,1Гц, 2,1Гц, 0,9Гц, 1Н), 6,98 (t, J=8,1Гц, 1Н), 6,04 (broad d, J=4,8Гц, 1Н), 2,60 (d, J=5,4Гц, 3Н); Rf=0,23 (50 % етилацетат - гексан). Приклад 13 Методика Н-6 Одержання (R)-3-(3-бром-фенокси)-пропан1,2-діолу До 3-бромфенолу (1,0г, 5,78ммоль) і (R)-(+)гліцидолу (428мг, 5,78ммоль, 1,0екв.) в етанолі (50мл) додають триетиламін (29мг, 0,29ммоль, 0,05екв.) та реакційну суміш кип'ятять зі зворотним холодильником в атмосфері аргону протягом 3год. Реакційну суміш охолоджують та виливають в етилацетат та воду. Органічний шар промивають водою, розсолом та сушать над сульфатом натрію. Розчинник вилучають за пониженого тиску і неочищений продукт очищають за допомогою РХСТ (колонка Biotage), елююючи за допомогою суміші 30% етилацетат - гексан, і одержують діол у вигляді білої твердої речовини (1,20г, 84,0%). 1НЯМР (ацетон-d6) d 7,23 (t, J=8,4Гц, 1Н), 7,11(m, 2H), 6,95 (m, 1H), 4,12 (m, 2H), 3,98 (m, 2H), 3,80 (m, 1H), 3,65 (m, 2H); R f=0,12 (30% етилацетат гексан). Приклад 14 Методика Н-7 Одержання 2-фтор-3-йодпіридину До розчину н-бутиллітію в гексанах (40,14мл, 1,6М) в атмосфері аргону при -78°С додають діізопропіламін (6,5г, 64,2ммоль, 1,0екв.). Після перемішування протягом 30хв при -78°С додають розчин 2-фторпіридину (6,23г, 64,2ммоль, 1,0екв.) у безводному THF (50мл). Реакційну суміш перемішують при -78°С протягом 4год. Потім додають 25 79772 йод (16,3г, 64,2ммоль, 1,0екв.) та реакційну суміш перемішують при -78°С протягом ще 30хв. Реакційну суміш гідролізують за допомогою суміші 10% води - THF та розбавляють етилацетатом та водою. Органічний шар промивають водою, розсолом та сушать. Розчинник випарюють за пониженого тиску і неочищений продукт очищають за допомогою РХСТ (колонка Biotage), елююючи за допомогою 20/8020 об/об етилацетат - гексан і одержують 2-фтор-3-йодпіридин у ви гляді жовтого масла (8,50г, 59,4%). 1Н-ЯМР (ацетон-d6) d 8,14 (m, 2Н), 6,94 (m, 1Н); ГХ-МС (М+=223, ЧУ=9,50хв); Rf=0,70 (30% етилацетат - гексан). Приклад 15 Методика Н-8 Одержання 3-йод-2-метоксипіридину До розчину метоксиду натрію (8,0мл, 35,9ммоль, 4,0екв., 25% у метанолі) у метанолі (60мл) додають 2-фтор-3-йодпіридин (2,0г, 8,97ммоль). Реакційну суміш кип'ятять зі зворотним холодильником в атмосфері аргону протягом 1год. Реакційну суміш розбавляють етилацетатом та водою. Органічний шар промивають водою, розсолом та сушать над сульфатом натрію. Розчинник вилучають за пониженого тиску й одержують 1,8г (85,4%) неочищеного продукту у вигляді жовтого масла. 1Н-ЯМР (ацетон-d6) d 8,16 (m, 2H), 6,78 (m, 1Н), 3,93 (s, 3Н); РХ-МС (ЕР МН+=236,2); Rf=0,75 (30% етилацетат - гексан). Приклад 16 Методика Н-9 Одержання (3-йод-піридин-2-іл)-метиламіну До розчину 40% метиламіну у воді (60мл) додають 2-фтор-3-йодпіридин (2,0г, 8,97ммоль) та реакційну суміш кип'ятять зі зворотним холодильником в атмосфері аргону протягом 4год. Охолоджену реакційну суміш розбавляють етилацетатом та водою. Органічний шар промивають водою, розсолом та сушать. Розчинник випарюють за пониженого тиску й одержують 1,70г (81,0 %) неочищеного продукту. 1Н-ЯМР (ацетон-d6) d 8,06 (dd, J=4,8, 1,5Гц, 1Н), 7,89 (dd, J=7,2, 1,8Гц, 1Н), 6,34 (m, 1 Η), 5,60 (broad, s, 1H), 2,94 (d, J=4,5Гц, 3Н); Rf=0,68 (30 % етилацетат - гексан). Приклад 17 Методика Н-10 Одержання (3-бромфеніл)аміду циклопропанкаpбонової кислоти 26 Суміш 3-броманіліну (1,0г, 5,81ммоль), циклопропанкарбонілхлориду (0,61г, 5,81ммоль, 1,0екв.) і триетиламіну (1,17г, 11,6ммоль, 2,0екв.) у безводному THF (20мл) перемішують при кімнатній температурі в атмосфері аргону протягом 16год. Реакційну суміш розбавляють етилацетатом та водою. Органічний шар промивають водою, розсолом та сушать над сульфа том магнію. Розчинник вилучають за пониженого тиску й одержують 1,05г (75,2 %) неочищеного продукту. 1Н-Я МР (ацетон-d6) d 8,60 (broad s, 1Н), 8,07 (dd, J=3,6, 2,1Гц, 1Н), 7,52 (m, 1 Η), 7,22 (m, 2H), 1,73 (m 1H), 0,90 (m, 2H), 0,80 (m, 2H); МС ЕР (МН+=242); Rf=0,46 (30% етилацетат - гексан). Приклад 18 Методика Η-11 Одержання 3-бром-N-(2-метоксіетил)бензолсульфонаміду Розчин 3-бромбензолсульфонілхлориду (1,0г, 3,72ммоль), 2-метоксіетиламіну (0,84г, 11,15ммоль, 3,0екв.), карбонату калію (2,57г, 18,59ммоль, 5,0екв.) в ацетоні (10,0мл) перемішують при 40°С протягом 4год. Реакційну суміш розбавляють етилацетатом, промивають водою, розсолом та сушать над сульфатоммагнію. Розчинник вилучають за пониженого тиску й очищають за допомогою РХСТ (колонка Biotage), елююючи за допомогою суміші 20-25% етилацетат - гексан, і одержують 1,05г (96%) продукту. Rf=0,33 (діоксид кремнію етилацетат:гексани, 3:7); 1Н-ЯМР (DMSO-d6) d 7,94 to 7,76 (m, 4H), 7,54 (t, J=7,9Гц, 1Н), 3,27 (t, J=5,6Гц, 2Н), 3,13 (s, 3Н), 2,93 (q, J=5,6Гц, 2Н). Приклад 19 Методика Н-12 Одержання діетил-(3-йод-бензил)-аміну Розчин 3-бромфенацилброміду (1,0г, 3,20ммоль), діетиламіну (0,70г, 9,60ммоль, 3,0екв.), карбонату калію (1,33г, 9,60ммоль, 3,0екв.) в ацетоні (10,0мл) перемішують при 40°С протягом 4год. Реакційну суміш розбавляють етилацетатом, промивають водою, розсолом та сушать над сульфатом магнію. Розчинник вилучають за пониженого тиску й очищають за допомогою РХСТ (колонка Biotage), елююючи за допомогою суміші 5-8% етилацетат -гексан, і одержують 0,92г (99%) продукту. Rf=0,28 (діоксид кремнію етилацетат:гексани, 1:9); 1Н-ЯМР (DMSO-d6) d 7,66 (bs, 1H), 7,59-7,55 (m, 1Н),7,33-7,29 (m, 1H), 7,10 (t, J=7,8Гц, 1Н), 3,47 (s, 2H), 2,42 (q, J=7,1Гц, 4H), 27 79772 0,95 (t, J=6,9, 6H). Приклад 20 Методика Η-13 Одержання 3-бром-N-метил-бензаміду Суспензію метиламінгідрохлориду (0,9г, 13,40ммоль, 3,0екв.) і триетиламіну (2,26г, 22,33ммоль, 5,0екв.) у безводному метиленхлориді (10мл) охолоджують до 0°С. Охолоджену суспензію обробляють 3-бромбензоїлхлоридом (1,0г, 4,47ммоль), а потім перемішують при кімнатній температурі протягом 4год. Реакційну суміш розбавляють етилацетатом, промивають водою, розсолом та сушать над сульфатом магнію. Розчинник вилучають за пониженого тиску й очищають за допомогою РХСТ (колонка Biotage), елююючи за допомогою суміші 35-45% етилацетат - гексан, і одержують 0,60г (63%) продукту. Rf=0,28 (діоксид кремнію етилацетат:гексани, 2:3); 1Н-ЯМР (D MSOd6) d 8,55 (bs, 1Н), 7,99 (t, J=1,7Гц, 1Н), 7,83 to 7,79 (m, 1H), 7,73 to 7,69 (m, 1H), 7,42 (t, J=8,0Гц, 1Н), 2,77 (d, J=6,7Гц, 3H). Приклад 21 Методика Н-14 Одержання 2-(3-бром-феніл)-ацетаміду Розчин 3-бромфенілацетонітрилу (1,0г, 5,10ммоль) в ацетоні (25мл) та воді (15мл) обробляють перкарбонатом натрію. Реакційну суміш перемішують при 60°С протягом ночі. Органічний розчинник вилучають за пониженого тиску і залишок розбавляють етилацетатом та водою. Шари поділяють і органічний шар промивають розсолом та сушать над сульфатом магнію. Розчинник вилучають за пониженого тиску і залишок промивають за допомогою суміші діетиловий ефір - гексани (1/1, об/об) й одержують 0,65г продукту (60%) у вигляді білої твердої речовини. Rf=0,18 (діоксид кремнію етилацетат:гексани, 3:2); 1Н-ЯМР (D MSOd6) d 7,50 (bs, 1H), 7,46-7,39 (m, 2H), 7,26-7,22 (m, 2H), 6,93 (bs, 1H), 3,37 (s, 2H). Приклад 22 Методика Н-15 Одержання 2-(3-бром-феніл)-пропан-2-олу 28 19,59ммоль, 3екв.) у діетиловому ефірі охолоджують до 0°С і обробляють за допомогою 3бромаацетофенону (1,3г, 6,53ммоль). Реакційну суміш перемішують при кімнатній температурі протягом 4год. Реакційну суміш розбавляють етилацетатом та водою. Шари поділяють і органічний шар промивають за допомогою насиченого розчину бікарбонату натрію, 2н НСІ, розсолу та сушать над сульфатом магнію. Розчинник вилучають за пониженого тиску й очищають за допомогою РХСТ (колонка Biotage), елююючи за допомогою суміші 5-10% етилацетат - гексан, і одержують 1,2г (90%) продукту. Rf=0,22 (діоксид кремнію етилацетат:гексани, 1:9); 1Н-ЯМР (DMSO-d 6) d 7,63 (t, J=1,8Гц, 1Н), 7,45-7,35 (m, 2Н), 7,25 (t, J=7,7, 1H), 5,15 (s, 1H), 1,39 (s, 6H). Загальна методика В: Одержання ціанофенолів, ціанотіофенолів і перетворення на сполуки формули (І) У цих методиках ціанофеноли або тіофеноли (II) одержують з легко доступних фенолів або тіофенолів, потім їх вводять у реакцію сполучення з (III) і одержують продукти формули (І), як це показано на Схемі реакцій для загальної методики В і конкретних прикладах, наведених нижче для цієї методики, де X=О. Схема реакцій для загальної методики В-1 Приклад 23 Методика В-1 Одержання 3-аміно-6-феніл-1-бензофуран-2іл)(2,4-дихлорфеніл)метанону Стадія 1: Одержання вихідної речовини 2ціано-5-фенілфенолу 3н розчин метилмагнійброміду (6,53мл, 29 79772 При перемішуванні до розчину 3-фенілфенолу (10,0г, 58,75ммоль) у безводному тетрагідрофурані (50мл) і безводному дихлоретані (50мл) при 0°С додають 1,0Μ трихлорид бору в дихлорметані (64,6мл, 64,6ммоль, 1,1екв.), а потім метилтіоціанат (4,4мл, 64,6ммоль, 1,1екв.) і хлорид алюмінію (7,83г, 58,75ммоль, 1,0екв.). Реакційну суміш перемішують при кімнатній температурі протягом 2 днів, а потім охолоджують до 0°С. До темнокоричневої реакційної суміші додають 50% водний розчин гідроксиду натрію (150мл), доки значення рН не стане більшим від 10. Отримані жовті двофазні шари перемішують при кип'ятінні зі зворотним холодильником протягом 1год, а потім охолоджують до кімнатної температури. Ці дво фазні шари поділяють і значення рН водного шару доводять до 3 за допомогою 2,0 н хлориду водню (~300мл) при 0°С. Підкислену водну суміш екстрагують етилацетатом (3X400мл) і об'єднані органічні шари сушать (МgSО 4), фільтрують і концентрують за пониженого тиску. Перекристалізація з ефіру-гексану (150мл) дає 2-ціано-5-фенілфенол у вигляді білої твердої речовини (5,81г, 47,2%). 1НЯМР (DMSO-d 6) d 11,20 (s, 1Н), 7,66 (d, J=8,7Гц, 1Н), 7,62-7,59 (m, 2Н), 7,51-7,42 (m, 3Н), 7,22-7,19 (m, 2H), R f=0,08, 25% етилацетат - гексан. Стадія 2: Одержання шуканої сполуки. 3аміно-6-феніл-1-бензофуран-2-іл)(2,4дихлорфеніл)метанону При перемішуванні до розчину 2-ціано-5фенілфенолу, о триманого на стадії 1 (5,71г, 29,25ммоль), і 2-хлор-1-(2,4-дихлорфеніл)етанону (7,19г, 32,17ммоль, 1,1екв.) у безводному Ν,Νдиметилформаміді (50мл) додають карбонат калію (4,85г, 35,1ммоль, 1,2екв.) і жовтогарячу реакційну суміш перемішують при 90°С протягом 17год. Отриману реакційну суміш темного винного кольору виливають у етилацетат (500мл) та воду (300мл). Етилацетатний шар промивають насиченим водним розчином хлориду амонію, водою та розсолом. Органічний шар потім сушать (МgSО4), фільтрують та випарюють у вакуумі. Неочищений продукт очищають на силікагелі (хроматографія на флеш-колонці), елююючи за допомогою суміші 10% етилацетат - гексан, а потім 20 % етилацетат - гексан. Перекристалізація з ефіру - гексану дає бензофуран у вигляді жовтої твердої речовини (7,56г, 67,6%). 1Н-ЯМР (DMSO-d6) d 8,10 (d, J=8,4Гц, 1Н), 7,75 (d, J=3,6Гц, 1H), 7,74 (d, J=3,0Гц, 1 Η), 7,71 (m, 2H), 7,62-7,53 (m, 5H), 7,47-7,35 (m, 3Н); МС РХ-МС (МН+=382); Аналіз: розрахований для C21H13Cl2NO2 : 65,99% Η 3,43% Ν 3,66%, знайдено С 65,70% Η 3,40% Ν 3,72%; температура плавлення (нескорегована) 144-146,5°С. Схема реакцій для загальної методики В-2 30 Приклад 24 Методика В-2а Одержання [3-аміно-6-(2-метилоксазол-4-іл)бензофуран-2-іл]-(2-метоксифеніл)-метанону Стадія 1: Одержання проміжного продукту: 4(3-метоксифеніл)-2-метилоксазолу До розчину 2-бром-3'-метоксіацетофенону (1,9г, 8,1ммоль) у 15мл толуолу додають ацетамід (1,2г, 20,3ммоль, 2,5екв.). Реакційну суміш перемішують при 110°С протягом 40год. Відфільтровують білу тверду речовину і промивають етилацетатом. Фільтрат і промивні розчини випарюють у вакуумі (для зниження температури кипіння додають трохи метанолу). Очищення за допомогою РХСТ (колонка Biotage) дає 1,1г (72%) 4-(3метоксифеніл)-2-метилоксазолу у вигляді ясножовтої рідини. 1Н-ЯМР (СН3ОН-d4) d 8,11 (s, 1Н), 7,25-7,28 (m, 3Н), 6,83-6,86 (m, 1H), 3,82 (s, 3Н), 2,49 (s, 3Н); Rf=0,36, 25% етилацетат - гексан. Стадія 2: Одержання проміжного продукту: 3(2-метилоксазол-4-іл)-фенолу До розчину 4-(3-метоксифеніл)-2метилоксазолу (1,1г, 5,8ммоль), отриманого на стадії 1, у безводному DCM (5мл) на бані з льодом додають 1Μ трибромід бору в DCM (18мл, 31 79772 17,4ммоль, 3екв.). Реакційну суміш перемішують при кімнатній температурі протягом 2год. Суміш виливають у лід та етилацетат. До нього додають близько 50мл 1н NaOH, а потім насичений водний розчин бікарбонату натрію до досягнення рН=8. Відокремлюють органічний шар та водний шар двічі екстрагують за допомогою EtOAc. Органічні шари об'єднують та випарюють у вакуумі. 0,88г (87%) 3-(2-метилоксазол-4-іл)-фенолу одержують у вигляді жовтої твердої речовини. 1Н-ЯМР (СН3ОН-d4) d 8,07 (s, 1Н), 7,22-7,15 (m, 3Н), 6,78 6,75 (m, 1Н), 2,52 (s, 3Н); МС РХ-МС (МН+=176,3); ТШХ Rf=0,15, 25% EtOAc-НЕХ. Стадія 3: Одержання проміжного продукту: 2гідрокси-4-(2-метилоксазол-4-іл)-бензальдегіду До розчину 3-(2-метилоксазол-4-іл)-фенолу (0,88г, 5,0ммоль), отриманого на стадії 2, у безводному ацетонітрилі (20мл) додають хлорид магнію (1,4г, 15ммоль, 3екв.), триетиламін (2,8мл, 20ммоль, 4екв.) і параформальдегід (0,6г, 20ммоль, 4екв.). Реакційну суміш нагрівають зі зворотним холодильником протягом 17год. Вихідна речовина витрачається повністю. Додають трохи води і насичений водний розчин хлориду амонію до рН=7. У цей момент осаджується трохи червоної твердої речовини. Червону тверду речовину відфільтровують і фільтрат 3 рази екстрагують за допомогою EtOAc. Більшу частину червоної твердої речовини розчиняють у МеОН. Екстракти в EtOAc і фільтрат у МеОН об'єдн ують та сушать над сульфатом магнію. Їх випарюють у вакуумі й одержують 2-гідрокси-4-(2-метилоксазол-4-іл)бензальдегід 1,0г (98%) у вигляді жовтої твердої речовини. 1Н-ЯМР (CH3OH-d4) d10,0 (s, 1H), 8,3 (s, 1Н), 7,73 (d, J=8Гц 1H), 7,4 (dd, J=8Гц, 1,6Гц, 1Н), 7,34 (d, J=1,6Гц, 1Н), 2,54 (s, 3Н); ТШХ Rf=0,24, 25% EtOAc-НЕХ. Стадія 4: Одержання проміжного продукту: 2гідрокси-4-(2-метилоксазол-4-іл)-бензонітрилу 32 нують та випарюють у вакуумі. Очи щення за допомогою РХСТ (колонка Biotage) дає 0,2г (20%) 2гідрокси-4-(2-метилоксазол-4-іл)-бензонітрилу у вигляді ясно-жовтої твердої речовини. 1Н-ЯМР (CH3OH-d4) d 8,2 (s, 1H), 7,51 (d, J=8Гц, 1Н), 7,31 (d, J=1,6Гц, 1Н), 7,26 (dd, J=8Гц, 1,6 Гц, 1Н), 2,51 (s, 3Н). Стадія 5: Одержання [3-аміно-6-(2метилоксазол-4-іл)-бензофуран-2-іл]-2метоксифеніл)-метанону До розчину 2-гідрокси-4-(2-метилоксазол-4-іл)бензонітрилу, отриманого на стадії 4 (25мг, 0,12ммоль), і 2-метоксифенацилброміду (31мг, 0,14ммоль, 1,1екв.) у безводному Ν,Νдиметилформаміді (2мл) додають карбонат калію (34мг, 0,25ммоль, 2екв.). Реакційну суміш струшують при 90°С протягом 17год. Суміш охолоджують до кімнатної температури та виливають у етилацетат та воду. Водний шар двічі екстрагують етилацетатом. Органічні шари об'єднують та випарюють у вакуумі. Очищення за допомогою ВЕРХ дає 19мг (43%) [3-аміно-6-(2-метилоксазол-4-іл)бензофуран-2-іл]-(2-метоксифеніл)-метанону у вигляді жовтої твердої речовини. 1Н-ЯМР (СН3ОНd4) d 8,23 (s, 1Н), 7,86 (d, J=8Гц, 1Н), 7,65 - 7,39 (m, 4H), 7,13 (d, J=8Гц, 1H), 7,05 (t, J=7,2Гц, 1Н), 3,82 (s, 3Н), 2,51 (s, ЗН). МС РХ-МС (МН+=349,2); Rf=0,33, 50% EtOAc - HEX. Приклад 25 Методика В-2b Одержання [3-аміно-6-(2-метилтіазол-4-іл)бензофуран-2-іл]-2,4-дихлорфеніл)-метанону Стадія 1: Одержання проміжного продукту: 4(3-метоксифеніл)-2-метилтіазолу До розчину 2-гідрокси-4-(2-метилоксазол-4-іл)бензальдегіду (1г, 4,9ммоль), отриманого на стадії 3, в оцтовій кислоті (5мл) додають нітроетан (0,74г, 9,8ммоль, 2екв.) і ацетат натрію (0,8г, 9,8ммоль, 2екв.). Реакційну суміш нагрівають зі зворотним холодильником протягом 17год. Вихідна речовина витрачається повністю. Додають трохи води і нейтралізують розчин насиченим водним розчином бікарбонату натрію до рН=7. Екстрагують 3 рази за допомогою EtOAc. Екстракти об'єд До розчину 2-бром-3'-метоксіацетофенону (1,0г, 4,4ммоль, 1,2екв.) у 10мл безводного етанолу додають тіоацетамід (0,27г, 3,6ммоль, 1екв.). Відразу ж утворюється деяка кількість твердої речовини. Реакційну суміш перемішують при 80°С протягом 1год. Реакційну суміш охолоджують до кімнатної температури, а потім на невеликий час приміщують у баню з льодом. Білу тверду речови 33 79772 ну відфільтровують, промивають гексаном та сушать у вакуумній сушильній шафі й одержують 0,67г (90%) 4-(3-метоксифеніл)-2-метилтіазолу. 1НЯМР (CH3OH-d4 і трохи DMSO-d 6) d 7,53 (s, 1H), 7,39 (m, 1H), 7,29-7,26 (m, 1Н), 7,18 (m, 1Н), 6,78 (m, 1Н), 3,74 (s, 3Н), 2,91 (s, 3Н); МС РХ-МС МН+=206,3; Rf=0,13, 2% EtOAc-НЕХ. Стадія 2: Одержання проміжного продукту: 3(2-метилтіазол-4-іл)-фенолу Використовують ту саму методику, що і при одержанні 3-(2-метилоксазол-4-іл)-фенолу, описану в Прикладі 24 вище. Вихід 74%. 1Н-ЯМР (CH3OH-d4) d 7,54 (s, 1Н), 7,32-7,19 (m, 3Н), 6,776,74 (m, 1H), 2,76 (s, 3Н); ТШХ Rf=0,57, 50% EtOAcНЕХ. Стадія 3: Одержання проміжного продукту: 2гідрокси-4-(2-метилтіазол-4-іл)-бензальдегіду Використовують ту саму методику, що й описана для одержання 2-гідрокси-4-(2-метилоксазол4-іл)-бензальдегіду. ТШХ Rf=0,71, 50% EtOAc-НЕХ. Неочищений продукт використовують на стадії 4 без додаткового очищення. Стадія 4: Одержання проміжного продукту: 2гідрокси-4-(2-метилтіазол-4-іл)-бензонітрилу для використання при одержанні Використовують ту саму методику, що й описана для одержання проміжного продукту 2гідрокси-4-(2-метилоксазол-4-іл)-бензонітрилу. Сумарний вихід за дві стадії дорівнює 83%. 1НЯМР (CH3OH-d4) d 7,75 (s, 1H), 7,52 (d, J=8,2Гц, 1H), 7,48 (d, J=1,6Гц 1H), 7,42 (dd, J=8,2Гц, 1,6Гц, 1Н), 2,75 (s, 3Н). МС РХ-МС МН+=217,2; Rf=0,18, 30% EtOAc-НЕХ. Стадія 5: Одержання 2-[3-аміно-6-(2метилтіазол-4-іл)-бензофуран-2-іл]-2.4дихлорфеніл)-метанону 34 Використовують ту саму методику, що й описана для одержання сполуки в Прикладі 24, стадія 5, вихід 33%. 1Н-ЯМР (DMSO-d6) d 8,09 (s, 1H), 8,06 (dd, J=8,2Гц, 0,8Гц, 1Н), 7,94 (m, 1Н), 7,89 (dd, J=8,2Гц, 1,2Гц, 1Н), 7,75 (dd, J=2Гц, 0,4Гц, 1Н), 7,59 (dd, 8,2Гц, 0,4Гц, 1Н), 7,55 (dd, J=8,2Гц, 1,6Гц, 1Н), 2,71 (s, 3Н). МС РХ-МС (МН+=403,2/405,2); Rf=0,57, 50% EtOAc - HEX. Приклад 26 Методика В-2с Одержання [3-аміно-6-(1-метил-1Н-піразол-3іл)-бензофуран-2-іл]-(2,4-дихлорфеніл)-метанону Стадія 1: Одержання проміжного продукту: 3(1-метил-1Н-піразол-3-іл)-фенолу 3-Гідроксіацетофенон (1г, 7,3ммоль) та Ν,Νдиметилформаміддиметилацеталь (2,6г, 22ммоль, 3екв.) струшують у посудині об'ємом 40мл при кімнатній температурі протягом 17год. Суміш випарюють у вакуумі й одержують фенол і метиловий ефір фенолу. До розчину цієї суміші в 10мл безводного етанолу додають метилгідразин (1г, 22ммоль, 3екв.). Реакційну суміш стр ушують при 80°С протягом 2год. Суміш випарюють у вакуумі. Трибромід бору (3екв.) у дихлорметані використовують для деметилування метилового простого ефіру, як це описано при одержанні в Прикладі 24, стадія 2. Трохи метилового простого ефіру ще залишається, та суміш використовують на стадії 2 без додаткового очищення. Стадія 2: Одержання проміжного продукту: 2гідрокси-4-(1-метил-1Н-піразол-3-іл)-бензонітрилу Використовують ту саму методику, що й описана для одержання сполуки в Прикладі 24, стадія 3 та стадія 4: 250мг 2-гідрокси-4-(1-метил-1Нпіразол-3-іл)-бензонітрилу і його ізомери, 2гідрокси-6-(1-метил-1Н-піразол-3-іл)-бензонітрилу одержують у вигляді жовтої твердої речовини. Суміш використовують на стадії 3 без додаткового очищення. МС РХ-МС МН +=200,1; ТШХ Rf=0,16, 50% EtOAc-НЕХ. Стадія 3: Одержання [3-аміно-6-(1-метил-1Нпіразол-3-іл)-бензофуран-2-іл]-(2,4-дихлорфеніл)метанону 35 79772 36 J=5,1Гц, 1,5Гц, 1Н), 8,18 (dt, J=8,0Гц, 2,1Гц, 1Н), 8,86 (d, J=7,8Гц, 1Н), 7,68 (d, J=1,2Гц, 1Н), 7,567,32 (m,7H), 5,42 (s, 2H); РХ-МС (ЕР МН+=287, ЧУ=2,39хв); Rf=0,08 (25% етилацетат - гексан). Стадія 2: Одержання вихідної речовини: 2гідрокси-4-(піридин-3-іл-рбензонітрилу Використовують ту саму методику, що й описана для одержання сполуки в Прикладі 24, стадія 5. [3-аміно-6-(1-метил-1Н-піразол-3-іл)бензофуран-2-іл]-(2,4-дихлорфеніл)-метанон одержують у вигляді ясно-жовтої твердої речовини. Вихід становить 12%. 1Н-ЯМР (CDCI3) d 7,7-7,8 (m, 2Н), 7,60 (d, J=10,8Гц, 1H), 7,51-7,48 (m, 2Н), 7,387,33 (m, 2Н), 6,55 (d, J=3,2Гц, 1Н), 5,99 (broad, s, 2H); 3,94 (s, 3Н). МС РХ-МС МН +=386,2/388,2; ТШХ Rf=0,3, 50% EtOAc - HEX. Схема реакцій для загальної методики В-3 Приклад 27 Методика В-3 Одержання (3-аміно-6-піридин-3ілбензофуран-2-іл)-(2-метоксифеніл)-метанону Стадія 1: Одержання вихідної речовини. 2бензилокси-4-піридин-3-іл-бензонітрилу Цю сполуку одержують з 2-бензилокси-4йодбензонітрилу (2,0г, 5,97ммоль) у спосіб, описаний для [3-аміно-6-(піридин-3-іл)-1-бензофуран-2іл](2,4-дихлорфеніл)метанону, й одержують 1,42г (83%) жовтувато-коричневої твердої речовини. 1НЯМР (DMSO-d6) d 8,98 (d, J=1,8Гц, 1Н), 8,64 (dd, У суху колбу, до якої приміщений 10% Pd/C (160,0мг, 0,56ммоль, 0,2екв.), додають розчин 2бензилокси-4-піридин-3-іл-бензонітрилу (800,0мг, 2,79ммоль) у суміші 1:1 об/об етилацетат - етанол (28,0мл). Реакційну суміш гідр ують в а тмосфері водню, що подається з приєднаного балону, протягом 16год. Реакційну суміш фільтрують крізь шар целіту і фільтрат концентрують та одержують 536,4мг (97,8%) білої твердої речовини. 1Н-ЯМР (DMSO-d6) d 11,21 (broads, 1Η), 8,82 (dd, J=2,4Гц, 0,6Гц, 1Η), 8,61 (dd, J=5,1Гц, 1,8Гц, 1H), 8,02 (ddd, J=7,8Гц, 2,1Гц, 1,2Гц, 1Н), 7,71 (d, J=8,4Гц, 1Н), 7,50 (ddd, J=8,1Гц, 4,5Гц, 0,6Гц, 1Н), 7,27-7,22 (m, 2H); РХ-МС (ЕР МН+=197, ЧУ=0,97мін); Rf=0,16 (75% етилацетат - гексан). Стадія 3: Одержання шуканої сполуки, (3аміно-6-піридин-3-ілбензофуран-2-іл)-(2метоксифеніл)-метанону При перемішуванні до розчину 2-гідрокси-4(піридин-3-іл)бензонітрилу (60,0мг, 0,31ммоль) і 2бром-2'-метоксіацетофенону (70,1мг, 0,31ммоль, 1,0екв.) у безводному N,N-диметилформаміді (5,0мл) додають карбонат калію (84,5мг, 0,62ммоль, 2,0екв.) і жовтогарячу реакційну суміш перемішують при 80°С протягом 17год. Отриману реакційну суміш темного винного кольору виливають у е тилацетат (100мл) та воду (50мл). Етилацетатний шар промивають насиченим водним розчином хлориду амонію, водою та розсолом. Органічний шар потім сушать над суль фатом натрію, фільтрують та випарюють за пониженого тиску. Неочищений продукт очищають за допомогою РХСТ (колонка Biotage), елююючи за допомогою 50% етилацетат - гексан. Перекристалізація із суміші ефір - гексан дає бензофуран у вигляді жовтої твердої речовини (24,4мг, 23,2%). 1Н-ЯМР (ацетон-d6) d 8,98 (d, J=1,5Гц, 1Н), 8,60 (dd, J=7,2, 1,5Гц, 1Н), 8,12 (m, 2Н), 7,70 (d, J=1,5Гц, 1Н), 7,65 (dd, J=6,3, 0,9Гц, 1Н), 7,52-7,41 (m, 3Н), 7,17 (d, J=7,5Гц, 1Н), 7,06 (t, J=6,6Гц, 1Н), 6,84 (broad, s, 2H), 2,85 (s, 3Н); РХ-МС (ЕР МН +=345, ЧУ=1,97хв). Приклад 28 Методика В-4 Одержання N-{3-[3-аміно-2-(2,4дихлорбензоїл)-бензофуран-6-іл]-піридин-1-ил} 37 79772 пропіонаміду 38 гексан, і одержують 980мг (89,2%) жовтої твердої речовини як продукт. 1Н-ЯМР (ацетон-d6) d 7,76 (m, 2Н), 7,69 (m, 1Н), 7,64-7,55 (m, 4Н), 7,48-7,36 (m, 5Н), 5,45 (s, 2Н), 2,61 (q, J=6,9Гц, 4Н), 1,05 (t, J=6,6Гц, 6Н); Rf=0,42 (30% етилацетат - гексан). Стадія 3: Одержання N-(4'-ціано-3'-гідроксибіфеніл-3-іл)-N-пропіоніл-пропіонаміду Стадія 1: Одержання 3'-аміно-3-бензилоксибіфеніл-4-карбонітрилу Розчин 2-(бензилокси)-4-йодбензонітрилу (6,20г, 18,5ммоль) у 1,2-диметоксіетані дегазують аргоном протягом 30хв. У цей момент додають тетракіс(трифенілфосфін)паладій(0), (2,13г, 1,85ммоль, 0,1екв.), а потім 3-амінофенілборонову кислоту (2,53мг, 18,5ммоль, 1,0екв.) і 2Μ водний розчин Na2СО3 (4,0мл). Реакційну суміш продувають аргоном протягом ще 10хв, а потім нагрівають при 80°С протягом ночі (18год). Реакційну суміш розбавляють етилацетатом, промивають водою, розсолом та сушать над сульфатом магнію. Розчинник вилучають за пониженого тиску й очищають за допомогою РХСТ (колонка Biotage), елююючи за допомогою суміші 30% етилацетат - гексан, і одержують 3,33г (59,9%) жовтої твердої речовини як продукт. 1Н-ЯМР (ацетон) d 7,71 (d, J=8,1Гц, 1Н), 7,58 (m, 2H), 7,48-7,30 (m, 5Η), 7,18 (m, 1H), 6,99 (m, 1H), 6,90 (m, 1H), 6,76 (m, 1H), 5,44 (s, 2H), 4,81 (broad, s, 2H); Rf=0,32 (30% етилацетат - гексан). Стадія 2: Одержання N-(3'-бензилокси-4'ціано-біфеніл-3-іл)-N-пропіоніл-пропіонаміду До розчину 3'-аміно-3-бензилокси-біфеніл-4карбонітрилу (800мг, 2,66ммоль) у дихлорметані (100мл) при 0°С краплями додають пропіонілхлорид (370мг, 4,00ммоль, 1,5екв.), а потім триетиламін (405мг, 4,00ммоль, 1,5екв.). Реакційну суміш перемішують при 0°С в атмосфері аргону протягом 1год. Реакційну суміш концентрують і залишок розчиняють в етилацетаті. Органічний шар промивають водою, розсолом та сушать над сульфатом магнію. Розчинник вилучають за пониженого тиску й очищають за допомогою РХСТ (колонка Biotage), елююючи за допомогою суміші 30% етилацетат У суху колбу, до якої приміщений 10% Pd/C (124,0мг, 0,13екв.), додають розчин N-(3'бензилокси-4'-ціано-біфеніл-3-іл)-N-пропіонілпропіонаміду (980мг, 2,38ммоль) у суміші 1:1 об/об етилацетат - етанол (10мл). Реакційну суміш гідрують в атмосфері водню, що подається з приєднаного балону, протягом 24год. Реакційну суміш фільтрують крізь шар целіту і фільтрат концентрують. Очищення за допомогою РХСТ (колонка Biotage) при елююванні за допомогою суміші 30% етилацетат - гексан дає 332мг (43,4%) продукту. 1 Н-ЯМР (ацетон-d6) d 9,95 (broad s, 1H), 7,75-7,58 (m, 4H), 7,35 (m, 3Н), 2,61 (q, J=7,2Гц, 4Н), 1,05 (t, J=7,2Гц, 6Н); РХ-МС (ЕР МН+=323) Rf=0,20 (30% етилацетат - гексан). Стадія 4: Одержання шуканих сполук: N-{3-[3аміно-2-(2,4-дихлорбензоїл)-бензофуран-6-іл]феніл}-N-пропіоніл-пропіонамід До N-(4'-ціано-3'-гідрокси-біфеніл-3-іл)-Nпропіоніл-пропіонаміду (70,0мг, 0,22ммоль) і 2, 2',4'-трихлорацетофенону (48,5мг, 0,22ммоль, 1,0екв.) у безводному N,N-диметилформаміді (5мл) додають карбонат калію (60,0мг, 0,43ммоль, 2,0екв.). Реакційну суміш перемішують в атмосфері аргону при 80°С протягом 16год. Коричневу реакційну суміш охолоджують та розбавляють етилацетатом та водою. Органічний шар промивають насиченим водним розчином хлориду амонію, водою, розсолом та сушать над сульфатом натрію. Розчинник випарюють за пониженого тиску і неочищений продукт очищають за допомогою РХСТ (колонка Biotage), елююючи за допомогою суміші 20% етилацетат - гексан, і одержують 39,6мг (35,8%) продукту. 1Н-ЯМР (ацетон-d6) d 8,10 (d, J=8,4Гц, 1Н), 7,83 (d, J=6,3Гц, 1Н), 7,72-7,53 (m, 7Η), 7,30 (m, 1H), 7,08 (broad, s, 2H), 2,63 (q, J=7,2Гц, 4H), 1,04 (t, J=7,2Гц, 6Н); MC EP (MH+=509); Rf=0,25 (30% етилацетат - гексан). 39 79772 Стадія 5: Одержання N-{3-[3-аміно-2-(2,4дихлорбензоїл)-бензофуран-6-іл]-піридин-1-ил}пропіонаміду До N-{3-[3-аміно-2-(2,4-дихлорбензоїл)бензофуран-6-іл]-феніл}-N-пропіоніл-пропіонаміду (230мг, 0,45ммоль) у безводному THF (5мл) додають 2 н водний розчин NaOH (0,46мл, 0,90ммоль, 2,0екв.). Реакційну суміш перемішують при кип'я тінні зі зворотним холодильником протягом 16год. Реакційну суміш розбавляють етилацетатом та водою. Органічний шар промивають насиченим водним розчином хлориду амонію, водою, розсолом та суша ть над сульфатом натрію. Розчинник випарюють за пониженого тиску і неочищений продукт очищають за допомогою РХСТ (колонка Biotage), елююючи за допомогою суміші 20% етилацетат - гексан, і одержують 161мг (78,4%) жовтої твердої речовини. 1Н-ЯМР (ацетоні) d 9,02 (broad s, 1H), 8,00 (m, 1Н), 7,95 (d, J=6,9Гц, 1Η), 7,53-7,40 (m, 6H), 7,28 (m, 2H), 6,96 (broad s, 2H), 2,26 (q, J=7,8Гц, 2Н), 1,04 (t, J=4,5Гц, 3Н); MC EP (MH+=453); Rf=0,28 (30% етилацетат - гексан). Приклад 29 Методика В-5 Приклад - [3-аміно-6-(4-метилтіоФен-3-іл)бензофуран-2-іл]-2,4-дихлорфеніл)-метанон Стадія 1: Одержання метилтіофен-3-іл)-бензонітрилу 2-гідрокси-4-(4 4-Бром-2-метокси-бензонітрил (2,4г, 11,32ммоль) розчиняють у DMF (25мл). До цього розчину додають біс(пінаколато)дибор (3г, 11,88ммоль), ацетат паладію(ІІ) (0,76г, 0,34ммоль) і ацетат калію (3,3г, 34ммоль). Цю суміш дегазують шляхом продування за допомогою Аr протягом 15хв і нагрівають при 80°С протягом 5год. До суміші потім додають 3-бром-4-метилтіофен (1,8г, 10,2ммоль), карбонат цезію (5,53г, 17ммоль) і тетракіс(трифенілфосфін)паладій(0). Розчин перемішують протягом 18год при 80°С. Реакційну суміш 40 виливають у суміш етилацетат:вода (1:1, 200:200мл). Органічний шар відділяють і додаткову кількість продукту екстрагують за допомогою EtOAc (3X200мл). Органічні шари об'єднують, промивають розсолом (100мл) та сушать над сульфатом натрію. Органічний шар концентрують у вакуумі і неочищений продукт розчиняють у метиленхлориді (2,5мл) та охолоджують до 0°С. Додають хлорид алюмінію (0,726г, 5,45ммоль) та розчин перемішують протягом 5хв. Потім додають етантіол (0,339г, 5,45ммоль) та розчин перемішують протягом 2год при кімнатній температурі. Додають воду (10мл) для припинення реакції і продукт екстрагують з водного шару за допомогою метиленхлориду (3X20мл). Органічні шари об'єднують та сушать над сульфа том натрію. Органічний розчин потім концентрують у вакуумі. Флешхроматографія (10% EtOAc:HEX®30% EtOAc:Hex) дає 0,231г (9,75%) 2-гідрокси-4-(4-метил-тіофен-3іл)-бензонітрилу. 1Н-Я МР (метиленхлориді) d 7,56 (d, J=8,5Гц, 1Н), 7,31 (d, J=4,2Гц, 1Н), 7,25-7,03 (m, 4H), 2,29 (s, 3Н). РХ-МС ЧУ: 3,34хв, [М+Н ]+: 216,1, Стадія 2: Одержання [3-аміно-6(4-метилтіофен-3-іл)-бензофуран-2-іл]-2,4дихлорфенілУметанону При перемішуванні до розчину 2-гідрокси-4-(4метил-тіофен-3-іл)-бензонітрилу, отриманого на стадії 1 (0,050г, 0,23ммоль), і 2-бром-1-(2-хлор-4фтор феніл)-етанону (0,071г, 0,28ммоль, 1,2екв.) у безводному Ν,Ν-диметилформаміді (2мл) додають карбонат калію (0,048г, 0,35ммоль, 1,5екв.) і жовтогарячу реакційну суміш перемішують при 80°С протягом 18год. Отриману реакційну суміш темного винного кольору виливають у етилацетат (5мл) та воду (5мл). Етилацетатний шар промивають водою та розсолом. Органічний шар потім сушать (МgSО4), фільтрують та випарюють у вакуумі. Неочищений продукт розчиняють в ацетонітрилі (2мл) і очищають за допомогою ВЕРХ (10% ацетонітрил:вода®90% ацетонітрил:вода). Бензофуран збирають у вигляді жовтої твердої речовини (0,066г, 40,0%). 1Н-ЯМР (CD2CI 2) d 7,72 (d, J=7,6Гц, 1Н), 7,63-7,584 (m, 1H), 7,38-7,30 (m, 4 Η), 7,187,09 (m, 2Η), 6,05 (s, 2 Η), 2,30 (s, 3Η); МС РХ-МС (МН+=386,2), ЧУ=4,12хв. Додаткові сполуки, наведені нижче в таблиці 1, одержують так, як це описано вище, вибираючи відповідні вихідні речовини, що легко доступні і/або синтез яких описаний у цьому винаході, та використовують способи Методик А і/або В, описані вище, або інші стандартні хімічні методики, відомі в цій галузі техніки. 41 79772 Таблиця 1 Приклади сполук, синтезованих за методикою В 42 215, детектором з діодною матрицею Gilson, колонкою YMC Pro C-18 (2x23мм, 120 А) і квадрупольним мас-спектрометром Micromass LCZ з ординарним фокусуванням з іонізацією електророзпиленням по z-напрямку. Спектри сканують у діапазоні 120-1000ат. од. маси протягом 2с. Дані, отримані детектором ВДСР (випарний детектор по світлорозсіюванню), також приймаються по аналоговому каналу. Елюювання в градієнтному режимі проводять за допомогою Буферного розчину А, що являє собою 2% розчин ацетонітрилу у воді з додаванням 0,02% TFA, і Буферного розчину В, що являє собою 2% розчин води в ацетонітрилі з додаванням 0,02% TFA, зі швидкістю, яка дорівнює 1,5мл/хв. Зразки елююють у такий спосіб: 90% А протягом 0,5хв, з переходом до 95% В протягом 3,5хв і підтримуванням 95% В протягом 0,5хв, а потім колонку повертають у вихідний стан протягом 0,1хв. Повний час аналізу складає 4,8хв. **прод. означає - наявна у продажу. Загальна методика С: Одержання сполук Формули (l) через 6-йод-бензофурани (IV) Наведене на Схемі реакцій для загальної методики С нижче являє собою застосовну в загальному випадку методику одержання сполук формули (І) через проміжні продукти формул (IV) і (V). Конденсація належним чином заміщеного 2-ціано5-йодфенолу (II) і 1-арил-2-галогенетанону (III) у лужному середовищі (такому як карбонат цезію, карбонат калію, карбонат натрію, DBU), у розчиннику, такому як DMF, MeCN, при температурах від кімнатної до 100°С дає 6-йодбензофуран (IV). Каталізовані паладієм реакції сполучення між (IV) і арилбороновими кислотами або боронатами (VI) дають шукані сполуки. Альтернативно, 6-йодбензофуран (IV) перетворюють на боронат (V), який потім використовують для одержання шуканих сполук шляхом сполучення з арилгалогенідами (VII) при каталізі паладієм. Схема реакцій для загальної методики С Виноски: *Нижче описані умови проведення РХМС: ВЕРХ - мас-спектри з електророзпиленням (ВЕРХ ЕР-МС) одержували з використанням системи ВЕРХ Gilson з двома насосами Gilson 306, автоматичним пробовідбірником Gilson Приклад 44 Методика С-1а Одержання [3-аміно-6-(3-піридиніл)-1бензофуран-2-іл](2,4-дихлорфеніл)метанону 43 79772 Стадія 1: Одержання вихідної речовини: 2ціано-5-йодфенол При перемішуванні до розчину 3-йодфенолу (20,0г, 90,9ммоль) у безводному дихлоретані (60мл) при 0°С додають 1,0Μ трихлорид бору в дихлорметані (100мл, 100,0ммоль, 1,1екв.), а потім метилтіоціанат (6,85мл, 100,0ммоль, 1,1екв.) і хлорид алюмінію (12,1г, 90,9ммоль, 1,0екв.). Реакційну суміш перемішують при кімнатній температурі протягом 3 днів, а потім охолоджують до 0°С. До темно-коричневої реакційної суміші додають 50% водний розчин гідроксиду натрію (150мл) до рН 11. Отримані жовті двофазні шари перемішують при кип'ятінні зі зворотним холодильником протягом 3год, а потім охолоджують до кімнатної температури. Двофазні шари поділяють і значення рН водного шару доводять до 1 за допомогою 50% водного розчину хлориду водню при 0°С. Підкислену водну суміш екстрагують етилацетатом (3X400мл) й об'єднані органічні шари сушать (Na2SO4), фільтрують і концентрують за пониженого тиску. Перекристалізація із суміші ефір-гексан (200мл) дає 2-ціано-5-йодфенол у вигляді білої твердої речовини (14,8г, 66,4%). 1Н-ЯМР (DMSOd6) d 11,43 (s, 1H), 7,38-7,36 (m, 2Н), 7,29 (dd, J=8,4, 1,5Гц, 1Н); МС ГХ-МС (М+=245; ЧУ=7,45хв); Rf=0,16, 25% етилацетат - гексан. Стадія 2: Одержання проміжного продукту: (3аміно-6-йод-1-бензофуран-2-іл)(2,4дихлорфеніл)метанону При перемішуванні до розчину 2-ціано-5йодфенолу (3,68г, 15,0ммоль) і 2,2',4'трихлорацетофенону (4,02г, 18,0ммоль, 1,2екв.) у безводному Ν,Ν-диметилформаміді (15мл) додають карбонат калію (3,11г, 22,5ммоль, 1,5екв.) і жовтогарячу реакційну суміш перемішують при 80°С протягом 16год. Отриману реакційну суміш темного винного кольору виливають у етилацетат (500мл) та воду (300мл). Етилацетатний шар промивають насиченим водним розчином хлориду амонію, водою та розсолом. Органічний шар потім сушать (Na2SO4), фільтрують та випарюють за пониженого тиску. Неочищений продукт очищають 44 за допомогою РХСТ (колонка Biotage), елююючи за допомогою суміші 20% етилацетат - гексан. Перекристалізація із суміші дихлорметан - гексан дає бензофуран у вигляді жовтої твердої речовини (6,16г, 95,0%). 1Н-ЯМР (DMSO-d6) d 7,88 (d, J=1,2Гц, 1Н), 7,82 (d, J=8,4Гц, 1H), 7,74 (dd, J=1,5, 0,9Гц, 1 Η), 7,61 (dd, J=8,4, 1,5Гц, 1Н), 7,55 -7,51 (m, 4H); РХ-МС (ЕР МН+=432/434). Стадія 3: Одержання шуканої сполуки: [3аміно-6-(3-піридиніл)-1-бензофуран-2-іл](2,4дихлорфеніл)метанону Розчин (3-аміно-6-йод-1-бензофуран-2-іл)(2,4дихлорфеніл)метанону (2,0г, 4,63ммоль) у толуолі (10мл) й етанолі (10мл) дегазують аргоном протягом 10хв. У цей момент додають піридин-3боронову кислоту (740мг, 6,02ммоль, 1,3екв.), а потім [1,1'-біс(дифенілфосфінофероцен]дихлорпаладієвий(ІІ) комплекс із дихлорметаном (1:1) (378мг, 0,46ммоль, 0,1екв.) і 2Μ водний розчин Na2СО3 (11,6мл). Реакційну суміш продувають аргоном протягом ще 10хв, а потім нагрівають при 80°С протягом ночі. Реакційну суміш розбавляють етилацетатом, промивають водою, розсолом та суша ть над сульфатом магнію. Розчинник вилучають за пониженого тиску й очищають за допомогою РХСТ (колонка Biotage), елююючи за допомогою суміші від 45 до 65% етилацетат - гексан, і одержують 1,69г (95,3%) жовтої твердої речовини як продукт. 1Н-ЯМР (D MSO-d6) d 8,95 (d, J=2,4Гц, 1Н), 8,56 (dd, J=4,5, 1,5Гц, 1Н), 8,14 (d, J=8,4Гц, 2 Η), 7,83 (s, 1H), 7,76 (d, J=1,8Гц, 1Н), 7,66 (dd, J=8,1, 1,2Гц, 1Н), 7,58-7,53 (m, 4H), 7,47 (dd, J=8,4, 4,8Гц, 1Н); РХ-МС (ЕР МН+=383/385, ЧУ=2,58мін). Аналіз: розраховано для C20H12CI2N2O 2: С 62,68% Η 3,16% N 7,31%, знайдено С 62,41% Η 3,18% Ν 7,23%. Приклад 45а Методика С-1b Одержання (3-аміно-5-фтор-6-піридин-3ілбензофуран-2-іл)-2,4-дихлорфеніл)-метанону Стадія 1: Одержання вихідної речовини: 4аміно-2-бензилокси-5-фторбензонітрилу Суміш 4-аміно-2, 5-дифторбензонітрилу 45 79772 (500мг, 3,24ммоль), бензилового спирту (385,9мг, 3,57ммоль, 1,1екв.), карбонату калію (896,2мг, 6,49ммоль, 2,0екв.) і молекулярних сит з розміром пір 4 ангстреми (500мг), у безводному N,Nдиметилформаміді (6,5мл) перемішують при 100°С в атмосфері аргону протягом 24год. Реакційну суміш розбавляють етилацетатом, промивають водою, розсолом та сушать над сульфатом натрію. Розчинник вилучають за пониженого тиску і неочищену речовину очищають за допомогою РХСТ (колонка Biotage), елююючи за допомогою суміші 15% етилацетат - гексан, і одержують 155,0мг (19,7%) продукту. 1Н-ЯМР (D MSO-d6) d 7,42-7,32 (m, 6Н), 6,49 (d, J=7,5Гц, 1H), 6,27 (broad s, 2H), 5,09 (s, 2H); PX-MC (ЕР МН+=243, ЧУ=2,75хв); Rf=0,27 (25% етилацетат - гексан). Стадія 2: Одержання вихідної речовини: 5фтор-2-гідрокси-4-йодбензонітрилу До суспензії 4-аміно-2-бензилокси-5фторбензонітрилу (155,0мг, 0,64ммоль) у концентрованому водному розчині НСІ (2,6мл) при 0°С додають нітрит натрію (66,2мг, 0,96ммоль, 1,5екв.), розчинений у воді (1,0мл). Після перемішування при 0°С протягом 1год, додають розчин йодиду калію (159,3мг, 0,96ммоль, 1,5екв.) у воді (5,1мл) та реакційну суміш перемішують при температурі навколишнього середовища протягом 3 днів. Реакційну суміш розбавляють етилацетатом, промивають водою, розсолом та сушать над сульфатом натрію. Розчинник вилучають за пониженого тиску і неочищену речовину очи щають за допомогою РХСТ (колонка Biotage), елююючи за допомогою суміші 25% етилацетат - гексан, і одержують 63,0мг (37,4%) продукту. 1Н-ЯМР (D MSOd6) d 10,20 (broad s, 1H), 7,54 (d, J=5,1Гц, 1Н), 7,47 (d, J=7,2Гц, 1Н); Rf=0,16 (25% етилацетат - гексан). Стадія 3: Одержання вихідної речовини: 3аміно-6-йод-1-бензофуран-2-іл)(2,4-дихлорфеніл)метанону При перемішуванні до розчину 5-фтор-2гідрокси-4-йодбензонітрилу (60мг, 0,23ммоль) і 2,2',4'-трихлорацетофенону (76,5мг, 0,34ммоль, 1,5екв.) у безводному N,N-диметилформаміді (3,3мл) додають карбонат калію (47,3мг, 0,34ммоль, 1,5екв.) і жовтогарячу реакційну суміш перемішують при 80°С протягом 16год. Отриману реакційну суміш темного винного кольору виливають у е тилацетат (100мл) та воду (50мл). Етилацетатний шар промивають насиченим водним розчином хлориду амонію, водою та розсолом. Органічний шар потім сушать над суль фатом натрію, фільтрують та випарюють за пониженого 46 тиску. Неочищений продукт очищають за допомогою РХСТ (колонка Biotage), елююючи за допомогою суміші 15% етилацетат - гексан, і одержують 41,0мг (39,9%) продукту. 1Н-ЯМР (ацетон-d6) d 7,95 (d, J=4,5Гц, 1Н), 7,83 (d, J=7,5Гц, 1Н), 7,65 (d, J=2,1Гц, 1Н), 7,61 (s, 1Н), 7,56 (d, J=1,8Гц, 1H), 7,00 (broad s, 2H); PX-MC (ЕР МН+=450, ЧУ=3,78хв); Rf=0,39 (25% етилацетат - гексан). Стадія 4: Одержання шуканої сполуки: (3аміно-5-фтор-6-піридин-3-ілбензофуран-2-іл)-2,4дихлорфеніл)-метанону Цю сполуку одержують з (3-аміно-6-йод-1бензофуран-2-іл)(2,4-дихлорфеніл)метанону (38,0мг, 0,08ммоль) у спосіб, описаний для [3аміно-6-(піридин-3-іл)-1-бензофуран-2-іл](2,4дихлорфеніл)метанону, і одержують 13,0мг (38,4%) продукту. 1Н-ЯМР (ацетон-d6) d 8,84 (t, J=1,8Гц, 1Н), 8,64 (dd, J=4,8Гц, 1,5Гц, 1Н), 8,068,01 (m, 1Н), 7,92 (d, J=10,2Гц, 1Н), 7,66 (d, J=1,8Гц, 1Н), 7,63 (s, 1Н), 7,62 (d, J=6,0Гц, 1Н), 7,56 (dd, J=8,1Гц, 2,1Гц, 1Н), 7,45 (ddd, J=7,2Гц, 4,8Гц, 0,9Гц, 1Н), 7,05 (broad s, 2H); РХ-МС (ЕР МН+=401, ЧУ=2,66хв). В описану вище методику стадії 3 можуть бути внесені невеликі зміни щодо паладієвого каталізатора, який використовується при каталізованих паладієм реакціях сполучення, як це показує наведений нижче приклад: Приклад 45b Одержання [3-аміно-6-(2-метил-феніл)бензофуран-2-іл]-(2,4-дихлорфеніл)-метанону У посудину об'ємом 7 мл при перемішуванні приміщують 75мг (0,17ммоль, 1екв.) (3-аміно-6йод-1-бензофуран-2-іл)(2,4-дихлорфеніл)метанону в 2,5мл дегазованого аргоном DME. До нього додають 10мг (0,01ммоль, 0,05екв.) Pd(PPh3)4 та посудину стр ушують протягом 5хв. У цей момент додають 29,1мг (0,21ммоль, 1,2екв.) 2метилфенілборонової кислоти і 0,43мл (0,43ммоль, 2,5екв.) 1Μ Nа2СО3 та реакційну суміш струшують при 80°С протягом ночі в атмосфері аргону. Потім леткі речовини вилучають і залишок очищають за допомогою препаративної ТШХ (25% EtOAc/Нех) і одержують 42,9мг (62%) шуканого продукту у вигляді жовтої твердої речовини. 1НЯМР (DMSO-d6) d 7,91 (d, 1H), 7,63 (d, 1H), 7,56 (d, 1H), 7,49 (dd, 1H), 7,34-7,24 (m, 8Н), 2,28 (s, 3Н), РХ-МС (з іонізацією за допомогою ЕР МН +=396,3, ЧУ=3,86хв), ТШХ Rf=0,48 (25% EtOAc/Нех). 47 79772 Приклад 46 Методика С-2: Одержання [3-аміно-6-(2-метил-3-піридиніл)-1бензофуран-2-іл](2,4-дихлорфеніл)-метанону Стадія 1: Одержання вихідної речовини: [3аміно-6-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2іл)-1-бензофуран-2-іл](2,4-дихлорфеніл)метанону 48 міш розбавляють етилацетатом, промивають водою, розсолом та суша ть над сульфатом магнію. Розчинник вилучають за пониженого тиску й очищають за допомогою РХСТ (колонка Biotage), елююючи за допомогою суміші від 45 до 65% етилацетат - гексан, і одержують 23мг (38,5%) жовтої твердої речовини як продукт. 1Н-ЯМР (D MSO-d6) d 8,46 (dd, J=4,5, 1,5Гц, 1Н), 8,11 (d, J=8,4Гц, 1H), 7,75 (d, J=2,1Гц, 1Η), 7,64-7,56 (m, 5H), 7,46 (s, 1H), 7,31-7,27 (m, 2Н), 2,41 (s, 3Н); РХ-МС (ЕР МН+=397/399, ЧУ=2,34хв). Додаткові сполуки, наведені нижче в таблиці 2, одержують у спосіб, аналогічний описаному вище, вибираючи відповідні вихідні речовини, які легко доступні і/або синтез яких описаний у цьому винаході, та використовуючи способи, описані вище, або інші стандартні хімічні методики, відомі у цій галузі техніки. Таблиця 2 Розчин (3-аміно-6-йод-1-бензофуран-2-іл)(2,4дихлорфеніл)метанону (225мг, 0,52ммоль) у 1,4діоксані (2,6мл) дегазують аргоном протягом 30хв. У цей момент додають [1,1'-біс(дифенілфосфіно)фероцен]дихлорпаладій (II), комплекс із дихлорметаном (1:1) (12,8мг, 0,02ммоль, 0,03екв.), а потім триетиламін (0,22мл, 1,56ммоль, 3,0екв.) і пінаколборан (0,13мл, 0,89ммоль, 1,7екв.). Реакційну суміш продувають аргоном протягом ще 10хв, а потім нагрівають при 80°С протягом ночі. Реакційну суміш розбавляють етилацетатом, промивають водою, розсолом та сушать над сульфатом натрію. Розчинник вилучають за пониженого тиску й очищають за допомогою РХСТ (колонка Biotage), елююючи за допомогою суміші 15% етилацетат гексан, і одержують 154,5мг (68,7%) жовтогарячого спіненої речовини. 1Н-ЯМР (DMSO-d6) d 8,05 (d, J=7,8Гц, 1 Η), 7,76 (d, J=2,4Гц, 1Η), 7,58-7,48 (m, 6 Η), 1,28 (s, 12H); РХ-МС (ЕР МН+=432/434, ЧУ=3,97мін). Стадія 2: Одержання шуканої сполуки: [3аміно-6-(2-метил-3-піридиніл)-1-бензофуран-2іл](2,4-дихлорфеніл)метанону Розчин [3-аміно-6-(4,4,5,5-тетраметил-1,3,2діоксаборолан-2-іл)-1-бензо-фуран-2-іл](2,4дихлорфеніл)метанону (65мг, 0,15ммоль) у толуолі (1,0мл) і етанолі (1,0мл) дегазують аргоном протягом 30хв. У цей момент додають 3-бром-2метилпіридин (33,6мг, 0,20ммоль, 1,3екв.), а потім [1,1'-біс(дифенілфосфінофероцен]дихлорпаладієвий(ІІ) комплекс із дихлорметаном (1:1) (12,3мг, 0,02ммоль, 0,1екв.) і 2Μ водний розчин Na2СО3 (0,38мл). Реакційну суміш продувають аргоном протягом ще 15хв, а потім нагрівають при 80°С протягом ночі. Реакційну су Приклади сполук Формули (1), синтезованих за загальною методикою С 49 79772 50 51 79772 52 53 79772 54 55 79772 56 трьох простих хімічних перетворень (див. опис експерименту), як це показано нижче на Схемі реакцій. Каталізовані паладієм реакції сполучення між (VIII) і арилбороновими кислотами або боронатами (VI) дають шукані сполуки формули (І). Альтернативно, 6-бромбензофуран (VIII) перетворюють на боронат (V), який потім використовують для одержання шуканих сполук шляхом сполучення з арилгалогенідами (VII) при каталізі паладієм. Схема реакцій для загальних методик D-1 і D-2 Виноски: *Нижче описані умови проведення РХМС: ВЕРХ - мас-спектри з електророзпиленням (ВЕРХ ЕР-МС) одержували з використанням системи ВЕРХ Gilson3 двома насосами Gilson 306, автоматичним пробовідбірником Gilson 215, детектором з діодною матрицею Gilson, колонкою YMC Pro C-18 (2x23мм, 120 А) і квадрупольним мас-спектрометром Micromass LCZ з ординарним фокусуванням з іонізацією електророзпиленням по z-напрямку. Спектри сканують у діапазоні 120-1000ат. од. маси протягом 2с. Дані, отримані детектором ВДСР (випарний детектор по світлорозсіюванню), також приймаються по аналоговому каналу. Елюювання в градієнтному режимі проводять за допомогою Буферного розчину А, що являє собою 2% розчин ацетонітрилу у воді з додаванням 0,02% TFA, і Буферного розчину В, що являє собою 2% розчин води в ацетонітрилі з додаванням 0,02% TFA, зі швидкістю 1,5мл/хв. Зразки елююють у такий спосіб: 90% А протягом 0,5хв, з переходом до 95% В протягом 3,5хв та підтримуванням 95% В протягом 0,5хв, а потім колонку повертають у ви хідний стан протягом 0,1хв Повний час аналізу складає 4,8хв. **прод. означає - наявна у продажу. Загальна методика D: Одержання сполук формули (І) через 6-бром-бензофуранові проміжні продукти (VIII) і боронати (V) і (VI). Альтернативні методики Одержання сполуки формули (І) наведені нижче на Схемах реакцій для Загальної методики D-1 і D-2 і на Схемі реакцій для Загальної методики D-3. У Загальних методиках D-1 і D-2 загальний проміжний продукт, [(3-аміно-6-бром-бензофуран2-іл)-(2,4-дихлорфеніл)-метанон (VIII) використовують для одержання 6-заміщених аналогів бензофурану формули (І). Сполуку (VIII) синтезують з 4-бром-2-фтор-бензонітрилу з використанням Якщо у формулі (І) R1 = нижчий алкіл, то синтез проводять відповідно до Загальної методики D-3. Проміжний продукт (VIII) ацилують звичайними способами, а потім виконують відновлення бораном з одержанням проміжного продукту (IX). Каталізовані паладієм реакції сполучення між (IX) і арилбороновими кислотами або боронатами (VI) дають шукані сполуки формули (І). Схема реакцій для загальної методики D-3 Методика D-3 Приклад 146 Одержання [(3-аміно-6-бром-бензофуран-2-іл)(2,4-дихлорфеніл)-метанону 57 79772 Стадія 1: Одержання вихідної речовини: 4бром-2-метокси-бензонітрилу Суміш 4-бром-2-фтор-бензонітрилу (15,0г, 75,0ммоль), метанолу (30,4мл, 350ммоль) і карбонату калію (31,1г, 225ммоль) у DMF (150мл) перемішують в атмосфері аргону при 55°С протягом ночі. У цей момент ТШХ (100% метиленхлорид) не виявляє вихідну речовину, та реакційну суміш виливають в ефір (300мл) та воду (150мл). Шари поділяють і органічний шар промивають водою (150мл) та розсолом (50мл), сушать над Mg2SO4, фільтрують та концентрують за пониженого тиску, одержуючи (15,2г, 95,5%) 4-бром-2метоксибензонітрил у вигляді білої твердої речовини. 1Н-ЯМР (CDCI3) d 7,41 (d, J=8,1Гц, 1Н), 7,16 (dd, J=8,1, 1,6Гц, 1Н), 7,13 (d, J=1,6Гц, 1Н), 3,93 (s, 3Н); МС Г Х-МС (М+=211; ЧУ=6,15хв). Стадія 2: Одержання проміжного продукту: 4бром-2-гідрокси-бензонітрилу 58 Цю сполуку одержують з 4-бром-2-гідроксибензонітрилу (4,0г, 20,3ммоль) у спосіб, описаний для [(3-аміно-6-йод-бензофуран-2-іл)-(2,4дихлорфеніл)-метанону (Приклад С-1 стадія 2), і одержують 6,1г (78%) [(3-аміно-6-бромбензофуран-2-іл)-(2,4-дихлорфеніл)-метанону у вигляді жовтої твердої речовини. 1Н-ЯМР (DMSOd6) d 7,96 (d, J=8,3Гц, 1Н), 7,74 (d, J=1,6Гц, 1Н), 7,72 (dd, J=1,7Гц, 1,0 Гц, 1Н), 7,56-7,49 (m, 4H), 7,44, (dd, J=8,5Гц, 1,7 Гц, 1Н). МС РХ-МС (МН+=386,1), РХ МС ЧУ: 3,68хв. Приклад 147 Методика D-1: Каталізоване паладієм сполучення [(3-аміно-6бром-бензофуран-2-іл)-(2,4-дихлорфеніл)метанону й арилборонових кислот або боронатів У точності використовують методики, описані в Прикладі С-1, стадія 3, але з застосуванням [(3аміно-6-бром-бензофуран-2-іл)-(2,4-дихлорфеніл)метанону (VIII) замість [(3-аміно-6-йодбензофуран2-іл)-(2,4-дихлорфеніл)-метанону (IV). Аналогічні реакції також описані в Прикладі D-3, стадія 2. Приклад 148 Методика D-2 Одержання [3-аміно-6-(3-етилфеніл)бензофуран-2-іл]-(2,4-дихлорфеніл)-метанону Стадія 1: Одержання [3-аміно-6-(4,4,5,5тетраметил-[1,3,2]діоксаборолан-2-іл)бензофуран-2-іл]-(2,4-дихлорфеніл)-метанону При перемішуванні до розчину 4-бром-2метокси-бензонітрилу (4,60г, 21,7ммоль) у метиленхлориді (20мл) додають хлорид алюмінію (14,5г, 108ммоль). Після перемішування в атмосфері аргону протягом 10хв додають додаткову кількість метиленхлориду (30мл) та суміш кип'я тять зі зворотним холодильником в атмосфері аргону протягом ночі. Реакційну суміш потім розбавляють етилацетатом, промивають водою, розсолом та сушать над сульфатом магнію. Розчинник вилучають за пониженого тиску, одержуючи (4,09г, 95,2%) 4-бром-2-гідрокси-бензонітрил у вигляді продукту ясно-сірого кольору. 1Н-ЯМР (CDCI3) d 7,35 (d, J=8,4Гц, 1Н), 7,19 (d, J=1,4Гц, 1Н), 7,14 (dd, J=8,4, 1,4Гц, 1Н), 6,15 (s, 1H); ТШХ Rf=0,78 (50% етилацетат - гексан). Стадія 3: [(3-аміно-6-бром-бензофуран-2-іл)(2,4-дихлорфеніл)-метанон Суміш [(3-аміно-6-бром-бензофуран-2-іл)-(2,4дихлорфеніл)-метанону (2,5г, 6,5ммоль), ацетату калію (1,97г, 19,5ммоль), біс(пінаколато)дибору (1,99г, 7,79ммоль) у безводному DMSO дегазують в атмосфері Аr протягом 30хв. Потім додають Pd(dppf)2Cl2 (0,53г, 0,65ммоль) та суміш дегазують ще 10хв. Реакційну суміш потім нагрівають при 100°С протягом 3,5год. Реакційну суміш потім виливають у етилацетат та воду. Органічний шар сушать над сульфатом магнію, фільтрують і концентрують у вакуумі. Неочищений залишок очищають на колонці з діоксидом кремнію, елююючи за допомогою суміші 25% етилацетат - гексан, і одержують 1,2г (43%) 3-аміно-6-(4,4,5,5тетраметил-[1,3,2]діоксаборолан-2-іл)бензофуран-2-іл]-(2,4-дихлорфеніл)-метанону у вигляді коричнево-жовтої твердої речовини. 1НЯМР (CDCI2) d 7,81 (s, 1Н), 7,67 (d, J=7Гц, 1Н), 7,60 (d, J=7Гц, 1Н), 7,55-7,46 (m, 2H), 7,34, (dd, J=8,2Гц, 2,0Гц, 1Η), 5,93 (bs, 2H), 1,33 (3, 12Η). МС РХ-МС 59 79772 (МН+=432,3, 434,2), РХ МС ЧУ: 3,95 хв. Стадія 2: Одержання [3-аміно-6-(3-етилфеніл)-бензофуран-2-іл]-(2,4-дихлорфеніл)метанону Цю сполуку одержують з 1-бром-3-етилбензол (0,06г, 0,30ммоль) у спосіб, описаний для [3-аміно6-(2-метилпіридиніл)-1-бензофуран-2-іл](2,4дихлорфеніл)метанону (Приклад С-2 стадія 2), і одержують 35,1мг (37%) [3-аміно-6-(3-етил-феніл)бензофуран-2-іл]-(2,4-дихлорфеніл)-метанону у вигляді жовтої твердої речовини. 1Н-ЯМР (CDCI3) d 7,67 (dd, J=8,1Гц, 1Н), 7,56-7,53 (m, 1Н), 7,55-7,49 (m, 3Н), 7,45-7,34 (m, 4H), 7,25-7,21 (dm, J=4Гц, 1Н), 6,04 (bs, 2Н), 2,72 (q, J=6Гц, 2Н), 1,28 (t, J=6Гц, 3Н). МС РХ-МС (МН+=410,3, 412,1), РХ МС ЧУ: 4,17хв. Приклад 149 Методика D-3 Одержання N-{3-[2-(2,4-дихлорбензоїл)-3метиламінобензофуран-6-іл]-феніл}-ацетаміду Стадія 1: Одержання проміжного продукту: (6бром-3-метиламіно-бензофуран-2-іл)-(2,4дихлорфеніл)-метанону Оцтово-мурашиний ангідрид одержують за такою методикою: Мурашин у кислоту (1,5мл, 39ммоль) краплями додають в оцтовий ангідрид (3мл, 32ммоль) у колбі об'ємом 250мл, приміщеній в баню з льодом, а потім обережно нагрівають при 60°С протягом 2год. В охолоджувану колбу з оцтово-мурашиним ангідридом (2,5екв.) додають розчин (3-аміно-6-бромбензофуран-2-іл)-(2,4дихлорфеніл)-метанону, отриманий за методикою D (5г, 13ммоль, 1екв.), у 20мл безводного THF. Реакційну суміш кип'ятять зі зворотним холодильником при 70°С протягом 40год. При охолодженні реакційної суміші осаджується велика кількість твердої речовини. Білу тверду речовину відфільт 60 ровують, промивають за допомогою THF та сушать у вакуумній сушильній шафі. Отриманий у такий спосіб продукт суспендують у 40 мл THF і краплями додають боранметилсульфід (3мл, 32ммоль, 2,5екв.), тримаючи колбу на бані з льодом. Реакційну суміш перемішують на бані з льодом протягом 3год, додають 10мл метанолу, перемішують протягом ще 30хв. Реакційну суміш випарюють і одержують зелену липку речовину. При додаванні до суміші EtOAc утворюється біла тверда речовина, і тверду речовину вилучають фільтруванням. Фільтрат концентрують і залишок очищають за допомогою РХСТ (колонка Biotage). 700мг (14%) 6-бром-3-метиламінобензофуран-2іл)-(2,4-дихлорфеніл)-метанону одержують у вигляді жовтої твердої речовини. 1Н-ЯМР (CDCI3) d 7,98 (broad, m, 1H), 7,82 (d, J=8Гц, 1Н), 7,52 (d, J=2Гц, 1Н), 7,48 (d, J=2Гц, 1Н), 7,44 (d, J=8Гц, 1Η), 7,35 (t, J=2Гц, 1Η), 7,33(t, J=2Гц, 1Η), 2,40 (s, 3Н). МС РХ-МС МН +=398/400/402; Rf=0,72, 50% EtOAc HEX. Стадія 2: Одержання N-{3-[2-(2,4дихлорбензоїл)-3-метиламіно-бензофуран-6-іл]феніл}-ацетаміду Розчин (6-бром-3-метиламіно-бензофуран-2іл)-(2,4-дихлорфеніл)-метанону (100мг, 0,25ммоль) у диметиловому ефірі етиленгліколю (1мл) дегазують аргоном протягом 10хв. У цей час додають дегазовану 3-ацетамідобензолборонову кислоту (49мг, 0,28ммоль, 1,1екв.) у диметиловому ефірі етиленгліколю (4мл), а потім [1,1'біс(дифенілфосфінофероцен]дихлорпаладієвий(ІІ) комплекс(ІІ) (20мг, 0,03ммоль, 0,1екв.) і 2 Μ водний розчин карбонату натрію (0,63мл, 1,25ммоль, 5екв.). Реакційну суміш продувають аргоном протягом 10хв і її нагрівають при 80°С протягом 5год. Реакційну суміш розбавляють за допомогою EtOAc, промивають водою та розсолом. Органічний шар сушать у вакуумі. Очищення за допомогою препаративної ТШХ дає 66,4мг (59%) N-{3-[2-(2,4-дихлорбензоїл)-3метиламіно-бензофуран-6-іл]-феніл}-ацетаміду у вигляді жовтої твердої речовини. 1Н-ЯМР (CDCI3) d 8,0 (broad, q, J=5,6Гц, 1Н), 7,91 (d, J=8,4Гц, 1H), 7,63 (broad, s, 1H), 7,50-7,33 (m, 8H), 3,42 (d, J=5,6Гц, 3Н), 2,21 (s, 3Н). МС РХ-МС МН+=453,2/455,2; Rf=0,13, 50% EtOAc - HEX. Інші сполуки, наведені в таблиці 3, можна одержати у спосіб, аналогічний описаним вище, вибираючи відповідні вихідні речовини, що легко доступні і/або синтез яких описаний у цьому винаході, та використовуючи способи, описані вище, або інші стандартні хімічні методики, відомі у цій галузі техніки.
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzofuran and benzothiophene derivatives useful in the treatment of hyper-proliferative disorders
Автори англійськоюDumas Jacques, Phillips Barton
Назва патенту російськоюБензофурановые и бензотиофеновые производные для лечения гиперпролиферативных заболеваний
Автори російськоюДюма Жак, Филлипс Бартон
МПК / Мітки
МПК: C07D 409/14, C07D 405/14, C07D 333/66, C07D 405/10, C07D 413/04, C07D 405/04, C07D 409/04, A61K 31/381, C07D 417/04, A61K 31/343, C07D 307/82, C07D 405/06, A61P 35/00
Мітки: похідні, гіперпроліферативних, бензофуранові, бензотіофенові, захворювань, лікування
Код посилання
<a href="https://ua.patents.su/53-79772-benzofuranovi-i-benzotiofenovi-pokhidni-dlya-likuvannya-giperproliferativnikh-zakhvoryuvan.html" target="_blank" rel="follow" title="База патентів України">Бензофуранові і бензотіофенові похідні для лікування гіперпроліферативних захворювань</a>
Попередній патент: Пристрій для стопоріння обертання лопатних секторів спрямного апарата планками у з’єднувальних площинах картера і турбіна, що містить вказаний пристрій
Наступний патент: Установка для комплексної обробки поверхні виробів у вакуумі
Випадковий патент: Спосіб обробки привибійної зони пласта












