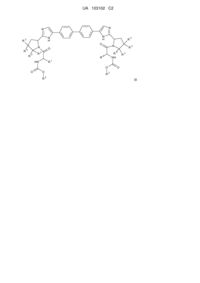
Похідні метил[2-метил({2-[4-(4′-{2-[7-(3-метил-2-{[(метилокси)карбоніл]аміно}бутаноіл)-1,4-діокса-7-азаспіро[4,4]нон-8-іл]-1н-імідазол-4-іл}-4-біфеніліл)-1н-імідазол-2-іл]-1-піролідиніл}карбоніл)пропіл]карбамат
Номер патенту: 103102
Опубліковано: 10.09.2013
Автори: Коуч Рікі, Чен Пінґ'юн, Казмірскі Вісло Міцісло, Таллант Метт'ю, Дуан Маошенґ, Нортон Бет Адамс, рімз Річард Мартін
Формула / Реферат
1. Сполука

або її фармацевтично прийнятна сіль, або будь-який її стереоізомер, або їх суміш.
2. Сполука за п. 1, де названа сполука є енантіомерно збагаченою наступним енантіомером
 .
.
3. Фармацевтично прийнятна сіль сполуки за п. 1.
4. Сіль за п. 3, де названа сіль - ди-HCl-сіль або сульфат.
5. Сіль за п. 4, де названа сіль - сульфат.
6. Сіль за п. 4, де названа сіль є кристалічною.
7. Фармацевтична композиція, яка містить сполуку або її фармацевтично прийнятну сіль за п. 1.
8. Спосіб лікування вірусної інфекції в людей, за яким застосовують фармацевтичну композицію за п. 7.
9. Спосіб за п. 8, де названа вірусна інфекція є інфекцією HCV.
10. Фармацевтична композиція для застосування в лікуванні вірусної інфекції в людей, яка містить сполуку або її фармацевтично прийнятну сіль за п. 1.
11. Сполука або її фармацевтично прийнятна сіль за п. 1 для застосування в лікуванні вірусної інфекції в людей.
12. Застосування сполуки або її фармацевтично прийнятної солі за п. 1 у виготовленні медикаменту для застосування в лікуванні вірусної інфекції в людей.
Текст
Реферат: Представлений винахід стосується сполуки формули III та її солей, а також фармацевтичної композиції, яка містить сполуки або солі, застосування сполуки формули III та її солей та способів лікування інфекції HCV. UA 103102 C2 (12) UA 103102 C2 N N R R N H N H 3 O N 3 R 3 R R N O 3 R HN R R NH 1 O R R 3 R 3 3 1 O O 3 R O 2 2 III UA 103102 C2 5 10 15 20 25 30 35 40 45 50 55 60 Заявлений винахід стосується противірусних сполук. Зокрема, заявлений винахід стосується сполук, корисних для лікування інфекції гепатиту вірусу C (HCV), кристалічних солей сполук, фармацевтичних композицій, які містять сполуки, та способів лікування інфекції HCV. Хронічні інфекції HCV є гострими проблемами щодо здоров’я, асоційованими із цирозом печінки, гепатоцелюлярним раком та печінковою недостатністю. Оцінено, що у всьому світі 170 мільйонів хронічних носіїв є при ризику розвитку хвороби печінки. Дивись, наприклад, Szabo, et al., Pathol.Oncol.Res. 2003, 9:215-221, та Hoofnagle JH, Hepatology 1997, 26:15S-20S. У Сполучених Штатах тільки 2,7 мільйони є хронічно інфікованими HCV, та встановлено, що число померлих залежних від HCV у 2000 дорівнює 8,000 − 10,000, та очікують значного підвищення у наступні роки. Інфекція HCV бессимптомно розвивається у великої долі хронічно інфікованих (та інфекційних) носіїв, які не відчували клінічні симптоми багато років. Цироз печінки, зрештою, може призводити до печінкової недостатності. Зараз зрозуміло, що печінкова недостатність, отримана внаслідок хронічної інфекції HCV, є головною причиною трансплантації печінки. HCV - член сімейства Flaviviridae вірусів РНК, які вражають тварин та людей. Геном - єдина нитка, приблизно, з 9,6-тисячами гетероциклічних основ нуклеїнової кислоти, РНК, та складається з одної відкритої рамки зчитування, яка кодує поліпротеін, приблизно, 3000 амінокислот, захищених нетрансльованими областями при 5’ та 3’ кінцях (5’- та 3’-UTR). Поліпротеін є попередником, принаймні, 10 окремих вірусних білків, важливих для реплікації та зборки вірусних часточок потомства. Організація структурних та неструктурних білків у поліпротеїні HCV є наступною: C-E1-E2-p7-NS2-NS3-NS4a-NS4b-NS5a-NS5b. Оскільки реплікативний цикл HCV не охоплює будь-який проміжний вид ДНК, та вірус не інтегровано в геном хазяїна, від інфекції HCV теоретично можна вилікувати. Тоді як патологія інфекції HCV переважно вражає печінку, вірус знайдено в інших типах клітин організму, охоплюючи лімфоцити периферійної крові. Дивись, наприклад, Thomson BJ and Finch RG, Clin Microbial Infect. 2005, 11:86-94, та Moriishi K та Matsuura Y, Antivir.Chem.Chemother. 2003, 14:285-297. Тепер звичайне лікування хронічного HCV − це інтерферон альфа (IFN-альфа) в комбінації з рибавірином, та це потребує, принаймні, шість (6) місяців лікування. IFN-альфа стосується сімейства нативних малих білків характерних біологічних дій, як-то противірусні, імунорегуляторні та протипухлинні активності, які створено та секретовано більшістю клітин з ядром у тварин на відклик на деякі хвороби, зокрема, на вірусні інфекції. IFN-альфа є важливим регулятором розвитку та диференціації, який впливає на клітинну комунікацію та імунологічний контроль. Лікування HCV інтерфероном часто асоційовано зі шкідливими побічними діями, як-то втома, лихоманка, озноб, головний біль, біль у м'язах, артралгія, помірна алопеція, психіатричні наслідки та асоційовані із цим розлади, автоімунний феномен та асоційовані із цим розлади, та дисфункція щитоподібної залози. Рибавірин, інгібітор інозин 5'-монофосфатдегідрогенази (IMPDH), підсилює ефективність IFN-альфа в лікуванні HCV. Незважаючи на уведення рибавірину, більше ніж у 50% пацієнтів не вилучено вірус дією звичайного лікування інтерфероном-альфа (IFN) та рибавірином. До цього часу звичайне лікування хронічного гепатиту C слід змінювати на комбінацію регульованого IFN-альфа плюс рибавірин. Однак, численні пацієнти ще мають значні побічні дії, головним чином, стосовно рибавірину. Рибавірин спричиняє значний гемоліз у 10-20% пацієнтів, яких лікували рекомендованими тепер дозами, та ці ліки є тератогенними та ембріотоксичними. Навіть із недавніми покращеннями суттєва доля пацієнтів не реагувала суттєвим зменшенням вірусного навантаження, і тепер існує чітка потреба щодо більш ефективної противірусної терапії інфекції HCV. Дивись, наприклад, Fried, et al. N. Engl. J Med 2002, 347:975-982. Розглядають рід підходів для подолання вірусу. Вони охоплюють, наприклад, застосування антисенсових олігонуклеотидів або рибосом для реплікації інгібування HCV. Крім того, сполуки низької молекулярної маси, які безпосередньо інгібують білки HCV та заважають вірусній реплікації, розглядають як привабливу стратегію для контролю інфекції HCV. Серед вірусних мішеней NS3/4A протеазу/хеліказу та NS5b РНК-залежну РНК-полімеразу вважають найбільш перспективними вірусними мішенями для нових ліків. Дивись, наприклад, Ni, Z. J. та Wagman, A. S. Curr. Opin. Drug Discov. Devel. 2004, 7, 446-459, Beaulieu, P. L. та Tsantrizos, Y. S. Curr. Opin. Investig. Drug 2004, 5, 838-850, та Griffith, et al., Ann. Rep. Med. Chem 39, 223-237, 2004. Окрім націлювання на вірусні гени та їх транскрипцію й продукти трансляції, противірусної активності також можна досягати націлюванням на білки клітини-хазяїна, які потрібні для вірусної реплікації. Наприклад, у Watashi, et al, Молecular Cell, 19, 111-122, 2005, показано як можна досягати противірусної активності інгібуванням циклофілінів клітини-хазяїна. Альтернативно, виявлено сильний агоніст TLR7 для зменшення рівнів плазми HCV у людей. Дивись, Horsmans, et al, Hepatology, 42, 724-731, 2005. 1 UA 103102 C2 5 Сполуки, названі корисними для лікування інфекції HCV розкрито, наприклад, у WO 2008/064218 (Leivers et. al), WO 2008/244380 (Bachand et. al), та US 2009/0068140 (Bachand et. al). У цих посиланнях також розкрито способи отримання сполук, композицій, які містять сполуки, фармацевтичні композиції, які містять сполуки та додаткові сполуки, способи лікування HCV, сполуки солей, шляхи застосування, та іншу інформація стосовно того, як зробити, створити рецептуру та застосувати сполуки. Коротко, згідно з одним аспектом заявленого винаходу розкрито сполуки формули I; N N N H N N H X O O (CRR)n N X 1 O R 1 HN R NH O O 2 R I 1 10 O 2 R де кожне R незалежно − Н або C1-3алкіл; 2 кожне R незалежно − С1-3алкіл; кожне X незалежно − СRR, O, або S; n дорівнює 2 або 3; та кожне R незалежно − метил, гідроген, або дейтерій. Згідно із ще одним аспектом заявленого винаходу розкрито сполуки формули II; N N H X (CRR)n N HN O R X O R 1 (CRR)n N X 1 NH O O R 20 N H O X 15 N R 2 O 2 II 1 де кожне R незалежно − Н або C1-3алкіл; 2 кожне R незалежно − С1-3алкіл; кожне X незалежно − СRR, O, або S; кожне n незалежно − 2 або 3; та кожне R незалежно − метил, гідроген, або дейтерій. Згідно із ще одним аспектом заявленого винаходу розкрито сполуки формули III; N R R N N H 3 N 3 R 3 R R N 1 R NH R 1 O R 2 3 R 3 O R R O O 3 HN O N H R 3 3 O 2 III 1 25 30 де кожне R незалежно − Н або C1-3алкіл; 2 кожне R незалежно − С1-3алкіл; 3 3 3 на кожному карбоні, на якому є R групи, будь-яка R − H, або групи R разом з карбоном, до якого вони приєднані, утворюють 4-, 5-, або 6-членне насичене спіро-кільце, за умови, що є не більше 1 спіро-кільця, на кожне насичене кільце, яке містить нітроген; 3 кожне насичене спіро, утворене із груп R , незалежно є циклоалкілом, або може містити 1 4 або 2 атоми оксигену, або 1 або 2 атоми сульфуру, або 1 SO 2, або 1 NR ; 4 кожне R незалежно − H, C(O)OC1-4алкіл, C(O)C1-4алкіл, C(O)NC1-4алкіл, або SO2C1-4алкіл; кожне спіро-кільце необов’язково може заміщуватися дейтерієм, флуором або 1 або 2 групами метилу. 2 UA 103102 C2 5 10 15 Згідно із ще одним аспектом заявленого винаходу розкрито фармацевтично прийнятні солі сполук формули I, II, або III. Згідно із ще одним аспектом заявленого винаходу розкрито фармацевтичні композиції, які містять сполуку формули I, II, або III, або її фармацевтично прийнятну сіль. Згідно із ще одним аспектом заявленого винаходу розкрито спосіб лікування вірусної інфекції, наприклад, інфекції HCV, у людей, який охоплює фармацевтичну композицію винаходу. 1 У вищенаведених формулах I, II, та III, окрім того, коли R є гідрогеном, карбон, до якого 1 приєднано R , є хіральним. Крім того, зображений третинний карбон у кожному із двох зображених 5-членних насичених гетероциклічних кілець, які містять нітроген, є також 1 хіральним. Отже, сполуки містять, принаймні, два хіральних атоми карбону, та коли кожне R − C1-3 алкіл, сполуки містять, принаймні, 4 хіральні атоми карбону. Отже, сполуки можуть існувати в різних енантіомерних сумішах. В утіленні винаходу сполуки формули I, II, або III, або їх фармацевтично прийнятні солі є енантіомерно збагаченими енантіомером, де всі з хіральних карбонів згідно з указаним вище параграфом є в S-конфігурації. Взагалі, зрозуміло, що посилання на енантіомерно збагачену сполуку або сіль означає, що конкретний енантіомер містить більше 50% за масою від загальної маси всіх енантіомерів сполуки або солі. Приклад сполуки із чотирма хіральними карбонами в S-конфігурації приведено нижче. N N N H N N H O O 20 25 30 35 40 O NH HN O O N O O O В утіленні винаходу кожне X є ідентичним. В утіленні винаходу кожний з усіх R − H або всі R − дейтерії (D). Іншими словами, в утіленні винаходу кожна група CRR у спіро є CH2, або кожна група CRR у спіро є CD2. Дейтерій звичайно є присутнім у дуже малих кількостях у гідрогенових сполуках. При позначенні замісника як дейтерій або D природну кількість дейтерію слід підвищувати, щоб у порівнянні з H більше половини цього конкретного заміснику була D. В утіленні винаходу не більше 2 R − метил. 3 В утіленні винаходу в сполуках формули III, коли групи R утворюють спіро-кільце на кожному насиченому кільці, яке містить нітроген, кожну з названих спіро-груп зв’язано з тим самим взаємним атомом карбону в кожному насиченому кільці, яке містить нітроген. Фармацевтично прийнятні солі можна отримувати добре відомими в рівні техніки способами. Придатні солі охоплюють описані, наприклад, у P. Heinrich Stahl, Camille G. Wermuth (eds.), handbook of Pharmaceutical Salts properties, selection, та Use; 2002. Дивись також, WO 2009/020828 (Kimet. Al), де описано отримання кристалічних солей деяких противірусних сполук. Переважні солі охоплюють солі HCl, наприклад сіль ді-HCl, та сульфатні солі. Сполуки та солі винаходу можна застосовувати як такі або в комбінації з одним або більше іншими терапевтичними засобами. У ще одному аспекті терапевтичний засіб вибрано з Standard of Care therapies, як-то інтерферон/рибофлавін, інгібітори реплікації малої молекули HCV (звичайно щодо безпосередньої противірусної дії. Придатні комбіновані лікування описано, наприклад у WO 2008/064218 (Leivers et. al), WO 2008/244380 (Bachand et. al), та US 2009/0068140 (Bachand et. al). Ці посилання також містять важливе розкриття стосовно шляхів застосування та іншу інформацію стосовно того як отримувати, розробляти рецептуру та застосовувати сполуки. Таблицю скорочень, застосованих у експериментальному розділі, надано нижче. 45 ДХМ ДМФ HATU ЕР РХ-МС ТГФ DIEA Дихлорметан N,N-диметилформамід (O-7-азабензотриазол-1-іл)-N,N,N’,N’-тетраметилуроніум гексафлуорофосфат) Електророзпилювальна рідинна хроматографія Мас-спектроскопія Тетрагідрофуран діізопропілетиламін 3 UA 103102 C2 ДМСО DME TEA Pd(dppf)Cl2 Десс-Мартин ВРМС диметилсульфоксид диметиоксиетан триетиламін комплекс 1,1'-біс(дифенілфосфіно)фероцен-паладій(II)дихлорид дихлорметан Десс-Мартин перйодинан Мас-спектрометрія високого розділення Інтермедіат 1: метил {(1S)-1-[((2S)-2-{4-[4'-(аміноацетил)-4-біфеніліл]-1H-імідазол-2-іл}-1піролідиніл)карбоніл]-2-метилпропіл}карбамат O 2HCl H N O N 5 NH2 N O N H O Інтермедіат 1 можна отримувати як показано нижче на схемі реакції. O O HCl H2 N Br 4 N O NH4OAc HN O O Br O HATU, DIEA O O N 7 OH HATU, DIEA O O N N Br HCl N H HCl N N H N H OH 9 O H N O O N O N Br N H 6 PdCl 2 (dppf) H N O N H N O N N H O HCl O Розчин 1,1-диметилетил[2-(4'-{2-[(2S)-1-((2S)-3-метил-2-{[(метилокси)карбоніл] аміно}бутаноіл)-2-піролідиніл]-1H-імідазол-4-іл}-4-біфеніліл)-2-оксоетил]карбамату (інтермедіат 11) (3,8 г, 6,3 ммол) у ДХМ (40 мл) обробляли HCl (10 мл, 4M у діоксані), що дало метил {(1S)-1[((2S)-2-{4-[4'-(аміноацетил)-4-біфеніліл]-1H-імідазол-2-іл}-1-піролідиніл) карбоніл]-2метилпропіл}карбамат (інтермедіат 1) як світлу жовту тверду речовину (3,5 г, кількісн.). Інтермедіат 2: (3S,7S,9S)-7,9-диметил-2-{N-[(метилокси)карбоніл]-L-валіл}-6,10-діокса-2азаспіро[4,5]декан-3-карбонова кислота O O HO O N O NH O 15 1 11 10 10 O H N O O 8 O Br O Інтермедіат 2 можна отримувати як показано в схемі реакції нижче. 4 UA 103102 C2 O O HATU, TEA O O OH HN HCl O OH O O Dess Martin O O NH O O O 13 12 O O OH HO O O O N O HO LiOH O O N TsOH O O O 15 20 O 2 14 10 O NH NH 5 O N O NH NH O O OH N До перемішуваного розчину метил (3S,7S,9S)-7,9-диметил-2-{N-[(метилокси)карбоніл]-Lваліл}-6,10-діокса-2-азаспіро[4,5]декан-3-карбонату (інтермедіат 14) (360 мг, 0,932 ммол) у змішаних розчинниках ТГФ (4 мл), т-бутанолу (1 мл) та води (1 мл) додавали LiOH (44 мг, 1,86 ммол). Отриману суміш перемішували протягом 2 год. при к.т. перед підкислюванням 1N HCl, приблизно, до рН 3 і потім розбавляли етилацетатом (100 мл). Розчин промивали розсолом. Органічний шар сушили над Na2SO4, фільтрували та випаровували, що дало (3S,7S,9S)-7,9диметил-2-{N-[(метилокси)карбоніл]-L-валіл}-6,10-діокса-2-азаспіро[4,5]декан-3-карбонову + кислоту (інтермедіат 2) (315 мг, вихід: 91%) як тверду речовину. ЕР РХ-МС m/z =373 (M+H) . Інтермедіат 4: 2-аміно-1-(4-бромофеніл)етанон O HCl Br H2 N До перемішуваного розчину 2-бромо-1-(4-бромофеніл)етанону (130 г 0,478 мол) у толуолі o (2500 мл) додавали гексаметилентетрамін (65,6 г 0,478 мол). Суміш перемішували при 40 C протягом 16 год. Отриману тверду речовину відфільтровували та промивали толуолом та етером, що дало білу тверду речовину. До перемішуваної суспензії цієї білої твердої речовини в етанолі (800 мл) додавали концентровану хлоридну кислоту (300 мл). Суміш перемішували при температурі навколишнього середовища протягом 20 год. Тверду речовину збирали фільтруванням та промивали етанолом і водою та сушили у вакуумі, що дало 2-аміно-1-(4бромофеніл)етанон (4) (95 г, вихід: 92%) як білу тверду речовину, яку застосовували без 1 -1 очищення в наступному етапі. H ЯМР (300 МГц, ДМСО-d6) δ млн 8,58 (s, br, 2H), 7,96 (d, J = + 8,7 Гц, 2H), 7,81 (d, J = 8,7 Гц, 2H), 4,48-4,52 (m, 2H). ЕР РХ-МС m/z = 214, 216 (M+H) . Інтермедіат 5: 1,1-диметилетил [2-(4-бромофеніл)-2-оксоетил]карбамат O O H N Br O 25 30 До суміші 2-аміно-1-(4-бромофеніл)етанон гідрогенхлориду (інтермедіат 4) (50 г, 0,2 мол), o Boc2O (48 г, 0,22 мол) у ДХМ (1000 мл) краплями додавали TEA (68,8 мл, 0,5 мол) при 0 C. Після додавання отриману суміш перемішували при температурі навколишнього середовища протягом ночі та фільтрували. Відфільтроване промивали 1 N HCl (300 мл×3) і розсолом, сушили над Na2SO4, концентрували у вакуумі, що дало не зовсім білу тверду речовину, яку потім промивали петролейним етером, що дало 1,1-диметилетил [2-(4-бромофеніл)-21 -1 оксоетил]карбамат (інтермедіат 5) (40 г, вихід: 64%). H ЯМР (300 МГц, CDCl3) δ млн 7,83 (d, J = 8,7 Гц, 2H), 7,65 (d, J = 8,7 Гц, 2H), 5,48 (s, br, 1H), 4,60-4,62 (m, 2H), 1,49 (s, 9H). ЕР РХ-МС + m/z =336 (M+Na) . Інтермедіат 6: 1,1-диметилетил{2-оксо-2-[4-(4,4,5,5-тетраметил-1,3,2-діоксоборолан-2іл)феніл]етил}карбамат 5 UA 103102 C2 O O B O H N O O Інтермедіат 6 можна отримувати як показано в схемі реакції нижче. O O O HCl H2 N Br Br Br Boc2O O Br H N O 5 4 O O O B B O O O O B H N O O 6 5 10 Pd(dppf)Cl2 (2,6 г 3,18 ммол) додавали до суміші 1,1-диметилетил [2-(4-бромофеніл)-2оксоетил]карбамату (інтермедіат 5) (20 г, 63,7 ммол), біс(пінаколато)дибору (19,4 г, 76,4 ммол) та KOAc (24,8 г, 0,254 мол) у діоксані (300 мл), колбу промивали азотом (3x) та нагрівали до 80 o C протягом 16 год. під атмосферою азоту. Реакційну суміш розбавляли гексаном (300 мл), фільтрували, концентрували та залишок очищували хроматографією на силікагелі (петролейний етер / етилацетат = 5/1), що дало 1,1-диметилетил{2-оксо-2-[4-(4,4,5,5тетраметил-1,3,2-діоксоборолан-2-іл)феніл]етил}карбамат (інтермедіат 6) (13,3 г, вихід: 58%) як 1 -1 білу тверду речовину. H ЯМР (300 МГц, CDCl3) δ млн 7,90-7,93 (m, 4H), 5,55 (s, br, 1H), 4,68 (s, + 2H), 1,48 (s, 9H), 1,35 (s, 12H). ЕР РХ-МС m/z = 384 (M+Na) . Інтермедіат 7: 1,1-диметилетил(2S)-2-({[2-(4-бромофеніл)-2-оксоетил]аміно}карбоніл)-1піролідинкарбонат O Br O HN O N 15 20 25 O Суміш 1-{[(1,1-диметилетил)окси]карбоніл}-L-піроліну (50 г, 0,233 мол), HATU (106 г, 0,279 мол) та DIEA (150 мл) у ДМФ (400 мл) перемішували при температурі навколишнього середовища протягом 10 хвил. Додавали 2-аміно-1-(4-бромофеніл)етанон гідрогенхлорид (інтермедіат 4) (70 г, 0,279 мол) у ДМФ (500 мл) та отриману суміш перемішували протягом ночі перед розбавленням EtOAc (4L). Розчин промивали 1N HCl (500 мл × 4) і розсолом, сушили над Na2SO4, концентрували. Сирий продукт рекристалізували зі суміші петролейного етеру / етилацетату (2/1), що дало 1,1-диметилетил(2S)-2-({[2-(4-бромофеніл)-2оксоетил]аміно}карбоніл)-1-піролідинкарбонат (інтермедіат 7) (58,4 г, вихід: 61%) як жовту 1 -1 тверду речовину. H ЯМР (300 МГц, ДМСО) δ млн 8,22 (s, 1H), 7,93 (d, J = 8,4 Гц, 2H), 7,77 (d, J = 8,4 Гц, 2H), 4,46-4,51 (m, 2H), 4,15-4,21 (m, 1H), 3,28-3,40 (m, 2H),1,78-1,90 (m, 4H), 1,29-1,41 + (m, 9H). ЕР РХ-МС m/z = 411,1, 4113,1 (M+H) . Інтермедіат 8: 1,1-диметилетил(2S)-2-[4-(4-бромофеніл)-1H-імідазол-2-іл]-1піролідинкарбонат O O N N 30 35 Br N H Суміш 1,1-диметилетил(2S)-2-({[2-(4-бромофеніл)-2-оксоетил]аміно}карбоніл)-1піролідинкарбонату (7) (40,0 г, 97,2 ммол) та NH4OAc (60 г, 0,778 мол) у ксилені (400 мл) o нагрівали до 150 C протягом 5 год. у герметичному реакторі. Реакційну суміш концентрували, та залишок розчиняли у EtOAc (500 мл) та промивали водн. NaHCO 3 і розсолом. Органічну фазу сушили над Na2SO4, концентрували до сухого стану. Сирий продукт очищували хроматографією на силікагелі (петролейний етер / етилацетат =1/1), що дало 1,1-диметилетил(2S)-2-[4-(4бромофеніл)-1H-імідазол-2-іл]-1-піролідинкарбонат (інтермедіат 8) (34 г, вихід: 89%) як 6 UA 103102 C2 1 -1 коричневу тверду речовину. H ЯМР (300 МГц, CDCl3) δ млн 7,52 (d, J = 8,4 Гц, 2H), 7,46 (d, J = 8,4 Гц, 2H), 7,20(s, 1H), 5,58-5,71 (m, 1H), 3,38-3,42 (m, 1H), 2,80-2,87 (m, 2H), 2,03-2,06 (m, 2H), + 1,88-2,00 (m, 2H), 1,49 (s, 9H). ЕР РХ-МС m/z =392, 394 (M+H) . Інтермедіат 9: 4-(4-бромофеніл)-2-[(2S)-2-піролідиніл]-1H-імідазол N H HCl N 5 10 15 Br N H 1,1-Диметилетил(2S)-2-[4-(4-бромофеніл)-1H-імідазол-2-іл]-1-піролідинкарбонат (інтермедіат 8) (72,4 г, 185 ммол) обробляли насичен. HCl у діоксані (200 мл), та перемішували при температурі навколишнього середовища протягом ночі. Отриману тверду речовину фільтрували та промивали петролейним етером, що дало 4-(4-бромофеніл)-2-[(2S)-21 піролідиніл]-1H-імідазол (інтермедіат 9) (60 г, вихід: 90%) як жовту тверду речовину. H ЯМР -1 (300 МГц, ДМСО-d6) δ млн 8,10 (s, 2H), 7,88 (d, J = 6,6 Гц, 2H), 7,70 (d, J = 6,6 Гц, 2H), 7,49 (s, 1H), 7,32 (s, 1H), 7,16 (s, 1H), 4,50-4,52 (m, 1H), 3,15-3,40 (m, 2H),1,88-2,88 (m, 4H). ЕР РХ-МС + m/z = 291,1, 293,1 (M+H) . Інтермедіат 10: метил[(1S)-1-({(2S)-2-[4-(4-бромофеніл)-1H-імідазол-2-іл]-1піролідиніл}карбоніл)-2-метилпропіл]карбамат O H N O N O N 20 25 Br N H N-[(метилокси)карбоніл]-L-валін (43,1 г, 0,246 мол) та HATU (93,5 г, 0,246 мол) у ДХМ (1000 мл) перемішували протягом 10 хвил. Уводили 4-(4-бромофеніл)-2-[(2S)-2-піролідиніл]-1Hімідазол (інтермедіат 9) (60 г, 0,205 мол). а потім − краплями DIEA (82,6 мл, 0,308 мол). Суміш перемішували при температурі навколишнього середовища протягом ночі перед розбавленням ДХМ (1000 мл) та промивали водн. NaHCO3 і розсолом. Органічну фазу сушили над Na2SO4, концентрували до сухого стану. Сирий продукт очищували хроматографією на силікагелі (петролейний етер / етилацетат = 1/1), що дало метил[(1S)-1-({(2S)-2-[4-(4-бромофеніл)-1Hімідазол-2-іл]-1-піролідиніл}карбоніл)-2-метилпропіл]карбамат (інтермедіат 10) (62 г, вихід: 67%) 1 як жовту тверду речовину. H ЯМР (300 МГц, CDCl3) δ:7,43-7,51(m, 4H), 7,17 (s, 1H), 5,53-5,57 (m, 1H), 5,20-5,22 (m, 1H), 5,29-5,33 (m, 1H), 3,64-3,71 (m, 5H), 2,99-3,03 (m, 1H), 1,88-2,31 (m, + 4H), 0,88-0,92 (m, 6H). ЕР РХ-МС m/z =449, 451 (M+H) . Інтермедіат 11: 1,1-диметилетил[2-(4'-{2-[(2S)-1-((2S)-3-метил-2-{[(метилокси)карбоніл]аміно} бутаноіл)-2-піролідиніл]-1H-імідазол-4-іл}-4-біфеніліл)-2-оксоетил]карбамат O O H N O N 30 35 40 45 N H N O N H O O До суміші метил[(1S)-1-({(2S)-2-[4-(4-бромофеніл)-1H-імідазол-2-іл]-1- піролідиніл}карбоніл)2-метилпропіл]карбамату (інтермедіат 10) (62 г, 0,138 мол), 1,1-диметилетил {2-оксо-2-[4(4,4,5,5-тетраметил-1,3,2-діоксоборолан-2-іл)феніл]етил}карбамату (інтермедіат 6) (47,7 г, 0,152 мол) та NaHCO3 (34,2 г, 0,414 мол) у суміші DME (800 мл) та води (260 мл) додавали Pd(dppf)Cl 2 o (5,63 г, 6,9 ммол). Перед нагріванням до 80 C протягом 16 год. колбу промивали азотом (3X). Реакцію охолоджували до к.т. та фільтрували. Фільтрат розбавляли EtOAc (1000 мл), та розчин промивали водн. NaHCO3 і розсолом, сушили над Na2SO4, концентрували. Залишок очищували хроматографією на силікагелі (петролейний етер / етилацетат = 1/2), що дало 1,1диметилетил[2-(4'-{2-[(2S)-1-((2S)-3-метил-2-{[(метилокси)карбоніл]аміно}бутаноіл)-2піролідиніл]-1H-імідазол-4-іл}-4-біфеніліл)-2-оксоетил]карбамат (інтермедіат 11) (45 г, вихід: 1 -1 54%) як жовту тверду речовину. H ЯМР (300 МГц, CDCl3) δ млн 8,03 (d, J = 8,4 Гц, 2H), 7,88760 (m, 6H), 5,58 (S, br, 1H), 5,42 (m, 1H), 5,28-5,30 (m, 1H), 4,71 (s, 2H), 4,32-4,35 (m, 1H), 3,703,84 (m, 5H), 2,96 (s, br, 1H), 1,96-2,11 (m, 4H), 1,49 (s, 9H), 0,88-0,92 (m, 6H). ЕР РХ-МС m/z + =604, (M+H) ; Інтермедіат 12: метил N-[(метилокси)карбоніл]-L-валіл-(4R)-4-гідрокси-L-пролінат 7 UA 103102 C2 O O OH N O NH O O 5 10 До перемішуваного розчину N-[(метилокси)карбоніл]-L-валіну (2,89 г,16,52 ммол) у ДХМ додавали TEA (3,51 г, 34,7 ммол) та HATU (3 г, 16,52 ммол). Після, приблизно, 10 хвил. перемішування уводили метил (4R)-4-гідрокси-L-пролінат гідрогенхлорид (3 г, 16,52 ммол). Отриману суміш перемішували протягом додаткових 4 год. при к.т. перед гасінням NaHCO 3 (сусп.). Шари відокремлювали та водний шар екстрагували ДХМ (2x). Поєднану органічну фазу сушили над Na2SO4, фільтрували та концентрували. Сирий продукт очищували хроматографією на колонці (силікагель, 0 − 70% етилацетат у гексані), що дало метил N-[(метилокси)карбоніл]-L1 валіл-(4R)-4-гідрокси-L-пролінат (інтермедіат 12) (3,5 г, вихід: 70%). H ЯМР (400 МГц, -1 ХЛОРОФОРМ-d) δ млн 5,34 - 5,54 (m, 1 H) 4,69 (t, J=8,41 Гц, 1 H) 4,55 (br. s., 1 H) 4,21 (s, 1 H) 3,92 - 4,08 (m, 1 H) 3,74 (s, 4 H) 3,66 (s, 3 H) 2,29 - 2,50 (m, 1 H) 1,92 - 2,19 (m, 2 H) 0,86 - 1,13 (m, + 6 H). ЕР РХ-МС m/z =303,5 (M+H) . Інтермедіат 13: метил N-[(метилокси)карбоніл]-L-валіл-4-оксо-L-пролінат O O O N O NH O O 15 20 25 До перемішуваного розчину N-[(метилокси)карбоніл]-L-валіл-(4R)-4-гідрокси-L-пролінату (інтермедіат 12) (3,5 г, 11,9 ммол) у ДХМ (80 мл) додавали Десс-Мартин (10 г) при к.т. Отриману суміш перемішували протягом додаткових 4 год. перед гасінням 5% водн. натрій тіосульфатом (350 мл) а потім − насич. NaHCO3 (200 мл). Перемішування продовжували протягом 10 хвил. та суміш екстрагували ДХМ (2 x 300 мл). Органічний шар сушили над MgSO 4, фільтрували та концентрували. Сирий продукт очищували хроматографією на колонці (силікагель, 0 − 70% етилацетат у гексані), що дало метил N-[(метилокси)карбоніл]-L-валіл-4-оксо-L-пролінат 1 -1 (інтермедіат 13) (701 мг, вихід: 20%). H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ млн 5,25 (d, J=9,18 Гц, 1 H) 5,07 (dd, J=10,74, 2,93 Гц, 1 H) 4,36 (d, J=17,77 Гц, 1 H) 3,97 - 4,23 (m, 2 H) 3,69 - 3,77 (m, 3 H) 3,63 (s, 3 H) 2,92 (dd, J=18,94, 10,74 Гц, 1 H) 2,62 (dd, J=18,94, 2,73 Гц, 1 H) 2,01 (t, J=3,32 Гц, 1 H) 0,86 - 1,16 (m, 6 H). Інтермедіат 14: метил(3S,7S,9S)-7,9-диметил-2-{N-[(метилокси)карбоніл]-L-валіл}-6,10діокса-2 азаспіро [4,5]декан-3-карбонат O O O O N O NH O 30 35 O Метил N-[(метилокси)карбоніл]-L-валіл-4-оксо-L-пролінат (інтермедіат 13) (650 мг, 2,164 ммол), (2S,4S)-2,4-пентандіол (902 мг, 8,66 ммол) та TsOH (82 мг, 0,43 ммол) нагрівали під дефлегматором у толуолі (40 мл) з уловлювачем Дин Штарка протягом ночі. Після охолоджували до к.т. та розбавляли етилацетатом, отриманий розчин промивали NaHCO 3 (сусп.) і розсолом. Органічне потім сушили над MgSO4, фільтрували та випаровували. Сирий продукт очищували хроматографією на колонці (силікагель, 0 − 50% етилацетат у гексані), що дало метил (3S,7S,9S)-7,9-диметил-2-{N-[(метилокси)карбоніл]-L-валіл}-6,10-діокса-21 азаспіро[4,5]декан-3-карбонат (інтермедіат 14) (366 мг, вихід: 44%) як олію. H ЯМР (400 МГц, 8 UA 103102 C2 -1 5 ХЛОРОФОРМ-d) δ млн 5,38 - 5,51 (m, 1 H) 4,54 (t, J=8,03 Гц, 1 H) 4,25 - 4,36 (m, 1 H) 3,91 - 4,05 (m, 2 H) 3,85 (d, J=10,04 Гц, 1 H) 3,54 - 3,77 (m, 6 H) 2,46 - 2,53 (m, 1 H) 2,12 (dd, J=12,92, 7,65 Гц, 1 H) 2,00 - 2,06 (m, 1 H) 1,54 - 1,75 (m, 3 H) 1,10 - 1,25 (m, 6 H) 1,03 (d, J=6,78 Гц, 3 H) 0,84 - 0,96 + (m, 3 H). ЕР РХ-МС m/z =409,3 (M+Na) . Інтермедіати 15 та 17 отримували, застосовуючи процедури, подібні описаним у отриманні інтермедіату 2: Інтермедіат 15: (3S,7R,9R)-7,9-диметил-2-{N-[(метилокси)карбоніл]-L-валіл}-6,10-діокса-2азаспіро[4,5]декан-3-карбонова кислота O O O N HO O N O O 10 1 -1 H ЯМР (400 МГц, ДМСО-d6) δ млн 12,53 (br. s., 1 H), 7,49 (d, 1H), 4,34 (d, 1H), 4,24 (t, 1H), 4,06 (br. m, 2H), 3,93 (t, 1H), 3,37 (m, 4H), 2,35 ( m, 1H), 2,09-1,86 (br. m, 2H), 1,59 (m, 2H), 1,17 (m, 6H), 0,91 (m, 6H). Інтермедіат 16: метил(8S)-7-{N-[(метилокси)карбоніл]-L-валіл}-1,4-діокса-7азаспіро[4,4]нонан-8-карбонат O O O N O O NH O O 15 + ЕР РХ-МС m/z =345,3 (M+H) . Інтермедіат 17: (8S)-7-{N-[(метилокси)карбоніл]-L-валіл}-1,4-діокса-7-азаспіро[4,4]нонан-8карбонова кислота O HO O N O O NH O 20 25 1 O -1 H ЯМР (400 МГц, ДМСО-d6) δ млн 12,56 (br. s., 1 H) 7,40 (d, J=8,39 Гц, 1 H) 4,33 (dd, J=8,78, 7,02 Гц, 1 H) 3,81 - 4,10 (m, 5 H) 3,41 - 3,66 (m, 5 H) 2,28 - 2,43 (m, 1 H) 1,94 - 2,11 (m, 1 H) 1,74 + 1,94 (m, 1 H) 0,67 - 1,05 (m, 6 H). ЕР РХ-МС m/z =331,6 (M+H) . Приклад 1: метил[(1S)-1-({(2S)-2-[4-(4'-{2-[(3S,7S,9S)-7,9-диметил-2-((2S)-3-метил-2{[(метилокси)карбоніл]аміно}бутаноіл)-6,10-діокса-2-азаспіро[4,5]дец-3-іл]-1H-імідазол-4-іл}-4біфеніліл)-1H-імідазол-2-іл]-1-піролідиніл}карбоніл)-2-метилпропіл]карбамат 9 UA 103102 C2 O N N O NH O O N O O O N O O NH NH O NH 1 O N H O N H O N HO O O N HATU, TEA NH2 N H O O O O 3 O 2 N N NH4OAc N H O N H O N dioxane O N NH NH O O O O O Example 1 5 10 15 20 25 30 До перемішуваного розчину ((3S,7S,9S)-7,9-диметил-2-{N-[(метилокси)карбоніл]-L-валіл}6,10-діокса-2-азаспіро[4,5]декан-3-карбонової кислоти (інтермедіат 2) (96 мг, 0,258 ммол) у ДМФ (2 мл) додавали TEA (78 мг, 0,773 ммол) та HATU (108 мг, 0,284 ммол). Після, приблизно, 3 хвил. перемішування уводили метил {(1S)-1-[((2S)-2-{4-[4'-(аміноацетил)-4-біфеніліл]-1Hімідазол-2-іл}-1-піролідиніл)карбоніл]-2-метилпропіл}карбамат дигідрогенхлорид (інтермедіат 1) (149 мг, 0,258 ммол). Після перемішування протягом додаткових 2 год. при к.т. суміш завантажували безпосередньо до РФ ВЕРХ, елюючи 5 − 80 % ацетонітрилом/ водою (0,2 % NH3H2O (конц.)), що дало метил[(1S)-1-({(2S)-2-[4-(4'-{2-[(3S,7S,9S)-7,9-диметил-2-((2S)-3-метил2-{[(метилокси)карбоніл]аміно}бутаноіл)-6,10-діокса-2-азаспіро[4,5]дец-3-іл]-1H-імідазол-4-іл}-4біфеніліл)-1H-імідазол-2-іл]-1-піролідиніл}карбоніл)-2-метилпропіл]карбамат (інтермедіат 3) як 1 -1 тверду речовину (135 мг, вихід: 61%). H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ млн 10,40 - 11,01 (m, 1 H) 7,32 - 8,30 (m, 10 H) 5,28 (br. s., 2 H) 4,53 - 4,96 (m, 4 H) 4,17 - 4,53 (m, 1 H) 3,40 - 4,17 (m, 11 H) 2,83 - 3,22 (m, 1 H) 2,26 - 2,74 (m, 3 H) 1,54 - 2,26 (m, 8 H) 0,47 - 1,43 (m, 18 H). ЕР РХ+ МС m/z = 858,6 (M+H) . До перемішуваного розчину метил[(1S)-1-({(2S)-2-[4-(4'-{2-[(3S,7S,9S)-7,9-диметил-2-((2S)-3метил-2-{[(метилокси)карбоніл]аміно}бутаноіл)-6,10-діокса-2-азаспіро[4,5]дец-3-іл]-1H-імідазол4-іл}-4-біфеніліл)-1H-імідазол-2-іл]-1-піролідиніл}карбоніл)-2-метилпропіл]карбамату (інтермедіат 3) (135 мг, 0,157 ммол) у діоксані (3 мл) додавали амоній ацетат (121 мг, 1,57 o ммол). Реакційну суміш нагрівали до 110 C у герметизованій трубці протягом ночі. Охолоджували до к.т., відфільтровували надлишок амоній ацетату. Фільтрат випаровували та залишок очищували хроматографією на колонці (силікагель, 0 –15% метанол у етилацетат), що дало метил[(1S)-1-({(2S)-2-[4-(4'-{2-[(3S,7S,9S)-7,9-диметил-2-((2S)-3-метил-2{[(метилокси)карбоніл]аміно}бутаноіл)-6,10-діокса-2-азаспіро[4,5]дец-3-іл]-1H-імідазол-4-іл}-4біфеніліл)-1H-імідазол-2-іл]-1-піролідиніл}карбоніл)-2-метилпропіл]карбамат (приклад 1) як 1 -1 тверду речовину (81 мг, вихід: 58%). H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ млн 10,23 - 11,01 (m, 1 H) 7,31 - 8,08 (m, 8 H) 7,23 (d, J=8,03 Гц, 2 H) 5,13 - 5,89 (m, 4 H) 3,34 - 4,69 (m, 13 H) 2,84 - 3,31 (m, 2 H) 2,63 - 2,84 (m, 1 H) 2,29 - 2,53 (m, 1 H) 1,85 - 2,29 (m, 4 H) 1,56 - 1,85 (m, 4 H) 1,16 - 1,47 + (m, 6 H) 0,63 - 1,16 (m, 12 H). ВРМС: (M+H) розраховано: 835,4456; знайдено: 835,4458. Приклад 2: метил[(1S)-2-метил-1-({(2S)-2-[4-(4'-{2-[(8S)-7-((2S)-3-метил-2{[(метилокси)карбоніл]аміно}бутаноіл)-1,4-діокса-7-азаспіро[4,4]нон-8-іл]-1H-імідазол-4-іл}-4біфеніліл)-1H-імідазол-2-іл]-1-піролідиніл}карбоніл)пропіл]карбамат N N N H O N H O N O N NH NH O 35 O O O O Метил[(1S)-2-метил-1-({(2S)-2-[4-(4'-{2-[(8S)-7-((2S)-3-метил-2-{[(метилокси)карбоніл] аміно}бутаноіл)-1,4-діокса-7-азаспіро[4,4]нон-8-іл]-1H-імідазол-4-іл}-4-біфеніліл)-1H-імідазол-2іл]-1-піролідиніл}карбоніл)пропіл]карбамат отримували з (8S)-7-{N-[(метилокси)карбоніл]-Lваліл}-1,4-діокса-7-азаспіро[4,4]нонан-8-карбонової кислоти (інтермедіат 17) та метил {(1S)-1 10 UA 103102 C2 5 [((2S)-2-{4-[4'-(аміноацетил)-4-біфеніліл]-1H-імідазол-2-іл}-1-піролідиніл)карбоніл]-2метилпропіл}карбамату дигідрогенхлориду (інтермедіат 1), а потім − синтетичні процедури в два 1 -1 етапи, подібні описаним у прикладі 1. H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ млн 10,00 - 11,36 (m, 2 H) 7,56 (br. s., 10 H) 7,02 - 7,34 (m, 2 H) 5,05 - 5,89 (m, 4 H) 3,76 - 4,65 (m, 6 H) 3,53 - 3,83 (m, 6 H) 2,77 - 3,54 (m, 2 H) 2,26 - 2,70 (m, 2 H) 1,45 - 2,26 (m, 6 H) 0,61 - 1,25 (m, 12 H). ВРМС: + (M+H) розраховано: 797,3986; знайдено: 797,3981. Приклад 3: диметил (4,4'-біфенілдіілбіс{1H-імідазол-4,2-дііл(3S,7S,9S)-7,9-диметил-6,10діокса-2-азаспіро[4,5]декан-3,2-дііл][(2S)-3-метил-1-оксо-1,2-бутандііл]})біскарбамат O O O N O O O N O O Br O OO O N Br N O N O O O O O O O N O O O O O 2 18 O NH4OAc O N O N O N N O N N N O O O O Example 3 10 15 20 25 30 35 N O Під атмосферою N2 до перемішуваної суспензії 1,1'-(4,4'-біфенілдііл)біс(2-бромоетанон) (113 мг, 0,285 ммол, отриманий згідно із процедурами запропонованими в WO 2009020825) у ацетонітрилі (5 мл) додавали (3S,7S,9S)-7,9-диметил-2-{N-[(метилокси)карбоніл]-L-валіл}-6,10діокса-2-азаспіро[4,5]декан-3-карбонову кислоту (інтермедіат 2) (212 мг, 0,571 мг). а потім 0 додавали TEA (57,5 мг, 0,571 ммол). Суміш перемішували при 50 C поки суспензія ставала прозорою. Після це охолоджували до к.т., реакційну суміш розбавляли етилацетатом та промивали розсолом. Органічну фазу сушили над MgSO 4, фільтрували та випаровували, що дало 4,4'-біфенілдіілбіс-2-оксо-2,1-етандііл(3S,7S,9S,3'S,7'S,9'S)біс(7,9-диметил-2-{N[(метилокси)карбоніл]-L-валіл}-6,10-діокса-2-азаспіро[4,5]декан-3-карбонат) (інтермедіат 18) + (280 мг, кількісн.). ЕР РХ-МС m/z = 979,6 (M+H) . До перемішуваного розчину 4,4'-біфенілдіілбіс-2-оксо-2,1-етандііл (3S,7S,9S,3'S,7'S,9'S)біс(7,9-диметил-2-{N-[(метилокси)карбоніл]-L-валіл}-6,10-діокса-2азаспіро[4,5]декан-3-карбонату) (інтермедіат 18) (280 мг, 0,286 ммол) у діоксані (5 мл) у герметизованій трубці додавали амоній ацетат (441 мг, 5,72 ммол). Реакційну суміш нагрівали o до 110 C протягом ночі. Охолоджували до к.т., відфільтровували надлишок амоній ацетату. Фільтрат випаровували та залишок очищували на колонці (силікагель, 0 –15% метанол у етилацетаті), що дало диметил (4,4'-біфенілдіілбіс{1H-імідазол-4,2-дііл(3S,7S,9S)-7,9-диметил6,10-діокса-2-азаспіро[4,5]декан-3,2-дііл][(2S)-3-метил-1-оксо-1,2-бутандііл]})біскарбамат 1 -1 (приклад 3) як тверду речовину (112 мг, вихід: 40%). H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ млн 10,30 - 10,99 (m, 2 H) 7,68 - 8,00 (m, 2 H) 7,61 (d, J=7,53 Гц, 6 H) 7,26 - 7,35 (m, 4 H) 5,59 (d, J=8,53 Гц, 1 H) 5,23 - 5,39 (m, 1 H) 4,44 (dd, J=8,41, 5,14 Гц, 2 H) 4,02 - 4,23 (m, 4 H) 3,97 (d, J=10,29 Гц, 2 H) 3,72 (s, 6 H) 3,62 (d, J=10,29 Гц, 2 H) 3,04 - 3,32 (m, 2 H) 2,70 (d, J=13,05 Гц, 2 H) + 1,93 (br. s., 2 H) 1,56 - 1,82 (m, 4 H) 1,13 - 1,46 (m, 12 H) 0,60 - 1,02 (m, 12 H). ВРМС: (M+H) розраховано: 939,4980; знайдено: 939,4981. Приклад 4: диметил (4,4'-біфенілдіілбіс{1H-імідазол-4,2-дііл(8S)-1,4-діокса-7азаспіро[4,4]нонан-8,7-дііл(2S)-3-метил-1-оксо-1,2-бутандііл]})біскарбамат 11 UA 103102 C2 O O N O O N O N N O N N N O O N O O 5 10 Диметил (4,4'-біфенілдіілбіс{1H-імідазол-4,2-дііл(8S)-1,4-діокса-7-азаспіро[4,4]нонан-8,7дііл(2S)-3-метил-1-оксо-1,2-бутандііл]})біскарбамат отримували з 1,1'-(4,4'-біфенілдііл)біс(2бромоетанону) та (8S)-7-{N-[(метилокси)карбоніл]-L-валіл}-1,4-діокса-7-азаспіро[4,4]нонан-8карбонової кислоти (інтермедіат 17) застосовуючи спосіб, подібний процедурам у два етапи, 1 -1 описаним у прикладі 3. H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ млн 11,10 - 11,23 (m, 1 H) 10,10 11,63 (m, 2 H) 7,40 - 8,15 (m, 8 H) 7,27 - 7,40 (m, 2 H) 5,23 - 5,88 (m, 2 H) 4,31 (dd, J=8,68, 6,54 Гц, 2 H) 3,83 - 4,21 (m, 10 H) 3,57 - 3,83 (m, 6 H) 3,05 - 3,46 (m, 3 H) 2,47 (dd, J=13,46, 8,59 Гц, 2 H) + 1,51 - 2,20 (m, 2 H) 1,08 (d, J=6,83 Гц, 2 H) 0,60 - 0,97 (m, 12 H). ВРМС: (M+H) розраховано: 855,4041; знайдено: 855,4039. Приклад 5: метил((1S)-1-метил-2-{(3S)-3-[4-(4'-{2-[(2S)-1-((2S)-3-метил-2{[(метилокси)карбоніл]аміно}бутаноіл)-2-піролідиніл]-1H-імідазол-4-іл}-4-біфеніліл)-1H-імідазол2-іл]-6,10-діокса-2-азаспіро[4,5]дец-2-іл}-2-оксоетил)карбамат N NH O 15 20 25 30 O O O N HO O N H N H O N H O O N H N H O N N N N N O N O O NH HATU, TEA O O HN O O До перемішуваного розчину N-[(метилокси)карбоніл]-L-аланіну (22,5 мг, 0,153 ммол, отриманого згідно із процедурою, запропонованою в WO 2003055474), у ДМФ (2 мл) додавали TEA (15,5 мг, 0,153 ммол) та HATU (58,2 мг, 0,153 ммол). Після, приблизно, 3 хвил. перемішування уводили метил[(1S)-1-({(2S)-2-[4-(4'-{2-[(3S)-6,10-діокса-2-азаспіро[4,5]дец-3-іл]1H-імідазол-4-іл}-4-біфеніліл)-1H-імідазол-2-іл]-1-піролідиніл}карбоніл)-2-метилпропіл]карбамат (приклад 19) (100 мг, 0,153 ммол). Після перемішування протягом додаткових 2 год. при к.т. реакційну суміш завантажували безпосередньо до РФ ВЕРХ, елюючи 5 − 80 % ацетонітрилом/ водою (0,2 % NH3H2O(конц.)), що дало метил((1S)-1-метил-2-{(3S)-3-[4-(4'-{2-[(2S)-1-((2S)-3метил-2-{[(метилокси)карбоніл]аміно}бутаноіл)-2-піролідиніл]-1H-імідазол-4-іл}-4-біфеніліл)-1Hімідазол-2-іл]-6,10-діокса-2-азаспіро[4,5]дец-2-іл}-2-оксоетил)карбамат (приклад 5) як тверду 1 -1 речовину (36 мг, вихід: 29%). H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ млн 10,04 - 11,11 (m, 2 H) 7,37 - 8,02 (m, 8 H) 7,18 - 7,36 (m, 2 H) 5,60 (br. s., 2 H) 5,17 - 5,40 (m, 2 H) 3,17 - 4,73 (m, 14 H) 2,79 - 3,19 (m, 1 H) 2,45 - 2,81 (m, 1 H) 2,29 - 2,45 (m, 1 H) 1,49 - 2,29 (m, 8 H) 1,22 - 1,47 (m, 3 H) + 0,73 - 1,16 (m, 6 H). ВРМС: (M+H) розраховано: 783,3830; знайдено: 783,3832. Інтермедіат 19: Отримання метил[(1S)-1-({(2S)-2-[4-(4'-{2-[(3S)-6,10-діокса-2азаспіро[4,5]дец-3-іл]-1H-імідазол-4-іл}-4-біфеніліл)-1H-імідазол-2-іл]-1-піролідиніл}карбоніл)-2метилпропіл]карбамат Інтермедіат 19 можна отримувати як показано в схемі реакції нижче. 12 UA 103102 C2 O N N H O N O O N O O O 21 20 N NH4OAc N dioxane N Pd/C, H2 O N N O NH O O O 19 22 5 O N H N H O O NH O N N O N H O N H O O NH O 1 N O N O O O O N H O N H O N HO NH O O N HATU, TEA NH2 Інтермедіат 21: фенілметил(3S)-3-({[2-(4'-{2-[(2S)-1-((2S)-3-метил-2{[(метилокси)карбоніл]аміно} бутаноіл)-2-піролідиніл]-1H-імідазол-4-іл}-4-біфеніліл)-2оксоетил]аміно}карбоніл)-6,10-діокса-2-азаспіро[4,5]декан-2-карбонат O N O N H O N H O N O N O O NH O 10 15 20 O До перемішуваного розчину (3S)-2-{[(фенілметил)окси]карбоніл}-6,10-діокса-2азаспіро[4,5]декан-3-карбонової кислоти (інтермедіат 20) (878 мг, 2,73 ммол) у ДМФ (10 мл) додавали TEA (829 мг, 8,20 ммол) та HATU (1039 мг, 2,73 ммол). Після, приблизно, 3 хвил. перемішування додавали метил[(1S)-1-({(2S)-2-[4-(4'-{2-[(3S)-6,10-діокса-2-азаспіро[4,5]дец-3-іл]1H-імідазол-4-іл}-4-біфеніліл)-1H-імідазол-2-іл]-1-піролідиніл}карбоніл)-2-метилпропіл]карбамат (інтермедіат 1) (1575 мг, 2,73 ммол). Отриману суміш перемішували протягом додаткових 2 год. при к.т. перед гасінням NaHCO3 (сусп.) та екстрагували EtOAc (3x). Комбіновані органічні шари сушили над Na2SO4, фільтрували та випаровували. Сирий продукт очищували хроматографією на колонці (силікагель, 0 − 6% MeOH (2M аміак) у ДХМ), що дало фенілметил (3S)-3-({[2-(4'-{2[(2S)-1-((2S)-3-метил-2-{[(метилокси)карбоніл] аміно}бутаноіл)-2-піролідиніл]-1H-імідазол-4-іл}-4біфеніліл)-2-оксоетил]аміно} карбоніл)-6,10-діокса-2-азаспіро[4,5]декан-2-карбонат (інтермедіат + 21) як тверду речовину (1,76 г, вихід: 80%). ЕР РХ-МС m/z =807,5 (M+H) . Інтермедіат 22: фенілметил (3S)-3-(4-{4'-[2-((2S)-1-{N-[(метилокси)карбоніл]-L-валіл}-2піролідиніл)-1H-імідазол-4-іл]-4-біфеніліл}-1H-імідазол-2-іл)-6,10-діокса-2-азаспіро[4,5]декан-2карбонат N N N NH O 25 30 O N H O N H O N O O O До перемішуваного розчину (3S)-3-({[2-(4'-{2-[(2S)-1-((2S)-3-метил-2{[(метилокси)карбоніл]аміно}бутаноіл)-2-піролідиніл]-1H-імідазол-4-іл}-4-біфеніліл)-2оксоетил]аміно}карбоніл)-6,10-діокса-2-азаспіро[4,5]декан-2-карбонату (інтермедіат 21) (1,76 г, 2,18 ммол) у діоксані (5 мл) у герметизованій трубці додавали амоній ацетат (1,68d, 21,8 ммол). o Реакційну суміш нагрівали до 110 C протягом ночі. Охолоджували до к.т., відфільтровували надлишок амоній ацетату. Фільтрат випаровували та залишок очищували на колонці (силікагель, 0 –15% метанол у етилацетаті), що дало фенілметил (3S)-3-(4-{4'-[2-((2S)-1-{N[(метилокси)карбоніл]-L-валіл}-2-піролідиніл)-1H-імідазол-4-іл]-4-біфеніліл}-1H-імідазол-2-іл)6,10-діокса-2-азаспіро[4,5]декан-2-карбонат (інтермедіат 22) (1,44 г, вихід 84%) як піну. ЕР РХ+ МС m/z =788,5 (M+H) . 13 UA 103102 C2 Інтермедіат 19: метил[(1S)-1-({(2S)-2-[4-(4'-{2-[(3S)-6,10-діокса-2-азаспіро[4,5]дец-3-іл]-1Hімідазол-4-іл}-4-біфеніліл)-1H-імідазол-2-іл]-1-піролідиніл}карбоніл)-2-метилпропіл]карбамат N N N O N H N H O N O NH O 5 10 O Фенілметил (3S)-3-(4-{4'-[2-((2S)-1-{N-[(метилокси)карбоніл]-L-валіл}-2-піролідиніл)-1Hімідазол-4-іл]-4-біфеніліл}-1H-імідазол-2-іл)-6,10-діокса-2-азаспіро[4,5]декан-2-карбонат (інтермедіат 22) (1,44 г,1,83 ммол) гідрогенізували в етанолі (100 мл) з балону з каталізатором Pd/C протягом 20 год., що дало метил[(1S)-1-({(2S)-2-[4-(4'-{2-[(3S)-6,10-діокса-2азаспіро[4,5]дец-3-іл]-1H-імідазол-4-іл}-4-біфеніліл)-1H-імідазол-2-іл]-1-піролідиніл}карбоніл)-2+ метилпропіл]карбамат (інтермедіат 19). ЕР РХ-МС m/z =654,4 (M+H) . Інтермедіат 20: (3S)-2-{[(фенілметил)окси]карбоніл}-6,10-діокса-2-азаспіро[4,5]декан-3карбонова кислота Інтермедіат 20 можна отримувати як показано в схемі реакції нижче. O O O OH N O O swern O N O O O O O O N O O O HO N O O O 23 24 O O 20 Інтермедіат 23: 2-метил 1-(фенілметил) (2S)-4-оксо-1,2-піролідиндикарбонат O O N O O O 15 20 25 30 При -78ºC до перемішуваного розчину оксалілхлориду (5,97 г, 47 ммол) у ДХМ (200 мл) повільно додавали ДМСО (4,8 г, 61,5 ммол). Після 10 хвил. перемішування розчин 2-метил 1(фенілметил) (2S,4R)-4-гідрокси-1,2-піролідиндикарбонату (10,1 г, 36,2 ммол) у ДХМ (30 мл) переносили до реакційної колби. Перемішування продовжували протягом 60 хвил. перед додаванням триетиламіну (10,98 г, 108 ммол). Охолоджувальну баню потім видаляли та реакційній суміші дозволяли повільно нагріватися до 0ºC, та гасили насич. розчином NH4Cl. Шари відокремлювали, та водний шар екстрагували ДХМ (2X). Комбіновані органічні шари сушили над MgSO 4, фільтрували та випаровували Сирий продукт очищували хроматографією на колонці (силікагель 0 − 50% етилацетат у гексані), що дало 2-метил 1-(фенілметил) (2S)-4-оксо-1,2-піролідин гідрогенкарбонат (інтермедіат 23) (6,3 г, 1 -1 вихід: 63%). H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ млн 7,29 - 7,56 (m, 5 H) 5,08 - 5,37 (m, 2 H) 4,80 - 5,02 (m, 1 H) 3,89 - 4,08 (m, 2 H) 3,53 - 3,88 (m, 3 H) 2,95 (dd, J=18,82, 10,79 Гц, 1 H) 2,63 (dd, 1 H). Інтермедіат 24: 3-метил 2-(фенілметил) (3S)-6,10-діокса-2-азаспіро[4,5]декан-2,3гідрогенкарбонат 14 UA 103102 C2 O O O N O O O 5 3-Метил 2-(фенілметил) (3S)-6,10-діокса-2-азаспіро[4,5]декан-2,3-гідрогенкарбонат (інтермедіат 24) (1,02 г, вихід 84%) отримували з 2-метил 1-(фенілметил) (2S)-4-оксо-1,2піролідингідрогенкарбонату (1,0 г, 3,61 ммол) та 1,3-пропандіолу (0,55 г, 7,21 ммол) за 1 процедурою, подібною описаній в отриманні інтермедіату 14 H ЯМР (400 МГц, ХЛОРОФОРМ-d) -1 δ млн 7,05 - 7,61 (m, 5 H) 4,91 - 5,25 (m, 2 H) 4,29 - 4,68 (m, 1 H) 3,75 - 4,07 (m, 5 H) 3,38 - 3,75 + (m, 4 H) 2,25 - 2,67 (m, 2 H) 1,51 - 2,00 (m, 1H). ЕР РХ-МС m/z =336,6 (M+H) . Інтермедіат 20: (3S)-2-{[(фенілметил)окси]карбоніл}-6,10-діокса-2-азаспіро[4,5]декан-3карбонова кислота O O HO N O O O 10 15 (3S)-2-{[(фенілметил)окси]карбоніл}-6,10-діокса-2-азаспіро[4,5]декан-3-карбонову кислоту (інтермедіат 20) (878 мг, вихід :90%) отримували з 3-метил 2-(фенілметил) (3S)-6,10-діокса-2азаспіро[4,5]декан-2,3-гідрогенкарбонату (інтермедіат 24) (1,02 г, 3,04 ммол) та LiOH (80 мг, 3,35 ммол), за процедурою, подібною описаній в отриманні інтермедіату 2. ЕР РХ-МС m/z =322,2 + (M+H) . Інтермедіати 26, 27, 28, 29, 31, 33 та 34 отримували, застосовуючи процедури подібні описаній в отриманні інтермедіату 20: O O O OH N O TsOH OH O O HO O O O N O O O LiOH N O O O O 23 20 Інтермедіат 25: гідрогенкарбонат-d2 3-метил 2-(фенілметил) (3S)-6,10-діокса-2-азаспіро[4,5]декан-2,3 O O O N O D O D O 1 25 -1 H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ млн 7,27 - 7,46 (m, 5 H) 4,97 - 5,27 (m, 2 H) 4,29 - 4,64 + (m, 1 H) 3,72 - 4,02 (m, 6 H) 3,49 - 3,72 (m, 3 H) 2,19 - 2,67 (m, 2 H). ЕР РХ-МС m/z =338,2 (M+H) . Інтермедіат 26: (3S)-2-{[(фенілметил)окси]карбоніл}-6,10-діокса-2-азаспіро[4,5]декан-3карбонова кислота-d2 15 UA 103102 C2 O O N O D O HO D O + ЕР РХ-МС m/z =324,2 (M+H) . Інтермедіат 27: (3S)-8,8-диметил-2-{[(фенілметил)окси]карбоніл}-6,10-діокса-2азаспіро[4,5]декан-3-карбонова кислота O O HO N O O O 5 Інтермедіат 28: карбонова кислота-d6 O D N O D D O D O 10 D D O HO Інтермедіат 29: карбонова кислота-d4 O D O HO O N O (3S)-2-{[(фенілметил)окси]карбоніл}-6,10-діокса-2-азаспіро[4,5]декан-3 (8S)-7-{[(фенілметил)окси]карбоніл}-1,4-діокса-7-азаспіро[4,4]нонан-8 D D D O Інтермедіат 30: 8-метил 7-(фенілметил) азаспіро[4,4]нонан-7,8-гідрогенкарбонат (2R,3R,8S)-2,3-диметил-1,4-діокса-7 O O O N O O 15 1 O -1 H ЯМР (400 МГц, ДМСО-d6) δ млн 1,12 - 1,24 (m, 6 H), 2,00 - 2,18 (m, 1 H), 2,35 - 2,46 (m, 1 H), 3,32 (s, 1 H), 3,35 - 3,44 (m, 1 H), 3,56 (s, 2 H), 3,64 (s, 3 H), 4,28 - 4,37 (m, 1 H), 4,38 - 4,45 (m, 0 H), 5,09 (s, 2 H), 7,24 - 7,41 (m, 5 H) + РХ-МС ( ЕРІ ): m/z = 350,1(M+H) ; Інтермедіат 31: (2R,3R,8S)-2,3-диметил-7-{[(фенілметил)окси]карбоніл}-1,4-діокса-7 16 UA 103102 C2 азаспіро[4,4]нонан-8-карбонова кислота O O H O N O O O + 5 РХ-МС ( ЕРІ ): m/z = 336,2(M+H) ; Інтермедіат 32: 8-метил 7-(фенілметил) азаспіро[4,4]нонан-7,8-гідрогенкарбонат (2S,3S,8S)-2,3-диметил-1,4-діокса-7 O O O N O O O 1 10 -1 H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ млн 1,18 - 1,31 (m, 6 H), 2,23 (dd, J=13,1, 5,9 Гц, 1 H), 2,39 (dt, J=13,1, 8,0 Гц, 1 H), 3,49 - 3,66 (m, 6 H), 3,76 (s, 1 H), 4,39 - 4,56 (m, 1 H), 4,98 - 5,26 (m, 2 H), 7,36 (s, 5H) + РХ-МС (ЕРІ): m/z = 350,1(M+H) ; Інтермедіат 33: (2S,3S,8S)-2,3-диметил-7-{[(фенілметил)окси]карбоніл}-1,4-діокса-7азаспіро[4,4]нонан-8-карбонова кислота O O H O N O O O + 15 РХ-МС ( ЕРІ ): m/z = 336,2(M+H) ; Інтермедіат 34: (5'S)-1'-{[(фенілметил)окси]карбоніл}тетрагідроспіро[фуро[3,4-d][1,3]діоксол2,3'-піролідин]-5'-карбонова кислота O H O O N O O O O + 20 РХ-МС ( ЕРІ ): m/z = 350,2(M+H) ; Приклад 6: метил[(1S)-2-метил-1-({(2S)-2-[4-(4'-{2-[(3S)-2-((2S)-3-метил-2{[(метилокси)карбоніл]аміно}бутаноіл)-6,10-діокса-2-азаспіро[4,5]дец-3-іл]-1H-імідазол-4-іл}-4біфеніліл)-1H-імідазол-2-іл]-1-піролідиніл}карбоніл)пропіл]карбамат 17 UA 103102 C2 N N O N H O NH N N H O HN O 5 10 O N O O O Метил[(1S)-2-метил-1-({(2S)-2-[4-(4'-{2-[(3S)-2-((2S)-3-метил-2-{[(метилокси)карбоніл] аміно}бутаноіл)-6,10-діокса-2-азаспіро[4,5]дец-3-іл]-1H-імідазол-4-іл}-4-біфеніліл)-1H-імідазол-2іл]-1-піролідиніл}карбоніл)пропіл]карбамат (47 мг, вихід: 53%) отримували з метил[(1S)-1-({(2S)2-[4-(4'-{2-[(3S)-6,10-діокса-2-азаспіро[4,5]дец-3-іл]-1H-імідазол-4-іл}-4-біфеніліл)-1H-імідазол-2іл]-1-піролідиніл}карбоніл)-2-метилпропіл]карбамату (інтермедіат 19) (68 мг, 0,104 ммол), N[(метилокси)карбоніл]-L-валіну (18,2 мг, 0,104) та HATU (40 мг, 0,104 ммол), за процедурою, 1 -1 подібною описаній в прикладі 5. H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ млн 10,20 - 11,06 (m, 2 H) 7,35 - 8,02 (m, 8 H) 7,22 (d, J=7,78 Гц, 2 H) 4,97 - 5,89 (m, 4 H) 3,22 - 4,58 (m, 15 H) 2,83 - 3,20 (m, 1 H) 2,58 - 2,83 (m, 1 H) 2,29 - 2,58 (m, 1 H) 1,57 - 2,31 (m, 8 H) 0,64 - 1,22 (m, 12 H). ВРМС: + (M+H) розраховано: 811,4143; знайдено: 811,4142. Продукти в прикладах 7 - 11 отримували, застосовуючи синтетичні послідовності, подібні описаним в прикладі 5 O N N O NH O N O HO N O O N O O NH O O O O O N H O N H O NH2 N H O O N HATU, TEA O 1 N N NH4OAc N dioxane N O Pd/C, H2 N O N H N H O N O O NH O N N O N H O N H O NH O O N N N H O N O O N H O NH HATU, TEA O HN N O HO O 15 N H O O O O Приклад 7: метил[(1S)-1-({(2S)-2-[4-(4'-{2-[(3S)-8,8-диметил-2-((2S)-3-метил-2{[(метилокси)карбоніл]аміно}бутаноіл)-6,10-діокса-2-азаспіро[4,5]дец-3-іл]-1H-імідазол-4-іл}-4біфеніліл)-1H-імідазол-2-іл]-1-піролідиніл}карбоніл)-2-метилпропіл]карбамат O N N O N O N N 1 O N N O 20 O O O N O -1 H ЯМР (400 МГц, ДМСО-d6) δ (млн ) 11,84 (br. s., 1 H), 11,80 (br. s, 1H), 7,90-7,60 (br. m, 9H), 7,52 (s, 1H), 7,36-7,25 (br. m, 2H), 5,09 (br. m, 1H), 4,98 (m, 1H), 4,49 (br. m, 1H), 4,14-4,02 (br. m, 18 UA 103102 C2 5 2H), 3,81 (br, 2H), 3,73-3,40 (br. m, 11H), 2,65 (m, 1H), 2,43-2,09 (br. m, 3H), 2,07-1,81 (br. m, 4H), 1,05-0,75 (br. m, 18H) + ЕР РХ-МС m/z = 839 (M + H) Чистота (РХ/МС) 96% Приклад 8: метил[(1S)-2-метил-1-({(2S)-2-[4-(4'-{2-[(3S)-2-((2S)-3-метил-2{[(метилокси)карбоніл]аміно}бутаноіл)-6,10-діокса-2-азаспіро[4,5]дец-3-іл]-1H-імідазол-4-іл}-4біфеніліл)-1H-імідазол-2-іл]-1-піролідиніл}карбоніл)пропіл]карбамат-d6 D D DD D O N N O N N N O N N O O O 15 -1 H ЯМР (400 МГц, CD3OD) δ млн 7,62 (m, 8H), 7,29 (m, 2H), 5,17 (m, 2H), 4,20 (m, 2H), 4,00 (m, 2H), 3,88 (m, 2H), 3,65 (s, 6H), 2,65 - 2,03 (m, 8H), 0,90 (m, 12H). + РХ-МС для C43H48N8O8D6 (M + H) розраховано: 817, знайдено: 817. + ВРМС для C43H48N8O8D6 (M + H) розраховано: 817,4519, знайдено: 817,4517 Чистота (РХ/МС) 95% Приклад 9: метил[(1S)-2-метил-1-({(2S)-2-[4-(4'-{2-[(8S)-7-((2S)-3-метил-2{[(метилокси)карбоніл]аміно}бутаноіл)-1,4-діокса-7-азаспіро[4,4]нон-8-іл]-1H-імідазол-4-іл}-4біфеніліл)-1H-імідазол-2-іл]-1-піролідиніл}карбоніл)пропіл]карбамат-d4 D D O N N O O N N N O O N -1 H ЯМР (400 МГц, CD3OD) δ млн 7,60 (m, 8H), 7,28 (m, 2H), 5,17 (m, 2H), 4,23 (m, 1H), 4,15 (m, 1H), 4,06 (m, 1H), 3,97 (m, 1H), 3,88 (m, 2H), 3,64 (s, 6H), 2,50 - 2,00 (m, 8H), 0,90 (m, 12H). + РХ-МС для C42H48N8O8D4 (M + H) розраховано: 801, знайдено: 801. + ВРМС для C42H48N8O8D4 (M + H) розраховано: 801,4237, знайдено: 801,4238 Чистота (РХ/МС) 91% Приклад 10: метил[(1S)-1-({(2S)-2-[4-(4'-{2-[(2R,3R,8S)-2,3-диметил-7-((2S)-3-метил-2{[(метилокси)карбоніл]аміно}бутаноіл)-1,4-діокса-7-азаспіро[4,4]нон-8-іл]-1H-імідазол-5-іл}-4біфеніліл)-1H-імідазол-2-іл]-1-піролідиніл}карбоніл)-2-метилпропіл]карбамат N N N H O N O N H O N HN O 30 D O O 1 25 D N N O 20 N O 1 10 O D 1 O NH O O O -1 H ЯМР (400 МГц, ДМСО-d6) δ млн 0,85 (d, J=6,4 Гц, 12 H), 1,24 (dd, J=11,9, 5,8 Гц, 6 H), 1,87 - 2,06 (m,4 H), 2,08 - 2,21 (m, 2 H), 2,34 - 2,43 (m, 1 H), 3,54 (s, 6 H), 3,59 - 3,68 (m, 2 H), 3,69 - 3,75 (m, 2 H), 3,81(br. s., 2 H), 3,97 - 4,14 (m, 3 H), 5,00 - 5,17 (m, 2 H), 7,25 - 7,33 (m, 2 H), 7,49 7,54 (m, 2 H), 7,62 - 7,71(m, 4 H), 7,78 (d, J=7,7 Гц, 4 H), 11,79 (br. s., 2 H); РХ-МС ( ЕРІ ): m/z = + + 825,5(M+H) ; ВРМС: (M+H) розраховано, 825,4299; знайдено, 825,4302. Чистота: 92% Приклад 11: метил[(1S)-1-({(2S)-2-[4-(4'-{2-[(2S,3S,8S)-2,3-диметил-7-((2S)-3-метил-2{[(метилокси)карбоніл]аміно}бутаноіл)-1,4-діокса-7-азаспіро[4,4]нон-8-іл]-1H-імідазол-5-іл}-4біфеніліл)-1H-імідазол-2-іл]-1-піролідиніл}карбоніл)-2-метилпропіл]карбамат 19 UA 103102 C2 N N N O N H O N H O N HN O O NH O O O 1 5 -1 H ЯМР (400 МГц, ДМСО-d6) δ млн 0,70 - 0,96 (m, 7 H), 1,12 - 1,35 (m, 4 H), 1,85 - 2,04 (m, 3 H), 2,04 -2,25 (m, 2 H), 2,31 - 2,47 (m, 1 H), 3,33 (s, 7 H), 3,45 - 3,61 (m, 8 H), 3,63 - 3,89 (m, 7 H), 3,94 - 4,15 (m, 4H), 4,91 - 5,17 (m, 2 H), 7,20 - 7,40 (m, 2 H), 7,49 - 7,59 (m, 1 H), 7,60 - 7,70 (m, 2 H), 7,70 - 7,81 (m, 2 H), 7,81 - 7,93 (m, 2 H), 7,96 - 8,08 (m, 0 H), 11,59 - 12,00 (m, 2 H); РХ-МС ( + + ЕРІ ): m/z 825,5(M+H) ; ВРМС: (M+H) розраховано, 825,4299; знайдено, 825,4302. Інтермедіат 36: (8S)-7-{[(фенілметил)окси]карбоніл}-1,4-дитіа-7-азаспіро[4,4]нонан-8карбонова кислота O O O HS N O O SH N 35: 8-метил S O 36 35 Інтермедіат гідрогенкарбонат N O S O 23 S HO S O O 10 O O 7-(фенілметил) (8S)-1,4-дитіа-7-азаспіро[4,4]нонан-7,8 O O S N O S O 15 20 До перемішуваного розчину 2-метил 1-(фенілметил) (2S)-4-оксо-1,2піролідингідрогенкарбонату (інтермедіат 23) (680 мг, 2,452 ммол) у безводному ДХМ (50 мл) додавали 1,2-етантіодіол (462 мг, 4,9 ммол), а потім − BF3 етерат (139 мг, 0,4 ммол). Отриману суміш перемішували протягом ночі при к.т. перед гасінням NaHCO 3 (сусп.). Шари відокремлювали та органічний шар сушили, фільтрували та випаровували. Залишок очищували хроматографією на колонці (силікагель, 0 − 50 % етилацетат у гексані), що дало 8-метил 7(фенілметил) (8S)-1,4-дитіа-7-азаспіро[4,4]нонан-7,8-гідрогенкарбонат (інтермедіат 35) як олію. 1 -1 H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ млн 7,28 - 7,48 (m, 5 H) 4,95 - 5,35 (m, 2 H) 4,34 - 4,63 (m, 1 H) 3,90 - 4,11 (m, 1 H) 3,82 - 3,90 (m, 1 H) 3,78 (s, 2 H) 3,50 - 3,69 (m, 1 H) 3,15 - 3,45 (m, 4 H) 2,74 (ddd, J=13,30, 7,78, 1,25 Гц, 1 H) 2,40 - 2,64 (m, 1 H). ЕР РХ-МС m/z =354,2 (M+H). Інтермедіат 36: (8S)-7-{[(фенілметил)окси]карбоніл}-1,4-дитіа-7-азаспіро[4,4]нонан-8карбонова кислота O S HO N O S O 25 30 (8S)-7-{[(Фенілметил)окси]карбоніл}-1,4-дитіа-7-азаспіро[4,4]нонан-8-карбонова (інтермедіат 36) кислота (36) (640 мг, вихід: 84%) отримували з 8-метил 7-(фенілметил) (8S)-1,4-дитіа-7азаспіро[4,4]нонан-7,8-гідрогенкарбонату (798 мг, 2,25 ммол) та LiOH (60 мг, 2,5 ммол), за процедурою, описаною в отриманні інтермедіату 2. ЕР РХ-МС m/z =340,1 (M+H). Інтермедіат 39: Отримання метил[(1S)-1-({(2S)-2-[4-(4'-{2-[(8S)-1,4-дитіа-7-азаспіро[4,4]нон-8 20 UA 103102 C2 іл]-1H-імідазол-4-іл}-4-біфеніліл)-1H-імідазол-2-іл]-1-піролідиніл}карбоніл)-2метилпропіл]карбамат O N N O S HO NH O N N O O NH4OAc 37 N N N S triflic acid N S N H N H O N S TFA O NH O N N S N H O N H O dioxane NH O O 38 5 O 36 N S NH S 1 S N O O O O N H O N H O NH2 N H O O N HATU, TEA O 39 Інтермедіат 37: фенілметил(8S)-8-({[2-(4'-{2-[(2S)-1-((2S)-3-метил-2{[(метилокси)карбоніл]аміно} бутаноіл)-2-піролідиніл]-1H-імідазол-4-іл}-4-біфеніліл)-2оксоетил]аміно}карбоніл)-1,4-дитіа-7-азаспіро[4,4]нонан-7-карбонат O N S N H O N H O N O N S O NH O 10 15 20 O Фенілметил (8S)-8-({[2-(4'-{2-[(2S)-1-((2S)-3-метил-2-{[(метилокси)карбоніл]аміно} бутаноіл)-2піролідиніл]-1H-імідазол-4-іл}-4-біфеніліл)-2-оксоетил]аміно}карбоніл)-1,4-дитіа-7азаспіро[4,4]нонан-7-карбонат (інтермедіат 37) (584 мг, вихід 68%) отримували з метил {(1S)-1[((2S)-2-{4-[4'-(аміноацетил)-4-біфеніліл]-1H-імідазол-2-іл}-1-піролідиніл) карбоніл]-2метилпропіл}карбамат дигідрогенхлорид (інтермедіат 1) (603 мг, 1,046 ммол), (8S)-7{[(фенілметил)окси]карбоніл}-1,4-дитіа-7-азаспіро[4,4]нонан-8-карбонова кислота (інтермедіат 36) (355 мг, 1,046 ммол) та HATU (498 мг, 1,046 ммол), за процедурою, подібною описаній в 1 -1 отриманні інтермедіату 21. H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ млн 7,88 - 8,03 (m, 2 H) 7,45 7,85 (m, 6 H) 7,05 - 7,45 (m, 6 H) 5,61 (br. s., 1 H) 4,98 - 5,41 (m, 2 H) 4,42 - 4,92 (m, 2 H) 4,35 (t, J=7,78 Гц, 1 H) 3,93 - 4,06 (m, 1 H) 3,86 (d, J=8,78 Гц, 3 H) 3,62 - 3,80 (m, 4 H) 3,35 (d, J=5,02 Гц, 4 H) 3,21 (d, J=7,28 Гц, 1 H) 2,61 - 2,96 (m, 2 H) 2,24 (br. s., 2 H) 1,93 - 2,16 (m, 2 H) 0,98 - 1,17 (m, 3 H) 0,91 (t, J=7,15 Гц, 6 H). ЕР РХ-МС m/z =825,2 (M+H). Інтермедіат 38: фенілметил (8S)-8-(4-{4'-[2-((2S)-1-{N-[(метилокси)карбоніл]-L-валіл}-2піролідиніл)-1H-імідазол-4-іл]-4-біфеніліл}-1H-імідазол-2-іл)-1,4-дитіа-7-азаспіро[4,4]нонан-7карбонат N N N NH O 25 30 S N H O N H O N S O O Фенілметил (8S)-8-(4-{4'-[2-((2S)-1-{N-[(метилокси)карбоніл]-L-валіл}-2-піролідиніл)-1Hімідазол-4-іл]-4-біфеніліл}-1H-імідазол-2-іл)-1,4-дитіа-7-азаспіро[4,4]нонан-7-карбонат (інтермедіат 38) (497 мг, 87%) отримували з фенілметил (8S)-8-({[2-(4'-{2-[(2S)-1-((2S)-3-метил-2{[(метилокси)карбоніл]аміно}бутаноіл)-2-піролідиніл]-1H-імідазол-4-іл}-4-біфеніліл)-2оксоетил]аміно}карбоніл)-1,4-дитіа-7-азаспіро[4,4]нонан-7-карбонату (інтермедіат 37) (584 мг, 0,71 ммол) та амоній ацетату (546 мг, 7,1 ммол), за процедурою, подібною описаній в отриманні інтермедіату (22). ЕР РХ-МС m/z =806,4 (M+H). Інтермедіат 39: метил[(1S)-1-({(2S)-2-[4-(4'-{2-[(8S)-1,4-дитіа-7-азаспіро[4,4]нон-8-іл]-1Hімідазол-4-іл}-4-біфеніліл)-1H-імідазол-2-іл]-1-піролідиніл}карбоніл)-2-метилпропіл]карбамат 21 UA 103102 C2 N N N H O N S N H S N NH O 5 10 O При к.т., до перемішуваного розчину фенілметил (8S)-8-(4-{4'-[2-((2S)-1-{N[(метилокси)карбоніл]-L-валіл}-2-піролідиніл)-1H-імідазол-4-іл]-4-біфеніліл}-1H-імідазол-2-іл)-1,4дитіа-7-азаспіро[4,4]нонан-7-карбонату (інтермедіат 38) (497 мг, 0,617 ммол) у ТФОК (6 мл) додавали трифлуороцтову кислоту (278 мг, 1,85 ммол). Отриману суміш перемішували при к.т. протягом 3 год. Випаровували розчинники, нейтралізували з NaHCO3(сусп.) та водну фазу екстрагували ДХМ (15% ІПС) (3X). Комбіновані органічні фази сушили, фільтрували та випаровували, що дало метил[(1S)-1-({(2S)-2-[4-(4'-{2-[(8S)-1,4-дитіа-7-азаспіро[4,4]нон-8-іл]-1Hімідазол-4-іл}-4-біфеніліл)-1H-імідазол-2-іл]-1-піролідиніл}карбоніл)-2-метилпропіл]карбамат (інтермедіат 39) (400 мг, вихід: 97%). ЕР РХ-МС m/z =672,2 (M+H). Приклад 12: метил[(1S)-2-метил-1-({(2S)-2-[4-(4'-{2-[(8S)-7-((2S)-3-метил-2{[(метилокси)карбоніл]аміно}бутаноіл)-1,4-дитіа-7-азаспіро[4,4]нон-8-іл]-1H-імідазол-4-іл}-4біфеніліл)-1H-імідазол-2-іл]-1-піролідиніл}карбоніл)пропіл]карбамат N N N H O N NH O 15 20 25 O O N S N O N O N O 40 O Метил[(1S)-2-метил-1-({(2S)-2-[4-(4'-{2-[(8S)-7-((2S)-3-метил-2-{[(метилокси)карбоніл] аміно}бутаноіл)-1,4-дитіа-7-азаспіро[4,4]нон-8-іл]-1H-імідазол-4-іл}-4-біфеніліл)-1H-імідазол-2іл]-1-піролідиніл}карбоніл)пропіл]карбамат (88 мг, вихід: 27%) отримували з метил[(1S)-1-({(2S)2-[4-(4'-{2-[(8S)-1,4-дитіа-7-азаспіро[4,4]нон-8-іл]-1H-імідазол-4-іл}-4-біфеніліл)-1H-імідазол-2-іл]1-піролідиніл}карбоніл)-2-метилпропіл] карбамату (інтермедіат 39) (250 мг, 0,372 ммол), N[(метилокси)карбоніл]-L-валіну (65 мг, 0,372 ммол) та HATU (141 мг, 0,372 ммол), за 1 -1 процедурою, подібною описаній в прикладі 5. H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ млн 10,07 11,08 (m, 2 H) 7,82 (br. s., 3 H) 7,58 (d, J=6,02 Гц, 5 H) 7,10 - 7,30 (m, 2 H) 5,54 (d, J=9,29 Гц, 2 H) 5,17 - 5,42 (m, 3 H) 4,01 - 4,48 (m, 2 H) 3,23 - 4,03 (m, 10 H) 2,70 - 3,19 (m, 2 H) 2,30 - 2,49 (m, 1 H) 1,91 - 2,29 (m, 4 H) 1,19 - 1,56 (m, 4 H) 1,07 (dd, J=10,54, 7,03 Гц, 2 H) 0,58 - 0,97 (m, 10 H). + ВРМС: (M+H) розраховано: 829,3530; знайдено: 829,3534. Приклад 13: метил[(1S)-2-метил-1-({(2S)-2-[4-(4'-{2-[(8S)-7-((2S)-2-{[(метилокси) карбоніл]аміно}бутаноіл)-1,4-дитіа-7-азаспіро[4,4]нон-8-іл]-1H-імідазол-4-іл}-4-біфеніліл)-1Hімідазол-2-іл]-1-піролідиніл}карбоніл)пропіл]карбамат N 35 S N HN N 30 S N H O N S N O O O Метил[(1S)-2-метил-1-({(2S)-2-[4-(4'-{2-[(8S)-7-((2S)-2-{[(метилокси)карбоніл] аміно} бутаноіл)1,4-дитіа-7-азаспіро[4,4]нон-8-іл]-1H-імідазол-4-іл}-4-біфеніліл)-1H-імідазол-2-іл]-1піролідиніл}карбоніл)пропіл]карбамат (35 мг, вихід: 27%) отримували з метил[(1S)-1-({(2S)-2-[4(4'-{2-[(8S)-1,4-дитіа-7-азаспіро[4,4]нон-8-іл]-1H-імідазол-4-іл}-4-біфеніліл)-1H-імідазол-2-іл]-1піролідиніл}карбоніл)-2-метилпропіл]карбамату (інтермедіат 39) (100 мг, 0,149 ммол), (2S)-2{[(метилокси)карбоніл]аміно}бутанової кислоти (24 мг, 0,15 ммол) та HATU (56,5 мг, 0,149 ммол), 1 -1 за процедурою, подібною описаній в прикладі 5. H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ млн 9,99 - 11,64 (m, 2 H) 7,53 (br. s., 8 H) 7,12 - 7,34 (m, 2 H) 5,26 (br. s., 2 H) 3,18 - 4,64 (m, 17 H) 2,79 (br. + s., 2 H) 1,43 - 2,62 (m, 8 H) 0,70 - 1,19 (m, 9 H). ВРМС: (M+H) розраховано: 815,3373; знайдено: 815,3373. Приклад 14: метил[(1S)-2-метил-1-({(2S)-2-[4-(4'-{2-[(8S)-7-({[(метилокси)карбоніл] 22 UA 103102 C2 аміно}ацетил)-1,4-дитіа-7-азаспіро[4,4]нон-8-іл]-1H-імідазол-4-іл}-4-біфеніліл)-1H-імідазол-2-іл]1-піролідиніл}карбоніл)пропіл]карбамат N N S N H O N H O NH HN N O 5 10 15 O S N O O Метил[(1S)-2-метил-1-({(2S)-2-[4-(4'-{2-[(8S)-7-({[(метилокси)карбоніл]аміно}ацетил)-1,4дитіа-7-азаспіро[4,4]нон-8-іл]-1H-імідазол-4-іл}-4-біфеніліл)-1H-імідазол-2-іл]-1піролідиніл}карбоніл)пропіл]карбамат (14 мг, вихід: 24%) отримували з метил[(1S)-1-({(2S)-2-[4(4'-{2-[(8S)-1,4-дитіа-7-азаспіро[4,4]нон-8-іл]-1H-імідазол-4-іл}-4-біфеніліл)-1H-імідазол-2-іл]-1піролідиніл}карбоніл)-2-метилпропіл]карбамату (інтермедіат 39) (50 мг, 0,074 ммол), N[(метилокси)карбоніл]гліцину (10 мг, 0,074 ммол) та HATU (28,3 мг, 0,074 ммол), за процедурою, 1 -1 подібною описаній в прикладі 5. H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ млн 9,86 - 11,31 (m, 2 H) 7,50 (br. s., 8 H) 6,91 - 7,27 (m, 2 H) 5,41 - 6,31 (m, 2 H) 5,24 (br. s., 2 H) 3,12 - 4,45 (m, 18 H) 2,77 + (br. s., 2 H) 1,77 - 2,50 (m, 4 H) 0,58 - 1,15 (m, 6 H). ВРМС: (M+H) розраховано: 787,3055; знайдено: 787,3056. Приклад 15: метил[(1S)-2-метил-1-({(2S)-2-[4-(4'-{2-[2-((2S)-3-метил-2{[(метилокси)карбоніл]аміно}бутаноіл)-8-окса-2-азаспіро[4,5]дец-3-іл]-1H-імідазол-4-іл}-4біфеніліл)-1H-імідазол-2-іл]-1-піролідиніл}карбоніл)пропіл]карбамат O N N N O N N O N N N 20 25 O O O O Розчин метил((1S)-2-метил-1-{[(2S)-2-(4-{4'-[({[2-((2S)-3-метил-2{[(метилокси)карбоніл]аміно}бутаноіл)-8-окса-2-азаспіро[4,5]дец-3-іл]карбоніл}аміно)ацетил]-4біфеніліл}-1H-імідазол-2-іл)-1-піролідиніл]карбоніл}пропіл)карбамату (інтермедіат 104) (131 мг, 0,16 ммол) та амоній ацетату (122 мг, 1,6 ммол) у діоксані (2 мл) дегазували та нагрівали до 110 0 C у герметизованій трубці протягом 18 год. Реакцію охолоджували до кімнатної температури та розбавляли етилацетатом і фільтрували та концентрували у вакуумі. Залишок очищували C 18 РФ-хроматографією, елюючи 10-90% водою/ацетонітрилом/0,2% NH4OH, що дало не зовсім 1 -1 білу тверду речовину (44 мг, 34% вихід). H ЯМР (400 МГц, МЕТАНОЛ-d4) δ млн 7,55 - 7,87 (m, 8 H) 7,32 (br. s., 4 H) 5,02 - 5,23 (m, 3 H) 4,13 - 4,34 (m, 4 H) 3,93 - 4,04 (m, 1 H) 3,88 (br. s., 2 H) 3,49 - 3,84 (m, 8 H) 1,86 - 2,54 (m, 10 H) 1,45 - 1,84 (m, 4 H) 0,69 - 1,12 (m, 12 H). ВРМС для + C44H57N8O7 (M + H) розраховано: 809,4350, знайдено: 809,4346. Чистота (РХ-МС): 96%. Отримання інтермедіату 104 O O O HATU, DIEA, CH2Cl2 O N H O LiOH O OH N THF-water-MeOH 101 N O 102 O N O O O O O HO N O 103 N O O O O O O O O NH2 103 HATU, DIEA N CH2Cl2 1 N N O N N 30 N N N O O N O O 104 O Інтермедіат 101: етил 8-окса-2-азаспіро[4,5]декан-3-карбонат, 23 H N N O O UA 103102 C2 O O N H O 5 Інтермедіат 101 отримували з кількісним виходом як рацемат із тетрагідро-2H-піран-4карбальдегіду (1,0 г, 8,8 ммол) за процедурою, описаною в WO 98/08850 стор. 50. Інтермедіат 102: етил 2-{N-[(метилокси)карбоніл]-L-валіл}-8-окса-2-азаспіро[4,5]декан-3карбонат O O N O O N O O 10 До розчину етил 8-окса-2-азаспіро[4,5]декан-3-карбонату (101) (200 мг, 0,94 ммол), HATU (392 мг, 1,03 ммол) та N-[(метилокси)карбоніл]-L-валіну (181 мг, 1,03 ммол) у безводн. CH 2Cl2 (6 мл) додавали основа Ханіга (0,33 мл, 1,88 ммол), та розчин перемішували при к.т. під азотом. Після 2 год. реакцію концентрували у вакуумі, очищували C 18 РФ-хроматографією, елюючи 1090% ACN/водою/0,2% NH4OH, що дало продукт як жовту олію(313 мг, 90% вихід). Інтермедіат 103: 2-{N-[(метилокси)карбоніл]-L-валіл}-8-окса-2-азаспіро[4,5]декан-3карбонова кислота O HO N O O N O O 15 20 25 До розчину етил 2-{N-[(метилокси)карбоніл]-L-валіл}-8-окса-2-азаспіро[4,5]декан-3-карбонату (102) (310 мг, 0,84 ммол) у суміші 2:1:1 ТГФ/води/метанолу (6 мл) додавали літій гідроксид моногідрат (70 мг, 1,67 ммол) та реакцію перемішували при кімнатній температурі протягом 2 год. Обробляли 1 N HCl (1,6 мл), розподіляли між EtOAc та водою (30 мл кожне), органічний шар екстрагували EtOAc (30 мл), сушили (MgSO 4) та концентрували, що дало білу піну (211 мг, 1 74% вихід). Цю речовину застосовували в наступних етапах без додаткового очищення. H ЯМР -1 (400 МГц, ДМСО-d6) δ млн 12,43 (br. s., 1 H) 7,19 - 7,41 (m, 1 H) 4,05 - 4,28 (m, 1 H) 3,91 - 4,05 (m, 2 H) 3,40 - 3,71 (m, 6 H) 3,20 - 3,28 (m, 1 H) 1,81 - 1,98 (m, 2 H) 1,70 - 1,80 (m, 1 H) 1,46 - 1,69 (m, 2 H) 1,32 - 1,46 (m, 1 H) 0,65 - 1,03 (m, 10 H). Інтермедіат 104: метил((1S)-2-метил-1-{[(2S)-2-(4-{4'-[({[2-((2S)-3-метил-2{[(метилокси)карбоніл]аміно}бутаноіл)-8-окса-2-азаспіро[4,5]дец-3-іл]карбоніл}аміно)ацетил]-4біфеніліл}-1H-імідазол-2-іл)-1-піролідиніл]карбоніл}пропіл)карбамат O O O N O H N N O O N N 30 N N O O O До розчину у безводн. CH2Cl2 2-{N-[(метилокси)карбоніл]-L-валіл}-8-окса-2азаспіро[4,5]декан-3-карбонової кислоти (103) (100 мг, 0,29 ммол), HATU (111 мг, 0,29 ммол) та метил {(1S)-1-[((2S)-2-{4-[4'-(аміноацетил)-4-біфеніліл]-1H-імідазол-2-іл}-1-піролідиніл)карбоніл]2-метилпропіл}карбамату дигідрогенхлориду (1) (168 мг, 0,29 ммол), отриманого як описано в прикладі 1, (2 мл), додавали основу Ханіга (0,2 мл, 1,17 ммол), та розчин перемішували при к.т. під азотом. Після 1 год. реакцію концентрували у вакуумі, очищували C 18 РФ-хроматографією, елюючи 10-90% ACN/водою/0,2% NH4OH, що дало продукт як жовту тверду речовину (133 мг, 24 UA 103102 C2 55% вихід). Приклад 16: метил[(1S)-2-метил-1-({(2S)-2-[4-(4'-{2-[2-((2S)-3-метил-2{[(метилокси)карбоніл]аміно}бутаноіл)-8,8-діоксидо-8-тіа-2-азаспіро[4,5]дец-3-іл]-1H-імідазол-4іл}-4-біфеніліл)-1H-імідазол-2-іл]-1-піролідиніл}карбоніл)пропіл]карбамат O N N O O S N N N O N N N O O 5 10 15 O O Розчин метил((1S)-2-метил-1-{[(2S)-2-(4-{4'-[({[2-((2S)-3-метил-2{[(метилокси)карбоніл]аміно}бутаноіл)-8,8-діоксидо-8-тіа-2-азаспіро[4,5]дец-3іл]карбоніл}аміно)ацетил]-4-біфеніліл}-1H-імідазол-2-іл)-1піролідиніл]карбоніл}пропіл)карбамату (108) (107 мг, 0,12 ммол) та амоній ацетату (94 мг, 1,2 0 ммол) у діоксані (1,5 мл) дегазували азотом та нагрівали до 110 C у герметизованій трубці протягом 18 год. Реакцію охолоджували до кімнатної температури та розбавляли етилацетатом і фільтрували та концентрували у вакуумі. Очищували НФХ що дало продукт як жовто1 -1 коричневу тверду речовину (39 мг, 37% вихід). H ЯМР (400 МГц, МЕТАНОЛ-d4) δ млн 7,64 (br. s., 10 Н) 7,32 (br. s., 2 Н) 5,05 - 5,24 (m, 1 Н) 4,04 - 4,29 (m, 1 Н) 3,99 (br. s., 1 Н) 3,81 (br. s., 1 Н) 3,55 - 3,73 (m, 6 Н) 3,03 - 3,25 (m, 4 Н) 1,80 - 2,47 (m, 14 Н) 0,68 - 1,06 (m, 16 Н). ВРМС для + C44H57N8O8S (M + Н) розраховано: 857,4020, знайдено: 857,4020. Чистота (РХ-МС): 97%. Отримання інтермедіату 108 O S O O O O HATU, DIEA, CH2Cl2 O O LiOH O OH N H N HO THF-water-MeOH N O O O O O 105 O S S N O 106 O N N O 107 O O O O N N O NH2 HATU, DIEA 107 N N O N O CH2Cl2 1 N O O 108 O H N S O N O O N N O O N O O Інтермедіат 105: етил 8-тіа-2-азаспіро[4,5]декан-3-карбонат 8,8-діоксид O O 20 O S N H O Цю сполуку отримували з виходом 90% із тетрагідро-2Н-тіопіран-4-карбальдегід 1,1-діоксиду (1,05 г, 6,47 ммол) в умовах як у прикладі 15. Інтермедіат 106: етил 2-{N-[(метилокси)карбоніл]-L-валіл}-8-тіа-2-азаспіро[4,5]декан-3карбонат 8,8-діоксид O O O S N O O N 25 O O Інтермедіат 106 отримували з виходом 60% із етил 8-тіа-2-азаспіро[4,5]декан-3-карбонат 8,8-діоксиду (105) (200 мг, 0,77 ммол) в умовах як у прикладі 15. 25 UA 103102 C2 Інтермедіат 107: 2-{N-[(метилокси)карбоніл]-L-валіл}-8-тіа-2-азаспіро[4,5]декан-3-карбонова кислота 8,8-діоксид O HO O S N O O N O O 5 10 Інтермедіат 107 отримували з кількісним виходом із етил 2-{N-[(метилокси)карбоніл]-Lваліл}-8-тіа-2-азаспіро[4,5]декан-3-карбонат 8,8-діоксиду (106) (187 мг, 0,45 ммол) в умовах як у 1 прикладі 15. Застосовували в наступних етапах без додаткового очищення. H ЯМР (400 МГц, -1 ДМСО-d6) δ млн 12,48 (br. s., 1 Н) 7,13 - 7,44 (m, 1 Н) 4,10 - 4,31 (m, 1 Н) 3,46 - 3,61 (m, 3 Н) 2,93 - 3,24 (m, 3 Н) 2,32 (dd, J=3,7, 1,76 Гц, 1 Н) 1,93 - 2,13 (m, 3 Н) 1,73 - 1,94 (m, 2 Н) 1,55 - 1,71 (m, 1 Н) 0,66 - 1,04 (m, 10 Н). Інтермедіат 108: метил((1S)-2-метил-1-{[(2S)-2-(4-{4'-[({[2-((2S)-3-метил-2{[(метилокси)карбоніл]аміно}бутаноіл)-8,8-діоксидо-8-тіа-2-азаспіро[4,5]дец-3іл]карбоніл}аміно)ацетил]-4-біфеніліл}-1H-імідазол-2-іл)-1-піролідиніл]карбоніл}пропіл)карбамат O O N N O H N N O S N O O N N 15 20 O O O Отримували з виходом 49% із 2-{N-[(метилокси)карбоніл]-L-валіл}-8-тіа-2-азаспіро[4,5]декан3-карбонової кислоти 8,8-діоксиду (107) (100 мг, 0,26 ммол) та метил{(1S)-1-[((2S)-2-{4-[4'(аміноацетил)-4-біфеніліл]-1H-імідазол-2-іл}-1-піролідиніл)карбоніл]-2-метилпропіл}карбамату дигідрогенхлориду (1) (148 мг, 0,26 ммол), способом аналогічним описаному в прикладі 15. Приклад 17: метил[(1S)-1-({(2S)-2-[4-(4'-{2-[8,8-дифлуоро-2-((2S)-3-метил-2{[(метилокси)карбоніл]аміно}бутаноіл)-2-азаспіро[4,5]дец-3-іл]-1H-імідазол-4-іл}-4-біфеніліл)-1Hімідазол-2-іл]-1-піролідиніл}карбоніл)-2-метилпропіл]карбамат F N O 35 N F N N O N N 30 N N O 25 O O O O Розчин амоній ацетату (540 мг, 6,9 ммол) та 2-{4'-[({[(2S)-1-((2S)-3-метил-2{[(метилокси)карбоніл]аміно}бутаноіл)-2-піролідиніл]карбоніл}окси)ацетил]-4-біфеніліл}-2оксоетил (3S)-8,8-дифлуоро-2-((2S)-3-метил-2-{[(метилокси)карбоніл]аміно}бутаноіл)-2азаспіро[4,5]декан-3-карбонату (інтермедіат 117) (307 мг, 0,35 ммол) у безводному діоксані (3,5 мл) дегазували азотом та нагрівали до 110 C у герметизованій трубці протягом 3 год. Реакцію охолоджували до кімнатної температури та розподіляли між EtOAc та насич. NaHCO 3 (35 мл кожне), органічний шар промивали розсолом та сушили (MgSO 4) і концентрували у вакуумі. Залишок очищували C18 реверсно-фазовою хроматографією, елюючи 10-100% ацетонітрилом/водою/0,2% NH4OH що дало заголовну сполуку як жовту тверду речовину (235 1 -1 мг, 80% вихід). H ЯМР (400 МГц, МЕТАНОЛ-d4) δ млн 7,69 - 7,82 (m, 3 Н) 7,63 (br. s., 5 Н) 7,17 7,37 (m, 2 Н) 5,03 - 5,19 (m, 1 Н) 4,20 (br. s., 1 Н) 4,06 - 4,16 (m, 1 Н) 3,96 (br. s., 1 Н) 3,85 (br. s., 1 Н) 3,62 (d, J=3,1 Гц, 6 Н) 2,24 - 2,38 (m, 3 Н) 2,15 (br. s., 3 Н) 1,85 - 2,09 (m, 8 Н) 1,77 - 1,85 (m, 2 + Н) 1,53 - 1,76 (m, 3 Н) 0,96 (br. s., 4 Н) 0,87 (d, J=6,3 Гц, 12 Н). ВРМС для C45H57N8O6F2 (M + Н) розраховано: 843,4369, знайдено: 843,4371. Чистота (РХ-МС): 97%. 26 UA 103102 C2 Отримання інтермедіату 70 O H N N H + O TFA O HATU O O HO O N N TEA O O H N OH H N O O O O O intermediate 61 intermediate 60 O O O O NaH Br O intermediate 61 O Br O N N H Br O intermediate 70 O 5 10 15 20 25 30 O Інтермедіат 60: (2S)-2-{[((2S)-2-{[(1,1-диметилетил)окси]карбоніл}-1-піролідиніл)карбоніл]аміно}-3метилбутанову кислоту (24,57 г, 143 ммол) та N-[(метилокси)карбоніл]-L-валін (25,1 г, 143 ммол) розчиняли в ДХМ (50 мл). DIPEA (75 мл, 430 ммол) та додавали HOBT (21,97 г, 143 ммол). Через 5 хвил. додавали EDC (27,5 г, 143 ммол). Реакцію перемішували при к.т. протягом 3 год. Розбавляли водою (50 мл) та додавали 1N HCl (1 мл). Осад відфільтровували та органічні/водні. шари фільтрували через гідрофобну фритту та концентрували до сухого стану, що дало 42,92 г безбарвної олії. Інтермедіат 61: 1,1-диметилетил N-[(метилокси)карбоніл]-L-валіл-L-пролінат (61 г, 186 ммол) розчиняли в HCl (50 мл, 1646 ммол) (150 мл 0,4 M розч.) та перемішували протягом 5 год. Концентрували до сухого стану, що дало 47,9 г продукту як світло-жовтої липкої піни. Інтермедіат 70 1,1'-(4,4'-біфенілдііл)біс(2-бромоетанон) (37,8 г, 95 ммол) розчиняли в ДМФ (800 мл) та дегазували протягом 15 хвил. (N2). Інтермедіат 61 (21,99 г, 81 ммол) розчиняли в ДМФ (100 мл). а потім − обережне додавання NaH (2,94 г, 73,4 ммол, 60% у олії) під азотом протягом 15 хвил. Розчин перемішували під N2 протягом 15 хвил., потім повільно краплями додавали протягом 15 хвил. до розчину 1,1'-(4,4'-біфенілдііл)біс(2-бромоетанону). а потім − перемішування протягом 1 год. при к.т.. Об’єм розчиннику потім зменшували у вакуумі, приблизно, до 100 мл та o охолоджували до 20 C. Повільно додавали 100 мл води, та отриману слабку зелено-жовту тверду речовину фільтрували та промивали водою (200 мл), гексан (200 мл) та сушили під вакуумом (12 год.). Сиру сполуку очищували на 500 г діоксиду силіцію гексаном/етилацетатом 1 (підвищуючи градієнт із 50% до 100% EA), отримуючи 14,5 г (37,3%) інтермедіату 70. H ЯМР -1 (400 МГц, ДМСО-d6) δ млн 8,11 (dd, J=12,0, 8,5 Гц, 4 Н) 7,96 (d, J=8,4 Гц, 4 Н) 7,41 (d, J=8,4 Гц, 1 Н) 5,43 - 5,75 (m, 2 Н) 4,99 (s, 2 Н) 4,53 (dd, J=8,6, 4,7 Гц, 1 Н) 4,03 (t, J=8,6 Гц, 1 Н) 3,76 - 3,90 (m, 1 Н) 3,60 - 3,73 (m, 1 Н) 3,53 (s, 3 Н) 2,22 - 2,37 (m, 1 Н) 2,12 - 2,21 (m, 1 Н) 1,85 - 2,06 (m, 3 Н) 0,90 (dd, J=10,7, 6,6 Гц, 6 Н). Отримання інтермедіату 117 O O CBz-Cl Triethylamine DCM O Dess-Martin DCM TBAF THF acetic acid N O NH O OH Si Si O N O O O O O O O O 113 111 110 112 F F F HO Pd(OH)2 EtOH, H2 O N O O N N H N 116 O ammonium acetate dioxane 110 oC, 3h N O O N N O 117 O 70 O acetonitrile, triethylamine O F F F O O O N THF-water-MeOH F N N O O 115 114 O O LiOH O Br O N O HO O O F O O O F O F O O HATU, DIEA, CH2Cl2 O O O O O 1)Deoxo-Fluor, EtOH 2) mCPBA, DCM, 3) separate enantiomers N O O N N O N N N O N N O N O 27 example 17 O O UA 103102 C2 Інтермедіат карбонат O 110: етил 8-{[(1,1-диметилетил)(диметил)силіл]оксо}-2-азаспіро[4,5]декан-3 Si NH O O 5 Цю сполуку отримували з виходом 98% як рацемат з 4-{[(1,1диметилетил)(диметил)силіл]оксо}циклогексанкарбальдегіду (суміш цис/транс ізомерів) (7,35 г, 30,3 ммол) в умовах як у прикладі 15. Інтермедіат 111: 3-етил 2-(фенілметил) 8-{[(1,1-диметилетил)(диметил)силіл]оксо}-2азаспіро[4,5]декан-2,3-гідрогенкарбонат O N O O 10 15 Si O O До розчину етил 8-{[(1,1-диметилетил)(диметил)силіл]оксо}-2-азаспіро[4,5]декан-3-карбонату (110) (10,61 г, 31,3 ммол), розчиненому в сухому ДХМ, додавали триетиламін (10,8 мл, 78 ммол), охолоджували до 0 ºC, а потім − додавання Cbz-Cl (6,2 мл, 43,5 ммол), та реакцію перемішували при 0 ºC, протягом 5 хвил., к.т. − протягом 1 год. Реакцію розбавляли ДХМ (700 мл), промивали 0,1N HCl (700 мл), сушили (MgSO 4) та концентрували у вакуумі. Залишок очищували хроматографією на силікагелі, елюючи 10-60% гексанами/EtOAc, що дало заголовну сполуку як жовту олію (5,73 г, 39% вихід). Інтермедіат 112: 3-етил 2-(фенілметил) 8-гідрокси-2-азаспіро[4,5]декан-2,3-гідрогенкарбонат OH N O O 20 25 30 O O До розчину 3-етил 2-(фенілметил) 8-{[(1,1-диметилетил)(диметил)силіл]оксо}-2азаспіро[4,5]декан-2,3-гідрогенкарбонату (111) (5,73 г, 12,05 ммол) у ТГФ (60 мл) додавали льодяну оцтову кислоту (1,38 мл, 24,0 ммол), а потім − ТБАФ (24 мл) як 1 M розчин у ТГФ. Реакцію перемішували при кімнатній температурі протягом 72 год. Реакцію розподіляли між EtOAc та водою (250 мл), органічний шар відокремлювали та промивали насичен. NaHCO 3 (100 мл) та сушили (MgSO4) і концентрували у вакуумі. Знайдено неповне протікання реакції 0 способом ТШХ. Залишок розчиняли в сухому ТГФ (60 мл), охолоджували до 0 C та обробляли HF-піридином (1,6 мл, 18,0 ммол), нагрівали до кімнатної температури та перемішували протягом 2 год. під азотом. Реакцію заливали в насичен. NaHCO 3 (100 мл) та твердий калій карбонат додавали до призупинення виділення газу. Екстрагували EtOAc (2 x 150 мл), органічні шари комбінували та промивали 0,1 N HCl (100 мл), сушили (MgSO 4) та концентрували у вакуумі, що дало заголовну сполуку з кількісним виходом як жовту олію, яку застосовували в наступних реакціях без додаткового очищення. Інтермедіат 113: 3-етил 2-(фенілметил) 8-оксо-2-азаспіро[4,5]декан-2,3-гідрогенкарбонат 28
ДивитисяДодаткова інформація
Назва патенту англійськоюChemical compounds
Автори англійськоюChen, Pengyun, Couch, Ricky, Duan, Maosheng, Grimes, Richard Martin, Kazmierski, Wieslaw Mieczyslaw, Norton, Beth, Adams, Tallant, Matthew
Автори російськоюЧен Пингьюн, Коуч Рики, Дуан Маошенг, Гримз Ричард Мартин, Казмирски Висло Мицисло, Нортон Бэт Адамс, Таллант Меттью
МПК / Мітки
МПК: C07C 403/00, A01N 57/00
Мітки: похідні, метил[2-метил({2-[4-(4'-{2-[7-(3-метил-2-{[(метилокси)карбоніл]аміно}бутаноіл)-1,4-діокса-7-азаспіро[4,4]нон-8-іл]-1н-імідазол-4-іл}-4-біфеніліл)-1н-імідазол-2-іл]-1-піролідиніл}карбоніл)пропіл]карбам
Код посилання
<a href="https://ua.patents.su/54-103102-pokhidni-metil2-metil2-4-4-2-7-3-metil-2-metiloksikarbonilaminobutanoil-14-dioksa-7-azaspiro44non-8-il-1n-imidazol-4-il-4-bifenilil-1n-imidazol-2-il-1-pirolidinilkarbonilpropilkarb.html" target="_blank" rel="follow" title="База патентів України">Похідні метил[2-метил({2-[4-(4′-{2-[7-(3-метил-2-{[(метилокси)карбоніл]аміно}бутаноіл)-1,4-діокса-7-азаспіро[4,4]нон-8-іл]-1н-імідазол-4-іл}-4-біфеніліл)-1н-імідазол-2-іл]-1-піролідиніл}карбоніл)пропіл]карбамат</a>
Попередній патент: Паралельний активний фільтр
Наступний патент: Вагон-хопер
Випадковий патент: Спосіб захисту будівельних споруд