Похідні (імідазол-5-іл)метил-2-хінолінону, спосіб їх отримання та фармацевтична композиція на їх основі
Номер патенту: 57717
Опубліковано: 15.07.2003
Автори: Санц Жерар Шарль, Вене Марк Гастон, Мюллер Філіпп, Ангебо Патрік Рене
Формула / Реферат
1. Производное (имидазол-5-ил)метил-2-хинолинона формулы (1),
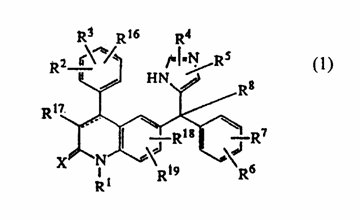
его стереоизомерная форма, его фармацевтически приемлемая кислотно-аддитивная соль, где:
пунктирная линия представляет необязательную связь;
X - кислород или сера;
R1 - водород, C1-12алкил, Ar1, Ar2С1-6алкил, хинолинилС1-6алкил, пиридилС1-6алкил, гидроксиС1-6алкил, С1-6алкилоксиС1-6алкил, моно- или ди(С1-6алкил)аминоС1-6алкил, аминоС1-6алкил,
или радикал формулы -Alk1 -C(=О)-R9, -Alk1-S(О)-R9 или –Alk1-S(О)2-R9,
где: Alk1 является С1-6 алкандиилом,
R9 -гидрокси, С1-6алкил, С1-6алкилокси, амино, С1-8алкиламино или
С1-8алкиламино, замещенное С1-6алкилоксикарбонилом;
R2, R3 и R16 каждый независимо является водородом, гидрокси, гало, циано, С1-6алкилом, С1-6алкилокси, гидроксиС1-6алкилокси, С1-6алкилоксиС1-6алкилокси, аминоС1-6алкилокси, моно - или ди(С1-6алкил)аминоС1-6алкилокси, Ar1, Ar2С1-6алкилом, Ar2окси, Ar2C1-6алкилокси, гидроксикарбонилом, С1-6алкилоксикарбонилом, тригалометилом, тригалометокси, С2-6алкенилом, 4,4-диметилоксазолилом; или
когда на смежных позициях R2 и R3, взятых вместе, может образоваться бивалентный радикал формулы
-О-СН2-О- (а-1),
-О-СН2-СН2-О- (а-2),
-О-СН=СН- (а-3),
-О-СН2-СН2- (а-4),
-О-СН2-СН2-СН2- (а-5), или
-СН=СН-СН=СН- (а-6);
R4 и R5 каждый независимо является водородом, гало, Ar1, C1-6алкилом, гидроксиС1-6алкилом, С1-6алкилоксиС1-6алкилом, С1-6алкилокси, С1-6алкилтио, амино, гидроксикарбонилом, С1-6алкилоксикарбонилом, С1-6алкилS(О)С1-6алкилом или С1-6алкилS(O)2С1-6алкилом;
R6 и R7 каждый независимо является водородом, гало, циано, С1-6алкилом, С1-6алкилокси, Ar2окси, тригалометилом, С1-6алкилтио, ди(С1-6алкил)амино, или
когда на смежных позициях R6 и R7, взятых вместе, может образоваться бивалентный радикал формулы
-О-СН2-О- (с-1), или
-СН=СН-СН=СН- (с-2);
R8 - водород, C1-6алкил, циано, гидроксикарбонил, С1-6алкилоксикарбонил, С1-6алкилкарбонилС1-6алкил, цианоС1-6алкил, С1-6алкилоксикарбонилС1-6алкил, карбоксиC1-6алкил, гидроксиС1-6алкил, аминоС1-6алкил, моно - или ди(С1-6алкил)аминоС1-6алкил, имидазолил, галоС1-6алкил, С1-6алкилоксиС1-6алкил, аминокарбонил С1-6алкил, или радикал формулы
-О-R10 (b-1),
-S-R10 (b-2),
-N-R11R12 (b-3),
где R10 - водород, С1-6алкил, С1-6алкилкарбонил, Ar1, Ar2С1-6алкил, С1-6алкилоксикарбонилС1-6алкил, или радикал формулы -Alk2- OR13
или-Alk2-NR14R15;
R11 - водород, С1-12 алкил, Ar1 или Ar2 С1-6 алкил;
R12 - водород, С1-6 алкил, С1-6алкилкарбонил, С1-6 алкилоксикарбонил, С1-6 алкиламинокарбонил, Ar1 , Ar2С1-6алкил, С1-6алкилкарбонилС1-6алкил, натуральная аминокислота, Ar1карбонил, Ar2С1-6алкилкарбонил, аминокарбонилкарбонил, С1-6алкилоксиС1-6алкилкарбонил, гидрокси, С1-6алкилокси, аминокарбонил, ди(С1-6алкил)аминоС1-6алкилкарбонил, амино, C1-6алкиламино, С1-6алкилкарбониламино, или радикал формулы -Alk2-OR13 или - Alk2-NR14R15,
где Alk2 – это C1-6алкандиил;
R13 - водород, С1-6алкил, С1-6алкилкарбонил, гидроксиС1-6алкил, Ar1 или Ar2С1-6алкил;
R14 - водород, C1-6алкил, Ar1 или Ar2С1-6алкил;
R15 - водород, C1-6алкил, C1-6алкилкарбонил, Ar1 или Ar2С1-6алкил;
R17 - водород, гало, циано, С1-6алкил, C1-6алкилоксикарбонил, Ar1;
R18 - водород, С1-6 алкил, С1-6алкилокси или гало;
R19 - водород или С1-6алкил;
Ar1- фенил или фенил, замещенный C1-6алкилом, гидрокси, амино,
С1-6алкилокси или гало; и
Ar2 - фенил или фенил, замещенный С1-6алкилом, гидрокси, амино, C1-6алкилокси или гало.
2. Соединение по п. 1, отличающееся тем, что X является кислородом.
3. Соединение по пп. 1 или 2, отличающееся тем, что пунктирная линия представляет собой связь.
4. Соединение по пп. 1, 2 или 3, отличающееся тем, что R1 является водородом, С1-6алкилом, С1-6алкилоксиС1-6алкилом или моно- или ди(С1-6алкил)аминоС1-6алкилом.
5. Соединение по любому из пунктов 1 - 4, отличающееся тем, что R3 является водородом, a R2 является гало, С1-6алкилом, С1-6алкенилом, С1-6алкилокси, тригалометокси или гидроксиС1-6алкилокси.
6. Соединение по любому из пунктов 1 - 5, отличающееся тем, что R8 является водородом, гидрокси, галоС1-6алкилом, гидроксиС1-6алкилом, цианоС1-6алкилом, С1-6алкилоксикарбонилС1-6алкилом, имидазолом или радикалом формулы -NR11R12, где R11 является водородом или С1-6алкилом и R12 является водородом, С1-6алкилом, С1-6алкилокси, С1-6алкилоксиС1-6алкилкарбонилом, гидрокси или радикалом формулы - Alk2- OR13, где R13 является водородом или С1-6алкилом.
7. Соединение по п.1, отличающееся тем, что оно представляет собой 4-(3-хлорфенил)-6-[(4-хлорфенил)гидрокси(1-метил- 1Н-имидазол-5-ил)метил ] - 1 -метил-2(1Н)-хинолинон;
6-[амино(4-хлорфенил)-1-метил-1Н-имидазол-5-илметил]-4-(3-хлорфенил)-1 -метил-2( 1 Н)-хинолинон;
6-[(4-хлорфенил)гидрокси(1-метил-1Н-имидазол-5-ил)метил]-4-(З-этоксифенил)-1-метил-2-( 1Н)-хинолинон;
6-[(4-хлорфенил)(1-метил-1Н-имидазол-5-ил)метил]-4-(3-этоксифенил)-1-метил-2(1Н)-хинолинон моногидрохлорид. моногидрат;
6-[амино(4-хлорфенил)(1-метил-1Н-имидазол-5-ил)метил]-4-(3-этоксифенил)-1 -метил-2-(1Н)-хинолинон, и
6-[амино(4-хлорфенил)(1-метил-1Н-имидазол-5-ил)]метил-1-метил-4-(3-пропилфенил)-2(1Н)-хинолинон; стереоизомерная его форма или его фармацевтически приемлемая кислотно-аддитивная соль.
8. Соединение по п.7, отличающееся тем, что оно представляет собой (В)-6-[амино(4-хлорфенил)(1-метил-1Н-имидазол-5-ил)метил] -4-(3-хлорфенил)-1-метил-2(1Н)-хинолинон, или его фармацевтически приемлемая кислая дополнительная соль.
9. Соединение по п.8, отличающееся тем, что оно представляет собой 6[амино(4-хлорофенил)(1-метил-1Н-имидазол–5-ил)метил]-4-(3-хлорофенил)-1-метил-2(1Н)-хинолинон в стереохимически изомерной форме, имеющей оптическое вращение [a]20D =+22.860 (с=49.22 мг/мл в метаноле).
10. Фармацевтическая композиция, содержащая фармацевтически приемлемые носители и активный ингредиент, отличающаяся тем, что в качестве активного ингредиента используют терапевтически эффективное количество соединения по любому из пп. 1 - 9.
11. Способ получения фармацевтической композиции по п. 10, включающий тщательное перемешивание активного ингредиента с фармацевтически приемлемым носителем, отличающийся тем, что в качестве активного ингредиента используют терапевтически эффективное количество компонента по любому из пп. 1 – 9.
12. Соединение по любому из пп. 1 - 9 для применения в качестве лекарственного препарата.
13. Соединение по п. 12 для ингибирования аномального роста клеток.
14. Соединение по п. 12 для ингибирования роста опухоли.
15. Соединение по п. 12 для ингибирования пролиферативных заболеваний.
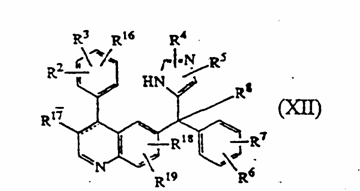
16. Соединение формулы (XII), в котором радикалы R2, R3, R4, R5, R6, R7, R8, R16, R17, R18 и R19 определены как в п. 1, его стереоизомерная форма или его фармацевтически приемлемая кислая или основная дополнительная соль.
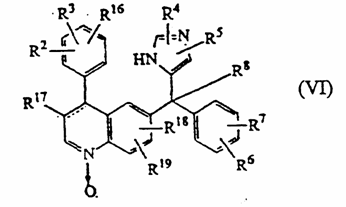
17. Соединение формулы (VI), в котором радикалы R2, R3, R4, R5, R6, R7, R8, R16, R17, R18, R19 определены как в п. 1, его стереоизомерная форма или его фармацевтически приемлемая кислая или основная дополнительная соль
18. Способ получения соединения по п. 1, в котором проводят гидролиз промежуточного эфира формулы (II), где R является С1-6алкилом, в водном растворе кислоты, в результате чего получают соединение формулы (1-а), где R1 является водородом,
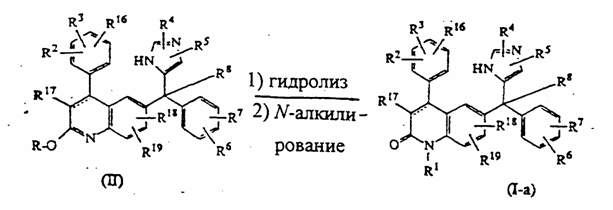 .
.
19. Способ по п. 18, отличающийся тем, что в качестве водного раствора кислоты используют водный раствор соляной кислоты.
20. Способ по п. 18, отличающийся тем, что дополнительно производят трансформацию формулы (1-а), где R1 является водородом, в соединение формулы (I-а).
21. Способ получения соединения по п. 1, в котором осуществляют реакцию промежуточного кетона формулы (III) с промежуточным соединением формулы (VI-а), где Р необязательно является защитной группой, которую удаляют после дополнительной реакции, в присутствии сильного основания в растворителе, в результате чего получают соединение формулы (I-b)
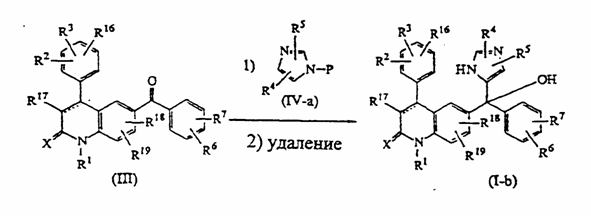 .
.
22. Способ получения соединения по п. 1, в котором осуществляют реакцию промежуточного соединения формулы (XXI) с промежуточным соединением формулы (IV-a), как описано в синтезе соединений формулы (I-b), с последующей обработкой кислотой в присутствии воды и реакцию полученного промежуточного соединения (XXIII) с реагентом, в результате чего получают соединение формулы (I-b-1)
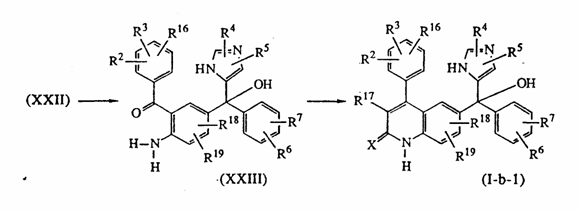 .
.
23. Способ по п. 22, отличающийся тем, что в качестве кислоты используют TiCl3.
24. Способ по п. 22, отличающийся тем, что в качестве реагента используют R17CH2COCl или R17CH2COOC2H5.
25. Способ получения соединения по п. 22, отличающийся тем, что после реакции промежуточного соединения (XXIII) с соответствующим реагентом осуществляют обработку основанием.
26. Способ по п. 25, отличающийся тем, что в качестве основания используют трет-бутоксид калия.
27. Способ получения соединения по п. 1, в котором осуществляют реакцию промежуточного соединения формулы (XIII), где W является соответствующей отщепляемой группой, с реагентом формулы (XIV) в растворителе, в результате чего получают соединение формулы (I-g)
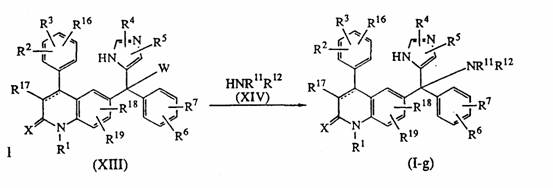 ,
,
где заместители R1 и R16 определены как в п. 1.
Текст
1 Производное (имидазол-5-ил)метил-2хинолинона формулы (1), (і) его стереоизомерная форма, его фармацевтически приемлемая кислотноаддитивная соль, где пунктирная линия представляет необязательную связь, X - кислород или сера, R1 - водород, Сі 12ЭЛКИЛ, Аг1, Аг2Сі єалкил, хинолинилСі єалкил, пиридилСі єалкил, гидроксиСі балкил, Сі єалкилоксиСі єалкил, моноили ди(Сі єалкил)аминоСі єалкил, аминоСі єалкил, или радикал формулы -Alk1 -C(=O)-R9, -Alk1-S(O)R9 или -Alk1-S(O)2-R9, где Alk1 является Сі є алкандиилом, R -гидрокси, Сі єалкил, Сі єалкилокси, амино, Сі валкиламино или Сі валкиламино, замещенное Сі єалкилоксикарбонилом, ? о 1 f> R , R и R каждый независимо является водородом, гидрокси, гало, циано, Сі єалкилом, Сі єалкилокси, гидроксиСі єалкилокси, Сі єалкилоксиСі єалкилокси, аминоСі балкилокси, моно - или ди(Сі єалкил)аминоСі балкилокси, Аг1, Аг2Сі єалкилом, Аг2окси, Аг2Сі балкилокси, гидроксикарбонилом, Сі єалкилоксикарбонилом, тригалометилом, тригалометокси, С2 єалкенилом, 4,4-диметилоксазолилом, или 2 3 когда на смежных позициях R и R , взятых вместе, может образоваться бивалентный радикал формулы -О-СНз-О- (а-1), -О-СН2-СН2-О- (а-2), -О-СН^СН- (а-3), -О-СНз-СНз- (а-4), -О-СН2-СН2-СН2- (а-5), или -СН=СН-СН=СН- (а-6), R4 и R5 каждый независимо является водородом, гало, Аг1, Сі бэлкилом, гидроксиСі єалкилом, Сі єалкилоксиСі єалкилом, Сі балкилокси, Сі єалкилтио, амино, гидроксикарбонилом, Сі балкилоксикарбонилом, Сі єалкилЗ(О)Сі єалкилом или Сі валкилЗ(О)2Сі єалкилом, Ru и R' каждый независимо является водородом, гало, циано, Сі єалкилом, Сі балкилокси, Аґокси, тригалометилом, Сі єалкилтио, ди(Сі єалкил)амино, или когда на смежных позициях R6 и R7, взятых вместе, может образоваться бивалентный радикал формулы -О-СН2-О- (с-1), или -СН=СН-СН=СН- (с-2), R8 - водород, Сі балкил, циано, гидроксикарбонил, Сі балкилоксикарбонил, Сі єал кил карбон ил С1 балкил, цианоСі єалкил, Сі балкилоксикарбонилСі єалкил, карбоксиСі єалкил, гидроксиСі єалкил, аминоСі єалкил, моно - или ди(Сі єалкил)аминоСі єалкил, имидазолил, галоСі єалкил, Сі єалкилоксиСі єалкил, аминокарбонил Сі єалкил, или радикал формулы -O-R10(b-1), -S-R10(b-2), -N-R11R12(b-3), 10 где R - водород, Сі єалкил, Сі єал кил карбон ил, Аг1, Аг2Сі єалкил, Сі балкилоксикарбонилСі єалкил, или радикал формулы -Alk2- OR13 Hnn-Alk2-NR14R1 , R11 - водород, Сі 1 алкил, Аг1 или Аг2 Сі єалкил, 2 R12 - водород, Сі є алкил, Сі єал кил карбон ил, Сі є алкилоксикарбонил, Сі є алкиламинокарбонил, Аг1 Аг2Сі єалкил, Сі балкилкарбонилСі єалкил, натуральная аминокислота, Аг1карбонил, Аг2Сі єалкилкарбонил, аминокарбонилкарбонил, Сі О 1 Ю 57717 єалкилоксиСі єалкилкарбонил, гидрокси, Сі метил-1 Н-имидазол-5-ил)метил] -4-(3-хлорфенил)1-метил-2(1Н)-хинолинон, или его єалкилокси, аминокарбонил, ди(Сі єалкил)аминоСі єал кил карбон ил, амино, Сі фармацевтически приемлемая кислая дополниєалкиламино, Сі єалкилкарбониламино или тельная соль 2 13 2 15 9 Соединение по п 8, отличающееся тем, что оно радикал формулы -Alk -OR или - Alk -NR R , 2 представляет собой 6[амино(4-хлорофенил)(1где Alk - это Сі єалкандиил, 13 метил-1Н-имидазол-5-ил)метил]-4-(3R - водород, Сі єалкил Сі єалкилкарбонил, 1 хлорофенил)-1 -метил-2(1 Н)-хинолинон в гидроксиСі єалкил, Аг или Аг Сі єалкил, 4 1 2 стереохимически изомерной форме, имеющей R - водород, Сі єалкил, Аг или Аг Сі єалкил, 20 15 1 оптическое вращение [a] D =+22 86° (с=49 22 R - водород, Сі єалкил, Сі єал кил карбон ил, Аг 2 мг/мл в метаноле) или Аг Сі єалкил, 17 R - водород, гало, циано, Сі єалкил, Сі 10 Фармацевтическая композиция, содержащая 1 єалкилоксикарбонил, Аг , фармацевтически приемлемые носители и 18 R - водород, Сі є алкил, Сі єалкилокси или гало, активный ингредиент, отличающаяся тем, что в 19 качестве активного ингредиента используют R - водород или Сі єалкил, 1 терапевтически эффективное количество соедиАг - фенил или фенил, замещенный Сі єалкилом, нения по любому из пп 1 - 9 гидрокси, амино, Сі єалкилокси или гало, и 11 Способ получения фармацевтической Аг2 - фенил или фенил, замещенный Сі єалкилом, композиции по п 10, включающий тщательное гидрокси, амино, Сі єалкилокси или гало перемешивание активного ингредиента с 2 Соединение по п 1, отличающееся тем, что X фармацевтически приемлемым носителем, является кислородом отличающийся тем, что в качестве активного ингредиента используют терапевтически 3 Соединение по пп 1 или 2, отличающееся тем, эффективное количество компонента по любому что пунктирная линия представляет собой связь из пп 1-9 4 Соединение по п п 1 , 2 или 3, отличающееся ТЄМ, ЧТО R ЯВЛЯеТСЯ ВОДОРОДОМ, С і бЭЛКИЛОМ, С і 12 Соединение по любому из пп 1-9 для єалкилоксиСі бал килом или моно- или ди(Сі применения в качестве лекарственного препарата єалкил)аминоСі єалкилом 13 Соединение по п 12 для ингибирования 5 Соединение по любому из пунктов 1 - 4, аномального роста клеток отличающееся тем, что R3 является водородом, 14 Соединение по п 12 для ингибирования роста a R2 является гало, Сі єалкилом, Сі єалкенилом, опухоли Сі єалкилокси, тригалометокси или гидроксиСі 15 Соединение по п 12 для ингибирования єалкилокси пролиферативных заболеваний 6 Соединение по любому из пунктов 1 - 5, 16 Соединение формулы (XII), в котором отличающееся тем, что R является водородом, радикалы R2, R3, R4, R5, R6, R7, R8, R16, R17, R18 и гидрокси, галоСі єалкилом, гидроксиСі єалкилом, R1 определены как в п 1 , его стереоизомерная цианоСі єалкилом, Сі єалкилоксикарбонилСі форма или его фармацевтически приемлемая єалкилом, имидазолом или радикалом формулы кислая или основная дополнительная соль 11 12 11 NR R , где R является водородом или Сі 1 бЭЛКИЛОМ И R 1 2 ЯВЛЯеТСЯ ВОДОРОДОМ, С і бЭЛКИЛОМ, Сі бэлкилокси, Сі єалкилоксиСі балкилкарбонилом, гидрокси или радикалом формулы - Alk2- OR13, где R 3 является водородом или Сі балкилом 7 Соединение по п 1, отличающееся тем, что оно представляет собой 4-(3-хлорфенил)-6-[(4хлорфенил)гидрокси(1 -метил1 Н-имидазол-5ил)метил ] -1 -метил-2(1Н)-хинолинон, 6-[амино(4-хлорфенил)-1 -метил-1 Н-имидазол-5илметил]-4-(3-хлорфенил)-1 -метил-2( 1 Н)хинолинон, 6-[(4-хлорфенил)гидрокси(1 -метил-1 Н-имидазол-5ил)метил]-4-(3-этоксифенил)-1 -метил-2-( 1Н)хинолинон, 6-[(4-хлорфенил)(1 -метил-1 Н-имидазол-5ил)метил]-4-(3-этоксифенил)-1 -метил-2(1 Н)хинолинон моногидрохлорид моногидрат, 6-[амино(4-хлорфенил)(1 -метил-1 Н-имидазол-5ил)метил]-4-(3-этоксифенил)-1 -метил-2-(1Н)хинолинон, и 6-[амино(4-хлорфенил)(1 -метил-1 Н-имидазол-5ил)]метил-1 -метил-4-(3-пропилфенил)-2(1 Н)хинолинон, стереоизомерная его форма или его фармацевтически приемлемая кислотноаддитивная соль 8 Соединение по п 7, отличающееся тем, что оно представляет собой (В)-6-[амино(4-хлорфенил)(1 (ХП) 17 Соединение формулы (VI), в котором 2 3 4 5 7 16 17 1 радикалы R , R , R , R , R* R , R*. R , R 17 R °, R , г-,18 г-,19 определены как в п 1, его стереоизомерная форма или его фармацевтически приемлемая кислая или основная дополнительная соль (VI) 18 Способ получения соединения по п 1, в котором проводят гидролиз промежуточного эфира формулы (II), где R является Сі єалкилом, в водном растворе кислоты, в результате чего получают соединение формулы (1-а), где R1 является водородом, 57717 (XXIII) с реагентом, в результате чего получают соединение формулы (l-b-1) (XXII) 19 Способ по п 18, отличающийся тем, что в качестве водного раствора кислоты используют водный раствор соляной кислоты 20 Способ по п 18, отличающийся тем, что дополнительно производят трансформацию 1 формулы (1-а), где R является водородом, в соединение формулы (1-а) 21 Способ получения соединения по п 1, в котором осуществляют реакцию промежуточного кетона формулы (III) с промежуточным соединением формулы (Vl-a), где Р необязательно является защитной группой, которую удаляют после дополнительной реакции, в присутствии сильного основания в растворителе, в результате чего получают соединение формулы (l-b) (XXIII) 23 Способ по п 22, отличающийся тем, что в качестве кислоты используют ТіСІз 24 Способ по п 22, отличающийся тем, что в 17 качестве реагента используют R CH2COCI или 17 R CH2COOC2H5 25 Способ получения соединения по п 22, отличающийся тем, что после реакции промежуточного соединения (XXIII) с соответствующим реагентом осуществляют обработку основанием 26 Способ по п 25, отличающийся тем, что в качестве основания используют трет-бутоксид калия 27 Способ получения соединения по п 1, в котором осуществляют реакцию промежуточного соединения формулы (XIII), где W является соответствующей отщепляемой группой, с реагентом формулы (XIV) в растворителе, в результате чего получают соединение формулы i-g) 22 Способ получения соединения по п 1, в котором осуществляют реакцию промежуточного соединения формулы (XXI) с промежуточным соединением формулы (IV-a), как описано в синтезе соединений формулы (l-b), с последующей обработкой кислотой в присутствии воды и реакцию полученного промежуточного соединения Настоящее изобретение относится к новым производным (имидазол 5-ил) метил-2хинолинона, их получению, а также фармацевтическим соединениям, содержащим указанные новые составы, применению этих составов в качестве лекарственных препаратов, а также методам лечения путем применения указанных препаратов Онкогены часто кодируют протеиновые компоненты путей сигнальных преобразований, что приводит к стимулированию роста клеток и митогенезису Онкогенная экспрессия в культивируемых клетках приводит к клеточной трансформации, которая характеризуется способностью клеток к перерастанию в мягкий агар и росту клеток как плотный очаг, что делает контактное ингибирование, проявляющееся в нетрансформированных клетках, недостаточной Мутация и/или сверхэкспрессия некоторых онкогенов часто связано с раковым заболеванием человека Определенная группа онкогенов известна как газ и обнаруживается у млекопитающих, птиц, насекомых, моллюсках, 1 1> f где заместители R и R определены как в п 1 растениях, грибках и дрожжах Семейство ras онкогенов млекопитающих состоит из трех основных групп («изоформ») H-ras, K-ras и N-ras онкогенов, Эти коды ras-онкогенов для тесно связаннных протеинов обычно известны как p21 r a s Будучи присоединенными к плазменным мембранам, мутантные или онкогенные формы p21 r a s вырабатывают сигнал для преобразования и неконтролируемого роста злокачественных опухолевых клеток Для приобретения этого трансформирующего потенциала исходное вещество p21 r a s онко-протеина должно подвергаться ферментнокатализированной фарнезиляции цистеинового осадка, находящегося в карбоксил-терминальном тетрапептиде Поэтому ингибиторы энзима, который катализирует эту модификацию, фарнезил протеиновая трансфераза, будет препятствовать мембранному присоединению р21 r a s и блокировать аберрантный рост ras трансформированных опухолей Следовательно, обычно принято считать, что ингибиторы фарнезил-трансферазы могут быть очень 57717 8 вместе, может образоваться бивалентный полезными как антиканцерогенные средства для радикал формулы опухолей, в которых ras способствует -О-СН2-О(а-1), трансформации -О-СН2-СН2-0(а-2), Онкогенные формы ras, поскольку они -О-СН=СН(а-3), подвержены мутации, часто находят во многих -О-СН2-СН2(а-4), раковых заболеваниях человека, особенно в более 50% раковых заболеваний толстой кишки и -О-СН2-СН2-СН2(а-5), или поджелудочной железы (Kohl et al , Science, -СН=СН-СН=СН(а-6), 4 5 vol 260, 1834-1837, 1993), и поэтому было R и R каждый независимо - водород, гало, 1 высказано предположение, что ингибиторы Аг , Сі єалкил, гидрокси Сі єалкил, Сі фарнезил трансферазы могут быть очень єалкилоксиСі єалкил, Сі єалкилокси, Сі єалкилтио, полезными при всех этих типах злокачественных амино, гидроксикарбонил, Сі єалкилоксикарбонил, опухолей Сі єалкил S(O) Сі єалкил или Сі єалкил S(O)2 Ci єалкил, В ЕП-0,371,564 описан (1Н-фзол-1-илметил) 6 7 замещенный хинолин и производные хинолинона, R и R каждый независимо - водород, гало, 2 которые подавляют плазменную элиминацию циано, Сі бэлкил, Сі єалкилокси, Аг окси, ретиноловых тригалометил, Сі єалкилтио, ди(Сі єалкил)амино, кислот Некоторые из этих соединений также или обладают способностью ингибировать когда на смежных позициях R6 and R7, взятых образование андрогенов из вместе, может образоваться бивалентный и/или ингибировать действие прогестинов радикал, имеющий формулу ароматического энзимного комплекса -0-СН2-0(с-1), или Неожиданно было обнаружено, что рассматриваемые новые соединения, имеющие -СН-СН-СН^СН(с-2), все заместитель фенила в 4-й позиции 2R водород, Сі бэлкил, циано, хинолиноновой части и в которых часть гидроксикарбонил, Сі єалкилокси карбон ил, Сі имидазола связана посредством атома углерода с єалкил-карбонилСі єалкил, цианоСі єалкил, Сі остальной частью молекулы, проявляют єалкилоксикарбонилСі єалкил, карбоксиСі єалкил, фарнезил-протеиновую трансферазную гидроксиСі єалкил, аминоСі єалкил, моно - или ди(Сі єалкил)аминоСі єалкил, имидазолил, галоСі активность ингибирования єалкил, Сі єалкил окси Сі єалкил, аминокарбонил Настоящее изобретение включает в себя Сі єалкил, или радикал, имеющий формулу соединения, имеющие формулу (I) 3 16 4 R R К -O-RIU (b-1), -S-R10 (b-2), -N-R11R12 (b-3), где R'u Сі єалкил, Сі водвород, (I) єалкилкарбонил, Аг , АґСі єалкил, Сі єалкилоксикарбонилСі єалкил, или радикал формулы -Alk2- OR13 или -Alk2-NR14R15, 11 1 2 R - водород, Сі єалкил, Аг или Аг Сі єалкил, фармацевтически приемлемые кислотные или R12 - водород, Сі єалкил, Сі єалкилкарбонил, основные дополнительные соли и Сі єалкилоксикарбонил, Сі балкиламино-карбонил, стереоизомерные ее формы, где 1 2 Аг , Аг Сі єалкил, Сі єалкилкарбонилСі єалкил, пунктирная линия представляет натуральная аминокислота, Аг1карбонил, Аг2 Сі необязательную связь, єалкилкарбонил, аминокарбонилкарбонил, Сі X - кислород или сера, єалкилоксиСі єалкил-карбонил, гидрокси, Сі R1 - водород, Сі 1 алкил, Аг1, Ar2Ci алкил, 2 єалкилокси, аминокарбонил, ди(і єалкил)аминоСі хинолинил Сі є алкил, пиридил С і R алкил, єалкилкар-бонил, амино, Сі єалкиламино, Сі гидрокси Сі є алкил, Сі є алкилокси Сі є алкил, єалкилкарбониламино, или радикал, имеющий моно- или ди (Сі є алкил)амино Сі є алкил. амино формулу Сі є алкил, -Alk2-OR13 или -Alk2-NR14R15, или радикал имеющий формулу -Alk1 -C(=0)где Alk2 - Сі єалканедиил, R9, -Alk1-S(0)-RS или -Alk-S(0)2-R9, где Alk1 R 3 - водород, Сі єалкил, Сі єалкилкарбонил, является Сі балканедиилом, гидроксиСі єалкил, Аг1 или Аг2Сі єалкил, R9 -гидрокси, Сі є алкил, Сі є алкилокси, 1 4 1 2 амино, Сі валкиламино или Ci s алкиламино, R - водород, Сі єалкил, Аг или Аг Сі єалкил, замещенные Zi1 R алкилоксикарбонилом, R15 - водород, Сі єалкил, Сі єалкилкарбонил, R2, R3 и R каждый независимо - водород, Аг или Аг2Сі єалкил, гидрокси, гало, циано, Сі є алкил, Сі є алкилокси, R17 - водород, гало, циано, Сі єалкил, Сі гидрокси Сі є алкилокси, Сі є алкилокси Сі є балкилоксикарбонил, Аг1, алкилокси, амино Сі єалкилокси моно - или ди (Сі д (і R18 - водород, Сі єалкил, Сі єалкилокси или єалкил)амино Сі єалкилокси, Аг , Аг2Сі єалкил, Аг2 гало, окси, Аг Сі єалкилокси, гидроксикарбонил, Сі 1 Q єалкилоксикарбонил, тригалометил, R - водород или Сі єалкил, тригалометокси, C-z алкенил, 4,4Аг1 - фенил или фенил, замещенный Сі диметилоксазолил, или єалкилом, гидрокси, амино, d-балкилокси или гало, когда на смежных позициях R2 and R3, взятых и Аг2 - фенил или фенил, замещенный Сі бал килом, гидрокси, амино, Сі єалкилокси или 57717 10 кислота представляет собой, например, гало, 4 5 неорганическую кислоту, такую как R или R могут быть также связаны с одним галоводородную кислоту, например, из атомов азота в имидазольном кольце В этом 4 5 хлористоводородную или бромистоводородную случае водород у азота замещается R или R и 4 5 кислоту, серную, азотную, фосфорную и им значения R и R , когда они связаны с азотом, 1 подобные кислоты, или органические кислоты, ограничены водородом, Аг , Сі єалкилом, такие как, например, уксусная, пропаноловая, гидроксиСі єалкилом, Сі єалкилокси Сі єалкилом, гидроксиуксусная, молчная, пировиноградная, Сі єалкилоксикарбонилом, Сі єалкилЗ(О) Сі щавелевая, малоновая, янтарная (т е єалкилом, Сі балкилЗ(О)2 Сі єалкилом бутандиоловая), фумаровая, малеиновая, винная, Упомянутый выше и используемый в лимонная, метансульфоновая, этансульфоновая, дальнейшем термин «гало» обозначает фтор, бензолсульфоновая, р-толуолсульфоновая, хлор, бром и йод, Сі балкил обозначает насыщенные углеводородные радикалы с прямой салициловая, р-аминосалициловая и им подобные и разветвленной цепями, имеющие от 1 до 6 кислоты атомов углерода, такие как, например, метил, Соединения формулы (I), обладающие этил, пропил, бутил, пентил, гексил и им кислотными свойствами, могут быть подобные, Сі валкил содержит насыщенные конвертированы в их фармацевтически углеводород иные радикалы с прямой и приемлемые основные дополнительные соли разветвленной цепями, как определено в Сі путем обработки указанных кислот балкиле, а также наивысшие его гомологи, соответствующим органическим или содержащие 7 или 8 атомов углерода, такие как, неорганическим основанием Соответствующая например гептил или октил, Сі ^алкил также основная соль представляет собой, например, содержит Сі валкил и наивысшие его гомологи, соль аммония, соли щелочных и щелочносодержащие от 9 до 12 атомов углерода, земельных металлов, например, соли лития, например, нонил, децил, ундецил, до-децил, Сі натрия, калия, магния, кальция и им подобные, ігбалкил также содержит Сі ^алкил и его соли с органическим основанием, например, соли наивысшие гомологи, содержащие от 13 до 16 бензатина, Ы-метил-О-глюкамина, оксиамина и атомов углерода, такие как, например, тридецил, соли с аминокислотами, например, аргинин, лизин тетрадецил, пентедицил и гек-садецил, Сгєалкени и им подобные л обозначает углеводородные радикалы с прямой Термины «кислая или основная и разветвленной цепями, содержащие одну дополнительная соль» обозначает гидратные и двойную связь и имеющие от 2 до 6 атомов растворимые дополнительные соли, которые углерода, такие как, например, этенил, 2соединения формулы (I) способны образовывать пропенил, 3-бутенил, 2-пентенил, 3-пентенил, 3Примерами таких солей являются гидраты, метил-2-бутенил и им подобные, Сі балканедиил алкоголяты и им подобные обозначает бивалентные насыщенные Термин «стереохимически изомерные формы углеводородные радикалы с прямой и соединений формулы (I)», используемый в разветвленной цепями, имеющие от 1 до 6 атомов дальнейшем, определяет все возможные углерода, такие как, например, метилен, 1,2соединения, состоящие из одинаковых атомов, этанедиил, 1,3-пропанедиил, 1,4-бутанедиил, 1 5связанных одинаковыми последовательностями пентанедиил, 1,6-гексанедиил и их разветвленные связей, но имеющие различные взаимоизомеры Термин «С(=О)>> обозначает незаменяемые трехмерные структуры, которые карбонильную группу, a «S(O)2» относится к соединения формулы (I) могут иметь Если иное сульфону Термин «натуральнная аминокислота» не оговорено или не указано, химический состав обозначает натуральную аминокислоту, которая соединения включает в себя смесь всех связана посредством ковалентной амидной связи, возможных стереоизомерных форм, которые образованной в результате потери молекулы воды указанное соединение может иметь Указанная между карбоксильной группой аминокислоты и смесь может содержать все диастереомеры и/или аминогруппы остатка молекулы Примерами энантиомеры базовой молекулярной структуры натуральных аминокислот являются глицин, указанного компонента Все стереоизомерные аланин, валин, лейцин, изолейцин, метио-нин, формы соединений формулы (I) как в чистом пролин, фениланалин, триптофан, серии, треонин, виде, так и в смеси с другими, представляются цистеин, тирозин, аспарагин, глутамин, выходящими за границы объема настоящего аспаргиновая кислота, глутаминовая кислота, изобретения лизин, аргинин, гистидин Фармацевтически приемлемая кислота или основные Некоторые соединения формулы (I) могут дополнительные соли, упомянутые выше, также существовать в своих таутомерных формах содержат терапевтически активную нетоксичную Такие формы, несмотря на то что они точно не кислоту и нетоксичные основные дополнительные указаны в вышеприведенной формуле, считаются соли, которые соединения формулы (I) способны включенными в объем настоящего изобретения образовывать Соединения формулы (I), Используемый в дальнейшем термин обладающие свойствами основания, могут быть «соединения по формуле (1)» включает в себя конвертированы в их фармацевтически фармацевтически приемлемую кислоту или приемлемую кислую дополнительную соль путем основные дополнительные соли и все обработки указанного основания стереоизомерные формы Предпочтительно заместитель R18 располагается на 5 или 7 позиции части соответствующей кислотой Соответствующая 57717 12 11 17 18 хинолинона, а заместитель R располагается на 8 R водород - R - водород 18 позиции, когда R находится на 7 позиции Наиболее предпочтительными соединениями являются Представляющими интерес соединениями являются соединения по формуле (1), в которых X 4-(3-хлорпентил)-6-[(4-хлорпентил)гидрокси(1является кислородом метил-1Н-имидпзол-5-ил)метил]-1-метил-2(1Н)хинолинон, Также интересными являются соединения по формуле (1), в которых пунктирная линия 6-[амино(4-хлорпентил)-1 -метил-1 Н-имидазолпредставляет связь для образования двойной 5-илметил]-4-(3-хлорфенил)-1 -метил-2(1 Н)связи хинолинон, Другой заслуживающей внимания группой 6-[(4-хлорфенил)гидрокси(1 -метил-1 Нсоединений являются соединения по формуле (1), имидазол-5-ил)метил]-4-(Зэтоксифенил)-1-метил1 в которых R - водород, Сі єалкил, Сі єалкилокси 2-(1Н)-хинолинон, Сі єалкил, ди(Сі єал-кил)амино Сі єалкил, или 6-[(4-хлорфенил)(1 -метил-1 Н-имидазол-51 9 1 радикал по формуле -Alk -C(=O)-R , где Alk ил)метил]-4-(3-этоксифенил)-1 -метил-2(1 Н)9 является метиленом и R является Сі в хинолинон моногидрохлорид моногидрат, алкиламином, замещенным Сі 6-[амино(4-хлорфенил)(1 -метил-1 Н-имидазол5-ил)метил]-4-(3-этоксифенил)-1 -метил-2-(1 Н)балкилоксикарбонилом хинолинон, Еще одной группой компонентов, представляющей интерес, являются компоненты 6-[амино(4-хлорфенил)(1 -метил-1 Н-имидазолпо формуле (1), где R - водород или гало, a R2 5-ил)]метил-1 -метил-4-(3-пропилфенил)-2(1 Н)является гало, Сі єалкил, C-z єал-кенил, Сі хинолинон, стереоизомерные его формы или єалкилокси, тригалометокси или гидрокси Сі фармацевтически приемлемая кислота или єалкилокси основная дополнительная соль, и Еще одной группой компонентов, (В)-6-[амино(4-хлорфенил)(1 -метил-1 Нпредставляющей интерес, являются компоненты имидазол-5-ил)метил]-4-(3-хлорфенил)-1-метилпо формуле (1), где R2 и R3 находятся на смежных 2(1Н)-хинолинон, или фармацевтически позициях и, взятые вместе, образуют приемлемая его кислая дополнительная соль бивалентный радикал по формуле (а-1), (а-2) или Соединения формулы (I), где X - кислород, (а-3) при этом указанные соединения представлены формулой (1-а), могут быть получены путем Еще одной группой компонентов, гидролиза промежуточного эфира формулы (II), представляющей интерес, являются компоненты где R является Сі єалкилом, известными в науке по формуле (1), где R является водородом, a R4 методами перемешивания промежуточного является водородом или Сі балкилом вещества формулы (II) в водном растворе Еще одной группой компонентов, кислоты Соответствующей кислотой является, представляющей интерес, является компоненты например, соляная кислота Соответственно, по формуле (1), где R является водородом, a R6 полученный хинолинон, где R1 - водород, может является d-балкилом или гало, предпочтительно быть превращен в хинолинон, где R имеет хлоро, особенно 4-хлоро значение, определенное выше, кроме водорода, Особой группой компонентов являются посредством известной N-алкиляции компоненты по формуле (I), где R8 - водород, гидрокси, галоСі єалкил, гидроксиСі єалкил, R 3 в 16 цианоСі єалкил, Сі єалкилокси-карбонилСі єалкил R4 11 12 1 имидазол, или радикал формулы -NR R , где R - водород или Сі єалкил и R12 - водород, Сі R z. єалкил, Сі єалкилокси, гидрокси, Сі єал-килоксиСі 2 єалкилкарбонил, или радикал по формуле-Alk OR13, где R13 является водородом или Сі бЭЛ КИЛОМ Предпочтительными компонентами являются КОМПОНеНТЫ, ГДЄ R1 ВОДОРОД, С і бЭЛКИЛ, Сі єалкилоксиСі єалкил, ди(Сі єалкил)аминоСі єалкил или радикал по формуле -Alk1-C(=O)-R9, где Alk является метиленом и R9 является Сі в алкиламином, замещенным Сі є алкилоксикарбонилом, R2 - гало, Сі єалкил, С-А балкенил, Сі бэл-килокси, тригалометокси, гидрокси Сі балкилокси или Ar1, R3 является водородом, R4 - метил связанный с азотом в 3-ей позиции имидазола, R - водород, R6 - хлоро, R7 водород, R8 - водород, гидрокси, галоСі єалкил, гидроксиСі єалкил, циано Сі єалкил, Сі єзлкилоксикарбонилСі єалкил, имидазлил, или радикал формулы NR 11 R 12 , где R11 - водород или Сі єалкил и R12 - водород, Сі єалкил, Сі єалкилокси, Сі єалкилокси Сі єалкил карбонил, или радикал формулы -Alk2 -OR13, где R13 - Сі єалкил, 1) гидролиз 2) N-алкиляция 1-а) Соединения по формуле (1), где R является гидрокси, при этом указанные соединения обозначены как соединения по формуле (l-b), могут быть получены в результате реакции промежуточного кетона формулы (III) с промежуточным веществом формулы (IV-a), где Р является необязательной защитной группой, такой как, например, группа сульфонила, т е группа диметиламиносульфонила, которая может быть удалена после дополнительной реакции Указанная реакция требует присутствия соответствующего сильного основания, такого, как, например, бутил литий в соответствующем 13 57717 растворителе, таком как, например, тетрагидрофуран и присутствия соответствующего силанопроизводного, такого, например, как триэтилхлорсилан В процессе обработки промежуточное производное силана гидролизуется Могут быть применены также и другие процедуры с защитными группами аналогов для силанопроизводных l-b) 2) Удаление Р Соединения по формуле (l-b-1), будучи компонентами формулы (l-b), где пунктирная линия является связью и R является водородом, могут быть получены реакцией промежуточного вещества, имеющего формулу (XXI), с промежуточным веществом, имеющим формулу (IV-a), как описано выше для синтеза соединений по формуле (l-b) Полученное таким образом промежуточное вещество по формуле (XXII) подвергается разрыву кольца части изоксазола путем перемешивания его с кислотой, такой как, например ТіСІз, в присутствии воды Последующая обработка промежуточного вещества, имеющего формулу (XXIII), с соответствующим веществом таким, как, например RI7CH2COCI или R17CH2COOC2H5, дает в результате как непосредственно вещество по формуле (l-b-1), так и промежуточное вещество, которое может быть конвертировано в соединение по формуле (l-b-1) путем обработки основанием, таким как, например трет-бутоксид калия & и " *' R» R« R « 14 (ИИ) (I g) Соединения формулы (I) могут также быть получены путем конвертирования соединений формулы (І) в другие соединения формулы (I) Соединения, в которых пунктирная линия представляет собой связь, могут быть конвертированы в соединения, в которых пунктирная линия не является связью, известными в науке методами гидрогенизации С другой стороны, соединения, в которых пунктирная линия не является связью, могут быть конвертированы в соединения, в которых пунктирная линия является связью, известными в науке окислительными реакциями Соединения формулы (І), в которых R8 является гидрокси, при этом указанные компоненты представлены формулой (l-b), могут быть конвертированы в соединения формулы (1с), в которой R8a имеет значение R10 за исключением водорода, известными в науке реакциями О-алкиляциии или О-ациляции, такими, например, как реакцией соединения формулы (l-b) с ал-килирующим реагентом, например, R8* W в соответствующих условиях, таких как, например, в биполярном апротонном растворителе, например DMF (N.N-диметилформамид), в присутствии основания, например гидрида натрия W являяется соответствующей отщепляемой группой, такой как, например, гало или сул ьфонил группа X X I 1 ) Промежуточные вещества по формуле (XXI) легко могут быть получены путем обработки промежуточного вещества по формуле (XVI), описанного выше, в присутствии кислоты Соединения по формуле (І), в которых R8 вляется радикалом формулы -N-R11R12, при этом указанные соединения, представленные формулой (l-g), могут быть получены реакцией промежуточного вещества формулы (XIII), где W является соответствующей отщепляемой группой, такой как, например, гало, с веществом формулы (XVI) Указанная реакция может быть выполнена путем перемешивания реактантов в соответствующем растворителе, например, тетрагидрофуране В противоположность описанной выше реакции, соединения по формуле (1-е) могут также быть получены путем взаимодействия промежуточного вещества формулы (l-b) с реагентом формулы R а -ОН в кислой среде Соединения формулы (l-b) могут также быть конвертированы в соединения формулы (l-g), где R11 является водородом, a R1 является Сі ібалкилкарбонилом, путем реакции компонентов формулы (l-b) в кислой среде, такой как, например серная кислота, с Сі ібалкил - CN по реакции Риттера (Ritter) Более того, соединения формулы (l-b) могут также быть превращены в соединения формулы (1-д), где R11 и R12 являются водородом, путем реакции соединений (l-b) с ацетатом аммония и соответствующей обработкой водным раствором ІЧНз Соединения формулы (l-b) могут также быть конвертированы в соединения формулы (l-d), где R8 является водородом, подвергая содинения формулы (l-b) соответствующим условиям восстановления, таким как перемешивание в 57717 16 15 трифтороацетатной кислоте в присутствии фотохимической перегруппировки соединений соответствующего восстанавливающего формулы (VI) Указанная перегруппировка может быть выполнена путем растворения реагентов в вещества, например, борогидрида натрия или же реакционно-инертном растворителе и облучением перемешивания соединений формулы (І-Ь) в с длиной волны Зббнм Предпочтительно кислой среде в присутствии формамида Более использовать дегазированные растворы и того, соединения формулы (l-d), в которых R8 проводить реакцию в инертной атмосфере, такой является водородом, могут быть превращены в как, например, безкислородном аргоне или азоте с соединения формулы (1-е), в которых R8b является целью минимизации нежелательной побочной Сі б алкил, посредством реакции компонентов реакции или уменьшения выхода продукта формулы (l-d) с реагентом формулы (V) в соответствующем растворителе, таком как, R3 например, диглим в присутствии основания, такого как, например, бутоксид калия л В? R" О а-1) Соединение формулы (l-f), определенное как соединение формулы (І), в которой X является серой, может быть получено посредством реакции соответствующего соединения формулы (1-а) с реагентом типа пентасульфида фосфора или реагента Лоуссона (Lawesson) в соответствующем растворителе, таком как, например, пиридин Соединения формулы (І), в которых R1 является водородом а X является кислородом, причем указанные соединения определены как соединения формулы (1-а-1), могут быть получены реакцией нитрона формулы (VI) с ангидридом карбоксильной кислоты, такой как, например, уксусный ангидрид, образуя таким образом соответствующий эфир на 2 -и позиции части хинолина Указанный хинолиновый эфир может быть подвергнут гидролизу in situ до соответствующего хинолинона с применением основания, например, карбоната натрия O-nN' H С другой стороны, соединения формулы (1-а1) могут быть получены посредством реакции нитрона формулы (VI) с сульфонилом, содержащим электрофильный реагент, такой как, например, р-толуолсульфонил хлорид в присутствии основания, такого как, например, водный раствор карбоната калия Эта реакция первоначально включает в себя образование производного 2-гидроксихинолина, который затем таутомеризуется до желаемого производного хинолинона Соединения формулы (1-а-1) могут быть также получены путем внутримолекулярной Соединения формулы (I) могут также быть конвертированы в друг в друга путем известных в науке реакций трансформации функциональных групп Количество таких трансформаций уже описано выше Другими примерами являются гидролиз карбоксильных эфиров до соответствующей карбоксильной кислоты или спирта, гидролиз амидов до соответствующих карбоксильных кислот или аминов, гидролиз нитрилов до соответствующих амидов, аминогруппы на имидазоле или фениле могут быть замещены водородом известной в науке реакцией диазотации с последующим замещеннием диазогруппы водородом, спирты могут быть конвертированы в сложные эфиры и простые эфиры, первичные амины могут быть конвертированы во вторичные или третичные амины, двойные связи могут быть гидрогенизированы до соответствующих одиночных связей Промежуточные вещества формулы (III) могут быть получены реакцией производной хинолинона формулы (VIII) с промежуточным веществом формулы (IX) или его функционального производного в соответствующих условиях, например, в крепкой кислоте, такой как полифосфорная кислота в соответствующем растворителе Промежуточное вещество формулы (VIII) может быть образовано путем циклизации промежуточного вещества формулы (VII) перемешиванием в присутствии крепкой кислоты, например полифосфорной кислоты Необязательно за указанной реакцией циклизации может следовать оксидация, которая может быть выполнена путем перемешивания промежуточного вещества, образованного после циклизации в соответствующем растворителе, таком как галогенированный ароматический растворитель, например, бромбензоле в присутствии окислительного агента, например, бромина или йодина На этой стадии также может быть целесообразным изменить заместитель R1 посредством известной в науке реакции трансформации функциональных групп 17 57717 18 гидрогенации, например, используя газ гидроген и палладий на угле в реакционно-инертном растворителе, таком как, например, тетрагидрофуран Промежуточные вещества формулы (XIX) конвертируются в промежуточные вещества формулы (XX) путем обработки промежуточного вещества (XIX) реакцией (VII) (VIII) ацетиляции, например, обработкой ангидридом Промежуточные вещества формулы (П-а-1), карбоксильной кислоты, например, уксусным будучи промежуточными веществами формулы ангидридом в реакционно-инертном растворителе, 1 (III), где пунктирная линия является связью, R и например, толуоле, с последующей обработкой 1 R являются водородом, а X - кислородом, могут основанием, например, трет-бутоксид ом калия в быть получены, начиная с промежуточного реакционно-инертном растворителе, например, вещества формулы (XVII), которое соответственно 1,2-диметоксиэтане Промежуточные вещества приготовлено путем защиты соответствующего формулы (Ш-а-1) могут быть получены обработкой кетона Указанное промежуточное вещество промежуточных веществ формулы (XX) в формулы (XVII) перемешивают с промежуточным условиях кислой среды веществом формулы (XVIII) в присутствии основания, например, гидроксида натрия, в соответствующем растворителе, таком как спирт, например, метанол Полученное таким образом промежуточное вещество формулы (XVI) (ITS а 1) (XVI) подвергают гидролизу кетала и размыканию кольца части изоксазола путем перемешивания промежуточного вещества формулы (XVI) с (XIX) (XX) кислотой, такой как, например, ТіСІз в присутствии Промежуточные вещества формулы (II) могут воды Для получения промежуточного вещества быть получены реакцией промежуточного формулы (XV), которое подвергают замыканию вещества формулы (X), где W является кольца в присутствии основания, такого как, соответствующей отщепляемой группой, такой например, трет-бутоксид калия, применяют как, например, гало, с промежуточным кетоном уксусный ангидрид формулы (XI) Эту реакцию проводят путем конвертации промежуточного вещества формулы (X) в органометаллическое соединение путем перемешивания его с сильным основанием, таким как литий бутил и последующим добавлением промежуточного кетона формулы (XI) Хотя -Li;"! 4-а' указанная реакция дает вначале гидрокси производное (т е R8 является гидрокси), (XVII) указанное гидрокси производное может быть конвертировано в другое промежуточное вещество, в котором R8, имеет другое определение, путем выполнения известной в I) acid/waier науке трансформации функциональных групп 8» (Ш-я-1) Промежуточные вещества формулы (lll-a-1) могут легко быть конвертированы в промежуточные вещества формулы (II 1-а), определенные как промежуточные вещества формулы (III), где пунктирная линия обозначает связь, X - кислород, R17 - водород, a R1 - отличный от водорода, используя известные в науке процедуры N-алкиляции Ш) (X) (П) Промежуточные нитроны формулы (VI) могут быть получены путем N-оксидации производных хинолина формулы (XII) с соответствующим окислительным агентом, таким как, например, т хлор-пероксибензойной кислоты или Н2О2 в соответствующем растворителе, таком как, например, дихлорометан (m-a-t) Другой путь получения промежуточных веществ формулы (Ш-а-1), где X является кислородом, a R1 - водород, начинается с промежуточного вещества формулы (XVI), которое легко ковертируется в промежуточное вещество формулы (XIX), используя условия каталитической 19 Й (XII)" К° ! О Е19 К° (VI) Указанная N-оксидация может быть также выполнена на исходном веществе хинолине формулы (XII) 20 19 57717 Предполагается, что промежуточные Настоящее изобретение предлагает метод вещества метаболизируются in vivo в соединения инибирования роста опухолей путем приема формулы (I) через промежуточное вещество эффективного количества соединения настоящего формулы (VI) Следовательно, промежуточные изобретения субъектами, например, вещества формулы (XII) и (VI) могут действовать млекопитающими (в большей части людьми) при как пролекарства соединений формулы (I) необходимости проведения такого лечения В частности, настоящее изобретение предлагает Соединения формулы (I) и некоторые метод ингибирования роста опухолей путем промежуточные вещества в своей структуре экспрессии активированного ras-онкогена содержат по меньшей мере один стереогенный посредством приема эффективного количества центр Этот стереогенный центр может соединения настоящего изобретения Примерами присутствовать в R или S конфигурациях опухолей, которые могут быть ингибированыны, Соединения формулы (I), полученные в однако этими примерами они не ограничиваются, описанных выше процессах, являются обычно являются рак легких (например, аденокарцинома), рацемическими смесями антиподов, которые рак поджелудочной железы (например, могут быть выделены друг из друга по известным панкреатическая карцинома, такая как, например, в науке процедурам разделения Рацемические карцинома экзокринной поджелудочной железы), соединения формулы (I) могут быть рак толстой кишки (кол о ректальная карцинома, конвертированы в соответствующие такая как, например, аденокарцинома толстой диастереометрические соли посредством реакции кишки и аденома толстой кишки), кроветворные с соответствующей хиральной кислотой опухоли лимфатических линий (например, острая Указанные диастереометрические соли затем лимфатическая лейкемия, В-клеточная лимфома, разделяют, например, путем селективной или лимфома Бэркитта (Burkitt)), лейкемия спинного фракционной кристаллизации, а антиподы мозга (например, острая лейкемия спиннного удаляют из них посредством щелочи Другой мозга (AML-острый миелобластный лейкоз)), рак способ разделения антиподов соединенний щитовидной железы, миелодиспластический формулы (I) включает в себя жидкую синдром, опухоли мезенхимальные обыкновенные хроматографию с использованием хиральной (например, фибросаркома и рабдомисаркома), стационарной фазы Указанные чистые меланомы, тератокарциномы, нейробластомы, стереохимически изомерные формы могут также карцинома почки, карцинома яичника, карцинома быть получены из соответствующих чистых мочевого пузыря и эпидермальная карцинома стереохимически изомерных форм определенных исходных веществ, при условии что реакция проходит стереоспецифически Предпочтительно, если желательно получить конкретный стереомер, указанное соединение следует синтезировать стереоспецифическими методами В этих методах предпочтительно применяют энантиомерно чистые исходные вещества Настоящее изобретение предлагает метод ингибирования ненормального роста клеток, включая конвертированные клетки, путем приема эффективного количества соединения настоящего изобретения Ненормальный рост клеток относится к клеткам, которые растут независимо от нормального регуляторного механизма (например, потери контактного ингибирования) При этом ненормальный рост включает в себя (1) опухолевые клетки (опухоли), выражающие активированные ras-онкогены, (2) опухолевые клетки, в которых ras-протеин активирован вследствие онкогеной мутации другого гена, (3) доброкачественные злокачественные клетки других прогрессирующих болезней, в которых происходит аберрантная ras-активация Более того, в литературе высказано предположение, что ras-онкогены не только способствуют росту опухолей in vivo прямым воздействием на рост опухолевых клеток, но также и косвенно, т е посредством ослабления вызывающего опухоли агиогенезиса (Rak J et al, Cancer Research, 55,4575-4580, 1995) Следовательно, фармакологически нацеленные мутантные rasонкогены возможно могут ингибировать рост твердых опухолей in vivo, частично путем ингибирования вызывающего опухоли ангиогенезиса Настоящее изобретение предлагает способ ингибирования разрастающихся клеток как доброкачественных, так и злокачественных, в которых ras-протеины являются аберрантно активированы как результат онкогенной мутации генов, т е ras-ген сам по себе не активирован онкогенной мутацией в онкогенную форму, причем указанное ингибирование выполнено в результате применения эффективного количества описанного здесь препарата субъектами, которые нуждаются в таком лечении Например, доброкачественное разрастание нарушает нейро-фиброматоз, или опухоли, в котором ras активирован благодаря мутации или сверхэкспрессии тирозинкиназных онкогенов, и могут быть ингибированы препаратами настоящего изобретения Следовательно, настоящее изобретение содержит препараты формулы (I) для применения в качестве лекарственных средств а также применение этих препаратов формулы (I) для производства медикаментов для лечения одной или более указанных выше болезней Некоторые из промежуточных веществ формулы (XIII), в которых W является гало, могут также проявлять фарнезил протеиновую активность ингибирования С точки зрения их полезных фармакологических свойств, указанные препараты могут быть представлены в различных фармацевтиеских формах для их приема Для приготовления фармацевтических препаратов настоящего изобретения, эффективное количество конкретного соединения на базе основной или кислой дополнительной соли в качестве активного ингредиента объединяют в 22 21 57717 плотную смесь с фармацевтически приемлемым Специалисты в данной области легко могут носителем, при этом носитель может иметь определить эффективное количество препарата разнообразные формы в зависимости от форм из результатов тестов, приведенных ниже, препарата, необходимого для приема Эти Вообще понятно, что эффективное количество фармацевтические соединения желательно будет находится в диапазоне от 0,0001 мг/кг до получать в стандартной дозировке, пригодной, 100мг/кг массы тела, и в частности от 0,001 мг/кг предпочтительно, для приема перорально, до 10мг/кг массы тела Может быть ректально, чрезкожно или посредством целесообразным принимать требуемую дозу два, парентеральной инъекции Например, для три, четыре или более суб-доз в соответствующие приготовления препаратов в форме пероральнои интервалы в течение дня Указанные суб-дозы дозировки, могут быть применены любые могут быть приготовлены как единичные дозы, фармацевтические среды, такие как, например, содержащие, например, от 0,01 до 500мг, а в вода, гликоли, масла, спирты и им подобные - в частности от 01мг до 200мг активного случае приготовления пероральных жидких ингредиента на единицу дозы препаратов, например, суспензий, сиропов, Экспериментальная часть эликсиров и растворов, или твердые носители, В дальнейшем «ТГФ» обозначает например, крахмал, сахар, каолин, смазывающие тетрагидрофуран, «ДИПЭ» обозначает и связывающие вещества, дизинтегрирующие диизопропилэфир, «ДХМ» обозначает агенты и им подобные - в случае приготовления дихлорметан, «ДМФ» обозначает N,Nпорошков, пилюль, капсул и таблеток Из-за их диметилформамид и «АЦН» обозначает легкого приема, таблетки и капсулы представляют ацетонитрил Для некоторых соединений собой наиболее приемлемую форму пероральнои формулы (1) абсолютная стсрехимическая дозировки, в этом случае применяют твердый конфигурация не была экспериментально фармацевтический носитель Для определена В этих случаях стереохимически парентеральных препаратов носитель обычно содержит стерильную воду, по крайней мере большую часть, хотя могут быть также включены и другие ингредиенты, придающие, например, растворимость Могут быть также приготовлены инъекционные растворы, в которых носитель содержит солевой раствор, раствор глюкозы или смесь растворов соли и глюкозы Инъекционные растворы могут быть также приготовлены на основе соответствующих жидких носителей, SUSPENDING агентов и им подобным В препаратах для чрезкожного применения носитель необязательно содержит агент, повышающий проникающую способность, и/или соответствующий увлажняющий агент, необязательно объединенный с соответствующими добавками любой природы в минимальной пропорции, которые не вызывают значительного раздражения кожи Указанные добавки могут облегчить прием препарата чрезкожно и\или может быть полезными для приготовления желаемых препаратов Эти препараты могут приниматься различными путями, например, трансдермально, в виде мази и т п Особенно предпочтительно формировать упомянутые фармацевтические препараты в таких формах, которые было бы легко принимать и имели одинаковую дозировку Форма дозировки, применяемая в описании и формуле изобретения, относится к физически отдельным единицам, имеющим одинаковую дозировку, при этом каждая единица содержит предварительно определенное количество активного ингредиента, расчитанного на получение желаемого терапевтического эффекта в сочетании с требуемым фармацевическим носителем Примерами таких форм дозировок являются таблетки (включая глазированные таблетки), капсулы, пилюли, пакеты с порошком, вафли, инъекционные растворы или суспензии, дозировки по объему чайных и столовых ложек и тому подобное, а также сегрегированное их множество изомерная форма, которая первой была изолирована, обозначена как «А», а вторая - как «В» без дальнейшей ссылки на действительную стереохимическую конфигурацию А Приготовление промежуточных веществ Пример А 1 1а) ^фенил-3-(3-хлорфенил)-2-пропанамид (58,6г) и полифосфорную кислоту (580г) перемешивали при температуре 100°С в течение ночи Продукт использовали без дальнейшей очистки, выход составлял (±)-4-(Зхлорфенил)-3,4дигидро-2(1Н)-хинолинон (промежут 1-а) 1-Ь) Промежуточное вещество (1-а) (58,6г), 4хлорбензойную кислоту (71,2г) и полифосфорную кислоту (580г) перемешивали при температуре 140°С в течение 48 часов Смесь погрузили в ледяную воду и отфильтровали Осадок промыли водой а затем разбавленным раствором NH4OH и поместили в ДХМ Органический слой высушили (МдЭОД отфильтровали и выпарили Осадок очистили в хроматографической колонке через силикагель (элюэнт CH2CI2/CH3OH/NH4OH 99/1/0 1) Очищенные фракции собрали, выпарили и рекристаллизовали из CH2CL2/CH3 ОН/ДИПЭ, при этом выход составлял 2,2г (±)-6-(4хлорбензол)-4-(3-хлорфенил)-3,4-дигидро-2(1Н)хинолинона (промежут І-b, т п 194,8 °С) 1 с) Бромин (3,4мл) в бромбензоле (80мл) добавляли по каплям при комнатной температуре в раствор промежуточного вещества (1-Ь) (26г) в бромбензоле (250мл) и смесь перемешивали при температуре 160°С в течение ночи Смесь охладили до комнатной температуры и обработали щелочью NH4OH Смесь выпарили, осадок поместили в АЦН и отфильтровали Фильтрат промыли водой и высушили на воздухе, выход составил 24г (92,7%) продукта Образец рекристаллизовали из СНгСЬг/СНзОН/ДИПЭ, выход составил 2,8г 6-(4-хлоробензол)-4-(3хлорфенил)-1 (1 Н)-хинолинона, т п 234,8°С (промежут 1-е) 1 d) Иодометан (6,2мл) добавили в смесь 24 23 57717 промежуточного вещества (1-е) (20г) и хлорида Смесь промежуточного вещества (3-а) (26г) в бен-зилтриэтиламмония (5,7г) в серной кислоте (2,5мл) и в воде (250мл) перемешивали и нагревали при температуре тетрагидрофуране (200мл) и гидроксиде натрия 110°С в течение 2 часов Смесь погрузили в лед, (1 ON) (200мл) и смесь перемешивали при обработали щелочью MN4OH и экстрагировали с комнатной температуре в течение ночи, после помощью ДХМ Органический слой высушили чего добавили ацетат этила и смесь (MgSO4), отфильтровали и высушили досуха декантировали Органический слой промыли Осадок очистили в хроматографической колонке водой, высушили (MgSO4), отфильтровали и через гель кремния Чистые фракции собрали и высушили досуха Осадок очистили в выпарили, выход составил 2,4г (11%) (±)-4-[(4хроматографической колонке через силихлорфенил)(1,2-дигидро-1 -метил-2-оксо-4-фенилкагель(элюэнт 6-хинолинил)гидроксиметил]г\1,г\1-диметил-1НСН2С1_2/СНзОН/МН4ОН99,75/0,25/0,1) Чистые имидазол-1-сульфонамида (промежут 3-Ь) фракции собрали и выпарили, выход составил 12,3г (75%) 6-(4-хлорбензол)-4-(3-хлорфенил)-1 Пример А 4 метил-2(1 Н)-хинолинона, т п 154,7°С (промежут 1 Соединение (3) (Зг) добавляли при комнатной d) температуре в тионолхлорид (25мл) Смесь перемешивали и кипятили с обратным Подобным образом, но начиная с холодильником при температуре 40°С в течение промежуточного вещества (1-Ь), был приготовлен ночи Растворитель выпарили досуха Продукт (±)-6-(4-хлорбензол)-4-(3-хлорфенил)-3,4-дигидроприменяли без дальнейшей очистки, выход 1-метил-2(1Н)-хинолинон (промежут 1-е) составлял 3,49г (±)-4-(3-хлорфенил)-1-метил-6-[1Пример А 2 (4-метилфенил)-1-(4-метил-4Н-пиррол-3-ил)этил]Бутиллитий в гексане (1,6М) (12,75мл) 2(1Н)-хинолинон гидрохлорида (промежут 4) добавляли по каплям при температуре -20°С в атмосфере N2 в раствор 6-бромо-4-(3-хлорфенил)Пример А 5 2-метоксихинолин (6,7г) в ТГФ (60мл) и смесь a) Толуол (1900мл) перемешивали в колбе с перемешивали при температуре -20°С в течение круглым дном (5л), используя водяной сепаратор 30 минут Раствор (1-бутил-1Н-имидазол-5-ил)(4Порционно добавляли (4-хлорфенил)(4хлорфенил)метанон (3,5г) в тетрагидрофуране нитрофенил)метанон (250г) и р(30мл) добавляли при температуре -20°С в толуолсульфоновую кислоту (54,5г) Затем в атмосфере N2 и смесь перемешивали при смесь влили этиленгликоль (237 5г) Смесь комнатной температуре в течение ночи перемешивали и кипятили с обратным Добавляли воду и смесь экстрагировали холодильником в течение 48 часов Растворитель этилацетатом Органический слой высушили выпарили Осадок растворили в этилацетате (% л) (MgSO4), отфильтровали и выпарили Осадок и дважды промыли 10 % раствором К2СО3 очистили в хроматографической колонке через Органический слой отделили, высушили (MgSO4), силикагель (элюент CH2CL2/CH3OH/NH4OH отфильтровали и растворитель выпарили Осадок 97/3/0,1) Чистые фракции собрали и выпарили, перемешали в ДИПЭ, отфильтровали и высушили выход составил 2,5г (общий 48%) (±)-а-(1-бутил(вакуум, 40°С, 24 часа), выход составил 265г 1Н-имидазол-5-ил)-4-(3-хлорфенил)-а-(4(91 %) 2-(4-хлорфенил)-2-(4-нитрофенил)-1,3хлорфенил)-2-метокси-6-хинолин-метанола диоксолана (промежут 5-а) (промежут 2) b) Гидроксид натрия (16,4г) и (3метоксифенил) добавляли при комнатной Пример А 3 температуре в раствор промежут (5-а) (25г) в За) Бутиллитий (30,1мл) медленно добавляли метаноле (100мл) и смесь перемешивали при при температуре -78°С в раствор N.N-диметил-ІНкомнатной температуре в течение ночи Добавили имидазол-1-сульфонамиде (8,4г) в воду, осадок отфильтровали, промыли холодным тетрагидрофуране (150мл) и смесь перемешивали метанолом и высушили Продукт применяли без при температуре -78°С в течение 15 минут дальнейшей очистки, выход составил ЗОг (90%) 5Добавили хлортриэтилсилан (8,1мл) и смесь [2-(4-хлорфенил)1,3-диоксолан-2-ил]-3-(3перемешивали пока температура достигла 20°С метоксифенил)-2,1-бензисоксазола(промежут 5Смесь охладили до температуры -78°С, добавили бутиллитий 30,1мл), смесь перемешивали при Ь) темепратуре -78°С в течение 1 часа и оставили c) Промежут (5-Ь) (ЗОг) в ТГФ (250мл) остывать до -15°С Смесь охладили снова до гидрогенизировали с палладием на угле (Зг) в 78°С, добавили раствор 6-(4-хлорбензол)-1-метилкачестве катализатора при комнатной 4-фенил-2(1 Н)-хинолинона (15г) в температуре в течение 12 часов под давлением 5 2,6 10 Па в аппарате Парра (Parr) После тетрагидрофуране (30мл) и смесь перемешивали поглощения ЬІ2 (1 эквивалент) катализатор пока температура достигла 20°С Смесь отфильтровали через целит и фильтрат выпарили гидролизовали и экстрагировали этилацетатом досуха Продукт применяли без дальнейшей Органический слой высушили (MgSO4), очистки, выход составил 31,2г (100%) (3отфильтровали и выпарили досуха Продукт метоксифенил)[2-амино-5-[2-(4-хлорофенил)-1,3использовали без дальнейшей очистки, выход диоксолан-2-ил]фенил]метанона (промежут 5-е) составлял 26г (100%) (±)-4-[(4-хлорфенил)(1,2d) Ацетангидрид (13,9мл) добавили в раствор дигидро-1-метил-2-оксо-4-фенил-6промежут (5-е) (31,2г) в толуоле (300мл) и смесь хинолинил)гидроксиметил]-г\І,І\І-диметил-2перемешивали и кипятили с обратным (триэтилсилил)-1Н-имидазол-1-сульфонамида холодильником в течение 2 часов Смесь (промежут 3-а) 26 25 57717 выпарили досуха и продукт применяли без гидролизовали водой, экстрагировали дальнейшей очистки, выход составил 36,4г (100%) посредством этилацетата и декантировали 1Ч-[2-(3-метоксибензоил)-4-[2-(4-хлорфенил)-1,3Органический слой высушили (МдБОД диоксолан-2-ил]фенил]ацетамида (промежут 5-d) отфильтровали а растворитель выпарили Осадок e) Трет-бутоксид калия (ЗЗг) порционно (8,2г) очистили в хроматографической колонке добавляли при комнатной температуре в раствор через силикагель(элюент промежут (5-d) (36,4г) в 1,2-диметоксиэтане (350г) СН2СІ2/СНзОН/МН4ОН96/4/0,2), и смесь перемешивали при комнатной выкристаллизовали от 2-пропанон/диэтилэфира температуре в течение ночи Смесь Полученное вещество отфильтровали и гидролизовали и экстрагировали посредством высушили, выход составил 1,5г (25%) (±)-3-(3ДХМ Органический слой высушили (MgSC^), хлорфенил)-а-(4-хлорфенил)-а-(1 -метил-1 Нотфильтровали и выпарили досуха Продукт имидазол-5-ил)-2,1-бензисоксазол-5-метанола применили без дальнейшей очистки, выход (промеюут 6-е) составил 43г 6-[2-(4-хлорофенил)-1,3-диоксолан-2d) В раствор промежут (6-е) (38г) в ТГФ ил]-4-(3-метоксифенил)-2(1Н)-хинолинона (300мл) при комнатной температуре добавили (промежут 5-е) ТіСІз (15%) в НгО (200мл) Смесь перемешивали f) Смесь промежут (5-е) ()43г) в HCI (3N, при комнатной температуре в течение 90 минут 400мл) и метаноле (150мл) перемешивали и Смесь вылили в лед базифицировали К2СО3, кипятили с обратным холодильником в течение отфильтровали через целит, промыли этилацетаночи Смесь охладили и отфильтровали Фильтрат том и декантировали Органический слой промыли водой и диэтилэфиром и высушили высушили (MgSO4), отфильтровали и Продукт применили без дальнейшей очистки, растворитель выпарили Осадок очистили в выход составил 27г (94 %) 6-(4-хлорбензоил)-4-(3хроматографической колонке через силикагель метоксифенил)-2(1Н)-хинолинона (промежут 5-г) (элюент СН2С1_2/СНзОН/МН4ОН99/3/0,1 и 95/5/0,1), выход составил 18,7г (49%) (±)-[2-амино-5-[(4д) Метилйодид (1,58мл) добавляли в раствор хлорфенил)гидрокси(1 -метил-1 Н-имидазол-5промежут (5-f) (7,6г) и хлорид ил)метил]фенил](3-хлорфенил)метанона (промебензилтриэтиламмония (ХБТЭА) (2,23г) в ТГФ жут 6-d) (80мл) и гидроксиде натрия (40%, 80мл) Смесь перемешивали при комнатнойтемпературе в В Приготовление конечных соединений течение 2 часов Добавляли воду и смесь Пример В 1 экстрагировали посредством этилацетата 1-метилимидазол (4,69мл) в Органический слой высушили (MgSO4), тетрагидрофуране (100мл) перемешивали при отфильтровали и растворитель выпарили Осадок температуре -78 С очистили в хролматографической колонке Раствор бутил-лития в гексане (2,5М) (36,7мл) быстрого испарения через силика-гель (элюент добавляли по каплям и смесь перемешивали при ДХМ 100%) Оставшуюся фракцию собрали и температуре -78°С в течение 15 минут Добавили растворитель выпарили, выход составил 7,1 г хлортриэтилсилан (9,87мл) и смесь поместили в (90%) 6-(4-хлорбензоил)-4-(3-метоксифенил)комнатную температуру Смесь охладили до метил-2(1Н)-хинолинона (промежут 5-д) 78°С, по каплям добавили раствор бутил-лития в гексане (2,5М) (36,7мл), перемешали при -78°С в Пример А 6 течение 1 часа и довели до -15°С Смесь a) 3-(3-хлорфенил)-5-[2-(4-хлорфенил)-1,3охладили до -78°С, добавили раствор диоксолан-2-ил]-2,1-бензисоксазол (промежут 6-а) промежуточного вещества (1-d) (20г) в ТГФ (40мл) приготовили аналогично промежут (3-Ь) и поместили в комнатную температуру Смесь b) Смесь промежут (6-а) (30г) в HCI 3N гидролизовали при 0°С и экстрагировали (200мл) и метаноле (165мл) перемешивали при этилацетатом Органический слой высушили температуре 100°С в течение 5 часов Смесь (MgSO4), отфильтровали и выпарили досуха, поместили в лед и базифицировали водным выход составил Збг продукта Этот продукт раствором ІЧНз Осадок отфильтровали, промыли очистили в хроматографической колонке через водой и диэтилэфиром и высушили, выход силикагель (элюент составил 24,9г (93%) (4-хлорфенил)[3-(3хлорфенил)-2 1 -бензисоксазол-5-ил]метанона СН2С1_2/СНзОН/МН4ОН97/3/0,1) Чистые фракции (промежут 6-Ь) Продукт применили без собрали, выпарили и выкристаллизовали от 2дальнейшей очистки пропанона, СНзОН H^HshO Осадок c) Бутиллитий в гексане (10мл) медленно отфильтровали, промыли (СгНбЬО и высушили, добавляли при температуре -70°С в потоке N2 в выход составил 12,4г (52%) (±)-4-(3-хлорфенил)-6раствор 1-метилимидазола (1,31 г) в ТГФ (30мл) [(4-хлорфенил)гидрокси(1 -метил-1 Н-имидазол-5Смесь перемешивали при -70°С в течение 45 ил)метил]-1-метил-2(1Н)-хинолинон, (соедин 3, минут Добавили хлортриэтилсилан (2,7мл) т п 233,6°С) Подобным образом, но используя Смесь оставили нагреваться до 15°С, после чего промежуточное вещество (5-д) или (1-е) вместо охладили до -70°С Медленно добавляли промежуточного вещества (1-d), были получены, бутиллитий (10мл) Смесь перемешивали при соответственно, (±)-6-[(4-хлорфе-нил)гидрокси(1температуре -70°С в течение 1 часа, оставили метил-1Н-имидазол-5-ил)метил]-4-(3нагреваться до температуры -15°С, после чего метоксифенил)-1-метил-2(1Н)-хинолинон (соедин охладили до -70°С Добавили раствор промежут 36) и (±)-4-[(3-хлорфенил)-6-[(4-хлорфенил) (6-Ь) (4,9г) в ТГФ (60мл) Смесь перемешивали гидрокси (1 -метил-1 Н-имидазол-5-ил)метил]-3,4 при -70°С в течение 30 минут, затем дигидро-1-метил-2(1Н)-хинолинон (соедин 127) 28 27 57717 Пример В 2 Остаток очистили в хроматографической колонке через силикагель(элюент Соляную кислоту (60мл) добавляли в раствор промежуточного вещества (2) (2,5г) в ТГФ (10мл) и СН2С1_2/СНзОН/МН4ОН98,5/1,5/0,1) Чистые смесь перемешивали и нагревали до 100°С в фракции собрали и выпарили Фракцию (1) течение 3 часов Затем смесь охладили, осадок рекристаллизовали от диэтилэфира, выход отфильтровали, промыли водой и диэтилэфиром составил 3,3г (42%) (±)[-6-](4-хлорфенил)(1-метили высушили, выход сотавил 2,7г (100%) (±)-6-[(11 Н-имидазол-4-ил)-1 -метил-4-фенил-2(1 Н)бутил-1 Н-имитдазол-5-ил)-(4хинолинон, тп149,9°С (соединен 44) Фракцию 2 хлорфенил)гидроксиметил]-4-(хлорфенил)-2(1Н)рекристаллизовали от 2-пропанона, метанола и хинолинона (соедин 8) диэтилэфира, выход составил 1,6г (20%) (±)-6-[(4хлорфенил)(1 -метил-1 Н-имидазол-5-ил)метил]-1 Пример В 3 метил-4-фенил-2(1Н)-хинолинона (Соединен 2, Гидрид натрия (0,28г) добавляли в смесь т п 96,8°С) соединения (3) (Зг) в ДМФ (50мл) в среде N2 и смесь перемешивали в течение 15мин Добавили Пример В 6 йодометан (1,5мл) и смесь перемешивали при Боргидрид натрия (5,6г) добавляли порционно комнатной температуре в течение 1 часа Смесь при температуре 0°С к соединению (3) (7,2г), гидролизовали и экстрагировали диэтилэфиром и растворенному в тритрифторацетатной кислоте метанолом Органический слой высушили (150мл), и смесь перемешивали при комнатной (MgSO4), отфильтровали и выпарили досуха, температуре в течение ночи Смесь перелили в выход составил 4,4г остатка Остаток очистили в лед, базифицировали NaOH 3N, затем хроматографической колонке через концентрированной NaOH и экстрагировали этилацетатом Органический слой высушили силикагель(элюент (MgSO4), отфильтровали и выпарили досуха СН2СІ_2/СНзОН/МН4ОН95,5/4,5/0,2) Чистые Остаток очистили в хроматографической колонке фракции собрали и выпарили Продукт поместили через си-ликагель(элюент CH2CL2/CH3OH 95/5) в соль этандиоловой кислоты (1 1) в 2-пропаноне Чистые фракции собрали и выпарили, выход и отфильтровали Остаток откристаллизовали от составил 4,3г (62%) фракции 1, 0,2г (3%) фракции 2-пропанона, диэтилэфира и ДИПЭ Осадок отфильтровали, промыли ди-этилэфиром, 2 и 2г (29%) фракции 3 Фракцию 1 высушили и рекристаллизовали от 2-пропанона, конвертировали в соль этандиоловой кислоты метанола и ДИПЭ Осадок отфильтровали, (1 1) в 2-пропаноне и диэтилэфире Осадок промыли диэтилэфиром и высушили, выход отфильтровали, промыли диэтилэфиром и составил 0,95г (25%) (±)-4-(3-хлорфенил)-6-[(4высушили, выход составил 4,7г (55%) (±)-4-(3хлорфенил)метокси(1-метил-1 Н-имидазол-5хлорфенил)-6-[(4-хлорфенил)(1 -метил-1 Нил)метил]-1-метил-2(1Н)-хино-линон имидазол-5-ил)метил]-1 -метил-2(1 Н)этандиоат(1 1) дигидрата, (соединен 4, хинолинонэтандиоат(1 1) моногидрата т п 154,6°С) (соединен 5, т п 157,4°С) Пример В 7 Пример В 4 Раствор соединения 90 (4,2г) в 1,2Йодометан (0,38мл) добавляли по каплям при диметоксиэтане (70мл) перемешивали в комнатной температуре в раствор соединения (8) атмосфере N2 в течение 30 минут Добавили (2,44г) и г\1,г\1,г\1-триэтилбензолметанаминхлорида порционно йодометан (0,83мл) а затем трет(0,54г) в тетрагидрофуране (30мл) и гидро-ксиде бутоксид калия (2г) и смесь перемешивали при натрия (40%) (30мл) и смесь перемешивали при комнатной температуре в течение 30 минут комнатной температуре в течение 3 часов Добавили воду и смесь-экстрагировали Добавили воду и смесь экстрагировали этилацетатом Органический слой высушили этилацетатом Органический слой высушили (MgSO4), отфильтровали и выпарили Остаток (MgSO4), отфильтровали и выпарили Остаток очистили в хроматографической колонке через очистили в хроматографической колонке через силикагель (элюент циклогек-сан/2силикагель(элюент пропанол/ЫЩОН 85/5/0,5 до 80/20/1) и СН2С1_2/СНзОН/МН4ОН96,5/3,5/0,1) Чистые конвертировали в соль этандиоловой кислоты, фракции собрали, выпарены и откристаллизовали выкристаллизовали от 2-пропанона и от 2-пропанона и ДИПЭ Осадок отфильтровали, отфильтровали, выход составил 1,16г (23,6%) (±)промыли диэтилэфиром и высушили, выход 4-(3-хлорфенил)-6-[1 -(4-хлорфенил)-1 -(1 -метилсоставил 1,4г (56%) (±)-4-(3-хлорфенил)-6-[(1 1 Н-имидазол-5-ил)этил]-1 -метил-2(1 Н)-хинолибутил-1 Н-имидазол-5-ил)(4нон этандиоата (1 1), (соединен 12, т п 203,9°С) хлорфенил)гидроксиметил]-1 -метил-2(1 Н)Подобным образом, но вместо йодометана хинолинона, (соединен 9, т п 174,6°С) используя дихлорметан, получали соответственно Пример В 5 (±)-6-[2-хлоро-1 -(4-хлорфенил)-1 -(1 -метил-1 НЙодометан (1,4мл) добавляли в смесь (±)-6имидазол-5-ил)этил]-4-(3-хлорфенил)-1-метил[(4-хлорфенил)-1 Н-имидазол-4-илметил]-1 -метил2(1Н)-хинолиннонэтандиоат(1 1) (соеди-нен 69) и 2(1 Н)-хинолинона (7,5г) и хлорид (±)-6-[2-бром-1 -(4-хлорффенил)-1 -(1 -метил-1 Нбензилтриэтиламмония (2г) в ТГФ гидроксида имидазол-5-ил)этил]-4-(3-хлорфенил)-1-метилнатрия (75мл) и смесь перемешивали при 2(1Н)-хинолинон (соединен 70) комнатной температуре в течение 1 часа Пример В 8 Добавили воду и смесь экстрагировали этилацетатом Органический слой высушили а) Соединение (3) (Зг) отделяли (в его (MgSO4), отфильтровали и выпарили досуха энантиомеры) и очищали 29 высокопроизводительной жидкой хроматографией через Хирацел OD (20мКм, элюент гексан/этанол 50/50) Чистую (А)-фракцию собрали и растворитель выпарили, выход составил 1,6г ((А), LiCI >99%) Чистую (В)-фракцию собрали и растворитель выпарили, выход сотавил 1,5г ((В), LiCI, 99%) (А)-остаток растворили в 2-пропаноле и конвертировали в соль этандиоловой кислоты (1 1) Осадок отфильтровали и высушили, выход составил 0,6г (17%) (А)-4-(3-хлорфенил)-6-[(4[хлорфенил)-гидрокси(1 -метил-1 Н-имидазол-5ил)метил]-1-метил-2(1Н)-хинолинон этандиоата (1 1), [a]D2°=+17,96° (с=1% в метаноле) (соединен 23) (В)-осадок растворили в 2пропаноле и конвертировали в соль этандиоловой кислоты(1 1) Осадок отфильтровали и высушили, выход составил 0,6г (17%) (В)-4-(3-хлорфенил)-6[4-хлорффенил)гидрокси(1 -метил-1 Н-имидазол-5ил)метил]-1-метил-2(1Н)-хинолинон этандиоата (1 1), [a] D °= -18,87° (с=1% в метаноле) (соединен 24) Ь) Соединение 14 (4г) отделили (в его энантиомеры) и очистили в хроматографической колонке через ХирацелИСЮ" (25см, элюент 100% этанол, поток 0,5мл/мин, длина волны 220нМ) Чистую (А)-фракцию собрали и растворитель выпарили Остаток растворили в ДХМ (100мл), отфильтровали и фильтрат выпарили Остаток перемешали в ДИПЭ (100мл), отфильтровали и высушили, выход составил 1,3г (А)-6-[амино(4хлорфенил)(1 -метил-1 Н-имидапзол-5-ил)метил]-4(3-хлорфенил)-1 -метил-2(1 Н)-хинолинона (соединен 74) Чистую (В)-фракцию собрали и растворитель выпарили Остаток выкристаллизовали от 2пропанола Осадок отфильтровали, выход сотавил 1,3г (В)-6-[амино(4-хлорфенил)(1-метил1 Н-имидазол-5-ил)метил]-4-(3-хлорфенил)-1 метил-2(1Н)-хинолинона ([a]D2°= +22,86° (с=49,22 мг/5 мл в метаноле) (соединен 75) Пример В 9 Через раствор соединения (47) (3,6г) в ТГФ (40мл) в течение 30 минут пропускали воздух Добавили соль 2-метил-2-пропанол калия (4,4г) Смесь перемешивали при комнатной температуре в течение 3 часов, гидролизовали и затем экстрагировали посредством ДХМ Органический слой отделили, высушили (MgSO4), отфильтровали и растворитель высушили, выход составил 2,9г продукта Продукт очистили в хроматографической колонке через силикагель (элюент CH2CL2/CH3OH/NH4OH 97,5/2,5/0,1) Чистые фракции собрали и растворитель выпарили Остаток выкристаллизовали от 2пропанона/ДИПЭ Осадок отфильтровали и высушили, выход составил 1,3г (35%) (±)-6-[(4хлорфенил)гидрокси(1 Н-имидазол-4-ил)метил]-1 метил-4-фенил-2(1Н)-хинолинон моногидрат (соединеню 43) Пример В 11 Соединение (3) (4г) растворили в ДХМ (10мл) и уксусной кислоте (5,6мл) при температуре 45°С Добавили хлорид цинка (5,5г) и циануксусную кислоту (3,5г) Смесь перемешали при температуре 120°С в течение 3 часов а затем при 160°С в течение 10 часов Добавили воду и смесь 57717 30 экстрагировали посредством ДХМ Органический слой промыли К2СО3 10%, высушили (MgSO4), отфильтровали и растворитель выпарили Остаток очистили в хроматографической колонке через силикагель (элюент CH2CL2/CH3OH/NH4OH 96/4/0,2), выкристаллизовали от 2пропанона/ДИПЭ, отфильтровали и высушили, выход составил 1,95г (45%) (±)-4-(3-хлорфенил)-р(4-хлорфенил)-1,2-дигидро-1 -метил-р-(1 -метил1 Н-имидазол-5ил)-2-оксо-6 хинолинпропаннитрила, (соединен 25, т п 151,3°С) Пример В 12 Серную кислоту (1мл) добавляли по каплям в ацетонитрил (30мл) при перемешивании Добавили соединение 3 (Зг) Смесь перемешивали при температуре 80°С в течение 3 часов и затем охладили Добавили КгСО 10% и смесь экстрагировали посредством этилацетата Органический слой отделили, высушили (MgSO4), отфильтровали и растворитель выпарили досуха Остаток (3,58г) растворили в 2-пропаноне и конвертировали в соль этандиоловой кислоты (1 1) Осадок отфильтровали, высушили и выкристаллизовали от 2-пропанона /СНзОН, выход составил 3,5г (92%) (±)-І\І-[(4-хлорфинил)[4(З-хлорфинил)-і ,2-дигидро-1 -метил-2-оксо-бхинолинил](1-метил-1 Н-имидазол-5ил)метил]ацетамидэтандиоата (1 1) (воединен 56) Пример В 13 В смесь промежуточного вещества 4 (7г) в ТГФ (40мл) добавляли при комнатной температуре водный раствор ІЧНз (40мл) Смесь перемешивали при температуре 80°С в течение 1 часа, затем гидролизовали и экстрагировали посредством ДХМ Органический слой отделили, высушили (MgSO4), отфильтровали и растворитель выпарили Остаток очистили в хроматографической колонке через силикагель(элюент толуол/2-пропанол/ ІЧЬЦОН 80/20/1) Чистые фракции собрали и растворитель выпарили, выход составил 4,4г (±)-6-[амино(4хлорфенил)(1 -метил-1 Н-имидазол-5-ил)метил]-4(3-хлорфенил)-1 -метил-2(1 Н)-хинолинона (соединен 14) Пример В 14 Раствор соединения 36 (6,2 г) в ДХМ (140мл) охладили и по каплям добавили трибромборан (32мл) Смесь перемешивали при комнатной температуре в течение двух дней Смесь вылили в ледяную воду, базифицировали водным раствором ІЧНз и экстрагировали посредством CH2CL2/CH3OH Органический слой отделили, высушили (MgSO4), отфильтровали и растворитель выпарили досуха, выход составил 6г (100%) (±)-6-[(4-хлорфенил)-гидрокси(1-метил-1 Нимидазол-5-ил)метил]-4-(3-гидроксифенил)-1метил-2(1Н)-хинолинона (соединен 54) Пример В 15 Смесь соединения 54 (2,5г), 2-xnop-N,Nдиметилэтанамин (1,9г) и карбонат калия (2,2г) в АЦН (50мл) и ДМФ (50мл) перемешивали при температуре 100°С в течение ночи Растворитель выпарили досуха Остаток поместили в и декантировали Органический слой 32 31 57717 высушили, отфильтровали и растворитель 50°С в течение 3 часов Добавили воду (5мл) и выпарили Остаток (2,7г) очистили в растворитель выпарили, выход составил 8,5г (+)хроматографической колонке через силикагель 4-(3-хлорфенил)-6-[(4-хлорфенил)гидрокси(1(элюент CH2CL2/CH3OH/NH4OH 97/3/0,1 до метил-1 Н-имидазол-5-ил)метил]-3-фенил-2(1 Н)90/10/0,1) Чистые фракции собрали и хинолинона (соединен 140) растворитель выпарили Остаток конвертировали Пример В 19 в соль этанэдоловой кислоты (1 1) в 2-пропаноне Водный раствор ІЧНз (150мл) охладили до 5°С Осадок отфильтровали, промыли 2Добавили раствор (±)-4-(3-хлорфенил)-1-метил-6пропанон/диэтилэфиром и высушили Остаток [1 -(4-метилфенил)-1 -(4-метил-4Н-пиррол-3конвертировали в свободное основание Осадок ил)этил]-2(1 Н)-хинолинона гидрохлорида (16,68г) отфильтровали и высушили, выход составил 0 35г в ТГФ (150мл) Смесь перемешивали при (12%) (±)-6-[(4-хлорфенил)гидрокси(1-метил-1 Hкомнатной температуре в течение 2 часов, имидaзoл-5-ил)мeтил]-4-[3-[2декантировали и экстрагировали посредством (диметиламино)этокси]-фенил]-1-метил-2(1Н)этилацетата Органический слой высушили хинолинона (соединен 62) (MgSO4), отфильтровали и растворитель выпарили досуха Реакцию проводили дважды Пример В 16 Остатки объединили и очистили в P4S10 добавляли в смесь соединения 90 (6г) в хроматографической колонке через силикагель пиридине (72г) Смесь перемешивали и кипятили с (элюент толуол/й-пропанол/ІЧЬЦОН 70-29-1) обратным холодильником в течение 6 часов Чистые фракции собрали и растворитель Добавили ледяную воду Осадок отфильтровали, выпарили Остаток выкристаллизовали от промыли водой и поместили в ДХМ Органический CH2CI2/CH3OH/CH3CN Осадок отфильтровали и слой отделили, высушили (MgSO4), материнский слой выпарили досуха, очистили в отфильтровали и растворитель выпарили досуха хроматографической колонке (элюент Остаток очистили в хроматографической колонке CH3OH/NH4OAc (0,5% в Н2О)70/30) Две чистые через силикагель (элюент CH2CL2/CH3OH/NH4OH фракции собрали их растворители выпарили 97,5/2,5/0,1) Чистые фракции собрали и досуха Фракцию 2 рекристаллизовали от растворитель выпарили Остаток СНгСЬ/диэтилэфира Осадок отфильтровали и выкристаллизовали от 2-пропанон/диэтилэфира высушили, выход составил 0,8г (±)-6-[амино(4Осадок отфильтровали и высушили, выход хлорфенил)(1 -метил-1 Н-имидазол-5-ил)метил]-3составил 1г (±)-4-(3-хлорфенил)-6-[(4хлор-4-(3-хлорфенил)-1 -метил-2(1 Н)-хинолинона хлорфенил)(1 -метил-1 Н-имидазол-5-ил)метил]-1 (соединен 143) метил-2(1Н)-хинолинэтиона (соединен 128) Пример В 17 Пример В 20 Смесь этилмалонилхлорида (6,4г) в ДХМ Серную кислоту (1 мл) добавляли при (50мл) добавляли по каплям при комнатной комнатной температуре в раствор соединения 3 температуре в раствор промежуточного вещества (3,5г) в метоксиацетонитриле (10мл) и смесь (б-d) (15г) и пиридина (10,7мл) в ДХМ (150мл) перемешивали и нагревали при 80°С в течение 3 Смесь перемешивали при комнатной температуре часов Смесь охладили, влили в лед, в течение ночи Добавили воду и смесь базифицировали водным раствором ІЧНз и декантировали Органический слой отделили, отфильтровали Осадок поместили в ДХМ высушили (MgSO4), отфильтровали и Органический слой отделили, высушили (MgSO4), растворитель выпарили Остаток (21 г) очистили в отфильтровали и растворитель выпарили хроматографической колонке через силикагель Остаток очистили в хроматографической колонке (элюент СН2СІ_2/2-пропанол/МН4ОН 92/8/0,4) через силикагель (элюент CH2CL2/CH3OH/NH4OH Чистые фракции собрали и растворитель 96/4/0,3) Чистые фракции собрали и выпарили, выход составил 10,9г (±)-этил4-(3растворитель выпарили Остаток конвертировали хлорфенил)-6-[(4-хлорфенил)гидрокси(1-метилв соль соляной кислоты (1 1) и выкристаллизовали 1 Н-имидазол-5-ил)метил]-1,2-дигидро-2-оксо-3от АЦН Осадок отфильтровали и высушили, хинолинкарбоксилата (соединен 144) выход составил 2,5г (58%) (±)-І\І-[(4-хлорфенил)[4(З-хлорфенил)-і ,2-дигидро-1 -метил-2-оксо-бПример В 18 хинолинил](1 -метил-1 Н-имидазол-5-ил)метил]-2a) Смесь бензолхлорида (3,1мл) в ДХМ (25мл) метоксиацетамид моногидрохлорида добавляли по каплям при комнатной температуре в раствор промежуточного вещества (б-d) и (соединен 89) пиридина (5мл) в ДХМ (70мл) Смесь Пример В 21 перемешивали при комнатной температуре в Раствор промежуточного вещества 4 (3,3г) в течение 45 минут Добавили воду и смесь ТГФ (10мл) добавляли по каплям при комнатной декантировали Органический слой отделили, температуре в раствор метанамина в воде (40мл) высушили (MgSO4), отфильтровали и Смесь перемешивали при температуре 80 С в растворитель выпарили, выход составил 8,8г (±)течение 45 минут, затем поместили в воду и г\1-[2-(3-хлорбензоил)-4-[(4-хлорфенил)-гидрокси(1экстрагировали посредством ДХМ Органический метил-1 Р-имидазол-5слой отделили, высушили (MgSO4), отфильтровали и растворитель выпарили ил)метил]фенил]бензоацетамида (промежут 7) Остаток очистили в хроматографической колонке Продукт применили без дальнейшей очистки через силикагель (элюент CH2CL2/CH3OH/NH4OH b) Трет-бутоксид калия (8,7г) добавили в 97/3/0,3 и 95/5/0,3) Чистые фракции собрали и смесь промежуточного вещества 7 (8,8г) в ДХМ растворитель выпарили Остаток (70мл) Смесь перемешивали при температуре 33 57717 Сселим выкристаллизовали от диэтилэфира Осадок отфильтровали и высушили, выход составил 0,89г 75 в зь (28%) (±)-4-(3-хлорфенил)-6-[(415 ВЗ 16 ВЗ хлорфенил)(метиламино)(1 -метил-1 Н-имидазол-517 аз ил)метил]-1-метил-2(1Н)-хинолинон моногидрата (соединен 61) 5 Я В2 В таблицах 1-8 приведены соединения, 19 В4 20 В2 полученные согласно одному из приведенных 21 В4 выше примеров, а в таблице 9 приведены как 22 83 экспериментальные (колонка с заголовком «ехр»), 23 В 8а так и теоретические (колонка с заголовком 24 BSJ «theor») данные элементного анализа значений BI! 25 углерода, водорода и азота соединений, 27 В2 полученных выше в экспериментальной части 23 В4 29 31 Е2 32 В6 33 Таблица 1 ВЗ В6 56 •>, Іримср No BI ВЗ RK аь Clfe СН) LHj С Ні снэ 4 Вб 5 Є5 6 7 В2 В2 В4 S 9 1 0 ВЗ аь н н Cj H н C 2H HC 3 аь (СВДЇСН, (CHjliCHi a t Физнч. данные он oat в н н он он оодсоо тп 233 й°С тгс І4Є-)б№>С ВЦ во 6! 65 66 Соед No ВІ2 58 ВU В 21 В2 ВІЗ 67 68 69 ВІЗ ВІЗ в? T n 198 °С C E H СНІ CHs OH СН-. CHs C 2s C s H )O H C 2s C s H )O H Ctb CH2-CN OH ЩСН2І5ОСН2С Hi т п 105"C, 3/2{ШО) С Hi н Cs H СНЗ и Cs H CS H Cs H Cs H Clb Cs H H CHi CHs OH OH >260'C H cmi30CHs H т п 140 "C, 3/2fC2H204| ! и 18GX, HCI CHs NHCOCl-b С2Ш04 Cils С2Ш041І02ІІ) СНь НЫ1ШЗОПИЯ CHE CH2)sSOCH. CBj Т а 164°С •NltCHs OH H20 X2H204 H20 -N(CHs)2 т п ібіУС Ci H CHi Cs H CHs -MH CHs -№1-(CH2)2-OH ai> C^ H CHs CHs Tn 2 1 6 X -ста • 74 В 20 CHs CH3 -NH CO?ffl2 S O CHs CH3 2С21-Ш4 т и 220 e C -«HOCH3 CH3CONH2 NH2 V2-(E) C4H4O4 NH2 2НС5 * Е14 тп 22Н°С снз В7 г я 196%, 020204 МН2 70 71 76 CHs -{СНзЬОСН! €Hj 81 ВІЗ CHs CH3 82 вдз CHs CH3 В4 (СН2)2Н(СНЗр CH3 2СКШ Ти 150 °С Ф я з я Данные ' OH •2СЖ204 1 n І70 °С 2H20 . 83 (Л) Г а Ж°С, Н20 CH2)20CHB -СН20СІВ СН2СНЗ NH2 ти Ш-200Т (A>, С2Ш04 111 lSO-20trC,(B), C2H204 T n 154"C OH un сш cm Tn 192"C 0{CH2)20H CHs CHs cm СНЗ вяь Tn 112 °С OH Ш снз 74 T ii 254"C OH CHs і п 2104;, С2НШ сю сю OH 8 13 СНз СНЗ СІ-Ь OH * «Із ВІЗ н C ( H) HC 32 HC s2 ( H) C 22 C 3 K)O H C 22 C s H)G H ї в І80"С C2H2Q4 3/2(H20)tii 144 °С, V2(C2H204) 0(CH2)20-C6H5 78 СНІ ВІЗ СНч Т п ]з5°С т п І74°С t n І85°С. 3f2C,Hfi, В.7 73 и (В) 0iCH2)sOH 0(СН2)2СНя lt )a 12 72 сш CHs CHs CHs CHs E1 СИ-, снз снз CHs Пример СН, ВІЗ CHS 1NH2 Соедин No 77 гл. 180Т, СгНгО, 1/2HJO BJ В7 СЕВ Фтнчесвашинне s т п 260°C HjO П 13 R -CH2Br CH20H O H Ra тчІЬУСіШ)* СН2СНЗ 0(CHj)iN(C тп 120 °С 14 34 84 S5 В4 8ft В4 87 В4 SS В4 89 820 90 91 В6 В 20 92 В 20 93 B2U 94 ВІЗ снз сш снз NH-OH CH3 CH2N{f_H3)2 cm 3/2C2H204 3/2H20 1 и 20а "с С2Н204тп2ІО ( І С N(CHJ)2 снз hHCOCH?N(CH ЗИ сні C3 H cm мщетукт снз CHJ сю снз снз снз сш снз снз cm сю СЮ СНь N ( H2 H HC ! N 2 ) N C CO H HO-C , ПСІ тПЇ20 V H - H O HC 5 С2Н204Ш0 N CC 2H MC CH аїр 242 X 1O6 5 N C C N 2 С2Н204 Н20 HOO H -H 6 5 « CH ти " іфиготоюігао трані.фцриащієй функциональных групи (чаданения 70 Е 1 прнгстовлето-фаіїсфйрчащіЕі функционажныч групп юедаііаіия 25 186 е С 35 36 57717 Таблица 3 Таблица 2 Соея Пр No No Соадіш No R R2 R1" Й CHs CHs СЇІй H H 3-СІ 3-Ct CHs CHs CHs CHs H 2 Ч ЗО Пример No Bl B5 Ь\ B6 j3 35 Bl 86 CHs CHs 3 0-CII2CHs 3-0-СНЇ-СЮ CHs CHs 36 Я? 33 81 61 Bl Bl СНв CHs CHs tHs СИІ H 3 т 92 5 91 4 7% 1 0 0 1 736 8 07 9 22 8 94 8 01 1013 8 02 Ю54 1109 12 49 1083 1219 890 13 15 868 1160 1127 1195 786 1049 7 78 790 10 55 8 87 8 57 ' 8 33 11 65 1123 8 18 10 92 8 47 8 57 10 87 8 33 9 91 7 47 8 01 8 33 ' С Фармакологический пример Пример С 1 , in vitro Анализ ингибирования Фарнезил Протеиновой Трансферази Фарнезил протеиновую трансферазу человека приготовили аналогично приведенной в (Reiss et al , Methods A Companion to Methods in Enzimology vol 1, 241 -245, 1990) Клетки остеосаркомы трансформированного вируса Кирштейна человека (ОСВК) (American Type Culyure Активность фарнезил протеиновой трансферазы измеряли методом фарнезил трансфераз-ной [3Н] сцинтилляции (Farnesyl Transferase [3H] Scintillation Assey) (American International pic,, England), в условиях, определенных производителем Для анализа ингибирования экзима смешали 0,20цСі субстрата 3 [ Н] - фареизилпирофосфата и субстрата биотинилированного ламинированного В пептида (биотип-YRASNRSCAIM) с исследуемыми соединениями в реакционном буфере, содержащем 50мМ HEPES, ЗОмМ MgCI2, 20мМ КСІ, 5мМ дитиотреитол, 0,01% Triton X-100 Тестируемое соединение поместили в Юшп объем диметилсульфоксида (ДМСО) и довели до концентрации от 1 до 10цг/мл и конечного объема ЮОшп Реакционную смесь нагревали до температуры 37°С Энзимная реакция началась при добавлении 20шп разбавленной фарнезил протеиновой трансферазы человека Для приготовления продукта реакции в диапазоне 4000-15000кл/мин, в течение 60 минут реакции инкубации добавляли достаточное количество полученного энзима при температуре 37°С Реакция закончилась после добавления проксимального гранулированного реагента (Amersharn) СТОП/ сцинтилляции Продукт реакции [3Н]-фарнезил-(суэ)-биотин ламин В пептид поглощался связанной стрептавидином сцинтилляторной проксимальной гранулой 42 41 57717 3 Количество [ Н]-фарнезил-(суэ)-биотин ламина В монослойный рост образца до клеток в тканевой пептина, синтезированного в присутствии или культуре Это восстановление легко отсутствии тестового компонента, определялось контролируется посредством подсчета количества как количество клеток в минуту на счетчике клеток в чашах тканевых культур жидкой сцинтилляции Wallac Model 1480 Micro Трансформированных клеток становится больше, beta Термин «cys продукта» обозначает чем клеток, возвращенных в прежнее состояние в активность фарнезил протеиновой траисферазы нетрансформированный фенотип Соединения, Активность фарнезил протеиновой трансферазы, которые возвращают трансформированный наблюдаемая в тестовом соединении, была фенотип, производят антиопухолевый эффект в приведена к активности фарнезил трансферазы в опухолях, несущих ras -генные мутации присутствии 10% ДМСО и выражена в процентах Метод ингибирования В отдельных опытах некоторые Соединения просеивали в тканевую культуру тестовые соединения, проявляющие 50% и более в NIH 3T3 клеток, трансформированных активности ингибирования фарнезил протеиновой активированным H-ras геном человека Т24 Клетки трансферазы, были оценены по зависимости сеяли при первоначальной плотности 200000 концентрация - активность ингибирования энзима клеток на ячейку (96 см площади поверхности) в Эффекты тестовых соединений в этих шести ячеистых кластерных чашах тканевых исследованиях были вычислены как ICso культур Тестовые соединения немедленно (концентрация тестовых соединений, добавляли к 3,0мл среды роста клеток в З.Ошп проявляющих 50% активности ингибирование объем ДМСО с конечной концентрацией ДМСО в энзимов) с использованием компьютерной среде роста клеток 0,1% Тестовые соединения программы LGIC50, разработанной Отделом применяли при концентрациях 5, 10, 50, 100 и научной информации RW Johnson Pharmaceutical 500нМ с одновременным контролем посредника Research Institute (Spring House, PA, USA) на VAX ДМСО (В случае проявления высокой активности компьютере при 5нМ, тестовое соединение тестируется при значительно низких концентрациях) Клеткам дают возможность разрастаться в течение 72 часов Таблица 10 Затем клетки отделяются в 1,0мл трипсин-ЕДТА клеточной среде диссоциации и подсчитываются Соединен Ьи Соединен N o JICOSIS(KM) ІС0»(нМ) на счетчике частиц Колтера (Coulter) 1 60 58 j 2В Измерения і 59 I 0.14 to Количество клеток, выраженное количеством 0.62 3 1.7 60 клеток на ячейку, измеряют с применением 1 1 4 24 61 счетчика частиц Колтера 5 25 63 1,0 При подсчете клеток вводится поправка на 7 1.6 64 11.6 12 42 40 начальную входную плотность клеток путем 66 ' 59 IS І 8.4 Ы вычитания 200000 34 24 2.7 69 Контрольное число клеток = [число клеток из 22 71 26 25 клеток, инкубированных ДСМО носителем, 57 74 100 29 200000] 75 0.86 34 1.6 Число клеток тестового соединения = [число 0 39 95 5? 35 клеток из клеток, инкубированных тестовым 2.8 36 96 0.11 соединением, - 200000] 2.9 37 10.1 97 % ингибирования тестового соединения = [10 59 6.4 ' 39 98 число клеток тест соединения / контрольное 910 99 42 1.7 число клеток] х 100 % 0.52 45 1000 100. IC50 (те концентрация тестового соединения, 57 52 146 68 необходимая для ингибирования активности энзимана на 50%), вычисленная при достаточном Пример С 2 «Анализ фенотипной реверсии количестве данных, приведена в таблице 11 Ras-трансформированных клеток» Введение активированных онкогенов, таких как мутантный ras ген, в подопытную белую мышь NIH ЗЕЗ конвертирует клетки в трансформирование фенотипы Клетки становятся онкогенными, проявляют анкерный независимый рост в полутвердой среде и теряют контактное ингибирование При потере контактного ингибирования появляются клеточные культуры, которые не образуют однородные монослои До некоторой степени клетки накапливаются в многоклеточных клубеньках и вырастают до очень большой плотности насыщения в пластических чашах тканевых культур Такие агенты, как ингибиторы протеиновой фарнезил трансферазы, возвращающие ras превращенный фенотип в прежнее состояние, восстанавливают однородный 43 57717 Таблица 11 Соедин No ІЗДпМ) 5 32 12 14 66 38 22 63 23 395 24 16 25 86 29 345 34 3(1 35 34 Соедин Mo 1С!й{пМ} __ 39 104 8І 89 91 92 93 94 96 98 mo 101 102 40 НО І 04 45 56 23 96 !05 !07 38 58 59 04 109 409 60 70 310 111 П2 16 61 63 53 119 46 66 67 68 19 5/ 3S 120 122 123 1 ІЗЗ 4І 69 14 125 І28 71 288 126 208 72 46 128 177 73 6S 130 32 74 100 !30 547 75 17 137 655 76 IS !43 82 78 46 146 65 79 657 і 48 25 80 81 500 83 152 33 і 74 154 45 84 231 155 69 86 95 156 25 87 25! 160 40 44 раствора соединения на Юг массы мыши Постоянно принимаемые дозы составляли 6,25, 12,5 и 25мг/кг Масса тела и размер опухоли контролировались в процессе последующих 15 дней лечения В конце лечения животных убивали, а опухоль взвешивали «Средняя масса вылеченного посредника опухоли» определяется как средняя масса опухолей, полученных от 10-15 белых мышей, прошедших курс лечения тестовым соединением «Средняя масса опухоли» определяется как средняя масса опухолей, полученных от 10 -15 белых мышей, не прошедших курс лечения тестовым компонентом % снижения конечной массы опухоли = [1средняя масса опухоли / средняя масса посредника вылеченной опухоли] х 100% 153 24 47 21В 45 62 0 78 15 11 366 24 12 18 67 • 35 Пример С 3 «Воричная опухолевая модель ингибирования фарнезил протеиновой трансферезы» Энзим протеиновая трансфераза катализирует ковалентнеє присоединение части фарнези-ла, полученной из фарнезил ras пирофосфата, к онкогенному продукту p21 Это ras приводит к присоединению p21 к плазменной мембране Будучи присоединенной к плазменной мембране, мутант или онкогенныеформы p21 r a s вырабатывает сигнал для трансформации и неконтролируемого роста злокачественных опухолевых клеток Поэтому ингибирование протеиновой фарнезил трансферазы предотвращает мембранное присоединение p21 r a s и подавляет рост ras-трансформированных опухолей Подопытным белым мышам ввели подкожно в паховую область 1x106 Е2 активированный H-ras ген, трансформированный NIH ЗТЗ фибробластовые клетки (Т24 клетки) После трех дней дали возможность опухоли установиться, исследование с тестовым соединением начали путем перорального введенния Тестовые соединения растворили в 20% р-циклодекстрина в 0,1 N растворе HCI и перорально ввели в как 0,1 мл Соединен. No 14 34 35 56 59 75 % снижения конечной массы гаі>ходи как доза 25ш/кг 66% 56% 39% 42% 56% 86% D Примеры соединений Следующие формулировки определяют типичные фармацевтические соединения в единичных формах дозировки, пригодных для систематического или местного их применения теплокровными животными в соответствии с настоящим изобретением Термин «Активный ингредиент» (АИ), используемый в приведенных примерах, относится к соединениям формулы (I), фармацевтически приемлемой кислоте или основной дополнительной соли или их стереохимическим формам Пример D 1 Пероральные растворы 9г метил 4-гидроксибензоата и 1г пропил 4гидроксибензоата расстворили в 4л кипящей очищенной воды В Зл этого раствор растворили Юг 2,3-дигидроксибутан-диоиковой кислоты и затем 20г АИ Последний раствор объединили с оставшейся частью первого раствора и 12л 1,2,3пропантриола и добавили к ним Зл 70% раствора сорбитола 40г сахарина натрия растворили в 0,5л воды и добавили 2мл малиновой эссенции и 2мл эссенции крыжовника Полученный раствор объединили с предыдущим, добавили воду до получения объема 20л создавая раствор для перорального применения, содержащий 5мг АИ на чайную ложку (5мл) Полученный раствор разлили в подходящие контейнеры Пример D 2 Капсулы 20г АИ, 6г л аур ил сульфата натрия, 56г крахмала, 56г лактозы, 0,8г коллоидного диоксида кремния и 1,2г стеарата магния энергично перемешали Полученную смесь затем поместили в 1000 соответствующих прочных капсул, каждая из которых содержала 20мг АИ Пример D 3 Таблетки, покрытые оболочкой 45 57717 Приготовление ядра таблетки Смесь ЮОг АИ, 570г лактозы и 200г крахмала хорошо смешали и после этого увлажнили раствором 5г додицилсульфата натрия и Юг поливинилпиролидона в около 20мл воды Влажную порошковую смесь просеяли, высушили и просеяли снова Затем добавили ЮОг микрокристаллической целлюлозы и 15г гидрогенизированного растительного масла Все хорошо перемешали и спрессовали в таблетки, получая 10000 таблеток, каждая из которых 10мг активного ингредиента Покрытие оболочкой В раствор 10г метилцеллюлозы в 75мл денатурального этанола добавили раствор 5г этил целлюлозы в 150мл дихлорметана Затем добавили 75мл дихлорметана и 2 5МЛ 1,2,3пропан-триола Юг полиэтиленгликоля расплавили и раствороили в 75мл дихлорметана Полученный раствор добавили к предыдущему и затем добавили 2,5г октадеканоата магния, 5г поливинилпирролидола и 30мл концентрированной красящей суспензии и все гомогенизировали Ядра таблеток покрыли Комп'ютерна верстка О Воробей 46 полученной таким образом смесью в соответствующем аппарате Пример D 4 Раствор для инъекций 1,8г метил 4-гидроксибензоата и 0,2г пропил 4-гидроксибензоата растворили в около 0,5л кипящей воды для инъекций После охлаждения до около 50°С добавили при перемешивании 4г молочной кислоты, 0,05г пропиленгликоля и 4г АИ Раствор охладили до комнатной температуры и разбавили водой для инъекций — 1л объема, при этом получается раствор 4мг/мл АИ Раствор стерилизовали путем фильтрации и влили в стерильные контейнеры Пример Р 5 Суппозитории Зг АИ растворили в растворе Зг 2,3дигидроксибутандиоловой кислоты в 25мл полиэтиленгликоля 400 12г поверхностноактивного вещества и ЗООг триглицерида расплавили вместе Полученную смесь хорошо перемешали с предыдущим раствором Полученную таким образом смесь поместили в расплав при температуре 37-38°С для образования 100 суппозиториев, содержащих 30мг/мд АИ каждый Підписано до друку 05 08 2003 Тираж39 прим Міністерство освіти і науки України Державний департамент інтелектуальної власності, Львівська площа, 8, м Київ, МСП, 04655, Україна ТОВ "Міжнародний науковий комітет", вул Артема, 77, м Київ, 04050, Україна
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of (imidazol-5-yl)methyl-2-quinolinone, a process for producing thereof and a pharmaceutical composition based thereon
Автори англійськоюVENET MARC GASTON, Muller Philippe
Назва патенту російськоюПроизводные (имидазол-5-ил)метил-2-хинолинона, способ их получения и фармацевтическая композиция на их основе
Автори російськоюВенэ Марк Гастон, Мюллер Филипп
МПК / Мітки
МПК: C07D 413/14, C07D 405/14, A61P 35/00, C07D 407/14, A61K 31/47, C07D 401/14, A61K 31/4709, C07D 401/06, C07D 521/00, C07D 215/22, A61P 43/00
Мітки: спосіб, похідні, фармацевтична, композиція, імідазол-5-іл)метил-2-хінолінону, отримання, основі
Код посилання
<a href="https://ua.patents.su/23-57717-pokhidni-imidazol-5-ilmetil-2-khinolinonu-sposib-kh-otrimannya-ta-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Похідні (імідазол-5-іл)метил-2-хінолінону, спосіб їх отримання та фармацевтична композиція на їх основі</a>
Попередній патент: Тиристор з двостороннім керуванням
Наступний патент: Бритва з овальною рамою
Випадковий патент: Контактний пристрій колекторно-щіткового механізму двигуна постійного струму