Тверда фармацевтична дозована форма
Номер патенту: 106634
Опубліковано: 25.09.2014
Автори: Шнайдер Петер, Айзенрайх Вольфрам, Пернчоб Нантарат
Формула / Реферат
1. Тверда фармацевтична дозована форма, що включає інгібітор SGLT-2-1-хлор-4-(β-D-глюкопіраноз-1-ил)-2-[4-((S)-тетрагідрофуран-3-ілокси)бензил]бензол, інший лікарський засіб - гідрохлорид метформіну і один або більше фармацевтичних ексципієнтів,
де діапазон доз інгібітора SGLT-2 становить від приблизно 1 мг до приблизно 25 мг, і
де діапазон доз гідрохлориду метформіну становить від приблизно 100 мг до приблизно 1500 мг, і
де фармацевтичні ексципієнти вибрані з групи, що включає один або більше наповнювачів, вибраних із групи, що включає мікрокристалічну целюлозу (МКЦ), D-маніт, кукурудзяний крохмаль і попередньо желатинізований крохмаль, сполучний агент, вибраний із групи, що включає коповідон.
2. Тверда фармацевтична дозована форма за п. 1, де доза інгібітора SGLT-2 становить 0,5, 1, 1,25, 2,5, 5, 10 або 12,5 мг.
3. Тверда фармацевтична дозована форма за п. 2, де доза інгібітора SGLT-2 становить 5 мг або 12,5 мг.
4. Тверда фармацевтична дозована форма за п. 1, 2 або 3, де доза гiдpoxлоpидy метформіну становить 500 мг, 850 мг або 1000 мг.
5. Тверда фармацевтична дозована форма за будь-яким із пп. 1-4, де розподіл частинок за розмірами, краще за об'ємом, краще визначений методом дифракції лазерного випромінювання, інгібітора SGLT-2 є таким, що 1 мкм < Х90 < 200 мкм.
6. Тверда фармацевтична дозована форма за будь-яким із попередніх пунктів, яка як наповнювач включає кукурудзяний крохмаль або мікрокристалічну целюлозу.
7. Тверда фармацевтична дозована форма за будь-яким із попередніх пунктів, що додатково включає змазуючу речовину - стеарат магнію або стеарилфумарат натрію.
8. Тверда фармацевтична дозована форма за будь-яким із попередніх пунктів, що додатково включає ковзну речовину - колоїдний безводний діоксид кремнію.
9. Тверда фармацевтична дозована форма за будь-яким із попередніх пунктів, що додатково включає наповнювач - мікрокристалічну целюлозу, змазуючу речовину - стеарилфумарат натрію та ковзну речовину - колоїдний безводний діоксид кремнію.
10. Тверда фармацевтична дозована форма за будь-яким із попередніх пунктів, що включає одну або більше наступних речовин у кількостях, зазначених нижче (мас. %, у розрахунку на загальну масу таблетки з нанесеним покриттям):
0,1-2,12 % інгібітора SGLT-2,
47-88 % гідрохлориду метформіну,
3,9-8,3 % сполучного агента (наприклад, коповідону),
2,3-8,0 % наповнювача 1 (наприклад, кукурудзяного крохмалю),
0-4,4 % наповнювача 2 (наприклад, попередньо желатинізованого крохмалю),
0-33 % нановнювача 3 (наприклад, D-маніту),
0,7-1,5 % змазуючої речовини (наприклад, стеарату магнію),
0,05-0,5 % ковзної речовини (наприклад, колоїдного безводного діоксину кремнію),
0,00-3,0 % дезінтегруючого агента (наприклад, кросповідону або натрієвої солі кроскармелози).
11. Тверда фармацевтична дозована форма за будь-яким із попередніх пунктів у вигляді таблетки.
12. Тверда фармацевтична дозована форма за п. 11, де таблетка вибрана з групи, що включає одношарову таблетку, двошарову таблетку, таблетку з пресованим покриттям, і таблетку з плівковим покриттям.
13. Тверда фармацевтична дозована форма за п. 11 або п. 12, де на таблетку нанесене плівкове покриття.
14. Тверда фармацевтична дозована форма за п. 13, де плівкове покриття включає плівкоутворювальний агент гіпромелозу, пластифікатор пропіленгліколь або поліетиленгліколь, необов'язково ковзну речовину - тальк, і необов'язково один або більше пігментів, вибраних із групи, що включає діоксин титану, оксид заліза червоний і/або оксид заліза жовтий і/або оксид заліза чорний та їх суміш.
15. Тверда фармацевтична дозована форма за будь-яким із попередніх пунктів у формі одношарової таблетки, що характеризується однією або більше властивостями:
- процентний вміст гідрохлориду метформіну становить приблизно 84 мас. % у розрахунку на загальну масу ядра таблетки,
- процентний вміст інгібітора SGLT-2 становить від приблизно 0,1 % до приблизно 2,5 мас. % у розрахунку на загальну масу ядра таблетки,
- міцність таблетки на розкришуваність дорівнює 100 Н або більше,
- маса ядра таблетки становить від приблизно 550 до приблизно 1180 мг.
16. Тверда фармацевтична дозована форма за будь-яким із попередніх пунктів, де дозована форма з негайним вивільненням характеризується тим, що у тесті на розчинність принаймні 75 мас. % інгібітора SGLT-2 й іншого лікарського засобу розчиняється через 45 хв.
Текст
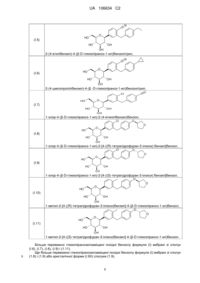
Реферат: Винахід стосується твердої фармацевтичної дозованої форми, що включає інгібітор SGLT-2-1хлор-4-(β-D-глюкопіраноз-1-ил)-2-[4-((S)-тетрагідрофуран-3-ілокси)бензил]бензол, діапазон доз якого становить від приблизно 1 мг до приблизно 25 мг; гідрохлорид метформіну, діапазон доз якого становить від приблизно 100 мг до приблизно 1500 мг; і один або більше фармацевтичних ексципієнтів, вибраних з групи, що включає один або більше наповнювачів, вибраних із групи, що включає мікрокристалічну целюлозу (МКЦ), D-маніт, кукурудзяний крохмаль і попередньо желатинізований крохмаль, сполучний агент, вибраний із групи, що включає коповідон. UA 106634 C2 (12) UA 106634 C2 UA 106634 C2 5 10 15 20 25 30 35 40 45 50 55 Галузь техніки, до якої відноситься даний винахід У даному винаході пропонуються фармацевтичні композиції, що містять фіксовані дозовані комбінації інгібітора SGLT-2 з іншим лікарським засобом, способи їх одержання та їх застосування для лікування ряду захворювань. Більше докладно, у даному винаході пропонуються пероральні тверді лікарські форми для фіксованої комбінації вибраного інгібітора SGLT-2 та іншого визначеного лікарського засобу. Крім того, у даному винаході пропонується спосіб одержання зазначеної лікарської форми. У даному винаході пропонується також застосування зазначеної фармацевтичної композиції та лікарської форми для лікування і/або профілактики вибраних захворювань і патологічних станів, насамперед одного або більше станів, вибраних із групи, що включає поряд із іншими цукровий діабет типу 1, цукровий діабет типу 2, порушену толерантність до глюкози, порушений рівень глюкози у крові натще та гіперглікемію. Більше того у даному винаході пропонуються способи лікування і/або профілактики таких захворювань і патологічних станів, які полягають у введенні фармацевтичної композиції або лікарської форми за даним винаходом пацієнтові, що потребує такого лікування. Передумови створення даного винаходу Діабет типу 2 стає все більше розповсюдженим захворюванням, яке, через високу частоту ускладнень, приводить до значного скорочення середньої тривалості життя. У зв'язку з пов'язаними з діабетом мікросудинними ускладненнями, у промислово розвинених країнах діабет типу 2 є у цей час найпоширенішою причиною розвитку втрати зору у дорослих, ниркової недостатності та ампутацій кінцівок. До того ж захворювання діабетом типу 2 підвищує у 2-5 разів ризик серцево-судинних захворювань. Після тривалого періоду розвитку захворювання більшість пацієнтів із діабетом типу 2 стають несприйнятливими до пероральних курсів лікування, а також інсулінозалежними, з необхідністю щоденних ін'єкцій і вимірів рівня глюкози декілька разів на день. У ході Британських проспективних досліджень з лікування цукрового діабету (UKPDS) було встановлено, що інтенсивне лікування метформіном, сульфонілсечовинами або інсуліном приводить тільки до обмеженого поліпшення глікемічного контролю (розходження рівнів HbA1c становить ~0,9 %). Крім того навіть у пацієнтів із групи інтенсивного лікування глікемічний контроль згодом значно погіршувався, що пояснюється погіршенням функції β-клітин. Важливо відзначити, що при інтенсивному лікуванні не спостерігається істотне зниження мікросудинних ускладнень, тобто серцево-судинних явищ. У зв'язку з цим багато пацієнтів, що страждають від цукрового діабету типу 2, практично не піддаються лікуванню, частково у зв'язку з обмеженнями тривалої ефективності, з переносимістю та складностями при введенні доз, якими характеризуються сучасні антигіпеглікемічні курси лікування. Пероральні лікарські засоби, які звичайно використовують для лікування (наприклад, такі як засоби терапії першої або другої лінії і/або засоби для моно- або комбінованої терапії (первинної або додаткової терапії)), включають, але не обмежуючись тільки ними, метформін, сульфонілсечовини, тіазолідиндіони, глініди та інгібітори α-глюкозидази. Багато випадків неефективного лікування є основною причиною високого рівня розвитку довгострокових ускладнень, асоційованих із гіперглікемією, або хронічних захворювань (включаючи мікро- і макросудинні ускладнення, наприклад, такі як діабетична нефропатія, ретинопатія або невропатія або серцево-судинні ускладнення) у пацієнтів, що страждають від діабету типу 2. У зв'язку з цим у медицині існує нереалізована потреба у способах, лікарських засобах і фармацевтичних композиціях з досить високою ефективністю у відношенні глікемічного контролю, у відношенні властивостей, що модифікують захворювання, і зниження захворюваності й смертності у зв'язку з серцево-судинними захворюваннями, і у той же час характеризуються поліпшеним профілем безпеки. Інгібітори SGLT2 являють собою новий клас агентів, які у цей час використовують при розробці способів лікування або поліпшення глікемічного контролю у пацієнтів із діабетом типу 2. Глюкопіранозилзаміщені похідні бензолу як інгібітори SGLT2 описані у публікаціях попереднього рівня техніки, наприклад, у заявках WO 01/27128, WO 03/099836, WO 2005/092877, WO 2006/034489, WO 2006/064033, WO 2006/117359, WO 2006/117360, WO 2007/025943, WO 2007/028814, WO 2007/031548, WO 2007/093610, WO 2007/128749, WO 2008/049923, WO 2008/055870, WO 2008/055940. Глюкопіранозилзаміщені похідні бензолу пропонуються як індуктори виведення цукру з сечею і як лікарські засоби, призначені для лікування діабету. 1 UA 106634 C2 5 10 15 20 25 30 35 40 45 50 55 Ниркова фільтрація та зворотне захоплення глюкози вносять вклад, поряд із іншими механізмами, у підтримку постійної концентрації глюкози у плазмі й, отже, можуть служити як антидіабетична мішень. Зворотне захоплення профільтрованої через епітеліальні клітини нирок глюкози відбувається за участю спільних натрій залежних білків-переносників глюкози (SGLT2), локалізованих у мембрані щіткової облямівки канальців за градієнтом натрію. Існує, принаймні, 3 ізоформи SGLT, які відрізняються типом експресії, а також фізико-хімічними властивостями. SGLT2 експресується винятково у нирках, у той час як SGLT1 експресується й в інших тканинах, таких як кишечник, ободова кишка, кістякові та серцеві м'язи. Встановлено, що SGLT3 є сенсором глюкози в інтерстиціальних клітинах кишечника та не проявляє транспортну функцію. Передбачається, що інші родинні, але ще не охарактеризовані гени можуть вносити додатковий вклад у зворотне захоплення глюкози. При нормоглікемії глюкоза повністю повторно абсорбується у нирках за участю SGLT2, причому ємність нирок за зворотнім захопленням глюкози насичується при концентрації глюкози більше 10 мМ, що приводить до глюкозурії ("цукровий діабет"). Таку граничну концентрацію можна зменшити за рахунок інгібування SGLT2. В експериментах з випробування інгібітора SGLT, флоризину, було встановлено, що при інгібуванні SGLT частково придушується зворотне захоплення глюкози з клубочкового фільтрату у кров, що приводить до зниження концентрації глюкози у крові та глюкозурії. Мета даного винаходу Мета даного винаходу полягає у розробці фармацевтичної композиції, що включає інгібітор SGLT2 та інший лікарський засіб, що характеризується високою однорідністю складу як відносно інгібітора SGLT2, так і іншого лікарського засобу. Інша мета даного винаходу полягає у розробці фармацевтичної композиції, що включає інгібітор SGLT2 та інший лікарський засіб, що характеризується високим вмістом іншого лікарського засобу та вкрай низьким вмістом інгібітора SGLT2. Ще одна мета даного винаходу полягає у розробці фармацевтичної композиції, що включає інгібітор SGLT2 та інший лікарський засіб, одержання якого є ефективним з погляду часових витрат і вартості виробництва лікарських форм. Інша мета даного винаходу полягає у розробці фармацевтичної композиції, що включає інгібітор SGLT2 та інший лікарський засіб, що дозволяє виключити або знизити злипання та кепінг (руйнування при пресуванні) у процесі одержання зазначеної композиції. Ще одна мета даного винаходу полягає у розробці фармацевтичної композиції, що включає інгібітор SGLT2 та інший лікарський засіб, що дозволяє виключити або знизити плівкоутворення у процесі одержання. Інша мета даного винаходу полягає у розробці лікарської форми, що включає інгібітор SGLT2 та інший лікарський засіб, що характеризується придатним розміром. Ще одна мета даного винаходу полягає у розробці лікарської форми, що включає інгібітор SGLT2 та інший лікарський засіб, що характеризується коротким часом розпаду, задовільною розчинністю і/або високою біодоступністю інгібітора SGLT2 у пацієнтів. Інша мета даного винаходу полягає у розробці фармацевтичної композиції та лікарської форми, кожна з яких включає інгібітор SGLT2 та інший лікарський засіб, а також способу профілактики, уповільнення прогресування, припинення або лікування метаболічного порушення, насамперед цукрового діабету типу 2. Ще одна мета даного винаходу полягає у розробці фармацевтичної композиції та лікарської форми, кожна з яких включає інгібітор SGLT2 та інший лікарський засіб, а також способу поліпшення глікемічного контролю у пацієнтів, які цього потребують, насамперед у пацієнтів із цукровим діабетом типу 2. Інша мета даного винаходу полягає у розробці фармацевтичної композиції та лікарської форми, кожна з яких включає інгібітор SGLT2 та інший лікарський засіб, а також способу поліпшення глікемічного контролю у пацієнтів із недостатнім глікемічним контролем. Ще одна мета даного винаходу полягає у розробці фармацевтичної композиції та лікарської форми, кожна з яких включає інгібітор SGLT2 та інший лікарський засіб, а також способу профілактики, уповільнення або припинення прогресування порушеної толерантності до глюкози (ПТГ), порушеного рівня глюкози у крові натще (ПГН), резистентності до інсуліну і/або метаболічного синдрому при цукровому діабеті типу 2. Інша мета даного винаходу полягає у розробці фармацевтичної композиції та лікарської форми, кожна з яких включає інгібітор SGLT2 та інший лікарський засіб, а також способу профілактики, уповільнення прогресування, припинення або лікування стану або порушення, вибраних із групи, що включає ускладнення, опосередковані цукровим діабетом. 2 UA 106634 C2 5 10 15 20 25 30 35 40 45 50 55 Ще одна мета даного винаходу полягає у розробці фармацевтичної композиції та лікарської форми, кожна з яких включає інгібітор SGLT2 та інший лікарський засіб, а також способу зниження маси тіла або запобігання збільшення маси тіла у пацієнтів, що потребують цього. Інша мета даного винаходу полягає у розробці фармацевтичної композиції та лікарської форми, кожна з яких включає інгібітор SGLT2 та інший лікарський засіб, що характеризуються високою ефективністю при лікуванні метаболічних порушень, насамперед таких, як цукровий діабет, ПТГ, ПГН, і/або гіперглікемія, і зазначені фармацевтична композиція та фармацевтична дозована форма характеризуються досить або надзвичайно високими фармакологічними і/або фармакокінетичними і/або фізико-хімічними властивостями. Інша мета даного винаходу полягає у розробці способу одержання лікарської форми за даним винаходом, одержання якої є ефективною з погляду часових витрат і вартості виробництва лікарських форм. Інші мети даного винаходу представляються очевидними для фахівців у даній галузі медицини на підставі опису і прикладів даної заявки. Короткий виклад сутності винаходу В одному об'єкті даного винаходу пропонується фармацевтична композиція, що включає в якості активних фармацевтичних інгредієнтів інгібітор SGLT-2, інший лікарський засіб і один або більше ексципієнтів. У ще одному об'єкті фармацевтичні композиції за даним винаходом являють собою тверду фармацевтичну композицію, наприклад, тверду фармацевтичну композицію для перорального введення. В іншому об'єкті іншим лікарським засобом, з яким комбінують інгібітор SGLT2 у складі фармацевтичної композиції за винаходом, є бігуанід (наприклад, метформін, такий як гідрохлорид метформіну). Кращим іншим лікарським засобом за даним винаходом є метформін, насамперед гідрохлорид метформіну (гідрохлорид 1,1-диметилгуаніду або гідрохлорид метформіну). В основному фармацевтичні ексципієнти вибрані з групи, що включає один або більше наповнювачів, один або більше сполучних агентів або розріджувачів, одну або більше змазуючих речовин, один або більше дезінтегруючих агентів, і одну або більше ковзних речовин, один або більше плівкоутворювальних агентів, один або більше пластифікаторів, один або більше пігментів тощо. Зазначені фармацевтичні композиції (таблетки) за даним винаходом звичайно включають сполучний агент. Більше докладно, фармацевтичні композиції (таблетки) за даним винаходом звичайно включають один або більше наповнювачів (наприклад, D-маніт, кукурудзяний крохмаль і/або попередньо желатинізований крохмаль і/або мікрокристалічну целюлозу), сполучний агент (наприклад, коповідон), змазуючу речовину (наприклад, стеарат магнію, стеарилфумарат натрію), і ковзну речовину (наприклад, колоїдний безводний діоксид кремнію). Придатні фармацевтичні ексципієнти вибрані з групи, що включає стандартні матеріали, такі як D-маніт, кукурудзяний крохмаль, мікрокристалічна целюлоза, попередньо желатинізований крохмаль як наповнювач, коповідон як сполучний агент, стеарат магнію або стеарилфумарат натрію як змазуюча речовина, колоїдний безводний діоксид кремнію як ковзна речовина, гіпромелозу як плівкоутворювальний агент, пропіленгліколь як пластифікатор, діоксид титану, оксид заліза червоний/жовтий/чорний або суміш зазначених пігментів, тальк тощо. Типова композиція за даним винаходом включає сполучний агент - коповідон (також відомий як кополівідон або Kollidon VA64). Типова композиція за даним винаходом включає наповнювач -кукурудзяний крохмаль, сполучний агент - коповідон, змазуючу речовину - стеарат магнію та ковзну речовину колоїдний безводний діоксид кремнію. Крім того, типова композиція за даним винаходом включає наповнювач - мікрокристалічну целюлозу, сполучний агент - коповідон, змазуючу речовину - стеарат магнію або стеарилфумарат натрію та ковзну речовину - колоїдний безводний діоксид кремнію та необов'язково дезінтегруючий агент - кросповідон або натрієву сіль кроскармелози. Таким чином, у даному винаході пропонується фармацевтична композиція (насамперед пероральна тверда фармацевтична дозована форма, переважно таблетка), що включає інгібітор SGLT2, гідрохлорид метформіну та один або більше фармацевтичних ексципієнтів, переважно один або більше наповнювачів, один або більше сполучних агентів, одну або більше ковзних речовин, і/або одну або більше змазуючих речовин. Більш переважно у даному винаході пропонується фармацевтична композиція (насамперед пероральна тверда фармацевтична дозована форма, переважно таблетка), що включає 3 UA 106634 C2 5 10 15 20 25 30 35 40 45 50 55 інгібітор SGLT2, гідрохлорид метформіну, коповідон як сполучний агент і один або більше додаткових фармацевтичних ексципієнтів. Типові фармацевтичні композиції за даним винаходом можуть включати компонент інгібітора SGLT2 (мас. %, у розрахунку на загальну масу інгібітора SGLT2): 0,1-10 % інгібітора SGLT-2, 0,1-3 % інгібітора SGLT-2, 0,4-2,2 % інгібітора SGLT-2 або 0,1-2,11 % інгібітора SGLT-2. Типові фармацевтичні композиції за даним винаходом можуть також включати компонент інгібітора SGLT2 (мас. %, у розрахунку на загальну масу інгібітора SGLT2): 0,1-10 % інгібітора SGLT-2, 0,1-3 % інгібітора SGLT-2, 0,4-2,2 % інгібітора SGLT-2 або 0,1-2,12 % інгібітора SGLT-2. Типові фармацевтичні композиції за даним винаходом можуть включати одну або більше наступних речовин у кількостях, зазначених нижче (мас. %, у розрахунку на загальну масу таблетки з нанесеним покриттям): 0,1-2,11 % інгібітора SGLT-2, 47-88 % гідрохлориду метформіну, 3,9-8,3 % сполучного агента (наприклад, коповідону), 2,3-8,0 % наповнювача 1 (наприклад, кукурудзяного крохмалю), 0-4,4 % наповнювача 2 (наприклад, попередньо желатинізованого крохмалю), 0-33 % наповнювача 3 (наприклад, D-маніту), 0,7-1,5 % змазуючої речовини (наприклад, стеарату магнію), 0,05-0,5 % ковзної речовини (наприклад, колоїдного безводного діоксиду кремнію), 0,00-3,0 % дезінтегруючого агента (наприклад, кросповідону або натрієвої солі кроскармелози). Типові фармацевтичні композиції за даним винаходом можуть включати одну або більше наступних речовин у кількостях, зазначених нижче (мас. %, у розрахунку на загальну масу таблетки з нанесеним покриттям): 0,1-2,12 % інгібітора SGLT-2, 47-88 % гідрохлориду метформіну, 3,9-8,3 % сполучного агента (наприклад, коповідону), 2,3-8,0 % наповнювача 1 (наприклад, кукурудзяного крохмалю), 0-4,4 % наповнювача 2 (наприклад, попередньо желатинізованого крохмалю), 0-33 % наповнювача 3 (наприклад, D-маніту), 0,7-1,5 % змазуючої речовини (наприклад, стеарату магнію), 0,05-0,5 % ковзної речовини (наприклад, колоїдного безводного діоксиду кремнію), 0,00-3,0 % дезінтегруючого агента (наприклад, кросповідону або натрієвої солі кроскармелози). В одному об'єкті даного винаходу склади фіксованих комбінацій є хімічно стабільними і/або а) характеризуються схожими профілями розчинності в умовах in-vitro і/або є біоеквівалентними відносно вільних комбінацій, або б) дозволяють досягти необхідних показників в умовах як invitro, так і in-vivo. У кращому варіанті здійснення даного винаходу пропонуються хімічно стабільні фіксовані комбінації, в яких зберігаються вихідні профілі розчинення відповідних монотаблеток, що містять індивідуальний лікарський засіб, і при цьому забезпечується прийнятний розмір. В одному варіанті фармацевтичну композицію за даним винаходом одержують грануляцією у псевдозрідженому шарі. Докладний опис складів фіксованих комбінацій за даним винаходом, наприклад, інгредієнти, співвідношення інгредієнтів (такі як, наприклад, співвідношення інгібітора SGLT-2, гідрохлориду метформіну та/або ексципієнтів), переважно у формі конкретних лікарських форм (таблетки), застосовуваних у даному винаході, а також способи їх одержання, представляються очевидними для фахівця у даній галузі техніки, і описані у даному описі та у прикладах заявки. Переважно інгібітор SGLT2 вибраний з групи, що включає глюкопіранозилзаміщені похідні бензолу формули (I) 4 UA 106634 C2 R 2 R HO 1 R 3 O I HO OH OH 1 5 10 15 2 де R означає хлор, метил або ціаногрупу, R означає H, метил, метоксигрупу або 3 гідроксигрупу, а R означає етил, циклопропіл, етиніл, етоксигрупу, (R)- тетрагідрофуран-3ілоксигрупу або (S)-тетрагідрофуран-3-ілоксигрупу, або проліки одного з вищезгаданих інгібіторів SGLT2. Нижче приводяться значення кращих замісників у складі глюкопіранозилзаміщених похідних бензолу формули (I), описаних вище. 1 Переважно R означає хлор або ціаногрупу, насамперед хлор. 2 Переважно R означає H. 3 Переважно R означає етил, циклопропіл, етиніл, (R)-тетрагідрофуран-3-ілоксигрупу або (S)3 тетрагідрофуран-3-ілоксигрупу. Ще більше переважно R означає циклопропіл, етиніл, (R)3 тетрагідрофуран-3-ілоксигрупу або (S)-тетрагідрофуран-3-ілоксигрупу. Найбільше переважно R означає етиніл, (R)-тетрагідрофуран-3-ілоксигрупу або (S)-тетрагідрофуран-3-ілоксигрупу. Переважно глюкопіранозилзаміщені похідні бензолу формули (I) вибрані з групи, що включає сполуки (1.1) - (1.11): O (I.1) HO N O HO OH OH 6-(4-етилбензил)-4-(β-D-глюкопіраноз-1-ил)-2-метоксибензонітрил, N O (I.2) O HO HO OH OH 2-(4-етилбензил)-4-(β-D-глюкопіраноз-1-ил)-5-метоксибензонітрил, N (I.3) O HO HO OH OH 1-ціано-2-(4-етилбензил)-4-(β-D-глюкопіраноз-1-ил)-5-метилбензол, N HO HO (I.4) O HO OH OH 2-(4-етилбензил)-4-(β-D-глюкопіраноз-1-ил)-5-гідроксибензонітрил, 5 UA 106634 C2 N O HO (I.5) HO OH OH 2-(4-етилбензил)-4-(β-D-глюкопіраноз-1-ил)бензонітрил, N (I.6) O HO HO OH OH 2-(4-циклопропілбензил)-4-(β -D-глюкопіраноз-1-ил)бензонітрил, Cl O HO (I.7) HO OH OH 1-хлор-4-(β-D-глюкопіраноз-1-ил)-2-(4-етинілбензил)бензол, Cl O O HO O (I.8) HO OH OH 1-хлор-4-(β-D-глюкопіраноз-1-ил)-2-[4-((R)-тетрагідрофуран-3-ілокси) бензил]бензол, Cl O O HO O (I.9) HO OH OH 1-хлор-4-(β-D-глюкопіраноз-1-ил)-2-[4-((S)-тетрагідрофуран-3-ілокси) бензил]бензол, O O HO O (I.10) HO OH OH 1-метил-2-[4-((R)-тетрагідрофуран-3-ілокси)бензил]-4-(β-D-глюкопіраноз-1-ил)бензол, O O HO O (I.11) HO OH OH 1-метил-2-[4-((S)-тетрагідрофуран-3-ілокси)бензил]-4-(β-D-глюкопіраноз-1-ил)бензол. 5 Більше переважно глюкопіранозилзаміщені похідні бензолу формули (I) вибрані зі сполук (I.6), (I.7), (I.8), (I.9) і (1.11). Ще більше переважно глюкопіранозилзаміщені похідні бензолу формули (I) вибрані зі сполук (1.8) і (1.9) або кристалічної форми (I.9X) сполуки (1.9). 6 UA 106634 C2 5 10 15 20 25 30 35 40 45 50 55 Фармацевтичні композиції за даним винаходом характеризуються високим ступенем однорідності та їхнє одержання є ефективним з погляду часових витрат і вартості виробництва лікарських форм, таких як таблетки і капсули. Крім того, в одному варіанті здійснення даного винаходу зазначені лікарські форми переважно являють собою таблетки. В іншому об'єкті даного винаходу пропонується фармацевтична дозована форма, що включає фармацевтичну композицію за даним винаходом. У ще одному об'єкті, фармацевтична дозована форма за даним винаходом являє собою тверду фармацевтичну дозовану форму, наприклад, тверду фармацевтичну дозовану форму для перорального введення. В одному об'єкті пропонується спосіб одержання лікарської форми за даним винаходом, що включає один або більше процесів грануляції, при цьому активний фармацевтичний інгредієнт гранулюють у суміші з одним або більше ексципієнтів. Зненацька було встановлено, що фармацевтична композиція, яка включає інгібітор SGLT2 та інший лікарський засіб, як описано вище у даному контексті, можна успішно використовувати для профілактики, уповільнення прогресування, припинення або лікування метаболічного порушення, насамперед для поліпшення глікемічного контролю у пацієнтів. Така фармацевтична композиція є перспективним агентом при розробці нових терапевтичних засобів, призначених для лікування та профілактики цукрового діабету типу 2, надлишкової маси тіла, ожиріння, ускладнень при цукровому діабеті та родинних патологічних станах. Отже, у першому об'єкті даного винаходу пропонується спосіб профілактики, уповільнення прогресування, припинення або лікування метаболічного порушення, вибраного з групи, що включає цукровий діабет типу 1, цукровий діабет типу 2, порушену толерантність до глюкози (ПТГ), порушений рівень глюкози натще (ПГН), гіперглікемію, гіперглікемію після прийому їжі, надлишкову масу тіла, ожиріння та метаболічний синдром у пацієнтів, що потребують такого лікування, і зазначений спосіб полягає у тому, що фармацевтичну композицію або фармацевтичну дозовану форму за даним винаходом вводять пацієнтові. В іншому об'єкті даного винаходу пропонується спосіб поліпшення глікемічного контролю і/або зменшення рівня глюкози у плазмі натще, рівня глюкози у плазмі після прийому їжі та/або глікозилованого гемоглобіну HbA1c у пацієнтів, що потребують такого лікування, і зазначений спосіб полягає у тому, що фармацевтичну композицію або фармацевтичну дозовану форму за даним винаходом вводять пацієнтові. Фармацевтична композиція за даним винаходом також має коштовні властивості, що модифікують симптоми, відносно захворювань або станів, пов'язаних із ПТГ, ПГН, резистентністю до інсуліну і/або метаболічним синдромом. У ще одному об'єкті даного винаходу пропонується спосіб профілактики, уповільнення, припинення або обігу прогресування ПТГ, ПГН, резистентності до інсуліну і/або метаболічного синдрому при цукровому діабеті типу 2 у пацієнтів, що потребують такого лікування, і зазначений спосіб полягає у тому, що фармацевтичну композицію або фармацевтичну дозовану форму за даним винаходом вводять пацієнтові. Оскільки застосування фармацевтичної композиції за даним винаходом приводить до поліпшення глікемічного контролю у пацієнтів, що потребують такого лікування, то її також можна використовувати для лікування станів і/або порушень, пов'язаних зі збільшенням рівня глюкози у крові. У ще одному об'єкті даного винаходу пропонується спосіб профілактики, уповільнення прогресування, припинення або лікування стану або порушення, вибраного з групи, що включає ускладнення, опосередковані цукровим діабетом, такі як, наприклад, катаракта та мікро- і макросудинні захворювання, такі як, нефропатія, ретинопатія, невропатія, ішемія тканин, діабетична стопа, артеріосклероз, інфаркт міокарда, гострий коронарний синдром, нестабільна стенокардія, стабільна стенокардія, інсульт, окклюзійне захворювання периферичної артерії, кардіоміопатія, серцева недостатність, порушення серцевого ритму та васкулярний рестеноз у пацієнтів, що потребують такого лікування, і зазначений спосіб полягає у тому, що фармацевтичну композицію або фармацевтичну дозовану форму за даним винаходом вводять пацієнтові. Насамперед можна лікувати, сповільнювати прогресування або запобігати розвиток одного або більше проявів діабетичної нефропатії, такого як гіперперфузія, протеїнурія та альбумінурія. Термін "ішемія тканин" насамперед означає діабетичну макроангіопатію, діабетичну мікроангіопатію, порушене ранозагоєння та діабетичну виразку. У даному описі терміни "мікро- і макросудинні захворювання" і "мікро- і макросудинні ускладнення" використовуються взаємозамінно. У результаті введення фармацевтичної композиції за даним винаходом і активності інгібітора SGLT2, надлишкова кількість глюкози не перетворюється у нерозчинну форму 7 UA 106634 C2 5 10 15 20 25 30 35 40 45 50 55 запасання, таку як жири, а виводиться з сечею пацієнта. Тому у результаті такого лікування не спостерігається збільшення маси тіла або відбувається навіть зниження маси тіла. В іншому об'єкті даного винаходу пропонується спосіб зниження маси тіла або профілактика збільшення маси тіла або прискорення зниження маси тіла у пацієнтів, що потребують такого лікування, і зазначений спосіб полягає у тому, що фармацевтичну композицію або фармацевтичну дозовану форму за даним винаходом вводять пацієнтові. Фармакологічна дія інгібітора SGLT2 у складі фармацевтичної композиції за даним винаходом не залежить від інсуліну. Отже, можна поліпшити глікемічний контроль без додаткового навантаження на бета-клітини підшлункової залози. Після введення фармацевтичної композиції за даним винаходом спостерігається вповільнення або запобігання дегенерації бета-клітин і зниження функціональності бета-клітин, такий як, наприклад, апоптоз або некроз. Більше того, можна поліпшити або відновити функціональність бета-клітин підшлункової залози, а також збільшити їх розмір і число. Було встановлено, що при лікуванні фармакологічною композицією за даним винаходом можна нормалізувати порушені гіперглікемією статус диференціації та гіперплазію бета-клітин підшлункової залози. У ще одному об'єкті даного винаходу пропонується спосіб профілактики, уповільнення, припинення або лікування дегенерації бета-клітин підшлункової залози і/або зниження функціональності бета-клітин підшлункової залози і/або поліпшення і/або відновлення функціональності бета-клітин підшлункової залози і/або відновлення функціональності секреції інсуліну підшлунковою залозою у пацієнтів, що потребують такого лікування, і зазначений спосіб полягає у тому, що фармацевтичну композицію або фармацевтичну дозовану форму за даним винаходом вводять пацієнтові. У результаті введення фармацевтичної композиції за даним винаходом насамперед можна знизити або придушити аномальне накопичення ектопічного жиру у печінці. Отже, в іншому об'єкті даного винаходу пропонується спосіб профілактики, уповільнення, припинення або лікування захворювань або порушень, пов'язаних із аномальним накопиченням ектопічного жиру у печінці, у пацієнтів, що потребують такого лікування, і зазначений спосіб полягає у тому, що пацієнтові вводять інгібітор SGLT2, описаний у даному контексті. Порушення або стани, пов'язані з аномальним накопиченням жиру у печінці переважно вибрані з групи, що включає неспецифічний жировий гепатоз, неалкогольний гепатоз печінки, неалкогольний стеатогепатит, індукований гіпераліментацією жировий гепатоз, діабетичний жировий гепатоз, алкогольний жировий гепатоз або токсичний жировий гепатоз. У зв'язку з цим, в одному об'єкті даного винаходу пропонується спосіб підтримки і/або поліпшення чутливості до інсуліну і/або лікування або профілактики гіперінсулінемії та/або резистентності до інсуліну у пацієнтів, що потребують такого лікування, і зазначений спосіб полягає у тому, що фармацевтичну композицію або фармацевтичну дозовану форму за даним винаходом вводять пацієнтові. У ще одному об'єкті даного винаходу пропонується застосування фармацевтичної композиції або лікарської форми за даним винаходом для одержання лікарського засобу, призначеного для - профілактики, уповільнення прогресування, припинення або лікування метаболічного порушення, вибраного з групи, що включає цукровий діабет типу 1, цукровий діабет типу 2, ПТГ, ПГН, гіперглікемію, гіперглікемію після прийому їжі, надлишкову масу тіла, ожиріння та метаболічний синдром, або - поліпшення глікемічного контролю і/або зменшення рівня глюкози у плазмі натще, рівня глюкози у плазмі після прийому їжі і/або глікозилованого гемоглобіну HbA1c, або - профілактики, уповільнення, припинення або обігу прогресування ПТГ, ПГН, резистентності до інсуліну і/або метаболічного синдрому при цукровому діабеті типу 2, або - профілактики, уповільнення прогресування, припинення або лікування стану або порушення, вибраного з групи, що включає ускладнення, опосередковані цукровим діабетом, такі як, наприклад, катаракта та мікро- і макросудинні захворювання, такі як, нефропатія, ретинопатія, невропатія, ішемія тканин, діабетична стопа, артеріосклероз, інфаркт міокарда, гострий коронарний синдром, нестабільна стенокардія, стабільна стенокардія, інсульт, окклюзійне захворювання периферичної артерії, кардіоміопатія, серцева недостатність, порушення серцевого ритму та васкулярний рестеноз, або - зниження маси тіла або профілактики збільшення маси тіла або прискорення зниження маси тіла, або - профілактики, уповільнення, припинення або лікування дегенерації бета-клітин підшлункової залози і/або зниження функціональності бета-клітин підшлункової залози і/або 8 UA 106634 C2 5 10 15 20 25 30 35 40 45 50 55 60 поліпшення і/або відновлення функціональності бета-клітин підшлункової залози і/або відновлення функціональності секреції інсуліну підшлунковою залозою, або - профілактики, уповільнення, припинення або лікування порушень або станів, пов'язаних із аномальним накопиченням жиру у печінці, або - підтримки і/або поліпшення чутливості до інсуліну і/або лікування або профілактики гіперінсулінемії та/або резистентності до інсуліну у пацієнтів, що потребують такого лікування, і зазначений спосіб полягає у тому, що пацієнтові вводять інгібітор SGLT2, як описано у даному контексті. В іншому об'єкті даного винаходу, пропонується застосування фармацевтичної композиції або лікарської форми за даним винаходом для одержання лікарського засобу, призначеного для лікування і профілактики, як описано у даному контексті. Визначення Термін "активний інгредієнт" фармацевтичної композиції за даним винаходом означає інгібітор SGLT2 за даним винаходом. У даному контексті іноді замість терміна "активний інгредієнт" використовується також термін "активна сполука". Термін "індекс маси тіла" або "ІМТ" людини означає масу у кілограмах, ділену на ріст у 2 метрах у квадраті, і в одиницях виміру ІМТ кг/м . Термін "надлишкова маса тіла" означає стан, при якому ІМТ у пацієнта становить більше 25 2 2 кг/м , але менше 30 кг/м . Терміни "надлишкова маса" і "передожиріння" використовуються взаємозамінно. 2 Термін "ожиріння" означає стан, у якому ІМТ у пацієнта дорівнює 30 кг/м або більше. Відповідно до визначення ВОЗ термін ожиріння класифікують у такий спосіб: термін "ожиріння 2 2 першого класу" означає стан, у якому ІМТ дорівнює 30 кг/м або більше, але менше 35 кг/м , 2 термін "ожиріння другого класу" означає стан, у якому ІМТ дорівнює 35 кг/м або більше, але 2 2 менше 40 кг/м , термін "ожиріння третього класу" означає стан, у якому ІМТ дорівнює 40 кг/м або більше. Термін "вісцеральне ожиріння" означає стан, у якому співвідношення окружності талії та окружності стегон дорівнює 1,0 або більше у чоловіків і 0,8 або більше у жінок. Такий показник означає ризик розвитку резистентності до інсуліну та предіабету. Термін "центральне ожиріння" звичайно означає стан, у якому окружність талії становить > 40 дюймів або 102 см у чоловіків і > 35 дюймів або 94 см у жінок. В японській етнічній групі або в японських пацієнтів центральне ожиріння означає окружність талії ≥ 85 см у чоловіків і ≥ 90 см у жінок (див., наприклад, дані комітету з дослідження метаболічного синдрому в Японії). Термін "еуглікемія" означає стан, у якому у пацієнта концентрація глюкози у крові натще перебуває у межах нормального діапазону, більше 70 мг/дл (3,89 ммоля/л) і менше 110 мг/дл (6,11 ммоля/л). Термін "натще" має звичайне медичне значення. Термін "гіперглікемія" означає стан, у якому у пацієнта концентрація глюкози у крові натще становить значення вище межі нормального діапазону, більше 110 мг/дл (6,11 ммоля/л). Термін "натще" має звичайне медичне значення. Термін "гіпоглікемія" означає стан, у якому у пацієнта концентрація глюкози у крові становить нижче нормального діапазону, насамперед перебуває у діапазоні від 60 до 115 мг/дл (від 3,3 до 6,3 ммоля/л). Термін "гіперглікемія після прийому їжі" означає стан, у якому у пацієнта через 2 год. після прийому їжі концентрація глюкози у крові або сироватці становить більше 200 мг/дл (11,11 ммоля/л). Термін " порушений рівень глюкози натще " або "ПГН" означає стан, у якому у пацієнта концентрація глюкози у крові натще або концентрація глюкози у сироватці натще перебуває у діапазоні від 100 до 125 мг/дл (тобто від 5,6 до 6,9 ммоля/л), насамперед більше 110 мг/дл і менше 126 мг/дл (7,00 ммоля/л). "Нормальний рівень глюкози натще" у крові у пацієнта означає концентрацію глюкози натще менше 100 мг/дл, тобто менше 5,6 ммоля/л. Термін "порушена толерантність до глюкози" або "ПТГ" означає стан, у якому концентрація глюкози у крові або сироватці у пацієнта через 2 год. після прийому їжі становить більше140 мг/дл (7,78 ммоля/л) і менше 200 мг/дл (11,11ммоля/л). Аномальну толерантність до глюкози, тобто концентрацію глюкози у крові або сироватці через 2 години після прийому їжі, вимірюють за рівнем цукру у крові у мг глюкози в одному дл плазми через 2 год. після прийому 75 г глюкози натще. "Нормальна толерантність до глюкози" у пацієнта відповідає концентрації глюкози у крові або сироватці через 2 години після прийому їжі менше 140 мг/дл (7,78 ммоля/л). Термін "гіперінсулінемія" означає стан, при якому у пацієнта з резистентністю до інсуліну, у присутності або відсутності еуглікемії концентрація інсуліну натще або після прийому їжі у сироватці або плазмі становить більш високе значення у порівнянні з нормальними худими 9 UA 106634 C2 5 10 15 20 25 30 35 40 45 50 55 60 пацієнтами без резистентності до інсуліну, в яких співвідношення окружності талії та окружності стегон становить < 1,0 (для чоловіків) або 4,0 або індекс ГМО-РІ вище верхньої межі нормального діапазону, що визначають за даними лабораторного аналізу рівнів глюкози та інсуліну. Термін "діабет типу 2" означає стан, при якому у пацієнта концентрація глюкози у крові натще або концентрація глюкози у плазмі натще становить більше 125 мг/дл (6,94 ммоля/л). Рівень глюкози у крові визначають стандартним методом лабораторного аналізу. Якщо проводять глюкозотолерантний тест, рівень цукру у крові хворого діабетом перевищує 200 мг глюкози на дл (11,1 ммоля/л) у плазмі через 2 год. після прийому 75 г глюкози на порожній шлунок. При проведенні глюкозотолерантного тесту 75 г глюкози пацієнт приймає перорально після голодування протягом 10-12 год., і рівень цукру у крові реєструють безпосередньо перед прийомом глюкози і через 1 і 2 год. після її прийому. У здорової людини рівень цукру у крові перед прийомом глюкози становить від 60 до 110 мг на дл плазми, менше 200 мг/дл через 1 год. після прийому глюкози і менше 140 мг/дл через 2 год. після прийому глюкози. Якщо через 2 год. значення становить від 140 до 200 мг, то у пацієнта спостерігається аномальна толерантність до глюкози. Термін "пізня стадія цукрового діабету типу 2" включає пацієнтів, що не піддаються вторинному курсу лікування, яким показана інсулінотерапія та у яких спостерігається прогресування мікро- і макросудинних ускладнень, наприклад, діабетична нефропатія або ішемічна хвороба серця (ІХС). Термін "HbA1c" являє собою продукт неферментативного глікозилування ланцюга гемоглобіну В, відомий фахівцям у даній галузі. При моніторингу у ході лікування цукрового діабету рівень HbA1c є надзвичайно важливим. Оскільки його продукування у значній мірі залежить від рівня цукру у крові та періоду життя еритроцитів, рівень HbA1c в якості "пам'яті рівня цукру у крові" відбиває середній рівень цукру у крові протягом 4-6 тижнів. Пацієнти з цукровим діабетом, у яких рівень HbA1c постійно підтримується у ході інтенсивного лікування діабету (тобто < 6,5 % від загального гемоглобіну у зразку), у значній мірі захищені від діабетичної мікроангіопатії. Наприклад, метформін сам по собі забезпечує середнє поліпшення рівня HbA1c у пацієнта з діабетом на 1,0-1,5 %. Таке зниження рівня HbA1c є недостатнім для всіх пацієнтів із діабетом, щоб забезпечити необхідний рівень HbA1c < 6,5 % і переважно 40 дюймів або 102 см у чоловіків і > 35 дюймів або 94 см у жінок, або в японській етнічній групі або в японських пацієнтів окружність талії ≥ 85 см у чоловіків і ≥ 90 см у жінок, 2. Тригліцериди: ≥ 150 мг/дл, 3. Холестерин-ЛПВЩ < 40 мг/дл у чоловіків, 4. Кров'яний тиск ≥ 130/85 мм рт. ст. (СКТ ≥ 130 або ДКТ ≥ 85), 5. Рівень глюкози у крові натще ≥ 110 мг/дл. Рекомендації NCEP були затверджені у 2002 р (Laaksonen D.E. та ін., Am. J. Epidemiol. 156, 1070-1077 (2002)). Рівні тригліцеридів і холестерину-ЛПВЩ у крові можна також визначити стандартними методами лабораторних аналізів і описані, наприклад, у довіднику Thomas L. (ред.) "Labor und Diagnose", TH-Books Verlagsgesellschaft mbH, Франкфурт на Майні, 2000. Широко відомий термін "гіпертензія" означає стан, при якому систолічний кров'яний тиск (СКТ) перевищує 140 мм рт. ст. і діастолічний кров'яний тиск (ДКТ) перевищує 90 мм рт. ст. Якщо у пацієнта встановлений діагноз діабет, останнім часом рекомендується знижувати систолічний кров'яний тиск до менше 130 мм рт. ст. і діастолічний кров'яний тиск до менше 80 мм рт. ст. Термін "інгібітор SGLT2", використаний у даному контексті, означає сполуки, насамперед глюкопіранозилпохідні, тобто сполуки, що містять глюкопіранозильний фрагмент, які інгібують натрій залежний білок-переносник глюкози 2 (SGLT2), насамперед SGLT2 людини (hSGLT2). Переважно сполуки, які інгібують hSGLT2, характеризуються значенням IC50 менше 1000 нМ, 11 UA 106634 C2 5 10 15 20 25 більш переважно менше 100 нМ, найбільше переважно менше 50 нМ. Інгібуючу активність сполук у відношенні hSGLT2 можна оцінити методами, описаними у літературі, насамперед описаними у заявках WO 2005/092877 або WO 2007/093610 (стор. 23-24), які включені у повному обсязі у даний опис як посилання. Термін "інгібітор SGLT2" включає також будь-які його фармацевтично прийнятні солі, гідрати і сольвати, включаючи відповідні кристалічні форми. Термін "лікування" включає медикаментозне лікування пацієнтів, у яких спостерігається прогресуючий зазначений стан, насамперед у явній формі. Медикаментозне лікування являє собою симптоматичне лікування для зниження інтенсивності симптомів специфічного стану або етіотропне лікування для обігу або часткового обігу симптомів стану або для припинення або вповільнення прогресування захворювання. Таким чином, композиції та способи за даним винаходом можна використовувати, наприклад, для медикаментозного лікування протягом певного періоду часу, а також для тривалого курсу лікування. Терміни "профілактичне лікування", "профілактика" є взаємозамінними та включають лікування пацієнтів групи ризику розвитку вищезгаданих станів з метою зниження згаданого ризику. Термін "таблетка" включає таблетки без покриття та таблетки з одним або більше покриттями. Крім того, термін "таблетка" включає одно-, двох-, трьох- або багатошарові таблетки, а також таблетки з пресованим покриттям, при цьому кожний зі зазначених типів таблеток не містить або містить одне або більше покриттів. Термін "таблетка" включає також мінітаблетки, таблетки, що плавляться, жувальні, шипучі та пероральні таблетки, що розпадаються. Термін "фармакопея" включає стандартні фармакопеї, такі як фармакопея США, "USP 31-NF 26, друге доповнене видання" (United States Pharmacopeial Convention) або "європейська фармакопея 6.3" (European Directorate for the Quality of Medicines і Health Care, 2000-2009). Докладний опис варіантів здійснення винаходу Об'єкти за даним винаходом, насамперед фармацевтичні композиції, способи та застосування, відносяться до інгібіторів SGLT2, як описано у даному контексті. Переважно інгібітор SGLT2 вибраний з групи, що включає глюкопіранозилзаміщені похідні бензолу формули (I), R 2 R HO 35 40 45 R O HO 30 1 3 I OH OH 1 2 де R означає хлор, метил або ціаногрупу, R означає H, метил, метоксигрупу або 3 гідроксигрупу, а R означає етил, циклопропіл, етиніл, етоксигрупу, (R)- тетрагідрофуран-3ілоксигрупу або (S)-тетрагідрофуран-3-ілоксигрупу, або проліки одного з інгібіторів SGLT2, зазначених вище. Сполуки формули (I) і способи їх одержання описані, наприклад, у наступних заявках: WO 2005/092877, WO 2006/117360, WO 2006/117359, WO 2006/120208, WO 2006/064033, WO 2007/031548, WO 2007/093610, WO 2008/020011, WO 2008/055870. Вищезгадані глюкопіранозилзаміщені похідні бензолу формули (I) містять наступні кращі замісники. 1 Переважно R означає хлор або ціаногрупу, насамперед хлор. 2 Переважно R означає H. 3 Переважно R означає етил, циклопропіл, етиніл, (R)-тетрагідрофуран-3-ілоксигрупу або (S)3 тетрагідрофуран-3-ілоксигрупу. Більше переважно R означає циклопропіл, етиніл, (R)3 тетрагідрофуран-3-ілоксигрупу або (S)-тетрагідрофуран-3-ілоксигрупу. Найбільше переважно R означає етиніл, (R)-тетрагідрофуран-3-ілоксигрупу або (S)-тетрагідрофуран-3-ілоксигрупу. Глюкопіранозилзаміщені похідні бензолу формули (I) переважно вибрані з групи, що включає сполуки (1.1) - (1.11): 12 UA 106634 C2 O (I.1) HO N O HO OH OH 6-(4-етилбензил)-4-(β-D-глюкопіраноз-1-ил)-2-метоксибензонітрил, N O (I.2) O HO HO OH OH 2-(4-етилбензил)-4-(β-D-глюкопіраноз-1-ил)-5-метоксибензонітрил, N (I.3) O HO HO OH OH 1-ціано-2-(4-етилбензил)-4-(β-D-глюкопіраноз-1-ил)-5-метилбензол, N HO (I.4) HO O HO OH OH 2-(4-етилбензил)-4-(β-D-глюкопіраноз-1-ил)-5-гідроксибензонітрил, N (I.5) HO O HO OH OH 2-(4-етилбензил)-4-(β-D-глюкопіраноз-1-ил)бензонітрил, N (I.6) HO HO O OH OH 2-(4-циклопропілбензил)-4-(β-D-глюкопіраноз-1-ил)бензонітрил, 13 UA 106634 C2 Cl O HO (I.7) HO OH OH 1-хлор-4-(β-D-глюкопіраноз-1-ил)-2-(4-етинілбензил)бензол, Cl O O O HO (I.8) HO OH OH 1-хлор-4-(β-D-глюкопіраноз-1-ил)-2-[4-((R)-тетрагідрофуран-3-ілокси) бензил]бензол, Cl O O HO O (I.9) HO OH OH 1-хлор-4-(β-D-глюкопіраноз-1-ил)-2-[4-((S)-тетрагідрофуран-3-ілокси) бензил]бензол, O O O HO (I.10) HO OH OH 1-метил-2-[4-((R)-тетрагідрофуран-3-ілокси)бензил]-4-(β-D-глюкопіраноз-1-ил)бензол, O O HO O (I.11) HO OH OH 1-метил-2-[4-((S)-тетрагідрофуран-3-ілокси)бензил]-4-(β-D-глюкопіраноз-1-ил)бензол. 5 10 15 Більше переважно глюкопіранозилзаміщені похідні бензолу формули (I) вибрані зі сполук (I.6), (I.7), (I.8), (I.9) і (1.11). Ще більше переважно глюкопіранозилзаміщені похідні бензолу формули (I) вибрані зі сполук (1.8) і (1.9). Згідно з даним винаходом, визначення перерахованих вище глюкопіранозилзаміщених похідних бензолу формули (I) також включають їхні гідрати, сольвати та поліморфні форми, а також їх проліки. Кристалічна форма кращої сполуки (I.7) описана у заявці WO 2007/028814, що включена у повному обсязі у даний опис. Кристалічна форма кращої сполуки (I.8) описана у заявці WO 2006/117360, що включена у повному обсязі у даний опис. Кристалічна форма кращої сполуки (I.9) описана у заявці WO 2006/117359, що включена у повному обсязі у даний опис. Кристалічна форма кращої сполуки (I.11), описана у заявці WO 2008/049923, що включена у повному обсязі у даний опис. Зазначені кристалічні форми характеризуються досить високим профілем розчинення, що забезпечує досить високу біодоступність інгібітора SGLT2. Крім того, кристалічні форми характеризуються фізико-хімічною стабільністю, що забезпечує досить високу стабільність фармацевтичної композиції при зберіганні. Для виключення будь-яких невизначеностей цитовані документи, в яких описані зазначені вище інгібітори SGLT2, у повному обсязі включені у даний опис як посилання. 14 UA 106634 C2 5 10 Краща кристалічна форма (I.9X) сполуки (1.9) характеризується порошковою рентгенівською дифрактограмою ПРД (випромінювання CuKα1), яка включає піки кута 2θ при 18,84, 20,36 і 25,21° (±0,1° 2θ). Переважно зазначена ПРД (випромінювання CuKα1) включає піки кута 2θ при 14,69, 18,84, 19,16, 19,50, 20,36 і 25,21° (±0,1° 2θ). Переважно зазначена ПРД (випромінювання CuKα1) включає піки кута 2θ при 14,69, 17,95, 18,43, 18,84, 19,16, 19,50, 20,36, 22,71, 23,44, 24,81, 25,21 і 25,65° (±0,1° 2θ). Більше конкретно кристалічна форма (I.9X) характеризується ПРД, отриманою з використанням випромінювання CuKα1, яка включає піки кута 2θ (± 0,1° 2θ), зазначені у таблиці 1. Таблиця 1 Порошкова рентгенівська дифрактограма кристалічної форми (I.9X) (наведені піки тільки аж до 30° кута 2θ): кут 2θ [°] 4,46 9,83 11,68 13,35 14,69 15,73 16,20 17,95 18,31 18,43 18,84 19,16 19,50 20,36 20,55 21,18 21,46 22,09 22,22 22,71 23,44 23,72 24,09 24,33 24,81 25,21 25,65 26,40 26,85 27,26 27,89 28,24 29,01 29,41 Значення d* [Å] 19,80 8,99 7,57 6,63 6,03 5,63 5,47 4,94 4,84 4,81 4,71 4,63 4,55 4,36 4,32 4,19 4,14 4,02 4,00 3,91 3,79 3,75 3,69 3,66 3,59 3,53 3,47 3,37 3,32 3,27 3,20 3,16 3,08 3,03 Інтенсивність I/I0 [%] 8 4 4 14 42 16 8 30 22 23 100 42 31 74 13 11 13 19 4 28 27 3 3 7 24 46 23 2 8 17 2 3 4 18 * - міжплощинна відстань 15 Ще більше переважно кристалічна форма (I.9X) характеризується ПРД, отриманою з використанням випромінювання CuKα1, яка включає піки кута 2θ (± 0,1° 2θ), зазначені на фіг. 1 заявки WO 2006/117359. 15 UA 106634 C2 5 10 15 20 25 30 35 40 45 50 55 60 Крім того, кристалічна форма (I.9X) характеризується температурою плавлення, рівною приблизно 151 °C ± 5 °C (яку визначали методом ДСК, і яка означає температуру початку плавлення, швидкість нагрівання 10 K/хв). Крива ДСК представлена на фіг. 2 патентної заявки WO 2006/117359. ПРД за даним винаходом одержували у режимі пропущення з використанням дифрактометра STOE-STADI P, обладнаному детектором положення (OED) і анодом з Cu як джерело рентгенівського випромінювання CuKα1 (λ = 1,54056 Å, 40 кВ, 40 мА). У таблиці 1, зазначеній вище, значення "2θ [°]" означають величину кута дифракції у градусах, а значення "d [Å]" означають зазначені міжплощинні відстані у кристалічній решітці в Å. Інтенсивності, зазначені на фіг. 1 заявки WO 2006/117359, наведені в одиницях імп/с. З урахуванням експериментальної помилки зазначені вище значення кутів 2θ варто вважати точними з відхиленням ± 0,1° 2θ, насамперед ± 0,05° 2θ. Слід зазначити, що для визначення відповідності зразка сполуки (I.9) кристалічній формі за винаходом, значення кута 2θ, спостережувані на дифрактограмі зразка, повинні збігатися з характеристичним значенням, зазначеним вище, при цьому значення може відрізнятися від характеристичного значення на величину не більше ± 0,1° 2θ, насамперед не більше ± 0,05 2θ. Температуру плавлення визначали методом ДСК (диференціальна скануюча калориметрія) на установці DSC 821 (фірми Mettler Toledo). В одному варіанті здійснення даного винаходу пропонується фармацевтична композиція або фармацевтична дозована форма за даним винаходом, що містить сполуку (1.9), де принаймні 50 мас. % сполуки (1.9) присутні у кристалічній формі (I.9X), як описано у даному контексті. Переважно у зазначеній композиції або лікарській формі принаймні 80 мас. %, більш переважно принаймні 90 мас. % сполуки (1.9) присутні у кристалічній формі (I.9X), як описано у даному контексті. Краща доза інгібітора SGLT2 перебуває у діапазоні від 0,5 мг до 200 мг, ще більше переважно від 1 до 100 мг, найбільше переважно від 1 до 50 мг на добу. Кращим є пероральне введення. Отже, вміст фармацевтичної композиції за даним винаходом може становити зазначені у даному контексті кількості, насамперед від 0,5 до 50 мг, переважно 1 до 25 мг, ще більше переважно від 2,5 до 12,5 мг. Конкретними дозуваннями за даним винаходом (наприклад, у розрахунку на таблетку або капсулу) є, наприклад, 0,5, 1, 1,25, 2, 2,5, 5, 7,5, 10, 12,5, 15, 20, 25 або 50 мг інгібітора SGLT2, наприклад, сполуки формули (I), насамперед сполуки (1.9) або її кристалічної форми (I.9X). Конкретними дозуваннями (наприклад, у розрахунку на таблетку або капсулу) є, наприклад, 0,5, 1, 1,25, 2,5, 5, 10 або 12,5 мг інгібітора SGLT2, наприклад, сполуки формули (I), насамперед сполуки (1.9) або її кристалічної форми (I.9X). В іншому об'єкті іншими лікарськими засобами, які комбінують з інгібітором SGLT2 у складі фармацевтичних композицій за даним винаходом, є бігуаніди (наприклад, метформін, такий як гідрохлорид метформіну). Кращим іншим лікарським засобом за даним винаходом є метформін, переважно гідрохлорид метформіну (гідрохлорид 1,1-диметилгуаніду або гідрохлорид метформіну). Метформін, антигіперглікемічний препарат класу бігуанідів, описаний у патенті US No.3174901. Спосіб одержання метформіну (диметилдигуаніду) та його гідрохлориду вперше був описаний у статті (Emil A. Werner і James Bell, J. Chem. Soc. 121, 1790-1794 (1922)). Інші фармацевтично придатні солі метформіну описані у патенті US No. 09/262526, опублікованому 4 березня 1999 року або US No. 3174901. У даному описі кращою формою метформіну є гідрохлорид метформіну. Доза метформіну звичайно становить приблизно від 250 мг до 3000 мг, переважно від 500 мг до 2000 мг, але не більше 2500 мг на добу, залежно від різних курсів лікування. Діапазон доз іншого лікарського засобу, метформіну, звичайно включає діапазон від 100 мг до 500 мг або від 200 мг до 850 мг (1-3 рази на добу), або від 300 мг до 1000 мг однократно або двічі на добу. Вміст гідрохлориду метформіну у стандартній лікарській формі для застосування за даним винаходом може становити від 100 мг до 2000 мг або від 100 мг до 1500 мг, переважно від 250 мг до 1000 мг. Конкретний вміст гідрохлориду метформіну у лікарській формі може становити 250, 500, 625, 750, 850 і 1000 мг. Зазначений вміст гідрохлориду метформіну у лікарській формі відповідає вмісту, схваленому до застосування у США при лікуванні діабету типу 2. Більше конкретний вміст гідрохлориду метформіну у фіксованій комбінації у стандартній лікарській формі за даним винаходом становить 500, 850 і 1000 мг. В іншому об'єкті даного винаходу пропонується фармацевтична композиція, склад, суміш або фармацевтична дозована форма, що практично не містить або містить незначну кількість 16 UA 106634 C2 5 10 15 20 25 30 35 40 45 50 55 60 домішок і/або продуктів розпаду. Це означає, наприклад, що композиція, склад, суміш або фармацевтична дозована форма містить приблизно
ДивитисяДодаткова інформація
Автори англійськоюSchneider, Peter, Eisenreich, Wolfram, Pearnchob, Nantharat
Автори російськоюШнайдер Петер, Айзенрайх Вольфрам, Пернчоб Нантарат
МПК / Мітки
МПК: A61K 9/20, A61K 31/155, A61K 31/351, A61P 3/10
Мітки: тверда, дозована, форма, фармацевтична
Код посилання
<a href="https://ua.patents.su/54-106634-tverda-farmacevtichna-dozovana-forma.html" target="_blank" rel="follow" title="База патентів України">Тверда фармацевтична дозована форма</a>
Попередній патент: Установка для термічного обеззаражування зерна
Наступний патент: Спосіб виготовлення обідка мундштука сигарети
Випадковий патент: Клапан компресора