Конденсовані гетероциклічні похідні як модулятори s1p
Номер патенту: 113719
Опубліковано: 10.03.2017
Автори: Смід Пітер, Коолен Гейн К.А.К., Івема Баккер Воутер І., ван Донген Марія Й.П., Слідрегт Леонардус А.Й.М., Ден Хартог Якобус А.Й.
Формула / Реферат
1. Конденсоване гетероциклічне похідне формули (І)
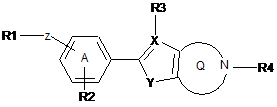 , (I)
, (I)
де формула (І) вибрана з-поміж формул А, В, С, D та Е:
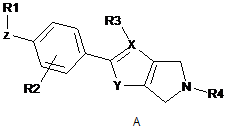 ,
, 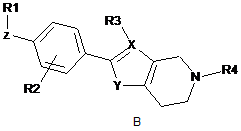 ,
,
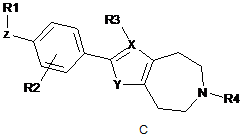 ,
, 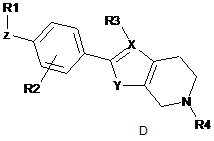 ,
,
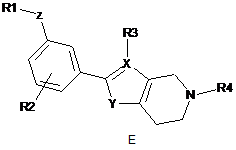 ,
,
де
R1 вибраний з-поміж ціано,
(2-4С)алкенілу, (2-4С)алкінілу, (1-4С)алкілу, кожний за бажанням заміщений CN або одним або більше атомами фтору,
(3-6С)циклоалкілу, (4-6С)циклоалкенілу або (8-10С)біциклічної групи, кожний за бажанням заміщений галогеном або (1-4С)алкілом, за бажанням заміщеним одним або більше атомами фтору,
фенілу, біфенілу, нафтилу, кожний за бажанням заміщений одним або більше замісниками, незалежно вибраними з-поміж галогену, ціано,
(1-4С)алкілу, за бажанням заміщеного одним або більше атомами фтору, (1-4С)алкокси, за бажанням заміщеного одним або більше атомами фтору, аміно, диметиламіно, й (3-6С)циклоалкілу, за бажанням заміщеного фенілом, який може бути заміщений (1-4С)алкілом або галогеном, та
фенілу, заміщеного фенокси, бензилом, бензилокси, фенілетилом або моноциклічним гетероциклом, кожний за бажанням заміщений (1-4С)алкілом,
Ζ - це група зв'язку -W-(Сn-алкілен)-Т-, де
W приєднаний до R1 й вибраний з-поміж зв'язку, -О-, -CO-, -S-, -SO-, -SO2-, -NH-, -СН=СН-, -С(СF3)=СН-, -СºС-, -СH2-О-, -CO-NH-, -NH-CO- й транс-циклопропілену; n - це ціле від 0 до 10; й
Τ приєднаний до феніленової частки й вибраний з-поміж зв'язку, -О-, -S-, -SO-, -SO2-, -NH-, -CO-, -СН=СН-, -СºС- й транс-циклопропілену; R2 - це Η або один або більше замісників, незалежно вибраних з-поміж ціано, галогену, (1-4С)алкілу, за бажанням заміщеного одним або більше атомами галогену, або (1-4С)алкокси, за бажанням заміщеного одним або більше атомами галогену;
X вибраний з-поміж С або Ν; якщо X - це С, R3 вибраний з-поміж Η й (1-4С)алкілу, інакше R3 не присутній; Υ вибраний з-поміж ΝΗ, О та S; та
R4 - це (1-4С)алкілен-R5, де один або більше атомів вуглецю у алкіленовій групі можуть незалежно бути заміщені одним або більше атомами галогену або (СH2)2, утворюючи циклопропілові частки, або R4 - це (3-6С)циклоалкілен-R5, -СH2-(3-6С)циклоалкілен-R5, (3-6С)циклоалкілен-СH2-R5 або -CO-CH2-R5, де R5 - це -ОН, -РО3Н2, -ОРО3Н2, -СООН, -СОО(1-4С)алкіл або тетразол-5-іл;
або його фармацевтично прийнятна сіль, сольват або гідрат або один або більше їх N-оксидів.
2. Сполука за пунктом 1, де
R1 вибраний з-поміж
(3-6С)циклоалкілу або (8-10С)біциклічної групи, за бажанням заміщений галогеном, (1-4С)алкілом, та
фенілу, за бажанням заміщеного одним або більше замісниками, незалежно вибраними з-поміж галогену, ціано, (1-4С)алкілу, (1-4С)алкокси, трифторметилу й трифторметокси;
W вибраний з-поміж зв'язку, -О-, -CO-, -S-, -SO-, -SO2-, -NH-, -СН=СН-, -СºС- й транс-циклопропілену; та
n - це ціле від 0 до 4; та
R2 - це Η або один або більше замісників, незалежно вибраних з-поміж галогену, (1-4С)алкілу, за бажанням заміщеного одним або більше атомами фтору або (1-4С)алкокси, за бажанням заміщеного одним або більше атомами фтору.
3. Сполука за будь-яким з пунктів 1 або 2, де сполука має структуру (Іb)
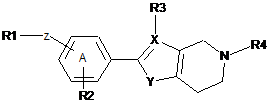 (Ib).
(Ib).
4. Сполука за будь-яким з пунктів 1-3, де Υ - це О.
5. Сполука за будь-яким з пунктів 1-4, де R4 вибраний з-поміж -(СH2)2-СООН, -(СН2)3-СООН, -СH2-СНСН3-СООН, -СН2-С(СН3)2-СООН, -СНСН3-СH2-СООН, -СH2-СF2-COOH й 1,3-циклобутилен-СООН.
6. Сполука за будь-яким з пунктів 1-5, де R1 - це за бажанням заміщений феніл.
7. Сполука за пунктом 6, де вибіркові замісники - це один або більше замісників, незалежно вибраних з-поміж галогену, ціано, (1-4С)алкілу, (1-4С)алкокси, трифторметилу й трифторметокси.
8. Сполука за будь-яким з пунктів 1-7, де Z - це -СH2О-.
9. Сполука за будь-яким з пунктів 1-8, де X - це N.
10. Сполука за пунктом 1, вибрана з-поміж
3-{2-[4-(2-фторбензилокси)-феніл]-6,7-дигідро-4Н-фуро[3,2-с]піридин-5-іл}-пропіонової кислоти,
3-{2-[4-(4-хлорбензилокси)-феніл]-6,7-дигідро-4Н-фуро[3,2-с]піридин-5-іл}-2-метилпропіонової кислоти,
3-{2-[4-бензилоксифеніл]-6,7-дигідро-4Н-фуро[3,2-с]піридин-5-іл}-масляної кислоти,
4-{2-[4-(2-фторбензилокси)-феніл]-6,7-дигідро-4Н-фуро[3,2-с]піридин-5-іл}-масляної кислоти,
4-{2-[4-(2-фторбензилокси)-2-фторфеніл]-6,7-дигідро-4Н-фуро[3,2-с]піридин-5-іл}-масляної кислоти,
3-{2-[4-(бензилокси)-феніл]-6,7-дигідро-Н-оксазоло[4,5-с]піридин-5-іл}-пропіонової кислоти,
4-{2-[4-(2,3-дифторбензилокси)-феніл]-6,7-дигідро-Н-оксазоло[4,5-с]піридин-5-іл}-масляної кислоти,
4-{2-[4-бензилоксифеніл]-6,7-дигідро-Н-оксазоло[4,5-с]піридин-5-іл}-масляної кислоти,
4-{2-[4-(4-трифторметилбензилокси)-2-фторфеніл]-6,7-дигідро-Н-оксазоло[4,5-с]піридин-5-іл}-масляної кислоти,
4-{2-[4-(2-фторбензилокси)-2-метилфеніл]-6,7-дигідро-Н-оксазоло[4,5-с]піридин-5-іл}-масляної кислоти,
4-{2-[4-(3,4-дихлорбензилокси)-2-фторфеніл]-6,7-дигідро-Н-оксазоло[4,5-с]піридин-5-іл}-масляної кислоти,
4-{2-[4-(2-фторбензилокси)-3-хлорфеніл]-6,7-дигідро-Н-оксазоло[4,5-с]піридин-5-іл}-масляної кислоти,
4-{2-[4-(4-хлорбензилокси)-3-фторфеніл]-6,7-дигідро-Н-оксазоло[4,5-с]піридин-5-іл}-масляної кислоти,
3-[2-(4-бензилоксифеніл)-6,7-дигідро-Н-оксазоло[4,5-с]піридин-5-іл]-2-метилпропіонової кислоти,
3-{2-[4-(4-трифторметилбензилокси)-феніл]-6,7-дигідро-Н-оксазоло[4,5-с]піридин-5-іл}-2-метилпропіонової кислоти,
3-{2-[4-(4-хлорбензилокси)-феніл]-6,7-дигідро-Н-оксазоло[4,5-с]піридин-5-іл}-2-метилпропіонової кислоти,
3-{2-[4-(2,3-дифторбензилокси)-феніл]-6,7-дигідро-Н-оксазоло[4,5-с]піридин-5-іл}-масляної кислоти,
3-{2-[4-(4-трифторметилбензилокси)-2-фторфеніл]-6,7-дигідро-Н-оксазоло[4,5-с]піридин-5-іл}-2-метилпропіонової кислоти,
цис- й транс-3-{2-[4-(4-трифторметоксибензилокси)-феніл]-6,7-дигідро-Н-оксазоло[4,5-с]піридин-5-іл}-циклобутанкарбоксильної кислоти,
цис- й транс-3-{2-[4-(3,4-дифторбензилокси)-феніл]-6,7-дигідро-Н-оксазоло[4,5-с]піридин-5-іл}-циклобутанкарбоксильної кислоти,
3-[2-(4-(2-фторбензилокси)-феніл)-6,7-дигідро-4Н-тіазол[5,4-с]піридин-5-іл]-пропіонової кислоти,
4-{2-[4-(3,5-дифторбензилокси)-феніл]-6,7-дигідро-4Н-тіазол-[4,5с]-піридин-5-іл}-масляної кислоти,
2-{2-[4-(3,5-дифторбензилокси)-феніл]-6,7-дигідро-Н-оксазоло[4,5-с]піридин-5-іл}-оцтової кислоти,
2-{2-[4-(3,5-дифторбензилокси)-феніл]-6,7-дигідро-Н-оксазоло[4,5-с]піридин-5-іл}-пропіонової кислоти,
3-{2-[4-(3,5-дифторбензилокси)-феніл]-6,7-дигідро-4Н-оксазоло[4,5-с]-піридин-5-іл}-циклопентанкарбоксильної кислоти,
4-{2-[4-(2,3-дифторбензилокси)-2-метилфеніл]-6,7-дигідро-4Н-оксазоло-[4,5с]-піридин-5-іл}-пентанової кислоти,
4-{2-[4-(2,3-дифторбензилокси)-2-метилфеніл]-6,7-дигідро-4Н-оксазоло[4,5-с]-піридин-5-іл}-2-метилмасляної кислоти,
4-{2-[4-(2,3-дифторбензилокси)-2-метилфеніл]-6,7-дигідро-4Н-оксазоло-[4,5с]-піридин-5-іл}-3-метилмасляної кислоти,
3-{2-[4-(2-фенілциклопропіл)-3-фторфеніл]-6,7-дигідро-4Н-оксазоло-[4,5-с]-піридин-5-іл}-циклобутанкарбоксильної кислоти,
4-(2-{4-[2-(3,5-дифторфеніл)-вініл]-феніл}-6,7-дигідро-4Н-оксазоло-[4,5с]-піридин-5-іл)-масляної кислоти,
4-(2-{4-[2-(3,5-дифторфеніл)-етил]-феніл}-6,7-дигідро-4Н-оксазоло[4,5с]піридин-5-іл)-масляної кислоти
або їх фармацевтично прийнятних солей, сольватів або гідратів або їх одного або більше N-оксидів.
11. Сполука формули
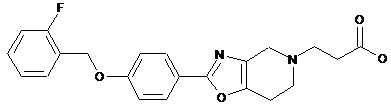
або її фармацевтично прийнятна сіль.
12. Сполука формули
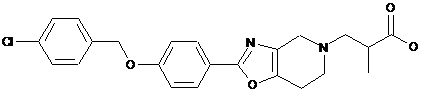
або її фармацевтично прийнятна сіль.
13. Сполука формули
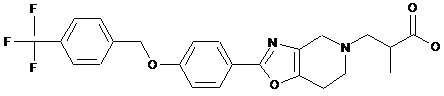
або її фармацевтично прийнятна сіль.
14. Сполука формули

або її фармацевтично прийнятна сіль.
15. Сполука формули

або її фармацевтично прийнятна сіль.
16. Сполука формули
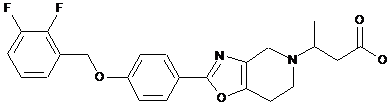
або її фармацевтично прийнятна сіль.
17. Сполука формули

або її фармацевтично прийнятна сіль.
18. Сполука формули

або її фармацевтично прийнятна сіль.
19. Сполука за будь-яким з пунктів 1-18 для застосування у терапії.
20. Сполука за будь-яким з пунктів 1-18 для застосування у лікуванні, полегшенні або запобіганні хворобам й станам, при яких задіяний будь-який рецептор S1P або при яких задіяна модуляція ендогенної сигнальної системи S1P через будь-який S1P-рецептор.
21. Сполука за пунктом 20, де хвороба - це розлади центральної нервової системи, як-от нейродегенеративні розлади, зокрема, вибрані з-поміж когнітивних розладів, хвороби Альцгеймера, (васкулярної) деменції, хвороби Ньюмена-Піка, й когнітивні дефіцити при шизофренії, нав'язлива поведінка, глибока депресія, аутизм, множинний склероз й біль, й, зокрема, когнітивні розлади, як-от пов'язане з віком зниження пізнавальної функції.
22. Фармацевтична композиція, що містить сполуку за будь-яким з пунктів 1-18 та принаймні одну фармацевтично прийнятну допоміжну речовину.
23. Застосування сполук за будь-яким з пунктів 1-18 для виготовлення медикаменту для лікування, полегшення або запобігання хворобам й станам, при яких задіяний будь-який рецептор S1P або при яких задіяна модуляція ендогенної сигнальної системи S1P через будь-який рецептор S1P.
24. Застосування за пунктом 23, де хвороба - це розлади центральної нервової системи, як-от нейродегенеративні розлади, зокрема, вибрані з-поміж когнітивних розладів, хвороби Альцгеймера, (васкулярної) деменції, хвороби Ньюмена-Піка, й когнітивні дефіцити при шизофренії, нав'язлива поведінка, глибока депресія, аутизм, множинний склероз й біль, й, зокрема, когнітивні розлади, як-от пов'язане з віком зниження пізнавальної функції.
Текст
Реферат: Даний винахід стосується конденсованого гетероциклічного похідного формули (І) UA 113719 C2 (12) UA 113719 C2 R3 R1 z X A Q N R4 Y R2 , (I) де R1 вибраний з-поміж ціано, (2-4С)алкенілу, (2-4С)алкінілу, (1-4С)алкілу, кожний за бажанням заміщений CN або одним або більше атомами фтору, (3-6С)циклоалкілу, (4-6С)циклоалкенілу або (8-10С)біциклічної групи, кожний за бажанням заміщений галогеном або (1-4С)алкілом, за бажанням заміщеним одним або більше атомами фтору, фенілу, біфенілу, нафтилу, кожний за бажанням заміщений одним або більше замісниками, незалежно вибраними з-поміж галогену, ціано, (1-4С)алкілу, за бажанням заміщеного одним або більше атомами фтору, (1-4С)алкокси, за бажанням заміщеного одним або більше атомами фтору, аміно, диметиламіно, й (3-6С)циклоалкілу, за бажанням заміщеного фенілом, який може бути заміщений (1-4С)алкілом або галогеном, та фенілу, заміщеного фенокси, бензилом, бензилокси, фенілетилом або моноциклічним гетероциклом, кожний за бажанням заміщений (1-4С)алкілом, Ζ - це група зв'язку, -W-(Сn-алкілен)-Т-, де W приєднаний до R1 й вибраний з-поміж зв'язку, -О-, -CO-, -S-, -SO-, -SO2-, -NH-, -CH=CH-, C(CF3)=CH-, -CC-, -CH2-O-, -O-CO-, -CO-O-, -CO-NH-, -NH-CO- й транс-циклопропілену; n - це ціле від 0 до 10; й Τ приєднаний до фенілен/піридилової частки й вибраний з-поміж зв'язку, -О-, -S-, -SO-, -SO2-, NH-, -CO-, -С=С-, -СС- й транс-циклопропілену; R2 - це Н або один або більше замісників, незалежно вибраних з-поміж ціано, галогену, (14С)алкілу, за бажанням заміщеного одним або більше атомами галогену, або (1-4С)алкокси, за бажанням заміщеного одним або більше атомами галогену; кільцева структура А може містити один атом азоту; X вибраний з-поміж С або Ν; якщо X - це С, R3 вибраний з-поміж Η й (1-4С)алкілу, інакше R3 не присутній; Υ вибраний з-поміж ΝΗ, О й S; структура Q - це 5-, 6- або 7- членний циклічний амін; та R4 - це (1-4С)алкілен-R5, де один або більше атомів вуглецю у алкіленовій групі можуть незалежно бути заміщені одним або більше атомами галогену або (СН2)2, утворюючи циклопропілові частки, або R4 - це (3-6С)циклоалкілен-R5, -СН2-(3-6С)циклоалкілен-R5, (3-6С)циклоалкілен-СН2-R5 або -CO-CH2-R5, де R5 - це -ОН, -РО3H2, -ОРО3Н2, -СООН, -СОО(14С)алкіл або тетразол-5-іл; або його фармацевтично прийнятної солі, сольвату або гідрату або їх одного або більше Nоксидів. Сполуки за винаходом мають спорідненість до рецепторів S1P й можуть бути застосовані при лікуванні, полегшенні або запобіганні хворобам й станам, при яких (будь-який) S1P-рецептор(и) задіяний(і) або при яких задіяна модуляція ендогенної сигнальної системи S1P через будь-який рецептор S1P. R3 R1 z X A Y R2 Q N R4 UA 113719 C2 5 10 15 20 25 30 35 40 Галузь техніки Винахід стосується нових конденсованих гетероциклічних похідних, що мають спорідненість до рецепторів S1P, фармацевтичних композицій, що містять зазначені сполуки, а також застосування зазначених сполук для приготування медикаменту для лікування, полегшення або запобігання захворювань та станів, при яких будь-який задіяний рецептор S1P або при яких задіяна модуляція ендогенної S1P сигнальної системи через рецептор S1P. Передумови створення винаходу Сфінгозин-1-фосфат (S1P) – це біоактивний сфінголіпід, який опосередує широкий ряд клітинних відгуків, як от проліферація, організація цитоскелету та міграція, збирання прилипання та щільного контакту, та морфогенез. S1P можуть зв'язуватися з членами сімейства генів діференцуючої ендотеліальної клітини (EDG рецептори) плазми локалізованих в мембранах G протеїн зв'язаних рецепторів. На сьогоднішній день, п'ять членів цього сімейства ідентифіковані як рецептори S1P у різних типах клітин, S1P1 (EDG-1), S1P2 (EDG-5), S1P3 (EDG-3), S1P4 (EDG-6) й S1P5 (EDG-8). S1P можуть викликати цитоскелетні реаранжування у багатьох типах клітин, щоб регулювати направлену міграцію імунних клітин, васкулярний гомеостаз та клітинний зв'язок у центральній нервовій системі (ЦНС) та у системі периферійних органів. Відомо, що S1P секретується судинним ендотелієм та є присутній у крові у концентрації 200900 наномоль та зв'язується альбуміном та іншими протеїнами плазми. Це забезпечує стабільне сховище у зовнішньо клітинних рідинах та ефективну доставку до високо-споріднених рецепторів клітинної поверхні. S1P зв'язується із низькою наномолярною спорідненістю з п'ятьма рецепторами S1P1-5. Додатково, тромбоцити також містять S1P та можуть бути локально вивільнені, спричиняючи, наприклад, ангіоспазм. Підтипи рецепторів S1P1, S1P2 та S1P3 широко експресуються та представляють домінантні рецептори у серцево-судиній системі. Далі, S1P1 – це також рецептор до лімфоцитів. Рецептори S1P4 майже винятково знаходяться у кровотвірній та лімфоїдній системах. S1P5 переважно (але не винятково) експресуються у центральній нервовій системі. Експресія S1P5 вважається обмеженою до олігодендрогліоцитів у мишей, мієлінізуючі клітини мозку, тоді як у щурів та людей виявлена експресія на рівні астроцитів та ендотеоліальних клітин, але не на рівні олігодендроцитів. Модулятори рецепторів S1P - це сполуки які сигналізують як (атн)агоністи одного або більше рецепторів S1P. Даний винахід стосується модуляторів рецепторів S1P5, зокрема агоністів, та переважно агоністів з селективністю щодо рецепторів S1P1 та/або S1P3, з точки зору небажаного серцево-судинного та/або імуномодулюючого ефектів. Встановлено, що S1P5 агоністи можуть застосовуватися у лікуванні когнітивних розладів, зокрема при старечому зниженню когнітивних функцій. Хоча дослідженя по розробці терапевтичного засобу, який може бути застосований для лікування старечого зниження когнітивних функцій та деменції продовжуються, успішних результатів досі не всановлено. Тому, є необхідність у новому терапевтичному засобі з бажаними властивостями. Опис винаходу Встановлено, що конденсовані гетероциклічні похідні формули (I) Конденсоване гетероциклічне похідне формули (I) R3 R1 z X A Y Q N R4 R2 45 50 (I) де R1 обраний з-поміж ціано, (2-4C)алкеніл, (2-4C)алкініл, (1-4C)алкіл, кожний за бажанням заміщений CN або одним або більше атомів фтору, (3-6C)циклоалкіл, (4-6C)циклоалкеніл або (8-10C)біциклічна група, кожний за бажанням заміщений галогеном або (1-4C)алкілом, за бажанням заміщеним одним або більше атомів фтору, феніл, біфеніл, нафтил, кожний за бажанням заміщений одним або більше замісників незалежно обраних з-поміж галогену, ціано, (1-4C)алкілу, за бажанням заміщеного одним або 1 UA 113719 C2 5 10 15 20 25 30 35 40 45 50 55 більше атомів фтору, (1-4C)алкокси, за бажанням заміщеного одним або більше атомів фтору, аміно, диметиламіно, та (3-6C)циклоалкілу, за бажанням заміщеного фенілом, який може бути заміщений (1-4C)алкілом або галогеном, та феніл, заміщений фенокси, бензил, бензилокси, фенілетилом або моноциклічним гетероциклом, кожний за бажанням заміщений (1-4C)алкілом, Z – це зв'язуюча група –W-(Cn-алкілен)-T- де W приєднаний до R1 та обраний з-поміж зв'язку, -O-, -CO-, -S-, -SO-, -SO2-, -NH-, -CH=CH-, C(CF3)=CH-, -C≡C-, -CH2-O-, -O-CO-, -CO-O-, -CO-NH-, -NH-CO- та транс-циклопропилену; n - це ціле від 0 lj 10; та T приєднаний до фенілен/піридилової частки й обраний з-поміж зв'язку, -O-, -S-, -SO-, -SO2-, -NH-, -CO-, -C=C-, -C≡C-, та транс-циклопропилену; R2 - це H або один або більше замісників, незалежно обраних з-поміж ціано, галогену, (1-4C)алкілу, за бажанням заміщеного одним або більше атомів галогену, або (1-4C)алкокси, за бажанням заміщеного одним або більше атомів галогену; кільцева структура A може містити один атом азоту; X обраний з-поміж C або N; якщо X - це C, R3 обраний з-поміж H та (1-4C)алкіл, інакше R3 не присутній; Y обраний з-поміж NH, O та S; структура Q - це 5-, 6- або 7- членний циклічний амін; та R4 - це (1-4C)алкілен-R5, де один або більше атомів вуглецю у алкіленовій групі може незалежно бути заміщений одним або більше атомів галогену або (CH 2)2 утворюючи циклопропильну частки, або R4 - це (3-6C)циклоалкілен-R5, -CH2-(3-6C)циклоалкілен-R5, (3-6C)циклоалкілен-CH2-R5 або -CO-CH2-R5, де R5 - це -OH, -PO3H2, -OPO3H2, -COOH, -COO(14C)алкіл або тетразол-5-іл; або її фармацевтично прийнятна сіль, сольват або гідрат або один або більше її N-оксидів виявляють спорідненість до рецепторів S1P. Зокрема, сполуки за винаходом виявляють вибіркову спорідненість до рецептора S1P5 перед рецептор(ами) S1P1 та/або S1P3. У WO 2008/012010, деякі із описаних сполук мають невелику структурну схожість зі сполуками за даним винаходом; але, вони описані як ліганди H3-рецепторів гістаміну. Сполуки за винаходом є модуляторами рецепторів S1P, зокрема, рецепторів S1P5. Точніше, сполуки за винаходом - це агоністи рецепторів S1P5. Сполуки за винаходом є корисними для лікування, полегшення або запобігання захворювань та станів, при яких будь-який задіяний рецептор(и) S1P, зокрема, S1P5, або при яких задіяна модуляція ендогенної сигнальної системи S1P через будь-який рецептор S1P. Зокрема, сполуки за даним винаходом можуть бути застосовані для лікування, полегшення або запобігання розладів ЦНС (центральної нервової системи), таких як нейродегенеративні розлади, зокрема -але не обмежуючись- когнітивні розлади (зокрема пов'язане з віком зниження когнітивної функції) та пов'язані стани, хвороба Альцгеймера, (васкулярна) деменція, хвороба Ньюмана-Піка, та когнітивні дефіцити при шизофренії, нав'язлива поведінка, глибока депресія та аутизм, множинний склероз, біль, тощо. Переважно, сполуки за даним винаходом можуть бути застосовані для лікування, полегшення або запобігання когнітивних розладів (зокрема пов'язані з віком зниження когнітивної функції) та пов'язані стани. У переважному варіанті за винаходом, сполуки мають формулу (I) де R1 обраний з-поміж (3-6C)циклоалкілу або (8-10C)біциклічної групи, за бажанням заміщеної галогеном, (14C)алкілу, та Фенілу, за бажанням заміщеного одним або більше замісників, незалежно обраних з-поміж галогену, ціано, (1-4C)алкілу, (1-4C)алкокси, трифторметил та трифторметокси; W обраний з-поміж зв'язку, -O-, -CO-, -S-, -SO-, -SO2-, -NH-, -CH=CH-, -C≡C-, та трансциклопропилену; та n - це ціле від 0 до 4; і переважно, n обраний з-поміж 0, 1 та 2; а R2 - це H або один або більше замісників, незалежно обраних з-поміж галогену, (1-4C)алкілу, за бажанням заміщеного одним або більше атомів фтору або (1-4C)алкокси, за бажанням заміщеного одним або більше атомів фтору; та де визначення інших груп / символів є як визначено раніше. У іншому варіанті, сполука за винаходом має структуру (Ia) 2 UA 113719 C2 R3 X R1 z Y Q N R4 R2 (Ia). У варіанті за винаходом, кільцева структура Q - це 6-членне кільце. Зокрема, сполука за винаходом має структуру (Ib) R3 R1 z X A N R4 Y R2 5 (Ib). У подальшому варіанті за винаходом, R4 обраний з-поміж -(CH2)2-OH, -CH2-COOH, -(CH2)2COOH, -(CH2)3-COOH, -CH2-CHCH3-COOH, -CH2-C(CH3)2-COOH, -CHCH3-CH2-COOH, COOH 10 15 20 25 30 35 40 -CH2-CF2-COOH, -CO-CH2-COOH, , 1,3-циклобутилен-COOH, -(CH2)2-PO3H2, (CH2)3-PO3H2, -(CH2)2-OPO3H2, -(CH2)3-OPO3H2, -CH2-тетразол-5-іл, -(CH2)2-тетразол-5-іл та -(CH2)3-тетразол-5-іл. Переважні групи R4 обрані з-поміж -(CH2)2-COOH, -(CH2)3-COOH, -CH2-CHCH3-COOH, -CH2-C(CH3)2-COOH, -CHCH3-CH2-COOH, -CH2-CF2-COOH. Більш переважними -(CH2)2-COOH, -CHCH3-CH2-COOH, -CH2-CHCH3-COOH та 1,3-циклобутиленCOOH. Зокрема переважною є -CH2-CHCH3-COOH. У іншому переважному варіанті, сполуки мають формулу (I) де Y - це O. Далі, у переважному варіанті за винаходом, X - це N. У переважних варіантах за винаходом, R1 - це інданіл, за бажанням заміщений галогеном, (1-4C)алкіл, або – більш переважно- R1 за бажанням заміщений фенілом, де вибіркові замісники обрані з-поміж будь-яких із раніше визначених замісників, але зокрема вибіркові замісники - це один або більше замісників, незалежно обраних з-поміж галогену, ціано, (1-4C)алкілу, (1-4C)алкокси, трифторметилу та трифторметокси. У високо переважних варіантах, R1 - це 4Cl-феніл або 4CF3-феніл. У варіанті за винаходом, R2 - це H або один або більше замісників, незалежно обраних зпоміж метилу, метокси, хлору або фтору. У переважному варіанті, R2 - це H або R2 представляє один метил, один метокси, один хлор, один хлор, або один або два атоми фтору. У варіантах за винаходом, де X - це CR3, R3 - це переважно H або метил та зокрема, R3 - це H. Далі, у варіанті за винаходом, Z - це зв'язуюча група -W-(CH2)n-T-, значення якої обрані зпоміж зв'язку, -O-, -CO-, -S-, -SO2-, -NH-, -CH2-, -(CH2)2-, -CCH3-O-, -CH=CH-, -C≡C-, -CH2-O-, -OCH2-, -CH2-S-, -S-CH2-, -CH2-SO2-, -SO2-CH2-, -CH2-NH-, -NH-CH2-, та транс-циклопропилену. У переважних варіантах, Z - це -O-, -CH2-O- або транс-циклопропилен. Зокрема, Z - це -CH2-O-. Термін галоген стосується фтору, хлору, брому, або йоду. Переважні галогени - це фтор та хлор, і зокрема хлор. Термін (1-4C)алкіл означає розгалужену або нерозгалужену алкільну групу, що має 1-4 атоми вуглецю, наприклад, метил, етил, пропил, ізопропил та бутил. Переважна алкільна група - це метил. Термін (1-4C)алкокси означає алкокси групу, що має 1-4 атоми вуглецю, де алкілові частки є як визначено вище. Переважна алкокси група - це метокси. Терміни (1-4C)алкілен та (Cn-алкілен) означають розгалужену або нерозгалужену алкіленову групу, що має 1-4 або n атомів вуглецю, відповідно, наприклад метилен, -CHCH3-, -C(CH3)2-, -CHCH3CH2-, і тому подібні. У визначенні R4, який є (1-4C)алкілен-R5, один або більше атомів вуглецю у алкіленовій групі може (серед інших) незалежно бути заміщений (CH 2)2 утворюючи R5 циклопропилову частку, означаючи утворення групи R4 як от 3 . UA 113719 C2 5 10 15 20 25 30 35 40 45 50 55 Термін (2-4C)алкініл означає розгалужену або нерозгалужену алкінільну групу, що має 2-4 атоми вуглецю, де потрійний зв'язок може бути присутнім у різних положеннях у групі, наприклад етиніл, пропаргіл, 1-бутиніл, 2-бутиніл, тощо Термін (3-6C)циклоалкіл означає циклічну алкільну групу, що має 3-6 атоми вуглецю, як от циклопропил, циклобутил, циклопентил або циклогексил. Переважними є циклопентил та циклогексил. Термін (4-6C)циклоалкеніл означає циклічну алкенільну групу, що має 4-6 атоми вуглецю та містить один або два подвійні зв'язки, наприклад циклогексеніл. Термін (3-6C)циклоалкілен означає циклічну алкільну групу, що має дві точки приєднання. Переважний - це 1,3-циклобутилен, що має структуру . Термін (8-10C)біциклічна група означає конденсовану кільцеву систему із двох груп, обраних з-поміж ароматичної та не-ароматичної кільцевих структур, що має разом 8-10 атоми вуглецю, наприклад інданова група. З посиланням на замісники, термін "незалежно" означає, що замісники можуть бути однакові або різні від кожного іншого у тій самій молекулі. Сполуки за винаходом можуть бути зручно одержані за допомогою способів, доступних з рівня техніки, та проілюстровані у експериментальній частині цього опису. Сполуки за даним винаходом можуть містити один або більше центрів асиметрії та можуть таким чином виступати як рацемати та рацемічні суміші, одиничні енантіомери, діастереомерні суміші та індивідуальні діастереомери. Додаткові центри асиметрії можуть бути присутніми в залежності від природи різних замісників у молекулі. Кожний такий асиметричний центр буде незалежно виробляти два оптичні ізомери та вважається, що усі можливі оптичні ізомери та діастереомери у суміші, і як чисті або частково очищені сполуки, включені в обсяг даного винаходу. Даний винахід охоплює усі такі ізомерні форми цих сполук. Незалежний синтез цих діастереомерів або їх хроматографічне розділення може можуть бути виконані відомими з рівня техніки відповідними модифікаціями описаної тут методології. Їх абсолютна стереохімія може бути визначена рентгенівською кристалографією кристалічних продуктів або кристалічних проміжних, які деривують, за необхідності, з реагентом, що містить асиметричний центр відомої абсолютної конфігурації. За бажанням, рацемічні суміші сполук можуть бути розділені таким чином, що індивідуальні енантіомери виділяються. Це розділення може бути виконане за допомогою способів, відомих з рівня техніки, як от сполучення рацемічної суміші сполук з енантіомерно чистою сполукою, утворюючи діастереомерну суміш, з подальшим розділенням індивідуальних діастереомерів стандартними методами, як от фракціональна кристалізація або хроматографія. Сполуки можуть існувати як поліморфи і, як такі, вважаються включеними до обсягу даного винаходу. Додатково, сполуки можуть утворювати сольвати з водою (тобто, гідрати) або звичайними органічними розчинниками, і такі сольвати також вважаються включеними до обсягу даного винаходу. Маркована ізотопами сполука формули (I) або їх фармацевтично прийнятні солі, включаючи марковані ізотопами сполуки формули (I), які визначаються PET або SPECT, також входять у 13 14 3 обсяг даного винаходу. Це ж саме стосується сполук формули (I), маркованих [ C]-, [ C]-, [ H]-, 18 125 [ F]-, [ I]- або іншими ізотопічно збагаченими атомами, придатними для зв'язування рецепторів або досліджень метаболізму. Термін "фармацевтично прийнятна сіль" стосується таких солей, які, з точки зору здорового медичного глузду, придатні для застосування у контакті із тканинами людини та нижчих тварин без небажаної токсичності, подразнення, алергічної реакції, і тому подібних, та мають з розумне співвідношення вигода/ризик. Фармацевтично прийнятні солі відомі з рівня техніки. Вони можуть бути одержані in situ при виділенні та очищенні сполук за винаходом, або окремо шляхом їх реакції з фармацевтично прийнятними нетоксичними основами або кислотами, включаючи неорганічні або органічні основи та неорганічні або органічні кислоти. Сполуки за винаходом можуть вводитись ентерально або парентерально. Точна доза та порядок введення цих сполук та їх композицій thereof будуть залежати від біологічної активності сполуки per se, віку, ваги та статі пацієнта, потреби індивідуального суб'єкта, якому застосовують медикамент, ступеню хвороби або потреби та розсуду медичного працівника. Взагалі, парентеральне введення потребує нижчих доз, ніж інші способи введення, які більш залежні від абсорбції. Але, дози для людини є переважно 0.001 – 10 мг на кг ваги тіла. Взагалі, 4 UA 113719 C2 5 10 15 20 25 30 35 40 45 50 55 60 ентеральне та парентеральне введення може бути у інтервалі 0.1 до 1,000 мг у день сумарних активних інргедієнтів. Змішані із фармацевтично придатними допоміжними речовинами, наприклад, як описано у st стандартному посиланні "Remington, The Science and Practice of Pharmacy" (21 edition, Lippincott Williams & Wilkins, 2005, див. зокрема Part 5: Фармацевтична Manufacturing) сполуки можуть бути спресовані у тверді дозувальні одиниці, як от пілюлі або таблетки, або бути упакованими у капсули або супозиторії. За допомогою фармацевтично придатних рідин сполуки можуть також набувати форми розчину, суспензії або емульсії. Для виготовлення дозувальних одиниць, наприклад, таблеток, передбачене застосування звичайних домішок, як от наповнювачі, барвники, полімерні звя'зувачі і тому подібні. Взагалі, можуть бути застосовані будь-які фармацевтично придатні домішкі, які не впливають на функцію активної сполуки. Придатні носії, з якими можуть бути застосовані сполуки за винаходом, включають, наприклад, лактозу, крохмаль, похідні целюлози і тому подібні, або їх суміші, застосовані у придатній кількості. Композиціями для внутрішньовенного введення можуть, наприклад, бути розчини сполуки за винаходому стерільному ізотонічному водному буфері. За необхідності, внутрішньовенні композиції можуть включати, наприклад, солюбілізуючі засоби, стабілізуючі засоби та/або місцеві анестетики для полегшення болю у місці ін'єкції. Фармацевтичні композиції за винаходом можуть утворені будь-яким шляхом та містять при наймні одну сполуку за даним винаходом та її фармацевтично прийнятні солі, з будь-яким фармацевтично придатним інгредієнтом, наповнювачем, носієм, допоміжним засобом або зв'язуючим. Під теміном "фармацевтично придатний" розуміють, що носій, розбавник або наповнювач має бути сумісний з іншими інгредієнтами суміші та не шкідливий для особи, яка його вживає. У варіанті за винаходом, передбачений фармацевтичний комплекс або набір, що містить один або більше контейнерів, наповнених однією або більше фармацевтичних композицій за винаходом. До такого контейнера(ів) можуть бути додані різні письмові матеріали, як от інструкція по застосуванню, або повідомлення у формі, передбаченій державним органом, регулюючим виробництво, застосування або продаж фармацевтичних продуктів, таке повідомлення може відображати погодження органу виробництва, застосування, або продажу для людей або ветеринарного застосування. Якщо не зазначено інше, усі затосовані тут технічні та наукові терміни, мають однакове значення, як звичайно зрозуміло фахівцеві у галузі данного винаходу. Хоча можуть бути застосовані методи та матеріали, подібні або еквівалентні до описаних у практиці або тестуванні даного винаходу, придатні методи та матеріали описані у цьому документі. ОПИС КРЕСЛЕНЬ Фігура 1 Процент чергування молодих та старих самців мишей C57BL/6J у T-лабіринті або з носієм (контрольні групи) або сполукою за винаходом (доза у мг/кг; p.o.) Наступні приклади призначені для більш детального подальшого ілюстрування винаходу. Будь-яке нове проміжне як описано тут, є іще одним варіантом за даним винаходом. ПРИКЛАДИ §1. АНАЛІТИЧНІ МЕТОДИ 1 13 Спектр ядерного магнітного резонансу ( H ЯМР та C ЯМР, APT) визначають у визначеному 1 13 розчинникузастосовуючи Bruker ARX 400 ( H: 400 МГц, C: 100 МГц) при 300 K, якщо не 19 13 зазначено інакше. F ЯМР та C ЯМР експерименти виконують на спектрометрі Varian Inova 1 13 19 500 працюючому при 11.74 T (499.9 МГц при H; 125.7 МГц при C; 50.7 МГц, 470.4 МГц при F) застосовуючи 5 мм SW пробу. Спектр визначають у дейтерованому хлороформі або DCM, одержаному від Cambridge Ізоtope Laboratories Ltd. Хімічні зсуви (δ) наведені у ч. на млн. 1 13 19 починаючи від тетраметилсилану ( H, C) або CCl3F ( F). Константи сполучення J наведені у Гц. Форми піків ЯМР спектру визначені за допомогою символів "q" (квартет), "dq" (подвійний квартет), "t" (триплет), "dt" (подвійний триплет), "d" (дуплет), "dd" (подвійний дуплет), "s" (синглет), "bs" (bs) та "m" (мультиплет). Сигнали NH та OH ідентифікують після змішування зразка із краплиною D2O. Випарювальна хроматографія стосується очищення, застосовуючи зазначений розбавник та силікагель (або Acros: 0.030-0.075 мм, або Merck силікагель 60: 0.040-0.063 мм). Колонкову хроматографію виконують, застосовуючи силікагель 60 (0.063-0.200 мм, Merck). Реакцію контролюють, застосовуючи тонкошарову хроматографію (TLC) на покритих кварцем пластикових листах (Merck покриття з силікагелем 60 F254) із визначеним розбавником. Плями візуалізують за допомогою УФ світла (254 нм) або I2. Точки топлення записують на апараті Büchi B-545 для вимірювання точок топлення. 5 UA 113719 C2 5 Рідинна Хроматографія- масс-спектрографія (LC-MS): - Спосіб A. Система LC-MS містить Waters 1525 µ-помпу. Помпу під'єднують до автовимірювача зразаків Waters 2777. Спосіб LC: етап 0 1 2 3 4 5 10 15 20 25 30 35 40 45 Загальний час 0.2 2.5 2.8 2.9 3.10 3.11 потік (мкл/хвил) 1600 1600 1600 1600 1600 500 A(%) 90 0 0 90 90 90 B(%) 10 100 100 10 10 10 A=100 % вода з 0.2 % HCOOH B=100 % ACN з 0.2 % HCOOH Автовимірювач зразків має 10 мкл петлю впорскування; об'єм ін'єкції складає 10 мкл. Автовимірювач зразків під'єднують до колонки Waters Sunfire C18 30*4.6 мм з 2.5 мкм particles. Колонку термостатують при кімнатній температурі +/- 23 °C Колонку під'єднують до Waters 2996 PDA. Довжину хвилі сканують від 240 до 320 нм. Роздільна здатність 1.2 нм й поглинання зразків 20 Гц. Після PDA потік розділяють 1:1 та під'єднують до Waters 2424 ELSD. ELSD має наступні параметри: Тиск газу: 40 psi Рівень даних 20 пунктів/сек Посилення 500 Константа часу 0.2 сек Режим охолодження нібулайзера Простір відхилення 50 °C Зразки також вимірюють масс-детектором Waters ZQ. Масс-спектрометр має наступні параметри: Дальність сканування: 117-900 А.о.м. Полярність: позитивна Формат даних: центроїд Час скан: 0.500 sec Час інтерскан: 0.05 sec Капілярність 2.5 kV Код 25 V Екстрактор 2 V RF лінза 0.5 V Температура джерела 125 °C Температура десольвації 400 °C Кодування газу 100 L/Hr Розчинення газу 800 L/Hr LM 1 Роздільна здатність 15 HM 1 Роздільна здатність 15 Іонна енергія 0.5 Примножувач 500 V Повну систему контролюють Masslynx 4.1. - Спосіб B. Система LC-MS складається з 2 мікропомп Perkin Elmer серії 200. Помпи під'єднують до кожної іншої за допомогою 50 мкл міксеру. Міксер під'єднують до автовимірювача зразків Gilson 215. Спосіб LC: 6 UA 113719 C2 етап 0 1 2 3 4 5 10 15 20 25 30 35 40 45 50 загальний час 0 1.8 2.6 2.8 3.0 потік (мкл/хвил) 1800 1800 1800 1800 1800 A (%) 95 0 0 95 95 B (%) 5 100 100 5 5 A=100 % вода з 0.1 % HCOOH B=100 % ацетонітрил з 0.1 % HCOOH Автовимірювач зразків має 2 мкл петлю впорскування. Автовимірювач зразків під'єднують до колонки Waters Sunfire C18 4.6 × 30 мм з 2.5 мкм частками. Колонку термостатують у колонковій печі Perkin Elmer серії 200 при 23 °C. Колонку під'єднують до вимірювача Perkin Elmer 785 UV/VIS з чарунками потоку 2.7 мкл. Довжину хвилі встановлюють 254 нм. UV вимірювач під'єднують до масс-спектрометра Sciex API 150EX. Масс-спектрометр має наступні параметри: Діапазон сканування: 100-900 А.о.м. Полярність: позитивна Режим сканування: профіль Роздільна здатність Q1: UNIT Етап size: 0.10 а.о.м. Час на скан: 0.500 sec NEB: 10 CUR: 10 IS: 5200 TEM: 325 DF: 30 FP: 225 EP: 10 Світлорозсіюючий детектор під'єднують до Sciex API 150. Світлорозсіюючий детектор – це 0 Polymer Labs PL-ELS 2100 що працює при 70 C та тиску 1.7 бар N2. Повну систему контролюють комп'ютером Dell preцисion GX370 що працює у Windows 2000. Повідомлений час утримання у Таблиці 1 (Rt) встановлений для піків у Total Ion Current (TIC) + хроматографі, яка виявляє масу [M+H] у розмірі з точністю 0.5 аом обчисленого точного MW та має пов'язані піки на випарювальній світлорозсіюючій (ELS) хроматограмі з відносною площею% (чистота) >85 %. §2. СКОРОЧЕННЯ ACE-Cl 1-Хлоретил хлороформат 9-BBN 9-борабіцикло[3.3.1]нонан димер CHCl3 Хлороформ CH2Cl2 Дихлорметан CH3CN Ацетонітрил CuBr2 бромід міді (II) DBU 1,8-диазабіцикло[5.4.0]ундец-7-ен DIAD диізопропилазодикарбоксилат DIPEA N, N-диізопропилетиламін DMF N, N-диметилформамід DMSO Диметил сульфоксид Et3N Триетиламін Et2O диетил ефір EtOH етанол EtOAc Етил ацетат HCl хлорид водню K2CO3 карбонат калію KHCO3 бікарбонат калію KI йодид калію KOH гідроксид калію KOtBu Карій трет-бутоксид MeOH метанол NaBH4 Натрій борогідрид 7 UA 113719 C2 5 10 15 NaHCO3 Натрій бікарбонат NaI Натрій йодид NaOH Натрій гідроксид NaOtBu Натрій трет-бутоксид Na2SO4 Натрій сульфат NBS N-Бромсукцинімід iPr2O диізопропил ефір RT Кімнатна температура SiO2 Силікагель TFA Трифтороцтова кислота THF тетрагідрофуран TMSCl Хлортриметилсилан TMSOTf Триметилсиліл трифторметансульфонат §3. ЗАГАЛЬНІ АСПЕКТИ СИНТЕЗУ Нижче описуються придатні способи синтезу заявленої сполуки. Ra Ra Rb Rb Tail N N COOH O O 25 30 COOH O O 1 20 Tail N 2 Для синтезу сполуки 1, описано два шляхи у відповідності до Схем 2 та 3. Обидва шляхи починаються зі сполукаи 6, синтез якої описаний у Схемі 1. Альфа алкіляція пірролідин-enаміну 4 з альфа-бром-ацетофенодинами (3) –таким чином вводячи Rb-групу у молекулу- дає сполуку 5. Одночасне зякриття кільця 5 при кислотних умовах дає сполуку 6 у чистому вигляді. Схема 1. Синтез ключового проміжного 6. Шлях A (див. Схема 2) починається з алкіляції піперидинових часток у 6 шляхом або стандартної алкіляції, відновлювальної алкіляції або реакції приєднання Майкла, даючи захищені сполуки карбоксильної кислоти 7. Частки бензилового ефіру можуть бути введені двома способами. По-перше, бром у 7 може бути перетворений безпосередньо у похідне бензил ефіру 9 шляхом реакції каталізації палладію. Додатково, бромід 7 може бути перетворений у похідне фенолу 8 шляхом палладій-опосередуваної реакції. Сполука 8 може бути перетворена у бажані похідні бензил ефіру 9 через стан трансферу фази з бензил бромідами або через реакцію Міцунобу зі спиртами бензилу. У кінці, зі сполук 9 може бути знятий захист, даючи кінцеві продукти 1. Схема 2. Шлях до сполук 1. 8 UA 113719 C2 5 10 15 Альтернативно, Шлях B (див. Схема 3) може бути продовжений для синтезу сполуки 1. Піперидин у сполуці 6 захищений BOC групою. Далі, спочатку частки бензил ефіру вводять або через пряму палладій-опосередувану реакцію брому у 10-12 або через перетворення брому у похідне фенолу 11, який може бути перетворений у 12 при алкіляції або стані Міцунобу. У кінці, сполука 12 може бути перетворена у 9 шляхом кислотного видалення BOC групи та подальше введення захищених хвостів карбоксильної кислоти. Схема 3. Шлях В до сполук 1. Для синтезу похідних оксазолу 2, розроблені три шляхи. Синтез ключового проміжного 20 визначений у Схемі 4. Ациляція комерційно доступної 14 з відповідним чином заміщеним бензоїл хлоридом (15) дає 16, який далі закривають кільце з 17 використовуючи трифенілфосфін та гексахлоретан. Метиляція піридину у 17 у чвертинну сіль 18 та подальше відновлення 18 з борогідридом натрію даючи на виході сполуку 19. Сполуку 19 деметилюють з 1-хлоретил хлороформатом, одержуючи ключове-проміжне 20. Схема 4. Синтез сполук 20. 9 UA 113719 C2 5 10 15 Перший шлях (Шлях C) до сполуки 2 визначений у Схемі 5 та починається від сполуки 20. Шляхом, подібним до описаного, для синтезу сполуки 7 у фуранільних рядах, t-бутил захищені хвости карбоксильної кислоти можуть бути введені у 20, даючи 21. Починаючи з 21, похідні бензил ефіру 23 можуть бути одержані або прямим палладій опосередуваним сполученням (2123) з бензиловими спиртамии або шляхом першого перетворення броміду у 21 на фенол 22 та подальшою бензиляцією 22 (у 23) за умови трансферу фази або реакції Міцунобу. У кінці, кислотне зняття захисту карбоксильної кислоти у 23 дає на виході сполуки 2. Схема 5. Шлях С до сполук 2. Альтернативно, шлях D може бути продовжений як визначено у Схемі 6. Сполуки 25 можуть бути одержані починаючи з 14 та відповідним чином заміщений похідне 4-бензилокси-бензойної кислоти (24) під впливом трифенілфосфіну та трихлорацетонітрилу. Сполука 25 може бути перетворена у бензилокси-похідні 23 способом, подібним до описаного вище у Схемах 4 та 5 для синтезу сполуки 21. таким чином, метиляція 25 та подальше відновлення з NaBH4 дає 26, яке деметилюють з ACE-Cl даючи на виході 27. У кінці, хвости вводять у 27 даючи сполуку 23. Звідси, t-бутильна група у 23 може бути видалена при кислотних умовах даючи сполуку 2. З іншого боку, бензил у 23 може бути видалений шляхом гідрогенізації, даючи похідні фенолу 22. Схема 6. Шлях D до сполук 2. 10 UA 113719 C2 5 Й у кінці, третій шлях (Шлях E) до сполуки 2 визначений у Схемі 7. Сполуку 20 захищають tбутилоксикарбонільною групою, даючи 28, яка може бути перетворена у відповідний фенол (29) при стандартних умовах палладію. Алкіляція 29 за умовах трансферу фази або реакції Міцунобу дає 30. З іншого боку, сполука 30 може також бути одержана безпосередньо із броміду 28 за умовах стану хімії палладію. Кислотне видалення BOC групи у 30 призводить до утворення сполуки 27, яка може бути алкільована у 23 як визначено у Схемі 5. Схема 7. Шлях Е для синтезу сполук 2. 10 11 UA 113719 C2 Схема 8 5 Похідні тіазолу 508 та 520 синтезують як описано у Схемах 8 та 9. Регулювання R-групи у реагентах призводить до введення Ra, Rb та Rc. Схема 9 Шлях синтезу по відношенню до ряду альтернативних хвостів та лінкерів визначений у Схемі 10. 12 UA 113719 C2 Схема 10 5 10 15 Для фахівця очевидно, що вибір певного шляху може бути оснований на доступності реагентів. Додатково, шляхи B, D та E дуже придатні для введення різновидів у Rc-хвостову частину сполук 1 та 2. Шляхи A та C мають введення Ra-Bn часток на останньому етапі синтезу, що робить його більш придатним для дослідження різновидів у цій частині молекули. §4. СИНТЕЗ ПРОМПКНИХ Загальна процедура для синтезу сполуки 5. До розчину t-бутил складного ефіру 4-оксопіперидин-1-карбоксильної кислоти у толуолі (2мл/ммоль) додають каталітичну кількість моно гідрату пара-толуолсульфонової кислоти (0.1екв) та пірролідин (4г). Суміш нагрівають до температури рефлюксу за умовах Діна-Старка 18 годин. Суміш концентрують при зниженому тиску осад знову розчиняють у толуолі. До цього розчину повільно додають (протягом 25 хвилин) розчин відповідним чином заміщеного 2-бром-1-(4-бром-феніл)-етанону (1.05екв) у толуолі/DCM (2мл/ммоль, ½, v/v). Суміш перемішують усю ніч при кімнатній температурі й одержаний білий рідкий розчин виливають у воду. Водний шар екстрагують з DCM (3 години) й поєднані органічні шари висушують (MgSO4) й далі концентрують при зниженому тиску. 13 UA 113719 C2 5 10 15 20 25 30 35 40 45 50 55 60 Одержану олію очищують хроматографією на силікагелі, одержуючи сполуку 5 з виходом 5090 %. Загальна процедура для синтезу сполуки 6. Сполуку 5 суспендують у концентрованій соляній кислоті (10екв, 12N). Суміш нагрівають (по етапах 10 °C на 30 хвилини) до 80 °C. Суміш починає сильно пінитись, таким чином додаючи достатньо об'єму у посудині для вихідної реакції. Після 45 хвилин, суміш охолоджують до 0 °C та нейтралізують з 50 мас. % розчину NaOH (екзотермічний). Після перемішування усю ніч при кімнатній температурі, одержаний твердий матеріал збирають фільтрацією й промивають з 0.1M NaOH. Світло-коричневий матеріал очищують екстракцією Соксхлета у EtOAc одержуючи 6 як бежеву тверду речовину, яку застосовують на наступному етапі без подальшого очищення. Загальна процедура для введення захищених хвостів карбоксильної кислоти (7). a) введення t-бутил складного ефіру пропіонової кислоти. Сполуку 6 суспендують у метанолі (4мл/ммоль) й додають DIPEA (1.05 г). У суміш додають t-бутил акрилат (1.2екв) й суміш нагрівають зі зворотнім холодильником 16 год. Перетворення перевіряють TLC аналіз. Розчинники випарюють й осад знову розчиняють у EtOAc й екстрагують з 5 % розчином NaHCO3.Органічний шар висушують (MgSO4), концентрують у вакуумі й осад очищують колонковою хроматографією на силікагелі, даючи чистий 7a. b) Введення t-бутил складного ефіру 2-метил-пропіонової кислоти. Сполуку 6 суспендують у DMF (6мл/ммоль). До цієї суспензії додають 1,8–диазабіцикло[5.4.0]ундец-7-ен (3г) й t-бутил метакрилат (2екв). Суміш нагрівають при 125 °C 16-100 год. Розчин охолоджують й додають 5 % NaHCO3 (15мл/ммоль) й екстрагують з EtOAc. Органічний шар промивають з водою (4x), сушать на MgSO4, концентрують у вакуумі й осад очищують колонковою хроматографією на силікагелі, даючи чистий 7b. c) Введення t-бутил складного ефіру 3-масляної кислоти. Сполуку 6 суспендують у 1,2дихлоретані (6мл/ммоль). До цієї суспензії додають t-бутилацетоацетат (1екв) й натрій триацетокси борогідрид (1.4екв). Суміш перемішують при кімнатній температурі 16 год. Якщо реакція не завершена, додають іншу порцію t-бутилацетоацетату (1екв) й натрій триацетокси борогідрид (1.4екв). У розчин додають 5 % NaHCO3 (15мл/ммоль) й суміш екстрагують з DCM. Поєднані органічні шари висушують на Na 2SO4, концентрують у вакуумі й осад очищують колонковою хроматографією на силікагелі, одержуючи чистий 7c. d)) Введення t-бутил складного ефіру 4-масляної кислоти. Сполуку 6 суспендують у ацетонітрилі (3мл/ммоль). До цієї суспензії додають карбонат калію (2екв), t-бутил 4-бромбутаноат (1.1екв) й калій йодид (1.1 екв). Суміш перемішують при кімнатній температурі 16год, після цього часу TLC аналіз показує завершену реакцію. Суміш концентрують у вакуумі й осад розчиняють у EtOAc, промивають з 5 % NaHCO3 (15мл/ммоль). Органічний шар висушують на Na2SO4, концентрують у вакуумі й осад очищують колонковою хроматографією на силікагелі, одержуючи на виході 7d. Загальна процедура введення часток бензил ефіру у 7 до сполуки 9. Розчин сполуки 7, відповідним чином заміщений бензиловий спирт (1.1екв), палладій(II) ацетат (0.02екв), 2-дітбутилфосфіно-3,4,5,6-третaметил-2",4",6’-триізопропил-1,1’біфеніл (0.02екв), карбонат цезію (1.5екв) у дегазованому толуолі (4мл/ммоль) нагрівають при 75 °C 16 год. Перетворення перевіряють аналізом TLC. Розчин охолоджують до кімнатної температури, розбавляють з DCM, фільтрують й концентрують у вакуумі. Осад очищують колонковою хроматографією на силікагелі, даючи сполуку 9 з виходом від 30-80 %. Загальна процедура перетворення похідних брому 7 у похідні фенолу 8. Сполука 7 розчиняють у толуолі (8ммл/ммоль) й у розчин додають гідроксид калію (2екв, 11.7N) й розчин дегазують. У розчин додають 2-діт-бутилфосфіно-2",4",6’-триізопропилбіфеніл (0.06екв) й трис(дибензиліденацетон)-дипалладій(0) (0.03екв). Суміш перемішують при 60 °C 1.25год. Суміш дають досягти кімнатної температури, розбавляють з EtOAc й промивають з 5 % NaHCO3 розчин (10мл/ммоль). Органічні шари висушують на MgSO 4, фільтрують й концентрують у вакуумі. Осад очищують колонковою хроматографією на силікагелі, даючи сполуку 8 з виходом від 25-85 %. Загальна процедура перетворення фенолу 8 на ефіри бензилу 9. Спосіб A) Сполуку 8 розчиняють у DCM/вода, 2/1, v/v (4мл/ммоль) й до цього розчину додають натрій гідроксид (2N, 3екв). До цієї суміші додають бромід тетрабутиламонію (0.1екв) й відповідним чином заміщений бензил бромід (1.1екв). Суміш перемішують 16год при кімнатній температурі після цього часу TLC аналіз виявляє завершену реакцію. Суміш розбавляють з DCM (15мл/ммоль), шари розділяють й водний шар екстрагують з DCM. Органічні шари висушують на MgSO4, фільтрують й концентрують у вакуумі. Осад очищують колонковою хроматографією на силікагелі, даючи чисту сполуку 9 з виходом від 80-90 %. 14 UA 113719 C2 5 10 15 20 25 30 35 40 45 50 55 60 Спосіб B) Сполуку 8 розчиняють у N, N’-диметилацетаміді (4мл/ммоль) й до цього розчину додають трифенілфосфін (1.25екв) та диізопропил азодикарбоксилат (1.25екв) й відповідним чином заміщений бензиловий спирт (1.2екв). Суміш перемішують при кімнатній температурі 16год, після цього часу TLC аналіз виявляє завершену реакцію. Суміш розбавляють з диетил ефіром й промивають з водою (3x). Поєднані органічні шари висушують на MgSO 4, фільтрують й концентрують у вакуумі. Осад очищують колонковою хроматографією на силікагелі, даючи сполуку 9 з виходом від 70-90 %. Загальна процедура кислотного зняття захисту сполук 9-1. Сполуку 9 розчиняють у розчині HCl у 1,4-диоксані (4N, 45екв) й суміш перемішують при кімнатній температурі 24 год. Нагрівання при 50 °C застосовують коли необхідно прискорити завершення реакції. Розчинники випарюють й додають диізопропиловий ефір щоб осадити продукт. Білий твердий матеріал фільтрують й сушать у вакуумі даючи сполуку 1 з виходом від 80-100 %. Загальна процедура для синтезу BOC захищених похідних 6. До суспензії сполуки 6 у DCM (6мл/ммоль) додають DIPEA (1екв), диметиламіно піридин (DMAP, 0.05екв) та ди-t-бутил дикарбонат (1.1екв). Суміш перемішують при кімнатній температурі 16год, після цього часу TLC аналіз виявляє завершену реакцію. Реакційну суміш промивають з 5 % ag. розчином NaHCO3 й одержані водні шари екстрагують з DCM. Поєднані органічні шари висушують на MgSO 4, фільтрують й концентрують у вакуумі. Осад очищують колонковою хроматографією на силікагелі, даючи сполуку 10 з виходом від 70-90 %. Загальна процедура для синтезу сполуки 11. Сполуку 10 розчиняють у 1,4-диоксан/вода, 1/1, v/v (2мл/ммоль) й у розчин додають гідроксид калію (4екв, 11.7N) й розчин дегазують. У розчин додають 2-діт-бутилфосфіно-2",4",6’-триізопропилбіфеніл (0.04екв) та трис(дибензиліденацетон)-дипалладій(0) (0.02екв). Суміш перемішують при 80 °C 16год. Суміш охолоджують до кімнатної температури, розбавляють з EtOAc, підкислюють до pH 6 з 0.1N HCl й екстрагують з EtOAc. Органічні шари висушують на MgSO4, фільтрують й концентрують у вакуумі. Осад очищують колонковою хроматографією на силікагелі, даючи чисту сполука 11 з виходом від 60-95 %. Загальна процедура для синтезу похідних бензил ефіру 12. Спосіб A) Сполуку 11 розчиняють у DCM/вода, 2/1, v/v (4мл/ммоль) й до цього розчину додають натрій гідроксид (2N, 3 екв). До цієї суміші додають тетрабутиламоній бромід (0.1екв) й відповідним чином заміщений бензил бромід (1.1екв). Суміш перемішують 16год при кімнатній температурі після цього часу TLC аналіз виявляє завершену реакцію. Суміш розбавляють з DCM (15мл/ммоль), шари розділяють й водний шар екстрагують з DCM. Органічні шари висушують на MgSO4, фільтрують й концентрують у вакуумі. Осад очищують колонковою хроматографією на силікагелі, даючи сполуку 12 з виходом від 80-90 %. Спосіб B) Сполуку 11 розчиняють у N, N’-диметилацетаміды (4мл/ммоль) й до цього розчину додають трифенілфосфін (1.25екв), диізопропил азодикарбоксилат (DIAD, 1.25екв) та відповідним чином заміщений бензиловий спирт (1.2екв). Суміш перемішують 16год при кімнатній температурі після цього часу TLC аналіз виявляє завершену реакцію. Суміш розбавляють з диетил ефіром й промивають з водою (3x). Поєднані органічні шари висушують на MgSO4, фільтрують й концентрують у вакуумі. Осад очищують колонковою хроматографією на силікагелі, даючи сполуку 12 з виходом від 70-90 %. Спосіб C) Сполуку 10 розчиняють у толуолі (8ммл/ммоль) й у розчин додають гідроксид калію (2екв, 11.7N) та розчин дегазують. У розчин додають відповідним чином заміщений бензил бромід (1.1екв), 2-ди-t-бутилфосфіно-2",4",6’-триізопропилбіфеніл (0.06екв) й трис(дибензиліденацетон)-дипалладій(0) (0.03екв). Суміш перемішують при 60 °C 1.25год. Суміш охолоджують до кімнатної температури, розбавляють з EtOAc й промивають з 5 % розчином NaHCO3 (10мл/ммоль). Органічні шари висушують на MgSO 4, фільтрують й концентрують у вакуумі. Осад очищують колонковою хроматографією на силікагелі, даючи сполуку 12 з виходом від 30-80 %. Загальна процедура зняття захисту сполук 12-13. Сполуку 12 розчиняють у DCM (10мл/ммоль) й додають трифтороцтову кислоту (10екв). Розчин нагрівають зі зворотнім холодильником 16год, після цього часу TLC аналіз виявляє завершену реакцію. Суміш нейтралізують з 5 % розчином NaHCO3. Суміш екстрагують з DCM (3x) й поєднані органічні шари промивають з розсолом, сушать на Na2SO4 й концентрують у вакуумі даючи сполуку 13 яку застосовують на наступному етапі без подальшого очищення. Загальна процедура введення захищені хвости карбоксильної кислоти (9) починаючи зі сполуки 13. a) введення t-бутил складного ефіру пропіонової кислоти. Сполуку 13 суспендують у метанолі (4мл/ммоль) й додають DIPEA (1.05г). У суміш додають 1.2eg t-бутил акрилату й суміш 15 UA 113719 C2 5 10 15 20 25 30 35 40 45 50 55 нагрівають зі зворотнім холодильником 16 год. Перетворення перевіряють TLC аналізом. Розчинники випарюють й осад знову розчиняють у EtOAc й екстрагують з 5 % розчином NaHCO3.Органічний шар висушують (MgSO4), концентрують у вакуумі й осад очищують колонковою хроматографією на силікагелі, даючи чистий 9a. b) Введення t-бутил складного ефіру 2-метил-пропіонової кислоти. До розчину сполуки 13 у DMF (6мл/ммоль) у пляшці з пірексу додають 1,8–диазабіцикло[5.4.0]ундец-7-ен (3г) й t-бутилметакрилат (2екв). Суміш нагрівають при 125 °C 100год. Розчин охолоджують й додають 5 % NaHCO3 (15мл/ммоль) та екстрагують з диетил ефір/EtOAc, 1/1, v/v. Органічний шар промивають з водою (4x), сушать на MgSO4, концентрують у вакуумі й осад очищують колонковою хроматографією на силікагелі, даючи чистий 9b. c) Введення t-бутил складного ефіру 3-масляної кислоти. Сполуку 13 суспендують у 1,2дихлоретані (6мл/ммоль). До цієї суспензії додають t-бутилацетоацетат (1екв) й натрій триацетокси борогідрид (1.4екв). Суміш перемішують при кімнатній температурі 16год. Якщо реакція не завершена, додають іншу порцію t-бутилацетоацетату (1екв) й натрій триацетокси борогідрид (1.4екв). Після завершення реакції, розчин розбавляють з 5 % NaHCO3 (15мл/ммоль) й суміш екстрагують з DCM. Поєднані органічні шари висушують на Na 2SO4, концентрують у вакуумі й осад очищують колонковою хроматографією на силікагелі, одержуючи чисту сполуку 9c. d)) Введення t-бутил складного ефіру 4-масляної кислоти. Сполуку 13 суспендують у ацетонітрилі (3мл/ммоль). До цієї суспензії додають карбонат калію (2екв), t-бутил 4-бромбутаноат (1.1екв) й калій йодид (1.1екв). Суміш нагрівають при кімнатній температурі 16год, після цього часу TLC аналіз виявляє завершену реакцію. Суміш концентрують у вакуумі й осад розчиняють у EtOAc, промивають з 5 % NaHCO3 (15мл/ммоль). Органічний шар висушують на Na2SO4, концентрують у вакуумі й осад очищують колонковою хроматографією на силікагелі, одержуючи на виході сполуку 9d. Загальна процедура для синтезу 2-(4-бром-феніл)-оксазоло[4,5-c]піридину 17. До охолодженої (0 °C) суспензії комерційно доступного 4-гідрокси-3-аміно-піридину у DCM (14, 6мл/ммоль) додають триетил амін (1.25екв) й розчин відповідним чином заміщеного бензоїл хлориду 15 (1екв, 0.3M у DCM). Реакційній суміші дають досягти кімнатної температури й суміш перемішують 16-64год, після цього часу TLC аналіз виявляє завершену реакцію. Суміш фільтрують, промивають з DCM й ефіром, одержуючи 16 як твердий матеріал (50-80 % вихід), який застосовують на наступному етапі без подальшого очищення. Гексахлоретан (2.5екв) розчиняють у DCM й трифеніл фосфіні (3екв) й додають триетил амін (8екв). Суміш перемішують 10 хвилин при кімнатній температурі й додають повільно сполуку 16 у 5 еквівалентних порціях. Суміш перемішують при кімнатній температурі 64 год., після цього часу TLC аналіз (DCM/MeOH, 97/3, v/v) виявляє завершену реакцію. Розчин концентрують й осад суспендують у DCM. Суміш фільтрують й осад промивають з DCM й диетил ефіром, даючи 17 на виході 30-80 %. Загальна процедура для синтезу сполуки 19.До розчину сполуки 17 у DMF додають йодметан (4г) й суміш перемішують 16год. Суміш концентрують у вакуумі й осад перемішують у EtOAc, даючи 18 як білу тверду речовину. Сполуку 18 розчиняють у метанолі (10мл/ммоль) й розчин охолоджують до 0 °C. Додають натрій борогідрид (2г) й суміш перемішують при 0 °C 2 год., після цього часу їй дають досягти кімнатної температури й перемішування продовжують 16 год. Додають воду (1мл/ммоль) й суміш перемішують 5 хвилин. Суміш спів-випарюють з ацетонітрилом й осад очищують колонковою хроматографією на силікагелі, одержуючи на виході сполуку 19 у 50-90 %. Загальна процедура для синтезу сполуки 20.До охолодженого (0 °C) розчину сполуки 19 у 1,2-дихлоретані (10мл/ммоль) додають DIPEA (2екв). При 0 °C додають 1-хлоретил хлороформат (3екв) й суміш перемішують 10 хвилин при 0 °C після цього часу температуру підвищують до температури рефлюксу. Після 2год, суміш концентрують у вакуумі й осад розчиняють у метанолі (10мл/ммоль). Розчин перемішують 48год при кімнатній температурі. Видалення розчинника призводить до виділення сполуки 20 на виході 70-90 %. Загальна процедура для синтезу сполуки 21. a) введення пропіонова кислота t-бутил складний ефір. Сполука 20 суспендують у метанол (10мл/ммоль) й DIPEA додають (2.05 г). У суміш додають 1.2eg t-бутил акрилат й суміш нагрівають зі зворотнім холодильником від 16 до 120год. Перетворення перевіряють TLC аналізом й коли необхідно додатковий реагенти додають прискорити завершення реакції. Розчинники випарюють й осад знову розчиняють у EtOAc й екстрагують з 5 % розчином NaHCO3. Органічний шар висушують (MgSO4), концентрують у 16 UA 113719 C2 5 10 15 20 25 30 35 40 45 50 55 вакуумі й осад очищують колонковою хроматографією на силікагелі, даючи 21a з виходом від 50-90 % b) Введення 2-метил-пропіонова кислота t-бутил складний ефір. До розчину сполуки 20 у DMF (6мл/ммоль) додають 1,8–диазабіцикло[5.4.0]ундец-7-ен (DBU, 3г) й t-бутилметакрилат (5екв). Суміш нагрівають при 125 °C 100год. Розчин охолоджують й 5 % NaHCO3 додають (15мл/ммоль) й екстрагують з диетил ефір/EtOAc, 1/1, v/v. Органічний шар промивають з водою (4x), сушать на MgSO4, концентрують у вакуумі й осад очищують колонковою хроматографією на силікагелі, даючи чистий 21b. c) Введення 3-масляна кислота t-бутил складний ефір. Сполука 20 суспендують у 1,2-дихлоретан (8мл/ммоль). До цієї суспензії додають tбутилацетоацетат (1.4екв), оцтова кислота (1г) й натрій триацетокси борогідрид (1.8екв). Суміш перемішують при кімнатній температурі 16год. Якщо реакція не завершена, інша порція of tбутилацетоацетат (1екв) й натрій триацетокси борогідрид (1.4екв) додають. Після завершену реакцію, розчин розбавляють з 5 % NaHCO3 (15мл/ммоль) й суміш екстрагують з DCM. Поєднані органічні шари висушують на Na 2SO4, концентрують у вакуумі й осад очищують колонковою хроматографією на силікагелі, одержуючи чисту сполуку 21c. d)) Введення t-бутил складного ефіру 4-масляної кислоти. Сполука 20 суспендують у DMF (5мл/ммоль). До цієї суспензії додають карбонат калію (3екв) й t-бутил 4-бромбутаноат (3екв). Суміш нагрівають при 80 °C 16год, після цього часу TLC аналіз виявляє завершену реакцію. Суміш концентрують у вакуумі й осад очищують колонковою хроматографією на силікагелі, одержуючи на виході 21d. Загальна процедура для синтезу сполуки 22. Сполуку 21 розчиняють у ацетонітрилі (25ммл/ммоль) й у розчин додають порошкоподібний гідроксид калію (2екв) й розчин дегазують. У розчин додають 2-діт-бутилфосфіно-3,4,5,6-тетраметил-2",4",6’-триізопропил-1,1-біфеніл (0.06екв) й трис-(дибензиліденацетон)-дипалладій(0) (0.03екв). Суміш перемішують при 60 °C 4год. Суміш охолоджують до кімнатної температури й концентрують у вакуумі. Осад розчиняють у DCM й промивають з 0.1M HCl й водою. Водні шари екстрагують з DCM й поєднані органічні шари висушують на MgSO4. Сполуку 22 одержують після колонкової хроматографії на силікагелі з виходом від 30-70 %. Загальна процедура введення бензил ефірової частки у 21 до сполуки 23. Розчин сполуки 21, відповідним чином заміщений бензиловий спирт (2екв), палладій(II) ацетат (0.02екв), 2-дітбутилфосфіно-3,4,5,6-тетраметил-2",4",6’-триізопропил-1,1’біфеніл (0.02екв), карбонат цезію (1.5екв) у дегазованому толуолі (3мл/ммоль) нагрівають при 75 °C 16 год. Перетворення перевіряють TLC аналізом. Розчин охолоджують до кімнатної температури, розбавляють з DCM, фільтрують й концентрують у вакуумі. Осад очищують колонковою хроматографією на силікагелі, даючи чисту сполуку 23 з виходом від 30-80 %. Загальна процедура перетворення фенолу 22 у бензилові ефіри 23. Спосіб A) Сполуку 22 розчиняють у DCM/вода, 2/1, v/v (4мл/ммоль) й до цього розчину додають натрій гідроксид (2N, 3 екв). До цієї суміші додають тетрабутиламоній бромід (0.1екв) й відповідним чином заміщений бензил бромід (1.1екв). Суміш перемішують 16год при кімнатній температурі, після цього часу TLC аналіз виявляє завершену реакцію. Суміш розбавляють з DCM (15мл/ммоль), шари розділяють й водний шар екстрагують з DCM. Органічні шари висушують на MgSO4, фільтрують й концентрують у вакуумі. Осад очищують колонковою хроматографією на силікагелі, даючи чисту сполуку 23 з виходом від 80-90 %. Спосіб B) Сполуку 22 розчиняють у сухому DCM (15мл/ммоль) й до цього розчину додають трифенілфосфін (1.8екв) й відповідним чином заміщений бензиловий спирт (1.8екв). До цієї суміші додають диізопропил азодикарбоксилат (1.8екв) й суміш перемішують 16год при кімнатній температурі, після цього часу TLC аналіз виявляє завершену реакцію. Суміш концентрують у вакуумі. Осад очищують колонковою хроматографією на силікагелі, даючи чисту сполуку 23 з виходом від 70-90 %. Спосіб C) Смолу PS-TBD (3.7 eq.) інкубують з розчином 22 (1.1г) у 1 мл ацетонітрилу 1.5 год. при 50 °C. Після цього, додають відповідним чином заміщений бензил бромід (1.10 eq.) у ацетонітрилі. Далі, реакційну суміш струшують й нагрівають при 75 °C 16год. Далі, розчинник видаляють фільтрацією й смолау промивають з 3 × 2.5 мл ACN. Поєднані органічні речовини концентрують у вакуумі, з подальшою випарювальною колонковою хроматографією на кремнеземі даючи сполуку 23 з виходом від 60-95 %. Загальна процедура зняття захисту 23 до сполуки 2. Сполуку 23 розчиняють у розчині HCl у 1,4-диоксані (4N, 100екв) й суміш перемішують 16 год. при кімнатній температурі. Нагрівання при 50 °C застосовують коли необхідно прискорити завершення реакції. Розчинники випарюють 17 UA 113719 C2 5 10 15 20 25 30 35 40 45 50 55 60 й додають диізопропил ефір, щоб осадити продукт. Білий твердий матеріал фільтрують й сушать у вакуумі, даючи сполуку 2 з виходом від 70-100 %. Загальна процедура для синтезу сполуки 25. До охолодженї (0 °C) суспензії комерційно доступного 4-гідрокси-3-аміно-піридину (14) у ацетонітрилі (15мл/ммоль) додають відповідним чином заміщену 4-бензилокси-бензойну кислоту (24, 1екв), трифенілфосфін (3екв) й трихлорацетонітрил (3екв). Реакційній суміші дають досягти кімнатної температури й суміш перемішують 16-64год при 80 °C. Суміш концентрують у вакуумі й осади розчиняють у DCM й промивають з 2N NaOH (3x). Поєднані водні шари екстрагують з DCM й органічні шари сушать (Na2SO4), даючи сирий 25 у вигляді олії, який застосовують на наступному етапі без подальшого очищення. Загальна процедура для синтезу сполуки 26. До розчину сполуки 25 у DMF (5мл/ммоль) додають йодметан (4г) й суміш перемішують 16год. Суміш концентрують у вакуумі й осад перемішують у EtOAc, даючи чвертинну сіль 25 як білийу тверду речовину. Сирий матеріал розчиняють у метанолі (10мл/ммоль) й розчин охолоджують до 0 °C. Додають натрій борогідрид (2.5г) й суміш перемішують при 0 °C 2 год., після цього часу їй дають досягти кімнатної температури й перемішування продовжують 16-64 год. Додають воду (1мл/ммоль) й суміш перемішують 5 хвилини. Суміш концентрують у вакуумі, осади суспендують у 2 N NaOH (5мл/ммоль) й екстрагують з DCM (3x). Поєднані органічні шари висушують (Na2SO4) й концентрують, даючи сирий 26 як жовтий твердий продукт, який застосовують на наступному етапі без подальшого очищення. Загальна процедура для сполуки 27. До охолодженого (0 °C) розчину сполуки 26 у 1,2дихлоретані (10мл/ммоль) додають DIPEA (2екв) й додають 1-хлоретил хлороформат (3екв). Суміш перемішують 10 хвилини при 0 °C, після цього часу температуру підвищують до температури рефлюксу. Після 4год, суміші дають досягти кімнатної температури й перемішування продовжують 16год. Суміш концентрують у вакуумі й осад розчиняють у метанолі (10мл/ммоль). Розчин перемішують 16-48год при кімнатній температурі. Видалення розчинника призводить до виділення сирого 27 у загальному виході 20-40 % базуючись на 25. Загальна процедура введення захищені хвости карбоксильної кислоти (до 23) починаючи зі сполуки 27. a) введення t-бутил складного ефіру пропіонової кислоти. Сполуку 27 суспендують у метанолі (4мл/ммоль) й додають DIPEA (1.05 г). У суміш додають 1.2eg t-бутил акрилату й суміш нагрівають зі зворотнім холодильником 16 год. Перетворення перевіряють TLC аналізом. Розчинники випарюють й осад знову розчиняють у EtOAc й екстрагують з 5 % розчином NaHCO3.Органічний шар висушують (MgSO4), концентрують у вакуумі й осад очищують колонковою хроматографією на силікагелі, даючи чистий 23a. b) Введення t-бутил складного ефіру 2-метил-пропіонової кислоти. До розчину сполуки 27 у DMF (6мл/ммоль) додають 1,8–диазабіцикло[5.4.0]ундец-7-ен (3г) й t-бутилметакрилат (4екв). Суміш нагрівають при 125 °C 100год. Розчин охолоджують й додають 5 % NaHCO3 (15мл/ммоль) й екстрагують з диетил ефір/EtOAc, 1/1, v/v. Органічний шар промивають з водою (4x), сушать на MgSO4, концентрують у вакуумі й осад очищують колонковою хроматографією на силікагелі, даючи чистий 23b. c) Введення t-бутил складного ефіру 3-масляної кислоти. Сполуку 27 суспендують у 1,2-дихлоретані (6мл/ммоль). До цієї суспензії додають tбутилацетоацетат (1екв) й натрій триацетокси борогідрид (1.4екв). Суміш перемішують при кімнатній температурі 16год. Якщо реакція не завершена, додають іншу порцію tбутилацетоацетату (1екв) й натрій триацетокси борогідриду (1.4екв). Після завершення реакції, розчин розбавляють з 5 % NaHCO3 (15мл/ммоль) й суміш екстрагують з DCM. Поєднані органічні шари висушують на Na2SO4, концентрують у вакуумі й осад очищують колонковою хроматографією на силікагелі, одержуючи чисту сполуку 23c. d)) Введення t-бутил складного ефіру 4-масляної кислоти. Сполуку 27 суспендують у ацетонітрилі (3мл/ммоль). До цієї суспензії додають карбонат калію (2екв), t-бутил 4-бромбутаноат (1.1екв) й калій йодид (1.1 екв). Суміш нагрівають при кімнатній температурі 16год, після цього часу TLC аналіз виявляє завершену реакцію. Суміш концентрують у вакуумі й осад розчиняють у EtOAc, промивають з 5 % NaHCO3 (15мл/ммоль). Органічний шар висушують на Na2SO4, концентрують у вакуумі й осад очищують колонковою хроматографією на силікагелі, одержуючи на виході 23d. e)) Введення 3-циклобутанкарбоксильної кислоти. Сполуку 27 суспендують у 1,2-дихлоретані (20мл/ммоль). До цієї суспензії додають 3оксоциклобутанкарбоксильну кислоту (1.3екв) й натрій триацетокси борогідрид (1.6екв). Суміш перемішують при кімнатній температурі 16год. Якщо реакція не завершена, додають іншу 18 UA 113719 C2 5 10 15 20 25 30 35 40 45 50 55 60 порцію 3-оксоциклобутанкарбоксильної кислоти (1.3екв) й натрій триацетокси борогідриду (1.6екв). Після завершення реакції, розчин розбавляють з 5 % NaHCO3 (15мл/ммоль) й суміш екстрагують з DCM. Поєднані органічні шари висушують на Na 2SO4, концентрують у вакуумі й осад очищують колонковою хроматографією на силікагелі, одержуючи чисту сполуку 2e. Загальна процедура гідрогенізації 23 до сполуки 22. До розчину сполуки 23 у етанолі (10мл/ммоль) додають гідроксид палладію на вуглеці (20 %, 0.22г). Гідрогенізація починають при атмосферному тиску водню. Перемішування продовжують 16год при кімнатній температурі. Суміш фільтрують крізь "Хайфло" й осад промивають з етанолом. Фільтрат концентрують у вакуумі даючи сполуку 22. Загальна процедура для синтезу сполуки 28. До суспензії сполуки 20 у DCM (6мл/ммоль) додають DIPEA (1екв), диметиламіно піридин (DMAP, 0.05екв) й ди-t-бутил дикарбонат (1.1екв). Суміш перемішують при кімнатній температурі 16год, після цього часу TLC аналіз виявляє завершену реакцію. Суміш концентрують у вакуумі. Осад очищують колонковою хроматографією на силікагелі, даючи чисту сполуку 28 з виходом від 70-90 %. Загальна процедура для синтезу сполуки 29. Сполуку 28 розчиняють у 1,4-диоксан/вода, 1/1, v/v (10мл/ммоль) й у розчин додають гідроксид калію (4екв, 11.7N) й розчин дегазують. У розчин додають 2-ди-t-бутилфосфіно-2",4",6’-триізопропилбіфеніл (0.04екв) й трис(дибензиліденацетон)-дипалладій(0) (0.02екв). Суміш перемішують при 80 °C 16год. Суміш охолоджують до кімнатної температури, розбавляють з EtOAc, підкислюють до pH 6 з 0.1N HCl й екстрагують з EtOAc. Органічні шари висушують на MgSO4, фільтрують й концентрують у вакуумі. Осад очищують колонковою хроматографією на силікагелі, даючи чисту сполуку 29 з виходом від 60-95 %. Загальна процедура для синтезу похідних бензил ефіру 30. Спосіб A) Сполуку 29 розчиняють у DCM/вода, 2/1, v/v (4мл/ммоль) й до цього розчину додають натрій гідроксид (2N, 3 екв). До цієї суміші додають тетрабутиламоній бромід (0.1екв) й відповідним чином заміщений бензил бромід (1.1екв). Суміш перемішують 16год при кімнатній температурі, після цього часу TLC аналіз виявляє завершену реакцію. Суміш розбавляють з DCM (15мл/ммоль), шари розділяють й водний шар екстрагують з DCM. Органічні шари висушують на MgSO4, фільтрують й концентрують у вакуумі. Осад очищують колонковою хроматографією на силікагелі, даючи чисту сполуку 30 з виходом від 80-90 %. Спосіб B) Сполука 29 розчиняють у N, N’-диметилацетаміді (4мл/ммоль) й до цього розчину додають трифенілфосфін (1.25екв), диізопропил азодикарбоксилат (1.25екв) й відповідним чином заміщений бензиловий спирт (1.2екв). Суміш перемішують 16год при кімнатній температурі, після цього часу TLC аналіз виявляє завершену реакцію. Суміш розбавляють з диетил ефіром й промивають з водою (3x). Поєднані органічні шари висушують на MgSO 4, фільтрують й концентрують у вакуумі. Осад очищують колонковою хроматографією на силікагелі, даючи чисту сполуку 30 з виходом від 70-90 %. Спосіб C) Сполуку 28 розчиняють у толуолі (8ммл/ммоль) й у розчин додають гідроксид калію (2екв, 11.7N) й розчин дегазують. У розчин додають відповідним чином заміщений бензил бромід (1.1екв), 2-ди-t-бутилфосфіно-2",4",6’-триізопропилбіфеніл (0.06екв) й трис(дибензиліденацетон)-дипалладій(0) (0.03екв). Суміш перемішують при 60 °C 1.25год. Суміш охолоджують до кімнатної температури, розбавляють з EtOAc й промивають з 5 % розчином NaHCO3 (10мл/ммоль). Органічні шари висушують на MgSO 4, фільтрують й концентрують у вакуумі. Осад очищують колонковою хроматографією на силікагелі, даючи чисту сполуку 30 з виходом від 30-80 %. Загальна процедура зняття захисту сполуки 30 до 27. Сполука 30 розчиняють у DCM (10мл/ммоль) й додають трифтороцтову кислоту (6екв). Розчин нагрівають зі зворотнім холодильником 16год, після цього часу TLC аналіз виявляє завершену реакцію. Суміш нейтралізують 5 % розчином NaHCO3. Суміш екстрагують з DCM (3x) й поєднані органічні шари промивають з розсолом, сушать на Na2SO4 й концентрують у вакуумі, даючи сполуку 27, яку застосовують на наступному етапі без подальшого очищення. §5. СИНТЕЗ ОКРЕМИХ СПОЛУК (Див. Таблицю 1) Усі похідні фуранілу із Таблиці 1 може бути одержані як описано далі, або шляхом A або B, з відповідними реагентами. Наступні сполуки є типовими прикладами. Усі похідні оксазолу із Таблиці 1 можуть бути одержані як описано далі, або шляхом C, D або E, обираючи відповідні реагенти. Наступні сполуки є типовими прикладами. t-бутил складний ефір 3-[2-(4-Бром-феніл)-2-оксо-етил]-4-оксо-піперидин-1-карбоксильної кислоти (5, Rb=H). До розчину t-бутил складного ефіру 4-оксо-піперидин-1-карбоксильної кислоти (4, 104.1г, 522 ммоль) у толуолі (800мл) додають каталітичну кількість моно гідрату 19 UA 113719 C2 5 10 15 20 25 30 35 40 45 50 55 60 пара-толуолсульфонової кислоти (0.5г, 2.6 ммоль) й пірролідину (172.8 мл, 2090ммоль). Суміш нагрівають до температури рефлюксу за умовах Діна-Старка 18 годин. Суміш концентрують при зниженому тиску й осад знову розчиняють у толуолі (600мл). До цього розчину додають повільно (протягом 25 хвилин) розчин 2-бром-1-(4-бром-феніл)-етанону (3, Rb=H, 145.2г, 522 ммоль) у толуолі/ DCM (900мл, ½, v/v). Суміш перемішують усю ніч при кімнатній температурі й одержаний білий рідкий розчин виливають у воду (1.5Л). Водний шар екстрагують з DCM (3 × 300мл) й поєднані органічні шари висушують (MgSO 4) й далі концентрують при зниженому тиску. Одержану олію очищують хроматографією на силікагелі (диетил ефір/нафтовий ефір, 2/3, v/v до 100 % диетил ефір) одержуючи сполуку 5 (Rb=H, 166.6г, 87 %) у якості твердої жовтої речовини. TLC аналіз, Rf 0.3 у диетил ефір/нафтовий ефір, 1/1, v/v. 2-[4-Бром-феніл]-4,5,6,7-тетрагідро-фуро[3,2-c]піридин (6, Rb=H). Сполуку 5 (Rb=H, 166г, 456 ммоль) суспендують у концентрованій соляній кислоті (500мл, 12N, 6моль). Суміш нагрівають при 10 °C 30 хвилин до 80 °C. Суміш починає пінитись сильно, утворюючи достатньо об'єму у посудині вихідної реакції. Після 45 хвилин, суміш охолоджують до 0 °C й нейтралізують з 50 мас. % розчином NaOH (екзотермічний). Після перемішування усю ніч при кімнатній температурі, одержаний твердий матеріал збирають фільтрацією й промивають з 250 мл 0.1M NaOH. Світло- коричневий матеріал очищують екстракцією Соксхлета у EtOAc, одержуючи 6 (Rb=H, 51г, 38 %) у якості твердої бежевої речовини, який застосовують на наступному етапі без подальшого очищення. LC-MS (Спосіб A): Rt 1.19, [M+H] 278. t-бутил складний ефір 3-[2-(4-Бром-феніл)-6,7-дигідро-4H-фуро[3,2-c]піридин-5-іл]пропіонової кислоти (7a, Rb=H). Сполука 6 (Rb=H, 1.46г, 5ммоль) суспендують у метанолі (30мл) й додають DIPEA (0.91мл, 1.05 г). У суміш додають t-бутил акрилат (0.88мл, 1.2екв) й суміш нагрівають зі зворотнім холодильником 16 год. Перетворення перевіряють аналізом TLC (диетил ефір/нафтовий ефір, 1/1, v/v). Розчинники випарюють й осад знову розчиняють у EtOAc й екстрагують з 5 % розчином NaHCO3.Органічний шар висушують (MgSO4), концентрують у вакуумі й осад очищують колонковою хроматографією на силікагелі (диетил ефір/нафтовий ефір, 2/3 to 1/1, v/v) даючи чистий 7a (Rb=H, 1.75г, 86 %) у якості твердої білої речовини. LC-MS (Спосіб A): Rt 1.38, [M+H] 407. t-бутил складний ефір 3-[2-(4-Гідрокси-феніл)-6,7-дигідро-4H-фуро[3,2-c]піридин-5-іл]пропіонової кислоти (8a, Rb=H). Сполуку 7a (Rb=H, 3.85г, 9.5ммоль) розчиняють у толуолі (80мл) й у розчин додають гідроксид калію (2екв, 11.7N) й розчин дегазують. У розчин додають 2-ди-t-бутилфосфіно-2",4",6’-триізопропилбіфеніл (0.24г, 0.57ммоль, 0.06екв) й трис(дибензиліденацетон)-дипалладій(0) (0.26г, 0.28ммоль, 0.03екв). Суміш перемішують при 60 °C 1.25год. Суміш охолоджують до кімнатної температури, розбавляють з EtOAc й промивають з 5 % NaHCO3 розчином (10мл/ммоль). Органічні шари висушують на MgSO 4, фільтрують й концентрують у вакуумі. Осад очищують колонковою хроматографією на силікагелі (диетил ефір/ нафтовий ефір, 1/1, v/v, Rf 0.1) даючи чисту сполуку 8a (Rb=H, 1.86г, 57 %) у якості твердої жовтої речовини. LC-MS (Спосіб A): Rt 1.14, [M+H] 344. t-бутил складний ефір 3-{2-[4-(2-Фтор-бензилокси)-феніл]-6,7-дигідро-4H-фуро[3,2-c]піридин5-іл}-пропіонової кислоти (9a, Ra=2F, Rb=H). Сполуку 8a (Rb=H, 1.24г, 3.61ммоль) розчиняють у N, N-диметилацетаміді (10мл) й до цього розчину додають трифенілфосфін (1.33г, 5.06ммоль, 1.4екв), диізопропил азодикарбоксилат (1мл, 5.05ммоль, 1.4екв) й 2-фторбензиловий спирт (0.46мл, 4.33ммоль, 1.2екв). Суміш перемішують 16год при кімнатній температурі, після цього часу TLC аналіз (диетил ефір, Rf 0.3) виявляє завершену реакцію. Суміш розбавляють з диетил ефіром й промивають з водою (3x). Поєднані органічні шари висушують на MgSO 4, фільтрують й концентрують у вакуумі. Осад очищують колонковою хроматографією на силікагелі (диетил ефір/нафтовий ефір, 1/1, v/v to 2/1, v/v) даючи чисту сполуку 9a (Ra=2F, Rb=H, 1.38г, 84 %) у вигляді олії. LC-MS (Спосіб A): Rt 1.46, [M+H] 452. 3-{2-[4-(2-Фтор-бензилокси)-феніл]-6,7-дигідро-4H-фуро[3,2-c]піридин-5-іл}-пропіонової кислоти (33). Сполуку 9a (Ra=2F, Rb=H, 1.38г, 3.1ммоль) розчиняють у розчині HCl у 1,4диоксані (4N, 30мл) й суміш перемішують 2 год. при 35 °C. Розчинники випарюють й додають диізопропил ефір (30мл) щоб осадити продукт, як сіль соляної кислоти. Білий твердий матеріал фільтрують й сушать у вакуумі даючи сполуку 33 (0.75г, 54 %) у якості твердої білої речовини. 1 H ЯМР (400 МГц, DMSO-d6): δ ч. на млн. 2.93 (t, J=7.6 Гц, 2 H), 3.07 (bs, 2 H), 3.28-3.55 (bs, 2 H), 3.44 (t, J=7.6 Гц, 2 H), 3.60 – 3.90 (bs, 2 H), 4.06 – 4.56 (bs, 2 H), 5.17 (s, 2 H), 6.76 (s, 1 H), 7.10 (d, J=8.8 Гц, 2 H), 7.21 – 7.31 (m, 2 H), 7.39-7.48 (m, 1 H), 7.57 (t, J=7.5 Гц, 1 H), 7.63 (d, J=8.8 Гц, 2 H), 10.7-11.5 (bs, 1 H), 12.3 – 13.2 (bs, 1 H); LC-MS (Спосіб A): Rt 1.39, [M+H] 396. t-бутил складний ефір 2-(4-Бром-феніл)-6,7-дигідро-4H-фуро[3,2-c]піридин-5-карбоксильної кислоти 10 (Rb=H). До суспензії сполуки 6 (Rb=H, 5г, 17ммоль) у DCM (100мл) додають DIPEA (2.92мл, 1екв), DMAP (0.1г, 0.05екв) й ди-t-бутил дикарбонат (4.1г, 18.8ммоль, 1.1екв). Суміш 20 UA 113719 C2 5 10 15 20 25 30 35 40 45 50 55 60 перемішують при кімнатній температурі 16год, після цього часу TLC аналіз (DCM, Rf, 0.40) виявляє завершену реакцію. Реакційну суміш промивають з 5 % розчином NaHCO3, розчин й одержані водні шари екстрагують з DCM. Поєднані органічні шари, висушують на MgSO 4, фільтрують й концентрують у вакуумі. Осад очищують колонковою хроматографією на силікагелі (елюент: 100 % DCM) даючи сполуку 10 (Rb=H, 5.99г, 92 %) у вигляді олії. t-бутил складний ефір 2-(4-Гідрокси-феніл)-6,7-дигідро-4H-фуро[3,2-c]піридин-5карбоксильної кислоти 11a (Rb=H). Сполука 10 (Rb=H, 11.77г, 31ммоль) розчиняють у 1,4диоксан/вода, 1/1, v/v (200мл) й у розчин додають гідроксид калію (6,98г, 124.5ммоль, 4екв) й розчин дегазують. У розчин додають 2-ди-t-бутилфосфіно-2",4",6’-триізопропилбіфеніл (0.53г, 1.24ммоль, 0.04екв) й трис-(дибензиліденацетон)-дипалладій(0) (0.57г, 0.62ммоль, 0.02екв). Суміш перемішують при 80 °C 16год. Суміш охолоджують до кімнатної температури, розбавляють з EtOAc, підкислюють до pH 6 з 0.1N HCl й екстрагують з EtOAc. Органічні шари висушують на MgSO4, фільтрують й концентрують у вакуумі. Осад очищують колонковою хроматографією на силікагелі (елюент: DCM/MeOH, 1/0 to 99.5/0.5) даючи сполуку 11 (Rb=H, 9г, 90 %) у якості твердої білої речовини. t-бутил складний ефір 2-[4-(4-Хлор-бензилокси)-феніл]-6,7-дигідро-4H-фуро[3,2-c]піридин-5карбоксильної кислоти (12, Ra=4Cl, Rb=H). Сполуку 11a (Rb=H, 2.0г, 6.34ммоль) розчиняють у DCM/вода, 2/1, v/v (30мл) й до цього розчину додають натрій гідроксид (2N, 10мл). До цієї суміші додають тетрабутиламоній бромід (0.2г, 0.63ммоль, 0.1екв) й 4-хлорбензил бромід (1.43г, 6.98ммоль, 1.1г). Суміш перемішують 16год при кімнатній температурі, після цього часу TLC аналіз (100 % DCM, Rf 0.55) виявляє завершену реакцію. Суміш розбавляють з DCM (15мл/ммоль), шари розділяють й водний шар екстрагують з DCM. Органічні шари висушують на MgSO4, фільтрують й концентрують у вакуумі. Осад очищують колонковою хроматографією на силікагелі (DCM/нафтовий ефір, 3/1 to 1/0, v/v) даючи сполуку 12 (Ra=4Cl, Rb=H, 2.3г, 82 %) у 1 вигляді жовтої олії. H ЯМР (400 МГц, CDCl3) δ ч. на млн. 1.4 (s, 9 H); 2.75 (bs, 2 H); 3.75 (bs, 2 H); 4.35 (bs, 2 H); 5.05 (s, 2 H); 6.4 (s, 1H), 6.94 (d, 1 H); 7.30 – 755 (m, 7 H). 2-[4-(4-Хлор-бензилокси)-феніл]-6,7-дигідро-4H-фуро[3,2-c]піридин (13, Ra=4Cl, Rb=H). Сполуку 12 (Ra=4Cl, Rb=H, 2.3г, 5.2ммоль) розчиняють у DCM (50мл) й додають трифтороцтову кислоту (4мл, 10екв). Розчин нагрівають зі зворотнім холодильником 16год, після цього часу TLC аналіз (100 % DCM, Rf 0.05) виявляє завершену реакцію. Суміш нейтралізують 5 % розчином NaHCO3. Суміш екстрагують з DCM (3x) й поєднані органічні шари промивають з розсолом, сушать на Na2SO4 й концентрують у вакуумі, даючи сирий 13 (Ra=4Cl, Rb=H, 1.79g) який застосовують на наступному етапі без подальшого очищення. LC-MS (Спосіб A): Rt 1.49, [M+H] 340. t-бутил складний ефір 3-{2-[4-(4-Хлор-бензилокси)-феніл]-6,7-дигідро-4H-фуро[3,2-c]піридин5-іл}-2-метил-пропіонової кислоти (9b, Ra=4Cl, Rb=H). До розчину сполуки 13a (0.25г, 0.74ммоль) у DMF (5мл) у 25мл пляшку з пірексу додають 1,8–диазабіцикло[5.4.0]ундец-7-ен (0.33мл, 2.21ммоль) й t-бутилметакрилат (0.24мл, 1.47ммоль). Суміш нагрівають при 140 °C 16год. Розчин охолоджують й додають 5 % NaHCO3 (10мл) й екстрагують з диетил ефіром/EtOAc, 1/1, v/v. Органічний шар промивають з водою (4 × 20мл), сушать на MgSO4, концентрують у вакуумі й осад очищують колонковою хроматографією на силікагелі (диетил ефір/нафтовий ефір, 9/1 до 4/1, v/v, Rf 0.65) даючи чистий 9b (Ra=4Cl, Rb=H, 0.1г, 28 %) у вигляді безбарвної олії. LC-MS (Спосіб A): Rt 1.88, [M+H] 482. 3-{2-[4-(4-Хлор-бензилокси)-феніл]-6,7-дигідро-4H-фуро[3,2-c]піридин-5-іл}-2-метилпропіонова кислота (77). Сполуку 9b (Ra=4Cl, Rb=H, 0.12г, 0.25ммоль) розчиняють у розчині HCl у 1,4-диоксані (4N, 2.8мл) й суміш перемішують 16 год. при кімнатній температурі. Розчинник випарюють й додають диізопропил ефір (30мл) щоб осадити продукт у вигляді солі соляної кислоти. Білий твердий матеріал фільтрують й сушать у вакуумі даючи сполуку 77 (0.09г, 74 %) 1 у якості твердої білої речовини. H ЯМР (400 МГц, DMSO-d6): δ ч. на млн. 1.29 (d, J=7.2 Гц, 3 H), 3.05-3.17 (m, 3 H), 3.23 (dd, J=5.4, 13.3 Гц, 1 H), 3.51-3.68 (m, 3 H), 4.24 (br. s., 2 H), 5.16 (s, 2 H), 6.73 (s, 1 H), 7.08 (d, J=8.9 Гц, 2 H), 7.42-7.53 (m, 4 H), 7.61 (d, J=8.9 Гц, 2 H), 10.4 – 13.1 (bs, 2H); 13 C ЯМР (101 МГц, DMSO-d6): δ ч. на млн. 16.42 (q, 1 C), 20.36 (t, 1 C), 35.17 (d, 1 C), 48.74 (t, 1 C), 49.57 (t, 1 C), 56.96 (t, 1 C), 68.60 (t, 1 C), 102.92 (d, 1 C), 113.06 (s, 1 C), 115.41 (d, 1 C), 123.20 (s, 1 C), 124.87 (d, 1 C), 128.41 (d, 1 C), 129.42 (d, 1 C), 132.46 (s, 1 C), 136.01 (s, 1 C), 145.10 (s, 1 C), 152.99 (s, 1 C), 157.85 (s, 1 C), 174.95 (s, 1 C). LC-MS (Спосіб A): Rt 1.56, [M+H] 426. t-бутил складний ефір 2-[4-(Бензилокси)-феніл]-6,7-дигідро-4H-фуро[3,2-c]піридин-5карбоксильної кислоти 12 (Ra=Rb=H). Сполуку 11 (Rb=H, 0.84г, 2.66ммоль) розчиняють у DCM/вода, 2/1, v/v (30мл) й до цього розчину додають натрій гідроксид (2N, 4.2мл). До цієї суміші додають тетрабутил-амоній бромід (0.09г, 0.27ммоль, 0.1екв) й бензил бромід (0.35мл, 21 UA 113719 C2 5 10 15 20 25 30 35 40 45 50 55 60 2.93 ммоль, 1.1г). Суміш перемішують 16год при кімнатній температурі, після цього часу TLC аналіз (DCM/MeOH, 98/2, v/v, Rf 0.8) виявляє завершену реакцію. Суміш розбавляють з DCM (100мл), шари розділяють й водний шар екстрагують з DCM. Органічні шари висушують на MgSO4, фільтрують й концентрують у вакуумі. Осад очищують колонковою хроматографією на силікагелі (DCM/нафтовий ефір, 3/1 to 1/0, v/v) даючи сполуку 12 (Ra=Rb=H, 1.03г, 95 %) у якості 1 твердої білої речовини. H ЯМР (400 МГц, CDCl3) δ ч. на млн. 1.4 (s, 9 H); 2.75 (bs, 2 H); 3.75 (bs, 2 H); 4.35 (bs, 2 H); 5.05 (s, 2 H); 6.35 (s, 1H); 6.98 (d, 2 H); 7.30 – 7.55 (m, 7 H). 2-[4-Бензилокси-феніл]-6,7-дигідро-4H-фуро[3,2-c]піридин (13, Ra=Rb=H). Сполуку 12 (Ra=Rb=H, 1.03г, 2.54ммоль) розчиняють у DCM (20мл) й додають трифтороцтову кислоту (1.5мл). Розчин нагрівають зі зворотнім холодильником 16год, після цього часу TLC аналіз (100 % DCM, Rf 0.05) виявляє завершену реакцію. Суміш нейтралізують з 5 % aq. NaHCO3 (40мл) й екстрагують з DCM (3 × 50мл) й поєднані органічні шари промивають з розсолом, сушать на Na2SO4 й концентрують у вакуумі даючи сполуку 13 (Ra=Rb=H, 0.67г, 86 %), яку застосовують на наступному етапі без подальшого очищення. LC-MS (Спосіб A): Rt 1.50, [M+H] 306. t-бутил складний ефір 3-{2-[4-Бензилокси-феніл]-6,7-дигідро-4H-фуро[3,2-c]піридин-5-іл}масляної кислоти (9c, Ra=Rb=H). Сполуку 13 (Ra=Rb=H, 0.16г, 0.52ммоль) суспендують у 1,2дихлоретані (3.2мл). До цієї суспензії додають t-бутилацетоацетат (0.09мл, 0.52ммоль) й натрій триацетокси борогідрид (0.16г, 0.73ммоль). Суміш перемішують при кімнатній температурі 16год, після цього часу додають іншу порцію t-бутилацетоацетату (1екв) й натрій триацетокси борогідриду (1.4екв) разом з краплиною оцтової кислоти. Після перемішування іще 60 год., знову додають порцію t-бутилацетоацетату (1екв) й натрій триацетокси борогідриду (1.4екв) й перемішування продовжують 36год. Розчин розбавляють з 5 % NaHCO3 (10мл) й суміш екстрагують з DCM (3 × 100мл). Поєднані органічні шари висушують на Na 2SO4, концентрують у вакуумі й осад очищують колонковою хроматографією на силікагелі (диетил ефір/нафтовий ефір, 9/1 to 4/1, v/v) одержуючи чисту сполуку 9c (Ra=Rb=H, 0.06г, 25 %) у якості твердої білої речовини. LC-MS (Спосіб A): Rt 1.68, [M+H] 448. 3-{2-[4-Бензилокси-феніл]-6,7-дигідро-4H-фуро[3,2-c]піридин-5-іл}-масляна кислота (76). Сполука 9c (Ra=Rb=H, 0.08г, 0.18ммоль) розчиняють у розчин HCl у 1,4-диоксані (4мл, 2N) й суміш перемішують 16 год. при кімнатній температурі. Розчинники випарюють й осад співвипарюють з циклогексаном. Диізопропил ефір (30мл) додають щоб осадити продукт у якості солі соляної кислоти, білий твердий матеріал фільтрують й сушать у вакуумі даючи сполуку 76 1 (0.06г, 80 %). H ЯМР (400 МГц, DMSO-d6), δ ч. на млн.: 1.38 (d, J=6.6 Гц, 3 H), 2.58-2.75 (m, 1 H), 2.90-3.18 (m, 3 H), 3.39-3.54 (m, 1 H), 3.61-3.78 (m, 1 H), 3.80-3.93 (m, 1 H), 4.13-4.32 (m, 2 H), 5.14 (s, 2 H), 6.76 (s, 1 H), 7.07 (d, J=8.8 Гц, 2 H), 7.30-7.36 (m, 1 H), 7.40 (s, 2 H), 7.45 (s, 2 H), 7.62 (d, J=8.8 Гц, 2 H), 10.15-10.80 (m, 1 H), 12.54-13.10 (m, 1 H);). LC-MS (Спосіб A): Rt 1.46, [M+H] 392. t-бутил складний ефір 4-[2-(4-Бром-феніл)-6,7-дигідро-4H-фуро[3,2-c]піридин-5-іл]-масляної кислоти (7d).Сполуку 6 (Rb=H, 4.55г, 16.3ммоль) суспендують у ацетонітрилі (55мл). До цієї суспензії додають карбонат калію (4.52г, 32.7 ммоль), t-бутил 4-бромбутаноат (4.38г, 19.6ммоль, 1.2екв) й калій йодид (3.2г, 19.6ммоль, 1.2екв). Суміш нагрівають до температури рефлюксу 16год, після цього часу TLC аналіз (диетил ефір/нафтовий ефір, 1/1, v/v, Rf 0.1) виявляє завершену реакцію. Суміш концентрують у вакуумі й осад розчиняють у EtOAc й промивають з 5 % NaHCO3 (2 × 60мл). Органічний шар висушують на Na2SO4, концентрують у вакуумі й осад очищують колонковою хроматографією на силікагелі (диетил ефір/нафтовий ефір, 1/1, v/v) одержуючи на виході 7d (Rb=H, 4.94г, 71 %) у якості твердої жовтої речовини. LC-MS (Спосіб A): Rt 1.37, [M+H] 420. t-бутил складний ефір 4-[2-(4-Гідрокси-феніл)-6,7-дигідро-4H-фуро[3,2-c]піридин-5-іл]масляної кислоти (8d). Сполуку 7d (Rb=H, 4.91г, 11.68ммоль) розчиняють у толуолі (100мл) й у розчин додають гідроксид калію (2мл, 11.7N) й розчин дегазують. У розчин додають 2-ди-tбутилфосфіно-2",4",6’-триізопропилбіфеніл (0.27г, 0.64ммоль, 0.06екв) й трис(дибензиліденацетон)-дипалладій(0) (0.29г, 0.32ммоль, 0.03екв). Суміш перемішують при 60 °C 1.25год. Суміш охолоджують до кімнатної температури, розбавляють з EtOAc й промивають 5 % розчином NaHCO3 (100мл). Органічні шари висушують на MgSO 4, фільтрують й концентрують у вакуумі. Осад очищують колонковою хроматографією на силікагелі (диетил ефір/ нафтовий ефір, 1/1 до 1/0, v/v, Rf 0.1) даючи чисту сполуку 8d (Rb=H, 4.0г) у якості твердої жовтої речовини. LC-MS (Спосіб A): Rt 1.21, [M+H] 358. t-бутил складний ефір 4-{2-[4-(2-Фтор-бензилокси)-феніл]-6,7-дигідро-4H-фуро[3,2-c]піридин5-іл}-масляної кислоти (9d). Сполука 8d (Rb=H, 0.43г, 1.2ммоль) розчиняють у DCM/вода, 2/1, v/v (5мл) й до цього розчину додають натрій гідроксид (1.8мл, 2N, 3екв). До цієї суміші додають 22 UA 113719 C2 5 10 15 20 25 30 35 40 45 50 55 60 тетрабутиламоній бромід (0.1екв) й 2F-бензил бромід (1.32ммоль, 250мг). Суміш перемішують 16год при кімнатній температурі після цього часу TLC аналіз (диетил ефір, Rf 0.5) виявляє завершену реакцію. Суміш розбавляють з DCM (15мл), шари розділяють й водний шар екстрагують з DCM. Органічні шари висушують на MgSO 4, фільтрують й концентрують у вакуумі. Осад очищують колонковою хроматографією на силікагелі (диетил ефір/нафтовий ефір, 1/1 to 1/0, v/v даючи сполуку 9d (Ra=2F, Rb=H) на виході 80 %. LC-MS (Спосіб A): Rt 1.49, [M+H] 466. 4-{2-[4-(2-Фтор-бензилокси)-феніл]-6,7-дигідро-4H-фуро[3,2-c]піридин-5-іл}-масляна кислота (35). Сполука 9d (Ra=2F, Rb=H, 0.3г, 0.64ммоль) розчиняють у розчині HCl у 1,4-диоксані (4N, 2.8мл) й суміш перемішують 16 год. при кімнатній температурі. Розчинники випарюють й додають диізопропил ефір (30мл) щоб осадити продукт у якості солі соляної кислоти. Білийтвердий матеріал фільтрують й сушать у вакуумі даючи сполуку 35 (0.32г, 95 %) у якості твердої 1 білої речовини. H ЯМР (400 МГц, DMSO-d6) δ ч. на млн.: 1.69-1.83 (m, 2 H), 2.18 (t, J=7.2 Гц, 2 H), 2.81-2.91 (m, 2 H), 3.02-3.13 (m, 2 H), 3.23-3.36 (bs, 1 H), 3.50-3.68 (bs, 1 H), 3.89 – 4.05 (m, 1 H), 4.15 – 4.29 (m, 1 H), 4.98 (s, 2 H), 6.58 (s, 1 H), 6.91 (d, J=8.7 Гц, 2 H), 7.02-7.12 (m, 2 H), 7.217.29 (m, 1 H), 7.38 (dt, J=7.7, 1.5 Гц, 1 H), 7.44 (d, J=8.7 Гц, 2 H), 9.80 (br.s., 1 H), 11.37-13.06 (bs, 1 H); LC-MS (Спосіб A): Rt 1.37, [M+H] 410. 4-{2-[4-(2-Фтор-бензилокси)-2-фтор-феніл]-6,7-дигідро-4H-фуро[3,2-c]-піридин-5-іл}-масляна кислота (73). Сполуку 73 одержують подібним способом як описано для 35 починаючи з 2-бром1 1-(4-бром-2-фтор-феніл)-етанону. Сполука 73: H ЯМР (400 МГц, DMSO-d6), δ ч. на млн.: 1.92 – 2.04 (m, 2 H), 2.38 (t, J=7.1 Гц, 2 H), 3.02 – 3.13 (m, 2 H), 3.17 – 3.28 (m, 2 H), 3.44 – 3.92 (bs, 2 H), 3.98-4.54 (bs, 2 H), 5.21 (s, 2 H), 6.70 (d, J=2.8 Гц, 1 H), 7.00 (dd, J=8.9, 1.9 Гц, 1 H), 7.12 (dd, J=13.4, 1.9 Гц, 1 H) 7.23 – 7.32 (m, 2 H) 7.41-7.50 (m, 1 H) 7.56 – 7.63 (m, 1 H) 7.69 (t, J=9.0 Гц, 1 H), 10.06-10.93 (bs, 1 H), 12.07-12.85 (bs, 1 H); LC-MS (Спосіб A): Rt 1.35, [M+H] 428. 2-(4-Бром-феніл)-оксазоло[4,5-c]піридин (17, Rb=H). До охолодженої (0 °C) суспензії комерційно доступного 4-гідрокси-3-аміно-піридину 14 (4г, 36ммоль) у DCM (200мл) додають триетил амін (6.3мл, 1.25екв) й розчин 4-бром-бензоїл хлориду (15, Rb=H, 8г, 36ммоль, 1екв, 0.3M у DCM). Реакційній суміші дають досягти кімнатної температури й суміш перемішують 16год. Суміш фільтрують, промивають з DCM й ефіром, одержуючи сирий 16 (Rb=H) у якості твердого матеріалу, який застосовують на наступному етапі без подальшого очищення. Гексахлоретан (10.2г, 43ммоль, 2.5екв) розчиняють у DCM (150мл) й додають трифеніл фосфін (13.56г, 51,69ммоль, 3екв) й триетил амін (19.2мл, 137.8ммоль, 8екв). Суміш перемішують 10 хвилин при кімнатній температурі й додають повільно сиру сполуку 16 (Rb=H) у 5 рівних порціях. Суміш перемішують при кімнатній температурі 64 год., після цього часу TLC аналіз (DCM/MeOH, 97/3, v/v, Rf 0.3) виявляє завершену реакцію. Розчин концентрують й осад суспендують у DCM. Суміш фільтрують й осад промивають з DCM й диетил ефіром, даючи сирий 17 (Rb=H) який застосовують на наступному етапі без подальшого очищення. 2-(4-Бром-феніл)-5-метил-4,5,6,7-тетрагідро-оксазоло[4,5-c]піридин (19, Rb=H). До розчину сполуки 17 (Rb=H, 11.4ммоль) у DMF (95мл) додають йодметан (2.84мл, 45.58ммоль, 4г) й суміш перемішують 16год. Суміш концентрують у вакуумі й осад перемішують у EtOAc, даючи сирий 18 (Rb=H, 3.3г, 69 %) у якості твердої білої речовини. Сполуку 18 (Rb=H, 2.3г, 5.5ммоль) розчиняють у метанолі (55мл) й розчин охолоджують до 0 °C. Додають натрій борогідрид (0.42г, 11ммоль, 2г) й суміш перемішують при 0 °C для 2 год., після цього часу їй дають досягти кімнатної температури й перемішування продовжують 16 год. Додають воду (4мл) й суміш перемішують 5 хвилини. Суміш спів-випарюють з ацетонітрилом й осад очищують колонковою хроматографією на силікагелі (DMA 0.5) одержуючи на виході сполуку 19 (Rb=H) на виході 61 %. 2-(4-Бром-феніл)-4,5,6,7-тетрагідро-оксазоло[4,5-c]піридин (20, Rb=H). До охолодженого (0 °C) розчину сполуки 19 (Rb=H, 0.95г, 3.2ммоль) у 1,2-дихлоретані (32мл) додають DIPEA (1.1мл, 6.4ммоль, 2екв). При 0 °C, додають 1-хлоретилхлороформат (1,05мл, 9.72ммоль, 3екв) й суміш перемішують 10 хвилин при 0 °C після цього часу температуру підвищують до температури рефлюксу. Після 2год, суміш концентрують у вакуумі й осад розчиняють у метанолі (35мл). Розчин перемішують 48год при кімнатній температурі. Осад фільтрують, твердий продукт промивають з диетил ефіром, даючи сполуку 20 (Rb=H, 0.9г, 88 %). LC-MS (Спосіб A): Rt 1.1, [M+H] 280. t-бутил складний ефір 3-[2-(4-Бром-феніл)-6,7-дигідро-H-оксазоло[4,5-c]піридин-5-іл]пропіонової кислоти (21, Rb=H). Сполуку 20 (Rb=H, 8г, 22.8ммоль) суспендують у метанолі (200мл) й додають DIPEA (8.15мл, 46.8ммоль, 2.05г). У суміш додають t-бутил акрилат (3.97мл, 27.4ммоль, 1.2екв) й суміш нагрівають зі зворотнім холодильником 120rs. Перетворення перевіряють TLC аналізом й після 16 й 64год додають додатковий t-бутил акрилат (3.97мл, 27.4ммоль, 1.2екв), щоб прискорити завершення реакції. Розчинники випарюють й осад знову розчиняють у EtOAc й екстрагують 5 % розчином NaHCO3.Органічний шар висушують (MgSO4), 23 UA 113719 C2 5 10 15 20 25 30 35 40 45 50 55 концентрують у вакуумі й осад очищують колонковою хроматографією на силікагелі (елюент: диетил ефір/нафтовий ефір, 1/1, v/v) даючи 21a (Rb=H, 8.8г, 93 %). LC-MS (Спосіб A): Rt 1.38, [M+H] 408. t-бутил складний ефір 3-{2-[4-(Бензилокси)-феніл)]-6,7-дигідро-H-оксазоло[4,5-c]піридин-5іл}-пропіонової кислоти (23a, Ra=Rb=H). Сполуку 21a (Rb=H, 0.9г, 2.21ммоль) розчиняють у дегазованому толуолі (7мл) й у розчин додають карбонат цезію (1.08г, 3.3ммоль), бензиловий спирт (0.46мл, 4.42ммоль, 2екв), 2-ди-t-бутилфосфіно-3,4,5,6-тетраметил-2",4",6’-триізопропил1,1-біфеніл (25.5мг, 0.05 ммоль, 0.02екв) й палладій(II) ацетат (9.92mг, 0.04ммоль, 0.02екв). Суміш перемішують при 70 °C 16год. Суміш охолоджують до кімнатної температури, концентрують у вакуумі й осад очищують колонковою хроматографією на силікагелі (диетил ефір/нафтовий ефір, 3/1, v/v) даючи чистий 23a (Ra=Rb=H, 0.71г, 74 %) у якості твердої білої речовини. LC-MS (Спосіб A): Rt 1.46, [M+H] 435. 3-{2-[4-(Бензилокси)-феніл)]-6,7-дигідро-H-оксазоло[4,5-c]піридин-5-іл}-пропіонова кислота (47). Сполуку 23a (Ra=Rb=H, 0.71г, 1.63ммоль) розчиняють у розчині HCl у 1,4-диоксані (4N, 12мл, 30екв) й суміш перемішують 16 год. при 50 °C. Розчинники випарюють й додають диетил ефір щоб осадити продукт. Білий твердий матеріал фільтрують й сушать у вакуумі даючи 1 сполуку 47 (0.67г, 93 %) у якості твердої білої речовини. H ЯМР (400 МГц, DMSO-d6): δ ч. на млн., 2.92 (t, J=7.1 Гц, 2 H), 3.06-3.31 (bs, 2 H), 3.57 (t, J=7.1 Гц, 2 H), 3.50-3.61 (bs, 1 H), 3.79-4.04 (bs, 1 H), 4.21-4.42 (bs, 1 H), 4.42-4.60 (bs, 1 H), 5.20 (s, 2 H), 7.16 (d, J=8.6 Гц, 2 H), 7.35 (t, J=7.5 Гц, 1 H), 7.41 (t, J=7.5 Гц, 2 H), 7.49 (d, J=7.5 Гц, 2 H), 7.93 (d, J=8.6 Гц, 2 H), 10.31-10.84 (bs, 1 H). LC-MS (Спосіб A): Rt 1.32, [M+H] 379. t-бутил складний ефір 4-[2-(4-Бром-феніл)-6,7-дигідро-H-оксазоло[4,5-c]піридин-5-іл]масляної кислоти (21d, Rb=H). Сполуку 20 (Rb=H, 2.5г, 7.92ммоль) суспендують у DMF (40мл). До цієї суспензії додають карбонат калію (3.8г, 27.7ммоль, 3.5екв) й t-бутил 4-бромбутаноат (5.3г, 23.7ммоль, 3екв). Суміш нагрівають при 80 °C 16год, після цього часу TLC аналіз виявляє завершену реакцію. Суміш концентрують у вакуумі й осад очищують колонковою хроматографією на силікагелі (елюент: диетил ефір/нафтовий ефір, 1/1, v/v до 100 % диетил ефір) одержуючи на виході 21d (Rb=H, 3.15г, 94 %) у якості твердої білої речовини. t-бутил складний ефір 4-{2-[4-(2,3-Дифтор-бензилокси)-феніл)]-6,7-дигідро-H-оксазоло[4,5c]піридин-5-іл}-масляної кислоти (23d, Ra=2,3-diF, Rb=H). Сполуку 21d (Rb=H, 0.6г, 1.42ммоль) розчиняють у дегазованому толуолі (5мл) й у розчин додають карбонат цезію (0.7г, 2.14ммоль), 2,3-дифтор-бензиловий спирт (0.32мл, 2.85ммоль, 2екв), 2-ди-t-бутилфосфіно-3,4,5,6тетраметил-2",4",6’-триізопропил-1,1-біфеніл (16.43мг, 0.03ммоль, 0.02екв) й палладій(II) ацетат (6.39мг, 0.03ммоль, 0.02екв). Суміш перемішують при 70 °C 16год. Суміш охолоджують до кімнатної температури, концентрують у вакуумі й осад очищують колонковою хроматографією на силікагелі (диетил ефір/нафтовий ефір, 2/1, v/v до 100 % диетил ефір) даючи чистий 23d (Ra=2,3-diF, Rb=H, 0.48г, 70 %) у вигляді олії. 4-{2-[4-(2,3-Дифтор-бензилокси)-феніл)]-6,7-дигідро-H-оксазоло[4,5-c]піридин-5-іл}-масляна кислота (57). Сполуку 23d (Ra=2,3-diF, Rb=H, 0.46г, 0.95ммоль) розчиняють у розчині HCl у 1,4диоксані (4N, 14мл, 60екв) й суміш перемішують 16 год. при кімнатній температурі. Розчинники випарюють й додають диетил ефір, щоб осадити продукт. Білий твердий матеріал фільтрують й 1 сушать у вакуумі даючи сполуку 57 (0.45г, 99 %) у якості твердої білої речовини. H ЯМР (400 МГц, DMSO-d6): δ ч. на млн. 2.08 (m., 2 H), 2.41 (t, J=7.0 Гц, 2 H), 3.00-3.29 (m, 2 H), 3.31 – 3.40 (m, 2 H), 3.48-3.70 (bs, 1 H), 3.70-3.96 (bs, 1 H), 4.18-4.38 (m, 1 H), 4.38-4.61 (m, 1 H), 5.26 (s, 2 H), 7.16 (d, J=8.8 Гц, 2 H), 7.19-7.25 (m, 1 H), 7.28 – 7.39 (m, 2 H), 7.94 (d, J=8.8 Гц, 2 H), 10.37-10.88 (bs, 1 H); LC-MS (Спосіб A): Rt 1.16, [M+H] 429. 4-{2-[4-Бензилокси-феніл]-6,7-дигідро-H-оксазоло[4,5-c]піридин-5-іл}-масляна кислота (53). Сполуку 53 одержують подібним способом як описано для синтезу 57 починаючи з 23d 1 (Ra=Rb=H). H ЯМР (400 МГц, DMSO-d6): δ ч. на млн. 2.01-2.17 (m, 2 H), 2.42 (t, J=6.9 Гц 2 H), 3.00-3.30 (m, 2 H), 3.32-3.41 (m, 2 H), 3.50-3.69 (m, 1 H), 3.78-3.96 (m, 1 H), 4.18-4.37 (m, 1 H), 4.43-4.59 (m, 1 H), 5.18 (s, 2 H), 7.14 (d, J=8.8 Гц, 2 H), 7.34 (t, J=7.9 Гц, 1 H), 7.40 (t, J=7.9 Гц, 2 H), 7.47 (d, J=7.9 Гц, 2 H), 7.93 (d, J=8.8 Гц, 2 H), 10.45-10.89 (bs, 1 H); LC-MS (Спосіб A): Rt 1.17, [M+H] 393. 4-{2-[4-(4-Трифторметил-бензилокси)-2-фтор-феніл]-6,7-дигідро-H-оксазоло[4,5-c]піридин-5іл}-масляна кислота (85). Сполука 85 одержують наступним шляхом C починаючи з 2-фтор-41 бром-бензоїл хлориду. H ЯМР (400 МГц, DMSO-d6), δ ч. на млн.: 1.98 – 2.11 (m, 2 H), 2.40 (t, J=7.1 Гц, 2 H), 3.10-3.24 (m, 2 H), 3.30-3.42 (m, 2 H), 3.51-3.66 (bs, 1 H), 3.79-3.97 (bs, 1 H), 4.254.39 (m, 1 H), 4.49-4.65 (m, 1 H), 5.32 (s, 2 H), 6.98-7.13 (m, 2 H), 7.66-7.78 (m, 4 H), 7.93 (t, J=8.6 Гц, 1 H), 9.91-10.46 (bs, 1 H); LC-MS (Спосіб A): Rt 1.77, [M+H] 479. 24 UA 113719 C2 5 10 15 20 25 30 35 40 45 50 55 60 4-{2-[4-(2-Фтор-бензилокси)-2-метил-феніл]-6,7-дигідро-H-оксазоло[4,5-c]піридин-5-іл}масляна кислота (89). Сполуку 89 одержують наступним шляхом C починаючи з 2-метил-41 бром-бензоїл хлориду. H ЯМР (400 МГц, DMSO-d6), δ ч. на млн.: 2.00-2.12 (m, 2 H), 2.41 (t, J=7.1 Гц, 2 H), 2.64 (s, 3 H), 3.05-3.26 (m, 2 H), 3.32-3.42 (m, 2 H), 3.50-3.70 (bs, 1 H), 3.79-3.95 (bs, 1 H), 4.22-4.39 (m, 1 H), 4.48-4.65 (m, 1 H), 5.21 (s, 2 H), 6.97-7.04 (m, 2 H), 7.17-7.27 (m, 2 H), 7.37-7.46 (m, 1 H), 7.56 (dt, J=7.4, 1.4 Гц, 1 H), 7.89 (d, J=8.5 Гц, 1 H), 9.97-10.46 (bs, 1 H); LC-MS (Спосіб A): Rt 1.61, [M+H] 425. 4-{2-[4-(3,4-Дихлор-бензилокси)-2-фтор-феніл]-6,7-дигідро-H-оксазоло[4,5-c]піридин-5-іл}масляна кислота (227). Сполуку 227 одержують наступним шляхом C починаючи з 2-фтор-41 бром-бензоїл хлориду. H ЯМР (600 МГц, DMSO-d6), δ ч. на млн.:1.74 (q, J=7.1 Гц, 2 H), 2.26 (t, J=7.1 Гц, 2 H), 2.55 (t, J=7.1 Гц, 2 H), 2.73-2.78 (m, 2 H), 2.81 (t, J=5.3 Гц, 2 H), 3.43 (br.s, 2 H), 5.21 (s, 2 H), 7.00 (dd, J=8.8, 2.5 Гц, 1 H), 7.11 (dd, J=13.0, 2.5 Гц, 1 H), 7.47 (dd, J=8.4, 2.0 Гц, 1 H), 7.69 (d, J=8.3 Гц, 1 H), 7.76 (d, J=1.9 Гц, 1 H), 7.89 (t, J=8.3 Гц, 1 H), 11.30-12.80 (bs, 1 H); LCMS (Спосіб A): Rt 1.42, [M+H] 479. 4-{2-[4-(2-Фтор-бензилокси)-3-хлор-феніл]-6,7-дигідро-H-оксазоло[4,5-c]піридин-5-іл}масляна кислота (283). Сполуку 283 одержують наступним шляхом C починаючи з 3-хлор-41 бром-бензоїл хлориду. H ЯМР (400 МГц, DMSO-d6): δ ч. на млн. 1.69-1.801.74 (m, , 2 H), 2.27 (t, J=7.2 Гц, 2 H), 2.55 (t, J=7.0 Гц, 2 H), 2.73 – 2.79 (m, , 2 H), 2.81 (t, J=4.6 Гц, 2 H), 3.43 (s, 2 H), 5.32 (s, 2 H), 7.25-7.33 (m, 2 H), 7.42 – 7.50 (m, 2 H), 7.58 – 7.65 (m, 1 H), 7.88 (dd, J=8.7, 2.1 Гц, 1 H), 7.93 (d, J=2.1 Гц, 1 H), 11.0 – 13.0 (bs, 1 H); LC-MS (Спосіб B): Rt 1.99*, [M+H] 445. 4-{2-[4-(4-Хлор-бензилокси)-3-фтор-феніл]-6,7-дигідро-H-оксазоло[4,5-c]піридин-5-іл}масляна кислота (211). Сполуку 211 одержують наступним шляхом C починаючи з 3-фтор-41 бром-бензоїл хлориду. H ЯМР (400 МГц, DMSO-d6) δ ч. на млн.: 1.95-2.06 (m, 2 H), 2.38 (t, J=7.2 Гц, 2 H), 3.09-3.20 (m, 2 H), 3.23 – 3.32 (m., 2 H), 3.44-3.53 (m, 1 H), 3.76-3.86 (m, 1 H), 4.20-4.32 (m, 1 H), 4.43-4.52 (m, 1 H), 5.28 (s, 2 H), 7.43 (t, J=8.6 Гц, 1 H), 7.51 (m, 4 H), 7.76 (m, 2 H),10.6511.02 (bs, 1 H), 12.03-12.77 (bs, 1 H); LC-MS (Спосіб B): Rt 2.03*, [M+H] 445. 2-(4-Бензилокси-феніл)-оксазоло[4,5-c]піридин (25, Ra=Rb=H).До охолодженої (0 °C) суспензії комерційно доступного 4-гідрокси-3-аміно-піридину (14, 19.3г, 175ммоль) у ацетонітрилі (1500мл) додають 4-бензилокси-бензойну кислоту (24, Ra=Rb=H, 40г, 175ммоль), трифенілфосфін (142.5г, 543ммоль, 3.1екв) й трихлорацетонітрил (54.5мл, 543ммоль, 3.1екв). Реакційній суміші дають досягти кімнатної температури й суміш перемішують 16год при 80 °C. Суміш концентрують у вакуумі й осади розчиняють у DCM й промивають з 2N NaOH (3x). Поєднані водні шари екстрагують з DCM й органічні шари сушать (Na 2SO4) даючи сирий 25 (Ra=Rb=H) у вигляді олії, який застосовують на наступному етапі без подальшого очищення. 2-(4-Бензилокси-феніл)-5-метил-4,5,6,7-тетрагідро-оксазоло[4,5-c]піридин (26, Ra=Rb=H). До розчину сирого 25 (Ra=Rb=H, 117ммоль) у DMF (540мл) додають йодметан (29.35мл, 471ммоль, 4г) й суміш перемішують 16год. Суміш концентрують у вакуумі й осад перемішують у EtOAc даючи чвертинну сіль 25 у якості білої твердої речовини, яку розчиняють у метанолі (950мл) й розчин охолоджують до 0 °C. Додають натрій борогідрид (10.2г, 268ммоль, 2.5г) й суміш перемішують при 0 °C 2 год., після цього часу їй дають досягти кімнатної температури й перемішування продовжують 64 год. Додають воду (117мл) й суміш перемішують 5 хвилини. Суміш концентрують у вакуумі, осадs суспендують у 2N NaOH (5мл/ммоль) й екстрагують з DCM (3x). Поєднані органічні шари висушують (Na2SO4) й концентрують даючи сирий 26 (Ra=Rb=H) у якості твердої жовтої речовини який застосовують на наступному етапі без подальшого очищення. 2-(4-Бензилокси-феніл)-4,5,6,7-тетрагідро-оксазоло[4,5-c]піридин (27, Ra=Rb=H). До охолодженого (0 °C) розчину сполуки 26 (Ra=Rb=H, 35.2г, 109.8ммоль) у 1,2-дихлоретані (880мл) додають DIPEA (37.61мл, 219.7ммоль, 2екв) й додають 1-хлоретил хлороформат (35,56мл, 329.6ммоль, 3екв). Суміш перемішують 10 хвилини при 0 °C, після цього часу температуру підвищують до температури рефлюксу. Після 4год, суміші дають досягти кімнатної температури й перемішування продовжують 16год. Суміш концентрують у вакуумі й осад розчиняють у метанол (880мл). Розчин перемішують 16год при кімнатній температурі, після цього часу TLC аналіз виявляє завершену реакцію. Видалення розчинника призводить до виділення сирого 27 (Ra=Rb=H) у загальному виході 20 % based на 25 (Ra=Rb=H). t-бутил складний ефір 3-[2-(4-Бензилокси-феніл)-4,5,6,7-тетрагідро-оксазоло[4,5-c]піридин]2-метил-пропіонової кислоти (28b).До розчину сполуки 27 (Ra=Rb=H, 13.45г, 43.9ммоль) у DMF (270мл) додають 1,8–диазабіцикло[5.4.0]ундец-7-ен (3г) й t-бутилметакрилат (28.54мл, 175.6ммоль, 4екв). Суміш нагрівають при 125 °C 100год. Розчин охолоджують й додають 5 % NaHCO3 (15мл/ммоль) й екстрагують з диетил ефір/EtOAc, 1/1, v/v. Органічний шар промивають 25 UA 113719 C2 5 10 15 20 25 30 35 40 45 50 55 з водою (4x), сушать на MgSO4, концентрують у вакуумі й осад очищують колонковою хроматографією на силікагелі (елюент: диетил ефір/нафтовий ефір, 1/2 до 3/1, v/v) даючи 23b (Ra=Rb=H, 14.58г, 74 %) у вигляді олії. 3-[2-(4-Бензилокси-феніл)-6,7-дигідро-H-оксазоло[4,5-c]піридин-5-іл]-2-метил-пропіонова кислота (146). Сполуку 23b (Ra=Rb=H, 0.45г, 1ммоль) розчиняють у розчині HCl у 1,4-диоксані (4N, 14мл, 60екв) й суміш перемішують 16 год. при кімнатній температурі. Розчинники випарюють й додають диетил ефір щоб осадити продукт. Білий твердий матеріал фільтрують й 1 сушать у вакуумі даючи сполуку 146 (0.43г, 99 %) у якості твердої білої речовини. H ЯМР (400 МГц, DMSO-d6), δ ч. на млн.:1.28 (d, J=7.3 Гц, 3 H), 3.07-3.20 (m, 3 H), 3.26 (dd, J=13.2, 4.9 Гц, 1 H), 3.60 (dd, J=13.2, 7.9 Гц, 1 H), 3.66 (bs, 2 H), 4.34 (br. s., 2 H), 5.18 (s, 2 H), 7.11-7.17 (m, 2 H), 7.31-7.37 (m, 1 H), 7.37-7.43 (m, 2 H), 7.44-7.49 (m, 2 H), 7.85-7.93 (m, 2 H), 10.17-12.85 (bs, 1 H); LC-MS (Спосіб A): Rt 1.48, [M+H] 393. 3-{2-[4-(4-Трифторметил-бензилокси)-феніл]-6,7-дигідро-H-оксазоло[4,5-c]піридин-5-іл}-21 метил-пропіонова кислота (156). Сполуку 156 одержують наступним шляхом C. H ЯМР (400 МГц, DMSO-d6): δ ч. на млн.: 1.29 (d, J=7.2 Гц, 3 H), 3.09-3.21 (bs, 3 H), 3.27 (dd, J=13.1, 5.3 Гц, 1 H), 3.57-3.72 (dd, J=13.1, 7.3 Гц, 1 H), 3.65-3.72 (bs, 2 H), 4.34 (br. s., 2 H), 5.33 (s, 2 H), 7.21 (d, J=8.8 Гц, 2 H), 7.68-7.74 (m, 2 H), 7.75-7.81 (m, 2 H), 7.93 (d, J=8.8 Гц, 2 H), 10.50-12.32 (bs, 1 H); 13 C ЯМР (101 МГц, DMSO-d6), δ Ч. НА МЛН.: 16.35 (q, 1 C), 19.25 (t, 1 C), 35.14 (d, 1 C), 49.04 (br. t., 1 C), 49.76 (br. t., 1 C), 57.23 (t, 1 C), 68.66 (t, 1 C), 115.60 (d, 2 C), 119.65 (s, 1 C), 124.21 (s, 1 3 JCF=272.5 Гц, 1 C), 125.34 (d, JCF=3.6 Гц, 2 C), 127.63 (d, 2 C), 128.05 (d, 2 C), 128.51 (s, 2 JCF=31.7 Гц, 1 C), 128.63 (s, 1 C), 141.51 (s, 1 C), 142.86 (s, 1 C), 160.11 (s, 1 C), 160.76 (s, 1 C), 174.95 (s, 1 C); LC-MS (Спосіб A): Rt 1.82, [M+H] 461. 3-{2-[4-(4-Хлор-бензилокси)-феніл]-6,7-дигідро-H-оксазоло[4,5-c]піридин-5-іл}-2-метил1 пропіонова кислота (157). Сполуку 157 одержують наступним шляхом C. H ЯМР (400 МГц, DMSO-d6), δ ч. на млн.: 1.19 (d, J=7.4 Гц, 3 H), 3.00-3.12 (m, 3 H), 3.18 (dd, J=13.2, 5.3 Гц, 1 H), 3.52 (dd, J=13.2, 7.1 Гц, 1 H), 3.56-3.66 (bs, 2 H), 4.24 (br. s., 2 H), 5.11 (s, 2 H), 7.08 (d, J=9.0 Гц, 2 13 H), 7.35-7.43 (m, 4 H), 7.81 (d, J=9.0 Гц, 2 H), 10.57-11.92 (bs, 1 H); C ЯМР (101 МГц, DMSO-d6), δ Ч. НА МЛН.: 16.44 (q, 1 C), 19.19 (t, 1 C), 35.09 (d, 1 C), 49.1 (br. t., 1 C), 49.6 (br. t., 1 C), 57.17 (t, 1 C), 68.72 (t, 1 C), 115.59 (d, 2 C), 119.50 (s, 1 C), 127.60 (d, 2 C), 128.45 (d, 2 C), 128.52 (s, 1 C), 129.51 (d, 2 C), 132.58 (s, 1 C), 135.69 (s, 1 C), 142.79 (s, 1 C), 160.22 (s, 1 C), 160.80 (s, 1 C), 174.92 (s, 1 C); LC-MS (Спосіб A): Rt 1.72, [M+H] 427. 3-{2-[4-(2,3-Дифтор-бензилокси)-феніл]-6,7-дигідро-H-оксазоло[4,5-c]піридин-5-іл}-масляна 1 кислота (175). Сполуку 175 одержують наступним шляхом C. H ЯМР (400 МГц, DMSO-d6), δч. на млн.: 1.27 (d, J=6.6 Гц, 3 H), 2.5-2.6 (m, 1 H), 2.8-3.1 (m, 3 H), 3.1-3.5 (bs, 2 H), 3.6-3.7 (bs, 1 H), 3.9 – 4.1 (bs, 2 H), 5.28 (s, 2 H), 7.0 – 7.2 (m, 2 H), 7.2-7.3 (m, 1 H), 7.4-7.5 (m, 2 H), 7.9 – 8.0 (m, 2 H), 12.16(br. s., 1 H); LC-MS (Спосіб A): Rt 1.3, [M+H] 429. 3-{2-[4-(4-Трифторметил-бензилокси)-2-фтор-феніл]-6,7-дигідро-H-оксазоло[4,5-c]піридин-51 іл}-2-метил-пропіонова кислота (271). Сполуку 271 одержують наступним шляхом C. H ЯМР (400 МГц, DMSO-d6), δ ч. на млн.: 1.29 (d, J=7.2 Гц, 3 H), 3.06-3.36 (m, 4 H), 3.51-3.68 (m, 2 H), 3.70 – 3.90 (bs, 1 H), 4.18-458 (bs, 2 H), 5.33 (s, 2 H), 7.03 (dd, J=8.7, 2.2 Гц, 1 H), 7.10 (dd, J=12.9, 2.2 Гц, 1 H), 7.65-7.71 (m, 2 H), 7.73-7.77 (m, 2 H), 7.92 (t, J=8.7 Гц, 1 H), 11.01 (br. s., 1 H); LC-MS (Спосіб A): Rt 1.56, [M+H] 479. t-бутил складний ефір 2-(4-Бром-феніл)-6,7-дигідро-H-оксазоло[4,5-c]піридин-5карбоксильної кислоти (28, Rb=H). До суспензії сполуки 20 (Rb=H, 14.3г, 48.2ммоль) у DCM (300мл) додають DIPEA (1екв) й ди-t-бутил дикарбонат (11.59г, 53ммоль, 1.1екв). Суміш перемішують при кімнатній температурі 16год, після цього часу TLC аналіз виявляє завершену реакцію. Суміш концентрують у вакуумі, даючи сиру чисту сполуку 28 (Rb=H), яку застосовують на наступному етапі без подальшого очищення. t-бутил складний ефір 2-(4-Гідрокси-феніл)-6,7-дигідро-H-оксазоло[4,5-c]піридин-5карбоксильної кислоти (29, Rb=H). Сполуку 28 (Rb=H, 9г, 20.4ммоль) розчиняють у 1,4-диоксані (90мл) й у розчин додають гідроксид калію (4.58г, 81ммоль, у 90 мл води) й розчин дегазують. У розчин додають 2-ди-t-бутилфосфіно-2",4",6’-триізопропилбіфеніл (346мг, 0.82ммоль, 0.04екв) й трис-(дибензиліденацетон)-дипалладій(0) (373.5мг, 0.41ммоль, 0.02екв). Суміш перемішують при 80 °C 16год, після цього часу LC-MS аналіз виявляє, що перетворення завершене. Суміш охолоджують до кімнатної температури, розбавляють з EtOAc, підкислюють до pH 6 з 0.1N HCl й екстрагують з EtOAc. Органічні шари висушують на MgSO 4, фільтрують й концентрують у вакуумі. Осад очищують колонковою хроматографією на силікагелі (DCM/MeOH, 97/3, v/v) даючи чисту сполуку 29 (Rb=H, 6г, 83 %). 26 UA 113719 C2 5 10 15 20 25 30 35 40 45 50 55 60 t-бутил складний ефір 2-[4-(4-Трифторметил-бензилокси)-феніл)-6,7-дигідро-H-оксазоло[4,5c]піридин-5-карбоксильної кислоти (30, Ra=4CF3, Rb=H). Сполуку 29 (Rb=H, 6г, 17ммоль) розчиняють у DCM/вода, 2/1, v/v (78мл/ммоль) й до цього розчину додають натрій гідроксид (27мл, 2N, 3 екв). До цієї суміші додають тетрабутиламоній бромід (549мг, 0.1екв) й 4трифторметил-бензил бромід (4.48г, 18.75ммоль, 1.1екв). Суміш перемішують 16год при кімнатній температурі після цього часу LC-MS аналіз виявляє завершену реакцію. Суміш розбавляють з DCM (200мл), шари розділяють й водний шар екстрагують з DCM. Органічні шари висушують на MgSO4, фільтрують й концентрують у вакуумі. Осад очищують колонковою хроматографією на силікагелі (елюент: EtOAc/нафтовий ефір, 1/3) даючи чисту сполуку 30 (Rb=H, 9.0г, 96 %) у вигляді безбарвної піни. 2-[4-(4-Трифторметил-бензилокси)-феніл)-6,7-дигідро-H-оксазоло[4,5-c]піридин(30, Ra=4CF3, Rb=H). Сполуку 30 (9.6г, 18.5ммоль) розчиняють у DCM (150мл) й додають трифтороцтову кислоту (8.5мл, 111ммоль, 6екв). Розчин нагрівають зі зворотнім холодильником 16год, після цього часу TLC аналіз виявляє завершену реакцію. Суміш нейтралізують з 5 % NaHCO3. Суміш екстрагують з DCM (3x) й поєднані органічні шари промивають з розсолом, сушать на Na2SO4 й концентрують у вакуумі, даючи сполуку 27 (Ra=4CF3, Rb=H) яку застосовують на наступному етапі без подальшого очищення. 3-{2-[4-(4-Трифторметоксибензилокси)-феніл]-6,7-дигідро-H-оксазоло[4,5-c]піридин-5-іл}циклобутан карбоксильна кислота (306).Сполуку 27 (Ra=4CF3, Rb=H 0.71г, 1.8ммоль) суспендують у 1,2-дихлоретані (40мл). До цієї суспензії додають 3-оксоциклобутанкарбоксильну кислоту (0.27г, 2.34ммоль, 1.3екв) й натрій триацетокси борогідрид (0.61г, 2.88ммоль, 1.6екв). Суміш перемішують при кімнатній температурі 16год, після цього часу TLC аналіз виявляє завершену реакцію. Розчин розбавляють 5 % NaHCO3 (15мл/ммоль) й суміш екстрагують з DCM. Поєднані органічні шари висушують на Na2SO4, концентрують у вакуумі й осад очищують колонковою хроматографією на силікагелі, одержуючи суміш цис й транс стереоізомерів у співвідношенні 2 до 1. Повторне очищення колонковою хроматографією на силікагелі (DCM/MeOH, 9/1, v/v) призводить до виділення двох збагачених стереоізомерних фракцій. Сполука 307-цис (Rf, 0.2, 0.46г, 51 %, цис/транс = 95/5) й 306-транс (Rf 0.25, 0.21г, 25 %, 1 цис/транс = 5/95). 307-цис: H ЯМР (400 МГц, DMSO-d6): δ ч. на млн. 1.92-2.05 (m, 2 H); 2.26-2.37 (m, 2 H); 2.68 (t, J=4.5 Гц, 2 H); 2.70-2.79 (m, 3 H); 2.89-3.00 (m, 1 H); 3.30 – 3.41 (bs, 2 H); 5.21 (s, 2 H) 7.14 (d, J=8.8 Гц, 2 H); 7.41 (d, J=8.5 Гц, 2 H); 7.61 (d, J=8.5 Гц, 2 H); 7.87 (d, J=8.8 Гц, 2 H); 1 12.15 (br. s., 1 H); 306-транс: H ЯМР (400 МГц, DMSO-d6) δ ч. на млн.: 2.10-2.21 (m, 2 H); 2.222.34 (m, 2 H); 2.67 (t, J=4.8 Гц, 2 H); 2.71-278 (m., 2 H); 2.84 – 2.95 (m, J=9.6 Гц, 1 H); 3.17 (quin, J=7.4 Гц, 1 H); 3.31 – 3.40 (bs, 2 H); 5.21 (s, 2 H); 7.14 (d, J=8.8 Гц, 2 H); 7.41 (d, J=8.5 Гц, 2 H); 7.61 (d, J=8.5 Гц, 2 H); 7.87 (d, J=8.8 Гц, 2 H); 12.20 (br. s., 1 H). LC-MS Rt 1.41, [M+H] = 489. 3-{2-[4-(3,4-Дифторбензилокси)-феніл]-6,7-дигідро-H-оксазоло[4,5-c]піридин-5-іл}-циклобутан карбоксильна кислота (277). Сполуки 278-цис й 277-транс одержують як описано для 306. 2781 цис: H ЯМР (400 МГц, DMSO-d6): δ ч. на млн. 1.93-2.04 (m, 2 H) 2.26-2.36 (m, 2 H) 2.68 (t, J=4.8 Гц, 2 H) 2.70-2.80 (m, 3 H) 2.88-3.00 (m, 1 H) 3.33-3.40 (bs, 2 H) 5.16 (s, 2 H) 7.14 (d, J=8.8 Гц, 2 H) 7.29-7.38 (m, 1 H) 7.47 (dt, J=10.7, 8.4 Гц, 1 H) 7.56 (ddd, J=11.5, 8.0, 2.0 Гц, 1 H) 7.87 (d, J=8.8 Гц, 1 2 H) 12.15 (br. s., 1 H); LC-MS (спосіб A): Rt 1.33, [M+H] = 441; 277-транс: H ЯМР (400 МГц, DMSO-d6): δ ч. на млн. 2.09-2.20 (m, 2 H) 2.23-2.31 (m, 2 H) 2.67 (t, J=4.5 Гц, 2 H) 2.70 – 2.77 (m, 2 H) 2.84-2.93 (m, 1 H) 3.12-3.22 (m, 1 H) 3.32 – 3.39 (bs, 2 H) 5.16 (s, 2 H) 7.14 (d, J=8.8 Гц, 2 H) 7.30-7.37 (m, 1 H) 7.47 (dt, J=10.8, 8.4 Гц, 1 H) 7.56 (ddd, J=11.4, 8.0, 1.9 Гц, 1 H) 7.87 (d, J=8.8 Гц, 2 H) 12.20 (br. s., 1 H);); LC-MS (спосіб A): Rt 1.31, [M+H] = 441. 3-Бром-N-бензилоксикарбоніл-4-піперидон (502). До охолодженого (0 °C) розчину Nбензилоксикарбоніл-4-піперидону (501, 27.3г 117 ммоль) у DCM (3мл/ммоль) додають DIPEA (25.5мл, 146.2ммоль, 1.25г) й триметилсиліл трифторметан сульфонат (25.4мл, 141 ммоль, 1.2г). Суміш перемішують 30 хвилин при 0 °C. Далі, додають N-бромсукцинімід (21.2г, 119.3ммол, 1.02г) й перемішування продовжують 16год при кімнатній температурі. Реакційну суміш промивають з 5 % NaHCO3 й органічний шар висушують (MgSO4) й далі концентрують при зниженому тиску. Одержану олію очищують хроматографією на силікагелі (диетил ефір/ нафтовий ефір, 1/1 до 1/0, v/v, Rf 0.1) одержуючи 502 на виході 90 % у вигляді жовтої олії. Бензил складний ефір 2-(4-Метокси-феніл)-6,7-дигідро-4H-тіазол[5,4-c]піридин-5карбоксильної кислоти (504). Сполуку 502 (2.0г, 6.5ммоль) розчиняють у етанолі (20мл). У розчин додають 4-метокситіобензамід (503, 1.09г, 6.5 ммоль, 1екв) й жовту суміш нагрівають зі зворотнім холодильником 17 год., після цього часу TLC аналіз виявляє повне перетворення 502. Реакційну суміш концентрують у вакуумі й осад розчиняють у EtOAc, промивають 5 % Na2SO4 й органічний шар висушують (MgSO4) й далі концентрують при зниженому тиску. Одержану олію очищують хроматографією на силікагелі (диетил ефір, Rf 0.3) одержуючи сполуку 504 на виході 27 UA 113719 C2 5 10 15 20 25 30 35 40 45 50 55 60 49 % у вигляді безбарвної олії. Сполуки, що мають a Rb замісник можуть бути одержані вибором відповідним чином заміщеного (Rb)- 4-метокситіобензаміду (503). 4-(4,5,6,7-Тетрагідро-тіазол[5,4-c]піридин-2-іл)-фенол 505. Сполуку 504 (18.0г, 47.3ммоль) розчиняють у етанолі (300мл). У охолоджений (-78 °C) розчин додають трибромід бору (5eг, 236ммоль) по краплинах. Після одного часу охолоджений розчин видаляють й суміш перемішують 16год при кімнатній температурі. Реакцію гасять з MeOH, суміш концентрують у вакуумі даючи сполуку 505 у вигляді олії, яку застосовують на наступному етапі без подальшого очищення. Загальна процедура для синтезу сполук 508. Сполуки 508 одержують починаючи зі сполуки 505 подібним способом, як описано для синтезу сполуки 7 й 21 (див. схеми 1-4). У вигляді типового прикладу ми описуємо синтез сполуки 508 (Ra=F, Rb=H, Rc=C2). t-бутил складний ефір 3-[2-(4-(Гідрокси-феніл)-6,7-дигідро-4H-тіазол[5,4-c]піридин-5-іл]пропіонової кислоти (506, Rb=H, Rc=C2). До суспензії 505 (Rb=H, 5.8г, 25.1ммоль) у MeOH (100мл) й DIPEA (5.1мл, 30.1ммоль, 1.2екв) додають t-бутил акрилат (4.4мл, 30.1ммоль, 1.2екв) й суміш нагрівають зі зворотнім холодильником 16год, після цього часу TLC аналіз (диетил ефір, Rf 0.2) виявляє повне перетворення 505. Реакційну суміш концентрують у вакуумі й осад розчиняють у EtOAc, промивають 5 % NaHCO3 й органічний шар висушують (Na2SO4) й далі концентрують при зниженому тиску. Одержану олію очищують хроматографією на силікагелі (диетил ефір) одержуючи сполуку 506 (Rb=H, Rc=C2) на виході 79 % у якості твердого білого матеріалу. t-бутил складний ефір 3-[2-(4-(2-Фтор-бензилокси)-феніл)-6,7-дигідро-4H-тіазол[5,4c]піридин-5-іл]-пропіонової кислоти (507, Ra=2F, Rb=H, Rc=C2). До суспензії 506 (Rb=H, Rc=C2, 0.5г, 1.4ммоль) у DMA (4мл) додають трифеніл фосфін (0.45г, 1.7ммоль, 1.25г), диізопропил азодикарбоксилат (0.33мл, 1.7ммоль, 1.25екв) й 2-фтор бензиловий спирт (0.17мл, 1.56ммоль, 1.15г) й суміш перемішують при кімнатній температурі 16год. Реакційну суміш перемішують у диетил ефірі (150мл) й промивають з 3 × 50 мл води. Поєднані органічні шари висушують (Na2SO4) й далі концентрують при зниженому тиску. Одержану олію очищують хроматографією на силікагелі (диетил ефір/нафтовий ефір, 2/1, v/v) одержуючи сполуку 507 (Ra=2F, Rb=H, Rc=C2) на виході 67 % у якості твердого білого матеріалу.3-[2-(4-(2-Фтор-бензилокси)-феніл)-6,7-дигідро-4H-тіазол[5,4-c]піридин-5-іл]-пропіонова кислота (38, Ra=2F, Rb=H, Rc=C2). Сполуку 507, Ra=2F, Rb=H, Rc=C2, 0.43г, 0.9ммоль) розчиняють у 4N HCl у диоксані (10мл). Суміш перемішують 16год при кімнатній температурі. Суміш концентрують у вакуумі й одержаний твердий матеріал промивають з диізопропил ефіром, даючи 38 у якості твердої білої речовини (Ra=2F, Rb=H, Rc=C2, 0.42г, 97 %). Сполука 1 38: H ЯМР (400 МГц, DMSO-d6), δ ч. на млн. 2.88-3.03 (m, 2H), 3.06-3.14 (m, 1 H), 3.20 (m, 1 H), 3.48 (broad signal, 3 H), 3.73-3.87 (m, 1 H), 4.44 (bd, J=15.9, 6.0 Гц, 1 H), 4.72 (b, J=15.9 Гц, 1 H), 5.22 (s, 2 H), 7.16 (d, J=8.6 Гц, 2 H), 7.23-7.32 (m, 2 H), 7.41-7.49 (m, 1 H), 7.59 (dt, J=7.6, 1.5 Гц, 1 H), 7.87 (d, J=8.6 Гц, 2 H), 11.63 (br. s., 1 H); LC-MS (Спосіб A): Rt 1.3, [M+H] 473. 4-Бром-N-(4-хлор-піридин-3-іл)-бензамід (510). Суміш 4-аміно-3-хлорпіридину (509, 5.9г, 46,2 ммоль), 4-бромбензоїл хлориду (15, 11.15г, 50.8ммоль) й карбонату калію (22.4г, 161.7 ммоль) у ацетонітрилі (150мл) нагрівають зі зворотнім холодильником 24год. Реакційну суміш концентрують у вакуумі, знову розчиняють у DCM й розчин промивають з водою. Органічний шар висушують (MgSO4), концентрують й одержану олію очищують колонковою хроматографією на силікагелі (DCM/MeOH, 99/1, v/v, Rf 0.2) даючи чистий 510 (10.4г, 72 %) у вигляді олії. Коли застосовують заміщену сполуку 15, Rb введений у сполуку 510. 2-(4-Бром-феніл)-тіазол-[4,5c]-піридин (511). Сполуку 510 (10.4г, 33.4ммоль) суспендують у толуолі (400мл) й додають реагент Лавессона (9.4г, 23.4ммоль, 0.7екв) й суміш нагрівають зі зворотнім холодильником 24 год., після цього часу TLC аналіз (DCM/MeOH, 97/3, v/v, Rf 0.7) виявляє завершену реакцію. Суміш концентрують у вакуумі й у олію додають NaHCO3 (5 % розчин, 200мл) й суспензію екстрагують з DCM (3 × 200мл). Поєднані органічні шари висушують над MgSO4, концентрують й олію очищують колонковою хроматографією на силікагелі (DCM/MeOH, 99/1 до 97/3, v/v) даючи чистий 511 (8.7г, 89 %) у вигляді олії. 2-(4-Бензилокси-феніл)-4,5,6,7-тетрагідро-тіазол-[4,5c]-піридин (518). Сполуки 518 одержують починаючи з 511 подібним способом, як описано для синтезу сполуки 27 у схемах 4 й 7. Відповідні хвости Rc можуть бути зв'язані з 518 подібним способом, як описано для сполуки 27. 4-{2-[4-(3,5-Дифтор-бензилокси)-феніл]-6,7-дигідро-4H-тіазол-[4,5c]-піридин-5-іл}–масляна кислота (446, Ra=3,5-F, Rb=H, Rc=C3). Сполуку 519 (Ra=3,5-F, Rb=H, Rc=C3, 0.79г, 1.58ммоль) розчиняють у 4N HCl у диоксані (25мл), перемішують 18год при 50 °C й 70год при кімнатній температурі. Суміш концентрують у вакуумі й одержану олію перемішують у диетил ефірі, 28
ДивитисяДодаткова інформація
Назва патенту англійськоюFused heterocyclic derivatives as s1p modulators
Автори англійськоюSmid, Pieter, Iwema Bakker, Wouter I., Coolen, Hein K.A.C., Sliedregt, Leonardus A.J.M., van Dongen, Maria J.P., Den Hartog, Jacobus, A.J.
Автори російськоюСмид Питер, Ивема Баккер Воутер И., Коолен Гейн К.А.К., Слидрегт Леонардус А.Й.М., ван Донген Мария Й.П., Ден Хартог Якобус А.Й.
МПК / Мітки
МПК: A61K 31/429, C07D 487/04, A61K 31/55, C07D 498/04, C07D 491/04, C07D 513/04, A61K 31/437, A61K 31/4355, A61K 31/4365
Мітки: модулятори, конденсовані, гетероциклічні, похідні
Код посилання
<a href="https://ua.patents.su/54-113719-kondensovani-geterociklichni-pokhidni-yak-modulyatori-s1p.html" target="_blank" rel="follow" title="База патентів України">Конденсовані гетероциклічні похідні як модулятори s1p</a>
Попередній патент: Каучукові суміші
Наступний патент: Привідний пристрій і дробарка
Випадковий патент: Агент для профілактики або зменшення пігментації












