Застосування ферменту фосфоліпіддіацилгліцеринацетилтрансферази як каталізатора в процесі біосинтетичного одержання триацилгліцерину
Номер патенту: 75041
Опубліковано: 15.03.2006
Автори: Стімне Стен, Ленман Маріт, Банас Антоні, Стахль Ульф, Ронне Ханс, Дахльквіст Андерс
Формула / Реферат
Застосування ферменту, що кодується нуклеотидною послідовністю, вибраною з групи, яка включає SEQ ID №1, SEQ ID №3, SEQ ID №4, SEQ ID №5, як каталізатора в ацил-СоА-незалежній реакції переносу жирних кислот з фосфоліпідів в діацилгліцерин в процесі біосинтетичного одержання триацилгліцерину.
Текст
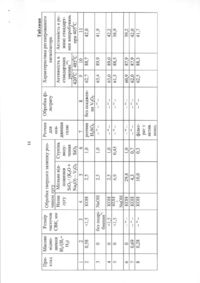
Застосування ферменту, що кодується нуклеотидною послідовністю, вибраною з групи, яка включає SEQ ID №1, SEQ ID №3, SEQ ID №4, SEQ ID №5, як каталізатора в ацил-СоАнезалежній реакції переносу жирних кислот з фосфоліпідів в діацилгліцерин в процесі біосинтетичного одержання триацилгліцерину. Даний винахід стосується виділення, ідентифікації і характеристики рекомбінантних молекул ДНК, що кодують ферменти, які каталізують перенос жирних кислот від фосфоліпідів до діацилгліцерину в біосинтетичному шляху одержання триацилгліцерину. Триацилгліцерин (ТАГ) є найбільш розповсюдженим у природі джерелом енергії, що має ліпідну основу. Вважається, що основний шлях синтезу ТАГ включає три послідовних переноси ацильної групи від ацил-СоА до гліцеринового скелету [1, 2]. Протягом багатьох років ацил-СоА: діацилгліцерин ацилтрансфераза (ДАГАТ), що каталізує реакцію переносу третьої ацил-групи, вважалася єдиним ферментом, який приймає участь у синтез ТАГ. Він переводить діацилгліцерин (ДАГ) із синтезу ліпіду мембрани в ТАГ [2]. Гени, що кодують цей фермент, були недавно ідентифіковані як у мишей [3], так і в рослинах [4, 5], і було показано, що закодовані білки аналогічні ацил-СоА: холестерин ацилтрансферазі (АХАТ). Також нещодавно повідомлялося, що в масляному грибі Моrtierella ramanniana існує інша ДАГАТ, яка не корелює ні з ДАГАТ миші, ні із сімейством генів АХАТ чи іншим відомим геном [6]. Даний винахід відноситься до нового типу ферментів і генів для трансформації, що кодують ці ферменти. Більш конкретно, винахід стосується до використання генів, що кодують не описаний раніше тип ферментів, тут і далі позначених як фосфоліпід: діацилгліцерин ацилтрансферази (ФДАТ), причому ці ферменти каталізують ацил-СоАнезалежну реакцію. Зазначений тип генів, експресується окремо в трансгенних організмах, збільшить загальну кількість масла (триацилгліцеринів), виробленого в клітині. При експресії в трансгенних організмах гени ФДАТ у комбінації з геном для синтезу рідкої жирної кислоти підвищать рівень рідких жирних кислот у триацилгліцеринах. У світі існує значний інтерес до одержання хімічної сировини, такої як жирні кислоти, для промислових цілей з поновлюваних рослинних ресурсів, а не з непоновлюваних нафтопродуктів. Ця концепція має велику привабливість для виробни (19) UA (11) 75041 (13) C2 (21) 2001107429 (22) 28.03.2000 (24) 15.03.2006 (86) PCT/EP00/02701, 28.03.2000 (31) 99106656.4 (32) 01.04.1999 (33) EP (31) 99111321.8 (32) 10.06.1999 (33) EP (31) 60/180,687 (32) 07.02.2000 (33) US (46) 15.03.2006, Бюл. № 3, 2006 р. (72) Дахльквіст Андерс, SE, Стахль Ульф, SE, Ленман Маріт, SE, Банас Антоні, SE, Ронне Ханс, SE, Стімне Стен, SE (73) БАСФ ПЛАНТ САЄНС ГМБХ, DE 3 75041 4 ків і споживачів на основі консервації ресурсів і кислоти з ланцюгом середньої довжини, з фосфозабезпечує значні можливості для розвитку нових ліпідів рослин. промислових культур для сільського господарства. Було показано, що ця ферментативна реакція Iснує різноманітна безліч рідких жирних кислот наявна в мікросомальних препаратах їх хлібопев оліях з диких видів рослин, що добре охарактекарських дріжджів (Saccharomyces cerevisiae). Даризовані. Багато які з цих кислот мають промислоний винахід далі стосується ферменту, що вклювий потенціал, що привело до інтересу до одочає амінокислотну послідовність, наведену нижче машнювання значимих видів рослин для під позначенням SEQ ID №2, чи до його функціозабезпечення агропромислового виробництва коннального фрагмента, похідного, алелі, чи гомологу кретних жирних кислот. ізоферменту. Був отриманий так званий "нокаутРозвиток методів генної інженерії разом з ний" мутант дріжджів, дефектний за відповідним більш глибоким розумінням біосинтезу рідких жиргеном, і було показано, що в мікросомальних мемних кислот уможливлює перенос генів, що кодують бранах мутанта цілком повністю відсутня активключові ферменти, які беруть участь у синтезі конність ФДАТ. У такий спосіб було доведено, що покретної жирної кислоти, з диких видів в одомашнерушений ген кодує фермент ФДАТ (послідовності ні олійні культури. Таким шляхом окремі жирні киSEQ ID №1 і 2). Крім того, цей фермент ФДАТ хаслоти можна одержувати з високим ступенем рактеризується амінокислотною послідовністю, чистоти і у великих кількостях при помірній вартоспозначеною далі SEQ ID №2, що містить ліпазну ті. ділянку консервативної послідовності FXKWVEA. В усіх культурах типу рапсу, соняшника, олійЦей винахід також стосується ферменту, що ної пальми і т.д. олія (тобто триацилгліцерини) є включає амінокислотну послідовність, позначену найбільш цінним продуктом насіння або плодів, а SEQ ID №1а, 2b чи 5а, чи його функціонального інші компоненти, такі як крохмаль, білок і волокно фрагменту, похідного, алелі, чи гомолога ізофервважаються побічними і менш цінними продуктамента. ми. Збільшення кількості олії відносно ваги за раДалі були ідентифіковані гени і/чи білки, що віхунок інших сполук олійної культури збільшить дповідають за раніше не відому функцію, і вони цінність цієї культури. Як би роботу генів, що регурозглядаються як складові сутності даного виналюють напрямок відновленого вуглецю у виробниходу. Був ідентифікований ген з цтво олії, можна було регулювати вбік посилення, Schizosaccharomyces pombe, SPBC776.14 (посліклітина акумулювала б більшу кількість олії за радовність SEQ ID №3), і передбачувана відкрита хунок інших продуктів. Такі гени можна використорамка зчитування SPBC776.14, САА22887 (послівувати не тільки в клітинах, що продукують велику довність SEQ ID №13). Далі були ідентифіковані кількість олії, таких як клітини олійних культур, але геномні послідовності Arabidopsis thaüana (посліпри їхній допомозі можна також індукувати значне довності SEQ ID №4, 10 і 11), що кодують передпродукування олії в культурах з низьким чи помірбачувані білки, а також були ідентифіковані пеним її вмістом, наприклад у сої, вівсі, кукурудзі, редбачувана відкрита рамка зчитування ААС80628 картоплі, цукровому буряку, ріпі, а також у мікроорз локусу АС 004557 А. thaliana (послідовність SEQ ганізмах. ID №14) і передбачувана відкрита рамка зчитуванБагато які з рідких жирних кислот, що предстаня AAD10668 з локусу АС 003027 А. thaliana (посвляють інтерес, наприклад, жирні кислоти з ланлідовність SEQ ID №15). цюгом середньої довжини, гідрокси- жирні кислоти, Також були ідентифіковані частково відсеквеепокси- жирні кислоти й ацетилен-жирні кислоти, нований кДНК клон з Neurospora crassa (послідовза фізичними властивостями сильно відрізняються ність SEQ ID №9) і клон Zea mays, що містить EST від звичайних жирних кислот рослин. У даному (Expressed Sequence Tag -маркерна експресована винаході виявлено, що у видах рослин, які в припослідовність), (послідовність SEQ ID №7) і відпороді акумулюють рідкі жирні кислоти в олії насіння відна передбачувана амінокислотна послідовність (тобто в триацилгліцерині), ці кислоти в мембран(SEQ ID №8). Крім того, були ідентифіковані два них (фосфо)ліпідах насіння відсутні чи присутні в кДНК клони, EST клон Arabidopsis thaiiana (послідуже невеликих кількостях. Низька концентрація довність SEQ ID №5 і відповідна передбачена аміцих кислот у мембранних ліпідах, ймовірно, обунокислотна послідовність SEQ ID №6) і EST клон мовлює певну функцію мембрани і, таким чином, Lycopersicon esculentum (послідовність SEQ ID певні функції клітини. Одним з аспектів винаходу є №12). Далі, ферменти, позначені ФДАТ, що кодуте, що насіння трансгенних культур можна змусити ються амінокислотною послідовністю з групи, що накопичувати великі кількості рідких жирних кисвключає послідовності під номерами SEQ ID №2а, лот, якщо ці кислоти ефективно видаляються з 3а, 5b, 6 і 7b, що містять ліпазну ділянку ліпідів мембрани і направляються в триацилгліцеFXKWVEA, розглядаються як такі, що складають рини насіння. суть винаходу. Крім того, фермент, що включає Винахідниками виявлений новий клас фермеамінокислотну послідовність, яка кодується нуклентів рослин, каталізуючих перенос жирних кислот отидною послідовністю, її частиною, похідним, від фосфоліпідів до діацилгліцерину в синтезі триалелем чи гомологом із групи, що включає посліацилгліцерину через ацил-СоА-незалежну реакдовності під номерами SEQ ID №1, 1b, 3, 3b, 4, 4а, цію, також виявлено, що ці ферменти (фосфоліпід: 4b, 5, 5b, 6b, 7, 8b, 9, 9b, 10, 10b, 11, 11b чи 12 чи діацилгліцерин ацилтрансферази, скорочено функціональний фрагмент, похідне, алель, гомоФДАТ) беруть участь у видаленні гідроксильовалог або ізофермент амінокислотної послідовності, них, епоксигенованих жирних кислот, а також, мощо кодує фермент, складають суть винаходу. жливо, інших рідких жирних кислот, таких як жирні Під функціональним фрагментом даного фер 5 75041 6 менту розуміють будь-яку поліпептидну послідовна 40%, переважно принаймні на 50-60%, краще ність, що виявляє специфічну ферментну активпринаймні на 70%, 80% чи 90%, і краще принаймні ність фосфоліпід: діацилгліцерин ацилтрансферана 95%, 96%, 97%, 98% або 99% чи більше гомози (ФДАТ). Довжина функціонального фрагмента логічна нуклеотидній послідовності під номером SEQ ID №1. може варіювати в межах від 660 10 амінокислот Усі вищенаведені визначення вірні для амінодо 660 250 амінокислот, переважно від 660 50 до кислотних послідовностей і функціональних фер660 100 амінокислот, причому "базове число" 660 ментів і можуть бути легко трансформовані фахівамінокислот відноситься в даному випадку до поцями в даній області техніки. ліпептидного ланцюга ферменту ФДАТ (послідовПід ізоферментами розуміють ферменти з таність SEQ ID №2), що кодується нуклеотидною кою ж чи подібною субстратною специфічністю і/чи послідовністю SEQ ID №1. Отже, "базове число" каталітичною активністю, але іншою первинною функціональної повної довжини ферменту може структурою. варіювати в залежності від кодуючої нуклеотидної З одного боку, даний винахід спрямований на послідовності. послідовності нуклеїнових кислот, що кодують Під частиною даної нуклеотидної послідовносФДАТ. Сюди відносяться як послідовності, що коті розуміють будь-яку нуклеотидну послідовність, дують біологічно активні ФДАТ, так і послідовності, що кодує поліпептид, який має специфічну активщо використовуються як зонди, вектори для транність фосфоліпід: діацилгліцерин ацилтрансферасформації або проміжних конструкцій при клонузи (ФДАТ). Довжина частини нуклеотидної посліванні. Кодуюча ФДАТ послідовність може кодувати довності може варіювати в широкому діапазоні повну чи часткову послідовність, в залежності від кількох сотень нуклеотидів, ґрунтуючись на кодуюцілей. Враховуються повна геномна послідовність чій області гена, чи висококонсервативної послідоабо її частина, послідовність кДНК, попередник вності. Наприклад, довжина варіює в межах від ФДАТ і зріла ФДАТ. 1900 10 до 1900 1000 нуклеотидів, переважно від Далі винахід включає нуклеотидну послідов1900 50 до 1900 700, краще від 1900 100 до ність, обрану з групи, що складаться з послідовно1900 500 нуклеотидів, причому "базове число" стей під номерами SEQ ID №1, 1b, 3, 3b, 4, 4а, 9b, 1900 нуклеотидов відповідає в даному випадку 10, 10b або 11 чи їхніх частин, похідних, алелей чи кодуючій нуклеотидній послідовності ферменту гомологів. Винахід стосується також неповної нукФДАТ SEQ ID №1. Отже, "базове число" функціолеотидної послідовності, що відповідає нуклеотинальної повної довжини гена може варіювати. дній послідовності повної довжини з групи посліПід алельним варіантом даної нуклеотидної довностей під номерами SEQ ID №1, 5, 5b, 6b, 7, послідовності розуміють будь-яку іншу нуклеотид8b, 9, 11b чи 12 або їхніх частин, похідних, алелей ну послідовність, що кодує поліпептид з функціочи гомологів. Крім того, нуклеотидна послідовність, нально еквівалентною активністю. До алелей відщо включає послідовність, принаймні, на 40% гоносяться, як варіанти даної нуклеотидної мологичну нуклеотидній послідовності з групи поспослідовності, які зустрічаються в природі, так і лідовностей під номерами SEQ ID №1, 1b, 3, 3b, 4, синтетичні нуклеотидні послідовності, отримані за 4а, 4b, 5, 5b, 6b, 7, 8b, 9, 9b, 10, 10b, 11, 11b чи 12, методами, відомими в даній області техніки. Також також розглядається в обсязі винаходу. розглядаються змінені нуклеотидні послідовності, Винахід стосується також генноінженерної що приводять до ферменту зі зміненою активністю конструкції, що включає описані нуклеотидні посі/чи регуляцією або стійкому до специфічних інгібілідовності даного винаходу, оперативно зв'язаної торів. Даний винахід далі включає природні чи з гетерологічною нуклеїновою кислотою. Термін синтетичні мутації раніше виділеної нуклеотидної "оперативно зв'язана" означає послідовну органіпослідовності. До цих мутацій відносяться заміна, зацію, наприклад із промотору, що кодує послідододавання, делеція, інверсія або вставка одного вності, термінатора і/чи інших регуляторних елечи більше нуклеотидів. ментів, причому кожен елемент може виконувати Під гомологічною нуклеотидною послідовністю свою функцію при експресії нуклеотидної послідорозуміють комплементарну послідовність і/чи посвності. лідовність, що специфічно гібридизується з даної Далі, в об'ємі винаходу розглядається вектор, нуклеотидною послідовністю. Гібридизовані посліщо включає описану нуклеотидну послідовність довності включають подібні нуклеотидні послідовданого винаходу. Сюди відноситься як вектор ексності з групи ДНК чи РНК, що специфічно взаємопресії, так і вектор, що включає додатково ген седіють з даними нуклеотидними послідовностями в лективного маркера і/чи нуклеотидні послідовності принаймні помірно жорстких умовах, відомих у для реплікації в клітині хазяїна і/чи інтеграції в геданій області техніки. Кращим необмежуючим прином клітини хазяїна. кладом жорстких умов гібридизації є наступні: гібЗ іншого боку, даний винахід стосується споридизація в 6 X розчині хлориду натрію/цитрату собу одержання ФДАТ у клітині хазяїна або її понатрію (SSC) при температурі близько 45° з настутомстві, включаючи генетично змінене насіння пним відмиванням один чи більше разів у розчині олійних культур, дріжджі і цвілеві гриби або будь0.2XSSC, 0.1% SDS при 50-60°. Також сюди відноякі інші накопичуючі олію організми, шляхом екссяться короткі нуклеотидні послідовності, наприпресії конструкції в клітині. Клітини, що містять клад довжиною від 10 до 30 нуклеотидів, переважФДАТ як результат продукування кодуючої ФДАТ но від 12 до 15 нуклеотидів. Також сюди послідовності, також розглядаються як такі, що відносяться праймери і гібридизаційні зонди. складають суть винаходу. Гомологічна послідовність, що складає суть Далі винахід включає трансгенну клітину або даного винаходу - це послідовність, що принаймні 7 75041 8 організм, що містять описану нуклеотидну посліЗ приведених тут специфічних послідовностей довність і/чи описану генноінженерну конструкцію можна одержати інші ФДАТ. Крім того, очевидно, і/чи описаний вектор. Далі предметом даного вищо можна одержати природні і синтетичні ФДАТ, находу є трансгенна клітина або організм, які яввикористовуючи модифіковані амінокислотні посляють собою еукаріотичну клітину або організм. лідовності і вихідні матеріали для моделювання Кращими трансгенними клітинами або організмом синтетичних білків із приведених як приклад ФДАТ є дріжджова клітина або клітина чи рослини або і з ФДАТ, які одержують при використанні приверослина. Даний винахід далі включає описану дених як приклад послідовностей. Модифіковані трансгенну клітину або організм зі зміненим біосиамінокислотні послідовності включають послідовнтетичним шляхом одержання триацилгліцерина. ності, що були мутовані, укорочені, збільшені чи Трансгенна клітина або організм, що мають змінезмінені подібним чином, у тому випадку, якщо посний вміст олії також включені в об'єм винаходу. лідовності були частково або повністю синтезоваДалі винахід включає трансгенну клітину або ні. Послідовності, що фактично отримані з препаорганізм, в яких активність ФДАТ змінена. Ця зміратів рослин або ідентичні їм, або кодують нена активність ФДАТ характеризується зміною в ідентичні білки, незалежно від способу, використаекспресії гена, каталітичної активності і/чи регуляного для одержання білка або послідовності, розгції активності ферменту. Більш того, трансгенна лядаються як отримані природним шляхом. клітина або організм включені в даний винахід, Далі, для пошуку і виявлення "гомологічних" чи причому змінений біосинтетичний шлях одержання "взаємозв'язаних" ФДАТ з різних рослинних і міктриацилгліцерину характеризується запобіганням робних джерел можна використовувати нуклеотинагромадження небажаних жирних кислот у ліпідні послідовності-зонди (ДНК чи РНК) цього винадах мембрани. З іншого боку, цей винахід стосуходу. ється також способів використання послідовності Далі, очевидно, що фахівець у даній області ДНК, що кодує ФДАТ, для збільшення вмісту олії в техніки за допомогою інформації, приведеної в клітині. даний заявці, може ідентифікувати активність Iнший аспект винаходу стосується переводу ФДАТ у будь-якому організмі, очистити фермент з великих кількостей рідких жирних кислот у триацицією активністю і у такий спосіб ідентифікувати лгліцерин, синтезований у клітині, шляхом вве"негомологічну" амінокислотну послідовність, що дення послідовності ДНК, що кодує ФДАТ, яка кодує такий фермент. специфічно видаляє ці жирні кислоти з ліпідів Даний винахід можна, власне кажучи, охаракмембрани і переводить їх у триацилгліцерин. Клітеризувати наступними аспектами: тини рослин з такою модифікацією також розгля1. Використання гена ФДАТ (геномний клон даються в об'ємі винаходу. або кДНК) для трансформації. Далі, винахід включає спосіб одержання триа2. Використання молекули ДНК за п.1, де зацилгліцерину, що включає вирощування описаної значена ДНК використовується для трансформації трансгенної клітини або організму в умовах, при будь-якого організму з метою експресування в яких експресуються описана нуклеотидна послідоданому організмі й одержання активного рекомбівність і при яких в описаних трансгенних клітинах нантного ферменту ФДАТ для збільшення вмісту працює зазначений фермент, що каталізує переолії в організмі. нос жирних кислот від фосфоліпідів до діацилглі3. Використання молекули ДНК за п.1, де зацерину з утворенням триацилгліцерину. значена ДНК використовується для Крім того, триацилгліцерини, які одержують трансформації будь-якого організму з метою описаним вище способом, включені в область дазапобігання нагромадження небажаних жирних ного винаходу. кислот у ліпідах мембрани. Крім того, об'єктом винаходу є використання 4. Використання за п.1, де зазначений ген описаної нуклеотидної послідовності і/чи описаноФДАТ використовується для трансформації трансго ферменту для одержання триацилгліцерину і/чи генних накопичуючих олію організмів, розроблених триацилгліцеринів з рідкими жирними кислотами. для одержання будь-якої рідкої жирної кислоти, Використання описаної нуклеотидної послідовносяка є шкідливою при вмісті у великих кількостях у ті і/чи описаного ферменту для трансформації ліпідах мембрани, до таких кислот відносяться будь-якої клітини або організму з метою експресужирні кислоти з ланцюгом середньої довжини, гідвання в цій клітині або організмі, що приводить до роксильовані жирні кислоти, епоксигеновані жирні зміненого, переважно зрослого, вмісту олії в клітикислоти й ацетиленові жирні кислоти. ні або організмі, розглядається в об'ємі даного 5. Використання за п.1, де зазначений ген винаходу. ФДАТ використовується для трансформації оргаФДАТ цього винаходу включає будь-яку амінонізмів, і де зазначені організми схрещують з іншикислотну послідовність, таку як білок, поліпептид ми накопичуючими олію організмами, розроблеабо пептидний фрагмент, одержану з мікроорганіними для одержання будь-якої рідкої жирної зму, тваринного чи рослинного джерела, і виявляє кислоти, яка є шкідливою при вмісті у великих кільздатність каталізувати одержання триацилгліцекостях у ліпідах мембрани, до таких кислот віднорину з фосфоліпіду і діацилгліцерину в умовах сяться жирні кислоти з ланцюгом середньої довроботи ферменту. Під "умовами роботи ферменту" жини, гідроксильовані жирні кислоти, розуміють будь-які необхідні умови, можливі в наепоксигеновані жирні кислоти й ацетиленові жирні вколишнім середовищі (наприклад, такі фактори як кислоти. температура, pH, відсутність інгібуючих речовин), 6. Використання за п.1, де фермент, що кодущо дозволяють ферменту функціонувати. ється зазначеним геном ФДАТ чи кДНК, кодує 9 75041 10 ФДАТ з вираженою ацил-специфічністю. 21. Білок за п.20, позначений як фосфоліпід: 7. Використання за п.1, де зазначений ген або діацилгліцерин ацилтрансфераза. кДНК, що кодують ФДАТ, отримані з 22. Білок за п.21 з вираженою ацилSaccharomyces cerevisae або містять нуклеотидні специфічністю. послідовності, що кодують амінокислотні послідо23. Білок за п.22 з амінокислотною послідовнівності, які на 30% чи більше ідентичні амінокислостю, приведеною далі під номерами SEQ ID №2, тній послідовності ФДАТ, приведеній під номером 13, 14 чи 15 (і білки, що кодуються повнорозмірниSEQ ID №2. ми чи частковими генами, приведеними далі під 8. Використання за п.1, де зазначений ген або номерами SEQ ID №1, 3, 4, 5, 7, 9, 190, 11 чи 12) кДНК, що кодують ФДАТ, отримані з чи амінокислотна послідовність, що принаймні на Saccharomyces cerevisae чи містять нуклеотидні 30% гомологична зазначеній амінокислотній поспослідовності, що кодують амінокислотні послідолідовності. 24. Білок за п.23, виділений з вності, які на 40% чи більше ідентичні амінокислоSaccharomyces cerevisae. тній послідовності ФДАТ, приведеній під номером Загальні методи: SEQ ID №2. Дріжджові штами і плазміди. У роботі викорис9. Використання за п.1, де зазначений ген або товували дикі штами дріжджів FY1679 (МАТ his3кДНК, що кодують ФДАТ, отримані з 200 teu2- 1 trp1- 6 ura3-52) чи W303-1A (MAT Saccharomyces cerevisae чи містять нуклеотидні ADE2-1 can1-100 his3-11,15 leu2-3,112 trp1-1 ura3послідовності, що кодують амінокислотні послідо1) (7). Штам FVKT004-04C(AL) з порушенням вності, які на 60% чи більше ідентичні амінокислоYNR008w::KanMX2, співгенний штаму FY1679, був тній послідовності ФДАТ, приведеній під номером отриманий з колекції Euroscarf (8). Фрагмент довSEQ ID №2. жиною 2751 пари основ, що містить ген YNR008w, 10. Використання за п.1, де зазначений ген із фланкуючою ДНК у 583 пари основ з 5' кінця і або кДНК, що кодують ФДАТ, отримані з 183 пари основ з 3' кінці був ампліфікований з геSaccharomyces cerevisae чи містять нуклеотидні номною ДНК W303-1A при використанні Taqпослідовності, кодують амінокислотні послідовносполімерази і послідовностей 5'ті, на 80% чи більше ідентичні амінокислотній посTCTCCATCTTCTGCAAAACCT-3' і 5'лідовності ФДАТ, приведеній під номером SE ID CCTGTCAAAAACCTTCTCCTC-3' у якості прайме№2. рів. Продукт ПЦР очищали за допомогою елект11. Використання за п.1, де зазначений ген рофорезу в агарозному гелі і клонували за сайтом або кДНК, що кодують ФДАТ, отримані з рослин EcoRI у плазміду pBluescript (pbtuescript-pdat). Для або містять нуклеотидні послідовності, що кодують дослідження комплементації клонований фрагамінокислотні послідовності, які на 40% чи більше мент вирізували з pBluescript за сайтами Hindlllідентичні амінокислотній послідовності ФДАТ з Sac і клонували за сайтами Hindlll-Sac у плазміду Arabidopsis thaliana чи білку, що кодується повноpFL39 [9], отримана плазміда позначена як pUS1. розмірною копією часткових кДНК клонів Zea mays, Для зверхекспресії гена ФДАТ фрагмент EcoRI Lycopericon escutentum чи Neurospora crassa. довжиною 2202 пари основ із плазміди pBluescript, 12. Трансгенні накопичуючі олію організми, що що містить тільки 24 пари основ 5'-фланкуючої включають у свій геном ген ФДАТ, перенесений ДНК, клонували за сайтом BamHI у вектор експреметодом рекомбінантних ДНК чи соматичною гібсії GAL1-TPK2 pJN92 [12], отримана конструкція ридизацією. позначена як pUS4. 13. Трансгенні накопичуючі олію організми за Мікросомальні препарати. Мікросоми з насіння п.12, що включають у свій геном ген ФДАТ, що має соняшника, що розвиваються, (Helianthus annuus), особливу субстратну специфічність до рідких жирRicinus communis i Crepis palaestina одержували за них кислот, і ген зазначеної рідкої жирної кислоти. способом, описаним Stobart і Stymne [11]. Для 14. Трансгенні організми за п. 12 чи 13 із групи, одержання мікросом дріжджів 1г дріжджових клітин що включає грибки, рослини і тварин. (свіжа вага) ресуспендували у 8мл крижаного бу15. Трансгенні організми за п. 12 чи 13 із групи, фера (20мМ Tris-Cl, pH 7.9, 10мМ МgСІ2, 1мМ ЭДщо включає сільськогосподарські рослини. ТА, 5% (об'ємних) гліцерину, 1мМ ДТТ, 0.3Μ суль16. Трансгенні організми за п.12 чи 13 із групи, фату амонію) у скляній пробірці об'ємом 12мл. У що включає сільськогосподарські рослини, причоцю пробірку додавали 4мл скляних бусин (діаметр му зазначений ген ФДАТ експресується під конт0.45-0.5мм), потім пробірку інтенсивно струшували ролем промотору, специфічного для органу нако(3 60с) у гомогенізаторі клітин MSK (В. Braun пичення. Melsungen AG, Німеччина). Гомогенізовану су17. Трансгенні організми за п.12 чи 13 із групи, спензію центрифугували при 20000 g протягом що включає сільськогосподарські рослини, причо15хв при 6°С, отриманий супернатант знову му зазначений ген ФДАТ експресується під контцентрифугували при 100000 g протягом 2г при ролем промотору з насіння. 6°С. Осад, отриманий при 100000 g, ресуспенду18. Олії з організмів за п. 12-17. вали в 0.1Μ розчині фосфату калію (pH 7.2) і збе19. Спосіб зміни ацил-специфічності ФДАТ рігали при -80°С. шляхом зміни нуклеотидної послідовності кодуюДалі цей препарат названий неочищеною мікчого гена, що зустрічається в природі, і, як насліросомальною дріжджовою фракцією. док такої зміни - одержання гена, що кодує ферЛіпідні субстрати. Радіоактивно мічені риціномент із новою ацил-специфічністю. леїнову (12-гідрокси-9-октадециленову) і верноле20. Білок, що кодується молекулою ДНК за п.1 ву (12,13-епокси-9-октадециленову) кислоти одерчи його функціональний фрагмент. жували ферментативно з [1-14С]олеїнової кислоти і 11 75041 12 [1-14С]лінолевої кислоти відповідно шляхом інкудопомогою хлороформу і розділяли за допомогою бації з мікросомальними препаратами з Ricinus тонкошарової хроматографії в суміші гексаcommunis і Crepis palaestina, відповідно [12]. Синна/диетилового ефіру/оцтової кислоти (35:70:1.5) тез фосфатидилхолінів (ФХ) чи фосфатидилетана пластинах із силікагелем 60 (Merck). Радіоактиноламінів (ФЕ) з 14С-міченими ацильними групами вні ліпіди виявляли і кількісно оцінювали на пласв положенні sn-2 проводили при використанні або тинах за допомогою електронної радіоавтографії ферментативного [13], або синтетичного [14] аци(instant tmager, Packard, US). лювання [14С]олеїнової, [14С]рицинолеїнової чи Культивування дріжджів. Дріжджові клітини [14С]вернолевої кислот. Діолеїл-ФХ, мічені за повирощували при 28°С у роторному шейкері в рідложенням sn-1, синтезували з sn-1-[14С]олеїл-лізокому середовищі YPD (1% дріжджового екстракту, ФХ і неміченої олеїнової кислоти, як описано в 2% пептону, 2% глюкози), синтетичному середороботі [14]. Sn-1-олеїл-sn-2-[14С]рицинолеїл-ДАГ вищі [18], що містить 2% (об'єм/ об'єм) гліцерину і синтезували з ФХ дією фосфоліпази С типу XI з Ε 2% (об'єм/об'єм) етанолу, чи в мінімальному сереCereus (Sigma Chemical Co.), як описано в роботі довищі [19], що містить 16 г/л гліцерину. [15]. Моновернолеїл- і дивернолеїл-ДАГ синтезуДаний винахід далі характеризується наступвали з ТАГ, екстрагованих з насіння Euphorbia ними прикладами, що не є обмежуючими: lagascae, при використанні ТАГ-ліпази (Rizhopus Aцил-СоА-незалежнйй синтез ТАГ мікросомаarrhizuz, Sigma Chemical Co.), як описано раніше ми олійного насіння. В олійному насінні виявляють [16]. Монорицинолеїл-ТАГ синтезували за тим же велику кількість рідких жирних кислот [20]. Багато способом при використанні ТАГ, екстрагованого з які з цих жирних кислот, такі як рицинолеїнова [21] касторових бобів. i вернолева [22] кислоти, синтезуються при викоЛіпідний аналіз. Для визначення загальної ліристанні в якості безпосереднього попередника підного складу дріжджів клітини збирали з 40мл фосфатидилхоліну (ФХ) з олеїловою чи линолерідкої культури, розбивали в шейкері зі скляними вою групами, етерифікованими за sn-2бусинами й екстрагували в хлороформ, як описано положенням, відповідно. Однак, хоча ФХ може Btigh і Dyer [17], потім проводили поділ за допомобути субстратом для синтезу рідких жирних кислот гою тонкошарової хроматографії в суміші гексаі є основним мембранним ліпідом в насінні, рідкі на/диетилового ефіру/оцтової кислоти (80:20:1) жирні кислоти рідко виявляють у мембранах. Запри використанні попередньо покритих пластин із мість цього вони в основному включаються в ТАГ. силікагелем 60 (Merck). Області ліпідів виявляли Таким чином, в олійному насінні, що накопичує швидкою експозицією з парами I2 і ідентифікували рідкі жирні кислоти, повиннен існувати механізм за допомогою відповідних стандартів. З пластин ефективного і селективного переносу цих рідких вирізували полярні ліпіди, стерінові ефіри і триаацильних груп від ФХ до ТАГ. Реакція переносу цилгліцерини, а також залишені мінорні ліпідні біохімічно охарактеризована для насіння касторокласи, що називаються іншими ліпідами. Метилові вих бобів (Ricinus communis) і Crepis раlаеstinа, ефіри жирних кислот одержували нагріванням сурослин, що накопичують великі кількості рисинолехого вирізаного матеріалу при 85°С протягом 60хв їнової і вернолевої кислот відповідно, і соняшника у 2% (об'єм/об'єм) сірчаній кислоті в безводному (Helianthus annuus), рослини, що містить в олії метанолі. Метилові ефіри екстрагували гексаном і насіння тільки звичайні жирні кислоти. Неочищені мікросомальні фракції з насіння, що розвивається, аналізували ГРХ на 50м 0.32мм кварцевій колонці інкубували з ФХ, у якого за sn-2 положенням олеїCP-Wax58-CB (Chromopack), як внутрішній станлова, рицинолеїлова і вернолева групи є 14Сдарт використовували метилгептадеканову кисломіченими. Після інкубації ліпіди екстрагували й ту. Кількісно оцінювали вміст жирних кислот у кожаналізували за допомогою тонкошарової хроматоній фракції, і цю величину використовували для графії. Було виявлено, що кількість радіоактивнособчислення відносної кількості кожного класу ліпіті, що включилася в нейтральну ліпідну фракцію, дів. Для визначення загального вмісту ліпідів аліклінійно зростала протягом 4 годин (дані не навевоти по 3 мл із дріжджових культур збирали дені). Розподіл [14С]ацильних груп всередині нейтцентрифугуванням і отримані осади промивали ральної ліпідної фракції аналізували через 80хв дистильованою водою і ліофилізували. Визначали (Фіг.1). Цікаво, що кількість і розподіл радіоактиввагу сухих клітин і кількісно оцінювали вміст жирності між різними нейтральними ліпідами сильно них кислот за допомогою ГРХ аналізу після перетзалежала як від виду рослин, так і від типу ворення метилових ефірів, як це описано вище. [14С]ацильного ланцюга. Так, у мікросомах соняшПотім обчислювали вміст ліпідів як нмоль жирної ника більшість радіоактивності включилося в ДАГ, кислоти (ЖК) на мг сухої ваги дріжджів. в незалежності від типу [14С]ацильної групи. НаФерментативні дослідження. Аліквоти неочивпротивагу, у мікросомах R. communis щених мікросомальних фракцій (що відповідають [14С]рицинолеїлова і [14С]вернолеві групи перева10нмоль мікросомальних ФХ) з насіння рослин, що жно включилися в ТАГ, в той час як [14С]олеїлові розвиваються, або дріжджових клітин ліофилізугрупи в основному виявлені в ДАГ. I нарешті, у вали протягом ночі. До висушених мікросомів по14 мікросомах С. palaestina тільки [ С]вернолеві грутім додавали Помічені субстратні ліпіди, розчинені пи включилися в ТАГ, у той час як в бензолі. Бензол упарювали в потоці N2, залиша[14С]рицинолеїлові групи в основному виявлені у ючи ліпіди в прямому контакті з мембранами, і виді вільних жирних кислот, а [14С]олеїловї групи додавали 0.1мл 50мМ фосфату калію (pH 7.2). у ДАГ. Це показує, що високі in vivo рівні рициноСуспензію ретельно перемішували і інкубували леїнової кислоти і вернолевої кислоти в ТАГ фракпри 30°С протягом визначеного періоду часу, до ції R. communis і С. Раlаestinа, відповідно, пояс90хв. З реакційної суміші ліпіди екстрагували за 13 75041 14 нюються ефективним і селективним переносом In vitro синтез триацилгліцеринів у мікросомавідповідних ацильних груп від ФХ до ТАГ у цих льних препаратах касторових бобів, що розвиваорганізмах. ються, приведений у таблиці 1. ФДАТ: нoвий фермент, що каталізує ацил-СоА незалежний синтез ТАГ. Було перевірено, чи може ДАГ служити як ацильним донором, так і ацильним акцептором у реакціях, що каталізуються мікросомами олійного насіння. Для цього немічений дивернолеїл-ДАГ інкубували або з sn-1-олеїл-sn-2[14С]рицинолеїл-ДАГ, або з sn-1-олеїл-sn-2[14С]рицмнолеїл-ФХ у присутності мікросом R. communis. Синтез молекул ТАГ, що містять як [14С]рицинолеїлову, так і вернолеву групи, був у 5 разів вище, коли ацил-донором служив [^С]рицинолеїл-ФХ, в порівнянні з [14С]рицинолеїлДАГ (Фіг.1В). Ці дані припускають, що ФХ є безпосереднім ацил-донором, а ДАГ-ацил-акцептором в ацил-СоА незалежному утворенні ТАГ мікросомами олійного насіння. Таким чином, ця реакція каталізуєтся новим ферментом, що був названий фосфоліпід: діацилгліцерин ацилтрансфераза (ФДАТ). Активність ФДАТ и мікросомах дріжджів. Дріжджові клітини дикого типу культивували в умовах, при яких індукується синтез ТАГ. З цих клітин одержували мікросомальні мембрани, інкубували з sn2-[14С]-рицинолеїл-ФХ і ДАГ і аналізували утворені 14 С-мічені продукти. Було виявлено, що отримані з ФХ [14С]рицинолеїлові групи всередині нейтральної ліпідної фракції в основному знаходилися у вигляді вільних жирних кислот або ТАГ, і що кількість синтезованого ТАГ залежало від кількості введеного в реакцію ДАГ (Фіг.2). In vitro синтез ТАГ, що містить як рицинолеїлову, так ί вернолеву групи, типу ТАГ, не наявного in vivo, з екзогенного доданого sn-2-[14С]рицинолеїл-ФХ і неміченого вернолеїл-ДАГ (Фіг.2, доріжка 3) очевидно демонструє наявність у дріжджових мікросомальних мембранах ацил-СоА незалежного синтезу ТАГ, що включає ФХ і ДАГ як субстрати. Отже, синтез ТАГ у дріжджах може каталізуватися ферментом, аналогічним ФДАТ, виявленої в рослинах. Ген, що кодує ФДАТ у дріжджах. Відомий ген (YNR008w) дріжджового генома, але нічого невідомо про функцію YNR008W, крім того, що ген не є необхідним для росту в нормальних умовах. Мікросомальні мембрани одержували з дріжджового штаму FVKT004-04C(AL) (8), у якому цей ген з невідомою функцією був порушений. Активність ФДАТ у мікросомах досліджували при використанні ФХ із радіоактивно міченими жирними кислота ми в положенні sn-2. У штамі з порушеним геном активність повністю була відсутня (Фіг.2 доріжка 4). Має значення той факт, що активність можна частково відновити присутністю YNR008W в одноколійній плазміді pUS1 (Фіг.2 доріжка 5). Крім того, ацильні групи фосфатидилетаноламіну (ФЕ) ефективно включалися в ТАГ мікросомами з дикого штаму, у той час як у мутантному штамі включення з цього субстрату не відбувалося (дані не приведені). Це показує, що YNR008W кодує дріжджову ФДАТ, яка каталізує перенос ацильної групи з sn2-положення фосфоліпідів до ДАГ, утворюючої в такий спосіб ТАГ. Варто помітити, що з радіоактивних ФХ не утворювалися холестеринові ефіри, навіть при інкубаціях з додаванням ергостеринів, а також порушення гена YNR008W не впливало на кількість радіоактивних вільних жирних кислот, що утворюються з ФХ (дані не приведені). Це вказує на те, що ФДАТ не має здатності синтезувати холестериновий ефір або фосфоліпазну активність. Підвищений вміст ТАГ у клітинах дріжджів зі зверхекспресією ФДАТ. Ефект зверхекспресії гена, що кодує ФДАТ, вивчали шляхом трансформації дріжджового штаму дикого типу плазмідою pUS4, в якій ген експресується з промотору GAL1:TPK2, що індукується галактозою. Як контроль використовували клітини, що містять порожній вектор експресії. Клітини вирощували в синтетичному середовищі з гліцерином і етанолом, експресію гена індукували або через 2 години (рання логарифмічна фаза), або через 25 годин (стаціонарна фаза) додаванням галактози. Потім клітини інкубували протягом ще 21 години, після чого їх збирали і проводили дослідження. Було виявлено, що зверхекспресія ФДАТ не спричиняє значного впливу на показник росту, визначений за оптичною щільністю. Однак, у штамі зі зверхекспресією ФДАТ загальний вміст ліпідів, вимірюваний як мкмоль жирних кислот на мг сухої ваги дріжджів, був на 47% (у логарифмічній фазі) або на 29% (у стаціонарній фазі) вище, ніж у контролі. Крім того, зверхекспресія ФДАТ не впливала на вміст полярних ліпідів або стеринового ефіру. Навпаки, підвищений вміст ліпідів у цих клітинах цілком залежить від підвищеного вмісту ТАГ (Фіг.3А, В). Так кількість ТАГ зросла в 2 рази в клітинах, зверхекспресуючих ФДАТ, у ранній логарифмічній фазі і на 40% у клітинах у стаціонарній фазі. Слід зазначити, що при 15 75041 16 зверхекспресії ФДАТ значне підвищення вмісту ФДАТ, діолеїл-ФЕ в якості ацил-донора приблизно ТАГ досягалося навіть в умовах (тобто в стаціонав 4 рази більш ефективний, ніж діолеїл-ФХ. Крім рній фазі), коли індукується ДАГАТ і значно сприяє того, рівень переносу ацильної групи сильно залесинтезу ТАГ. Активність ФДАТ in vitrо, досліджена жить від типу переносимо)' ацил-групи. Так, рицив мікросомах зі штаму, зверхекспресуючого ФДАТ, нолеїл-група в положенні sn-2 ФХ переноситься в була в 7 разів вище, ніж у контрольному штамі, це ТАГ у 2.5 рази більш ефективно, ніж олеїл-група в спостереження співпадає з підвищеними рівнями тому ж положенні (Фіг.4В, смуги 1 і 3). Навпаки, ТАГ, що спостерігалися in vivo (Фіг.3С). Ці резульдріжджова ФДАТ переносить вернолеву й олеїлотати ясно вказують на потенційне використання ву групи однаково ефективно (Фіг.4В, смуги 1 і 4). гена ФДАТ для підвищення вмісту олії в трансгеАцильній ланцюг акцепторної молекули ДАГ також них організмах. впливає на ефективність реакції. Так, ДАГ з рициСубстратна специфічність дріжджової ФДАТ. нолеїловою чи вернолевою групою є більш ефекСубстратну специфічність дріжджової ФДАТ достивним ацил-акцептором, ніж діолеїл-даг (Фіг.4В, ліджували за допомогою мікросом, отриманих зі смуги 1, 5 і 6). Разом ці результати ясно показуштаму, зверхекспресуючого ФДАТ (Фіг.4). Рівень ють, що ефективність переносу ацильної групи, синтезу ТАГ в умовах, приведених на Фіг.4, з діокатализованого ФДАТ, сильно залежить від власлеїл-ФХ як ацил-донора, складав 0.15нмоль у хвитивостей субстратних ліпідів. лину на мг білка. За умови, коли обидві олеїлГени ФДАТ. Нуклеотидні і амінокислотні послігрупи ФХ є міченими, у даних умовах експеримендовності декількох генів ФДАТ приведені під номету було можливо виявити перенос 11пмоль/хв рами SEQ ID №1-15. Подальші умовні і/чи часткові [14С]олеїл-ланцюги в ТАГ і утворення 15пмоль/хв послідовності приведені під номерами SEQ ID лізо-ФХ. У мікросомах зі штаму, дефіцитного за №1а-5а і 1b-11b відповідно. Одна з геномних посФДАТ, не було виявлено ТАГ, а лізо-ФХ був виявлідовностей Arabidopsis (SEQ ID №4) ідентифіколений у слідових кількостях, що припускає, що вана в EST кДНК клоні Arabidopsis, T04806. Цей дріжджова ФДАТ каталізує утворення еквімоляркДНК клон повністю охарактеризований, нуклеотиних кількостей ТАГ і лізо-ФХ при наявності ФХ і дна послідовність приведена під номером SEQ ІD ДАГ в якості субстратів. Той факт, що лізо-ФХ №5. Ґрунтуючись на гомології послідовностей утвориться в трохи більших кількостях, ніж ТАГ, кДНКТ04806 і геномній послідовності Arabidopsis може пояснюватися присутністю в дріжджових thaliana (SEQ ID №4), можна помітити, що в поломікросомах фосфоліпази, яка продукує лізо-ФХ і женні 417 в кДНК клоні присутній додатковий А неетерифіковані жирні кислоти з ФХ. (дані не приведені). При виключенні цього нуклеоСпецифічність дріжджової ФДАТ стосовно різтида вийде амінокислотна послідовність, закодоних положень ацил-групи досліджували шляхом вана в послідовності під номером SEQ ID №6. інкубації мікросом з діолеїл-ФХ, у якого Підвищенний вміст ТАГ у насінні Arabidopsis [14С]ацильна група знаходиться або в положенні thaliana, експресують дріжджову ФДАТ. Для ексsn-1 (Фіг.4А смуга 2), або в положенні sn-2 (Фіг.4А пресії гена дріжджовий ФДАТ у Arabidopsis thaliana смуга 3). Було виявлено, що в першому випадку фрагмент EcoRI із плазміди pBlescript-PDAT клоосновним 14С-міченим продуктом був лізо-ФХ, а в нували разом з паріп-промотором (25) у вектор останньому - ТАГ. Був зроблений висновок про те, pGPTV-KAN (26). Відбирали плазміду що дріжджова ФДАТ має специфічність до пере(pGNapPDAT) з геном дріжджової ФДАТ у правиносу ацил-групи з положення sn-2 фосфоліпіду до льній орієнтації і трансформували їй Agrobacferium ДАГ, при цьому утворяться sn-1-лізо-ФХ і ТАГ. У tumefaciens. Ці бактерії використовували для траданих умовах дослідження з sn-1-міченого ФХ звонсформації рослин columbia Arabidopsis thaliana [3ротною дією CDP-холін (цитидиндифосфат-холін): 24] методом кореневої трансформації [27]. Як конхолін фосфотрансферази утворяться слідові кільтроль використовували рослини, трансформовані кості 14С-міченого ДАГ. Цей мічений ДАГ може порожнім вектором. бути далі перетворений у ТАГ дією ФДАТ. Отже, Збирали насіння першого покоління (Т1) і пронеможливо відрізнити, чи утворяться мінорні кільрощували на середовищі, що містить канаміцин. кості міченого ТАГ у присутності діолеїл-ФХ, що Від окремих рослин збирали насіння другого поконесе [14С]ацил-групу в sn-1 положенні, чи синтезуління (Т2) і досліджували вміст у них жирних кисються прямо з sn-1-міченого ФХ під дією ФДАТ, що лот шляхом кількісної оцінки метилових ефірів цих також може діяти за sn-1 положенням, чи він спокислот методом газо-рідинної хроматографії після чатку переводиться в sn-1-мічений ДАГ і потім метилювання насіння 2% сірчаною кислотою в ацилюється ФДАТ зі строгою селективністю до метанолі при 85°С протягом 1.5 години. Як внутріпереносу ацил-групп за sn-2-положенням ФХ. Рашній стандарт при кількісній оцінці використовувазом ці факти вказують на те, що ФДАТ, що кодули метилові ефіри гептадеканової кислоти. ються YNR008w, катализує перенос ацил-групи від Після трансформації pGNapPDAT від однієї sn-2 положення ФХ до ДАГ, при цьому утворяться рослини Т1 (26-14) одержали сім рослин Т2, з яких ТАГ і лізо-ФХ. 3 рослини дали насіння зі статистично (за двостоДалі вивчали субстратну специфічність ФДАТ роннім критерієм з табличною поправкою) більш стосовно головної групи ацил-донора, переносимій високим вмістом олії в порівнянні з насіннями, ацильній групі і ацильним ланцюгам акцепторної отриманими від рослин Т2, що походять від росмолекули ДАГ. ФХ і ФЕ є двома основними мемлини Т1 (32-4), трансформованого порожнім векбранними ліпідами S. cerevisiae, і, як показано на тором (таблиця 2). Фіг.4В (смуги 1 і 2), у реакції, зо каталізується 17 75041 18 Таблиця 2 Рослина Т1 32-4 Номер рослини Т2 1 4 5 6 7 8 9 10 nmol жирних кислот на мг насіння 1277 1261 1369 1312 1197 1240 1283 1381 Стандарт ±11 (n=2) ±63 (n=3) ±17 (n=3) ±53 (n=4) ±54 (n=5) ±78 (n=4) ±54 (n=5) ±35 (n=5) 26-14 1 2 3 5 6 7 8 1444 1617* 1374 1562* 1393 1433 1581* ±110 (n=4) ±109 (n=4) ±37 (n=2) ±70 (n=4) ±77 (n=4) ±98 (n=4) ±82 (n=4) У переліку послідовностей: genomic DNA - геномная ДНК cDNA- кднк ΦIΓ.1. Метаболізм 14С-міченого ФХ в нейтральну ліпідну фракцію мікросомами рослин. (А) Мікросоми з насіння соняшника, що розвивається, R. communis і С. palaestina інкубували протягом 80хв при 30°С із ФХ (8 нмоль) з олеїновою групою в sn1 положенні і 14С-міченою олеїновою, рицинолеїновою чи вернолевою кислотою в положенні sn-2. Методом тонкошарової хроматографії з наступною електронною радіоавтографією кількісно оцінювали радіоактивність, що включилася в ТАГ (незаштриховані смуги), ДАГ (зафарбовані смуги) і неетерифіковані жирні кислоти (заштриховані смуги), дані приведені у відсотках від внесеного міченого субстрату. (В) In vitro синтез ТАГ, що несе дві вернолеві й одну [14С]рицинолеїлову групи, мікросомами з R. communis. В якості субстрату додавали немічений дивернолеїл-ДАГ (5нмоль) разом або з sn-1-олеїл-sn-2-[14С]рицинолеїл-ДАГ (0.4нмоль, 7700 (розп/хв)/нмоль), або з sn-1-олеїл-sn-2[14С]рицинолеїл-ФХ (0.4нмоль, 7700 (розп/хв)/нмоль). Мікросоми інкубували із субстратами протягом 30хв при 30°С, після чого відбирали зразки для ліпідного аналізу, як описано в розділі "загальні методи". Приведено середні значення двох експериментів. ΦIΓ.2. Активність ФДАТ у дріжджових мікросомах, визначена за допомогою радіоавтографії нейтральних ліпідних продуктів, розділених ТШХ. Досліджували активність ФДАТ мікросомальних мембран (10нмоль ФХ) із дріжджового штаму дикого типу FY1679 (доріжки 1-3), співгенного дріжджового штаму (FVKT004-04C(AL)) з порушеним геном YNR008w (доріжка 4) або того ж штаму з порушенням, трансформованого плазмідою pUS1, що містить ген YNR008w після його нативного промотору (доріжка 5). В якості субстрату використовували 2нмоль sn-1-олеїл-sn-2-[14С]рицинолеїл-ФХ разом або з 5нмоль діолеїл-ДАГ (доріжки 2, 4 і 5), або з rac-олеїл-вернолеїл-ДАГ (доріжка 3). Дослідження ферменту і ліпідний аналіз проводили, як описано в розділі Матеріали і Методи. Клітини попередньо культивували протягом 20г у рідкому середовищі YPO, збирали і ресуспендували в рівному об'ємі мінімального середовища (19), що містить 16г/л гліцерину. Потім клітини вирощували ще 24 години і збирали. Селекцію за плазмідою проводили вирощуванням клітин у синтетичному середовищі без урацилу (18). Скорочення: 1-OH-TAG, монорицинолеїл-ТАГ; 1-ΟΗ-1-ep-TAG, монорицинолеїлмоноверноліл-ТАГ; OH-FA, неетерифікована рицинолеїнова кислота. ФІГ.3. Вміст ліпідів (А. В) і активність ФДАТ (С) ν дріжджових клітинах зі звеохекспресією ФДАТ. Ген ФДАТ у плазміді pUS4 зверхекспресувався з індукованого галактозою промотору GAL1-TPK2 у штамі дикого типу W303-1A (7). Експресію індукували після (А) 2 годин або (В) 25 годин росту додаванням галактози до кінцевої концентрації 2% (вага/об'єм). Потім клітини інкубували ще 22 години і збирали. Кількість ліпідів у зібраних клітинах визначали ГРХ аналізом жирних кислот і виражали в мкмоль жирних кислот на мг сухої ваги в ТАГ (незаштрихована смуга), полярних ліпідах (заштрихована смуга), стеринових ефірах (зафарбована смуга) чи в інших ліпідах (смуга в смужку). Приведено середні значення результатів для трьох незалежних культур дріжджів. (С) In vitro синтез ТАГ мікросомами, отриманими з дріжджових клітин, що містять або порожній вектор (вектор), або плазміду з ФДАТ (+ФДАТ). Клітини вирощували так само, як зазначено в описі Фіг.3А. До аліквот мікросом (10нмоль ФХ) додавали субстратні ліпіди діолеїл-ДАГ (2.5нмоль) і sn-1-олеїл-sn-2[14С]-олеїл-ФХ (2нмоль) і проводили інкубацію при 28°С протягом 10хв. Кількість мітки, що включилася в ТАГ, визначали електронною радіоавтографією. Приведено середні значення результатів двох експериментів. ФIГ.4. Субстратна специфічність дріжджової ФДАТ. Активність ФДАТ досліджували інкубацією аліквот ліофілізованих мікросом (10нмоль ФХ) із субстра 19 75041 20 тними ліпідами при 30°С протягом 10хв (А) чи 90хв відповідно. Синтетичний ди-рицинолеїл-ФХ люб'я(В). В якості субстрату використовували немічений зно наданий Metapontum Agribios (Iталія). ДАГ (2.5нмоль) разом з різними міченими фосфоТАБ.2: ліпідами, як показано на малюнку. (А) СпецифічЗагальна кількість жирних кислот на мг насіння ність дріжджової ФДАТ до sn-положення стосовно рослин Т2, отриманих від окремих рослин субстрату -ацил-донору. Діолеїл-ДАГ разом з sn-1Arabidopsis thaliana, трансформованих геном дрі[14С]олеїл-sn-2-[14С]олеїл-ФХ (ди-[14С]-ФХ), sn-1жджової ФДАТ під контролем паріп промотору (26[14С]олеїл-sn-2-олеїл-фх (sn1-[14С]-ФХ) чи sn-114) чи трансформованих порожнім вектором (32олеїл-sn-2-[14С]олеїл-ФХ (sn2-[14C]-ΦΧ). (В) Спе4). цифічність дріжджової ФДАТ стосовно головної * = статистичне розходження між контрольнигрупи фосфоліпіду й ацил-групи фосфоліпіду, а ми рослинами і рослинами, трансформованими також до діацилгліцерину. Діолеїл-ДАГ разом з snФДАТ за двостороннім критерієм з табличною по1-олеїл-sn-2-[14С]олеїл-ФХ (олеїл-ΦΧ), sn-1-олеїлправкою при =5. sn-2-[14С]олеїл-ФЕ (олеїл-ФЕ), sn-1-олеїл-sn-2Опис послідовностей : 14 [ С]рицинолеїл-ФХ (рицинолеїл-ФХ) чи sn-1SEQ ID №1: Послідовність геномної ДНК і пеолеїл-sn-2-[14С]верноліл-ФХ (верноліл-ФХ). В ексредбачувана амінокислотна послідовність гена периментах, наведених у двох крайніх праворуч ФДАТ Saccharomyces cerevisae, YNR008w, номер смугах, використовували монорицинолеїл-ДАГ у GenBank Z7 1623 і Y13139, ID номер нуклеотид(рицинолеїл-ДАГ) чи моно-вернолеїл-ДАГ (верноної послідовності 1302481. 14 леїл-ДАГ) разом з sn-1-олеїл-sn-2-[ С]олеїл-ФХ. SEQ ID №2: Амінокислотна послідовність у Мітку, що включилася в ТАГ (зафарбовані смуги) і передбачуваній відкритій рамці зчитування лізо-ФХ (ЛФХ, незафарбовані смуги), кількісно YNR008w з Saccharomyces cerevisae. оцінювали за допомогою електронної радіоавтоSEQ ID №3: Послідовність геномної ДНК гена графії. Приведено середні значення результатів SPBC776.14 Schizosaccharomyces pombe. двох експериментів. Використовували мікросоми з SEQ ID №4: Послідовність геномної ДНК часклітин W303-1A, зверхекспресуючих ген ФДАТ із тини локусу Arabidopsis thaliana, номер у GenBank промотору GAL1-TPK2, як це зазначено в описі AB006704. Фіг.3. Експресію індукували в ранній стаціонарній SEQ ID №5: Нуклеотидна послідовність кДНК фазі і збирали клітини після додаткового нарощуклону Arabidopsis thaliana, номер GenBank Т04806, вання протягом 24 годин. ID номер нуклеотидної послідовності 315966. ТАБ.1: SEQ ID №6: Передбачена амінокислотна посIn vitro синтез триацилгліцеринів у лідовність кДНК клону, Arabidopsis thaliana, номер мікpосомальних препаратах з касторових бобів, у GenBank N04806. що розвиваються. Аліквоти мікросом (20нмоль ФХ) SEQ ID №7: Нуклеотидна й амінокислотна поліофилізували і додавали субстратні ліпіди в бенслідовності EST клону Zea mays, номер у GenBank зольному розчині: (А) 0.4нмоль [14С]-ДАГ (7760 Αί491339, ID номер нуклеотидної послідовності (розп/хв)/нмоль) і, де зазначено, 1.6нмоль неміче4388167. ного ДАГ; (В) 0.4нмоль [14С]-ДАГ (7760 SEQ ID №8: Передбачена амінокислотна пос(розп/хв)/нмоль) і 5нмоль неміченого дилідовність EST клону Zea mays, номер у GenBank рицинолеїл-ФХ і (С) 0.25нмоль [14С]-ФХ (4000 Аl491339, ID номер нуклеотидної послідовності (розп/хв)/нмоль) і 5нмоль неміченого ДАГ. Бензол 4388167. упарювали N2 і додавали 0.1мл 50мМ розчину фоSEQ ID №9: Послідовність ДНК частини EST сфату калію, ретельно перемішували і інкубували клону Neospora crassa W07G1, номер у GenBank при 30°С протягом (А) 20хв; (В) і (С) 30хв. ДосліΑl398644, ID номер нуклеотидної послідовності дження зупиняли екстракцією ліпідів у хлороформ. 4241729. Потім ліпіди розділяли за допомогою тонкошароSEQ ID №10: Послідовність геномної ДНК часвої хроматографії на пластинах з силікагелем 60 тини локусу Arabidopsis thaliana, номер у GenBank (Merck; Darmstadt, Germany) у суміші гексаAC004557. на/диетилового ефіру/оцтової кислоти 35:70:1.5. SEQ ID №11: Послідовність геномної ДНК часВізуалізували радіоактивні ліпіди і кількісно оцінютини локусу Arabidopsis thaliana, номер у GenBank вали радіоактивність на пластині за допомогою AC003027. електронної радіоавтографії (instant tmager, SEQ ID №12: Послідовність ДНК частини кДНК Packard, US). Приведено середні значення реклону Lycopersicon esculentum, номер у GenBank зультатів двох експериментів. Al486635. Радіоактивність у різних типах утворених триSEQ ID №13: Амінокислотна послідовність пеацилгліцеринів (ТАГ). Використовувані скороченредбачуваної відкритої рамки зчитування ня: 1-ОН-, моно-рицинолеїл; 2-ОН, ди-рицинолеїл-; САА22887 гена SPBC776.14 Schizosaccharomyces 3-ОН-, тририцинолеїл; 1-OH-1-ver-, моноpombe. рицинолеїл-моновернолеїл-; 1-OH-2-ver-, монориSEQ ID №14: Амінокислотна послідовність пецинолеїл-дивернолеїл-. Радіоактивно мічені ДАГ і редбачуваної відкритої рамки зчитування ФХ одержували ферментативним шляхом. РадіоаААС80628 Arabidopsis thaliana, отриманої з локусу, ктивно мічена рицинолеїл-група знаходиться в snArabidopsis thaliana з номером у GenBank 2-положенні ліпіду, а немічена олеїл-група - у sn-1AC004557. положенні. Немічений ДАГ з вернолеїл- чи рициSEQ ID № 15: Амінокислотна послідовність нолеїл-ланцюгами одержували дією ТАГ ліпази (6) передбачуваної відкритої рамки зчитування на олію Euphorbia iagascae чи касторового бобу ААС80628 Arabidopsis thaliana, отриманої з локусу 21 75041 22 Arabidopsis thaliana з номером у GenBank 3. Cases. S. et ai. (1998) Proc. Natl. Aсаd Sci. AC003027. USA 95,13018-13023. Додаткові умовні в/чи часткові послідовності: 4. Hobbs, D. Η., Lu, С. & Hills, Μ. J. (1999) FEBS SEQ ID №1а: Амінокислотна послідовність Lett. 452.145-9 дріжджової відкритої рамки зчитування (ORF) 5. Zou, J.. Wei, Y., Jako, C. Kumar, Α., Selvaraj, YNR008w з Saccharomyces cerevisae. G. & Taylor, D. С (1999) Рlаnt J. 19, 645-653. SEQ ID №2a: Амінокислотна послідовність об6. Lardizabal, K., Hawkins, D., Mai, J., & Wagner, ласті геномної послідовності Arabidopsis thaliana N. (1999) Abstract presented at the Biochem. Mot. (AC004557). Plant Fatty Acids Glycerolipids Symposium, South SEQ ID №3а: Амінокислотна послідовність обLake Tahoe, USA. ласті геномної послідовності Arabidopsis thaliana 7. Thomas. B. J. & Rothstein, R. (1989) Cell 56, (АВ006704). 619-630. SEQ ID №4а: Послідовність геномної ДНК і ві8. Entian. K.-D. & Kotter, P. (1998) Меth. дповідна амінокислотна послідовність дріжджової Microbiol 26, 431-449. ORF YNR008w з Saccharomyces cerevisae. 9. Kern, L, de Montigny, J., Jund, R. & Lacroute, SEQ ID №5a: Амінокислотна послідовність F. (1990) Gene 88,149-157. дріжджової ORF YNR008w з Saccharomyces 10. Ronne, H., Cariberg, M., Hu, G.-Z. & Nehlin, cerevisae, отримана з відповідної послідовності J. 0. (1991) Mol. Cell. Biol. 11, 4876-4884. геномної ДНК. 11. Stobart, K. & Stymne, S. (1990) in Metnod in SEQ ID №1b: Геномна послідовність ДНК гена Plant Biochemistry, vol 4, eds. Harwood. J. L & ФДАТ Saccharomyces cerevisae, YNR008w, ID ноBowyer. J. R. (Academic press, London), pp. 19-46. мер нуклеотидної послідовності в GenBank 12. Bator, M., Smith, Μ. Α., Jonsson, L, Stobrt, A. 1302481, і передбачувана амінокислотна послідоK. & Stymne, S. (1991) Biochem. J. 280,507-514. вність. 13. Banas, Α., Johansson, t. & Stymne, S. (1992) SEQ ID №2b: Передбачувана амінокислотна Plant Science 84,137-144. послідовність дріжджового гена YNR008w з 14. Kanda, P. & Wells, M. A. (1981) J. Lpid. Res. Saccharomyces cerevisae. 22. 877-879. SEQ ID №3b: Послідовність геномної ДНК гена 15. Stahl, U., Ek, В. & Stymne. S. (1998) Plant SPBC776.14 з Schizosaccharomyces pombe. Physiol 117, 197-205. SEQ ID №4b: Послідовність геномної ДНК час16. Stobart, K., Mancha, M. & Lenman M, тини локусу Arabidopsis thaliana, номер у GenBank Dahiqvist. A. & Stymne, S. (1997) Planta 203, 58-66. AB006704. 17. Bligh, E. G. & Dyer, W. J. (1959) Can. J. SEQ ID №5b: Нуклеотидна послідовність і відBiochem. Physiol. 37, 911-917. повідна амінокислотна послідовність EST клону 18. Sherman, F., Fink, G. R. & Hicks. J. B. (1986) Arabidopsis thaliana, номер у GenBank T04806, Ю in Laboratory Course Manual for Methods in Yeasr номер 315966. Genentics (Cold Spring Harbor Laboratory) SEQ ID №6b: Нуклеотидна й амінокислотна 19. Meesters, P. A. E. P., Huijberts, G. N. M. and послідовності кДНК клону Zea mays, ID номер у Eggink. G. (1996; Appl. Microbiol Biotechnol. 45, 575GenBank 4388167. 579. SEQ ID №7b: Амінокислотна послідовність 20. van de Loo, F. J., Fox, B. G. & Sommerville, кДНК клону Zea mays, ID номер у GenBank С (1993), in Lipid metabolism in plants, ed. Moore, T. 4388167. S. (CRC Press, Inc.), pp. 91-126. SEQ ID №8b: Послідовність ДНК частини кДНК 21. van de Loo, F. J., Broun, P.. Turner, S. & клону Neurospora crassa W07G1, ID номер Sommerville, S. (1995) Proc. Natl. Acad Sci USA 4241729. 95.6743-6747. SEQ ID №9b: Послідовність геномної ДНК час22. Lee, M., Lenman, M., Banas, Α., Bafor, M., тини локусу Arabidopsis thaliana з номером у Singh, S., Schweizer, M., Nilsson, R., Lifjenberg, С, GenBank AC004557. Dahlqvist. Α., Gummeson, P-0., Sjödahl, S., Green, SEQ ID №10b: Послідовність геномної ДНК чаΑ., and Stymne. S. (1998) Science 280. 915-918. стини локусу Arabidopsis thaliana з номером у 23. Thompson, J. D., Gibson, T. J., Plewniak. F., GenBank AC003027. Jeanmougin, F. & Higgins, D. G. (1997) Nucl. Acids SEQ ID №11b: Послідовність ДНК частини Res. 24. 4876-4882. кДНК клону Lycopersicon esculentum з номером у 24. Saitou. N. & Nei. M. (1987) Mol. Biol Evol 4, GenBank Αl486635. 406-425. Посилальні матеріали, згадані в описі: 25. Staiberg, K., Ellerstrom, M.. Josefsson, L, & 1. Bell, R. Μ. & Coleman, R. Α. (1980) Annu. Rask, L (1993) Plant Mol. Biol. 23, 671 Rev. Biochem. 49. 459-487. 26. Becker, D., Kemper, E., Schell, J., Masterson, 2. Stymne, S. & Stobart, К. (1987) in The R. (1992) Plant Mol. Вiоl 20, 1195 biochemistry of plants: a comprehensive treatsie. Vol. 27. D. Valvekens, M. Van Montagu, and Van 9, ed. Stumpf, P. K. (Academic Press, New York), pp. Lusbettens (1988) Proc. Natl. Acad. Sci. U.S.A. 85, 175-214. 5536. 23 75041 24 25 75041 26 27 75041 28 29 75041 30 31 75041 32 33 75041 34 35 75041 36 37 75041 38 39 75041 40 41 75041 42 43 75041 44 45 75041 46 47 75041 48 49 75041 50 51 75041 52 53 75041 54 55 75041 56 57 75041 58 59 75041 60
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of ferment of phospholipiddiacyglycerintransferase as catalyst in the process of biosynthetic producing triacylglycerin
Назва патенту російськоюПрименение фермента фосфолипиддиацилглицеринацетилтрансферазы в качестве катализатора в процессе биосинтетического получения триацилглицерина
МПК / Мітки
МПК: C12N 1/19, C12P 7/64, C12N 9/10, C12N 5/10, C12N 15/54, C12N 15/09, A01H 5/00
Мітки: біосинтетичного, одержання, ферменту, фосфоліпіддіацилгліцеринацетилтрансферази, процесі, каталізатора, триацилгліцерину, застосування
Код посилання
<a href="https://ua.patents.su/54-75041-zastosuvannya-fermentu-fosfolipiddiacilglicerinacetiltransferazi-yak-katalizatora-v-procesi-biosintetichnogo-oderzhannya-triacilglicerinu.html" target="_blank" rel="follow" title="База патентів України">Застосування ферменту фосфоліпіддіацилгліцеринацетилтрансферази як каталізатора в процесі біосинтетичного одержання триацилгліцерину</a>
Попередній патент: Реактор з циркулюючим псевдозрідженим шаром (варіанти)
Наступний патент: Спусковий механізм і спосіб здійснення пострілу боєприпасом
Випадковий патент: Спосіб калібрування цифрової знімальної камери, сполученої з gps-приймачем