Дейтеровані 1-піперазино-3-феніліндани для лікування шизофренії
Номер патенту: 110526
Опубліковано: 12.01.2016
Автори: Андерсен Петер Хонґор, Бадоло Лассіна, Йорґенсен Мортен, Єнсен Клаус Ґерві, Венеґор Метте Ґраулунн, Якобсен Міккель Фоґ
Формула / Реферат
1. Сполука формули Y:
 , (Y)
, (Y)
де
R1-R10 незалежно є воднем або дейтерієм, де кожен з R6-R10 являє собою дейтерій, де принаймні один з R1-R10 містить принаймні приблизно 50 % дейтерію, або її фармацевтично прийнятна кислотно-адитивна сіль.
2. Сполука за п. 1, де кожен з R3-R5 являє собою водень.
3. Сполука за п. 1, де кожен з R3-R5 являє собою дейтерій.
4. Сполука за п. 2, де сполука являє собою сполуку формули
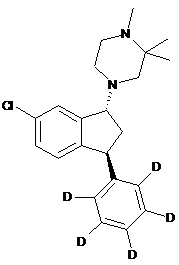 (1R, 3S)-(II).
(1R, 3S)-(II).
5. Сполука за п. 2, де сполука являє собою сполуку формули
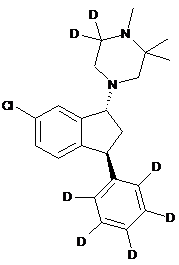 (1R, 3S)-(VII).
(1R, 3S)-(VII).
6. Сполука за п. 3, де сполука являє собою сполуку формули
 (1R, 3S)-(IV).
(1R, 3S)-(IV).
7. Сполука за п. 3, де сполука являє собою сполуку формули
 (1R, 3S)-(VI).
(1R, 3S)-(VI).
8. Сполука за п. 1, де кожен з R1 і R2 являє собою дейтерій.
9. Сполука за п. 8, де кожен з R3-R5 являє собою дейтерій.
10. Сполука за п. 8, де кожен з R3-R5 являє собою водень.
11. Сполука за будь-яким з пп. 1-10, де принаймні приблизно 85 % сполуки має атом дейтерію в кожному положенні, де він позначений як дейтерій, і будь-який атом, не позначений як дейтерій, присутній в приблизно природному відносному співвідношенні його ізотопів.
12. Сполука за будь-яким з пп. 1-11, де принаймні приблизно 90 % сполуки має атом дейтерію в кожному положенні, де він позначений як дейтерій, і будь-який атом, не позначений як дейтерій, присутній в приблизно природному відносному співвідношенні його ізотопів.
13. Сполука за п. 1, де сполука являє собою гідротартратну сіль сполуки формули
 (1R, 3S)-(IV).
(1R, 3S)-(IV).
14. Сполука за п. 13, де сполука існує в поліморфній формі, що має рентгенівську порошкову дифрактограму (XRPD), показану на фігурі 18.
15. Сполука за п. 13, де принаймні приблизно 85 % сполуки має атом дейтерію в кожному положенні, де він позначений як дейтерій, і будь-який атом, не позначений як дейтерій, присутній в приблизно природному відносному співвідношенні його ізотопів.
16. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-15 і один або більше фармацевтично прийнятних носіїв, розріджувачів або ексципієнтів.
17. Фармацевтична композиція за п. 16, де сполука являє собою гідротартратну сіль сполуки формули
 (1R, 3S)-(IV).
(1R, 3S)-(IV).
18. Композиція за п. 16 або 17, в якій носій включає гідроксипропіл-β-циклодекстрин у воді і в якій принаймні приблизно 85 % сполуки має атом дейтерію в кожному положенні, де він позначений як дейтерій, і будь-який атом, не позначений як дейтерій, присутній в приблизно природному відносному співвідношенні його ізотопів.
19. Застосування сполуки за будь-яким з пп. 1-15 або композиції за будь-яким з пп. 16-18 для виробництва лікарського засобу для лікування психозу, інших захворювань, що включають у себе психотичні симптоми, психотичних розладів або захворювань, які присутні з психотичними симптомами.
20. Застосування за п. 19, де психозом або захворюванням, що включає у себе психотичні симптоми, є шизофренія, шизофреніформний розлад, шизоафективний розлад, маревний розлад, короткочасний психотичний розлад, розділений психотичний розлад, біполярний розлад або манія при біполярному розладі.
21. Застосування за будь-яким з пп. 19-20, що додатково містить сполуку, вибрану з групи, що складається з сертиндолу, оланзапіну, респеридону, кветіапіну, арипіпразолу, галоперидолу, клозапіну, зипразидону і озанетанту.
22. Застосування за будь-яким з пп. 19-20, де психозом або захворюванням, що включає у себе психотичні симптоми, є шизофренія.
23. Застосування за будь-яким з пп. 19-20, де психозом або захворюванням, що включає у себе психотичні симптоми, є шизофренія, де фармацевтична композиція містить ефективну кількість гідротартратної солі сполуки формули
 (1R, 3S)-(IV)
(1R, 3S)-(IV)
і гідроксипропіл-β-циклодекстрин у воді, і де принаймні приблизно 85 % сполуки (IV) має атом дейтерію в кожному положенні, де він позначений як дейтерій, і будь-який атом, не позначений як дейтерій, присутній в приблизно природному відносному співвідношенні його ізотопів.
24. Сполука формули
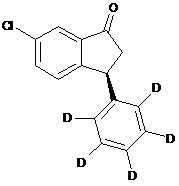 (S)-(XV).
(S)-(XV).
25. Спосіб одержання сполуки формули
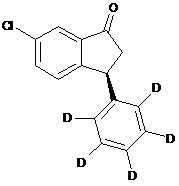 , (S)-(XV)
, (S)-(XV)
який включає обробку сполуки (XIV) сполукою [(S)-BINAP]Rh(I)BF4
 (XIV).
(XIV).
26. Спосіб за п. 25, де [(S)-BINAP]Rh(I)BF4 використовують в каталітичній кількості.
27. Спосіб одержання сполуки формули
 , (XIV)
, (XIV)
який включає
а) обробку сполуки формули
 (XII)
(XII)
біс(пінаколато)дибороном і b) обробку 2-бром-5-хлорбензальдегідом.
28. Спосіб за п. 27, де обробка сполуки формули
 (XII)
(XII)
біс(пінаколато)дибороном також включає додавання Pd(II).
29. Спосіб за п. 28, де обробка 2-бром-5-хлорбензальдегідом також включає додавання Pd(0).
30. Спосіб одержання тартрату сполуки (1R,3S)-(IV), який включає обробку рацемічного транс-1-(6-хлор-3-феніл(d5)-індан-1-іл)-1(d3),2,2-триметилпіперазину L-(+)-винною кислотою.
31. Спосіб за п. 30, де рацемічний транс-1-(6-хлор-3-феніл(d5)-індан-1-іл)-1(d3),2,2-триметилпіперазин отримують з його відповідної сукцинатної солі.
Текст
Реферат: Винахід стосується дейтерованих 1-піперазино-3-фенілінданів і їх солей, що мають активність відносно D1- і D2-рецепторів дофаміну, а також 5НТ2-рецепторів в центральній нервовій системі, до лікарських засобів, що містять такі сполуки як активні інгредієнти, до застосування таких композицій при лікуванні захворювань центральної нервової системи і до способів лікування, які включають введення таких сполук. UA 110526 C2 (12) UA 110526 C2 UA 110526 C2 5 10 15 20 25 30 35 40 45 Для цієї заявки заявляється пріоритет за попередньою заявкою на патент США № 61/498651, поданою 20 червня 2011 р., і за попередньою заявкою на патент США № 61/537103, поданою 21 вересня 2011 р., повний зміст кожної з яких включено в цей опис шляхом посилання. Всі патенти, заявки на патенти і публікації, що цитуються в цьому описі, отже, включені шляхом посилання у їхньому повному обсязі. Описи цих публікацій у їхньому повному обсязі таким чином включені шляхом посилання в цю заявку, щоб більш повно описати стан даної галузі техніки, відомої фахівцеві в даній галузі на дату цього винаходу, описаного і заявленого в цій заявці. Галузь техніки, до якої відноситься винахід Цей винахід відноситься до дейтерованих 1-піперазино-3-фенілінданів і їх солей з активністю відносно D1- і D2-рецепторів дофаміну, а також відносно 5НТ 2-рецепторів серотоніну в центральній нервовій системі, до лікарських засобів, які містять такі сполуки як активні інгредієнти, і до застосування таких сполук при лікуванні захворювань центральної нервової системи. Попередній рівень техніки Будь-де в цій заявці посилання на різні публікації робляться стосовно їх повного змісту. Розкриті змісти цих публікацій, отже, включені шляхом посилання в дану заявку для повнішого опису стану галузі техніки, до якої відноситься даний винахід. 4-((1R,3S)-6-Хлор-3-феніліндан-1-іл)-1,2,2-триметилпіперазин і його солі, фармацевтичні композиції, які містять ці солі, і медичне застосування вищевказаного, що включає лікування шизофренії або інших захворювань, що включають у себе психотичні симптоми, описані в WO2005/016900. 4-((1R,3S)-6-Хлор-3-феніліндан-1-іл)-1,2,2-триметилпіперазин має загальну формулу (Х), надалі його називають сполукою (Х). . У EP 638073 описується група транс-ізомерів 3-арил-1-(1-піперазиніл)інданів, заміщених в 2і/або 3-положенні кільця піперазину. Ці сполуки описуються як такі, що мають високу афінність відносно D1- і D2-рецепторів дофаміну і 5-НТ2-рецепторів, і передбачається, що вони є корисними для лікування деяких захворювань центральної нервової системи, зокрема шизофренії. Енантіомер вказаної вище формули (Х) був описаний Bøgesø та іншими в J Med. Chem., 1995, 38, page 4380-4392, у формі фумаратної солі, див. таблицю 5, сполука (-)-38. У даній публікації зроблений висновок, що (-)-енантіомер сполуки 38 є сильнодіючим D1/D2антагоністом, що виявляє деяку D1-селективність in vitro. Ця сполука описана також як сильнодіючий антагоніст 5-НТ2. Вказується також, що дана сполука не індукує каталепсію у щурів. Етіологія шизофренії є невідомою, але дофамінова гіпотеза шизофренії (Carlsson, Am. J. Psychiatry 1978, 135, 164-173), сформульована на початку 1960-х років, забезпечила теоретичну основу для розуміння біологічних механізмів, що лежать в основі цього розладу. У своїй найпростішій формі дофамінова гіпотеза стверджує, що шизофренія пов'язана з гіпердофамінергічним станом, - точка зору, яка підтверджується тим фактом, що всі присутні сьогодні на ринку антипсихотичні лікарські засоби виявляють деякий антагонізм щодо D2рецептора дофаміну (Seeman Science and Medicine 1995, 2, 28-37). Проте, в той же час є загальноприйнятим, що антагонізм щодо D2-рецепторів дофаміну в лімбічних ділянках мозку відіграє ключову роль при лікуванні позитивних симптомів шизофренії, блокада D2-рецепторів в стріарних ділянках головного мозку викликає екстрапірамідні симптоми (EPS). Як описано в ЕР 1 UA 110526 C2 5 10 15 20 25 30 35 40 638073, профіль змішаного інгібування D 1/D2-рецепторів дофаміну спостерігали при застосуванні деяких так званих "атипових" антипсихотичних сполук, зокрема клозапіну (8-хлор11-(4-метилпіперазин-1-іл)-5Н-дибензо[b,е][1,4]діазепіну), що використовується при лікуванні пацієнтів з шизофренією. Крім того, селективні антагоністи D1 були пов'язані з лікуванням розладів сну і алкогольної залежності (D.N Eder, Current Opinion in Investigational Drugs, 2002 3(2):284-288). Дофамін може також відігравати важливу роль в етіології афективних розладів (P. Willner, Brain. Res. Rev. 1983, 6, 211-224, 225-236 та 237-246; Bøgesø et al., J Med. Chem., 1985, 28, 1817-1828). У ЕР 638073 описано, як сполуки, що мають афінність відносно 5-НТ2-рецепторів, зокрема антагоністи 5-НТ2А-рецепторів, були запропоновані для лікування різних захворювань, таких як шизофренія, включаючи негативні симптоми у пацієнтів з шизофренією, депресія, тривога, порушення сну, напади мігрені і викликаний нейролептиками паркінсонізм. Було також зроблено припущення, що антагонізм щодо 5-НТ2А-рецепторів зменшує частоту появи екстрапірамідних побічних ефектів, викликаних класичними нейролептиками (Balsara et al. Psychopharmacology 1979, 62, 67-69). Ізотопне заміщення одного або декількох атомів водню (Н) атомами дейтерію (D) в сполуці може викликати кінетичний ізотопний ефект, який може впливати на швидкість реакції, наприклад, метаболізм сполуки. Особливо це виявляється у разі, коли ізотопна заміна є в хімічному зв'язку, який розривається або утворюється на стадії, яка обмежує швидкість. У такому разі заміну називають первинним ізотопним ефектом. Коли ізотопне(і) заміщення не залучене(і) в один або декілька зв'язків, які розриваються, тоді можна спостерігати меншу зміну швидкості, що називається вторинним ізотопним ефектом. Суть винаходу Цей винахід відноситься до сполук, у яких один або більше атомів водню (H) в одній або більше метаболічних ділянках M1, M2 і M3 сполуки (X) замінені атомами дейтерію (D). У одному аспекті цей винахід відноситься до сполуки формули Y: , 1 10 1 10 де R -R незалежно являють собою водень або дейтерій і де принаймні один з R -R містить принаймні приблизно 50% дейтерію, або її фармацевтично прийнятної кислотноадитивної солі. У іншому аспекті даний винахід відноситься до фармацевтичних композицій, які містять сполуку формули (Y) і один або більше фармацевтично прийнятних носіїв, розріджувачів або ексципієнтів. У іншому аспекті даний винахід відноситься до застосування сполуки формули (Y) або фармацевтичної композиції, що містить сполуку формули (Y), при лікуванні психозу, інших захворювань, що включають у себе психотичні симптоми, психотичних розладів або захворювань, які присутні з психотичними симптомами. У ще одному аспекті даний винахід відноситься до виробництва лікарського засобу, що містить сполуку формули (Y), для лікування психозу, інших захворювань, що включають у себе психотичні симптоми, психотичних розладів або захворювань, які присутні з психотичними 2 UA 110526 C2 5 симптомами. У ще одному аспекті цей винахід відноситься до способів лікування психозу, інших захворювань, що включають у себе психотичні симптоми, психотичних розладів або захворювань, які присутні з психотичними симптомами, які включають введення ефективної кількості сполуки формули (Y) або фармацевтичної композиції, що містить сполуку формули (Y), суб'єктові, що потребує такого лікування. У ще одному аспекті цей винахід відноситься до сполуки формули У ще одному аспекті цей винахід відноситься до способу одержання сполуки формули 10 15 20 25 30 35 40 (S)-(XV), який включає обробку сполуки (XIV) сполукою [(S)-BINAP]Rh(I)BF4. У ще одному аспекті цей винахід відноситься до способу одержання тартрату сполуки (1R,3S)-(IV), який включає обробку рацемічного транс-1-(6-хлор-3-феніл(d5)-індан-1-іл)-1(d3),2,2триметилпіперазину L-(+)-винною кислотою. Крім того, інші завдання і переваги винаходу стануть очевидними фахівцям в даній галузі із запропонованого тут опису винаходу, який є просто ілюстративним та не обмежує цей винахід. Таким чином, фахівцями в даній галузі техніки будуть розпізнані інші варіанти здійснення, що не виходять за межі суті та обсягу цього винаходу. Стислий опис ілюстративних матеріалів На фіг. 1 показані основні метаболічні ділянки сполуки (Х). На фіг. 2 показано сполуку (I) і сполуку (XI), кожну у вигляді (1R,3S)-енантіомера. 13 На фіг. 3 показані ЯМР-спектри сполуки (II) і сполуки (V). Показані окремі ділянки C ЯМР спектрів з протонною розв'язкою і розв'язкою протона і дейтерію сполуки (II) [фіг. 3A] і сполуки (V) [фіг. 3B]. На фіг. 4 показаний мас-спектр сполуки (IV). На фіг. 5 показано утворення метаболітної сполуки (XI) в результаті метаболізму сполуки (X) і сполуки (I) (0,1 мкМ) в кріоконсервованих гепатоцитах собаки (n=2, вертикальні відрізки репрезентують максимальні і мінімальні результати). На фіг. 6 показано утворення метаболітної сполуки (XI) в результаті метаболізму сполуки (X) і сполуки (I) (1 мкМ) в кріоконсервованих гепатоцитах собаки (n=2, вертикальні відрізки репрезентують максимальні і мінімальні результати). На фіг. 7 показано утворення десметилметаболіту в результаті метаболізму сполук (II), (IV) і (X) (1 мкМ) в мікросомах печінки людини (n=3, вертикальні відрізки репрезентують стандартне відхилення). На фіг. 8 показано утворення десметилметаболіту в результаті метаболізму сполук (II), (IV) і (X) (10 мкМ) в мікросомах печінки людини (n=3, вертикальні відрізки репрезентують стандартне відхилення). На фіг. 9 показано утворення десметилметаболіту в результаті метаболізму сполуки (III) (10 мкМ) в мікросомах печінки людини (n=3, вертикальні відрізки репрезентують стандартне відхилення). 3 UA 110526 C2 5 10 15 20 25 30 35 40 45 50 55 60 На фіг. 10 показано утворення десметилметаболіту в результаті метаболізму сполуки (V) (10 мкМ) в мікросомах печінки людини (n=3, вертикальні відрізки репрезентують стандартне відхилення). На фіг. 11 показано утворення десметилметаболіту в результаті метаболізму сполуки (VI) (10 мкМ) в мікросомах печінки людини (n=3, вертикальні відрізки репрезентують стандартне відхилення). На фіг. 12 показано утворення десметилметаболіту в результаті метаболізму сполуки (VII) (10 мкМ) в мікросомах печінки людини (n=3, вертикальні лінії репрезентують стандартне відхилення). На фіг. 13 показана хімічна структура сполук (I) - (VII), (X) - (XI) і (XIX) - (XXI). На фіг. 14 показано утворення десметилметаболіту в результаті метаболізму сполук (II) і (X) (10 мкМ) за допомогою рекомбінантного CYP2C19 печінки людини (n=3, стандартне відхилення). На фіг. 15 показано утворення десметилметаболіту в результаті метаболізму сполуки (IV) і сполуки (X) (1 мкМ) за допомогою рекомбінантного CYP2C19 печінки людини (n=3, вертикальні відрізки репрезентують стандартне відхилення). На фіг. 16 показана PCP-індукована гіперактивність у мишей для сполуки (IV). На фіг. 17 показана каталептична реакція у щурів для сполуки (IV). На фіг. 18 показані рентгенівські дифрактограми двох партій гідротартратної солі сполуки (IV). Докладний опис винаходу Атипові антипсихотики були предметом численних досліджень у фармацевтичній промисловості, вони показали перспективність при лікуванні психічних розладів, таких як шизофренія, біполярний розлад, деменція, тривожний розлад і обсесивно-компульсивний розлад (ОCD). Механізм дії цих агентів залишається невідомим; проте всі антипсихотичні засоби діють до деякої міри на дофамінову систему. Більшість атипових антипсихотиків виявляє активність відносно рецепторів дофаміну підтипів 1 і 2 (D 1 і D2, відповідно) і відносно рецепторів серотоніну підтипу 2 (5-HT2). В деяких випадках визначення "атиповий" було призначено для антипсихотиків, які не викликають екстрапірамідні побічні ефекти; проте, було показано, що деякі атипові антипсихотики все ж таки викликають екстрапірамідні побічні ефекти, хоча і у меншій мірі, ніж такі ефекти спостерігаються у типових антипсихотиків (публікація Weiden, P.J., "EPS profiles: the atypical antipsychotics are not all the same" J. Psychiatr. Pract. 2007, 13(1): 13-24; ця публікація включена в цей опис шляхом посилання у її повному обсязі). Схвалені атипові антипсихотики включають, наприклад, амісульприд (Solian), арипіпразол (Abilify), азенапін (Saphris), блонансерин (Lonasen), клотіапін (Entumine), клозапін (Clozaril), ілоперидон (Fanapt), луразидон (Latuda), мозапрамін (Cremin), оланзапін (Zyprexa), паліперидон (Invega), пероспірон (Lullan), кветіапін (Seroquel), ремоксиприд (Roxiam), рисперидон (Risperdal), сертиндол (Serdolect), суплірид (Sulpirid, Eglonyl), зипразидон (Geodon, Zeldox) і зотепін (Nipolept). Декілька інших таких нейролептиків знаходяться в даний час у стадії розробки. Оскільки механізм дії атипових нейролептиків добре не відомий, то побічні дії, пов'язані з цими лікарськими засобами, було важко планувати. Таким чином, існує потреба в додаткових антипсихотичних терапіях з потенціалом ослабленої побічної дії і/або покращеним терапевтичним профілем щодо існуючих терапій. У одному аспекті даний винахід відноситься до сполук, у яких один або більше атомів водню (Н) в одній або більше з метаболічних ділянок M1, M2 і M3 сполуки (X) були замінені атомами дейтерію (D). Сполука (X) і її варіанти описані, наприклад, в патентах США №№ 5807855; 7648991; 7767683; 7772240; 8076342; патентних публікаціях США №№ 2008/0269248; 2010/0069676; 2011/0178094; 2011/0207744; WO 2005/016900; ЕР 0638073 і J Med. Chem. 1995, 38, 4380-4392; причому кожна з публікацій включена в цей опис шляхом посилання у її повному обсязі. Кінетична дія ізотопу може потенційно впливати на швидкість метаболізму в одній або більше з метаболічних ділянок M1, M2 і М3, показаних на фігурі 1. Автори цього винаходу визначили три основні метаболічні ділянки 4-((1R,3S)-6-хлор-3-феніліндан-1-іл)-1,2,2триметилпіперазину (сполуки (Х)), позначені як M1, M2 і M3 і показані на фігурі 1. Дейтерування сполуки на ділянці, що піддається окиснювальному метаболізму, може в деяких випадках зменшити швидкість метаболізму сполуки унаслідок первинного ізотопного ефекту. Якщо стадія розщеплювання зв'язку С-Н є стадією, що обмежує швидкість, можна спостерігати значний ізотопний вплив. Проте, якщо інші стадії впливають на швидкість метаболізму сполуки, то стадія розщеплювання зв'язку С-Н не є стадією, що обмежує швидкість, і ізотопна дія може мати невелике значення. Крім того, негативну ізотопну дію можна 4 UA 110526 C2 5 10 15 20 25 30 35 40 45 50 55 60 спостерігати, коли швидкість реакції збільшується при заміщенні дейтерієм. Таким чином, включення дейтерію на ділянці, що піддається окиснювальному ферментативному метаболізму, має непередбачуваний вплив на фармакокінетичні характеристики (див., наприклад, патент США № 7678914; Drug Metab. Dispos. 1986, 14, 509; Arch Toxicol 1990, 64, 109; Int. Arch. Occup. Environ. Health 1993, 65 (Suppl. 1): S139, кожна публікація включена в цей опис шляхом посилання у її повному обсязі). Вплив включення дейтерію є непередбачуваним, і не існує у багатьох лікарських засобах або класах лікарських засобів. Знижений метаболічний кліренс спостерігали у деяких дейтерованих сполук щодо недейтерованих похідних, тоді як на метаболізм інших сполук це не впливало. Приклади досліджень, що вказують на відсутність передбачуваності відносно включення дейтерію, включають патент США № 6221335; J. Pharm. Sci. 1975, 64, 367-391; Adv. Drug. Res. 1985, 14, 1-40; J Med. Chem. 1991, 34, 2871-2876; Can. J. Physiol. Pharmacol. 1999, 79-88; Silverman, R. B., The Organic Chemistry of Drug Design and Drug nd Action, 2 Ed. (2004), 422; Curr. Opin. Drug Dev. 2006, 9, 101-109; Chemical Res. Tox. 2008, 1672; Harbeson, S.L and Tung, R.D. "Deuterium in Drug Discovery and Development", в Ann. Rep. Med. Chem. 2011, 46, 404-418; кожна публікація включена в цей опис шляхом посилання у її повному обсязі. Навіть включення дейтерію у відомі ділянки метаболізму має непередбачуваний вплив на метаболічний профіль. Метаболічне перемикання може мати результат, при якому метаболічний профіль конкретного лікарського засобу змінюється унаслідок включення дейтерію, таким чином приводячи до різних пропорцій метаболітів (або до різних метаболітів), на відміну від спостережуваного профілю у недейтерованого аналога того ж лікарського засобу. Новий метаболічний профіль може привести до певного токсикологічного профілю дейтерованого аналога. Доповненням до потенційних ускладнень включення дейтерію є можливість обміну дейтерій/водень у фізіологічному середовищі (Adv. Drug. Res. 1985, 14, 1-40; ця публікація включена в цей опис шляхом посилання у її повному обсязі). У деяких варіантах здійснення ізотопне заміщення одного або більше атомів водню в сполуці (X) атомами дейтерію створювало кінетичний ізотопний ефект, який впливає на швидкість метаболізму. Ізотопне заміщення атомів водню в сполуці (X) атомами дейтерію приводить до меншого метаболізму дейтерованої сполуки, яке, як показано, відбувається в гепатоцитах собаки, в яких, наприклад, було відмічено приблизно 50%-ве зниження утворення десметилметаболіту (сполуки (XI)) із сполуки (I) (фігура 2) в порівнянні з утворенням сполуки (XI) внаслідок метаболізму сполуки (Х). Дейтерування вільного фенілу, необов'язково у поєднанні з дейтеруванням 1-метильної групи (сполуки (II) і (IV)), несподівано зменшує кількість десметилметаболіту, продукованого в мікросомах печінки людини, в порівнянні з недейтерованою сполукою (сполукою (Х)). Також несподівано дейтерування 1-метильної групи вплинуло на метаболізм в гепатоцитах собаки, але не гепатоцитах людини, що, таким чином, свідчить про непередбачуваність впливу дейтерування на фармакологічні властивості. Впливом зменшеного метаболізму є вища біологічна доступність дейтерованої початкової сполуки і менше утворення метаболіту. Без зв'язку з будь-якою теорією, на основі результатів, описаних в експериментальній частині даної заявки, передбачається побачити таку ж дію після декількох введень доз людям, що дозволяє вводити людям нижчі дози, тобто давати менше навантаження всьому організму, наприклад, печінці, і рідше проводити введення доз. Відомо, що десметилметаболіт (сполука (XI)) має спорідненість до hERG і, таким чином, потенційно сприяє пролонгації QTc. Як вказано вище, дейтерування вільного фенілу, необов'язково у поєднанні з дейтеруванням 1-метильної групи (сполуки (II) і (IV)), несподівано зменшує кількість десметилметаболіту, продукованого в мікросомах печінки людини, в порівнянні з недейтерованою сполукою (сполука (Х)). Відповідно, і без обмеження будь-якою теорією, передбачається, що буде менше взаємодії з каналом hERG і, як наслідок, нижче навантаження на серце при дозуванні дейтерованих варіантів сполуки (X) [наприклад, сполук формули (Y)], в порівнянні з дозуванням сполуки (X). Цей винахід далі детально описується в ілюстративних варіантах здійснення, представлених в цьому описі. Визначення Термін "сполука(и) винаходу", вживаний тут, означає сполуки (Y), (I), (II), (III), (IV), (V), (VI) і/або (VII) і може включати їх солі, гідрати і/або сольвати. Сполуки цього винаходу отримують в різних формах, таких як солі, гідрати і/або сольвати, і винахід включає композиції і способи, що охоплюють всі варіантні форм цих сполук. Термін "композиція(ї) винаходу", вживаний в тут, означає композиції, які містять сполуки (Y), (I), (II), (III), (IV), (V), (VI) і/або (VII) або їх солі, гідрати і сольвати. Композиції винаходу можуть 5 UA 110526 C2 5 10 15 20 25 30 35 40 45 50 55 60 додатково містити один або декілька хімічних компонентів, таких як, наприклад, ексципієнти, розріджувачі, наповнювачі або носії. Термін "спосіб(оби) винаходу", вживаний тут, означає способи, що включають лікування сполуками і/або композиціями винаходу. Вживаний тут термін "приблизно" використовують в цьому описі для позначення терміну апроксимативно, навколо, поблизу, біля або в діапазоні. Коли термін "приблизно" застосовують у поєднанні з числовим діапазоном, то він змінює цей діапазон розширенням вище і нижче за межі вказаних числових значень. Взагалі, термін "приблизно" застосовують в цьому описі винаходу для зміни числових значень вище і нижче вказаної величини на 20 відсотків вгору або вниз (вище або нижче). Термін "ефективна кількість", "достатня кількість" або "терапевтично ефективна кількість", вживаний в даному описі винаходу, означає кількість сполуки, яка є достатньою для досягнення корисних або бажаних результатів, зокрема клінічних результатів. Як така, ефективна кількість може бути достатньою, наприклад, для зниження або пом'якшення тяжкості і/або зменшення тривалості ураження або захворювання або одного або декількох його симптомів, запобігання розвитку станів, пов'язаних з ураженням або захворюванням, запобігання рецидиву, розвитку або виникненню одного або більше симптомів, що асоціюються з ураженням або захворюванням, або посилення або ж поліпшення іншим чином профілактичної або терапевтичної дії(ій) іншої терапії. Ефективна кількість включає також таку кількість сполуки, яка запобігає або істотно послаблює небажані побічні дії. Вживаний в даному описі, а також добре відомий в даній галузі техніки термін "лікування" є підходом для отримання корисних або бажаних результатів, зокрема клінічних результатів. Корисні або бажані клінічні результати можуть включати, але не обмежуються ними, ослаблення або зменшення інтенсивності одного або декількох симптомів або захворювань, зниження ступеня захворювання, стабілізацію (тобто не погіршення) стану захворювання, запобігання розповсюдженню захворювання, затримку або уповільнення розвитку захворювання, поліпшення або тимчасове полегшення патологічного стану і ремісію (або часткову або повну), що піддається виявленню або не піддається виявленню. Термін "лікування" може також означати продовження виживаності в порівнянні з очікуваною виживаністю без отримання лікування. Термін "що потребує цього" відноситься до необхідності симптоматичного або безсимптоматичного полегшення захворювання, такого як, наприклад, психоз або психотичний розлад. Суб'єкт, що потребує цього, може або не може бути підданий лікуванню захворювань, пов'язаних, наприклад, з психозом або психотичним розладом. Термін "носій" відноситься до розріджувача, ад'юванта, ексципієнта або наповнювача, з яким вводять сполуку. Необмежувальні приклади таких фармацевтичних носіїв включають рідини, такі як вода, оливи і олії, включаючи оливи, що походять з нафти, жири тваринного походження, олії рослинного походження або оливи синтетичного походження, наприклад арахісову олію, соєву олію, мінеральну оливу, кунжутну олію і тому подібне. Фармацевтичними носіями можуть бути також фізіологічний розчин, аравійська камедь, желатин, крохмальна паста, тальк, кератин, колоїдний діоксид кремнію, сечовина і тому подібне. Крім того, можна застосовувати допоміжні, стабілізуючі агенти, загусники, мастильні агенти і барвники. Інші приклади відповідних фармацевтичних носіїв описані в публікації Remington: The Science and st Practice of Pharmacy, 21 Edition (University of the Sciences in Philadelphia, ed., Lippincott Williams & Wilkins 2005), ця публікація включена в цей опис шляхом посилання у її повному обсязі). Терміни "тварина", "суб'єкт" і "пацієнт", вживані в цьому описі, включають всіх членів тваринного світу, що включає, але не обмежується вказаним, ссавців, тварин (наприклад, кішок, собак, коней, свиней тощо) і людей. Термін "ізотопний варіант", вживаний в даному описі винаходу, означає сполуку, отриману заміною одного або більше атомів водню в початковій сполуці, що не містить атоми дейтерію, на атоми дейтерію. Відомо, що в більшості синтетичних сполук елементи представлені у природному співвідношенні їх ізотопів, щоприводить до притаманного природного включення дейтерію. Проте, природний ізотопний вміст ізотопів водню, наприклад дейтерію, є неістотним (приблизно 0,015%) щодо ступеня постійного ізотопного заміщення сполук, вказаних в цьому описі. Таким чином, вживане тут позначення атома як дейтерію в певному положенні вказує, що вміст дейтерію значно більший, ніж природний вміст дейтерію. Передбачається, що будь-який атом, не вказаний як конкретний ізотоп, є будь-яким стабільним ізотопом цього атома, як це буде очевидним фахівцеві в даній галузі. Сполуки (Y) є ізотопними варіантами сполуки (X). 6 UA 110526 C2 5 10 15 20 25 30 35 У деяких варіантах здійснення сполуки (I), (II), (III), (IV), (V), (VI) і (VII) є ізотопними варіантами сполуки (Х). M1 є ділянкою сполуки (X), сприйнятливою до метаболізму; M1 складається з -CН2- у 6положенні піперазину сполуки (X). М2 є ділянкою сполуки (Х), сприйнятливою до метаболізму; М2 складається з метилу, зв'язаного з N піперазину сполуки (X). M3 є ділянкою сполуки (X), сприйнятливою до метаболізму; M3 складається з фенільної групи сполуки (Х). Початковою сполукою є хімічна сполука, яка є основою для її похідних, що отримуються або заміщенням, або розкладанням, наприклад, метаболічним розкладанням. У контексті цього винаходу початкова сполука є активним фармацевтичним інгредієнтом (API). У деяких варіантах здійснення будь-який атом водню, не позначений як дейтерій, має свій природний ізотопний вміст. У деяких варіантах здійснення будь-який атом водню, не позначений як дейтерій, має ізотопний вміст дейтерію менше 1%. У одному аспекті цей винахід відноситься до сполуки формули (Y) , 1 10 1 10 де R -R незалежно є воднем або дейтерієм, причому принаймні один з R -R містить принаймні приблизно 50% дейтерію, або її фармацевтично прийнятної кислотно-адитивної солі. У іншому аспекті винахід відноситься до фармацевтичної композиції, яка містить сполуку формули (Y) і один або більше фармацевтично прийнятних носіїв, розріджувачів або ексципієнтів. У іншому аспекті винахід відноситься до застосувань сполуки формули (Y) або фармацевтичної композиції, яка містить сполуку формули (Y), при лікуванні психозу, інших захворювань, що включають у себе психотичні симптоми, психотичних розладів або захворювань, які присутні з психотичними симптомами. У ще одному аспекті винахід відноситься до виробництва лікарського засобу, що містить сполуку формули (Y), для лікування психозів, інших захворювань, що включають у себе психотичні симптоми, психотичних розладів або захворювань, які присутні з психотичними симптомами. У ще одному аспекті цей винахід відноситься до способів лікування психозу, інших захворювань, що включають у себе психотичні симптоми, психотичних розладів або захворювань, які присутні з психотичними симптомами, які включають введення ефективної кількості сполуки формули (Y) або фармацевтичної композиції, яка містить сполуку формули (Y). У деяких варіантах здійснення сполука є рацемічною. У деяких варіантах здійснення сполука є енантіомерно збагаченою. У деяких варіантах здійснення сполука вибрана з групи, що складається з 7 UA 110526 C2 і 8 UA 110526 C2 1 5 10 15 2 3 5 У деяких варіантах здійснення R і R являють собою дейтерій, R -R являють собою 6 10 дейтерій або R -R являють собою дейтерій. 1 2 У деяких варіантах здійснення R і R являють собою дейтерій. У деяких варіантах 1 2 3 5 здійснення R і R являють собою дейтерій і R -R являють собою водень. 3 5 У деяких варіантах здійснення R -R являють собою дейтерій. У деяких варіантах здійснення 3 5 R -R являють собою водень. 6 10 У деяких варіантах здійснення R -R являють собою дейтерій. У деяких варіантах 6 10 3 5 здійснення R -R являють собою дейтерій і R -R являють собою водень. 1 5 У деяких варіантах здійснення R -R являють собою дейтерій. 1 2 6 10 У деяких варіантах здійснення R , R і R -R являють собою дейтерій. 3 10 У деяких варіантах здійснення R -R являють собою дейтерій. 1 10 У деяких варіантах здійснення R -R являють собою дейтерій. У деяких варіантах здійснення сполука являє собою сполуку формули або сполуку формули 9 UA 110526 C2 У деяких варіантах здійснення сполука являє собою сполуку формули У деяких варіантах здійснення сполука являє собою сполуку формули 5 У деяких варіантах здійснення сполука являє собою сполуку формули 10 UA 110526 C2 У деяких варіантах здійснення сполука являє собою сполуку формули У деяких варіантах здійснення сполука являє собою сполуку формули 5 У деяких варіантах здійснення сполука являє собою сполуку формули 11 UA 110526 C2 5 10 15 20 25 30 35 40 У деяких варіантах здійснення принаймні приблизно 75% сполуки має атом дейтерію в кожному положенні, де він позначений як дейтерій, і будь-який атом, не позначений як дейтерій, присутній в приблизно природному відносному співвідношенні його ізотопів. У деяких варіантах здійснення принаймні приблизно 85% сполуки має атом дейтерію в кожному положенні, де він позначений як дейтерій, і будь-який атом, не позначений як дейтерій, присутній в приблизно природному відносному співвідношенні його ізотопів. У деяких варіантах здійснення принаймні приблизно 90% сполуки має атом дейтерію в кожному положенні, де він позначений як дейтерій, і будь-який атом, не позначений як дейтерій, присутній в приблизно природному відносному співвідношенні його ізотопів. У деяких варіантах здійснення сполука є сіллю, вибраною з групи, що складається з фумарату, малеату, сукцинату і тартрату. У деяких варіантах здійснення сполукою є фумаратна сіль. У деяких варіантах здійснення сполукою є гідрофумаратна сіль. У деяких варіантах здійснення сполукою є малеатна сіль. У деяких варіантах здійснення сполукою є гідромалеатна сіль. У деяких варіантах здійснення сполукою є сукцинатна сіль. У деяких варіантах здійснення сполукою є гідросукцинатна сіль. У деяких варіантах здійснення сполукою є тартратна сіль. У деяких варіантах здійснення сполукою є гідротартратна сіль. У деяких варіантах здійснення сполука являє собою гідротартратну сіль сполуки (1R,3S)(IV). У деяких варіантах здійснення, психозом або захворюванням, що включає у себе психотичні симптоми, є шизофренія, шизофреніформний розлад, шизоафективний розлад, маревний розлад, короткочасний психотичний розлад, розділений психотичний розлад, біполярний розлад або манія при біполярному розладі. У деяких варіантах здійснення психозом або захворюванням, що включає у себе психотичні симптоми, є шизофренія. У деяких варіантах здійснення способи додатково включають введення одного або декількох нейролептичних агентів. У деяких варіантах здійснення застосування додатково включають застосування одного або декількох нейролептичних агентів. У деяких варіантах здійснення нейролептичний агент вибраний з групи, що складається з сертиндолу, оланзапіну, рисперидону, кветіапіну, арипіпразолу, галоперидолу, клозапіну, зипразидону і озанетанту. У деяких варіантах здійснення введення є пероральним, сублінгвальним або трансбукальним. У деяких варіантах здійснення введення є пероральним. У деяких варіантах здійснення суб'єктом є ссавець. У деяких варіантах здійснення суб'єкт є гризуном, кішкою, собакою, мавпою, конем, свинею, великою рогатою худобою або людиною. У деяких варіантах здійснення суб'єкт є гризуном, кішкою, собакою, мавпою, великою рогатою худобою або людиною. У деяких варіантах здійснення суб'єктом є миша, щур, кішка, собака, мавпа або людина. У деяких варіантах здійснення суб'єктом є миша, щур, собака, мавпа або людина. У деяких варіантах здійснення суб'єктом є миша, щур, собака або людина. У деяких варіантах здійснення суб'єктом є миша, щур або людина. У деяких варіантах здійснення суб'єктом є собака або людина. У деяких варіантах здійснення суб'єктом є людина. У деяких варіантах здійснення позначення положення як "D" в сполуці означає, що мінімальне включення дейтерію в цьому положенні становить більше, ніж приблизно 40%. У деяких варіантах здійснення позначення положення як "D" в сполуці означає, що мінімальне 12 UA 110526 C2 5 10 15 20 25 30 35 40 45 50 55 60 включення дейтерію в цьому положенні становить більше, ніж приблизно 50%. У деяких варіантах здійснення позначення положення як "D" в сполуці означає, що мінімальне включення дейтерію в цьому положенні становить більше, ніж приблизно 60%. У деяких варіантах здійснення позначення положення як "D" в сполуці означає, що мінімальне включення дейтерію в цьому положенні становить більше, ніж приблизно 65%. У деяких варіантах здійснення позначення положення як "D" в сполуці означає, що мінімальне включення дейтерію в цьому положенні становить більше, ніж приблизно 70%. У деяких варіантах здійснення позначення положення як "D" в сполуці означає, що мінімальне включення дейтерію в цьому положенні становить більше, ніж приблизно 75%. У деяких варіантах здійснення позначення положення як "D" в сполуці означає, що мінімальне включення дейтерію в цьому положенні становить більше, ніж приблизно 80%. У деяких варіантах здійснення позначення положення як "D" в сполуці означає, що мінімальне включення дейтерію в цьому положенні становить більше, ніж приблизно 85%. У деяких варіантах здійснення позначення положення як "D" в сполуці означає, що мінімальне включення дейтерію в цьому положенні становить більше, ніж приблизно 90%. У деяких варіантах здійснення позначення положення як "D" в сполуці означає, що мінімальне включення дейтерію в цьому положенні становить більше, ніж приблизно 95%. У деяких варіантах здійснення позначення положення як "D" в сполуці означає, що мінімальне включення дейтерію в цьому положенні становить більше, ніж приблизно 97%. У деяких варіантах здійснення позначення положення як "D" в сполуці означає, що мінімальне включення дейтерію в цьому положенні становить більше, ніж приблизно 99%. Фармацевтично прийнятні солі Цей винахід включає також солі сполук, зазвичай фармацевтично прийнятні солі. Такі солі включають фармацевтично прийнятні кислотно-адитивні солі. Кислотно-адитивні солі включають солі неорганічних кислот, а також органічних кислот. Репрезентативні приклади відповідних неорганічних кислот включають хлористоводневу, бромистоводневу, йодистоводневу, фосфорну, сірчану, сульфамінову, азотну кислоти і тому подібне. Репрезентативні приклади відповідних органічних кислот включають мурашину, оцтову, трихлороцтову, трифтороцтову, пропіонову, бензойну, коричну, лимонну, фумарову, гліколеву, ітаконову, молочну, метансульфонову, малеїнову, яблучну, малонову, мигдалеву, щавлеву, пікринову, піровиноградну, саліцилову, бурштинову, метансульфонову, етансульфонову, винну, аскорбінову, памову, бісметиленсаліцилову, етандисульфонову, глюконову, цитраконову, аспарагінову, стеаринову, пальмітинову, етилендіамінтетраоцтову (EDTA), гліколеву, памінобензойну, глутамінову, бензолсульфонову, п-толуолсульфонову кислоти, теофіліноцтові кислоти, а також 8-галогентеофіліни, наприклад, 8-бромтеофілін і тому подібне. Додаткові приклади фармацевтично прийнятних неорганічних або органічних кислотно-адитивних солей включають фармацевтично прийнятні солі, перелічені в публікаціях Berge, S.M. et al., J Pharm. Sci. 1977, 66, 2, і Gould, P.L., Int. J. Pharmaceutics 1986, 33, 201-217; зміст кожної з них включено в цей опис шляхом посилання. Крім того, сполуки даного винаходу можуть існувати в несольватованих, а також в сольватованих формах з фармацевтично прийнятними розчинниками, такими як вода, етанол і тому подібне. Взагалі, такі сольватовані форми вважають за еквівалентні несольватованим формам для цілей цього винаходу. Заголовки і підзаголовки застосовують тут тільки для зручності і не мають тлумачитися як такі, що обмежують винахід у будь-якому випадку. Застосування будь-якого і всіх прикладів або виразів, що стосуються прикладів, (включаючи "приміром" ("for instance"), "наприклад" ("for example"), "наприклад" ("e.g.") і "такий як" ("as such)") в даному описі призначено тільки для кращого висвітлення винаходу і не накладає обмежень на об'єм винаходу, якщо не вказано інакше. Застосування форм однини і множини (застосування термінів з артиклями "a", "an" і "the") і подібних референтів в контексті опису цього винаходу слід тлумачити як такі, що охоплюють як форму однини, так і форму множини, якщо в цьому описі нема інших вказівок або якщо контекст явно не суперечить цьому. Якщо не вказане інше, всі точні значення, представлені в цьому описі, є представниками відповідних приблизних значень (наприклад, можна вважати, що всі точні значення з прикладів, надані по відношенню до конкретного чинника або вимірювання, передбачають також відповідне приблизне значення вимірювання, модифіковане словом "приблизно", де це доречно). В цьому описі винаходу опис будь-якого аспекту або аспекту цього винаходу, зроблений із застосуванням термінів, таких як "що містить", "що має", "що включає" або "що охоплює" щодо елементу або елементів, призначений для підтвердження аналогічного аспекту або аспекту 13 UA 110526 C2 5 10 15 20 25 30 35 цього винаходу, зробленого із застосуванням термінів "що складається з", "що в основному складається з" або "що по суті є" щодо даного конкретного елементу або елементів, якщо інше не вказано в даному описі або безсумнівно суперечить контексту. Ілюстративні синтези сполук винаходу можна легко здійснити за способами, описаними, наприклад, в патентах США №№ 5807855; 7648991; 7767683; 7772240; 8076342; патентних публікаціях США №№ 2008/0269248; 2010/0069676; 2011/0178094; 2011/0207744; WO 2005/016900; ЕР 0638073 і J. Med. Chem. 1995, 38, 4380-4392; кожне з джерел включене в цей опис шляхом посилання у його повному обсязі. Такі способи і аналогічні способи можна здійснювати із застосуванням дейтерованих реагентів і/або проміжних продуктів і/або введенням атомів дейтерію в хімічну структуру згідно з прописами, відомими в даній галузі техніки. Наступні ілюстративні способи синтезу включають перетворення інданону А в проміжний продукт C за допомогою обробки 3-бром-6-хлоріндан-1-ону (А; для посилань щодо цієї речовини див. публікації Bøgesø EP 35363 A1 19810909 і Kehler, Juhl, Püschl, WO 2008025361; кожна з цих публікацій включена в цей опис шляхом посилання у її повному обсязі) основою, такою як триетиламін, в розчиннику, такому як тетрагідрофуран, при температурі навколишнього середовища (схема 1). Видалення осадженої гідробромідної солі аміну фільтруванням і концентрування фільтрату дасть 6-хлорінден-1-он (B). Цю речовину можна піддати взаємодії з феніл-d5-бороновою кислотою у присутності приблизно 1 еквівалента основи, такої як триетиламін, і каталітичної кількості суміші [Rh(ndb)2]BF4(біс(норборнадієн)родію(I) тетрафторборату) і рацемічного BINAP (2,2'-біс(дифенілфосфіно)-1,1’-бінафтилу), 1:1, у відповідному розчиннику (наприклад, суміші приблизно 10:1 розчинників 1,4-діоксану і води) в атмосфері аргону при підвищеній температурі (наприклад, приблизно 100°С). Обробка дозволить отримати рацемічний 6-хлор-3-феніл-d5-індан-1-он (С). Схема 1. Приклад синтезу проміжного продукту С Обробка 6-хлор-3-феніл-d5-індан-1-ону (С) основою-відновником, таким як борогідрид натрію (~2 еквіваленти) в суміші розчинників 10:1 тетрагідрофурану і води при низькій температурі (приблизно -15°C) приведе до відновлення карбонільної групи у відповідний спирт (схема 2). Обробка дасть рацемічний цис-6-хлор-3-феніліндан-1-ол (D). Обробка цієї речовини вінілбутиратом (приблизно 5 еквівалентів) і Novozym 435® в розчиннику, такому як діізопропіловий етер, при температурі навколишнього середовища дасть (1S,3S)-6-хлор-3феніліндан-1-ол (Е) після обробки. Схема 2. Приклад синтезу проміжного продукту Е Альтернативно, проведення послідовності реакцій від А до Е із застосуванням фенілборонової кислоти або 4,4,5,5-тетраметил-2-феніл-[1,3,2]діоксаборолану замість 4,4,5,5тетраметил-2-d5-феніл-[1,3,2]діоксаборолану приведе до одержання (1S,3S)-6-хлор-3феніліндан-1-олу (Е') (схема 3). 14 UA 110526 C2 Схема 3. Приклад синтезу проміжного продукту Е' 5 10 15 Наступні альтернативні способи синтезу для отримання Е' описані в патентній літературі (Dahl, Wøhlk Nielsen, Suteu, Robin, Brøsen WO2006/086984 A1; Bang-Andersen, Bøgesø, Jensen, Svane, Dahl, Howells, Lyngsø, Mow WO2005/016901 A1; кожна з них включена в цей опис шляхом посилання у її повному обсязі). У цих процедурах бензилціанід застосовують як один з субстратів. Застосування бензилціаніду-d7 (є комерційно доступним від Aldrich, номер за каталогом # 495840), або феніл-d5-ацетонітрилу (є комерційно доступним від Aldrich, номер за каталогом # 495859, або від CDN, номер за каталогом # D-5340, або від Kanto, номер за каталогом # 49132-27) і такої ж процедури може привести до отримання проміжного продукту E (схема 4). Як альтернативи комерційно джерелам, бензилціаніду-d7 і феніл-d5-ацетонітрилу, можна застосовувати одержаний ціанід натрію і бензил-d7-хлорид (комерційно доступний від Aldrich, номер за каталогом № 217336) і бензил-2,3,4,5,6-d5-хлорид (комерційно доступний від Aldrich, номер за каталогом № 485764), відповідно. Схема 4. Приклад синтезу проміжних продуктів Е і Е' Обробка сполуки Е приблизно 4 еквівалентами діізопропілетиламіну і приблизно 2 15 UA 110526 C2 5 10 15 20 25 30 еквівалентами метансульфонового ангідриду в тетрагідрофурані при приблизно -18°C з подальшим повільним нагріванням до приблизно -5°С і подальшою обробкою приблизно 4 еквівалентами 2,2-диметилпіперазину приведе до утворення 1-((1R,3S)-6-хлор-3-феніл-d5-індан1-іл)-3,3-диметилпіперазину (F), який можна очистити після реакції (схема 5). Альтернативно, спирт E можна перетворити на відповідний хлорид, переважно із збереженням конфігурації у C1, і одержати при цьому (1S,3S)-1-хлор-3-d5-феніліндан (E’’; аналогічно E’ можна перетворити на (1S,3S)-1-хлор-3-феніліндан (Е’’’)). Хлорид E’’ можна піддати взаємодії з 2,2диметилпіперазином з одержанням F. Кінцеву стадію можна проводити, як описано для одержання солі, сполука (I)•бутандіова кислота, із застосуванням йодметану, одержуючи при цьому сполуку (II), або d3-йодметану, одержуючи при цьому сполуку (IV), відповідно. Альтернативно, як описано нижче, метильну групу або d3-метильну групу можна ввести нагріванням із зворотним холодильником в HCHO/HCOOH або DCDO/DCOOD, відповідно. Схема 5. Приклад синтезу проміжних продуктів F і сполук (II) і (IV) трет-Бутиловий естер (2-аміно-2-метилпропіл)-карбамінової кислоти (G) можна одержати з 2-метилпропан-1,2-діаміну і ди-трет-бутилдикарбонату (альтернативно вказується, що G є комерційно доступним від: Prime, номер за каталогом # POI-1362-MB4; Rovathin, номер за каталогом # NX45401). Реакція G з галогенацетилгалогенідом, таким як або хлорацетилхлорид, або бромацетилбромід, дасть трет-бутиловий естер [2-(2-хлорацетиламіно)-2метилпропіл]карбамінової кислоти або трет-бутиловий естер [2-(2-бромацетиламіно)-2метилпропіл]карбамінової кислоти (Н), відповідно (схема 6). Обробка будь-якого варіанту сполуки Н кислотою з подальшою обробкою основою приведе до утворення 6,6диметилпіперазин-2-ону (I). Цю речовину можна відновити до 2,2-диметил-5,5-d2-піперазину (J) обробкою літійалюмінійдейтеридом. Схема 6. Приклад синтезу проміжного продукту J Як альтернативу, сполуку J можна одержати з 2-аміно-2-метилпропіонової кислоти. Реакція 2-аміно-2-метилпропіонової кислоти і ди-трет-бутилдикарбонату дасть 2-третбутоксикарбоніламіно-2-метилпропіонову кислоту (K) (схема 7). Функціональну кислотну групу можна перетворити на відповідний амід Вайнреба реакцією з O,N-диметилгідроксиламіном у присутності відповідного реагенту сполучання, такого як 2-(1H-7-азабензотриазол-1-іл)-1,1,3,3тетраметилуронійгекса-фторфосфатметанаміній (HATU) або 1-етил-3-(3диметиламінопропіл)карбодіімід (EDC), одержуючи при цьому трет-бутиловий естер [1(метоксиметилкарбамоїл)-1-метилетил]карбамінової кислоти (L). Селективним відновленням 16 UA 110526 C2 5 аміду Вайнреба одержують трет-бутиловий естер (1,1-диметил-2-оксоетил)карбамінової кислоти (М). Відновне амінування із застосуванням альдегіду М і метилового естеру амінооцтової кислоти можна застосовувати для одержання метилового естеру (2-третбутоксикарбоніламіно-2-метилпропіламіно)оцтової кислоти (N). Обробка карбаматного естеру N відповідною кислотою, такою як трифтороцтова кислота, приведе до утворення піперазинону I, який при обробці літійалюмінійдейтеридом дає піперазин J. Схема 7. Альтернативний приклад синтезу проміжного продукту J 10 Застосування J замість 2,2-диметилпіперазину, як описано для перетворення Е на сполуки (II) і (IV), приведе до одержання сполуки (VI) і сполуки (VII), відповідно. Аналогічно цьому, застосування Е' і J замість 2,2-диметилпіперазину і Е приведе до одержання сполуки (III) і сполуки (V). У іншому аспекті цей винахід відноситься до способу одержання сполуки формули 15 , який включає обробку сполуки (XIV) сполукою [(S)-BINAP]Rh(I)BF4. У іншому аспекті винахід відноситься до способу одержання тартрату сполуки (1R,3S)-(IV), який включає обробку рацемічного транс-1-(6-хлор-3-феніл(d5)-індан-1-іл)-1(d3),2,2триметилпіперазину L-(+)-винною кислотою. У деяких варіантах здійснення рацемічний транс-1-(6-хлор-3-феніл(d5)-індан-1-іл)-1(d3),2,2триметилпіперазин одержують з його відповідної сукцинатної солі. У деяких варіантах здійснення сукцинат рацемічного транс-1-(6-хлор-3-феніл(d5)-індан-1-іл)1(d3),2,2-триметилпіперазину одержують з малеатної солі рацемічного транс-1-(6-хлор-3феніл(d5)-індан-1-іл)-3,3-диметилпіперазину. У деяких варіантах здійснення ацетофенон-d5 перетворюють на еноловий етер. У деяких варіантах здійснення еноловим етером є силіловий еноловий етер. У деяких варіантах здійснення еноловий етер ацетофенону-d5 перетворюють на відповідний вінілборонат. У деяких варіантах здійснення еноловий етер ацетофенону-d5 обробляють біс(пінаколато)дибороном. У 20 25 17 UA 110526 C2 5 10 15 20 25 30 35 40 45 50 55 60 деяких варіантах здійснення вінілборонат обробляють 2-галоген-5-хлорбензальдегідом. У деяких варіантах здійснення ці сполуки існують як рацемати. У деяких варіантах здійснення ці сполуки існують із вмістом більше, ніж приблизно 70% енантіомерного надлишку. У деяких варіантах здійснення ці сполуки існують із вмістом більше, ніж приблизно 75% енантіомерного надлишку. У деяких варіантах здійснення ці сполуки існують із вмістом більше, ніж приблизно 80% енантіомерного надлишку. У деяких варіантах здійснення ці сполуки існують із вмістом більше, ніж приблизно 85% енантіомерного надлишку. У деяких варіантах здійснення ці сполуки існують із вмістом більше, ніж приблизно 90% енантіомерного надлишку. У деяких варіантах здійснення ці сполуки існують із вмістом більше, ніж приблизно 92% енантіомерного надлишку. У деяких варіантах здійснення ці сполуки існують із вмістом більше, ніж приблизно 95% енантіомерного надлишку. У деяких варіантах здійснення ці сполуки існують із вмістом більше, ніж приблизно 97% енантіомерного надлишку. У деяких варіантах здійснення ці сполуки існують із вмістом більше, ніж приблизно 99% енантіомерного надлишку. Фармацевтичні композиції Цей винахід далі відноситься до фармацевтичних композицій, що містять терапевтично ефективну кількість сполук цього винаходу і фармацевтично прийнятний носій або розріджувач. Сполуки винаходу можна вводити окремо або в комбінації з фармацевтично прийнятними носіями, розріджувачами або ексципієнтами у вигляді однієї або у вигляді декількох доз. Фармацевтичні композиції цього винаходу можна виготовити з фармацевтично прийнятними носіями або розріджувачами, а також будь-якими іншими відомими ад'ювантами і ексципієнтами згідно з загальноприйнятими методиками, такими як методики, що описані в Remington: The st Science and Practice of Pharmacy, 21 Edition (University of the Sciences in Philadelphia, ed., Lippincott Williams & Wilkins 2005). Подальші приклади композицій сполук цього винаходу описані, наприклад, в патентах США №№ 5807855; 7648991; 7767683; 7772240; 8076342; патентних публікаціях США №№ 2008/0269248; 2010/0069676; 2011/0178094; 2011/0207744, WO 2005/016900, ЕР 0638073 і J. Med. Chem. , 38, 4380-4392; кожен документ включений в цей опис шляхом посилання у його повному обсязі. Фармацевтичні композиції можна спеціально виготовити для введення будь-яким відповідним шляхом, таким як пероральний, назальний, місцевий (зокрема трансбукальний і під'язиковий) і парентеральний (включаючи підшкірний, внутрішньом'язовий, внутрішньооболонковий, внутрішньовенний і внутрішньошкірний) шляхи. Слід мати на увазі, що шлях введення залежатиме від загального стану і віку суб'єкта, що піддається лікуванню, природи захворювання, що піддається лікуванню, і активного інгредієнта. Добова доза сполук винаходу в розрахунку на вільну основу є відповідною від приблизно 1,0 до приблизно 160 мг/добу, більш відповідною від приблизно 1 до приблизно 100 мг, наприклад, переважно від приблизно 2 до приблизно 55, така як від приблизно 2 до приблизно 15 мг, наприклад, від приблизно 3 до приблизно 10 мг. У деяких варіантах здійснення добова доза складає від приблизно 0,1 мг до приблизно 500 мг. У деяких варіантах здійснення добова доза складає від приблизно 1 мг до приблизно 500 мг. У деяких варіантах здійснення добова доза складає від приблизно 1 мг до приблизно 400 мг. У деяких варіантах здійснення добова доза складає від приблизно 1 мг до приблизно 300 мг. У деяких варіантах здійснення добова доза складає від приблизно 1 мг до приблизно 200 мг. У деяких варіантах здійснення добова доза складає від приблизно 1 мг до приблизно 160 мг. У деяких варіантах здійснення добова доза складає від приблизно 1 мг до приблизно 100 мг. У деяких варіантах здійснення добова доза складає від приблизно 1 мг до приблизно 60 мг. У деяких варіантах здійснення добова доза складає від приблизно 2 мг до приблизно 30 мг. У деяких варіантах здійснення добова доза складає від приблизно 2 мг до приблизно 15 мг. У деяких варіантах здійснення добова доза складає від приблизно 3 мг до приблизно 10 мг. У деяких варіантах здійснення добова доза складає приблизно 60 мг. У деяких варіантах здійснення добова доза складає приблизно 50 мг. У деяких варіантах здійснення добова доза складає приблизно 40 мг. У деяких варіантах здійснення добова доза складає приблизно 30 мг. У деяких варіантах здійснення добова доза складає приблизно 20 мг. У деяких варіантах здійснення добова доза складає приблизно 10 мг. У деяких варіантах здійснення добова доза складає приблизно 5 мг. У деяких варіантах здійснення добова доза складає приблизно 3 мг. У деяких варіантах здійснення добова доза складає приблизно 2 мг. У деяких варіантах здійснення добова доза складає приблизно 1 мг. Для парентеральних шляхів введення, таких як внутрішньовенне, внутрішньооболонкове, внутрішньом'язове і аналогічне введення, типовими дозами є дози близько половини дози, вживаної для перорального введення. Сполуки цього винаходу зазвичай застосовують у вигляді вільної речовини або у вигляді фармацевтично прийнятної солі. Приклади відповідних органічних і неорганічних кислот є 18 UA 110526 C2 5 10 15 20 25 30 35 40 такими, як описано тут. У деяких варіантах здійснення композиція містить циклодекстрин. У деяких варіантах здійснення композиція містить циклодекстрин у воді. У деяких варіантах здійснення циклодекстрин являє собою гідроксипропіл--циклодекстрин. У деяких варіантах здійснення композиція містить гідроксипропіл--циклодекстрин у воді. Лікування розладів Цей винахід відноситься також до медичного застосування сполук цього винаходу, наприклад, для лікування захворювань центральної нервової системи, включаючи психоз, зокрема шизофренію, або інші захворювання, що включають у себе психотичні симптоми, таких як, наприклад, шизофренія, шизофреніформний розлад, шизоафективний розлад, маревний розлад, короткочасний психотичний розлад, розділений психотичний розлад, а також інші психотичні розлади або захворювання, які присутні з психотичними симптомами, наприклад, біполярний розлад, такий як манія при біполярному розладі. Сполуки і/або композиції цього винаходу можна додатково застосовувати при лікуванні розладів, таких як розлади, описані, наприклад, в патентах США №№ 5807855; 7648991; 7767683; 7772240; 8076342; патентних публікаціях США №№ 2008/0269248; 2010/0069676; 2011/0178094; 2011/0207744; WO 2005/016900, ЕР 0638073 і J Med. Chem. 1995, 38, 4380-4392; кожен документ включений в цей опис шляхом посилання у його повному обсязі. Винахід також відноситься до медичного застосування сполук цього винаходу як комбінованої терапії у поєднанні з іншими терапевтичними агентами, такими як агенти, що описані, наприклад, в патентах США №№ 5807855; 7648991; 7767683; 7772240; 8076342; патентних публікаціях США №№ 2008/0269248; 2010/0069676; 2011/0178094; 2011/0207744; WO 2005/016900, ЕР 0 638 073 і J Med. Chem. 1995, 38, 4380-4392; кожен документ включений в цей опис шляхом посилання у його повному обсязі. Повинно бути зрозуміло, що одна або більше відмітних ознак будь-якого з описаних тут варіантів здійснення можна об'єднати і/або переставити в межах цього винаходу для отримання додаткових варіантів здійснення, які також входять в обсяг цього винаходу. Фахівцям в даній галузі техніки буде зрозуміло або вони будуть здатні встановити із застосуванням не більше ніж звичайного експериментування багато еквівалентів описаних тут конкретних варіантів здійснення винаходу. Передбачається, що такі еквіваленти знаходяться в межах обсягу цього винаходу. Цей винахід далі описується наступними необмежувальними прикладами. Приклади Нижче наводяться приклади для полегшення повнішого розуміння цього винаходу. Нижченаведені приклади ілюструють приклади способів здійснення і застосування цього винаходу на практиці. Проте, обсяг цього винаходу не обмежується конкретними варіантами здійснення, описаними в цих прикладах, які призначені тільки для цілей ілюстрації, оскільки для отримання аналогічних результатів можна застосовувати альтернативні способи. Очищення сполук хроматографією відноситься до використання хроматографії на силікагелі із застосуванням або ручної флеш-хроматографії або автоматизованої флеш-хроматографії, що зазвичай виконується із застосуванням градієнтів елюенту від гептанів до етилацетату або суміші етилацетату, триетиламіну і метанолу. Опис способів РХ-МС Сполуки (I), (II), (III), (IV), (V), (VI) і (VII) характеризували за допомогою РХ-МС із застосуванням наступних методів (таблиця 1). 45 Таблиця 1 Методи аналізу РХ-МС Устаткування Методи WXV-AB5, WXV-AB10 і WXV-AB30 Система РХ-МС Agilent 1100 з детектором ELS (метод WuXiAB25, система РХ-МС Agilent 1200 з детектором ELS) Насос G1311A Апарат для дегазації G1379A Автоматичний пробовідбірник з лунокG1367A планшетів Піч для колонок G1316A DAD G1315B G1946C або G1956А [метод WuXiAB25 MSD 6110] 19 UA 110526 C2 Таблиця 1 Методи аналізу РХ-МС Колонка Об'єм ін'єкції Витрата потоку Рухомі фази УФдетектування Детектування ELSD WXV-AB05 WXV-AB10 WXV-AB30 WuXiAB25 Методи WXV-AB5, WXV-AB10 і WXV-AB30 Alltech ELSD 800 [метод WuXiAB25 ELSD Aligent 1200] YMC ODS-AQ [метод WuXiAB25 Aligent TC-C18] Розмір частинок 5 мкм Розмір пор 12 нм 50 х 2,0 мм ID [метод WuXiAB25 50 х 2,1 Розмір мм ID] 2 мкл Температура колонки 50°С 0,8 мл/хв. А В Тривалість експерименту Градієнт 0,1 TFA у воді 0,05% TFA в ацетонітрилі 4,5 хв. Лінійний Довжина хвилі 254 нм Температура 50°С Тиск газу Час 0 хв. 3,5 хв. 3,55 хв. 0 хв. 3,4 хв. 3,5 хв. 3,51 хв. 0 хв. 3,2 хв. 3,5 хв. 3,55 хв. 0 хв. 3,4 хв. 4 хв. 4,01 хв. 4,5 хв. 3,2 бар Градієнт 95% А 5% В 0% А 100% В 95% А 6% В 90% А 10% В 100% B 100% B 90% А 10% В 70% А 30% В 0% А 100% В 0% А 100% В 70% А 30% В 75% А 25% В 0% А 100% В 0% А 100% В 75% А 25% В 75% А 25% В Метод 131 Sciex API150EX, забезпечене APPI-джерелом, що працює в режимі позитивних іонів Устаткування РХ-МС проводили на приладі Sciex API150EX, забезпеченим APPI-джерелом, що працює в режимі позитивних іонів. Устаткування ВЕРХ складалося з насосів РХ Shimadzu LC10-ADvp, детектора PDA (що працює при 254 нМ) і системного контролера SXL-10A. Автоматичний пробовідбірник - Gilson. Автоматичний пробовідбірник Gilson 215 Піч для колонок Jones Chromatography 7990R ELSD Sedere Sedex 85 Колонка Waters Symmetry C-18 Розмір частинок 3,5 мкм Розмір 30 х 4,6 мм ID Об'єм ін'єкції 10 мкл Температура 60°С колонки 20 UA 110526 C2 Таблиця 1 Методи аналізу РХ-МС Методи WXV-AB5, WXV-AB10 і WXV-AB30 Витрата потоку Рухомі фази 3,0 мл/хв. 5 0,05% TFA у воді 0,05% TFA в метанолі 2,8 хв. нелінійний Довжина хвилі 254 нм Температура 50°С Тиск газу Час 0,01 хв. 0,27 хв. 0,53 хв. 0,80 хв. 1,07 хв. 1,34 хв. 1,60 хв. 1,87 хв. 2,14 хв. 2,38 хв. 2,40 хв. УФдетектування Детектування ELSD А B Тривалість експерименту Градієнт 4,4 бар Градієнт 17% B у А 28% B у А 39% B у А 50% B у А 59% B у А 68% B у А 78% B у А 86% B у А 93% B у А 100% В 17% B у А Опис методів хіральної ВЕРХ Чистоту енантіомерів аналізували на системі Hewlett Packard серії 1100, забезпеченій діодним матричним детектором, і із застосуванням ChemStation для LC Rev. A.08.03 [847]. Параметри методу ВЕРХ показані в наведеній нижче таблиці (таблиця 2). Сполука (X) має час утримування приблизно 13,6-13,7 хв., тоді як її енантіомер, 4-((1S,3R)-6-хлор-3-феніліндан-1-іл)1,2,2-триметилпіперазин,елююється при 8,5-8,6 хв. Таблиця 2 Методи аналізу хіральної ВЕРХ Препарат зразка Колонка Температура колонки (°C) Ін'єкція (мкл) Детектування: довжина хвилі, ширина піку (нм) Тривалість експерименту Витрата потоку (мл/хв.) Рухома фаза 10 1-3 мл у суміші гексан/2-пропанол (80/20 об./об.) Chiralpak ADH, 5 мкм, 250 х 4,6 мм 30 5 240,8 30 хв. 0,6 Гексан/2-пропанол/діетиламін/пропіонова кислота, 90/10/0,2/2 Приклад 1. Одержання солі 4-((1R,3S)-6-хлор-3-феніліндан-1-іл)-1-метил-d3-2,2диметилпіперазин•бутандіова кислота·(сіль: сполука(I)•бутандіова кислота). Схема 8. Синтез сполуки (I) 21 UA 110526 C2 гідрохлорид 1-((1R,3S)-6-хлор-3феніліндан-1-іл)-3,3диметилпіперазину (гідрохлорид сполуки (XI)) 5 10 15 20 25 30 35 40 сіль сполуки (I) і бутандіової кислоти Гідрохлорид 1-((1R,3S)-6-хлор-3-феніліндан-1-іл)-3,3-диметилпіперазину (11,1 г) розчиняли в суміші толуолу (74 мл) і води (74 мл). Одержання гідрохлориду 1-((1R,3S)-6-хлор-3феніліндан-1-іл)-3,3-диметилпіперазину описано в патентній літературі (Dahl, Wohlk Nielsen, Suteu, Robin, Brøsen WO2006/086984 А1; Bang-Andersen, Bøgesø, Jensen, Svane, Dahl, Howells, Lyngsø, Mow WO2005/016901 А1; кожен документ включений в цей опис шляхом посилання у його повному обсязі). Додавали 12,0 М розчин гідроксиду калію у воді (5,38 мл), бромід тетра-Nбутиламонію (1,42 г) і d3-йодметан (номер за каталогом Aldrich # 176036; 2,4 мл) і суміш перемішували при кімнатній температурі протягом 18 годин (схема 8). Суміш профільтрували через скляний фільтр в ділильну лійку. Тверду речовину на фільтрі промивали толуолом (50 мл) в ділильну лійку. Водний шар екстрагували толуолом (100 мл) і об'єднані органічні шари промивали концентрованим водним аміаком (100 мл) і потім водою (100 мл), а після цього сушили над сульфатом натрію, фільтрували і концентрували у вакуумі, одержуючи при цьому блідо-жовту оливу. Оливу охолоджували до -78°С у вакуумі, внаслідок чого олива тверднула. Після нагрівання до кімнатної температури олива ставала напівтвердою. Цю речовину розчиняли в ацетоні (30 мл). В окремій колбі бутандіову кислоту (3,46 г) суспендували в ацетоні (30 мл) і нагрівали до кипіння із зворотним холодильником (не вся кількість двоосновної кислоти переходила в розчин). До розчину сирого продукту додавали кислотну суспензію і додатковий ацетон (50 мл) додавали до залишку бутандіової кислоти і потім виливали в розчин. Суміш перемішували протягом ночі. Протягом ночі відбувалося часткове осадження, і суміш концентрували у вакуумі. Залишок повторно розчиняли в ацетоні (70 мл), і нагрівали до кипіння із зворотним холодильником, і залишали для охолодження до кімнатної температури, і перемішували протягом 2 годин. Суміш профільтрували, одержуючи при цьому сіль 4-((1R,3S)-6-хлор-3-феніліндан-1-іл)-1метил-d3-2,2-диметилпіперазин•бутандіова кислота (сіль: сполука (I)•бутандіова кислота; 7,61 г). РХ-МС (метод 131): RT(УФ) 1,57 хв.; чистота за УФ/ELS була 100%/100%; спостережувана маса 13 складала 358,0. Включення трьох атомів дейтерію відповідало >99%. С ЯМР-спектр з розв'язкою протонів показав гептет у приблизно 36,4 м.д. (ppm), відповідний дейтерованій 13 метаболічній ділянці М2; цей сигнал перетворювався на синглет в С ЯМР-спектрі з розв'язкою протонів і дейтерію. Всі інші сигнали були синглетами в обох спектрах. Оптична чистота ізомеру була >95% ee. Приклад 2. Альтернативний спосіб одержання солі 4-((1R,3S)-6-хлор-3-феніліндан-1-іл)-1метил-d3-2,2-диметилпіперазин•бутандіова кислота (сіль: сполука (I)•бутандіова кислота). Вільну основу 1-((1R,3S)-6-хлор-3-феніліндан-1-іл)-3,3-диметилпіперазину одержували з відповідної гідрохлоридної солі розподілом 23,4 г солі між сумішшю води (100 мл), концентрованого водного розчину гідроксиду калію (40 мл) і толуолу (250 мл). Органічний шар промивали сумішшю води (50 мл) і концентрованого водного розчину гідроксиду калію (10 мл). Об'єднані водні шари екстрагували толуолом (75 мл). Об'єднані органічні шари сушили над сульфатом натрію, фільтрували і концентрували у вакуумі, одержуючи при цьому вільну основу 1-((1R,3S)-6-хлор-3-феніліндан-1-іл)-3,3-диметилпіперазину (21,0 г) у вигляді безбарвної оливи. Цю речовину розчиняли в суміші толуолу (150 мл) і води (150 мл) перед додаванням 12,0 М водного розчину гідроксиду калію (11,3 мл), броміду тетра-N-бутиламонію (2,98 г) і d3-йодметану 22 UA 110526 C2 5 10 15 (4,9 мл) і суміш перемішували при кімнатній температурі протягом 18 годин. Обробку і очищення проводили, як описано вище, і отримували сіль 4-((1R,3S)-6-хлор-3феніліндан-1-іл)-1-метил-d3-2,2-диметилпіперазин•бутандіова кислота (сіль: сполука (I)•бутандіова кислота; 14,34 г; 48,9%). Приклад 3. Одержання 4-((1R,3S)-6-хлор-3-феніл-d5-індан-1-іл)-1,2,2-триметилпіперазину (сполука (II)) і 4-((1R,3S)-6-хлор-3-феніл-d5-індан-1-іл)-1-метил-d3-2,2-диметилпіперазину (сполука (IV)). До розчину сполуки А (57 г) в тетрагідрофурані (600 мл) додавали по краплях триетиламін (30 мл) впродовж 30 хвилин. Реакційну суміш витримували при кімнатній температурі протягом 3 годин. Осаджену тверду речовину відокремлювали фільтруванням і фільтрат концентрували у вакуумі. Залишок знову осаджували з діетилового етеру, одержуючи при цьому сполуку В (31 г) у вигляді жовтої твердої речовини. До розчину сполуки феніл-d5-боронова кислота (25 г) в суміші 1,4-діоксан/вода (900 мл/90 мл) додавали [Rh(ndb)2]BF4 (1,3 г), рацемічний BINAP (2,1 г) і триетиламін (14 мл), потім реакційну суміш витримували при кімнатній температурі протягом 2 годин в атмосфері N2. Потім додавали сполуку інденон (19 г) і одержану суміш нагрівали до 100°С протягом 3 годин. Осаджену тверду речовину відфільтрували. Фільтрат концентрували у вакуумі. Залишок очищали хроматографією, одержуючи при цьому інданон C (10 г). Схема 9. Синтез сполуки С 20 25 30 35 40 13,4 кг 3-бром-6-хлоріндан-1-ону (A; посилання на цю речовину див.: Bøgesø EP 35363 А1 19810909 і Kehler, Juhl, Püschl, WO 2008025361; кожен вказаний документ включений в цей опис шляхом посилання у його повному обсязі) розчиняли в тетрагідрофурані (170,8 л) і розчин охолоджували до 0-5°С (схема 9). Впродовж 0,5 години додавали триетиламін (9,1 л). Суміш перемішували при 0-5°С протягом 5 годин перед додаванням додаткової порції триетиламіну (2,48 л) протягом 0,5 години і перемішування продовжували протягом 2 годин. Суміш фільтрували і фільтрат концентрували до 30 л перед додаванням н-гептану (102 л). Об'єм зменшували до 60 л. Додавали ще н-гептан (203 л) і суміш перемішували протягом 1 години. Додавали силікагель (17,2 кг). Суміш фільтрували і залишкову тверду речовину промивали нгептаном (100 л). Об'єднані фільтрати концентрували до 30 л і перемішували при 0-5°С протягом 1 години. Суміш центрифугували і залишкову тверду речовину сушили, одержуючи при цьому 6-хлорінден-1-он (сполука B; 2,42 кг), достатньо чистий для наступної стадії. У реактор додавали 2-метилтетрагідрофуран (85 л) і N,N-диметилацетамід (12,4 л) з подальшим додаванням ацетату калію (10,9 кг) і біс(пінаколато)диборону (14,8 кг). Одержану суміш перемішують протягом 0,5 години. Додавали Pd(dppf)Cl2-DCM (0,91 кг) з подальшим додаванням бромбензолу-d5 (9,0 кг) і 2-метилтетрагідрофурану (12,2 л). Суміш нагрівали до 8085°С протягом 3 годин, після чого температуру знижували до температури навколишнього середовища. Неочищену суміш фільтрували через кізельгур і силікагель. Осад на фільтрі промивали 2-метилтетрагідрофураном (31 л). Об'єднані фільтрати концентрували до приблизно 25 л, підтримуючи температуру нижче 35°С. Додавали н-гептан (52 л) і 7% водний розчин NaHCО3 (31 л) і одержану суміш перемішували протягом 0,5 години. Органічний шар перемішували з 7%-вим водним NaHCО3 (31 л) протягом 0,5 години. Об'єднані водні шари екстрагували н-гептаном (22 л) протягом 0,5 години. Об'єднані органічні екстракти промивали 25%-вим водним розчином NaCl (50 л) протягом 0,5 години. Органічний шар концентрували, 23 UA 110526 C2 5 10 15 20 25 30 35 40 45 підтримуючи температуру нижче 35°С, одержуючи при цьому 4,4,5,5-тетраметил-2-d5-феніл[1,3,2]діоксаборолан (сполука B'; 10,5 кг), достатньо чистий для наступної стадії. У реактор додавали послідовно 1,4-діоксан (85 л), 6-хлорінден-1-он (сполука B; 9,09 кг, одержана за способом, аналогічним способу, описаному вище), 1,5-циклооктадієн (0,2 л), біс(норборнадієн)родію(I) тетрафторборат (0,52 кг), триетиламін (5,5 л), 4,4,5,5-тетраметил-2-d5феніл-[1,3,2]діоксаборолан (сполука B'; 6,5 кг) і 1,4-діоксан (26 л). Суміш нагрівали до 48-53°С і перемішували при цій температурі протягом 5 годин. Реакцію гасили додаванням 2 М водним HCl (13 кг). Потім додавали н-гептан (110 л), метил-трет-бутиловий етер (32 л) і воду (90 л) і одержану суміш перемішували протягом 0,3 години. Органічний шар промивали водою (90 л) протягом 0,3 години. Об'єднані водні шари екстрагували сумішшю метил-трет-бутилового етеру (30 л) і н-гептану (57 л) протягом 0,3 години. Об'єднані органічні шари профільтрували через силікагель (13 кг). Осад на фільтрі промивали сумішшю 2:1 н-гептану і метил-трет-бутилового етеру (19,5 кг). Фільтрат концентрували приблизно до 25 л. Додавали н-гептан (45 л) і об'єм суміші зменшували до приблизно 25 л. Додавали н-гептан (45 л) і об'єм суміші зменшували до приблизно 35 л. Суміш перемішували при 0-5°С протягом 3 годин. Суміш центрифугували і тверду речовину, що залишилася, сушили, одержуючи при цьому рацемічний 6-хлор-3-d5феніліндан-1-он (сполука С; 8,4 кг), достатньо чистий для наступної стадії. У реактор додавали тетрагідрофуран (90 л) з подальшим додаванням води (10 л) і 6-хлор-3d5-феніліндан-1-ону (сполука С; 7,73 кг) (схема 10). Суміш охолоджували до температури -35 - 30°C. Порціями додавали борогідрид натрію (1,5 кг), підтримуючи температуру -35 - -30°С. Одержану суміш перемішували при температурі -35 - -30°С протягом 5 годин, після чого давали їй можливість нагрітися до температури навколишнього середовища. Надлишок борогідриду натрію гасили додаванням 2 М водного HCl (7,6 кг), підтримуючи температуру нижче 45°С. Додавали воду (17 л) і метил-трет-бутиловий етер (67 л) і суміш перемішували протягом 0,3 години. Водний шар екстрагували метил-трет-бутиловим етером (39 л) протягом 0,3 години. Об'єднані органічні шари промивали сольовим розчином (36 кг) протягом 0,3 години. Органічний шар профільтрували через силікагель (6,4 кг). Осад на фільтрі промивали метил-третбутиловим етером (20 л). Об'єднані фільтрати концентрували приблизно до 30 л, підтримуючи температуру нижче 45°С. Додавали н-гептан (55 л) і одержану суміш концентрували приблизно до 30 л, підтримуючи температуру нижче 45°С. Одержану суміш перемішували при 0-5°С протягом 2 годин. Суміш центрифугували і осад на фільтрі промивали н-гептаном (12 л), перш ніж її знову центрифугували. Тверду речовину, що залишилася, сушили, одержуючи при цьому неочищену речовину D. 4,87 кг цієї речовини розчиняли в метил-трет-бутиловому етері (20 л) і сушили над Na2SO4 (2 кг) протягом 0,25 години. Суміш профільтрували і осад на фільтрі промивали метил-трет-бутиловим етером (4,4 л). Об'єднаний фільтрат концентрували приблизно до 20 л, підтримуючи температуру нижче 45°С. Додавали н-гептан (32 л) і суміш концентрували приблизно до 25 л, підтримуючи температуру нижче 45°С. Додавали н-гептан (16 л) і суміш концентрували до приблизно 20 л, підтримуючи температуру нижче 45°С. Тверду речовину відфільтрували і сушили, одержуючи при цьому рацемічний цис-6-хлор-3-d5феніліндан-1-ол (сполука D; 4,99 кг), достатньо чистий для наступної стадії. Схема 10. Синтез і розділення сполуки Е на ізомери До розчину рацемічного цис-6-хлор-3-d5-феніліндан-1-олу (сполука D, 50 г) в 2ізопропоксипропані (200 мл) додавали вінілбутират (120 мл) і новозим-435 (15 г). Суміш витримували при температурі навколишнього середовища протягом 2 днів. Тверду речовину відфільтровували. Фільтрат випаровували і очищали хроматографією на силікагелі, одержуючи при цьому (1S,3S)-6-хлор-3-d5-феніліндан-1-ол (сполука Е; 13 г), достатньо чистий для наступної стадії. Розчин (1S,3S)-6-хлор-3-d5-феніліндан-1-олу (сполука Е; 7 г) у ТГФ (100 мл) обробляли 24 UA 110526 C2 5 10 15 20 25 30 35 40 45 50 SOCl2 (6,6 г) при температурі навколишнього середовища протягом ночі. Суміш виливали в охолоджену льодом воду і екстрагували етилацетатом. Органічний шар промивали насиченим сольовим розчином. Органічний шар сушили над Na2SО4, фільтрували і концентрували у вакуумі, одержуючи при цьому проміжний хлорид (7,5 г). 3,5 г цієї речовини розчиняли в 2бутаноні (50 мл) і піддавали взаємодії з 2,2-диметилпіперазином (1,7 г) у присутності K2CО3 (2,7 г) при кип'ятінні із зворотним холодильником протягом ночі. Тверду речовину відфільтрували. Фільтрат концентрували у вакуумі і залишок очищали за допомогою препаративної ВЕРХ на приладі Shimadzu FRC-10A, забезпеченому колонкою C18 Synergi (250 мм х 50 мм, 10 мкм), із застосуванням води і ацетонітрилу (що містить 0,1% TFA, об./об.) як елюенту, одержуючи при цьому 1-((1R,3S)-6-хлор-3-d5-феніліндан-1-іл)-3,3-диметилпіперазин (сполука F; 2,6 г), достатньо чистий для наступної стадії. Розчин 1-((1R,3S)-6-хлор-3-d5-феніліндан-1-іл)-3,3-диметилпіперазину (сполука F; 2,2 г) у HCHO/НСООН (3 мл/3 мл) кип'ятили із зворотним холодильником протягом ночі. Леткі речовини видаляли у вакуумі. Залишок розподіляли між етилацетатом і 10% водним NaOH. Органічний шар сушили над Na2SО4, профільтрували і концентрували у вакуумі. Залишок очищали хроматографією на силікагелі, одержуючи при цьому 4-((1R,3S)-6-хлор-3-d5-феніліндан-1-іл)1,2,2-триметилпіперазин (сполука (II); 1,89 г). РХ-МС (метод WXV-AB05): RT(УФ) 2,43 хв.; чистота за УФ/ELS 95,1%/99,6%; спостережувана маса 360,2. Включення п'яти атомів дейтерію 13 складає >95%. С ЯМР-спектр з розв'язкою протонів показав три триплети у приблизно 126,1, 127,2 і 128,2 м.д., відповідні дейтерованим метаболічним ділянкам М3; цей сигнал 13 перетворювався на три синглети в C ЯМР-спектрі з розв'язкою протонів і дейтерію. Всі інші сигнали були синглетами в обох спектрах. Оптична чистота ізомеру >95% ee. Розчин 1-((1R,3S)-6-хлор-3-d5-феніліндан-1-іл)-3,3-диметилпіперазину (сполука F; 3,0 г) у DCDO/DCOOD (4 мл/4 мл) кип'ятили із зворотним холодильником протягом ночі. Леткі речовини видаляли у вакуумі. Залишок розподіляли між етилацетатом і 10% водним NaOH. Органічний шар сушили над Na2SО4, профільтрували і концентрували у вакуумі. Залишок очищали хроматографією на силікагелі, одержуючи при цьому 4-((1R,3S)-6-хлор-3-d5-феніліндан-1-іл)-1d3-метил-2,2-диметилпіперазин (сполука (IV); 2,14 г). РХ-МС (метод WXV-AB10): RT(УФ) 2,06 хв.; чистота за УФ/ELS 98%/100%; спостережувана маса 363,3. Включення восьми атомів 13 дейтерію складає >94%. С ЯМР-спектр з розв'язкою протонів показав гептет у приблизно 36,4 м.д., відповідний дейтерованій метаболічній ділянці М2; цей сигнал перетворюється на синглет 13 13 в С ЯМР-спектрі з розв'язкою протонів і дейтерію. С ЯМР-спектр з розв'язкою протонів показав також три триплети у приблизно 126,1, 127,2 і 128,2 м.д., відповідні дейтерованим 13 метаболічним ділянкам М3; ці сигнали перетворюються на три синглети в С ЯМР-спектрі з розв'язкою протонів і дейтерію. Всі інші сигнали були синглетами в обох спектрах. Оптична чистота ізомеру була >95% ee. Приклад 4. Одержання 4-((1R,3S)-6-хлор-3-феніліндан-1-іл)-1,2,2-триметилпіперазину-6,6-d2 (сполука (III)), 4-((1R,3S)-6-хлор-3-феніліндан-1-іл)-1-метил-d3-2,2-диметилпіперазину-6,6-d2 (сполука (V)), 4-((1R,3S)-6-хлор-3-феніл-d5-індан-1-іл)-1-метил-d3-2,2-диметилпіперазину-6,6-d2 (сполука (VI)) і 4-((1R,3S)-6-хлор-3-феніл-d5-індан-1-іл)-1,2,2-триметилпіперазину-6,6-d2 (сполука (VII). 2-Аміно-2-метилпропіонову кислоту (50,0 г) суспендували в суміші метанолу і триетиламіну (9:1, 1,2 л) (схема 11). Додавали 1 М водний розчин NaOH (450 мл) при перемішуванні до тих пір, поки вся тверда речовина не розчинилася. Додавали ди-трет-бутилдикарбонат (Boc2О; 214,0 г) і суміш перемішували при температурі навколишнього середовища протягом ночі. Органічні леткі речовини видаляли у вакуумі. Додавали EtOAc (500 мл). Органічний шар промивали насиченим сольовим розчином і сушили над Nа2SО4, фільтрували, потім концентрували, одержуючи при цьому 2-трет-бутоксикарбоніламіно-2-метилпропіонову кислоту (сполука K; 90 г) у вигляді білої твердої речовини, яку застосовували безпосередньо на наступній стадії. Схема 11. Синтез проміжного продукту J 25 UA 110526 C2 5 10 15 20 25 30 35 Суміш одержаної 2-трет-бутоксикарбоніламіно-2-метилпропіонової кислоти (сполука K; 60,0 г) і гідрохлориду 1-етил-3-(3-диметиламінопропіл)-карбодііміду (EDC·HCl; 86,4 г) в дихлорметані (900 мл) перемішували при температурі навколишнього середовища, потім додавали гідрохлорид N,O-диметилгідроксиламіну (35,3 г) і триетиламін (150 мл). Одержану суміш перемішували при температурі навколишнього середовища протягом 3 днів. Додавали воду і велику частину летких речовин видаляли у вакуумі. Залишок розподіляли між DCМ і водним розчином NaHCО3. Органічний шар промивали 3 М водним HCl, потім насиченим сольовим розчином, після чого сушили над Na2SО4, фільтрували і концентрували у вакуумі. Залишок очищали хроматографією на силікагелі, одержуючи при цьому трет-бутиловий естер [1(метоксиметилкарбамоїл)-1-метилетил]карбамінової кислоти (сполука L; 28,2 г) у вигляді білої твердої речовини, достатньо чистої для наступної стадії. Літійалюмінійгідрид (7,8 г) додавали до перемішуваного розчину трет-бутилового естеру [1(метоксиметилкарбамоїл)-1-метилетил]карбамінової кислоти (сполука L; 42,0 г) в безводному діетиловому етері (1,5 л) при -40°С. Потім суміш перемішували при такій же температурі протягом приблизно 5 хвилин. Надлишок LiAlH4 гасили розчином гідросульфату калію у воді. Одержану суміш розподіляли між EtOAc і 3 М водним HCl. Органічний шар промивали насич. водним розчином NaHCО3, сушили над Nа2SО4, фільтрували і концентрували у вакуумі, одержуючи при цьому трет-бутиловий естер (1,1-диметил-2-оксоетил)-карбамінової кислоти (сполука М; 29 г), достатньо чистий для наступної стадії. Гідрохлорид метилового естеру амінооцтової кислоти (80,6 г) і Et3N (160 мл) розчиняли в DCМ (1000 мл) і перемішували протягом 15 хвилин, щоб виділити амін з солі. Потім додавали розчин трет-бутилового естеру 1,1-диметил-2-оксоетил)-карбамінової кислоти (сполука M; 29,0 г) в DCМ (600 мл). Одержану суміш перемішували протягом 0,5 години при температурі навколишнього середовища, потім додавали NaBH(OAc) 3 (102 г) і суміш перемішували при температурі навколишнього середовища протягом ночі. Додавали насич. водний розчин NaHCО3. Водний шар екстрагували DCМ. Об'єднані органічні шари сушили над Nа 2SО4, фільтрували і концентрували у вакуумі. Залишок очищали хроматографією на силікагелі, одержуючи при цьому метиловий естер (2-трет-бутоксикарбоніламіно-2-метилпропіламіно)оцтової кислоти (сполука N; 26,5 г) у вигляді білої твердої речовини, яку безпосередньо застосовували на наступній стадії. Розчин метилового естеру (2-трет-бутоксикарбоніламіно-2-метилпропіламіно)-оцтової кислоти (сполука N; 26,5 г) в DCМ (800 мл) перемішували при температурі навколишнього середовища, додавали по краплях TFA (180 мл). Суміш перемішували при 30-40°С протягом 5 годин, після чого концентрували у вакуумі. Залишок розподіляли між розчиненим толуолом і водою. Органічний шар сушили над Nа2SО4, фільтрували і концентрували у вакуумі. Тверду 26 UA 110526 C2 5 10 15 20 25 30 35 40 45 речовину, що залишилася, розчиняли в суміші етанолу (400 мл) і метанолу (90 мл). Додавали K2CО3 (207 г) і суміш кип'ятили із зворотним холодильником протягом ночі. Суміш охолоджували до кімнатної температури. Додавали DCM (2500 мл) і суміш перемішували протягом 1 години при температурі навколишнього середовища. Тверду речовину відфільтровували і фільтрат концентрували у вакуумі, одержуючи при цьому 6,6-диметилпіперазин-2-он (сполука I; 5,85 г) у вигляді білої твердої речовини, достатньо чистої для наступної стадії. Розчин 6,6-диметилпіперазин-2-ону (сполука I; 3,6 г) в ТГФ (20 мл) перемішують при 0°С. Додавали літійалюмінійдейтерид (LiAlD4; 3,6 г), потім суміш кип'ятили із зворотним холодильником протягом ночі. Суміш охолоджували до температури навколишнього середовища і додавали Nа2SО4. Суміш перемішували протягом 0,5 години перед видаленням більшої частини летких речовин у вакуумі. Залишок суспендували в насиченому розчині HCl в EtOAc при кімнатній температурі протягом 0,5 години. Тверду речовину відфільтровували і сушили, одержуючи при цьому 2,2-d2-6,6-диметилпіперазин у вигляді біс-гідрохлоридної солі (сполука J•2НСl; 5,3 г), достатньо чистої для наступної стадії. До розчину сполуки Е' (5 г) в ТГФ (50 мл) додавали SOCl 2 (4,7 г) і одержану суміш перемішували протягом ночі при температурі навколишнього середовища (схема 12). Суміш виливали у воду з льодом і екстрагували EtOAc. Органічний шар промивали насиченим сольовим розчином, сушили над Nа2SО4, фільтрували і концентрували у вакуумі, одержуючи при цьому відповідний хлорид (5,3 г), який застосовували безпосередньо на наступній стадії. 3,3 г цієї речовини розчиняли в 2-бутаноні (50 мл) і піддавали взаємодії з 2,2-d2-6,6диметилпіперазином (сполука J; 3 г) у присутності K2CО3 (8,28 г) при кип'ятінні із зворотним холодильником протягом ночі. Тверду речовину відфільтрували. Фільтрат концентрували у вакуумі. Залишок очищали за допомогою препаративної ВЕРХ на приладі Shimadzu FRC-10A, забезпеченому колонкою Synergy C18 (250 мм х 50 мм, 10 мкм) із застосуванням води і ацетонітрилу (що містить 0,1% TFA, об./об.) як елюентів, одержуючи при цьому 1-((1R,3S)-6хлор-3-феніліндан-1-іл)-3,3-d2-5,5-диметилпіперазин (сполука O; 1,7 г). Схема 12. Синтез сполуки (III) і сполуки (V) Розчин 1-((1R,3S)-6-хлор-3-феніліндан-1-іл)-3,3-d2-5,5-диметилпіперазину (сполука O; 0,5 г) у HCHO/HCOOH (1 мл/1 мл) кип'ятили із зворотним холодильником протягом ночі. Леткі речовини видаляли у вакуумі. Залишок розподіляли між EtOAc і 10% водним NaOH. Органічний шар сушили над Nа2SО4, фільтрували і концентрували у вакуумі. Залишок очищали хроматографією на силікагелі, одержуючи при цьому 4-((1R,3S)-6-хлор-3-феніліндан-1-іл)-1,2,2триметилпіперазин-6,6-d2 (сполука (III); 0,33 г). РХ-МС (метод WXV-AB30): RT(УФ) 1,42 хв.; чистота за УФ/ELS 100%/100%; спостережувана маса 357,2. Включення двох атомів дейтерію 13 складало >97%. C ЯМР-спектр з розв'язкою протонів показав квінтет у приблизно 49,5 м.д., 13 відповідний дейтерованій метаболічній ділянці М1; цей сигнал перетворювався на синглет в C 13 ЯМР-спектрі з розв'язкою протонів і дейтерію. C ЯМР-спектр з розв'язкою протонів додатково показав три триплети при приблизно 126,1, 127,2 і 128,2 м.д., відповідні дейтерованим 13 метаболічним ділянкам М3; ці сигнали перетворювалися на три синглети в C ЯМР-спектрі з розв'язкою протонів і дейтерію. Всі інші сигнали були синглетами в обох спектрах. Оптична чистота ізомеру була >95% ee. Розчин 1-((1R,3S)-6-хлор-3-феніліндан-1-іл)-3,3-d2-5,5-диметилпіперазину (сполука O; 0,7 г) у DCDO/DCOOD (1 мл/1 мл) кип'ятили із зворотним холодильником протягом ночі. Леткі речовини видаляли у вакуумі. Залишок розподіляли між EtOAc і 10% водним NaOH. Органічний шар сушили над Nа2SО4, фільтрували і концентрували у вакуумі. Залишок очищали хроматографією на силікагелі, одержуючи при цьому 4-((1R,3S)-6-хлор-3-феніліндан-1-іл)-1метил-d3-2,2-диметилпіперазин-6,6-d2 (сполука (V); 0,49 г). РХ-МС (метод WXVAB25): RT(УФ) 2,13 хв.; чистота за УФ/ELS 100%/100%; спостережувана маса 360,2. Включення п'яти атомів 27 UA 110526 C2 13 5 10 15 20 25 30 35 40 45 дейтерію складало >95%. C ЯМР-спектр з розв'язкою протонів показав гептет у приблизно 36,4 м.д., відповідний дейтерованій метаболічній ділянці М2; цей сигнал перетворюється на 13 13 синглет в C ЯМР-спектрі з розв'язкою протонів і дейтерію. C ЯМР-спектр з розв'язкою протонів додатково показав квінтет у приблизно 49,5 м.д., відповідний дейтерованій 13 метаболічній ділянці М1; цей сигнал перетворювався на синглет в C ЯМР-спектрі з розв'язкою протонів і дейтерію. Всі інші сигнали були синглетами в обох спектрах. Оптична чистота ізомеру була >95% ee. Розчин (1S,3S)-6-хлор-3-d5-феніліндан-1-олу (сполука Е; 7 г) у ТГФ (100 мл) обробляли SOCl2 (6,6 г) при температурі навколишнього середовища протягом ночі (схема 13). Суміш виливали у воду з льодом і екстрагували етилацетатом. Органічний шар промивали насиченим сольовим розчином. Органічний шар сушили над Na2SО4, фільтрували і концентрували у вакуумі, одержуючи при цьому проміжний хлорид (7,5 г). Схема 13. Синтез сполуки (VI) і сполуки (VII) 1,8 г цієї речовини розчиняли в 2-бутаноні (30 мл) і піддавали взаємодії з 2,2-d2-6,6диметилпіперазином (сполука J; 1,4 г) у присутності K2CО3 (5,5 г) при кип'ятінні із зворотним холодильником протягом ночі. Тверду речовину відфільтровували. Фільтрат концентрували у вакуумі. Залишок очищали за допомогою препаративної ВЕРХ на приладі Shimadzu FRC-10A, забезпеченому колонкою Synergy C18 (250 мм х 50 мм, 10 мкм) із застосуванням води і ацетонітрилу (що містить 0,1% TFA, об./об.) як елюентів, одержуючи при цьому 1-((1R,3S)-6хлор-3-d5-феніліндан-1-іл)-3,3-d2-5,5-диметилпіперазин (сполука Р; 1,7 г). Розчин 1-((1R,3S)-6-хлор-3-d5-феніліндан-1-іл)-3,3-d2-5,5-диметилпіперазину (сполука Р; 1 г) у DCDO/DCOOD (1,5 мл/1,5 мл) кип'ятили із зворотним холодильником протягом ночі. Леткі речовини видаляли у вакуумі. Залишок розподіляли між ЕtOAc і 10% водним NaOH. Органічний шар сушили над Na2SO4, фільтрували і концентрували у вакуумі. Залишок очищали хроматографією на силікагелі, одержуючи при цьому 4-((1R,3S)-6-хлор-3-d5-феніліндан-1-іл)-1d3-метил-2,2-диметилпіперазин-6,6-d2 (сполука (VI); 0,55 г). РХ-МС (метод WuXiAB25): RT(УФ) 2,13 хв.; чистота за УФ/ELS 98,2%/100%; спостережувана маса 365,2. Включення десяти атомів 13 дейтерію складає >91%. C ЯМР-спектр з розв'язкою протонів показав гептет у приблизно 36,4 м.д., відповідний дейтерованій метаболічній ділянці М2; цей сигнал перетворюється на синглет 13 13 в C ЯМР-спектрі з розв'язкою протонів і дейтерію. C ЯМР-спектр з розв'язкою протонів додатково показав квінтет у приблизно 49,5 м.д., відповідний дейтерованій метаболічній ділянці 13 М1; цей сигнал перетворювався на синглет в C ЯМР-спектрі з розв'язкою протонів і дейтерію. 13 C ЯМР-спектр з розв'язкою протонів додатково показав три триплети у приблизно 126,1, 127,2 і 128,2 м.д., відповідні дейтерованим метаболічним ділянкам М3; ці сигнали перетворювалися 13 на три синглети в C ЯМР-спектрі з розв'язкою протонів і дейтерію. Всі інші сигнали були синглетами в обох спектрах. Оптична чистота ізомеру була >95% ee. Розчин 1-((1R,3S)-6-хлор-3-d5-феніліндан-1-іл)-3,3-d2-5,5-диметилпіперазину (сполука Р; 0,7 г) у HCHO/HCOOH (1 мл/1 мл) кип'ятили із зворотним холодильником протягом ночі. Леткі речовини видаляли у вакуумі. Залишок розподіляли між EtOAc і 10% водним NaOH. Органічний шар сушили над Na2SO4, фільтрували і концентрували у вакуумі. Залишок очищали хроматографією на силікагелі, одержуючи при цьому 4-((1R,3S)-6-хлор-3-d5-феніліндан-1-іл)-1метил-2,2-диметилпіперазин-6,6-d2 (сполука (VII); 0,47 г). РХ-МС (метод WXV-AB30): RT(УФ) 1,33 хв.; чистота за УФ/ELS 97,4%/100%; спостережувана маса 362,3. Включення семи атомів 13 дейтерію складало >93%. C ЯМР-спектр з розв'язкою протонів показав квінтет у приблизно 49,5 м.д., відповідний дейтерованій метаболічній ділянці М1; цей сигнал перетворювався на 13 13 синглет в C ЯМР-спектрі з розв'язкою протонів і дейтерію. C ЯМР-спектр з розв'язкою протонів додатково показав три триплети у приблизно 126,1, 127,2 і 128,2 м.д., відповідні 28
ДивитисяДодаткова інформація
Назва патенту англійськоюDeuterated 1-piperazino-3-phenyl indanes for treatment of schizophrenia
Автори англійськоюJorgensen, Morten, Andersen, Peter, Hongaard, Jensen, Klaus, Gjervig, Hvenegaard, Mette, Graulund, Badolo, Lassina, Jacobsen, Mikkel, Fog
Автори російськоюЙоргенсен Мортен, Андерсен Петер Хонгор, Енсен Клаус Герви, Венегор Метте Граулунн, Бадоло Лассина, Якобсен Миккель Фог
МПК / Мітки
МПК: C07D 241/04, A61P 25/00, C07B 59/00, A61K 31/495
Мітки: 1-піперазино-3-феніліндани, лікування, шизофренії, дейтеровані
Код посилання
<a href="https://ua.patents.su/55-110526-dejjterovani-1-piperazino-3-fenilindani-dlya-likuvannya-shizofreni.html" target="_blank" rel="follow" title="База патентів України">Дейтеровані 1-піперазино-3-феніліндани для лікування шизофренії</a>
Попередній патент: Похідні піразолу
Наступний патент: Способи і пристрої для вдосконалення механізмів оновлення параметрів nfc
Випадковий патент: Пристрій для піднімання затонулих об'єктів і проведення підводних робіт ("морський стакан")