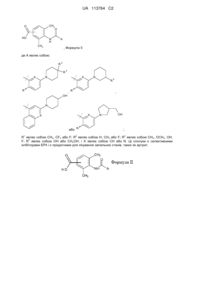
Сполуки диметилбензойної кислоти
Номер патенту: 113764
Опубліковано: 10.03.2017
Автори: Бланко-Пілладо Марія-Джізус, Ветман Татіана Наталі, Кукліш Стівен Лі, Фішер Метью Джозеф
Формула / Реферат
1. Сполука формули:
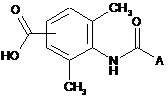 ,
,
де А являє собою:
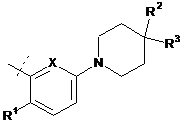 ,
, 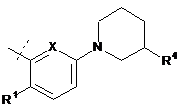 ,
,
 або
або 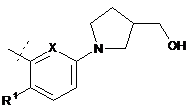 ;
;
R1 являє собою СН3, CF3 або F;
R2 являє собою Н, СН3 або F;
R3 являє собою СН3, ОСН3, ОН, F;
R4 являє собою ОН або СН2ОН; і
X являє собою СН або N;
або її фармацевтично прийнятна сіль.
2. Сполука або сіль за п. 1, де А являє собою:
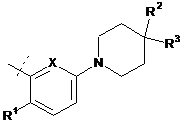 .
.
3. Сполука або сіль за п. 1 або п. 2, де R1 являє собою СН3.
4. Сполука або сіль за будь-яким з пп. 1-3, де X являє собою N.
5. Сполука або сіль за будь-яким з пп. 1-4, де R2 являє собою Η і R3 являє собою ОН.
6. Сполука за п. 1, яка являє собою:
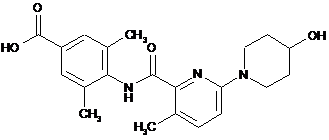 ,
,
або її фармацевтично прийнятна сіль.
7. Сполука за п. 1, яка являє собою:
 .
.
8. Гідратована сполука за п. 7.
9. Гідратована сполука за п. 8, яка відрізняється тим, що має суттєвий пік в спектрі дифракції рентгенівських променів, при куті дифракції 2-тета 9,0°, в поєднанні з двома або більше піками при куті дифракції 2-тета, вибраним з групи, яку складають 5,8°, 8,5°, 9,8°, 11,6°, 11,8°, 17,5° і 24,2°.
10. Спосіб лікування у пацієнта остеоартриту, який включає введення пацієнту, який потребує такого лікування, ефективної кількості сполуки або її фармацевтично прийнятної солі за пп. 1-9.
11. Спосіб лікування у пацієнта ревматоїдного артриту, який включає введення пацієнту, який потребує такого лікування, ефективної кількості сполуки або її фармацевтично прийнятної солі за пп. 1-9.
12. Спосіб лікування у пацієнта болю, пов'язаного з остеоартритом або ревматоїдним артритом, який включає введення пацієнту, який потребує такого лікування, ефективної кількості сполуки або її фармацевтично прийнятної солі за пп. 1-9.
13. Сполука або її фармацевтично прийнятна сіль за пп. 1-9 для застосування в терапії.
14. Сполука або її фармацевтично прийнятна сіль за пп. 1-9 для застосування в лікуванні остеоартриту.
15. Сполука або її фармацевтично прийнятна сіль за пп. 1-9 для застосування в лікуванні ревматоїдного артриту.
16. Сполука або її фармацевтично прийнятна сіль за пп. 1-9 для застосування в лікуванні болю, пов'язаного з остеоартритом або ревматоїдним артритом.
17. Фармацевтична композиція, яка містить сполуку або її фармацевтично прийнятну сіль за пп. 1-9 в комбінації з одним або більше фармацевтично прийнятними носіями, розріджувачами або допоміжними речовинами.
Текст
Реферат: Цей винахід пропонує сполуку Формули II: (72) Винахідник(и): Бланко-Пілладо Марія-Джізус (US), Ветман Татіана Наталі (US), Фішер Метью Джозеф (US), Кукліш Стівен Лі (US) (73) Власник(и): ЕЛІ ЛІЛЛІ ЕНД КОМПАНІ, Lilly Corporate Center, Indianapolis, Indiana 46285, United States of America (US) (74) Представник: Шляховецький Ілля Олександрович, реєстр. №190 (56) Перелік документів, взятих до уваги експертизою: US 7705035 B2 (BOYD MICHAEL [CA] ET AL.), 27.04.2010 DATABASE HCAPLUS, ACS, Database accession no. 134:51387(DN), URL: STN, XP002714917 [A] 1-17 * abstract * * RN104363-98-6 COLUCCI J. ET AL., "Discovery of 4-{1-[({1-[4(trifluoromethyl)benzyl]-1H-indol-7yl}carbonyl)amino]cyclopropyl}benzoic acid (MF-766), a highly potent and selective EP4 antagonist for treating inflammatory pain", BIOORGANIC & MEDICINAL CHEMISTRY LETTERS, PERGAMON, vol. 20, no. 12, pages 3760-3763 UA 113764 C2 (12) UA 113764 C2 CH3 O HO N H O A CH3 , Формула II де А являє собою: R 2 R X 3 N X N R R 1 1 , R 4 , OH N X X 1 або R 1 2 N OH ; 3 R являє собою СН3, CF3 або F; R являє собою Н, СН3 або F; R являє собою СН3, ОСН3, ОН, 4 F; R являє собою ОН або СН2ОН; і X являє собою СН або N. Ці сполуки є селективними інгібіторами ЕР4 і є придатними для лікування запальних станів, таких як артрит. UA 113764 C2 5 10 15 20 25 30 Цей винахід стосується нових сполук диметилбензойної кислоти, фармацевтичних композицій, що містять ці сполуки, способів застосування вказаних сполук для лікування фізіологічних розладів і проміжних хімічних сполук та способів, придатних для синтезу вказаних сполук. Цей винахід має відношення до галузі лікування запальних станів, таких як артрит, у тому числі остеоартрит і ревматоїдний артрит, а також болю, пов'язаного з цими станами. Артритом вражено мільйони пацієнтів в одних тільки Сполучених Штатах, і він є однією з основних причин інвалідності. Лікування часто включає застосування NSAIDs (нестероїдні протизапальні лікарські засоби) або інгібіторів COX-2 (циклооксигеназа-2), які можуть бути джерелом небажаних серцево-судинних побічних ефектів. У зв'язку з цим пацієнтам, які мають проблеми, пов'язані з серцево-судинною системою, такі як гіпертонія, може бути протипоказаним застосування NSAIDs або інгібіторів COX-2. Отже існує необхідність в альтернативному лікуванні остеоартриту і ревматоїдного артриту, за варіантом, якому віддають перевагу, без побічних ефектів, спричинюваних лікуванням, яке існує на цей час. Чотири підтипи рецепторів простагландину Е2 (PGE2) були визначені як EP1, EP2, EP3 та EP4. Було виявлено, що EP4 є основним рецептором, залученим до запального болю суглобів в моделях ревматоїдного артриту і остеоартриту у гризунів (Дивись J. Pharmacol. Exp. Ther., 325, 425 (2008)). Отже, селективний антагоніст EP4 може бути корисним в лікуванні артриту, у тому числі артритного болю. Крім того, було висловлено припущення, що, оскільки антагонізм по відношенню до EP4 не заважає біосинтезу простаноїдів, таких як PGI 2 та ТхА2, то селективний антагоніст EP4 може бути нездатним спричинювати серцево-судинні побічні ефекти, які спостерігаються у разі NSAID та інгібіторів СОХ-2. (Дивись, наприклад, Bioorganic & Medicinal Chemistry Letters, 21, 484 (2011)). У WO 96/02509 розкриті певні похідні хіноліну, які є селективними непептидними антагоністами NK3, придатними для лікування низки розладів, у тому числі, наприклад, легеневих розладів, розладів ЦНС, нейрогенного запалення і запального болю. Крім того, у патенті США № 7,705,035 розкриті певні амідні похідні індоліну, придатні для застосування як ліганди, агоністів або антагоністів EP4, придатні для лікування різних розладів, таких як остеоартрит, ревматоїдний артрит, та гострий і хронічний біль. Цей винахід пропонує певні нові сполуки, які є селективними інгібіторами EP4 відносно EP1, EP2 та EP3. Крім того, цим винаходом запропоновані певні нові сполуки, здатні до зниження серцево-судинних або шлунково-кишкових побічних ефектів у порівнянні з традиційними NSAID. Відповідно, цей винахід пропонує сполуку Формули II: , 35 де A являє собою: 1 R являє собою CH3, CF3 або F; 1 UA 113764 C2 2 5 10 15 20 25 30 35 40 45 50 R являє собою H, CH3 або F; 3 R являє собою CH3, OCH3, OH, F; 4 R являє собою OH або CH2OH; та X являє собою CH або N; або її фармацевтично прийнятну сіль. Цей винахід також пропонує сполуку Формули I: або її фармацевтично прийнятну сіль. Цей винахід також пропонує гідратовану сполуку Формули I. Цей винахід також пропонує спосіб лікування у пацієнта артриту, який включає введення пацієнту, який потребує такого лікування, ефективної кількості сполуки Формули I або Формули II, або її фармацевтично прийнятної солі. Цей винахід також пропонує спосіб лікування у пацієнта остеоартриту, який включає введення пацієнту, який потребує такого лікування, ефективної кількості сполуки Формули I або Формули II, або її фармацевтично прийнятної солі. Крім того, цей винахід пропонує спосіб лікування у пацієнта ревматоїдного артриту, який включає введення пацієнту, який потребує такого лікування, ефективної кількості сполуки Формули I або Формули II, або її фармацевтично прийнятної солі. Цей винахід також пропонує спосіб лікування у пацієнта болю, пов'язаного з артритом, який включає введення пацієнту, який потребує такого лікування, ефективної кількості сполуки Формули I або Формули II, або її фармацевтично прийнятної солі. Цей винахід також пропонує спосіб лікування у пацієнта болю, пов'язаного з остеоартритом або ревматоїдним артритом, який включає введення пацієнту, який потребує такого лікування, ефективної кількості сполуки Формули I або Формули II, або її фармацевтично прийнятної солі. Крім того, цей винахід пропонує сполуку Формули I або Формули II, або її фармацевтично прийнятну сіль, для застосування в терапії, зокрема у лікуванні остеоартриту. На додаток до цього, цей винахід пропонує сполуку Формули I або Формули II, або її фармацевтично прийнятну сіль, для застосування у лікуванні ревматоїдного артриту. Цей винахід також пропонує сполуку Формули I або Формули II, або її фармацевтично прийнятну сіль, для застосування у лікуванні болю, пов'язаного з остеоартритом або ревматоїдним артритом. Крім того, цей винахід пропонує застосування сполуки Формули I або Формули II, або її фармацевтично прийнятної солі, для виготовлення лікарського засобу для лікування остеоартриту. Цей винахід пропонує застосування сполуки Формули I або Формули II, або її фармацевтично прийнятної солі для виготовлення лікарського засобу для лікування ревматоїдного артриту. Цей винахід також пропонує застосування сполуки Формули I або Формули, II або її фармацевтично прийнятної солі, для виготовлення лікарського засобу для лікування болю, пов'язаного з остеоартритом або ревматоїдним артритом. Цей винахід також пропонує фармацевтичну композицію, яка містить сполуку Формули I або Формули II, або її фармацевтично прийнятну сіль, в комбінації з одним або більше фармацевтично прийнятними носіями, розріджувачами або допоміжними речовинами. У варіанті здійснення цього винаходу, який заслуговує особливої уваги, композиція додатково містить один або декілька інших терапевтичних агентів. Цей винахід також охоплює нові проміжні хімічні сполуки та способи синтезу сполуки Формули I або Формули II, або її фармацевтично прийнятної солі. Крім того, цей винахід включає спосіб лікування у пацієнта запальних станів, таких як артрит, у тому числі остеоартрит і ревматоїдний артрит, який включає введення пацієнту, який потребує такого лікування, ефективної кількості антагоніста прозапального простагландину, наприклад, антагоніста EP4, в комбінації з ефективною кількістю модулятора рецептора ліпоксину або резолвіну, наприклад, модулятора BLT-1, BLT-2, ALX/FPR1, GPR32, CysLT1, CysLT2 або ChemR23. Один з аспектів цього винаходу включає спосіб лікування у пацієнта запального захворювання, такого як артрит, у тому числі остеоартрит і ревматоїдний артрит, який включає введення пацієнту, який потребує такого лікування, ефективної кількості інгібітору прозапальної 2 UA 113764 C2 5 10 15 20 25 30 35 40 простагландинсинтази, наприклад, інгібітору mPGES-1, в комбінації з ефективною кількістю модулятора рецептора ліпоксину або резолвіну, наприклад, модулятора BLT-1, BLT-2, ALX/FPR1, GPR32, CysLT1, CysLT2 або ChemR23. У значенні, вживаному у цьому описі, терміни "лікування" або "лікувати" означають стримування, уповільнення, зупинення або звернення прогресування або тяжкості існуючого симптому або розладу. У значенні, вживаному у цьому описі, термін "пацієнт" означає ссавця, наприклад, мишу, морську свинку, пацюка, собаку або людину. Зрозуміло, що пацієнтом, якому віддають перевагу, є людина. У значенні, вживаному у цьому описі, термін "ефективна кількість" означає кількість або дозу сполуки за даним винаходом або її фармацевтично прийнятної солі, яка, при одноразовому або багаторазовому введенні пацієнту, забезпечує бажаний ефект у пацієнта при визначенні захворювання або лікуванні. Ефективна кількість може бути легко визначена лікарем, який ставить діагноз, як фахівцем в даній галузі, шляхом використання відомих методик і спостереження результатів, одержаних за аналогічних обставин. При визначенні ефективної кількості для пацієнта лікарем, який ставить діагноз, до уваги приймається ряд факторів, в тому числі, але не обмежуючись ними: вид ссавця; його розмір, вік і загальний стан здоров'я; конкретне захворювання або спричинюваний розлад; ступінь або ураження захворювання(-ям) або тяжкість захворювання чи розладу; реакція індивідуального пацієнта; конкретна введена сполука; спосіб введення; характеристики біодоступності лікарського засобу, який вводять; вибрана схема приймання лікарського засобу; використання супутнього лікарського засобу; та інші значущі обставини. Сполука Формули I або Формули II, або її фармацевтично прийнятна сіль є загалом ефективними в широкому діапазоні доз. Наприклад, добові дози зазвичай знаходяться в діапазоні від приблизно 0,01 мг/кг до приблизно 50 мг/кг маси тіла. У деяких випадках рівні доз нижче нижньої межі вказаного вище діапазону можуть бути більш ніж достатніми, тоді як в інших випадках можуть бути використані ще більш високі дози з прийнятними побічними ефектами, і тому вказаний вище діапазон доз не є призначеним для обмеження обсягу даного винаходу будь-яким чином. Сполуки за цим винаходом переважно виготовляють у вигляді фармацевтичних композицій, які вводять будь-яким шляхом, який робить вказану сполуку біодоступною. За варіантом, якому віддають найбільшу перевагу, такі композиції є призначеними для перорального введення. Такі фармацевтичні композиції і способи їх одержання є добре відомими в цій галузі. (Дивись, наприклад, Remington: The Science and Practice of Pharmacy (D.B. Troy, Editor, 21st Edition, Lippincott, Williams & Wilkins, 2006). Є зрозумілим, що Формула II охоплює Формулу IIa та Формулу IIb: Сполуки Формули I і Формули II є зокрема корисними в способах лікування за даним винаходом, але перевагу віддають певним групам, замісникам і конфігураціям. У наведених нижче абзацах розриті такі групи, замісники та конфігурації, яким віддають перевагу. Слід розуміти, що ці переваги стосуються як способів лікування, так і нових сполук за даним винаходом. За варіантом, якому віддають перевагу, A являє собою: 3 UA 113764 C2 1 5 10 15 20 25 30 35 40 45 За варіантом, якому віддають перевагу, R являє собою CH3. За варіантом, якому віддають перевагу, X являє собою N. 2 3 Крім того, за варіантом, якому віддають перевагу, коли R являє собою H, то R являє собою OH. Сполукою, якій віддають перевагу, є 4-[[6-(4-гідрокси-1-піперидил)-3-метилпіридин-2карбоніл]аміно]-3,5-диметилбензойна кислота, яка являє собою: або її фармацевтично прийнятна сіль. Особливу перевагу віддають 4-[[6-(4-гідрокси-1-піперидил)-3-метилпіридин-2карбоніл]аміно]-3,5-диметилбензойній кислоті. Крім того, перевагу віддають гідратованій 4-[[6-(4-гідрокси-1-піперидил)-3-метилпіридин-2карбоніл]аміно]-3,5-диметилбензойній кислоті. Перевагу також віддають гідратованій 4-[[6-(4-гідрокси-1-піперидил)-3-метилпіридин-2карбоніл]аміно]-3,5-диметилбензойній кислоті, яка характеризується суттєвим піком у спектрі дифракції рентгенівських променів, при куті дифракції 2-тета 9,0°, в поєднанні з двома або більше піками при куті дифракції 2-тета, вибраним з групи, яку складають 5,8°, 8,5°, 9,8°, 11,6°, 11,8°, 17,5° і 24,2°. У значенні, вживаному у цьому описі, "DMEM" означає модифіковане за способом Дульбекко середовище Егла; "DMSO" означає диметилсульфоксид; "IPA" означає ізопропіловий спирт; "MeOH" означає метанол; "EtOH" означає етанол; "DMF" означає диметилформамід; "THF" означає тетрагідрофуран; "EtOAc" означає етилацетат, "FBS" означає ембріональну бичачу сироватку; "PGE2" означає простагландин Е2; "FBS" означає ембріональну бичачу сироватку; "IBMX" означає (3-ізобутил-1-метилксантин); "MES" означає (2-(N-морфоліно)етансульфонову кислоту; "HEPES" означає (2-[4-(2-гідроксіетил)піперазин-1-іл]етансульфонову кислоту; "HTRF" означає метод гомогенної флуоресценції з розділенням у часі; "НОК" означає культуру клітин нирки людського ембріону; і "IC 50" означає концентрацію агента, яка спричинює 50 % максимальної інгібувальної реакції, можливої для цього засобу. Фармацевтично прийнятні солі і загальна методика їх одержання є добре відомими в цій галузі. Дивись, наприклад, Gould, P.L., "Salt selection for basic drugs, ” International Journal of Pharmaceutics, 33: 201-217 (1986); Bastin, R.J., et al. "Salt Selection and Optimization Procedures for Pharmaceutical New Chemical Entities, ” Organic Process Research and Development, 4: 427-435 (2000); та S.M. Berge, et al., "Pharmaceutical Salts, ” Journal of Pharmaceutical Sciences, 66: 1-19 (1977). Фахівцю в галузі синтезу буде зрозуміло, що сполука Формули I є легкоперетворюваною, і може бути виділена у формі фармацевтично прийнятних солей з використанням методів і умов, добре відомих фахівцю в цій галузі. Сполуки за цим винаходом або їхні фармацевтично прийнятні солі можна одержати різноманітними відомими у цій галузі способами, з яких деякі ілюструються наведеними нижче схемами, препаративними методиками та прикладами. Для одержання сполук Формули Е або Формули II, або їх фармацевтично прийнятних солей, конкретні стадії синтезу кожного із описаних шляхів можуть комбінуватись різноманітними способами або здійснюватись упоєднанні зі стадіями різних схем. Продукти кожної стадії наведених нижче схем можуть виділятись традиційними методами, у тому числі шляхом екстрагування, випарювання, осадження, хроматографування, фільтрування, розтирання та кристалізації. Реагенти та вихідні матеріали є легко доступними для фахівця в цій галузі. Всі замісники, якщо не вказано інше, відповідають попередньо наведеному визначенню. Зрозуміло, що ці схеми, препаративні методики та приклади не призначені для обмеження обсягу даного винаходу будь-яким чином. 4 UA 113764 C2 Схема 1 Препаративна методика 1 Синтез 6-хлор-3-метилпіридин-2-карбонової кислоти. 5 10 15 20 25 30 Схема 1, стадія А. 1н водний розчин NaOH (10 мл) додають до перемішуваного розчину метил-6-хлор-3-метилпіридин-2-карбоксилату (1,0 г, 5,39 ммоль) в суміші THF:метанол (10 мл:2 мл). Суміш перемішують при кімнатній температурі протягом 3 год. Органічний розчинник видаляють при зниженому тиску, і напівтверду речовину розчиняють у воді, і підкислюють до рН 1-2 із застосуванням 1н водного розчину HCl. Одержаний осад відфільтровують, промивають водою, і сушать при температурі 40С у вакуумній сушильній шафі протягом 12 год. до одержання вказаної в заголовку сполуки у вигляді твердої речовини білого кольору (780 мг, 84 %). Мас-спектр (m/z): 172,0 (M+1). Препаративна методика 2 Синтез етил-4-[(6-хлор-3-метилпіридин-2-карбоніл)аміно]-3,5-диметилбензоату. Схема 1, стадія В. До розчину 6-хлор-3-метилпіридин-2-карбонової кислоти (0,78 г, 4,55 ммоль) в CH2Cl2 (15 мл) при кімнатній температурі додають етил-4-аміно-3,5-диметилбензоат (0,878 г, 4,55 ммоль) і N, N-діізопропілетиламін (1,98 мл, 11,36 ммоль). Після перемішування реакційної суміші протягом 10 хв, за допомогою шприца додають циклічний ангідрид 1пропанфосфонової кислоти (50 % розчин в етилацетаті, 3,25 мл, 5,46 ммоль). Через 48 год. розчинник видаляють при зниженому тиску, залишок розбавляють водою, і екстрагують етилацетатом. Органічні шари об'єднують, і сушать над сульфатом магнію, фільтрують, і концентрують при зниженому тиску. Одержаний залишок очищають флеш-хроматографією (силікагель) із застосуванням градієнта 0-40 % розчину етилацетату в гексанах. Після очищення, тверду речовину розтирають з 30 % розчином етилацетату в гексанах, і фільтрують до одержання вказаної в заголовку сполуки у вигляді порошку білого кольору (0,907 г, 57,5 %). Мас-спектр (m/z): 347,2 (M+1). Препаративна методика 3 Синтез трет-бутилдиметил-(4-піперидилокси)силану. 5 UA 113764 C2 5 10 15 20 25 30 35 Схема 1, реагент стадії С. До розчину 4-гідроксипіперидину (2,00 г, 9,89 ммоль) в CH2Cl2 (30 мл) додають 1H-імідазол (2,69 г, 39,55 ммоль), потім додають трет-бутилдиметилхлорсилан (3,58 г, 23,73 ммоль), і цю реакційну суміш перемішують при кімнатній температурі. Через 12 год. реакційну суміш промивають водою, насиченим розчином NaHCO3 і розсолом. Органічні шари об'єднують, сушать над сульфатом магнію, фільтрують, і концентрують при зниженому тиску. Одержаний залишок очищають флеш-хроматографією (силікагель) із застосуванням градієнта від 100 % CH2Cl2 до суміші 10 % 7н розчину аміаку в MeOH/90 % CH2Cl2 для одержання вказаної в заголовку сполуки (3,69 г, 86,3 %). Мас-спектр (m/z): 216,2 (M+1). Препаративна методика 4 Синтез етил-4-[[6-[4-(трет-бутил(диметил)силіл)окси-1-піперидил]-3-метилпіридин-2карбоніл]аміно]-3,5-диметилбензоату. Схема 1, стадія C. До розчину етил-4-[(6-хлор-3-метилпіридин-2-карбоніл)аміно]-3,5диметилбензоату (440 мг, 1,27 ммоль) в THF (1,6 мл) додають (iPr)Pd(цинаміл)Cl (16,43 мг, 0,03 ммоль), і потім додають біс(триметилсиліл)амід літію (3,81 мл). Реакційну суміш продувають азотом протягом 5 хв, після чого перемішують при кімнатній температурі. Через 18 год. цю реакційну суміш розбавляють насиченим розчином NaHCO 3, і екстрагують етилацетатом. Органічні шари об'єднують, сушать над сульфатом магнію, фільтрують, і концентрують при зниженому тиску. Одержаний залишок очищають флеш- хроматографією (силікагель) із застосуванням градієнта 0-30 % розчину етилацетату в гексанах для одержання вказаної в заголовку сполуки (278 мг, 41 %). Мас-спектр (m/z): 526,2 (M+1). Препаративна методика 5 Синтез етил-4-[[6-(4-гідрокси-1-піперидил)-3-метилпіридин-2-карбоніл]аміно]-3,5диметилбензоату. Схема 1, стадія D. До розчину етил-4-[[6-[4-(трет-бутил(диметил)силіл)окси-1-піперидил]-3метилпіридин-2-карбоніл]аміно]-3,5-диметилбензоату (342 мг, 0,650 ммоль) в THF (4 мл) додають 1,0 М розчин Bu4NF в THF (0,975 мл, 0,975 ммоль) при температурі 0С. Реакційну суміш поступово нагрівають до температури навколишнього середовища. Через 12 год. цю реакційну суміш розбавляють водою з льодом, і екстрагують етилацетатом. Органічні шари об'єднують, сушать над сульфатом натрію, фільтрують, і концентрують при зниженому тиску для одержання залишку. Цей залишок очищають флеш-хроматографією (силікагель) із застосуванням градієнта 0-40 % розчину етилацетату в гексанах для одержання вказаної в заголовку сполуки (223 мг, 83,3 %). Мас-спектр (m/z): 412,2 (M+1). Схема 2 6 UA 113764 C2 Препаративна методика 6 Синтез 6-хлор-3-метилпіридин-2-карбоксилату калію. 5 10 15 20 25 Схема 2, стадія А. Метил-6-хлор-3-метилпіридин-2-карбоксилат (50 г, 269,4 ммоль) додають до розчину гідроксиду калію (18,7 г, 282,9 ммоль) в ізопропіловому спирті (2000 мл). Суміш перемішують при температурі навколишнього середовища протягом 1 год. Додають гексани (500 мл), тверду речовину відфільтровують, промивають гексанами, і сушать при зниженому тиску при температурі 45C протягом 4 год. до одержання вказаної в заголовку сполуки (52 г, 1 92 %). Мас-спектр (m/z): 172,0 (M+1). H ЯМР (300 МГц, D2O): 7,62 (d, J=8,0 Гц, 1H), 7,27 (d, J=8,0 Гц, 1H), 2,23 (s, 3H). Препаративна методика 7 Синтез метил-4-[(6-хлор-3-метилпіридин-2-карбоніл)аміно]-3,5-диметилбензоату. Схема 2, стадія В. До суспензії 6-хлорпіридин-2-карбоксилату калію (52 г, 265,8 ммоль) в диметилформаміді (676 мл) додають біс(2-оксо-3-оксазолідиніл)фосфоніл хлорид (115 г, 451,8 ммоль). Суміш перемішують при температурі навколишнього середовища протягом 30 хв. Додають метил-4-аміно-3,5-диметилбензоат (42,9 г, 239,2 ммоль, дивись Препаративну методику 12) і діізопропілетиламін (115,9 мл, 664,5 ммоль). Реакційну суміш перемішують при температурі навколишнього середовища протягом 16 год. Потім суміш виливають у воду (2000 мл), і перемішують протягом 30 хв. Одержану тверду речовину відфільтровують, і сушать при зниженому тиску при температурі 45C. Сухий матеріал розтирають з гексаном (1400 мл) протягом 2 год. Тверду речовину відфільтровують, і сушать у вакуумі до одержання вказаної в заголовку сполуки (69 г, 78 %) у вигляді твердої речовини білого кольору. Мас-спектр (m/z): 1 333,05 (M+1). H ЯМР (300 МГц, DMSO): 10,16 (s, 1H), 7,89 (d, J=8,2 Гц, 1H), 7,73 (s, 2H), 7,63 (d, J=8,2 Гц, 1H), 3,85 (s, 3H), 2,49 (s, 3H), 2,28 (s, 6H). Схема 3 Приклад 1 7 UA 113764 C2 Синтез 4-[[6-(4-гідрокси-1-піперидил)-3-метилпіридин-2-карбоніл]аміно]-3,5диметилбензойної кислоти. 5 10 15 20 25 30 35 40 45 50 Схема 3, стадія А. 1н водний розчин NaOH (1,08 мл) додають до перемішуваного розчину етил-4-[[6-(4-гідрокси-1-піперидил)-3-метилпіридин-2-карбоніл]аміно]-3,5-диметилбензоату (223 мг, 0,541 ммоль) в суміші THF:MeOH (4 мл:2 мл). Після нагрівання при температурі 40C протягом 12 год. органічний розчинник видаляють при зниженому тиску, і напівтверду речовину розчиняють у воді, та підкислюють до рН 3 1н водним розчином HCl. Одержаний осад відфільтровують, промивають водою, і сушать при температурі 40С у вакуумній сушильній шафі протягом 12 год. до одержання вказаної в заголовку сполуки у вигляді твердої речовини білого кольору (160 мг, 77 %). Мас-спектр (m/z): 384,2 (M+1). Альтернативний синтез 4-[[6-(4-гідрокси-1-піперидил)-3-метилпіридин-2-карбоніл]аміно]-3,5диметилбензойної кислоти. Схема 3, стадія В. 4-гідроксипіперидин (171,2 г, 1660 ммоль) додають до розчину метил-4[(6-хлор-3-метилпіридин-2-карбоніл)аміно]-3,5-диметилбензоату (69 г, 207,3 ммоль) в Nметилпіролідоні (483 мл), і цю суміш перемішують при температурі 150С протягом 4 год. Згадану суміш охолоджують до температури навколишнього середовища, і виливають у воду (1000 мл). Суміш промивають метил-трет-бутиловим простим ефіром (300 мл). Після цього водний шар підкислюють до рН 2 36 % водним розчином HCl. Суміш екстрагують розчином (1/1) етилацетат/метил-трет-бутиловий ефір (3250 мл). Органічний шар упарюють досуха. До залишку додають воду (500 мл), і одержану суміш перемішують протягом 30 хв, фільтрують, і відфільтрований матеріал сушать в вакуумній сушильній шафі при температурі 45C протягом ночі. Висушену тверду речовину світло-брунатного кольору розчиняють в ацетоні (500 мл), і нагрівають до температури 50С. Повільно додають воду (1000 мл), і цю суміш перемішують при температурі 50C протягом 2 год. Суміш охолоджують до температури навколишнього середовища, фільтрують, і відфільтрований матеріал сушать при зниженому тиску при температурі 45C. Висушений матеріал перемішують в етилацетаті (600 мл) при температурі 50С протягом двох годин. Суміш охолоджують до температури навколишнього середовища, фільтрують, і відфільтрований матеріал сушать при зниженому тиску при температурі 45C протягом ночі до одержання вказаної в заголовку сполуки у вигляді твердої речовини білого 1 кольору (50,8 г, 64 %). Мас-спектр (m/z): 384,2 (M+1). H ЯМР (300 МГц, DMSO): 12,85 (s, 1H), 9,87 (s, 1H), 7,71 (s, 2H), 7,49 (d, J=8,7 Гц, 1H), 7,01 (d, J=8,7 Гц, 1H), 4,68 (d, J=4,1 Гц, 1H), 4,114,04 (m, 2H), 3,70 (m, 1H), 3,15-3,07 (m, 2H), 2,41 (s, 3H), 2,27 (s, 6H), 1,81-1,77 (m, 2H), 1,44-1,32 (m, 2H). Дифракція рентгенівських променів на порошку Порошкові рентгенограми (XRD) кристалічних твердих речовин одержують за допомогою порошкового рентгенівського дифрактометру Bruker D4 Endeavor, спорядженого джерелом CuKα (λ=1,54060 е) та детектором Vantec, які функціонують при 35 кВ та 50 мА. Зразок сканують у межах 4-40 у напрямку 2θ з величиною кроку, що дорівнює 0,0087 2θ, при швидкості сканування 0,5 с/крок, з 0,6 мм розходженням, фіксованим антирозсіюванням 5,28 мм та 9,5 мм діафрагмами детектору. Кварцовий тримач зразка наповнюють сухим порошком, і одержують рівну поверхню, застосовуючи предметне скло. У кристалографічній галузі добре відомо, що, для будь-якої даної кристалічної форми, відносна інтенсивність дифракційних піків може змінюватись унаслідок переважного орієнтування, що є наслідком таких факторів, як морфологія і форма (габітус) кристалу. Там, де наявні впливи переважного орієнтування, інтенсивність піків змінюється, але положення характеристичних піків поліморфу є незмінними. Дивись, наприклад, The U.S. Pharmacopeia 35-National Formulary 30 Chapter Characterization of crystalline and partially crystalline solids by X-ray powder diffraction (XRPD) Official December 1, 2012-May 1, 2013. Крім того, у кристалографічній галузі також добре відомо, що, для будь-якої даної кристалічної форми, кутові позиції піків можуть дещо змінюватись. Наприклад, кутові позиції можуть зсовуватись унаслідок змін температури або вологості, при яких здійснюють аналіз зразку, зміщення зразку або присутності чи відсутності внутрішнього стандарту. У даному разі змінність положення піків 0,2° у напрямку 2θ буде враховувати ці 8 UA 113764 C2 5 10 15 потенційні зміни без перешкоджання однозначній ідентифікації вказаної кристалічної форми. Підтвердження кристалічної форми може бути здійсненим на основі будь-якої унікальної комбінації відмінних піків (в 2θ), зазвичай, більш визначних піків. Рентгенограми вказаної кристалічної форми, зібрані при температурі і відносній вологості навколишнього середовища, коригують на основі NIST 675 стандартних піків при 8,85 2θ та 26,77 2θ. Приклад А Одержання гідратованої 4-[[6-(4-гідрокси-1-піперидил)-3-метилпіридин-2-карбоніл]аміно]-3,5диметилбензойної кислоти. 4-[[6-(4-гідрокси-1-піперидил)-3-метилпіридин-2-карбоніл]аміно]-3,5-диметилбензойну кислоту (240,7 мг) розчиняють в 10 мл суміші (1:1) ацетон:вода, одержуючи прозорий розчин блідого кольору. Суміш концентрують при кімнатній температурі, і кристалічна гідратована форма починає повільно випадати в осад з розчину протягом декількох хвилин. Одержані тверді речовини відфільтровують, і сушать на повітрі з одержанням 197,5 мг вказаної в заголовку сполуки. Одержаний зразок вказаної в заголовку Прикладу А сполуки характеризується порошковою рентгенограмою, одержаною з використанням випромінювання CuKα, як такий, що має піки дифракції (значення 2-тета), наведені нижче в Таблиці 1. Зокрема, рентгенограма має пік при 9,0° в поєднанні з двома або більше піками, вибраними з групи, яку складають 5,8°, 8,5°, 9,8°, 11,6°, 11,8°, 17,5° та 24,2° з допуском на кути дифракції 0,2. 20 Таблиця 1 Рентгенівські дифракційні піки сполуки Прикладу А. Пік 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Кут (2-тета°) 5,8 8,5 9,0 9,8 11,6 11,8 14,1 15,3 15,4 17,5 20,4 20,8 22,7 24,2 24,6 27,5 Ентенсивність (%) 43 16 100 21 62 34 9 15 30 43 11 21 13 35 19 9 Схема 4 25 Препаративна методика 8 Синтез 1-йод-2,4-диметил-3-нітробензолу. Схема 4, стадія А. До 1,3-диметил-2-нітробензолу (68,5 г, 453,2 ммоль) додають сірчану 9 UA 113764 C2 5 10 15 20 25 30 35 кислоту (27,2 мл, 510 ммоль), оцтову кислоту (543,8 мл, 9,49 моль), йод (46 г, 181,3 ммоль) і HIO4 (91,9 г, 403,3 ммоль). Реакційну суміш нагрівають до температури 90С протягом 7 діб. Реакційну суміш охолоджують до температури навколишнього середовища, і додають воду (500 мл). Одержану тверду речовину відфільтровують, і промивають холодною водою. Тверду речовину сушать при зниженому тиску при температурі 45С протягом ночі для одержання 1 вказаної в заголовку сполуки у вигляді твердої речовини жовтого кольору (119 г, 95 %). H ЯМР (300,16 МГц, CDCl3): δ 7,80 (d, J=8,2 Гц, 1H), 6,85 (d, J=8,2 Гц, 1H), 2,37 (s, 3H), 2,23 (s, 3H). Препаративна методика 9 Синтез метил-2,4-диметил-3-нітробензоату Схема 4, стадія В. В 2 л автоклав Парра з автоматичним перемішуванням додають 1-йод2,4-диметил-3-нітробензол (70 г, 252,7 ммоль), Pd(OAc)2 (2,8 г, 12,6 ммоль), 1,4біс(дифенілфосфіно)бутан (6,5 г, 15,2 ммоль), ацетонітрил (462 мл), триетиламін (88,2 мл) і метанол (280 мл). Автоклав Парра герметизують, продувають та підвищують тиск із використанням СО до 551,6 кПа (80 фунтів на квадратний дюйм). Суміш нагрівають до температури 100С протягом 2 год. Одержану суміш охолоджують до температури навколишнього середовища, після чого вигружають. Цю суміш концентрують досуха при зниженому тиску. Додають етилацетат (300 мл) і воду (300 мл). Шари розділяють, і водний шар відкидають. Органічний шар сушать над MgSO 4, фільтрують, і концентрують досуха для одержання вказаної в заголовку сполуки у вигляді масла червоного кольору, яке 1 кристалізується при відстоюванні (52 г, 98 %). H ЯМР (300,13 МГц, CDCl3): δ 7,89 (d, J=8,2 Гц, 1H), 7,19 (d, J=8,2 Гц, 1H), 3,91 (s, 3H), 2,49 (s, 3H), 2,33 (s, 3H). Препаративна методика 10 Синтез метил-3-аміно-2,4-диметилбензоату. Схема 4, стадія C. До розчину метил-2,4-диметил-3-нітробензоату (37 г, 176,9 ммоль) в метанолі (370 мл) додають 10 % паладій на деревному вугіллі з вологістю 50 % (5,6 г). Реакційну суміш барботують воднем, і поміщають в атмосферу водню на 6 діб. Суміш фільтрують через діатомову землю, і фільтрат упарюють досуха. Одержаний залишок очищають флеш-хроматографією (силікагель) з елююванням 20 % розчином етилацетату в гексанах для одержання вказаної в заголовку сполуки у вигляді масла жовтого кольору (20,5 г, 1 65 %). Мас-спектр (m/z): 180,1 (M+1). H ЯМР (300,16 МГц, DMSO-d6): δ 6,89 (s, 2H), 4,78 (s, 2H), 3,76 (s, 3H), 2,23 (s, 3H), 2,12 (s, 3H). Схема 5 Препаративна методика 11 Синтез метил-3,5-диметил-4-нітробензоату. 10 UA 113764 C2 5 10 15 20 Схема 5, стадія А. До розчину 3,5-диметил-4-нітробензойної кислоти (10,0 г, 0,0512 моль) в МеОН (150 мл) додають тіонілхлорид (10 мл) при температурі 0С, і цю реакційну суміш нагрівають до температури 80С. Через 16 год. згадану реакційну суміш охолоджують до кімнатної температури, і розчинник видаляють при зниженому тиску. Залишок розбавляють водою (50 мл), підлужнюють насиченим розчином NaHCO 3 до рН 7-8, і екстрагують EtOAc (2120 мл). Органічні шари об'єднують, і сушать над безводним сульфатом натрію. Розчинник видаляють при зниженому тиску для одержання вказаної в заголовку сполуки у вигляді твердої 1 речовини світло-жовтого кольору (10,71 г, 98,3 %). H ЯМР (400 МГц, DMSO): δ 7,83 (s, 2H), 3,88 (s, 3H), 2,30 (s, 6H). Препаративна методика 12 Синтез метил-4-аміно-3,5-диметилбензоату. Схема 5, стадія B. До розчину метил-3,5-диметил-4-нітробензоату (10,0 г, 0,0478 моль) в метанолі (100 мл) при температурі 0С додають залізний порошок (15,7 г, 0,2869 моль) і 37 % розчин HCl (1,72 г, 0,0478 моль). Реакційну суміш гріють при температурі 80С протягом 16 год. Цю суміш охолоджують до кімнатної температури, фільтрують через шар Celite, і промивають метанолом з подальшим упарюванням фільтрату насухо для одержання вказаної в заголовку сполуки у вигляді твердої речовини брунатного кольору (7,8 г, 99 %). Мас-спектр (m/z): 180,2 (M+1). Схема 6 Препаративна методика 13 Синтез метил-4-[(5-бром-2-фторбензоїл)аміно]-3,5-диметилбензоату. 11 UA 113764 C2 5 10 15 20 25 30 35 40 Схема 6, стадія А. До розчину 5-бром-2-фторбензойной кислоти (3,50 г, 15,9 ммоль) в CH2Cl2 (50 мл) при температурі 0С додають метил-4-аміно-3,5-диметилбензоат (2,86 г, 15,9 ммоль, дивись Препаративну методику 12) і N, N-діізопропілетиламін (8,35 мл, 47,9 ммоль). Після перемішування реакційної суміші протягом 10 хв, за допомогою шприца додають циклічний ангідрид 1-пропанфосфонової кислоти (50 % розчин в етилацетаті, 20,5 мл, 31,9 ммоль), і перемішують при температурі навколишнього середовища. Через 36 год. розчинник видаляють при зниженому тиску, залишок розбавляють водою, і екстрагують етилацетатом. Органічні шари об'єднують, сушать над безводним Na2SO4, фільтрують, і концентрують при зниженому тиску. Одержаний залишок очищають флеш-хроматографією (силікагель) з використанням 10 % розчину етилацетату в гексані до одержання вказаної в заголовку сполуки у вигляді твердої речовини білого кольору (4,20 г, 69 %). Мас-спектр (m/z): 380,2 (M+1). Препаративна методика 14 Синтез трет-бутилдиметил-(3-піперидилметокси)силану. Схема 6, стадія B. До розчину піперидин-3-ілметанолу (2,10 г, 0,018 моль) в CH2Cl2 (20 мл) додають триетиламін (5,53 г, 0,0547 моль), потім додають трет-бутилдиметилхлорсилан (4,127 г, 0,0275 моль), і цю реакційну суміш перемішують при кімнатній температурі. Через 24 год. згадану реакційну суміш промивають водою, насиченим розчином NaHCO 3 і розсолом. Органічні шари об'єднують, сушать над сульфатом натрію, фільтрують, і концентрують при зниженому тиску. Одержаний залишок очищають флеш-хроматографією (силікагель) із застосуванням градієнта 0-10 % розчину MeOH в дихлорметані для одержання вказаної в заголовку сполуки (2,50 г, 60 %). Мас-спектр (m/z): 231,2 (M+1). Препаративна методика 15 Синтез метил-4-[[5-[3-[[трет-бутил(диметил)силіл]оксиметил]-1-піперидил]-2фторбензоїл]аміно]-3,5-диметилбензоату. Схема 6, стадія B. До розчину метил-4-[(5-бром-2-фторбензоїл)аміно]-3,5-диметилбензоату (0,40 г, 1,05 ммоль), трет-бутилдиметил-(3-піперидилметокси)силану (0,362 г, 1,57 ммоль) і Cs2CO3 (1,04 г, 3,15 ммоль) в 1,4-діоксані (6 мл) додають Pd2(dba)3 (0,10 г, 0,105 ммоль), і потім додають S-Phos (2-дициклогексилфосфін-2,6-диметоксибіфеніл) (0,043 г, 0,105 ммоль). Цю суміш продувають азотом протягом 5 хв, і потім гріють при температурі 90С. Через 16 год. згадану реакційну суміш охолоджують до температури навколишнього середовища, фільтрують через Celite, і промивають EtOAc. Об'єднані фільтрати сушать над сульфатом натрію, фільтрують, концентрують при зниженому тиску, і очищають флеш-хроматографією (силікагель) з використанням 10 % розчину EtOAc в гексані для одержання вказаної в заголовку сполуки у вигляді масла блідо-жовтого кольору (0,22 г, 40 %). Мас-спектр (m/z): 529,2 (M+1). Препаративна методика 16 Синтез метил-4-[[2-фтор-5-[3-(гідроксиметил)-1-піперидил]бензоїл]аміно]-3,5диметилбензоату. 12 UA 113764 C2 5 10 15 20 25 30 Схема 6, стадія C. До розчину метил-4-[[5-[3-[[трет-бутил(диметил)силіл]оксиметил]-1піперидил]-2-фторбензоїл]аміно]-3,5-диметилбензоату (0,30 г, 0,54 ммоль) в THF (8 мл) додають 1,0 М розчин Bu4NF в THF (0,35 г, 1,60 ммоль) при температурі 0С. Реакційну суміш поступово нагрівають до температури навколишнього середовища. Через 4 год. цю реакційну суміш розбавляють водою з льодом, і екстрагують етилацетатом. Органічні шари об'єднують, сушать над сульфатом натрію, фільтрують, і концентрують при зниженому тиску, одержуючи залишок. Цей залишок очищають флеш-хроматографією (силікагель) із застосуванням як елюєнта градієнта етилацетату в гексанах для одержання вказаної в заголовку сполуки у вигляді твердої речовини білого кольору (0,10 г, 55 %). Мас-спектр (m/z): 414,2 (M+1). Приклад 2 Синтез 4-[[2-фтор-5-[3-(гідроксиметил)-1-піперидил]бензоїл]аміно]-3,5-диметилбензойної кислоти. Схема 6, стадія D. 2н водний розчин NaOH (2,00 мл) додають до перемішуваного розчину метил-4-[[2-фтор-5-[3-(гідроксиметил)-1-піперидил]бензоїл]аміно]-3,5-диметилбензоату (0,18 г, 0,43 ммоль) в суміші THF:метанол (3 мл:1 мл). Через 16 год. при температурі 50С органічний розчинник видаляють при зниженому тиску, залишок розбавляють водою, підкислюють до рН 4 1н розчином HCl, і екстрагують CH2Cl2. Органічні шари об'єднують, і сушать над безводним сульфатом натрію. Розчинник видаляють при зниженому тиску, одержаний осад розтирають з діетиловим ефіром, і фільтрують для одержання вказаної в заголовку сполуки у вигляді твердої речовини білого кольору (0,12 г, 69 %). Мас-спектр (m/z): 401,2 (M+1). Хіральне розділення рацемічної 4-[[2-фтор-5-[3-(гідроксиметил)-1-піперидил]бензоїл]аміно]3,5-диметилбензойної кислоти. 4-[[2-фтор-5-[3-(гідроксиметил)-1-піперидил]бензоїл]аміно]-3,5-диметилбензойну кислоту розділяють хіральною хроматографією із застосуванням Chiralpak AD-H, 25 % МеОН/СО2, 5 мл/хв, 225 нм, для одержання: Приклад 2А: Езомер 1 4-[[2-фтор-5-[3-(гідроксиметил)-1-піперидил]бензоїл]аміно]-3,5диметилбензойної кислоти. Максимальне елюювання відбувається через 2,52 хв. Мас-спектр (m/z): 401,2 (M+1). Приклад 2B: Езомер 2 4-[[2-фтор-5-[3-(гідроксиметил)-1-піперидил]бензоїл]аміно]-3,5диметилбензойної кислоти. Максимальне елюювання відбувається через 2,93 хв. Мас-спектр (m/z): 401,2 (M+1). Схема 7 35 13 UA 113764 C2 Препаративна методика 17 Синтез метил-3-[(5-бром-2-фторбензоїл)аміно]-2,4-диметилбензоату. 5 10 15 20 25 30 35 Схема 7, стадія А. До розчину 5-бром-2-фторбензойної кислоти (500 мг, 2,28 ммоль) в CH2Cl2 (15 мл) при температурі 0C додають метил-3-аміно-2,4-диметилбензоат (409 мг, 2,28 ммоль, дивись Препаративну методику 10) і N, N-діізопропілетиламін (737,6 мг, 5,71 ммоль). Після перемішування реакційної суміші протягом 10 хв, за допомогою шприца додають циклічний ангідрид 1-пропанфосфонової кислоти (50 % розчин в етилацетаті, 1,74 г, 2,74 ммоль), і перемішують при температурі 50C. Через 16 год. розчинник видаляють при зниженому тиску, і залишок розтирають з MeOH до одержання вказаної в заголовку сполуки у вигляді твердої речовини білого кольору (450 мг, 51,8 %). Мас-спектр (m/z): 380,2 (M+1). Препаративна методика 18 Синтез метил-3-[[5-[3-[[трет-бутил(диметил)силіл]оксиметил]-1-піперидил]-2фторбензоїл]аміно]-2,4-диметилбензоату. Схема 7, стадія B. До розчину метил-3-[(5-бром-2-фторбензоїл)аміно]-2,4-диметилбензоату (0,7 г, 1,84 ммоль), трет-бутилдиметил-(3-піперидилметокси)силану (2,53 г, 11,03 ммоль, дивись Препаративну методику 14) і Cs2CO3 (1,81 г, 5,50 ммоль) в 1,4-діоксані (15 мл) додають Pd2(dba)3 (0,168 г, 0,184 ммоль), і потім додають S-Phos (0,075 г, 0,184 моль). Реакційну суміш продувають азотом протягом 5 хв, після чого гріють при температурі 120С. Через 6 год. цю реакційну суміш концентрують при зниженому тиску, і одержаний залишок використовують далі без додаткового очищення. Препаративна методика 19 Синтез метил-3-[[2-фтор-5-[3-(гідроксиметил)-1-піперидил]бензоїл]аміно]-2,4диметилбензоату. Схема 7, стадія C. До розчину метил-3-[[5-[3-[[трет-бутил(диметил)силіл]оксиметил]-1піперидил]-2-фторбензоїл]аміно]-2,4-диметилбензоату (2,9 г, 5,48 ммоль) в THF (20 мл) додають 1,0 М розчин Bu4NF в THF (5,73 г, 0,0219 моль) при температурі 0С. Реакційну суміш поступово нагрівають до температури навколишнього середовища. Через 4 год. цю реакційну суміш розбавляють водою з льодом, і екстрагують етилацетатом. Органічні шари об'єднують, сушать над сульфатом натрію, фільтрують, і концентрують при зниженому тиску, одержуючи залишок. Цей залишок очищають флеш-хроматографією (силікагель) із застосуванням градієнта 35-45 % розчину етилацетату в гексані для одержання вказаної в заголовку сполуки у вигляді твердої речовини білого кольору (0,38 г, 16,8 %). Мас-спектр (m/z): 415,2 (M+1). Приклад 3 Синтез 3-[[2-фтор-5-[3-(гідроксиметил)-1-піперидил]бензоїл]аміно]-2,4-диметилбензойної 14 UA 113764 C2 кислоти. 5 10 15 20 25 Схема 7, стадія D. Розчин NaOH (0,146 мг, 0,00366 моль) в 1,5 мл H 2O додають до перемішуваного розчину метил-3-[[2-фтор-5-[3-(гідроксиметил)-1-піперидил]бензоїл]аміно]-2,4диметилбензоату (0,38 г, 0,000916 моль) в суміші THF:EtOH (3 мл:2 мл). Через 4 год. при температурі навколишнього середовища, органічний розчинник видаляють при зниженому тиску, залишок розбавляють водою, підкислюють до рН 4 1н розчином HCl, і екстрагують етилацетатом. Органічні шари об'єднують, і сушать над безводним сульфатом натрію. Розчинник видаляють при зниженому тиску для одержання вказаної в заголовку сполуки у вигляді твердої речовини світло-жовтого кольору (85 мг г, 36,8 %). Мас-спектр (m/z): 401,2 (M+1). Схема 8 Препаративна методика 20 Синтез метил-3-[(5-бром-2-метилбензоїл)аміно]-2,4-диметилбензоату Схема 8, стадія А. До розчину 5-бром-2-метилбензойної кислоти (2,0 г, 0,093 моль) в CH2Cl2 (20 мл) при температурі 0C додають метил-3-аміно-2,4-диметилбензоат (1,49 г, 0,0084 моль, дивись Препаративну методику 10) і N, N-діізопропілетиламін (4,79 г, 0,0372 моль). Після перемішування реакційної суміші протягом 10 хв, за допомогою шприца додають циклічний ангідрид 1-пропанфосфонової кислоти (50 % розчин в етилацетаті, 8,87 г, 0,028 моль), і перемішують при температурі 50C. Через 16 год. розчинник видаляють при зниженому тиску, залишок розбавляють водою, і двічі екстрагують етилацетатом. Органічні шари об'єднують, сушать над безводним Na2SO4, фільтрують, і концентрують при зниженому тиску. Одержаний залишок очищають флеш-хроматографією (силікагель) з використанням 10 % розчину етилацетату в гексані до одержання вказаної в заголовку сполуки у вигляді твердої речовини 15 UA 113764 C2 білого кольору (2,80 г, 80 %). Мас-спектр (m/z): 376,1 (M+1). Препаративна методика 21 Синтез метил-3-[[5-[3-[[трет-бутил(диметил)силіл]оксиметил]-1-піперидил]-2метилбензоїл]аміно]-2,4-диметилбензоату. 5 10 15 20 25 30 35 Схема 8, стадія B. До розчину метил-3-[(5-бром-2-метилбензоїл)аміно]-2,4-диметилбензоату (0,5 г, 1,32 ммоль), трет-бутилдиметил-(3-піперидилметокси)силану (0,45 г, 1,99 ммоль, дивись Препаративну методику 14) і Cs2CO3 (1,29 г, 3,98 ммоль) в 1,4-діоксані (15 мл) додають Pd2(dba)3 (0,12 г, 0,132 ммоль), і потім додають S-Phos (0,050 г, 0,132 ммоль). Реакційну суміш продувають азотом протягом 5 хв, після чого гріють при температурі 110С. Через 6 год. цю реакційну суміш охолоджують до температури навколишнього середовища, фільтрують через Celite, і промивають EtOAc. Об'єднані фільтрати сушать над сульфатом натрію, фільтрують, концентрують при зниженому тиску, і очищають флеш-хроматографією (силікагель) із застосуванням як елюєнта 15 % розчину EtOAc в гексані для одержання вказаної в заголовку сполуки у вигляді напівтвердої речовини брунатного кольору (0,6 г, 85 %). Мас-спектр (m/z): 525,2 (M+1). Препаративна методика 22 Синтез метил-3-[[5-[3-(гідроксиметил)-1-піперидил]-2-метилбензоїл]аміно]-2,4диметилбензоату. Схема 8, стадія C. До розчину метил-3-[[5-[3-[[трет-бутил(диметил)силіл]оксиметил]-1піперидил]-2-метилбензоїл]аміно]-2,4-диметилбензоату (0,60 г, 1,14 ммоль) в THF (15 мл) додають 1,0 М розчин Bu4NF в THF (0,596 г, 2,28 ммоль) при температурі 0С. Реакційну суміш поступово нагрівають до температури навколишнього середовища. Через 1 год. цю реакційну суміш розбавляють водою з льодом, і екстрагують етилацетатом. Органічні шари об'єднують, сушать над сульфатом натрію, фільтрують, і концентрують при зниженому тиску, одержуючи залишок. Цей залишок очищають флеш-хроматографією (силікагель) із застосуванням як елюєнта градієнта 4 % розчину метанолу в дихлорметані для одержання вказаної в заголовку сполуки у вигляді твердої речовини білого кольору (0,4 г, 85,5 %). Мас-спектр (m/z): 411,4 (M+1). Приклад 4 Синтез 3-[[5-[3-(гідроксиметил)-1-піперидил]-2-метилбензоїл]аміно]-2,4-диметилбензойної кислоти. Схема 8, стадія D. 4н водний розчин NaOH (4,00 мл) додають до перемішуваного розчину метил-3-[[5-[3-(гідроксиметил)-1-піперидил]-2-метилбензоїл]аміно]-2,4-диметилбензоату (0,4 г, 0,975 ммоль) в суміші THF:MeOH (10 мл:5 мл). Через 4 год. при температурі навколишнього 16 UA 113764 C2 5 10 15 20 25 30 середовища органічний розчинник видаляють при зниженому тиску, залишок розбавляють водою, підкислюють до рН 4 1н розчином HCl, і двічі екстрагують за допомогою 10 % розчину IPA в CH2Cl2. Органічні шари об'єднують, і сушать над безводним сульфатом натрію. Розчинник видаляють при зниженому тиску, одержаний осад розтирають з діетиловим ефіром, і фільтрують для одержання вказаної в заголовку сполуки у вигляді твердої речовини світлобрунатного кольору (0,28 г, 72,5 %). Мас-спектр (m/z): 397,2 (M+1). Хіральне розділення рацемічної 3-[[5-[3-(гідроксиметил)-1-піперидил]-2-метилбензоїл]аміно]2,4-диметилбензойної кислоти. 3-[[5-[3-(гідроксиметил)-1-піперидил]-2-метилбензоїл]аміно]-2,4-диметилбензойну кислоту розділяють хіральною хроматографією із застосуванням Chiralcel OJ-H, 15 % МеОН/СО2, 5 мл/хв, 225 нм, для одержання: Приклад 4А: Езомер 1 3-[[5-[3-(гідроксиметил)-1-піперидил]-2-метилбензоїл]аміно]-2,4диметилбензойної кислоти. Максимальне елюювання відбувається через 1,76 хв. Мас-спектр (m/z): 397,2 (M+1). Приклад 4B: Езомер 2 3-[[5-[3-(гідроксиметил)-1-піперидил]-2-метилбензоїл]аміно]-2,4диметилбензойної кислоти. Максимальне елюювання відбувається через 2,49 хв. Мас-спектр (m/z): 397,2 (M+1). Схема 9 Препаративна методика 23 Синтез метил-4-[(5-бром-2-метилбензоїл)аміно]-3,5-диметилбензоату. Схема 9, стадія А. До розчину 5-бром-2-метилбензойної кислоти (2,0 г, 0,008 моль) в CH2Cl2 (20 мл) при температурі 0C додають метил-4-аміно-3,5-диметилбензоат (1,28 г, 0,0072, дивись Препаративну методику 12) і N, N-діізопропілетиламін (4,12 г, 0,032 моль). Після перемішування реакційної суміші протягом 10 хв, за допомогою шприца додають циклічний ангідрид 1пропанфосфонової кислоти (50 % розчин в етилацетаті, 7,63 г, 0,024 моль), і перемішують при температурі 50C. Через 16 год. розчинник видаляють при зниженому тиску, залишок розбавляють водою, і двічі екстрагують етилацетатом. Органічні шари об'єднують, і сушать над безводним Na2SO4, фільтрують, і концентрують при зниженому тиску. Одержаний залишок очищають флеш-хроматографією (силікагель) з використанням 12 % розчину етилацетату в гексані до одержання вказаної в заголовку сполуки у вигляді твердої речовини білого кольору (2,9 г, 97 %). Мас-спектр (m/z): 376,0 (M+1). Препаративна методика 24 17 UA 113764 C2 Синтез метил-4-[[5-[3-[[трет-бутил(диметил)силіл]оксиметил]-1-піперидил]-2метилбензоїл]аміно]-3,5-диметилбензоату. 5 10 15 20 25 30 35 Схема 9, стадія B. До розчину метил-4-(5-бром-2-метилбензамідо)-3,5-диметилбензоату (0,5 г, 0,0013 моль), трет-бутилдиметил-(3-піперидилметокси)силану (0,45 г, 0,0019 моль, Препаративна методика 14) і Cs2CO3 (1,29 г, 0,0039 моль) в 1,4-діоксані (15 мл) додають Pd2(dba)3 (0,12 г, 0,00013 моль), і потім додають S-Phos (0,054 г, 0,00013 моль). Реакційну суміш продувають азотом протягом 5 хв, після чого гріють при температурі 110С. Через 16 год. цю реакційну суміш охолоджують до температури навколишнього середовища, фільтрують через Celite, і промивають EtOAc. Об'єднані фільтрати сушать над сульфатом натрію, фільтрують, концентрують при зниженому тиску, і очищають флеш-хроматографією (силікагель) із застосуванням як елюєнта 15 % розчину етилацетату в гексані для одержання вказаної в заголовку сполуки у вигляді напівтвердої речовини брунатного кольору (0,4 г, 57,3 %). Масспектр (m/z): 525,2 (M+1). Препаративна методика 25 Синтез метил-4-[[5-[3-(гідроксиметил)-1-піперидил]-2-метилбензоїл]аміно]-3,5диметилбензоату. Схема 9, стадія C. До розчину метил-4-[[5-[3-[[трет-бутил(диметил)силіл]оксиметил]-1піперидил]-2-метилбензоїл]аміно]-3,5-диметилбензоату (0,40 г, 0,76 ммоль) в THF (10 мл) додають 1,0 М розчин Bu4NF в THF (0,39 г, 1,52 ммоль) при температурі 0С. Реакційну суміш поступово нагрівають до температури навколишнього середовища. Через 1 год. цю реакційну суміш розбавляють водою з льодом, і екстрагують етилацетатом. Органічні шари об'єднують, сушать над сульфатом натрію, фільтрують, і концентрують при зниженому тиску, одержуючи залишок. Цей залишок очищають флеш-хроматографією (силікагель) із застосуванням градієнта 4 % розчину MeOH в дихлорметані для одержання вказаної в заголовку сполуки у вигляді твердої речовини світло-брунатного кольору (0,30 г, 96 %). Мас-спектр (m/z): 411,5 (M+1). Приклад 5 Синтез 4-[[5-[3-(гідроксиметил)-1-піперидил]-2-метилбензоїл]аміно]-3,5-диметилбензойної кислоти. Схема 9, стадія D. 4н водний розчин NaOH (2,00 мл) додають до перемішуваного розчину метил-4-[[5-[3-(гідроксиметил)-1-піперидил]-2-метилбензоїл]аміно]-3,5-диметилбензоату (0,3 г, 0,73 ммоль) в суміші THF:MeOH (10 мл:5 мл). Через 16 год. при температурі навколишнього середовища, органічний розчинник видаляють при зниженому тиску, залишок розбавляють 18 UA 113764 C2 5 10 15 20 25 30 водою, підкислюють до рН 4 1н розчином HCl, і екстрагують 10 % розчином IPA в CH2Cl2. Органічні шари об'єднують, і сушать над безводним сульфатом натрію. Розчинник видаляють при зниженому тиску, одержаний осад розтирають з діетиловим ефіром, і фільтрують для одержання вказаної в заголовку сполуки у вигляді твердої речовини світло-брунатного кольору (0,27 г, 90 %). Мас-спектр (m/z): 397,2 (M+1). Хіральне розділення рацемічної 4-[[5-[3-(гідроксиметил)-1-піперидил]-2-метилбензоїл]аміно]3,5-диметилбензойної кислоти. 4-[[5-[3-(гідроксиметил)-1-піперидил]-2-метилбензоїл]аміно]-3,5-диметилбензойну кислоту розділяють хіральною хроматографією із застосуванням Chiralpak AD-H, 30 % EtOH/СО2, 5 мл/хв, 225 нм, для одержання: Приклад 5А: Езомер 1 4-[[5-[3-(гідроксиметил)-1-піперидил]-2-метилбензоїл]аміно]-3,5диметилбензойної кислоти. Максимальне елюювання відбувається через 4,22 хв. Мас-спектр (m/z): 397,2 (M+1). Приклад 5B: Езомер 2 4-[[5-[3-(гідроксиметил)-1-піперидил]-2-метилбензоїл]аміно]-3,5диметилбензойної кислоти. Максимальне елюювання відбувається через 5,30 хв. Мас-спектр (m/z): 397,2 (M+1). Схема 10 Препаративна методика 26 Синтез метил-3-[[5-[3-[[трет-бутил(диметил)силіл]оксиметил]піролідин-1-іл]-2метилбензоїл]аміно]-2,4-диметилбензоату. Схема 10, стадія А. До розчину метил-3-[(5-бром-2-метилбензоїл)аміно]-2,4диметилбензоату (0,5 г, 1,32 ммоль), трет-бутилдиметил(піролідин-3-ілметокси)силану (0,4 г, 1,99 ммоль) і Cs2CO3 (1,2 г, 3,99 ммоль) в 1,4-діоксані (15 мл) додають Pd2(dba)3 (0,12 г, 0,132 ммоль), і потім додають S-Phos (0,054 г, 0,132 ммоль). Реакційну суміш продувають азотом протягом 5 хв, і потім гріють при температурі 100С. Через 16 год. цю реакційну суміш охолоджують до температури навколишнього середовища, фільтрують через Celite, і промивають EtOAc. Об'єднані фільтрати сушать над сульфатом натрію, фільтрують, концентрують при зниженому тиску, і очищають флеш-хроматографією (силікагель) з використанням 20 % розчину EtOc в гексані для одержання вказаної в заголовку сполуки у вигляді напівтвердої речовини брунатного кольору (0,36 г, 53 %). Мас-спектр (m/z): 511,2 (M+1). 19 UA 113764 C2 Препаративна методика 27 Синтез метил-3-[[5-[3-(гідроксиметил)піролідин-1-іл]-2-метилбензоїл]аміно]-2,4диметилбензоату. 5 10 15 20 25 30 Схема 10, стадія B. До розчину метил-3-[[5-[3-[[третбутил(диметил)силіл]оксиметил]піролідин-1-іл]-2-метилбензоїл]аміно]-2,4-диметилбензоату (0,35 г, 0,686 ммоль) в THF (50 мл) додають 1,0 М розчин Bu4NF в THF (0,537 г, 2,05 ммоль) при температурі 0С. Реакційну суміш поступово нагрівають до температури навколишнього середовища. Через 2 год. цю реакційну суміш розбавляють водою з льодом, і двічі екстрагують етилацетатом. Органічні шари об'єднують, сушать над сульфатом натрію, фільтрують, і концентрують при зниженому тиску, одержуючи залишок. Цей залишок очищають флешхроматографією (силікагель) із застосуванням градієнта 50 % розчину етилацетату в гексані для одержання вказаної в заголовку сполуки у вигляді твердої речовини брунатного кольору (150 мг, 51 %). Приклад 6 Синтез 3-[[5-[3-(гідроксиметил)піролідин-1-іл]-2-метилбензоїл]аміно]-2,4-диметилбензойної кислоти. Схема 10, стадія C. 5н водний розчин NaOH (5,00 мл) додають до перемішуваного розчину метил-3-[[5-[3-(гідроксиметил)-1-піперидил]-2-метилбензоїл]аміно]-2,4-диметилбензоату (0,4 г, 0,975 ммоль) в MeOH (5 мл). Через 5 год. при температурі навколишнього середовища, органічний розчинник видаляють при зниженому тиску, залишок розбавляють водою, підкислюють до рН 4 1н розчином HCl, і двічі екстрагують 10 % розчином IPA в CH2Cl2. Органічні шари об'єднують, і сушать над безводним сульфатом натрію. Розчинник видаляють при зниженому тиску, одержаний осад розтирають з діетиловим ефіром, і фільтрують для одержання вказаної в заголовку сполуки у вигляді твердої речовини брунатного кольору (70 мг, 56 %). Мас-спектр (m/z): 381,2 (M-1). Схема 11 Препаративна методика 28 20 UA 113764 C2 Синтез метил-3-[(5-бром-2-метилбензоїл)аміно]-2,4-диметилбензоату. 5 10 15 20 25 30 35 Схема 11, стадія А. До розчину 5-бром-2-метилбензойної кислоти (2,0 г, 0,0093 моль) в CH2Cl2 (20 мл) при кімнатній температурі додають метил-3-аміно-3,5-диметилбензоат (1,49 г, 0,0083 моль, дивись Препаративну методику 12) і N, N-діізопропілетиламін (4,79 г, 0,037 моль). Після перемішування реакційної суміші протягом 10 хв, за допомогою шприца додають циклічний ангідрид 1-пропанфосфонової кислоти (50 % розчин в етилацетаті, 8,87 г, 0,027 моль), і гріють при температурі 50C. Через 16 год. цю реакційну суміш розбавляють CH2Cl2, промивають водою і розсолом. Органічні шари об'єднують, і сушать над безводним Na 2SO4, фільтрують, і концентрують при зниженому тиску. Одержаний залишок очищають флешхроматографією (силікагель) з використанням 10 % розчину EtOAc в гексані до одержання вказаної в заголовку сполуки у вигляді порошку білого кольору (2,8 г, 80 %). Препаративна методика 29 Синтез метил-3-[[5-[3-[[трет-бутил(диметил)силіл]окси-1-піперидил]-2-метилбензоїл]аміно]2,4-диметилбензоату. Схема 11, стадія B. До розчину метил-3-(5-бром-2-метилбензоїл)аміно]-2,4диметилбензоату (0,5 г, 1,32 ммоль), трет-бутилдиметил-(3-піперидилокси)силану (0,425 г, 1,98 ммоль) і Cs2CO3 (1,28 г, 3,96 ммоль) в 1,4-діоксані (15 мл) додають Pd2(dba)3 (0,12 г, 0,132 ммоль), і потім додають S-Phos (0,054 г, 0,132 ммоль). Реакційну суміш продувають азотом протягом 5 хв, після чого гріють при температурі 100С. Через 16 год. цю реакційну суміш охолоджують до температури навколишнього середовища, фільтрують через Celite, і промивають EtOAc. Об'єднані фільтрати сушать над сульфатом натрію, фільтрують, концентрують при зниженому тиску, і очищають флеш-хроматографією (силікагель) з використанням 10 % розчину EtOAc в гексані для одержання вказаної в заголовку сполуки у вигляді напівтвердої речовини брунатного кольору (0,4 г, 60 %). Препаративна методика 30 Синтез метил-3-[[5-(3-гідрокси-1-піперидил)-2-метилбензоїл]аміно]-2,4-диметилбензоату. Схема 11, стадія C. До розчину метил-3-[[5-[3-[трет-бутил(диметил)силіл]окси-1-піперидил]2-метилбензоїл]аміно]-2,4-диметилбензоату (0,4 г, 0,78 ммоль) в THF (20 мл) додають 1,0 М розчин Bu4NF в THF (0,409 г, 1,56 ммоль) при температурі 0С. Реакційну суміш поступово нагрівають до температури навколишнього середовища. Через 1 год. цю реакційну суміш розбавляють водою з льодом, і двічі екстрагують етилацетатом. Органічні шари об'єднують, сушать над сульфатом натрію, фільтрують, і концентрують при зниженому тиску, одержуючи залишок. Цей залишок очищають флеш-хроматографією (силікагель) із застосуванням градієнта 3 % розчину метанолу в дихлорметані для одержання вказаної в заголовку сполуки у 21 UA 113764 C2 вигляді твердої речовини білого кольору (0,3 г, 97 %). Приклад 7 Синтез 3-[[5-(3-гідрокси-1-піперидил)-2-метилбензоїл]аміно]-2,4-диметилбензойної кислоти. 5 10 15 20 Схема 11, стадія D. 4н водний розчин NaOH (2,00 мл) додають до перемішуваного розчину 3-[[5-(3-гідрокси-1-піперидил)-2-метилбензоїл]аміно]-2,4-диметилбензоату (0,3 г, 0,75 ммоль) в суміші THF:MeOH (5 мл:2 мл). Через 3 год. при температурі навколишнього середовища органічний розчинник видаляють при зниженому тиску, залишок розбавляють водою, підкислюють до рН 4 1н розчином HCl, і екстрагують 10 % розчином IPA в CH2Cl2. Органічні шари об'єднують, і сушать над безводним сульфатом натрію. Розчинник видаляють при зниженому тиску, одержаний осад розтирають з діетиловим ефіром, і фільтрують для одержання вказаної в заголовку сполуки у вигляді твердої речовини не зовсім білого кольору (0,274 г, 94 %). Мас-спектр (m/z): 383,2 (M+1). Схема 12 Препаративна методика 31 Синтез етил-4-[(5-бром-2-метилбензоїл)аміно]-3,5-диметилбензоату. Схема 12, стадія А. До розчину 5-бром-2-метилбензойної кислоти (1,35 г, 6,15 ммоль) в THF (15 мл), CH2Cl2 (15 мл) і DMF (14,27 мкл, 184,57 мкмоль) краплями при температурі 0C додають оксалілхлорид (587,12 мкл, 6,77 ммоль), і реакційній суміші дозволяють повільно нагріватися до температури навколишнього середовища. Через 2 год. розчинник видаляють при зниженому 22 UA 113764 C2 5 10 15 20 25 30 35 40 тиску. До залишку додають CH2Cl2 (30 мл), і реакційну суміш охолоджують до температури 0С, потім додають етил-4-аміно-3,5-диметилбензоат (1,19 г, 6,15 ммоль), і услід додають 4піридинаміну, N, N-диметил- (37,58 мг, 307,61 мкмоль) і піридин (1,49 мл, 18,46 ммоль). Охолоджувальну баню видаляють, і прозорому розчину дозволяють нагріватися до температури навколишнього середовища. Через 5 год. розчинник видаляють, реакційну суміш розбавляють етилацетатом, і промивають 1н розчином HCl, насиченим розчином бікарбонату натрію і розсолом. Органічні шари об'єднують, сушать над безводним Na 2SO4, фільтрують, і концентрують при зниженому тиску. Одержаний залишок розтирають з гексаном, і одержану тверду речовину відфільтровують до одержання вказаної в заголовку сполуки у вигляді твердої речовини білого кольору (1,80 г; 75,2 %). Мас-спектр (m/z): 390,2 (M+1). Препаративна методика 32 Синтез етил-4-[[5-(1,4-діокса-8-азаспіро[4.5]декан-8-іл)-2-метилбензоїл]аміно]-3,5диметилбензоату. Схема 12, стадія В. До розчину етил-4-[(5-бром-2-метилбензоїл)аміно]-3,5-диметилбензоату (0,5 г, 1,28 ммоль), 1,4-діокса-8-азаспіро(4.5)декану (0,22 г, 1,54 ммоль) і Cs2CO3 (1,25 г, 3,84 ммоль) в THF (10 мл) додають Pd(OAc)2 (0,04 г, 0,19 ммоль), потім додають рацемічний 2,2'біс(дифенілфосфіно)-1,1‘-бінафтил (119,7 мг, 0,19 ммоль). Реакційну суміш продувають азотом протягом 5 хв, і потім гріють при температурі 90С. Через 16 год. цю реакційну суміш охолоджують до температури навколишнього середовища, розбавляють хлоридом амонію, і двічі екстрагують EtOAc. Об'єднані органічні шари сушать над сульфатом натрію, фільтрують, і концентрують при зниженому тиску. Одержаний залишок очищають флеш-хроматографією (силікагель) з використанням 0-100 % розчину етилацетату в гексані для одержання вказаної в заголовку сполуки у вигляді твердої речовини брунатного кольору (0,21 г, 36,2 %). Мас-спектр (m/z): 453,2 (M+1).Препаративна методика 33 Синтез етил-3,5-диметил-4-[[2-метил-5-(4-оксо-1-піперидил)бензоїл]аміно]бензоату. Схема 12, стадія C. До розчину етил-4-[[5-(1,4-діокса-8-азаспіро[4.5]декан-8-іл)-2метилбензоїл]аміно]-3,5-диметилбензоату (205 мг, 452,99 мкмоль) в ацетоні (5 мл) додають суміш 5 М розчину HCl (1 мл) в H2O (1 мл), і нагрівають до температури 60С. Через 12 год. суміш охолоджують до температури навколишнього середовища, розбавляють 2 М розчином NaOH до рН 6, і екстрагують етилацетатом. Об'єднані органічні шари сушать над сульфатом натрію, фільтрують, і концентрують при зниженому тиску. Одержаний залишок очищають флешхроматографією (силікагель) з використанням 0-40 % розчину етилацетату в гексані для одержання вказаної в заголовку сполуки у вигляді піни не зовсім білого кольору (0,11 г, 61 %). Мас-спектр (m/z): 409,2 (M+1). Препаративна методика 34 Синтез 3,5-диметил-4-[[2-метил-5-(4-оксо-1-піперидил)бензоїл]аміно]бензойної кислоти. Схема 12, стадія D. 2н водний розчин NaOH (2,00 мл) додають до перемішуваного розчину 23 UA 113764 C2 5 10 15 20 25 етил-3,5-диметил-4-[[2-метил-5-(4-оксо-1-піперидил)бензоїл]аміно]бензоату (0,11 г, 269,28 мкмоль) в суміші THF:MeOH (2,4 мл:1,2 мл). Через 16 год. при температурі навколишнього середовища органічний розчинник видаляють при зниженому тиску, і залишок розбавляють водою, підкислюють до рН 7 1н розчином HCl, і двічі екстрагують етилацетатом. Органічні шари об'єднують з водним шаром, і концентрують при зниженому тиску. Одержані в результаті тверді речовини розтирають з сумішшю ацетонітрил:етанол (1:1) до одержання суспензії білого кольору, яку фільтрують через шар Celite. Фільтрат концентрують при зниженому тиску, і осад розтирають з ацетоном, і фільтрують для одержання вказаної в заголовку сполуки у вигляді твердої речовини не зовсім білого кольору (99 мг, 99 %). Мас-спектр (m/z): 381,2 (M+1). Приклад 8 Синтез 4-[[5-(4-гідрокси-1-піперидил)-2-метилбензоїл]аміно]-3,5-диметилбензойної кислоти. Схема 12, стадія E. До розчину 3,5-диметил-4-[[2-метил-5-(4-оксо-1піперидил)бензоїл]аміно]бензойної кислоти (69,5 мг, 182,68 мкмоль) в метанолі (1,83 мл) додають тетрагідроборат натрію (13,82 мг, 365,36 мкмоль), і одержану суміш перемішують при температурі навколишнього середовища. Через 1 год. суміш гасять насиченим розчином NH 4Cl (0,2 мл), і екстрагують сумішшю CHCl3 (3 мл):IPA (1 мл). Об'єднані органічні шари сушать над сульфатом натрію, фільтрують, і концентрують при зниженому тиску. Одержану тверду речовину розтирають з H2O (5 мл), фільтрують, і промивають Н2О (5 мл). Залишок очищають хроматографією з оберненою фазою (C18) з використанням 20 % розчину ацетонітрилу в H2O з 0,1 % мурашиної кислоти для одержання вказаної в заголовку сполуки у вигляді порошку білого кольору (0,01 г, 15,7 %). Мас-спектр (m/z): 383,2 (M+1). Схема 13 Препаративна методика 35 Синтез метил-3-[(5-бром-2-метилбензоїл)аміно]-2,4-диметилбензоату. 24 UA 113764 C2 5 10 15 20 25 30 35 Схема 13, стадія А. До розчину 5-бром-2-метилбензойної кислоти (2,45 г, 11,16 ммоль) в THF (10 мл), CH2Cl2 (10 мл) і DMF (20,00 мкл, 258,65 мкмоль) краплями при температурі 0C додають оксалілхлорид (1,16 мл, 13,39 ммоль), і реакційній суміші дозволяють повільно нагріватися до температури навколишнього середовища. Через 2 год. розчинник видаляють при зниженому тиску. До залишку додають CH2Cl2 (40 мл), і реакційну суміш охолоджують до температури 0 °C, потім додають етил-4-аміно-3,5-диметилбензоат (2 г, 11,16 ммоль), і услід додають N, N-диметилпіридин-4-амін (13,63 мг, 0,11 ммоль) і піридин (2,71 мл, 33,48 ммоль). Охолоджувальну баню видаляють, і прозорому розчину дозволяють нагріватися до температури навколишнього середовища. Через 2 год. розчинник видаляють, реакційну суміш розбавляють етилацетатом, і промивають 1н розчином HCl, насиченим розчином бікарбонату натрію і розсолом. Органічні шари об'єднують, сушать над безводним Na2SO4, фільтрують, і концентрують при зниженому тиску до одержання вказаної в заголовку сполуки у вигляді твердої речовини світло-жовтого кольору (4,0 г; 95,5 %). Мас-спектр (m/z): 376,0 (M+1). Препаративна методика 36 Синтез метил-3-[[5-(1,4-діокса-8-азаспіро[4.5]декан-8-іл)-2-метилбензоїл]аміно]-2,4диметилбензоату. Схема 13, стадія В. До розчину метил-3-[(5-бром-2-метилбензоїл)аміно]-2,4диметилбензоату (0,5 г, 1,33 ммоль), 1,4-діокса-8-азаспіро(4.5)декану (228,34 мг, 1,59 ммоль) і Cs2CO3 (1,3 г, 3,99 ммоль) в 1,4-діоксані (10 мл) додають Pd(OAc)2 (29,84 мг, 132,89 мкмоль), і потім додають рацемічний 2,2'-біс(дифенілфосфіно)-1,1'-бінафтил (82,75 мг, 132,89 мкмоль). Реакційну суміш продувають азотом протягом 10 хв, після чого нагрівають до температури 90С. Через 3 год. утворюється дуже незначна кількість продукту. До реакційної суміші додають Pd(OAc)2 (29,84 мг, 132,89 мкмоль), і потім додають рацемічний 2,2'-біс(дифенілфосфіно)-1,1'бінафтил (82,75 мг, 132,89 мкмоль), і нагрівають до температури 100 °C. Через 12 год. цю реакційну суміш охолоджують до температури навколишнього середовища, розбавляють водою, і екстрагують EtOAc. Об'єднані органічні шари промивають розсолом, сушать над сульфатом натрію, фільтрують, і концентрують при зниженому тиску. Одержаний залишок очищають флеш-хроматографією (силікагель) з використанням 0-100 % розчину етилацетату в гексані для одержання вказаної в заголовку сполуки у вигляді твердої речовини брунатного кольору (0,26 г, 44,62 %). Мас-спектр (m/z): 439,2 (M+1). Препаративна методика 37 Синтез метил-2,4-диметил-3-[[2-метил-5-(4-оксо-1-піперидил)бензоїл]аміно]бензоату. Схема 13, стадія C. До розчину метил-3-[[5-(1,4-діокса-8-азаспіро[4.5]декан-8-іл)-2метилбензоїл]аміно]-2,4-диметилбензоату (250 мг, 570,09 мкмоль) THF (2 мл) додають 4 М розчин HCl (1 мл), і перемішують при температурі навколишнього середовища. Суміш концентрують при зниженому тиску, удруге розчиняють в ацетоні (5 мл) з подальшим 25 UA 113764 C2 5 10 15 20 25 30 35 додаванням 5н розчину HCl. Через 22 год. при температурі 60C суміш охолоджують до температури навколишнього середовища, розбавляють 2 М розчином NaOH до рН 6, і двічі екстрагують етилацетатом. Об'єднані органічні шари сушать над сульфатом натрію, фільтрують, і концентрують при зниженому тиску. Одержаний залишок очищають флешхроматографією (силікагель) з використанням 0-50 % розчину етилацетату в гексані для одержання вказаної в заголовку сполуки у вигляді піни не зовсім білого кольору (0,12 г, 53,36 %). Мас-спектр (m/z): 395,2 (M+1). Препаративна методика 38 Синтез 2,4-диметил-3-[[2-метил-5-(4-оксо-1-піперидил)бензоїл]аміно]бензойної кислоти. Схема 13, стадія D. 2н водний розчин NaOH (1,00 мл) додають до перемішуваного розчину метил-2,4-диметил-3-[[2-метил-5-(4-оксо-1-піперидил)бензоїл]аміно]бензоату (0,12 г, 304,20 мкмоль) в суміші THF:MeOH (2 мл:1 мл). Через 16 год. при температурі навколишнього середовища органічний розчинник видаляють при зниженому тиску, і залишок розбавляють водою, підкислюють до рН 6 1н розчином HCl, і екстрагують етилацетатом. Органічні шари об'єднують з водним шаром, і концентрують при зниженому тиску. Одержані в результаті тверді речовини розчиняють в суміші ацетонітрил/H2O, і ліофілізують для одержання вказаної в заголовку сполуки у вигляді твердої речовини не зовсім білого кольору (58 мг, 50,12 %). Масспектр (m/z): 381,2 (M+1). Приклад 9 Синтез 3-[[5-(4-гідрокси-1-піперидил)-2-метилбензоїл]аміно]-2,4-диметилбензойної кислоти. Схема 13, стадія E. До розчину 2,4-диметил-3-[[2-метил-5-(4-оксо-1піперидил)бензоїл]аміно]бензойної кислоти (51 мг, 134,05 мкмоль) в метанолі (1,34 мл) додають тетрагідроборат натрію (10,14 мг, 268,11 мкмоль), і одержану суміш перемішують при температурі навколишнього середовища. Через 1 год. суміш гасять, і доводять до рН 7 насиченим розчином NH4Cl, і двічі екстрагують сумішшю CHCl3 (3 мл):IPA (1 мл). Об'єднані органічні шари сушать над сульфатом натрію, фільтрують, і концентрують при зниженому тиску. Одержану тверду речовину удруге розчиняють у суміші CHCl3:IPA (3:1), розбавляють HCl до рН 2, і екстрагують сумішшю CHCl3:IPA (3:1). Об'єднані органічні шари сушать над сульфатом натрію, фільтрують, і концентрують при зниженому тиску. Одержаний залишок розчиняють в МеОН, і фільтрують через бавовняну пробку. Фільтрат концентрують при зниженому тиску, потім розчиняють в H2O, і ліофілізують протягом 12 годин для одержання вказаної в заголовку сполуки у вигляді порошку не зовсім білого кольору (0,04 г, 81,9 %). Мас-спектр (m/z): 383,2 (M+1). Схема 14 26 UA 113764 C2 Препаративна методика 39 Синтез 6-хлор-3-метилпіридин-2-карбонової кислоти. 5 10 15 20 25 Схема 14, стадія А. 1н водний розчин NaOH (10,00 мл) додають до перемішуваного розчину метил-6-хлор-3-метилпіридин-2-карбоксилату (1,0 г, 5,39 ммоль) в суміші THF:MeOH (10 мл:2 мл). Суміш перемішують при кімнатній температурі протягом 3 год. Органічний розчинник видаляють при зниженому тиску, напівтверду речовину розчиняють у воді, і підкислюють до рН 1-2 1н водним розчином HCl. Одержаний осад відфільтровують, промивають водою, і сушать при температурі 40 °C у вакуумній сушильній шафі протягом 12 год. до одержання вказаної в заголовку сполуки у вигляді твердої речовини білого кольору (780 мг, 84 %). Мас-спектр (m/z): 172,0 (M+1). Препаративна методика 40 Синтез метил-3-[(6-хлор-3-метилпіридин-2-карбоніл)аміно]-2,4-диметилбензоату. Схема 14, стадія В. До розчину 6-хлор-3-метилпіридин-2-карбонової кислоти (0,35 г, 0,20 ммоль) в CH2Cl2 (6 мл) при кімнатній температурі додають метил-3-аміно-3,5-диметилбензоат (0,36 г, 0,20 ммоль, дивись Препаративну методику 12) і N, N-діізопропілетиламін (0,77 г, 0,60 ммоль). Після перемішування реакційної суміші протягом 10 хв, за допомогою шприца додають циклічний ангідрид 1-пропанфосфонової кислоти (50 % розчин в етилацетаті, 2,54 г, 0,80 ммоль). Через 16 год. при температурі навколишнього середовища реакційну суміш розбавляють CH2Cl2, промивають водою і розсолом. Органічні шари об'єднують, і сушать над безводним Na2SO4, фільтрують, і концентрують при зниженому тиску до одержання вказаної в заголовку сполуки у вигляді порошку білого кольору (0,52 г, 76 %). Мас-спектр (m/z): 333,2 (M+1). Препаративна методика 41 27 UA 113764 C2 Синтез трет-бутилдиметил-(4-піперидилокси)силану. 5 10 15 20 25 30 35 Схема 14, стадія C. До розчину 4-гідроксипіперидину (2,00 г, 9,89 ммоль) в CH2Cl2 (30 мл) додають 1H-імідазол (2,69 г, 39,55 ммоль), потім додають трет-бутилдиметилхлорсилан (3,58 г, 23,73 ммоль), і реакційну суміш перемішують при кімнатній температурі. Через 12 год. цю реакційну суміш промивають водою, насиченим розчином NaHCO 3 і розсолом. Органічні шари об'єднують, і сушать над сульфатом натрію, фільтрують, і концентрують при зниженому тиску. Одержаний залишок очищають флеш-хроматографією (силікагель) із застосуванням градієнта від 100 % CH2Cl2 до 10 % 7н розчину аміаку в суміші MeOH/90 % CH2Cl2 для одержання вказаної в заголовку сполуки (3,69 г, 86,3 %). Мас-спектр (m/z): 216,2 (M+1). Препаративна методика 42 Синтез метил-3-[[6-(4-гідрокси-1-піперидил)-3-метилпіридин-2-карбоніл]аміно]-2,4диметилбензоату. Схема 14, стадія C. До розчину метил-3-(6-хлор-3-метилпіколінамідо)-2,4-диметилбензоату (0,50 г, 0,0015 моль), трет-бутилдиметил-(4-піперидилокси)силану (0,90 г, 0,0045 моль) і Cs 2CO3 (2,00 г, 0,006 моль) в толуолі (6 мл) додають Pd2(dba)3 (0,14 г, 0,00015 моль), і потім додають BINAP (0,086 г, 0,00015 моль). Реакційну суміш продувають азотом протягом 5 хв, і потім гріють при температурі 120 °C. Через 4 год. цю реакційну суміш охолоджують до температури навколишнього середовища, фільтрують через Celite, і промивають EtOAc. Об'єднаний фільтрат сушать над сульфатом натрію, фільтрують, і концентрують при зниженому тиску для одержання вказаної в заголовку сполуки у вигляді напівтвердої речовини білого кольору (0,220 г, 29 %). Мас-спектр (m/z): 398,2 (M+1). Приклад 10 Синтез 3-[[6-(4-гідрокси-1-піперидил)-3-метилпіридин-2-карбоніл]аміно]-2,4диметилбензойної кислоти. Схема 14, стадія D. 2н водний розчин NaOH (2,00 мл) додають до перемішуваного розчину метил-3-[[6-(4-гідрокси-1-піперидил)-3-метилпіридин-2-карбоніл]аміно]-2,4-диметилбензоату (0,21 г, 0,52 ммоль) в суміші THF:метанол (3 мл:1 мл). Через 16 год. при температурі навколишнього середовища, органічний розчинник видаляють при зниженому тиску, залишок розбавляють водою, підкислюють до рН 6 1н водним розчином HCl, і екстрагують етилацетатом (220 мл). Органічні шари об'єднують, і сушать над безводним сульфатом натрію. Розчинник видаляють при зниженому тиску, одержаний осад розтирають з пентаном, і фільтрують для одержання вказаної в заголовку сполуки у вигляді твердої речовини білого кольору (0,082 г, 39 %). Мас-спектр (m/z): 384,2 (M+1). Схема 15 28
ДивитисяДодаткова інформація
Автори англійськоюBlanco-Pillado, Maria-Jesus, Vetman, Tatiana Natali, Fisher, Matthew Joseph, Kuklish, Steven Lee
Автори російськоюБланко-Пилладо Мария-Джизус, Ветман Татиана Натали, Фишер Метью Джозеф, Куклиш Стивен Ли
МПК / Мітки
МПК: C07D 401/04, A61K 31/4025, A61K 31/445, C07D 207/08, A61K 31/4709, C07D 211/46, A61K 31/402, C07D 211/42
Мітки: диметилбензойної, сполуки, кислоти
Код посилання
<a href="https://ua.patents.su/56-113764-spoluki-dimetilbenzojjno-kisloti.html" target="_blank" rel="follow" title="База патентів України">Сполуки диметилбензойної кислоти</a>
Попередній патент: Колесо вагонетки
Наступний патент: Ароматизовані прутки, призначені для використання у аерозолеутворювальних виробах
Випадковий патент: Спосіб пункційної біопсії селезінки у великої рогатої худоби із сонографічним контролем