Похідні 4- або 5-аміносаліцилової кислоти
Номер патенту: 96264
Опубліковано: 25.10.2011
Автори: Сантагада Вінченцо, Фьоруччі Стефано, Уоллейс Джон Л., Календо Джузеппе, Спараторе Анна, Чіріно Джузеппе
Формула / Реферат
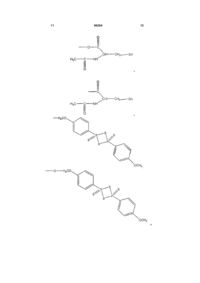
1. Сполука загальної формули:
![]() , (І)
, (І)
у якій:
А означає
 ,
,
де -N= знаходиться в положенні 4 або 5,
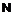 ,
,
де -NH знаходиться в положенні 4 або 5,
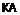 ,
,
де -NH2 знаходиться в положенні 4 або 5, або
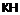 ,
,
де -NH2 знаходиться в положенні 4 або 5;
L означає О, О-С=О, N або ковалентний зв'язок з утворенням складноефірного зв'язку, ангідридного зв'язку, амідного зв'язку або азозв'язку;
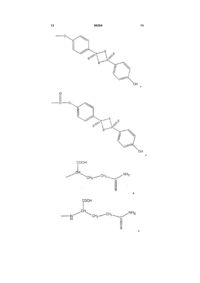
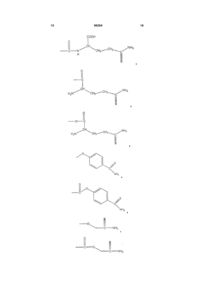
R означає частину молекули, яка вивільняє сірководень, що вивільняє сірководень у тканину, вибрану з групи, що складається з:
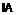 ,
,
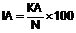 ,
,
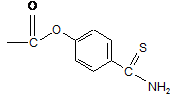 ,
,
або її сіль.
2. Сполука за п. 1, де А означає
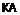 ,
,
L означає О, R означає
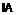 .
.
3. Сполука за п. 2, яка є 4-(5-тіоксо-5Н-[1,2]дитіол-3-іл)феніловим ефіром 5-аміно-2-гідроксибензойної кислоти.
4. Сполука за п. 1, де А означає
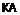 ,
,
L означає ковалентний зв’язок, R означає
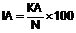 .
.
5. Сполука за п. 4, яка є 4-тіокарбамоїлфеніл-5-аміно-2-гідроксибензоатом.
6. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-5 або її фармацевтично прийнятну сіль і фармацевтично прийнятний наповнювач або носій.
7. Застосування сполуки за будь-яким із пп. 1-5 для виробництва лікарського засобу, призначеного для лікування в суб'єкта запального захворювання шлунково-кишкового тракту.
8. Застосування за п. 7, у якому запальне захворювання вибирають із групи, яка включає хворобу Крона, неспецифічний виразковий коліт і спастичний коліт.
9. Застосування сполуки за будь-яким із пп. 1-5 для виробництва лікарського засобу, призначеного для профілактики раку ободової кишки.
10. Застосування сполуки за будь-яким із пп. 1-5 для лікування в суб'єкта запального захворювання шлунково-кишкового тракту.
11. Застосування сполуки за п. 10, у якому запальне захворювання вибирають із групи, яка включає хворобу Крона, неспецифічний виразковий коліт і спастичний коліт.
12. Застосування сполуки за будь-яким із пп. 1-5 для профілактики раку ободової кишки.
Текст
1. Сполука загальної формули: L A R , (І) N , де -N= знаходиться в положенні 4 або 5, UA OH (19) (21) a200714842 (22) 31.03.2006 (24) 25.10.2011 (86) PCT/CA2006/000484, 31.03.2006 (31) PCT/CA2005/000819 (32) 27.05.2005 (33) CA (46) 25.10.2011, Бюл.№ 20, 2011 р. (72) УОЛЛЕЙС ДЖОН Л., CA, ЧІРІНО ДЖУЗЕППЕ, IT, КАЛЕНДО ДЖУЗЕППЕ, IT, СПАРАТОРЕ АННА, IT, САНТАГАДА ВІНЧЕНЦО, IT, ФЬОРУЧЧІ СТЕФАНО, IT (73) АНТІБ ТЕРАПЬЮТІКС ІНК., CA (56) US 4 412 992 A US 5 013 727 A US 6 602 915 B2 US 4 440 763 A DZIERZEWICZ Z. ET AL.: 'Susceptibility of Desulfovibrio desulfuricans intestinal strains to sulfasalazine and its biotransformation products' MED. SCI. MONIT. vol. 10, no. 6, 2004, pages BR185 - BR190 EDMOND L.M. ET AL: 'The effect of 5-aminosalicylic acid-containing drugs on sulfide production by sulfatereducing and amino acid-fermenting bacteria' INFLAMMATORY BOWEL DISEASES vol. 9, no. 1, 2003, pages 10 – 17 FIORUCCI ET AL.: 'Inhibition of Hydrogen Sulfide Generation Contributes to gastric Injury Caused by Anti-Inflammatory Nonsteroidal Drugs' GASTROENTEROLOGY vol. 129, no. 4, October 2005, pages 1210 – 1224 DISTRUTTI E. ET AL.: 'Evidence that Hydrogen Sulfide Exerts Antinociceptive Effects in the Gastrointestinal Tract by Activating KATP Channels' J. PHARMACOLOGY & EXP. THER. vol. 316, no. 1, 2006, pages 325 – 335 SIDHU R. ET AL.: 'L-Cysteine and Sodium Hydrogensulphide Inhibit Spontaneous Contractility in Isolated Pregnant Rat Uterine Strips in Vitro' PHARMACOLOGY & TOXICOLOGY vol. 88, 2001, pages 198 – 203 2 (11) 1 3 96264 4 O O C C OH OH OH NH , де -NH знаходиться в положенні 4 або 5, O C OH H2 N , де -NH2 знаходиться в положенні 4 або 5, або O C H2 N , L означає О, R означає S S S. 3. Сполука за п. 2, яка є 4-(5-тіоксо-5Н-[1,2]дитіол3-іл)феніловим ефіром 5-аміно-2гідроксибензойної кислоти. 4. Сполука за п. 1, де А означає O C OH OH O H2 N H2 N , де -NH2 знаходиться в положенні 4 або 5; L означає О, О-С=О, N або ковалентний зв'язок з утворенням складноефірного зв'язку, ангідридного зв'язку, амідного зв'язку або азозв'язку; R означає частину молекули, яка вивільняє сірководень, що вивільняє сірководень у тканину, вибрану з групи, що складається з: S S S, O S C NH2 , O C O S C NH2 , або її сіль. 2. Сполука за п. 1, де А означає , L означає ковалентний зв’язок, R означає O S C NH2 . 5. Сполука за п. 4, яка є 4-тіокарбамоїлфеніл-5аміно-2-гідроксибензоатом. 6. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-5 або її фармацевтично прийнятну сіль і фармацевтично прийнятний наповнювач або носій. 7. Застосування сполуки за будь-яким із пп. 1-5 для виробництва лікарського засобу, призначеного для лікування в суб'єкта запального захворювання шлунково-кишкового тракту. 8. Застосування за п. 7, у якому запальне захворювання вибирають із групи, яка включає хворобу Крона, неспецифічний виразковий коліт і спастичний коліт. 9. Застосування сполуки за будь-яким із пп. 1-5 для виробництва лікарського засобу, призначеного для профілактики раку ободової кишки. 10. Застосування сполуки за будь-яким із пп. 1-5 для лікування в суб'єкта запального захворювання шлунково-кишкового тракту. 11. Застосування сполуки за п. 10, у якому запальне захворювання вибирають із групи, яка включає хворобу Крона, неспецифічний виразковий коліт і спастичний коліт. 12. Застосування сполуки за будь-яким із пп. 1-5 для профілактики раку ободової кишки. 5 Даний винахід належить до сполук, придатних для лікування кишкових захворювань, таких як запальне захворювання кишечнику (IBD) і спастичний коліт (IBS), і хіміопрофілактики раку ободової кишки. Зокрема, були створені похідні 4- і 5аміносаліцилової кислоти, що містять частину молекули, яка вивільняє сірководень, зв'язану за допомогою азогрупи, складноефірного, ангідридного, складнотіоефірного або амідного зв'язку з молекулою 5- або 4-аміносаліцилової кислоти. Запальне захворювання кишечнику (IBD) є загальною назвою захворювань, які викликають запалення тонкої кишки і ободової кишки. Неспецифічний виразковий коліт є найпоширенішим запальним захворюванням кишечнику, що уражає різні відділи шлунково-кишкового (GI) тракту, зокрема нижній відділ шлунково-кишкового тракту й більш конкретно ободову і/або пряму кишку. Другим запальним захворюванням кишечнику є хвороба Крона, що уражає головним чином тонку кишку (клубову кишку) і товсту кишку (ободову кишку). Неспецифічний виразковий коліт важко діагностувати, тому що симптоми даного захворювання подібні до інших захворювань кишечнику й хвороби Крона. Хвороба Крона відрізняється від неспецифічного виразкового коліту тим, що викликає більш глибоке запалення стінки тонкої кишки. Крім того, хвороба Крона звичайно виникає в тонкій кишці, хоча зазначене захворювання може також уражати ротову порожнину, стравохід, шлунок, дванадцятипалу кишку, товсту кишку, апендикс і анус. Неспецифічний виразковий коліт уражає людей будь-якого віку, але найчастіше виникає у віці 15-30 років або менш часто у віці 50-70 років. Дане захворювання іноді виникає в дітей і підлітків. Неспецифічний виразковий коліт рівною мірою уражає чоловіків і жінок і, очевидно, є спадкоємним захворюванням у деяких родинах. Крім того, важливо відзначити, що приблизно в 5 відсотків людей неспецифічний виразковий коліт є причиною виникнення раку ободової кишки. Ризик виникнення раку підвищується залежно від тривалості й ступеню ураження ободової кишки. Наприклад, якщо уражені тільки нижній відділ ободової кишки й пряма кишка, ризик виникнення раку не перевищує середнього показника. Однак при ураженні всієї ободової кишки ризик виникнення раку може в 32 рази перевищувати середній показник. Таким чином, цілком можливо, що лікарські засоби, придатні для лікування IBD, можуть бути також використані для профілактики раку ободової кишки. Патогенез IBD, очевидно, визначається багатофакторними взаємодіями генетичних факторів, імунологічних факторів і факторів навколишнього середовища. Недавно отримані дані дозволяють припустити, що патологічна активація імунної системи слизової оболонки під впливом антигенів є головним чинником патогенезу IBD. Слідом за поданням антигену при виникненні запального процесу відразу ж відбувається утворення цитокінів, дрібних пептидних молекул гліко 96264 6 протеїну, які направляють сигнали в різні популяції клітин, що визначають напрямок наступних імунних і запальних реакцій. Прозапальні цитокіни включають інтерлейкін (IL)-l, IL-6, IL-8 і альфафактор некрозу пухлин (TNF-). Макрофаги є основним джерелом цитокінів, при цьому епітеліальні клітини також здатні продукувати ряд зазначених пептидних факторів. Хелперні Т-клітини (Th) є ще одним важливим джерелом цитокінів. Th1-клітини, асоційовані із клітиноопосередкованою імунною реакцією, продукують IL-2, гамма-інтерферон (IFN-) і TNF-. Ключовий фактор транскрипції, який бере участь у регулюванні запалення, NFB, що специфічно визначає патогенез IBD, регулює кількість цитокінів, які продукуються Th1-клітинами (див. публікацію Neurath et al. (1996) Nature Med. 2: 998-1004). Th2клітини підсилюють синтез антитіл В-клітинами й продукують IL-4, IL-5, IL-6 і IL-10. Вважається, що хемокіни також сприяють патогенезу коліту. Хемокіни є прозапальними білками, які беруть участь в імунних і запальних реакціях у результаті хемоатракції й активації лейкоцитів. Наприклад, RANTES є С-С хемокіном, що стимулює рекрутинг і активацію клітин запального інфільтрату, таких як моноцити, лімфоцити, мастоцити й еозинофіли. Недавно було встановлено, що число RANTES збільшується під час хронічної фази коліту (див. публікацію Ajuebor et al. (2001) J Immunol. 166: 552-558). Лікування неспецифічного виразкового коліту залежить від тяжкості захворювання. Більшість людей проходять курс лікарського лікування. У тяжких випадках суб'єкту може знадобитися хірургічне втручання для видалення ураженої ободової кишки. Спастичний коліт (IBS) є розповсюдженим, але погано дослідженим захворюванням, що викликає різні кишкові симптоми, які включають біль у черевній порожнині, діарею і/або констипацію, здуття, газоутворення й спазми. Через те що зазначені симптоми можуть бути викликані цілим рядом різних захворювань кишечнику, IBS звичайно діагностують тільки після виключення більш серйозного захворювання. Існує усе більше даних, що вказують на роль запалення в патогенезі IBS. Проведене лікування спрямоване на те, щоб викликати й зберегти ремісію й поліпшити якість життя людей, що страждають IBD/IBS. У цей час існує декілька типів лікарських засобів, призначених для досягнення зазначеної мети. Аміносаліцилати, які є лікарськими засобами, що містять 5-аміносаліцилову кислоту (5-ASA; мезаламін) або 4-аміносаліцилову кислоту (4-ASA), допомагають лікувати запалення. Однак мезаламін і 4-ASA можуть всмоктуватися при проходженні по шлунково-кишковому тракті, що негативно впливає на кількість мезаламіну, який досягає нижнього відділу шлунково-кишкового тракту, зокрема ободової і прямої кишки. Тому були створені різні препарати на основі мезаламіну з метою захисту мезаламіну при проходженні препарату по кишечнику й верхньому відділу шлунковокишкового тракту. 7 Крім того, були створені деякі проліки мезаламіну, які забезпечують доставку мезаламіну в ободову кишку. Зазначені проліки звичайно в меншому ступені всмоктуються в кишечнику й верхньому відділі шлунково-кишкового тракту, завдяки чому вони легше досягають ободової кишки. Сульфасалазин являє собою комбінацію сульфапіридину й 5-ASA і використовується для досягнення й збереження ремісії. Сульфасалазин метаболізується в організмі з утворенням 5-ASA і сульфапіридину. Сульфапіридиновий компонент доставляє протизапальну 5-ASA у тонку кишку. Однак сульфапіридин може викликати побічні ефекти, такі як нудота, блювання, печіння в серці, діарея й головний біль. Зазначені шкідливі побічні ефекти звичайно приписують активності сульфапіридину в шлунково-кишковому тракті, а також усмоктуванню організмом. Інші лікарські засоби на основі 5-ASA, такі як олсалазин, іпсалазид і балсалазид, які мають різні носії, викликають менше побічних ефектів і можуть бути використані людьми, що погано переносять сульфасалазин. На відміну від сульфасалазину розпад зазначених сполук 5-ASA у кишечнику може не викликати утворення небажаних продуктів обміну речовин. Як правило, сполуки 5-ASA уводять перорально, за допомогою клізми або в супозиторії залежно від місця запалення в ободовій кишці. Більшість людей, що страждають легкою або помірною формою неспецифічного виразкового коліту, спочатку піддають лікуванню зазначеною групою лікарських засобів. Однак таке лікування не можна вважати оптимальним головним чином через погану ефективність даного лікарського засобу, що, крім того, характеризується поганою сумісністю з організмом суб'єкта. Іншими застосовуваними лікарськими засобами є кортикостероїди, такі як преднізон, гідрокортизон, будезонід і т. д., і імуномодулятори, такі як азатіоприн і 6-меркаптопурин (6-МР). Зазначені лікарські засоби можуть викликати побічні ефекти, такі як гіпертензія, підвищений ризик виникнення інфекцій і т. д. Сульфасалазин, олсалазид і балсалазид є похідними мезаламіну, у яких носій, що не є мезаламіном, пов'язаний з мезаламіном за допомогою діазозв'язку. Зазначені проліки погано всмоктуються в кишечнику й верхньому відділі шлунковокишкового тракту й тому можуть досягати ободової кишки, де вони розщеплюються азоредуктазами мікрофлори кишечнику з вивільненням мезаламіну й носія безпосередньо в ободову кишку. Інші похідні мезаламіну включають носій, приєднаний до мезаламіну за допомогою карбоксильних і гідроксильних функціональних груп молекули. Поряд з вищевказаними лікарськими засобами в науковій літературі були описані препарати на основі складних ефірів або амідів амінокислот, таких як L-серин і L-гліцин, або з додаванням інших біологічних сполук, таких як таурин. Активність зазначених проліків ґрунтується на дії карбоксипептидаз і амінопептидаз А, що викликають вивільнення мезаламіну. (R. Pellicciari et al. (1993) Journal of Medicinal Chemistry, 36, pg. 4201-7). 96264 8 Більшість раніше відомих носіїв, приєднаних до мезаламіну, є інертними. Таким чином, до 5ASA або 4-ASA бажано приєднати носії, які також є біологічно активними й придатними для лікування IBD/IBS. Частина молекули, здатна вивільняти сірководень (H2S) у тканину, звичайно зв'язана за допомогою азогрупи, складноефірного, ангідридного, складнотіоефірного або амідного зв'язку з молекулою 4- або 5-аміносаліцилової кислоти (4- або 5ASA) з утворенням похідного 4- або 5-ASA за даним винаходом. Завдяки приєднанню Н2Sвивільнюючої частини молекули до 4- або 5-ASA за допомогою ковалентного зв'язку похідні за даним винаходом можуть діяти як проліки, які погано всмоктуються в кишечнику й верхньому відділі шлунково-кишкового тракту й, таким чином, можуть легко досягати ободової кишки. У науковій літературі добре описані протизапальні властивості 4- або 5-ASA і їхнє застосування для лікування неспецифічного виразкового коліту. 4- або 5-ASA зменшує запалення в кишечнику, діарею (часті випорожнення), ректальну кровотечу й біль у шлунку. Недавно було встановлено, що H2S діє як нейромодулятор й чинить протизапальну дію. Крім того, встановлено, що H2S модулює ноцицепцію при розширенні прямій і ободовій кишці (див. публікацію Distrutti et al. (2005) Evidence That Hydrogen Sulfide Exerts Antinociceptive Effects in the Gastrointestinal Tract by Activating KATP Channels. J. Pharm. and Exp. Ther. 316:325-335, що включена в даний опис винаходу як посилання). І нарешті, як відомо, H2S є релаксантом гладких м'язів у тканинах кишечнику (див. публікацію Teague, В. et al. (2002) The Smooth Muscle Relaxant effect of Hydrogen Sulfide In Vitro: Evidence for a Physiological Role to Control Intestinal Contractility. Br. J. Pharmacol. 137: 139-145, що включена в даний опис винаходу як посилання). Досить дивним є те, що Н2S-вивільнююча частина, зв'язана ковалентним зв'язком з 4- або 5ASA, характеризується кращою здатністю вивільнення H2S у порівнянні з окремо використовуваною частиною H2S. З вищевикладеного виходить, що H2S може вивільнятися як у період часу, коли Н2S-вивільнююча частина зв'язана ковалентним зв'язком з 4- або 5-ASA, так і після відщеплення H2S-вивільнюючої частини від 4- або 5-ASA у результаті гідролізу або розщеплення різними ферментами, які присутні у шлунково-кишковому тракті, з вивільненням двох активних інгредієнтів, а саме 4- або 5-аміносаліцилової кислоти і H2Sвивільнюючої частини, які роблять подальший вплив. Похідні за даним винаходом роблять більш ефективний вплив в порівнянні з окремо використовуваною 4- або 5-ASA, окремо використовуваною H2S-вивільнюючою частиною і сумішшю 4або 5-ASA і Н2S-вивільнюючої частини відносно зменшення запалення, діареї й прихованої крові в калі в суб'єктів, що страждають колітом, і ослаблення вісцерального болю, зумовленої розширенням прямої і ободової кишки. Крім того, похідні за даним винаходом зменшують також рівні мРНК циклооксигенази (СОХ)-1, СОХ-2, конститутивної 9 96264 ендотеліальної синтази оксиду азоту (eNOS) і індуцибельної NOS (iNOS), які, як вважається, є ферментами, опосередковуючими запалення. Таким чином, одним об'єктом даного винаходу є похідні за даним винаходом, призначені для лікування запального захворювання шлунковокишкового (GI) тракту, такого як запальне захворювання кишечнику (IBD) і спастичний коліт (IBS). He обмежуючи себе якою-небудь теорією, можна відзначити, що сірководень, який вивільняється із частини молекули, яка вивільняє сірководень, чинить протизапальний вплив в результаті інгібування NFB, фактора транскрипції, що регулює експресію декількох прозапальних генів. Крім того, вважається, що антиноцицептивна дія H2S може + торкати АТР-чутливі К (КАТР) канали. Іншим об'єктом даного винаходу є похідні 4або 5-ASA за даним винаходом, які ефективно знижують життєздатність ракових клітин НТ-29 в ободовій кишці людини й, таким чином, дозволяють запобігати і/або лікувати рак ободової кишки. Сполуки за даним винаходом мають нижченаведену загальну формулу, 10 , де -NH2 знаходиться в положенні 4 або 5, або (І) A—L—R , у якій: А означає де -NH2 знаходиться в положенні 4 або 5; L означає О, О-С=О, S, N або ковалентний зв'язок і утворює складноефірний зв'язок, ангідридний зв'язок, складнотіоефірний зв'язок, амідний зв'язок або зв'язувальну азогрупу; і R означає частину молекули, яка вивільняє сірководень, що вивільняє H2S у тканину. Очевидно, що в даному винаході може бути використана будь-яка нетоксична частина молекули, яка ефективно вивільняє сірководень, що вивільняє H2S у присутності тканини. В переважному варіанті здійснення винаходу R вибирають із групи, яка включає: , де -N= знаходиться в положенні 4 або 5, , , де -NH знаходиться в положенні 4 або 5, 11 96264 12 , 13 96264 14 15 96264 16 17 96264 18 i . Всі вищевказані частини молекули вивільняють H2S у біологічні тканини; однак механізм дії більшості H2S-вивільнюючих частин відрізняється від N-ацетилцистеїну. Добре відомо, що Nацетилцистеїн перетворюється в цистеїн у різних тканинах і в результаті метаболізму цистеїну in vivo утворюється H2S. H2S продукують головним чином два типи піридоксиль-5'-фосфат-залежних ферментів, опосередковуючих метаболізм Lцистеїну, а саме цистатіон--ліаза і цистатіон-синтаза (див. публікацію Fujii et al. (2005) Hydrogen Sulfide as a Endogenous Modulator of Biliary Bicarbonate Excretion in the Rat Liver. Antioxid. Redox. Signal. 7:788-794, що включена в даний опис винаходу як посилання). В об'єм даного винаходу входять також фармацевтично прийнятні солі, такі як, наприклад, солі лужних металів і лужноземельних металів, нетоксичних амінів і амінокислот. Переважними солями є солі аргініну й агматину. В об'єм даного винаходу входять також фармацевтично прийнятні кислотно-адитивні солі. Іншим об'єктом даного винаходу є фармацевтична композиція, що містить сполуку за даним винаходом й фармацевтично прийнятний наповнювач або носій, що призначений, зокрема, для лікування запального захворювання шлунковокишкового тракту. Інші варіанти здійснення даного винаходу належать до способів лікування запального захворювання шлунково-кишкового тракту, такого як запальне захворювання кишечнику (IBD) і спастичний коліт (IBS), у суб'єкта, який потребує такого лікування, які включають введення зазначеному суб'єкту ефективної кількості похідних 4або 5-ASA і їхніх солей. Крім того, даний винахід належить до способів лікування або профілактики раку ободової кишки в потребуючого суб'єкта, які включають введення зазначеному суб'єкту ефективної кількості похідних 4- або 5-ASA і їхніх солей. Інший варіант здійснення даного винаходу належить до застосування похідних 4- або 5-ASA і їхніх солей за даним винаходом для приготування лікарського засобу, призначеного для лікування запального захворювання шлунковокишкового тракту. Даний винахід належить також до застосування похідних 4- або 5-ASA і їхніх солей для лікування запального захворювання шлунково-кишкового тракту. Переважні сполуки мають нижченаведені формули: 2-гідрокси-4- або 5-[4-(5-тіоксо-5Н-[1,2]дитіол-3-іл)фенілазо]-бензойна кислота (II), 4-(5-тіоксо-5Н-[1,2]дитіол-3-іл)феніловий ефір 4- або 5-аміно-2-гідроксибензойної кислоти (III), 19 96264 20 4- або 5-аміно-2-[4-(5-тіоксо-5Н-[1,2]дитіол-3-іл)феноксикарбонілокси]бензойна кислота (IV), 2-гідрокси-4- або 5-[4-(5-тіоксо-5Н-[1,2]дитіол-3-іл)феноксикарбоніламіно] бензойна кислота (V), 4- або 5-{[(1-карбокси-2-меркаптоетилкарбамоїл) метил}азо]гідроксибензойна кислота (VI), (1-карбокси-2-меркаптоетилкарбамоїл)метиловий ефір 4- або 5-аміно-2-гідроксибензойної кислоти (VII), 21 96264 22 4- або 5-аміно-2-[(1-карбокси-2-меркаптоетилкарбамоїл)метоксикарбонілокси]бензойна кислота (VIII), 4- або 5-[(1-карбокси-2-меркаптоетилкарбамоїл)метоксикарбоніламіно]-2-гідроксибензойна кислота (IX), ангідрид 4- або 5-аміно-2-гідроксибензойної кислоти з N-ацетилцистеїном (X), 4- або 5-(2-ацетиламіно-3-меркаптопропіоніламіно)-2-гідроксибензойна кислота (XI), 23 96264 24 2-(2-ацетиламіно-3-меркаптопропіонілокси)-4- або 5-амінобензойна кислота (XII), 5 5 5 5 5 5 2-гідрокси-4або 5-({4-[4-(4-метоксифеніл)-2,4-дитіоксо-2 4 -[1,3,2,4]дитіадифосфетан-2іл]феноксиметил}азо)бензойна кислота (XIII), 4або 5-аміно-2-{4-[4-(4-(4-метоксифеніл)-2,4-дитіоксо-2 4 -[1,3,2,4]дитіадифосфетан-2іл]феноксиметоксикарбонілокси}бензойна кислота (XIV), 2-гідрокси-4або 5-{4-[4-(4-метоксифеніл)-2,4-дитіоксо-2 4 -[1,3,2,4]дитіадифосфетан-2іл]феноксиметоксикарбоніламіно}бензойна кислота (XV), 25 96264 5 26 5 4-[4-(4-метоксифетл)-2,4-дитіоксо-2 4 -[1,3,2,4]дитіадифосфетан-2-іл]феноксиметиловий ефір 4- або 5-аміно-2-гідроксибензойної кислоти (XVI), 5 5 4-[4-(4-гiдpoкcифeнiл)-2,4-дитioкco-2 4 -[1,3,2,4]дитiaдифocфeтaн-2-іл]феніловий ефір 4- або 5-аміно2-гідроксибензойної кислоти (XVII), 5 5 5 5 4або 5-аміно-2-{4-[4-(4-гідроксифеніл)-2,4-дитіоксо-2 4 -[1,3,2,4]дитіадифосфетан-2іл]феноксикарбонілокси}бензойна кислота (XVIII), 2-гідрокси-4або 5-{4-[4-(4-гідроксифеніл)-2,4-дитіоксо-2 4 -[1,3,2,4]дитіадифосфетан-2іл]феноксикарбоніламіно}бензойна кислота (XIX), 4- або 5-(1-карбокси-3-тіокарбамоїлпропілазо)-2-гідроксибензойна кислота (XX), 27 96264 28 2-(4- або 5-аміно-2-гідроксибензоїламіно)-4-тіокарбамоїлмасляна кислота (XXI), 4- або 5-аміно-2-(1-карбокси-3-тіокарбамоїлпропілкарбамоїлокси)бензойна кислота (XXII), 2-гідрокси-4- або 5-[3-(1-гідроксиметил-3-тіокарбамоїлпропіл)-уреїдо] бензойна кислота (XXIII), 4- або 5-аміно-2-(2-аміно-4-тіокарбамоїлбутирилокси)бензойна кислота (XXIV), 29 96264 30 4- або 5-(2-аміно-4-тіокарбамоїлбутириламіно)-2-гідроксибензойна кислота (XXV), ангідрид 4- або 5-аміно-2-гідроксибензойної кислоти з 2-аміно-4-тіокарбамоїлмасляною кислотою (XXVI), 4-тіокарбамоїлфеніл-4- або 5-аміно-2-гідроксибензоат (XXVII), 4- або 5-аміно-2-(4-тіокарбамоїлфеноксикарбонілокси)бензойна кислота (XXVIII), 31 96264 32 2-гідрокси-4- або 5-(4-тіокарбамоїлфеноксикарбоніламіно)бензойна кислота (XXIX), тіокарбамоїлметиловий ефір 4- або 5-аміно-2-гідроксибензойної кислоти (XXX), 4- або 5-аміно-2-тіокарбамоїлметоксикарбонілоксибензойна кислота (XXXI), 2-гідрокси-4- або 5-тіокарбамоїлметоксикарбоніламінобензойна кислота (XXXII), ангідрид 4- або 5-аміно-2-гідроксибензойної кислоти з моно(2-меркаптоетиловим) ефіром сірчаної кислоти (XXXIII), 33 96264 34 4або 5-аміно-2-(2меркаптоетоксисульфонілокси)бензойна кислота (XXXIV) і 4-(5-тіоксо-5Н-[1,2]дитіол-3-іл)феніловий ефір 5-аміно-2-гідроксибензойної кислоти (XXXV), 4-(5-тіоксо-5Н-[1,2]дитіол-3-іл)феніловий ефір 5-аміно-2-гідроксибензойної кислоти (XXXV). Найбільш переважними сполуками є нижченаведені сполуки: 4-тіокарбамоїлфеніл-4- або 5-аміно-2-гідроксибензоат (XXVII) і ангідрид 4- або 5-аміно-2-гідроксибензойної кислоти з N-ацетилцистеїном (X). Короткий опис креслень На Фіг. 1 показана оцінка інтенсивності захворювання в мишей, що страждають TNBSіндукованим колітом, після лікування зростаючими дозами мезаламіну й сполуки XXXV за даним винаходом. На Фіг. 2 показана активність мієлопероксидази (МРО) у мишей, що страждають TNBSіндукованим колітом, після лікування зростаючими дозами мезаламіну й сполуки XXXV за даним винаходом. На Фіг. 3 показана оцінка інтенсивності захворювання в мишей, що страждають TNBSіндукованим колітом, після лікування сполукою XXXV, окремо використовуваним мезаламіном, окремо використовуваним 5-п-гідроксифеніл-1,2дитіон-3-тіоном (ADT-OH) і сумішшю мезаламіну й ADT-OH. На Фіг. 4 показана активність мієлопероксидази (МРО) у мишей, що страждають TNBSіндукованим колітом, після лікування сполукою XXXV, окремо використовуваним мезаламіном, окремо використовуваним ADT-OH і сумішшю мезаламіну й ADT-OH. 35 На Фіг. 5 показана оцінка інтенсивності захворювання в мишей, що страждають TNBSіндукованим колітом, після лікування сполукою XXVII, окремо використовуваним мезаламіном, окремо використовуваним 4гідрокситіобензамідом (4-НТВ) і сумішшю мезаламіну й 4-НТВ. На Фіг. 6 показана активність мієлопероксидази (МРО) у мишей, що страждають TNBSіндукованим колітом, після лікування сполукою XXVII, окремо використовуваним мезаламіном, окремо використовуваним 4-НТВ і сумішшю мезаламіну й 4-НТВ. На Фіг. 7 показана активність мієлопероксидази (МРО) у мишей, що страждають TNBSіндукованим колітом, після лікування 50 мг/кг мезаламіну й еквімолярною дозою сполуки XXXV за даним винаходом. На Фіг. 8 показана оцінка інтенсивності захворювання в мишей, що страждають TNBSіндукованим колітом, після лікування наповнювачем (1% CMC), 50 мг/кг мезаламіну й еквімолярною дозою сполуки XXXV за даним винаходом. На Фіг. 9 показана експресія мРНК фактора некрозу пухлин (TNF-α) в ободовій кишці в мишей, що страждають TNBS-індукованим колітом, після лікування наповнювачем (1% CMC), 50 мг/кг мезаламіну й еквімолярною дозою сполуки XXXV за даним винаходом. На Фіг. 10 показана експресія мРНК гаммаінтерферону (IFN-) у мишей, що страждають TNBS-індукованим колітом, після лікування наповнювачем (1% CMC), 50 мг/кг мезаламіну й еквімолярною дозою сполуки XXXV за даним винаходом. На Фіг. 11 показана експресія мРНК інтерлейкіну (IL), а саме IL-1, -2, -10 і -12, у мишей, що страждають TNBS-індукованим колітом, після лікування наповнювачем (1% CMC), 50 мг/кг мезаламіну й еквімолярною дозою сполуки XXXV за даним винаходом. На Фіг. 12 показані рівні мРНК RANTES в ободовій кишці в мишей, що страждають TNBSіндукованим колітом, після лікування наповнювачем (1% CMC), 50 мг/кг мезаламіну й еквімолярною дозою сполуки XXXV за даним винаходом. На Фіг. 13 показана експресія мРНК СОХ-1 і СОХ-2 в ободовій кишці в мишей, що страждають TNBS-індукованим колітом, після лікування наповнювачем (1% CMC), 50 мг/кг мезаламіну й еквімолярною дозою сполуки XXXV за даним винаходом. На Фіг. 14 показана експресія мРНК eNOS і iNOS в ободовій кишці в мишей, що страждають TNBS-індукованим колітом, після лікування наповнювачем (1% CMC), 50 мг/кг мезаламіну й еквімолярною дозою сполуки XXXV за даним винаходом. На Фіг. 15(а) і (b) показана оцінка сприйняття вісцерального болю щурами у тваринній моделі при використанні відповідно мезаламіну й сполуки XXXV за даним винаходом. На Фіг. 16(а) і (b) показаний тиск у прямій кишці у тваринній моделі сприйняття вісцерального 96264 36 болю щурами при використанні відповідно мезаламіну й сполуки XXXV за даним винаходом. На Фіг. 17 показані оцінки сприйняття болю при використанні мезаламіну, сполуки XXXV і сполуки XXVII із глібенкламідом або без зазначеного лікарського засобу. На Фіг. 18 показані оцінки сприйняття болю при використанні сполуки XXXV, сполуки XXVII, мезаламіну, ADT-OH і 4-НВТ. На Фіг. 19 показана адгезія лейкоцитів у відповідь на внутрішньошлункове введення аспірину. На Фіг. 20 зображена стовпчаста діаграма адгезії лейкоцитів наприкінці експерименту (після закінчення 60-65 хвилин). На Фіг. 21 зображена стовпчаста діаграма, що показує утворення H2S цистеїном, ADT-OH, сполукою XXXV, 4-НТВ і сполукою XXVII. На Фіг. 22 зображена крива зміни реакції залежно від концентрації, що показує вазорелаксуючу дію Н2S-вивільнюючих частин молекули за даним винаходом. Детальний опис переважного варіанта здійснення винаходу Даний винахід далі буде описано з посиланням на переважні варіанти здійснення винаходу. Однак слід зазначити, що зазначені варіанти здійснення винаходу наведені тільки з метою ілюстрації винаходу й не обмежують об'єм винаходу, представленого у формулі винаходу. Сполуки за даним винаходом містять дві активні частини: 4- або 5-ASA і частину, яка вивільняє сірководень, які зв'язані одна з одною за допомогою азогрупи, складноефірного, ангідридного, складнотіоефірного або амідного зв'язку. Наявність ферментів азоредуктази уможливлює вивільнення 4- або 5-ASA із проліків, зв'язаних азогрупою, забезпечуючи в такий спосіб спрямовану доставку в ободову кишку й зменшення системного усмоктування. Аналогічним чином, присутність карбоксипептидаз і амінопептидаз А також уможливлює вивільнення 4- або 5ASA із проліків, зв'язаних відповідно складноефірним і амідним зв'язком. Естерази й тіоестерази також розщеплюють відповідно складноефірні й складнотіоефірні зв'язки. І нарешті, ліпази розщеплюють ангідридні зв'язки. Сполуки за даним винаходом можуть бути отримані при використанні відомих вихідних речовин і реагентів. Сполуки за даним винаходом можуть бути використані для профілактики або лікування різних захворювань, зокрема запальних захворювань шлунково-кишкового тракту, які включають, не обмежуючись ними, запальні захворювання ротової порожнини, такі як запалення слизової оболонки, інфекційні захворювання (наприклад, вірусні, бактеріальні й грибкові захворювання) і хворобу Крона; запальні захворювання стравоходу, такі як езофагіт, ураження, викликані хімічними речовинами (наприклад, ураження, що виникає при проковтуванні лугу), гастроезофагеальна рефлюксна хвороба, рефлюкс жовчної кислоти, виразка стравоходу Баррета, хвороба Крона й звуження стравоходу; запальні захворювання, такі як гастрит (наприклад, 37 Helicobacter pyroli, пептичний езофагіт і атрофічний гастрит), глютенова хвороба, пептична виразка, передпухлинні стани шлунка, невиразкова диспепсія й хвороба Крона; запальні захворювання шлунка, такі як хвороба Крона, надмірний розвиток мікрофлори, пептична виразка й фісури тонкої кишки; запальні захворювання ободової кишки, такі як хвороба Крона, неспецифічний виразковий коліт, спастичний коліт, інфекційний коліт (наприклад, псевдомембранозний коліт, зокрема коліт, викликаний бактеріями роду Clostridium difficile, ентерит, викликаний бактеріями роду Salmonella, інфекційні захворювання, викликані шигелами, йерсиніоз, криптоспірідіоз, мікроспірідіоз і вірусні інфекції), променевий коліт, коліт у хазяїна з ослабленим імунітетом (наприклад, тифліт), передпухлинні стани ободової кишки (наприклад, дисплазія, запальні захворювання кишечнику й поліпозний коліт), проктит, запалення, зумовлене гемороєм, прокталгія й тріщини прямої кишки; захворювання печінки, жовчного міхура і/або жовчних проток, такі як холангіт, склерозуючий холангіт, первинний цироз жовчних проток і холецистит; і кишковий абсцес. Залежно від конкретного стану або захворювання, що підлягає лікуванню, сполуки за даним винаходом можна вводити суб'єктам у будь-яких терапевтично прийнятних, ефективних і безпечних дозах, які можуть бути легко визначені фахівцем у даній галузі. Зазначені сполуки найбільш бажано вводять у кількості від близько 1 до близько 2000 мг/добу у виді однократної дози або розділених доз, хоча доза може бути змінена залежно від маси тіла й стану здоров'я підлягаючого лікуванню суб'єкта й конкретного способу введення. Однак найбільш бажана доза знаходиться в межах від близько 0,1 до близько 100 мг/кг, переважно від близько 5 до 90 мг/кг і більш переважно від близько 5 до 50 мг/кг. Проте доза може бути змінена залежно від маси тіла й стану здоров'я підлягаючого лікуванню суб'єкта, індивідуальної реакції на зазначений лікарський засіб, а також від типу вибраного фармацевтичного препарату й часу введення. У деяких випадках більш прийнятною може бути доза нижча нижньої межі вищевказаного діапазону, у той час як в інших випадках можуть бути використані більш високі дози без виникнення шкідливих побічних ефектів за умови, що такі більші дози спочатку ділять на декілька менших доз, призначених для введення протягом дня. Сполуки за даним винаходом можна вводити у вигляді будь-якого фармацевтичного препарату, тип якого залежить від способу введення. Зазначені фармацевтичні композиції можуть бути отримані стандартними методами з використанням сумісних фармацевтично прийнятних наповнювачів або носіїв. Приклади таких композицій включають капсули, таблетки, черезшкірні пластири, коржі, пастилки, аерозолі, сиропи, порошки, гранули, гелі, еліксири, супозиторії й тому подібні, розчини, виготовлені по індивідуальному рецепту, ін'єктовані препарати, ректальні, назальні, очні, вагінальні й інші препарати. Переважним 96264 38 способом введення є пероральне й ректальне введення. Для перорального введення можна використовувати таблетки, що містять різні наповнювачі, такі як мікрокристалічна целюлоза, цитрат натрію, карбонат кальцію, дикальційфосфат і гліцин, поряд з різними дезінтеграторами, такими як крохмаль (переважно кукурудзяний крохмаль, картопляний крохмаль або крохмаль із кассави), альгінова кислота й певні комплексні силікати, і гранулюючи ми сполучними речовинами, такими як полівінілпіролідон, сахароза, желатин і аравійська камедь. Крім того, у процесі таблетування можуть бути використані змащувальні речовини, такі як стеарат магнію, лаурилсульфат натрію й тальк. Тверді композиції подібного типу можуть бути також використані для наповнення желатинових капсул; переважні речовини, використовувані для зазначеної мети, включають також лактозу або молочний цукор, а також високомолекулярні поліетиленгліколі. При одержанні водних суспензій і/або еліксирів для перорального введення активний інгредієнт може бути об'єднаний з підсолоджувачами або ароматизаторами, барвниками й при бажанні з емульгуючими і/або суспендуючими агентами разом з такими розріджувачами, як вода, етанол, пропіленгліколь, гліцерин і різні комбінації зазначених речовин. Можна приготувати лікарську форму з негайною дією, регульованою дією, уповільненою дією, пролонгованою дією або цілеспрямованою пролонгованою дією. Визначення вищевказаних термінів відомі фахівцям у даній галузі. Крім того, на профіль дії лікарської форми може впливати склад полімерної суміші, склад матриці з покриттям, склад частинок, склад частинок з покриттям, склад іонообмінної смоли, осмотичні характеристики композиції або полімерна композиція, що біологічно розкладається. Не обмежуючи себе якою-небудь теорією, можна відзначити, що на дію лікарського препарату може впливати сприятлива дифузія, розчинність, ерозія, іонний обмін, осмос або комбінація вищевказаних факторів. Для парентерального введення можна використовувати розчин активної сполуки в кунжутній олії або арахісовому маслі або у водному розчині пропіленгліколю. Водні розчини при необхідності повинні бути належним чином забуферені (рН переважно вище 8), при цьому водний розріджувач насамперед повинен бути ізотонічним. Для внутрішньовенних ін'єкцій можуть бути використані водні розчини. Всі зазначені розчини одержують у стерильних умовах, створюваних стандартними фармацевтичними методами, добре відомими фахівцям у даній галузі. Нижче наведені не обмежуючі даний винахід приклади, які повинні дозволити фахівцеві в даній галузі реалізувати й використовувати даний винахід. Одержання сполук Приклад 1 Синтез 2-гідрокси-5-[4-(5-тіоксо-5Н[1,2]дитіол-3-іл)фенілазо]бензойної кислоти (4) [сполука формули II] 39 Синтез трет-бутилового ефіру (4пропенілфеніл)карбамінової кислоти (2) До розчину 4-пропенілфеніламіну (1) (10,0 ммоль) в 25 мл діоксану й 12,5 мл води додавали триетиламін (15,0 ммоль) і ди-третбутилдикарбонат (15,0 ммоль), перемішуючи суміш при 0°С протягом 1/2 години. Реакційну суміш перемішували механічною мішалкою протягом 24 годин при кімнатній температурі. Розчинник випарювали й до залишку по краплях додавали 3M розчин HCl (15 мл). Осад фільтрували, промивали водою й сушили. Залишок уводили у відкриту колонку із силікагелем і елюювали СН2Сl2/MeOH (9/1), одержуючи при цьому трет-бутиловий ефір (4пропенілфеніл)карбамінової кислоти (2) (вихід 90%). Синтез 5-(4-амінофеніл)-[1,2]дитіол-3-тіону (3) Трет-бутиловий ефір (4пропенілфеніл)карбамінової кислоти (2, 4,5 ммоль) і сірку (31,5 ммоль) нагрівали в диметилформаміді (500 мл) протягом 8 годин, розчинник видаляли й залишок майже повністю розчиняли в толуолі. Розчин у толуолі екстрагували 2Н водним розчином гідроксиду натрію з утворенням осаду жовтогарячої твердої речовини. Продукт 96264 40 розчиняли в киплячій воді, обробляли 4Н розчином хлористоводневої кислоті протягом 30 хвилин при кімнатній температурі й додавали 4Н розчин NaOH, одержуючи при цьому необхідний продукт (3) (вихід 55%) Синтез 2-гідрокси-5-[4-(5-тіоксо-5Н[1,2]дитіол-3-іл)фенілазо]бензойної кислоти (4) 5-(4-амінофеніл)-[1,2]дитіол-3-тіон (3, 0,56 ммоль) розчиняли в суміші 5 мл концентрованої HCl і 2,5 мл води й діазотували розчином нітриту натрію (0,56 ммоль). Тим часом у воді розчиняли саліцилову кислоту (0,56 ммоль), гідроксид калію (1,12 ммоль) і карбонат натрію. Суспензію діазосполуки додавали порціями до лужного розчину саліцилової кислоти й протягом всієї реакції лужність підтримували на досить високому рівні, додаючи додаткові кількості розчину гідроксиду калію. Через 2 дні реакційну суміш нагрівалі протягом 30 хвилин при 50°С. Азосполуку (4) осаджували за допомогою HCl і відфільтровували (вихід 85%), одержуючи при цьому сполуку формули II, 2-гідрокси-5-[4-(5-тіоксо-5Н-[1,2]дитіол-3іл)фенілазо]бензойну кислоту. Приклад 2 Синтез 2-гідрокси-4-[4-(5-тіоксо-5Н[1,2]дитіол-3-іл)фенілазо]бензойної кислоти (2) [сполука формули II] 41 96264 42 Синтез 2-гідрокси-4-[4-(5-тіоксо-5Н[1,2]дитіол-3-іл)фенілазо]бензойної кислоти (2) 4-аміно-2-гідроксибензойну кислоту (1,1 ммоль) розчиняли в суміші 10 мл концентрованої HCl і 5 мл води й діазотували розчином нітриту натрію (1 ммоль). Суспензію діазосполуки додавали порціями до розчину 5-феніл-[1,2]дитіол-3тіону (1 ммоль) у диметилформаміді. Через 2 дні реакційну суміш нагрівалі протягом 30 хвилин при 50°С. Суміш охолоджували, азосполуку (2) оса джували за допомогою HCl і відфільтровували (вихід 65%), одержуючи при цьому сполуку формули II, 2-гідрокси-5-[4-(5-тіоксо-5Н-[1,2]-дитіол-3іл)фенілазо]бензойну кислоту. Приклад 3 Загальний спосіб синтезу 4-(5-тіоксо-5Н[1,2]дитіол-3-іл)фенілового ефіру 4- або 5-аміно2-гідроксибензойної кислоти (4) [сполука формули XXXV] Синтез 5-п-гідроксифеніл-1,2-дитіон-3-тіону (ADT-OH) Анетол (1) (32,5 г, 0,21 моль) і сірку (45 г, 1,40 моль) нагрівали в диметилформаміді (250 мл) протягом 8 годин, розчинник видаляли, і залишок майже повністю розчиняли в толуолі. Розчин у толуолі екстрагували 2Н водним розчином гідроксиду натрію з утворенням осаду жовтогарячої твердої речовини (8,5 г), температура плавлення вища 300°С. Продукт розчиняли в киплячій воді й додавали хлористоводневу кислоту, одержуючи при цьому жовтогарячий осад (2) (вихід 50%), 1 температура плавлення 188-189°С. Н ЯМР (ДМСО) 6,86 (д, 2Н), 7,68 (с, 1Н), 7,75 (д, 2Н), 10,51 (с, -ОН); MS (ESI), m/z 225 (Μ). 43 Синтез 4- або 5-трет-бутоксикарбоніламіно-2гідроксибензойної кислоти (1) До розчину 4- або 5-аміносаліцилової кислоти (10,0 ммоль) в 25 мл діоксану й 12,5 мл води додавали триетиламін (15,0 ммоль) і ди-третбутилдикарбонат (15,0 ммоль), перемішуючи суміш при 0°С протягом 1/2 години. Реакційну суміш перемішували механічною мішалкою протягом 24 годин при кімнатній температурі. Розчинник випарювали й до залишку по краплях додавали 3M розчин HCl (15 мл). Осад фільтрували, промивали водою й сушили. Залишок уводили у відкриту колонку із силікагелем і елюювали СН2Сl2/MeOH (9/1), одержуючи при цьому 4або 5-трет-бутоксикарбоніламіно-2гідроксибензойну кислоту (1) (вихід 80%). Синтез 4- або 5-трет-бутоксикарбоніламіно-2трет-бутоксибензойної кислоти (2) Сполуку (1) (12,0 ммоль), концентровану H2SO4 (6,0 ммоль) і DCM (100 мл) перемішували в атмосфері газоподібного ізобутилену під тиском 0,35 атм. (5 фунтів/кв. дюйм) протягом 6 годин при кімнатній температурі. Розчин промивали холодним 10% NaHCO3 (2100 мл) і насиченим розчином солі (100 мл), сушили (Na2SO4) і упарювали. Залишок розчиняли в МеОН/ССl4 (1:1) (400 мл), промивали водою (300 мл) і екстрагували МеОН/водою (1:1) (2200 мл). Екстракт сушили (Na2SO4) і упарювали з утворенням білої твердої речовини (2), яку перекристалізовували DCM/гексаном (вихід 83%). Синтез 4-(5-тіоксо-5Н-[1,2]дитіол-3іл)фенілового ефіру 4або 5-аміно-2гідроксибензойної кислоти (4) До розчину 4або 5-третбутоксикарбоніламіно-2-гідроксибензойної кисло 96264 44 ти (2) (3,0 ммоль) в 50 мл диметилформаміду додавали гідроксибензотриазол (3,3 ммоль) і DCC (3,3 ммоль), перемішуючи суміш при 0°С протягом 1 години. До реакційної суміші додавали 5-п-гідроксифеніл-1,2-дитіон-3-тіон (ADT-OH) (3,0 ммоль) і перемішували механічною мішалкою протягом 3 годин при 0°С і протягом 72 годин при кімнатній температурі. Суміш фільтрували й фільтрат упарювали при зниженому тиску, щоб видалити розчинник. Отриманий у такий спосіб маслянистий залишок розчиняли в етилацетаті; органічний шар промивали насиченим розчином солі, сушили над безводним MgSO4, фільтрували й випарювали розчинник. Неочищений проміжний продукт (3) обробляли розчином 40% TFA (трифтороцтовою кислотою) в СН2Сl2. Через 2 години розчинник видаляли з утворенням сполуки (3) у вигляді неочищеного залишку. Залишок уводили у відкриту колонку із силікагелем і елюювали СН2Сl2/MeOH (8/2), одержуючи при цьому 4-(5тіоксо-5Н-[1,2]дитіол-3-іл)феніловий ефір 4- або 5-аміно-2-гідроксибензойної кислоти (4) [сполука формули XXXV] (вихід 40%). Сполука: 4-(5-тіоксо-5Н-[1,2]дитіол-3іл)феніловий ефір 5-аміно-2-гідроксибензойної 1 кислоти (4): Н ЯМР (ДМСО) 7,07 (д, 2Н), 7,38 (д, 2Н), 7,46 (д, 2Н), 7,79 (с, 1Н), 7,85 (с, 1Н), 8,01 + (д, 2Н), 10,35 (с, -ОН); MS (ESI), m/z 362 (М ). Приклад 4 Загальний спосіб синтезу 2-(третбутоксикарбоніл)-4або 5амінофенілгідрокарбонату (5) і 3-(третбутоксикарбоніл)-4або 5гідроксифенілкарбамінової кислоти (6) 45 Синтез 4або 5-аміно-2етоксикарбонілоксибензойної кислоти (1) і 4- або 5-етоксикарбоніламіно-2-гідроксибензойної кислоти (2) 4- або 5-аміносаліцилову кислоту (3,0 ммоль) розчиняли в 40 мл хлороформу в круглодонній колбі, оснащеній сушильною трубкою. Поступово додавали етилхлорформіат (3,0 ммоль) і нагрівали розчин зі зворотним холодильником протягом 2 годин. Хлороформ випарювали у вакуумі, і залишок поглинали простим ефіром. Ефірну фазу знебарвлювали вугіллям, фільтрували й видаляли розчинник у вакуумі. Отриманий залишок розчиняли в етанолі, і продукт осаджували нгексаном у вигляді неочищеної маслянистої напівтвердої речовини. Неочищений продукт очищали флеш-хроматографією на силікагелі, виконуючи елюювання діетиловим ефіром/гексаном (7:3, об/об), у результаті чого були отримані зазначені в заголовку сполуки: 4- або 5-аміно-2етоксикарбонілоксибензойна кислота (1: вихід 58%) і 4або 5-етоксикарбоніламіно-2гідроксибензойна кислота (2: вихід 34%). Синтез трет-бутилового ефіру 4- або 5-аміно2-етоксикарбонілоксибензойної кислоти (3) До розчину сполуки (1) (3,0 ммоль) в 50 мл диметилформаміду додавали гідроксибензотриазол (3,3 ммоль) і DCC (3,3 ммоль), перемішуючи суміш при 0°С протягом 1 години. До реакційної суміші додавали трет-бутанол (3,0 ммоль) і перемішували механічною мішалкою протягом 3 годин при 0°С і протягом 72 годин при кімнатній температурі. Суміш фільтрували й фільтрат упарювали при зниженому тиску, щоб видалити розчинник. Отриманий у такий спосіб маслянистий залишок розчиняли в етилацетаті; органічний шар промивали насиченим розчином солі, сушили над безводним MgSO4, фільтрували й випа 96264 46 рювали розчинник. Залишок уводили у відкриту колонку із силікагелем і елюювали СН2Сl2/MeOH (9,5/0,5), одержуючи при цьому трет-бутиловий ефір 4-або 5-аміно-2етоксикарбонілоксибензойної кислоти (3) (вихід 55%). Синтез трет-бутилового ефіру 4- або 5етоксикарбоніламіно-2-гідроксибензойної кислоти (4) Сполука (4) була отримана способом, описаним для одержання сполуки (3). Вихід 74%. Синтез 2-(трет-бутоксикарбоніл)-4- або 5амінофенілгідрокарбонату (5) До розчину сполуки (3) (3,5 г, 0,011 моль) в етанолі (80 мл) додавали 1Н розчин NaOH (40 мл). Реакційну суміш перемішували протягом 2 годин при кімнатній температурі. Потім розчин робили нейтральним, додаючи 1H розчин HCl. Етанол видаляли й залишок екстрагували етилацетатом (3150 мл); органічні шари промивали насиченим розчином солі, сушили над безводним MgSO4, фільтрували й випарювали розчинник, одержуючи при цьому 2-(трет-бутоксикарбоніл)-4або 5-амінофенілгідрокарбонат (5) (3 г, 0,010 моль, вихід 89%) у вигляді білої твердої речовини. Синтез 3-(трет-бутоксикарбоніл)-4- або 5гідроксифенілкарбамінової кислоти (6) Сполука (6) була отримана способом, описаним для одержання сполуки (5). Вихід 91%. Приклад 5 Загальний спосіб синтезу 4- або 5-аміно-2-(1карбокси-3тіокарбамоїлпропілкарбамоїлокси)бензойної кислоти (11) [сполука формули XXII] і 4- або 5-[3-(1карбокси-3-тіокарбамоїлпропіл)уреїдо]-2гідроксибензойної кислоти (12) 47 Синтез 5-Тіо-L-глутамін-OtВu (2) L-Глутамін-OtВu·НСІ (1) (1,2 ммоль, 0,3 г) і реагент Лавессона (0,75 ммоль, 0,3 г) додавали до бензолу (20 мл) і суміш нагрівали зі зворотним холодильником протягом 15 хвилин. Потім реак 96264 48 ційну суміш охолоджували й упарювали у вакуумі. Неочищений продукт очищали хроматографією на 100 г силікагелю й елюювали сумішами етилацетату й н-гексану. Було отримано 0,2 г (вихід 76%) продукту (2) у вигляді білої твердої 49 96264 50 + речовини. Н ЯМР (CDCl3) СН2Сl2 1,4 (с, 9Н), 1,8-2,8 (м, 5Н), 4,0-4,8 (м, 3Н); MS (ESI), m/z 219 (М ). Синтез 2-(трет-бутоксикарбоніл)-4- або 5трет-бутоксикарбоніламінофенілгідрокарбонату (7) До розчину сполуки (5) (10,0 ммоль) в 25 мл діоксану й 12,5 мл води додавали триетиламін (15,0 ммоль) і ди-трет-бутил-дикарбонат (15,0 ммоль), перемішуючи суміш при 0°С протягом 1/2 години. Реакційну суміш перемішували механічною мішалкою протягом 24 годин при кімнатній температурі. Розчинник випарювали й до залишку по краплях додавали 3M розчин HCl (15 мл). Осад фільтрували, промивали водою й сушили. Залишок уводили у відкриту колонку із силікагелем і елюювали СН2Сl2/MeOH (9/1), одержуючи при цьому 2-(трет-бутоксикарбоніл)-4- або 5-третбутоксикарбоніламінофенілгідрокарбонат (7) (вихід 80%). Синтез 3-(трет-бутоксикарбоніл)-4- або 5гідроксифенілкарбамінової кислоти (8) Сполуку (6) (12,0 ммоль), концентровану H2SO4 (6,0 ммоль) і DCM (100 мл) перемішували в атмосфері газоподібного ізобутилену під тиском 0,35 атм. (5 фунтів/кв. дюйм) протягом 6 годин при кімнатній температурі. Розчин промивали холодним 10% NaHCO3 (2100 мл) і насиченим розчином солі (100 мл), сушили (Na2SO4) і упарювали. Залишок розчиняли в МеОН/ССІ4 (1:1) (400 мл), промивали водою (300 мл) і екстрагували МеОН/водою (1:1) (2200 мл). Екстракт сушили (Na2SO4) і упарювали з утворенням білої твердої речовини (8), яку перекристалізовували DCM/гексаном (вихід 83%). Синтез 4- або 5-аміно-2-(1-карбокси-3тіокарбамоїлпропілкарбамоїлокси) бензойної кислоти (11) До розчину сполуки (7) (3,0 ммоль) в 50 мл диметилформаміду, додавали гідроксибензотри азол (3,3 ммоль) і DCC (3,3 ммоль), перемішуючи суміш при 0°С протягом 1 години. До реакційної суміші додавали трет-бутиловий ефір 2-аміно-4тіокарбамоїлмасляної кислоти (3,0 ммоль) і триетиламін (3,0 ммоль) і перемішували механічною мішалкою протягом 3 годин при 0°С і протягом 72 годин при кімнатній температурі. Суміш фільтрували й фільтрат упарювали при зниженому тиску, щоб видалити розчинник. Отриманий у такий спосіб маслянистий залишок розчиняли в етилацетаті; органічний шар промивали насиченим розчином солі, сушили над безводним MgSO4, фільтрували й випарювали розчинник. Неочищений проміжний продукт (9) обробляли розчином 40% TFA в СН2Сl2. Через 2 години розчинник видаляли з утворенням сполуки (11) у вигляді неочищеного залишку. Залишок уводили у відкриту колонку із силікагелем і елюювали СН2Сl2/МеОН (8/2), одержуючи при цьому 4- або 5-аміно-2-(1карбокси-3-тіокарбамоїлпропілкарбамоїлокси)бензойну кислоту (11) (вихід 45%) [сполука формули XXII]. Синтез 4або 5-[3-(1-карбокси-3тіокарбамоїлпропіл)уреїдо]-2-гідроксибензойної кислоти (12) Сполука (12) була отримана способом, описаним для одержання сполуки (11). Вихід 38%. Приклад 6 Загальний спосіб синтезу 4- або 5-аміно-2-[4(5-тіоксо-5Н-[1,2]дитіол-3іл)феноксикарбонілокси]бензойної кислоти (15) [сполука формули IV] і 2-гідрокси-4- або 5-[4-(5тіоксо-5Н-[1,2]дитіол-3іл)феноксикарбоніламіно]бензойної кислоти (16) [сполука формули V] 1 51 Синтез 5-п-гідроксифеніл-1,2-дитіон-3-тіону (ADT-OH) Анетол (1) (32,5 г, 0,21 моль) і сірку (45 г, 1,40 моль) нагрівали в диметилформаміді (250 мл) протягом 8 годин; розчинник видаляли й залишок майже повністю розчиняли в толуолі. Розчин у 96264 52 толуолі екстрагували 2Н водним розчином гідроксиду натрію з утворенням осаду жовтогарячої твердої речовини (8,5 г), температура плавлення вище 300°С. Продукт розчиняли в киплячій воді й додавали хлористоводневу кислоту, одержуючи при цьому жовтогарячий осад (2) (вихід 50%), 53 96264 54 температура плавлення 188-189°С. Н ЯМР (ДМСО) 6,86 (д, 2Н), 7,68 (с, 1Н), 7,75 (д, 2Н), 10,51 (с, -ОН); MS (ESI), m/z 225 (Μ). Синтез 2-(трет-бутоксикарбоніл)-4- або 5трет-бутоксикарбоніламінофенілгідрокарбонату (7) До розчину сполуки (5) (10,0 ммоль) в 25 мл діоксану й 12,5 мл води додавали триетиламін (15,0 ммоль) і ди-трет-бутил-дикарбонат (15,0 ммоль), перемішуючи при 0°С протягом 1/2 години. Реакційну суміш перемішували механічною мішалкою протягом 24 годин при кімнатній температурі. Розчинник випарювали й до залишку по краплях додавали 3M розчин HCl (15 мл). Осад фільтрували, промивали водою й сушили. Залишок уводили у відкриту колонку із силікагелем і елюювали СН2Сl2/MeOH (9/1), одержуючи при цьому 2-(трет-бутоксикарбоніл)-4- або 5-третбутоксикарбоніламінофенілгідрокарбонат (7) (вихід 80%). Синтез 3-(трет-бутоксикарбоніл)-4- або 5гідроксифенілкарбамінової кислоти (8) Сполуку (6) (12,0 ммоль), концентровану H2SO4 (6,0 ммоль) і DCM (100 мл) перемішували в атмосфері газоподібного ізобутену під тиском 0,35 атм. (5 фунтів/кв. дюйм) протягом 6 годин при кімнатній температурі. Розчин промивали холодним 10% NaHCO3 (2100 мл) і насиченим розчином солі (100 мл), сушили (Na2SO4) і упарювали. Залишок розчиняли в МеОН/ ССl4 (1:1) (400 мл), промивали водою (300 мл) і екстрагували МеОН/водою (1:1) (2200 мл). Екстракт сушили (Na2SO4) і упарювали з утворенням білої твердої речовини (8), яку перекристалізовували DCM/гексаном (вихід 83%). Синтез 4- або 5-аміно-2-[4-(5-тіоксо-5Н[1,2]дитіол-3-іл)феноксикарбонілокси]бензойної кислоти (15) До розчину сполуки (7) (3,0 ммоль) в 50 мл диметилформаміду додавали гідроксибензотриа зол (3,3 ммоль) і DCC (3,3 ммоль), перемішуючи суміш при 0°С протягом 1 години. До реакційної суміші додавали 5-п-гідроксифеніл-1,2-дитіон-3тіон (ADT-OH) (3,0 ммоль) і перемішували механічною мішалкою протягом 3 годин при 0°С і протягом 72 годин при кімнатній температурі. Суміш фільтрували й фільтрат упарювали при зниженому тиску, щоб видалити розчинник. Отриманий у такий спосіб маслянистий залишок розчиняли в етилацетаті; органічний шар промивали насиченим розчином солі, сушили над безводним MgSO4, фільтрували й випарювали розчинник. Неочищений проміжний продукт (13) обробляли розчином 40% TFA в СН2Сl2. Через 2 години розчинник видаляли з утворенням сполуки (15) у вигляді неочищеного залишку. Залишок уводили у відкриту колонку із силікагелем і елюювали СН2Сl2/MeOH (8/2), одержуючи при цьому 4- або 5-аміно-2-[4-(5-тіоксо-5Н-[1,2]-дитіол-3іл)феноксикарбонілокси]бензойну кислоту (15) (вихід 45%), сполука формули IV. Синтез 2-гідрокси-4- або 5-[4-(5-тіоксо-5Н[1,2]дитіол-3-іл)феноксикарбоніламіно]бензойної кислоти (16) Сполука (16), сполука формули V, була отримана способом, описаним для одержання сполуки (15). Вихід 38%. Приклад 7 Загальний спосіб синтезу 4- або 5-аміно-2-{45 5 [4-(4-гідроксифеніл)-2,4-дитіоксо-2 4 [1,3,2,4]дитiaдифocфeтaн-2iл]фeнoкcикapбoнiлoкcи}бензойної]кислоти (19) [сполука формули XIV] і 2-гідрокси-4- або 5-{4-[45 5 (4-гідроксифеніл)-2,4-дитioкco-2 4 -[1,3,2,4]дитiaдифocфeтaн-2-iлlфeнoкcикapбoнiлaмiнo) бензойної кислоти (20) [сполука формули XIII] 1 55 Синтез ангідриду (пгідроксифеніл)дитіофосфонової кислоти Червоний фосфор (4 г, 0,129 моль), сірку (4 г, 0,125 моль) і PhOH (4 г, 0,042 моль) нагрівали протягом 5,5 години при 155-158°С; реакційну 96264 56 суміш охолоджували при кімнатній температурі й осад збирали (5,5 г, вихід 34%), температура плавлення 224-226°С. Результати аналізів ЯМР і мас-спектроскопії (MS) відповідали структурі ангідриду п-гідроксифенілдитіофосфонової кислоти. 57 Синтез 2-(трет-бутоксикарбоніл)-4- або 5трет-бутоксикарбоніламінофенілгідрокарбонату (7) До розчину сполуки (5) (10,0 ммоль) в 25 мл діоксану й 12,5 мл води додавали триетиламін (15,0 ммоль) і ди-трет-бутил-дикарбонат (15,0 ммоль), перемішуючи суміш при 0°С протягом 1/2 години. Реакційну суміш перемішували механічною мішалкою протягом 24 годин при кімнатній температурі. Розчинник випарювали й до залишку по краплях додавали 3M розчин HCl (15 мл). Осад фільтрували, промивали водою й сушили. Залишок уводили у відкриту колонку із силікагелем і елюювали СН2Сl2/MeOH (9/1), одержуючи при цьому 2-(трет-бутоксикарбоніл)-4- або 5-третбутоксикарбоніламінофенілгідрокарбонат (7) (вихід 80%). Синтез 3-(трет-бутоксикарбоніл)-4- або 5гідроксифенілкарбамінової кислоти (8) Сполуку (6) (12,0 ммоль), концентровану H2SO4 (6,0 ммоль) і DCM (100 мл) перемішували в атмосфері газоподібного ізобутену під тиском 0,35 атм. (5 фунтів/кв. дюйм) протягом 6 годин при кімнатній температурі. Розчин промивали холодним 10% NaHCO3 (2100 мл) і насиченим розчином солі (100 мл), сушили (Na2SO4) і упарювали. Залишок розчиняли в МеОН/ССl4 (1:1) (400 мл), промивали водою (300 мл) і екстрагували МеОН/водою (1:1) (2200 мл). Екстракт сушили (Na2SO4) і упарювали з утворенням білої твердої речовини (8), яку перекристалізовували DCM/гексаном (вихід 83%). Синтез 4або 5-аміно-2-{4-[4-(45 5 гідроксифеніл)-2,4-дитіоксо-2 4 [1,3,2,4]дитіадифосфетан-2іліфеноксикарбонілокси}бензойної кислоти (19) До розчину сполуки (7) (3,0 ммоль) в 50 мл диметилформаміду додавали гідроксибензотриазол (3,3 ммоль) і DCC (3,3 ммоль), перемішуючи 96264 58 суміш при 0°С протягом 1 години. До реакційної суміші додавали ангідрид пгідроксифенілдитіофосфонової кислоти (3,0 ммоль) і перемішували механічною мішалкою протягом 3 годин при 0°С і протягом 72 годин при кімнатній температурі. Суміш фільтрували й фільтрат упарювали при зниженому тиску, щоб видалити розчинник. Отриманий у такий спосіб маслянистий залишок розчиняли в етилацетаті; органічний шар промивали насиченим розчином солі, сушили над безводним MgSO4, фільтрували й випарювали розчинник. Неочищений проміжний продукт (17) обробляли розчином 40% TFA в СН2Сl2. Через 2 години розчинник видаляли з утворенням сполуки (19) у вигляді неочищеного залишку. Залишок уводили у відкриту колонку із силікагелем і елюювали СН2Сl2/MeOH (8/2), одержуючи при цьому 4- або 5-аміно-2-{4-[4-(45 5 гідроксифеніл)-2,4-дитіоксо-2 4 [1,3,2,4]дитiaдифocфeтaн-2iл]фeнoкcикapбoнiлoкcи}бeнзoйнy кислоту (19) (вихід 65%), сполука формули XIV. Синтез 2-гідрокси-4або 5-{4-[4-(45 5 гідроксифеніл)-2,4-дитіоксо-2 4 [1,3,2,4]дитіадифосфетан-2іл]феноксикарбоніламіно)бензойної кислоти (20) Сполука (20), сполука формули XIII, була отримана способом, описаним для одержання сполуки (19). Вихід 48%. Приклад 8 Загальний спосіб синтезу 4- або 5-аміно-2-(4тіокарбамоїлфеноксикарбонілокси)бензойної кислоти (23) [сполука формули XXVIII] і 2-гідрокси4або 5-(4тіокарбамоїлфеноксикарбоніламін)бензойної кислоти (24) [сполука формули XXIX] 59 Синтез 2-(трет-бутоксикарбоніл)-4- або 5трет-бутоксикарбоніламінофенілгідрокарбонат (7) До розчину сполуки (5) (10,0 ммоль) в 25 мл діоксану й 12,5 мл води додавали триетиламін 96264 60 (15,0 ммоль) і ди-трет-бутил-дикарбонат (15,0 ммоль), перемішуючи суміш при 0°С протягом 1/2 години. Реакційну суміш перемішували механічною мішалкою протягом 24 годин при кімнатній
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of 4-or 5-aminosalicylic acid
Автори англійськоюWallace John L., Sparatore Anna, Cirino Giuseppe, Caliendo Giuseppe, Santagada Vincenzo, Fiorucci Stefano
Назва патенту російськоюПроизводные 4- или 5-аминосалициловой кислоты
Автори російськоюУоллейс Джон Л., Чирино Джузеппе, Календо Джузеппе, Спараторе Анна, Сантагада Винченцо, Фьоруччи Стефано
МПК / Мітки
МПК: C07C 333/00, A61K 31/325, C07C 327/00, C07D 339/00, C07C 321/00, C07F 9/6578
Мітки: кислоти, похідні, 5-аміносаліцилової
Код посилання
<a href="https://ua.patents.su/56-96264-pokhidni-4-abo-5-aminosalicilovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Похідні 4- або 5-аміносаліцилової кислоти</a>
Попередній патент: Спосіб та пристрій для переробки відпрацьованих абразивних суспензій для відновлення їх компонентів багаторазового використання
Наступний патент: Композиція і спосіб інгібування jak шляху передачі сигналу
Випадковий патент: Роторно-поршневий двигун внутрішнього згоряння