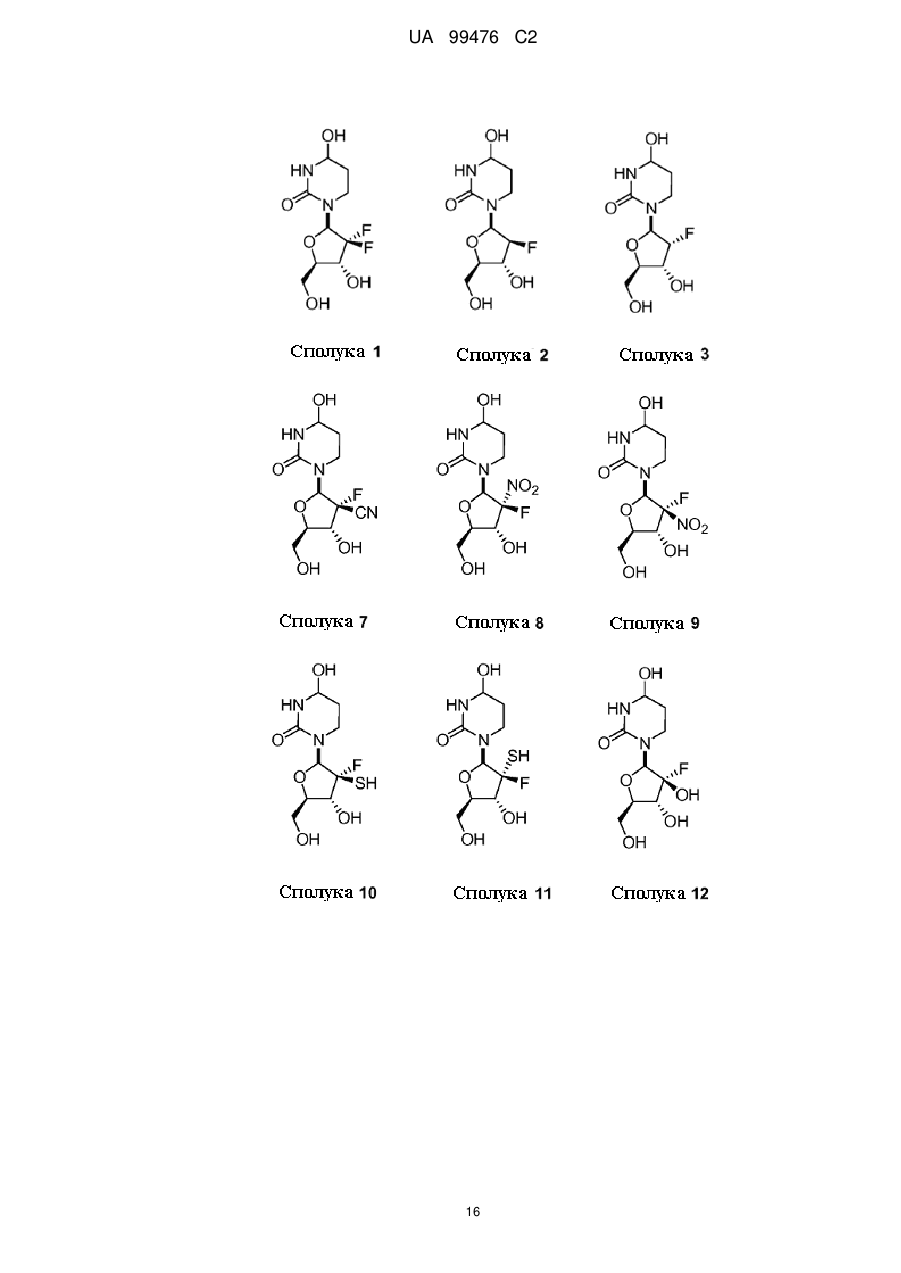
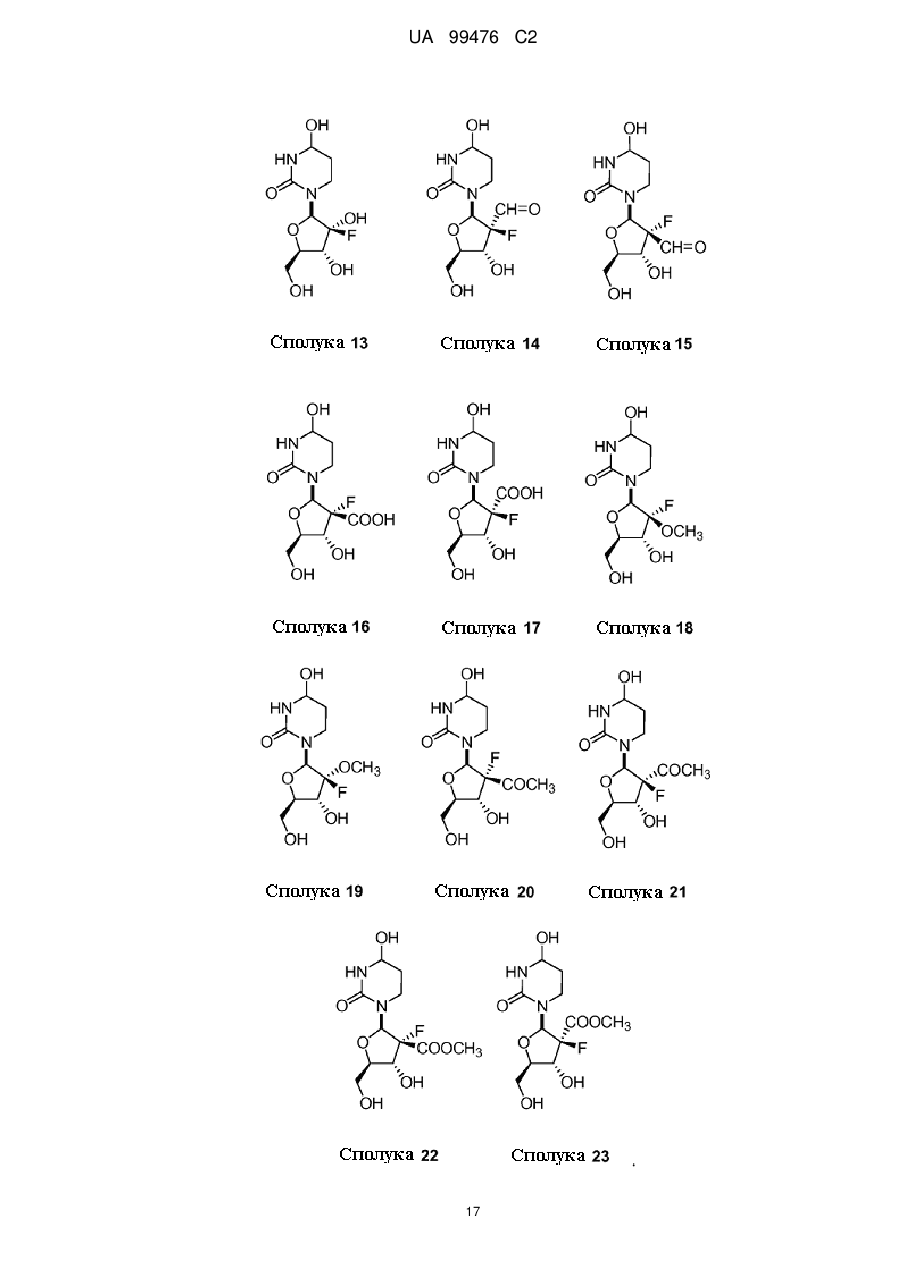
2′-фтор-2′-деокситетрагідроуридини як інгібітори цитидиндеамінази
Номер патенту: 99476
Опубліковано: 27.08.2012
Автори: Лапідус Ріна, Гамільтон Грегорі С., Дювалл Бріджет, Цукамото Такаші, Ферраріс Дейна В.
Формула / Реферат
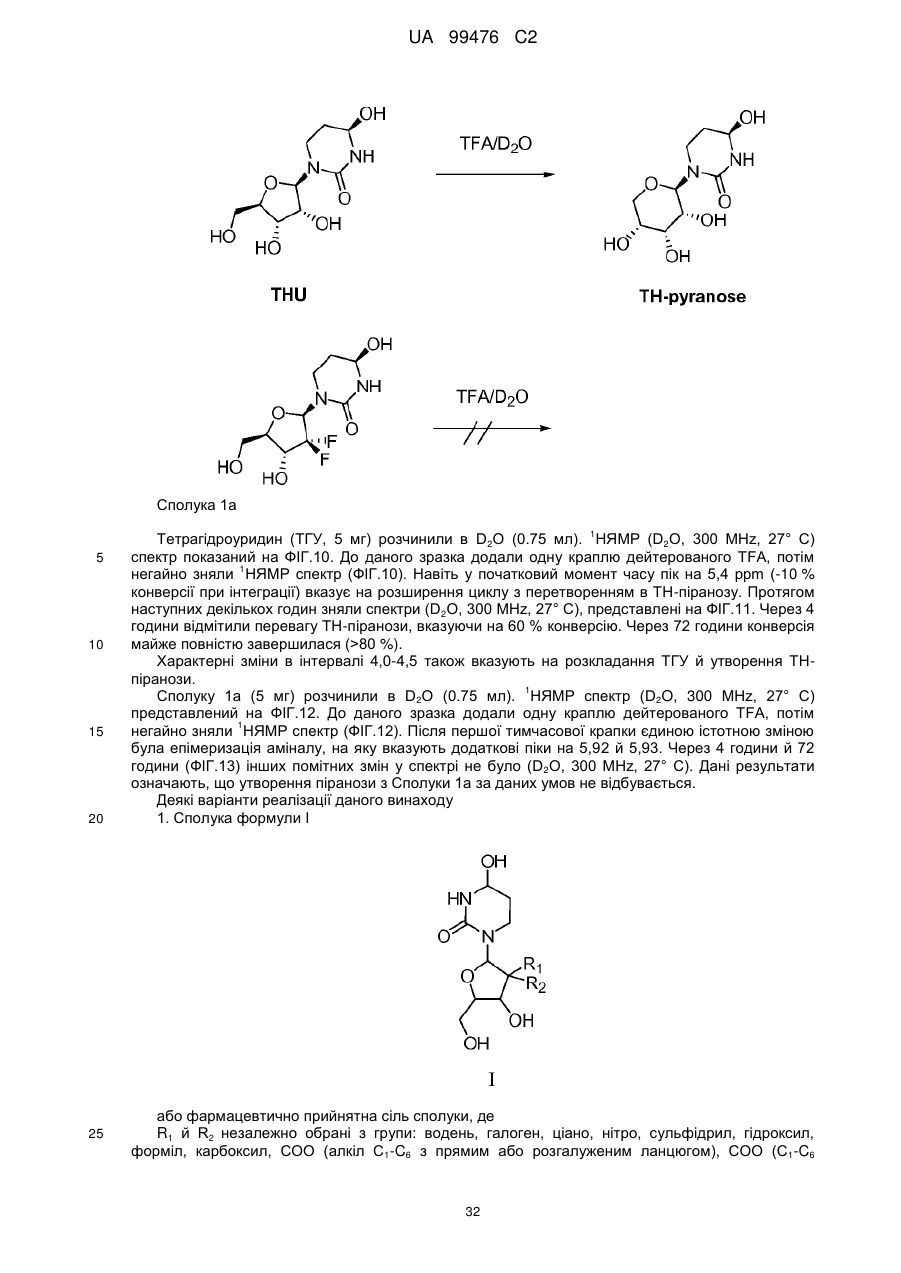
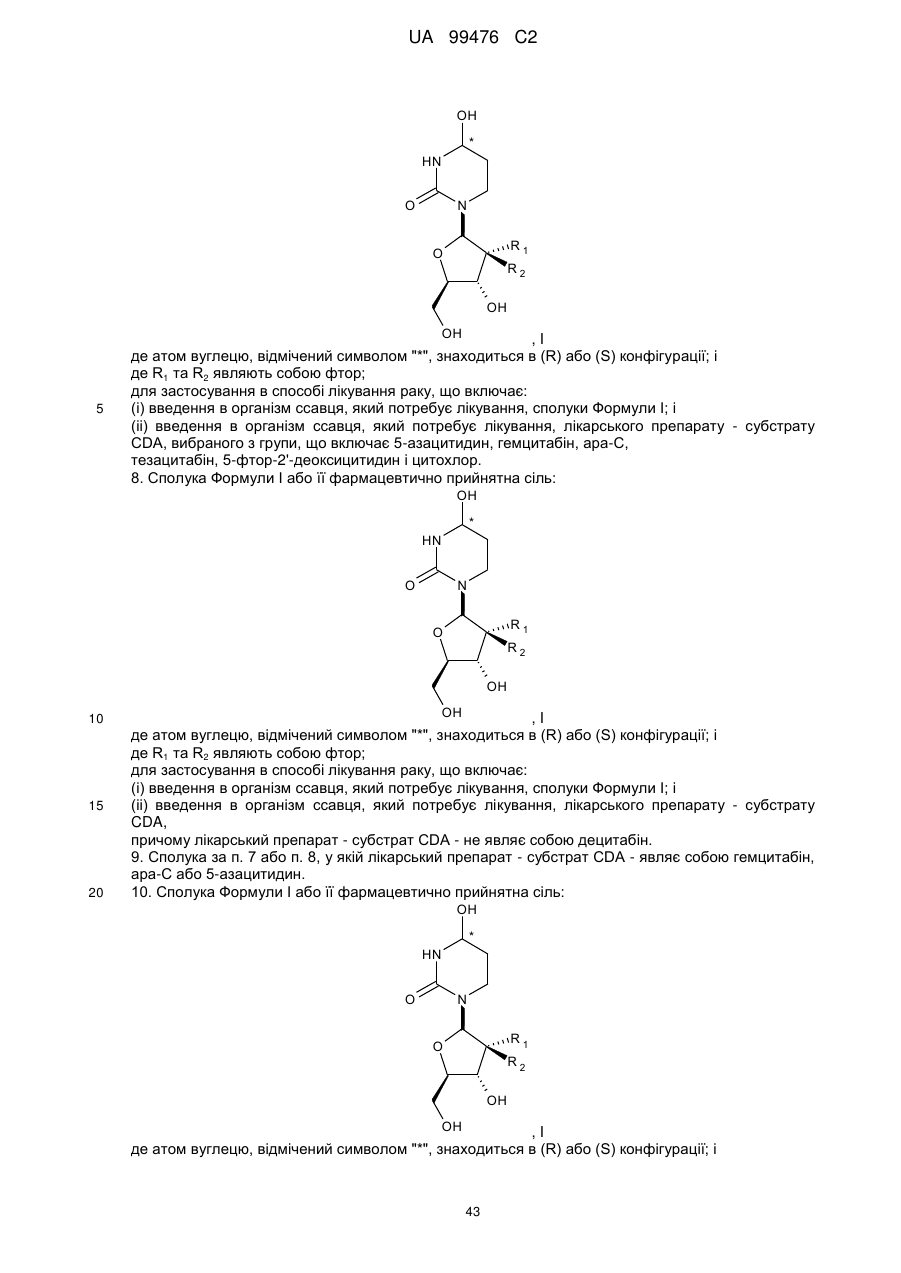
1. Сполука Формули І або її фармацевтично прийнятна сіль:
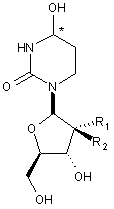 , I
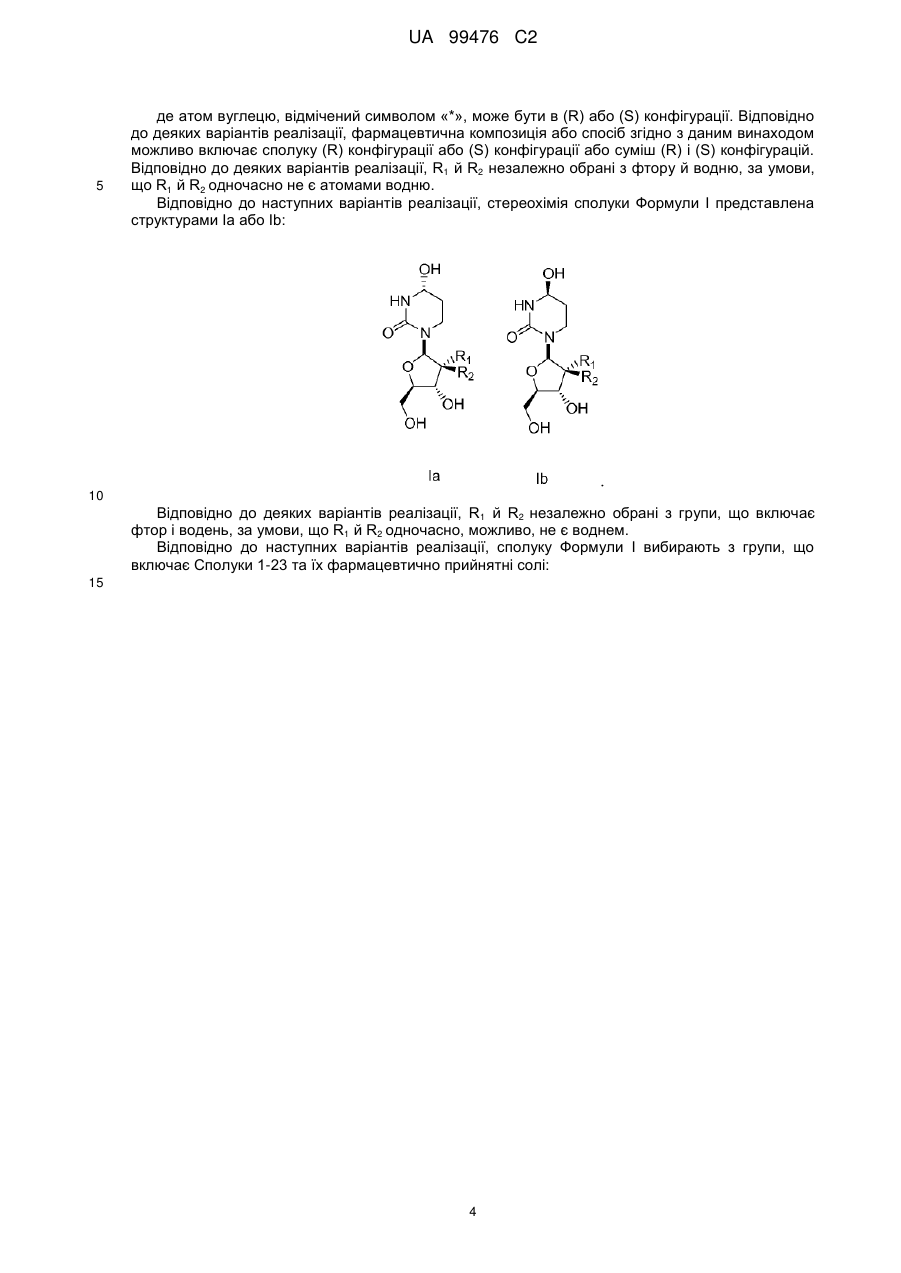
, I
де атом вуглецю, відмічений символом "*", знаходиться в (R) або (S) конфігурації; і де R1 та R2 являють собою фтор.
2. Композиція, що містить
(і) сполуку за п. 1 або її фармацевтично прийнятну сіль, та
(іі) лікарський препарат субстрат CDA, вибраний з групи, що включає 5-азацитидин, гемцитабін, ара-С, тезацитабін, 5-фтор-2'-деоксицитидин і цитохлор.
3. Композиція, що містить
(і) сполуку за п. 1 або її фармацевтично прийнятну сіль, та
(іі) лікарський препарат - субстрат CDA;
причому лікарський препарат - субстрат CDА - не являє собою децитабін.
4. Композиція за п. 2 або п. 3, у якій лікарський препарат - субстрат CDA - являє собою гемцитабін, ара-С або 5-азацитидин.
5. Композиція, що містить
(і) сполуку за п. 1 або її фармацевтично прийнятну сіль, та
(іі) лікарський препарат - субстрат CDA;
причому лікарський препарат - субстрат CDА - являє собою децитабін.
6. Фармацевтична композиція, яка містить сполуку за п. 1 або композицію за будь-яким з пп. 2-4 та фармацевтично прийнятний наповнювач.
7. Сполука Формули І або її фармацевтично прийнятна сіль:
 , I
, I
де атом вуглецю, відмічений символом "*", знаходиться в (R) або (S) конфігурації; і
де R1 та R2 являють собою фтор;
для застосування в способі лікування раку, що включає:
(і) введення в організм ссавця, який потребує лікування, сполуки Формули І; і
(іі) введення в організм ссавця, який потребує лікування, лікарського препарату - субстрату CDA, вибраного з групи, що включає 5-азацитидин, гемцитабін, ара-С,
тезацитабін, 5-фтор-2'-деоксицитидин і цитохлор.
8. Сполука Формули І або її фармацевтично прийнятна сіль:
 , I
, I
де атом вуглецю, відмічений символом "*", знаходиться в (R) або (S) конфігурації; і
де R1 та R2 являють собою фтор;
для застосування в способі лікування раку, що включає:
(і) введення в організм ссавця, який потребує лікування, сполуки Формули І; і
(іі) введення в організм ссавця, який потребує лікування, лікарського препарату - субстрату CDA,
причому лікарський препарат - субстрат CDА - не являє собою децитабін.
9. Сполука за п. 7 або п. 8, у якій лікарський препарат - субстрат CDA - являє собою гемцитабін, ара-С або 5-азацитидин.
10. Сполука Формули І або її фармацевтично прийнятна сіль:
 , I
, I
де атом вуглецю, відмічений символом "*", знаходиться в (R) або (S) конфігурації; і
де R1 та R2 являють собою фтор;
для застосування в способі лікування раку, що включає:
(і) введення в організм ссавця, який потребує лікування, сполуки Формули І; і
(іі) введення в організм ссавця, який потребує лікування, лікарського препарату - субстрату CDA,
причому лікарський препарат - субстрат CDА - являє собою децитабін.
11. Застосування сполуки Формули І або її фармацевтично прийнятної солі:
 , I
, I
де атом вуглецю, відмічений символом "*", знаходиться в (R) або (S) конфігурації; і
де R1 та R2 являють собою фтор;
для виготовлення лікарського засобу для лікування раку.
12. Сполука або застосування за будь-яким з пп. 7-9 або 11, де рак вибраний з групи, що включає гематологічні форми раку, такі як мієлодиспластичний синдром, лейкоз, гострий мієлоїдний лейкоз та хронічний мієлоїдний лейкоз, та солідні форми раку, такі як рак підшлункової залози, рак яєчників, перитонеальний рак, недрібноклітинний рак легень, метастатичний рак молочної залози, рак сечового міхура, плоскоклітинний рак, перехідно-клітинний рак, аденокарциному, гінекологічний рак, карциному фалопієвої труби, рак печінки, печінково-клітинний рак, рак легень, рак шийки матки, рак урогенітальних шляхів і рак дванадцятипалої кишки.
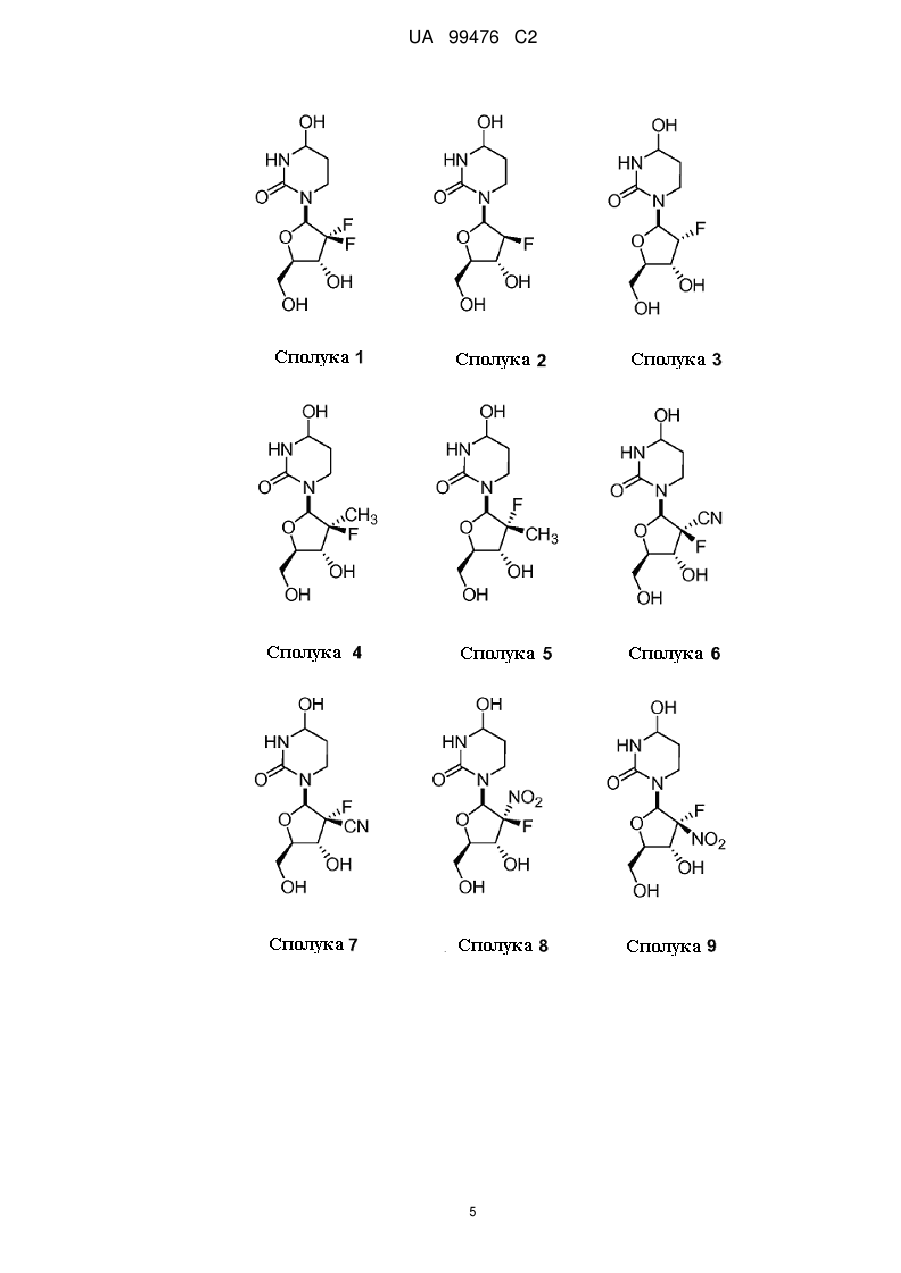
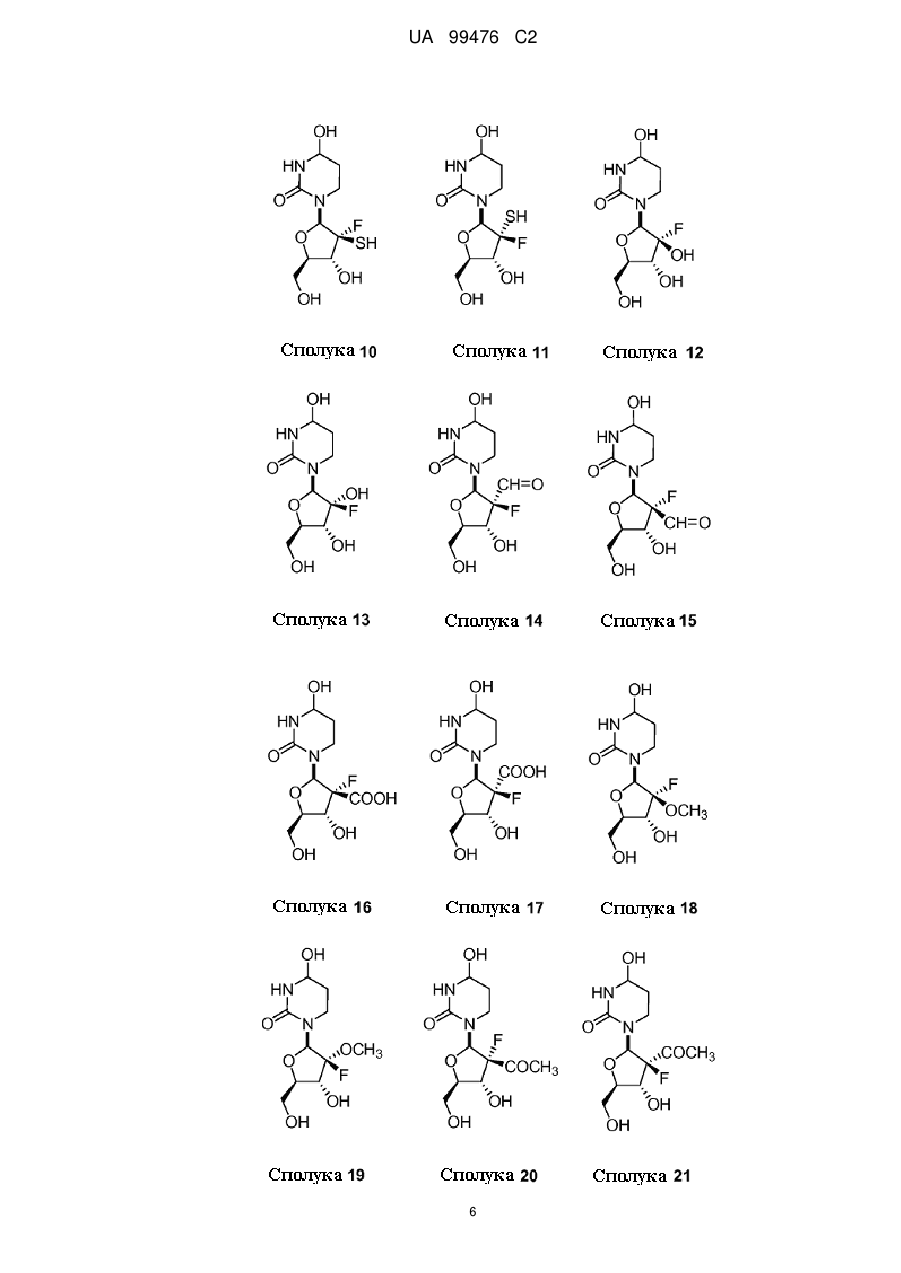
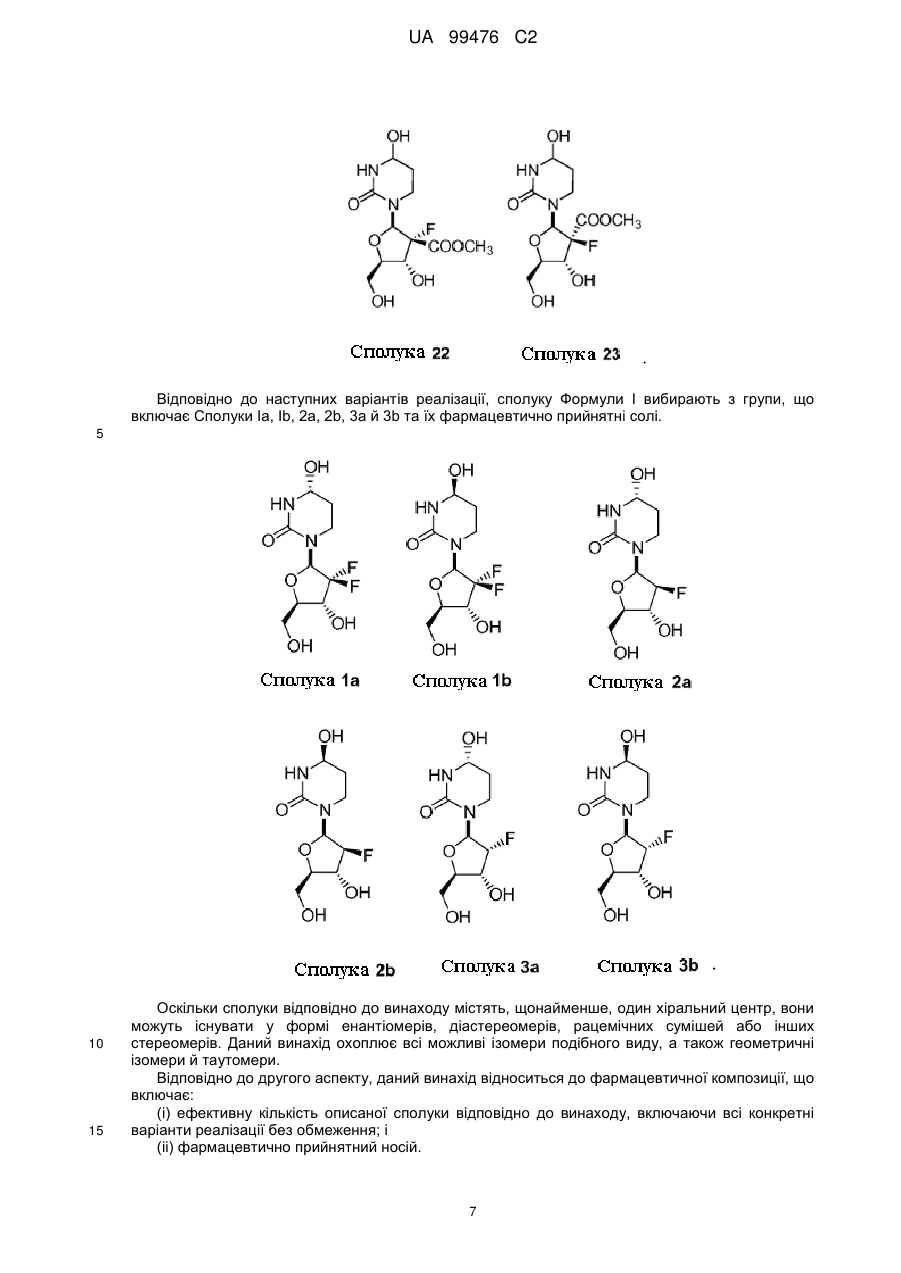
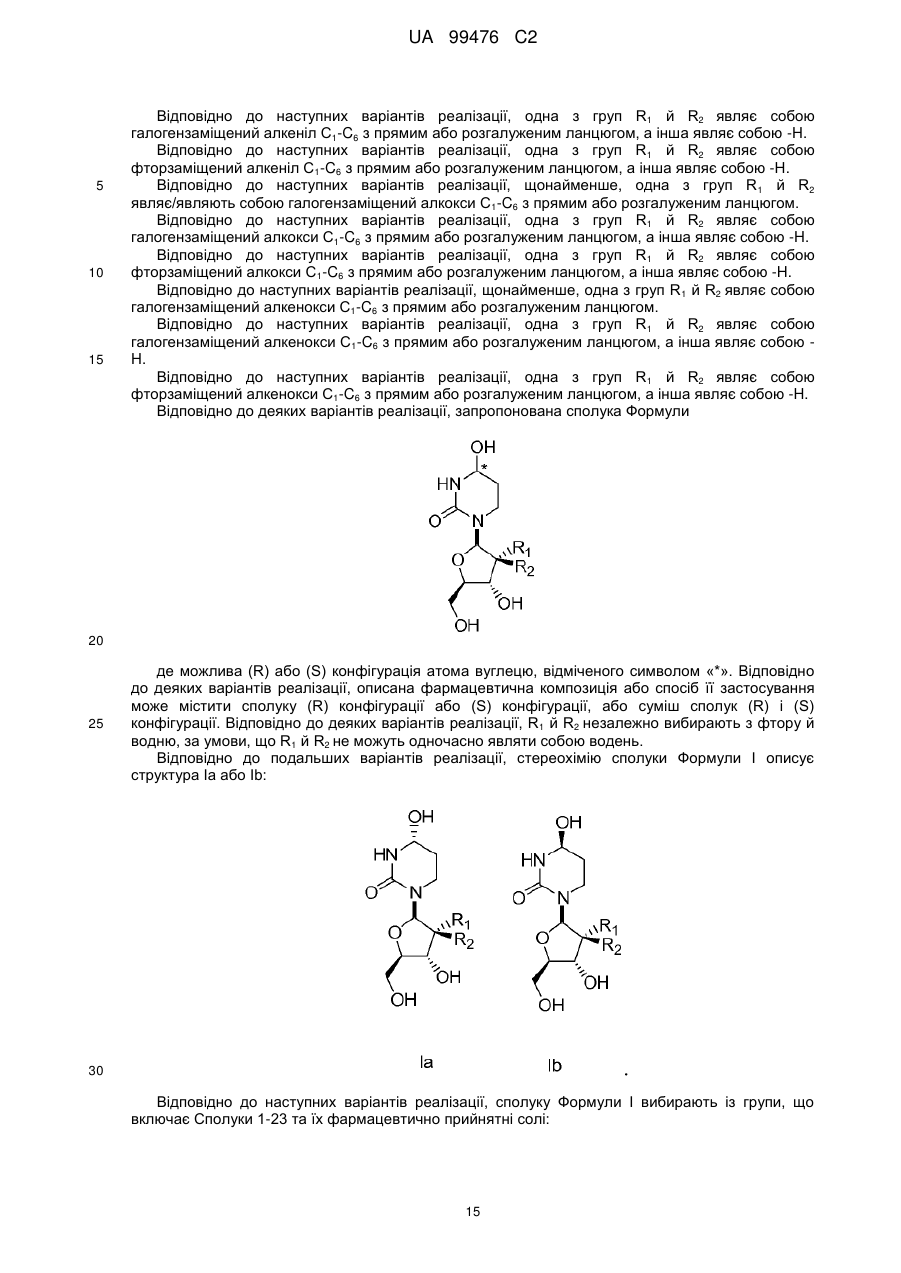
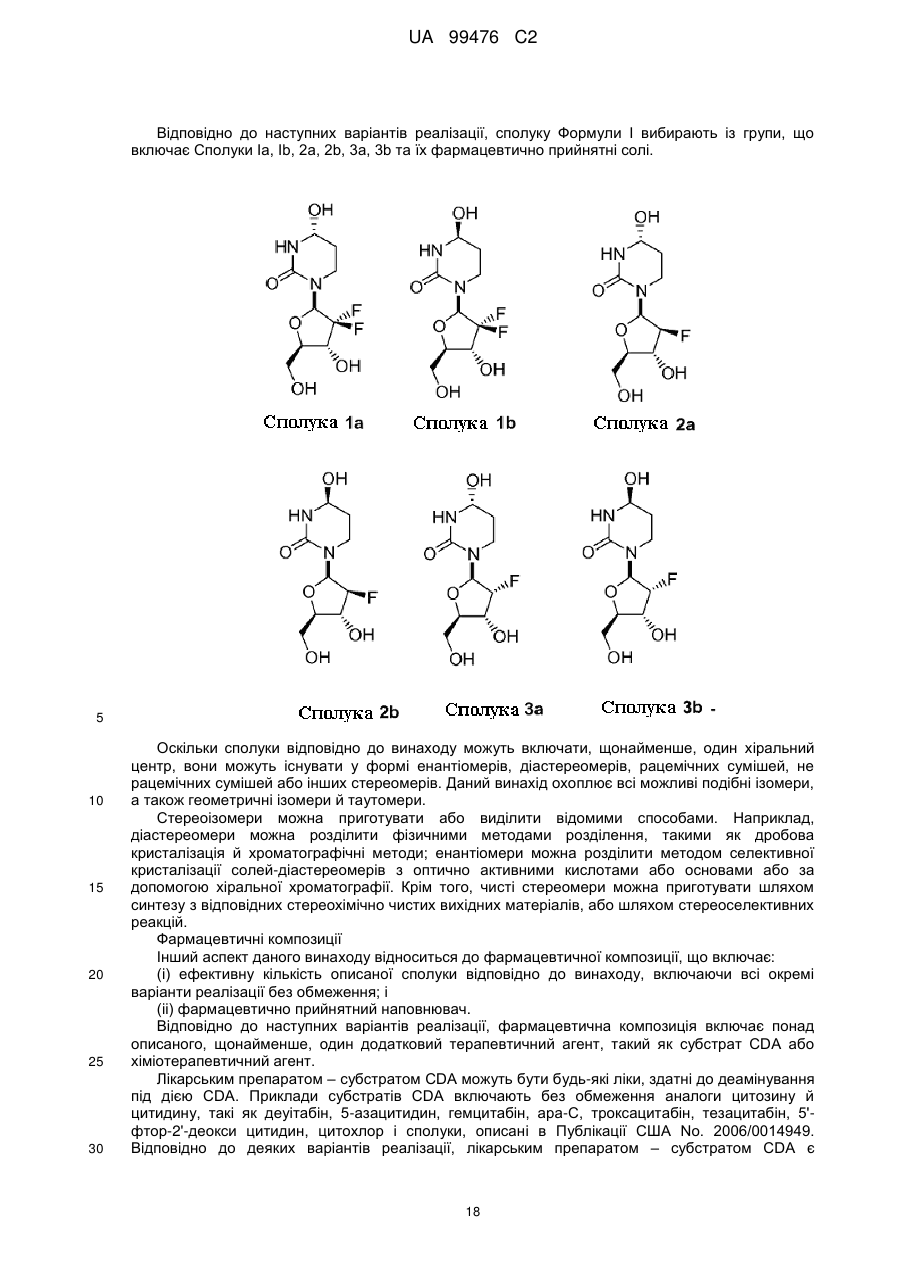
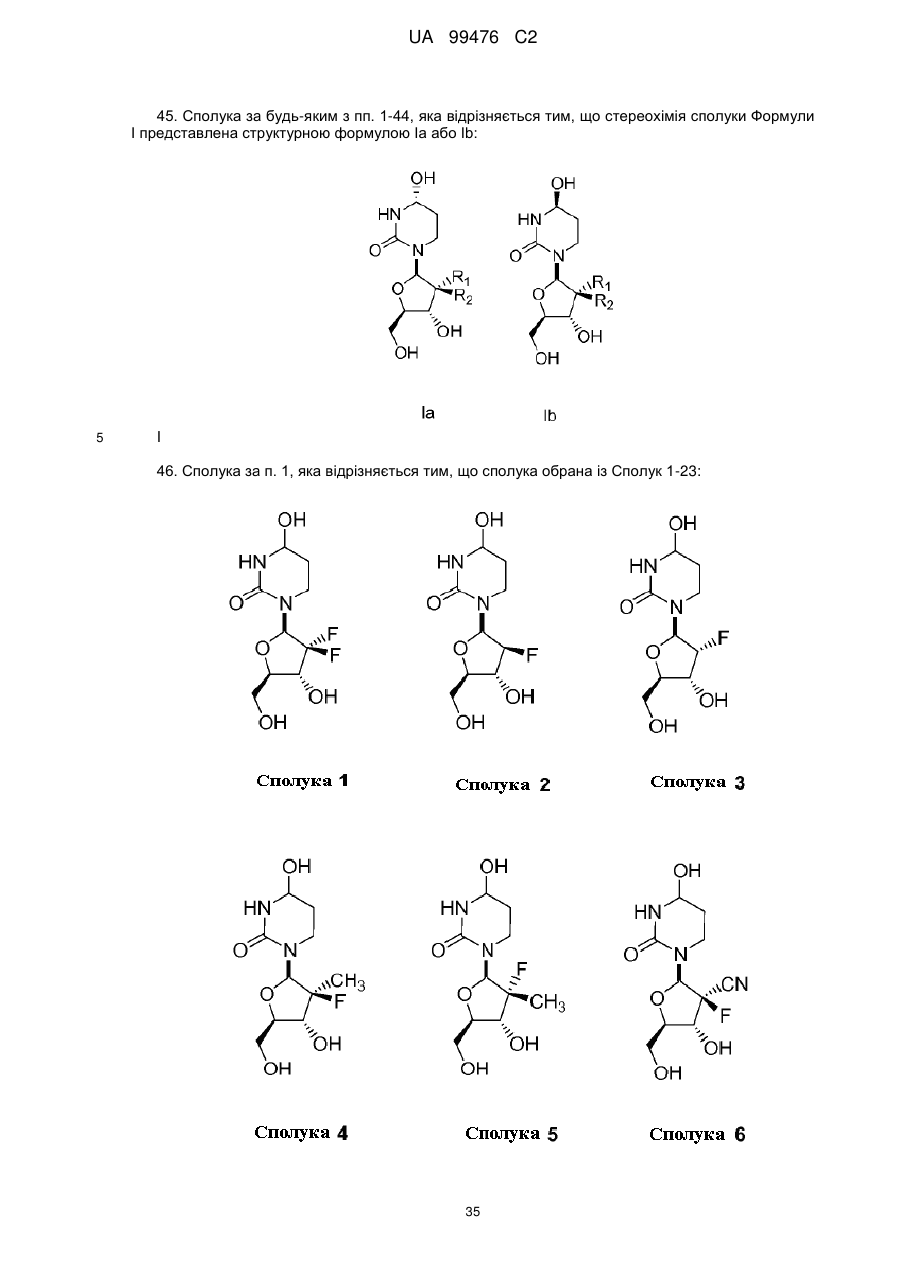
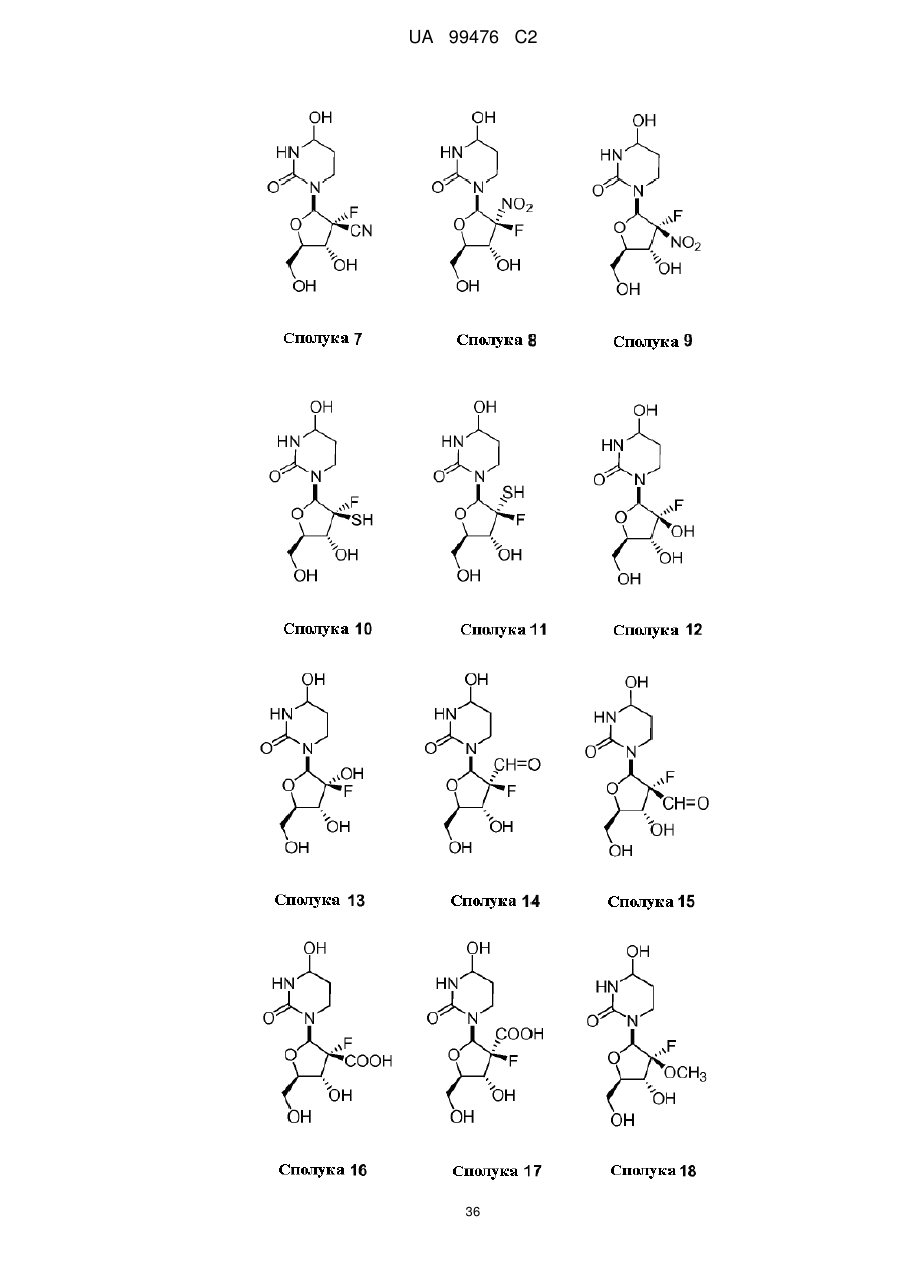
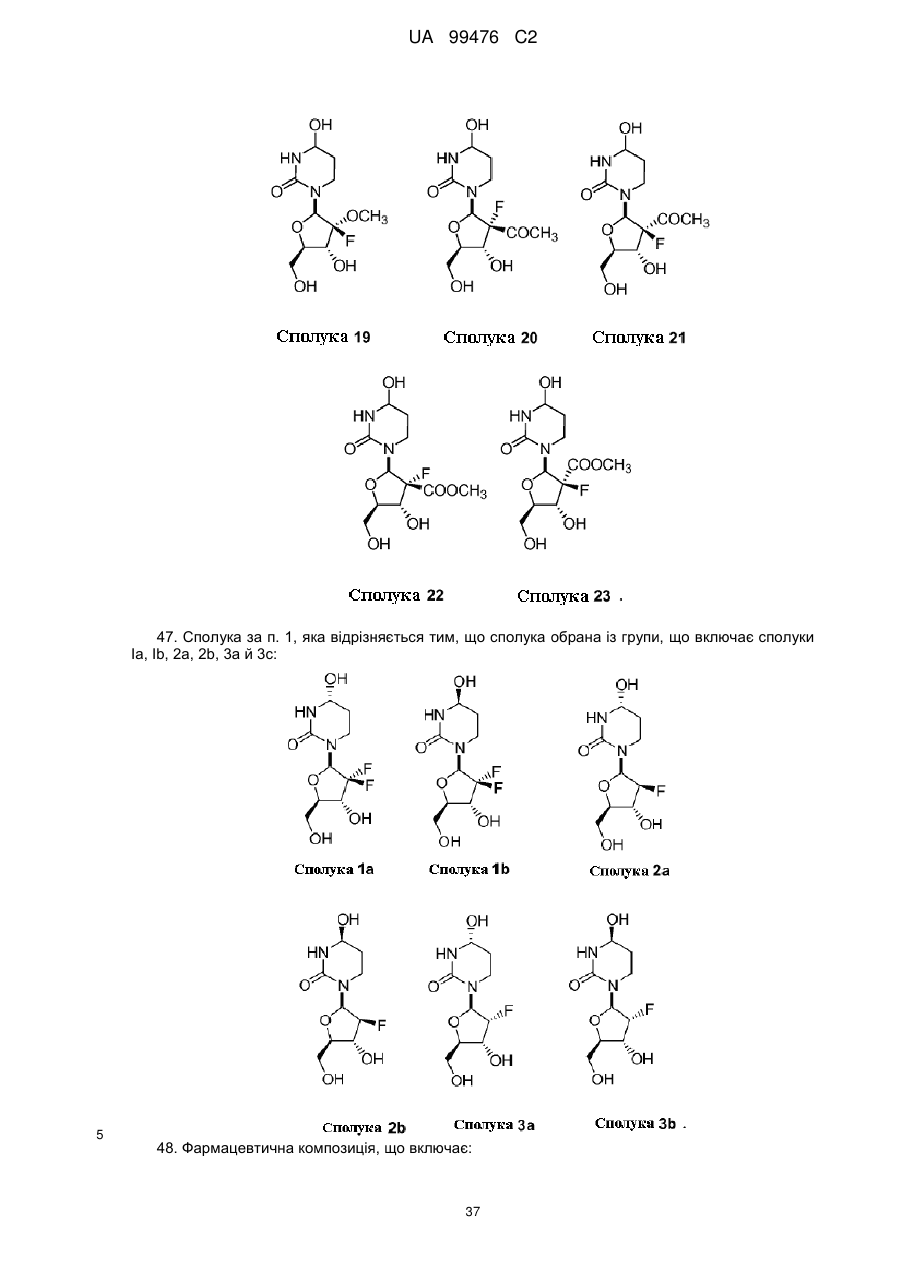
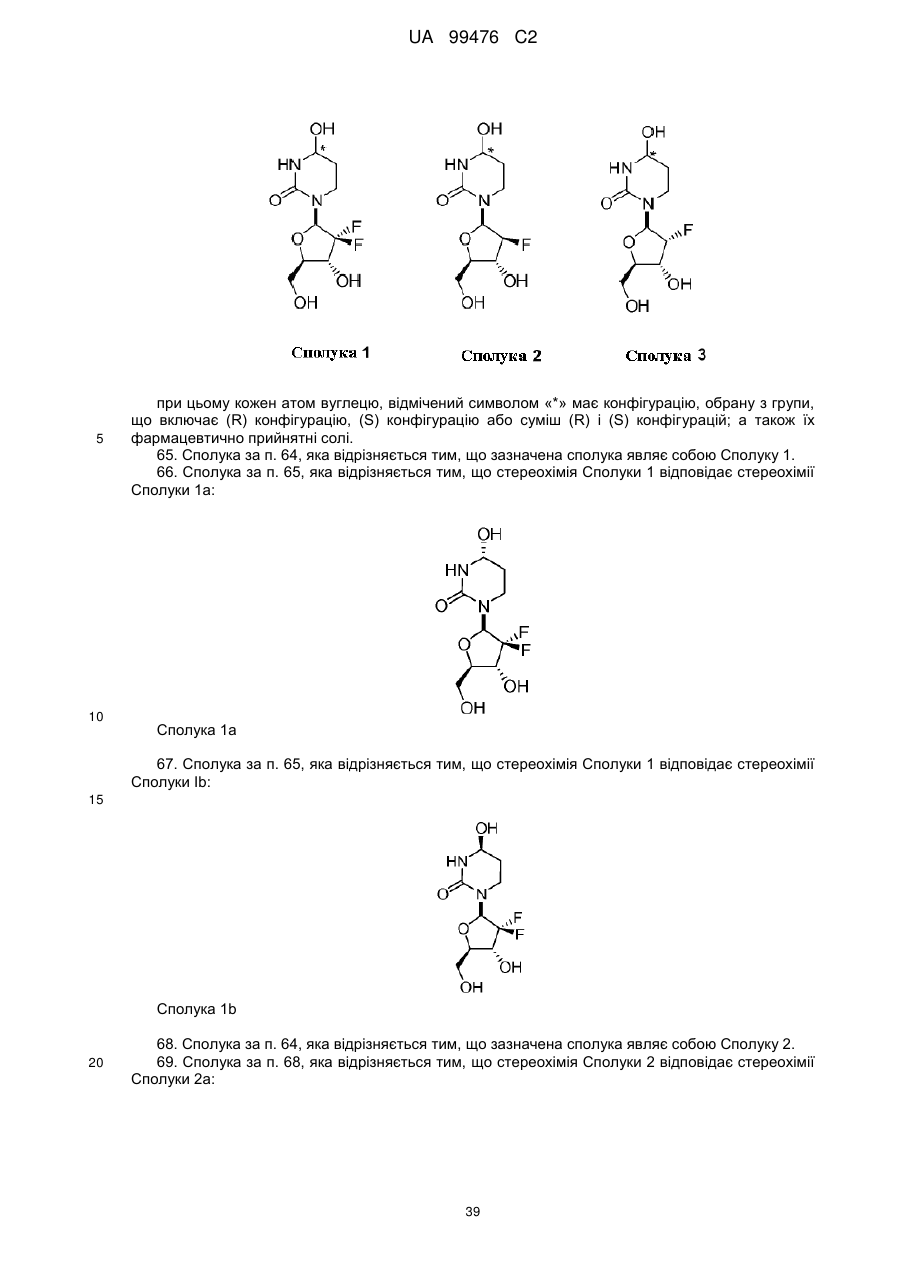
13. Сполука, композиція або застосування за будь-яким з пп. 1-4, 6-9 або 11-12, де сполука Формули І представлена сполукою 1а або її фармацевтично прийнятною сіллю:
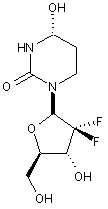
Сполука 1а.
14. Сполука, композиція або застосування за будь-яким з пп. 1-4, 6-9 або 11-13, де сполука представлена сполукою 1а:

Сполука 1a.
15. Фармацевтична композиція, яка містить композицію за п. 5 та фармацевтично прийнятний наповнювач.
16. Сполука за п. 10, де рак вибраний з групи, що включає гематологічні форми раку, такі як мієлодиспластичний синдром, лейкоз, гострий мієлоїдний лейкоз та хронічний мієлоїдний лейкоз, та солідні форми раку, такі як рак підшлункової залози, рак яєчників, перитонеальний рак, недрібноклітинний рак легень, метастатичний рак молочної залози, рак сечового міхура, плоскоклітинний рак, перехідно-клітинний рак, аденокарциному, гінекологічний рак, карциному фалопієвої труби, рак печінки, печінково-клітинний рак, рак легень, рак шийки матки, рак урогенітальних шляхів і рак дванадцятипалої кишки.
17. Сполука або композиція за будь-яким з пп. 5, 10, 15 або 16, де сполука Формули І представлена сполукою 1а або її фармацевтично прийнятною сіллю:

Сполука 1a.
18. Сполука або композиція за будь-яким з пп. 5, 10 або 15-17, де сполука представлена
сполукою 1а:

Сполука 1а.
Текст
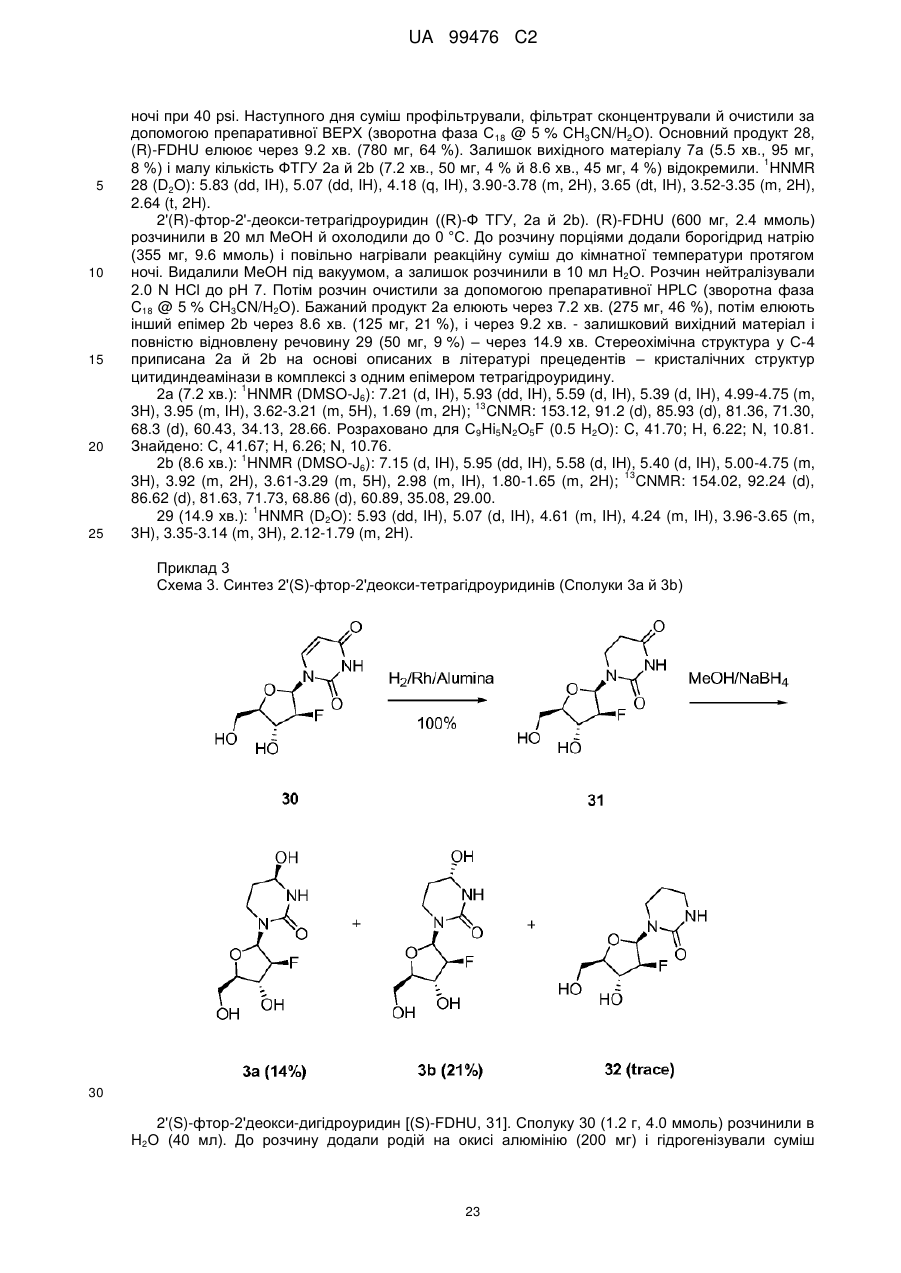
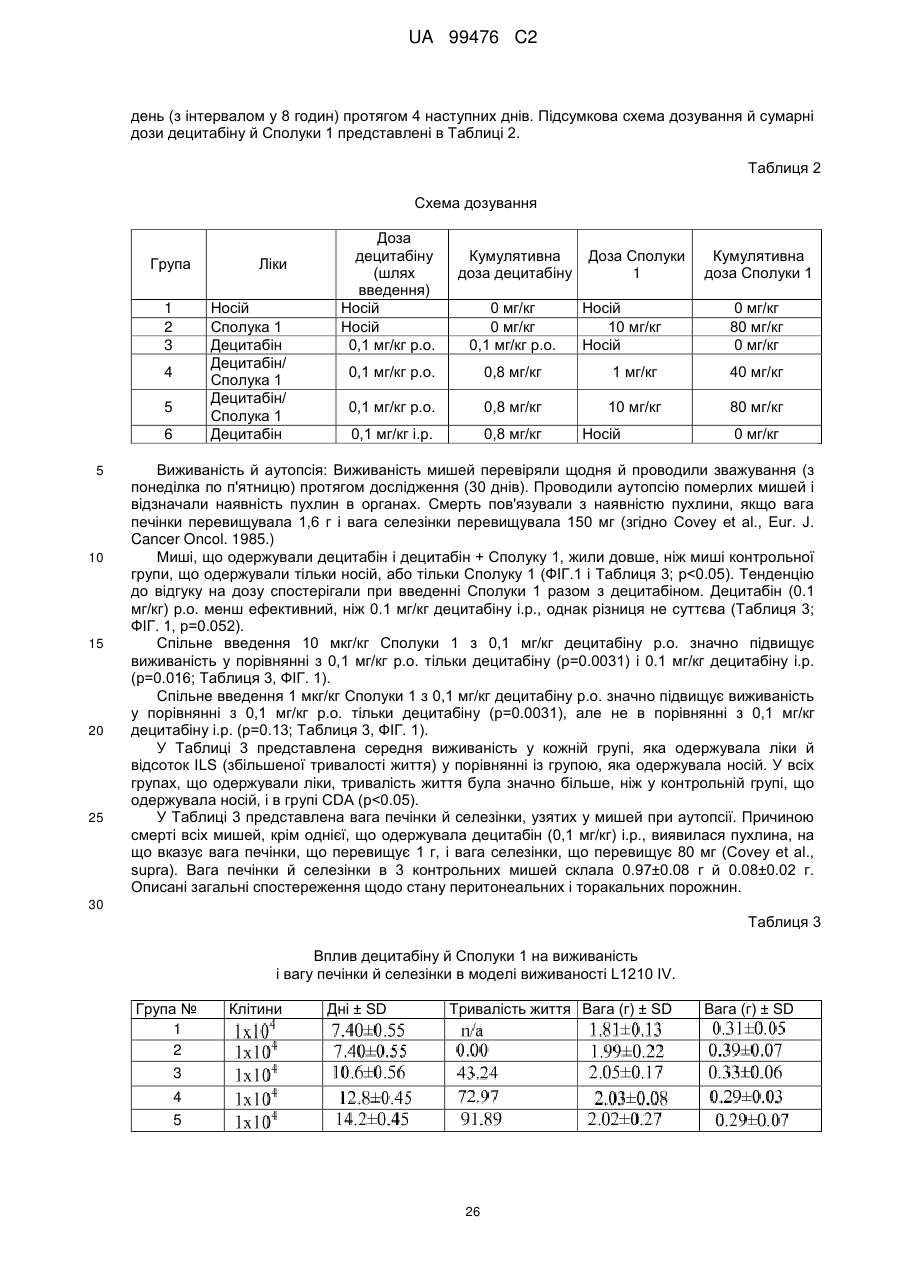
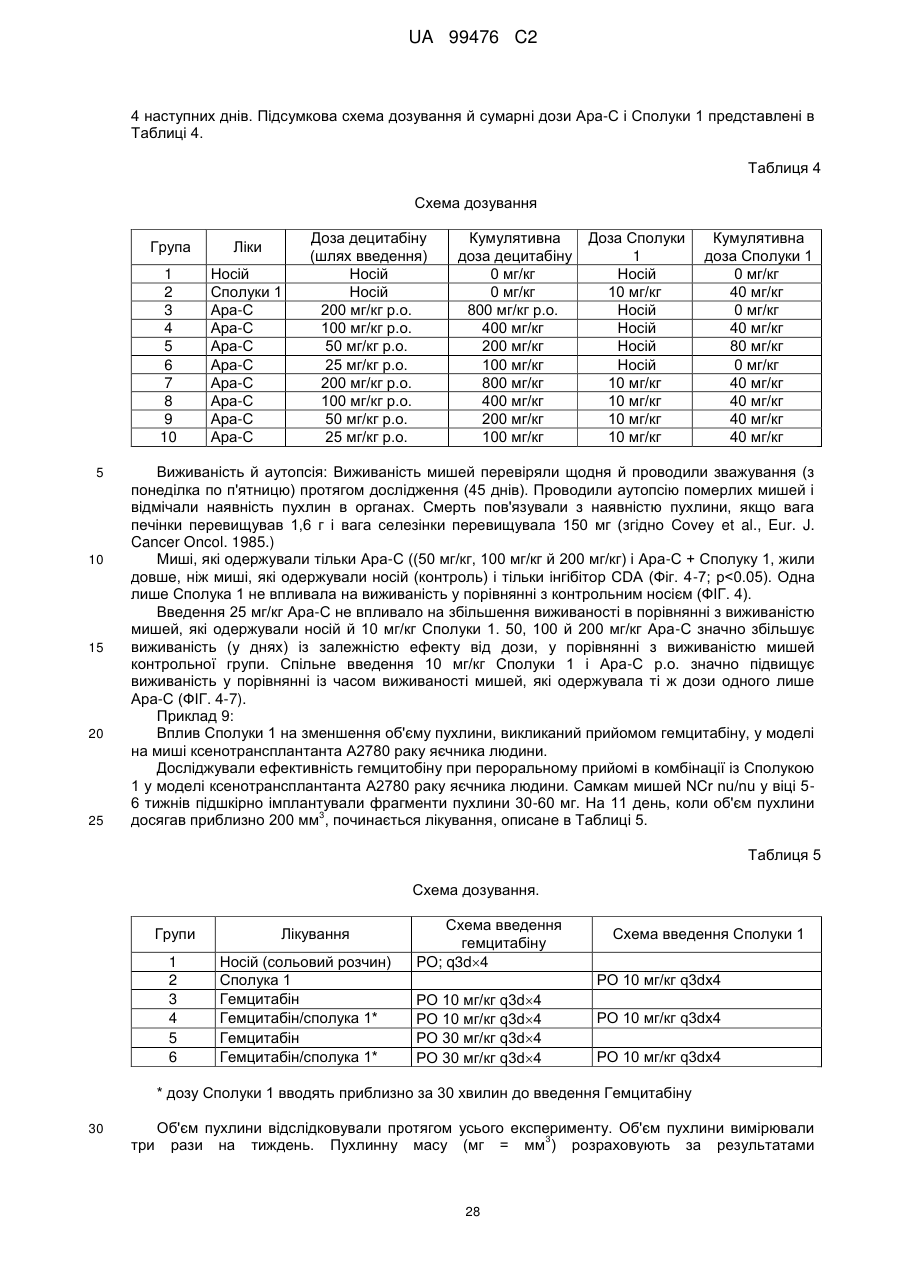
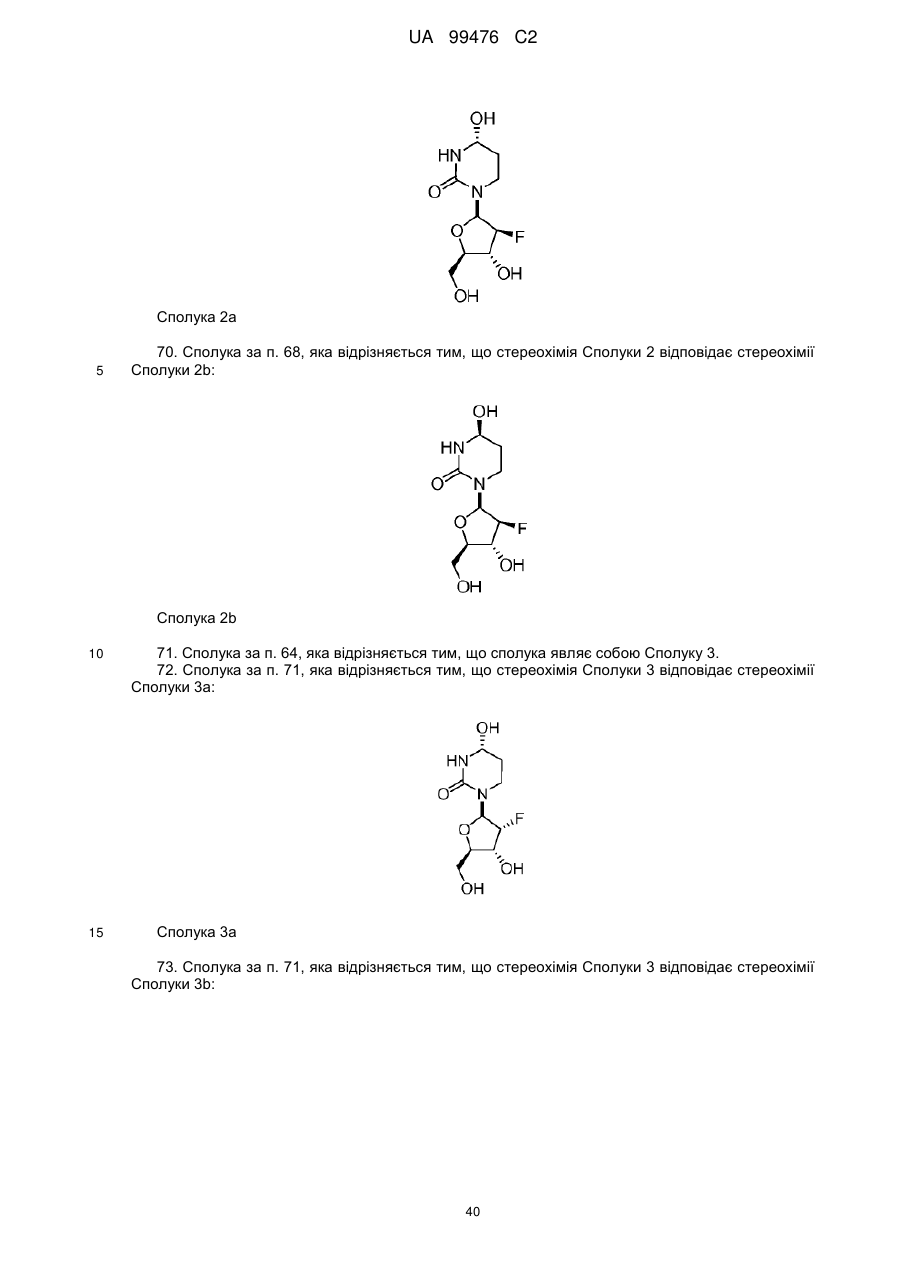
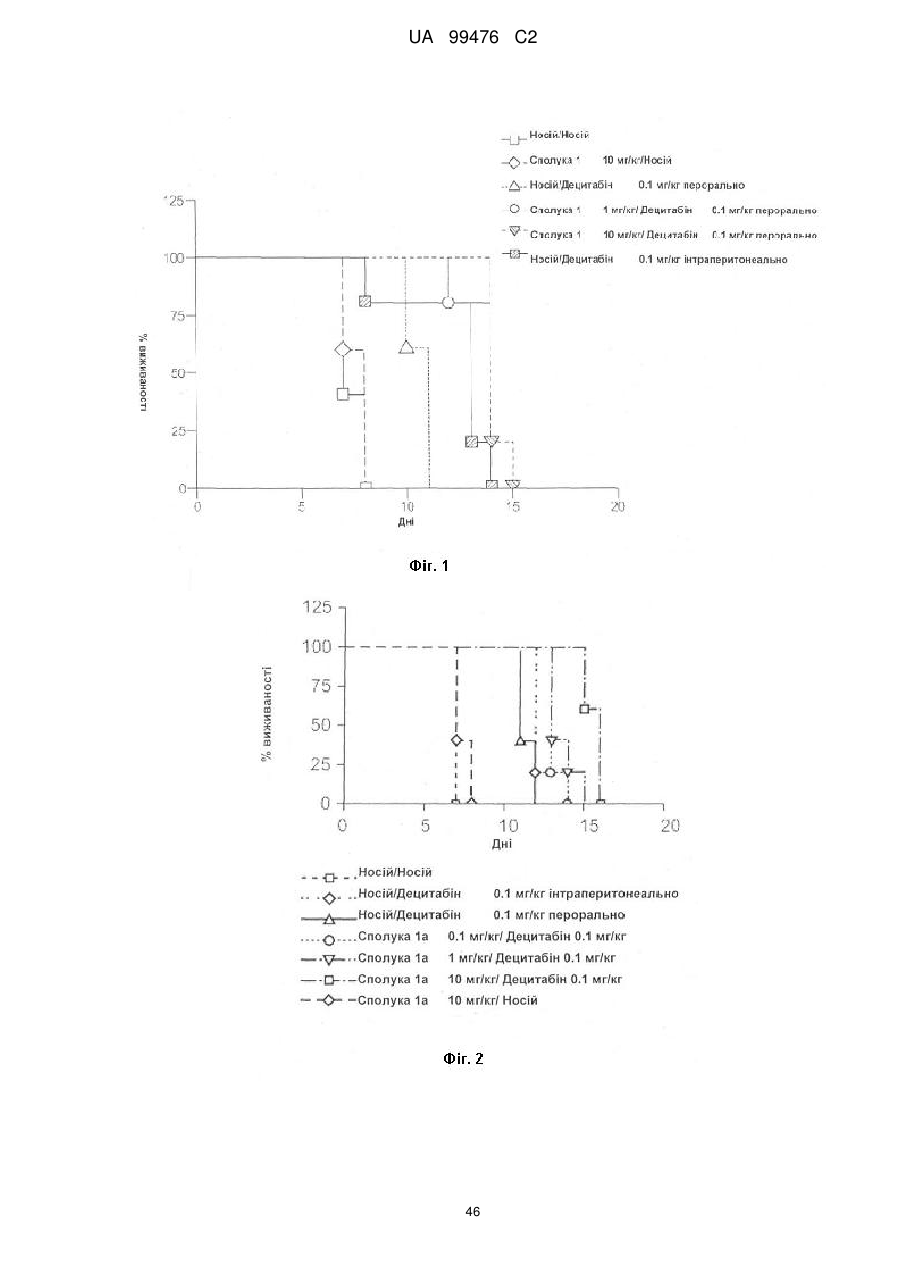
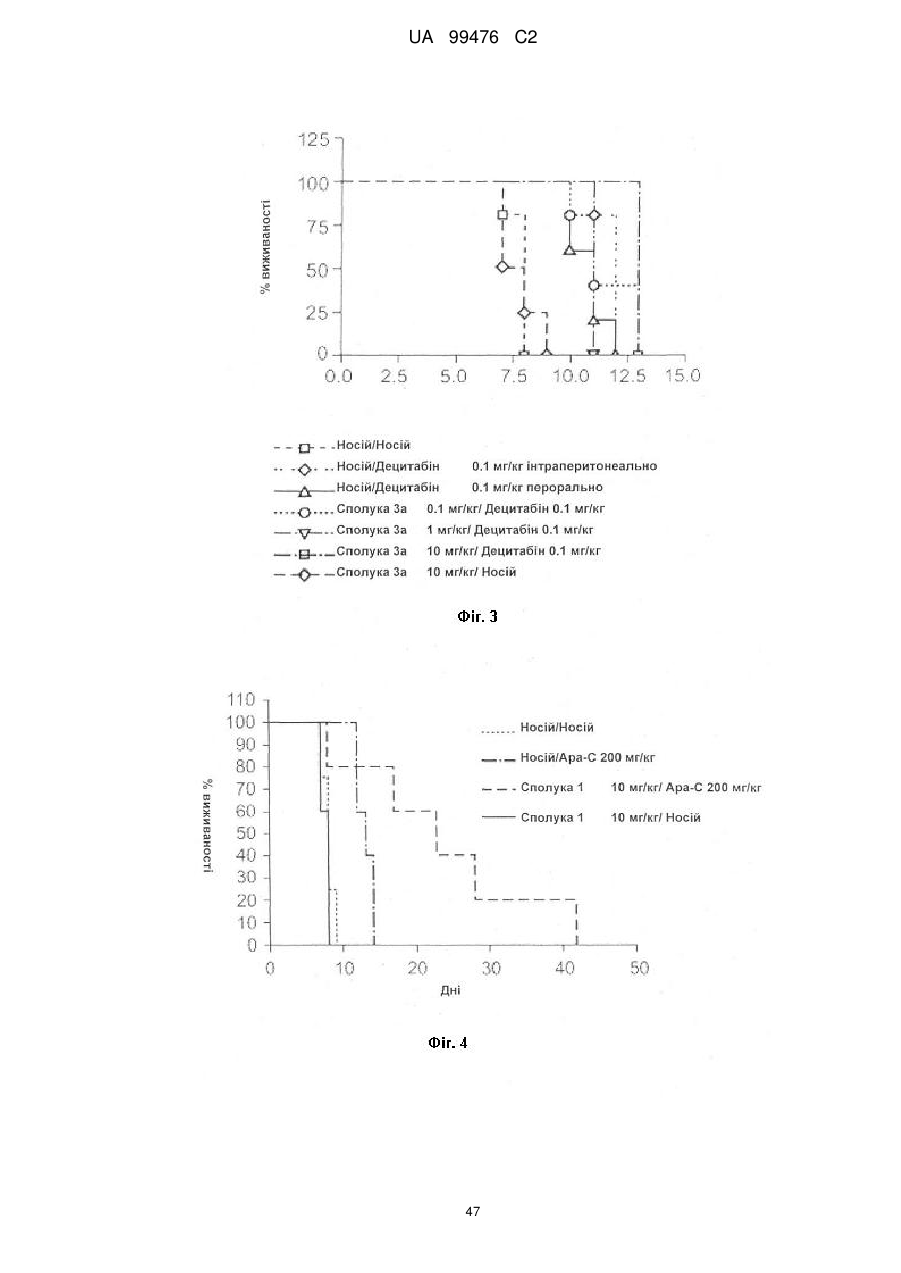
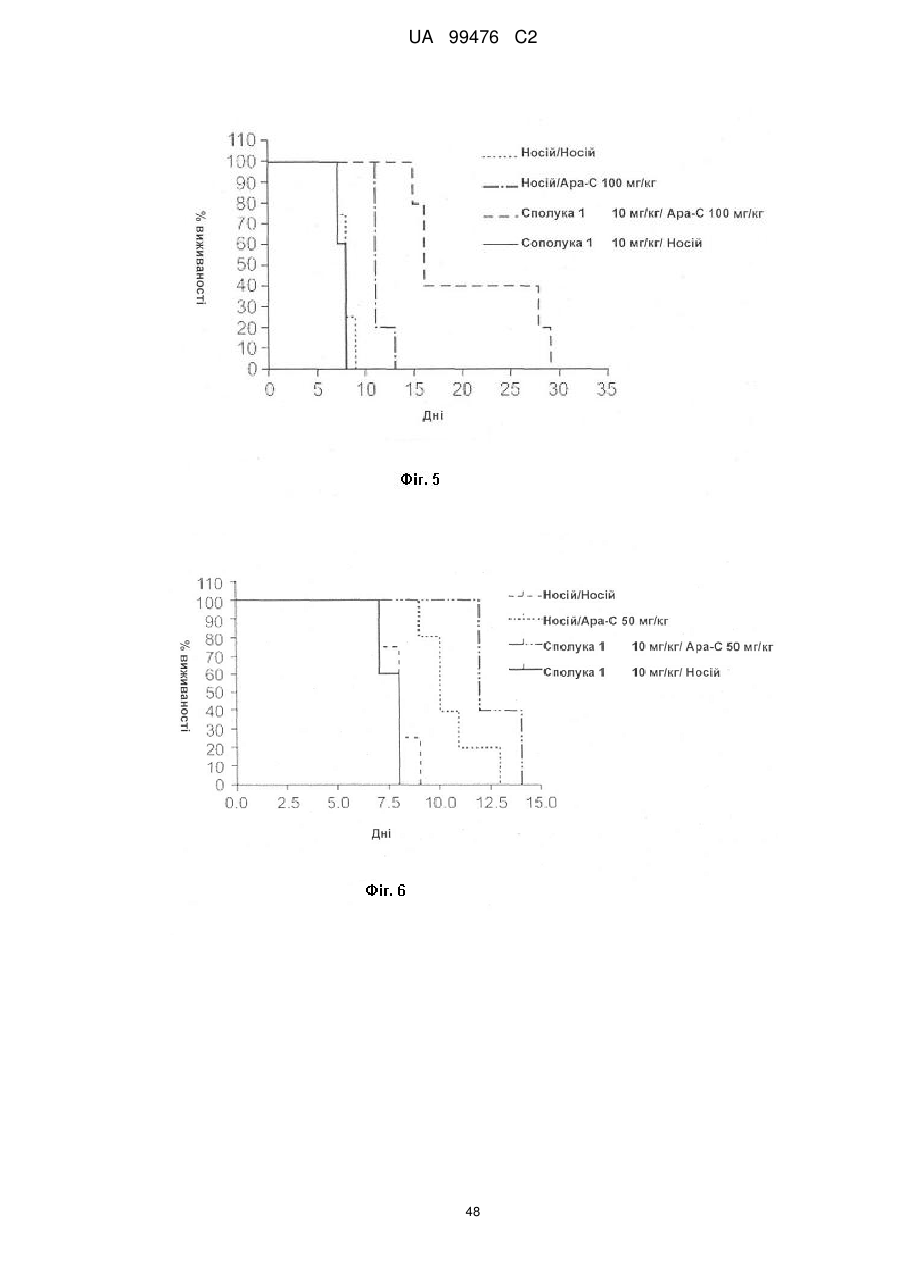
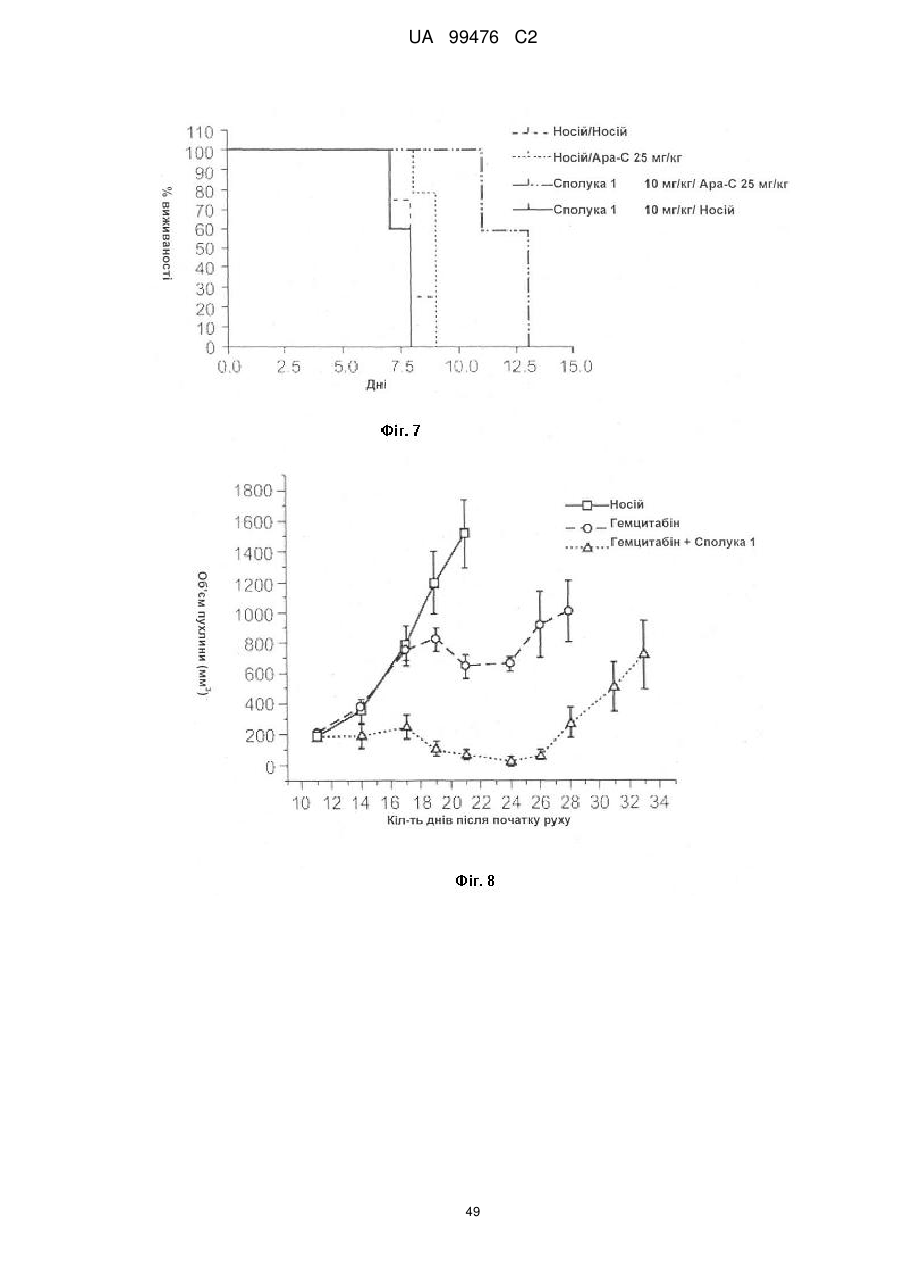
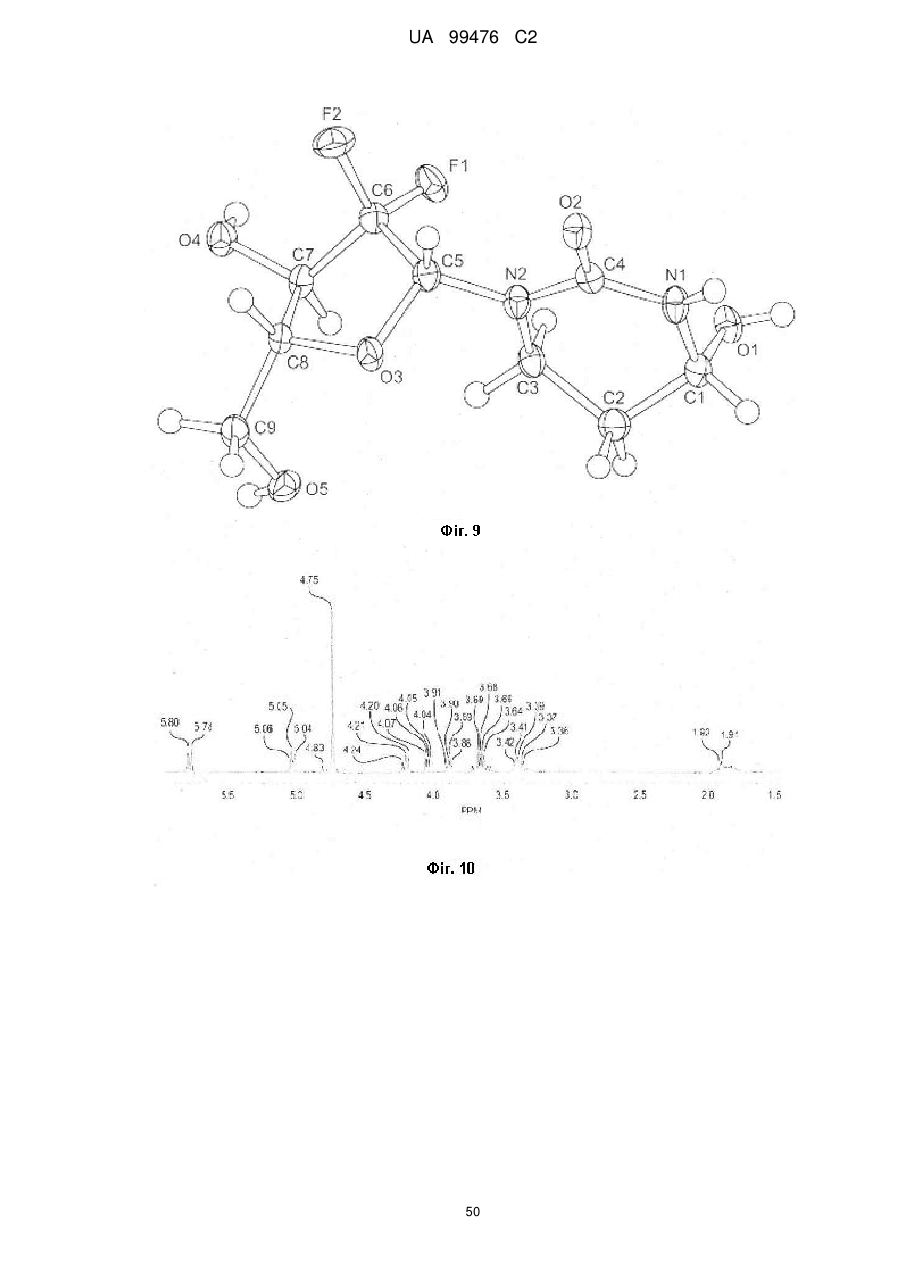
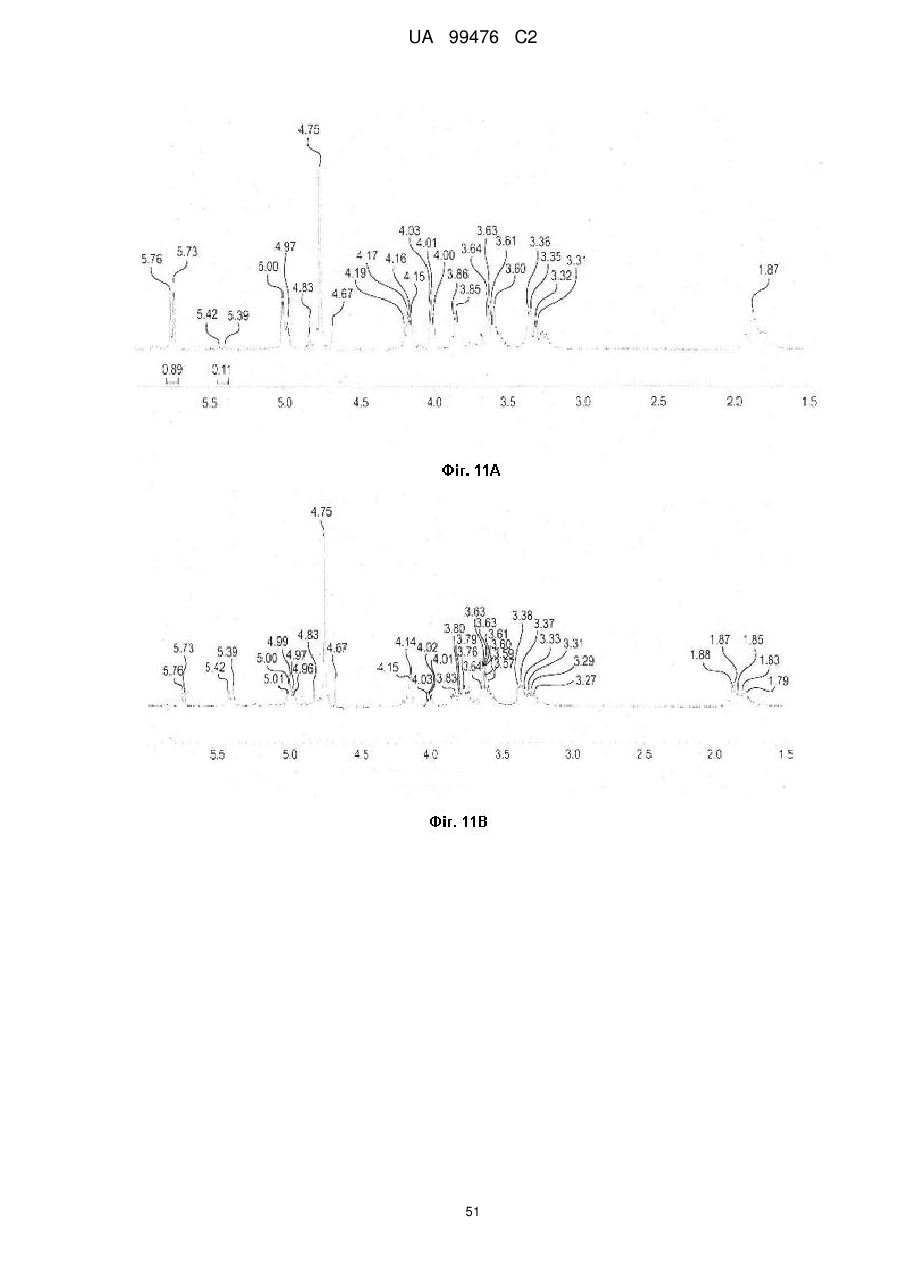
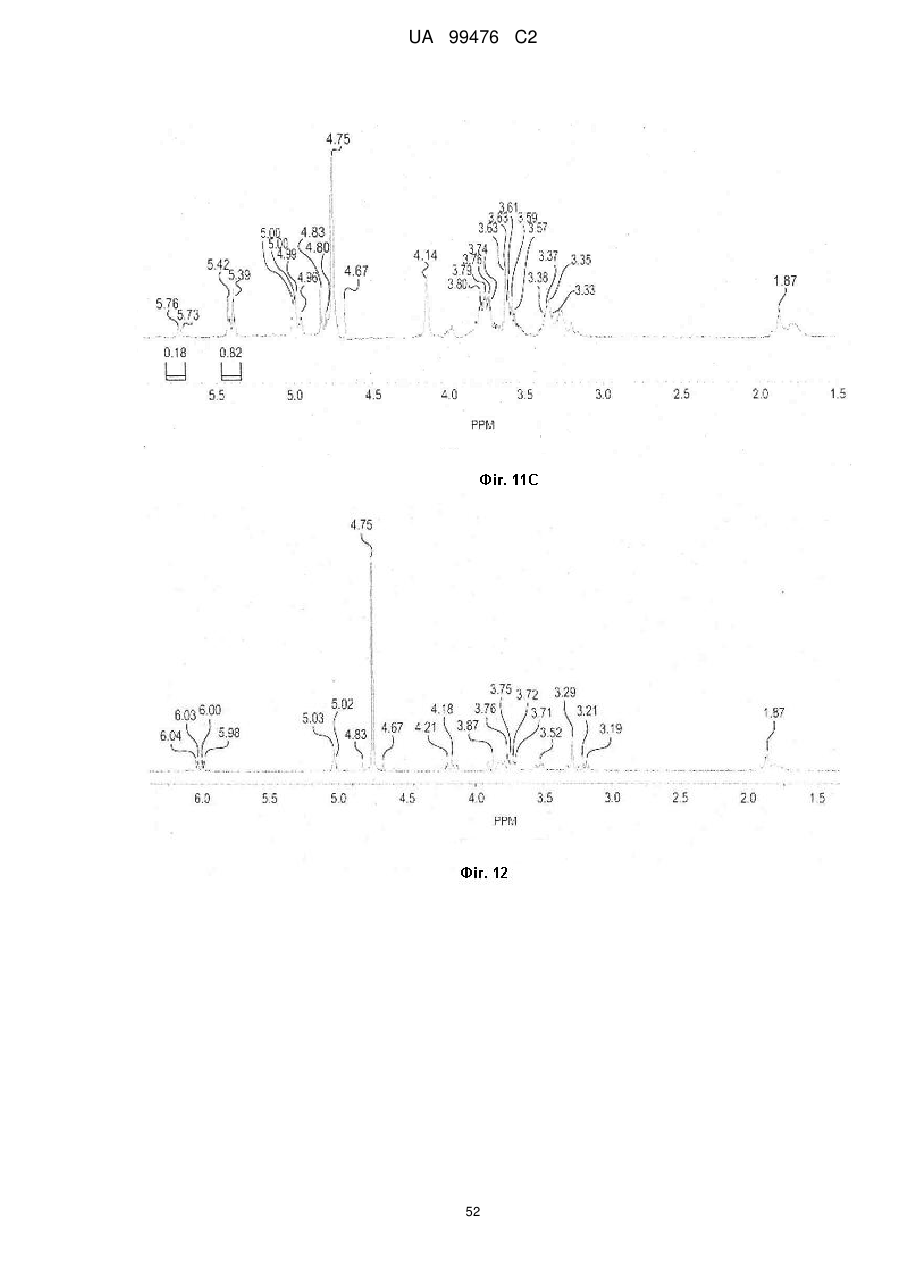
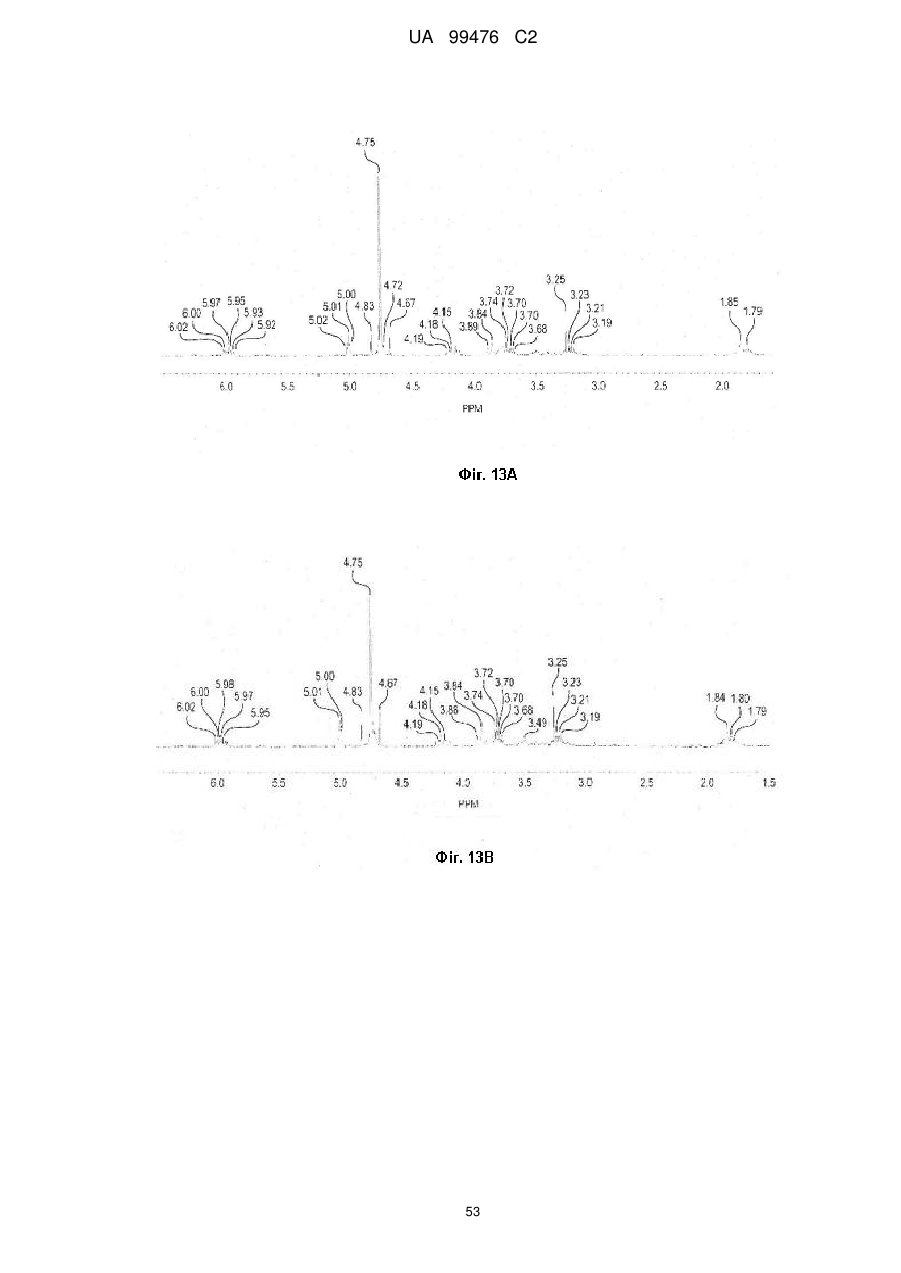
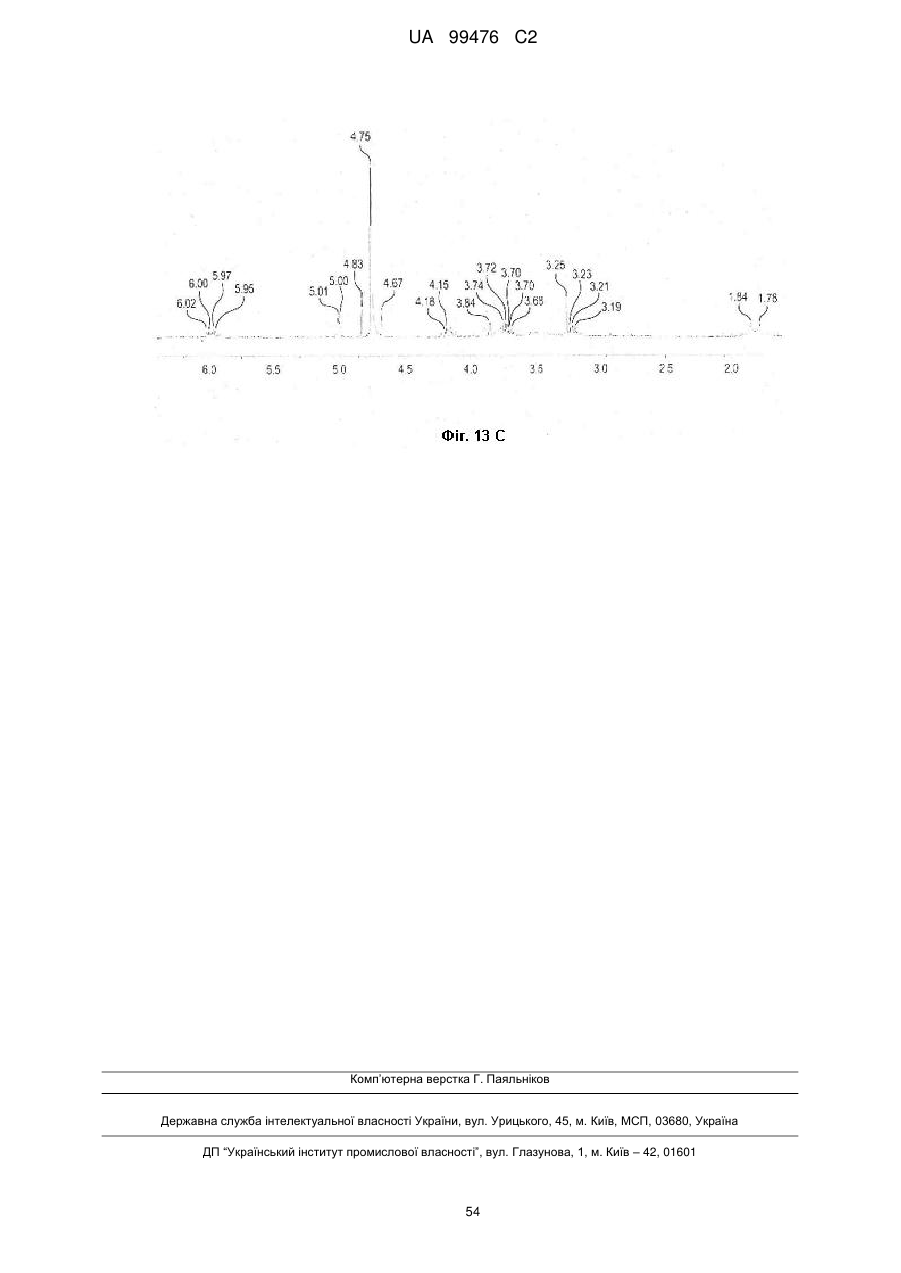
Реферат: Винахід належить до сполук, які є похідними тетрагідроуридину, і фармацевтичних композицій, що включають зазначені сполуки, а також до застосування зазначених сполук. UA 99476 C2 (12) UA 99476 C2 UA 99476 C2 5 10 15 20 25 30 35 40 Дана заявка претендує на пріоритет тимчасової Патентної заявки США No. 60/980,397, поданої 16 жовтня 2007, зміст якої включено в дану заявку у всій повноті за допомогою посилання. Даний винахід відноситься до сполук – визначених похідною тетрагідроуридину, які є інгібіторами цитидиндеамінази, фармацевтичних композицій і наборів, що включають зазначені сполуки, а також способів одержання й застосування зазначених сполук. Дія ферментів аденозин деамінази (ADA, EC 3.5.4.4) і цитидиндеамінази (CDA, EC 3.5.4.5) спрямована на деамінування природних амінопуринових й амінопіридинових нуклеозидів, відповідно, в організмі людини й в інших організмах. Крім того, вони можуть конвертувати активні ліки на основі нуклеозидів у неактивні метаболіти. Наприклад, при деамінуванні ліків арабінозиладенін (флударабін, ара-А), що містять пуриновий нуклеозид, під дією ферменту ADA утворюється сполука, у якій вихідна аміногрупа заміщена гідроксилом; дана сполука не є активним противопухлинним агентом у порівнянні з вихідною сполукою. Аналогічно, ліки арабінозилцитозин (цитарабін, ара-С), що застосовуються для лікування лейкозу при метаболічній деградації під дією CDA перетворюється в неактивний арабінозилурацил. CDA є компонентом, що бере участь в реутилізації піримідину. Вона конвертує цитидин і деоксицитидин в уридин і деоксиуридин, відповідно, шляхом гідролітичного деамінування (Arch. Biochem. Biophys. 1991, 290, 285-292; Methods Enzymol. 1978, 51, 401-407; Biochem. J. 1967, 104, 7P). Крім того, CDA деамінує ряд синтетичних аналогів цитозину, які є клінічно корисними ліками, такими як вищевказані ліки з (Cancer Chemother. Pharmacol. 1998, 42, 373-378; Cancer Res. 1989, 49, 3015-3019; Antiviral Chem. Chemother. 1990, 1, 255-262). Конверсія сполук цитозину в похідні уридину зазвичай призводить до втрати терапевтичної активності або появи додаткових побічних ефектів. Крім того, показано, що в ракових клітинах, що проявляють резистентність до ліків - аналогів цитозину, найчастіше спостерігається надекспресія CDA (Leuk. Res. 1990, 14, 751-754). Лейкемічні клітини з високим рівнем експресії CDA можуть проявляти резистентність до антиметаболітів цитозину і таким чином обмежувати антинеопластичну активність подібної терапії (Biochem. Pharmacol. 1993, 45, 1857-1861). Таким чином, інгібітори CDA можуть виявитися корисними ад'ювантами при комбінованій хіміотерапії. Протягом вже декількох років відомо, що тетрагідроуридин (ТГУ) є інгібітором цитидиндеамінази. Тетрагідроуридин (ТГУ) У різних публікаціях висловлені припущення про те, що спільне із ТГУ введення підвищує ефективність й активність ліків на основі цитидину при пероральному введенні. Наприклад, показано, що ТГУ збільшує активність анти-лейкемічного агента 5-азацитидину у мишей L1210 з лейкозом (Cancer Chemotherapy Reports 1975, 59, 459-465). Комбінацію ТГУ й 5-азацитидину також досліджували на моделі серповидноклітинної анемії у бабуїнів (Am. J. Hematol. 1985, 18, 283-288), а також у пацієнтів-людей із серповидноклітинною анемією в комбінації з 5азацитодином, який вводять перорально (Blood 1985, 66, 527-532). 1 UA 99476 C2 5 10 15 20 25 30 35 40 5-азацитидин 5-аза-2’-деоксицитидин ара-С (децитабін) Показано також, що ТГУ збільшує ефективність ара-С при пероральному введенні у мишей L1210 з лейкозом (Cancer Research 1970, 30, 2166; Cancer Invest 1987, 5, (4), 293-9) та у мишей з пухлинами (Cancer Treat. Rep. 1977, 61, 1355-1364). Комбінацію ара-С, що вводять внутрівенно, з ТГУ, що вводять внутрівенно, досліджували в ході декількох клінічних випробувань на людях (Cancer Treat. Rep. 1977, 61, 1347-1353; Cancer Treat. Rep. 1979, 63, 1245-1249; Cancer Res. 1988, 48, 1337-1342). Зокрема, провели дослідження комбінацій серед пацієнтів з гострим мієлолейкозом (AML) і хронічним мієлолейкозом (CML) (Leukemia 1991, 5, 991-998; Cancer Chemother. Pharmacol. 1993, 31, 481-484). 5-аза-2'-деоксицитидин (децитабін) є антинеопластичним агентом, який застосовується для лікування мієлодиспластичного синдрому (MDS), з потенційною можливістю застосування для лікування AML й CML. Як і для інших ліків на основі цитидину, його пероральна біодоступность обмежена через деактивацию під дією CDA. Показано, що ТГУ підсилює ефективність децитабіну в моделі захворювання серповидних клітин у бабуїнів (Am. J. Hematol. 1985, 18, 283288). Крім того, показано, що інший інгібітор CDA, зебуларин, підсилює ефективність децитабіну в моделі лейкозу у мишей L1210 (Anticancer Drugs 2005, 16, 301-308). Інший антинеопластичний препарат, гемцитабін, також досліджували в сполученні з інгібіторами CDA (Biochem. Pharmacol. 1993, 45, 1857-1861). Показано, що спільне введення із ТГУ змінює фармакокінетику й біодоступність гемцитабіну у мишей (Abstr. 1556, 2007 AACR Annual Meeting, April 14-18, 2007, Los Angeles, CA; Clin. Cancer Res. 2008, 14, 3529-3535). 5-фтор-2'-деоксицитидин (фторцитидин, FdCyd) являє собою інший ще один протираковий препарат на основі цитидину, що є інгібітором ДНК метилтрансферази. Досліджували зміни його метаболізму й фармакокінетики під дією ТГУ в мишачій моделі (Clin Cancer Res., 2006, 12, 7483-7491; Cancer Chemother. Pharm. 2008, 62, 363-368). Результати вищевказаних досліджень підтверджують терапевтичну користь при введенні інгібіторів CDA разом з ліками на основі цитокіну, такими як ара-С, децитабін, 5-азацитидин й інші. Проте, інгібітори CDA на початковій стадії, такі як ТГУ, мають певні недоліки, включаючи нестабільність у кислому середовищі (J. Med. Chem. 1986, 29, 2351) і низьку біодоступність (J. Clin. Pharmacol. 1978, 18, 259). Внаслідок цього існує нагальна потреба в розробці нових, ефективних і терапевтично корисних інгібіторів CDA. Даний винахід відноситься до сполук – визначених похідною тетрагідроуридину, фармацевтичних композицій і наборів, що включають зазначені сполуки, а також способів одержання й застосування зазначених сполук. Зазначені сполуки, композиції, набори й способи відповідно до винаходу можуть мати певні переваги. Наприклад, сполуки й композиції відповідно до винаходу можуть інгібувати ферментну активність CDA та/або збільшити період напіврозпаду, біодоступність та/або ефективність ліків, які являють собою субстрати CDA. Крім того, сполуки, композиції, набори й способи відповідно до винаходу можуть мати покращені характеристики, такі як розчинність у воді, хімічна стабільність, рівні абсорбції лікарських засобів, рівні токсичності, строк придатності, відтворюваність при виробництві й виготовленні складів, а також терапевтична ефективність. В одному варіанті реалізації, згідно із даним винаходом запропонована сполука Формули I: 45 2 UA 99476 C2 5 10 15 20 25 30 35 або фармацевтично прийнятна сіль зазначеної сполуки, де R1 й R2 незалежно вибирають із групи, що включає водень, галоген, ціано, нітро, сульфогідрил, гідроксил, форміл, карбоксил, COO(C 1-C6 алкіл з прямим або розгалуженим ланцюгом), COO (C1-C6 алкеніл з прямим або розгалуженим ланцюгом), COO (C 1-C6 алкініл з прямим або розгалуженим ланцюгом), CO (C1-C6 алкіл з прямим або розгалуженим ланцюгом), CO (C1-C6 алкеніл з прямим або розгалуженим ланцюгом), CO (C1-C6 алкініл із прямим або розгалуженим ланцюгом), C1-C6 алкіл з прямим або розгалуженим ланцюгом, C1-C6 алкеніл з прямим або розгалуженим ланцюгом, C1-C6 алкініл із прямим або розгалуженим ланцюгом, C1C6 алкокси з прямим або розгалуженим ланцюгом й C1-C6 алкенокси з прямим або розгалуженим ланцюгом; при цьому в кожному окремому випадку C 1-C6 алкіл із прямим або розгалуженим ланцюгом, C1-C6 алкеніл з прямим або розгалуженим ланцюгом, C1-C6 алкініл з прямим або розгалуженим ланцюгом, C1-C6 алкокси з прямим або розгалуженим ланцюгом або C1-C6 алкенокси з прямим або розгалуженим ланцюгом можуть бути незалежно незаміщеними або містити від одного до чотирьох замісників, незалежно обраних із групи, що включає галоген, гідроксил, ціано, нітро, форміл, карбоксил й сульфогідрил; і, за умови, що одна із груп R 1 й R2 являє собою -H, інша не є -H, -OH або -CH2OH. Відповідно до деяких варіантів реалізації, R1 й R2 незалежно обрані із групи, що включає водень, галоген, гідроксил, ціано, нітро, сульфогідрил, C 1-C6 алкіл з прямим або розгалуженим ланцюгом, C1-C6 алкеніл з прямим або розгалуженим ланцюгом, C 1-C6 алкініл з прямим або розгалуженим ланцюгом, C1-C6 алкокси з прямим або розгалуженим ланцюгом або C1-C6 алкенокси з прямим або розгалуженим ланцюгом; де в кожному окремому випадку C 1-C6 алкіл з прямим або розгалуженим ланцюгом, C1-C6 алкеніл з прямим або розгалуженим ланцюгом, C1C6 алкініл з прямим або розгалуженим ланцюгом, C1-C6 алкокси з прямим або розгалуженим ланцюгом або C1-C6 алкенокси з прямим або розгалуженим ланцюгом можуть бути незалежно незаміщеними або містити замісники – один або декілька атомів галогену; і за умови, що одна із груп R1 й R2 являє собою -H, інша не є -H або -OH. Відповідно до деяких варіантів реалізації, R1 й R2 незалежно вибирають із групи, що включає водень, галоген, C1-C6 алкіл, C1-C6 алкеніл, C1-C6 алкокси й C1-C6 алкенокси; де в кожному окремому випадку C1-C6 алкіл з прямим або розгалуженим ланцюгом, C1-C6 алкеніл з прямим або розгалуженим ланцюгом, C1-C6 алкокси з прямим або розгалуженим ланцюгом або C1-C6 алкенокси з прямим або розгалуженим ланцюгом можуть бути незалежно незаміщеними або містити замісники – від одного до трьох атомів галогену; і за умови, що одна з груп R1 й R2 являє собою -H, інша не є –H або –OH. Відповідно до деяких варіантів реалізації,сполука представлена Формулою: 3 UA 99476 C2 5 де атом вуглецю, відмічений символом «*», може бути в (R) або (S) конфігурації. Відповідно до деяких варіантів реалізації, фармацевтична композиція або спосіб згідно з даним винаходом можливо включає сполуку (R) конфігурації або (S) конфігурації або суміш (R) і (S) конфігурацій. Відповідно до деяких варіантів реалізації, R1 й R2 незалежно обрані з фтору й водню, за умови, що R1 й R2 одночасно не є атомами водню. Відповідно до наступних варіантів реалізації, стереохімія сполуки Формули I представлена структурами Ia або Ib: 10 Відповідно до деяких варіантів реалізації, R1 й R2 незалежно обрані з групи, що включає фтор і водень, за умови, що R1 й R2 одночасно, можливо, не є воднем. Відповідно до наступних варіантів реалізації, сполуку Формули I вибирають з групи, що включає Сполуки 1-23 та їх фармацевтично прийнятні солі: 15 4 UA 99476 C2 5 UA 99476 C2 6 UA 99476 C2 Відповідно до наступних варіантів реалізації, сполуку Формули I вибирають з групи, що включає Сполуки Ia, Ib, 2a, 2b, 3a й 3b та їх фармацевтично прийнятні солі. 5 10 15 Оскільки сполуки відповідно до винаходу містять, щонайменше, один хіральний центр, вони можуть існувати у формі енантіомерів, діастереомерів, рацемічних сумішей або інших стереомерів. Даний винахід охоплює всі можливі ізомери подібного виду, а також геометричні ізомери й таутомери. Відповідно до другого аспекту, даний винахід відноситься до фармацевтичної композиції, що включає: (i) ефективну кількість описаної сполуки відповідно до винаходу, включаючи всі конкретні варіанти реалізації без обмеження; і (ii) фармацевтично прийнятний носій. 7 UA 99476 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно до наступних варіантів реалізації, фармацевтична композиція включає додаткову ефективну кількість, щонайменше, одного додатково терапевтичного агента, такого як лікарський препарат – субстрат CDA або хіміотерапевтичний агент. "Ефективна кількість" сполуки відповідно до винаходу може становити від 0,1 % за вагою до приблизно 100 % за вагою. Відповідно до деяких варіантів реалізації, ефективна кількість сполуки становить від 0,1 до 20 % вага/вага. Відповідно до інших варіантів реалізації, ефективна кількість становить від 1 до 10 % вага/вага. Відповідно до інших варіантів реалізації, ефективна кількість становить від 2 до 5 % вага/вага. Фармацевтичні композиції відповідно до винаходу можна приготувати у виді рідких і твердих лікарських форм, включаючи форми, адаптовані для (1) перорального введення, наприклад, рідкі дозовані форми (наприклад, водні й неводні розчини або суспензії); таблетки (наприклад, призначені для букального, сублінгвального або системного поглинання); капсули, болюси, порошки, гранули, пасти для нанесення на язик, тверді желатинові капсули, м'які желатинові капсули, аерозолі для зрошення порожнини рота, коржі, льодяники, пігулки, сиропи, суспензії, еліксири, рідини, емульсії й мікроемульсії; (2) парентерального введення, наприклад, шляхом підшкірної, внутрім'язової, внутрішньовенної або епідуральної ін'єкції, наприклад, стерильного розчину або суспензії; (3) місцевого застосування, наприклад, у виді крему, мазі, пластиру, м'якої прокладки або спрею, що наноситься на шкіру; (4) вагінального або ректального введення, наприклад, у виді песарію, крему або піни; (5) сублінгвального введення; (6) окулярного введення; (7) трансдермального введення або (8) інтраназального введення. Можна виготовити фармацевтичні композиції з негайним, уповільненим або контрольованим вивільненням. Відповідно до деяких варіантів реалізації, фармацевтичні композиції виготовляють для перорального введення. Відповідно до наступних варіантів реалізації, фармацевтичні композиції виготовляють для перорального введення у виді твердої лікарської форми. Інший варіант реалізації даного винаходу відноситься до способу інгібування цитидиндеамінази, що включає введення в організм суб'єкта, який потребує лікування, ефективної кількості описаної фармацевтичної композиції відповідно до винаходу, включаючи всі конкретні варіанти реалізації без обмеження. Відповідно до деяких варіантів реалізації, суб'єкт є ссавцем. Відповідно до подальших варіантів реалізації, суб'єкт є людиною. Інший варіант реалізації даного винаходу відноситься до способу лікування раку, що включає введення в організм суб'єкта, який потребує лікування (i) ефективної кількості описаної сполуки або фармацевтичної композиції відповідно до винаходу, включаючи всі конкретні варіанти реалізації без обмеження; і (ii) лікарський препарат – субстрат CDA, включаючи всі описані тут конкретні варіанти реалізації без обмеження. Відповідно до деяких варіантів реалізації, суб'єкт є ссавцем. Відповідно до подальших варіантів реалізації, суб'єкт є людиною. Відповідно до деяких варіантів реалізації, рак вибирають зі злоякісних гематологічних захворювань і солідних форм раку. Відповідно до наступних варіантів реалізації, гематологічний рак вибирають з групи, що включає МДС (мієлодиспластичний синдром) і лейкемію (лейкоз). Відповідно до наступних варіантів реалізації, солідний рак вибирають з групи, що включає рак підшлункової залози, перитонеальний рак, недрібноклітинний рак легень й рак молочної залози. Відповідно до інших варіантів реалізації, лейкоз являє собою гострий мієлолейкоз (ACL) або хронічний мієлолейкоз (CML). Інший варіант реалізації даного винаходу відноситься до способу інгібування деградації лікарського препарату – субстрату CDA під дією цитидиндеамінази, що включає введення ефективної кількості сполуки або фармацевтичної композиції відповідно до винаходу, включаючи всі часткові варіанти реалізації без обмеження, суб'єкту, який одержує лікування лікарським препаратом – субстратом CDA. "Лікарський препарат – субстрат CDA" включає всі описані тут часткові варіанти реалізації без обмеження. Відповідно до окремих варіантів реалізації, суб'єкт є ссавцем. Відповідно до інших варіантів реалізації, суб'єкт є людиною. Інший варіант реалізації даного винаходу відноситься до набору, що містить, щонайменше, одну стандартну дозовану форму, причому стандартна дозована форма містить сполуку або фармацевтичну композицію відповідно до винаходу. Крім того, набір може містити контейнер та/або упаковку, прийнятну для комерційного продажу. Контейнер, виготовлений з фармацевтично прийнятного матеріалу, може мати будьяку традиційну форму або вид, відомий фахівцям у даній галузі, такий як паперова або картонна 8 UA 99476 C2 5 10 15 20 25 30 35 40 45 50 55 60 коробка, скляна або пластикова пляшка або банка, повторно герметизований пакет або блістерупаковка з індивідуальними дозами, які вилучаються з упаковки для прийому відповідно до терапевтичного розкладу. Одна упаковка може містити більше одного контейнера одночасно. Наприклад, таблетки можуть знаходитися в блістер-упаковці, яка у свою чергу може знаходитися в коробці. КОРОТКИЙ ОПИС КРЕСЛЕНЬ На Фіг.1 представлений графік, що демонструє вплив Сполуки 1 на виживаність мишей, які одержували децитабін, у моделі лімфоми L 1210 на мишах. На Фіг.2 представлений графік, що демонструє вплив Сполуки 1а на виживаність мишей, які одержували децитабін, у моделі лімфоми L 1210 на мишах. На Фіг.3 представлений графік, що демонструє вплив Сполуки 3а на виживаність мишей, які одержували децитабін, у моделі лімфоми L 1210 на мишах. На Фіг.4 представлений графік, що демонструє вплив Сполуки 1а на виживаність мишей, які одержували Ара-С (200 мг/кг), у моделі L 1210 на мишах. На Фіг.5 представлений графік, що демонструє вплив Сполуки 1а на виживаність мишей, які одержували Ара-С (100 мг/кг), у моделі L 1210 на мишах. На Фіг.6 представлений графік, що демонструє вплив Сполуки 1а на виживаність мишей, які одержували Ара-С (50 мг/кг), у моделі L 1210 на мишах. На Фіг.7 представлений графік, що демонструє вплив Сполуки 1а на виживаність мишей, які одержували Ара-С (25 мг/кг), у моделі L 1210. На Фіг.8 представлений графік, що демонструє вплив Сполуки 1 на зменшення розмірів пухлини, викликане введенням гемцитабіну, у мишачій моделі ксенотранстплантата ракових клітин яєчника людини лінії А2780. На Фіг.9 представлене зображення в програмі ORTEP кристалічної структури Сполуки 1а. 1 На Фіг.10 представлений H ЯМР спектр ТГУ (тетрагідроуридину) в D2O. 1 На Фіг.11 представлений H ЯМР спектр ТГУ в D2O у присутності трифтороцтової кислоти, у різні моменти часу. 1 На Фіг.12 представлений H ЯМР спектр Сполуки 1а в D2O. 1 Фіг. 13 представлений H ЯМР спектр Сполуки 1а в D2O у присутності трифтороцтової кислоти, у різні моменти часу. Даний винахід відноситься до сполук – визначених похідною тетрагідроуридину, фармацевтичних композицій і наборів, що включають зазначені сполуки, а також способів одержання й застосування зазначених сполук. Сполуки, композиції, набори й способи відповідно до винаходу можуть мати певні переваги. Наприклад, сполуки й композиції відповідно до винаходу здатні інгібувати ферментну активність CDA та/або збільшити період напіврозпаду, біодоступність та/або ефективність лікарських препаратів, які являють собою субстрати CDA. Крім того, сполуки, композиції, набори й способи відповідно до винаходу можуть мати покращені характеристики, такі як розчинність у воді, хімічна стабільність, рівні абсорбції лікарських засобів, рівні токсичності, строк придатності, відтворюваність при виробництві й виготовленні складів, а також терапевтична ефективність. Визначення У тексті заявки й формулі винаходу використовують наступні визначення. У тексті заявки й формулі винаходу слова (терміни) в однині включають і множину, якщо в тексті не зазначеного іншого. Так, наприклад, посилання на фармацевтичну композицію, що містить "сполуку" може стосуватися двох і більше сполук. Термін "алкіл" відноситься до насиченого вуглеводневого радикала з прямим або розгалуженим вуглецевим ланцюгом. Приклади включають без обмеження метил, етил, пропіл, ізо-пропіл, бутил, ізо-бутил, трет-бутил, n-пентил й n-гексил. Відповідно до деяких варіантів реалізації, алкільний ланцюг являє собою C 1-C6 вуглецевий ланцюг, прямий або розгалужений. Відповідно до деяких варіантів реалізації, алкільний ланцюг являє собою C2-C5 вуглецевий ланцюг, прямий або розгалужений. Відповідно до деяких варіантів реалізації, алкільний ланцюг являє собою C 1-C4 вуглецевий ланцюг, прямий або розгалужений. Відповідно до деяких варіантів реалізації, алкільний ланцюг являє собою C 2-C4 вуглецевий ланцюг, прямий або розгалужений. Відповідно до деяких варіантів реалізації, алкільний ланцюг являє собою C3-C5 вуглецевий ланцюг, прямий або розгалужений. Відповідно до деяких варіантів реалізації, алкільний ланцюг являє собою С 1-С2 вуглецевий ланцюг, прямий або розгалужений. Відповідно до деяких варіантів реалізації, алкільний ланцюг являє собою С 2С3 вуглецевий ланцюг, прямий або розгалужений. Термін "алкеніл" відноситься до вуглеводневого радикала з прямим або розгалуженим вуглеводневим ланцюгом, який включає, щонайменше, один вуглець-вуглецевий подвійний 9 UA 99476 C2 5 10 15 20 25 30 35 40 45 50 55 60 зв'язок. Приклади включають без обмеження етеніл, пропеніл, ізо-пропеніл, бутеніл, ізо-бутеніл, трет-бутеніл, n-пентеніл й n-гексеніл. Відповідно до деяких варіантів реалізації, алкенільний ланцюг являє собою C2-C6 вуглецевий ланцюг, прямий або розгалужений. Відповідно до деяких варіантів реалізації, алкенільний ланцюг являє собою C2-C5 вуглецевий ланцюг, прямий або розгалужений. Відповідно до деяких варіантів реалізації, алкенільний ланцюг являє собою C 2-C4 вуглецевий ланцюг, прямий або розгалужений. Відповідно до деяких варіантів реалізації, алкенільний ланцюг являє собою C3-C5 вуглецевий ланцюг, прямий або розгалужений. Термін "алкокси" відноситься до алкільної групи, зв'язаної через атом кисню. Термін "алкенокси" відноситься до алкенільної групи, зв'язаної через атом кисню. Термін "циклоалкіл" відноситься до неароматичного циклічного алкільного радикалу. Термін "циклоалкеніл" відноситься до неароматичного циклічного алкенільного радикалу. Термін "галоген" відноситься до фтор-, хлор-, бром- або йод- радикалів. Термін "заміщений" означає, що, щонайменше, один водень зазначеної групи заміщений іншим радикалом, за умови, що нормальна валентність зазначеної групи не перевищена. По відношенню до всіх груп, що містять один або декілька замісників, заміщення подібними групами не повинне призводити до утворення сполуки, яка стерично невигідна, не здійсненна з огляду на синтез та/або не має природну стабільність. Термін "лікарський препарат – субстрат CDA" відноситься до ліків, які можна деамінувати впливом CDA. Приклади субстратів CDA включають без обмеження аналоги цитидину, такі як децитабін, 5-азацитидин, гемцитабін, ара-С, троксацитабін, тезацитабін, 5'-фтор-2'деоксицитидин і цитохлор (cytochlor). Термін "ефективна кількість" відноситься до кількості, необхідної для досягнення бажаного ефекту (напр., збільшення періоду напіврозпаду, біодоступності або ефективності лікарського препарату – субстрату CDA, лікування суб'єкта, хворого раком, інгібування цитидиндеамінази в організмі суб'єкта або інгібування деградації субстрату CDA при впливі цитидиндеамінази). Термін "період напіврозпаду" відноситься до періоду часу, необхідного для зниження концентрації або вмісту сполуки в організмі суб'єкта рівно наполовину відносно заданої концентрації або вмісту. Термін "фармацевтично прийнятний" відноситься до характеристик та/або речовин, прийнятних для пацієнта з фармакологічної й токсикологічної точки зору, та/або для хімікафармацевта, що виготовляє ліки, з фізичної та/або хімічної точки зору, включаючи композицію, склад, стабільність, переносимість пацієнтом, біодоступність і сумісність з іншими інгредієнтами. Термін "фармацевтично прийнятний носій" відноситься до всіх речовин, що не є терапевтичними агентами, які застосовуються як наповнювач, розріджувач, ад'ювант, зв'язуючий агент та/або носій, що доставляє терапевтичний агент в організм суб'єкта; або ж до речовин, що додають до фармацевтичної композиції для покращення характеристик, пов'язаних з обробкою й зберіганням, або для забезпечення можливості або полегшення готування одиничної дозованої форми для прийому сполуки або композиції. Фармацевтично прийнятні носії добре відомі фахівцям в галузі фармацевтики, вони описані, наприклад, в Remington's th Pharmaceutical Sciences, Mack Publishing Co., Easton, Pa (e.g., 20 Ed., 2000), і Handbook of st nd Pharmaceutical Excipients, American Pharmaceutical Association, Washington, D.C., (напр., 1 , 2 й rd 3 Eds., 1986, 1994 й 2000, відповідно). Як відомо фахівцям у даній галузі, наповнювачі (носії) можуть виконувати різні функції; їх називають змочувальними агентами, буферними агентами, суспендуючими агентами, змазуючими агентами, емульгаторами, розпушувачами, консервантами, сурфактантами, колорантами, ароматизаторами й підсолоджувачами. Приклади фармацевтично прийнятних інгредієнтів включають без обмеження (1) цукри, такі як лактоза, глюкоза й сахароза; (2) крохмалі, такі як кукурудзяний і картопляний крохмаль; (3) целюлозу та її похідні, такі як натрій карбоксиметилцелюлоза, етилцелюлоза, ацетат целюлози, гідроксипропілметилцелюлоза й гідроксипропілцелюлоза; (4) порошкоподібний тракагант; (5) солод; (6) желатин; (7) тальк; (8) наповнювачі, такі як олія какао або супозиторні воски; (9) олії, такі як арахісова олія, бавовняна олія, сафлорова олія, кунжутна олія, маслинова олія, кукурудзяна олія або соєва олія; (10) гліколі, такі як пропіленгліколь; (11) поліоли, такі як гліцерин, сорбітол, манітол і поліетиленгліколь; (12) складні ефіри, такі як етил олеат й етил лаурат; (13) агар; (14) буферні агенти, такі як гідроксид магнію й гідроксид алюмінію; (15) альгінова кислота; (16) апірогенна вода; (17) ізотонічний сольовий розчин; (18) розчин Рінгера; (19) етиловий спирт; (20) pН буферні розчини; (21) поліефіри, полікарбонати та/або поліангідриди; й (22) інші нетоксичні сумісні речовини, що застосовуються у фармацевтичних складах. Термін "фармацевтично прийнятна сіль" відноситься до солі кислоти або основи сполуки згідно із даним винаходом, що має бажану фармацевтичну активність й не є несприятливою ні в 10 UA 99476 C2 5 10 15 20 25 30 35 40 45 50 55 біологічному, ні в будь-якому іншому сенсі. Солі, утворені кислотами, включають, без обмеження, ацетат, адипат, альгінат, аспартат, бензоат, бензосульфонат, бісульфат, бутират, цитрат, камфорат, камфоросульфонат, циклопентанпропіонат, диглюконат, додецилсульфат, етансульфонат, фумарат, глюкогептаноат, гліцерофосфат, гемісульфат, гептаноат, гексаноат, гідрохлорид, гідробромід, гідройодид, 2-гідроксиетан-сульфонат, лактат, малеат, метансульфонат, 2-нафталінсульфонат, нікотинат, оксалат, тіоцианат, тозилат й ундеканоат. Приклади солей основ включають, без обмеження, солі амонію, солі лужних металів, такі як солі натрію й калію, солі лужноземельних металів, такі як солі кальцію й магнію, солі органічних основ, такі як солі дициклогексиламіну, N-метил-D-глюкаміну а також солі амінокислот, таких як аргінін і лізин. Відповідно до деяких варіантів реалізації, основні азотвмісні групи, можуть бути кватернізовані за допомогою різних агентів, включаючи нижчі алкілгаліди, такі як метил, етил, пропіл і бутил хлориди, броміди та йодиди; діалкіл сульфати, такі як диметил, диетил, дибутил і діаміл сульфати; галіди з довгими вуглецевими ланцюгами, такі як децил, лаурил, міристил і стеарил хлориди, броміди та йодиди; а також аралкіл галіди, такі як фенетил броміди. Термін "одинична дозована форма" відноситься до фізично дискретних одиниць, придатних для прийому як одинична доза людиною або іншим суб'єктом. Кожна одинична дозована форма містить певну розраховану кількість активної речовини (напр., сполуки або композиції відповідно до винаходу, лікарського препарату – субстрату CDA та/або іншого терапевтичного агента), що викликає бажаний ефект. Термін "ізомери" відноситься до сполук, що містять однакові атоми в однаковій кількості, отже, що має однакову молекулярну вагу, але відрізняються за розташуванням або конфігурацією атомів. Термін "стереоізомери" відноситься до ізомерів, які відрізняються тільки розташуванням атомів у просторі. Термін "діастереомери" відноситься до стереоізомерів, які не є дзеркальним відображенням один одного. Термін "енантіомери" відноситься до стереоізомерів, що являють собою ненакладувані дзеркальні відображення один одного. Енантіомери включають "енантіометрично чисті" ізомери, які включають, в основному, один ізомер, наприклад, у кількості, що перевищує 90 %, 92 %, 95 %, 98 % або 99 %, або на 100 % складаються з одного ізомеру. Термін "епімери" відноситься до стереоізомерів сполуки, які відрізняються конфігурацією одного з декількох стереогенних центрів. Термін "рацемічна" відноситься до суміші, що містить індивідуальні енантіомери в рівних частинах. Термін "нерацемічна" відноситься до суміші, що містить індивідуальні енантіомери в нерівних частинах. Нерацемічну суміш можна збагатити енантіомером R- або S-конфігурації, включаючи без обмеження співвідношення, які складають приблизно 50/50, приблизно 60/40 і приблизно 70/30 R- до S-енантіомера, або S- до R-енантіомера в сумішах. "Можливо" або "можливий" означає, що описана далі подія або обставина може відбутися або не відбутися, і що опис включає ситуації, де подія відбувається, і ситуації, де подія не відбувається. Наприклад, термін "алкіл, можливо заміщений" охоплює як алкіл заміщений, так і алкіл незаміщений. Термін "суб'єкт" відноситься до клітини або тканини, in vitro або in vivo, до людини або тварини. Суб'єкт, що являє собою людину або тварину, може бути названий "пацієнт". "Тварина" відноситься до живого організму, що має відчуття і здатного до вільного руху, для підтримки життя якого необхідний кисень й органічна їжа. Термін "ссавець" відноситься до теплокровних хребетних тварин з хутром або волоссям. Приклади включають без обмеження людину, а також коней, свиней, велику рогату худобу, мишевидних гризунів, собак або кішок. Поняття "лікування" стосовно хвороби, розладу або стану відноситься до: (i) інгібування хвороби, розладу або стану, напр., припинення розвитку; та/або (ii) полегшення тяжкості захворювання, розладу або стану, напр., індукування регресії клінічних симптомів. Поняття "запобігання" стосовно хвороби, розладу або стану відноситься до запобігання хвороби, розладу або стану, напр., до припинення розвитку клінічних симптомів захворювання, розладу або стану. Термін "рак" відноситься до аномального росту клітин з тенденцією до проліферації неконтрольованим чином і, у деяких випадках, до поширення з утворенням метастазів. Специфічні типи раку включають без обмеження ракові захворювання, згадані в Публікації No. US 2006/0014949 та наступні: 11 UA 99476 C2 5 10 15 20 25 30 35 40 45 - кардіальні: саркома (напр., такі як ангіосаркома, фібросаркома, рабдоміосаркома, ліпосаркома тощо), міксома, рабдоміома, фіброма, ліпома й тератома; - легеневі: бронхогенний рак (напр., такий як плоскоклітинний рак, недиференційований дрібноклітинний рак, недиференційований крупноклітинний рак, аденокарцинома тощо), альвеолярна (напр., бронхіолярна) карцинома, аденома бронха, саркома, лімфома, хондроматозна гамартома, мезотієлома; - шлунково-кишкові: стравоходу (напр., плоскоклітинна карцинома, аденокарцинома, лейміосаркома, лімфома тощо), шлунку (напр., карцинома, лімфома, лейміосаркома тощо), підшлункової залози (напр., протокова аденокарцинома, інсулінома, глюкагонома, гастринома, карциноїдні пухлини, віпома тощо), тонкого кишечнику (напр., аденокарцинома, лімфома, карциноїдні пухлини, саркома Капоші, лейоміома, гемангіома, ліпома, нейрофіброма, фіброма тощо), товстого кишечнику (напр., аденокарцинома, тубулярна аденома, ворсинчаста аденома, гамартома, лейоміома тощо); - урогенітальних шляхів: нирки (напр., аденокарцинома, пухлина Уілма, нефробластома, лімфома, лейкемія тощо), сечового міхура й уретри (напр., плоскоклітинна карцинома, перехідно-клітинний рак, аденокарцинома тощо), передміхурової залози (напр., аденокарцинома, саркома), яєчка (напр., семинома, тератома, ембріональна карцинома, хоріокарцинома, саркома, інтерстиціально-клітинна карцинома, фіброма, фіброаденома, аденоматоїдні пухлини, ліпома тощо); - печінки: гепатома (напр., гепатоцелюлярна карцинома тощо), холангіокарцинома, гепатобластома, ангіосаркома, гепатоцелюлярна аденома, гемангіома; - кістки: остеогенна саркома (напр., остеосаркома тощо), фібросаркома, злоякісна фіброзна гістіома, хондросаркома, саркома Евінга, злоякісна лімфома (напр., ретикулоклітинна саркома), множинна мієлома, злоякісна гігантоклітинна пухлина, хордома, остеохронфрома (osteochronfroma) (напр., кістково-хрящовий екзостоз), доброякісна хондрома, хондробластома, хондроміксофіброма, остеоїдна остеома й гігантоклітинні пухлини; - нервової системи: черепа (напр., остеома, гемангіома, гранулема, ксантома, остит деформуючий тощо), м'яких мозкових оболонок (напр., менінгіома, менінгіосаркома, гліоматоз тощо), мозку (напр., астроцитома, медулобластома, гліома, епендімома, гермінома [пінеалома], гліобластома мультиформна, олігодендрогліома, шванома, ретинобластома, уроджені пухлини тощо), спинного мозку (напр., нейрофіброма, менінгіома, гліома, саркома тощо); - гінекологічні: матки (напр., ендометріальна карцинома тощо), шийки матки (напр., цервікальна карцинома, передпухлинна цервікальна дисплазія тощо), яєчника (напр., карцинома яєчника [серозна цистаденокарцинома, муцинозна цистаденокарцинома, некласифікований рак], гранульозо-текальноклітинні пухлини, пухлина з клітин Сертолі-Лейдіга, дисгермінома, злоякісна тератома тощо), вульви (напр., плоскоклітинна карцинома, інтраепітеліальна карцинома, аденокарцинома, фібросаркома, меланома тощо), піхви (напр., світлоклітинний рак, плоскоклітинний рак, кістевидна саркома (ембріональна рабдоміосаркома)], фалопієвих труб (карцинома тощо); - гематологічні: крові (напр., мієлоїдний лейкоз [гострий і хронічний], гострий лімфобластичний лейкоз, хронічний лімфолейкоз, мієлопроліферативні захворювання, множинна мієлома, мієлодиспластичний синдром тощо), хвороба Ходжкіна, лімфома неходжкінська; - шкіри: злоякісна меланома, базально-клітинний рак, плоскоклітинний рак, саркома Капоші, бородавки, диспластичний невус, ліпома, ангіома, дерматофіброма, келоїди, псоріаз тощо; і - наднирок: нейробластома. Сполуки Один аспект даного винаходу відноситься до сполуки Формули I: 12 UA 99476 C2 5 10 15 20 25 30 35 40 45 або фармацевтично прийнятної солі цієї сполуки, де R1 й R2 незалежно обрані з групи, що включає водень, галоген, ціано, нітро, сульфідрил, гідроксил, форміл, карбоксил, COO (алкіл C 1-C6 з прямим або розгалуженим ланцюгом), COO (алкеніл C1-C6 з прямим або розгалуженим ланцюгом), COO (алкініл C 1-C6 з прямим або розгалуженим ланцюгом), CO (алкіл C1-C6 з прямим або розгалуженим ланцюгом), CO (алкеніл C1-C6 з прямим або розгалуженим ланцюгом, CO (алкініл C1-C6 з прямим або розгалуженим ланцюгом), алкіл C1-C6 з прямим або розгалуженим ланцюгом, алкеніл C1-C6 з прямим або розгалуженим ланцюгом, алкініл C1-C6 з прямим або розгалуженим ланцюгом, алкоксил C1-C6 з прямим або розгалуженим ланцюгом й алкенокси C1-C6 з прямим або розгалуженим ланцюгом; де в кожному окремому випадку алкіл C1-C6 з прямим або розгалуженим ланцюгом, алкеніл C1C6 з прямим або розгалуженим ланцюгом, алкініл C1-C6 з прямим або розгалуженим ланцюгом, алкокси C1-C6 з прямим або розгалуженим ланцюгом або алкенокси C 1-C6 з прямим або розгалуженим ланцюгом може незалежно бути незаміщеним або містити від 1 до 4 замісників, незалежно обраних з групи, що включає галоген, гідроксил, ціано, нітро, форміл, карбоксил і сульфідрил; за умови, що якщо одна із груп R1 й R2 являє собою -H, то інша не є -H, -OH або CH2OH. Відповідно до деяких варіантів реалізації, R1 й R2 незалежно обрані із групи, що включає водень, галоген, гідроксил, ціано, нітро, сульфідрил, алкіл C 1-C6 з прямим або розгалуженим ланцюгом, алкеніл C1-C6 з прямим або розгалуженим ланцюгом, алкініл C1-C6 з прямим або розгалуженим ланцюгом, алкокси C1-C6 з прямим або розгалуженим ланцюгом й алкенокси C 1C6 з прямим або розгалуженим ланцюгом; де в кожному окремому випадку алкіл C 1-C6 з прямим або розгалуженим ланцюгом, алкеніл C1-C6 з прямим або розгалуженим ланцюгом, алкініл C1-C6 з прямим або розгалуженим ланцюгом, алкокси C1-C6 з прямим або розгалуженим ланцюгом або алкенокси C1-C6 з прямим або розгалуженим ланцюгом може незалежно бути незаміщеним або містити один або декілька галогенів-замісників; за умови, що якщо одна із груп R1 й R2 являє собою -H, то інша не є –H або -OH. Відповідно до деяких варіантів реалізації, R1 й R2 незалежно обрані із групи, що включає водень, галоген, C1-C6 алкіл, C1-C6 алкеніл, C1-C6 алкокси й C1-C6 алкенокси; де в кожному окремому випадку алкіл C1-C6 з прямим або розгалуженим ланцюгом, алкеніл C1-C6 з прямим або розгалуженим ланцюгом, алкініл C1-C6 з прямим або розгалуженим ланцюгом, алкокси C 1C6 з прямим або розгалуженим ланцюгом або алкенокси C1-C6 з прямим або розгалуженим ланцюгом може незалежно бути незаміщеним або містити від одного до трьох галогенівзамісників, за умови, якщо одна із груп R1 й R2 являє собою -H, то інша не є –H або -OH. Відповідно до наступних варіантів реалізації, щонайменше, одна з груп R1 й R2 являє собою галоген. Відповідно до наступних варіантів реалізації, щонайменше, одна з груп R 1 й R2 являє собою фтор. Відповідно до наступних варіантів реалізації, одна з груп R1 й R2 являє собою галоген, а інша являє собою -H. Відповідно до наступних варіантів реалізації, одна з груп R 1 й R2 являє собою фтор, а інша являє собою -H. Відповідно до наступних варіантів реалізації, кожна R1 й R2 являє собою фтор. Відповідно до наступних варіантів реалізації, одна із груп R 1 й R2 являє собою галоген, а інша являє собою -CN. Відповідно до наступних варіантів реалізації, одна з груп R 1 й R2 являє собою фтор, а інша являє собою -CN. 13 UA 99476 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно до наступних варіантів реалізації, одна з груп R1 й R2 являє собою галоген, а інша являє собою -NO2. Відповідно до наступних варіантів реалізації, одна з груп R 1 й R2 являє собою фтор, а інша являє собою -NO2. Відповідно до наступних варіантів реалізації, одна з груп R1 й R2 являє собою галоген, а інша являє собою -SH. Відповідно до наступних варіантів реалізації, одна з груп R1 й R2 являє собою фтор, а інша являє собою -SH. Відповідно до наступних варіантів реалізації, одна з груп R1 й R2 являє собою галоген, а інша являє собою -OH. Відповідно до наступних варіантів реалізації, одна з груп R 1 й R2 являє собою фтор, а інша являє собою -OH. Відповідно до наступних варіантів реалізації, одна з груп R1 й R2 являє собою галоген, а інша являє собою -CHO. Відповідно до наступних варіантів реалізації, одна з груп R 1 й R2 являє собою фтор, а інша являє собою -CHO. Відповідно до наступних варіантів реалізації, одна з груп R1 й R2 являє собою галоген, а інша являє собою -COOH. Відповідно до наступних варіантів реалізації, одна з груп R 1 й R2 являє собою фтор, а інша являє собою -COOH. Відповідно до наступних варіантів реалізації, одна з груп R1 й R2 являє собою галоген, а інша являє собою -COORx, де Rx обраний з групи, що включає алкіл C1-C6 з прямим або розгалуженим ланцюгом, алкеніл C1-C6 з прямим або розгалуженим ланцюгом й алкініл C1-C6 з прямим або розгалуженим ланцюгом. Відповідно до наступних варіантів реалізації, одна з груп R 1 й R2 являє собою фтор, а інша являє собою -COORx, де Rx обраний з групи, що включає алкіл C1-C6 з прямим або розгалуженим ланцюгом, алкеніл C1-C6 з прямим або розгалуженим ланцюгом й алкініл C1-C6 з прямим або розгалуженим ланцюгом. Відповідно до наступних варіантів реалізації, одна з груп R1 й R2 являє собою галоген, а інша являє собою -CORx, де Rx обраний з групи, що включає алкіл C1-C6 з прямим або розгалуженим ланцюгом, алкеніл C1-C6 з прямим або розгалуженим ланцюгом й алкініл C1-C6 з прямим або розгалуженим ланцюгом. Відповідно до наступних варіантів реалізації, одна з груп R 1 й R2 являє собою фтор, а інша являє собою -CORx, де Rx обраний з групи, що включає алкіл C1-C6 з прямим або розгалуженим ланцюгом, алкеніл C1-C6 з прямим або розгалуженим ланцюгом й алкініл C1-C6 з прямим або розгалуженим ланцюгом. Відповідно до наступних варіантів реалізації, одна з груп R1 й R2 являє собою галоген, а інша являє собою алкіл C1-C6 з прямим або розгалуженим ланцюгом. Відповідно до наступних варіантів реалізації, одна з груп R 1 й R2 являє собою фтор, а інша являє собою алкіл C1-C6 з прямим або розгалуженим ланцюгом. Відповідно до наступних варіантів реалізації, одна з груп R1 й R2 являє собою галоген, а інша являє собою алкеніл C1-C6 з прямим або розгалуженим ланцюгом. Відповідно до наступних варіантів реалізації, одна з груп R 1 й R2 являє собою фтор, а інша являє собою алкеніл C1-C6 з прямим або розгалуженим ланцюгом. Відповідно до наступних варіантів реалізації, одна з груп R1 й R2 являє собою галоген, а інша являє собою алкокси C1-C6 з прямим або розгалуженим ланцюгом. Відповідно до наступних варіантів реалізації, одна з груп R 1 й R2 являє собою фтор, а інша являє собою алкокси C1-C6 з прямим або розгалуженим ланцюгом. Відповідно до наступних варіантів реалізації, одна з груп R1 й R2 являє собою галоген, а інша являє собою алкенокси C1-C6 з прямим або розгалуженим ланцюгом. Відповідно до наступних варіантів реалізації, одна з груп R 1 й R2 являє собою фтор, а інша являє собою алкенокси C1-C6 з прямим або розгалуженим ланцюгом. Відповідно до наступних варіантів реалізації, щонайменше одна з груп R 1 й R2 являє собою C1-C6 галогензаміщений алкіл з прямим або розгалуженим ланцюгом. Відповідно до наступних варіантів реалізації, одна з груп R1 й R2 являє собою C1-C6 галогензаміщений алкіл з прямим або розгалуженим ланцюгом, а інша являє собою -H. Відповідно до наступних варіантів реалізації, одна з груп R1 й R2 являє собою C1-C6 фторзаміщений алкіл з прямим або розгалуженим ланцюгом, а інша являє собою -H. Відповідно до наступних варіантів реалізації, щонайменше, одна з груп R 1 й R2 являє собою галогензаміщений алкеніл C1-C6 з прямим або розгалуженим ланцюгом. 14 UA 99476 C2 5 10 15 Відповідно до наступних варіантів реалізації, одна з груп R1 й R2 являє собою галогензаміщений алкеніл C1-C6 з прямим або розгалуженим ланцюгом, а інша являє собою -H. Відповідно до наступних варіантів реалізації, одна з груп R 1 й R2 являє собою фторзаміщений алкеніл C1-C6 з прямим або розгалуженим ланцюгом, а інша являє собою -H. Відповідно до наступних варіантів реалізації, щонайменше, одна з груп R 1 й R2 являє/являють собою галогензаміщений алкокси C1-C6 з прямим або розгалуженим ланцюгом. Відповідно до наступних варіантів реалізації, одна з груп R1 й R2 являє собою галогензаміщений алкокси C1-C6 з прямим або розгалуженим ланцюгом, а інша являє собою -H. Відповідно до наступних варіантів реалізації, одна з груп R 1 й R2 являє собою фторзаміщений алкокси C1-C6 з прямим або розгалуженим ланцюгом, а інша являє собою -H. Відповідно до наступних варіантів реалізації, щонайменше, одна з груп R 1 й R2 являє собою галогензаміщений алкенокси C1-C6 з прямим або розгалуженим ланцюгом. Відповідно до наступних варіантів реалізації, одна з груп R 1 й R2 являє собою галогензаміщений алкенокси C1-C6 з прямим або розгалуженим ланцюгом, а інша являє собою H. Відповідно до наступних варіантів реалізації, одна з груп R 1 й R2 являє собою фторзаміщений алкенокси C1-C6 з прямим або розгалуженим ланцюгом, а інша являє собою -H. Відповідно до деяких варіантів реалізації, запропонована сполука Формули 20 25 де можлива (R) або (S) конфігурація атома вуглецю, відміченого символом «*». Відповідно до деяких варіантів реалізації, описана фармацевтична композиція або спосіб її застосування може містити сполуку (R) конфігурації або (S) конфігурації, або суміш сполук (R) і (S) конфігурації. Відповідно до деяких варіантів реалізації, R1 й R2 незалежно вибирають з фтору й водню, за умови, що R1 й R2 не можуть одночасно являти собою водень. Відповідно до подальших варіантів реалізації, стереохімію сполуки Формули I описує структура Ia або Ib: 30 Відповідно до наступних варіантів реалізації, сполуку Формули I вибирають із групи, що включає Сполуки 1-23 та їх фармацевтично прийнятні солі: 15 UA 99476 C2 16 UA 99476 C2 17 UA 99476 C2 Відповідно до наступних варіантів реалізації, сполуку Формули I вибирають із групи, що включає Сполуки Ia, Ib, 2a, 2b, 3a, 3b та їх фармацевтично прийнятні солі. 5 10 15 20 25 30 Оскільки сполуки відповідно до винаходу можуть включати, щонайменше, один хіральний центр, вони можуть існувати у формі енантіомерів, діастереомерів, рацемічних сумішей, не рацемічних сумішей або інших стереомерів. Даний винахід охоплює всі можливі подібні ізомери, а також геометричні ізомери й таутомери. Стереоізомери можна приготувати або виділити відомими способами. Наприклад, діастереомери можна розділити фізичними методами розділення, такими як дробова кристалізація й хроматографічні методи; енантіомери можна розділити методом селективної кристалізації солей-діастереомерів з оптично активними кислотами або основами або за допомогою хіральної хроматографії. Крім того, чисті стереомери можна приготувати шляхом синтезу з відповідних стереохімічно чистих вихідних матеріалів, або шляхом стереоселективних реакцій. Фармацевтичні композиції Інший аспект даного винаходу відноситься до фармацевтичної композиції, що включає: (i) ефективну кількість описаної сполуки відповідно до винаходу, включаючи всі окремі варіанти реалізації без обмеження; і (ii) фармацевтично прийнятний наповнювач. Відповідно до наступних варіантів реалізації, фармацевтична композиція включає понад описаного, щонайменше, один додатковий терапевтичний агент, такий як субстрат CDA або хіміотерапевтичний агент. Лікарським препаратом – субстратом CDA можуть бути будь-які ліки, здатні до деамінування під дією CDA. Приклади субстратів CDA включають без обмеження аналоги цитозину й цитидину, такі як деуітабін, 5-азацитидин, гемцитабін, ара-С, троксацитабін, тезацитабін, 5'фтор-2'-деокси цитидин, цитохлор і сполуки, описані в Публікації США No. 2006/0014949. Відповідно до деяких варіантів реалізації, лікарським препаратом – субстратом CDA є 18 UA 99476 C2 5 10 15 20 25 30 35 40 45 50 55 60 децитабін. Відповідно до інших варіантів реалізації, лікарським препаратом – субстратом CDA є 5-азацитидин. Відповідно до інших варіантів реалізації, лікарським препаратом – субстратом CDA є гемцитабін. Відповідно до наступних варіантів реалізації, лікарським препаратом – субстратом CDA є ара-С. Приклади хіміотерапевтичних агентів включають без обмеження: алкілуючі агенти (напр., можливо включають доксорубіцин, циклофосфамід, естрамустин, кармустин, мітоміцин, блеоміцин тощо); антиметаболіти (напр., можливо включають 5-фтор-урацил, капецитабін, гемцитабін, неларабін, флударабін, метотрексат тощо); плптинуючі агенти (напр., можливо включають цисплатин, оксаліплатин, карбоплатин тощо); інгібітори топоізомерази (напр., можливо включають топотекан, іринотекан, етопозид тощо); тубулінові агенти (напр., можливо включають паклітаксел, доцетаксел, вінорелбін, вінбластин, вінкристин, інші таксани, епотилони тощо); сигнальні інгібітори (напр., інгібітори кінази, антитіла, інгібітори фарнесилтрансферази тощо); й інші хіміотерапевтичні агенти (напр., тамоксифен, антимітотичні агенти, такі як інгібітори поло-подібних кіназ або інгібітори аврора-кіназ тощо). Ефективна кількість сполуки відповідно до винаходу може варіювати приблизно від 0,1 % ваги до 100 % ваги. Відповідно до деяких варіантів реалізації, ефективна кількість сполуки становить від 0,1 до 20 % вага/вага. Відповідно до інших варіантів реалізації, ефективна кількість становить 1-10 % вага/вага. Відповідно до деяких інших варіантів реалізації, ефективна кількість становить 2-5 % вага/вага. Фармацевтичні композиції відповідно до винаходу можна приготувати у виді рідких і твердих лікарських форм, включаючи форми, адаптовані для: (1) перорального введення, наприклад, рідкі дозовані форми (наприклад, водні й неводні розчини або суспензії); таблетки (наприклад, призначені для букального, сублінгвального або системного поглинання); капсули, болюси, порошки, гранули, пасти для нанесення на язик, тверді желатинові капсули, м'які желатинові капсули, аерозолі для зрошення порожнини рота, коржі, льодяники, пігулки, сиропи, суспензії, еліксири, рідини, емульсії й мікроемульсії; (2) парентерального введення, наприклад, шляхом підшкірної, внутрім'язової, внутрішньовенної або епідуральної ін'єкції, наприклад, стерильного розчину або суспензії; (3) місцевого застосування, наприклад, у виді крему, мазі, пластиру, м'якої прокладки або спрею, що наноситься на шкіру; (4) вагінального або ректального введення, наприклад, у виді песарію, крему або піни; (5) сублінгвального введення; (6) окулярного введення; (7) трансдермального введення або (8) інтраназального введення. Можна виготовити фармацевтичні композиції з негайним, уповільненим або контрольованим вивільненням. Відповідно до деяких варіантів реалізації, фармацевтичні композиції призначені для перорального введення. Відповідно до наступних варіантів реалізації, фармацевтичні композиції для перорального введення виготовляють у виді твердої лікарської форми. Фармацевтичні композиції відповідно до винаходу можна виготовити за допомогою відомих матеріалів і способів, що включають без обмеження змішування та/або подрібнювання сполуки відповідно до винаходу з фармацевтично прийнятним наповнювачем й, можливо, з додатковим терапевтичним агентом (агентами). Способи Інший аспект даного винаходу відноситься до способу інгібування цитидиндеамінази, що включає введення суб'єктові, який потребує лікування, ефективної кількості сполуки або фармацевтичної композиції відповідно до винаходу, включаючи всі окремі приклади без обмеження. Відповідно до деяких варіантів реалізації, суб'єкт є ссавцем. Відповідно до наступних варіантів реалізації, суб'єкт є людиною. Інший аспект даного винаходу відноситься до способу лікування раку, що включає введення суб'єктові, який потребує лікування: (і) ефективної кількості сполуки або фармацевтичної композиції відповідно до винаходу, включаючи всі окремі варіанти реалізації без обмеження; і (іі) лікарський препарат – субстрат CDA, включаючи всі описані тут окремі варіанти реалізації без обмеження. Відповідно до деяких варіантів реалізації, суб'єкт є ссавцем. Відповідно до інших варіантів реалізації, суб'єкт є людиною. Відповідно до деяких варіантів реалізації, ракове захворювання обране з гематологічних ракових захворювань і солідних форм раку. Відповідно до інших варіантів реалізації, гематологічний рак обраний із групи, що включає МДС і лейкемію. Відповідно до інших варіантів реалізації, солідна форма раку обрана із групи: рак підшлункової залози, рак яєчника, перитонеальний рак, недрібноклітинний рак легень й рак 19 UA 99476 C2 5 10 15 20 25 30 35 40 45 50 55 60 молочної залози. Відповідно до наступних варіантів реалізації, лейкемія являє собою гострий мієлоїдний лейкоз (AML) або хронічний мієлоїдний лейкоз (CML). Інший аспект даного винаходу відноситься до способу інгібування деградації лікарського препарату – субстрату CDA під дією цитидиндеамінази, що включає введення ефективної кількості сполуки або фармацевтичної композиції відповідно до винаходу, включаючи всі описані тут окремі варіанти реалізації без обмеження, суб'єкту, який одержує лікування лікарським препаратом – субстратом CDA. "Лікарський препарат – субстрат CDA" включає без обмеження всі описані тут окремі варіанти реалізації без обмеження. Відповідно до деяких варіантів реалізації, суб'єкт є ссавцем. Відповідно до інших варіантів реалізації, суб'єкт є людиною. Можливе введення сполуки або композиції відповідно до винаходу будь-яким прийнятним шляхом, відомим фахівцям у даній галузі, наприклад, пероральним, парентеральним шляхом, інгаляцією розпиленої речовини, ректальним, назальним, букальним, вагінальним, інтраокулярним, інтрапульмонарним шляхом, через місцеве застосування або імплантований резервуар. Термін "парентеральний шлях" включає без обмеження введення шляхом підшкірної, внутрішньовенної, внутрім'язової, внутрічеревної, інтратекальної, інтравентрикулярної, інтрастернальної, інтракраніальної, ендостальної ін'єкції або шляхом інфузії. Будь-який режим введення, відомий фахівцям у даній галузі техніки, для регулювання часу й послідовності доставки ліків може бути використаний та повторений стільки разів, скільки буде необхідно для досягнення технічного результату в способах згідно із даним винаходом. Наприклад, сполуку або композицію відповідно до винаходу можна вводити 1, 2, 3 або 4 рази на добу, у виді одиничної дози, множинних дискретних доз або шляхом безперервної інфузії. Сполуку або композицію відповідно до винаходу можна вводити перед, після або одночасно із прийомом лікарського препарату – субстрату CDA. Режим введення можливо включає попередній прийом та/або спільне введення з, щонайменше, одним додатковим терапевтичним агентом. У цьому випадку, сполуку або композицію відповідно до винаходу, лікарський препарат – субстрат CDA й, щонайменше, один додатковий терапевтичний агент можна вводити одночасно, окремо, послідовно. Приклади режимів введення включають без обмеження: введення кожної сполуки, композиції, лікарського препарату – субстрату CDA та/або терапевтичного агента послідовно; і спільне введення кожної сполуки, композиції, лікарського препарату – субстрату CDA та/або терапевтичного агента, в основному, одночасно (напр., у виді одиничної дозованої форми) або у виді множинних, окремих стандартних дозованих форм для кожної сполуки, композиції, лікарського препарату – субстрату CDA та/або терапевтичного агента. Для фахівців у даній галузі очевидно, що "ефективна кількість" або "рівень дози" залежить від багатьох факторів, таких як шлях введення, режим введення, вибір сполуки або композиції, а також конкретного захворювання й стану пацієнта, якого лікують. Наприклад, призначений рівень дози може варіюватися залежно від активності, швидкості екскреції й можливої токсичності конкретної застосовуваної сполуки або композиції; віку, ваги, загального здоров'я, статі й дієти пацієнта, якого лікують; частоти введення доз; іншого терапевтичного агента (агентів), спільно введеного; а також типу й ступеня тяжкості захворювання. Згідно із даним винаходом рівні доз становлять приблизно від 0,001 до 10,000 мг/кг/доба. Відповідно до деяких варіантів реалізації, рівень дози становить приблизно від 0,1 до 1,000 мг/кг/доба. Відповідно до інших варіантів реалізації, рівень дози становить приблизно від 1 до 100 мг/кг/доба. Відповідно до інших варіантів реалізації, рівень дози становить приблизно від 1 до 50 мг/кг/доба. Відповідно до інших варіантів реалізації, рівень дози становить приблизно від 1 до 25 мг/кг/доба. Відповідні рівні дозування, спосіб введення й режим введення може уточнити фахівець у даній галузі, використовуючи відомі методики. Набори Інший аспект даного винаходу відноситься до набору, що включає, щонайменше, одну одиничну дозовану форму; дана одинична дозована форма включає сполуку або фармацевтичну композицію відповідно до винаходу. Крім того, набір може включати контейнер та/або упаковку, прийнятну для комерційного продажу. Контейнер, виготовлений з фармацевтично прийнятного матеріалу, може мати будьяку традиційну форму або вид, відомий фахівцям у даній галузі, такий як паперова або картонна коробка, скляна або пластикова пляшка або банка, повторно герметизований пакет або блістерупаковка з індивідуальними дозами, які вилучають з упаковки для прийому відповідно до терапевтичного режиму. Одна упаковка може містити більше одного контейнера одночасно. Наприклад, таблетки в блістер-упаковці можуть знаходитись в коробці. 20 UA 99476 C2 5 10 15 20 25 30 35 Крім того, набір може містити інформацію. Інформація може бути представлена на текстоносії. Текстоносій, можливо, включає етикетку. Інформація може бути звернена до лікаря, фармацевта або пацієнта. Інформація може містити вказівку на те, що одинична дозована форма здатна викликати один або декілька несприятливих побічних ефектів. Інформація може містити інструкції із введення одиничної дозованої форми, наприклад, описаний тут спосіб (режим) введення. Ці інструкції можна представляти в різних формах. Наприклад, інформація може включати таблицю, де зазначені вага або вагові інтервали й дози, що відповідають певній вазі або ваговому інтервалу. Інформація може додаватися до контейнера, наприклад: міститися на етикетці (напр., на сигнатурі або на окремій етикетці), приклеєної до контейнера; знаходитися всередині контейнера у виді вкладки з текстом; бути нанесеною безпосередньо на контейнер, наприклад, у виді тексту, надрукованого на стінці коробки або блістера-упаковки; або міститися в тексті, прив'язаному або прикріпленому, наприклад, на інструкції, прикріпленій до горлечка пляшки за допомогою мотузки, ліски або іншого типу шнура, або за допомогою пристосування типу кліпси або мотузки з петлею. Для фахівця в даній галузі очевидно, що часткові варіанти реалізації даного винаходу можливо відносяться до одного, декількох або до всіх вищезгаданих аспектів; точно так само інші аспекти можуть охоплювати один, декілька або всі варіанти реалізації, вищезгадані й нижченаведені, поряд з іншими варіантами реалізації. Відмінні від згаданих у робочих прикладах (або там, де зазначені інші) числа, що описують кількість інгредієнтів, умови реакції тощо, представлені в даному описі й формулі винаходу, варто розглядати з урахуванням поняття "приблизно". Відповідно, якщо не зазначене інше, ці числа є наближеними значеннями й можуть варіювати залежно від бажаних характеристик відповідно до мети даного винаходу. І нарешті, без наміру обмежити доктрини еквівалентів рамками винаходу, кожен чисельний параметр варто розглядати з огляду на кількість значимих цифр і звичайних методик округлення. У той час як числові інтервали й параметри, що встановлюють рамки даного винаходу, є приблизними, чисельні значення, представлені в робочих прикладах, дані з максимальною точністю. Будь-яке чисельне значення, тим не менше, по суті містить певні помилки, що виникають внаслідок стандартних відхилень відповідних вимірювальних приладів. Приклади Наступні приклади є ілюстративними й не обмежують даного винаходу. Синтез сполук Сполуку згідно із даним винаходом можна приготувати описаним тут способом та/або із застосуванням або адаптацією відомих методик. Для фахівця в даній галузі очевидно, що один або декілька реагентів, етапів та/або умов, зазначених у реакційних схемах, можливо, буде потрібно змінити для того, щоб ввести інші замісники при R1 й R2. Приклад 1. Схема 1. Синтез похідних дифтортетрагідроуридину (Сполуки 1а й 1b). 40 21 UA 99476 C2 5 10 2'2'-Дифтор-дигідро-уридин (DFDHU, 25). Гемцитабін 24 (3.0 г, 11.4 ммоль) розчинили в H 2O (50 мл). До розчину додали родій на окисі алюмінію (900 мг) і гідрогенізували суміш протягом ночі при 40 psi. Наступного дня суміш профільтрували, відігнали воду під вакуумом і знову розчинили утворену липку тверду речовину в H 2O. До розчину додали родій на окисі алюмінію (900 мг) і гідрогенізували суміш протягом ночі при 40 psi. Родій відфільтрували, фільтрат сконцентрували, у результаті одержали неочищену суміш дифтордигідроуридину (5, DFDHU) і ~10 % дифтортетрагідроуридину Ia й Ib (DFTHU). Одержану суміш очистили зворотнофазною ВЕРХ (HPLC) (зворотна фаза C 18 @ 5 % CH3CN/H2O), у результаті одержали 1.84 г (61 %, 14.5 хвилин) DFDHU 25 й 175 мг (17 %, Ia, 9.5 хвилин й Ib, 13.9 хв.) епімерів ДФТГУ. Абсолютну конфігурацію C-4 у сполуці Ia визначили за допомогою рентгенівської дифракції монокристалу; дані відповідають описаним в літературі прецедентам – кристалічним структурам цитидиндеамінази у комплексі з одним епімером тетрагідроуридину. 1 H ЯМР 5:6.00 (dd, IH), 4.20 (q, IH), 3.92-3.72 (m, 3H), 3.64 (m, IH), 3.43 (m, IH), 2.68 (t, 2H). 15 20 25 30 2'2'-Дифтор-тетрагідроуридин (ДФТГУ, Ia й Ib). DFDHU 25 (1.2 г, 4.9 ммоль) розчинили в 30 мл MeOH й охолодили до 0 °C. До розчину порціями додали борогідрид натрію (540 мг, 14.6 ммоль) і повільно нагрівали реакційну суміш до кімнатної температури. Після перемішування при кімнатній температурі протягом 4 годин видалили MeOH під вакуумом, а залишок розчинили в 15 мл H2O. Розчин нейтралізували додаванням 2.0 N HCl до pН 7. Потім розчин очистили за допомогою препаративної HPLC (зворотна фаза C18 @ 5 % CH3CN/H2O). Елюювання солей відбувається через 5.2 хв. Один пік з'являється через 7.5 хв. (12 %). Один епімер ДФТГУ Ia елюює через 9.5 хв. (350, 29 %). Інший епімер Ib елюює через 14.3 хв. (370 мг, 31 %). Деоксигенований продукт 26 елюює через 17 хвилин (200 мг, 17 %). 1 Ia HNMR (D2O, 9.5 хв.): 6.03 (dd, IH), 5.04 (bs, IH), 4.20 (q, IH), 3.90-3.71 (m, 3H), 3.53 (dt, IH), 3.30 (dt, IH), 1.92-1.75 (m, 2H). Розраховано для C9Hi4N2O5F2 (0.15 H2O): C, 39.90; H, 5.32; N, 10.34. Знайдено: C, 39.87; H, 5.41; N, 10.26. 1 Ib HNMR (D2O, 14.3 хв.): 5.97 (dd, IH), 5.03 (bt, IH), 4.16 (q, IH), 3.91-3.68 (m, 3H), 3.41 (dt, IH), 3.20 (dt, IH), 1.95-1.80 (m, 2H). Розраховано для C9Hi4N2O5F2 (0.60 H2O): C, 38.74; H, 5.49; N, 1 10.04. Знайдено: C, 38.55; H, 5.36; N, 9.87.26 H NMR (D2O) 5.99 (dd, J=15 Hz, 6 Hz, IH), 4.17 (m, IH), 3.89 (m, IH), 3.75 (m, 2H), 3.42 (m, IH), 3.21 (t, J=6 Hz, 2H), 3.18 (m, IH), 1.86 (m, 2H). Приклад 2: Схема 2. Синтез 2'(R)-фтор-2'деокси-тетрагідроуридинів (Сполуки 2a й 2b) 35 2'(R)-фтор-2'деокси-дигідроуридин [(R)-FDHU, 28]. 2’(R)-фтор-2'-деоксиуридин 27 (1.2 г, 4.9 ммоль) розчинили в H2O (30 мл) з декількома краплями концентрованого гідроксиду амонію (5 крапель). До розчину додали родій на окисі алюмінію (300 мг) і гідрогенізували суміш протягом 22 UA 99476 C2 5 10 15 20 25 ночі при 40 psi. Наступного дня суміш профільтрували, фільтрат сконцентрували й очистили за допомогою препаративної ВЕРХ (зворотна фаза C 18 @ 5 % CH3CN/H2O). Основний продукт 28, (R)-FDHU елюює через 9.2 хв. (780 мг, 64 %). Залишок вихідного матеріалу 7a (5.5 хв., 95 мг, 1 8 %) і малу кількість ФТГУ 2a й 2b (7.2 хв., 50 мг, 4 % й 8.6 хв., 45 мг, 4 %) відокремили. HNMR 28 (D2O): 5.83 (dd, IH), 5.07 (dd, IH), 4.18 (q, IH), 3.90-3.78 (m, 2H), 3.65 (dt, IH), 3.52-3.35 (m, 2H), 2.64 (t, 2H). 2'(R)-фтор-2'-деокси-тетрагідроуридин ((R)-Ф ТГУ, 2a й 2b). (R)-FDHU (600 мг, 2.4 ммоль) розчинили в 20 мл MeOH й охолодили до 0 °C. До розчину порціями додали борогідрид натрію (355 мг, 9.6 ммоль) і повільно нагрівали реакційну суміш до кімнатної температури протягом ночі. Видалили MeOH під вакуумом, а залишок розчинили в 10 мл H2O. Розчин нейтралізували 2.0 N HCl до pН 7. Потім розчин очистили за допомогою препаративної HPLC (зворотна фаза C18 @ 5 % CH3CN/H2O). Бажаний продукт 2a елюють через 7.2 хв. (275 мг, 46 %), потім елюють інший епімер 2b через 8.6 хв. (125 мг, 21 %), і через 9.2 хв. - залишковий вихідний матеріал і повністю відновлену речовину 29 (50 мг, 9 %) – через 14.9 хв. Стереохімічна структура у C-4 приписана 2a й 2b на основі описаних в літературі прецедентів – кристалічних структур цитидиндеамінази в комплексі з одним епімером тетрагідроуридину. 1 2a (7.2 хв.): HNMR (DMSO-J6): 7.21 (d, IH), 5.93 (dd, IH), 5.59 (d, IH), 5.39 (d, IH), 4.99-4.75 (m, 13 3H), 3.95 (m, IH), 3.62-3.21 (m, 5H), 1.69 (m, 2H); CNMR: 153.12, 91.2 (d), 85.93 (d), 81.36, 71.30, 68.3 (d), 60.43, 34.13, 28.66. Розраховано для C 9Hi5N2O5F (0.5 H2O): C, 41.70; H, 6.22; N, 10.81. Знайдено: C, 41.67; H, 6.26; N, 10.76. 1 2b (8.6 хв.): HNMR (DMSO-J6): 7.15 (d, IH), 5.95 (dd, IH), 5.58 (d, IH), 5.40 (d, IH), 5.00-4.75 (m, 13 3H), 3.92 (m, 2H), 3.61-3.29 (m, 5H), 2.98 (m, IH), 1.80-1.65 (m, 2H); CNMR: 154.02, 92.24 (d), 86.62 (d), 81.63, 71.73, 68.86 (d), 60.89, 35.08, 29.00. 1 29 (14.9 хв.): HNMR (D2O): 5.93 (dd, IH), 5.07 (d, IH), 4.61 (m, IH), 4.24 (m, IH), 3.96-3.65 (m, 3H), 3.35-3.14 (m, 3H), 2.12-1.79 (m, 2H). Приклад 3 Схема 3. Синтез 2'(S)-фтор-2'деокси-тетрагідроуридинів (Сполуки 3a й 3b) 30 2'(S)-фтор-2'деокси-дигідроуридин [(S)-FDHU, 31]. Сполуку 30 (1.2 г, 4.0 ммоль) розчинили в H2O (40 мл). До розчину додали родій на окисі алюмінію (200 мг) і гідрогенізували суміш 23 UA 99476 C2 5 10 15 20 25 30 35 40 45 протягом ночі при 50 psi. Наступного дня суміш профільтрували через шар целітів і сконцентрували під вакуумом. Бажаний продукт 31 одержали з кількісним виходом (>1.0 г). 1 HNMR (D2O): 6.08 (dd, IH), 5.09 (dt, IH), 4.28 (m, IH), 3.85-3.80 (m, 2H), 3.72 (m, 2H), 3.51 (m, IH), 2.65 (t, J=9 Hz, 2H). 2'(S)-фтор-2'деокси-тетрагідроуридин [(S)-ФТГУ, 3a й 3b]. Сполуку 31 (1.12 мг, 4.55 ммоль) розчинили в 28 мл MeOH й охолодили до 0 °C. До розчину порціями додали борогідрид натрію (475 мг, 12.55 ммоль) і залишили реакційну суміш для продовження реакції на 1 годину й 15 хв. MeOH видалили під вакуумом і розчинили залишок в 15 мл 5 % CH3CN/H2O. Розчин нейтралізували 2.0 N HCl до pН 7 (~3 мл). Потім розчин очистили за допомогою препаративної HPLC (зворотна фаза C18 Phenomenex Luna з 5 % CH3CN/H2O (ізократичний елюент і рефрактометричний детектор). Бажаний продукт 3a елюює через 9.3 хв. (163 мг, 14 %), потім був детектований інший епімер 3b через 13.4 хв. (236 мг, 21 %), залишковий вихідний матеріал (не визначений кількісно), а також повністю відновлений продукт 32 (не визначений кількісно). Стереохімічна структура в C-4 приписана 3a й 3b на основі описаних у літературі прецедентів – кристалічних структур цитидиндеамінази в комплексі з одним епімером тетрагідроуридину. 1 3a (9.3 хв.): HNMR (D2O) 6.12 (dd, IH), 5.04 (dt, IH), 5.03 (m, IH), 4.27 (m, IH), 3.83-3.59 (m, 13 4H), 3.34 (m, IH), 1.86 (m, 2H). CNMR: 157.9, 98.6 (d), 83.9 (d), 82.5, 75.7 (d), 74.0, 62.6, 37.5, 30.0. Розраховано для C9Hi5N2O5F (0.25 H2O): C, 42.44; H, 6.13; N, 11.00. Знайдено: C, 42.49; H, 1 6.09; N, 10.82. 3b (13.4 хв.): HNMR (D2O) 6.07 (dd, IH), 5.02 (dt, IH), 5.02 (t, IH), 4.26 (dt, IH), 13 3.84-3.66 (m, 4H), 3.35 (m, IH), 1.86 (m, 2H); CNMR: 157.8, 98.2 (d), 84.4, 82.0, 75.7, 74.0, 62.4, 38.4, 29.3. Розраховано для C9Hi5N2O5F (0.4 H2O): C, 41.96; H, 6.19; N, 10.87. Знайдено: C, 41.99; H, 6.15; N, 10.91. Приклад 4: Ферментативна активність CDA. Здатність сполук за винаходом інгібувати ферментативну активність CDA можна продемонструвати за допомогою наступного методу дослідження. Методика визначення ферментативної активності CDA основана на опублікованих методологічних підходах (наприклад, Cacciamani, T. et al., Arch. Biochem. Biophys. 1991, 290, 285-92; Cohen R. et al., J. Biol. Chem., 1971, 246, 7566-8; Vincenzetti S. et al, Protein Expr. Purif. 1996, 8, 247-53). В ході дослідження відслідковували зміни поглинання на 286 нм при каталізованому CDA деамінуванні цитидину з утворенням уридину. Реакцію проводять у калійфосфатному буфері (pН 7.4, 20 мМ, що містить 1 мМ DTT) у загальному об'ємі 200 мкл на 96лунковому планшеті. Кінцева реакційна суміш містить цитидин (50 мкМ) і очищену рекомбінантну CDA людини. Очищений фермент розбавляють, щоб забезпечити зміну величини поглинання приблизно на 2 мілі-оптичні одиниці/хв. Періодично виконують фонові вимірювання до додавання CDA для того, щоб переконатися у відсутності змін величин поглинання у відсутності CDA. Після додавання CDA проводять моніторинг змін величини поглинання протягом 20-30 хвилин. У присутності потенційних інгібіторів досліджують по вісім концентрацій кожного зразка в інтервалі 0,1-1 мМ для розрахунку величин IC50. Швидкість зміни величини поглинання в часі для зразків, що містять як цитидин, так й CDA, але не містять інгібітору (сумарна), приймають за 100 %. Ферментативну активність CDA у присутності сполуки, виражену у відсотках від сумарної активності, віднімають від 100 %, щоб одержати величину інгібування (у відсотках) при різних концентраціях сполуки. За результатами вищеописаного дослідження розрахували інгібуючий ефект Сполук 1 і 2. Величини IC50 представлені в Таблиці 1. "Ia" і "Ib" означають окремі стереоізомери; "1" означає суміш епімерів. Таблиця 1. Інгібуючий ефект тестованих сполук. 24 UA 99476 C2 Збільшення ефективності лікарських препаратів – субстратів CDA. Здатність сполук за винаходом до збільшення ефективності лікарських препаратів – субстратів CDA можна продемонструвати на моделі лімфоми L 1210 у мишей. 5 Приклад 5 Вплив інгібітору CDA, Сполуки 1, на виживаність мишей, що одержували децитабін (0,1 мг/кг), у моделі лімфоми Ll 210. 10 Методи Самок мишей 30 CD2F1 у віці 6-7 тижнів випадковим чином розділили на 6 груп: Група № 1 2 3 4 5 6 15 20 25 30 L1210 i.v. і носій + носій p.o.х 2 протягом 4 днів L1210 i.v. і носій + Сполука 1 10 мг/кг p.o.х 2 протягом 4 днів L1210 i.v. і носій + 0,1 мг/кг децитабіну p.o.х 2 протягом 4 днів L1210 i.v. і Сполука 1 1 мг/кг + 0.1 мг/кг децитабіну p.o.х 2 протягом 4 днів L1210 i.v. і Сполука 1 10 мг/кг + 0.1 мг/кг децитабіну p.o.х 2 протягом 4 днів L1210 i.v. і носій + 0.1 мг/кг децитабіну i.p.х 2 протягом 4 днів L1210 внутрішньовенна (i.v.) ін'єкція: Перед експериментом клітини L 1210 перевивали, щонайменше, 3 рази мишам-самкам CD2F1. За тиждень до умертвіння за допомогою CO 2 миші одержували інтраперитонеально (i.p.) ін'єкцію L1210 асцитичної рідини. Кожну мишу фіксували в положенні черевцем догори, протирали черевце тампоном, змоченим у спирті, і робили невеликий розріз для проникнення в черевну порожнину. У порожнину ввели 2 мл охолодженого на крижаній бані 2,1 % бичачого сироваткового альбуміну (BSA) у сольовому розчині. Рідину видалили з порожнини, за допомогою 18G 3 cc шприца перенесли в чисту стерильну пробірку й зберігають на льоду. Рідину розбавили 1:10 в 2.1 % BSA у сольовому розчині, додали до 2 мл розведеної асцитичної рідини й додали одну краплю Zap-o-globin™'а. Розведену асцитичну рідину (знову розведену 1:10) помістили в гемоцитометр і розрахували кількість клітин/мл. 4 Вихідний розчин асцитичної рідини в BSA розвели до 1 × 10 клітин/0.1 мл. Миші одержали ін'єкцію 0,1 мл клітинного розчину через голку 27G. Приготування розчину дозування: Підготовлені миші одержували дозу носія або Сполуки 1 p.o. за 30 хвилин до введення децитабіну. Приготували основний розчин децитабіну концентрації 1 мг/мл в PBS і розбавили відповідно для одержання розчину дозування концентрації 0,01 й 0,02 мг/мл. Схема дозування: Свіжий розчин децитабіну готували двічі на день. Всі розчини дозування під час дозування тримали на льоду. Миші одержували дози i.p. або перорально (p.o.) двічі на 25 UA 99476 C2 день (з інтервалом у 8 годин) протягом 4 наступних днів. Підсумкова схема дозування й сумарні дози децитабіну й Сполуки 1 представлені в Таблиці 2. Таблиця 2 Схема дозування Група Носій Сполука 1 Децитабін Децитабін/ Сполука 1 Децитабін/ Сполука 1 Децитабін 1 2 3 4 5 6 5 10 15 20 25 Ліки Доза децитабіну (шлях введення) Носій Носій 0,1 мг/кг p.o. Кумулятивна доза децитабіну 0 мг/кг 0 мг/кг 0,1 мг/кг p.o. Доза Сполуки 1 Кумулятивна доза Сполуки 1 Носій 10 мг/кг Носій 0 мг/кг 80 мг/кг 0 мг/кг 0,1 мг/кг p.o. 0,8 мг/кг 1 мг/кг 40 мг/кг 0,1 мг/кг p.o. 0,8 мг/кг 10 мг/кг 80 мг/кг 0,1 мг/кг i.p. 0,8 мг/кг Носій 0 мг/кг Виживаність й аутопсія: Виживаність мишей перевіряли щодня й проводили зважування (з понеділка по п'ятницю) протягом дослідження (30 днів). Проводили аутопсію померлих мишей і відзначали наявність пухлин в органах. Смерть пов'язували з наявністю пухлини, якщо вага печінки перевищувала 1,6 г і вага селезінки перевищувала 150 мг (згідно Covey et al., Eur. J. Cancer Oncol. 1985.) Миші, що одержували децитабін і децитабін + Сполуку 1, жили довше, ніж миші контрольної групи, що одержували тільки носій, або тільки Сполуку 1 (ФІГ.1 і Таблиця 3; p
ДивитисяДодаткова інформація
Назва патенту англійською2'-fluoro-2'-deoxytetrahydrouridines as cytidine deaminase inhibitors
Автори англійськоюHamilton, Gregory, S., Tsukamoto, Takashi, Ferraris, Dana, V., Duvall, Bridget, Lapidus, Rena
Назва патенту російською2'-фтор-2'-деокситетрагидроуридины как ингибиторы цитидиндеаминазы
Автори російськоюГамильтон Грегори С., Цукамото Такаши, Феррарис Дейна В., Дювалл Бриджет, Лапидус Рина
МПК / Мітки
МПК: A61K 31/706, C07H 19/04, A61P 35/00
Мітки: інгібітори, цитидиндеамінази, 2'-фтор-2'-деокситетрагідроуридини
Код посилання
<a href="https://ua.patents.su/56-99476-2-ftor-2-deoksitetragidrouridini-yak-ingibitori-citidindeaminazi.html" target="_blank" rel="follow" title="База патентів України">2′-фтор-2′-деокситетрагідроуридини як інгібітори цитидиндеамінази</a>
Попередній патент: Фармацевтична композиція з протизапальною та репаративною дією
Наступний патент: Уловлювач для вантажопідйомних механізмів
Випадковий патент: Спосіб моделювання хроноритмів кислотнорегулювальної функції нирок під впливом блокади синтезу монооксиду нітрогену