Поліциклічні похідні як агоністи gpr40 для лікування діабету та метаболічного синдрому та спосіб їх отримання
Номер патенту: 115975
Опубліковано: 25.01.2018
Автори: Жанг Лінг, Донг Квінг, Хан Джігуй, Ванг Янг, Янг Фанглонг, Ванг Чунфей
Формула / Реферат
1. Сполука формули (I) або її таутомер, мезомер, рацемат, енантіомер, діастереомер і суміш і її фармацевтично прийнятна сіль:
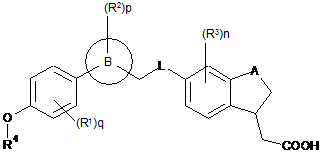 , (І)
, (І)
де:
A являє собою -O-;
L являє собою -O-;
кільце B являє собою феніл;
R1, R2 і R3 кожен незалежно вибирають з групи, яка складається з галогену, гідроксилу та алкілу, де алкіл є необов’язково заміщеним однією або більше групами, що вибирають з групи, яка складається з галогену та гідроксилу;
R4 вибирають з групи, яка складається з наступних циклоалкілу, гетероциклілу та гетероарилу:
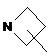 ,
, 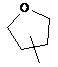 ,
, 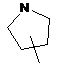 ,
, 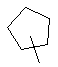 ,
, 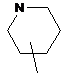 ,
,  ;
;
де циклоалкіл, гетероцикліл або гетероарил кожен необов’язково є заміщеним однією або більше групами, що вибирають з групи, яка складається з галогену, гідроксилу, ціано, нітро, алкілу, алкокси, циклоалкілу, гетероциклілу, арилу, гетероарилу, -C(O)OR5, -OC(O)R5, -C(O)R5, -NHC(O)R5, -NR6R7 та -S(O)mR5;
R5 вибирають з групи, яка складається з водню, алкілу, циклоалкілу, гетероциклілу, арилу і гетероарилу, де алкіл, циклоалкіл, гетероцикліл, арил або гетероарил кожен необов’язково заміщений однією або більше групами, що вибирають з групи, яка містить алкіл, галоген, гідроксил, ціано, алкокси, циклоалкіл, гетероцикліл, арил, гетероарил, карбоксил і алкоксикарбоніл;
R6 і R7 кожен незалежно вибирають з групи, що містить водень, алкіл, циклоалкіл, гетероцикліл, арил і гетероарил, де алкіл, циклоалкіл, гетероцикліл, арил або гетероарил кожен необов’язково заміщений однією або більше групами, що вибирають з групи, яка містить алкіл, галоген, гідроксил, алкокси, циклоалкіл, гетероцикліл, арил, гетероарил, карбоксил і алкоксикарбоніл;
m є 0, 1 або 2;
n є 0, 1, 2 або 3;
p є 0, 1, 2, 3 або 4; і
q є 0, 1, 2, 3 або 4.
2. Сполука формули (I) або її таутомер, мезомер, рацемат, енантіомер, діастереомер і суміш і її фармацевтично прийнятна сіль за пунктом 1, що вибирають з сполуки формули (II) або її таутомеру, мезомеру, рацемату, енантіомера, діастереомеру і суміші і її фармацевтично прийнятної солі:
 , (ІІ)
, (ІІ)
де A, L, R1~R4, n, p і q є такими, як визначено в пункті 1.
3. Сполука формули (I) або її таутомер, мезомер, рацемат, енантіомер, діастереомер і суміш і її фармацевтично прийнятна сіль за пунктом 1 або 2, де R1 вибирають з групи, що містить алкіл, галоген і гідроксіалкіл.
4. Сполука формули (I) або її таутомер, мезомер, рацемат, енантіомер, діастереомер і суміш і її фармацевтично прийнятна сіль за будь-яким одним з пунктів 1-3, де R2 вибирають з групи, що містить алкіл і галоген.
5. Сполука формули (I) або її таутомер, мезомер, рацемат, енантіомер, діастереомер і суміш і її фармацевтично прийнятна сіль за будь-яким одним з пунктів 1-4, де р є 0.
6. Сполука формули (I) або її таутомер, мезомер, рацемат, енантіомер, діастереомер і суміш і її фармацевтично прийнятна сіль за будь-яким одним з пунктів 1-5, де n є 0.
7. Сполука формули (I) або її таутомер, мезомер, рацемат, енантіомер, діастереомер і суміш і її фармацевтично прийнятна сіль за пунктом 2, що вибирають з сполуки формули (III) або її таутомеру, мезомеру, рацемату, енантіомера, діастереомеру і суміші і її фармацевтично прийнятної солі:
 , (ІІІ)
, (ІІІ)
де:
кільце E вибирають з групи, яка складається з наступних циклоалкілу, гетероциклілу та гетероарилу:
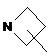 ,
, 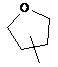 ,
, 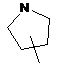 ,
,  ,
, 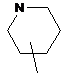 ,
,  ;
;
R1 вибирають з групи, що містить галоген, гідроксил та алкіл, де алкіл є необов’язково заміщеним однією або більше групами, що вибирають з групи, яка складається з галогену та гідроксилу;
R5 вибирають з групи, що містить водень, алкіл, циклоалкіл, гетероцикліл, арил і гетероарил, де алкіл, циклоалкіл, гетероцикліл, арил або гетероарил кожен необов’язково заміщений однією або більше групами, що вибирають з групи, яка містить алкіл, галоген, гідроксил, ціано, алкокси, циклоалкіл, гетероцикліл, арил, гетероарил, карбоксил і алкоксикарбоніл;
R6 і R7 кожен незалежно вибирають з групи, що містить водень, алкіл, циклоалкіл, гетероцикліл, арил і гетероарил, де алкіл, циклоалкіл, гетероцикліл, арил або гетероарил кожен необов’язково заміщений однією або більше групами, що вибирають з групи, яка містить алкіл, галоген, гідроксил, алкокси, циклоалкіл, гетероцикліл, арил, гетероарил, карбоксил і алкоксикарбоніл;
R8 вибирають з групи, що містить галоген, гідроксил, ціано, нітро, алкіл, алкокси, циклоалкіл, гетероцикліл, арил, гетероарил, -C(O)OR5, -OC(O)R5, -C(O)R5, -NHC(O)R5, -NR6R7 і -S(O)mR5;
m є 0, 1 або 2;
q є 0, 1, 2, 3 або 4; і
s є 0, 1, 2 або 3.
8. Сполука формули (I) або її таутомер, мезомер, рацемат, енантіомер, діастереомер і суміш і її фармацевтично прийнятна сіль за пунктом 7, що вибирають зі сполуки формули (IV) або її таутомеру, мезомеру, рацемату, енантіомера, діастереомеру і суміші і її фармацевтично прийнятної солі:
 , (IV)
, (IV)
де кільце E, R1, R8, s і q є такими, як визначено в пункті 7.
9. Сполука формули (I) або її таутомер, мезомер, рацемат, енантіомер, діастереомер і суміш і її фармацевтично прийнятна сіль за будь-яким одним з пунктів 1-8, де сполуку вибирають з групи, що містить:
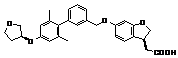 ,
, 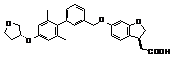 ,
, 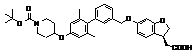 ,
,
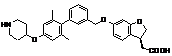 ,
, 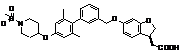 ,
, 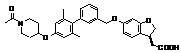 ,
,
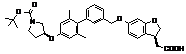 ,
, 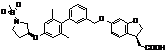 ,
, 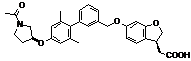 ,
,
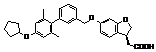 ,
, 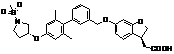 ,
, 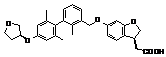 ,
,
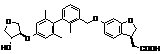 ,
, 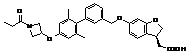 ,
, ![]() ,
,
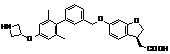 ,
, 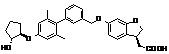 ,
, 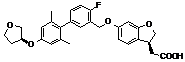 ,
,
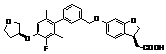 ,
, 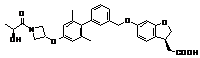 ,
, 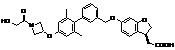 ,
,
 ,
,  ,
,  ,
,
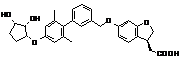 ,
, 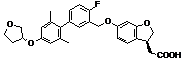 ,
, 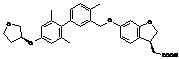 ,
,
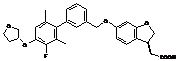 ,
, 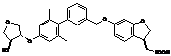 ,
, 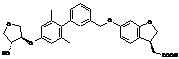 ,
,
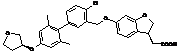 ,
, 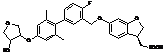 ,
, 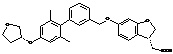 ,
, 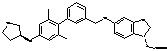 ,
, 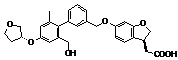 або
або 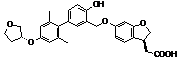 .
.
10. Сполука формули (IA):
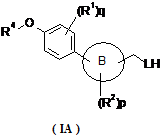 ,
,
де кільце B, L, R1, R2, p і q є такими, як визначено в пункті 1, та R4 є вибраним з наступних циклоалкілу та гетероциклілу: ![]() ,
, ![]() ,
, ![]() ,
, ![]() .
.
11. Спосіб одержання сполуки формули (I) або її таутомеру, мезомеру, рацемату, енантіомера, діастереомеру і суміші і її фармацевтично прийнятної солі за пунктом 1, що містить стадії:
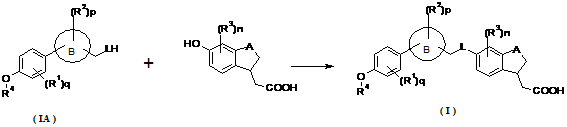
конденсації сполуки формули (IA) з гідроксилзаміщеною бензоциклічною сполукою в розчиннику з утворенням сполуки формули (I);
де кільце B, A, L, R1~R3, n, p і q є такими, як визначено в пункті 1, та R4 є таким, як визначено в пункті 10.
12. Сполука формули (IB):
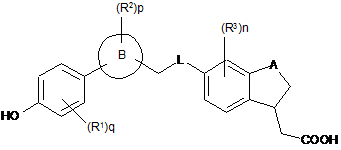 , (ІВ)
, (ІВ)
де кільце B, A, L, R1~R3, n та p є такими, як визначено в пункті 1, та q є 2, 3 або 4.
13. Спосіб одержання сполуки формули (I) або її таутомеру, мезомеру, рацемату, енантіомера, діастереомеру і суміші і її фармацевтично прийнятної солі за пунктом 1, що містить стадії:
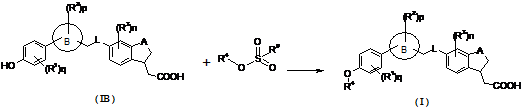
взаємодії сполуки формули (IB) і R4-заміщеного алкілсульфонату в розчиннику з утворенням сполуки формули (I);
де кільце B, A, L, R1~R4, n та p є такими, як визначено в пункті 1; q є 2, 3 або 4; і R9 є алкіл.
14. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки формули (I) або її таутомеру, мезомеру, рацемату, енантіомера, діастереомеру і суміші і її фармацевтично прийнятної солі за будь-яким одним з пунктів 1-9 і фармацевтично прийнятний носій.
15. Застосування сполуки формули (I) або її таутомеру, рацемату, енантіомера, діастереоізомеру і суміші і її фармацевтично прийнятної солі за будь-яким одним з пунктів 1-9 або фармацевтичної композиції за пунктом 14 в одержанні медикаменту, що регулює функціонування рецептора GPR40.
16. Застосування сполуки формули (I) або її таутомеру, рацемату, енантіомера, діастереоізомеру і суміші і її фармацевтично прийнятної солі за будь-яким одним з пунктів 1-9 або фармацевтичної композиції за пунктом 14 в одержанні медикаменту для профілактики і лікування діабету і метаболічного синдрому, переважно діабетом є діабет типу II.
17. Сполука формули (I) або її таутомер, мезомер, рацемат, енантіомер, діастереомер і суміш і її фармацевтично прийнятна сіль за будь-яким одним з пунктів 1-9 або фармацевтична композиція за пунктом 14 для використання як регулятора функціонування рецептора GPR40.
18. Спосіб регулювання рецептора GPR40, що містить стадію введення суб’єкту, що цього потребує, терапевтично ефективної кількості сполуки формули (I) або її таутомеру, мезомеру, рацемату, енантіомера, діастереомеру і суміші і її фармацевтично прийнятної солі за будь-яким одним з пунктів 1-9 або фармацевтичної композиції за пунктом 14.
19. Сполука формули (I) або її таутомер, мезомер, рацемат, енантіомер, діастереомер і суміш і її фармацевтично прийнятна сіль за будь-яким одним з пунктів 1-9 або фармацевтична композиція за пунктом 14 для використання як медикаменту для профілактики і лікування діабету і метаболічного синдрому.
20. Спосіб профілактики і лікування діабету і метаболічного синдрому, що містить стадію введення суб’єкту, що цього потребує, терапевтично ефективної кількості сполуки формули (I) або її таутомеру, мезомеру, рацемату, енантіомера, діастереомеру і суміші і її фармацевтично прийнятної солі за будь-яким одним з пунктів 1-9 або фармацевтичної композиції за пунктом 14.
21. Застосування сполуки формули (I) або її таутомеру, мезомеру, рацемату, енантіомера, діастереомеру і суміші і її фармацевтично прийнятної солі за будь-яким одним з пунктів 1-9 або фармацевтичної композиції за пунктом 14 в одержанні медикаменту, що є агоністом GPR40.
22. Сполука формули (I) або її таутомер, мезомер, рацемат, енантіомер, діастереомер і суміш і її фармацевтично прийнятна сіль за будь-яким одним з пунктів 1-9 або фармацевтична композиція за пунктом 14 для використання як агоніста GPR40.
23. Спосіб збудження рецептора GPR40, що включає стадію введення суб’єкту, що цього потребує, терапевтично ефективної кількості сполуки формули (I) або її таутомеру, мезомеру, рацемату, енантіомера, діастереомеру і суміші і її фармацевтично прийнятної солі за будь-яким одним з пунктів 1-9 або фармацевтичної композиції за пунктом 14.
Текст
Реферат: UA 115975 C2 (12) UA 115975 C2 Представлений винахід описує поліциклічні похідні, що представлені загальною формулою (І), спосіб їх одержання, фармацевтичні композиції, що містять похідні, і їх застосування як терапевтичних агентів, особливо агоністів GPR40, і при одержанні лікарських засобів для лікування захворювань, таких як діабет і метаболічні розлади і т. і., де кожен замісник в загальній формулі (І) має таке ж саме значення, як в описі. (R2)p (R3)n B O R L A (R1)q 4 COOH (І) UA 115975 C2 5 10 15 20 25 30 35 40 45 50 55 Галузь винаходу Цей опис стосується нових поліциклічних похідних, способів одержання, фармацевтичних композицій, що їх містять, і їх застосування як терапевтичного агента, зокрема, як агоніста GPR40 і при одержанні медикаменту для лікування діабету, метаболічного синдрому і т.і… Передумови створення винаходу Діабет типу II також відомий як неінсулінзалежний цукровий діабет або діабет повнолітніх, в основному проявляється в недостатній секреції інсуліну у пацієнтів або тіло не може ефективно використовувати інсулін (а саме резистентність до інсуліну). Донедавна в світі налічувалось приблизно 185 мільйони діабетиків, з яких діабет типу II мають приблизно 90-95 % всіх пацієнтів на діабет, і цей показник збільшується на 6 % щорічно. В 2010, смертність від діабету типу II досягла приблизно 9,7 % дорослих китайців віком понад 20 років. Донедавна, лікування діабету типу II включало: агенти, що стимулюють секретування інсуліну, такі як сульфонілсечовини, що промотують панкреатичні β клітини продукувати більше інсуліну; протидіабетичні агенти, такі як метформін, що зменшує утворення глюкози у печінці; рецептор, що активується проліфератором пероксисом-γ (PPAR-γ), такі як тіазолідиндіони, що поліпшують чутливість до інсуліну і збільшують біодоступність інсуліну; і інгібітори αглюкозидази, що перешкоджають продукуванню глюкози. Однак, існуючі способи лікування мають деякі недоліки. Наприклад, сульфонілсечовини і ін'єкції інсуліну можна пов'язати з випадками гіпоглікемії і збільшенням ваги. Крім того, пацієнти часто втрачають відповідь на сульфонілсечовини з часом і набувають толерантності. Метформін і інгібітори α-глюкозидази часто призводять до проблем з гастроінтестинальним трактом, а агоністи PPAR-γ мають тенденцію викликати набір ваги і едему. Дослідники спрямували свої зусилля в декілька напрямків для того щоб винайти нові, більш ефективні протидіабетичні лікарські засоби для ринку. Наприклад, винахідники цього винаходу досліджують шляхи зменшення надмірного продукування печінкової глюкози, збільшити трансдукцію сигнального шляху інсулін-викликаного повторного захоплення глюкози, поліпшити глюкоза-стимульовану секрецію інсуліну (GSIS) в панкреатичних β клітинах, і досліджують ожиріння і метаболізм жиру, ненормальне акумулювання і т.і… Вільні жирні кислоти (FFA) відіграють ключову роль в декількох аспектах метаболізму, наприклад, вони є "запалом", що підвищує інсулін в панкреатичних β клітинах у відповідь на глюкозу у стані насичення і вони є вихідними точками для ліпогенезу. Спочатку, GPR40 знайшли у формі єдиного рецептора в геномі людини. GPR40 експресується з високими рівнями в панкреатичних β клітинах і інсулін-серетуючих лініях клітин. GPR40, також відомий як рецептор жирної кислоти 1 (FFAR1), є представником генної суперродини G-протеїн зв'язаних рецепторів ("GPCR"). GPCR є представниками протеїнів, що мають сім трансмембранних доменів, і можуть відповідати на різні молекули, таким чином, активуючи внутрішньо молекулярні шляхи передачі сигналу, і є критичними для досягнення різних фізіологічних функцій. Активація GPR40 пов'язана з регулюванням Gq родини внутрішньо клітинних сигнальних протеїнів і супроводжується підвищенням рівнів іонів кальцію. GPR40 був першим ідентифікованим рецептором жирної кислоти на поверхні клітини, здатним зв'язувати більшість звичайних жирних кислот в плазмі, таких як пальмітат, олеат, стеарат, лінолеат і ліноленат і т.і… GPR40 може вважатись "поживночутливим' рецептором, що відіграє декілька тканинозалежних ролей, що можуть впливати на загальну використання глюкози і/або метаболізм жиру. Наприклад, довголанцюгові FFA збільшують GSIS в панкреатичних β клітинах через активацію GPR40. Регулятори GPR40 приймають участь інкреції, що стимулює GSIS, однак, вони також можуть бути об'єднані з різними протидіабетичними лікарськими засобами. Базуючись на викладеному вище, агоністи GPR40 можуть бути використані для лікування діабету і пов'язаних станів, зокрема, діабету типу II, ожиріння, зниження толерантності до глюкози, резистентності до інсуліну, метаболічного синдрому X, гіперліпідемії, гіперхолестеролемії, атеросклерозу, нейродегенеративних розладів (наприклад, хвороба Альцгеймера) і інші показання, такі як інсульт. Беручи GPR40 як потенційну терапевтичну ціль, сполука, що знаходить і модифікує GPR40, має дужу важливу дослідницьку цінність і перспективність. На сьогодні, в деяких заявках на патенти було описано ряд агоністів GPR40, таких як WO2005087710, WO2005051890 і WO2004106276 і т.і… Однак, хоча на сьогодні був описаний ряд агоністів GPR40 для лікування розладів, таких як діабет і метаболічний синдром X і т.і., все ще існує потреба в розробці нових сполук з більшою активністю. Після тривалих пошуків, представлений опис забезпечує сполуки формули (I) і відкриття, що ці сполуки мають такі структури, що проявляють кращу ефективність і функції. Короткий опис винаходу 1 UA 115975 C2 Представлений опис забезпечує сполуку формули (I) і або її таутомер, мезомер, рацемат, енантіомер, діастереомер і суміш і її фармацевтично прийнятну сіль, також як і метаболіти, метаболічні попередники або їх проліки. 2 (R )p 3 (R )n L B O 4 R A 1 (R )q COOH (I) 5 10 15 20 25 30 35 40 де: A вибирають з групи, що містить -O-, -CH2- і -CH2CH2-; L вибирають з групи, що містить O- і -NH-; кільце B вибирають з групи, що містить арил і гетероарил; 1 2 3 R , R і R кожен незалежно вибирають з групи, що містить галоген, гідроксил, ціано, нітро, 5 5 5 алкіл, алкокси, циклоалкіл, гетероцикліл, арил, гетероарил, -C(O)OR , -OC(O)R , -C(O)R , 5 6 7 5 NHC(O)R , -NR R і -S(O)mR , де алкіл, алкокси, циклоалкіл, гетероцикліл, арил або гетероарил кожен необов'язково заміщений однією або більше груп, що вибирають з групи, яка містить галоген, гідроксил, ціано, нітро, алкіл, алкокси, циклоалкіл, гетероцикліл, арил, гетероарил, 5 5 5 5 6 7 5 C(O)OR , -OC(O)R , -C(O)R , -NHC(O)R , -NR R і -S(O)mR ; 4 R вибирають з групи, що містить циклоалкіл, гетероцикліл, арил і гетероарил, де циклоалкіл, гетероцикліл, арил або гетероарил кожен необов'язково заміщений однією або більше груп, що вибирають з групи, яка містить галоген, гідроксил, ціано, нітро, алкіл, алкокси, 5 5 5 5 6 7 циклоалкіл, гетероцикліл, арил, гетероарил, -C(O)OR , -OC(O)R , -C(O)R , -NHC(O)R , -NR R і 5 S(O)mR ; 5 R вибирають з групи, що містить водень, алкіл, циклоалкіл, гетероцикліл, арил і гетероарил, де алкіл, циклоалкіл, гетероцикліл, арил або гетероарил кожен необов'язково заміщений однією або більше груп, що вибирають з групи, яка містить алкіл, галоген, гідроксил, ціано, алкокси, циклоалкіл, гетероцикліл, арил, гетероарил, карбоксил і алкоксикарбоніл; 6 7 R і R кожен незалежно вибирають з групи, що містить водень, алкіл, циклоалкіл, гетероцикліл, арил і гетероарил, де алкіл, циклоалкіл, гетероцикліл, арил або гетероарил кожен необов'язково заміщений однією або більше груп, що вибирають з групи, яка містить алкіл, галоген, гідроксил, алкокси, циклоалкіл, гетероцикліл, арил, гетероарил, карбоксил і алкоксикарбоніл; m є 0, 1 або 2; n є 0, 1, 2 або 3; p є 0, 1, 2, 3 або 4; і q є 0, 1, 2, 3 або 4; 1 4 за умови, що: коли p і n є 0, q є 2, R є метил, A є -O-, і R є гетероцикліл, гетероцикліл не містить атом S. У втіленні винаходу, сполуку формули (I) або її таутомер, мезомер, рацемат, енантіомер, діастереомер і суміш і її фармацевтично прийнятну сіль, де кільцем B є арил, переважно феніл. В іншому втіленні винаходу, сполуку формули (I) або її таутомер, мезомер, рацемат, енантіомер, діастереомер і суміш і її фармацевтично прийнятну сіль, вибирають з сполуки формули (II) або її таутомеру, рацемату, енантіомеру, діастереомеру і суміші і її фармацевтично прийнятної солі: 2 (R )p 3 (R )n L O 4 R A 1 (R )q COOH ( II ) 1 45 4 де A, L, R ~R , n, p і q є визначеними у формулі (I). В іншому втіленні винаходу, сполуку формули (I) або формули (II) або її таутомер, мезомер, рацемат, енантіомер, діастереомер і суміш і її фармацевтично прийнятну сіль, де L є -O-. В іншому втіленні винаходу, сполуку формули (I) або формули (II) або її таутомер, мезомер, 1 рацемат, енантіомер, діастереомер і суміш і її фармацевтично прийнятну сіль, де R вибирають з групи, що містить алкіл, галоген і гідроксиалкіл. 2 UA 115975 C2 5 10 15 В іншому втіленні винаходу, сполуку формули (I) або формули (II) або її таутомер, мезомер, 2 рацемат, енантіомер, діастереомер і суміш і її фармацевтично прийнятну сіль, де R вибирають з групи, що містить водень, алкіл і галоген. В іншому втіленні винаходу, сполуку формули (I) або формули (II) або її таутомер, мезомер, 3 рацемат, енантіомер, діастереомер і суміш і її фармацевтично прийнятну сіль, де R є водень. В іншому втіленні винаходу, сполуку формули (I) або формули (II) або її таутомер, мезомер, 4 рацемат, енантіомер, діастереомер і суміш і її фармацевтично прийнятну сіль, де R вибирають з групи, що містить циклоалкіл, гетероцикліл і гетероарил, де циклоалкіл або гетероцикліл кожен необов'язково заміщений однією або більше груп, що вибирають з групи, яка містить галоген, гідроксил, ціано, нітро, алкіл, алкокси, циклоалкіл, гетероцикліл, арил, гетероарил, 5 5 5 5 6 7 5 5 6 7 C(O)OR , -OC(O)R , -C(O)R , -NHC(O)R , -NR R і -S(O)mR ; і R , R , R і m є визначеними у формулі (I). В іншому втіленні винаходу, сполуку формули (I) або формули (II) або її таутомер, мезомер, 4 рацемат, енантіомер, діастереомер і суміш і її фармацевтично прийнятну сіль, де R вибирають з групи, що містить наступні циклоалкіл, гетероцикліл і гетероарил: O N N N N 20 ; де циклоалкіл, гетероцикліл або гетероарил кожен необов'язково заміщений однією або 5 більше груп, що вибирають з групи, яка містить галоген, гідроксил, алкіл, алкокси, -C(O)OR , 5 5 5 6 7 5 5 6 7 OC(O)R , -C(O)R , -NHC(O)R , -NR R і -S(O)mR ; і R , R , R і m є визначеними у формулі (I). Крім того, в іншому втіленні винаходу, сполука формули (II) або її таутомер, мезомер, рацемат, енантіомер, діастереомер і суміш і її фармацевтично прийнятну сіль, вибирають з сполуки формули (III) або її таутомеру, мезомеру, рацемату, енантіомеру, діастереомеру і суміші і її фармацевтично прийнятної солі: O O 8 (R )s O E 1 (R )q COOH ( III ) 25 30 35 40 45 50 де: кільце E вибирають з групи, що містить циклоалкіл, гетероцикліл і гетероарил; 1 R вибирають з групи, що містить галоген, гідроксил, ціано, нітро, алкіл, алкокси, циклоалкіл, 5 5 5 5 6 7 5 гетероцикліл, арил, гетероарил, -C(O)OR , -OC(O)R , -C(O)R , -NHC(O)R , -NR R і -S(O)mR , де алкіл, циклоалкіл, алкокси, гетероцикліл, арил або гетероарил кожен необов'язково заміщений однією або більше груп, що вибирають з групи, яка містить галоген, гідроксил, ціано, нітро, 5 5 5 алкіл, алкокси, циклоалкіл, гетероцикліл, арил, гетероарил, -C(O)OR , -OC(O)R , -C(O)R , 5 6 7 5 NHC(O)R , -NR R і -S(O)mR ; 5 R вибирають з групи, що містить водень, алкіл, циклоалкіл, гетероцикліл, арил і гетероарил, де алкіл, циклоалкіл, гетероцикліл, арил або гетероарил кожен необов'язково заміщений однією або більше груп, що вибирають з групи, яка містить алкіл, галоген, гідроксил, ціано, алкокси, циклоалкіл, гетероцикліл, арил, гетероарил, карбоксил і алкоксикарбоніл; 6 7 R і R кожен незалежно вибирають з групи, що містить водень, алкіл, циклоалкіл, гетероцикліл, арил і гетероарил, де алкіл, циклоалкіл, гетероцикліл, арил або гетероарил кожен необов'язково заміщений однією або більше груп, що вибирають з групи, яка містить алкіл, галоген, гідроксил, алкокси, циклоалкіл, гетероцикліл, арил, гетероарил, карбоксил і алкоксикарбоніл; 8 R вибирають з групи, що містить галоген, гідроксил, ціано, нітро, алкіл, алкокси, циклоалкіл, 5 5 5 5 6 7 5 гетероцикліл, арил, гетероарил, -C(O)OR , -OC(O)R , -C(O)R , -NHC(O)R , -NR R і -S(O)mR ; m є 0, 1 або 2; q є 0, 1, 2, 3 або 4; і s є 0, 1, 2 або 3; 1 за умови, що: коли q є 2, R є метил, E є гетероцикліл, гетероцикліл не містить атом S. В іншому втіленні винаходу, сполуку формули (III) або її таутомер, мезомер, рацемат, енантіомер, діастереомер і суміш і її фармацевтично прийнятну сіль, де кільце E вибирають з групи, що містить наступні циклоалкіл, гетероцикліл і гетероарил: 3 UA 115975 C2 O N N N N 5 ; де циклоалкіл, гетероцикліл або гетероарил кожен необов'язково заміщений однією або 5 більше груп, що вибирають з групи, яка містить галоген, гідроксил, алкіл, алкокси, -C(O)OR , 5 5 5 6 7 5 5 6 7 OC(O)R , -C(O)R , -NHC(O)R , -NR R і -S(O)mR ; і R , R , R і m є визначеними у формулі (III). Крім того, в іншому втіленні винаходу, сполуку формули (III) або її таутомер, мезомер, рацемат, енантіомер, діастереомери і суміш і її фармацевтично прийнятну сіль, вибирають з сполуки формули (IV) або її таутомеру, мезомеру, рацемату, енантіомеру, діастереомеру і суміші і її фармацевтично прийнятної солі: O O 8 (R )s O 1 (R )q E COOH ( IV ) 10 1 8 де E, R , R , s і q є визначеними у формулі (III). Сполука формули (I) представленого опису переважно включає, але не обмежується: приклад № Структура і назва O O O O 1 COOH 2-((S)-6-((2',6'-диметил-4'-(((S)-тетрагідрофуран-3-іл)окси)біфеніл- 3-іл)метокси)-2,3дигідробензофуран-3-іл)оцтова кислота O O O O 2 COOH 2-((S)-6-((2',6'-диметил-4'-(((R)-тетрагідрофуран-3-іл)окси)біфеніл- 3-іл)метокси)-2,3дигідробензофуран-3-іл)оцтова кислота O O O N O O 3 COOH (S)-2-(6-((4'-((1-(трет-бутоксикарбоніл)піперидин-4-іл)окси)-2',6'- диметилбіфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота O HN O O 4 COOH (S)-2-(6-((2',6'-диметил-4'-(піперидин-4-ілокси)біфеніл- 3-іл)метокси)-2,3дигідробензофуран-3-іл)оцтова кислота O O S O N O O 5 COOH (S)-2-(6-((2',6'-диметил-4'-((1-(метилсульфоніл)піперидин-4- іл)окси)біфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота O O N O O 6 COOH (S)-2-(6-((4'-((1-ацетилпіперидин-4-іл)окси)-2',6'-диметилбіфеніл-3-іл) метокси)-2,3дигідробензофуран-3-іл)оцтова кислота O O 7 O N O O COOH 4 UA 115975 C2 приклад № Структура і назва 2-((S)-6-((4'-(((S)-1-(трет-бутоксикарбоніл)піролідин-3-іл)окси)-2',6'- диметилбіфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота O O S N O O O 8 COOH 2-((S)-6-((2',6'-диметил-4'-(((S)-1-(метилсульфоніл)піролідин-3-іл)окси) біфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота O O N O O 9 COOH 2-((S)-6-((4'-(((S)-1-ацетилпіролідин-3-іл)окси)-2',6'-диметилбіфеніл- 3-іл)метокси)-2,3дигідробензофуран-3-іл)оцтова кислота O O O 10 COOH (S)-2-(6-((4'-(циклопентилокси)-2',6'-диметилбіфеніл-3-іл)метокси)- 2,3дигідробензофуран-3-іл)оцтова кислота O O S N O O O 11 COOH 2-((S)-6-((2',6'-диметил-4'-(((R)-1-(метилсульфоніл)піролідин-3- іл)окси)біфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота O O O O 12 COOH 2-((S)-6-((2,2',6'-триметил-4'-(((S)-тетрагідрофуран-3-іл)окси)біфеніл- 3-іл)метокси)-2,3дигідробензофуран-3-іл)оцтова кислота O O 13 O O і її енантіомер 2-((S)-6-((4'-(((3R, 4R)/(3S, 4S)-4-гідрокситетрагідрофуран-3-іл)окси)-2',6'диметилбіфеніл-3-іл)метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота HO COOH O O O N 14 O COOH (S)-2-(6-((2',6'-диметил-4'-((1-пропіонілазетидин-3-іл)окси)біфеніл- 3-іл)метокси)-2,3дигідробензофуран-3-іл)оцтова кислота O O O N 15 O COOH (S)-2-(6-((4'-((1-(циклопропанкарбоніл)азетидин-3-іл)окси)-2',6'- диметилбіфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота O HN 16 O O COOH (S)-2-(6-((4'-(азетидин-3-ілокси)-2',6'-диметилбіфеніл-3-іл)метокси)-2,3дигідробензофуран-3-іл)оцтова кислота 5 UA 115975 C2 приклад № Структура і назва O 17 O O HO COOH 2-((S)-6-((4'-((1R, 2R)/(1S, 2S)-2-гідроксициклопентил))-2',6'- диметилбіфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота F O O 18 O O COOH 2-((S)-6-((4-фтор-2',6'-диметил-4'-(((S)-тетрагідрофуран-3- іл)окси)біфеніл-3-іл)метокси)2,3-дигідробензофуран-3-іл)оцтова кислота O O 19 O O COOH F 2-((S)-6-((3'-фтор-2',6'-диметил-4'-(((S)-тетрагідрофуран-3-іл)окси) біфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота O O N OH 20 O O COOH 2-((S)-6-((4'-((1-((S)-2-гідроксипропаноїл)азетидин-3-іл)окси)-2',6'- диметилбіфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота O O HO N O O 21 COOH (S)-2-(6-((4'-((1-(2-гідроксиацетил)азетидин-3-іл)окси)-2',6'- диметилбіфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота O O N HO 22 O O COOH 2-((S)-6-((4'-((1-((S)-2-гідроксипропаноїл)піперидин-4-іл)окси)-2',6'- диметилбіфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота O O O N 23 O O COOH (S)-2-(6-((4'-((1-(метоксикарбоніл)піперидин-4-іл)окси)-2',6'- диметилбіфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота O O S O O 24 N O COOH (S)-2-(6-((2',6'-диметил-4'-((5-(метилсульфоніл)піридин-2-іл)окси)біфеніл-3-іл)метокси)2,3-дигідробензофуран-3-іл)оцтова кислота HO 25 OH O O O COOH 2-((S)-6-((4'-(((1R, 2S, 3S)-2,3-дигідроксициклопентил)окси)-2',6'- диметилбіфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота 6 UA 115975 C2 приклад № Структура і назва F O O 26 O O COOH 2-((S)-6-((4-фтор-2',6'-диметил-4'-(((R)-тетрагідрофуран-3-іл)окси) біфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота O O 27 O O COOH 2-((S)-6-((2',4,6'-триметил-4'-(((S)-тетрагідрофуран-3-іл)окси)біфеніл-3-іл)метокси)-2,3дигідробензофуран-3-іл)оцтова кислота O O 28 O O F COOH 2-((S)-6-((3'-фтор-2',6'-диметил-4'-(((R)-тетрагідрофуран-3-іл)окси) біфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота O O 29 O O HO COOH 2-((S)-6-((4'-(((3S, 4S)-4-гідрокситетрагідрофуран-3-іл)окси)-2',6'- диметилбіфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота O O 30 O O HO COOH 2-((S)-6-((4'-(((3R, 4R)-4-гідрокситетрагідрофуран-3-іл)окси)-2',6'- диметилбіфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота Cl O O O 31 COOH O 2-((S)-6-((4-хлор-2',6'-диметил-4'-(((S)-тетрагідрофуран-3-іл)окси)біфеніл-3-іл)метокси)2,3-дигідробензофуран-3-іл)оцтова кислота F O O O 32 O COOH HO 2-((3S)-6-((4-фтор-4'-((4-гідрокситетрагідрофуран-3-іл)окси)-2',6'- диметилбіфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота O O O 33 O COOH 2-((R)-6-((2',6'-диметил-4'-(((R)-тетрагідрофуран-3-іл)окси)біфеніл-3-іл)- метокси)-2,3дигідробензофуран-3-іл)оцтова кислота O O O 34 O COOH 2-((R)-6-((2',6'-диметил-4'-(((S)-тетрагідрофуран-3-іл)окси)біфеніл-3-іл)- метокси)-2,3дигідробензофуран-3-іл)оцтова кислота 7 UA 115975 C2 приклад № Структура і назва O O O O 35 OH COOH 2-((S)-6-((2'-(гідроксиметил)-6'-метил-4'-(((R)-тетрагідрофуран-3-іл)окси)- біфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота OH O O O O 36 COOH 2-((S)-6-((4-гідрокси-2',6'-диметил-4'-(((R)-тетрагідрофуран-3-іл)окси) біфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота 5 або її таутомер, мезомер, рацемат, енантіомер, діастереоізомер і суміш і її фармацевтично прийнятну сіль. Представлений опис стосується сполуки формули (IA) як проміжних сполук в синтезі сполуки формули (I) або її таутомеру, мезомеру, рацемату, енантіомеру, діастереоізомеру і суміші і її фармацевтично прийнятної солі: 1 (R )q 4 R O B L 2 (R )p ( IA ) 1 10 2 4 де кільце B, L, R , R , R , p і q є визначеними у формулі (I). Представлений опис стосується способу одержання сполуки формули (I) або її таутомеру, мезомеру, рацемату, енантіомеру, діастереоізомеру і суміші і її фармацевтично прийнятної солі, що містить стадії: 2 2 (R )p (R )p 3 3 (R )n L B O 4 R HO (R )n A O 4 R 1 (R )q COOH A 1 (R )q COOH (I) ( IA ) 15 L B + конденсацію сполуки формули (IA) з гідроксил-заміщеною бензоциклічною сполукою в розчиннику; необов'язково, додаткове проведення гідролізу естеру в основному середовищі з утворенням сполуки формули (I); лужне середовище забезпечується за допомогою гідроксиду лужного металу, переважно, гідроксид натрію або гідроксид калію; 1 4 де кільце B, A, L, R ~R , n, p і q є визначеними у формулі (I). Представлений опис стосується сполуки формули (IB): 2 (R )p 3 (R )n B HO L A 1 (R )q COOH ( IB ) 20 1 3 де кільце B, A, L, R ~R , n, p і q є визначеними у формулі (I). Представлений опис стосується способу одержання сполуки формули (I) або її таутомеру, мезомеру, рацемату, енантіомеру, діастереоізомеру і суміші і її фармацевтично прийнятної солі, що містить стадії: 8 UA 115975 C2 2 (R )p 2 (R )p 3 (R )n B HO L 3 O A + 1 (R )q (R )n 9 R 4 R O O ( IB ) 15 20 25 30 35 40 45 50 O 4 R 1 (R )q COOH (I) 4 10 A S COOH 5 L B взаємодію сполуки формули (IB) і R -заміщеного алкілсульфонату в розчиннику, необов'язково, додаткове проведення гідролізу естеру в основному середовищі з утворенням сполуки формули (I); лужне середовище забезпечується за допомогою гідроксиду лужного металу, переважно, гідроксид натрію або гідроксид калію; 1 4 9 де кільце B, A, L, R ~R , n, p і q є визначеними у формулі (I), і R є алкіл, переважно метил. Крім того, в іншому аспекті, представлений опис стосується фармацевтичної композиції, що містить терапевтично ефективну кількість сполуки формули (I) або її таутомер, мезомер, рацемат, енантіомер, діастереомер і суміш і її фармацевтично прийнятну сіль або її пролікарську форму і фармацевтично прийнятний носій або ексціпієнт. В ще одному іншому аспекті, представлений опис також стосується застосування сполуки формули (I) або її таутомеру, мезомеру, рацемату, енантіомеру, діастереоізомеру і суміші і її фармацевтично прийнятної солі або фармацевтичної композиції, що її містить, при одержанні медикаменту як регулятора GPR40 рецептора. В ще одному іншому аспекті, представлений опис стосується сполуки формули (I) або її таутомеру, мезомеру, рацемату, енантіомеру, діастереомеру і суміші і її фармацевтично прийнятної солі або фармацевтичної композиції, що її містить, для використання як регулятора GPR40 рецептора. В ще одному іншому аспекті, представлений опис стосується способу регулювання GPR40 рецептора, що містить стадію введення суб'єкту, що цього потребує, терапевтично ефективної кількості сполуки формули (I) або її таутомеру, мезомеру, рацемату, енантіомеру, діастереомеру і суміші і її фармацевтично прийнятної солі або фармацевтичної композиції, що її містить. Представлений опис стосується застосування сполуки формули (I) або її таутомеру, мезомеру, рацемату, енантіомеру, діастереоізомеру і суміші і її фармацевтично прийнятної солі або фармацевтичної композиції, що її містить, при одержанні медикаменту як агоніста GPR40. В ще одному іншому аспекті, представлений опис стосується сполуки формули (I) або її таутомеру, мезомеру, рацемату, енантіомеру, діастереомеру і суміші і її фармацевтично прийнятної солі або фармацевтичної композиції, що її містить, для використання як агоніста GPR40. В ще одному іншому аспекті, представлений опис стосується способу збудження рецептора GPR40, що містить стадію введення суб'єкту, що цього потребує, терапевтично ефективної кількості сполуки формули (I) або її таутомеру, мезомеру, рацемату, енантіомеру, діастереомеру і суміші і її фармацевтично прийнятної солі або фармацевтичної композиції, що її містить. Представлений опис також стосується застосування сполуки формули (I), або її таутомеру, мезомеру, рацемату, енантіомеру, діастереомеру і суміші і її фармацевтично прийнятної солі або фармацевтичної композиції, що її містить, при одержанні медикаменту для лікування діабету і метаболічного синдрому, переважно, діабетом є діабет типу II. В ще одному іншому аспекті, представлений опис стосується способу профілактики і лікування діабету і метаболічного синдрому, що містить стадію введення суб'єкту, що цього потрeбує, терапевтично ефективної кількості сполуки формули (I) або її таутомеру, мезомеру, рацемату, енантіомеру, діастереомеру і суміші і її фармацевтично прийнятної солі або фармацевтичної композиції, що її містить, переважно, діабетом є діабет типу II. В ще одному іншому аспекті, представлений опис стосується сполуки формули (I), або її таутомеру, мезомеру, рацемату, енантіомеру, діастереомеру і суміші і її фармацевтично прийнятної солі або фармацевтичної композиції, що її містить, для використання як медикаменту для профілактики і лікування діабету і метаболічного синдрому, переважно, діабетом є діабет типу II. В ще одному іншому аспекті, представлений опис стосується способу регулювання інсуліну, що містить стадію введення суб'єкту, що цього потребує, терапевтично ефективної кількості сполуки формули (I) або її таутомеру, мезомеру, рацемату, енантіомеру, діастереомеру і суміші і її фармацевтично прийнятної солі або фармацевтичної композиції, що її містить. 9 UA 115975 C2 5 10 15 20 25 30 35 40 45 50 В ще одному іншому аспекті, представлений опис стосується сполуки формули (I), або її таутомеру, мезомеру, рацемату, енантіомеру, діастереомеру і суміші і її фармацевтично прийнятної солі або фармацевтичної композиції, що її містить, для використання як медикаменту для регулювання інсуліну. Представлений опис стосується застосування сполуки формули (I) або її таутомеру, мезомеру, рацемату, енантіомеру, діастереомеру і суміші і її фармацевтично прийнятної солі або фармацевтичної композиції, що її містить, при одержанні медикаменту для регулювання інсуліну. ДЕТАЛЬНИЙ ОПИС ВИНАХОДУ Якщо не вказано інше, в описі і формулі винаходу використовуються наступні терміни, що мають наступні значення. "Алкіл" стосується насиченої аліфатичної вуглеводневої групи, що включає C 1-C20 нерозгалужені і розгалужені групи. Переважно алкільною групою є алкіл, що має 1-10 атомів вуглецю, більш переважно, що має 1-6 атомів вуглецю. Показовими прикладами є, але не обмежується, метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, трет-бутил, втор-бутил, нпентил, 1,1-диметилпропіл, 1,2-диметилпропіл, 2,2-диметилпропіл, 1-етилпропіл, 2-метилбутил, 3-метилбутил, н-гексил, 1-етил-2-метилпропіл, 1,1,2-триметилпропіл, 1,1-диметилбутил, 1,2диметилбутил, 2,2-диметилбутил, 1,3-диметилбутил, 2-етилбутил, 2-метилпентил, 3метилпентил, 4-метилпентил, 2,3-диметилбутил, н-гептил, 2-метилгексил, 3-метилгексил, 4метилгексил, 5-метилгексил, 2,3-диметилпентил, 2,4-диметилпентил, 2,2-диметилпентил, 3,3диметилпентил, 2-етилпентил, 3-етилпентил, н-октил, 2,3-диметилгексил, 2,4-диметилгексил, 2,5-диметилгексил, 2,2-диметилгексил, 3,3-диметилгексил, 4,4-диметилгексил, 2-етилгексил, 3етилгексил, 4-етилгексил, 2-метил-2-етилпентил, 2-метил-3-етилпентил, н-ноніл, 2-метил-2етилгексил, 2-метил-3-етилгексил, 2,2-діетилпентил, н-децил, 3,3-діетилгексил, 2,2-діетилгексил і їх ізомери розгалуженого ланцюга. Більш переважно, алкільна група є нижчим алкілом, що має 1-6 атомів вуглецю. Показовими прикладами є, але не обмежується, метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, трет-бутил, втор-бутил, н-пентил, 1,1-диметилпропіл, 1,2диметилпропіл, 2,2-диметилпропіл, 1-етилпропіл, 2-метилбутил, 3-метилбутил, н-гексил, 1-етил2-метилпропіл, 1,1,2-триметилпропіл, 1,1-диметилбутил, 1,2-диметилбутил, 2,2-диметилбутил, 1,3-диметилбутил, 2-етилбутил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 2,3диметилбутил і т.і… Алкільна група може бути заміщеною або незаміщеною. Коли заміщена, група(и) замісник може бути приєднана по будь-якій придатній точці приєднання, переважно група(и) замісник є однією або більше груп, що незалежно вибирають з групи, що містить алкіл, алкеніл, алкініл, алкокси, алкілсульфо, алкіламіно, галоген, тіол, гідроксил, нітро, ціано, циклоалкіл, гетероциклоалкіл, арил, гетероарил, циклоалкокси, гетероциклічний алкокси, 5 5 5 5 циклоалкілтіо, гетероциклічний алкілтіо, карбоніл, -C(O)OR , -OC(O)R , -C(O)R , -NHC(O)R , 6 7 5 NR R і -S(O)mR . "Циклоалкіл" стосується насиченої або часткової ненасиченої моноциклічної або поліциклічної вуглеводневої групи, що має від 3 до 20 атомів вуглецю, переважно від 3 до 12 атомів вуглецю, більш переважно від 3 до 10 атомів вуглецю, і найбільш переважно від 3 до 6 атомів вуглецю. Показовими прикладами моноциклічного циклоалкілу є, але не обмежується циклопропіл, циклобутил, циклопентил, циклопентеніл, циклогексил, циклогексеніл, циклогексадієніл, циклогептил, циклогептатриєніл, циклооктил і т.і… Поліциклічним циклоалкілом є циклоалкіл, що має спірокільце, конденсоване кільце і містковане кільце. "Спіроциклоалкіл" стосується 5-20 членної поліциклічної вуглеводневої групи з кільцями з'єднаними через один спільний атом вуглецю (так званий спіроатом), де одне або більше кілець може містити один або більше або подвійних зв'язків, але жодне з кілець не має повністю кон'югованої π-електронної системи. Переважно спіроциклоалкіл є 6-14 членним, більш переважно 7-10 членним. Відповідно до кількості спільних спіроатомів, спіроциклоалкіл розподіляють на моноспіроциклоалкіл, диспіроциклоалкіл або поліспіроциклоалкіл, перевага надається моноспіроциклоалкілу або диспіроциклоалкілу, більш переважно 4-членному/4членному, 4-членному/5-членному, 4-членному/6-членному, 5-членному/5-членному або 5членному/6-членному моноспіроциклоалкілу. Показовими прикладами спіроциклоалкілу є, але не обмежується, наступні групи: 10 UA 115975 C2 i 5 10 . "Конденсований циклоалкіл" стосується 5-20 членної поліциклічної вуглеводневої групи, де кожне кільце системи ділить сусідню пару атомів вуглецю з іншим кільцем, де одне або більше кілець може містити один або більше або подвійних зв'язків, але жодне з кілець не має повністю кон'югованої π-електронної системи. Переважно, конденсована циклоалкільна група є 6-14 членною, більш переважно 7-10 членною. Згідно з кількістю членів, конденсований циклоалкіл ділять на біциклічний, трициклічний, тетрацикліний або поліциклічний конденсований циклоалкіл, перевага надається біциклічному або трициклічному конденсованому циклоалкілу, більш переважно 5-членному/5-членному, або 5-членному/6-членному біциклічному конденсованому циклоалкілу. Показовими прикладами конденсованого циклоалкілу є, але не обмежується, наступні групи: i 15 20 "Місткований циклоалкіл" стосується 5-20 членної поліциклічної вуглеводневої групи, де кожні два кільця в системі ділять два окремі атоми вуглецю. Згадані кільця можуть мати одне або більше подвійних зв'язків, але мають не повністю кон'юговану π-електронну систему. Переважно місткований циклоалкіл є 6-14 членним, більш переважно 7-10 членним. Згідно з кількістю членів, місткований циклоалкіл ділиться на біциклічний, трициклічний, тетрациклічний або поліциклічний місткований циклоалкіл, перевага надається біциклічному, трициклічному або тетрациклічному місткованому циклоалкілу, більш переважно біциклічному або трициклічному місткованому циклоалкілу. Показовими прикладами місткованого циклоалкілу є, але не обмежується, наступні групи: . i 25 30 35 . Згаданий циклоалкіл може бути конденсований з арилом, гетероарилом або гетероциклоалкілом, де кільцем зв'язаним з батьківською структурою є циклоалкіл. Показовими прикладами є, але не обмежується, інданілацетат, тетрагідронафталін, бензоциклогептил і т.і… Згаданий циклоалкіл може бути заміщеним або незаміщеним. Коли заміщений, переважно група(и) замісник є однією або більше груп, що незалежно вибирають з групи, що містить алкіл, алкеніл, алкініл, алкокси, алкілсульфо, алкіламіно, галоген, тіол, гідроксил, нітро, ціано, циклоалкіл, гетероциклоалкіл, арил, гетероарил, циклоалкокси, гетероциклічний алкокси, 5 5 5 5 циклоалкілтіо, гетероциклічний алкілтіо, карбоніл, -C(O)OR , -OC(O)R , -C(O)R , -NHC(O)R , 6 7 5 NR R і -S(O)mR . "Гетероцикліл" стосується 3-20 членної насиченої або частково ненасиченої моноциклічної або поліциклічної вуглеводневої групи, що має один або більше гетеро атомів, що вибирають з групи, що містить N, O, і S(O)m (де m є цілим числом від 0 до 2) як кільцеві атоми, але за виключенням -O-O-, -O-S- або -S-S- в кільці, а атоми, що залишились є C. Переважно, гетероцикліл є 3-12 членним, що має 1-4 згаданих гетероатомів; більш переважно 3-10 членним; найбільш переважно 4-6 членним. Показовими прикладами моноциклічного гетероциклілу є, але не обмежується, піролідиніл, піперидил, піперазиніл, морфолініл, сульфо 11 UA 115975 C2 5 10 морфолініл, гомопіперазиніл, фурил, азетидиніл і т.і… Поліциклічним гетероциклілом є гетероцикліл, що має спірокільце, конденсоване кільце і містковане кільце. "Спірогетероцикліл" стосується 5-20 членної поліциклічної гетероциклільної групи з кільцями з'єднаними через один спільний атом вуглецю (так званий спіроатом), де згадані кільця мають один або більше гетероатомів, що вибирають з групи, що містить N, O, і S(O) m (де m є цілим числом від 0 до 2) як кільцеві атоми, а атоми, що залишились, є C, де одне або більше кілець може містити один або більше або подвійних зв'язків, але жодне з кілець не має повністю кон'югованої π-електронної системи. Переважно, спірогетероцикліл є 6-14 членним, більш переважно 7-10 членним. Відповідно до кількості спільних спіроатомів, спірогетероцикліл розподіляють на моноспірогетероцикліл, диспірогетероцикліл або поліспірогетероцикліл, перевага надається моноспірогетероциклілу або диспірогетероциклілу, більш переважно 4членному/4-членному, 4-членному/5-членному, 4-членному/6-членному, 5-членному/5-членному або 5-членному/6-членному моноспірогетероциклілу. Показовими прикладами спірогетероциклілу є, але не обмежується, наступні групи: N N N N S O O i O N H . 15 20 25 "Конденсований гетероцикліл" стосується 5-20 членної поліциклічної гетероциклільної групи, де кожне кільце системи ділить сусідню пару атомів вуглецю з іншим кільцем, де одне або більше кілець може містити один або більше або подвійних зв'язків, але жодне з кілець не має повністю кон'югованої π-електронної системи, і де згадані кільця мають один або більше гетероатомів, що вибирають з групи, що містить N, O, і S(O) m (де m є цілим числом від 0 до 2) як кільцеві атоми, а атоми, що залишились, є C. Переважно, конденсований гетероцикліл є 6-14 членним, більш переважно 7-10 членним. Згідно з кількістю членів, конденсований гетероцикліл ділять на біциклічний, трициклічний, тетрацикліний або поліциклічний конденсований гетероцикліл, перевага надається біциклічному або трициклічному конденсованому гетероцикліл, більш переважно 5-членному/5-членному, або 5-членному/6-членному біциклічному конденсованому гетероцикліл. Показовими прикладами конденсованого гетероциклілу є, але не обмежується, наступні групи: O N H O N H N N N N N N N O 30 35 40 N N N O і . "Місткований гетероцикліл" стосується 5-14 членної поліциклічної гетероциклільної групи, де кожні два кільця в системі ділять два окремі атоми вуглецю. Згадані кільця можуть мати одне або більше подвійних зв'язків, але мають не повністю кон'юговану π-електронну систему, і згадані кільця мають один або більше гетероатомів, що вибирають з групи, що містить N, O і S(O)m (де m є цілим числом від 0 до 2) як кільцеві атоми, а атоми, що залишились, є C. Переважно, місткований гетероцикліл є 6-14 членним, більш переважно 7-10 членним. Згідно з кількістю членів, місткований гетероцикліл ділиться на біциклічний, трициклічний, тетрациклічний або поліциклічний місткований гетероцикліл, перевага надається біциклічному, трициклічному або тетрациклічному місткованому гетероциклілу, більш переважно біциклічному або трициклічному місткованому гетероциклілу. Показовими прикладами місткованого гетероциклілу є, але не обмежується, наступні групи: 12 UA 115975 C2 N H N N N N N N N i . Згадане кільце гетероциклілу може бути конденсованим з арилом, гетероарилом або циклоалкілом, де кільце зв'язане з батьківською структурою є гетероциклілом. Показовими прикладами є, але не обмежується, наступні групи: O 5 10 15 20 25 H N H N H N N S і . Гетероцикліл може бути необов'язково заміщеним або незаміщеним. Коли заміщений, переважно група(и) замісник є однією або більше груп, що незалежно вибирають з групи, що містить алкіл, алкеніл, алкініл, алкокси, алкілсульфо, алкіламіно, галоген, тіол, гідроксил, нітро, ціано, циклоалкіл, гетероциклоалкіл, арил, гетероарил, циклоалкокси, гетероциклічний алкокси, 5 5 5 5 циклоалкілтіо, гетероциклічний алкілтіо, карбоніл, -C(O)OR , -OC(O)R , -C(O)R , -NHC(O)R , 6 7 5 NR R і -S(O)mR . "Циклоалкіліден" стосується насиченого або частково ненасиченого моноциклічного або поліциклічного вуглеводню з якого формально видалені два водні, що мають 3-20 атомів вуглецю, переважно 3-12 атомів вуглецю, більш переважно моноциклічний циклоалкілiден, що має 3-10 вуглеців, найбільш переважно 3-6 вуглеців. Показовими прикладами моноциклічного циклоалкілiдену є, але не обмежується, циклопропіліден, циклобутиліден, циклопентиліден, циклогексиліден, циклогептиліден, циклооктиліден, 1,2-циклопропіліден, 1,3-циклобутиліден, 1,4-циклогексиліден і т.і… Поліциклічний циклоалкіліден включає субспіро, субконденсований і субмісткований циклоалкіліден. "Арил" стосується 6-14 членного моноциклічного вуглецевого кільця або поліциклічного конденсованого кільця ("конденсованf" циклічна система означає, що кожне кільце в системі ділить сусідню пару атомів вуглецю з іншим кільцем в системі) і має повністю кон'юговану πелектронну систему. Переважно, арил є 6-10 членним, таким як феніл і нафтил, найбільш переважно, феніл. Згаданий арил може бути конденсованим з гетероарилом, гетероциклілом або циклоалкілом, де кільцем зв'язаним з батьківською структурою є арил. Показовими прикладами є, але не обмежується, наступні групи: O O O N H N N O N O H N N N S H N O O O H N H N N 30 35 40 O N O і . Арильна група може бути заміщеною або незаміщеною. Коли заміщена, переважно група(и) замісник є однією або більше груп, що незалежно вибирають з групи, що містить алкіл, алкеніл, алкініл, алкокси, алкілсульфо, алкіламіно, галоген, тіол, гідроксил, нітро, ціано, циклоалкіл, гетероциклоалкіл, арил, гетероарил, циклоалкокси, гетероциклічний алкокси, циклоалкілтіо, 5 5 5 5 6 7 5 гетероциклічний алкілтіо, карбоніл, -C(O)OR , -OC(O)R , -C(O)R , -NHC(O)R , -NR R і -S(O)mR . "Гетероарил" стосується гетероарилу, що має 1-4 гетероатомів, що вибирають з групи, якамістить N, O, і S як кільцеві атоми і має 5-14 кільцевих атомів, переважно 5-10- членне кільце, і більш переважно 5- або 6-членне кільце. Прикладами є фурил, тієніл, піридил, піроліл, налкілпіроліл, піримідиніл, піразиніл, імідазоліл, тетразоліл і т.і… Згаданий гетероарил може бути конденсованим з кільцем арилу, гетероциклілу або циклоалкілу, де кільцем зв'язаним з батьківською структурою є гетероарильне кільце. Показовими прикладами є, але не обмежується, наступні групи, 13 UA 115975 C2 O N N O N N N N H N N O N S N N H N N 5 10 15 20 25 30 35 40 45 50 і . Гетероарильна група може бути необов'язково заміщеною або незаміщеною. Коли заміщена, переважно група(и) замісник є однією або більше груп, що незалежно вибирають з групи, що містить алкіл, алкеніл, алкініл, алкокси, алкілсульфо, алкіламіно, галоген, тіол, гідроксил, нітро, ціано, циклоалкіл, гетероциклоалкіл, арил, гетероарил, циклоалкокси, 5 5 гетероциклічний алкокси, циклоалкілтіо, гетероциклічний алкілтіо, карбоніл, -C(O)OR , -OC(O)R , 5 5 6 7 5 -C(O)R , -NHC(O)R , -NR R і -S(O)mR . "Алкокси" стосується -O-(алкільної), і -O-(незаміщеної циклоалкільної) групи, де алкіл є таким як визначено вище. Показовими прикладами є, але не обмежується, метокси, етокси, пропокси, бутокси, циклопропілокси, циклобутилокси, циклопентилокси, циклогексилокси і т.і… Алкокси може бути необов'язково заміщеним або незаміщеним. Коли заміщений, переважно група(и) замісник є однією або більше груп, що незалежно вибирають з групи, що містить алкіл, алкеніл, алкініл, алкокси, алкілсульфо, алкіламіно, галоген, тіол, гідроксил, нітро, ціано, циклоалкіл, гетероциклоалкіл, арил, гетероарил, циклоалкокси, гетероциклічний алкокси, 5 5 5 5 циклоалкілтіо, гетероциклічний алкілтіо, карбоніл, -C(O)OR , -OC(O)R , -C(O)R , -NHC(O)R , 6 7 5 NR R і -S(O)mR . "Галоалкіл" стосується алкілу заміщеного одним або більше галогенів, де алкіл є таким як визначено вище. "Гідрокси" стосується -OH групи. "Гідроксиалкіл" стосується алкільної групи заміщеної гідроксилом, де алкіл є таким як визначено вище. "Галоген" стосується фтору, хлору, брому або йоду. "Аміно" стосується -NH2 групи. "Ціано" стосується -CN групи. "Нітро" стосується-NO2 групи. "Бензил" стосується -CH2-(феніл) групи. "Карбоніл" стосується =O. "Карбоксил" стосується -C(O)OH групи. "Алкоксикарбоніл" стосується -C(O)O(алкіл) або (циклоалкіл) групи, де алкіл і циклоалкіл є такими як визначено вище. "Необов'язково" означає, що випадок або умову описану далі, що може мати місце, але необов'язково, і опис включає випадки приклади випаку або події, що може мати місце або ні. Наприклад, "гетероциклічна група необов'язково заміщена алкілом" означає, що алкільна група може бути присутня, але необов'язково, і опис включає випадок, коли гетероциклічна група заміщена алкілом і гетероциклічна група не заміщена алкілом. "Заміщений" стосується одного або більше атомів водню в групі, переважно до 5, більш переважно 1-3 атомів водню, що назалежно замінені відповідною кількістю замісників. Зрозуміло, що замісники присутні тільки в їх можливих хімічних положеннях. Фахівець в цій галузі здатен визначити, якщо заміщення можливе або неможливе без прикладання надмірних зусиль. Наприклад, комбінування аміно або гідроксильної групи, що має вільний водень і атомів вуглецю, що мають ненасичені зв'язки (такий як олефіновий) може бути нестабільною. "Фармацевтчина композиція" стосується суміші однієї або більше сполук описаних тут або фізіологічно/фармацевтично прийнятних солей або їх проліків, і інших хімічних компонентів, таких як фізіологічно/фармацевтично прийнятні носії і ексціпієнти. Призначенням фармацевтичної композиції є полегшення введення сполуки в організм, що сприяє абсорбції активного інгредієнта і, таким чином, проявляє біологічну активність. 5 7 m і R ~R є такими як визначено у формулі (I). СПОСІБ СИНТЕЗУ СПОЛУК ПРЕДСТАВЛЕНОГО ВИНАХОДУ Для того щоб створити винахід, винахід використовує наступні технічні рішення: Спосіб одержання сполук формули (I) або їх таутомерів, рацематів, енантіомерів, діастереомерів і сумішей і їх фармацевтично прийнятних солей, містить наступні схеми: Схема 1: 14 UA 115975 C2 2 (R )p 9 R O S 4 R 4 R OH O L B + O HO 1 (R )q 2 2 (R )p (R )p 3 3 (R )n L B O 4 R HO (R )n A L B A + O 4 R 1 (R )q COOH 1 (R )q COOH (I) ( IA ) 4 5 10 15 Взаємодія R -заміщеного гідроксилу з алкілсульфонілгалоїдом (переважно 4 метансульфонілхлоридом) в лужному середовищі дає R -заміщений алкілсульфонат; 4 нагрівання R -заміщеного алкілсульфонату з гідроксил-заміщеним фенілом в розчиннику в присутності карбонату цезію дає сполуку формули (IA); конденсування сполуки формули (IA) з гідроксил-заміщеною бензоциклічною сполукою в розчиннику в присутності трифенілфосфіну і діізопропілазодикарбоксилату дає сполуку формули (I); 1 4 9 де кільце B, L, A, R ~R , n, p і q є визначеними у формулі (I), і R є алкіл, переважно метил. Лужні умови включають органічний луг і неорганічний луг, де згаданий органічний луг містить, але не обмежується, триетиламін, N, N-діізопропілетиламін, N, N-диметилформамід, нбутиллітій, трет-бутоксид калію, бромід тетрабутиламонію, переважно триетиламін; де згаданим неорганічним лугом є, але не обмежується, гідрид натрію, гідроксид натрію, гідроксид калію, карбонат натрію, бікарбонат натрію, карбонат калію, бікарбонат калію і карбонат цезію, переважно карбонат натрію, карбонат калію, гідроксид натрію або гідроксид калію. Розчинником є, але не обмежується: оцтова кислота, метанол, етанол, ацетонітрил, тетрагідрофуран, дихлорметан, диметилсульфоксид, 1,4-діоксан, вода або N, Nдиметилформамід. Схема 2: 2 (R )p 3 2 (R )p (R )n 3 (R )n L B Si HO B L A A + HO 1 (R )q COOH O COOH 1 (R )q ( IB ) 2 (R )p 3 O + (R )n 9 R 4 R L B A S O O O 4 R 1 (R )q COOH (I) 20 25 30 Конденсування алкілсілілокси-заміщеного фенілу з гідроксил-заміщеною бензоциклічною сполукою в розчиннику в присутності трифенілфосфіну і діізопропілазодикарбоксилату з 4 наступним зняттям захисту дає сполуку формули (IB); нагрівання сполуки формули (IB) з R 4 заміщеним алкілсульфонатом (переважно R -заміщеним метансульфонатом) в розчиннику в присутності карбонату цезію дає сполуку формули (I); 1 4 9 де кільце B, L, A, R ~R , n, p і q є такими як визначено вище, і R є алкіл, переважно метил. Лужні умови включають органічний луг і неорганічний луг, де згаданий органічний луг містить, але не обмежується, триетиламін, N, N-діізопропілетиламін, N, N-диметилформамід, нбутиллітій, трет-бутоксид калію, бромід тетрабутиламонію, переважно триетиламін, де згаданим неорганічним лугом є, але не обмежується, гідрид натрію, гідроксид натрію, гідроксид калію, карбонат натрію, бікарбонат натрію, карбонат калію, бікарбонат калію і карбонату цезію, переважно карбонат натрію, карбонат калію, гідроксид натрію або гідроксид калію. 15 UA 115975 C2 Розчинником є, але не обмежується: оцтова кислота, метанол, етанол, ацетонітрил, тетрагідрофуран, дихлорметан, диметилсульфоксид, 1,4-діоксан, вода або N, Nдиметилформамід. Схема 3: 1 (R )q HO 8 (R )s 8 (R )s OH 9 R O E + S E O OH O OH O 8 HO (R )s O (R )q E 5 10 + 1 (R )s O E 1 (R )q COOH COOH (III-A) O 8 O ( III ) Взаємодія кільце E-заміщеного гідроксилу з алкілсульфонілгалоїдом (переважно метансульфонілхлоридом) в лужному середовищі в розчиннику дає кільце E-заміщений алкілсульфонат; нагрівання кільце E-заміщеного алкілсульфонату в розчиннику з гідроксилзаміщеним біфеніловим спиртом в присутності карбонату цезію дає сполуку формули (III-A); конденсування сполуки формули (III-A) з гідроксил-заміщеним дигідробензофураном в розчиннику в присутності трифенілфосфіну і діізопропілазодикарбоксилату дає сполуку формули (III); 1 8 9 де кільце E, R , R , s і q є визначеними у формулі (III), і R є алкіл, переважно метил. Схема 4: O OH Si O HO + HO 1 (R )q COOH COOH 1 (R )q (III-B) O 8 O 8 (R )s + O O O O E (R )s S 9 R O E 1 (R )q COOH O 15 20 25 30 ( III ) Конденсування алкілсилілокси-заміщеного біфенілового спирту з гідроксил-заміщеним дигідробензофураном в розчиннику в присутності трифенілфосфіну і діізопропілазодикарбоксилату з наступним зняттям захисту дає сполуку формули (III-B); нагрівання сполуки формули (III-B) з кільце E-заміщеним алкілсульфонатом (переважно кільце E-заміщеним метансульфонатом) в розчиннику в присутності карбонату цезію дає сполуку формули (III); 8 коли R є гідроксил, гідроксил необов'язково додатково захищають захисною групою, і потім захисну групу видаляють, одержуючи сполуку формули (III); 1 8 9 де кільце E, R , R , s і q є визначеними у формулі (III), і R є алкіл, переважно метил. Лужні умови включають органічний луг і неорганічний луг, де згаданий органічний луг містить, але не обмежується, триетиламін, N, N-діізопропілетиламін, N, N-диметилформамід, нбутиллітій, трет-бутоксид калію, бромід тетрабутиламонію, переважно триетиламін, де згаданим неорганічним лугом є, але не обмежується, гідрид натрію, гідроксид натрію, гідроксид калію, карбонат натрію, бікарбонат натрію, карбонат калію, бікарбонат калію і карбонату цезію, переважно карбонат натрію, карбонат калію, гідроксид натрію або гідроксид калію. Розчинником є, але не обмежується: оцтова кислота, метанол, етанол, ацетонітрил, тетрагідрофуран, дихлорметан, диметилсульфоксид, 1,4-діоксан, вода або N, Nдиметилформамід. Схема 5: 16 UA 115975 C2 O HO O + O O S E 1 (R )q 9 R O COOH ( III-B ) O O O E O O 8 (R )s 1 O E (R )q 1 (R )q COOH COOH ( III ) (III-C) 5 10 15 20 25 30 35 40 45 Нагрівання сполуки формули (III-B) і кільце E-заміщеного алкілсульфонату (переважно кільце E-заміщеного метансульфонату) в розчиннику в присутності карбонату цезію дає сполуку 8 формули (III-C); взаємодія сполуки формули (III-C) з заміщеним R (переважно сульфонілхлоридом або ангідридом) дає сполуку формули (III); 1 8 де кільце E, R , R , s і q є визначеними у формулі (III). Лужні умови включають органічний луг і неорганічний луг, де згаданий органічний луг містить, але не обмежується, триетиламін, N, N-діізопропілетиламін, N, N-диметилформамід, нбутиллітій, трет-бутоксид калію, бромід тетрабутиламонію, переважно триетиламін, де згаданим неорганічним лугом є, але не обмежується, гідрид натрію, гідроксид натрію, гідроксид калію, карбонат натрію, бікарбонат натрію, карбонат калію, бікарбонат калію і карбонату цезію, переважно карбонат натрію, карбонат калію, гідроксид натрію або гідроксид калію. Розчинником є, але не обмежується: оцтова кислота, метанол, етанол, ацетонітрил, тетрагідрофуран, дихлорметан, диметилсульфоксид, 1,4-діоксан, вода або N, Nдиметилформамід. ПЕРЕВАЖНІ ВТІЛЕННЯ Наступні приклади слугують ілюстрацією винаходу, але приклади не повинні розглядатись як обмеження рамок винаходу. Приклади Структуру сполуки визначали за допомогою ЯМР або МС. ЯМР знімали на Bruker AVANCE400. Розчинниками були дейтерований-диметилсульфоксид (DМСO-d6), дейтерованийхлороформ (CDCl3) і дейтерований-метанол (CD3OD) з тетраметилсиланом (TМС) як внутрішнім -6 стандартом. Хімічні зсуви ЯМР (δ) приводили в 10 (м.ч.). МС знімали на масспектрометрі FINNIGAN LCQAd (ЕСІ) (виробник: Thermo, тип: Finnigan LCQ advantage MAX). ВЕРХ проводили на спектрометрі високоефективної рідинної хроматографії 1200DAD (хроматографічна колонка Sunfire C18 150×4,6 мм) і спектрометрі високоефективної рідинної хроматографії Waters 2695-2996 (хроматографічна колонка Gimini C18 150×4,6 мм). Середній коефіцієнт інгібування кінази і IC50 визначали на NovoStar ELIASA (BMG Co., Germany). Для тонкошарової хроматографії використовували силікагелі пластинки Yantai Huanghai HSGF254 або Qingdao GF254. Розміри пластинок, що використовували в ТШХ, були від 0,15 мм до 0,2 мм, і розміри пластинок, що використовували для очистки продукту, були від 0,4 мм до 0,5 мм. Як носій в колонковій хроматографії зазвичай використовували силікагель Yantai Huanghai 200-300 меш. Відомий вихідний матеріал винаходу можна одержати за допомогою звичайного способу синтезу відомого в цій галузі або отримати від ABCR GmbH & Co. KG, Acros Organics, Aldrich Chemical Company, Accela ChemBio Inc або Dari Chemical Company і т.і… Якщо не вказано інше, наступні реакції проводили в атмосфері азоту або аргону. Термін "атмосфера азоту" або "атмосфера аргону" означає, що до реакційної колби приєднують 1 л кульку з азотом або аргоном. Термін "атмосфера водню" означає, що до реакційної колби приєднують 1 л кульку з воднем. Реакції під тиском водню проводили використовуючи гідрогенатор Parr 3916EKX і генератор водню QL-500. 17 UA 115975 C2 5 10 15 20 В реакціях гідрування, реакційну систему зазвичай вакуумують і наповнюють воднем, і повторюють цю операцію тричі. Реакції з мікрохвильовим опроміненням проводили в мікрохвильовому реакторі CEM Discover-S 908860. Якщо не вказано інше, розчин, що використовували в наступній реакції, означає водний розчин. Якщо не вказано інше, температура реакції в наступній реакції була кімнатною температурою і інтервал температури був 20 °C-30 °C. Протікання реакції контролювали за допомогою тонкошарової хроматографії (ТШХ), система розчинників включала: A: дихлорметан і метанол, B: н-гексан і етилацетат, C: петролейний ефір і етилацетат, D: ацетон. Об'ємне співвідношення розчинника коригували згідно з полярністю сполук. Система елюювання для очищення сполук за допомогою колонкової хроматографії і тонкошарової хроматографії включала: A: дихлорметан і метанол, B: н-гексан і етилацетат, C: н-гексан і ацетон, D: н-гексан, E: етилацетат. Об'ємне співвідношення розчинника коригували згідно з полярністю сполук і іноді також додавали малі кількості лужного реагенту, такого як триетиламін, і кислого реагенту. Приклад 1 2-((S)-6-((2',6'-Диметил-4'-(((S)-тетрагідрофуран-3-іл)окси)біфеніл-3-іл)метокси)-2,3дигідробензофуран-3-іл)оцтова кислота O O O O COOH O O OH Стадія 1 O O S OH O Стадія 2 O O O 1c O O O Стадія 4 O O Стадія 3 O 1b 1a O O 1 1d COOH O 25 30 35 40 45 Стадія 1 (R)-Тетрагідрофуран-3-іл метансульфонат (R)-Тетрагідрофуран-3-ол 1a (300 мг, 3,40 ммоль) і триетиламін (687 мг, 6,80 ммоль) розчиняли в 20 мл дихлорметану на бані з льодом, після чого додавали метансульфонілхлорид (468 мг, 4,10 ммоль). Реакційний розчин нагрівали до кімнатної температури і перемішували 2 години. До реакційного розчину додавали 10 мл дихлорметану, промивали водою (30 мл×3), сушили безводним сульфатом магнію і фільтрували. Фільтрат концентрували при пониженому тиску, одержуючи вказану в заголовку сполуку, (R)-тетрагідрофуран-3-іл метансульфонат, 1b (520 мг) як жовту олію, що безпосередньо використовували на наступній стадії без додаткової очистки. Стадія 2 (S)-(2',6'-Диметил-4'-((тетрагідрофуран-3-іл)окси)біфеніл-3-іл)метанол Неочищений (R)-тетрагідрофуран-3-ілметансульфонат 1b (520 мг, 3,13 ммоль), 3'(гідроксиметил)-2,6-диметилбіфеніл-4-ол (714 мг, 3,13 ммоль, одержали за способом описаним в патентній заявці CN101616913) і карбонат цезію (3,10 г, 9,39 ммоль) розчиняли в 30 мл N, Nдиметилформаміду. Реакційну суміш нагрівали до 80 C і перемішували 7 годин. Одержаний розчин концентрували при пониженому тиску. Залишок очищали колонковою хроматографією на силікагелі, використовуючи систему елюювання B, одержуючи вказану в заголовку сполуку, (S)-(2',6'-диметил-4'- ((тетрагідрофуран-3-іл)окси)біфеніл-3-іл)метанол, 1c (500 мг, вихід 54,0 %) як безбарвну олію. МС m/z (EСI): 299,3 [M+1] Стадія 3 Метил 2-((S)-6-((2',6'-диметил-4'-(((S)-тетрагідрофуран-3-іл)окси)біфеніл-3- іл)метокси)-2,3дигідробензофуран-3-іл)ацетат 18 UA 115975 C2 5 10 15 20 25 30 (S)-(2',6'-Диметил-4'-((тетрагідрофуран-3-іл)окси)біфеніл-3-іл)метанол 1c (143 мг, 0,48 ммоль), метил (S)-2-(6-гідроксил-2,3-дигідробензофуран-3-іл)ацетат (100 мг, 0,48 ммоль, одержали за способом описаним в патентній заявці CN101616913. Рацемат розділяли хіральною ВЕРХ, умови розділення: хіральна колонка Chiralpak IA, рухома фаза: н-гексан: тетрагідрофуран = 80: 20, швидкість потоку: 1,0 мл/хвилину. Відповідний компонент збирали і розчинник видаляли на роторному випаровувачі і трифенілфосфін (189 мг, 0,72 ммоль) розчиняли в 20 мл дихлорметану. Реакційний розчин охолоджували до 0 C, після чого додавали діізопропілазодикарбоксилат (146 мг, 0,72 ммоль), потім нагрівали до кімнатної температури і перемішували 2 години. Одержаний розчин концентрували при пониженому тиску. Залишок очищали колонковою хроматографією на силікагелі, використовуючи систему елюювання B, одержуючи вказану в заголовку сполуку, метил 2-((S)-6-((2',6'-диметил-4'-(((S)тетрагідрофуран-3-іл)окси)біфеніл-3-іл)метокси)-2,3-дигідробензофуран-3-іл)ацетат, 1d (220 мг, вихід 94,0 %) як білу тверду речовину. МС m/z (EСI): 489,4 [M+1] Стадія 4 2-((S)-6-((2',6'-Диметил-4'-(((S)-тетрагідрофуран-3-іл)окси)біфеніл-3-іл)метокси)-2,3дигідробензофуран-3-іл)оцтова кислота Метил 2-((S)-6-((2',6'-Диметил-4'-(((S)-тетрагідрофуран-3-іл)окси)біфеніл-3- іл)метокси)-2,3дигідробензофуран-3-іл)ацетат 1d (220 мг, 0,45 ммоль) розчиняли в 15 мл метанолу, після чого додавали 3 M водний розчин гідроксиду натрію (1,5 мл, 4,50 ммоль). Реакційна суміш реагувала 3 години. Суміш концентрували при пониженому тиску, додавали 10 мл води і краплями додавали 1 M хлорводневу кислоту доводячи pH до 2. Одержаний розчин екстрагували етилацетатом (20 мл×2). Об'єднані органічні екстракти промивали насиченим розчином хлориду натрію (30 мл), сушили безводним сульфатом магнію і фільтрували. Фільтрат концентрували при пониженому тиску, одержуючи вказану в заголовку сполуку, 2-((S)-6-((2',6'-диметил-4'-(((S)тетрагідрофуран-3- іл)окси)біфеніл-3-іл)метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота, 1 (210 мг, вихід 100 %), як білу тверду речовину. МС m/z (EСI): 473,2 [M-1] 1 H ЯМР (400 MГц, CDCl3) δ 7,45 (дт, 2H), 7,21 (с, 1H), 7,11 (дд, 2H), 6,66 (с, 2H), 6,58-6,46 (м, 2H), 5,10 (с, 2H), 5,04-4,94 (м, 1H), 4,80 (н, 1H), 4,33 (дд, 1H), 4,11-4,01 (м, 3H), 4,01-3,92 (м, 1H), 3,85 (ддд, 1H), 2,85 (дд, 1H), 2,66 (дд, 1H), 2,30-2,19 (м, 2H), 2,03 (с, 6H). Приклад 2 2-((S)-6-((2',6'-Диметил-4'-(((R)-тетрагідрофуран-3-іл)окси)біфеніл-3-іл)метокси)-2,3дигідробензофуран-3-іл)оцтова кислота O O O O COOH 35 O O OH Step 1 O O S OH O Step 2 O O O 2c O O O Step 4 O O Step 3 O 2b 2a O O 2 2d COOH O 40 45 Стадія 1 (S)-Тетрагідрофуран-3-іл метансульфонат (S)-Тетрагідрофуран-3-ол 2a (300 мг, 3,40 ммоль) і триетиламін (687 мг, 6,80 ммоль) розчиняли в 20 мл дихлорметанe на бані з льодом, після чого додавали метансульфонілхлорид (908 мг, 7,93 ммоль). Реакційний розчин нагрівали до кімнатної температури і перемішували 2 години. До одержаного розчину додавали 10 мл дихлорметану, промивали водою (30 мл×2), сушили безводним сульфатом магнію і фільтрували. Фільтрат концентрували при пониженому тиску, одержуючи неочищену вказану в заголовку сполуку, (S)-тетрагідрофуран-3-іл метансульфонат, 2b як жовту олію (522 мг, вихід 92,5 %). Стадія 2 (R)-(2',6'-Диметил-4'-((тетрагідрофуран-3-іл)окси)біфеніл-3-іл)метанол 19 UA 115975 C2 5 10 15 20 25 30 35 40 Неочищений (S)-тетрагідрофуран-3-іл метансульфонат 2b (522 мг, 3,14 ммоль), 3'(гідроксиметил)-2,6-диметилбіфеніл-4-ол (714 мг, 3,13 ммоль, одержали за способом описаним в патентній заявці CN101616913) і карбонат цезію (3,10 г, 9,39 ммоль) розчиняли в 30 мл N, Nдиметилформаміду. Реакційну суміш нагрівали до 80 C і перемішували 12 годин. Одержаний розчин концентрували при пониженому тиску і залишок очищали колонковою хроматографією на силікагелі, використовуючи систему елюювання B, одержуючи вказану в заголовку сполуку, (R)-(2',6'-диметил-4'-((тетрагідрофуран-3-іл)окси)біфеніл-3-іл)метанол, 2c (540 мг, вихід 58,0 %) як безбарвну олію. МС m/z (EСI): 299,2 [M+1] Стадія 3 Метил 2-((S)-6-((2',6'-диметил-4'-(((R)-тетрагідрофуран-3-іл)окси)біфеніл-3- іл)метокси)-2,3дигідробензофуран-3-іл)ацетат (R)-(2',6'-Диметил-4'-((тетрагідрофуран-3-іл)окси)біфеніл-3-іл)метанол 2c (143 мг, 0,48 ммоль), метил (S)-2-(6-гідроксил-2,3-дигідробензофуран-3-іл)ацетат (100 мг, 0,48 ммоль) і трифенілфосфін (189 мг, 0,72 ммоль) розчиняли в 20 мл дихлорметану. Реакційний розчин охолоджували до 0 C, після чого додавали діізопропілазодикарбоксилат (146 мг, 0,72 ммоль). Реакційний розчин нагрівали до кімнатної температури і перемішували 12 годин. Одержаний розчин концентрували при пониженому тиску і залишок очищали колонковою хроматографією на силікагелі, використовуючи систему елюювання B, одержуючи вказану в заголовку сполуку, метил 2-((S)-6-((2',6'-диметил-4'-(((R)-тетрагідрофуран-3-іл)окси)біфеніл-3-іл)метокси)-2,3дигідробензофуран-3-іл)ацетат, 2d (201 мг, вихід 85,9 %) як безбарвну олію. МС m/z (EСI): 489,4 [M+1] Стадія 4 2-((S)-6-((2',6'-Диметил-4'-(((R)-тетрагідрофуран-3-іл)окси)біфеніл-3-іл)метокси)-2,3дигідробензофуран-3-іл)оцтова кислота Метил 2-((S)-6-((2',6'-диметил-4'-(((R)-тетрагідрофуран-3-іл)окси)біфеніл-3- іл)метокси)-2,3дигідробензофуран-3-іл)ацетат 2d (201 мг, 0,41 ммоль) розчиняли в 15 мл метанолу. До реакційного розчину додавали 2 M водний розчин гідроксиду натрію (2 мл, 4,10 ммоль) і перемішували 3 години. Одержаний розчин концентрували при пониженому тиску, додавали 10 мл води і краплями додавали 1 M хлорводневу кислоту, доводячи pH до 2~3. Розчин екстрагували етилацетатом (20 мл×2). Об'єднані органічні екстракти промивали насиченим розчином хлориду натрію (30 мл), сушили безводним сульфатом магнію і фільтрували. Фільтрат концентрували при пониженому тиску, одержуючи вказану в заголовку сполуку, 2-((S)-6-((2',6'диметил-4'-(((R)-тетрагідрофуран-3-іл)окси)біфеніл-3іл)метокси)-2,3-дигідробензофуран-3іл)оцтова кислота, 2 (150 мг, вихід 77,1 %) як білу тверду речовину. МС m/z (EСI): 473,4 [M-1] 1 H ЯМР (400 MГц, CDCl3) δ 7,45 (дт, 2H), 7,21 (с, 1H), 7,11 (дд, 2H), 6,66 (с, 2H), 6,58-6,48 (м, 2H), 5,10 (с, 2H), 5,04-4,94 (м, 1H), 4,80 (н, 1H), 4,33 (дд, 1H), 4,11-4,01 (м, 3H), 4,00-3,91 (м, 1H), 3,86 (дд, 1H), 2,85 (дд, 1H), 2,66 (дд, 1H), 2,33-2,16 (м, 2H), 2,03 (с, 6H). Приклад 3 (S)-2-(6-((4'-((1-(трет-бутоксикарбоніл)піперидин-4-іл)окси)-2',6'-диметилбіфеніл-3іл)- метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота O O O N O O COOH 20 UA 115975 C2 O HN Стадія 1 O O Стадія 2 N OH OH 3b 3a O N 3c O O S O O O Стадія 3 Si H HO O Si Стадія 5 O 3f 3e 3d O Si OH Стадія 4 H O O O Стадія 7 Стадія 6 O HO O O 3h 3g O O O O O O N O 3j 10 15 20 25 30 35 40 O O N O O O 5 O Стадія 8 3 COOH O Стадія 1 трет-Бутил 4-гідроксипіперидин-1-карбоксилат 4-Гідроксил-піперидин 3a (1,01 г, 10 ммоль) і триетиламін (2,02 г, 20 ммоль) розчиняли в 20 мл дихлорметану на бані з льодом, після чого додавали ди-трет-бутилдикарбонат (2,18 г, 10 ммоль). Реакційну суміш нагрівали до кімнатної температури і перемішували 3 години. Розчин промивали водою (20 мл×2), сушили безводним сульфатом натрію і фільтрували. Фільтрат концентрували при пониженому тиску одержуючи неочищену вказану в заголовку сполуку третбутил 4-гідроксипіперидин-1-карбоксилат, 3b (2 г) як безбарвну олію, що безпосередньо використовували на наступній стадії без додаткової очистки. Стадія 2 трет-Бутил 4-((метилсульфоніл)окси)піперидин-1-карбоксилат Неочищений трет-бутил 4-гідроксипіперидин-1-карбоксилат 3b (2,01 г, 10 ммоль) розчиняли в 30 мл дихлорметану на бані з льодом, після чого додавали триетиламін (2,02 г, 20 ммоль) і метансульфонілхлорид (1,26 г, 11 ммоль). Реакційний розчин нагрівали до кімнатної температури і перемішували 3 години. Одержаний розчин промивали водою (20 мл×2), сушили безводним сульфатом натрію і фільтрували. Фільтрат концентрували при пониженому тиску, одержуючи неочищену вказану в заголовку сполуку, трет-бутил 4((метилсульфоніл)окси)піперидин-1-карбоксилат, 3c (2,20 г) як світло-жовту тверду речовину, що безпосередньо використовували на наступній стадії без додаткової очистки. Стадія 3 4'-((трет-Бутилдиметилсиліл)окси)-2',6'-диметилбіфеніл-3-карбальдегід 4'-Гідрокси-2',6'-диметилбіфеніл-3-карбальдегід 3d (7,20 г, 31,80 ммоль, одержали за способом описаним в патентній заявці CN101616913), трет-бутилдиметилсилілхлорид (5,27 г, 34,90 ммоль) і імідазол (2,60 г, 38,10 ммоль) розчиняли в 60 мл N, N-диметилформаміду. Реакційний розчин нагрівали до 60 C і перемішували 12 годин. Одержаний розчин концентрували при пониженому тиску і залишок очищали колонковою хроматографією на силікагелі, використовуючи систему елюювання B, одержуючи вказану в заголовку сполуку, 4'((трет-бутилдиметилсиліл)окси)-2',6'-диметилбіфеніл- 3-карбальдегід, 3e (10 г, вихід 92,0 %) як коричневу олію. МС m/z (EСI): 341,2 [M+1] Стадія 4 (4'-((трет-Бутилдиметилсиліл)окси)-2',6'-диметилбіфеніл-3-іл)метанол 4'-((трет-Бутилдиметилсиліл)окси)-2',6'-диметилбіфеніл-3-карбальдегід 3e (2,60 г, 38,10 ммоль) розчиняли в 80 мл метанолу, після чого додавали боргідрид натрію (1,66 г, 43,95 ммоль). Реакційну суміш перемішували 3 години. До одержаної суміші додавали 50 мл ацетону і концентрували при пониженому тиску. До залишку додавали 200 мл етилацетату, промивали водою (60 мл×2), сушили безводним сульфатом натрію і фільтрували. Фільтрат концентрували при пониженому тиску одержуючи неочищену вказану в заголовку сполуку, (4'-((третбутилдиметилсиліл)окси)- 2',6'-диметилбіфеніл-3-іл)метанол, 3f (9,80 г, вихід 98,0 %) як безбарвну олію. 21 UA 115975 C2 5 10 15 20 25 30 35 40 45 50 55 МС m/z (EСI): 343,2 [M+1] Стадія 5 (S)-Метил 2-(6-((4'-((трет-бутилдиметилсиліл)окси)-2',6'-диметилбіфеніл-3- іл)метокси)-2,3дигідробензофуран-3-іл)ацетат (4'-((трет-Бутилдиметилсиліл)окси)-2',6'-диметилбіфеніл-3-іл)метанол 3f (1,19 г, 3,48 ммоль), метил (S)-2-(6-гідроксил-2,3-дигідробензофуран-3-іл)ацетат (660 мг, 3,17 ммоль) і трифенілфосфін (1,34 г, 4,75 ммоль) розчиняли в 10 мл дихлорметану. Реакційний розчин охолоджували до 0 C, після чого додавали діізопропілазодикарбоксилат (960 мг, 4,75 ммоль), потім нагрівали до кімнатної температури і перемішували 4 години. Одержаний розчин концентрували при пониженому тиску і залишок очищали колонковою хроматографією на силікагелі, використовуючи систему елюювання B, одержуючи вказану в заголовку сполуку, (S)метил 2-(6-((4'-((трет-бутилдиметилсиліл)окси)2',6'-диметилбіфеніл-3-іл)метокси)-2,3дигідробензофуран-3-іл)-ацетат, 3g (1,28 г, вихід 76,0 %) як білу тверду речовину. МС m/z (EСI): 533,3 [M+1] Стадія 6 (S)-метил 2-(6-((4'-Гідрокси-2',6'-диметилбіфеніл-3- іл)метокси)-2,3-дигідробензофуран-3іл)ацетат (S)-Метил 2-(6-((4'-((трет-бутилдиметилсиліл)окси)-2',6'-диметилбіфеніл-3- іл)метокси)-2,3дигідробензофуран-3-іл)ацетат 3g (1,28 г, 2,40 ммоль) розчиняли в 50 мл тетрагідрофурану, після чого додавали 10 мл 6 M хлорводневої кислоти. Реакційний розчин перемішували при кімнатній температурі 12 годин. Одержаний розчин концентрували при пониженому тиску і до залишку додавали 100 мл етилацетату. Органічну фазу послідовно промивали водою (20 мл×2) і насиченим розчином хлориду натрію (20 мл), сушили безводним сульфатом натрію і фільтрували. Фільтрат концентрували при пониженому тиску. До залишку додавали 60 мл метанолу і 1 мл концентрованої сірчаної кислоти. Одержаний розчин нагрівали до 70 C і перемішували 1,5 години. Розчин концентрували при пониженому тиску, додавали 100 мл етилацетату, промивали водою (20 мл×2), сушили безводним сульфатом натрію і фільтрували. Фільтрат концентрували при пониженому тиску і залишок очищали за допомогою системи елюювання B, одержуючи вказану в заголовку сполуку, (S)-метил 2-(6-((4'-гідрокси-2',6'диметилбіфеніл-3-іл)метокси)- 2,3-дигідробензофуран-3-іл)ацетат, 3h (670 мг, вихід 67,0 %) як безбарвну олію. МС m/z (EСI): 419,2 [M+1] Стадія 7 Метил (S)-2-(6-((4'-((1-(трет-бутоксикарбоніл)піперидин-4-іл)окси)-2',6'- диметилбіфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)ацетат 4-[(Метилсульфоніл)окси]піперидин-1-карбонової кислоти трет-бутиловий естер (134 мг, 0,48 ммоль), (S)-метил 2-(6-((4'-гідрокси-2',6'-диметилбіфеніл-3-іл)метокси)-2,3- дигідробензофуран3-іл)ацетат 3h (200 мг, 0,48 ммоль) і карбонат цезію (470 мг, 1,43 ммоль) розчиняли в 10 мл N, N-диметилформаміду. Реакційну суміш нагрівали до 80 C і перемішували 12 годин. До одержаного розчину додавали 30 мл етилацетату. Органічну фазу послідовно промивали водою (20 мл×2) і насиченим розчином хлориду натрію (20 мл), сушили безводним сульфатом натрію і фільтрували. Фільтрат концентрували при пониженому тиску і залишок очищали за допомогою системи елюювання B, одержуючи вказану в заголовку сполуку, метил (S)-2-(6-((4'-((1-(третбутоксикарбоніл)піперидин-4-іл)окси)-2',6'-диметилбіфеніл-3-іл)метокси)-2,3дигідробензофуран-3-іл)ацетат, 3j (101 мг, вихід 35,0 %) як безбарвний слиз. МС m/z (EСI): 502,3 [M-99] Стадія 8 (S)-2-(6-((4'-((1-(трет-бутоксикарбоніл)піперидин-4-іл)окси)-2',6'-диметилбіфеніл-3іл) метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота Метил (S)-2-(6-((4'-((1-(трет-бутоксикарбоніл)піперидин-4-іл)окси)-2',6'- диметилбіфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)ацетат 3j (26 мг, 0,04 ммоль) розчиняли в 5 мл метанолу, після чого додавали 1 M водний розчин гідроксиду натрію (0,5 мл, 0,43 ммоль). Реакційний розчин реагував 1,5 годин. Розчин концентрували при пониженому тиску, додавали 3 мл води, краплями додавали 1 M лимонну кислоту, доводячи pH до 4~5, і екстрагували етилацетатом (20 мл×2). Об'єднані органічні екстракти промивали насиченим розчином хлориду натрію (30 мл), сушили безводним сульфатом магнію і фільтрували. Фільтрат концентрували при пониженому тиску, одержуючи вказану в заголовку сполуку, (S)-2-(6-((4'-((1-(третбутоксикарбоніл)піперидин-4-іл)окси)2',6'-диметилбіфеніл-3-іл)метокси)-2,3дигідробензофуран-3-іл)оцтова кислота, 3 (12 мг, вихід 47,4 %) як білу тверду речовину. МС m/z (EСI): 586,3 [M-1] 22 UA 115975 C2 1 5 H ЯМР (400 MГц, CDCl3) δ 7,51-7,38 (м, 2H), 7,21 (с, 1H), 7,11 (дд, 2H), 6,70 (с, 2H), 6,51-6,54 (м, 2H), 5,10 (с, 2H), 4,80 (н, 1H), 4,52 (с, 1H), 4,33 (н, 1H), 3,76-3,85 (м, 3H), 3,41 (с, 2H), 2,85 (д, 1H), 2,66 (дд, 1H), 2,03 (с, 6H), 1,90 (д, 4H), 1,52 (с, 9H). Приклад 4 (S)-2-(6-((2',6'-Диметил-4'-(піперидин-4-ілокси)біфеніл-3-іл)метокси)-2,3- дигідробензофуран3-іл)оцтова кислота O HN O O COOH O O O N O O O O O 4a O O O O HN Стадія 2 я Стадія 1 я O 3j O HN O 4 COOH 10 15 20 25 30 35 Стадія 1 (S)-Метил 2-(6-((2',6'-диметил-4'-(піперидин-4-ілокси)біфеніл-3-іл)метокси)2,3дигідробензофуран-3-іл)ацетат Метил (S)-2-(6-((4'-((1-(трет-бутоксикарбоніл)піперидин-4-іл)окси)-2',6'-диметил- біфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)ацетат 3j (75 мг, 0,13 ммоль) розчиняли в 15 мл хлорводневої кислоти в діоксані. Реакційний розчин реагував 1 годину. Одержаний розчин концентрували при пониженому тиску одержуючи неочищену вказану в заголовку сполуку, (S)метил 2-(6-((2',6'-диметил-4'-(піперидин-4-ілокси)біфеніл-3- іл)метокси)-2,3-дигідробензофуран3-іл)ацетат, 4a (75 мг), як білу тверду речовину, що безпосередньо використовували на наступній стадії без додаткової очистки. Стадія 2 (S)-2-(6-((2',6'-Диметил-4'-(піперидин-4-ілокси)біфеніл-3-іл)метокси)-2,3- дигідробензофуран3-іл)оцтова кислота Неочищений (S)-метил 2-(6-((2',6'-диметил-4'-(піперидин-4-ілокси)біфеніл-3- іл)метокси)-2,3дигідробензофуран-3-іл)ацетат 4a (31 мг, 0,06 ммоль) розчиняли в 5 мл метанолу, після чого додавали 1 M водний розчин гідроксиду натрію (0,6 мл, 0,62 ммоль). Реакційний розчин реагував 2 години. Одержаний розчин концентрували при пониженому тиску, додавали 3 мл води, краплями додавали 1 M лимонну кислоту, доводячи pH до 5, і екстрагували етилацетатом (20 мл×2). Об'єднані органічні екстракти промивали насиченим розчином хлориду натрію (30 мл), сушили безводним сульфатом магнію і фільтрували. Фільтрат концентрували при пониженому тиску, одержуючи вказану в заголовку сполуку, (S)-2-(6-((2',6'-диметил-4'(піперидин-4-ілокси)біфеніл-3-іл)метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота, 4 (31 мг, вихід 100 %) як білу тверду речовину. МС m/z (EСI): 486,3 [M-1] 1 H ЯМР (400 MГц, DМСO-d6) δ 7,51-7,38 (м, 2H), 7,21 (с, 1H), 7,11 (дд, 2H), 6,70 (с, 2H), 6,516,54 (м, 2H), 5,10 (с, 2H), 4,80 (н, 1H), 4,52 (с, 1H), 4,33 (н, 1H), 3,81-3,86 (м, 1H), 3,15 (с, 2H), 2,81 (с, 2H), 2,85 (д, 1H), 2,66 (дд, 1H), 2,03 (с, 6H), 1,90 (д, 4H). Приклад 5 (S)-2-(6-((2',6'-Диметил-4'-((1-(метилсульфоніл)піперидин-4-іл)окси)біфеніл- 3іл)метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота O O S O N O O COOH 23 UA 115975 C2 O HN O O O S O N Стадія 1 я O O O 5a O 4a O O O O O S O N O O Стадія 2 я COOH 5 5 10 15 20 25 30 Стадія 1 (S)-Метил 2-(6-((2',6'-диметил-4'-((1-(метилсульфоніл)піперидин-4-іл)окси)біфеніл3іл)метокси)-2,3-дигідробензофуран-3-іл)ацетат (S)-Метил 2-(6-((2',6'-диметил-4'-(піперидин-4-ілокси)біфеніл-3-іл)метокси)-2,3дигідробензофуран-3-іл)ацетат 4a (26 мг, 0,05 ммоль) розчиняли в 5 мл дихлорметану, після чого додавали метансульфонілхлорид (6 мг, 0,05 ммоль) і триетиламін (15 мг, 0,15 ммоль). Реакційний розчин реагував 1 годину. До одержаного розчину додавали 10 мл води, концентрували при пониженому тиску одержуючи неочищену вказану в заголовку сполуку, (S)метил 2-(6-((2',6'-диметил-4'-((1-(метилсульфоніл)піперидин-4-іл)окси)біфеніл-3-іл) метокси)-2,3дигідробензофуран-3-іл)ацетат, 5a (40 мг) як білу тверду речовину, що безпосередньо використовували на наступній стадії без додаткової очистки. МС m/z (EСI): 578,3 [M-1] Стадія 2 (S)-2-(6-((2',6'-Диметил-4'-((1-(метилсульфоніл)піперидин-4-іл)окси)біфеніл3-іл)метокси)2,3-дигідробензофуран-3-іл)оцтова кислота Неочищений (S)-метил 2-(6-((2',6'-диметил-4'-((1-(метилсульфоніл)піперидин-4іл)окси)біфеніл-3-іл)метокси)-2,3-дигідробензофуран-3-іл)ацетат 5a (28 мг, 0,05 ммоль) розчиняли в 5 мл етанолу, після чого додавали 1 M водний розчин гідроксиду натрію (0,5 мл, 0,50 ммоль). Реакційний розчин реагував 1 годину. До одержаного розчину краплями додавали 1 M хлорводневу кислоту, доводячи pH до 5, і екстрагували етилацетатом (20 мл×2). Об'єднані органічні екстракти промивали насиченим розчином хлориду натрію (30 мл), сушили безводним сульфатом магнію і фільтрували. Фільтрат концентрували при пониженому тиску і залишок очищали за допомогою препаративного розділення, одержуючи вказану в заголовку сполуку, (S)-2-(6-((2',6'-диметил-4'((1-(метилсульфоніл)піперидин-4-іл)окси)біфеніл-3-іл)метокси)-2,3дигідробензофуран-3- іл)оцтова кислота, 5 (12 мг, вихід 44,0 %) як білу тверду речовину. МС m/z (EСI): 564,3 [M-1] 1 H ЯМР (400 MГц, CDCl3) δ 7,38-7,45 (м, 2H), 7,18 (с, 1H), 7,05-7,10 (м, 2H), 6,67 (с, 2H), 6,476,51 (м, 2H), 5,07 (с, 2H), 4,77 (н, 1H), 4,57 (с, 1H), 4,30 (н, 1H), 3,82 (н, 1H), 3,36-3,41 (м, 4H), 2,79-2,84 (м, 4H), 2,59-2,66 (м, 1H), 2,00-2,04 (м, 10H). Приклад 6 (S)-2-(6-((4'-((1-Ацетилпіперидин-4-іл)окси)-2',6'-диметилбіфеніл-3-іл)метокси)2,3-дигідробензофуран-3-іл)оцтова кислота O O N O O COOH O O HN Стадія 1 O O O 4a 6a O Стадія 2 O O O O O N O N O O O COOH 6 24 UA 115975 C2 5 10 15 20 25 30 Стадія 1 (S)-метил 2-(6-((4'-((1-Ацетилпіперидин-4-іл)окси)-2',6'-диметилбіфеніл-3- іл)метокси)-2,3дигідробензофуран-3-іл)ацетат (S)-Метил 2-(6-((2',6'-диметил-4'-(піперидин-4-ілокси)біфеніл-3-іл)метокси)-2,3дигідробензофуран-3-іл)ацетат 4a (20 мг, 0,04 ммоль) розчиняли в 2 мл дихлорметану, після чого додавали оцтовий ангідрид (5 мг, 0,05 ммоль) і триетиламін (12 мг, 0,12 ммоль). Реакційний розчин перемішували 2 години. Одержаний розчин концентрували при пониженому тиску і залишок очищали ТШХ, використовуючи систему елюювання A, одержуючи вказану в заголовку сполуку, (S)-метил 2-(6-((4'-((1- ацетилпіперидин-4-іл) окси)-2',6'-диметилбіфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)ацетат, 6a (10 мг, вихід 47,0 %) як безбарвну олію. МС m/z (EСI): 544,3 [M+1] Стадія 2 (S)-2-(6-((4'-((1-Ацетилпіперидин-4-іл)окси)-2',6'-диметилбіфеніл-3-іл)метокси)- 2,3дигідробензофуран-3-іл)оцтова кислота (S)-Метил 2-(6-((4'-((1-ацетилпіперидин-4-іл)окси)-2',6'-диметилбіфеніл-3- іл)метокси)-2,3дигідробензофуран-3-іл)ацетат 6a (10 мг, 0,02 ммоль) розчиняли в 2 мл суміші рощчинників тетрагідрофуран і метанол (О/О = 1:1), після чого додавали 1 M водний розчин гідроксиду літію (0,2 мл, 0,20 ммоль). Реакційний розчин перемішували 2 години. Одержаний розчин концентрували при пониженому тиску, краплями додавали 1 M хлорводневу кислоту, доводячи pH до 5, і екстрагували етилацетатом (20 мл×2). Об'єднані органічні екстракти промивали насиченим розчином хлориду натрію (30 мл), сушили безводним сульфатом магнію і фільтрували. Фільтрат концентрували при пониженому тиску, одержуючи вказану в заголовку сполуку, (S)-2-(6-((4'-((1-ацетилпіперидин-4-іл)окси)2',6'-диметилбіфеніл-3-іл)метокси)-2,3дигідробензофуран-3-іл)оцтова кислота, 6 (8 мг, вихід 84,2 %) як білу тверду речовину. МС m/z (EСI): 530,4 [M+1] 1 H ЯМР (400 MГц, CDCl3) δ 7,37-7,45 (м, 2H), 7,18 (с, 1H), 7,05-7,10 (м, 2H), 6,67 (с, 2H), 6,476,51 (м, 2H), 5,07 (с, 2H), 4,75-4,79 (м, 1H), 4,57 (с, 1H), 4,28-4,31 (м, 1H), 3,73-3,83 (м, 4H), 2,782,83 (м, 1H), 2,58-2,64 (м, 1H), 2,22-2,26 (м, 1H), 2,15 (м, 3H), 1,94-2,06 (м, 10H). Приклад 7 2-((S)-6-((4'-(((S)-1-(трет-бутоксикарбоніл)піролідин-3-іл)окси)-2',6'-диметилбіфеніл3іл)метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота O O O N O O COOH O O O O N OH N Стадія 1 7b 7a 3h N Стадія 2 7c OH O O S Стадія 3 O O O O O O N Стадія 4 O O O N O 7d O O 7 COOH O 35 40 Стадія 1 (R)-трет-Бутил 3-гідроксипіролідин-1-карбоксилат (R)-Піролідин-3-ол 7a (348 мг, 4 ммоль) і триетиламін (808 мг, 8 ммоль) розчиняли в 20 мл дихлорметану, після чого додавали ди-трет-бутилдикарбонат (959 мг, 4,40 ммоль) на бані з льодом. Реакційний розчин нагрівали до кімнатної температури і перемішували 3 години. До одержаного розчину додавали 50 мл дихлорметану, промивали насиченим розчином хлориду натрію (5 мл×3), сушили безводним сульфатом магнію і фільтрували. Фільтрат концентрували при пониженому тиску. Залишок очищали колонковою хроматографією на силікагелі, використовуючи систему елюювання B, одержуючи вказану в заголовку сполуку, (R)-трет-бутил 3-гідроксипіролідин-1-карбоксилат, 7b (400 мг, вихід 53,4 %) як безбарвну олію. Стадія 2 (R)-трет-Бутил 3-((метилсульфоніл)окси)піролідин-1-карбоксилат 25 UA 115975 C2 5 10 15 20 25 30 35 40 45 (R)-трет-Бутил 3-гідроксипіролідин-1-карбоксилат 7b (375 мг, 2 ммоль) розчиняли в 10 мл дихлорметану на бані з льодом, після чого додавали триетиламін (404 мг, 4 ммоль) і метансульфонілхлорид (274 мг, 2,40 ммоль). Реакційний розчин нагрівали до кімнатної температури і перемішували 3 години. До одержаного розчину додавали 5 мл води і екстрагували дихлорметаном (20 мл×3). Об'єднані органічні екстракти промивали насиченим розчином хлориду натрію (30 мл), сушили безводним сульфатом магнію і фільтрували. Фільтрат концентрували при пониженому тиску одержуючи неочищену вказану в заголовку сполуку, (R)трет-бутил 3-((метилсульфоніл)окси)- піролідин-1-карбоксилат, 7c (530 мг) як жовту олію, що безпосередньо використовували на наступній стадії без додаткової очистки. Стадія 3 Метил 2-(((S)-6-((4'-((S)-1-(трет-бутоксикарбоніл)піролідин-3-іл)окси)-2',6'- диметилбіфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)ацетат (R)-трет-Бутил 3-((метилсульфоніл)окси)піролідин-1-карбоксилат 7c (190 мг, 0,72 ммоль), метил (S)-2-(6-((4'-гідроксил-2',6'-диметилбіфеніл-3-іл)метокси)-2,3дигідробензофуран-3іл)ацетат 3h (200 мг, 0,48 ммоль) і карбонат цезію (310 мг, 0,96 ммоль) розчиняли в 10 мл N, Nдиметилформаміду. Реакційний розчин нагрівали до 80 C і перемішували 12 годин. До одержаного розчину додавали 5 мл води і 50 мл етилацетату. Органічну фазу промивали насиченим розчином хлориду натрію (20 мл), сушили безводним сульфатом натрію і фільтрували. Фільтрат концентрували при пониженому тиску і залишок очищали за допомогою системи елюювання B, одержуючи вказану в заголовку сполуку метил 2-(((S)-6-((4'-((S)-1-(третбутоксикарбоніл)піролідин-3-іл)окси)-2',6'-диметилбіфеніл3-іл)метокси)-2,3дигідробензофуран-3-іл)ацетат, 7d (130 мг, вихід 46,4 %) як безбарвну олію. МС m/z (EСI): 488,2 [M-99] Стадія 4 2-((S)-6-((4'-(((S)-1-(трет-бутоксикарбоніл)піролідин-3-іл)окси)-2',6'диметилбіфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота Метил 2-(((S)-6-((4'-((S)-1-(трет-бутоксикарбоніл)піролідин-3-іл)окси)-2',6'- диметилбіфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)ацетат 7d (30 мг, 0,05 ммоль) розчиняли в 4 мл суміші розчинників тетрагідрофуран і метанол (О/О = 1:1), після чого додавали 1 M водний розчин гідроксиду літію (0,1 мл, 0,10 ммоль). Реакційний розчин перемішували 2 години. Одержаний розчин концентрували при пониженому тиску, краплями додавали 1 M хлорводневу кислоту, доводячи pH до 5, і екстрагували етилацетатом (20 мл×2). Об'єднані органічні екстракти промивали насиченим розчином хлориду натрію (30 мл), сушили безводним сульфатом магнію і фільтрували. Фільтрат концентрували при пониженому тиску і залишок очищали ТШХ, використовуючи систему елюювання A, одержуючи вказану в заголовку сполуку, 2-((S)-6-((4'(((S)-1-(третбутоксикарбоніл)піролідин-3-іл)окси)-2',6'-диметилбіфеніл-3-іл)метокси)-2,3дигідробензо-фуран-3-іл)оцтова кислота, 7 (10 мг, вихід 34,4 %) як білу тверду речовину. МС m/z (EСI): 572,3 [M-1] 1 H ЯМР (400 MГц, CDCl3) δ 7,37-7,45 (м, 2H), 7,18(с, 1H), 7,05-7,10 (м, 2H), 6,63 (с, 2H), 6,476,51 (м, 2H), 5,07 (с, 2H), 4,91 (с, 1H), 4,75-4,79 (м, 1H), 4,28-4,32 (м, 1H), 3,80-3,86 (м, 1H), 3,523,67 (м, 3H), 2,78-2,84 (м, 1H), 2,59-2,65 (м, 1H), 2,59-2,66 (м, 1H), 2,22-2,24 (м, 1H), 2,00-2,03 (м, 7H), 1,49 (с, 9H). Приклад 8 2-((S)-6-((2',6'-Диметил-4'-(((S)-1-(метилсульфоніл)піролідин-3-іл)окси)біфеніл-3-іл)-метокси)2,3-дигідробензофуран-3-іл)оцтова кислота O O S N O O O COOH 26 UA 115975 C2 O O O N H N O O O Стадія 1 O O O O 8a 7d O O O O Стадія 2 O S N O O S N Стадія 3 O O O O O O 8b 8 COOH O 5 10 15 20 25 30 35 40 45 Стадія 1 Метил 2-((S)-6-((2',6'-диметил-4'-((S)-піролідин-3-ілокси)біфеніл-3іл)метокси)-2,3дигідробензофуран-3-іл)ацетат Метил 2-(((S)-6-((4'-((S)-1-(трет-бутоксикарбоніл)піролідин-3-іл)окси)-2',6'- диметилбіфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)ацетат 7d (100 мг, 0,17 ммоль) розчиняли в 3 мл дихлорметану, після чого додавали 2 мл трифтороцтової кислоти на бані з льодом. Реакційний розчин перемішували 1 годину. Одержаний розчин концентрували при пониженому тиску одержуючи неочищену вказану в заголовку сполуку, метил 2-((S)-6-((2',6'-диметил-4'-((S)піролідин-3-ілокси)біфеніл-3-іл)метокси)-2,3-дигідробензофуран-3-іл)ацетат, 8a (90 мг) як безбарвну олію, що безпосередньо використовували на наступній стадії без додаткової очистки. Стадія 2 Метил 2-((S)-6-((2',6'-диметил- 4'-(((S)-1-(метилсульфоніл)піролідин-3- іл)окси)біфеніл-3-іл) метокси)-2,3-дигідробензофуран-3-іл)ацетат Неочищений метил 2-((S)-6-((2',6'-диметил-4'-((S)-піролідин-3-ілокси)біфеніл-3- іл)метокси)2,3-дигідробензофуран-3-іл)ацетат 8a (45 мг, 0,09 ммоль) розчиняли в 3 мл дихлорметану, після чого додавали метансульфонілхлорид (13 мг, 0,11 ммоль) і триетиламін (18 мг, 0,18 ммоль). Реакційний розчин перемішували 2 години. До одержаного розчину додавали 30 мл етилацетату. Органічну фазу промивали насиченим розчином хлориду натрію (30 мл), сушили безводним сульфатом магнію і фільтрували. Фільтрат концентрували при пониженому тиску і залишок очищали ТШХ, використовуючи систему елюювання A, одержуючи вказану в заголовку сполуку, метил 2-((S)-6-((2',6'-диметил-4'-(((S)-1-(метилсульфоніл)піролідин-3-іл)окси)біфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)ацетат, 8b (40 мг, вихід 77,0 %) як безбарвну олію. МС m/z (EСI): 583,4 [M+18] Стадія 3 2-((S)-6-((2',6'-Диметил-4'-(((S)-1-(метилсульфоніл)піролідин-3- іл)окси)біфеніл-3-іл)метокси)2,3-дигідробензофуран-3-іл)оцтова кислота Метил 2-((S)-6-((2',6'-диметил-4'-(((S)-1-(метилсульфоніл)піролідин-3іл)окси)біфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)ацетат 8b (30 мг, 0,05 ммоль) розчиняли в 2 мл суміші розчинників тетрагідрофуран і метанол (О/О = 1:1), після чого додавали 1 M водний розчин гідроксиду літію (0,1 мл, 0,10 ммоль). Реакційний розчин перемішували 2 години. Одержаний розчин концентрували при пониженому тиску, краплями додавали 1 M хлорводневу кислоту, доводячи pH до 5, і екстрагували етилацетатом (20 мл×2). Об'єднані органічні екстракти промивали насиченим розчином хлориду натрію (30 мл), сушили безводним сульфатом магнію і фільтрували. Фільтрат концентрували при пониженому тиску, одержуючи вказану в заголовку сполуку, 2-((S)-6-((2',6'-диметил-4'-(((S)-1-(метилсульфоніл)піролідин-3-іл)окси)біфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)оцтова кислота, 8 (28 мг, вихід 94,2 %) як білу тверду речовину. МС m/z (EСI): 550,2 [M-1] 1 H ЯМР (400 MГц, CDCl3) δ 7,38-7,46 (м, 2H), 7,17 (с, 1H), 7,05-7,09 (м, 2H), 6,59 (с, 2H), 6,476,52 (м, 2H), 5,07 (с, 2H), 4,96 (с, 1H), 4,75-4,79 (м, 1H), 4,28-4,32 (м, 1H), 3,80-3,86 (м, 1H), 3,613,67 (м, 3H), 3,45-3,52 (м, 1H), 2,88 (с, 3H), 2,79-2,84 (м, 1H), 2,59-2,66 (м, 1H), 2,33-2,38 (м, 1H), 2,17-2,25 (м, 1H), 1,99 (с, 6H). Приклад 9 2-((S)-6-((4'-(((S)-1-Ацетилпіролідин-3-іл)окси)-2',6'-диметилбіфеніл-3-іл)метокси)-2,3дигідробензофуран-3-іл)оцтова кислота 27 UA 115975 C2 O O N O O COOH O H N O Стадія 1 O O N O O O 8a 9a O O O O O O N Стадія 2 O O COOH 9 5 10 15 20 25 30 35 Стадія 1 Метил 2-((S)-6-((4'-(((S)-1-ацетилпіролідин-3-іл)окси)-2',6'-диметилбіфеніл-3- іл)метокси)-2,3дигідробензофуран-3-іл)ацетат Неочищений метил 2-((S)-6-((2',6'-диметил-4'-((S)-піролідин-3-ілокси)біфеніл- 3-іл)метокси)2,3-дигідробензофуран-3-іл)ацетат 8a (45 мг, 0,09 ммоль) розчиняли в 3 мл дихлорметану, після чого додавали оцтовий ангідрид (13 мг, 0,11 ммоль) і триетиламін (18 мг, 0,18 ммоль). Реакційний розчин перемішували 2 години. До одержаного розчину додавали 20 мл дихлорметану. Органічну фазу промивали насиченим розчином хлориду натрію (30 мл), сушили безводним сульфатом магнію і фільтрували. Фільтрат концентрували при пониженому тиску одержуючи неочищену вказану в заголовку сполуку метил 2-((S)-6-((4'-(((S)-1-ацетилпіролідин-3іл)окси)-2',6'-диметилбіфеніл-3-іл)метокси)- 2,3-дигідробензофуран-3-іл)ацетат, 9a (45 мг, вихід 92,5 %) як безбарвну олію. МС m/z (EСI): 530,4 [M+1] Стадія 2 2-((S)-6-((4'-(((S)-1-Ацетилпіролідин-3-іл)окси)-2',6'-диметилбіфеніл-3іл)метокси)-2,3дигідробензофуран-3-іл)оцтова кислота Неочищений метил 2-((S)-6-((4'-(((S)-1-ацетилпіролідин-3-іл)окси)-2',6'- диметилбіфеніл-3іл)метокси)-2,3-дигідробензофуран-3-іл)ацетат 9a (40 мг, 0,08 ммоль) розчиняли в 2 мл суміші розчинників тетрагідрофуран і метанол (О/О = 1:1), після чого додавали 1 M водний розчин гідроксиду літію (0,4 мл, 0,40 ммоль). Реакційний розчин перемішували 3 години. Одержаний розчин концентрували при пониженому тиску. До залишку додавали 10 мл води, краплями додавали 1 M хлорводневу кислоту, доводячи pH до 3, і екстрагували етилацетатом (20 мл×2). Об'єднані органічні екстракти промивали насиченим розчином хлориду натрію (30 мл), сушили безводним сульфатом магнію і фільтрували. Фільтрат концентрували при пониженому тиску і залишок очищали ТШХ, використовуючи систему елюювання A, одержуючи вказану в заголовку сполуку, 2-((S)-6-((4'-(((S)-1-ацетилпіролідин-3-іл)окси)-2',6'-диметилбіфеніл-3-іл)метокси)-2,3дигідробензофуран-3-іл)оцтова кислота 9 (20 мг, вихід 51,3 %) як білу тверду речовину. МС m/z (EСI): 514,3 [M-1] 1 H ЯМР (400 MГц, CDCl3) δ 7,41 (дд, 2H), 7,15 (д, 1H), 7,05 (д, 2H), 6,61 (д, 2H), 6,52-6,42 (м, 2H), 5,06 (с, 2H), 4,97 (д, 1H), 4,76 (дд, 1H), 4,28 (дд, 1H), 3,93-3,56 (м, 5H), 2,79 (дд, 1H), 2,60 (дд, 1H), 2,40-2,17 (м, 2H), 2,16-2,07 (м, 3H), 2,02-1,92 (м, 6H). Приклад 10 (S)-2-(6-((4'-(Циклопентилокси)-2',6'-диметилбіфеніл-3-іл)метокси)-2,3- дигідробензофуран-3іл)оцтова кислота O O O COOH 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPolycyclic derivatives, preparation method and medical uses thereof
Автори англійськоюYang, Fanglong, Dong, Qing, Han, Jihui, Wang, Chunfei, Zhang, Ling, Wang, Yang
Автори російськоюЯнг Фанглонг, Донг Квинг, Хан Джигуй, Ванг Чунфэй, Жанг Линг, Ванг Янг
МПК / Мітки
МПК: C07D 307/79, C07D 407/12, A61K 31/343, C07D 405/12
Мітки: похідні, gpr40, метаболічного, лікування, агоністи, отримання, поліциклічні, синдрому, діабету, спосіб
Код посилання
<a href="https://ua.patents.su/57-115975-policiklichni-pokhidni-yak-agonisti-gpr40-dlya-likuvannya-diabetu-ta-metabolichnogo-sindromu-ta-sposib-kh-otrimannya.html" target="_blank" rel="follow" title="База патентів України">Поліциклічні похідні як агоністи gpr40 для лікування діабету та метаболічного синдрому та спосіб їх отримання</a>
Попередній патент: Пестицидні суміші, які включають спірогетероциклічні піролідиндіони
Наступний патент: Системи та способи для основаного на пріоритеті керування сеансами та мобільністю двопріоритетних пристроїв мтс
Випадковий патент: Спосіб знешкодження токсичних речовин