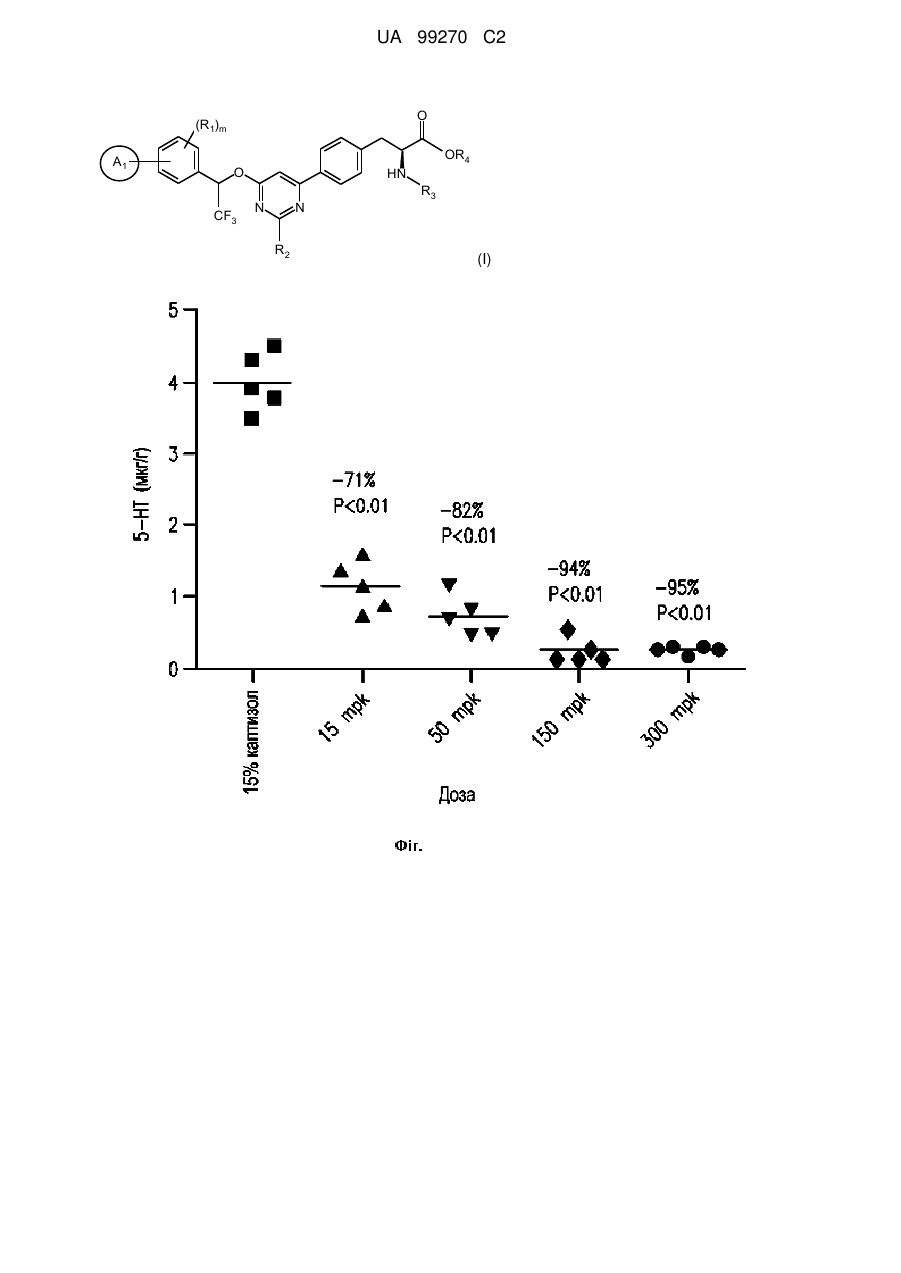
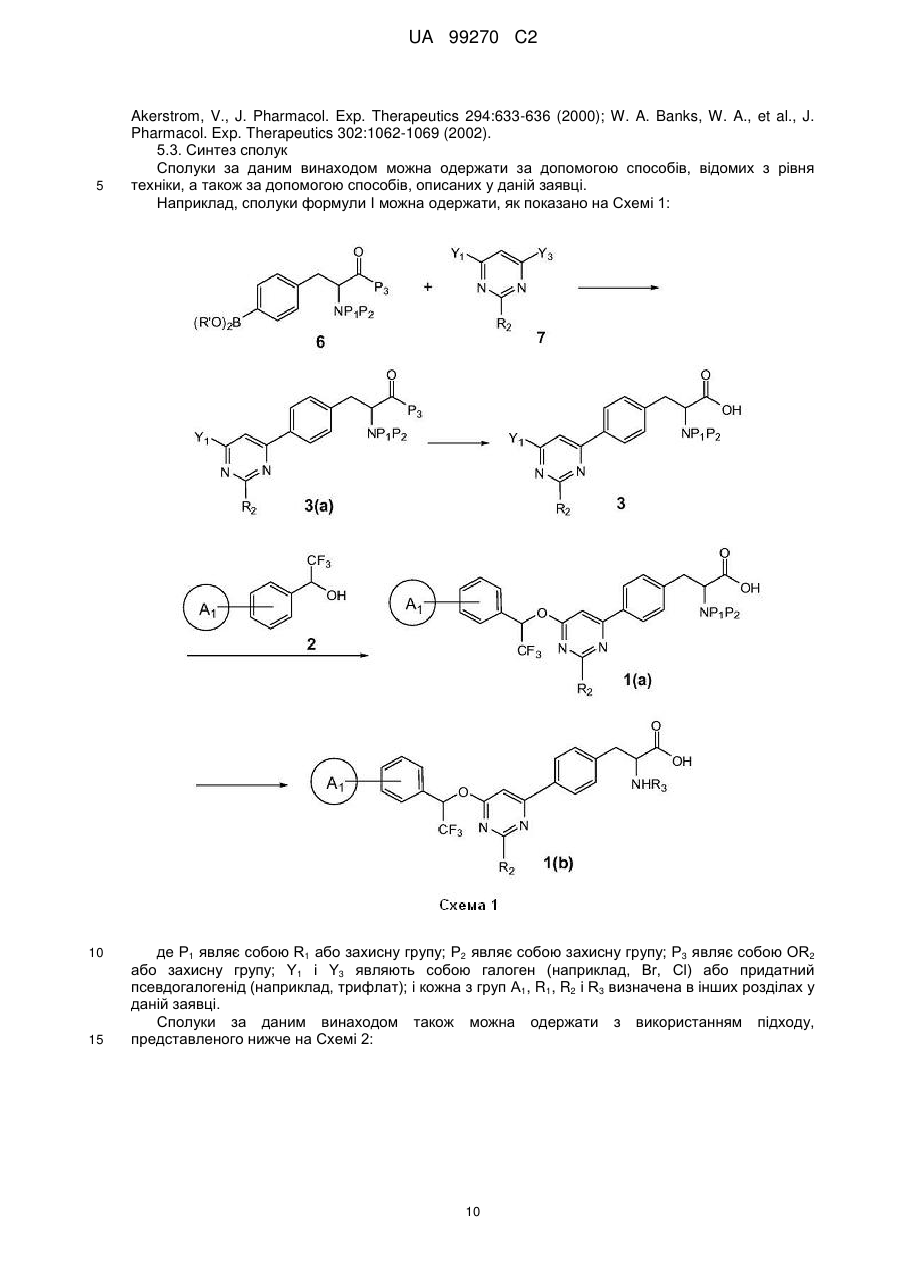
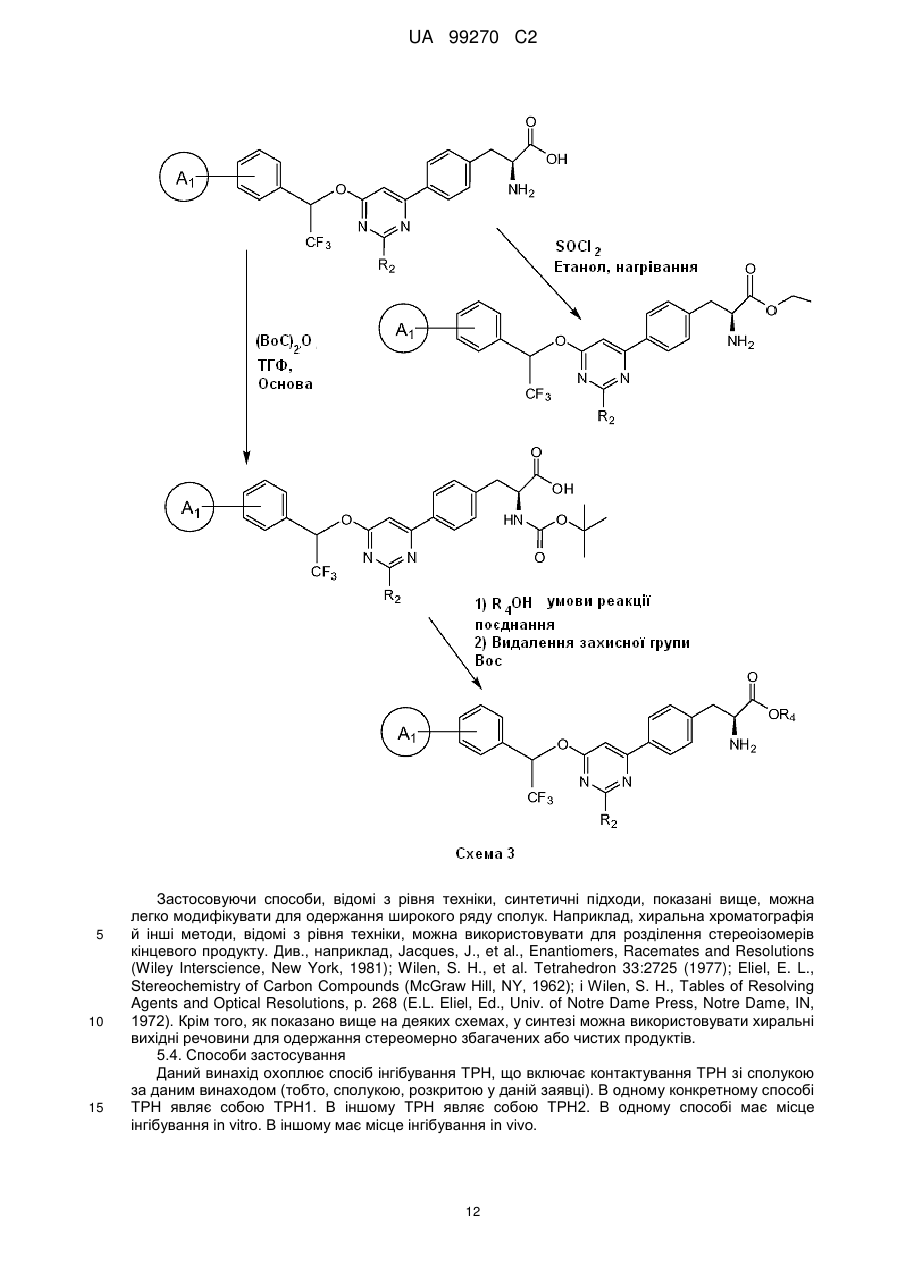
Сполуки на основі 4-феніл-6-(2,2,2-трифтор-1-фенілетокси)піримідину і їх застосування
Номер патенту: 99270
Опубліковано: 10.08.2012
Автори: Чжан Ченьмінь, Ван Ін, Цзинь Хайхун, Девасагаярадж Арокіасамі, Ши Чжи-Цай, Туноорі Ашок
Формула / Реферат
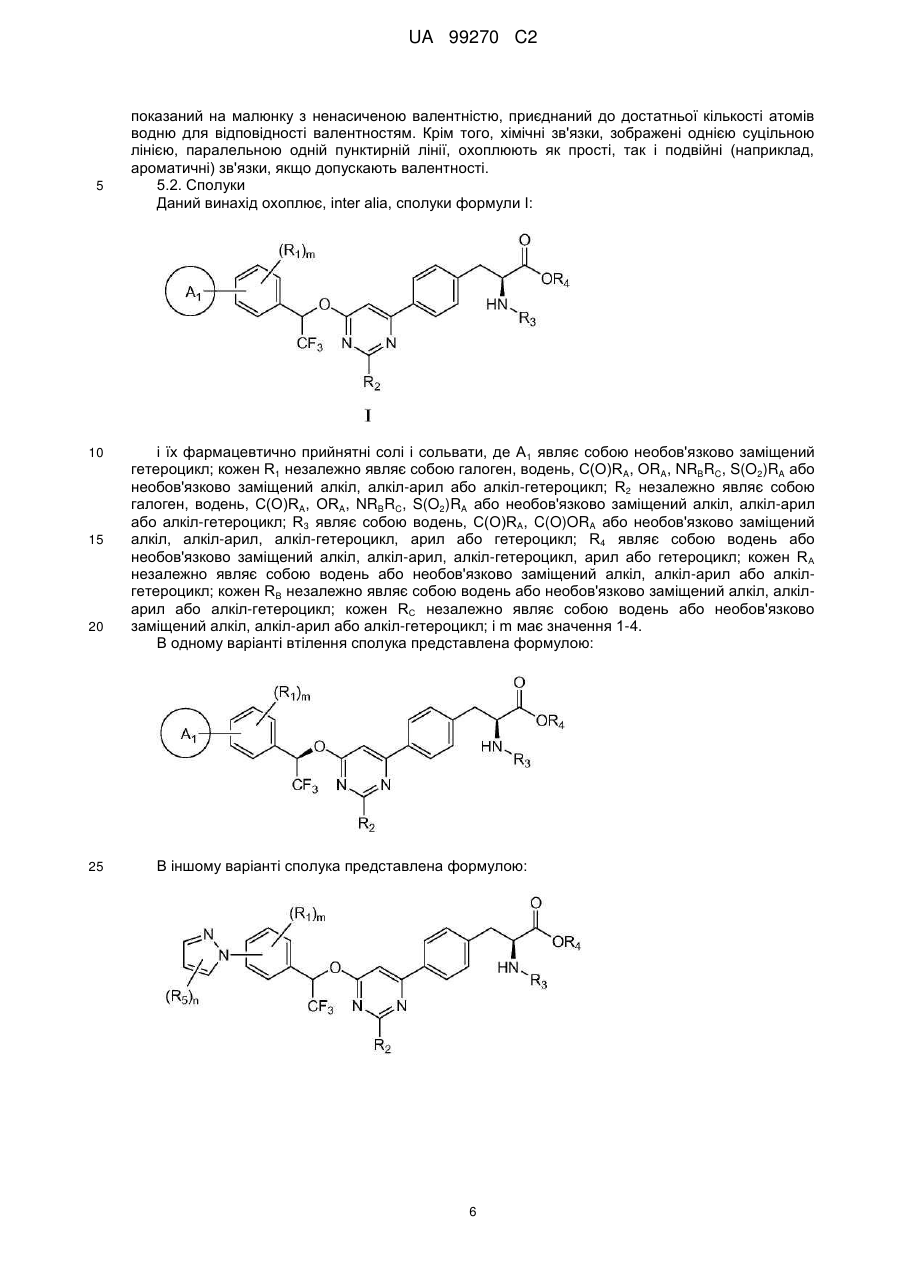
1. Сполука формули І:
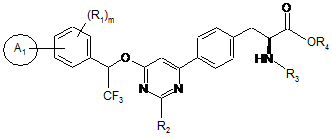 , I
, I
її фармацевтично прийнятна сіль і сольват,
де
А1 являє собою необов'язково заміщений гетероцикл;
кожен R1 незалежно являє собою галоген, водень, C(O)RA, ORA, NRBRC, S(O2)RA або необов'язково заміщений алкіл, алкіларил або алкілгетероцикл;
R2 незалежно являє собою галоген, водень, C(O)RA, ORA, NRBRC, S(O2)RA або необов'язково заміщений алкіл, алкіларил або алкілгетероцикл;
R3 являє собою водень, C(O)RA, C(O)ORA або необов'язково заміщений алкіл, алкіларил, алкілгетероцикл, арил або гетероцикл;
R4 являє собою водень або необов'язково заміщений алкіл, алкіларил, алкілгетероцикл, арил або гетероцикл;
кожен RA незалежно являє собою водень або необов'язково заміщений алкіл, алкіларил або алкілгетероцикл;
кожен RB незалежно являє собою водень або необов'язково заміщений алкіл, алкіларил або алкілгетероцикл;
кожен RC незалежно являє собою водень або необов'язково заміщений алкіл, алкіларил або алкілгетероцикл; і
m має значення 1-4.
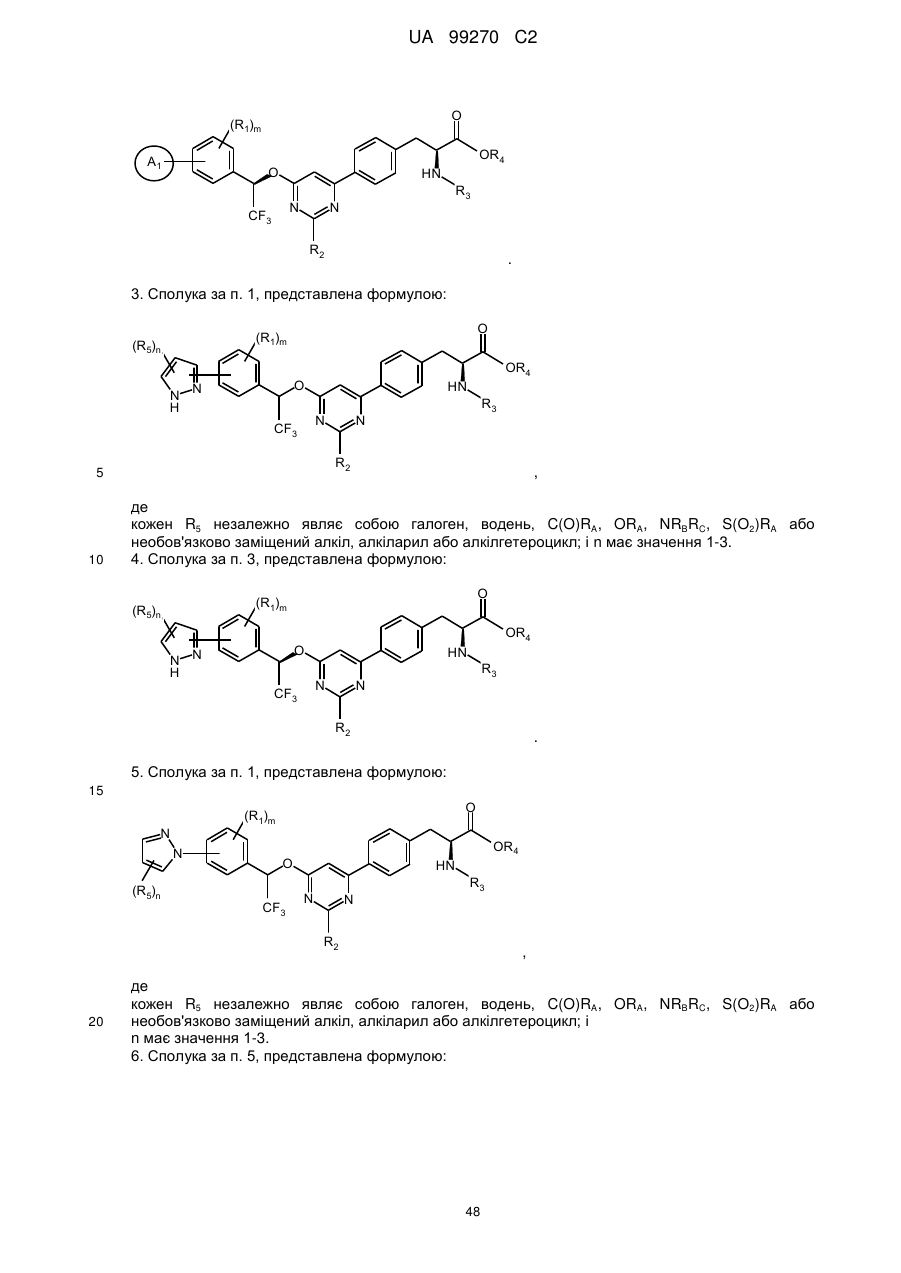
2. Сполука за п. 1, представлена формулою:
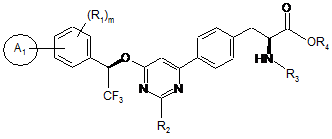 .
.
3. Сполука за п. 1, представлена формулою:
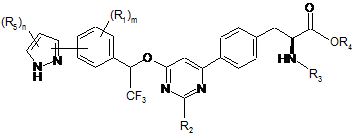 ,
,
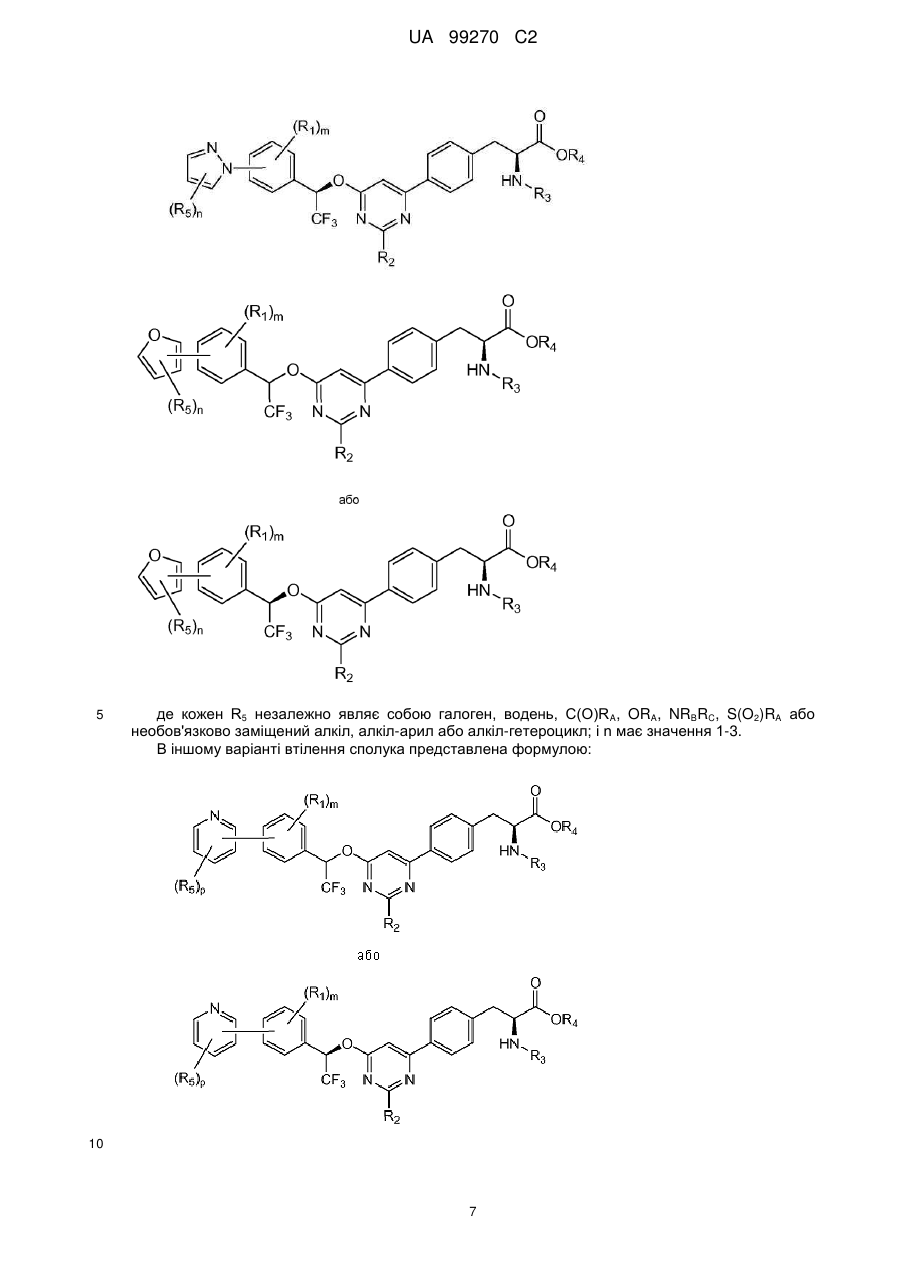
де
кожен R5 незалежно являє собою галоген, водень, C(O)RA, ORA, NRBRC, S(O2)RA або необов'язково заміщений алкіл, алкіларил або алкілгетероцикл; і n має значення 1-3.
4. Сполука за п. 3, представлена формулою:
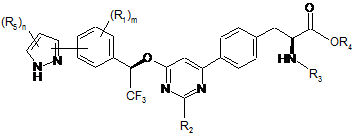 .
.
5. Сполука за п. 1, представлена формулою:
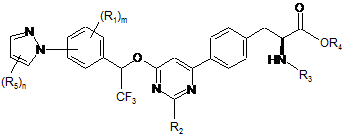 ,
,
де
кожен R5 незалежно являє собою галоген, водень, C(O)RA, ORA, NRBRC, S(O2)RA або необов'язково заміщений алкіл, алкіларил або алкілгетероцикл; і
n має значення 1-3.
6. Сполука за п. 5, представлена формулою:
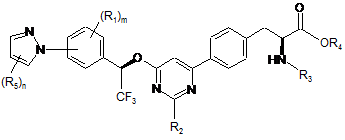 .
.
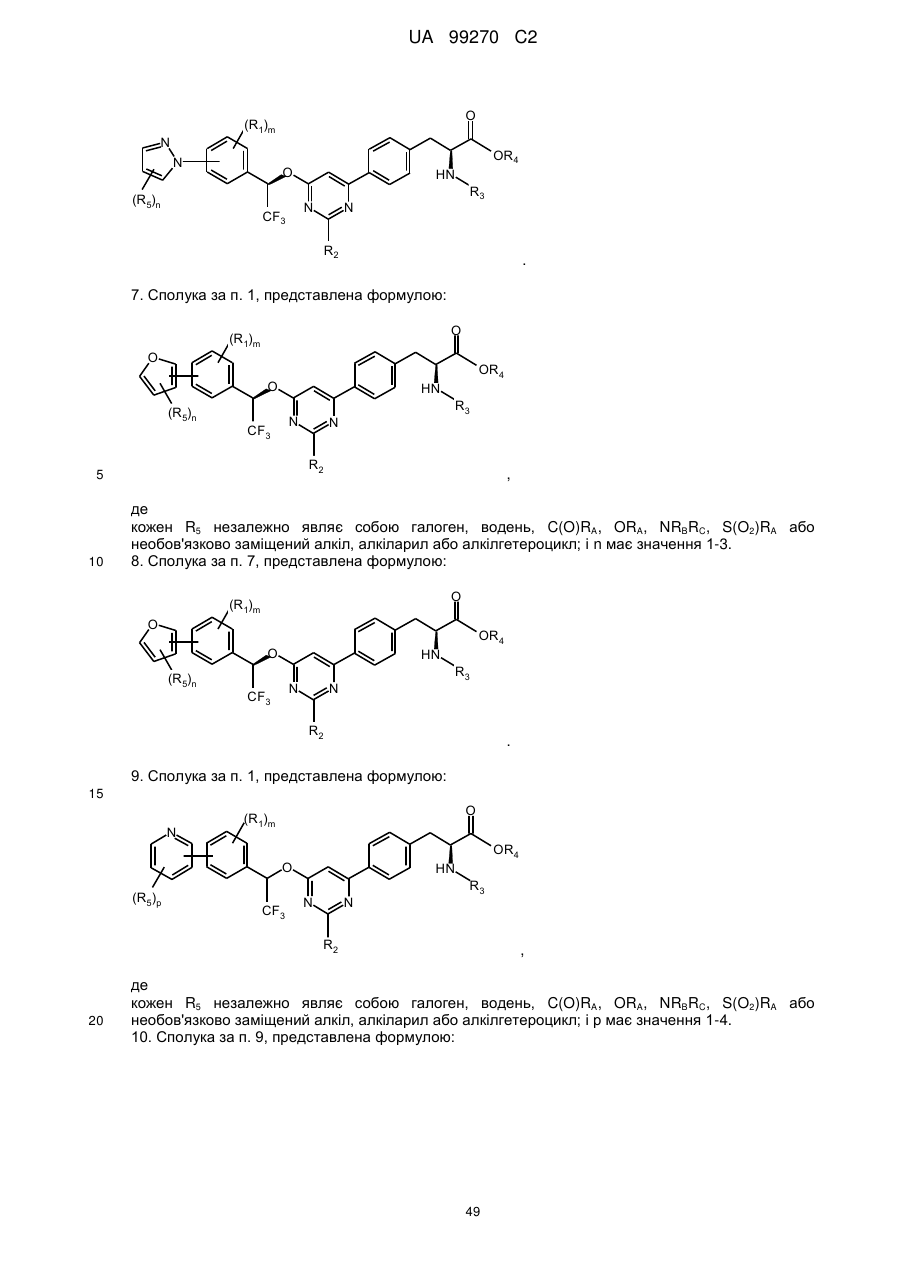
7. Сполука за п. 1, представлена формулою:
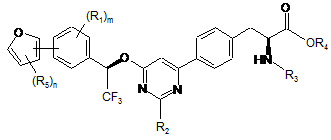 ,
,
де
кожен R5 незалежно являє собою галоген, водень, C(O)RA, ORA, NRBRC, S(O2)RA або необов'язково заміщений алкіл, алкіларил або алкілгетероцикл; і n має значення 1-3.
8. Сполука за п. 7, представлена формулою:
 .
.
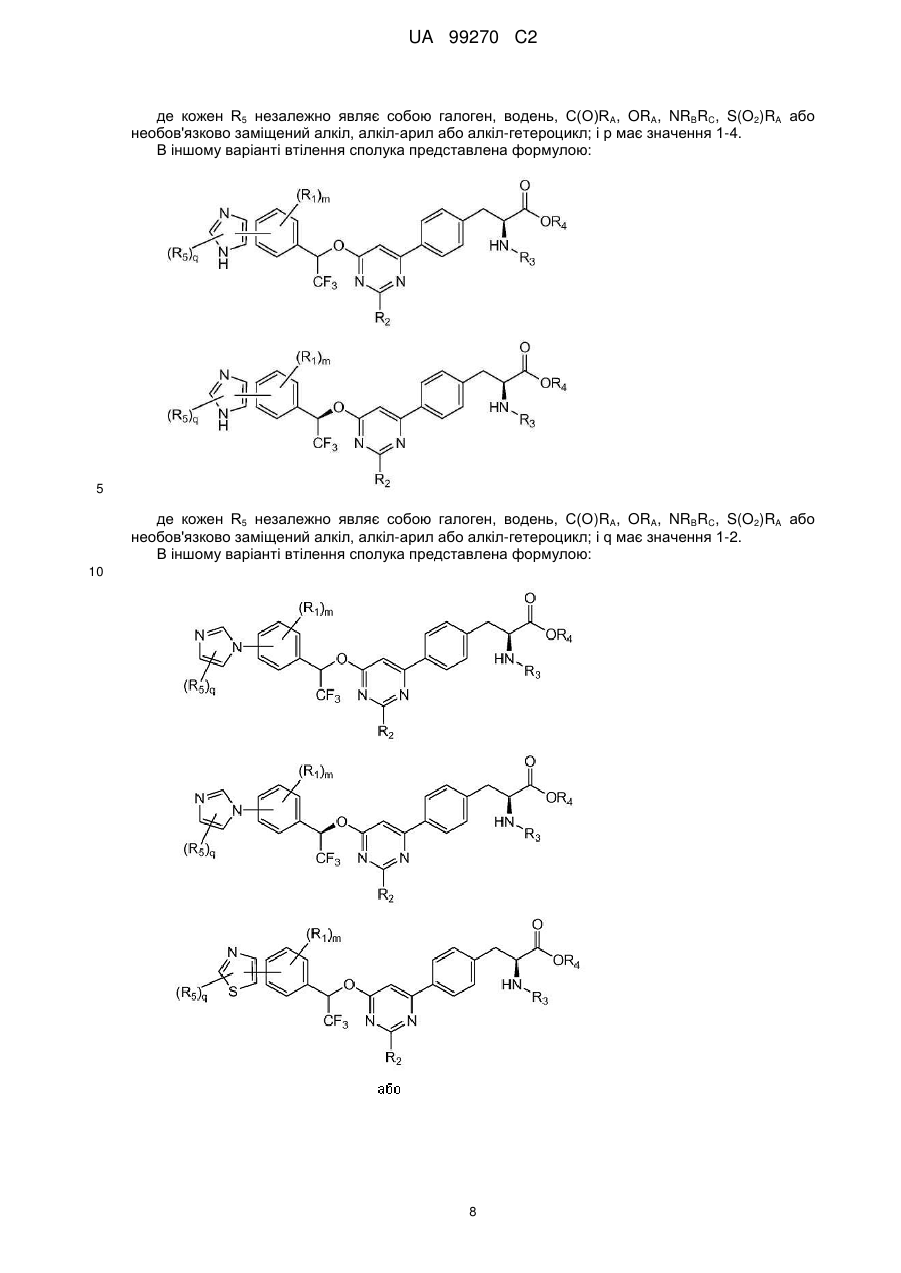
9. Сполука за п. 1, представлена формулою:
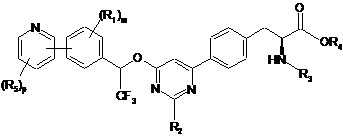 ,
,
де
кожен R5 незалежно являє собою галоген, водень, C(O)RA, ORA, NRBRC, S(O2)RA або необов'язково заміщений алкіл, алкіларил або алкілгетероцикл; і р має значення 1-4.
10. Сполука за п. 9, представлена формулою:
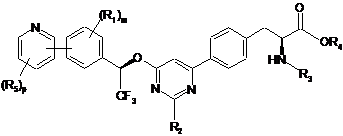 .
.
11. Сполука за п. 1, представлена формулою:
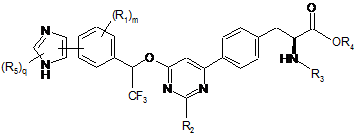 ,
,
де
кожен R5 незалежно являє собою галоген, водень, C(O)RA, ORA, NRBRС, S(O2)RA або необов'язково заміщений алкіл, алкіларил або алкілгетероцикл; і q має значення 1-2.
12. Сполука за п. 11, представлена формулою:
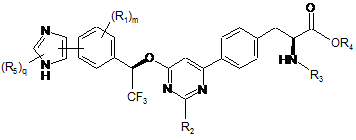 .
.
13. Сполука за п. 1, представлена формулою:
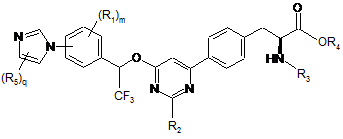 ,
,
де
кожен R5 незалежно являє собою галоген, водень, C(O)RA, ORA, NRBRC, S(O2)RA або необов'язково заміщений алкіл, алкіларил або алкілгетероцикл; і q має значення 1-2.
14. Сполука за п. 13, представлена формулою:
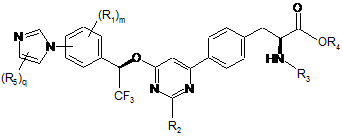 .
.
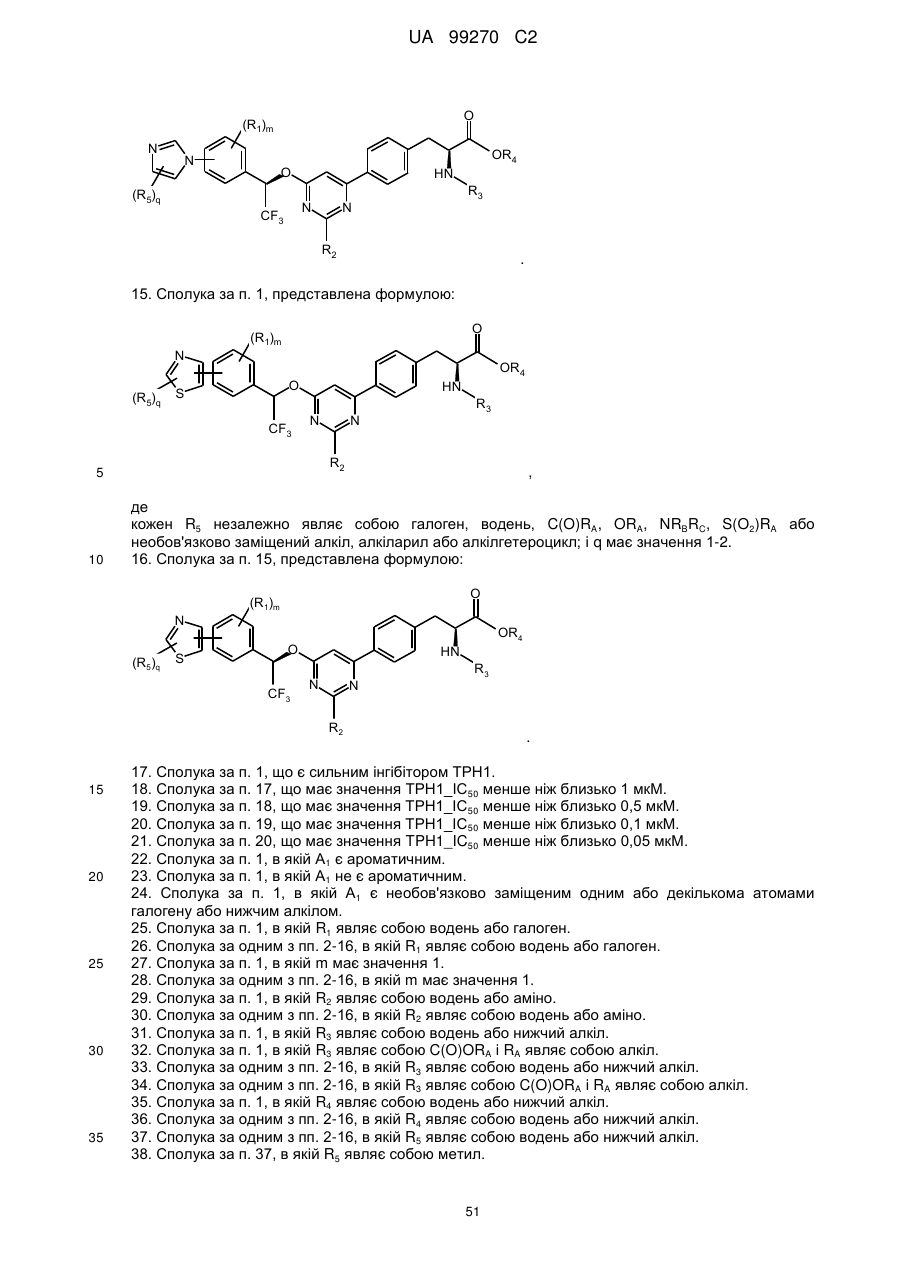
15. Сполука за п. 1, представлена формулою:
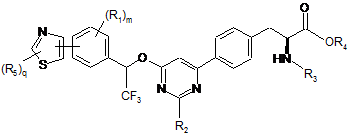 ,
,
де
кожен R5 незалежно являє собою галоген, водень, C(O)RA, ORA, NRBRC, S(O2)RA або необов'язково заміщений алкіл, алкіларил або алкілгетероцикл; і q має значення 1-2.
16. Сполука за п. 15, представлена формулою:
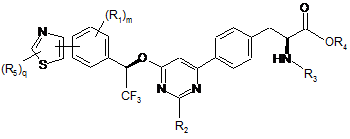 .
.
17. Сполука за п. 1, що є сильним інгібітором ТРН1.
18. Сполука за п. 17, що має значення ТРН1_ІС50 менше ніж близько 1 мкМ.
19. Сполука за п. 18, що має значення ТРН1_ІС50 менше ніж близько 0,5 мкМ.
20. Сполука за п. 19, що має значення ТРН1_ІС50 менше ніж близько 0,1 мкМ.
21. Сполука за п. 20, що має значення TPH1_IC50 менше ніж близько 0,05 мкМ.
22. Сполука за п. 1, в якій А1 є ароматичним.
23. Сполука за п. 1, в якій А1 не є ароматичним.
24. Сполука за п. 1, в якій А1 є необов'язково заміщеним одним або декількома атомами галогену або нижчим алкілом.
25. Сполука за п. 1, в якій R1 являє собою водень або галоген.
26. Сполука за одним з пп. 2-16, в якій R1 являє собою водень або галоген.
27. Сполука за п. 1, в якій m має значення 1.
28. Сполука за одним з пп. 2-16, в якій m має значення 1.
29. Сполука за п. 1, в якій R2 являє собою водень або аміно.
30. Сполука за одним з пп. 2-16, в якій R2 являє собою водень або аміно.
31. Сполука за п. 1, в якій R3 являє собою водень або нижчий алкіл.
32. Сполука за п. 1, в якій R3 являє собою C(O)ORA і RA являє собою алкіл.
33. Сполука за одним з пп. 2-16, в якій R3 являє собою водень або нижчий алкіл.
34. Сполука за одним з пп. 2-16, в якій R3 являє собою C(O)ORA і RA являє собою алкіл.
35. Сполука за п. 1, в якій R4 являє собою водень або нижчий алкіл.
36. Сполука за одним з пп. 2-16, в якій R4 являє собою водень або нижчий алкіл.
37. Сполука за одним з пп. 2-16, в якій R5 являє собою водень або нижчий алкіл.
38. Сполука за п. 37, в якій R5 являє собою метил.
39. Сполука за одним з пп. 3-8, в якій n має значення 1.
40. Сполука за п. 9 або 10, в якій р має значення 1.
41. Сполука за одним з пп. 11-16, в якій q має значення 1.
42. Сполука або її фармацевтично прийнятна сіль або сольват, вибрана з групи:
(S)-2-аміно-3-(4-{2-аміно-6-[2,2,2-трифтор-1-(4-піридин-4-ілфеніл)етокси]піримідин-4-іл}феніл)пропіонова кислота;
(S)-2-аміно-3-(4-{6-[2,2,2-трифтор-1-(2-піридин-4-ілфеніл)етокси]піримідин-4-іл}феніл)пропіонова кислота;
(S)-2-аміно-3-(4-{2-аміно-6-[2,2,2-трифтор-1-(2-(4-метилтіофен-3-іл)феніл]етокси}піримідин-4-іл)феніл]пропіонова кислота;
(S)-2-аміно-3-(4-{2-аміно-6-[2,2,2-трифтор-1-(2-(5-метилтіофен-3-іл)феніл]етокси}піримідин-4-іл)феніл]пропіонова кислота;
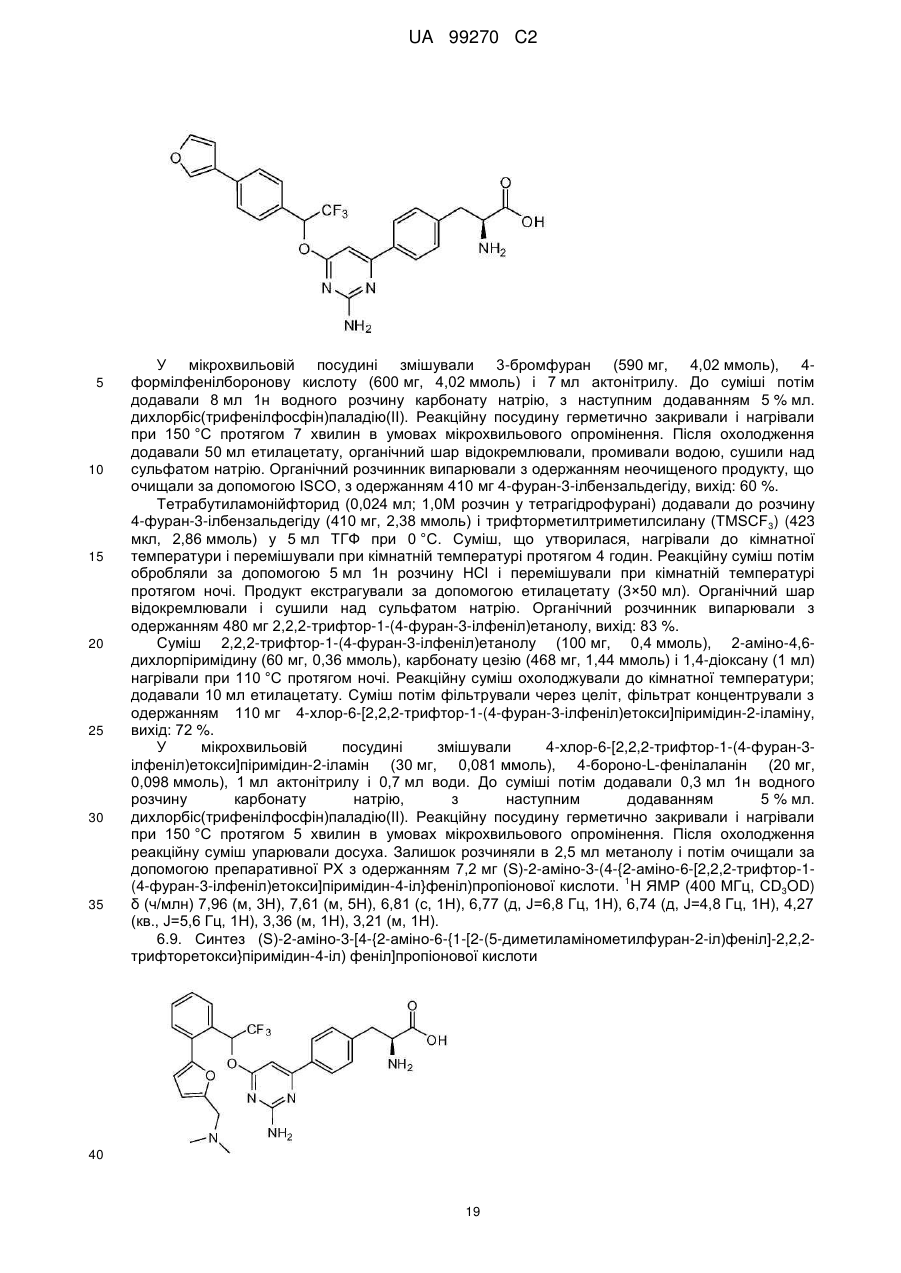
(S)-2-аміно-3-(4-{2-аміно-6-[2,2,2-трифтор-1-(4-фуран-3-ілфеніл)етокси]піримідин-4-іл}феніл)пропіонова кислота;
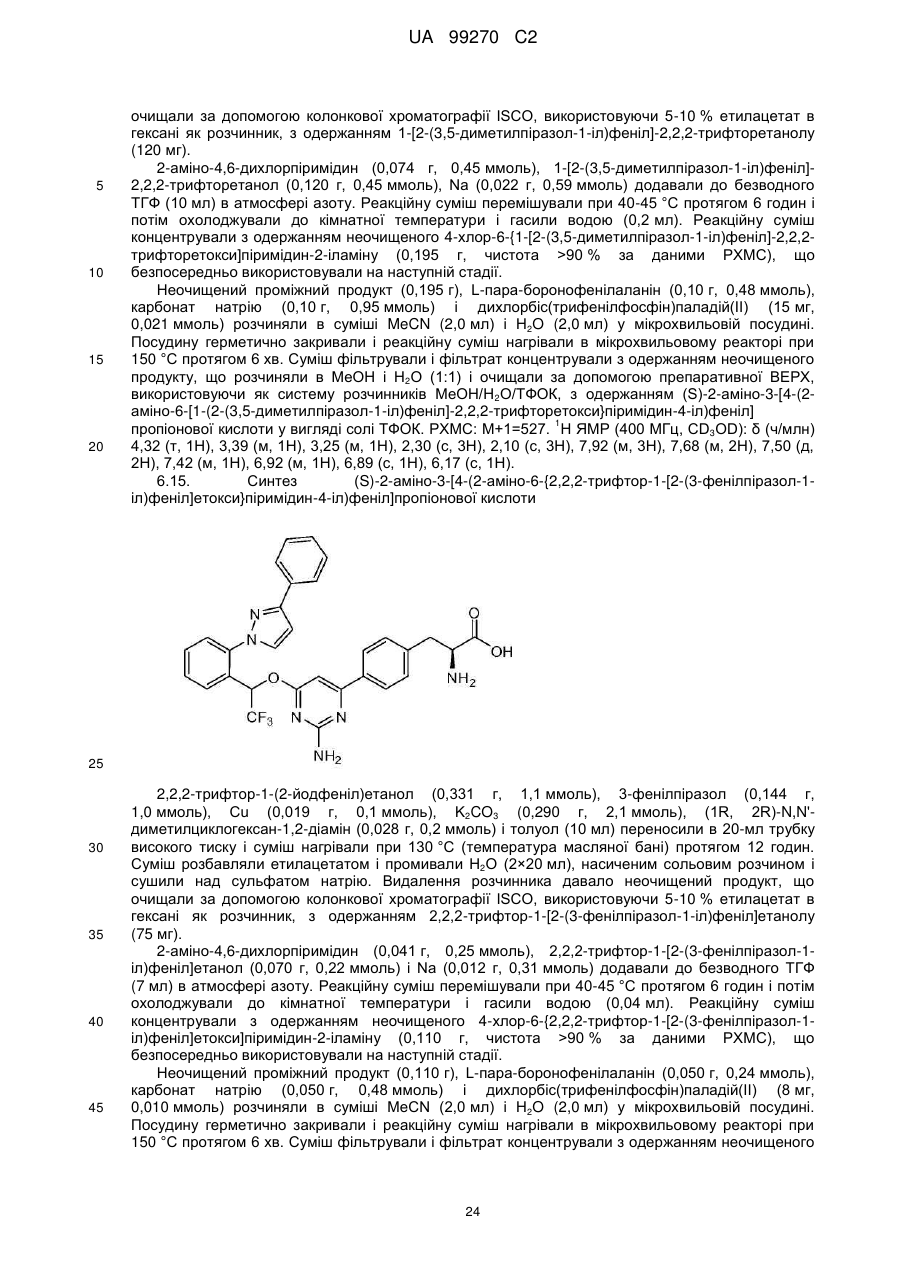
(S)-2-аміно-3-[4-{2-аміно-6-{1-[2-(5-диметиламінометилфуран-2-іл)феніл]-2,2,2-трифторетокси}піримідин-4-іл)феніл]пропіонова кислота;
(S)-2-аміно-3[4-(2-аміно-6-{1-[2-(6-ціанопіридин-3-іл)феніл]-2,2,2-трифторетокси}піримідин-4-іл)феніл]пропіонова кислота;
(S)-2-аміно-3-(4-{2-аміно-6-[2,2,2-трифтор-1-(2-імідазол-1-ілфеніл)етокси]піримідин-4-іл}феніл)пропіонова кислота;
(S)-2-аміно-3-(4-{6-[2,2,2-трифтор-1-(2-піразол-1-ілфеніл)етокси]піримідин-4-іл}феніл)пропіонова кислота;
(S)-2-аміно-3-[4-(2-аміно-6-{2,2,2-трифтор-1-[2-(3-трифторметилпіразол-1-іл)феніл]етокси}піримідин-4-іл)феніл]пропіонова кислота;
(S)-2-аміно-3-[4-(2-аміно-6-{1-[2-(3,5-диметилпіразол-1-іл)феніл]-2,2,2-трифторетокси}піримідин-4-іл)феніл]пропіонова кислота;
(S)-2-аміно-3-[4-(2-аміно-6-{2,2,2-трифтор-1-[2-(3-фенілпіразол-1-іл)феніл]етокси}піримідин-4-іл)феніл]пропіонова кислота;
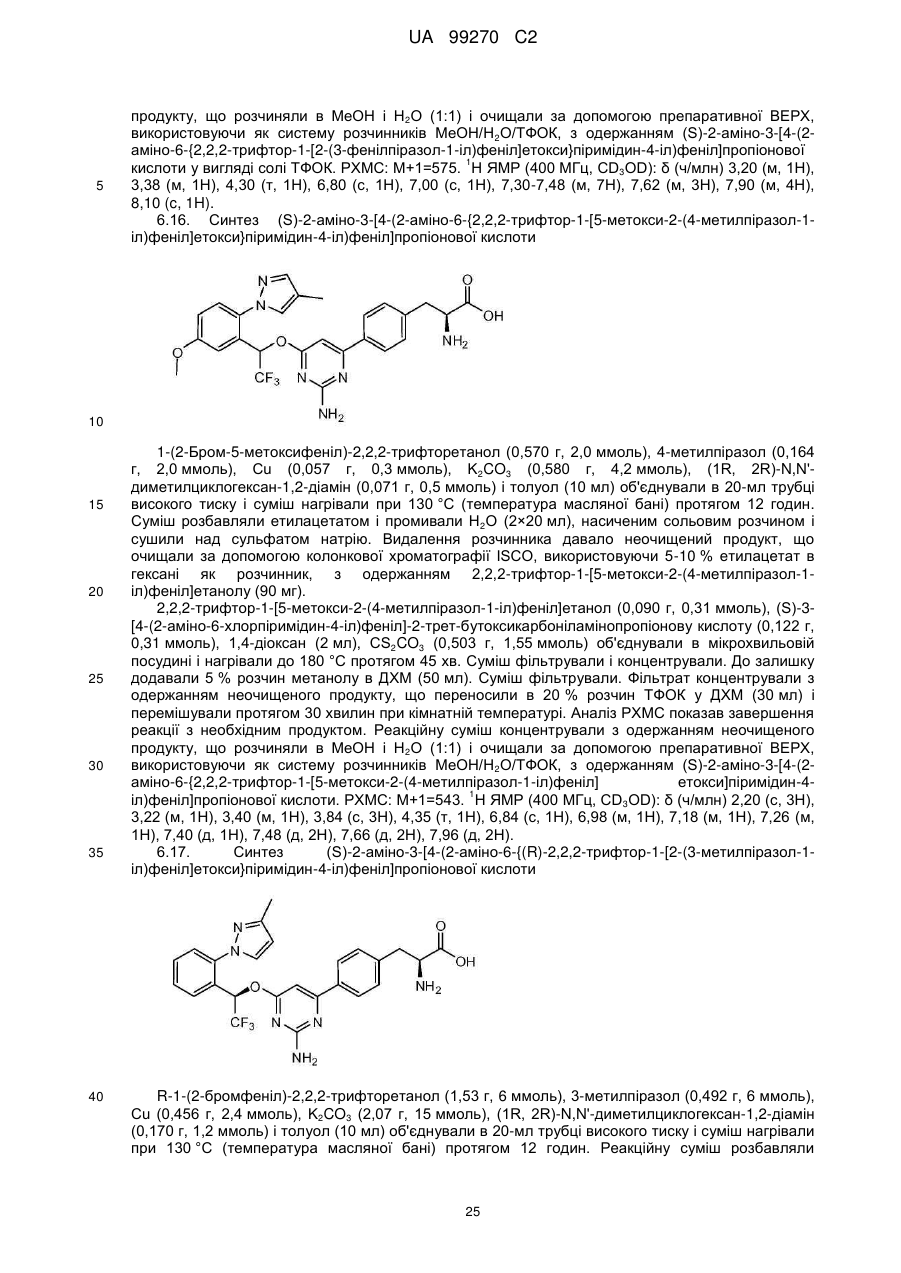
(S)-2-аміно-3-[4-(2-аміно-6-{2,2,2-трифтор-1-[5-метокси-2-(4-метилпіразол-1-іл)феніл]етокси}піримідин-4-іл)феніл]пропіонова кислота;
(S)-2-аміно-3-[4-(2-аміно-6-{(R)-2,2,2-трифтор-1-[2-(3-метилпіразол-1-іл)феніл]етокси}піримідин-4-іл)феніл]пропіонова кислота;
(S)-2-аміно-3-[4-(2-аміно-6-{1-[4-хлор-2-(3-метилпіразол-1-іл)феніл]-2,2,2-трифторетокси}піримідин-4-іл)феніл]пропіонова кислота;
етиловий ефір (S)-2-аміно-3-[4-(2-аміно-6-{(R)-1-[4-хлор-2-(3-метилпіразол-1-іл)феніл]-2,2,2-трифторетокси}піримідин-4-іл)феніл]пропіонової кислоти;
(S)-2-аміно-3-(4-(2-аміно-6-((R)-1-(4-хлор-2-(3-метил-1Н-піразол-1-іл)феніл)-2,2,2-трифторетокси)піримідин-4-іл)феніл)пропанова кислота;
(S)-2-аміно-3-(4-{2-аміно-6-[2,2,2-трифтор-1-(2-тіазол-2-ілфеніл)етокси]піримідин-4-іл}феніл)пропіонова кислота;
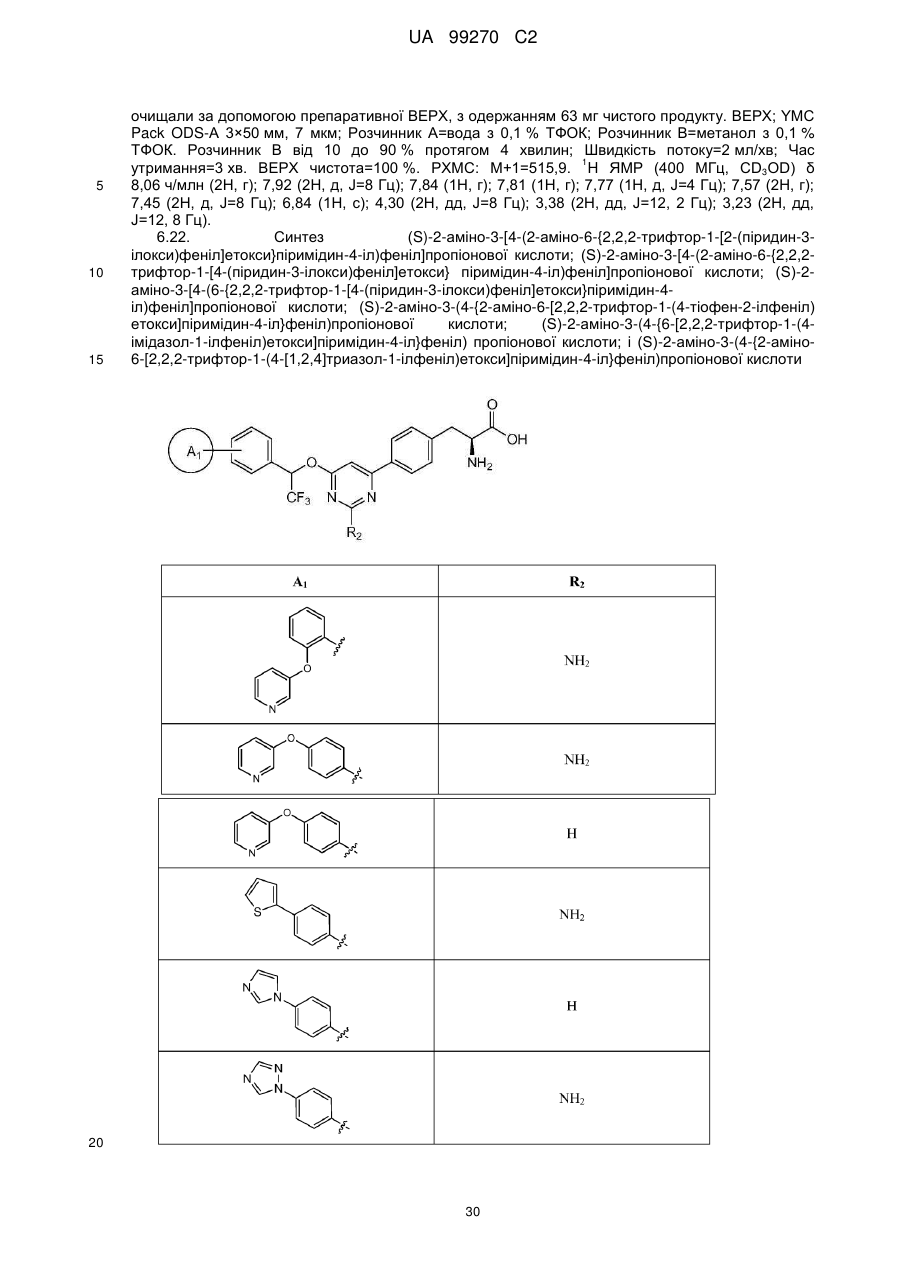
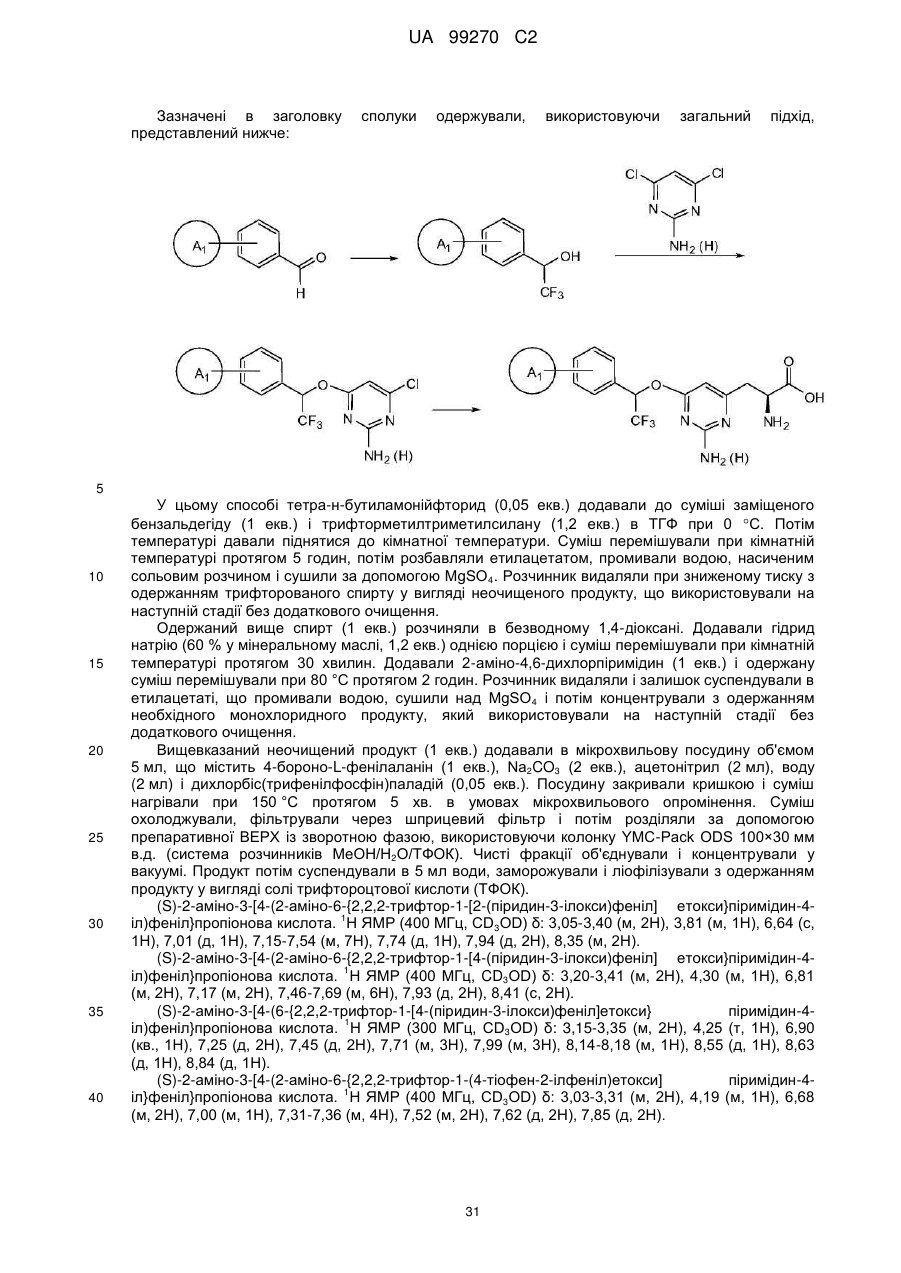
(S)-2-аміно-3-[4-(2-аміно-6-{2,2,2-трифтор-1-[2-(піридин-3-ілокси)феніл]етокси}піримідин-4-іл)феніл]пропіонова кислота;
(S)-2-аміно-3-[4-(2-аміно-6-{2,2,2-трифтор-1-[4-(піридин-3-ілокси)феніл]етокси}піримідин-4-іл)феніл]пропіонова кислота;
(S)-2-аміно-3-[4-(6-{2,2,2-трифтор-1-[4-(піридин-3-ілокси)феніл]етокси}піримідин-4-іл)феніл]пропіонова кислота;
(S)-2-аміно-3-(4-{2-аміно-6-[2,2,2-трифтор-1-(4-тіофен-2-ілфеніл)етокси]піримідин-4-іл}феніл)пропіонова кислота;
(S)-2-аміно-3-(4-{6-[2,2,2-трифтор-1-(4-імідазол-1-ілфеніл)етокси]піримідин-4-іл}феніл)пропіонова кислота;
(S)-2-аміно-3-(4-{2-аміно-6-[2,2,2-трифтор-1-(4-[1,2,4]триазол-1-ілфеніл)етокси]піримідин-4-іл}феніл)пропіонова кислота;
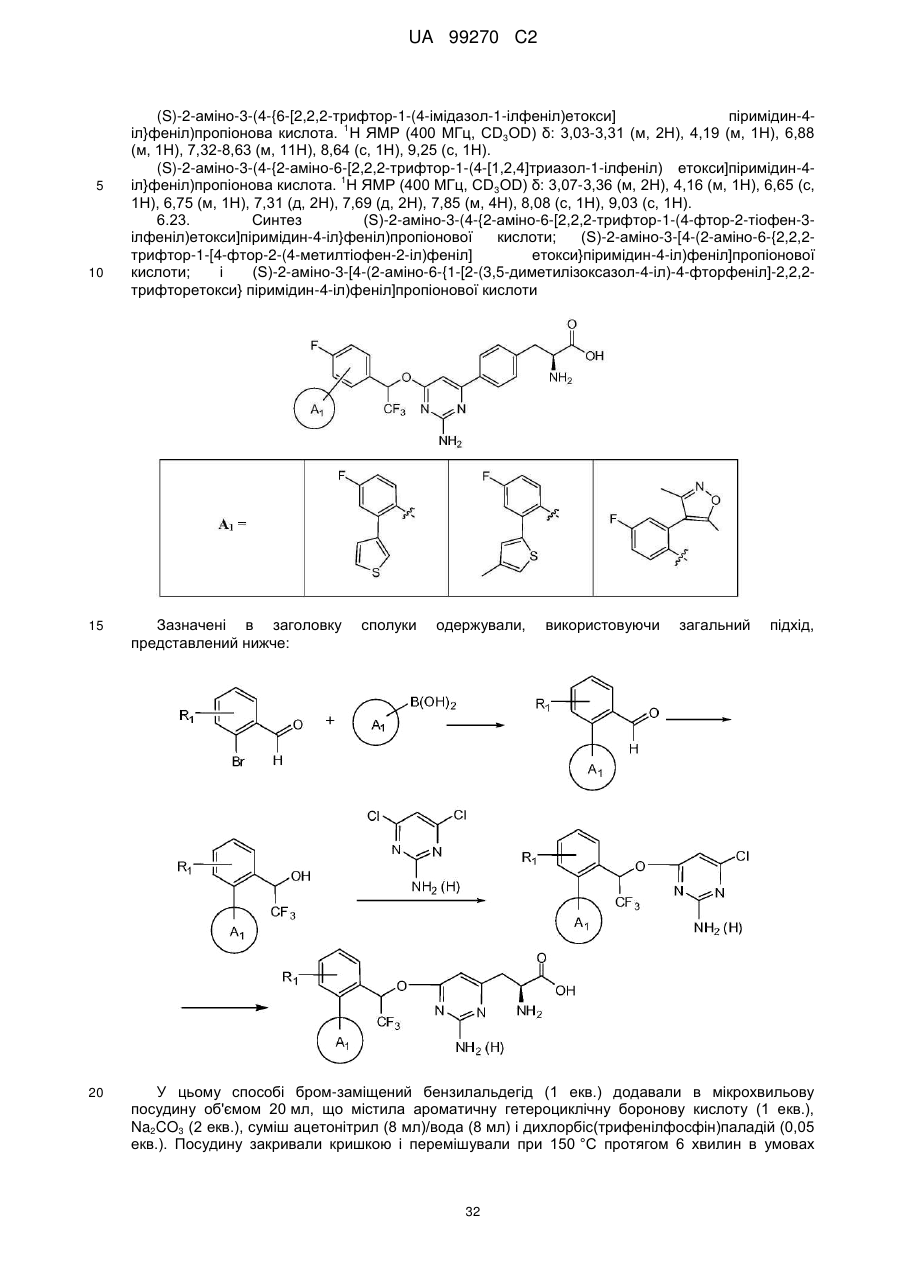
(S)-2-аміно-3-(4-{2-аміно-6-[2,2,2-трифтор-1-(4-фтор-2-тіофен-3-ілфеніл)етокси]піримідин-4-іл}феніл)пропіонова кислота;
(S)-2-аміно-3-[4-(2-аміно-6-{2,2,2-трифтор-1-[4-фтор-2-(4-метилтіофен-2-іл)феніл]етокси}піримідин-4-іл)феніл]пропіонова кислота;
(S)-2-аміно-3-[4-(2-аміно-6-{1-[2-(3,5-диметилізоксазол-4-іл)-4-фторфеніл]-2,2,2-трифторетокси}піримідин-4-іл)феніл]пропіонова кислота;
(S)-2-аміно-3-[4-(2-аміно-6-{2,2,2-трифтор-1-[5-фтор-2-(3-метилпіразол-1-іл)феніл]етокси}піримідин-4-іл)феніл]пропіонова кислота;
(S)-2-аміно-3-[4-(2-аміно-6{2,2,2-трифтор-1-[5-хлор-2-(3-метилпіразол-1-іл)феніл]етокси}піримідин-4-іл)феніл]пропіонова кислота;
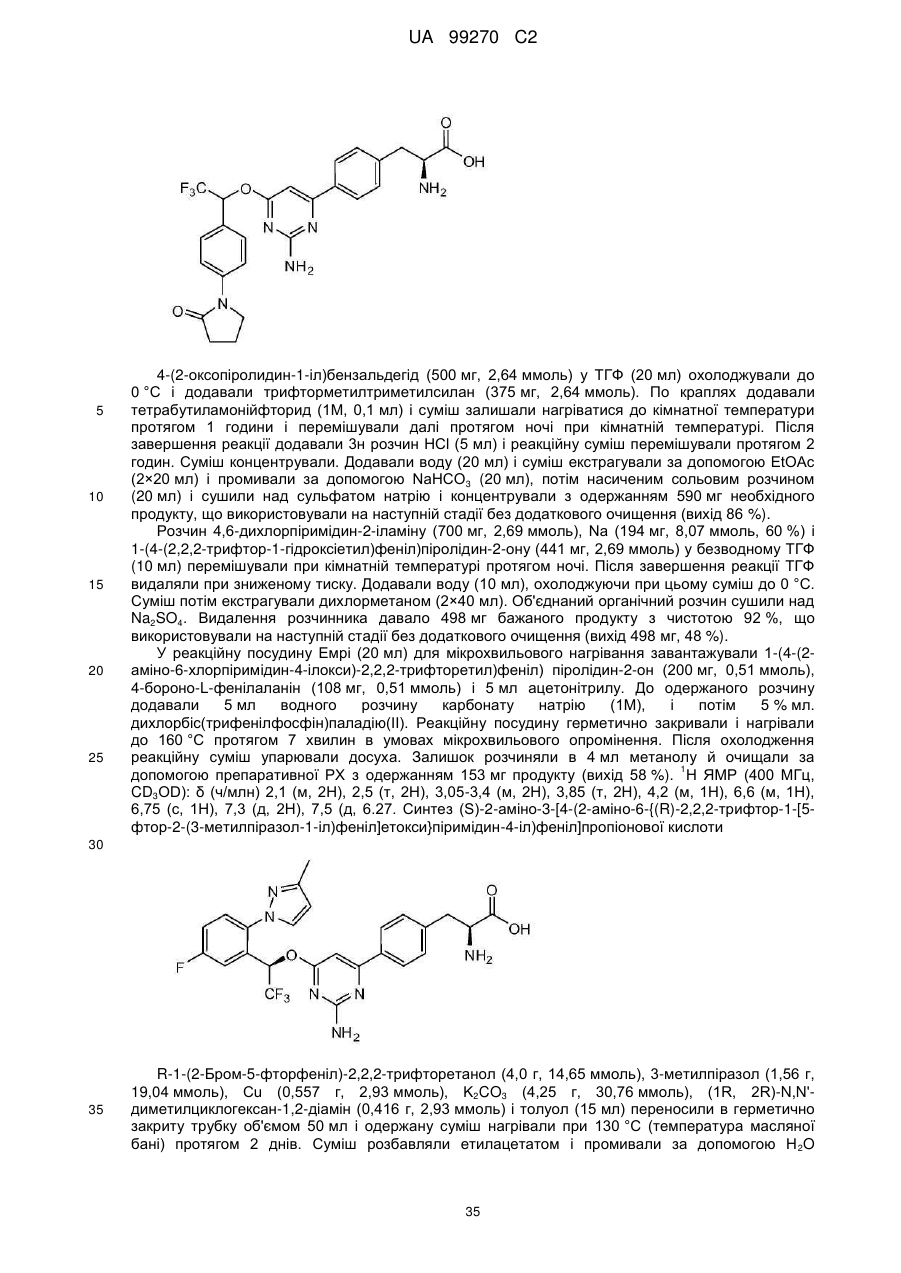
(S)-2-аміно-3-[4-(2-аміно-6-{2,2,2-трифтор-1-[4-(2-оксопіролидин-1-іл)феніл]етокси}піримідин-4-іл)феніл]пропіонова кислота;
(S)-2-аміно-3-[4-(2-аміно-6-{(R)-2,2,2-трифтор-1-[5-фтор-2-(3-метилпіразол-1-іл)феніл]етокси}піримідин-4-іл)феніл]пропіонова кислота;
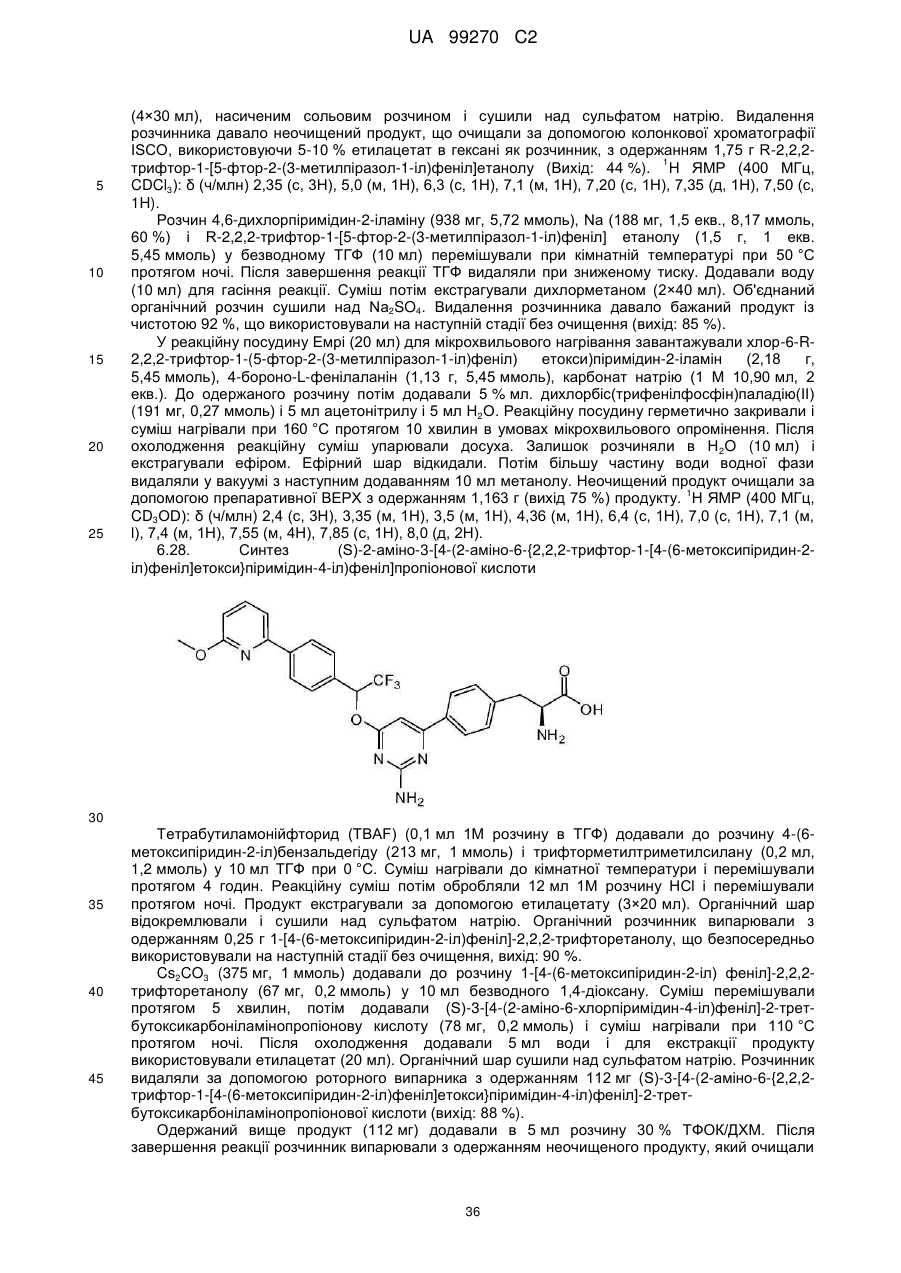
(S)-2-аміно-3-[4-(2-аміно-6-{2,2,2-трифтор-1-[4-(6-метоксипіридин-2-іл)феніл]етокси}піримідин-4-іл)феніл]пропіонова кислота;
(S)-2-аміно-3-[4-(2-аміно-6-{2,2,2-трифтор-1-[2-фтор-4-(5-метоксипіридин-3-іл)феніл]етокси}піримідин-4-іл)феніл]пропіонова кислота;
(S)-2-аміно-3-[4-(2-аміно-6-{(S)-2,2,2-трифтор-1-[4-(2-фторпіридин-4-іл)феніл]етокси}піримідин-4-іл)феніл]пропіонова кислота;
(S)-2-аміно-3-[4-(2-аміно-6-{(S)-2,2,2-трифтор-1-[4-(5-метоксипіридин-3-іл)феніл]етокси}піримідин-4-іл)феніл]пропіонова кислота;
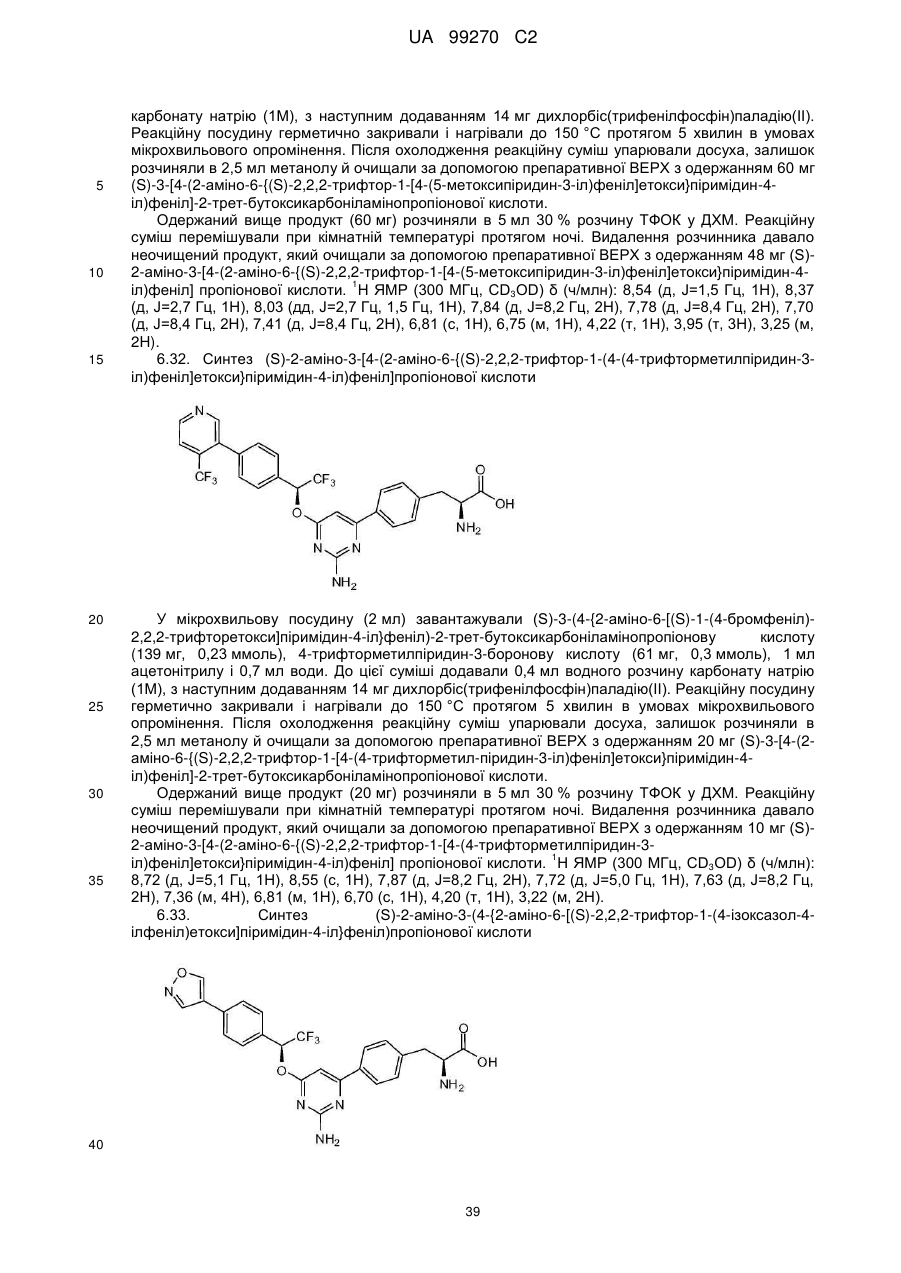
(S)-2-аміно-3-[4-(2-аміно-6-{(S)-2,2,2-трифтор-1-[4-(4-трифторметилпіридин-3-іл)феніл]етокси}піримідин-4-іл)феніл]пропіонова кислота;
(S)-2-аміно-3-(4-{2-аміно-6-[(S)-2,2,2-трифтор-1-(4-ізоксазол-4-ілфеніл)етокси]піримідин-4-іл}феніл)пропіонова кислота;
(S)-2-аміно-3-(4-{2-аміно-6-[2,2,2-трифтор-1-(2-піримідин-5-ілфеніл)етокси]піримідин-4-іл}феніл)пропіонова кислота;
(S)-2-аміно-3-(4-{2-аміно-6-[2,2,2-трифтор-1-(2-тіофен-3-ілфеніл)етокси]піримідин-4-іл}феніл)пропіонова кислота;
(S)-2-аміно-3-[4-(2-аміно-6-{2,2,2-трифтор-1-[2-(1-метил-1Н-піразол-4-іл)феніл]етокси}піримідин-4-іл)феніл]пропіонова кислота;
(S)-2-аміно-3-(4-{6-[2,2,2-трифтор-1-(2-фуран-3-ілфеніл)етокси]піримідин-4-іл}феніл)пропіонова кислота;
(S)-2-аміно-3-(4-{6-[2,2,2-трифтор-1-(2-фуран-2-ілфеніл)етокси]піримідин-4-іл}феніл)пропіонова кислота;
(2S)-2-аміно-3-(4-(2-аміно-6-(2,2,2-трифтор-1-(4-(піридин-3-іл)феніл)етокси)піримідин-4-іл)феніл)пропанова кислота;
(2S)-2-аміно-3-(4-(2-аміно-6-(2,2,2-трифтор-1-(2-(2-метилпіридин-4-іл)феніл)етокси)піримідин-4-іл)феніл)пропанова кислота;
(2S)-2-аміно-3-(4-(2-аміно-6-(2,2,2-трифтор-1-(2-(4-метилтіофен-3-іл)феніл)етокси)піримідин-4-іл)феніл)пропанова кислота;
(2S)-3-(4-(6-(1-(2-(1Н-піразол-1-іл)феніл)-2,2,2-трифторетоксі)-2-амінопіримідин-4-іл)феніл)-2-амінопропанова кислота;
(2S)-2-аміно-3-(4-(2-аміно-6-(2,2,2-трифтор-1-(4-(фуран-2-іл)феніл)етокси)піримідин-4-іл)феніл)пропанова кислота;
(2S)-2-аміно-3-(4-(6-(2,2,2-трифтор-1-(2-(піридин-3-ілокси)феніл)етокси)піримідин-4-іл)феніл)пропанова кислота;
(2S)-3-(4-(6-(1-(2-(1H-1,2,4-триазол-1-іл)феніл)-2,2,2-трифторетоксі)-2-амінопіримідин-4-іл)феніл)-2-амінопропанова кислота;
(2S)-2-аміно-3-(4-(2-аміно-6-(2,2,2-трифтор-1-(2-(фуран-3-іл)феніл)етокси)піримідин-4-іл)феніл)пропанова кислота;
(2S)-2-аміно-3-(4-(2-аміно-6-(2,2,2-трифтор-1-(4-(фуран-2-іл)-3-метоксифеніл)етокси)піримідин-4-іл)феніл)пропанова кислота;
(2S)-2-аміно-3-(4-(5-(2,2,2-трифтор-1-(2-(фуран-2-іл)феніл)етокси)піразин-2-іл)феніл)пропанова кислота;
(2S)-3-(4-(5-(1-(2-(1Н-піразол-1-іл)феніл)-2,2,2-трифторетокси)піразин-2-іл)феніл)-2-амінопропанова кислота;
(2S)-2-аміно-3-(4-(2-аміно-6-(1-(4,5-диметокси-2-(1Н-піразол-1-іл)феніл)-2,2,2-трифторетокси)піримідин-4-іл)феніл)пропанова кислота;
(2S)-2-аміно-3-(4-(2-аміно-6-(2,2,2-трифтор-1-(2-(2-метил-1Н-імідазол-1-іл)феніл)етокси)піримідин-4-іл)феніл)пропанова кислота;
(2S)-2-аміно-3-(4-(2-аміно-6-(2,2,2-трифтор-1-(2-(5-метилтіофен-2-іл)феніл)етокси)піримідин-4-іл)феніл)пропанова кислота;
(2S)-2-аміно-3-(4-(2-аміно-6-(1-(2-(5-(диметилкарбамоїл)фуран-2-іл)феніл)-2,2,2-трифторетокси)піримідин-4-іл)феніл)пропанова кислота;
(2S)-2-аміно-3-(4-(2-аміно-6-(2,2,2-трифтор-1-(4-фтор-2-(тіофен-2-іл)феніл)етокси)піримідин-4-іл)феніл)пропанова кислота;
(2S)-2-аміно-3-(4-(6-(2,2,2-трифтор-1-(4-фтор-2-(тіофен-2-іл)феніл)етокси)піримідин-4-іл)феніл)пропанова кислота;
(2S)-2-аміно-3-(4-(6-(2,2,2-трифтор-1-(4-фтор-2-(тіофен-3-іл)феніл)етокси)піримідин-4-іл)феніл)пропанова кислота;
(2S)-2-аміно-3-(4-(6-(2,2,2-трифтор-1-(4-фтор-2-(4-метилтіофен-2-іл)феніл)етокси)піримідин-4-іл)феніл)пропанова кислота;
(S)-2-аміно-3-(4-(2-аміно-6-((R)-2,2,2-трифтор-1-(4-(6-фторпіридин-3-іл)феніл)етокси)піримідин-4-іл)феніл)пропанова кислота;
(2S)-3-(4-(6-(1-(4-(1H-імідазол-1-іл)феніл)-2,2,2-трифторетоксі)-2-амінопіримідин-4-іл)феніл)-2-амінопропанова кислота;
(2S)-2-аміно-3-(4-(6-(2,2,2-трифтор-1-(4-(тіофен-2-іл)феніл)етокси)піримідин-4-іл)феніл)пропанова кислота;
(S)-2-аміно-3-(4-(2-аміно-6-((R)-2,2,2-трифтор-1-(4-(піримідин-5-іл)феніл)етокси)піримідин-4-іл)феніл)пропанова кислота;
(2S)-2-аміно-3-(4-(6-(1-(2-(3,5-диметилізоксазол-4-іл)-4-фторфеніл)-2,2,2-трифторетокси)піримідин-4-іл)феніл)пропанова кислота;
(S)-2-аміно-3-(4-(2-аміно-6-((R)-2,2,2-трифтор-1-(4-(2-метилпіридин-4-іл)феніл)етокси)піримідин-4-іл)феніл)пропанова кислота;
(2S)-3-(4-(6-(1-(4-(1Н-1,2,4-триазол-1-іл)феніл)-2,2,2-трифторетокси)піримідин-4-іл)феніл)-2-амінопропанова кислота;
(2S)-2-аміно-3-(4-(2-аміно-6-(2,2,2-трифтор-1-(4-(піперидин-1-ілметил)феніл)етокси)піримідин-4-іл)феніл)пропанова кислота;
(2S)-2-аміно-3-(4-(2-аміно-6-(2,2,2-трифтор-1-(2-фтор-4-(2-метилпіридин-4-іл)феніл)етокси)піримідин-4-іл)феніл)пропанова кислота;
(2S)-2-аміно-3-(4-(2-аміно-6-(1-(4-(6-хлорпіридазин-3-іл)феніл)-2,2,2-трифторетокси)піримідин-4-іл)феніл)пропанова кислота;
(2S)-2-аміно-3-(4-(2-аміно-6-(1-(4-(4-трет-бутилтіазол-2-іл)феніл)-2,2,2-трифторетокси)піримідин-4-іл)феніл)пропанова кислота;
(2S)-2-аміно-3-(4-(2-аміно-6-(2,2,2-трифтор-1-(3'-метокси-3-(3-метил-1H-піразол-1-іл)біфеніл-4-іл)етокси)піримідин-4-іл)феніл)пропанова кислота або
(2S)-2-аміно-3-(4-(2-аміно-6-(1-(5-хлор-2-(3-метил-1H-піразол-1-іл)феніл)-2,2,2-трифторетокси)піримідин-4-іл)феніл)пропанова кислота.
43. Сполука за п. 42, що є стереомерно чистою.
44. Композиція, що містить сполуку за п. 1 і фармацевтично прийнятний ексципієнт або розріджувач.
45. Стандартна лікарська форма для однократного введення, що містить композицію за п. 44.
46. Спосіб інгібування ТРН1-активності, в якому здійснюють контактування ТРН1 зі сполукою за п. 1.
47. Спосіб лікування, профілактики або контролю захворювання або розладу, опосередкованого периферичним серотоніном, що включає введення пацієнту, який потребує такого лікування, профілактики або контролю, терапевтично або профілактично ефективної кількості сполуки за п. 1.
48. Спосіб лікування, профілактики або контролю захворювання або розладу, що включає введення пацієнту, який потребує такого лікування, профілактики або контролю, терапевтично або профілактично ефективної кількості сполуки за п. 1, де захворювання або розлад являє собою карциноїдну кризу або карциноїдний синдром.
49. Спосіб лікування, профілактики або контролю захворювання або розладу, що включає введення пацієнту, який потребує такого лікування, профілактики або контролю, терапевтично або профілактично ефективної кількості сполуки за п. 1, де захворювання або розлад являє собою шлунково-кишкове захворювання або розлад.
50. Спосіб за п. 49, де шлунково-кишкове захворювання або розлад являє собою глютеїнову хворобу, констипацію, хворобу Крона, діарею, блювання, функціональний абдомінальний біль, функціональні аноректальні розлади, функціональний метеоризм, функціональну диспепсію, функціональні розлади жовчного міхура, синдром подразненої товстої кишки (IBS; включаючи IBD-d, IBS-c і IBS-a), непереносимість лактози, MEN типу І і II, нудоту, синдром Огілві, панкреатичний холерний синдром, недостатність підшлункової залози, сфінктер при розладах Одді, виразковий коліт і синдром Золінгера-Елісона.
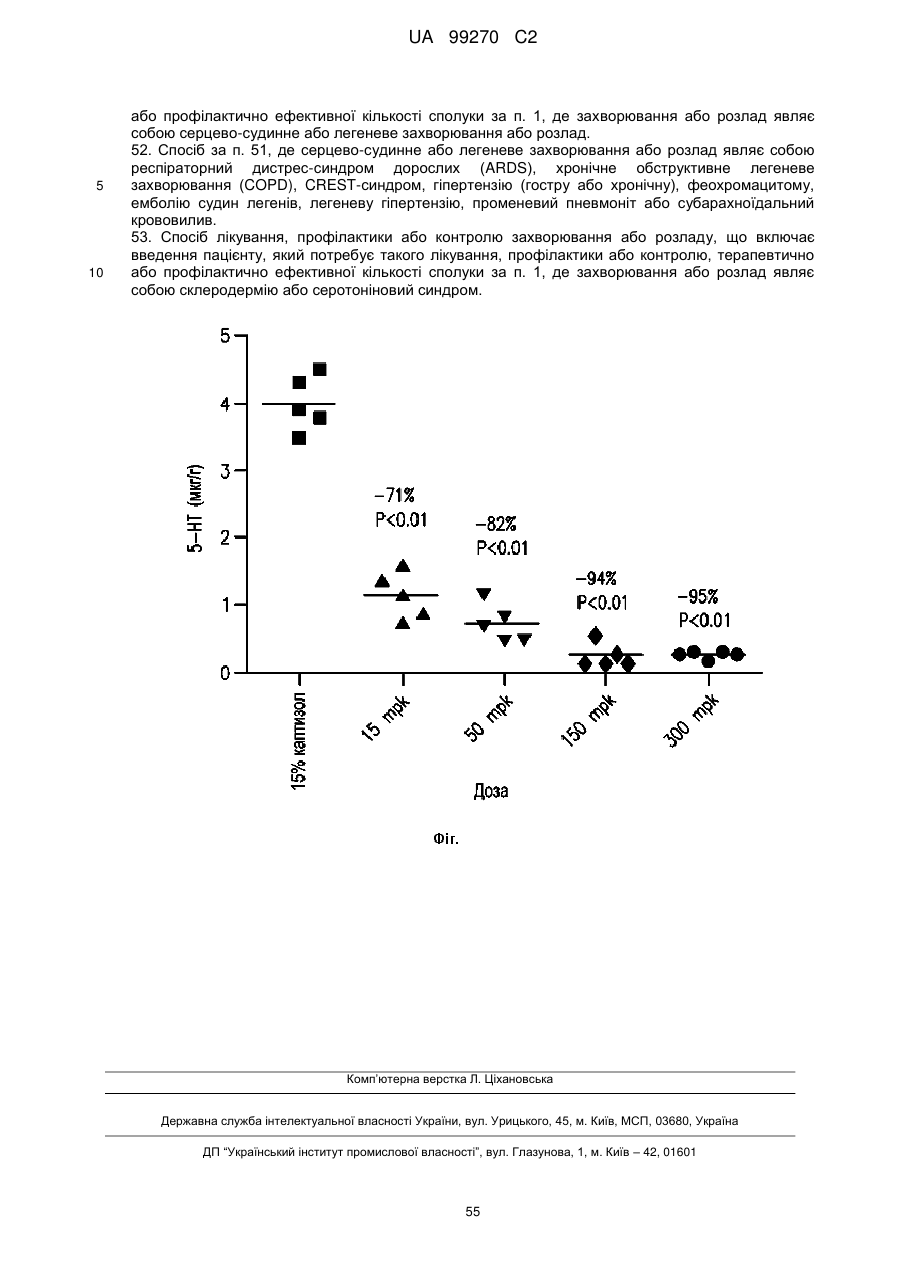
51. Спосіб лікування, профілактики або контролю захворювання або розладу, що включає введення пацієнту, який потребує такого лікування, профілактики або контролю, терапевтично або профілактично ефективної кількості сполуки за п. 1, де захворювання або розлад являє собою серцево-судинне або легеневе захворювання або розлад.
52. Спосіб за п. 51, де серцево-судинне або легеневе захворювання або розлад являє собою респіраторний дистрес-синдром дорослих (ARDS), хронічне обструктивне легеневе захворювання (COPD), CREST-синдром, гіпертензію (гостру або хронічну), феохромацитому, емболію судин легенів, легеневу гіпертензію, променевий пневмоніт або субарахноїдальний крововилив.
53. Спосіб лікування, профілактики або контролю захворювання або розладу, що включає введення пацієнту, який потребує такого лікування, профілактики або контролю, терапевтично або профілактично ефективної кількості сполуки за п. 1, де захворювання або розлад являє собою склеродермію або серотоніновий синдром.
Текст
Реферат: Розкриті сполуки формули І, а також композиції, що їх містять, і їх застосування для лікування, профілактики і/або контролю захворювання або розладу. UA 99270 C2 (12) UA 99270 C2 O (R1)m A1 OR4 O CF3 HN N N R2 R3 (I) UA 99270 C2 5 10 15 20 25 30 35 40 45 Дана заявка на патент заявляє пріоритет попередньої заявки на патент США № 60/874596, поданої 12 грудня 2006 року, включеної в повному обсязі в дану заявку за допомогою посилання. 1. Галузь, до якої належить винахід Даний винахід стосується сполук на основі 4-феніл-6-(2,2,2-трифтор-1фенілетокси)піримідину, композицій, що їх включають і їх застосування для лікування, запобігання і контролю при захворюваннях і розладах. 2. Передумови створення винаходу Нейротрансмітер серотонін [5-гідрокситриптамін (5-HT)] бере участь у різних аспектах центральної нервової системи, зв'язаних з контролем настрою і регуляцією сну, занепокоєнням, алкоголізмом, наркотичною залежністю, споживанням їжі і сексуальною поведінкою. У периферичних тканинах серотонін, за наявними відомостями, залучений у регулювання судинного тонусу, перистальтику кишечнику, первинний гемостаз і імунну клітинну відповідь. Walther, D. J., et al., Science 299:76 (2003). Фермент триптофангідроксилаза (TPH) каталізує стадію, що обмежує швидкість біосинтезу серотоніну. Повідомлялося про дві ізоформи TPH: TPH1, що експресується на периферії, переважно в шлунково-кишковому (GI) тракті; і TPH2, що експресується в серотонергічних нейронах. Id. Ізоформа TPH1 кодується геном tph1; TPH2 кодується геном tph2. Id. Повідомлялося про мишей, дефіцитних по гену tph1 (миші з генним "нокаутом"). Як повідомлялося, в одному випадку миші експресували нормальні кількості серотоніну в класичних серотонергічних відділах головного мозку, але велика недостатність серотоніну спостерігалася на периферії. Id. В іншому випадку миші з "нокаутом" демонстрували аномальну серцеву активність, що приписували недостатності периферичного серотоніну. Cote, F., et al., PNAS 100(23): 13525-13530 (2003). Оскільки серотонін залучений у таку множину біохімічних процесів, лікарські засоби, що впливають на серотонінові рецептори, часто мають побічні несприятливі ефекти. Таким чином, існує необхідність у нових способах лікування захворювань і розладів, що викликані, опосередковані чи зв'язані із серотоніном. 3. Короткий виклад винаходу Даний винахід частково спрямований на сполуки формули I: і їх фармацевтично прийнятні солі і сольвати, де A1 являє собою необов'язково заміщений гетероцикл; кожен R1 незалежно являє собою галоген, водень, C(O)RA, ORA, NRBRC, S(O2)RA або необов'язково заміщений алкіл, алкіл-арил або алкіл-гетероцикл; R2 незалежно являє собою галоген, водень, C(O)RA, ORA, NRBRC, S(O2)RA або необов'язково заміщений алкіл, алкіл-арил або алкіл-гетероцикл; R3 являє собою водень, C(O)RA, C(O)ORA або необов'язково заміщений алкіл, алкіл-арил, алкіл-гетероцикл, арил або гетероцикл; R4 являє собою водень або необов'язково заміщений алкіл, алкіл-арил, алкіл-гетероцикл, арил або гетероцикл; кожен R А незалежно являє собою водень або необов'язково заміщений алкіл, алкіл-арил або алкілгетероцикл; кожен RB незалежно являє собою водень або необов'язково заміщений алкіл, алкіларил або алкіл-гетероцикл; кожен RС незалежно являє собою водень або необов'язково заміщений алкіл, алкіл-арил або алкіл-гетероцикл; і m має значення 1-4. Конкретні сполуки інгібують TPH (наприклад, TPH1) активність. Даний винахід також стосується фармацевтичних композицій і способів лікування, профілактики і контролю при різних захворюваннях і розладах. 4. Короткий опис фігур креслень 1 UA 99270 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фіг. представляє дозо-залежний ефект сполуки за даним винаходом на рівні 5-HT у тонкій кишці в мишей. Сполуку вводили перорально в розчині 15 % Сарtіsоl® при 15, 50, 150 і 300 мг/кг. 5. Докладний опис винаходу Даний винахід оснований, частково, на тому відкритті, що відключення гена tph1 у мишей значно знижує рівні GI серотоніну, але при цьому робить незначний, якщо взагалі такий мається, вимірюваний ефект на центральну нервову систему (ЦНС). Даний винахід також оснований на відкритті сполук, що інгібують TPH (наприклад, TPH1). При введенні ссавцям, переважні сполуки за даним винаходом знижують рівні серотоніну, володіють фармакокінетичними і фармакодинамічними властивостями, що уможливлює їх практичне застосування для лікування, запобігання і контролю при захворюваннях і розладах, і вони мають широку межу безпеки між фармакологічним ефектом і токсичністю або небажаними побічними реакціями. 5.1. Визначення Якщо не зазначено інше, термін "алкеніл" означає вуглеводень із прямим ланцюгом, розгалужений і/або циклічний, що містить від 2 до 20 (наприклад, від 2 до 10 або від 2 до 6) атомів вуглецю і що включає, щонайменше, один подвійний зв'язок вуглець-вуглець. Репрезентативні алкенільні групи включають вініл, аліл, 1-бутеніл, 2-бутеніл, ізобутиленіл, 1пентеніл, 2-пентеніл, 3-метил-1-бутеніл, 2-метил-2-бутеніл, 2,3-диметил-2-бутеніл, 1-гексеніл, 2гексеніл, 3-гексеніл, 1-гептеніл, 2-гептеніл, 3-гептеніл, 1-октеніл, 2-октеніл, 3-октеніл, 1-ноненіл, 2-ноненіл, 3-ноненіл, 1-деценіл, 2-деценіл і 3-деценіл. Якщо не зазначено інше, термін "алкіл" означає вуглеводень із прямим ланцюгом, розгалужений і/або циклічний ("циклоалкіл"), що містить від 1 до 20 (наприклад, від 1 до 10 або від 1 до 4) атомів вуглецю. Алкільні групи, що містять від 1 до 4 вуглеців відносять до "нижчого алкілу". Приклади алкільних груп включають метил, етил, пропіл ізопропіл, н-бутил, трет-бутил ізобутил, пентил, гексил, ізогексил, гептил, 4,4-диметилпентил, октил, 2,2,4-триметилпентил, ноніл, децил, ундецил і додецил. Циклоалкільні групи можуть бути моноциклічними або поліциклічними, і приклади включають циклопропіл, циклобутил, циклопентил, циклогексил і адамантил. Додаткові приклади алкільних груп включають лінійні, розгалужені і/або циклічні частини (наприклад, 1-етил-4-метилциклогексил). Термін "алкіл" включає насичені вуглеводні, також як і алкенільні й алкінільні групи. Якщо не зазначено інше, термін "алкокси" означає -O-алкільну групу. Приклади алкоксигруп включають -OCH3, -OCH2CH3, -O(CH2)2CH3, -O(CH2)3CH3, -O(CH2)4CH3 і -O(CH2)5CH3. Якщо не зазначено інше, термін "алкіларил" або "алкіл-арил" означає алкільну групу, зв'язану з арильною групою. Якщо не зазначено інше, термін "алкілгетероарил" або "алкіл-гетероарил" означає алкільну групу, зв'язану з гетероарильною групою. Якщо не зазначено інше, термін "алкілгетероцикл" або "алкіл-гетероцикл" означає алкільну групу, зв'язану з гетероциклильною групою. Якщо не зазначено інше, термін "алкініл" означає вуглеводень із прямим ланцюгом, розгалужений або циклічний, що містить від 2 до 20 (наприклад, від 2 до 20 або від 2 до 6) атомів вуглецю і що включає, щонайменше, один потрійний зв'язок вуглець-вуглець. Репрезентативні алкінільні групи включають ацетиленіл, пропініл, 1-бутиніл, 2-бутиніл, 1пентиніл, 2-пентиніл, 3-метил-1-бутиніл, 4-пентиніл, 1-гексиніл, 2-гексиніл, 5-гексиніл, 1-гептиніл, 2-гептиніл, 6-гептиніл, 1-октиніл, 2-октиніл, 7-октиніл, 1-нониніл, 2-нониніл, 8-нониніл, 1-дециніл, 2-дециніл і 9-дециніл. Якщо не зазначено інше, термін "арил" означає ароматичне кільце або ароматичну або частково ароматичну кільцеву систему, що складається з атомів вуглецю і водню. Арильна група може включати кілька кілець, зв'язаних або конденсованих разом. Приклади арильних груп включають антраценіл, азуленіл, біфеніл, флуореніл, індан, інденіл, нафтил, фенантреніл, феніл, 1,2,3,4-тетрагідронафталін і толіл. Якщо не зазначено інше, термін "арилалкіл" або "арил-алкіл" означає арильну групу, зв'язану з алкільною групою. Якщо не зазначено інше, терміни "біогідролізований амід", "біогідролізований складний ефір", "біогідролізований карбамат", "біогідролізований карбонат", "біогідролізований уреїдо" і "біогідролізований фосфат" означають амід, складний ефір, карбамат, карбонат, уреїдо або фосфат, відповідно, сполуки, що або 1) не втручаються в біологічну активність сполуки, але можуть повідомляти сполуці вигідні властивості in vivo, такі як засвоєння, тривалість дії або початок дії; або 2) є біологічно неактивною, але перетворюється in vivo у біологічно активну сполуку. Приклади біогідролізованих складних ефірів включають нижчі складні алкілові ефіри, складні алкоксіацилоксиефіри, складні алкілациламіноалкілові ефіри і складні холінові ефіри. 2 UA 99270 C2 5 10 15 20 25 30 35 40 45 50 55 Приклади біогідролізованих амідів включають нижчі алкіламіди, аміди α-амінокислот, алкоксіациламіди й алкіламіноалкілкарбоніламіди. Приклади біогідролізованих карбаматів включають нижчі алкіламіни, заміщені етилендіаміни, амінокислоти, гідроксіалкіламіни, гетероциклічні і гетероароматичні аміни і поліефіраміни. Якщо не зазначено інше, фрази "захворювання або розлад, опосередкований периферичним серотоніном" і "захворювання і розлад, опосередкований периферичним серотоніном" означають захворювання і/або розлад, що мають один або декількома симптомів, на тяжкість яких впливають рівні периферичного серотоніну. Якщо не зазначено інше, термін "галоген" включає фтор, хлор, бром і йод. Якщо не зазначено інше, термін "гетероалкіл" стосується алкільної групи (наприклад, лінійної, розгалуженої або циклічної), в якій, щонайменше, один з атомів вуглецю замінений гетероатомом (наприклад, N, O або S). Якщо не зазначено інше, термін "гетероарил" означає арильну групу, в якій, щонайменше, один з атомів вуглецю замінений гетероатомом (наприклад, N, O або S). Приклади включають акридиніл, бензімідазоліл, бензофураніл, бензоізотіазоліл, бензоізоксазоліл, бензохіназолініл, бензотіазоліл, бензоксазоліл, фурил, імідазоліл, індоліл, ізотіазоліл, ізоксазоліл, оксадіазоліл, оксазоліл, фталазиніл, піразиніл, піразоліл, піридазиніл, піридил, піримідиніл, піримідил, піроліл, хіназолініл, хінолініл, тетразоліл, тіазоліл і триазиніл. Якщо не зазначено інше, термін "гетероарилалкіл" або "гетероарил-алкіл" означає гетероарильну групу, зв'язану з алкільною групою. Якщо не зазначено інше, термін "гетероцикл" стосується ароматичного, частково ароматичного або неароматичного моноциклічного або поліциклічному кільця або кільцевої системи, що складається з вуглецю, водню і, щонайменше, одного гетероатома (наприклад, N, O або S). Гетероцикл може включати декілька (тобто, два або більше) кільця, конденсованих або зв'язаних разом. Гетероцикли включають гетероарили. Приклади включають бензо[1,3]діоксоліл, 2,3-дигідро-бензо[1,4]діоксиніл, цинолініл, фураніл, гідантоїніл, морфолініл, оксетаніл, оксираніл, піперазиніл, піперидиніл, піролідиноніл, піролідиніл, тетрагідрофураніл, тетрагідропіраніл, тетрагідропіридиніл, тетрагідропіримідиніл, тетрагідротіофеніл, тетрагідротіопіраніл і валеролактаміл. Якщо не зазначено інше, термін "гетероциклоалкіл" або "гетероцикл-алкіл" стосується гетероциклічної групи, зв'язаної з алкільною групою. Якщо не зазначено інше, термін "гетероциклоалкіл" стосується неароматичного гетероциклу. Якщо не зазначено інше, термін "гетероциклоалкілалкіл" або "гетероциклоалкіл-алкіл" стосується гетероциклоалкільної групи, зв'язаної з алкільною групою. Якщо не зазначено інше, терміни "контролювати", "контролюючий" і "контроль" охоплюють запобігання рецидиву визначеного захворювання або розладу або одного або декількох його симптомів у пацієнта, що вже переніс захворювання або розлад, і/або продовження періоду часу, протягом якого пацієнт, що вже переніс захворювання або розлад, залишається в ремісії. Терміни охоплюють модуляцію порога, розвитку і/або тривалості захворювання або розладу, або зміна того, як пацієнт відповідає на захворювання або розлад. Якщо не зазначено інше, термін "фармацевтично прийнятні солі" стосується солей, одержаних з фармацевтично прийнятних нетоксичних кислот або основ, включаючи неорганічні кислоти і основи, а також органічні кислоти і основи. Придатні фармацевтично прийнятні основно-адитивні солі включають солі металів, утворені з алюмінію, кальцію, літію, магнію, калію, натрію і цинку, або органічні солі, утворені з лізину, N,N'-дибензилетилендіаміну, хлорпрокаїну, холіну, діетаноламіну, етилендіаміну, меглуміну (N-метилглюкаміну) і прокаїну. Придатні нетоксичні кислоти включають неорганічні й органічні кислоти, такі як оцтова, альгінова, антранілова, бензолсульфонова, бензойна, камфорсульфонова, лимонна, етенсульфонова, мурашина, фумарова, фуранкарбонова, галактоуронова, глюконова, глюкуронова, глутамінова, гліколева, бромистоводнева, хлористоводнева, ізетіонова, молочна, малеїнова, яблучна, мигдальна, метансульфонова, муцинова, азотна, памова, пантотенова, фенілоцтова, фосфорна, пропіонова, саліцилова, стеаринова, бурштинова, сульфамінова, сірчана, винна кислота і пара-толуолсульфонова кислота. Конкретні нетоксичні кислоти включають хлористоводневу, бромистоводневу, фосфорну, сірчану і метансульфонову кислоти. Приклади конкретних солей, таким чином, включають гідрохлорид і мезилат. Інші є добре th відомими в даній галузі. Див., наприклад, Remington's Pharmaceutical Sciences, 18 ed. (Mack th Publishing, Easton PA: 1990) і Remington: The Science і Practice of Pharmacy, 19 ed. (Mack Publishing, Easton PA: 1995). 3 UA 99270 C2 5 10 15 20 25 30 35 40 45 50 55 60 Якщо не зазначено інше, термін "сильний інгібітор TPH1" являє собою сполуку, що має значення TPH1_ IC50 менше, ніж близько 10 мкм. Якщо не зазначено інше, терміни "запобігати", "запобігаючий" і "запобігання" припускають дію, що має місце до того, як пацієнт починає страждати визначеним захворюванням або розладом, що інгібує або знижує тяжкість захворювання або розладу або одного або декількох його симптомів. Терміни охоплюють профілактику. Якщо не зазначено інше, термін "проліки" охоплює фармацевтично прийнятні складні ефіри, карбонати, тіокарбонати, N-ацильні похідні, N-ацилоксіалкільні похідні, четвертинні похідні третинних амінів, N-основи Маніха, основи Шифа, кон'югати амінокислот, фосфатні складні ефіри, солі металів і сульфонатні складні ефіри сполук, розкритих у даній заявці. Приклади проліків включають сполуки, що містять біогідролізовану групу (наприклад, біогідролізований амід, біогідролізований карбамат, біогідролізований карбонат, біогідролізований складний ефір, біогідролізований фосфат або біогідролізований уреїдний аналог). Фахівці в даній галузі можуть легко визначити й одержати проліки сполук, розкритих у даній заявці. Див., наприклад, Design of Prodrugs, Bundgaard, A. Ed., Elseview, 1985; Bundgaard, H., "Design and Application of Prodrugs", A Textbook of Drug Design and Development, Krosgaard-Larsen and H. Bundgaard, Ed., 1991, Chapter 5, p. 113-191; і Bundgaard, H., Advanced Drug Delivery Review, 1992, 8, 1-38. Якщо не зазначено інше, "профілактично ефективна кількість" сполуки являє собою кількість, достатню для запобігання захворюванню або стану або одному або декільком симптомам, зв'язаним з захворюванням або станом, або запобігання його рецидиву. Профілактично ефективна кількість сполуки являє собою кількість терапевтичного засобу, окремо або в комбінації з іншими засобами, що забезпечує профілактичну користь у запобіганні захворюванню. Термін "профілактично ефективна кількість" може охоплювати кількість, що поліпшує профілактику в цілому або підвищує профілактичну ефективність іншого профілактичного засобу. Якщо не зазначено інше, термін "захищаюча група" або "захисна група", коли він використаний відносно частини молекули, що піддається хімічній реакції, означає хімічну групу, що не є реакційноспроможною в умовах цієї хімічної реакції, і яка може бути вилучена із забезпеченням групи, що є реакційноспроможною у цих умовах. Захисні групи добре відомі в даній галузі. Див., наприклад, Greene, T.W. and Wuts, P.G.M., Protective Groups in Organic rd Synthesis (3 ed., John Wiley & Sons: 1999); Larock, R.C., Comprehensive Organic Transformations nd (2 ed., John Wiley & Sons: 1999). Деякі приклади включають бензил, дифенілметил, тритил, Cbz, Boc, Fmoc, метоксикарбоніл, етоксикарбоніл і фталімідо. Якщо не зазначено інше, термін "псевдогалоген" стосується поліатомного аніона, що має подібність з іоном галогену в його кислотно-основній, замісній і окислювально-відновній хімії, в основному, має низку основність й утворює вільний радикал в умовах радикальної полімеризації з перенесенням атома. Приклади псевдогалогенів включають азидні іони, ціанід, ціанат, тіоціанат, тіосульфат, сульфонати і сульфонільні галогеніди. Якщо не зазначено інше, термін "селективний інгібітор TPH1" являє собою сполуку, що має значення TPH2_IC50, щонайменше, приблизно в 10 разів більше ніж його значення TPH1_IC 50. Якщо не зазначено інше, термін "стереомерно збагачена композиція" сполуки стосується суміші зазначеної сполуки і її стереоізомера(ів), що містить більше зазначеної сполуки, ніж її стереоізомера(ів). Наприклад, стереоізомерично збагачена композиція (S)-бутан-2-олу охоплює суміші (S)-бутан-2-олу і (R)-бутан-2-олу в співвідношеннях, наприклад, близько 60/40, 70/30, 80/20, 90/10, 95/5 і 98/2. Якщо не зазначено інше, термін "стереоізомерна суміш" охоплює рацемічні суміші, а також стереомерно збагачені суміші (наприклад, R/S=30/70, 35/65, 40/60, 45/55, 55/45, 60/40, 65/35 і 70/30). Якщо не зазначено інше, термін "стереомерно чистий" означає композицію, що містить один стереоізомер сполуки і, власно кажучи, не містить інших стереоізомерів цієї сполуки. Наприклад, стереомерно чиста композиція сполуки, що має один стереоцентр, власно кажучи, не містить протилежного стереоізомера сполуки. Стереомерно чиста композиція сполуки, що має два стереоцентри, власно кажучи, не містить інших діастереомерів сполуки. Стереомерно чиста композиція сполуки, що має декілька стереоцентрів, але яка представлена або названа таким способом, що стереохімії визначені не для всіх її стереоцентрів, власно кажучи, не містить ізомерів сполуки, що мають різні стереохімії на стереоцентрах, для яких стереохімія визначена. Наприклад, "стереомерно чистий ((1R)-1,2-дихлорпропіл)бензол" стосується ((1R)1,2-дихлорпропіл)бензолу, що, власно кажучи, не містить ((1S)-1,2-дихлорпропіл)бензолу. Типово стереомерно чиста сполука містить більше ніж близько 80 % по масі одного стереоізомера сполуки і менше ніж близько 20 % по масі інших стереоізомерів сполуки, більше 4 UA 99270 C2 5 10 15 20 25 30 35 40 45 50 55 60 ніж близько 90 % по масі одного стереоізомера сполуки і менше ніж близько 10 % по масі інших стереоізомерів сполуки, більше ніж близько 95 % по масі одного стереоізомера сполуки і 5 % по масі інших стереоізомерів сполуки, більше ніж близько 97 % по масі одного стереоізомера сполуки і менше ніж близько 3 % по масі інших стереоізомерів сполуки, або більше ніж близько 99 % по масі одного стереоізомера сполуки і менше ніж близько 1 % по масі інших стереоізомерів сполуки. Якщо не зазначено інше, термін "заміщений", коли він використовується для опису хімічної структури або групи, стосується похідного цієї структури або групи, де один або кілька атомів водню заміщені атомом, хімічною групою або функціональною групою, такою як, але не обмежуючи цим, спирт, альдегід, алкокси, алканоїлокси, алкоксикарбоніл, алкеніл, алкіл (наприклад, метил, етил, пропіл, трет-бутил), алкініл, алкілкарбонілокси (-OC(O)алкіл), амід (C(O)NH-алкіл- або -алкілNHC(O)алкіл), амідиніл(-C(NH) NH-алкіл або -C(NR)NH2), амін (первинний, вторинний і третинний, такий як алкіламіно, ариламіно, арилалкіламіно), ароил, арил, арилокси, азо, карбамоїл (-NHC(O)O-алкіл- або -OC(O)NH-алкіл), карбаміл (наприклад, CONH2, а також CONH-алкіл, CONH-арил і CONH-арилалкіл), карбоніл, карбоксил, карбонова кислота, ангідрид карбонової кислоти, хлорид карбонової кислоти, ціано, складний ефір, епоксид, ефір (наприклад, метокси, етокси), гуанідино, галоген, галогеналкіл (наприклад, -CCl3, CF3, -C(CF3)3), гетероалкіл, напівацеталь, імін (первинний і вторинний), ізоціанат, ізотіоціанат, кетон, нітрил, нітро, кисень (тобто, для одержання оксогрупи), фосфодіефір, сульфід, сульфонамідо (наприклад, SO2NH2), сульфон, сульфоніл (включаючи алкілсульфоніл, арилсульфоніл і арилалкілсульфоніл), сульфоксид, тіол (наприклад, сульфгідрил, тіоефір) і сечовина (-NHCONH-алкіл-). Якщо не зазначено інше, "терапевтично ефективна кількість" сполуки являє собою кількість, достатню для забезпечення терапевтично сприятливого ефекту при лікуванні або контролі захворювання або стану, або для відстрочки або мінімізування одного або декількох симптомів, зв'язаних з захворюванням або станом. Терапевтично ефективна кількість сполуки являє собою кількість терапевтичного засобу, окремо або в поєднанні з іншими терапевтичними засобами, що забезпечує терапевтичну користь при лікуванні або контролі захворювання або стану. Термін "терапевтично ефективна кількість" може охоплювати кількість, що забезпечує терапевтичне поліпшення в цілому, зменшує або допомагає уникнути симптомів або причин захворювання або стану або підвищує терапевтичну ефективність іншого терапевтичного засобу. Якщо не зазначено інше, термін "TPH1_IC50" являє собою IC50 сполуки для TPH1, визначену з використанням аналізу інгібування in vitro, описаного в прикладах, нижче. Якщо не зазначено інше, термін " TPH2_IC50" являє собою IC50 сполуки для TPH2, визначену з використанням аналізу інгібування in vitro, описаного в прикладах, нижче. Якщо не зазначено інше, терміни "лікувати" "лікуючий" і "лікування" припускають дію, що відбувається в той час, коли пацієнт страждає від конкретного захворювання або розладу, що знижує тяжкість захворювання або розладу або одного або декількох його симптомів, або гальмує або сповільнює розвиток захворювання або розладу. Якщо не зазначено інше, термін "включають" має те саме значення, що і "включають, але не обмежуються цим", а термін "включає" має те ж значення, що і "включає, але не обмежується цим". Аналогічним чином, термін "такий як" має те ж значення, що і термін "такий як, але не обмежуючись цим". Якщо не зазначено інше, один або кілька прикметників, що безпосередньо передують ряду іменників, повинні бути витлумачені стосовно кожного з іменників. Наприклад, фраза "необов'язково заміщений алкіл, арил або гетероарил" має те ж значення, що і "необов'язково заміщений алкіл, необов'язково заміщений арил або необов'язково заміщений гетероарил." Варто помітити, що хімічна група, яка утворює частину більш великої сполуки, може бути описана в даній заявці, використовуючи назву, що звичайно відповідає їй, коли вона існує у вигляді окремої молекули, або назву, що звичайно відповідає її радикалу. Наприклад, терміни "піридин" і "піридил" відповідають тим же значенням, що використовували для опису групи, приєднаної до інших хімічних груп. Таким чином, дві фрази "XOH, де X являє собою піридил", і "XOH, де X являє собою піридин", відповідають тим же значенням і охоплюють сполуки піридин2-ол, піридин-3-ол і піридин-4-ол. Також варто помітити, що якщо стереохімія структури або частини структури не зазначена, наприклад, жирною або пунктирною лінією, структуру або частину структури варто інтерпретувати як таук, що охоплює всі її стереоізомери. Аналогічним чином, назви сполук, що мають один або декілька хіральних центрів, що точно не визначають стереохімію цих центрів, охоплюють чисті стереоізомери і їх суміші. Більше того, передбачається, що будь-який атом, 5 UA 99270 C2 5 10 15 20 25 показаний на малюнку з ненасиченою валентністю, приєднаний до достатньої кількості атомів водню для відповідності валентностям. Крім того, хімічні зв'язки, зображені однією суцільною лінією, паралельною одній пунктирній лінії, охоплюють як прості, так і подвійні (наприклад, ароматичні) зв'язки, якщо допускають валентності. 5.2. Сполуки Даний винахід охоплює, inter alia, сполуки формули I: і їх фармацевтично прийнятні солі і сольвати, де A 1 являє собою необов'язково заміщений гетероцикл; кожен R1 незалежно являє собою галоген, водень, C(O)RA, ORA, NRBRC, S(O2)RA або необов'язково заміщений алкіл, алкіл-арил або алкіл-гетероцикл; R2 незалежно являє собою галоген, водень, C(O)RA, ОRA, NRBRC, S(O2)RA або необов'язково заміщений алкіл, алкіл-арил або алкіл-гетероцикл; R3 являє собою водень, C(O)RA, C(O)ORA або необов'язково заміщений алкіл, алкіл-арил, алкіл-гетероцикл, арил або гетероцикл; R4 являє собою водень або необов'язково заміщений алкіл, алкіл-арил, алкіл-гетероцикл, арил або гетероцикл; кожен R А незалежно являє собою водень або необов'язково заміщений алкіл, алкіл-арил або алкілгетероцикл; кожен RB незалежно являє собою водень або необов'язково заміщений алкіл, алкіларил або алкіл-гетероцикл; кожен RС незалежно являє собою водень або необов'язково заміщений алкіл, алкіл-арил або алкіл-гетероцикл; і m має значення 1-4. В одному варіанті втілення сполука представлена формулою: В іншому варіанті сполука представлена формулою: 6 UA 99270 C2 5 де кожен R5 незалежно являє собою галоген, водень, C(O)RA, ORA, NRBRC, S(O2)RA або необов'язково заміщений алкіл, алкіл-арил або алкіл-гетероцикл; і n має значення 1-3. В іншому варіанті втілення сполука представлена формулою: 10 7 UA 99270 C2 де кожен R5 незалежно являє собою галоген, водень, C(O)RA, ORA, NRBRC, S(O2)RA або необов'язково заміщений алкіл, алкіл-арил або алкіл-гетероцикл; і p має значення 1-4. В іншому варіанті втілення сполука представлена формулою: 5 де кожен R5 незалежно являє собою галоген, водень, C(O)RA, ORA, NRBRC, S(O2)RA або необов'язково заміщений алкіл, алкіл-арил або алкіл-гетероцикл; і q має значення 1-2. В іншому варіанті втілення сполука представлена формулою: 10 8 UA 99270 C2 5 10 15 20 25 30 35 40 45 50 де кожен R5 незалежно являє собою галоген, водень, C(O)RA, ORA, NRBRC, S(O2)RA або необов'язково заміщений алкіл, алкіл-арил або алкіл-гетероцикл; і q має значення 1-2. У відношенні різних формул, розкритих у даній заявці, у конкретних сполуках за даним винаходом A1 є ароматичним. В інших A1 не є ароматичним. У деяких випадках A1 необов'язково заміщений одним або декількома атомами галогену або нижчим алкілом. У деяких випадках R1 являє собою водень або галоген. У деяких випадках m має значення 1. У деяких випадках R2 являє собою водень або аміно. У деяких випадках R3 являє собою водень або нижчий алкіл. В інших випадках R3 являє собою C(O)ORA і RА являє собою алкіл. У деяких випадках R4 являє собою водень або нижчий алкіл. У деяких випадках R5 являє собою водень або нижчий алкіл (наприклад, метил). У деяких випадках n має значення 1. У деяких випадках p має значення 1. У деяких випадках q має значення 1. Даний винахід охоплює стереомерно чисті сполуки і їх стереомерно збагачені композиції. Стереоізомери можуть бути асиметрично синтезовані або розділені з використанням стандартних технічних прийомів, таких як хиральні колонки, хиральні агенти розділення або ферментативне розділення. Див., наприклад, Jacques, J., et al., Enantiomers, Racemates and Resolutions (Wiley Interscience, New York, 1981); Wilen, S. H., et al., Tetrahedron 33:2725 (1977); Eliel, E. L., Стереохімія of Carbon Compounds (McGraw Hill, NY, 1962); і Wilen, S. H., Tables of Resolving Agents and Optical Resolutions, p. 268 (E.L. Eliel, Ed., Univ. of Notre Dame Press, Notre Dame, IN, 1972). Конкретні сполуки за даним винаходом є сильними інгібіторами TPH1. Окремі сполуки мають значення TPH1_ IC50 менше ніж близько 10, 5, 2,5, 1, 0,75, 0,5, 0,4, 0,3, 0,2, 0,1 або 0,05 мкм. Конкретні сполуки є селективними інгібіторами TPH1. Окремі сполуки мають значення TPH1_ IC50 приблизно в 10, 25, 50, 100, 250, 500 або 1000 разів менше, ніж їх значення TPH2_IC50. Конкретні сполуки не інгібують істотно тирозингідроксилазу людини (TH). Наприклад, окремі сполуки мають значення IC50 для TH більше ніж близько 100, 250, 500 або 1000 мкм. Конкретні сполуки не інгібують істотно фенілаланінгідроксилазу людини (PAH). Наприклад, окремі сполуки мають значення IC50 для PAH більше ніж близько 100, 250, 500 або 1000 мкм. Конкретні сполуки за даним винаходом не демонструють істотне зв'язування (наприклад, інгібують зі значенням IC50 більше ніж близько 10, 25, 50, 100, 250, 500, 750 або 1000 мкм) з одним або декількома з наступних: ангіотензинперетворювальним ферментом, рецептором еритропоетину (EPO), фактором IX, фактором XI, інтегрином (наприклад, α4), ізоксазоліновим або ізоксазоловим рецептором фібриногену, металопротеазою, нейтральною ендопептидазою (NEP), фосфатазою (наприклад, тирозинфосфатазою), фосфодіестеразою (наприклад, PDE-4), полімеразою, PPARγ, TNF-α, адгезивною молекулою-1 клітин судин (VCAM-1) або рецептором вітронектину. Здатність сполуки зв'язуватися з (наприклад, інгібувати) кожну з цих мішеней можна легко визначити, використовуючи способи, відомі з рівня техніки, як описано в посилальних документах, наведених вище. Окремі сполуки за даним винаходом не інгібують клітинну адгезію. При введенні ссавцям (наприклад, мишам, щурам, собакам, мавпам або людям), деякі сполуки за даним винаходом не мають здатність легкого проникнення через гематоенцефалічний бар'єр (наприклад, менше ніж близько 5, 2,5, 2, 1,5, 1, 0,5 або 0,01 відсотків сполуки в крові проходить у головний мозок). Здатність або нездатність сполуки проникати через гемато-енцефалічний бар'єр можна визначити за допомогою способів, відомих з рівня техніки. Див., наприклад, Riant, P. et al., Journal of Neurochemistry 51:421-425 (1988); Kastin, A.J., 9 UA 99270 C2 5 10 15 Akerstrom, V., J. Pharmacol. Exp. Therapeutics 294:633-636 (2000); W. A. Banks, W. A., et al., J. Pharmacol. Exp. Therapeutics 302:1062-1069 (2002). 5.3. Синтез сполук Сполуки за даним винаходом можна одержати за допомогою способів, відомих з рівня техніки, а також за допомогою способів, описаних у даній заявці. Наприклад, сполуки формули I можна одержати, як показано на Схемі 1: де P1 являє собою R1 або захисну групу; P2 являє собою захисну групу; P3 являє собою OR2 або захисну групу; Y1 і Y3 являють собою галоген (наприклад, Br, Cl) або придатний псевдогалогенід (наприклад, трифлат); і кожна з груп A1, R1, R2 і R3 визначена в інших розділах у даній заявці. Сполуки за даним винаходом також можна одержати з використанням підходу, представленого нижче на Схемі 2: 10 UA 99270 C2 5 10 Окремі реакції, показані вище на схемах, можна здійснити, використовуючи умови, відомі з рівня техніки. Наприклад, добре відомі паладієві каталізатори й умови, придатні для реакції поєднання по методу Сузуки бору і галоген-вмісних груп, і приклади представлені нижче. Крім того, типи і придатні застосування захисних груп добре відомі, наприклад, способи їхнього видалення і заміщення групами, такими як, але не обмежуючись цим, водень (наприклад, гідроліз у кислому або основному середовищі). Складноефірні похідні сполук за даним винаходом можна легко одержати з використанням способів, таких як представлені нижче на Схемі 3: 11 UA 99270 C2 5 10 15 Застосовуючи способи, відомі з рівня техніки, синтетичні підходи, показані вище, можна легко модифікувати для одержання широкого ряду сполук. Наприклад, хиральна хроматографія й інші методи, відомі з рівня техніки, можна використовувати для розділення стереоізомерів кінцевого продукту. Див., наприклад, Jacques, J., et al., Enantiomers, Racemates and Resolutions (Wiley Interscience, New York, 1981); Wilen, S. H., et al. Tetrahedron 33:2725 (1977); Eliel, E. L., Stereochemistry of Carbon Compounds (McGraw Hill, NY, 1962); і Wilen, S. H., Tables of Resolving Agents and Optical Resolutions, p. 268 (E.L. Eliel, Ed., Univ. of Notre Dame Press, Notre Dame, IN, 1972). Крім того, як показано вище на деяких схемах, у синтезі можна використовувати хиральні вихідні речовини для одержання стереомерно збагачених або чистих продуктів. 5.4. Способи застосування Даний винахід охоплює спосіб інгібування TPH, що включає контактування TPH зі сполукою за даним винаходом (тобто, сполукою, розкритою у даній заявці). В одному конкретному способі TPH являє собою TPH1. В іншому TPH являє собою TPH2. В одному способі має місце інгібування in vitro. В іншому має місце інгібування in vivo. 12 UA 99270 C2 5 10 15 20 25 30 35 40 45 50 55 60 Один варіант втілення охоплює спосіб інгібування TPH1 у ссавця (наприклад, людини), що включає введення ссавцю сполуки за даним винаходом. В одному конкретному способі TPH2 істотно не інгібується. В одному способі сполука не може легко проникати через гематоенцефалічний бар'єр. В іншому сполука є селективним інгібітором TPH1. Даний винахід охоплює способи лікування, запобігання і контролю різних захворювань і розладів, опосередкованих периферичним серотоніном, що включають інгібування TPH1 активності в пацієнта, що потребує такого лікування, запобігання або контролю. У конкретному варіанті втілення інгібування здійснюють шляхом введення пацієнту терапевтично або профілактично ефективної кількості сильного інгібітору TPH1. Приклади сильних інгібіторів TPH1 розкриті в даній заявці. Конкретні захворювання і розлади включають карциноїдний синдром і шлунково-кишкові захворювання і розлади. Приклади конкретних захворювань і розладів включають біль у черевній порожнині (наприклад, зв'язаний з медулярною карциномою щитовидної залози), занепокоєння, карциноїдний синдром, глютенову хворобу, констипацію (наприклад, констипацію ятрогенного характеру і ідіопатичну констипацію), хворобу Крона, депресію, діабет, діарею (наприклад, жовчо-кислотну діарею, ентеротоксин-індуковану секреторну діарею, діарею ятрогенного характеру, ідіопатичну діарею (наприклад, ідіопатичну секреторну діарею) і діарею мандрівників), блювання, функціональний абдомінальний біль, функціональні аноректальні розлади, функціональний метеоризм, функціональну диспепсію, функціональні розлади жовчного міхура, синдром подразненої товстої кишки (IBS; включаючи IBD-d, IBS-c і IBS-a), непереносимість лактози, MEN типу I і II, нудоту, синдром Огілві, панкреатичний холерний синдром, недостатність підшлункової залози, феохромацитому, склеродермію, соматизацію, сфінктер при розладах Одді, виразковий коліт і ульцерогенну аденому підшлункової залози (синдром Золінгера-Елісона). Додаткові захворювання і розлади включають серцево-судинні і легеневі захворювання і розлади, такі як гостра і хронічна гіпертензія, хронічне обструктивне легеневе захворювання (COPD), емболія судин легенів (наприклад, бронхостеноз і легенева гіпертензія в результаті емболії судин легенів), легенева гіпертензія (наприклад, легенева гіпертензія, зв'язана з портальною гіпертензією) і променевий пневмоніт (включаючи, пневмоніт, що приводить до або сприяє легеневій гіпертензії). Інші захворювання включають мігрень, що супроводжується нудотою і блюванням, респіраторний дистрес-синдром дорослих (ARDS), карциноїдну кризу, CREST синдром (кальциноз, феномен Рейно, шлункова дисфункція, склеродактилія, телеангіектазія), серотоніновий синдром і субарахноїдальний крововилив. У конкретних способах за даним винаходом лікування, контроль і/або запобігання захворювань або розладів досягаються без несприятливих ефектів, зв'язаних зі змінами рівнів серотоніну в центральній нервовій системі (ЦНС). Приклади таких несприятливих ефектів включають тривожне порушення, занепокоєння, депресію і розлади сну (наприклад, безсоння і порушення сну). 5.5. Фармацевтичні композиції Даний винахід охоплює фармацевтичні композиції, що включають одну або кілька сполук за даним винаходом. Деякі фармацевтичні композиції являють собою окремі стандартні лікарські форми, придатні для перорального введення, введення через слизову оболонку (наприклад, назального, сублінгвального, вагінального, букального або ректального), парентерального (наприклад, підшкірного, внутрішньовенного, болюсної ін'єкції, внутрішньом'язового або внутрішньоартеріального) або черезшкірного введення пацієнту. Приклади лікарських форм включають, але не обмежуються цим: таблетки; каплети; капсули, такі як м'які еластичні желатинові капсули; саше; пастилки; таблетки для розсмоктування; дисперсії; супозиторії; мазі; припарки (гарячі компреси); пасти; порошки; пов'язки; креми; пластири; розчини; накладки; аерозолі (наприклад, назальні спреї або інгалятори); гелі; рідкі лікарські форми, придатні для перорального введення або введення через слизову оболонку пацієнту, включаючи суспензії (наприклад, водні або неводні рідкі суспензії, емульсії масло-в-воді або рідкі емульсії вода-вмаслі), розчини й еліксири; рідкі лікарські форми, придатні для парентерального введення пацієнту; і стерильні тверді речовини (наприклад, кристалічні або аморфні тверді речовини), які можна реструктурувати з одержанням рідких лікарських форм, придатних для парентерального введення пацієнту. Композиція повинна відповідати способу введення. Наприклад, пероральне введення сполуки, що може розкладатися в шлунку, можна здійснювати з використанням ентеросолюбільного покриття. Аналогічним чином, композиція може містити інгредієнти, що прискорюють доставку активного інгредієнта(інгредієнтів) до ділянки їхньої дії. Наприклад, сполуки можна вводити у формах, що являють собою ліпосоми, для їх захисту від 13 UA 99270 C2 5 10 15 20 25 30 35 40 45 50 55 60 розкладальних ферментів, прискорення їх транспорту в кровотоці і здійснення їх доставки через клітинні мембрани. Аналогічним чином, погано розчинні сполуки можна включати в рідкі лікарські форми (і лікарські форми, придатні для реструктурування) за допомогою солюбілізуючих речовин, емульгаторів і поверхнево-активних речовин, таких як, але не обмежуючись цим, циклодекстрини (наприклад, α-циклодекстрин, β-циклодекстрин, Captisol® і Encapsin™ (див., наприклад, Davis and Brewster, Nat. Rev. Drug Disc. 3:1023-1034 (2004)), Labrasol®, Labrafil®, Labrafac®, кремафор і не-водні розчинники, такі як, але не обмежуючись цим, етиловий спирт, ізопропіловий спирт, етилкарбонат, етилацетат, бензиловий спирт, бензилбензоат, пропіленгліколь, 1,3-бутиленгліколь, диметилформамід, диметилсульфоксид (ДМСО), біосумісні олії (наприклад, олія насіння бавовнику, арахісова олія, кукурудзяна олія, олія зародків рослин, оливкова олія, касторова олія і кунжутна олія), гліцерин, тетрагідрофурфуриловий спирт, поліетиленгліколі, складні ефіри жирних кислот сорбітану і їх суміші (наприклад, ДМСО:кукурудзяна олія). Погано розчинні сполуки також можна включати в суспензії, використовуючи інші методики, відомі з рівня техніки. Наприклад, наночастинки сполуки можна суспендувати у рідині з одержанням наносуспензії (див., наприклад, Rabinow, Nature Rev. Drug Disc. 3:785-796 (2004)). Форми наночастинок сполук, описаних у даній заявці, можна одержати за допомогою способів, описаних у патентних публікаціях США № 2004-0164194, 2004-0195413, 2004-0251332, 20050042177 A1, 2005-0031691 A1 і патентах США № 5145684, 5510118, 5518187, 5534270, 5543133, 5662883, 5665331, 5718388, 5718919, 5834025, 5862999, 6431478, 6742734, 6745962, кожний з який у повному обсязі включений у дану заявку за допомогою посилання. В одному варіанті втілення форма наночастинок включає частинки, що мають середній розмір частинок менше ніж близько 2000 нм, менше ніж близько 1000 нм або менше ніж близько 500 нм. Композиція, форма і тип лікарської форми типово варіюють у залежності від застосування. Наприклад, лікарська форма, застосовна при лікуванні гострої форми захворювання, може містити більші кількості одного або декількох активних інгредієнтів у порівнянні з лікарською формою, застосовуваною при лікуванні хронічної форми того ж захворювання. Аналогічним чином, лікарська форма для парентерального введення може містити менші кількості одного або декількох активних інгредієнтів у порівнянні з лікарською формою для перорального введення, застосовуваною для лікування того ж самого захворювання. Такі відмінності повинні бути очевидні для фахівців у даній галузі. Див., наприклад, Remington's Pharmaceutical Sciences, th 18 ed., Mack Publishing, Easton PA (1990). 5.5.1. Лікарські форми для перорального введення Фармацевтичні композиції за даним винаходом, придатні для перорального введення, можуть бути представлені у вигляді дискретних лікарських форм, таких як, але не обмежуючись цим, таблетки (наприклад, жувальні таблетки), каплети, капсули і рідини (наприклад, сиропи з доданим ним приємним смаком). Такі лікарські форми містять попередньо визначені кількості активних інгредієнтів і можуть бути одержані способами, використовуваними у фармацевтиці і добре відомими фахівцям у даній галузі. Див., в основному, Remington's Pharmaceutical th Sciences, 18 ed., Mack Publishing, Easton PA (1990). Типові лікарські форми для перорального введення одержують шляхом ретельного перемішування активного інгредієнта(інгредієнтів) з, щонайменше, одним ексципієнтом, відповідно до традиційних методів складання фармацевтичних композицій. Ексципієнти можуть мати самі різні форми, у залежності від форми препарату, бажаної для введення. Через легкість їхнього введення таблетки і капсули представляють найбільш вигідні стандартні лікарські форми для перорального введення. Якщо необхідно, на таблетки може бути нанесене покриття за допомогою стандартних водних або неводних технологій. Такі лікарські форми можна одержати традиційними методами, використовуваними у фармацевтиці. Головним чином, фармацевтичні композиції і лікарські форми одержують шляхом однорідного і ретельного змішування активних інгредієнтів з рідкими носіями, тонкоподрібненими твердими носіями або і тими й іншими, а потім продукту додають бажану для представлення форму, якщо потрібно. Розпушувачі можна включати у тверді лікарські форми, що сприяє швидкій розчинності. Змащувальні речовини, також можуть бути включені, що полегшує виготовлення лікарських форм (наприклад, таблеток). 5.5.2. Лікарські форми для парентерального введення Лікарські форми для парентерального введення можна вводити пацієнтам різними шляхами, включаючи підшкірне, внутрішньовенне (включаючи болюсну ін'єкцію), внутрішньом'язове і внутрішньоартеріальне введення. Оскільки їх введення звичайне обходить стороною природний захист пацієнтів від забруднюючих домішок, лікарські форми для парентерального введення є 14 UA 99270 C2 5 10 15 20 25 30 35 40 45 50 55 особливо стерильними або здатними до стерилізації перед введенням пацієнту. Приклади лікарських форм для парентерального введення включають розчини, готові для ін'єкцій, сухі продукти, готові до розчинення або суспендування у фармацевтично прийнятному носії для ін'єкцій, суспензії, готові для ін'єкцій, і емульсії. Придатні носії, що можуть бути використані для одержання лікарських форм для парентерального введення за даним винаходом, добре відомі фахівцям у даній галузі. Приклади включають воду для ін'єкцій USP; водні наповнювачі, такі як хлорид натрію для ін'єкцій, розчин Рінгера для ін'єкцій, розчин декстрози для ін'єкцій, розчин декстрози і хлориду натрію для ін'єкцій і розчин, лактат-вмісний розчин Рінгера для ін'єкцій; водорозчинні наповнювачі, такі як етиловий спирт, поліетиленгліколь і поліпропіленгліколь; і неводні наповнювачі, такі як кукурудзяна олія, бавовняна олія, арахісова олія, кунжутна олія, етилолеат, ізопропілміристат і бензилбензоат. 6. ПРИКЛАДИ 6.1. Одержання мишей з перерваним геном tph1 Екзон 3 мишачого гена TPH1 видаляли методом генного таргетування, в основному, як описано Wattler et al., Biotechniques 26(6): 1150-6 (1999). Одержані тварини з генним "нокаутом" демонстрували нормальну активність TPH у головному мозку, але істотне зниження експресії TPH у кишці. 6.2. Фізіологічні ефекти переривання гена tph1 Мишей, гомозиготних (-/-) по перериванню гена tph1, досліджували разом з мишами, гетерозиготними (+/-) по перериванню цього гена, разом з мишами дикого типу (+/+). У ході аналізу мишей піддавали медичній обробці, використовуючи комплекс медичних діагностичних процедур, розроблених для оцінки основних систем органів суб'єкта-ссавця. Шляхом дослідження гомозиготних (-/-) мишей з генним "нокаутом" у бажаних кількостях і разом з гетерозиготними (+/-) мишами і мишами дикого типу (+/+) були одержані більш достовірні і повторювані дані. Переривання гена tph1, насамперед, впливало на ізоформу TPH у шлунково-кишковому тракті (TPH1) і надавало незначний ефект або не надавало жодного ефекту на ізоформу TPH у головному мозку (TPH2). Переривання гена не надавало ніяких вимірюваних побічних ефектів на центральну нервову систему. Це було підтверджено імунохімією серотоніну, що показала значне зниження або відсутність серотоніну в шлунку, дванадцятипалій кишці, худій кишці, підклубовій кишці, сліпій кишці і товстій кишці, тоді як рівні серотоніну у вставних нейронах не змінювалися. Деякі миші, гомозиготні (-/-) по перериванню гена tph1, демонстрували зменшення тромбозу, без істотного посилення кровотечі або інших несприятливих показань. 6.3. Методи ВЕРХ аналізу У деяких з наступних прикладів синтезу представлені дані часу втримання, одержані методом високоефективної рідинної хроматографії (ВЕРХ). Різні умови, використовувані для одержання цих значень часу втримання, описані нижче: Спосіб A: YMC-PACK ODS-A 3,0×50 мм; Розчинник A=H2O, 0,1 % ТФОК; Розчинник B=MeOH, 0,1 % ТФОК; B % від 10 до 90 % протягом 4 хв; швидкість потоку=2 мл/хв; довжина хвилі спостереження=220 і 254 нм. Спосіб B: YMC-PACK ODS-A 3,0×50 мм; Розчинник A=90 % води, 10 % MeOH з 0,1 % ТФОК; Розчинник B=90 % MeOH, 10 % води з 0,1 % ТФОК; B % від 0 до 100 % протягом 4 хв; швидкість потоку=2 мл/хв; довжина хвилі спостереження=220 і 254 нм. Спосіб C: ShimPack VP ODS 4,6×50 мм; Розчинник A=90 % H2O, 10 % MeOH, 1 %ТФОК; Розчинник B=10 % H2O, 90 % MeOH, 1 %ТФОК; B % від 0 до 100 % протягом 2 хв; швидкість потоку=3,5 мл/хв; довжина хвилі спостереження=220 і 254 нм. Спосіб D: Shim VP ODS 4,6×50 мм; Розчинник A=H2O з 0,1 % ТФОК; Розчинник B=MeOH з 0,1 % ТФОК; B % від 0 до 100 % протягом 4 хв; швидкість потоку=3 мл/хв; довжина хвилі спостереження=254 нм. Спосіб E: YMC Pack ODS-A 4,6×33 мм; Розчинник A=H2O, 0,1 % ТФОК; Розчинник B=MeOH з 0,1 % ТФОК; B % від 10 до 90 % протягом 3 хв; швидкість потоку 2 мл/хв; довжина хвилі спостереження 220 і 254 нм. Спосіб F: YMC-Pack ODS-A 3,0×50 мм; Розчинник A=90 % H2O, 10 % MeOH, 1 % ТФОК; Розчинник B=10 % H2O, 90 % MeOH, 1 % ТФОК; B % від 10 до 90 % протягом 4 хв; швидкість потоку=2 мл/хв довжина хвилі спостереження=220 і 254 нм. 6.4. Синтез (S)-2-аміно-3-(4-{2-аміно-6-[2,2,2-трифтор-1-(4-піридин-4ілфеніл)етокси]піримідин-4-іл}феніл)пропіонової кислоти 60 15 UA 99270 C2 5 10 15 20 25 30 35 40 Тетрабутиламонійфторид (0,027 мл; 1,0M розчин у тетрагідрофурані) додавали до розчину 4-піридин-4-ілбензальдегіду (500 мг, 2,73 ммоль) і трифторметилтриметилсилану (TMSCF3) (485 мкл, 3,28 ммоль) у 5 мл ТГФ при 0 C. Одержану суміш нагрівали до кімнатної температури і перемішували при кімнатній температурі протягом 4 годин. Реакційну суміш потім обробляли за допомогою 5 мл 1н розчину HCl і перемішували при кімнатній температурі протягом ночі. Розчинник випарювали досуха, додавали 9 мл 1M водного розчину карбонату натрію, водну фазу екстрагували за допомогою хлороформу (3×10 мл) і об'єднаний шар хлороформу промивали водою, сушили над MgSO4. Органічний розчинник видаляли у вакуумі з одержанням 360 мг 2,2,2-трифтор-1-(4-піридин-4-ілфеніл)етанолу, вихід: 51 %. Суміш 2,2,2-трифтор-1-(4-піридин-4-ілфеніл)етанолу (100 мг, 0,40 ммоль), 2-аміно-4,6дихлорпіримідину (60 мг, 0,38 ммоль) і карбонату цезію (468 мг, 1,44 ммоль) розчиняли в 2 мл 1,4-діоксану в 50-мл герметично закритій трубці. Суміш нагрівали при 110 °C протягом ночі, потім охолоджували до кімнатної температури; додавали 10 мл етилацетату і потім фільтрували через целіт. Фільтрат концентрували з одержанням 120 мг 4-хлор-6-[2,2,2трифтор-1-(4-піридин-4-ілфеніл)етокси]піримідин-2-іламіну, вихід: 80 %. У мікрохвильовій посудині 4-хлор-6-[2,2,2-трифтор-1-(4-піридин-4-ілфеніл)етокси]піримідин2-іламіну (30 мг, 0,080 ммоль), 4-бороно-L-фенілаланін (21 мг, 0,098 ммоль) і 1 мл актонітрилу і 0,7 мл води змішували разом. Потім до суміші додавали 0,3 мл 1н водного розчину карбонату натрію, з наступним додаванням 5 % мл. дихлорбіс-(трифенілфосфін)паладію(II). Реакційну посудину герметично закривали і нагрівали при 150 °C протягом 5 хвилин в умовах мікрохвильового опромінення. Після охолодження реакційну суміш упарювали досуха. Залишок розчиняли в 2,5 мл метанолу і потім очищали за допомогою препаративної РХ з одержанням 6,7 мг (S)-2-аміно-3-(4-{2-аміно-6-[2,2,2-трифтор-1-(4-піримідин-4-ілфеніл)етокси]піримідин-41 іл}феніл) пропіонової кислоти. H ЯМР (400 МГц, CD3OD) δ (ч/млн) 8,82 (c, 2H), 8,26 (c, 2H), 8,02 (д, J=8 Гц, 2H), 7,97 (д, J=8,4 Гц, 2H), 7,86 (д, J=8,4 Гц, 2H), 7,45 (д, J=8 Гц, 2H), 6,89 (кв., J=6,8 Гц, 1H), 6,81 (д, J=2 Гц, l), 4,29 (т, J=1,6 Гц, 1H), 3,39 (м, 1H), 3,19 (м, 1H). 6.5. Синтез (S)-2-аміно-3-(4-{6-[2,2,2-трифтор-1-(2-піридин-4-ілфеніл)етокси]піримідин-4іл}феніл)пропіонової кислоти Тетрабутиламонійфторид (0,027 мл; 1,0M розчин у тетрагідрофурані) додавали до розчину 2-піридин-4-ілбензальдегіду (500 мг, 2,73 ммоль) і трифторметилтриметилсилану (TMSCF3) (485 мкл, 3,28 ммоль) у 5 мл ТГФ при 0 °C. Одержану суміш нагрівали до кімнатної температури і перемішували при кімнатній температурі протягом 4 годин. Реакційну суміш потім обробляли за допомогою 5 мл 1н розчину HCl і перемішували при кімнатній температурі протягом ночі. Розчинник випарювали досуха, додавали 9 мл 1M водного розчину карбонату натрію, водну фазу екстрагували за допомогою хлороформу (3×10 мл) і об'єднаний органічний шар промивали водою, сушили над MgSO4. Органічний розчинник випарювали з одержанням 300 мг 2,2,2-трифтор-1-(2-піридин-4-ілфеніл)етанолу, вихід: 43 %. Суміш 2,2,2-трифтор-1-(2-піридин-4-ілфеніл)етанолу (100 мг, 0,40 ммоль), 4,6дихлорпіримідину (54 мг, 0,38 ммоль), карбонату цезію (468 мг, 1,44 ммоль) і 1,4-діоксану (1 мл). 16 UA 99270 C2 5 10 15 Суміш нагрівали при 110 °C протягом ночі. Реакційну суміш охолоджували до кімнатної температури. Додавали 10 мл етилацетату і потім суміш фільтрували через целіт. Фільтрат концентрували з одержанням 110 мг 4-хлор-6-[2,2,2-трифтор-1-(2-піридин-4ілфеніл)етокси]піримідину, вихід: 76 %. У мікрохвильовій посудині разом змішували 4-хлор-6-[2,2,2-трифтор-1-(4-піридин-4ілфеніл)етокси]піримідин (30 мг, 0,082 ммоль), 4-бороно-L-фенілаланін (21 мг, 0,098 ммоль), 1 мл актонітрилу і 0,7 мл води. Потім до суміші додавали 0,3 мл 1н водного розчину карбонату натрію, з наступним додаванням 5 % мл. дихлорбіс(трифенілфосфін)паладію(II). Реакційну посудину герметично закривали і нагрівали при 150 °C протягом 5 хвилин в умовах мікрохвильового опромінення. Після охолодження реакційну суміш упарювали досуха. Залишок розчиняли в 2,5 мл метанолу і потім очищали за допомогою препаративної РХ з одержанням 19 мг (S)-2-аміно-3-(4-{6-[2,2,2-трифтор-1-(2-піридин-4-ілфеніл)етокси]піримідин-41 іл}феніл)пропіонової кислоти. H ЯМР (400 МГц, CD3OD) δ (ч/млн) 8,94 (д, J=6 Гц, 2H), 8,79 (д, J=1,2 Гц, 1H), 8,15 (м, 4H), 7,84 (т, J=5,2 Гц, 1H), 7,62 (м, 3H), 7,46 (м, 3H), 6,66 (кв., J=6,4 Гц, 1H), 4,31 (кв., J=6 Гц, 1H), 3,41 (м, 1H), 3,26 (м, 1H). 6.6. Синтез (S)-2-аміно-3-(4-{2-аміно-6-[2,2,2-трифтор-1-(2-(4-метилтіофен-3іл)феніл]етокси}піримідин-4-іл)феніл]пропіонової кислоти 20 25 30 35 40 45 У мікрохвильовій посудині змішували разом 3-бром-4-метилтіофен (653 мг, 3,69 ммоль), 2формілфенілборонову кислоту (500 мг, 3,36 ммоль) і 7 мл актонітрилу. До одержаного розчину додавали 6,7 мл 1н водного розчину карбонату натрію, з наступним додаванням 5 % мл. дихлорбіс(трифенілфосфін)паладію(II). Реакційну посудину герметично закривали і нагрівали при 150 °C протягом 5 хвилин в умовах мікрохвильового опромінення. Після охолодження додавали 50 мл етилацетату, органічний шар відокремлювали, промивали водою, сушили за допомогою сульфату натрію. Органічний розчинник випарювали з одержанням неочищеного продукту, що очищали за допомогою колонки ISCO CombiFlash з одержанням 530 мг 2-(4метилтіофен-3-іл)бензальдегіду, вихід: 78 %. Тетрабутиламонійфторид (0,013 мл; 1,0M розчин у тетрагідрофурані) при 0 °C додавали до розчину 2-(4-метилтіофен-3-іл)бензальдегіду (260 мг, 1,29 ммоль) і трифторметилтриметилсилану (TMSCF3) (228 мкл, 1,54 ммоль) у 5 мл ТГФ. Суміш, що утворилася, нагрівали до кімнатної температури і перемішували при кімнатній температурі протягом 4 годин. Реакційну суміш потім обробляли за допомогою 5 мл 1н розчину HCl і перемішували при кімнатній температурі протягом ночі. Продукт екстрагували за допомогою етилацетату (3×50 мл). Органічний шар відокремлювали і сушили над сульфатом натрію. Органічний розчинник випарювали з одержанням 340 мг 2,2,2-трифтор-1-[2-(4-метилтіофен-3іл)феніл]етанолу, вихід 97 %. Суміш 2,2,2-трифтор-1-[2-(4-метилтіофен-3-іл)феніл]етанолу (100 мг, 0,37 ммоль), 2-аміно4,6-дихлорпіримідину (54 мг, 0,33 ммоль), карбонату цезію (481 мг, 1,48 ммоль) і 1,4-діоксану (1 мл) нагрівали при 110 °C протягом ночі. Реакційну суміш охолоджували до кімнатної температури; додавали 10 мл етилацетату. Суміш потім фільтрували через целіт, фільтрат концентрували з одержанням 100 мг 4-хлор-6-{2,2,2-трифтор-1-[2-(4-метилтіофен-3іл)феніл]етокси}піримідин-2-іламіну, вихід: 76 %. У мікрохвильовій посудині змішували 4-хлор-6-{2,2,2-трифтор-1-[2-(4-метилтіофен-3іл)феніл]етокси}піримідин-2-іламін (30 мг, 0,075 ммоль), 4-бороно-L-фенілаланін (19 мг, 0,09 ммоль), 1 мл актонітрилу і 0,7 мл води. До суміші додавали 0,3 мл 1н водного розчину карбонату натрію, з наступним додаванням 5 % мл. дихлорбіс-(трифенілфосфін)паладію(II). Реакційну посудину герметично закривали і нагрівали при 150 °C протягом 5 хвилин в умовах 17 UA 99270 C2 5 мікрохвильового опромінення. Після охолодження реакційну суміш упарювали досуха. Залишок розчиняли в 2,5 мл метанолу і потім очищали за допомогою препаративної ВЕРХ з одержанням 15,1 мг (S)-2-аміно-3-(4-{2-аміно-6-[2,2,2-трифтор-1-(2-(4-метилтіофен-31 іл)феніл]етокси}піримідин-4-іл}феніл) пропіонової кислоти. H ЯМР (400 МГц, CD3OD) δ (ч/млн) 7,94 (д, J=8 Гц, 2H), 7,80 (c, 1H), 7,50 (м, 5H), 7,25 (м, 2H), 7,03 (c, 1H), 6,94 (c, 1H), 4,31 (т, J=5,6 Гц, 1H), 3,48 (м, 1H), 3,26 (м, 1H), 1,98 (c, 3H). 6.7. Синтез (S)-2-аміно-3-(4-{2-аміно-6-[2,2,2-трифтор-1-(2-(5-метилтіофен-3іл)феніл]етокси}піримідин-4-іл)феніл]пропіонової кислоти 10 15 20 25 30 35 40 45 У мікрохвильовій посудині змішували 4-бром-2-метилтіофен (653 мг, 3,69 ммоль), 2формілфенілборонову кислоту (500 мг, 3,36 ммоль) і 7 мл актонітрилу. До одержаного розчину додавали 6,7 мл 1н водного розчину карбонату натрію, з наступним додаванням 5 % мл. дихлорбіс(трифенілфосфін)паладію(II). Реакційну посудину герметично закривали і нагрівали при 150 °C протягом 5 хвилин в умовах мікрохвильового опромінення. Після охолодження додавали 50 мл етилацетату, органічний шар відокремлювали, промивали водою, сушили за допомогою сульфату натрію, органічний розчинник випарювали і залишок очищали за допомогою ISCO з одержанням 550 мг 2-(5-метилтіофен-3-іл) бензальдегіду, вихід 81 %. Тетрабутиламонійфторид (0,028 мл; 1,0M розчин у тетрагідрофурані) додавали до розчину 2-(5-метилтіофен-3-іл)бензальдегіду (550 мг, 1,29 ммоль) і трифторметилтриметилсилану о (TMSCF3) (483 мкл, 3,27 ммоль) у 10 мл ТГФ при 0 . Суміш, що утворилася, нагрівали до кімнатної температури і перемішували при кімнатній температурі протягом 4 годин. Реакційну суміш потім обробляли за допомогою 10 мл 1н розчину HCl і перемішували при кімнатній температурі протягом ночі. Продукт екстрагували за допомогою етилацетату (3×50 мл). Органічний шар відокремлювали і сушили над сульфатом натрію. Органічний розчинник випарювали з одержанням 650 мг 2,2,2-трифтор-1-[2-(5-метилтіофен-3-іл)феніл]етанолу, вихід: 87 %. Суміш 2,2,2-трифтор-1-[2-(5-метилтіофен-3-іл)феніл]етанолу (100 мг, 0,37 ммоль), 2-аміно4,6-дихлорпіримідину (54 мг, 0,33 ммоль), карбонату цезію (481 мг, 1,48 ммоль) і 1,4-діоксану (2 мл) нагрівали при 110 °C протягом ночі. Реакційну суміш охолоджували до кімнатної температури; додавали 10 мл етилацетату. Суміш потім фільтрували через целіт, фільтрат концентрували з одержанням 90 мг 4-хлор-6-{2,2,2-трифтор-1-[2-(5-метилтіофен-3-іл)феніл] етокси}піримідин-2-іламіну, вихід: 68 %. У мікрохвильовій посудині змішували 4-хлор-6-{2,2,2-трифтор-1-[2-(5-метилтіофен-3іл)феніл]етокси}піримідин-2-іламін (30 мг, 0,075 ммоль), 4-бороно-L-фенілаланін (19 мг, 0,09 ммоль), 1 мл актонітрилу і 0,7 мл води. До суміші додавали 0,3 мл 1н водного розчину карбонату натрію, з наступним додаванням 5 % мл. дихлорбіс(трифенілфосфін)паладію(II). Реакційну посудину герметично закривали і нагрівали при 150 °C протягом 5 хвилин в умовах мікрохвильового опромінення. Після охолодження реакційну суміш упарювали досуха. Залишок розчиняли в 2,5 мл метанолу і потім очищали за допомогою препаративної РХ з одержанням 10,1 мг (S)-2-аміно-3-(4-{2-аміно-6-[2,2,2-трифтор-1-(2-(5-метилтіофен-31 іл)феніл)етокси]піримідин-4-іл}феніл) пропіонової кислоти. H ЯМР (400 МГц, CD3OD) δ (ч/млн) 7,83 (д, J=8,4 Гц, 2H), 7,63 (д, J=7,2 Гц, 1H), 7,34 (м, 4H), 7,26 (м, 1H), 7,12 (д, J=1,2 Гц, 1H), 6,92 (кв., J=6,8 Гц, 1H), 6,82 (д, J=1,2 Гц, 1H), 6,64 (c, 1H), 4,21 (т, J=5,6 Гц, 1H), 3,29 (м, 1H), 3,20 (м, 1H), 2,47 (c, 3H). 6.8. Синтез (S)-2-аміно-3-(4-{2-аміно-6-[2,2,2-трифтор-1-(4-фуран-3ілфеніл)етокси]піримідин-4-іл}феніл)пропіонової кислоти 18 UA 99270 C2 5 10 15 20 25 30 35 У мікрохвильовій посудині змішували 3-бромфуран (590 мг, 4,02 ммоль), 4формілфенілборонову кислоту (600 мг, 4,02 ммоль) і 7 мл актонітрилу. До суміші потім додавали 8 мл 1н водного розчину карбонату натрію, з наступним додаванням 5 % мл. дихлорбіс(трифенілфосфін)паладію(II). Реакційну посудину герметично закривали і нагрівали при 150 °C протягом 7 хвилин в умовах мікрохвильового опромінення. Після охолодження додавали 50 мл етилацетату, органічний шар відокремлювали, промивали водою, сушили над сульфатом натрію. Органічний розчинник випарювали з одержанням неочищеного продукту, що очищали за допомогою ISCO, з одержанням 410 мг 4-фуран-3-ілбензальдегіду, вихід: 60 %. Тетрабутиламонійфторид (0,024 мл; 1,0M розчин у тетрагідрофурані) додавали до розчину 4-фуран-3-ілбензальдегіду (410 мг, 2,38 ммоль) і трифторметилтриметилсилану (TMSCF3) (423 мкл, 2,86 ммоль) у 5 мл ТГФ при 0 °C. Суміш, що утворилася, нагрівали до кімнатної температури і перемішували при кімнатній температурі протягом 4 годин. Реакційну суміш потім обробляли за допомогою 5 мл 1н розчину HCl і перемішували при кімнатній температурі протягом ночі. Продукт екстрагували за допомогою етилацетату (3×50 мл). Органічний шар відокремлювали і сушили над сульфатом натрію. Органічний розчинник випарювали з одержанням 480 мг 2,2,2-трифтор-1-(4-фуран-3-ілфеніл)етанолу, вихід: 83 %. Суміш 2,2,2-трифтор-1-(4-фуран-3-ілфеніл)етанолу (100 мг, 0,4 ммоль), 2-аміно-4,6дихлорпіримідину (60 мг, 0,36 ммоль), карбонату цезію (468 мг, 1,44 ммоль) і 1,4-діоксану (1 мл) нагрівали при 110 °C протягом ночі. Реакційну суміш охолоджували до кімнатної температури; додавали 10 мл етилацетату. Суміш потім фільтрували через целіт, фільтрат концентрували з одержанням 110 мг 4-хлор-6-[2,2,2-трифтор-1-(4-фуран-3-ілфеніл)етокси]піримідин-2-іламіну, вихід: 72 %. У мікрохвильовій посудині змішували 4-хлор-6-[2,2,2-трифтор-1-(4-фуран-3ілфеніл)етокси]піримідин-2-іламін (30 мг, 0,081 ммоль), 4-бороно-L-фенілаланін (20 мг, 0,098 ммоль), 1 мл актонітрилу і 0,7 мл води. До суміші потім додавали 0,3 мл 1н водного розчину карбонату натрію, з наступним додаванням 5 % мл. дихлорбіс(трифенілфосфін)паладію(II). Реакційну посудину герметично закривали і нагрівали при 150 °C протягом 5 хвилин в умовах мікрохвильового опромінення. Після охолодження реакційну суміш упарювали досуха. Залишок розчиняли в 2,5 мл метанолу і потім очищали за допомогою препаративної РХ з одержанням 7,2 мг (S)-2-аміно-3-(4-{2-аміно-6-[2,2,2-трифтор-11 (4-фуран-3-ілфеніл)етокси]піримідин-4-іл}феніл)пропіонової кислоти. H ЯМР (400 МГц, CD3OD) δ (ч/млн) 7,96 (м, 3H), 7,61 (м, 5H), 6,81 (c, 1H), 6,77 (д, J=6,8 Гц, 1H), 6,74 (д, J=4,8 Гц, 1H), 4,27 (кв., J=5,6 Гц, 1H), 3,36 (м, 1H), 3,21 (м, 1H). 6.9. Синтез (S)-2-аміно-3-[4-{2-аміно-6-{1-[2-(5-диметиламінометилфуран-2-іл)феніл]-2,2,2трифторетокси}піримідин-4-іл) феніл]пропіонової кислоти 40 19 UA 99270 C2 5 10 15 20 25 30 35 40 45 Триацетоксиборгідрид натрію (844 мг, 4 ммоль) додавали до розчину 5-бромфуран-2карбальдегіду (350 мг, 2 ммоль) і диметиламіну (2 мл, 2M розчин у ТГФ) у 10 мл 1,2дихлоретану (DCE). Потім додавали 0,2 мл HOAc. Суміш перемішували при кімнатній температурі протягом ночі, з наступним додаванням 15 мл DCE. Органічну фазу промивали водою, сушили над сульфатом натрію. Розчинник видаляли за допомогою роторного випарника з одержанням 400 мг (5-бромфуран-2-ілметил)диметиламіна, вихід: 97 %. У мікрохвильовій посудині змішували (5-бромфуран-2-ілметил)диметиламін (385 мг, 1,88 ммоль), 2-формілфенілборонову кислоту (288 мг, 1,93 ммоль) і 3,7 мл актонітрилу. Потім до суміші додавали 3,7 мл 1н водного розчину карбонату натрію, з наступним додаванням 5 % мл. дихлорбіс(трифенілфосфін)паладію(II). Реакційну посудину герметично закривали і нагрівали при 150 °C протягом 5 хвилин в умовах мікрохвильового опромінення. Після охолодження додавали 20 мл 1н розчину HCl. Суміш екстрагували за допомогою етилацетату (3×10 мл) і етилацетатний шар відкидали. До водної фази додавали 1н розчин NaOH, щоб довести рівень pН до 10, потім екстрагували за допомогою етилацетату (3×20 мл). Об'єднаний органічний шар промивали водою і сушили над сульфатом натрію. Розчинник випарювали з одержанням 300 мг 2-(4-диметиламінометилциклопента-1,3-діеніл)бензальдегіду, вихід: 69 %. Тетрабутиламонійфторид (0,013 мл; 1,0M розчин у тетрагідрофурані) додавали до розчину 2-(4-диметиламінометилциклопента-1,3-діеніл)бензальдегіду (287 мг, 1,25 ммоль) і трифторметилтриметилсилану (TMSCF3) (222 мкл, 1,5 ммоль) у 5 мл ТГФ при 0 °C. Суміш, що утворилася, нагрівали до кімнатної температури і перемішували при кімнатній температурі протягом 4 годин. Реакційну суміш потім обробляли за допомогою 5 мл 1н розчину HCl і перемішували при кімнатній температурі протягом ночі. Продукт екстрагували за допомогою етилацетату (3×50 мл). Органічний шар відокремлювали і сушили над сульфатом натрію. Органічний розчинник випарювали з одержанням 250 мг 1-[2-(5-диметиламінометилфуран-2-іл) феніл]2,2,2-трифторетанолу, вихід 66 %. Суміш 1-[2-(5-диметиламінометилфуран-2-іл)феніл]-2,2,2-трифторетанолу (225 мг, 0,75 ммоль), 2-аміно-4,6-дихлорпіримідину (111 мг, 0,67 ммоль), карбонату цезію (978 мг, 3,01 ммоль) і 1,4-діоксану (3 мл) нагрівали при 110 °C протягом ночі. Реакційну суміш охолоджували до кімнатної температури; додавали 10 мл етилацетату. Суміш потім фільтрували через целіт, фільтрат концентрували з одержанням 110 мг 4-хлор-6-{1-[2-(5диметиламінометилфуран-2-іл)феніл]2,2,2-трифторетокси}піримідин-2-іламіну, вихід 87 %. У мікрохвильовій посудині змішували 4-хлор-6-{1-[2-(5-диметиламінометилфуран-2іл)феніл]2,2,2-трифторетокси}піримідин-2-іламін (37 мг, 0,087 ммоль), 4-бороно-L-фенілаланін (22 мг, 0,10 ммоль), 1 мл актонітрилу і 0,7 мл води. Потім додавали 0,3 мл 1 н водного розчину карбонату натрію, з наступним додаванням 5 % мл. дихлорбіс(трифенілфосфін)паладію(II). Реакційну посудину герметично закривали і нагрівали при 150 °C протягом 5 хвилин в умовах мікрохвильового опромінення. Після охолодження реакційну суміш упарювали досуха. Залишок розчиняли в 2,5 мл метанолу і потім очищали за допомогою препаративної РХ з одержанням 16 мг (S)-2-аміно-3-[4-{2-аміно-6-{1-[2-(5-диметиламінометилфуран-2-іл)феніл]-2,2,21 трифторетокси}піримідин-4-іл} феніл]пропіонової кислоти. H ЯМР (400 МГц, CD3OD) δ 7,88 (д, J=8,4 Гц, 2H), 7,71 (д, J=7,6 Гц, 1H), 7,62 (д, J=7,6 Гц, 1H), 7,42 (м, 2H), 7,40 (д, J=1,6 Гц, 2H), 7,34 (д, J=8,4 Гц, 1H), 6,89 (кв., J=3,6 Гц, 2H), 6,66 (c, 1H), 4,54 (c, 2H), 4,20 (кв., J=6 Гц, 1H), 3,3 (м, 1H), 3,14 (м, 1H), 2,84 (c, 6H). 6.10. Синтез (S)-2-аміно-3-[4-(2-аміно-6-{1-[2-(6-ціанопіридин-3-іл)феніл]-2,2,2трифторетокси}піримідин-4-іл)феніл]пропіонової кислоти 20 UA 99270 C2 5 10 15 20 25 30 35 У мікрохвильовій посудині змішували 5-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2іл)піридин-2-карбонітрил (279 мг, 1,51 ммоль), 2-бромбензальдегід (230 мг, 1 ммоль) і 2 мл актонітрилу. Потім додавали 2 мл 1н водного розчину карбонату натрію з наступним додаванням 5 % мл. дихлорбіс(трифенілфосфін)паладію(II). Реакційну посудину герметично закривали і нагрівали при 100 °C протягом 10 хвилин в умовах мікрохвильового опромінення. Після охолодження додавали 50 мл етилацетату, органічний шар відокремлювали, промивали водою і сушили над сульфатом натрію. Органічний розчинник випарювали з одержанням неочищеного продукту, що очищали за допомогою ISCO, з одержанням 150 мг 5-(2формілфеніл)піридин-2-карбонітрилу, вихід 72 %. Тетрабутиламонійфторид (5,3 мкл, 1,0M розчин у тетрагідрофурані) додавали до розчину 5(2-формілфеніл)піридин-2-карбонітрилу (110 мг, 0,53 ммоль) і трифторметилтриметилсилану (120 мкл, 0,81 ммоль) у 5 мл ТГФ при 0 °C. Суміш, що утворилася, нагрівали до кімнатної температури і перемішували при кімнатній температурі протягом 4 годин. Реакційну суміш потім обробляли за допомогою 5 мл 1н розчину HCl і перемішували при кімнатній температурі протягом ночі. Продукт екстрагували за допомогою етилацетату (3×50 мл). Органічний шар відокремлювали і сушили над сульфатом натрію. Органічний розчинник випарювали з одержанням 140 мг 5-[2-(2,2,2-трифтор-1-гідроксіетил)феніл]піридин-2-карбонітрилу, вихід 95 %. Суміш 5-[2-(2,2,2-трифтор-1-гідроксіетил)феніл]піридин-2-карбонітрилу (46 мг, 0,165 ммоль), (S)-3-[4-(2-аміно-6-хлорпіримідин-4-іл)феніл]-2-трет-бутоксикарбоніламінопропіонової кислоти (59 мг, 0,15 ммоль), карбонату цезію (195 мг, 0,6 ммоль) і 1,4-діоксану (1 мл) нагрівали при 110 °C протягом ночі. Реакційну суміш охолоджували до кімнатної температури, потім вливали в 5 мл води. Додавали 1н розчин HCl, щоб довести рівень pН до 4,5, водну фазу екстрагували за допомогою етилацетату (3×10 мл). Об'єднаний органічний шар промивали насиченим сольовим розчином і сушили над сульфатом натрію. Розчинник випарювали з одержанням 80 мг неочищеного (S)-3-[4-(2-аміно-6-{1-[2-(6-ціанопіридин-3-іл)феніл]-2,2,2трифторетокси}піримідин-4-іл)феніл]-2-трет-бутоксикарбоніламінопропіонової кислоти, вихід 84 %. 80 мг (S)-3-[4-(2-аміно-6-{1-[2-(6-ціанопіридин-3-іл)феніл]-2,2,2-трифторетокси}піримідин-4іл)феніл]-2-трет-бутоксикарбоніламінопропіонової кислоти розчиняли в розчині 30 % трифтороцтовоїкислоти в дихлорметані (5 мл). Суміш перемішували при кімнатній температурі протягом 1 години. Розчинник випарювали і залишок очищали за допомогою препаративної ВЕРХ з одержанням 12,6 мг (S)-2-аміно-3-[4-(2-аміно-6-{1-[2-(6-ціанопіридин-3-іл)феніл]-2,2,21 трифторетокси}піримідин-4-іл)феніл]пропіонової кислоти. H ЯМР (400 МГц, CD3OD) δ (ч/млн) 8,86 (c, 1H), 8,17 (д, J=2 Гц, 1H), 8,15 (д, J=2 Гц, 1H), 7,96 (м, 2H), 7,59 (м, 1H), 7,36 (м, 3H), 6,7 (c, 1H), 6,65 (д, J=6,8 Гц, 1H), 4,25 (м, 1H), 3,47 (м, 1H), 3,23 (м, 1H). 6.11. Синтез (S)-2-аміно-3-(4-{2-аміно-6-[2,2,2-трифтор-1-(2-імідазол-1ілфеніл)етокси]піримідин-4-іл}феніл)пропіонової кислоти 40 45 50 До 2-імідазол-1-ілбензальдегіду (0,344 м, 2 ммоль) у ТГФ (8 мл) додавали трифторметилтриметилсилан (0,341 м, 2,4 ммоль). Реакційну суміш охолоджували до 0-5 °C (баня з крижаною водою) і додавали тетра-н-бутиламонійфторид (0,035 мл, 0,035 ммоль, 1M у ТГФ). Крижану баню видаляли і суміш перемішували при кімнатній температурі протягом 6 годин. Додавали 2н розчин HCl (5 мл) і реакційну суміш додатково перемішували протягом 3 годин при кімнатній температурі. Розчинник видаляли на роторному випарнику при зниженому тиску. Неочищений залишок розчиняли в ДХМ (30 мл), промивали водою (20 мл), насиченим сольовим розчином (20 мл) і сушили за допомогою сульфату натрію. Розчинник видаляли з одержанням неочищеного 2,2,2-трифтор-1-(2-імідазол-1-ілфеніл)етанолу (0,45 г, 93 %), що безпосередньо використовували на наступній стадії. 2-аміно-4,6-дихлорпіримідин (0,107 г, 0,65 ммоль), 2,2,2-трифтор-1-(2-імідазол-1ілфеніл)етанол (0,157 г, 0,65 ммоль) і Na (0,03 г, 0,78 ммоль) додавали до безводного ТГФ 21 UA 99270 C2 5 10 15 (10 мл) в атмосфері азоту. Реакційну суміш перемішували при 40-45 °C протягом 6 годин і потім охолоджували до кімнатної температури і гасили водою (0,2 мл). Реакційну суміш концентрували з одержанням неочищеного 4-хлор-6-[2,2,2-трифтор-1-(2-імідазол-1ілфеніл)етокси]піримідин-2-іламіну (0,24 г, чистота >90 % за даними РХМС), що безпосередньо використовували на наступній стадії. Вищевказаний неочищений проміжний продукт (0,24 г), L-пара-боронофенілаланін (0,140 г, 0,67 ммоль), карбонат натрію (0,14 г, 1,32 ммоль) і дихлорбіс(трифенілфосфін)паладій(II) (15 мг, 0,021 ммоль) розчиняли в суміші MeCN (2,0 мл) і H2O (2,0 мл) у мікрохвильовій посудині. Реакційну суміш герметично закривали і перемішували в мікрохвильовому реакторі при 150 °C протягом 6 хв. Суміш фільтрували і фільтрат концентрували. Залишок розчиняли в MeOH і H 2O (1:1) і очищали за допомогою препаративної ВЕРХ, використовуючи як систему розчинників MeOH/H2O/ТФОК, з одержанням (S)-2-аміно-3-(4-[2-аміно-6-[2,2,2-трифтор-1-(2-імідазол-1ілфеніл)етокси]піримідин-4-іл]фенілпропіонової кислоти у вигляді солі ТФОК. РХМС: M+1=499. 1 H ЯМР (400 МГц, CD3OD): δ (ч/млн) 3,20-3,41 (м, 2H), 4,30 (т, 1H), 6,61 (м, 1H), 6,88 (c, 1H), 7,48 (д, 2H), 7,69 (д, 1H), 7,72-7,81 (м, 2H), 7,83 (м, 1H), 7,98 (м, 3H), 8,02 (м, 1H), 9,40 (м, 1H). 6.12. Синтез (S)-2-аміно-3-(4-{6-[2,2,2-трифтор-1-(2-піразол-1-ілфеніл) етокси]піримідин-4іл}феніл)пропіонової кислоти 20 25 30 35 40 45 До 2-піразол-1-ілбензальдегіду (0,344 г, 2 ммоль) у ТГФ (8 мл) додавали трифторметилтриметилсилан (0,341 г, 2,4 ммоль). Суміш охолоджували до 0-5 °C (баня з крижаною водою) і додавали тетра-н-бутиламонійфторид (0,035 мл, 0,035 ммоль, 1M у ТГФ). Крижану баню видаляли і суміш перемішували при кімнатній температурі протягом 6 годин. Додавали 2н розчин HCl (5 мл) і реакційну суміш додатково перемішували при кімнатній температурі протягом 3 годин. Розчинник видаляли на роторному випарнику при зниженому тиску. Залишок розчиняли в ДХМ (30 мл), промивали водою (20 мл), насиченим сольовим розчином (20 мл) і сушили над сульфатом натрію. Розчинник видаляли у вакуумі з одержанням неочищеного 2,2,2-трифтор-1-(2-піразол-1-ілфеніл)етанола (0,45 г, 93 %) який безпосередньо використовували в наступному експерименті. 4,6-Дихлорпіримідин (0,082 г, 0,55 ммоль), 2,2,2-трифтор-1-(2-піразол-1-ілфеніл)етанол (0,121 г, 0,50 ммоль), Na (0,03 г, 0,78 ммоль) додавали до безводного ТГФ (10 мл) в атмосфері азоту. Реакційну суміш перемішували при 40-45 °C протягом 6 годин і потім охолоджували до кімнатної температури і гасили водою (0,2 мл). Реакційну суміш концентрували з одержанням неочищеного 4-хлор-6-[2,2,2-трифтор-1-(2-піразол-1-ілфеніл)етокси]піримідину (0,20 г, чистота >90 % за даними РХМС), що безпосередньо використовували на наступній стадії. Неочищений проміжний продукт (0,20 г), L-пара-боронофенілаланін (0,105 г, 0,50 ммоль), карбонат натрію (0,105 г, 1 ммоль), дихлорбіс(трифенілфосфін)паладій(II) (15 мг, 0,021 ммоль) розчиняли в суміші MeCN (2,0 мл) і H2O (2,0 мл) у мікрохвильовій посудині. Посудину герметично закривали і реакційну суміш нагрівали в мікрохвильовому реакторі при 150 °C протягом 6 хв. Суміш фільтрували і фільтрат концентрували. Залишок розчиняли в MeOH і H 2O (1:1) і потім очищали за допомогою препаративної ВЕРХ, використовуючи як систему розчинників MeOH/H2O/ТФОК, з одержанням (S)-2-аміно-3-(4-[6-[2,2,2-трифтор-1-(2-піразол-1ілфеніл)етокси]піримідин-4-іл] фенілпропіонової кислоти у вигляді солі ТФОК. РХМС: M+1=484. 1 H ЯМР (400 МГц, CD3OD): δ (ч/млн) 3,20-3,40 (м, 2H), 4,30 (т, 1H), 6,63 (c, 1H), 7,10 (м, 1H), 7,50 (м, 3H), 7,60 (м, 3H), 7,84 (м, 2H), 8,16 (м, 3H), 8,68 (c, 1H). 6.13. Синтез (S)-2-аміно-3-[4-(2-аміно-6-{2,2,2-трифтор-1-[2-(3-трифторметилпіразол-1іл)феніл]етокси}піримідин-4-іл)феніл]пропіонової кислоти 22 UA 99270 C2 5 10 15 20 25 30 35 40 2,2,2-трифтор-1-(2-йодфеніл)етанол (0,331 г, 1,1 ммоль), 3-трифторметилпіразол (0,136 г, 1,0 ммоль), Cu (0,019 г, 0,1 ммоль), K2CO3 (0,290 г, 2,1 ммоль), (1R, 2R)-N,N'диметилциклогексан-1,2-діамін (0,028 г, 0,2 ммоль) і толуол (10 мл) об'єднували в 20-мл трубці високого тиску. Суміш нагрівали при 130 °C (температура масляної бані) протягом 12 годин. Реакційну суміш розбавляли етилацетатом і промивали H 2O (2×20 мл), насиченим сольовим розчином і сушили за допомогою сульфату натрію. Видалення розчинника давало неочищений продукт, що очищали за допомогою колонкової хроматографії ISCO, використовуючи 5-10 % етилацетат в гексані як розчинник, з одержанням 140 мг 2,2,2-трифтор-1-[2-(3трифторметилпіразол-1-іл)феніл]етанолу. 2-аміно-4,6-дихлорпіримідин (0,074 г, 0,45 ммоль), 2,2,2-трифтор-1-[2-(3трифторметилпіразол-1-іл)феніл]етанол (0,140 г, 0,45 ммоль) і Na (0,022 г, 0,59 ммоль) додавали до безводного ТГФ (10 мл) в атмосфері азоту. Реакційну суміш перемішували при 4045 °C протягом 6 годин і потім охолоджували до кімнатної температури і гасили водою (0,2 мл). Реакційну суміш концентрували з одержанням неочищеного 4-хлор-6-[2, 2,2-трифтор-1-[2-(3трифторметилпіразол-1-іл)феніл]етокси]піримідин-2-іламіну (0,21 г, чистота >90 % за даними РХМС), що безпосередньо використовували на наступній стадії. Неочищений проміжний продукт (0,21 г), L-пара-боронофенілаланін (0,1 г, 0,48 ммоль), карбонат натрію (0,1 г, 0,94 ммоль) і дихлорбіс(трифенілфосфін)паладій(II) (15 мг, 0,021 ммоль) розчиняли в суміші MeCN (2,0 мл) і H2O (2,0 мл) у мікрохвильовій посудині. Посудину герметично закривали і реакційну суміш нагрівали в мікрохвильовому реакторі при 150 °C протягом 6 хв. Реакційну суміш фільтрували і фільтрат концентрували з одержанням неочищеного продукту, що розчиняли в MeOH і H2O (1:1) і очищали за допомогою препаративної ВЕРХ, використовуючи як систему розчинників MeOH/H2O/ТФОК, з одержанням (S)-2-аміно-3-[4-(2-аміно-6-[2,2,2-трифтор-1-(2-(3-трифторметилпіразол-1ілфеніл)етокси]піримідин-4-іл]фенілпропіонової кислоти у вигляді солі ТФОК. РХМС: M+1=567. 1 H ЯМР (400 МГц, CD3OD): δ (ч/млн) 3,2 (м, 1H), 3,35 (м, 1H), 4,30 (т, 1H), 6,80 (c, 1H), 6,85 (м, 1H), 6,98 (д, 1H), 7,45 (д, 2H), 7,59 (м, 1H), 7,68 (м, 2H), 7,88 (м, 1H), 7,95 (д, 2H), 8,20 (1H). 6.14. Синтез (S)-2-аміно-3-[4-(2-аміно-6-{1-[2-(3,5-диметилпіразол-1-іл)феніл]-2,2,2трифторетокси}піримідин-4-іл)феніл]пропіонової кислоти 2,2,2-трифтор-1-(2-йодфеніл)етанол (0,331 г, 1,1 ммоль), 3,5-диметилпіразол (0,096 г, 1,0 ммоль), Cu (0,019 г, 0,1 ммоль), K2CO3 (0,290 г, 2,1 ммоль), (1R, 2R)-N,N'диметилциклогексан-1,2-діамін (0,028 г, 0,2 ммоль) і толуол (10 мл) об'єднували в 20-мл трубці високого тиску і суміш нагрівали при 130 °C (температура масляної бані) протягом 12 годин. Суміш розбавляли етилацетатом і промивали H2O (2×20 мл), насиченим сольовим розчином і сушили над сульфатом натрію. Видалення розчинника давало неочищений продукт, що 23 UA 99270 C2 5 10 15 20 очищали за допомогою колонкової хроматографії ISCO, використовуючи 5-10 % етилацетат в гексані як розчинник, з одержанням 1-[2-(3,5-диметилпіразол-1-іл)феніл]-2,2,2-трифторетанолу (120 мг). 2-аміно-4,6-дихлорпіримідин (0,074 г, 0,45 ммоль), 1-[2-(3,5-диметилпіразол-1-іл)феніл]2,2,2-трифторетанол (0,120 г, 0,45 ммоль), Na (0,022 г, 0,59 ммоль) додавали до безводного ТГФ (10 мл) в атмосфері азоту. Реакційну суміш перемішували при 40-45 °C протягом 6 годин і потім охолоджували до кімнатної температури і гасили водою (0,2 мл). Реакційну суміш концентрували з одержанням неочищеного 4-хлор-6-{1-[2-(3,5-диметилпіразол-1-іл)феніл]-2,2,2трифторетокси]піримідин-2-іламіну (0,195 г, чистота >90 % за даними РХМС), що безпосередньо використовували на наступній стадії. Неочищений проміжний продукт (0,195 г), L-пара-боронофенілаланін (0,10 г, 0,48 ммоль), карбонат натрію (0,10 г, 0,95 ммоль) і дихлорбіс(трифенілфосфін)паладій(II) (15 мг, 0,021 ммоль) розчиняли в суміші MeCN (2,0 мл) і H2O (2,0 мл) у мікрохвильовій посудині. Посудину герметично закривали і реакційну суміш нагрівали в мікрохвильовому реакторі при 150 °C протягом 6 хв. Суміш фільтрували і фільтрат концентрували з одержанням неочищеного продукту, що розчиняли в MeOH і H2O (1:1) і очищали за допомогою препаративної ВЕРХ, використовуючи як систему розчинників MeOH/H 2O/ТФОК, з одержанням (S)-2-аміно-3-[4-(2аміно-6-[1-(2-(3,5-диметилпіразол-1-іл)феніл]-2,2,2-трифторетокси}піримідин-4-іл)феніл] 1 пропіонової кислоти у вигляді солі ТФОК. РХМС: M+1=527. H ЯМР (400 МГц, CD3OD): δ (ч/млн) 4,32 (т, 1H), 3,39 (м, 1H), 3,25 (м, 1H), 2,30 (c, 3H), 2,10 (c, 3H), 7,92 (м, 3H), 7,68 (м, 2H), 7,50 (д, 2H), 7,42 (м, 1H), 6,92 (м, 1H), 6,89 (c, 1H), 6,17 (c, 1H). 6.15. Синтез (S)-2-аміно-3-[4-(2-аміно-6-{2,2,2-трифтор-1-[2-(3-фенілпіразол-1іл)феніл]етокси}піримідин-4-іл)феніл]пропіонової кислоти 25 30 35 40 45 2,2,2-трифтор-1-(2-йодфеніл)етанол (0,331 г, 1,1 ммоль), 3-фенілпіразол (0,144 г, 1,0 ммоль), Cu (0,019 г, 0,1 ммоль), K2CO3 (0,290 г, 2,1 ммоль), (1R, 2R)-N,N'диметилциклогексан-1,2-діамін (0,028 г, 0,2 ммоль) і толуол (10 мл) переносили в 20-мл трубку високого тиску і суміш нагрівали при 130 °C (температура масляної бані) протягом 12 годин. Суміш розбавляли етилацетатом і промивали H2O (2×20 мл), насиченим сольовим розчином і сушили над сульфатом натрію. Видалення розчинника давало неочищений продукт, що очищали за допомогою колонкової хроматографії ISCO, використовуючи 5-10 % етилацетат в гексані як розчинник, з одержанням 2,2,2-трифтор-1-[2-(3-фенілпіразол-1-іл)феніл]етанолу (75 мг). 2-аміно-4,6-дихлорпіримідин (0,041 г, 0,25 ммоль), 2,2,2-трифтор-1-[2-(3-фенілпіразол-1іл)феніл]етанол (0,070 г, 0,22 ммоль) і Na (0,012 г, 0,31 ммоль) додавали до безводного ТГФ (7 мл) в атмосфері азоту. Реакційну суміш перемішували при 40-45 °C протягом 6 годин і потім охолоджували до кімнатної температури і гасили водою (0,04 мл). Реакційну суміш концентрували з одержанням неочищеного 4-хлор-6-{2,2,2-трифтор-1-[2-(3-фенілпіразол-1іл)феніл]етокси]піримідин-2-іламіну (0,110 г, чистота >90 % за даними РХМС), що безпосередньо використовували на наступній стадії. Неочищений проміжний продукт (0,110 г), L-пара-боронофенілаланін (0,050 г, 0,24 ммоль), карбонат натрію (0,050 г, 0,48 ммоль) і дихлорбіс(трифенілфосфін)паладій(II) (8 мг, 0,010 ммоль) розчиняли в суміші MeCN (2,0 мл) і H2O (2,0 мл) у мікрохвильовій посудині. Посудину герметично закривали і реакційну суміш нагрівали в мікрохвильовому реакторі при 150 °C протягом 6 хв. Суміш фільтрували і фільтрат концентрували з одержанням неочищеного 24 UA 99270 C2 5 продукту, що розчиняли в MeOH і H2O (1:1) і очищали за допомогою препаративної ВЕРХ, використовуючи як систему розчинників MeOH/H 2O/ТФОК, з одержанням (S)-2-аміно-3-[4-(2аміно-6-{2,2,2-трифтор-1-[2-(3-фенілпіразол-1-іл)феніл]етокси}піримідин-4-іл)феніл]пропіонової 1 кислоти у вигляді солі ТФОК. РХМС: M+1=575. H ЯМР (400 МГц, CD3OD): δ (ч/млн) 3,20 (м, 1H), 3,38 (м, 1H), 4,30 (т, 1H), 6,80 (c, 1H), 7,00 (c, 1H), 7,30-7,48 (м, 7H), 7,62 (м, 3H), 7,90 (м, 4H), 8,10 (c, 1H). 6.16. Синтез (S)-2-аміно-3-[4-(2-аміно-6-{2,2,2-трифтор-1-[5-метокси-2-(4-метилпіразол-1іл)феніл]етокси}піримідин-4-іл)феніл]пропіонової кислоти 10 15 20 25 30 35 40 1-(2-Бром-5-метоксифеніл)-2,2,2-трифторетанол (0,570 г, 2,0 ммоль), 4-метилпіразол (0,164 г, 2,0 ммоль), Cu (0,057 г, 0,3 ммоль), K2CO3 (0,580 г, 4,2 ммоль), (1R, 2R)-N,N'диметилциклогексан-1,2-діамін (0,071 г, 0,5 ммоль) і толуол (10 мл) об'єднували в 20-мл трубці високого тиску і суміш нагрівали при 130 °C (температура масляної бані) протягом 12 годин. Суміш розбавляли етилацетатом і промивали H2O (2×20 мл), насиченим сольовим розчином і сушили над сульфатом натрію. Видалення розчинника давало неочищений продукт, що очищали за допомогою колонкової хроматографії ISCO, використовуючи 5-10 % етилацетат в гексані як розчинник, з одержанням 2,2,2-трифтор-1-[5-метокси-2-(4-метилпіразол-1іл)феніл]етанолу (90 мг). 2,2,2-трифтор-1-[5-метокси-2-(4-метилпіразол-1-іл)феніл]етанол (0,090 г, 0,31 ммоль), (S)-3[4-(2-аміно-6-хлорпіримідин-4-іл)феніл]-2-трет-бутоксикарбоніламінопропіонову кислоту (0,122 г, 0,31 ммоль), 1,4-діоксан (2 мл), CS2CO3 (0,503 г, 1,55 ммоль) об'єднували в мікрохвильовій посудині і нагрівали до 180 °C протягом 45 хв. Суміш фільтрували і концентрували. До залишку додавали 5 % розчин метанолу в ДХМ (50 мл). Суміш фільтрували. Фільтрат концентрували з одержанням неочищеного продукту, що переносили в 20 % розчин ТФОК у ДХМ (30 мл) і перемішували протягом 30 хвилин при кімнатній температурі. Аналіз РХМС показав завершення реакції з необхідним продуктом. Реакційну суміш концентрували з одержанням неочищеного продукту, що розчиняли в MeOH і H2O (1:1) і очищали за допомогою препаративної ВЕРХ, використовуючи як систему розчинників MeOH/H 2O/ТФОК, з одержанням (S)-2-аміно-3-[4-(2аміно-6-{2,2,2-трифтор-1-[5-метокси-2-(4-метилпіразол-1-іл)феніл] етокси]піримідин-41 іл)феніл]пропіонової кислоти. РХМС: M+1=543. H ЯМР (400 МГц, CD3OD): δ (ч/млн) 2,20 (c, 3H), 3,22 (м, 1H), 3,40 (м, 1H), 3,84 (c, 3H), 4,35 (т, 1H), 6,84 (c, 1H), 6,98 (м, 1H), 7,18 (м, 1H), 7,26 (м, 1H), 7,40 (д, 1H), 7,48 (д, 2H), 7,66 (д, 2H), 7,96 (д, 2H). 6.17. Синтез (S)-2-аміно-3-[4-(2-аміно-6-{(R)-2,2,2-трифтор-1-[2-(3-метилпіразол-1іл)феніл]етокси}піримідин-4-іл)феніл]пропіонової кислоти R-1-(2-бромфеніл)-2,2,2-трифторетанол (1,53 г, 6 ммоль), 3-метилпіразол (0,492 г, 6 ммоль), Cu (0,456 г, 2,4 ммоль), K2CO3 (2,07 г, 15 ммоль), (1R, 2R)-N,N'-диметилциклогексан-1,2-діамін (0,170 г, 1,2 ммоль) і толуол (10 мл) об'єднували в 20-мл трубці високого тиску і суміш нагрівали при 130 °C (температура масляної бані) протягом 12 годин. Реакційну суміш розбавляли 25 UA 99270 C2 5 10 15 20 етилацетатом і промивали H2O (2×20 мл), насиченим сольовим розчином і сушили над сульфатом натрію. Видалення розчинника давало неочищений продукт, що очищали за допомогою колонкової хроматографії ISCO, використовуючи 5-10 % етилацетату в гексані як розчинник, з одержанням R-2,2,2-трифтор-1-[2-(3-метилпіразол-1-іл)феніл]етанолу (1,8 г). 2-аміно-4,6-дихлорпіримідин (1,2 г, 7,4 ммоль), R-2,2,2-трифтор-1-[2-(3-метилпіразол-1іл)феніл]етанол (1,8 г, 7,03 ммоль) і Na (0,380 г, 10 ммоль) додавали до безводного ТГФ (40 мл) в атмосфері азоту. Реакційну суміш перемішували при 40-45 °C протягом 6 годин і потім охолоджували до кімнатної температури і гасили водою (0,1 мл). Реакційну суміш концентрували з одержанням 4-хлор-6-{R-2,2,2-трифтор-1-[2-(3-метилпіразол-1-іл)феніл]етокси] піримідин-2-іламіну (3,0 г, чистота >90 % за даними РХМС), що безпосередньо використовували на наступній стадії. Неочищений проміжний продукт (0,750 г), L-пара-боронофенілаланін (0,420 г, 2,0 ммоль), карбонат натрію (0,430 г, 4,0 ммоль) і дихлорбіс(трифенілфосфін)паладій(II) (30 мг, 0,043 ммоль) розчиняли в суміші MeCN (7,0 мл) і H2O (7,0 мл) у мікрохвильовій посудині. Посудину герметично закривали і реакційну суміш нагрівали в мікрохвильовому реакторі при 150 °C протягом 7 хв. Суміш фільтрували і фільтрат концентрували з одержанням неочищеного продукту, що розчиняли в MeOH і H2O (1:1) і очищали за допомогою препаративної ВЕРХ, використовуючи як систему розчинників MeOH/H 2O/ТФОК, з одержанням (S)-2-аміно-3-[4-(2аміно-6-{R-2,2,2-трифтор-1-[2-(3-метилпіразол-1-іл)феніл]етокси}піримідин-41 іл)феніл]пропіонової кислоти у вигляді солі ТФОК. РХМС: M+1=514. H ЯМР (400 МГц, CD3OD): δ (ч/млн) 2,40 (c, 3H), 3,30 (м, 1H), 3,42 (м, 1H), 4,38 (т, 1H), 6,21 (c, 1H), 7,02 (c, 1H), 7,18 (м, 1H), 7,54 (д, 1H), 7,61 (м, 4H), 7,82 (м, 2H), 7,97 (д, 2H). 6.18. Синтез (S)-2-аміно-3-[4-(2-аміно-6-{1-[4-хлор-2-(3-метилпіразол-1-іл)феніл]-2,2,2трифторетокси}піримідин-4-іл)феніл]пропіонової кислоти 25 30 35 40 45 50 1-(4-Хлор-2-йодфеніл)-2,2,2-трифторетанол (0,840 г, 2,5 ммоль), 3-метилпіразол (0,230 г, 2,8 ммоль), Cu (0,190 г, 1,0 ммоль), K2CO3 (0,863 г, 6,25 ммоль), (1R, 2R)-N,N'диметилциклогексан-1,2-діамін (0,071 г, 0,5 ммоль) і толуол (10 мл) об'єднували в 20-мл трубці високого тиску і суміш нагрівали при 130 °C (температура масляної бані) протягом 12 годин. Суміш розбавляли етилацетатом і промивали H2O (2×20 мл), насиченим сольовим розчином і сушили над сульфатом натрію. Видалення розчинника давало неочищений продукт, що очищали за допомогою колонкової хроматографії ISCO, використовуючи 5-10 % етилацетат в гексані як розчинник, з одержанням 1-[4-хлор-2-(3-метилпіразол-1-іл)феніл]-2,2,2трифторетанолу (240 мг). 1-[4-хлор-2-(3-метилпіразол-1-іл)феніл]-2,2,2-трифторетанол (0,120 г, 0,41 ммоль), (S)-3-[4(2-аміно-6-хлорпіримідин-4-іл)феніл]-2-трет-бутоксикарбоніламінопропіонову кислоту (0,176 г, 0,45 ммоль), 1,4-діоксан (4 мл) і CS2CO3 (0,533 г, 1,64 ммоль) об'єднували в герметично закритій трубці об'ємом 20 мл і суміш нагрівали при 100 °C протягом 12 годин. Суміш концентрували. До залишку додавали 10 % метанол у ДХМ (50 мл) і суміш фільтрували. Фільтрат концентрували з одержанням неочищеного продукту, що переносили в суміш ТГФ/3н HCl (30 мл/15 мл) і одержану суміш перемішували при 40-45 °C протягом 12 годин. Аналіз РХМС показав завершення реакції з необхідним продуктом. Суміш концентрували з одержанням неочищеного продукту, що розчиняли в MeOH і H2O (1:1) і очищали за допомогою препаративної ВЕРХ, використовуючи як систему розчинників MeOH/H2O/ТФОК, з одержанням (S)-2-аміно-3-[4-(2аміно-6-{1-[4-хлор-2-(3-метилпіразол-1-іл)феніл]-2,2,2-трифторетокси} піримідин-41 іл)феніл]пропіонової кислоти у вигляді солі ТФОК. РХМС: M+1=547. H ЯМР (400 МГц, CD3OD): δ (ч/млн) 2,30 (c, 3H), 3,10-3,30 (м, 2H), 4,20 (т, 1H), 6,32 (д, 1H), 6,74 (c, 1H), 7,0 (кв., 1H), 7,38 (д, 2H), 7,50 (м, 2H), 7,72 (м, 1H), 7,90 (м, 3H). 26 UA 99270 C2 6.19. Синтез етилового ефіру (S)-2-аміно-3-[4-(2-аміно-6-{R-1-[4-хлор-2-(3-метилпіразол-1іл)феніл]-2,2,2-трифторетокси}піримідин-4-іл)феніл] пропіонової кислоти 5 10 15 20 25 30 35 40 45 50 Зазначену в заголовку сполуку одержували постадійно, як описано нижче: Стадія 1: Синтез 1-(2-бром-4-хлорфеніл)-2,2,2-трифторетанону У 2-горлу круглодонну колбу об'ємом 500 мл, що містить безводний метанол (300 мл), додавали тіонілхлорид (29,2 мл, 400 ммоль) по краплях при 0-5 °C (баня з крижаною водою) протягом 10 хв. Баню з крижаною водою видаляли і додавали 2-бром-4-хлорбензойну кислоту (25 г, 106 ммоль). Суміш нагрівали до слабого кипіння зі зворотним холодильником протягом 12 годин. Хід реакції відслідковували за допомогою ТШХ і РХМС. Після завершення реакції реакційну суміш концентрували. Неочищений продукт розчиняли в дихлорметані (ДХМ, 250 мл), промивали водою (50 мл), насиченим водним розчином NaHCO3 (50 мл), насиченим сольовим розчином (50 мл), сушили над сульфатом натрію і концентрували з одержанням метилового ефіру 2-бром-4-хлорбензойної кислоти (26 г, 99 %), що безпосередньо використовували на наступній стадії. Метиловий ефір 2-бром-4-хлорбензойної кислоти (12,4 г, 50 ммоль) у толуолі (200 мл) охолоджували до -70 °C і додавали трифторметилтриметилсилан (13 мл, 70 ммоль). Тетрабутиламонійфторид (1M, 2,5 мл) додавали по краплях і суміш залишали нагріватися до кімнатної температури протягом 4 годин, після цього її перемішували протягом 10 годин при кімнатній температурі. Реакційну суміш концентрували з одержанням неочищеного [1-(2-бром-4хлорфеніл)-2,2,2-трифтор-1-метоксіетокси]триметилсилану. Неочищений проміжний продукт розчиняли в метанолі (100 мл) і додавали 6н розчин HCl (100 мл). Суміш витримували при 4550 °C протягом 12 годин. Метанол видаляли і неочищену речовину екстрагували дихлорметаном (200 мл). Об'єднаний ДХМ шар промивали водою (50 мл), NaHCO3 (50 мл), насиченим сольовим розчином (50 мл) і сушили над сульфатом натрію. Видалення розчинника давало неочищений продукт, що очищали за допомогою колонкової хроматографії ISCO, використовуючи 1-2 % етилацетат в гексані як розчинник, з одержанням 1-(2-бром-41 хлорфеніл)-2,2,2-трифторетанону (10 г, 70 %). H ЯМР (300 МГц, CDCl3): δ (ч/млн) 7,50 (д, 1H), 7,65 (д, 1H), 7,80 (с, 1H). Стадія 2: Синтез R-1-(2-бром-4-хлорфеніл)-2,2,2-трифторетанолу До катехолборану (1M у ТГФ 280 мл, 280 ммоль) у 2-літровій 3-горлій круглодонній колбі в атмосфері азоту додавали S-2-Метил-CBS оксазаборолідин (7,76 г, 28 ммоль) і одержану суміш перемішували при кімнатній температурі протягом 20 хв. Реакційну суміш охолоджували до 78 °C (баня сухий лід/ацетон) і по краплях додавали 1-(2-бром-4-хлорфеніл)-2,2,2трифторетанон (40 г, 139 ммоль) у ТГФ (400 мл) протягом 2 годин. Реакційну суміш залишали нагріватися до -36 °C і перемішували при цій температурі протягом 24 годин і далі перемішували при -32 °C ще протягом 24 годин. Додавали 3н розчин NaOH (250 мл) і охолоджувальну баню заміняли банею лід-вода. Потім по краплях додавали 30 % розчин пероксиду водню у воді (250 мл) протягом 30 хвилин. Баню з крижаною водою видаляли і суміш перемішували при кімнатній температурі протягом 4 годин. Органічний шар відокремлювали, концентрували і повторно розчиняли в простому ефірі (200 мл). Водний шар екстрагували простим ефіром (2×200 мл). Об'єднані органічні шари промивали 1н водним розчином NaOH (4×100 мл), насиченим сольовим розчином і сушили над сульфатом натрію. Видалення розчинника давало неочищений продукт, який очищали за допомогою колонкової хроматографії, використовуючи від 2 до 5 % етилацетату в гексані як розчинник, з одержанням бажаного спирту 36,2 г (90 %, >95 % е.и.). Спирт (36,2 г) кристалізували з гексану (80 мл) з 1 одержанням R-1-(2-бром-4-хлорфеніл)-2,2,2-трифторетанолу 28,2 г (70 %; 99-100 % е.і.). H ЯМР (400 МГц, CDCl3): δ (ч/млн) 5,48 (м, 1H), 7,40 (д, 1H), 7,61 (д, 2H). Стадія 3: Синтез R-1-[4-хлор-2-(3-метилпіразол-1-іл)феніл]-2,2,2-трифторетанолу 27 UA 99270 C2 5 10 15 20 25 30 35 40 45 R-1-(2-бром-4-хлорфеніл)-2,2,2-трифторетанол (15,65 г, 54,06 ммоль), 3-метилпіразол (5,33 г, 65 ммоль), Cu (2,06 г, 10,8 ммоль), K2CO3 (15,7 г, 113,5 ммоль), (1R, 2R)-N,N'диметилциклогексан-1,2-діамін (1,54 г, 10,8 ммоль) і толуол (80 мл) об'єднували в трубці високого тиску об'ємом 250 мл і нагрівали до 130 °C (температура масляної бані) протягом 12 годин. Реакційну суміш розбавляли етилацетатом і промивали H 2O (4×100 мл), насиченим сольовим розчином і сушили над сульфатом натрію. Видалення розчинника давало неочищений продукт, що очищали за допомогою колонкової хроматографії ISCO, використовуючи 5-10 % етилацетат в гексані як розчинник, з одержанням R-1-[4-хлор-2-(31 метилпіразол-1-іл)феніл]-2,2,2-трифторетанолу (13,5 г; 86 %). H ЯМР (400 МГц, CDCl3): δ (ч/млн) 2,30 (с, 3H), 4,90 (м, 1H), 6,20 (с, 1H), 6,84 (д, 1H), 7,20 (с, 1H), 7,30 (д, 1H), 7,50 (д, 1H). Стадія 4: Синтез етилового ефіру (S)-2-аміно-3-[4-(2-аміно-6-{R-1-[4-хлор-2-(3-метилпіразол1-іл)феніл]-2,2,2-трифторетокси}піримідин-4-іл)феніл} пропіонової кислоти. R-1-[4-хлор-2-(3-метилпіразол-1-іл)феніл]-2,2,2-трифторетанол (17,78 г, 61,17 ммоль), (S)-3[4-(2-аміно-6-хлорпіримідин-4-іл)феніл]-2-трет-бутоксикарбоніламінопропіонову кислоту (20,03 г, 51 ммоль), 1,4-діоксан (250 мл) і Cs2CO3 (79,5 г, 244 ммоль) об'єднували в 3-горлій круглодонній колбі об'ємом 500 мл і нагрівали до 100 °C (температура масляної бані) протягом 12-24 годин. Хід реакції відслідковували за допомогою РХМС. Після завершення реакції суміш охолоджували до 60 °C і додавали воду (250 мл) і ТГФ (400 мл). Органічний шар відокремлювали і промивали насиченим сольовим розчином (150 мл). Розчинник видаляли з одержанням неочищеного BOCзахищеного продукту, що переносили в ТГФ (400 мл), 3н розчин HCl (200 мл). Суміш нагрівали при 35-40 °C протягом 12 годин. ТГФ видаляли у вакуумі. Водний шар, що залишився, екстрагували за допомогою ізопропілацетату (2×100 мл) і концентрували окремо для витягування спирту (3,5 г), який не прореагував. Сліди органічного розчинника, що залишився, видаляли з водної фракції під вакуумом. У 1-л хімічну склянку, обладнану терморегулятором і pH-метром, додавали H3PO4 (40 мл, 85 % розчин у воді) і воду (300 мл) потім 50 % розчин NaOH у воді, щоб довести рівень pН до 6,15. Температуру підвищували до 58 °C і вищевказаний кислотний водний розчин додавали по краплях у буфер з одночасним додаванням 50 % розчину NaOH у воді, таким чином, щоб підтримати рівень рН у межах 6,1-6,3. Після завершення додавання осаджену тверду речовину фільтрували і промивали гарячою водою (50-60 °C) (2×200 мл) і сушили з одержанням неочищеної (S)-2-аміно-3-[4-(2-аміно-6-{R-1-[4-хлор-2-(3-метилпіразол-1-іл)феніл]-2,2,2трифторетокси}піримідин-4-іл)феніл}пропіонової кислоти (26,8 г; 95 %). РХМС і ВЕРХ аналіз показав сполуку з чистотою близько 96-97 %. До безводного етанолу (400 мл) по краплях додавалиSOCl2 (22 мл, 306 ммоль) при 0-5 °C. Додавали неочищену кислоту (26,8 г) з вищеописаної реакції. Баню з крижаною водою видаляли і реакційну суміш нагрівали при 40-45 °C протягом 6-12 годин. Після завершення реакції етанол видаляли у вакуумі. До залишку додавали крижану воду (300 мл) і екстрагували ізопропілацетатом (2×100 мл). Водний розчин нейтралізували за допомогою насиченого розчину Na2CO3 до доведення pН до 6,5. Розчин екстрагували етилацетатом (2×300 мл). Об'єднаний етилацетатний шар промивали насиченим сольовим розчином і концентрували з одержанням 24 г неочищеного складного ефіру (ВЕРХ чистота 96-97 %). Неочищений складний ефір потім очищали за допомогою колонкової хроматографії ISCO, використовуючи 5 % етанолу в ДХМ як розчинник, з одержанням етилового ефіру (S)-2-аміно-3-[4-(2-аміно-6-(R-1-[4-хлор-2-(3метилпіразол-1-іл)феніл]-2,2,2-трифторетокси}піримідин-4-іл)феніл}пропіонової кислоти (20,5 г; 1 70 %; чистота за даними ВЕРХ 98 %). РХМС M+1=575. H ЯМР (400 МГц, CD3OD): δ (ч/млн) 1,10 (т, 3H), 2,25 (с, 3H), 2,85 (м, 2H), 3,65 (м, 1H), 4,00 (кв., 2H), 6,35 (с, 1H), 6,60 (с, 1H), 6,90 (м, 1H), 7,18 (д, 2H), 7,45 (м, 2H), 7,70 (д, 1H), 7,85 (м, 3H). 6.20. Синтез (S)-2-аміно-3-(4-(2-аміно-6-((R)-1-(4-хлор-2-(3-метил-1H-піразол-1-іл)феніл)2,2,2-трифторетокси)піримідин-4-іл)феніл)пропaнової кислоти 50 28
ДивитисяДодаткова інформація
Назва патенту англійською4-phenyl-6-(2,2,2-trifluoro-1-phenylethoxy)pyrimidine-based compounds and methods of their use
Автори англійськоюDevasagayaraj, Arokiasamy, Jin, Haihong, Shi, Zhi-Cai, Tunoori, Ashok, Wang, Ying, Zhang, Chengmin
Назва патенту російськоюСоединения на основе 4-фенил-6-(2,2,2-трифтор-1-фенилетокси)пиримидина и их применение
Автори російськоюДевасагаярадж Арокиасами, Цзинь Хайхун, Ши Чжи-Цай, Туноори Ашок, Ван Ин, Чжан Ченьминь
МПК / Мітки
МПК: C07D 409/12, C07D 403/12, A61P 9/00, A61P 11/00, C07D 417/12, C07D 405/12, C07D 413/12, C07D 401/12, A61P 1/00
Мітки: застосування, сполуки, 4-феніл-6-(2,2,2-трифтор-1-фенілетокси)піримідину, основі
Код посилання
<a href="https://ua.patents.su/57-99270-spoluki-na-osnovi-4-fenil-6-222-triftor-1-feniletoksipirimidinu-i-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Сполуки на основі 4-феніл-6-(2,2,2-трифтор-1-фенілетокси)піримідину і їх застосування</a>
Попередній патент: Сорго, резистентний до гербіциду ацетил-cоa-карбоксилази
Наступний патент: Спосіб обробки напівгідрату сульфату кальцію
Випадковий патент: Пристрій для зменшення розгойдування вантажу