Спосіб виявлення генетично модифікованої сої методом полімеразної ланцюгової реакції
Номер патенту: 111914
Опубліковано: 24.06.2016
Автори: Семенівська Олена Анатоліївна, Вакуленко Микола Михайлович, Жукова Ярослава Фрідріхівна
Формула / Реферат
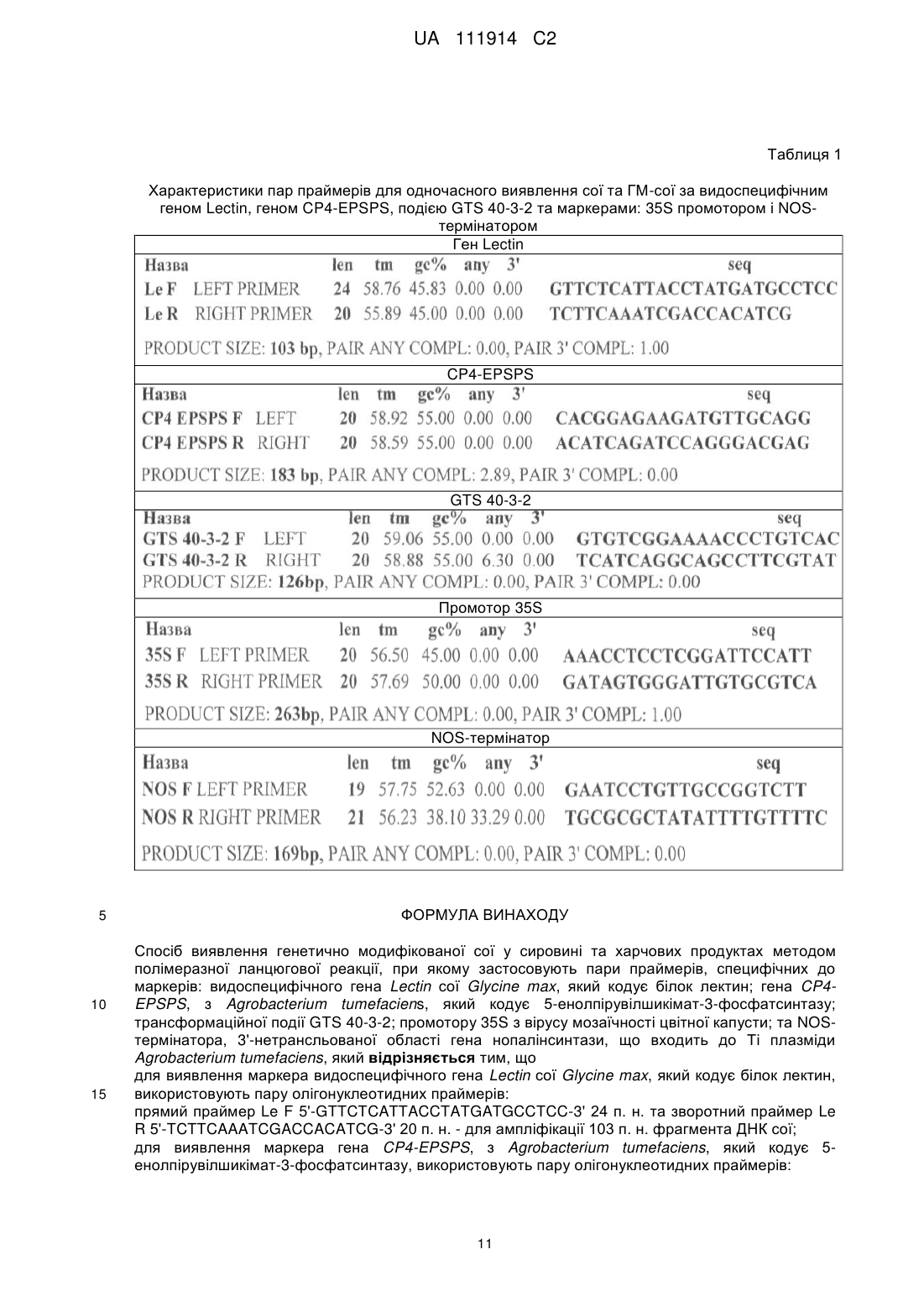
Спосіб виявлення генетично модифікованої сої у сировині та харчових продуктах методом полімеразної ланцюгової реакції, при якому застосовують пари праймерів, специфічних до маркерів: видоспецифічного гена Lectin сої Glycine max, який кодує білок лектин; гена CP4-EPSPS, з Agrobacterium tumefaciens, який кодує 5-енолпірувілшикімат-3-фосфатсинтазу; трансформаційної події GTS 40-3-2; промотору 35S з вірусу мозаїчності цвітної капусти; та NOS-термінатора, 3'-нетрансльованої області гена нопалінсинтази, що входить до Ті плазміди Agrobacterium tumefaciens, який відрізняється тим, що
для виявлення маркера видоспецифічного гена Lectin сої Glycine max, який кодує білок лектин, використовують пару олігонуклеотидних праймерів:
прямий праймер Le F 5'-GTTCTCATTACCTATGATGCCTCC-3' 24 п. н. та зворотний праймер Le R 5'-TCTTCAAATCGACCACATCG-3' 20 п. н. - для ампліфікації 103 п. н. фрагмента ДНК сої;
для виявлення маркера гена CP4-EPSPS, з Agrobacterium tumefaciens, який кодує 5-енолпірувілшикімат-3-фосфатсинтазу, використовують пару олігонуклеотидних праймерів:
прямий праймер CP4-EPSPS F 5'-CACGGAGAAGATGTTGCAGG-3' 22 п. н. та зворотний праймер CP4-EPSPS R 5'-ACATCAGATCCAGGGACGAG-3' 20 п. н. - для ампліфікації 183 п. н. фрагмента ДНК;
для виявлення трансформаційної події GTS 40-3-2 використовують пару олігонуклеотидних праймерів:
прямий праймер GTS 40-3-2 F 5'-CACGGAGAAGATGTTGCAGG-3' 20 п. н. та зворотний праймер GTS 40-3-2 R 5'-TCATCAGGCAGCCTTCGTAT-3' 20 п. н. - для ампліфікації 126 п. н. фрагмента ДНК;
для виявлення маркера промотору 35S з вірусу мозаїчності цвітної капусти, використовують пару олігонуклеотидних праймерів:
прямий праймер 35S F 5'-AAACCTCCTCGGATTCCATT-3' 20 п. н. та зворотний праймер 35S R 5'-GATAGTGGGATTGTGCGTCA-3' 20 п. н. для ампліфікації 263 п. н. фрагмента ДНК;
для виявлення маркера NOS-термінатор, 3'-нетрансльованої області гена нопалінсинтази, що входить до Ті плазміди Agrobacterium tumefaciens, використовують пару олігонуклеотидних праймерів:
прямий праймер NOS F 5'-GAATCCTGTTGCCGGTCTT-3' 19 п. н. та зворотний праймер NOS R 5'-TGCGCGCTATATTTTGTTTTC-3' 21 п.н. для ампліфікації 169 п. н. фрагмента ДНК.
Текст
Реферат: Винахід належить до способу виявлення генетично модифікованої сої у сировині та харчових продуктах методом полімеразної ланцюгової реакції, при якому застосовують пари праймерів специфічних до маркерів: видоспецифічного гена Lectin сої Glycine max, який кодує білок лектин; гена CP4-EPSPS, з Agrobacterium tumefaciens, який кодує 5-енолпірувілшикімат-3фосфатсинтазу; трансформаційної події GTS 40-3-2; промотору35S з вірусу мозаїчності цвітної капусти; та NOS-термінатора, 3'-нетрансльованої області гена нопалінсинтази, що входить до Ті плазміди Agrobacterium tumefaciens. UA 111914 C2 5 10 15 20 25 30 35 40 45 50 55 Винахід належить до галузі біотехнології, молекулярної біології та генної інженерії, а саме до способу ідентифікації послідовностей ДНК генетично модифікованих джерел і харчових продуктів на їх основі, завдяки ампліфікації ДНК в процесі проведення полімеразної ланцюгової реакції. Генетично модифіковані (ГМ) рослини і виготовлені з них продукти займають все більший сегмент у харчовій галузі, що обумовило необхідність контролю за якісним та кількісним вмістом ГМ інгредієнтів. У свою чергу, це стимулювало розвиток та застосування різноманітних аналітичних методів, що дають можливість детектувати генетично модифіковані організми (ГМО), або ГМ компоненти, ідентифікувати їх та здійснювати оцінку їх кількісного вмісту. Найпоширенішими методами якісного і кількісного аналізу ГМ компонентів є такі, що базуються на аналізі нуклеїнових кислот, насамперед - методі полімеразної ланцюгової реакції, скорочено - ПЛР. З одного боку, це обумовлено чутливістю методу ПЛР, оскільки для аналізу потрібна зовсім незначна кількість вихідного матеріалу, а з іншого - тією обставиною, що молекула ДНК є достатньо стійкою до впливу різних факторів, тому її можна аналізувати як у сирому рослинному матеріалі - сировині, так і в харчових продуктах, що містять інгредієнти, отримані з ГМ рослин. Метод ПЛР базується на ферментативній ампліфікації певної ділянки ДНК, тобто, маркера за допомогою підібраних пар праймерів. Праймери - синтетичні олігонуклеотиди - короткі фрагменти нуклеїнової кислоти комплементарні певним послідовностям ДНК або РНК, які ініціюють синтез комплементарного ланцюга за участі ДНК-полімерази. Праймерів має бути два - прямий та зворотний, які обмежують ділянку ДНК, що піддається ампліфікації, тобто чисельному копіюванню. Праймери ініціюють синтез нового ланцюга ДНК починаючи з 3'-кінця праймера. [1]. Для виявлення ГМО за допомогою ПЛР потрібно виділити ДНК з відібраної проби, провести, безпосередньо, полімеразну ланцюгову реакцію і візуалізувати продукти реакції. Метод ПЛР дозволяє здійснити якісну оцінку досліджуваного матеріалу на наявність ГМ інгредієнтів за принципом так/ні та ідентифікувати конкретну лінію ГМ рослин [2]. Для гена або ділянки ДНК, яка цікавить дослідників, підбирається пара праймерів, за допомогою якої можна провести ампліфікацію ділянки характерної довжини і отримати амплікони, зручні для ідентифікації після розділення методом електрофорезу в агарозному гелі [3]. Генетично модифікований організм і всі наступні ідентичні клони, які виникають в результаті процесу трансформації мають загальну назву трансформаційна подія. Оскільки нагальною стає потреба наявності одночасно кількох ознак, наприклад, стійкість до комах і стійкість до гербіцидів, в одній рослині, популярним став процес стекінгу генів - процес створення ГМО продукту із складанням і накопиченням необхідних, або вигідних досліднику генів різних організмів. Цього можна досягнути, або шляхом генної інженерії, або за допомогою звичайного схрещування генетично модифікованих рослин з двома різними модифікаціями. На сьогодні зареєстровано 30 ліній трансгенної сої, з них 24 лінії використовуються в якості продуктів харчування, або добавок до них. Донині трансформаційна подія GTS 40-3-2 єдина трансгенна лінія сої, яка дозволена до продажу в Європейському Союзі (Рішення Комісії R 96/281/ЕС від 3 квітня 1996 р.) [4]. Трансгенна лінія сої GTS 40-3-2 (Roundup Ready ) розроблена фірмою Monsanto Canada Inc. у 1996 році на базі технології рекомбінантних ДНК, яка полягала у введенні гена толерантності до гліфосату ферменту 5-енолпірувілшикімат-3фосфат синтази (EPSPS), виділеного зі штаму СР4 Agrobacterium tumefaciens [5]. Діагностування генетично модифікованих інгредієнтів (ГМІ) у продуктах харчування в даний час є нагальною потребою. Директивою Європейського Парламенту та Ради ЄС від 22.09.2003 1829/2003 про генетично модифіковану їжу та корми з квітня 2004 року запроваджено нові правила маркування в країнах ЄЕС, за якими встановлено пороговий рівень ГМI, що дорівнює 0,9 %. Введення 0,9 % порогового рівня пов'язано з чутливістю методу визначення ГМI і випадковим потраплянням ГМІ в харчові продукти. Обов'язкове маркування харчових продуктів з ГМІ введено і в Україні. Відомі різні пари праймерів для ідентифікації та детекції ДНК сої та її генетичних модифікацій [6, 7, 8, 9]. У процесі діагностики генетично модифікованих організмів було виявлено, що більшість відомих рішень, пов'язаних з вибором маркерів для діагностики, не враховує той факт, що останнім часом йде швидке зростання кількості продуктів, що містять ГМ рослини, отримані за різними технологіями, що призводить до можливості недостовірного виявлення продуктів харчування, що містять генетично модифіковані домішки [10, 11, 12, 13, 14]. 1 UA 111914 C2 5 10 15 20 25 30 35 40 45 50 55 60 У перелік з відомими маркерами, а саме 35S промоторної ділянки вірусу мозаїчності цвітної капусти, NOS-термінатора нопалін синтази з Agrobacterium tumefaciens, маркера EPSPS, який представляє ген 5-енолпірувілшикімат-3-фосфатсинтази з Agrobacterium tumefaciens (CP4), що забезпечує стійкість рослин до гербіциду Roundup, входить маркер трансформаційної події лінії сої GTS 40-3-2, яка була розроблена, щоб забезпечити використання гліфосату, активного інгредієнту гербіциду Roundup®, як варіант боротьби з бур'янами та маркер видоспецифічного гена сої - лектину. Якісне визначення ГМО засноване на ідентифікації генетично модифікованих регуляторних послідовностей промотору 35S і NOS-термінатора, застосовується при скринінгових дослідженнях харчової продукції, отриманої з використанням сировини рослинного походження, що має ГМ інгредієнти. Експресія гена CP4-EPSPS у трансгенних рослинах забезпечує їх стійкість до гербіциду гліфосату. Трансформаційна подія GTS 40-3-2 також надає рослинам стійкість до гліфосату і містить єдину функціональну експресійну касету. Касета складається з промотору 35S, послідовністей, що кодують хлоропласт-транзитну пептидну активність за рахунок ферменту EPSPS і сигнал поліаденилювання NOS (NOS-термінатор). Промотор 35S вірусу мозаїчності цвітної капусти та NOS-термінатор, присутні у багатьох трансгенних рослинах, дозволених до застосування в рамках ЄС і більшості інших країн. Водночас результати виявлення трансформаційної події GTS 40-3-2 для харчових продуктів не завжди відповідають аналізу на присутність промотору 35S та NOS-термінатора. Це можна пояснити значним поширенням цих вставок у різних конструкціях, які використовувалися для трансформації цілого ряду рослин. Отже, наявність промотору 35S та/або NOS-термінатора у зразках, які показали відсутність трансформаційної події GTS 40-3-2, може свідчити про виявлення інших ГМ рослин/продуктів або іншої трансформаційної події сої - прототип [15]. Спосіб виявлення генетично модифікованої сої методом полімеразної ланцюгової реакції для аналізування культур сої та генетично модифікованої сої у сировині та харчових продуктах методом полімеразної ланцюгової реакції є об'єктом даного винаходу. Винахід спосіб виявлення генетично модифікованої сої методом полімеразної ланцюгової реакції, який розраховує, застосовує п'ять пар праймерів з розробленим власним дизайном для одночасного ідентифікування вибраних п'яти маркерів включає наступні стадії: вибір маркерів, підбір, розрахунок пар праймерів, опираючись на дані нуклеотидних послідовностей GenBank, синтез пар праймерів, виділення ДНК, застосування: ампліфікація ДНК за допомогою ПЛР, виявлення-реєстрація електрофореграмою отриманого результату і аналіз отриманого результату. Спосіб виявлення генетично модифікованої сої методом полімеразної ланцюгової реакції, який розраховує та застосовує пари праймерів до маркерів: видоспецифічного гена Lectin сої Glycine max, який кодує білок лектин; гена CP4-EPSPS, з Agrobacterium tumefaciens, який кодує 5-енолпірувілшикімат-3-фосфатсинтазу; трансформаційної події GTS 40-3-2; промотору 35S з вірусу мозаїчності цвітної капусти; та NOS-термінатора, 3’-нетрансльваної області гена нопалінсинтази, що входить до Ті плазміди Agrobacterium tumefaciens, за аналізування наявності сої та генетично модифікованої сої у сировині та харчових продуктах, який відповідно до винаходу застосовує пари праймерів до маркерів: для виявлення маркера видоспецифічного гена Lectin сої Glycine max, який кодує білок лектин, використовують пару олігонуклеотидних праймерів: прямий праймер Le F 5’GTTCTCATTACCTATGATGCCTCC-3’ 24 п. н. та зворотний праймер Le R 5’TCTTCAAATCGACCACATCG-3' 20 п. н. - для ампліфікації 103 п. н. фрагмента ДНК сої; для виявлення маркера гена CP4-EPSPS, з Agrobacterium tumefaciens, який кодує 5енолпірувілшикімат-3-фосфатсинтазу, використовують пару олігонуклеотидних праймерів: прямий праймер CP4-EPSPS F 5’-CACGGAGAAGATGTTGCAGG-3’ 22 п. н. та зворотний праймер CP4-EPSPS R 5’-ACATCAGATCCAGGGACGAG-3’ 20 п. н. - для ампліфікації 183 п. н. фрагмента ДНК; для виявлення трансформаційної події GTS 40-3-2 використовують пару олігонуклеотидних праймерів: прямий праймер GTS 40-3-2 F 5'-CACGGAGAAGATGTTGCAGG-3' 20 п. н. та зворотний праймер GTS 40-3-2 R 5’-TCATCAGGCAGCCTTCGTAT-3’ 20 п. н. -для ампліфікації 126 п. н. фрагмента ДНК; для виявлення маркера промотору 35S з вірусу мозаїчності цвітної капусти, використовують пару олігонуклеотидних праймерів: прямий праймер 35S F 5’-AAACCTCCTCGGATTCCATT-3’ 20 п. н. та зворотний праймер 35S R 5’-GATAGTGGGATTGTGCGTCA-3’ 20 п. н. - для ампліфікації 263 п. н. фрагмента ДНК; 2 UA 111914 C2 5 10 15 20 25 30 35 40 45 для виявлення маркера NOS-термінатор, 3'-нетрансльованої області гена нопалінсинтази, що входить до Ті плазміди Agrobacterium tumefaciens, використовують пару олігонуклеотидних праймерів: прямий праймер NOS F 5'-GAATCCTGTTGCCGGTCTT-3’ 19 п. н. та зворотний праймер NOS R 5'-TGCGCGCTATATTTTGTTTTC-3’ 21 п. н. - для ампліфікації 169 п. н. фрагмента ДНК. Така сукупність вибраних маркерів та пар праймерів, в одному аналізі одночасно, дозволяє у способі виявлення генетично модифікованої сої методом полімеразної ланцюгової реакції з високою ефективністю, швидко, з мінімальними витратами реалізувати технічну задачу виявлення ГМО. Тобто, виявлення маркера видоспецифічного гена Lectin сої Glycine max за відповідною парою олігонуклеотидних праймерів та одночасне виявлення хоча б одного з інших чотирьох маркерів за відповідною парою олігонуклеотидних праймерів підтверджує наявність у зразку ДНК ГМ-сої. Виявлення цих маркерів у кількості від 2 до 5, з обов'язковим маркером видоспецифічного гена Lectin сої Glycine max, підтверджує наявність у зразку ДНК ГМ-сої. Запропоновані пари праймерів можуть бути застосовані при дослідних та виробничих роботах з ідентифікації генетично модифікованих домішок у харчових продуктах методом полімеразної ланцюгової реакції. Пари праймерів вибрані з урахуванням вимог високої специфічності до ділянок генів досліджуваних об'єктів ГМО, що дозволяє вибірково ампліфікувати фрагмент ДНК трансгенної рослини безпосередньо з виділеного біологічного зразка. При виборі пар праймерів враховують вимоги, які стандартно застосовуються до праймерів: відсутність високостабільних вторинних структур, межі температур плавлення, які не перевищують 2-3 °C, а також вибір довжини праймерів в діапазоні від 15 до 35 н. о. Для розрахунку пар праймерів використовувалися послідовності, характерні для ідентифікованої трансгенної рослини і представлені в базі даних нуклеотидних послідовностей GenBank (http://ncbi.nlm.nih.gov), в яких вибиралися найбільш консервативні ділянки, що не використовувалися раніше. Для точного виявлення ГМ-сої методом полімеразної ланцюгової реакції використовують пари олігонуклеотидних праймерів. Розроблено власний дизайн пар праймерів для одночасного ідентифікування ГМ-сої за п'ятьма маркерами: видоспецифічним геном Lectin сої Glycine max, який кодує білок лектин; геном CP4-EPSPS, з Agrobacterium tumefaciens, який кодує 5енолпірувілшикімат-3-фосфатсинтазу; трансформаційною подією GTS 40-3-2; промотором 35S з вірусу мозаїчності цвітної капусти; та NOS-термінатором, 3’-нетрансльованої області гена нопалінсинтази, що входить до Ті плазміди Agrobacterium tumefaciens. Спосіб виявлення генетично модифікованої сої методом полімеразної ланцюгової реакції здійснюється наступним чином. Виконуємо розрахунок пар праймерів до вибраних маркерів, опираючись на дані нуклеотидних послідовностей GenBank. Розраховані пари олігонуклеотидних праймерів являють собою набори з двох праймерів - прямого та зворотнього, які ампліфікують вибрані фрагменти ДНК. Розрахунок пари праймерів для видоспецифічного гена Lectin, для виявлення маркера видоспецифічного гена Lectin сої Glycine max, який кодує білок лектин. Розрахунок пари праймерів до гена Lectin сої Glycine max зображено на фігурі 1. Фігура 1 зображена на 5 аркушах. 3 UA 111914 C2 5 10 Розрахунок пари праймерів для виявлення маркера СР4 EPSPS, з Agrobacterium tumefaciens, який кодує 5-енолпірувілшикімат-3-фосфатсинтазу, використовують пару олігонуклеотидних праймерів. Розрахунок пари праймерів до маркера СР4 EPSPS зображено на фігурі 2. Фігура 1 зображена на 10 аркушах. Розрахунок пари праймерів для виявлення трансформаційної події GTS 40-3-2, використовують пару олігонуклеотидних праймерів. Розрахунок пари праймерів до трансформаційної події GTS 40-3-2 зображено на фігурі 3. Фігура 1 зображена на 7 аркушах. 4 UA 111914 C2 5 10 Розрахунок пари праймерів для виявлення маркера промотору 35S з вірусу мозаїчності цвітної капусти, використовують пару олігонуклеотидних праймерів. Розрахунок пари праймерів до маркера промотору 35S зображено на фігурі 4. Фігура 1 зображена на 10 аркушах. Розрахунок пари праймерів для виявлення маркера NOS-термінатор, 3'-нетрансльованої області гена нопалінсинтази, що входить до Ті плазміди Agrobacterium tumefaciens, використовують пару олігонуклеотидних праймерів. Розрахунок пари праймерів до маркера NOS-термінатор зображено на фігурі 5. Фігура 1 зображена на 10 аркушах. 5 UA 111914 C2 5 10 15 20 25 30 Розраховані нами пари праймерів ампліфікують характерні фрагменти ДНК розміром 103 п. н. - для маркера видоспецифічного гена Lectin; розміром 183 п. н. - для маркера гена СР4 EPSPS; розміром 126 п. н. - для трансформаційної події GTS 40-3-2; розміром 263 п. н. - для маркера промотору 35S та розміром 169 п. н. - для маркера NOS-термінатор. Розраховані п'ять пар праймерів дозволяють використовувати в одному аналізі одночасно від 1 до 5 маркерів. У таблиці 1 наведено "Характеристики пар праймерів для одночасного виявлення сої та ГМсої за видоспецифічним геном Lectin, геном СР4 EPSPS, подією GTS 40-3-2 та маркерами: 35S промотором і NOS-термінатором". Виконуємо синтез праймерів, виділення ДНК, ампліфікацію ДНК за допомогою ПЛР, виявлення-реєстрація на електрофореграмі отриманого результату і аналіз отриманого результату. Спосіб виявлення генетично модифікованої сої методом полімеразної ланцюгової реакції виконують наступним чином. Готують такі проби: - проба ДНК позитивного контролю з парами праймерів до відповідного маркера: гена Lectin, гена СР4 EPSPS, трансформаційної події GTS 40-3-2, промотору 35S та NOS-термінатора; - проба ДНК негативного контролю з парами праймерів до відповідного маркера: гена Lectin, гена СР4 EPSPS, трансформаційної події GTS 40-3-2, промотору 35S та NOS-термінатора; - проба контроль якості реакційної суміші - без ДНК, тобто вода, з парами праймерів до відповідного маркера: гена Lectin, гена СР4 EPSPS, трансформаційної події GTS 40-3-2, промотору 35S та NOS-термінатора. Провадять аналіз пар праймерів за допомогою полімеразної ланцюгової реакції. Для проведення полімеразної ланцюгової реакції використовують реакційну суміш, яка містить воду, десятикратний ПЛР-буфер з MgCl2, розчин чотирьох дезоксирибонуклеотидтрифосфатів, термостабільну Taq ДНК полімеразу пари праймерів та пробу ДНК, або води, в об'ємі: Н2О 8,5 мкл 10Х буфер 3MgCl2 25 мМ 2 мкл dNTP 0,5 мМ 2 мкл Taq-полімераза 0,5 мкл праймер 1 F (10 пкМ/мкл) 2,5 мкл праймер 2 R (10 пкМ/мкл) 2,5 мкл проба ДНК/вода 2 мкл 25 мкл. Для виконання способу проводять полімеразну ланцюгову реакцію в ампліфікаторі з відповідним програмним забезпеченням. Параметри: - початкова стадія денатурації ДНК при 94 °C впродовж 5 хвилини; - 30 циклів, які складаються з: - етапу при 94 °C впродовж 30 секунд, - етапу при (55-60)°С впродовж 30 секунд, - етапу при 72 °C впродовж 60 секунд; 6 UA 111914 C2 5 10 15 20 25 30 35 40 45 50 - кінцева стадія елонгації при 72 °C впродовж 5 хвилин. Продукти ПЛР аналізують за допомогою електрофорезу у агарозному гелі, який містить бромистий етидій для візуалізації результату в ультрафіолетовому світлі з довжиною хвилі 254 нм, отримують електрофореграму. Для виявлення маркерів ДНК гена Lectin, гена CP4-EPSPS, трансформаційної події GTS 403-2, промотору 35S та NOS-термінатора у сировині та харчових продуктах методом полімеразної ланцюгової реакції застосовують пари праймерів: для виявлення маркера видоспецифічного гена Lectin сої Glycine max, який кодує білок лектин, використовують пару олігонуклеотидних праймерів: прямий праймер Le F 5’GTTCTCATTACCTATGATGCCTCC-3’ 24 п. н. та зворотний праймер Le R 5'TCTTCAAATCGACCACATCG-3’ 20 п. н. - для ампліфікації 103 п. н. фрагмента ДНК сої; для виявлення маркера гена СР4 EPSPS, з Agrobacterium tumefaciens, який кодує 5енолпірувілшикімат-3-фосфатсинтазу, використовують пару олігонуклеотидних праймерів: прямий праймер CP4-EPSPS F 5’-CACGGAGAAGATGTTGCAGG-3’ 22 п. н. та зворотний праймер CP4-EPSPS R 5’-ACATCAGATCCAGGGACGAG-3’ 20 п. н. - для ампліфікації 183 п. н. фрагмента ДНК; для виявлення трансформаційної події GTS 40-3-2 використовують пару олігонуклеотидних праймерів: прямий праймер GTS 40-3-2 F 5’-CACGGAGAAGATGTTGCAGG-3' 20 п. н. та зворотний праймер GTS 40-3-2 R 5’-TCATCAGGCAGCCTTCGTAT-3' 20 п. н. - для ампліфікації 126 п. н. фрагмента ДНК; для виявлення маркера промотору 35S з вірусу мозаїчності цвітної капусти, використовують пару олігонуклеотидних праймерів: прямий праймер 35S F 5’-AAACCTCCTCGGATTCCATT-3’ 20 п. н. та зворотний праймер 35S R 5’-GATAGTGGGATTGTGCGTCA-3’ 20 п. н. - для ампліфікації 263 п. н. фрагмента ДНК; для виявлення маркера NOS-термінатор, 3'-нетрансльованої області гена нопалінсинтази, що входить до Ті плазміди Agrobacterium tumefaciens, використовують пару олігонуклеотидних праймерів: прямий праймер NOSF 5’-GAATCCTGTTGCCGGTCTT-3’ 19 п. н. та зворотний праймер NOS R 5’-TGCGCGCTATATTTTGTTTTC-3’ 21 п. н. - для ампліфікації 169 п. н. фрагмента ДНК. Приклад 1. Виявлення сої, ГМ-сої, тютюну, ГМ-тютюну у зразках з парами праймерів для видоспецифічного гена Lectin, гена CP4-EPSPS, трансформаційної події GTS 40-3-2, промотору 35S та NOS-термінатора. Для виявлення видоспецифічного гена Lectin, гена CP4-EPSPS, трансформаційної події GTS 40-3-2, промотору 35S та NOS-термінатора у зразках сої були використані розроблені пари праймерів. Для проведення полімеразної ланцюгової реакції використовували реакційну суміш з відповідними парами праймерів та пробами ДНК сої, ДНК ГМ-сої, ДНК тютюну, ДНК ГМ-тютюну в об'ємі 25 мкл. Реакційна суміш містила воду, десятикратний ПЛР-буфер з MgCl2, розчин чотирьох дезоксирибонуклеотидтрифосфатів, термостабільну Taq ДНК полімеразу пари праймерів та пробу ДНК, або води, в об'ємі: Н2О 8,5 мкл 10Х буфер 3MgCl2 25 мМ 2 мкл dNTP 0,5 мМ 2 мкл Taq-полімераза 0,5 мкл праймер 1 F (10 пкМ/мкл) 2,5 мкл праймер 2 R (10 пкМ/мкл) 2,5 мкл проба ДНК/вода 2 мкл 25 мкл. Ампліфікацію об'ємів проводили в ампліфікаторі "GeneAmp PCR System 9600" за температури 55 °C. Параметри: - початкова стадія денатурації ДНК при 94 °C впродовж 5 хвилини; - 30 циклів, які складаються з: - етапу при 94 °C впродовж 30 секунд, - етапу при 5 5 °C впродовж 30 секунд, - етапу при 72 °C впродовж 60 секунд; - кінцева стадія елонгації при 72 °C впродовж 5 хвилин. 7 UA 111914 C2 5 10 15 20 25 30 35 40 45 50 Очікувані амплікони за використаних пар праймерів: для гена Lectin - довжиною 103 п. н., для CP4-EPSPS - 183 п. н., для трансформаційної події GTS 40-3-2 - 126 п. н., для 35S промотору - 263 п. н. та для NOS-термінатора - 169 п. н. Розділення отриманих ампліконів проводили методом електрофорезу у 2 % агарозному гелі та фарбували бромистим етидієм, фотографували в ультрафіолетовому світлі з довжиною хвилі 254 нм - фото 1. Фото 1. Електрофореграма виявлення сої, ГМ-сої та ГМ-тютюну у зразках з парами праймерів для видоспецифічного гена Lectin, CP4-EPSPS, трансформаційної події GTS 40-3-2, промотору 35S та NOS-термінатора. Позначення на фото 1: Доріжки частини А: 1 - вода*, 2 - ДНК сої, 3 - ДНК ГМ-сої, 4 - ДНК-маркер, 100 п. н., 5 - вода*, 6 - ДНК сої, 7 - ДНК ГМ-сої, 8 - вода*, 9 - ДНК сої, 10 - ДНК ГМ-сої; Доріжки частини Б: 1 - вода*, 2 - ДНК сої, 3 - ДНК ГМ-сої, 4 - ДНК тютюну, 5 - ДНК ГМтютюну, 6 - ДНК-маркер, 100 п. н., 7 - ДНК сої, 8 - ДНК ГМ-сої, 9 - ДНК тютюну, 10 - ДНК ГМтютюну. * Контроль якості реакційної суміші - ПЛР за відсутності ДНК. Наявність на електрофореграмі продуктів ампліфікації розміром 103 п. н. характерних, за використаних пар праймерів, для гена Lectin, дозволяє стверджувати, що у зразках ДНК сої, доріжка 2 частини А, та ДНК ГМ-сої, доріжка 3 частини А, дійсно міститься ДНК сої. Відсутність на електрофореграмі продуктів ампліфікації розміром 183 п. н. характерних, за використаних пар праймерів, для гена CP4-EPSPS, вказує, що у використаному матеріалі ДНК ГМ-сої, доріжка 7 частини А, даний ген відсутній. Наявність на електрофореграмі продуктів ампліфікації розміром 126 п. н. характерних, за використаних пар праймерів, для трансформаційної події GTS 40-3-2, вказує, що зразок ДНК ГМ-сої, доріжка 10 частини А, містить модифіковану ДНК. Відсутність на електрофореграмі продуктів ампліфікації розміром 263 п. н. характерних, за використаних пар праймерів, для промотору 35S, вказує, що у зразку ДНК ГМ-сої, доріжка 3 частини Б, промотору 35S не виявлено, проте зразок ДНК ГМ-тютюну, доріжка 5 частини Б, містив промотор 35S, тобто модифіковану ДНК. Наявність на електрофореграмі продуктів ампліфікації розміром 169 п. н. характерних, за використаних пар праймерів, для NOS-термінатора, вказує, що зразки ДНК ГМ-сої, доріжка 8 частини Б, та ДНК ГМ-тютюну, доріжка 10 частини Б, містили NOS-термінатор, тобто модифіковану ДНК. Отже, спосіб виявлення генетично модифікованої сої методом полімеразної ланцюгової реакції, показав ефективність пар праймерів для виявлення видоспецифічного гена Lectin, трансформаційної події GTS 40-3-2, промотору 35S та NOS-термінатора. У даному зразку ГМ сої ген CP4-EPSPS та промотор 35S не виявлено. Приклад 2. Ідентифікація гена CP4-EPSPS, трансформаційної події GTS 40-3-2 та промотору 35S у зразках сої, ГМ-сої, тютюну, ГМ-тютюну та плазміді pUC57. Оскільки у попередньому дослідженні з ГМ соєю, приклад 1, не було виявлено необхідний ампліфікований фрагмент 183 п. н. гена CP4-EPSPS та продукт ампліфікації розміром 263 п. н. промотору 35S, було проведено ПЛР з плазмідою pUC57, яка містила модифікований ген CP4EPSPS Agrobacterium tumefaciens, та з ДНК ГМ-сої, ДНК немодифікованої сої, ДНК ГМ-тютюну, ДНК немодифікованого тютюну. Для проведення полімеразної ланцюгової реакції використовували реакційну суміш з відповідними парами праймерів та пробами ДНК сої, ДНК ГМ-сої, ДНК тютюну, ДНК ГМ-тютюну, плазміди pUC57 в об'ємі 25 мкл. Реакційна суміш містила воду, десятикратний ПЛР-буфер з MgCl2, розчин чотирьох дезоксирибонуклеотидтрифосфатів, термостабільну Taq ДНК полімеразу пари праймерів та пробу ДНК, або води, в об'ємі: Н2О 8,5 мкл 10Х буфер 3MgCl2 25 мМ 2 мкл dNTP 0,5 мМ 2 мкл Taq-полімераза 0,5 мкл праймер 1 F (10 пкМ/мкл) 2,5 мкл праймер 2 R (10 пкМ/мкл) 2,5 мкл проба ДНК, вода 2 мкл 25 мкл. Ампліфікацію об'ємів проводили в ампліфікаторі "GeneAmp PCR System 9600" за температури 60 °C. Параметри: 8 UA 111914 C2 55 - початкова стадія денатурації ДНК при 94 °C впродовж 5 хвилини; - 30 циклів, які складалися з: - етапу при 94 °C впродовж 30 секунд, - етапу при 60 °C впродовж 30 секунд, - етапу при 72 °C впродовж 60 секунд; - кінцева стадія елонгації при 72 °C впродовж 5 хвилин. Очікувані амплікони за використаних пар праймерів: для гена CP4-EPSPS - 183 п. н., для трансформаційної події GTS 40-3-2 - 126 п. н., для промотору 35S-263 п. н. Розділення отриманих ампліконів проводили методом електрофорезу у 2 % агарозному гелі та фарбували бромистим етидієм, фотографували в ультрафіолетовому світлі з довжиною хвилі 254 нм - фото 2. Фото 2. Електрофореграма виявлення сої, ГМ-сої, плазміди pUC57 та ГМ-тютюну при використанні пар праймерів для гена CP4-EPSPS, трансформаційної специфічної події GTS 403-2 та промотору 35S. Позначення на фото 2: Доріжки частини А: 1 - вода*, 2 - ДНК сої, 3 - ДНК ГМ-сої, 4 - плазміда pUC57, 5 - ДНК тютюну, 6 - ДНК ГМ-тютюну, 7 - ДНК-маркер, 100 п. н., 8 - вода*, 9 - ДНК сої, 10 - ДНК ГМ-сої; Доріжки частини Б: 1 - вода*, 2 - ДНК сої, 3 - ДНК ГМ-сої, 4 - плазміда pUC57, 5 - ДНК тютюну, 6 - ДНК ГМ-тютюну, 7 - ДНК-маркер, 100 п. н., 8 - плазміда pUC57, 9 - ДНК сої, 10 - ДНК ГМ-сої. * Контроль якості реакційної суміші - ПЛР за відсутності ДНК. Наявність на електрофореграмі продуктів ампліфікації розміром 183 п. н. характерних, за використаних пар праймерів, для гена CP4-EPSPS, вказує на наявність гена CP4-EPSPS у зразку плазміди pUC57, доріжка 4 частини А. У зразках ДНК ГМ-сої, доріжка 3 частини А, цей фрагмент не виявлено. Наявність на електрофореграмі продуктів ампліфікації розміром 126 п. н., характерних, за використаних пар праймерів, для трансформаційної події GTS 40-3-2, підтвердила, що зразок плазміди pUC57, доріжка 4 частини Б, містить дану модифікацію. Відсутність відповідного продукту ампліфікації розміром 126 п. н. у зразку ДНК ГМ-сої, доріжка 3 частини Б, вказує на неможливість виявлення даного фрагмента за даних умов експерименту. Відсутність відповідного продукту ампліфікації розміром 126 п. н. у зразку ДНК ГМ-тютюну, доріжка 6 частини Б, свідчить про високу специфічність цього амплікону для ГМ-сої, тобто ДНК ГМ-тютюну не містить даної модифікації. Відсутність на електрофореграмі, за використаних праймерів, продуктів ампліфікації розміром 263 п. н. характерних для промотору 35S, у зразку ДНК ГМ-сої, доріжка 10 частини А, вказала на неможливість виявлення даного фрагмента за даних умов експерименту або відсутність даної модифікації у зразку ГМ-сої. Водночас продукти ампліфікації розміром 263 п. н. виявлено у зразку плазміди pUC57, доріжка 8 частини Б, та у ДНК ГМ-тютюну, доріжка 10 частини Б, що свідчить про ефективну роботу пар праймерів для виявлення 35S. Таким чином показано, що розроблені пари праймерів для ідентифікації гена CP4-EPSPS, трансформаційної події GTS 40-3-2 та промотору 35S є робочими і можуть застосовуватися для їх виявлення. Отже, виявлення маркера видоспецифічного гена Lectin сої Glycine max за відповідною парою олігонуклеотидних праймерів та одночасне виявлення хоча б одного з інших чотирьох маркерів за відповідною парою олігонуклеотидних праймерів підтверджує наявність у зразку ДНК ГМ-сої. Розроблений спосіб виявлення генетично модифікованої сої методом полімеразної ланцюгової реакції за розрахованими п'ятьма парами праймерів: до гена Lectin, гена CP4EPSPS, трансформаційної події GTS 40-3-2, промотору 35S та NOS-термінатора, дозволяє використовувати в одному аналізі одночасно від 2 до 5 маркерів, з обов'язковим маркером видоспецифічного гена Lectin сої Glycine max, та виявляти генетичні модифікації сої. Також можна виявляти модифікації інших культур у випадку наявності в них відповідних маркерів. Спосіб виявлення генетично модифікованої сої методом полімеразної ланцюгової реакції аналізує сою та генетично модифіковану сою у сировині та харчових продуктах методом полімеразної ланцюгової реакції. 60 Джерела інформації: [1] Enzymatic amplification of beta-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia / RK Saiki, S Scharf, F Faloona, KB Mullis, GT Horn, HA Erlich, and N Arnheim // Science, 1985, v. 230, p. 1350-1354. 5 10 15 20 25 30 35 40 45 50 9 UA 111914 C2 5 10 15 20 25 30 35 40 [2] Primer-directed enzymatic amplification of DNA with a thermostable DNA polymerase / Saiki RK, Gelfand DH, Stoffel S, Scharf SJ, Higuchi R, Horn GT, Mullis KB, Erlich HA. // Science, 1988, v. 239, p. 487-491. [3] PCR Protocols / Innis et al. // Academic Press. Inc., 1990, p. 219-227. [4] Commision Decision 96/281/EC of 3 April 1996 concerning the placing on the market of genetically modified soya beans (Glycine max L.) with increased tolerance to the herbicide glyphosate, pursuant to Council Directive 90/220/EEC [5] Molecular characterization of GTS 40-3-2 Roundup Ready Soybean (Adobe Acrobat PDF 764K) (http://ceragmc.org/files/cera/GmCropDatabase/docs/decdocs/gts40-3-2-dossier.pdf)[PDF Size: 745.83K bytes] [6] Evidence for landscape-level, pollen-mediated gene flow from genetically modified creeping bentgrass with CP4 EPSPS as a marker. Lidia S Watrud, Ε Henry Lee, Anne Fairbrother, Connie Burdick, Jay R Reichman, Mike Bollman, Marjorie Storm, George King, Peter К Van de Water // Proc Natl Acad Sci USA 2004 Oct 24;101(40):14533-8. Epub 2004 Sep 24. [7] Анализ образцов пищевых продуктов на присутствие генетически модифицированных организмов. Практическое руководство / М. Кверчи, М. Мацара, Ги Ван де Эдде // Италия 2006, XI стр. [8] Впровадження методів контролю генетично модифікованих компонентів у насіннєвому матеріалі сільськогосподарських культур та стандартизація їх нормативного забезпечення / Я.В. Пірко, В.І. Корховий, Г.П. Кашеваров, І.К. Комарницький, П.А. Карпов, А.І. Ємець, М.В. Кучук, Б.В. Сорочинський, Я.Б. Блюм // Наука та інновації. - 2009. - Т. 5, N 2. – С. 38-49. [9] Впровадження методів оцінки наявності та вмісту генетично модифікованих компонентів у продуктих харчування, кормах і парфюмерно-косметичних виробах / Я.Б. Блюм, М.О. Банникова, П.А. Карпов, І.К. Комарницький, М.В. Кучук, Б.В. Сорочинський // Наука та інновації. 2008. Τ 4. № 2. С. 40-48. [10] Method, apparatus and system for quantifying the content of genetically modified material in a sample / Hurst M. et al. // US Patent Apll. 20070015186 (January 18,2007). [11] Quantitative PCR for DNA identification based on genome-specific interspersed repetitive elements / Walker JA, Hughes DA, Hedges DJ, Anders BA, Laborde ME, Shewale J, Sinha SK, Batzer MA. // Genomics, 2004, v. 83 (3) p. 518-527. [12] Methods for detection of GMOs in food and feed / Marmiroli N., Maestri E., Gulli M., Malcevschi Α., Peano C, Bordoni R., De Bellis G. // Anal. Bioanal. Chem. - 2008. - 392. - P. 369-384. [13] Сучасні методи молекулярного аналізу генетично модифікованих рослин / Секан А.С., Сорочинський Б.В. // (2011) Біотехнологія. Т.4, № 1, С. 106-114 [14] Современные методы идентификации ГМИ в пищевых продуктах / Сорокина Е.Ю., Чернышева О.Н. // "Пищевая промышленность", 2003, № 6. С. 20-21. [15] Дифференцирующий и специфический олигонуклеотиды для идентификации последовательностей ДНК трасгенных растений в пищевых продуктах, способ идентификации трансгенных продуктов, биочип, комбинация олигонуклеотидов (варианты) и набор для осуществления этого способа / Грановский Н.Э., Белецкий И.П., Шляпникова Е.А., Шляпников Ю.М., Гаврюшкин А.В., Бирюков С.В. // Патент RU 2453605/ 17.07.2012. 10 UA 111914 C2 Таблиця 1 Характеристики пар праймерів для одночасного виявлення сої та ГМ-сої за видоспецифічним геном Lectin, геном CP4-EPSPS, подією GTS 40-3-2 та маркерами: 35S промотором і NOSтермінатором Ген Lectin CP4-EPSPS GTS 40-3-2 Промотор 35S NOS-термінатор 5 10 15 ФОРМУЛА ВИНАХОДУ Спосіб виявлення генетично модифікованої сої у сировині та харчових продуктах методом полімеразної ланцюгової реакції, при якому застосовують пари праймерів, специфічних до маркерів: видоспецифічного гена Lectin сої Glycine max, який кодує білок лектин; гена CP4EPSPS, з Agrobacterium tumefaciens, який кодує 5-енолпірувілшикімат-3-фосфатсинтазу; трансформаційної події GTS 40-3-2; промотору 35S з вірусу мозаїчності цвітної капусти; та NOSтермінатора, 3'-нетрансльованої області гена нопалінсинтази, що входить до Ті плазміди Agrobacterium tumefaciens, який відрізняється тим, що для виявлення маркера видоспецифічного гена Lectin сої Glycine max, який кодує білок лектин, використовують пару олігонуклеотидних праймерів: прямий праймер Le F 5'-GTTCTCATTACCTATGATGCCTCC-3' 24 п. н. та зворотний праймер Le R 5'-TCTTCAAATCGACCACATCG-3' 20 п. н. - для ампліфікації 103 п. н. фрагмента ДНК сої; для виявлення маркера гена CP4-EPSPS, з Agrobacterium tumefaciens, який кодує 5енолпірувілшикімат-3-фосфатсинтазу, використовують пару олігонуклеотидних праймерів: 11 UA 111914 C2 5 10 15 прямий праймер CP4-EPSPS F 5'-CACGGAGAAGATGTTGCAGG-3' 22 п. н. та зворотний праймер CP4-EPSPS R 5'-ACATCAGATCCAGGGACGAG-3' 20 п. н. - для ампліфікації 183 п. н. фрагмента ДНК; для виявлення трансформаційної події GTS 40-3-2 використовують пару олігонуклеотидних праймерів: прямий праймер GTS 40-3-2 F 5'-CACGGAGAAGATGTTGCAGG-3' 20 п. н. та зворотний праймер GTS 40-3-2 R 5'-TCATCAGGCAGCCTTCGTAT-3' 20 п. н. - для ампліфікації 126 п. н. фрагмента ДНК; для виявлення маркера промотору 35S з вірусу мозаїчності цвітної капусти, використовують пару олігонуклеотидних праймерів: прямий праймер 35S F 5'-AAACCTCCTCGGATTCCATT-3' 20 п. н. та зворотний праймер 35S R 5'-GATAGTGGGATTGTGCGTCA-3' 20 п. н. для ампліфікації 263 п. н. фрагмента ДНК; для виявлення маркера NOS-термінатор, 3'-нетрансльованої області гена нопалінсинтази, що входить до Ті плазміди Agrobacterium tumefaciens, використовують пару олігонуклеотидних праймерів: прямий праймер NOS F 5'-GAATCCTGTTGCCGGTCTT-3' 19 п. н. та зворотний праймер NOS R 5'-TGCGCGCTATATTTTGTTTTC-3' 21 п. н. для ампліфікації 169 п. н. фрагмента ДНК. 12 UA 111914 C2 Фіг. 1 13 UA 111914 C2 продовження 1 Фіг. 1 14 UA 111914 C2 продовження 2 Фіг. 115 UA 111914 C2 продовження 3 Фіг. 1 16 UA 111914 C2 продовження 4 Фіг. 1 17 UA 111914 C2 Фіг. 2 18 UA 111914 C2 продовження 1 Фіг. 2 19 UA 111914 C2 продовження 2 Фіг. 2 20 UA 111914 C2 продовження 3 Фіг. 2 21 UA 111914 C2 продовження 4 Фіг. 2 22 UA 111914 C2 продовження 5 Фіг. 2 23 UA 111914 C2 продовження 6 Фіг. 2 24 UA 111914 C2 продовження 7 Фіг. 2 25 UA 111914 C2 продовження 8 Фіг. 2 26 UA 111914 C2 продовження 9 Фіг. 2 27 UA 111914 C2 Фіг. 3 28
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C12N 15/11, C12Q 1/68, C12Q 1/04
Мітки: ланцюгової, спосіб, полімеразної, генетично, модифікованої, виявлення, реакції, сої, методом
Код посилання
<a href="https://ua.patents.su/58-111914-sposib-viyavlennya-genetichno-modifikovano-so-metodom-polimerazno-lancyugovo-reakci.html" target="_blank" rel="follow" title="База патентів України">Спосіб виявлення генетично модифікованої сої методом полімеразної ланцюгової реакції</a>
Попередній патент: Спосіб отримання дифузійного соку
Наступний патент: Ємнісний гравіметр
Випадковий патент: Спосіб закриття тонкокишкової нориці