Індазоли
Номер патенту: 108442
Опубліковано: 27.04.2015
Автори: Ко Джонатан Уодсворт, Джонс Пітер, Денхардт Крістоф Мартін, Сабніс Йогеш Еніл, Вакенхут Флоріан Майкл, Вайтлок Гейвін Алістер, Кортум Стівен Уейд
Формула / Реферат
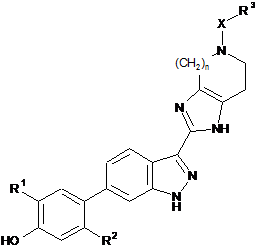
1. Сполука формули (І)
 (I)
(I)
або її фармацевтично прийнятна сіль або фармацевтично прийнятний сольват згаданої сполуки або фармацевтично прийнятної солі, де:
R1 означає галоген;
R2 означає С1-С6алкіл, необов'язково заміщений одним або декількома атомами фтору;
X означає зв'язок, -CO-, -SO2- або -СН2-;
R3 означає арил1, Het1 або Het2, кожен з яких необов'язково заміщений 1 замісником -Y-R4 та/або 1-4 замісниками, кожен з яких незалежно вибраний з R5;
n має значення 1 або 2;
арил1 означає феніл або нафтил;
Het1 означає (і) 6-членний ароматичний гетероцикл, що містить 1-3 атоми N, або (іі) 5-членний ароматичний гетероцикл, що містить або (а) 1-4 атоми N, або (b) 1 атом О або S і 0-3 атоми N;
Het2 означає (і) 10-членний біциклічний ароматичний гетероцикл, що містить 1-4 атоми N, або (іі) 9-членний біциклічний ароматичний гетероцикл, що містить або (а) 1-4 атоми N, або (b) 1 атом О або S і 0-3 атоми N, або (ііі) 8-членний біциклічний ароматичний гетероцикл, що містить (а) 1-4 атоми N або (b) 1 атом О або S і 1-3 атоми N, або (с) 2 атоми О або S і 0-2 атоми N;
Y означає зв'язок або -О-;
R4 означає арил2 або Het3;
R5 означає С1-С6алкіл, С3-С8циклоалкіл, галоген, -CN-OR6, -NR7R8, -SR6, -SOR9, -SO2R9, -COR6, -OCOR6, -COOR6, -NR6COR6, -CONR7R8, -NR6SO2R9, -SO2NR7R8, -NR6CONR7R8, -NR6COOR9 або -NR6SO2NR7R8;
R6 означає Н, С1-С6алкіл або С3-С8циклоалкіл, де згаданий С1-С6алкіл необов'язково заміщений галогеном або С3-С8циклоалкілом;
R7 і R8 означають (а) кожен незалежно Н, С1-С6алкіл або С3-С8циклоалкіл, де згаданий С1-С6алкіл необов'язково заміщений -NR10R11, де R10 і R11 означають С1-С6алкіл або, взяті разом з атомом азоту, до якого вони приєднані, утворюють насичене 4-, 5- або 6-членне гетероциклічне кільце, що містить 1-2 атоми азоту або 1 атом азоту і 1 атом кисню, де згадане гетероциклічне кільце необов'язково заміщене однією або декількома С1-С6алкільними або С3-С8циклоалкільними групами; або (b) взяті разом з атомом азоту, до якого вони приєднані, утворюють насичене 4-, 5- або б-членне гетероциклічне кільце, що містить 1-2 атоми азоту або 1 атом азоту і 1 атом кисню, де згадане гетероциклічне кільце необов'язково заміщене однією або декількома С1-С6алкільними або С3-С8циклоалкільними групами;
R9 означає С1-С6алкіл або С3-С8циклоалкіл;
арил2 означає феніл або нафтил, де згадані феніл і нафтил необов'язково заміщені 1-5 замісниками, вибраними з С1-С6алкілу, С3-С8циклоалкілу, галогену, -CN-OR6, -NR7R8, -SR6, -SOR9, -SO2R9, -COR6, -OCOR6, -COOR6, -NR6COR6, -CONR7R8, -NR6SO2R9, -SO2NR7R8, -NR6CONR7R8, -NR6COOR9 і -NR6SO2NR7R8; і
Het3 означає насичений або частково насичений моноциклічний 3-8-членний гетероцикл, що містить 1 або 2 гетероатоми, вибрані з О і N, де згаданий гетероцикл необов'язково заміщений 1-5 замісниками, вибраними з С1-С6алкілу, С3-С8циклоалкілу, галогену, оксо, -OR6, -NR7R8, -SR6, -SOR9, -SO2R9, -COR6, -OCOR6, -COOR6, -NR6COR6, -CONR7R8, -NR6SO2R9, -SO2NR7R8, -NR6CONR7R8, -NR6COOR9 і -NR6SO2NR7R8.
2. Сполука формули (І) за п. 1 або її фармацевтично прийнятна сіль або фармацевтично прийнятний сольват згаданої сполуки або солі, де R1 означає фтор.
3. Сполука формули (І) за п. 1 або п. 2 або її фармацевтично прийнятна сіль або фармацевтично прийнятний сольват згаданої сполуки або солі, де R2 означає -СН2СН3 або -CH2CF3.
4. Сполука формули (І) за будь-яким одним з пп. 1-3 або її фармацевтично прийнятна сіль або фармацевтично прийнятний сольват згаданої сполуки або солі, де n має значення 1.
5. Сполука формули (І) за будь-яким одним з пп. 1-3 або її фармацевтично прийнятна сіль або фармацевтично прийнятний сольват згаданої сполуки або солі, де n має значення 2.
6. Сполука формули (І) за будь-яким одним з пп. 1-5 або її фармацевтично прийнятна сіль або фармацевтично прийнятний сольват згаданої сполуки або солі, де X означає зв'язок.
7. Сполука формули (І) за будь-яким одним з пп. 1-5 або її фармацевтично прийнятна сіль або фармацевтично прийнятний сольват згаданої сполуки або солі, де X означає -СО-.
8. Сполука формули (І) за будь-яким одним з пп. 1-5 або її фармацевтично прийнятна сіль або фармацевтично прийнятний сольват згаданої сполуки або солі, де X означає -SO2-.
9. Сполука формули (І) за будь-яким одним з пп. 1-5 або її фармацевтично прийнятна сіль або фармацевтично прийнятний сольват згаданої сполуки або солі, де X означає -СН2-.
10. Сполука формули (І) за будь-яким одним з пп. 1-9 або її фармацевтично прийнятна сіль або фармацевтично прийнятний сольват згаданої сполуки або солі, де R3 означає феніл, тіазоліл, хінолініл, піримідиніл, [1,8]нафтиридиніл або піридил, кожен з яких необов'язково заміщений 1 замісником, вибраним з піперидинілу, (фторфеніл)окси, фенілокси і морфолінілу, і 1-2 замісниками, кожен з яких незалежно вибраний з фтору, хлору, ціано, метокси і гідрокси.
11. Сполука формули (І) за п. 1, яка вибрана з групи
{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл}-(4-фторфеніл)метанон;
{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл}ізотіазол-3-ілметанон;
{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл}ізотіазол-3-ілметанон;
{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл}-(5-піперидин-1-ілпіразин-2-іл)метанон;
{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл}-(6-феноксипіридин-3-іл)метанон;
5-етил-2-фтор-4-{3-[5-(6-морфолін-4-ілпіридин-3-сульфоніл)-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-2-іл]-1Н-індазол-6-іл}фенол;
5-етил-2-фтор-4-{3-[5-(6-феноксипіридин-3-сульфоніл)-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-2-іл]-1Н-індазол-6-іл}фенол;
(5-хлорпіридин-2-іл)-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-4,5,7,8-тетрагідро-1Н-імідазо[4,5-d]азепін-6-іл}метанон;
2-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-4,5,7,8-тетрагідро-1Н-імідазо[4,5-d]азепін-6-карбоніл}ізонікотинонітрил;
{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-4,5,7,8-тетрагідро-1Н-імідазо[4,5-d]азепін-6-іл}-(4-фторфеніл)метанон;
{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-4,5,7,8-тетрагідро-1Н-імідазо[4,5-d]азепін-6-іл}ізотіазол-3-ілметанон;
5-етил-2-фтор-4-{3-[5-(4-фторбензолсульфоніл)-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-2-іл]-1Н-індазол-6-іл}фенол;
{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл}-[5-(2-фторфенокси)піразин-2-іл]метанон;
4-[3-(6-бензил-1,4,5,6,7,8-гексагідроімідазо[4,5-d]азепін-2-іл)-1Н-індазол-6-іл]-5-етил-2-фторфенол;
(5-хлорпіридин-2-іл)-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл}метанон;
5-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-карбоніл}піридин-2-карбонітрил;
5-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-4,5,7,8-тетрагідро-1Н-імідазо[4,5-d]азепін-6-карбоніл}піридин-2-карбонітрил;
5-етил-2-фтор-4-[3-(5-хінолін-6-ілметил-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-2-іл)-1Н-індазол-6-іл]фенол;
5-етил-2-фтор-4-{3-[5-(4-гідроксибензил)-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-2-іл]-1Н-індазол-6-іл}фенол;
5-етил-2-фтор-4-{3-[5-(3-гідроксибензил)-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-2-іл]-1Н-індазол-6-іл}фенол;
4-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-ілметил}піридин-2-карбонітрил;
5-етил-2-фтор-4-{3-[5-(3-метоксибензил)-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-2-іл]-1Н-індазол-6-іл}фенол;
5-етил-2-фтор-4-[3-(5-хінолін-3-ілметил-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-2-іл)-1Н-індазол-6-іл]фенол;
5-етил-2-фтор-4-{3-[5-(6-феноксипіридин-3-ілметил)-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-2-іл]-1Н-індазол-6-іл}фенол;
5-етил-2-фтор-4-{3-[5-(3,4,5,6-тетрагідро-2Н-[1,2']біпіридинил-5'-ілметил)-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-2-іл]-1Н-індазол-6-іл}фенол;
3-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-ілметил}піридин-2-карбонітрил;
5-етил-2-фтор-4-{3-[5-(4-фторбензил)-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-2-іл]-1Н-індазол-6-іл}фенол;
5-етил-2-фтор-4-[3-(5-[1,8]нафтиридин-2-ілметил-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-2-іл)-1Н-індазол-6-іл]фенол;
(2-{6-[5-фтор-4-гідрокси-2-(2,2,2-трифторетил)феніл]-1Н-індазол-3-іл}-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл)-(5-піперидин-1-ілпіразин-2-іл)метанон;
(2-{6-[5-фтор-4-гідрокси-2-(2,2,2-трифторетил)феніл]-1Н-індазол-3-іл}-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл)-(4-фторфеніл)метанон або
4-[3-(5-бензил-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-2-іл)-1Н-індазол-6-іл]-2-фтор-5-(2,2,2-трифторетил)фенол;
або її фармацевтично прийнятна сіль або фармацевтично прийнятний сольват згаданої сполуки або солі.
12. Сполука формули (І) за п. 1, яка вибрана з групи
{5-[(2-диметиламіноетил)метиламіно]піразин-2-іл}-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл}метанон;
{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл}-[5-(2-піролідин-1-ілетиламіно)піразин-2-іл]метанон;
[5-(2-диметиламіноетиламіно)піразин-2-іл]-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл}метанон;
[5-(4-диметиламінопіперидин-1-іл)піразин-2-іл]-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл}метанон;
{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл}-{5-[етил(2-гідроксіетил)аміно]піразин-2-іл}метанон;
[5-((R)-3-диметиламінопіролідин-1-іл)піразин-2-іл]-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл}метанон;
[5-((S)-3-диметиламінопіролідин-1-іл)піразин-2-іл]-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл}метанон;
{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5с]піридин-5-іл}-[5-(2-піперидин-1-ілетиламіно)піразин-2-іл]метанон;
{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл}-[5-(2-піперазин-1-ілетиламіно)піразин-2-іл]метанон;
{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-]піридин-5-іл}-(4-метил-3,4,5,6-тетрагідро-2Н-[1,2']біпіразиніл-5'-іл)метанон;
{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл}-(5-морфолін-4-ілпіразин-2-іл)метанон;
{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5с]піридин-5-іл}-[5-(4-метилпіперидин-1-іл)піразин-2-іл]метанон;
(5-циклопентиламінопіразин-2-іл)-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл}метанон;
{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл}-[5-(2-морфолін-4-ілетиламіно)піразин-2-іл]метанон;
{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл}-(4-ізопропіл-3,4,5,6-тетрагідро-2Н-[1,2']біпіразиніл-5'-іл)метанон;
{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл}-(5-піролідин-1-ілпіразин-2-іл)метанон;
{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-]піридин-5-іл}-[5-(етилметиламіно)піразин-2-іл]метанон;
(5-циклогексиламінопіразин-2-іл)-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл}метанон;
(5-диметиламінопіразин-2-іл)-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл}метанон;
(5-азетидин-1-ілпіразин-2-іл)-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл}метанон;
2-фтор-4-{3-[5-(4-фторбензил)-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-2-іл]-1Н-індазол-6-іл}-5-(2,2,2-трифторетил)фенол;
2-фтор-4-{3-[5-(3,4,5,6-тетрагідро-2Н-[1,2']біпіридинил-5'-ілметил)-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-2-іл]-1Н-індазол-6-іл}-5-(2,2,2-трифторетил)фенол;
2-фтор-4-{3-[5-(6-феноксипіридин-3-ілметил)-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-2-іл]-Н-індазол-6-іл}-5-(2,2,2-трифторетил)фенол;
2-фтор-4-{3-[5-(4-метоксибензил)-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-2-іл]-1Н-індазол-6-іл}-5-(2,2,2-трифторетил)фенол;
2-фтор-4-{3-[5-(4-гідроксибензил)-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-2-іл]-1Н-індазол-6-іл}-5-(2,2,2-трифторетил)фенол;
2-фтор-4-{3-[5-(3-метоксибензил)-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-2-іл]-1Н-індазол-6-іл}-5-(2,2,2-трифторетил)фенол;
2-фтор-4-{3-[5-(3-гідроксибензил)-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-2-іл]-1Н-індазол-6-іл}-5-(2,2,2-трифторетил)фенол;
2-фтор-4-[3-(5-хінолін-6-ілметил-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-2-іл)-1Н-індазол-6-іл]-5-(2,2,2-трифторетил)фенол;
2-фтор-4-[3-(5-хінолін-3-ілметил-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-2-іл)-1Н-індазол-6-іл]-5-(2,2,2-трифторетил)фенол;
2-фтор-4-[3-(5-[1,8]нафтиридин-3-ілметил-4,5,6,7-тетрагідро-1Н-імідазо[4,5-с]піридин-2-іл)-1Н-індазол-6-іл]-5-(2,2,2-трифторетил)фенол;
((3R,5S)-3,5-диметил-3,4,5,6-тетрагідро-2Н-[1,2']біпіразиніл-5'-iл)-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл}метанон;
{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл}-((S)-3-метил-3,4,5,6-тетрагідро-2Н-[1,2']біпіразиніл-5'-іл)метанон;
((2S,5R)-2,5-диметил-3,4,5,6-тетрагідро-2Н-[1,2']біпіразиніл-5'-іл)-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-с]піридин-5-іл}метанон;
{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Н-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-]піридин-5-іл}-(3,4,5,6-тетрагідро-2Н-[1,2']біпіразиніл-5'-іл)метанон;
або її фармацевтично прийнятна сіль або фармацевтично прийнятний сольват згаданої сполуки або солі.
13. Фармацевтична композиція, що містить сполуку формули (І) за будь-яким одним з пп. 1-12 або її фармацевтично прийнятну сіль або фармацевтично прийнятний сольват згаданої сполуки або солі і фармацевтично прийнятний ексципієнт.
14. Спосіб лікування захворювання або стану, для яких показаний інгібітор JAK, у суб'єкта, що потребує такого лікування, який включає введення суб'єктові терапевтично ефективної кількості сполуки формули (І) за будь-яким одним з пп. 1-13 або її фармацевтично прийнятної солі або фармацевтично прийнятного сольвату згаданої сполуки або солі.
15. Спосіб лікування захворювання або стану, вибраного з групи, яка включає: алергічний риніт, закладеність носа, нежить, цілорічний риніт, запальні захворювання порожнини носа, астму всіх типів, хронічне обструктивне захворювання легенів, хронічну або гостру бронхоконстрикцію, хронічний бронхіт, обструкцію периферичних дихальних шляхів, емфізему, хронічну еозинофільну пневмонію, дистрес-синдром у дорослих, загострення надмірної активності дихальних шляхів унаслідок застосування іншої лікарської терапії, судинне захворювання легенів, легеневу артеріальну гіпертензію, гостре ушкодження легенів, бронхоектаз, синусит, алергічний кон'юнктивіт, ідіопатичний легеневий фіброз або атопічний дерматит, який включає введення суб'єктові терапевтично ефективної кількості сполуки формули (І) за будь-яким одним з пп. 1-13 або її фармацевтично прийнятної солі або фармацевтично прийнятного сольвату згаданої сполуки або солі.
16. Спосіб лікування хронічного обструктивного захворювання легенів, що включає введення суб'єктові терапевтично ефективної кількості сполуки формули (І) за будь-яким одним з пп. 1-13 або її фармацевтично прийнятної солі або фармацевтично прийнятного сольвату згаданої сполуки або солі.
17. Спосіб лікування захворювання або стану, вибраного з групи, яка включає: запалення, нейрозапалення, артрит, ревматоїдний артрит, спондилоартропатію, артрит при системному еритематозному вовчаку, остеоартрит, подагричний артрит, біль, лихоманку, легеневий саркоїдоз, силікоз, серцево-судинне захворювання, атеросклероз, інфаркт міокарда, тромбоз, застійну серцеву недостатність і реперфузійне ушкодження серця, кардіоміопатію, інсульт, ішемію, реперфузійне ушкодження, набряк головного мозку, травму головного мозку, нейродегенерацію, захворювання печінки, запальні захворювання кишечнику, хворобу Крона, виразковий коліт, нефрит, ретиніт, ретинопатію, макулярну дегенерацію, глаукому, діабет (типу 1 і типу 2), діабетичну нейропатію, вірусну і бактерійну інфекцію, міалгію, ендотоксиновий шок, синдром токсичного шоку, аутоімунне захворювання, остеопороз, розсіяний склероз, ендометріоз, менструальні болі, вагініт, кандидоз, рак, фіброз, ожиріння, м'язову дистрофію, поліміозит, хворобу Альцгеймера, гіперемію шкіри, екзему, псоріаз, атопічний дерматит і сонячний опік, що включає введення суб'єктові терапевтично ефективної кількості сполуки формули (І) за будь-яким одним з пп. 1-13 або її фармацевтично прийнятної солі або фармацевтично прийнятного сольвату згаданої сполуки або солі.
18. Спосіб лікування псоріазу, що включає введення суб'єктові терапевтично ефективної кількості сполуки формули (І) за будь-яким одним з пп. 1-13 або її фармацевтично прийнятної солі або фармацевтично прийнятного сольвату згаданої сполуки або солі.
Текст
Реферат: Представлений винахід стосується сполук формули (І) UA 108442 C2 (12) UA 108442 C2 X (CH2)n R 3 N N NH R HO N 1 N H R 2 (I) їх фармацевтично прийнятних солей і фармацевтично прийнятних сольватів згаданих сполук і солей, де замісники визначені в цьому документі; композицій, що містять такі сполуки; та використання таких сполук в лікуванні різноманітних захворювань, зокрема астми та ХОЗЛ. UA 108442 C2 5 10 15 20 25 30 35 40 45 50 55 60 Представлений винахід стосується індазолу, фармацевтичних композицій, що містять такі сполуки та їх використання як медикаментів. Зокрема, представлений винахід забезпечує похідні 6-феніл-1H-індазолу, які є інгібіторами Янус-кінази (JAK) і придатні для лікування алергічних і респіраторних станів, зокрема хронічного обструктивного захворювання легенів. Хронічне обструктивне захворювання легенів (ХОЗЛ) знаходиться на четвертому місці серед провідних причин смерті в США і характеризується обструкцією дихальних шляхів, яка не повністю зворотна під дією бронхолітичних засобів. Обмеження повітряного потоку, як правило, має неухильно прогресуючий характер і спровоковано аномальною запальною реакцією легенів на подразнення різними патогенними частинками або газами, в першу чергу сигаретним димом. Симптоми типово є пов'язаними з диханням (наприклад, хронічний кашель, задишка при фізичному навантаженні, виділення мокроти і дихання з хрипом). Стани пацієнтів з періодами стійкого захворювання упереміж із запальними загостреннями, в результаті призводять до гострого погіршення функції легенів і до частої госпіталізації. Існуючі посібники з лікування рекомендують бронхолітичні засоби як основний напрямок медикаментозного лікування ХОЗЛ. Проте, протизапальні інгаляційні кортикостероїди (ICS) і комбіновані продукти бронхолітичний засіб/інгаляційний кортикостероїд є широко використовуваними. При тому, що інгаляційні кортикостероїди дійсно забезпечують деякі переваги відносно короткочасного покращення у функції легенів і частоти загострень, вони не спрямовані на запалення, які важко піддаються лікуванню кортикостероїдами, яке є характерною особливістю цього захворювання і, як припускають відіграє центральну роль в прогресуванні захворювання. Існує наявна потреба медицини в протизапальній терапії ХОЗЛ, яка буде спрямована на складову хронічного запалення і в кінцевому рахунку на забезпечення полегшення симптомів, зниження частоти загострень і зменшення ступеня тяжкості загострення. Рецептор-асоційовані тирозинкінази JAK 1, JAK 2, JAK 3 і тирозинкіназа 2 (TYK2) родини Янус-кіназ (JAK) залучені в передачу сигналу, пов'язану з різними запальними цитокінами. JAK кінази можуть функціонувати як або гетеро-, або гомо-димери, що фосфорилюють STAT транскрипційні фактори, які регулюють транскрипцію запальних генів. Пероральні інгібітори JAK 1/JAK 3, такі як CP-690550 проявляли виражену протизапальну активність в запальних захворюваннях, таких як ревматоїдний артрит і псоріаз. Передбачається, що більшість залежних від JAK цитокінів відіграють центральну роль у патології ХОЗЛ, що викликає взаємодію численних запальних клітин, таких як Т-лімфоцити, нейтрофіли, макрофаги та епітеліальні клітини легенів. Наприклад, JAK 1/JAK 3 гетеродимер відіграє центральну роль у виживаності T-лімфоцитів і активації, при цьому вважається, що JAK 2 є визначальним для регуляції активації нейтрофілів і апоптозу. JAK 1 і JAK 2 відіграють важливу роль в IL-13 опосередкованій передачі сигналу запальної реакції в макрофагах, що припускає перехід гострих запальних подій до хронічного прогресуючого захворювання. Важливо відзначити, що JAK 1, JAK 2 і TYK 2 також відіграють важливу роль в передачі сигналу, опосередкованого IFNγ, цитокіном, пов'язаним з хронічним запаленням, спостережуваним у ХОЗЛ, який моделює активність T клітин, епітеліальних клітин і макрофагів, при цьому, не бувши модельованим кортикостероїдами. Фагоцитоз макрофагами бактерій в легенях у пацієнтів з ХОЗЛ є пониженим, вірогідно в деякій мірі через високі локальні рівні IFNγ. Дослідження in vitro на клітинах, виділених з крові хворого, показали, що інгібітори JAK підвищують ступінь фагоцитозу у присутності IFNγ. Отже, разом з проявом безпосереднього протизапального ефекту, інгібітори JAK можуть також підвищувати здатність легенів підтримувати стерильне середовище. Таким чином, цілком імовірно, інгібітори JAK є корисними в лікуванні ряду запальних захворювань, що включають захворювання легенів, такі як ХОЗЛ, астма і судинне захворювання легенів. Сполуки, які мають широкий спектр інгібувальної активності відносно всіх Янус-кіназ, зокрема, цілком імовірно мають високий протизапальний ефект. Однак, такий профіль селективності може також призвести до небажаних побічних ефектів у великому колі кровообігу, зокрема до анемії і нейтропенії, обумовлених інгібуванням JAK 2. З цього виходить, що для лікування захворювання легенів, особливу перевагу слід надавати інгібіторам JAK, які можуть вводитися шляхом інгаляції і, які інгібують Янус-кінази локально в легенях, без значної системної дії. Таким чином, існує потреба в розробці нових інгібіторів JAK, які є сильними селективними інгібіторами Янус-кіназ з відповідними метаболічною стабільністю і фармакокінетичними властивостями, особливо сполук, які можуть вводитися шляхом інгаляції і є активними в легеневій тканині, і в той же час, які мають слабке системне проникнення або високу системну лабільність. Винахід, таким чином, забезпечує, як втілення E1, сполуку формули (I): 1 UA 108442 C2 3 R X N (CH2)n N NH R HO 5 10 15 20 25 30 35 40 N 1 N H 2 R (I) або її фармацевтично прийнятну сіль, або фармацевтично прийнятний сольват згаданої сполуки або фармацевтично прийнятної солі, де: 1 R означає галоген; 2 R означає C1-C6 алкіл, необов'язково заміщений одним або декількома атомами фтору; X означає зв'язок, -CO- -SO2- або -CH2-; 3 1 1 2 4 R означає Арил , Het або Het , кожен з яких необов'язково заміщений 1 замісником -Y-R 5 та/або 1-4 замісниками, кожен з яких незалежно вибраний з R ; n має значення 1 або 2; 1 Арил означає феніл або нафтил; 1 Het означає (i) 6-членний ароматичний гетероцикл, що містить 1-3 атомів N або (ii) 5членний ароматичний гетероцикл, що містить або (a) 1-4 атомів N, або (b) 1 атом O або S і 0-3 атомів N; 2 Het означає (i) 10-членний біциклічний ароматичний гетероцикл, що містить 1-4 атомів N або (ii) 9-членний біциклічний ароматичний гетероцикл, що містить або (a) 1-4 атомів N, або (b) 1 атом O або S і 0-3 атомів N, або (iii) 8-членний біциклічний ароматичний гетероцикл, що містить (a) 1-4 атомів N або (b) 1 атом O або S і 1-3 N атомів або (c) 2 O атома або S і 0-2 N атомів; Y означає зв'язок або -O-; 4 2 3 R означає Арил або Het ; 5 6 7 8 6 9 9 R означає C1-C6 алкіл, C3-C8 циклоалкіл, галоген, -CN-OR , -NR R , -SR , -SOR , -SO2R , 6 6 6 6 6 7 8 6 9 7 8 6 7 8 COR , -OCOR , -COOR , -NR COR , -CONR R , -NR SO2R , -SO2NR R , -NR CONR R , 6 9 6 7 8 NR COOR або -NR SO2NR R ; 6 R означає H, C1-C6 алкіл або C3-C8 циклоалкіл, згаданий алкіл C1-C6; 7 8 R і R кожен незалежно означає H, C1-C6 алкіл або C3-C8 циклоалкіл, або взяті разом з атомом азоту, до якого вони приєднані, можуть утворювати насичене 4-, 5- або 6-членне гетероциклічне кільце, що містить 1-2 атоми азоту або 1 атом азоту і 1 кисню, де згадане гетероциклічне кільце необов'язково заміщене однією або декількома C 1-C6 алкільними або C3C8 циклоалкільними групами; 9 R означає C1-C6 алкіл або C3-C8 циклоалкіл; 2 Арил означає феніл або нафтил, де згаданий феніл і нафтил необов'язково заміщені 1-5 6 7 8 6 замісниками, вибраними з C1-C6 алкілу, C3-C8 циклоалкілу, галогену, -CN-OR , -NR R , -SR , 9 9 6 6 6 6 6 7 8 6 9 7 8 SOR , -SO2R , -COR , -OCOR , -COOR , -NR COR , -CONR R , -NR SO2R , -SO2NR R , 6 7 8 6 9 6 7 8 NR CONR R , -NR COOR і -NR SO2NR R ; та 3 Het означає насичений або частково насичений моноциклічний 3-8-членний гетероцикл, що містить 1 або 2 гетероатомів, вибраних з O і N, де згаданий гетероцикл необов'язково 6 заміщений 1-5 замісниками, вибраними з C1-C6 алкілу, C3-C8 циклоалкілу, галогену, оксо, -OR , 7 8 6 9 9 6 6 6 6 6 7 8 6 9 NR R , -SR , -SOR , -SO2R , -COR , -OCOR , -COOR , -NR COR , -CONR R , -NR SO2R , 7 8 6 7 8 6 9 6 7 8 SO2NR R , -NR CONR R , -NR COOR і -NR SO2NR R . Винахід також забезпечує як втілення E2, сполуку формули (I), або її фармацевтично прийнятну сіль, або фармацевтично прийнятний сольват згаданої сполуки або фармацевтично 2 3 1 прийнятної солі, де R , n, X і R мають значення, як визначено у втіленні E1, і R означає фтор. 2 UA 108442 C2 5 10 15 20 25 30 35 40 45 50 55 Винахід також забезпечує як втілення E3, сполуку формули (I), або її фармацевтично прийнятну сіль, або фармацевтично прийнятний сольват згаданої сполуки або фармацевтично 1 3 прийнятної солі, де R має значення, як визначено або у втіленні E1, або E2, n, X і R мають 2 значення, як визначено у втіленні E1, і R означає –CH2CH3 або –CH2CF3. Винахід також забезпечує як втілення E4, сполуку формули (I), або її фармацевтично прийнятну сіль, або фармацевтично прийнятний сольват згаданої сполуки або фармацевтично 1 2 прийнятної солі, де R має значення, як визначено або у втіленні E1, або E2, R має значення, 3 як визначено або у втіленні E1, або E3, X і R мають значення, як визначено у втіленні E1, і n має значення 1 Винахід також забезпечує як втілення E5, сполуку формули (I), або її фармацевтично прийнятну сіль, або фармацевтично прийнятний сольват згаданої сполуки або фармацевтично 1 2 прийнятної солі, де R має значення, як визначено або у втіленні E1, або E2, R має значення, 3 як визначено або у втіленні E1, або E3, X і R мають значення, як визначено у втіленні E1, і n має значення 2. Винахід також забезпечує, як втілення E6, сполуку формули (I), або її фармацевтично прийнятну сіль, або фармацевтично прийнятний сольват згаданої сполуки або фармацевтично 1 2 прийнятної солі, де R має значення, як визначено або у втіленні E1, або E2, R має значення, як визначено або у втіленні E1, або E3, n має значення, визначене в будь-якому одному з 3 втілень E1, E4 або E5, R має значення, як визначено у втіленні E1, і X означає зв'язок. Винахід також забезпечує як втілення E7, сполуку формули (I), або її фармацевтично прийнятну сіль, або фармацевтично прийнятний сольват згаданої сполуки або фармацевтично 1 2 прийнятної солі, де R має значення, як визначено або у втіленні E1, або E2, R має значення, як визначено або у втіленні E1, або E3, n має значення, визначене в будь-якому одному з 3 втілень E1, E4 або E5, R має значення, як визначено у втіленні E1, і X означає -CO-. Винахід також забезпечує як втілення E8, сполуку формули (I), або її фармацевтично прийнятну сіль, або фармацевтично прийнятний сольват згаданої сполуки або фармацевтично 1 2 прийнятної солі, де R має значення, як визначено або у втіленні E1, або E2, R має значення, як визначено або у втіленні E1, або E3, n має значення, визначене в будь-якому одному з 3 втілень E1, E4 або E5, R має значення, як визначено у втіленні E1, і X означає -CH2-. Винахід також забезпечує, як втілення E9, сполуку формули (I), або її фармацевтично прийнятну сіль, або фармацевтично прийнятний сольват згаданої сполуки або фармацевтично 1 2 прийнятної солі, де R має значення, як визначено або у втіленні E1, або E2, R має значення, як визначено або у втіленні E1, або E3, n має значення, визначене в будь-якому одному з 3 втілень E1, E4 або E5, R має значення, як визначено у втіленні E1, і X означає -SO2-. Винахід також забезпечує як втілення E10, сполуку формули (I), або її фармацевтично прийнятну сіль, або фармацевтично прийнятний сольват згаданої сполуки або фармацевтично 1 2 прийнятної солі, де R має значення, як визначено або у втіленні E1, або E2, R має значення, як визначено або у втіленні E1, або E3, n має значення, як визначено в будь-якому одному з втілень E1, E4 або E5, X має значення, як визначено в будь-якому одному з втілень E1, E6, E7, 3 E8 або E9, і R означає феніл, тіазоліл, хінолініл, піримідиніл, [1,8]нафтиридиніл або піридил, 4 кожен з яких необов'язково заміщений 1 замісником -Y-R і 1-4 замісниками, кожен з яких 5 незалежно вибраний з R . Винахід також забезпечує як втілення E11, сполуку формули (I), або її фармацевтично прийнятну сіль, або фармацевтично прийнятний сольват згаданої сполуки або фармацевтично 1 2 прийнятної солі, де R має значення, як визначено або у втіленні E1, або E2, R має значення, як визначено або у втіленні E1, або E3, n має значення, як визначено в будь-якому одному з втілень E1, E4 або E5, X має значення, як визначено в будь-якому одному з втілень E1, E6, E7, 3 E8 або E9, і R означає феніл, тіазоліл, хінолініл, піримідиніл, [1,8]нафтиридиніл або піридил, кожен з яких необов'язково заміщений 1 замісником, вибраним з піперидинілу, (фторфеніл)окси, фенілокси і морфолінілу, і 1-2 замісниками, кожен з яких незалежно вибраний з фтору, хлору, ціано, метокси і гідрокси. Винахід також забезпечує, як втілення E12, сполуку формули (I), або її фармацевтично прийнятну сіль, або фармацевтично прийнятний сольват згаданої сполуки або фармацевтично 1 2 прийнятної солі, де R має значення, як визначено або у втіленні E1, або E2, R має значення, як визначено або у втіленні E1, або E3, n має значення, як визначено в будь-якому одному з втілень E1, E4 або E5, X має значення, як визначено в будь-якому одному з втілень E1, E6, E7, 3 E8 або E9, і R означає фторфеніл, метоксифеніл, тіазоліл, гідроксифеніл, феніл, хінолініл, [1,8]нафтиридиніл, (піперидиніл) піридил, (піперидиніл) піримідиніл, ((фторфеніл)окси) піримідиніл, (фенілокси) піридил, (морфолініл) піридил, хлорпіридил або ціанопіридил. 3 UA 108442 C2 5 10 Винахід також забезпечує як втілення E13, сполуку формули (I), або її фармацевтично прийнятну сіль, або фармацевтично прийнятний сольват згаданої сполуки або фармацевтично 1 2 прийнятної солі, де R має значення, як визначено або у втіленні E1, або E2, R має значення, як визначено або у втіленні E1, або E3, n має значення, визначене в будь-якому одному з 3 втілень E1, E4 або E5, і -X-R означає (фторфеніл)карбоніл, (тіазоліл)карбоніл, бензил, ((піперидиніл)піримідиніл)карбоніл, ((фенокси)піридил)карбоніл, ((морфолініл)піридил)сульфоніл, ((фенокси)піридил)сульфоніл, (хлорпіридил)карбоніл, (ціанопіридил)карбоніл, (фторфеніл)карбоніл, (тіазоліл)карбоніл, (фторфеніл)сульфоніл, ((фторфенокси)піримідиніл)карбоніл, (хінолініл)метил, (гідроксифеніл)метил, (ціанопіридил)метил, (метоксифеніл)метил, ((фенокси)піридил)метил, ((піперидиніл)піридил)метил, ((ціанопіридил)метил, (фторфеніл)метил або ([1,8]нафтиридиніл)метил. Винахід також забезпечує як втілення E14, сполуку формули: 3 R X N N NH N F N H HO CH3 15 20 25 30 35 40 (Ia) або її фармацевтично прийнятну сіль, або фармацевтично прийнятний сольват згаданої сполуки або фармацевтично прийнятної солі, де X має значення, як визначено в будь-якому 3 одному з втілень E1, E6, E7, E8 або E9, і R має значення, як визначено в будь-якому одному з 3 втілень E1, E10, E11 або E12, або –X-R має значення, як визначено у втіленні E13. Особливо переважні сполуки формули (I) включають: {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо [4,5-c]піридин-5-іл}-(4-фторфеніл)метанон; {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо [4,5-c]піридин-5-іл}ізотіазол-3-іл-метанон; {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо [4,5-c]піридин-5-іл}ізотіазол-3-іл-метанон; {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо [4,5-c]піридин-5-іл}-(5-піперидин-1-іл-піразин-2-іл)метанон; {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо [4,5c]піридин-5-іл}-(6-феноксипіридин-3-іл)метанон; 5-Етил-2-фтор-4-{3-[5-(6-морфолін-4-іл-піридин-3-сульфоніл)-4,5,6,7-тетрагідро-1Hімідазо[4,5-c]піридин-2-іл]-1H-індазол-6-іл}фенол; 5-Етил-2-фтор-4-{3-[5-(6-феноксипіридин-3-сульфоніл)-4,5,6,7-тетрагідро-1H-імідазо [4,5-c]піридин-2-іл]-1H-індазол-6-іл}фенол; (5-Хлорпіридин-2-іл)-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-4,5,7,8тетрагідро-1H-імідазо[4,5-d]азепін-6-іл}метанон; 2-{2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-4,5,7,8-тетрагідро-1H-імідазо[4,5d]азепін-6-карбоніл}ізонікотинонітрил; {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-4,5,7,8-тетрагідро-1H-імідазо [4,5-d]азепін-6-іл}-(4-фторфеніл)метанон; {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-4,5,7,8-тетрагідро-1H-імідазо [4,5-d]азепін-6-іл}ізотіазол-3-іл-метанон; 4 UA 108442 C2 5 10 15 20 25 30 35 40 45 50 55 5-Етил-2-фтор-4-{3-[5-(4-фторбензолсульфоніл)-4,5,6,7-тетрагідро-1H-імідазо [4,5-c]піридин-2-іл]-1H-індазол-6-іл}фенол; {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо [4,5-c]піридин-5-іл}-[5-(2-фторфенокси)піразин-2-іл]метанон; 4-[3-(6-Бензил-1,4,5,6,7,8-гексагідроімідазо[4,5-d]азепін-2-іл)-1H-індазол-6-іл]-5-етил-2фторфенол; (5-Хлорпіридин-2-іл)-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7тетрагідроімідазо[4,5-c]піридин-5-іл}метанон; 5-{2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо [4,5c]піридин-5-карбоніл}піридин-2-карбонітрил; 5-{2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-4,5,7,8-тетрагідро-1H-імідазо[4,5d]азепін-6-карбоніл}піридин-2-карбонітрил; 5-Етил-2-фтор-4-[3-(5-хінолін-6-ілметил-4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин-2-іл)-1Hіндазол-6-іл]фенол; 5-Етил-2-фтор-4-{3-[5-(4-гідроксибензил)-4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин-2-іл]-1Hіндазол-6-іл}фенол; 5-Етил-2-фтор-4-{3-[5-(3-гідроксибензил)-4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин-2-іл]-1Hіндазол-6-іл}фенол; 4-{2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5c]піридин-5-ілметил}піридин-2-карбонітрил; 5-Етил-2-фтор-4-{3-[5-(3-метоксибензил)-4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин-2-іл]-1Hіндазол-6-іл}фенол; 5-Етил-2-фтор-4-[3-(5-хінолін-3-ілметил-4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин-2-іл)-1Hіндазол-6-іл]фенол; 5-Етил-2-фтор-4-{3-[5-(6-феноксипіридин-3-ілметил)-4,5,6,7-тетрагідро-1H-імідазо[4,5c]піридин-2-іл]-1H-індазол-6-іл}фенол; 5-Етил-2-фтор-4-{3-[5-(3,4,5,6-тетрагідро-2H-[1,2']біпіридинил-5'-ілметил)-4,5,6,7-тетрагідро1H-імідазо[4,5-c]піридин-2-іл]-1H-індазол-6-іл}фенол; 3-{2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5c]піридин-5-ілметил}піридин-2-карбонітрил; 5-Етил-2-фтор-4-{3-[5-(4-фторбензил)-4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин-2-іл]-1Hіндазол-6-іл}фенол; 5-Етил-2-фтор-4-[3-(5-[1,8]нафтиридин-2-ілметил-4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин2-іл)-1H-індазол-6-іл]фенол; (2-{6-[5-Фтор-4-гідрокси-2-(2,2,2-трифторетил)феніл]-1H-індазол-3-іл}-1,4,6,7тетрагідроімідазо[4,5-c]піридин-5-іл)-(5-піперидин-1-іл-піразин-2-іл)метанон; (2-{6-[5-Фтор-4-гідрокси-2-(2,2,2-трифторетил)феніл]-1H-індазол-3-іл}-1,4,6,7тетрагідроімідазо[4,5-c]піридин-5-іл)-(4-фторфеніл)метанон; 4-[3-(5-Бензил-4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин-2-іл)-1H-індазол-6-іл]-2-фтор-5(2,2,2-трифторетил)фенол; або їх фармацевтично прийнятні солі, або фармацевтично прийнятні сольвати згаданих сполук або солей. Інші переважні сполуки формули (I) включають: {5-[(2-Диметиламіноетил)метиламіно]піразин-2-іл}-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Hіндазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-c]піридин-5-іл}метанон; {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5c]піридин-5-іл}-[5-(2-піролідин-1-іл-етиламіно)піразин-2-іл]метанон; [5-(2-Диметиламіноетиламіно)піразин-2-іл]-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1H-індазол3-іл]-1,4,6,7-тетрагідроімідазо[4,5-c]піридин-5-іл}метанон; [5-(4-Диметиламінопіперидин-1-іл)піразин-2-іл]-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Hіндазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-c]піридин-5-іл}метанон; {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5c]піридин-5-іл}-{5-[Етил(2-гідроксиетил)аміно]піразин-2-іл}метанон; [5-((R)-3-Диметиламінопіролідин-1-іл)піразин-2-іл]-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Hіндазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-c]піридин-5-іл}метанон; [5-((S)-3-Диметиламінопіролідин-1-іл)піразин-2-іл]-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1Hіндазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-c]піридин-5-іл}метанон; {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7тетрагідроімідазо[4,5c]піридин-5-іл}-[5-(2-піперидин-1-іл-етиламіно)піразин-2-іл]метанон; 5 UA 108442 C2 5 10 15 20 25 30 35 40 45 50 55 60 {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5c]піридин-5-іл}-[5-(2-піперазин-1-іл-етиламіно)піразин-2-іл]метанон; {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-]піридин5-іл}-(4-метил-3,4,5,6-тетрагідро-2H-[1,2']біпіразиніл-5'-іл)метанон; {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5c]піридин-5-іл}-(5-морфолін-4-іл-піразин-2-іл)метанон; {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7тетрагідроімідазо[4,5c]піридин-5-іл}-[5-(4-метилпіперидин-1-іл)піразин-2-іл]метанон; (5-Циклопентиламінопіразин-2-іл)-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]1,4,6,7-тетрагідроімідазо[4,5-c]піридин-5-іл}метанон; {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5c]піридин-5-іл}-[5-(2-морфолін-4-іл-етиламіно)піразин-2-іл]метанон; {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5c]піридин-5-іл}-(4-ізопропіл-3,4,5,6-тетрагідро-2H-[1,2']біпіразиніл-5'-іл)метанон; {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5c]піридин-5-іл}-(5-піролідин-1-іл-піразин-2-іл)метанон; {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-]піридин5-іл}-[5-(етилметиламіно)піразин-2-іл]метанон; (5-Циклогексиламінопіразин-2-іл)-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]1,4,6,7-тетрагідроімідазо[4,5-c]піридин-5-іл}метанон; (5-Диметиламінопіразин-2-іл)-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7тетрагідроімідазо[4,5-c]піридин-5-іл}метанон; (5-Азетидин-1-іл-піразин-2-іл)-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7тетрагідроімідазо[4,5-c]піридин-5-іл}метанон; 2-Фтор-4-{3-[5-(4-фторбензил)-4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин-2-іл]-1H-індазол-6іл}-5-(2,2,2-трифторетил)фенол; 2-Фтор-4-{3-[5-(3,4,5,6-тетрагідро-2H-[1,2']біпіридинил-5'-ілметил)-4,5,6,7-тетрагідро-1Hімідазо[4,5-c]піридин-2-іл]-1H-індазол-6-іл}-5-(2,2,2-трифторетил)фенол; 2-Фтор-4-{3-[5-(6-феноксипіридин-3-ілметил)-4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин-2іл]-H-індазол-6-іл}-5-(2,2,2-трифторетил)фенол; 2-Фтор-4-{3-[5-(4-метоксибензил)-4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин-2-іл]-1Hіндазол-6-іл}-5-(2,2,2-трифторетил)фенол; 2-Фтор-4-{3-[5-(4-гідроксибензил)-4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин-2-іл]-1Hіндазол-6-іл}-5-(2,2,2-трифторетил)фенол; 2-Фтор-4-{3-[5-(3-метоксибензил)-4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин-2-іл]-1Hіндазол-6-іл}-5-(2,2,2-трифторетил)фенол; 2-Фтор-4-{3-[5-(3-гідроксибензил)-4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин-2-іл]-1Hіндазол-6-іл}-5-(2,2,2-трифторетил)фенол; 2-Фтор-4-[3-(5-хінолін-6-ілметил-4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин-2-іл)-1H-індазол6-іл]-5-(2,2,2-трифторетил)фенол; 2-Фтор-4-[3-(5-хінолін-3-ілметил-4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин-2-іл)-1H-індазол6-іл]-5-(2,2,2-трифторетил)фенол; 2-Фтор-4-[3-(5-[1,8]нафтиридин-3-ілметил-4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин-2-іл)1H-індазол-6-іл]-5-(2,2,2-трифторетил)фенол; ((3R, 5S)-3,5-Диметил-3,4,5,6-тетрагідро-2H-[1,2']біпіразиніл-5'-іл)-{2-[6-(2-етил-5-фтор-4гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-c]піридин-5-іл}метанон; {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5c]піридин-5-іл}-((S)-3-метил-3,4,5,6-тетрагідро-2H-[1,2']біпіразиніл-5'-іл)метанон; ((2S, 5R)-2,5-Диметил-3,4,5,6-тетрагідро-2H-[1,2']біпіразиніл-5'-іл)-{2-[6-(2-етил-5-фтор-4гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-c]піридин-5-іл}метанон; {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5-]піридин5-іл}-(3,4,5,6-тетрагідро-2H-[1,2']біпіразиніл-5'-іл)метанон; або їх фармацевтично прийнятні солі, або фармацевтично прийнятні сольвати згаданих сполук або солей. Найбільш переважним є {2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7тетрагідроімідазо[4,5-c]піридин-5-іл}-(5-піперидин-1-іл-піразин-2-іл)метанон або його фармацевтично прийнятна сіль, або фармацевтично прийнятний сольват згаданої сполуки або солі. Представлений винахід також забезпечує: спосіб лікування захворювання, для якого показаний інгібітор JAK, у суб'єкта, що потребує такого лікування, який включає введення 6 UA 108442 C2 5 10 15 20 25 30 35 40 45 50 55 60 суб'єктові терапевтично ефективної кількості сполуки формули (I), або її фармацевтично прийнятної солі, або фармацевтично прийнятного сольвата згаданої сполуки або солі; використання сполуки формули (I), або її фармацевтично прийнятної солі, або фармацевтично прийнятного сольвата згаданої сполуки або солі, для одержання медикаменту для лікування захворювання або стану, для яких показаний інгібітор JAK; сполуку формули (I) або її фармацевтично прийнятну сіль, або їх сольват для використання як медикамент; сполуку формули (I) або її фармацевтично прийнятну сіль, або фармацевтично прийнятний сольват згаданої сполуки або солі для використання в лікуванні захворювання або стану, для яких показаний інгібітор JAK; фармацевтичну композицію, що містить сполуку формули (I), або її фармацевтично прийнятну сіль, або фармацевтично прийнятний сольват згаданої сполуки або солі, і фармацевтично прийнятний ексціпієнт; фармацевтичну композицію для лікування захворювання або стану, для яких показаний інгібітор JAK, що містить сполуку формули (I), або її фармацевтично прийнятну сіль, або фармацевтично прийнятний сольват згаданої сполуки або солі. Захворювання або стан, для яких показаний інгібітор JAK, переважно є алергічним або респіраторним станом, таким як алергічний риніт, закладеність носа, нежить, цілорічний риніт, запальні захворювання порожнини носа, астма всіх типів, хронічне обструктивне захворювання легенів (ХОЗЛ), хронічна або гостра бронхоконстрикція, хронічний бронхіт, обструкція периферичних дихальних шляхів, емфізема, хронічна еозинофільна пневмонія, дистрессиндром у дорослих, загострення надмірної активності дихальних шляхів унаслідок застосування іншої лікарської терапії, судинне захворювання легенів (включаючи легеневу артеріальну гіпертензію), гостре ушкодження легенів, бронхоектаз, синусит, алергічний кон'юнктивіт, ідіопатичний легеневий фіброз або атопічний дерматит, особливо астма або хронічне обструктивне захворювання легенів, найбільш особливо хронічне обструктивне захворювання легенів. Інші захворювання і стани, що представляють інтерес, включають запалення (включаючи нейрозапалення), артрит (включаючи ревматоїдний артрит, спондилоартропатії, артрит при системному еритематозному вовчаку, остеоартрит і подагричний артрит), біль, лихоманку, легеневий саркоїдоз, силікоз, серцево-судинне захворювання (включаючи атеросклероз, інфаркт міокарду, тромбоз, застійну серцеву недостатність і реперфузійне ушкодження серця), кардіоміопатію, інсульт, ішемію, реперфузійне ушкодження, набряк головного мозку, травму головного мозку, нейродегенерацію, захворювання печінки, запальні захворювання кишечника (включаючи хворобу Крону і виразковий коліт), нефрит, ретиніт, ретинопатію, макулярну дегенерацію, глаукому, діабет (включаючи діабет типу 1 і типу 2), діабетичну нейропатію, вірусну і бактерійну інфекцію, міалгію, ендотоксиновий шок, синдром токсичного шоку, аутоімунне захворювання, остеопороз, розсіяний склероз, ендометріоз, менструальні болі, вагініт, кандидоз, рак, фіброз, ожиріння, м'язову дистрофію, поліміозит, хворобу Альцгеймера, гіперемію шкіри, екзему, псоріаз, атопічний дерматит і сонячний опік. Типи астми включають атопічну астму, неатопічну астму, алергічну астму, IgEопосередковану атопічну бронхіальну астму, бронхіальну астму, ідіопатичну астму, власне астму, спадкову астму, викликану патофізіологічними порушеннями, придбану астму, викликану чинниками навколишнього середовища, ідіопатичну астму, викликану невідомими або неясними чинниками, бронхітну астму, емфізематозну форму астми, бронхіальну астму фізичного напруження, бронхіальну астму, викликану алергеном, бронхіальну астму, викликану холодним повітрям, виробничу астму, інфекційну астму, викликану бактерійною, грибковою, протозойною або вірусною інфекціями, неалергічну астму, ранню астму, астматичний синдром у новонароджених і бронхіоліт. Лікування астми включає паліативне лікування з метою вилікувати симптоми і стани астми, такі як свистяче дихання, кашель, задишку, утрудненість дихання, поверхневе або прискорене дихання, роздування крил носа (збільшення розміру отворів носа при утрудненні дихання), втягування (рухи всередину в області шиї і міжреберних проміжків або в області нижче за ребра при утрудненні дихання), ціаноз (сірий або синюшний відтінок шкіри, починаючи з області навколо рота), ринорею або закладеність носа, і головний біль. Представлений винахід також стосується будь-якого використання, способів або композицій, як визначено вище, де сполука формули (I), або її фармацевтично прийнятна сіль, або фармацевтично прийнятний сольват згаданої сполуки або солі, використовується в комбінації з іншою фармакологічно активною сполукою, зокрема з одною з функціонально визначених класів або конкретними сполуками, перерахованими нижче. Як правило, сполуки комбінації вводитимуться разом, як рецептура у поєднанні з одним або декількома фармацевтично прийнятними ексціпієнтами. 7 UA 108442 C2 5 10 15 20 25 30 35 40 45 50 55 60 Придатні агенти для використання в комбінованій терапії із сполукою формули (I), або її фармацевтично прийнятною сіллю, або фармацевтично прийнятним сольватом згаданої сполуки або солі, особливо в лікуванні респіраторного захворювання, включають: антагоніст білка, активуючого 5-ліпоксигеназу (FLAP); антагоніст лейкотрієну (LTRA), такий як антагоніст LTB4, LTC4, LTD4, LTE4, CysLT1 або CysLT2, наприклад, монтелукаст або зафірлукаст; антагоніст рецептора гістаміну, такий як антагоніст рецептора гістаміну 1 типу або антагоніст рецептора гістаміну 2 типу, наприклад, лоратадин, фексофенадин, дезлоратадин, левоцетиризин, метапірилен або цетиризин; агоніст α1-адренорецептора або агоніст α2-адренорецептора, наприклад, фенілефрин, метоксамін, оксиметазолін або метилнорефрин; антагоніст мускаринового рецептора М3, наприклад, тіотропій або іпратропій; здвоєний антагоніст мускаринового рецептора М3/агоніст β2 рецептора; інгібітор ФДЕ, такий як інгібітор ФДЕ3, інгібітор ФДЕ4 або інгібітор ФДЕ5, наприклад, теофілін, силденафіл, варденафіл, тадалафіл, ібудиласт, циломіласт або рофлуміласт; кромоглікат натрію або недокроміл натрію; інгібітор циклооксигенази (COX), такий як неселективний інгібітор (наприклад, аспірин або ібупрофен) або селективний інгібітор (наприклад, целекоксиб або валдекоксиб); глюкокортикостероїд, наприклад, флутиказон, мометазон, дексаметазон, преднізолон, будезонід, циклезонід або бекламетазон; протизапальні моноклональні антитіла, наприклад, інфліксімаб, адалімумаб, танезумаб, ранібізумаб, бевацизумаб або меполізумаб; агоніст β2, наприклад, салметерол, альбутерол, сальбутамол, фенотерол або формотерол, особливо агоніст β2 тривалої дії; антагоніст інтегріну, наприклад, наталізумаб; інгібітори молекул адгезії, такі як антагоніст, VLA-4; антагоніст кінін-B1- або В2-рецептора; імуносупресор, такий як інгібітор метаболічного шляху IGE (наприклад, омалізумаб) або циклоспорин; інгібітор матричної металопротеази (MMP), такий як інгібітор MMP-9 або MMP-12; антагоніст тахікінінового рецептора NK1, NK2 або NK3; інгібітор протеази, такий як інгібітор еластази, хімази або катепсину G; агоніст аденозинового рецептора A2a; антагоніст аденозинового рецептора A2b; інгібітор урокінази; агоніст дофамінового рецептора (наприклад, ропінірол), зокрема, агоніст D2 дофамінового рецептора (наприклад, бромокриптин); модулятор метаболічного шляху NFκB, такий як інгібітор IKK; інший модулятор цитокінового сигнального шляху, такий як інгібітор JAK кінази, syk кінази, p38 кінази, SPHK-1 кінази, Rho кінази, EGF-R або MK-2; муколітик, мукокінетик або засіб проти кашлю; антибіотик; антивірусний засіб; вакцина; хемокін; блокатор епітеліального натрієвого каналу (ENaC) або інгібітор епітеліального натрієвого каналу (ENaC); агоніст нуклеотидного рецептора, такий як агоніст P2Y2; інгібітор тромбоксану; ніацин; інгібітор 5-ліпоксигенази (5-LO), наприклад, Зилейтон; фактор адгезії, такий як VLAM, ICAM або ELAM; антагоніст CRTH2 рецептора (DP2); антагоніст рецептора простагландину D2 (DP1); інгібітор гематопоетичної простагландин-D2-синтази (HPGDS); інтерферон-β; розчинний людський рецептор TNF (фактора некрозу пухлини), наприклад, Етанерцепт; інгібітор HDAC; інгібітор фосфоїнозитид-3-кінази гамма (PI3Kγ); інгібітор фосфоїнозитид-3-кінази дельта (PI3Kδ); 8 UA 108442 C2 5 10 15 20 25 30 35 40 45 50 55 60 антагоніст CXCR-1 або CXCR-2 рецептора; інгібітор IRAK-4; і інгібітор TLR-4 або TLR-9; включаючи фармацевтично прийнятні солі специфічно названих сполук і фармацевтично прийнятні сольвати згаданих специфічно названих сполук і солей. Окрім придатності для лікування людини, сполуки формули (I) також придатні для ветеринарного лікування домашніх тварин, екзотичних тварин і сільськогосподарських тварин. У представленій заявці, наступні скорочення мають значення, викладені нижче: ACOH означає оцтову кислоту; APCI (стосовно мас-спектрометрії) означає хімічну іонізацію при атмосферному тиску; BOP означає гексафторфосфат (бензотриазол-1-ілокси)тріс(диметиламіно)фосфонію; Обчисл. означає обчислені дані елементного аналізу; CDCl3 означає дейтерований хлороформ; CO2Et означає етилкарбоксилат; DCC означає N, N’-дициклогексилкарбодіімід; DCM означає дихлорметан; DEA означає діетиламін; DIAD означає діізопропілазодикарбоксилат; DIEA означає N, N-діізопропілетиламін; DIPEA означає N, N-діізопропілетиламін; DMA означає N, N-диметилацетамід; ДМФ означає диметилформамід; ДМСО-d6 означає повністю дейтерований диметилсульфоксид; EDC/EDCI означає гідрохлорид N-(3-Диметиламінопропіл)-N’-етилкарбодііміду; ES (стосовно мас-спектрометрії) означає іонізацію електророзпилюванням; Et означає етил; EtOAc означає етилацетат Пр. означає Приклад; год. означає година(и); HATU означає гексафторфосфат N, N,N",N’-тетраметил-O-(7-азабензотриазол-1-іл)уронію; HBTU означає гексафторфосфат N, N,N",N’-тетраметил-O-(1H-бензотриазол-1-іл)уронію; HCl означає хлорводневу кислоту; 1 1H ЯМР або H ЯМР означає протонний ядерний магнітний резонанс; HOAt означає 1-гідрокси-7-азабензотриазол; HOBt означає 1-гідроксибензотриазол; ВЕРХ означає високоефективну рідинну хроматографію; H2SO4 означає сірчану кислоту; IPA означає ізопропіловий спирт; iPr означає ізопропіл; K2CO3 означає карбонат калію; KMnO4 означає перманганат калію; KOH означає гідроксид калію; KOAc означає ацетат калію; РХ-МС означає рідинну хроматомас-спектрометрію; МСНР означає мас-спектрометрію з низькою роздільною здатністю; NMM означає 4-метилморфолін; Me означає метил; MECN означає ацетонітрил; MeOD-d4 означає повністю дейтерований метанол; MgSO4 означає сульфат магнію; 2-MeТГФ означає 2-метилтерагідрофуран; хв. означає хвилина(и); МС означає мас-спектроскопію; NaCl означає хлорид натрію; NAH означає гідрид натрію; NBS означає N-бромсукцинімід; NIS означає N-йодсукцинімід; NMP означає N-метилпіролідин; Спост. означає спостережуваний; Pd(OAc)2 означає ацетат паладію(II); 9 UA 108442 C2 5 10 15 20 25 30 35 40 45 50 55 60 ЧУ означає час утримування; SEM-Cl означає (2-хлорметоксиетил)триметилсилан; SPhos означає 2-дициклогексилфосфіно-2",6’-диметоксибіфеніл; STAB означає триацетоксиборогідрид натрію; TBTU означає тетрафторборат O-(бензотриазол-1-іл)-N, N,N",N’-тетраметилуронію; TEA означає триетиламін; TFA означає трифтороцтову кислоту; ТГФ означає тетрагідрофуран; tBME означає 2-метокси-2-метилпропан; p-TSOH означає пара-толуолсульфонову кислоту. Якщо не вказане інше, то наукові і технічні терміни, використовувані в контексті представленого винаходу мають значення, які є цілком зрозумілими фахівцям в даній галузі. Слід розуміти, що фраза "терапевтично ефективний" визначає кількість сполуки або фармацевтичної композиції або об'єднану кількість активних інгредієнтів у випадку комбінованої терапії. Вказана кількість або об'єднана кількість дозволяє досягти мети лікування відповідного стану. Термін "лікування" використовують в цьому документі для опису представленого винаходу і, якщо не вказане інше, він означає введення сполуки, фармацевтичної композиції або комбінації з метою здійснення превентивного, паліативного, підтримуючого, відновного або радикального лікування. Термін лікування охоплює будь-яке об'єктивне або суб'єктивне покращення відносно відповідного стану або захворювання у суб'єкта. Термін "превентивне лікування", використовуваний в цьому документі для опису представленого винаходу, означає, що сполуку, фармацевтичну композицію або комбінацію призначають суб'єктові, щоб усунути або запобігти виникненню відповідного стану у суб'єкта, зокрема у суб'єкта або члена популяції, який в значній мірі має схильність до відповідного стану. Термін "паліативне лікування", використовуваний в цьому документі для опису представленого винаходу, означає, що сполуку, фармацевтичну композицію або комбінацію призначають суб'єктові з метою вилікувати ознаки та/або симптоми стану, необов'язково модифікуючи прогресування відповідного стану або етіологію, що лежить в його основі. Термін "підтримуюча терапія", використовуваний в цьому документі для опису представленого винаходу, означає, що сполуку, фармацевтичну композицію або комбінацію призначають суб'єктові як частину схеми терапії, проте подібна терапія не обмежується введенням сполуки, фармацевтичної композиції або комбінації. Якщо спеціально не вказане інше, підтримуюча терапія може охоплювати превентивне, паліативне, поновлювальне або радикальне лікування, особливо у тому випадку, коли сполуки або фармацевтичні композиції об'єднують з іншими компонентами підтримуючої терапії. Термін "поновлювальне лікування", використовуваний в цьому документі для опису представленого винаходу, означає, що сполуку, фармацевтичну композицію або комбінацію призначають суб'єктові з метою модифікувати розвиток або етіологію стану, що лежать у їх основі. Не обмежуючі приклади включають збільшення об'єму форсованого видиху в секунду (FEV 1) для захворювань легенів, зниження швидкості погіршення функції легенів у динаміці, пригнічення прогресу деструкції нервів, відновлення біомаркерів, які пов'язані і корелюються з захворюваннями або розладами, зниження в рецидивності, покращення якості життя, зниження часу госпіталізації під час випадку гострого нападу, і тому подібне. Термін "радикальне лікування", використовуваний в цьому документі для опису представленого винаходу, означає, що сполуку, фармацевтичну композицію або комбінацію призначають суб'єктові з метою досягнення повної ремісії захворювання або розладу або досягнення того, що захворювання або розлад вже не виявляється після подібного лікування. Термін "селективний", використовуваний в цьому документі для опису функціональновизначеного рецепторного ліганду або інгібітору ферменту, означає селективний для визначеного підтипу рецептора або ферменту, в порівнянні з іншими підтипами рецептора або ферменту в цьому ж сімействі. Наприклад, селективний інгібітор ФДЕ5 є сполукою, яка інгібує фермент ФДЕ5 підтипу більш дієвіше, ніж будь-який інший фермент підтипу ФДЕ. Така селективність є вищою переважно щонайменше в 2 рази (при визначенні з використанням стандартних аналізів зв'язування), переважніше щонайменше в 10 разів, найпереважніше щонайменше в 100 разів. Термін "алкіл", окремо або в комбінації, означає нерозгалужену або розгалужену ациклічну, насичену вуглеводневу групу формули C nH2n+1. Приклади таких груп включають метил, етил, нпропіл, ізопропіл, н-бутил, ізобутил, втор-бутил, трет-бутил, пентил, ізо-аміл і гексил. Якщо не вказане інше, алкільна група містить від 1 до 6 атомів вуглецю. 10 UA 108442 C2 5 10 15 20 25 30 35 40 45 50 55 Вміст атомів вуглецю і різних інших вуглеводнево-вмісних замісників в алкілі позначається за допомогою префіксу, що позначає нижчу і вищу кількість атомів вуглецю в заміснику, тобто, префікс Ci-Cj означає замісник, який містить кількість атомів вуглецю в інтервалі від цілого числа "i" до цілого числа "j", включно. Так, наприклад, C 1-C6 алкіл відноситься до алкілу, що містить від одного до шести атомів вуглецю, включно. Термін "гідрокси", в даному контексті означає радикал OH. 3 Het означає насичений або частково насичений (тобто, неароматичний) гетероцикл і може бути приєднаний за допомогою кільцевого атому азоту (коли гетероцикл приєднується до атому вуглецю) або кільцевого атому вуглецю (у будь-якому випадку). В рівній мірі, коли гетероцикл заміщений, замісник може розташовуватися на кільцевому атомі азоту (якщо замісник з'єднується через атом вуглецю) або на кільцевому атомі вуглецю (у будь-якому випадку). Конкретні приклади включають оксираніл, азиридиніл, оксетаніл, азетидиніл, тетрагідрофураніл, піролідиніл, тетрагідропіраніл, піперидиніл, 1,4-діоксаніл, морфолініл, піперазиніл, азепаніл, оксепаніл, оксазепаніл і діазепініл. 3 Het може бути повністю насиченим або частково ненасиченим, тобто може мати один або більше ненасичених зв'язків, але не може бути повністю ароматичним. 1 Het означає ароматичний гетероцикл і може бути приєднаний через кільцевий атом вуглецю (у будь-якому випадку) або кільцевий атом азоту з відповідною валентністю (коли гетероцикл приєднаний через атом вуглецю). В рівній мірі, коли гетероцикл заміщений, замісник може розташовуватися на кільцевому атомі вуглецю (у будь-якому випадку) або на кільцевому атомі азоту з відповідною валентністю (якщо замісник з'єднується через атом вуглецю). Конкретні приклади включають тієніл, фураніл, піроліл, піразоліл, імідазоліл, оксазоліл, ізоксазоліл, тіазоліл, ізотіазоліл, триазоліл, оксадіазоліл, тіадіазоліл, тетразоліл, піридил, піридазиніл, піримідиніл і піразиніл. 2 Het означає ароматичний гетероцикл і може бути приєднаний через кільцевий атом вуглецю (у будь-якому випадку) або кільцевий атом азоту з відповідною валентністю (коли гетероцикл приєднується до атому вуглецю). В рівній мірі, коли гетероцикл заміщений, замісник може розташовуватися на кільцевому атомі вуглецю (у будь-якому випадку) або на кільцевому 2 атомі азоту з відповідною валентністю (якщо замісник з'єднується через атом вуглецю). Het означає ароматичний і, таким чином, обов'язково конденсований біцикл. Конкретні приклади включають імідазо[2,1-b][1,3]тіазоліл, бензофураніл, бензотієніл, індоліл, бензімідазоліл, індазоліл, бензотриазоліл, піроло[2,3-b]піридил, піроло[2,3-c]піридил, піроло[3,2-c]піридил, піроло[3,2-b]піридил, імідазо[4,5-b]піридил, імідазо[4,5-c]піридил, піразоло[4,3-d]піридил, піразоло[4,3-c]піридил, піразоло[3,4-c]піридил, піразоло[3,4-b]піридил, ізоіндоліл, індазоліл, пуриніл, індолізиніл, імідазо[1,2-a]піридил, імідазо[1,5-a]піридил, піразоло[1,5-a]піридил, піроло[1,2-b]піридазиніл, імідазо[1,2-c]піримідиніл, хінолініл, ізохінолініл, цінолініл, хіназолініл, хіноксалініл, фталазиніл, 1,6-нафтиридиніл, 1,7-нафтиридиніл, 1,8-нафтиридиніл, 1,5нафтиридиніл, 2,6-нафтиридиніл, 2,7-нафтиридиніл, піридо[3,2-d]піримідиніл, піридо[4,3d]піримідиніл, піридо[3,4-d]піримідиніл, піридо[2,3-d]піримідиніл, піридо[2,3-d]піразиніл, піридо[3,4-b]піразиніл, піримідо[5,4-d]піримідиніл, піразинo[2,3-b]піразиніл і піримідо[4,5d]піримідин. Термін "циклоалкіл" означає моноциклічну, насичену вуглеводневу групу формули C nH2n-1. Приклади включають циклопропіл, циклобутил, циклопентил, циклогексил і циклогептил. Якщо не вказане інше, циклоалкільная група містить від 3 до 8 атомів вуглецю. Термін "оксо" означає приєднаний подвійним зв'язком кисень. Термін "алкокси" означає радикал, що містить алкільний радикал, зв'язаний з атомом кисню, такий як метоксирадикал. Приклади таких радикалів включають метокси, етокси, пропокси, ізопропокси, бутокси і трет-бутокси. Термін "галоген" означає фтор, хлор, бром або йод. Терміни "сумісне введення", "сумісно введений" і "в комбінації з", використовувані в даному контексті, що відносяться до комбінації сполуки формули (I) та одного або декількох інших терапевтичних засобів, включають наступне: - одночасне введення такої комбінації сполуки формули (I) і додаткового терапевтичного засобу пацієнтові, що потребує лікування, коли такі компоненти виготовляються разом у вигляді єдиної лікарської форми, яка вивільнює вказані компоненти в організмі згаданого пацієнта по суті в один і той же час, - по суті, одночасне введення такої комбінації сполуки формули (I) і додаткового терапевтичного засобу пацієнтові, що потребує лікування, коли такі компоненти виготовляються окремо один від одного у вигляді окремих лікарських форм, які приймаються згаданим 11 UA 108442 C2 5 10 15 20 25 30 35 40 45 50 55 60 пацієнтом по суті в один і той же час, після чого вказані компоненти в організмі згаданого пацієнта вивільнюються суті в один і той же час, - послідовне введення такої комбінації сполуки формули (I) і додаткового терапевтичного засобу пацієнтові, що потребує лікування, коли такі компоненти виготовляються окремо один від одного у вигляді окремих лікарських форм, які приймаються згаданим пацієнтом послідовно одна за одною із значним інтервалом в часі між кожним введенням, після чого вказані компоненти в організмі згаданого пацієнта, вивільнюються по суті в різні проміжки часу; та - послідовне введення такої комбінації сполуки формули (I) і додаткового терапевтичного засобу пацієнтові, що потребує лікування, коли такі компоненти виготовляються разом у вигляді єдиної лікарської форми, яка вивільнює вказані компоненти у контрольований спосіб. Термін "ексціпієнт", використовуваний в даному контексті, описує будь-який інгредієнт, інший ніж сполука формули (I). Вибір ексціпієнта буде в значному ступеню залежати від чинників, таких як конкретний спосіб введення, дії ексціпієнта на розчинність і стабільність, і виду лікарської форми. Термін "ексціпієнт" охоплює розчинник, носій або ад'ювант. Один із шляхів здійснення винаходу полягає у призначенні сполуки формули (I) у формі проліків. Таким чином, певні похідні сполуки формули (I), які самі по собі можуть мати незначну фармакологічну активність або її не мати, можуть при введенні до організму або нанесенні на тіло перетворюватися на сполуку формули (I), що має потрібну активність, наприклад, шляхом гідролітичного розщеплювання, особливо гідролітичного розщеплювання, що промотується ферментом естерази або пептидази. Такі похідні позначаються як "проліки". Додаткова інформація про застосування проліків може бути знайдена в "Pro-drugs as Novel Delivery Systems", Vol. 14, ACS Symposium Series (T. Higuchi і W. Stella) і "Bioreversible Carriers in Drug Design", Pergamon Press, 1987 (Ed. E. B. Roche, American Pharmaceutical Association). Посилання теж може бути зроблене на Nature Reviews/Drug Discovery, 2008, 7, 355 і Current Opinion in Drug Discovery і Development, 2007, 10, 550. Проліки, відповідно до винаходу, можуть, наприклад, бути одержані шляхом заміни відповідних функціональних груп, присутніх у сполуках формули (I) певними фрагментами, відомими для фахівців в даній галузі як "профрагменти", як описано, наприклад, у "Design of Prodrugs" автора H. Bundgaard (Elsevier, 1985). Таким чином, проліки, згідно з винаходом, є (a) похідною естеру або аміду карбонової кислоти в сполуці формули (I); (b) похідною естеру, карбонату, карбамату, фосфату або етеру гідроксильної групи в сполуці формули (I); (c) похідною аміду, іміну, карбамату або аміну аміногрупи в сполуці формули (I); (d) похідними тіоетеру, тіокарбонату, тіокарбамату або сульфіду тіолової групи в сполуці формули (I); або (e) похідною оксиму або іміну карбонільної групи в сполуці формули (I). Деякі конкретні приклади проліків, згідно з винаходом, включають: (i) коли сполука формули (I) містить функціональну групу карбонової кислоти (-COOH), її естер, таку як сполука, в якій водень функціональної групи карбонової кислоти сполуки формули (I), замінений на C1-C8 алкіл (наприклад, етил) або (C1-C8 алкіл) C(=O)OCH2t (наприклад, BuC(=O)OCH2-); (ii) коли сполука формули (I) містить функціональну спиртову групу (-OH), її естер, таку як сполука, в якій водень функціональної спиртової групи сполуки формули (I), замінений на – CO(C1-C8 алкіл) (наприклад, метилкарбоніл) або спирт етерифікують амінокислотою; (iii) коли сполука формули (I) містить функціональну спиртову групу (-OH), її етер, таку як сполука, в якій водень функціональної спиртової групи сполуки формули (I), замінений на (C1-C8 алкіл)C(=O)OCH2- або –CH2OP(=O)(OH)2; (iv) коли сполука формули (I) містить функціональну спиртову групу (-OH), її фосфат, таку як сполука, в якій водень функціональної спиртової групи сполуки формули (I), замінений на – 2+ P(=O)(OH)2 або –P(=O)(ONa)2 або –P(=O)(O-)2Ca ; (v) коли сполука формули (I) містить первинну або вторинну функціональну аміногрупу (-NH2 або –NHR, де R ≠ H), її амід, наприклад, сполука, в якій, залежно від конкретного випадку, один або обидва водні функціональної аміногрупи сполуки формули (I) замінений/замінені на (C1C10)алканоїл –COCH2NH2 або аміногрупу дериватизують амінокислотою; (vi) коли сполука формули (I) містить первинну або вторинну функціональну аміногрупу (NH2 або –NHR, де R ≠ H), її амін, наприклад, сполука, в якій, залежно від конкретного випадку, один або обидва водні функціональної аміногрупи сполуки формули (I) замінений/замінені на – CH2OP(=O)(OH)2. Визначені сполуки формули (I) можуть самі по собі надавати дію як проліки інших сполук формули (I). Можливо також, що дві сполуки формули (I) можуть об'єднуватися у формі проліків. У певних випадках, проліки сполуки формули (I) можуть бути створені за допомогою 12 UA 108442 C2 5 10 15 20 25 30 35 40 45 50 55 60 внутрішнього зв'язку між двома функціональними групами в сполуці формули (I), наприклад, утворенням лактону. Наведені нижче посилання на сполуки формули (I), включають посилання на сполуки самі по собі та їх проліки. Винахід включає такі сполуки формули (I), а також фармацевтично прийнятні солі таких сполук і фармацевтично прийнятні сольвати згаданих сполук і солей. Фармацевтично прийнятні солі сполук формули (I) включають кислотно-адитивні і основні солі. Прийнятні кислотно-адитивні солі одержують із кислот, які утворюють нетоксичні солі. Приклади включають ацетатні, адипатні, аспартатні, бензоатні, безилатні, бикарбонатні/карбонатні, бисульфатні/сульфатні, боратні, камсилатні, цитратні, едизилатні, езилатні, форміатні, фумаратні, глюцептатні, глюконатні, глюкуронатні, гексафторфосфатні, гібензатні, гідрохлоридні/хлоридні, гідробромідні/бромідні, гідройодидні/йодидні, ізетіонатні, лактатні, малатні, малеатні, малонатні, мезилатні, метилсульфатні, нафтилатні, 2-напсилатні, нікотинатні, нітратні, оротатні, оксалатні, пальмітатні, памоатні, фосфатні/гідрофосфатні/дигідрофосфатні, піроглютаматні, сахаратні, стеаратні, сукцинатні, танатні, тартратні, тозилатні та трифторацетатні, солі нафталін-1,5-дисульфонової кислоти та ксинофоатні солі. Прийнятні основні солі одержують із основ, які утворюють нетоксичні солі. Приклади включають солі алюмінію, аргініну, бензатину, кальцію, холіну, діетиламіну, діоламіну, гліцину, лізину, магнію, меглуміну, оламіну, калію, натрію, трометаміну та цинку. Можуть утворюватися також напівсолі кислот і основ, наприклад, гемісульфати і напівсолі кальцію. Для огляду відповідних солей див. Handbook of Pharmaceutical Salts: Properties, Selection, and Use авторів Stahl і Wermuth (WILEY-VCH, 2002). Фармацевтично прийнятні солі сполук формули (I) можуть бути одержані одним або декількома з трьох способів: (i) шляхом взаємодії сполуки формули (I) з необхідною кислотою або основою; (ii) шляхом видалення кислотно- або основно-лабільної захисної групи з відповідного попередника сполуки формули (I) або шляхом розмикання кільця відповідного циклічного попередника, наприклад, лактону або лактаму, з використанням необхідної кислоти або основи; або (iii) шляхом перетворення однієї солі сполуки формули (I) на іншу шляхом взаємодії з відповідною кислотою або основою, або шляхом використання відповідної іонообмінної колонки. Всі три реакції, як правило, здійснюються в розчині. Одержана сіль може бути осаджена з розчину і зібрана фільтруванням, або може бути вилучена випаровуванням розчинника. Ступінь іонізації в одержаній солі може змінюватися від повністю іонізованої до майже неіонізованої солі. Сполуки формули (I) та їх фармацевтично прийнятні солі можуть існувати як у несольватованих, так і у сольватіваних формах. Термін "сольват" використовують в цьому документі для опису молекулярного комплексу, що містить сполуку формули (I) або її фармацевтично прийнятну сіль, та одну або декілька фармацевтично прийнятних молекул розчинника, наприклад етанолу. Термін "гідрат" використовується, коли розчинник є водою. Прийнятою на даний час системою класифікації органічних гідратів є система, яка визначає гідрати з ізольованим сайтом, канальні гідрати і гідрати, координовані іоном металу, - див. Polymorphism in Pharmaceutical Solids автора K. R. Morris (Ed. H. G. Brittain, Marcel Dekker, 1995). Гідрати з ізольованим сайтом є гідратами, в яких молекули води ізольовані від безпосереднього контакту один з одним органічними молекулами, що знаходяться між ними. В канальних гідратах молекули води лежать у каналах кристалічної решітки, де вони знаходяться поряд з іншими молекулами води. У гідратах, координованих іоном металу, молекули води зв'язані з іоном металу. Коли розчинник або вода є міцно зв'язаними, даний комплекс матиме добре визначену стехіометрію, незалежно від вологості. Проте, коли розчинник або вода є слабо зв'язаними, як у канальних сольватах і гігроскопічних сполуках, вміст води/розчинника залежатиме від вологості та умов сушіння. У таких випадках нестехіометричні кількості будуть нормою. Також включеними в об'єм даного винаходу є багатокомпонентні комплекси (відмінні від солей і сольватів), де лікарський засіб і щонайменше один інший компонент присутні в стехіометричних або нестехіометричних кількостях. Комплекси цього типу включають клатрати (комплекси включення лікарський засіб-хазяїн) і співкристали. Останні, зазвичай визначають як кристалічні комплекси нейтральних молекулярних компонентів, які зв'язані один з одним через нековалентні взаємодії, але вони також могли б бути комплексом нейтральної молекули з сіллю. Співкрістали можна одержати кристалізацією з розплаву, перекристалізацією з розчинників або 13 UA 108442 C2 5 10 15 20 25 30 35 40 45 50 55 60 шляхом фізичного розтирання компонентів один з одним - див. Chem Commun, 17, 1889-1896, O. Almarsson, M.J. Zaworotko (2004). Що стосується загального огляду багатокомпонентних комплексів, див. J Pharm Sci, 64 (8), 1269-1288, by Haleblian (August 1975). Сполуки представленого винаходу можуть існувати у великій різноманітності твердих станів, що варіюються від повністю аморфних до повністю кристалічних. Поняття "аморфний" відноситься до стану, при якому речовина не має дальнього порядку структури на молекулярному рівні і залежно від температури може проявляти фізичні властивості твердої речовини або рідини. Зазвичай подібні речовини не дають характерної рентгенограми і, проявляючи одночасно властивості твердої речовини, формальніше описуються як рідина. При нагріванні відбувається зміна від властивостей твердої речовини до властивостей рідини, яка характеризується зміною стану, типово другого порядку ("склування"). Поняття "кристалічний" відноситься до твердого стану, при якому речовина має регулярну впорядковану внутрішню структуру на молекулярному рівні і дає характерну рентгенограму з визначеними піками. Подібні речовини при достатньому нагріванні також проявлятимуть властивості рідини, а зміна від твердої речовини до рідини характеризується фазовим переходом, зазвичай першого порядку ("температура плавлення"). Сполуки формули (I) можуть також існувати в мезоморфному стані (мезофаза або рідкий кристал) при піддаванні дії відповідних умов. Мезоморфним станом являє собою проміжний стан між істинним кристалічним станом і істинним рідким станом (або розплавом, або розчином). Мезоморфізм, що виникає в результаті зміни температури, описують як "термотропний", а мезоморфізм, що відбувається в результаті додавання другого компонента, такого як вода або інший розчинник, описують як "ліотропний". Сполуки, які можуть утворювати ліотропні мезофази, описують як "амфіфільні" і складаються з молекул, які містять іонну (таку як + - + + - + -COO Na , -COO K , або -SO3 Na ) або неіонну (таку як -N N (CH3)3) полярну головну групу. Для того, щоб одержати більше інформації див. Crystals and the Polarizing Microscope авторів N. H. Hartshorne і A. Stuart, 4th Edition (Edward Arnold, 1970). Надалі в даній заявці всі посилання на сполуку формули (I) включають посилання на фармацевтично прийнятні солі, сольвати, багатокомпонентні комплекси та їх рідкі кристали, а також на сольвати, багатокомпонентні комплекси і рідкі кристали фармацевтично прийнятних солей цих сполук. Сполуки формули (I) можуть проявляти поліморфізм та/або один або декілька видів ізомерії (наприклад, оптична, геометрична або таутомерна ізомерія). Сполуки формули (I) можуть також бути міченими ізотопами сполуками. Таке варіювання є не явним для сполук формули (I), визначених на основі їх структурних особливостей і, таким чином, рамками винаходу. Сполуки формули (I), що містять один або декілька асиметричних атомів вуглецю, можуть існувати у вигляді двох або більш за стереоізомерів. Коли сполука формули (I) містить алкенільну або алкеніленову групу, можливі геометричні цис/транс (або Z/E) ізомери. Коли структурні ізомери є взаємоперетворюваними через низький енергетичний бар'єр, може мати місце таутомерна ізомерія ("таутомерія"). Це може набувати форму протонної таутомерії в сполуках формули (I), що містять, наприклад, іміно-, кето- або оксимну групу, або так званої таутомерії за валентністю в сполуках, які містять ароматичну групу. Звідси витікає, що окрема сполука може демонструвати більш ніж один тип ізомерії. Фармацевтично прийнятні солі сполук формули (I) можуть також містити протиіон, який є оптично активним (наприклад, d-лактат або l-лізин) або рацемічною сумішшю (наприклад, dlтартрат або dl-аргінін). Цис/транс ізомери можуть бути виділені традиційними методами, добре відомими фахівцям в даній галузі, наприклад, з використанням хроматографії і фракціонованої кристалізації. Традиційні методи одержання/виділення індивідуальних енантіомерів включають хіральний синтез із придатного оптично чистого попередника або розділення рацемату (або рацемату солі або похідної) з використанням, наприклад, хіральної високоефективної рідинної хроматографії (ВЕРХ). Альтернативно, рацемат (або рацемічний попередник) можна піддавати взаємодії з придатною оптично активною сполукою, наприклад спиртом, або у випадку, коли сполука формули (I) містить кислотну або основну групу, з основою або кислотою, такими як 1фенілетиламін або винна кислота. Одержану діастереомерну суміш можна розділити за допомогою хроматографії та/або фракціонованої кристалізації та один або обидва діастереоізомери перетворити на відповідний чистий енантіомер(енантіомери) за допомогою способів, добре відомих фахівцям в даній галузі. Хіральні сполуки формули (I) (та їх хіральні попередники) можна одержати в енантіомерно-збагаченій формі з використанням хроматографії, типово ВЕРХ, на асиметричній смолі, з рухомою фазою, що складається з вуглеводню, типово гептану або гексану, що містить від 0 до 50 об. % изопропанолу, типово від 14 UA 108442 C2 5 10 15 20 25 30 35 40 45 50 55 60 2 до 20 %, і від 0 до 5 об. % алкіламіну, типово 0,1 % діетиламіну. Концентрування елюату надає збагачену суміш. Може бути застосована хіральна хроматографія з використанням суб- і надкритичних рідин. Способи хіральної хроматографії, придатні для використання в деяких втіленнях представленого винаходу, відомі фахівцям в даній галузі (див., наприклад, Smith, Roger M., Loughborough University, Loughborough, UK; Chromatographic Science Series (1998), 75 (Supercritical Fluid Chromatography with Packed Columns), pp. 223-249 і наведені там посилання). У деяких наведених в цьому документі релевантних прикладах, колонки були придбані у Chiral Technologies, Inc, West Chester, Pennsylvania, USA, дочірній компанії Daicel® Chemical Industries, Ltd., Tokyo, Japan. Коли який-небудь рацемат кристалізується, можливі кристали двох різних типів. Першим типом є рацемічна сполука (істинний рацемат), вказаний вище, де утворюється одна гомогенна форма кристала, що містить обидва енантіомери в еквімолярних кількостях. Другий тип є рацемічною сумішшю або конгломератом, де утворюються дві кристалічні форми в еквімолярних кількостях, кожна з яких включає один енантіомер. Хоча обидві кристалічні форми, присутні в рацемічній суміші, мають однакові фізичні властивості, вони можуть мати різні фізичні властивості в порівнянні з істинним рацематом. Рацемічні суміші можна розділити за допомогою стандартних способів, відомих фахівцям в даній області, - див., наприклад, Stereochemistry of Organic Compounds авторів E. L. Eliel і S. H. Wilen (Wiley, 1994). Представлений винахід включає всі фармацевтично прийнятні мічені ізотопами сполуки формули (I), де один або декілька атомів заміщені атомами, що мають таке ж атомне число, але атомна маса або масове число яких відмінні від атомної маси або масового числа, які переважають в природі. Мічені ізотопами сполуки формули (I) зазвичай можна одержати традиційними методиками, відомими фахівцям в даній області, або способами, аналогічними способам, описаним у супровідних Прикладах і Прикладах одержання, використовуючи прийнятний мічений ізотопами реагент замість неміченого реагенту, використаного раніше. Зокрема, атоми водню можуть бути замінені атомами важкого водню, оскільки такі дейтеровані сполуки іноді мають більшу стійкість до метаболізму. Також до об'єму представленого винаходу включені метаболіти сполук формули (I), тобто сполуки, утворені in vivo після введення лікарського засобу, часто окисленням або деалкілуванням. Деякі приклади метаболітів відповідно до представленого винаходу включають: (i) коли сполука формули (I) містить метильну групу, її гідроксиметильну похідну (-CH3 → CH2OH): (ii) коли сполука формули (I) містить алкоксигрупу, її гідроксильну похідну (-OR → -OH); (iii) коли сполука формули (I) містить третинну аміногрупу, її похідну з вторинною аміногрупою (-NRR" → -NHR або –NHR"); (iv) коли сполука формули (I) містить вторинну аміногрупу, її похідну з первинною аміногрупою (-NHR → -NH2); (v) коли сполука формули (I) містить фенільну групу, її фенольну похідну (-Ph → -PhOH); і (vi) коли сполука формули (I) містить амідну групу, її похідну карбонової кислоти (-CONH2 → COOH). Для введення пацієнтові, яким є людина, загальна добова доза сполуки формули (I) типово знаходиться в межах від 0,01 мг до 500 мг, в залежності, звичайно, від способу введення. В іншому втіленні представленого винаходу, загальна добова доза сполуки формули (I) типово знаходиться в межах від 0,1 мг до 300 мг. У наступному втіленні представленого винаходу, загальна добова доза сполуки формули (I) типово знаходиться в межах від 1 мг до 30 мг. Загальну добову дозу можна вводити у вигляді однієї дози або у вигляді роздільних доз, і вона може, на розсуд лікаря, виходити за рамки типових меж, вказаних в цьому документі. Ці дози вказані з розрахунку на середньостатистичну людину з масою тіла від приблизно 65 кг до 70 кг. Лікар з легкістю зможе визначити дози для суб'єктів, маса тіла яких не потрапляє у вказані межі, таких як діти і літні люди. У випадку інгаляторів сухого порошку та аерозолів, одиницю дозування відміряють за допомогою попередньо заповненої капсули, блістера або кишені, або за допомогою системи, в якій застосовується камера з гравіметрично відміряною дозою. Одиниці, що відміряються, відповідно до представленого винаходу типово формують таким чином, щоб вводити відміряну дозу або "пшик", що містить від 1 до 5000 мкг лікарського засобу. Загальна добова доза буде типово знаходиться в межах від 1 мкг до 20 мг, яку можна вводити у вигляді однієї дози або, типовіше, у вигляді роздільних доз протягом доби. Сполуку формули (I) можна вводити в чистому вигляді або у формі фармацевтичної композиції, яка, як активний компонент містить ефективну дозу щонайменше однієї сполуки 15 UA 108442 C2 5 10 15 20 25 30 35 40 45 50 55 60 представленого винаходу, на додаток до стандартних фармацевтично нешкідливих ексціпієнтів та/або добавок. Фармацевтичні композиції, придатні для доставки сполук, згідно з винаходом, і способи їх приготування є цілком очевидними для фахівців. Подібні композиції і способи їх одержання можна знайти, наприклад, у Remington's Pharmaceutical Sciences, 19th Edition (Mack Publishing Company, 1995). Сполуки формули (I) можуть призначатися перорально. Пероральне введення може включати проковтування, так що сполука потрапляє до шлунково-кишкового тракту, або ж може використовуватися букальне або сублінгвальне введення, за допомогою якого сполука із порожнини рота відразу ж потрапляє до кров'яного потоку. Склади, придатні для перорального введення, включають тверді склади, такі як таблетки, капсули, що містять частинки, рідини або порошки, пастилки (включаючи наповнені рідиною пастилки), жувальні гумки, мульти- і наночастинки, гелі, тверді розчини, ліпосоми, плівки, облатки, спреї та рідкі склади. Рідкі склади включають суспензії, розчини, сиропи та еліксири. Подібні склади можуть використовуватися як наповнювачі в м'яких або твердих капсулах і, як правило, включають носій, наприклад воду, етанол, поліетиленгліколь, пропіленгліколь, метилцелюлозу, або придатну олію і один або декілька емульгаторів та/або суспендувальних агентів. Рідкі склади можна також приготувати відновленням з твердої речовини, наприклад з пакетика-саше. Сполуки формули (I) можуть використовуватися у вигляді швидко-розчинних лікарських форм, лікарських форм, що швидко розпадаються на частини, таких як лікарські форми, описані в документі Expert Opinion in Therapeutic Patents, 11 (6), 981-986, авторів Liang і Chen (2001). Для таблетованих лікарських форм у залежності від дози лікарський засіб складає від 1 до 80 мас. % від маси лікарської форми, типовіше складає від 5 до 60 мас. % від маси лікарської форми. Окрім лікарського засобу, таблетки в загальному випадку містять розпушувач. Приклади розпушувачів включають натрію крохмальгліколят, натрій- карбоксиметилцелюлозу, кальційкарбоксиметилцелюлозу, кроскармелозу натрію, кросповідон, полівінілпіролідон, метилцелюлозу, мікрокристалічну целюлозу, заміщену нижчими алкілами гідроксипропілцелюлозу, крохмаль, попередньо желатинізований крохмаль та альгінат натрію. В загальному випадку розпушувач складає від 1 до 25 мас. %. У одному варіанті здійснення представленого винаходу розпушувач складає від 5 до 20 мас. % від маси лікарської форми. Зв'язувальні речовини, зазвичай використовують, щоб додати складам таблеток здібність до зчеплення. Придатні зв'язувальні речовини включають мікрокристалічну целюлозу, желатин, цукри, поліетиленгліколь, природні і синтетичні смоли, полівінілпіролідон, попередньо желатинізований крохмаль, гідроксипропілцелюлозу і гідроксипропілметилцелюлозу. Таблетки можуть також містити розчинники, такі як лактоза (моногідрат, осушений розпилюванням моногідрат, безводна лактоза і тому подібне), маніт, ксиліт, декстроза, цукроза, сорбіт, мікрокристалічна целюлоза, крохмаль і гідрат двоосновного фосфату кальцію. Таблетки можуть також включати поверхнево-активні речовини, такі як лаурилсульфат натрію і полісорбат 80, і гліданти, такі як діоксид кремнію і тальк. Якщо вони присутні, поверхнево-активні речовини можуть складати від 0,2 до 5 мас. % від маси таблетки, а гліданти можуть складати від 0,2 від 1 мас. % таблетки. Таблетки в загальному випадку можуть також включати лубриканти, такі як стеарат магнію, стеарат кальцію, стеарат цинку, стеарилфумарат натрію і суміші стеарату магнію і лаурилсульфату натрію. Лубриканти в загальному випадку складають від 0,25 до 10 мас. %. У одному варіанті здійснення представленого винаходу лубриканти складають від 0,5 до 3 мас. % від маси таблетки. Інші можливі інгредієнти включають антиоксиданти, барвники, ароматизатори, консерванти і речовини, що маскують смак. Приклади складів таблеток містять аж до приблизно 80 мас. % лікарського засобу, від приблизно 10 до приблизно 90 мас. % зв'язувальної речовини, від приблизно 0 до приблизно 85 мас. % розбавника, від приблизно 2 до приблизно 10 мас. % розпушувача і від приблизно 0,25 до приблизно 10 мас. % лубриканта. Суміші для приготування таблеток можна спресувати безпосередньо або за допомогою вальців, одержуючи таблетки. Як альтернатива суміші для приготування таблеток або частини сумішей перед таблетуванням можна піддати вологому гранулюванню, сухому гранулюванню або гранулюванню в розплаві, застосувати метод застигання розплаву або екструзію. Кінцевий склад може включати один або декілька шарів і може мати покриття або не мати покриття; він може бути також інкапсульованим. Склади для таблеток наводяться в документі Pharmaceutical Dosage Forms: Tablets, Vol. 1, авторів H. Lieberman і L. Lachman (Marcel Dekker, New York, 1980). Плівки для перорального введення для людей або для використання у ветеринарії, як правило, є легкорозчинними у воді або тонкоплівковими лікарськими формами, які легко набухають у воді, які можуть бути швидко розчинними або мукоадгезивними і, як правило, 16 UA 108442 C2 5 10 15 20 25 30 35 40 45 50 55 включають сполуку формули (I), плівкоутворюючий полімер, зв'язувальну речовину, розчинник, зволожуючий засіб, пластифікатор, стабілізатор або емульгатор, модифікатор в'язкості та розчинник. Деякі компоненти складу можуть виконувати більш ніж одну функцію. Плівкоутворюючий полімер може бути вибраний з натуральних полісахаридів, білків або синтетичного гідроколоїду і, як правило, він присутній в діапазоні від 0,01 до 99 мас. %, типовіше в діапазоні від 30 до 80 мас. %. Інші можливі інгредієнти включають антиоксиданти, барвники, ароматизатори і підсилювачі ароматизаторів, консерванти, агенти, що стимулюють виділення слини, охолоджувальні засоби, співрозчинники (включаючи олії), пом'якшувальні речовини, наповнювачі, піногасники, поверхнево-активні речовини та агенти, що маскують смак. Плівки відповідно до представленого винаходу, як правило, готують випарювальним сушінням тонких водних плівок, нанесених на здатну відділятися основу для плівки або папір. Вказану процедуру можна здійснити в сушильній шафі або у тунельній печі, як правило, в комбінованому пристрої для нанесення і сушіння, або методом сублімаційного сушіння або вакуумуванням. Тверді склади для перорального призначення можуть бути приготовані для миттєвого та/або модифікованого вивільнення. Склади для модифікованого вивільнення включають склади для відстроченого, пролонгованого, пульсуючого, контрольованого, направленого або програмованого вивільнення. Прийнятні склади для модифікованого вивільнення, придатні для використання, згідно з даним винаходом, описані в патенті США № 6106864. Детальний опис інших відповідних технологій для вивільнення, таких як високоенергійні дисперсії, а також осмотично активні і покриті оболонкою частинки, можна знайти в документі Pharmaceutical Technology On-line, 25(2), 1-14, Verma et al. (2001). Використання жувальної гумки для здійснення контрольованого вивільнення описане в WO-A-00/35298. Сполуки формули (I) можна також вводити безпосередньо в кров'яний потік, у м'яз або у внутрішній орган. Такі засоби для парентерального введення включають внутрішньовенне, внутрішньоартеріальне, внутрішньочеревинне, внутрішньооболонкове, внутрішньошлуночкове, внутрішньоуретральне, внутрішньогрудинне, внутрішньочерепне, внутрішньом'язове та підшкірне введення. Відповідні пристрої для парентерального введення включають шприци з голками (зокрема з мікроголками), шприци без голок і методи вливання. Сполуки представленого винаходу можна також наносити місцево на шкіру або слизову оболонку, тобто наносити на шкіру або вводити через шкіру. Сполуки формули (I) можна також вводити інтраназально або шляхом інгаляції, як правило, у формі сухого порошку (як індивідуально, так і у вигляді суміші, наприклад, у вигляді сухої суміші з лактозою, або у вигляді порошкоподібних компонентів, наприклад, змішаних з фосфоліпідами, такими як фосфатидилхолін), з інгалятора сухого порошку, у вигляді аерозольного спрею з контейнера під тиском, насосу, спрею, пульверизатора (переважно пульверизатора, що використовує метод електродинаміки для одержання дрібнодисперсного аерозолю) або аерозольного інгалятора, як з використанням, так і без використання придатного газу-витискувача, такого як 1,1,1,2-тетрафторетан або 1,1,1,2,3,3,3-гептафторпропан, або у вигляді крапель для носа. Для інтраназального використання порошок може містити біоадгезивний агент, такий як, наприклад, хітозан або циклодекстрин. Доставка за допомогою інгаляції є переважним шляхом введення для сполуки представленого винаходу. Контейнер під тиском, насос, спрей, пульверизатор або аерозольний інгалятор містить розчин або суспензію сполуки формули (І), які включають, наприклад, етанол, водний етанол або розчин альтернативного агента для диспергування, солюбілізації або пролонгованого вивільнення активної речовини, що витискує газ як розчинник і необов'язкову поверхневоактивну речовину, таку як триолеат сорбітану, олеїнову кислоту або олігомолочну кислоту. Перед використанням у вигляді сухого порошку або суспензії лікарський продукт подрібнюють до частинок, розміри яких придатні для доставки шляхом інгаляції (зазвичай менше ніж 5 мікронів). Цього можна досягти, використовуючи будь-який придатний спосіб подрібнення, такий як у спіральному вихровому млині, вихровому млині з псевдозрідженим шаром, надкритичною обробкою з одержанням наночастинок, гомогенізацією при високому тиску або сушінням розпилюванням. Капсули (виготовлені, наприклад, з желатину або гідроксипропілметилцелюлози), прозорі упаковки і картриджи для використання в інгаляторі або інсуфляторі можуть бути виготовлені таким чином, щоб вони містили суміш порошків сполуки представленого винаходу, придатної порошкоподібної основи, такої як лактоза або крохмаль, і модифікуючих добавок, таких як lлейцин, маніт або стеарат магнію. Лактоза може бути в безводній формі або у формі моногідрату, останній є переважним. Інші відповідні наповнювачі включають декстран, глюкозу, мальтозу, сорбіт, ксиліт, фруктозу, цукрозу і трегалозу. 17 UA 108442 C2 5 10 15 20 25 30 35 40 45 Придатний склад у вигляді розчину для застосування в пульверизаторі з використанням електродинаміки з метою одержання дрібнодисперсного аерозолю може містити від 1 мкг до 20 мг сполуки представленого винаходу за одне приведення пристрою в дію, і об'єм при приведенні пристрою в дію може варіюватися від 1 мкл до 100 мкл. Типовий склад може включати сполуку формули (І), пропіленгліколь, стерильну воду, етанол і хлорид натрію. Альтернативні розчинники, які можуть використовуватися замість пропіленгліколю, включають гліцерин і поліетиленгліколь. До складів, згідно з даним винаходом, призначених для інтраназального введення, можуть додаватися відповідні ароматизатори, такі як ментол або левоментол, або підсолоджувачі, такі як сахарин або сахарин натрію. Склади для інтраназального введення можуть бути виготовлені для миттєвого та/або модифікованого вивільнення з використанням, наприклад, PGLA. Склади для модифікованого вивільнення включають склади для відстроченого, пролонгованого, пульсуючого, контрольованого, направленого і програмованого вивільнення. Сполуки формули (I) можуть також вводитися безпосередньо до ока або вуха, як правило, у формі крапель мікронізованої суспензії або розчину в ізотонічному стерильному фізіологічному розчині з відкоригованим значенням рН. Сполуки формули (I) можуть об'єднуватися з розчинними макромолекулярними речовинами, такими як циклодекстрин і їх придатними похідними або полімерами на основі поліетиленгліколю з метою покращення їх розчинності, швидкості розчинення, маскування смаку, біодоступності та/або стійкості при використанні в будь-яких вищезгаданих способах введення. Встановлено, що комплекси лікарський засіб-циклодекстрин, наприклад, в загальному випадку придатні для більшості лікарських форм і шляхів введення. Можуть використовуватися як комплекси включення, так і комплекси, що не є комплексами включення. Як альтернатива прямому комплексоутворенню з лікарським засобом, циклодекстрин може застосовуватися як допоміжна добавка, тобто як носій, розбавник або солюбілізатор. Найчастіше в цих цілях використовують альфа-, бета- і гамма- циклодекстрини, приклади яких можуть бути знайдені в публікаціях міжнародних патентних заявок WO-A-91/11172, WO-A94/02518 і WO-A-98/55148. Оскільки може виявитися бажаним вводити активні сполуки в комбінації, наприклад, з метою лікування конкретного захворювання або стану, то відповідно до представленого винаходу дві або декілька фармацевтичних композицій, принаймні одна з яких містить сполуку формули (І), можуть для зручності об'єднуватися у формі набору, придатного для сумісного введення композицій. Таким чином, набір представленого винаходу включає дві або декілька окремих фармацевтичних композицій, принаймні одна з яких містить сполуку формули (I) і засоби для роздільного зберігання вказаних композицій, такі як контейнер, окремі пляшечки або окремі пакетики з фольги. Наприклад, набір є упаковкою типу "блістер", використовуваною для розфасовки таблеток, капсул і тому подібне. Такий набір придатний, зокрема, для введення різних лікарських форм, наприклад пероральних або парентеральних, для введення окремих композицій через різні інтервали дозування або для визначення титру окремих композицій по відношенню одна до одної. З метою полегшення додержання хворим режиму і схем лікування, набір, як правило, містить інструкції для введення і може бути забезпечений так званою пам'яткою. Всі сполуки формули (I) можуть бути одержані за допомогою спеціальних і загальних експериментальних процедур, описаних надалі у поєднанні зі звичайними загальними знаннями фахівця в даній галузі (див., наприклад, Comprehensive Organic Chemistry, Ed. Barton and Ollis, Elsevier; Comprehensive Organic Transformations: A Guide to Functional Group Preparations, 1 2 3 Larock, John Wiley and Sons). У загальних способах, які наведені надалі, R , R , R , X і n мають значення, наведені у втіленні E1, описаному вище, якщо не встановлене інше. Сполуки формули (I) можуть бути одержані взаємодією сполуки формули: 18 UA 108442 C2 H N (CH2)n N NH N 1 R HO 5 10 15 20 25 30 35 40 45 N H 2 R (II) зі сполукою формули: 3 1 R -X-LG (III) 1 де LG означає придатну групу, що відходить, таку як, атом галогену. Реакція типово буде здійснюватися в прийнятному інертному розчиннику у присутності основи, такої як діізопропілетиламін. Коли X являє собою -SO2-, може використовуватися, наприклад, 1 сульфонілхлорид (LG =Cl). У типовій процедурі, розчин сполуки формули (II) в ДМФ обробляють одним еквівалентом сульфонілхлориду і 1 еквівалентом діізопропілетиламіну, і перемішують при кімнатній температурі. Коли X являє собою -CH2-, може використовуватися 1 алкілбромід (LG =Br). У типовій процедурі, розчин сполуки формули (II) в ДМФ обробляють 1,1 0 еквівалентами алкілброміду і 1,1 еквівалентами діізопропілетиламіну і перемішують при 50 C. 1 Коли X являє собою –CO-, може використовуватися хлорид кислоти (LG =Cl). У типовій процедурі, розчин сполуки формули (II) в ДМФ обробляють 1,1 еквівалентами хлориду кислоти і 1,1 еквівалентами діізопропілетиламіну і перемішують при кімнатній температурі. 1 Де X означає карбонільну групу, група LG , що відходить, може бути створена in situ із відповідної карбонової кислоти формули 3 R -CO2H (IV) за допомогою конденсувального реагенту, такого як HATU. У типовій процедурі, розчин сполуки формули (iI) в ДМФ обробляють 1,1 еквівалентами HATU та 1,1 еквівалентами діізопропілетиламіну, і перемішують при кімнатній температурі протягом 30 хвилин. Потім додають еквівалент кислоти формули (IV). Для загального огляду утворення амідного зв'язку, див. Chem. Soc. Rev., 2009, 38(2), 606-631 Де X означає -CH2-, альдегід формули: 3 R -CHO (V) альтернативно може бути конденсований з сполукою формули (II), в умовах відновлення, для забезпечення цільової сполуки формули (I). У типовій процедурі, розчин сполуки формули (II) в ДМФ обробляють 1,5 еквівалентами альдегіду формули (V), 2 еквівалентами діізопропілетиламіну і 1,5 еквівалентами оцтової кислоти, і перемішують при кімнатній температурі протягом однієї години. Потім додають триацетоксиборогідрид натрію (1,5 еквівалентів) і продовжують перемішувати при кімнатній температурі. Сполуки формули (II) можуть бути одержані за допомогою послідовних реакцій конденсації арил-гетероарил- і гетероарил-гетероарил- органометалевих сполук. Один з прикладів можливої послідовності реакцій демонструється в Схемі 1 (PG = захисна група, LG = група, що відходить, M = сполука металу; де проілюстровані множинні захисні групи, які можуть бути однаковими або різними). При проведенні цих реакцій вільні групи NH, як правило, потребуватимуть захисту. Прийнятні захисні групи, їх введення та їх видалення є частиною стандартних загальнодоступних відомостей фахівця в даній галузі – див., наприклад, "Protective Groups in Organic Chemistry" авторів Wuts і Greene (Wiley-Blackwell). Прийнятні умови реакції для різних стадій, необхідні для одержання і взаємодії сполук в Схемі 1, можуть бути знайдені в конкретних Прикладах одержання, викладених нижче. Для загального огляду хімії органометалевої перехресної конденації, див. "Handbook of 19 UA 108442 C2 Organopalladium Chemistry for Organic Synthesis" (Volume 1) editied by Ei-ichi Negishi (John Wiley & Sons). Схема 1 1 1 M R + PG N 2 O R LG 1 N PG (VIII) (IX) PG M N N 1 R PG + N N PG 2 O (CH2)n N R LG PG 1 (VII) (VI) H N (CH2)n N NH N 1 R N H 2 HO 5 R (II) Сполуки формули (I) можуть бути також одержані обробкою сполуки формули: 3 R X N (CH2)n HN N H Y N R1 N HO 2 PG 1 R (X) 20 UA 108442 C2 1 5 кислотою (наприклад, концентрованою хлорводневою кислотою). PG є кислотно-лабільною захисною групою, а C=Y являє собою карбонільну групу або кислотно-лабільну, захищену карбонільну групу (наприклад, кеталь). Реакція зазвичай здійснюється в прийнятному інертному розчиннику при нагріванні. Сполуки формули (X) можуть бути одержані із попередників формули: CN N R1 PG N 2 O PG 1 R (XI) та 3 R X N (CH2)n Y H2N 10 15 20 (XII) Сполуки формули (XI) можуть бути утворені за допомогою реакцій, в яких утворюється арилгетероарильний зв'язок, які обговорювалися вище. Фахівцеві даної галузі буде зрозуміло, що багато сполук формули (I) можуть бути взаємоперетворені шляхом перетворення функціональної групи. Вихідні матеріали, необхідні для здійснення способів, описаних вище, в більшості випадків є комерційно доступними, а в інших випадках можуть бути описані в літературі або в Прикладах одержання, викладених нижче, або можуть бути одержані з використанням процедур, аналогічних, описаним в літературі або в Прикладах одержання, викладених нижче. На додаток до загальних способів, представлених вище, наведені надалі подробиці опису експериментальної частини ілюструють, зокрема, яким чином можуть бути одержані деякі сполуки формули (I). Всі Приклади представляють сполуку формули (I). Приклади одержання і проміжні сполуки придатні для використання в синтезі сполук формули (I). Наступні методи ВЕРХ були використані в дослідженні, наведених нижче Прикладів: Метод A 25 Умови ВЕРХ Колонка Температура Виявлення Об'єм введеної проби Швидкість потоку Рухома фаза Градієнт Аналітичний (QC) GEMINI-NX 3 мкм C18 110A Кімнатна УФ 225 нм - ELSD - МС 5 мкл 1,5 мл/хв. A: H2O+0,1 % ацетат амонію B: MECN+0,1 % ацетат амонію Час (хв.) %B 0 5 0-3,0 5-95 3,0-4,0 95 4,0-4,1 95-5 4,1-5,0 5 21 Препаративна GEMINI-NX 5 мкм C18 21,2 × 100 мм Кімнатна УФ 225 нм - ELSD - МС 1000 мкл 18 мл/хв. A: H2O+0,1 % DEA B: MECN+0,1 % DEA Час (хв.) %B 0-1,0 5 1,0-7,0 5-98 7,0-9,0 98 9,0-9,10 98-5 9,10-10 5 UA 108442 C2 Метод B Умови ВЕРХ Аналітичний (QC) Gemini-NX3 мкм C18 110A Колонка Температура Виявлення Об'єм введеної проби Швидкість потоку Рухома фаза Градієнт Препаративна GEMINI-NX 5 мкм C18 21,1 × 100 мм Кімнатна УФ 225 нм - ELSD – МС 1000 мкл 18 мл/хв. A: H2O+0,1 % мурашина кислота B: MECN+0,1 % мурашина B: MECN+0,1 % мурашина кислота кислота Час (хв.) %B Час (хв.) %B 0 5 початковий 20 0-3,0 5-95 1 20 3,0-4,0 95 5,4 70 4,0-4,1 95-5 6,33 98 4,1-5,0 5 6,4 20 7 20 Кімнатна УФ 225 нм - ELSD – МС 5 мкл 1,5 мл/хв. A: H2O+0,1 % мурашина кислота Метод C 5 Умови ВЕРХ Колонка Температура Виявлення Об'єм введеної проби Швидкість потоку Рухома фаза Градієнт Препаративна Phenomenex Luna C18 5 мкм-100Å 21,2 × 150 мм Кімнатна УФ 254 нм - ELSD - МС 1000 мкл 18 мл/хв. A: H2O+0,05 % мурашина кислота B: MECN+0,05 % мурашина кислота Час (хв.) 0-2,5 2,5-17,5 17,5-22,5 22,5-22,6 22,6-23,0 %B 5 5-95 95 95-5 5 Препаративна Zorbax SB C18 5 мкм-100Å 21,2 × 150 мм Кімнатна УФ 254 нм - ELSD - МС 1000 мкл 20 мл/хв. A: H2O+0,05 % NH4OAc B: MECN+0,05 % NH4OAc Час (хв.) 0-2,5 2,5-17,5 17,5-22,5 22,5-22,6 22,6-23,0 %B 5 5-95 95 95-5 5 Метод D Умови ВЕРХ Колонка Температура Виявлення Об'єм введеної проби Швидкість потоку Рухома фаза Градієнт 10 22 UA 108442 C2 Метод E Умови ВЕРХ Колонка Температура Виявлення Об'єм введеної проби Швидкість потоку Рухома фаза Градієнт Препаративна Luna Феніл-Гексил 5 мкм-100Å 21,2 × 150 мм Кімнатна УФ 254 нм - ELSD - МС 1000 мкл 20 мл/хв. A: H2O+0,05 % NH4OAc B: MECN+0,05 % NH4OAc Час (хв.) 0-2,5 2,5-17,5 17,5-22,5 22,5-22,6 22,6-23,0 %B 5 5-95 95 95-5 5 Метод F 5 Умови ВЕРХ Препаративна Xterra RP18 Колонка Температура Виявлення Об'єм введеної проби Швидкість потоку Рухома фаза Градієнт 19-250 мм Кімнатна УФ 254 нм - ELSD - МС 1000 мкл 16 мл/хв. A: H2O+0,05 % NH4OAc B: MECN+0,05 % NH4OAc Час (хв.) 0-2,5 2,5-17,5 17,5-22,5 22,5-22,6 22,6-25,0 %B 5 5-95 95 95-5 5 Метод G Умови ВЕРХ Колонка Температура Виявлення Об'єм введеної проби Швидкість потоку Рухома фаза Градієнт 10 Препаративна Sunfire C18 30 × 100 мм 5 мкм Кімнатна УФ 254 нм - ELSD - МС 1000 мкл 16 мл/хв. A: H2O+0,05 % NH4OAc B: MECN+0,05 % NH4OAc Час (хв.) 0-2,5 2,5-17,5 17,5-22,5 22,5-22,6 22,6-25,0 %B 5 5-95 95 95-5 5 Приклад 1 {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо [4,5-c]піридин-5-іл}-(4-фторфеніл)метанон 23 UA 108442 C2 5 10 15 20 25 30 35 40 45 50 55 60 До розчину тригідробромідної солі 5-етил-2-фтор-4-[3-(4,5,6,7-тетрагідро-1H-імідазо[4,5c]піридин-2-іл)-1H-індазол-6-іл]фенолу (Приклад одержання 25, 50 мг, 80 мкмоль) в ДМФ (1 мл), додавали HATU (32 мг, 84 мкмоль) і DIPEA (56 мкл, 320 мкмоль). Реакційну суміш перемішували при кімнатній температурі протягом 30 хвилин. До реакційної суміші додавали 4-фторбензойну кислоту (11,2 мг, 80 мкмоль) і продовжували перемішувати протягом 18 годин. До реакційної суміші додавали насичений водний розчин гідрокарбонату натрію (5 мл). Одержану тверду речовину збирали фільтрацією, промивали також насиченим водним розчином гідрокарбонату натрію. Неочищений матеріал очищували за допомогою ВЕРХ, Методу B, одержуючи 7,7 мг вказаної в заголовку сполуки. + РХ-МС (Метод A): ЧУ 2,52 хв. (100 % площа), ES m/z 500,182 [M+H] . Приклад 2 {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо [4,5-c]піридин-5-іл}ізотіазол-3-іл-метанон Вказану в заголовку сполуку одержували із тригідробромідної солі 5-етил-2-фтор-4-[3(4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин-2-іл)-1H-індазол-6-іл]фенолу (Приклад одержання 25, 50 мг, 80 мкмоль) і ізотіазол-3-карбонової кислоти (11 мг, 80 мкмоль) з використанням способу, подібного до описаного в Прикладі 1. Неочищений матеріал очищували за допомогою ВЕРХ, Методу A, одержуючи 7,7 мг вказаної в заголовку сполуки. + РХ-МС (Метод A) ЧУ 2,39 хв. (100 % площа), ES m/z 489,143 [M+H] . Приклад 3 {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо [4,5-c]піридин-5-іл}ізотіазол-3-іл-метанон До розчину N-(1-бензил-4,4-діетоксипіперидин-3-іл)-6-(2-етил-5-фтор-4-гідроксифеніл)-1(тетрагідропіран-2-іл)-1H-індазол-3-карбоксамідину (Приклад одержання 9, 6,06 г, 9,41 ммоль) у етанолі (34 мл) додавали концентровану хлорводневу кислоту (12 M, 15,8 мл, 189 ммоль). 0 Реакційну суміш нагрівали при 65 C протягом 18 годин. Реакційну суміш концентрували у вакуумі і додавали до неї свіжий етанол (34 мл) і концентровану хлорводневу кислоту (12 M, 0 15,8 мл, 189 ммоль). Реакційну суміш нагрівали при 65 C протягом додаткових 4 годин. До 0 реакційної суміші при 65 C додавали воду (20 мл), а потім реакційну суміш залишали повільно охолоджуватися до кімнатної температури. Розчинники видаляли у вакуумі і залишок розподіляли між 2-MeТГФ (200 мл) і насиченим водним розчином гідрокарбонату натрію (100 мл). Органічний шар також промивали насиченим водним розчином гідрокарбонату натрію (100 мл). Об'єднані водні шари повторно екстрагували, з використанням 2-MeТГФ (250 мл). Об'єднані органічні шари сушили над MgSO4 і концентрували у вакуумі, одержуючи піну коричневого кольору. Неочищений матеріал розчиняли в MECN (150 мл) і етанолі (30 мл) і нагрівали при 0 50 C протягом 2 днів. Продукт кристалізували з цього розчину і збирали фільтрацією, і сушили у вакуумі, одержуючи вказану в заголовку сполуку у вигляді кристалічної твердої речовини білого кольору (3,53 г) з 80 % виходом. 1 H ЯМР (400 МГц, CD3OD) δ млн. ч. 1,04 (т, 3H), 2,52 (к, 2H), 2,81 (т, 2H), 2,91 (т, 2H), 3,62 (с, 2H), 3,80 (с, 2H), 6,87 (д, 1H), 6,92 (д, 1H), 7,11 (д, 1H), 7,26-7,43 (м, 6H), 8,22 (д, 1H). + РХ-МС: m/z 468 [M+H] , 466 [M-H] . Приклад 4 {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо [4,5-c]піридин-5-іл}-(5-піперидин-1-іл-піразин-2-іл)метанон До розчину 5-піперидин-1-іл-піразин-2-карбонової кислоти (Приклад одержання 43, 10,7 г, 51,8 ммоль) в ДМФ (200 мл) додавали DIPEA (24,6 мл, 141 ммоль) і HATU (21,5 г, 56,5 ммоль) і одержану суміш перемішували при кімнатній температурі протягом 10 хвилин перед додаванням краплями до суспензії дигідрохлоридной солі 5-етил-2-фтор-4-[3-(4,5,6,7тетрагідро-1H-імідазо[4,5-c]піридин-2-іл)-1H-індазол-6-іл]фенолу (Приклад одержання 11, 19,5 г, 47,1 ммоль) в ДМФ (200 мл) протягом 30 хвилин, використовуючи додаткових 75 мл ДМФ для промивання посудини. Реакційну суміш потім перемішували при кімнатній температурі протягом 18 годин. Додаткову частину 5-піперидин-1-іл-піразин-2-карбонової кислоти (1,07 г, 5,18 ммоль) в ДМФ (40 мл) обробляли з використанням DIPEA (2,46 мл, 14,1 ммоль) і активували, використовуючи HATU (2,15 г, 5,65 ммоль), і одержану суміш перемішували при кімнатній температурі протягом 10 хвилин перед додаванням до початкової реакційної суміші, яку потім перемішували протягом додаткових 4 годин при кімнатній температурі. Реакційну суміш виливали на воду (1,2 л) і коригували розчином гідроксиду натрію значення показника pH до 7. Одержану суспензію перемішували при кімнатній температурі протягом 30 хвилин. Осад збирали фільтрацією, промивали водою (400 мл) і потім сушили під вакуумом. Неочищений матеріал розчиняли в етанолі (113 мл) і обробляли, використовуючи 1M водний розчин 24 UA 108442 C2 5 10 15 20 25 30 35 40 45 50 55 гідроксиду натрію. Реакційну суміш перемішували при кімнатній температурі протягом 18 годин. Осад збирали фільтрацією, промивали холодним розчином 1:3 1 M гідроксиду натрію:етанолу (100 мл) і сушили під вакуумом, одержуючи сіль натрію вказаної в заголовку сполуки, 16,14 г. Одержаний матеріал розчиняли у воді (100 мл) і обробляли 10 % водним розчином лимонної кислоти (10 мл), для коригування значення pH до 4. Додавали декілька крапель 1 M гідроксиду натрію для коригування значення pH до 7. Одержану суспензію перемішували при кімнатній температурі протягом 1 години і тверду речовину збирали фільтрацією, промивали водою і потім сушили під вакуумом, одержуючи вказану в заголовку сполуку у вигляді твердої речовини білого кольору (13,864 г) з 89 % виходом. 1 H ЯМР (400 МГц, ДМСО-d6) δ млн. ч. 0,94 (т, 3H), 1,54-1,60 (м, 2H), 1,60-1,67 (м, 2H), 2,38 (к, 2H), 2,71-2,83 (м, 2H), 3,64-3,71 (м, 4H), 3,85-3,98 (м, 4H), 4,63-4,78 (м, 2H), 6,66 (д, 1H), 6,73 (д, 1H), 7,00-7,08 (м, 1H), 7,16-7,24 (м, 1H), 816-8,25 (м, 1H), 8,29 (с, 1H), 8,37 (с, 1H). + РХ-МС: m/z 567 [M+H] , 565 [M-H] Приклад 5 {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо [4,5-c]піридин-5-іл}-(6-феноксипіридин-3-іл)метанон Вказану в заголовку сполуку одержували із тригідробромідної солі 5-етил-2-фтор-4-[3(4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин-2-іл)-1H-індазол-6-іл]фенолу (Приклад одержання 25, 50 мг, 80 мкмоль) і 6-феноксинікотинової кислоти (17 мг, 80 мкмоль), використовуючи спосіб, розкритий в Прикладі 1. Неочищений матеріал очищували за допомогою ВЕРХ, Методу A, одержуючи 3,1 мг вказаної в заголовку сполуки. + РХ-МС (Метод A): ЧУ 2,67 хв. (100 % площа), ES m/z 575,213 [M+H] . Приклад 6 5-Етил-2-фтор-4-{3-[5-(6-морфолін-4-іл-піридин-3-сульфоніл)-4,5,6,7-тетрагідро-1Hімідазо[4,5-c]піридин-2-іл]-1H-індазол-6-іл}фенол До розчину тригідробромідної солі 5-етил-2-фтор-4-[3-(4,5,6,7-тетрагідро-1H-імідазо[4,5c]піридин-2-іл)-1H-індазол-6-іл]фенолу (Приклад одержання 25, 50 мг, 80 мкмоль) в ДМФ (1 мл), додавали 6-морфолін-4-іл-піридин-3-сульфонілхлорид (21 мг, 80 мкмоль) і DIPEA (56 мкл, 320 мкмоль). Реакційну суміш перемішували при кімнатній температурі протягом 18 годин. Додавали насичений водний розчин гідрокарбонату натрію (5 мл) і одержану тверду речовину збирали фільтрацією, і знову промивали насиченим водним розчином гідрокарбонату натрію. Неочищений матеріал очищували за допомогою ВЕРХ, Методу A, одержуючи 18,7 мг вказаної в заголовку сполуки. РХ-МС (Метод A): ЧУ 2,58 хв. (100 % площа), ES m/z 602,206 [M-H] . Приклад 7 5-Етил-2-фтор-4-{3-[5-(6-феноксипіридин-3-сульфоніл)-4,5,6,7-тетрагідро-1H-імідазо [4,5-c]піридин-2-іл]-1H-індазол-6-іл}фенол Вказану в заголовку сполуку одержували із тригідробромідної солі 5-етил-2-фтор-4-[3(4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин-2-іл)-1H-індазол-6-іл]фенолу (Приклад одержання 25, 50 мг, 80 мкмоль) і 6-феноксипіридин-3-сульфонілхлориду (22 мг, 80 мкмоль), використовуючи спосіб, розкритий в Прикладі 6. Неочищений матеріал очищували за допомогою ВЕРХ, Методу A, одержуючи 8,4 мг вказаної в заголовку сполуки. + РХ-МС (Метод A): ЧУ 2,82 хв. (100 % площа), ES m/z 611,18 [M+H] . Приклад 8 (5-Хлорпіридин-2-іл)-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-4,5,7,8тетрагідро-1H-імідазо[4,5-d]азепін-6-іл}метанон До розчину 5-хлорпіридин-2-карбонової кислоти (13,2 мг, 85 мкмоль) в ДМФ (1 мл) додавали HATU (32 мг, 85 мкмоль) і одержану реакційну суміш перемішували при кімнатній температурі протягом 30 хвилин. Додавали тригідробромідную сіль 5-етил-2-фтор-4-[3-(1,4,5,6,7,8гексагідроімідазо[4,5-d]азепін-2-іл)-1H-індазол-6-іл]фенолу (Приклад одержання 32, 50 мг, 80 мкмоль) і DIPEA (56 мкл, 320 мкмоль), і продовжували перемішувати при кімнатній температурі протягом 18 годин. До реакційної суміші додавали насичений водний розчин гідрокарбонату натрію (5 мл). Одержану тверду речовину збирали фільтрацією і знову промивали насиченим водним розчином гідрокарбонату натрію. Неочищений матеріал очищували за допомогою ВЕРХ, Методу A, одержуючи 20,5 мг вказаної в заголовку сполуки. РХ-МС (Метод A): ЧУ 2,76 хв. (100 % площа), ES m/z 531,163 [M-H] . Приклад 9 2-{2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-4,5,7,8-тетрагідро-1H-імідазо[4,5d]азепін-6-карбоніл}ізонікотинонітрил 25 UA 108442 C2 5 10 15 20 25 30 35 40 45 50 55 60 Вказану в заголовку сполуку одержували із 4-ціанопіридин-2-карбонової кислоти (12,5 мг, 85 мкмоль) і тригідробромідної солі 5-етил-2-фтор-4-[3-(1,4,5,6,7,8-гексагідроімідазо[4,5-d]азепін-2іл)-1H-індазол-6-іл]фенолу (Приклад одержання 32, 50 мг, 80 мкмоль), використовуючи спосіб, розкритий в Прикладі 8. Неочищений матеріал очищували за допомогою ВЕРХ, Методу B, одержуючи 6,5 мг вказаної в заголовку сполуки. + РХ-МС (Метод A): ЧУ 2,66 хв. (100 % площа), ES m/z 522,198 [M+H] . Приклад 10 {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-4,5,7,8-тетрагідро-1H-імідазо [4,5-d]азепін-6-іл}-(4-фторфеніл)метанон Вказану в заголовку сполуку одержували із 4-фторбензойної кислоти (12,5 мг, 85 мкмоль) і тригідробромідної солі 5-етил-2-фтор-4-[3-(1,4,5,6,7,8-гексагідроімідазо[4,5-d]азепін-2-іл)-1Hіндазол-6-іл]фенолу (Приклад одержання 32, 50 мг, 80 мкмоль), використовуючи спосіб, розкритий в Прикладі 8. Неочищений матеріал очищували за допомогою ВЕРХ, Методу B, одержуючи 14,5 мг вказаної в заголовку сполуки. + РХ-МС (Метод A): ЧУ 2,76 хв. (100 % площа), ES m/z 514,198 [M+H] . Приклад 11 {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-4,5,7,8-тетрагідро-1H-імідазо [4,5-d]азепін-6-іл}ізотіазол-3-іл-метанон Вказану в заголовку сполуку одержували із ізотіазол-3-карбонової кислоти (11 мг, 85 мкмоль) і тригідробромідної солі 5-етил-2-фтор-4-[3-(1,4,5,6,7,8-гексагідроімідазо[4,5-d]азепін-2іл)-1H-індазол-6-іл]фенолу (Приклад одержання 32, 50 мг, 80 мкмоль), використовуючи спосіб, розкритий в Прикладі 8. Неочищений матеріал очищували за допомогою ВЕРХ, Методу B, одержуючи 10,3 мг вказаної в заголовку сполуки. + РХ-МС (Метод A): ЧУ 2,54 хв. (100 % площа), ES m/z 503,159 [M+H] . Приклад 12 5-Етил-2-фтор-4-{3-[5-(4-фторбензолсульфоніл)-4,5,6,7-тетрагідро-1H-імідазо [4,5-c]піридин-2-іл]-1H-індазол-6-іл}фенол До розчину тригідробромідної солі 5-етил-2-фтор-4-[3-(4,5,6,7-тетрагідро-1H-імідазо[4,5c]піридин-2-іл)-1H-індазол-6-іл]фенолу (Приклад одержання 25, 50 мг, 80 мкмоль) в ДМФ (1 мл), додавали 4-фторбензолсульфонілхлорид (16 мг, 80 мкмоль) і DIPEA (56 мкл, 320 мкмоль). Реакційну суміш перемішували при кімнатній температурі протягом 4 годин. До реакційної суміші додавали насичений водний розчин гідрокарбонату натрію (5 мл). Одержану тверду речовину збирали фільтрацією і знову промивали насиченим водним розчином гідрокарбонату натрію. Неочищений матеріал очищували за допомогою хроматографії з оберненою фазою (Метод C), одержуючи 7 мг вказаної в заголовку сполуки. 1 H ЯМР (400 МГц, CD3OD) δ млн. ч. 1,02 (т, 3H), 2,52 (к, 2H), 3,78-3,81 (м, 2H), 4,37-4,29 (м, 2H), 6,88-6,96 (м, 2H), 7,15 (д, 1H), 7,32-7,36 (м, 2H), 7,40 (с, 1H), 7,89-7,95 (м, 2H), 8,21 (д, 1H). + РХ-МС: m/z 536 [M+H] . Приклад 13 {2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо [4,5-c]піридин-5-іл}-[5-(2-фторфенокси)піразин-2-іл]метанон До розчину 5-(2-фторфенокси)піразин-2-карбонової кислоти (Приклад одержання 45, 19 мг, 80 мкмоль) в ДМФ (1 мл) додавали HBTU (32 мг, 85 мкмоль) і одержану реакційну суміш перемішували при кімнатній температурі протягом 30 хвилин. Додавали тригідробромідную сіль 5-етил-2-фтор-4-[3-(4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин-2-іл)-1H-індазол-6-іл]фенолу (Приклад одержання 25, 50 мг, 80 мкмоль) і DIPEA (56 мкл, 320 мкмоль), і продовжували перемішувати при кімнатній температурі протягом 18 годин. До реакційної суміші додавали насичений водний розчин гідрокарбонату натрію (5 мл). Одержану тверду речовину збирали фільтрацією і знову промивали насиченим водним розчином гідрокарбонату натрію. Неочищений матеріал очищували за допомогою ВЕРХ, Методу B, одержуючи 8,3 мг вказаної в заголовку сполуки. РХ-МС (Метод A): ЧУ 2,97 хв. (100 % площа), ES m/z 594,199 [M-H] . Приклад 14 4-[3-(6-Бензил-1,4,5,6,7,8-гексагідроімідазо[4,5-d]азепін-2-іл)-1H-індазол-6-іл]-5-етил-2фторфенол До розчину тригідробромідної солі 5-етил-2-фтор-4-[3-(1,4,5,6,7,8-гексагідроімідазо[4,5d]азепін-2-іл)-1H-індазол-6-іл]фенолу (Приклад одержання 32, 50 мг, 80 мкмоль) в ДМФ (1 мл), додавали бензилбромід (14,4 мг, 10 мкл, 85 мкмоль) і DIPEA (56 мкл, 320 мкмоль). Реакційну ° суміш нагрівали при 50 C протягом 18 годин. Реакційну суміш потім охолоджували до кімнатної температури і розподіляли між EtOAc (50 мл) і водою (50 мл). Органічний шар промивали 26 UA 108442 C2 5 10 15 20 25 30 35 40 45 50 55 60 насиченим розчином хлориду натрію (50 мл), сушили над сульфатом натрію і концентрували у вакуумі, одержуючи олію коричневого кольору. Неочищений матеріал очищували за допомогою хроматографії з оберненою фазою (Метод C), одержуючи 4 мг вказаної в заголовку сполуки. 1 H ЯМР (400 МГц, CD3OD) δ млн. ч. 1,02 (т, 3H), 2,55 (к, 2H), 3,08-3,11 (м, 4H), 3,34-3,38 (м, 4H), 4,23 (с, 2H), 6,88-6,94 (м, 2H), 7,18 (д, 1H), 7,41-7,4 (м, 3H), 7,52-7,55 (м, 2H), 8,20 (д, 1H), 8,39 (ш с, 1H). + РХ-МС: m/z 482 [M+H] , 480 [M-H] . Приклад 15 (5-Хлорпіридин-2-іл)-{2-[6-(2-етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7тетрагідроімідазо[4,5-c]піридин-5-іл}метанон До розчину 5-хлорпіридин-2-карбонової кислоти (12 мг, 80 мкмоль) в ДМФ (1 мл) додавали HBTU (32 мг, 85 мкмоль) і одержану реакційну суміш перемішували при кімнатній температурі протягом 30 хвилин. Додавали тригідробромідную сіль 5-етил-2-фтор-4-[3-(4,5,6,7-тетрагідро1H-імідазо[4,5-c]піридин-2-іл)-1H-індазол-6-іл]фенолу (Приклад одержання 25, 50 мг, 80 мкмоль) і DIPEA (56 мкл, 320 мкмоль), і продовжували перемішувати при кімнатній температурі протягом 18 годин. До реакційної суміші додавали насичений водний розчин гідрокарбонату натрію (5 мл). Одержану тверду речовину збирали фільтрацією і знову промивали насиченим водним розчином гідрокарбонату натрію. Неочищений матеріал очищували за допомогою хроматографії з оберненою фазою (Метод C), одержуючи 3,3 мг вказаної в заголовку сполуки. 1 H ЯМР (400 МГц, CD3OD) δ млн. ч. 1,02 (т, 3H), 2,52 (к, 2H), 2,88-2,96 (м, 2H), 3,79-3,82 (м, 2H), 4,15-4,19 (м, 2H), 6,82-6,96 (м, 2H), 7,08-7,18 (м, 1H), 7,39-7,41 (м, 1H), 7,69-7,71 (м, 1H), 7,99-8,01 (м, 1H), 8,19-8,21 (д, 1H), 8,38-8,42 (м, 1H). + РХ-МС: m/z 517 [M+H] , 515 [M-H] . Приклад 16 5-{2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо [4,5-c]піридин-5-карбоніл}піридин-2-карбонітрил До розчину тригідробромідної солі 5-етил-2-фтор-4-[3-(4,5,6,7-тетрагідро-1H-імідазо[4,5c]піридин-2-іл)-1H-індазол-6-іл]фенолу (Приклад одержання 25, 50 мг, 80 мкмоль) в ДМФ (1 мл), додавали 6-ціанонікотиноїлхлорид (Приклад одержання 46, 17 мг, 96 мкмоль) і DIPEA (56 мкл, 320 мкмоль). Реакційну суміш перемішували при кімнатній температурі протягом 72 годин і потім додавали насичений водний розчин гідрокарбонату натрію (5 мл). Одержану тверду речовину збирали фільтрацією і знову промивали насиченим водним розчином гідрокарбонату натрію. Неочищений матеріал очищували за допомогою хроматографії з оберненою фазою (Метод C), одержуючи 6,9 мг вказаної в заголовку сполуки. 1 H ЯМР (400 МГц, CD3OD) δ млн. ч. 1,02 (т, 3H), 2,52 (к, 2H), 2,85-2,98 (м, 2H), 3,75-3,79 (м, 2H), 4,15-4,19 (м, 2H), 6,82-6,96 (м, 2H), 7,08-7,18 (м, 1H), 7,38-7,40 (м, 1H), 8,00 (д, 1H), 8,158,20 (м, 2H), 8,22 (д, 1H). + РХ-МС: m/z 508 [M+H] , 506 [M-H] . Приклад 17 5-{2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-4,5,7,8-тетрагідро-1H-імідазо[4,5d]азепін-6-карбоніл}піридин-2-карбонітрил До розчину тригідробромідної солі 5-етил-2-фтор-4-[3-(1,4,5,6,7,8-гексагідроімідазо[4,5d]азепін-2-іл)-1H-індазол-6-іл]фенолу (Приклад одержання 32, 28 мг, 44 мкмоль) в ДМФ (1 мл) додавали 6-ціанонікотиноїлхлорид (Приклад одержання 46, 20,9 мг, 141 мкмоль) і DIPEA (31 мкл, 176 мкмоль). Реакційну суміш перемішували при кімнатній температурі протягом 18 годин і потім додавали насичений водний розчин гідрокарбонату натрію (5 мл). Одержану тверду речовину збирали фільтрацією і знову промивали насиченим водним розчином гідрокарбонату натрію. Неочищений матеріал очищували за допомогою ВЕРХ, Методу A, одержуючи 10,3 мг вказаної в заголовку сполуки. РХ-МС (Метод A): ЧУ 2,69 хв. (100 % площа), ES m/z 522,198 [M-H] . Приклад 18 5-Етил-2-фтор-4-[3-(5-хінолін-6-ілметил-4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин-2-іл)-1Hіндазол-6-іл]фенол До розчину тригідробромідної солі 5-етил-2-фтор-4-[3-(4,5,6,7-тетрагідро-1H-імідазо[4,5c]піридин-2-іл)-1H-індазол-6-іл]фенолу (Приклад одержання 25, 50 мг, 132 мкмоль) в ДМФ (1 мл), додавали хінолін-6-карбальдегід (31 мг, 198 мкмоль), DIPEA (34 мг, 46 мкл, 264 мкмоль) і ACOH (11,8 мг, 11 мкл, 198 мкмоль). Реакційну суміш перемішували при кімнатній температурі протягом 1 години. Додавали STAB (42 мг, 198 мкмоль) і продовжували перемішувати протягом 18 годин. Реакційну суміш розподіляли між EtOAc (10 мл) і насиченим водним розчином гідрокарбонату натрію (10 мл). Органічний шар знову промивали насиченим водним розчином 27 UA 108442 C2 5 10 15 20 25 30 35 40 45 50 55 гідрокарбонату натрію (2 × 10 мл), сушили над сульфатом магнію і концентрували у вакуумі, одержуючи олію коричневого кольору. Неочищений матеріал очищували за допомогою ВЕРХ, Методу A, одержуючи 20,6 мг вказаної в заголовку сполуки. РХ-МС (Метод A): ЧУ 2,59 хв. (100 % площа), ES m/z 519,223 [M-H] . Приклад 19 5-Етил-2-фтор-4-{3-[5-(4-гідроксибензил)-4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин-2-іл]-1Hіндазол-6-іл}фенол Вказану в заголовку сполуку одержували із 4-гідроксибензальдегіду (24,2 мг, 198 мкмоль) і тригідробромідної солі 5-етил-2-фтор-4-[3-(4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин-2-іл)-1Hіндазол-6-іл]фенолу (Приклад одержання 25, 50 мг, 132 мкмоль), використовуючи спосіб, розкритий в Прикладі 18. Неочищений матеріал очищували за допомогою ВЕРХ, Методу A, одержуючи 31,4 мг вказаної в заголовку сполуки. РХ-МС (Метод A): ЧУ 2,32 хв. (100 % площа), ES m/z 482,207 [M-H] . Приклад 20 5-Етил-2-фтор-4-{3-[5-(3-гідроксибензил)-4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин-2-іл]-1Hіндазол-6-іл}фенол Вказану в заголовку сполуку одержували із 3-гідроксибензальдегіду (24,2 мг, 198 мкмоль) і тригідробромідної солі 5-етил-2-фтор-4-[3-(4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин-2-іл)-1Hіндазол-6-іл]фенолу (Приклад одержання 25, 50 мг, 132 мкмоль), використовуючи спосіб, розкритий в Прикладі 18. Неочищений матеріал очищували за допомогою ВЕРХ, Методу A, одержуючи 39,6 мг вказаної в заголовку сполуки. + РХ-МС (Метод A): ЧУ 2,39 хв. (100 % площа), ES m/z 484,207 [M+H] . Приклад 21 4-{2-[6-(2-Етил-5-фтор-4-гідроксифеніл)-1H-індазол-3-іл]-1,4,6,7-тетрагідроімідазо[4,5c]піридин-5-ілметил}піридин-2-карбонітрил Вказану в заголовку сполуку одержували із 4-формілпіридин-2-карбонітрилу (26 мг, 198 мкмоль) і тригідробромідної солі 5-етил-2-фтор-4-[3-(4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин2-іл)-1H-індазол-6-іл]фенолу (Приклад одержання 25, 50 мг, 132 мкмоль), використовуючи спосіб, розкритий в Прикладі 18. Неочищений матеріал очищували за допомогою ВЕРХ, Методу B, одержуючи 16 мг вказаної в заголовку сполуки. + РХ-МС (Метод B): ЧУ 1,75 хв. (100 % площа), ES m/z 494,203 [M+H] . Приклад 22 Сіль мурашиної кислоти і 5-етил-2-фтор-4-{3-[5-(3-метоксибензил)-4,5,6,7-тетрагідро-1Hімідазо[4,5-c]піридин-2-іл]-1H-індазол-6-іл}фенолу До розчину тригідробромідної солі 5-етил-2-фтор-4-[3-(4,5,6,7-тетрагідро-1H-імідазо[4,5c]піридин-2-іл)-1H-індазол-6-іл]фенолу (Приклад одержання 25, 50 мг, 132 мкмоль) в ДМФ (1 мл) додавали 3-метоксибензальдегід (27 мг, 198 мкмоль), DIPEA (34 мг, 46 мкл, 264 мкмоль) і ACOH (11,8 мг, 11 мкл, 198 мкмоль). Реакційну суміш перемішували при кімнатній температурі протягом 1 години. Додавали STAB (42 мг, 198 мкмоль) і продовжували перемішувати протягом 18 годин. До реакційної суміші додавали насичений водний розчин гідрокарбонату натрію (5 мл). Одержану тверду речовину збирали фільтрацією і знову промивали насиченим водним розчином гідрокарбонату натрію. Неочищений матеріал очищували за допомогою ВЕРХ, Методу B, одержуючи 30,1 мг вказаної в заголовку сполуки. РХ-МС (Метод A): ЧУ 2,64 хв. (100 % площа), ES m/z 496,223 [M-H] . Приклад 23 5-Етил-2-фтор-4-[3-(5-хінолін-3-ілметил-4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин-2-іл)-1Hіндазол-6-іл]фенол Вказану в заголовку сполуку одержували із хінолін-3-карбальдегіду (31 мг, 198 мкмоль) і тригідробромідної солі 5-етил-2-фтор-4-[3-(4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин-2-іл)-1Hіндазол-6-іл]фенолу (Приклад одержання 25, 50 мг, 132 мкмоль), використовуючи спосіб, розкритий в Прикладі 22. Неочищений матеріал очищували за допомогою ВЕРХ, Методу B, одержуючи 14,3 мг вказаної в заголовку сполуки. + РХ-МС (Метод A): ЧУ 2,59 хв. (100 % площа), ES m/z 519,223 [M+H] . Приклад 24 5-Етил-2-фтор-4-{3-[5-(6-феноксипіридин-3-ілметил)-4,5,6,7-тетрагідро-1H-імідазо[4,5c]піридин-2-іл]-1H-індазол-6-іл}фенол Вказану в заголовку сполуку одержували із 6-феноксипіридин-3-карбальдегіду (39 мг, 198 мкмоль) і тригідробромідної солі 5-етил-2-фтор-4-[3-(4,5,6,7-тетрагідро-1H-імідазо[4,5-c]піридин2-іл)-1H-індазол-6-іл]фенолу (Приклад одержання 25, 50 мг, 132 мкмоль), використовуючи 28
ДивитисяДодаткова інформація
Назва патенту англійськоюIndazoles
Автори англійськоюCoe, Jotham, Wadsworth, Dehnhardt, Christoph, Martin, Jones, Peter, Kortum, Steven Wade, Sabnis, Yogesh, Anil, Wakinhut, Florian, Michel, Whitlock, Gavin, Alistair
Автори російськоюКо Джонатан Уодсворт, Денхардт Кристоф Мартин, Джонс Питер, Кортум Стивен Уэйд, Сабнис Йогеш Энил, Вакенхут Флориан Майкл, Вайтлок Гэйвин Алистер
МПК / Мітки
МПК: A61K 31/55, C07D 471/04, C07D 487/04, A61P 11/00, A61K 31/437
Мітки: індазоли
Код посилання
<a href="https://ua.patents.su/59-108442-indazoli.html" target="_blank" rel="follow" title="База патентів України">Індазоли</a>
Попередній патент: Спосіб зміцнення довгомірної деталі зі сталевого або алюмінієвого сплаву і автоматизована система пристроїв для його здійснення
Наступний патент: Спосіб виробництва масляної пасти
Випадковий патент: Ультразвуковий змішувач-активатор