Спосіб одержання поліфункціональних похідних 1,2,4-триазолу
Номер патенту: 106610
Опубліковано: 25.09.2014
Автори: Сливка Михайло Васильович, Усенко Руслан Миколайович, Лендєл Василь Георгійович
Формула / Реферат
Спосіб одержання поліфункціональних похідних 1,2,4-триазолу формули (І)
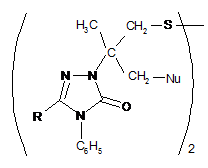 , (I)
, (I)
який включає нуклеофільне розщеплення модельного конденсованого гетероциклу, який відрізняється тим, що спочатку металільні похідні формули (II)
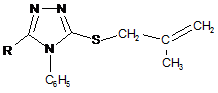 (ІІ)
(ІІ)
піддають взаємодії з галогенами Вr2 або І2, після чого утворений конденсований органічний катіон (III)
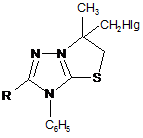 (III)
(III)
піддають нуклеофільному розщепленню, використовуючи нуклеофільні реагенти, які являють собою NaOH, HNAlk2, причому фрагментами Nu, R, Hlg є: Nu=ОН, NAlk2; R=Ar, Alk; Hlg=Br, I; де Ar є арил, Alk - алкіл.
Текст
Реферат: Винахід належить до органічної хімії, а саме до способів одержання поліфункціональних похідних 1,2,4-триазолу. Спосіб одержання поліфункціональних похідних 1,2,4-триазолу формули (І) H3C CH2 S CH2 Nu C N R N N C6H5 O 2 (I) полягає у тому, що металільні похідні формули (II) N N CH2 CH2 C S N R CH3 C6H5 (II) піддають взаємодії з галогенами Вr2 або І2, після чого утворений конденсований органічний катіон (III) UA 106610 C2 (12) UA 106610 C2 CH3 CH2HIg N N S R N C6H5 (III) піддають нуклеофільному розщепленню, використовуючи нуклеофільні реагенти, які являють собою NaOH, HNAlk2, причому фрагментами Nu, R, Hlg є: Nu=ОН, NAlk2; R=Ar, Alk; Hlg=Br, I. Таким чином, розроблено прийом взаємодії штучно створеного реакційного центру з нуклеофільними реагентами, що забезпечило проведення функціоналізації 1,2,4-триазолів при звичайних умовах чи помірному нагріванні без використання важкодоступних реагентів та складного апаратурного оформлення. Використання запропонованого способу забезпечує селективність утворення поліфункціональних похідних, для синтезу яких відомі методи функціоналізації є неприйнятними. Спосіб однозначно діє у випадку дії нуклеофільних реагентів різної природи, тому може бути використаний як загальний для функціоналізації 1,2,4триазолів. Винахід може бути використаний у науково-дослідних хімічних та хімікофармацевтичних лабораторіях. UA 106610 C2 5 10 15 20 25 Винахід належить до органічної хімії, а саме до способів одержання поліфункціональних похідних 1,2,4-триазолу. Відомі кілька підходів при функціоналізації симетричних триазолів. Для введення функціональних груп широко використовується спосіб функціоналізації алкільних замісників трансмутацією наявних функціональних груп [1]. Цей прийом успішно використовують при відносній стабільності модельного гетероциклу та відсутності в його складі інших функціональних груп чи замісників, які здатні до перетворень в умовах реакції. Також використовують спосіб, який передбачає введення функціональної групи в складі нуклеофільного реагенту, яким діють на модельний триазол [2]. Цей метод є прийнятний лише у випадку наявності активного реакційного центру в складі вихідного гетероциклу і основним недоліком цього способу є важкодоступність реагентів, що містять необхідну для введення в гетероцикл функціональну групу. Найбільш близьким за технічною суттю до заявлюваного є спосіб одержання N-вінільних функціональних похідних 5,6-членних нітрогеновмісних гетероциклів, який включає в себе нуклеофільне розщеплення модельного конденсованого гетероциклу [3]. Цей прийом характеризується введенням у вихідний гетероцикл вінільного фрагмента і меркапто-групи. Основним обмеженням цього способу є присутність у вихідному конденсованому триазолтіоні метінового протону, що спричинює при дії нуклеофільних реагентів елімінування останнього з утворення виключно вінільного фрагмента. Задачею винаходу є розробка загального підходу одержання поліфункціональних похідних 1,2,4-триазолу, який характеризується універсальністю, простотою експерименту, доступністю реагентів та високими виходами, так як відомі методи функціоналізації гетероциклів є неприйнятними для їх синтезу. Поставлена задача вирішується таким чином, що в способі одержання поліфункціональних похідних 1,2,4-триазолу формули (І) H3C CH2 S CH2 Nu C N N O N R C6H5 2 , (І) який включає нуклеофільне розщеплення модельного конденсованого гетероциклу, який відрізняється тим, що на спочатку металільні похідні формули (II) N N S N R CH2 C CH2 CH3 C6H5 30 (ІІ) піддають взаємодії з галогенами Вr2 або І2, після чого утворений конденсований органічний катіон (III) CH3 CH2HIg N N S R N C6H5 35 (ІІІ) піддають нуклеофільному розщепленню, використовуючи нуклеофільні реагенти, які являють собою NaOH, HNAlk2, причому фрагментами Nu, R, Hlg є: Nu=OH, NAlk2; R=Ar, Alk; Hlg=Br, I; де Ar є арил, Alk - алкіл. Модельним об'єктом для досліджень було використано металільні тіоетери 4,5дизаміщеного-1,2,4-триазолу (2), які можна отримати високими виходами методами реакцією 1 UA 106610 C2 5 10 15 алкілування триазол-3-тіону (1). Для штучного створення активного реакційного центру позитивно зарядженого атому Нітрогену - було вибрано прийом електрофільної галогеногетероциклізації металільних похідних (2), який характеризується простотою виконання, доступністю реактивів та високими (іноді кількісними) виходами. В результаті отримують поліконденсовані тіазолотриазоли (3) з позитивно зарядженим гетероатомом, що не містять атом Гідрогену в α-положенні до позитивно зарядженого гетероатому і до галогенометильної групи. Суть розробленого способу функціоналізації системи 1,2,4-триазолу полягає в тому, що дія нуклеофільних реагентів різної природи призводить виключно до нуклеофільного заміщення атому галогену на фрагмент діючого нуклеофілу (чи конкурентного нуклеофілу середовища, в якому проводять синтез), яке супроводжується руйнуванням поліциклічної системи (3) з селективним формуванням поліфункціональних похідних 1,2,4-триазолу (4). Склад синтезованих поліфункціональних похідних 1,2,4-триазолу (4) підтверджено даними елементного аналізу; індивідуальність методом тонкошарової хроматографії (ТШХ); будову доведено методом спектроскопії ядерного магнітного резонансу на ядрах Протону та ІЧ спектроскопією. Приклад 1. Схема функціоналізації на основі 3-металілтіо-4,5-дизаміщеного- 1,2,4-триазолу (2) H N R 1) NaOH 2) ClCH2C(CH3)=CH2 N S N N CH2 CH2 CH3 Nu CH2HIg HIg N 1) H-Nu 2) H2O N S O C6 H5 HIg2 S C N CH2 CH3 2 H3 C R C C6 H5 1 N CH2 S N R C6 H 5 N N R N C6 H5 2 3 4 20 25 30 35 40 Nu=OH, NAlk2; R=Ar, Alk; Hlg=Br, I; де Ar є арил, Alk - алкіл. 3-S-Металілтіо-4-феніл-1,2,4-триазол (2). Триазол (1) (0,054 моль) [4] розчиняють в розчині гідроксид калію (0,054 моль) в етанолі при нагріванні. Після охолодження до кімнатної температури, добавляють металілхлорид (0,092 моль) в 5 мл етанолу. Суміш нагрівають на водяній бані протягом 1 години. Кінцевий продукт, який випадає в осад після охолодження реакційної суміші, відфільтровують і перекристалізовують в етанолі. 3-5-Металілтіо-4,5-дифеніл-1,2,4-триазол (2a). Кристали білого кольору. Вихід 70 %, Тпл 138140 °C. Rf=0,88 (ізопропанол: гексан = 5:1). Спектр ПМР в ДМСО-Д6 (δ, м. ч., J, Гц), 1,70 с (3Н, СН3), 3,76 с (2Н, СН2), 4,87 д (2Н, =СН2), 7,35-7,55 м (10Н, 2С6Н5). Знайдено, %: N 13,74. C18H17N3S. Вирахувано, %: N 13,68. 5-Бензил-3-S-металілтіо-4-феніл-1,2,4-триазол (2б). Вихід 41 %. Тпл 78-80 °C. Спектр ПМР в ДМСО-Д6 (δ, м. ч., J, Гц): 1,65 с (3Н, СН3), 3,65 с (2Н, СН2), 3,99 с (2Н, CH2Ph), 4,79 д (2Н, =СН2, 13), 6,89-7,53 м (10Н, 2С6Н5). Знайдено, %: N 13,10. С19H19N3S. Вирахувано, %: N 13,08. 3-S-Металілтіо-5-n-нітрофеніл-4-феніл-1,2,4-триазол (2в). Вихід 57 %. Тпл 172-173 °C. Спектр ПМР в ДМСО-Д6 (δ, м. ч., J, Гц): 1,72 с (3Н, СН3), 3,82 с (2Н, СН2), 4,85 с (1Н, =СН2), 4,94 с (1Н, =СН2), 7,48, 7,61, 8,20 3 м (9Н, С6Н5, С6Н4). Знайдено, %: N 16,11. C18H16N4O2S. Вирахувано, %: N 15,90. 6-Бромометил-6-метил-3-феніл-5,6-дигідро-3H-[1,3]тіазоло [3,2-b]-[1,2,4]триазол-7-ій броміди (3а-в). Розчиняють S-металіл-1,2,4-триазол (2) (0,0033 моль) в 15 мл льодяної оцтової кислоти. Бром (0,0066 моль) розчиняють в 5 мл СН3СООН. При постійному перемішуванні повільно 2 UA 106610 C2 5 10 15 20 25 30 35 40 45 50 55 прикопують розчин брому до розчину триазолу (2). Перемішують протягом 2 годин. Утворену смолу розтирають у ацетоні. Продукт перекристалізовують в льодяній оцтовій кислоті. 6-Бромометил-6-метил-2,3-дифеніл-5,6-дигідро-3H-[1,3]тіазоло[3,2-b][1,2,4]триазол-7-ій бромід (3а). Вихід 62 %. Т топл 300-303 °C. Rf=0б52 (оцтова кислота: етанол: гексан = 1:3:2). Спектр ПМР в ДМСО-Д6 (δ, м. ч., J, Гц), 2.01 с (3Н, СН3), 4,31 с (2Н, СН2 цикл), 4,43-4,54 к (2Н, 13 СН2Вr, 7,7), 7,50-7,72 м (10Н, 2С6Н5). Спектр ЯМР С в ДМСО-Д6 (δ, м. ч.): 23,26, 37,89, 48,20, 69,11, 123,88, 126,85, 129,55, 129,91, 131,42, 132,43, 132,62, 132,96, 154,47, 160,05. Знайдено, %: N 9,05.C18H15Br2N3S. Вирахувано, %: N 8,99. 2-Бензил-6-бромометил-6-метил-3-феніл-5,6-дигідро-3H-[1,3]тіазоло[3,2-b][1,2,4]триазол-7-ій бромід (36). Вихід 56 %. Тпл 278-280 °C. Rf=0,75 (оцтова кислота: етанол: гексан = 1:3:2). Спектр ПМР в ДМСО-Д6 (δ, м. ч., J, Гц), 1,89 с (3Н, СН3), 4,18 к (2Н, СН2 цикл, 12,3), 4,30 с (2Н, CH2Ph), 4,33-4,42 к (2Н, СН2Вr, 2,7), 7,09-7,77 м (10Н, 2С6Н5). Знайдено, %: N 8,71. C19H17Br2N3S. Вирахувано, %: N 8,77. 6-Бромометил-2-(4-нітрофеніл)-6-метил-3-феніл-5,6-дигідро-3H-[1,3]тіазоло[3,2b][1,2,4]триазол-7-ій бромід (3в). Вихід 46,2 %. Тпл 259-261 °C. Rf=0,63 (оцтова кислота: етанол: гексан = 1:3:2). Спектр ПМР в ДМСО-Д6 (δ, м. ч., J, Гц), 1.96 с (3Н, СН3), 4,24 м (2Н, СН2 цикл), 4,44 м (2Н, СН2Вr), 7,62, 8,34 2м (9Н, С6Н5, С6Н4). Знайдено, %: N 10,82. C18H16Br2N4O2S. Вирахувано, %: N 10,94. 6-(Йодомометил)-6-метил-2,3-дифеніл-5,6-дигідро-3H-[1,3]тіазоло[3,2-][1,2,4]триазол-7-ій йодид (3г). Розчиняють тіоефір (2а) (0,0016 моль) в 15 мл етанолу або в 10 мл хлороформі. Йод (0,0033 моль) розчиняють в мінімальній кількості етанолу (55 мл) або хлороформу (45 мл). Прикопують розчин йоду при перемішуванні до розчину триазолу (2а). Суміш перемішують 7 діб. Випаровують розчинник. Смолу, яка утворюється, розчиняють в ДМФА. Добавляють еквімолярну кількість калій йодиду (0,0016 моль). Перемішують 2 години. Фільтрують. Осад промивають водою. Продукт нагрівають в хлороформі протягом 5 годин. Вихід 58 % (етанол). Вихід 59 % (хлороформ). Тпл 247-250 °C. Rf=0,67 (оцтова кислота: етанол: гексан = 1:3:2). Спектр ПМР в ДМСО-Д6 (δ, м. ч., J, Гц), 1,98 с (3Н, СН3), 3,98 с (2Н, СН2 цикл), 4,36-4,45 к (2Н, CH2 J, 3,7), 7,43-7,70 м (10Н, 2С6Н5). Знайдено, %: N 7,34. C18H15I2N3S. Вирахувано, %: N 7,49. 1-{2-Гідрокси-1-[3-гідрокси-2-метил-2-(5-оксо-3,4-дифеніл-4,5-дигідро-1Н-1,2,4-триазол-1іл)пропілдисулфанілметил]-1-метилетил}-3,4-дифеніл-4,5-дигідро-1Н-1,2,4-триазол-5-он (4а). Розчиняють монобромід (3) (0,00062 моль) в 5 мл ДМФА, гідроксид калію у 10 мл води. Розчин лугу доливають до розчину триазолу при перемішуванні. Перемішують протягом 2 годин. Вихід 95 %. Тпл 165-167 °C. Rf=0,77 (ізопропанол: гексан = 5:1). Спектр ПМР в ДМСО-Д6 (δ, м. ч., J, Гц), 1,92 с (3Н, СН3), 3,12 с (2Н, CH2S), 4,16 с (2Н, СН2 цикл), 7,30-7,45 м (10Н, 2С6Н5). Знайдено, %: N 12,32. C36H36N6O4S2. Вирахувано, %: N 12,35. 1-(1-Метил-2-[2-метил-3-морфоліно-2-(5-оксо-3,4-дифеніл-4,5-дигідро-1Н-1,2,4-триазол-1іл)пропілдисулфаніл1-1-морфолінометилетил}-3,4-диФеніл-4,5-дигідро-1Н-1,2,4-триазол-5-он (4б). Тіазолотриазолієву сіль (3) (0,0009 моль) розчиняють в 5 мл морфоліну, перемішують протягом 4 години. Розбавляють водою, фільтрують і перекристалізовують в ацетоні. Вихід 83 %. Тпл 193-194 °C. Rf=0,15 (ізопропанол: гексан = 1:5). Спектр ПМР в ДМСО-Д6 (δ, м. ч, J, Гц), 1,80 с (3Н, СН3), 2,21 с (4Н, 2CH2Nцикл), 2,87 с (2Н, CH2S), 3,35-3,48 м (6Н, 2СН2Оцикл, -1 CH2N), 7,36-7,56 м (10Н, 2С6Н5). ІЧ спектр (v, см ): 710 ср (CH2-S); 1590 с (С=О). Знайдено, %: N 13,72. C44H52N8O4S2. Вирахувано, %: N 13,69. Таким чином, було розроблено прийом взаємодії штучно створеного реакційного центру з нуклеофільними реагентами, що забезпечило проведення функціоналізації 1,2,4-триазолів при звичайних умовах чи помірному нагріванні без використання важкодоступних реагентів та складного апаратурного оформлення. Використання запропонованого способу нуклеофільного розщеплення отриманих електрофільною галогеноциклізацією металілтіотриазолів конденсованих тіазолотриазолів з позитивно зарядженим гетероатомом забезпечує селективність утворення поліфункціональних похідних, для синтезу яких відомі методи функціоналізації є неприйнятними. Спосіб однозначно діє як у випадку дії нуклеофільних реагентів різної природи, тому може бути використаний як загальний для функціоналізації 1,2,4-триазолів. Винахід може бути використаний у науково-дослідних хімічних та хіміко-фармацевтичних лабораторіях. Джерела інформації: 1. Mazzone G., Bonina F., Blandino G. 3-Methylthio-, 3-(substituted-amino)ethylthio-, 3carboxymethylthio-, 3,3'-(dithiobis)-5-агуl-4H(R)-1,2,4-triazoles and N-substituted 2-aminomethyl 3 UA 106610 C2 5 10 derivatives of 5-aryl-4H(R)-1,2,4-triazoline-3-thiones: synthesis and biological activity // Farmaco Ed. Sci. - 1981. -V.36, № 12. - P. 1004-1018. CA: (96) 122698m. 2. E.S.H.El Ashry, A.A. Kassem, H. Abdel-Hamid, F.F. Louis, Sh. A. Khattab, and M.R. Aouad. Synthesis and Alkylation of 5-(3-Chlorobenzo[b]thien-2-yl)-4H-1,2,4-triazole-3-thiol Under Classical and Microwave Conditions. // J. Heterocycl. Chem. - 2006. - V. 43. - №№ 11-12. - P. 1427-1430. 3. Патент (Україна), заявка № 89300 C2 (Україна), МПК С07В 41|00, С07В 43|00, С07D 513|00, C07D 249|00. Спосіб одержання TV-вінільних функціональних похідних 5,6-членних нітрогеновмісних гетероциклів. /М.В. Сливка, Мар. В. Сливка, P.M. Усенко, В.Г. Лендєл /Заявл. 10.09.2008. Опубліковано 11.01.2010, Бюл. № 17, 14 с. - Прототип. 4. С.М. Хрипак, В.И. Станинец, М.В. Сливка, Ю.Л. Зборовский. Окислительная гетероциклизация натриевых солей 3-меркапто-4-фенил-3H-1,2,4-триазолов. //Укр. Хім. Журн. 2001. -т. 67, № 4. -С. 110-113. ФОРМУЛА ВИНАХОДУ 15 Спосіб одержання поліфункціональних похідних 1,2,4-триазолу формули (І) H3C CH2 S CH2 Nu C N N O N R C6H5 2 , (I) який включає нуклеофільне розщеплення модельного конденсованого гетероциклу, який відрізняється тим, що спочатку металільні похідні формули (II) N S N R 20 N CH2 C CH2 CH3 C6H5 (ІІ) піддають взаємодії з галогенами Вr2 або І2, після чого утворений конденсований органічний катіон (III) CH3 CH2HIg N N S R N C6H5 25 (III) піддають нуклеофільному розщепленню, використовуючи нуклеофільні реагенти, які являють собою NaOH, HNAlk2, причому фрагментами Nu, R, Hlg є: Nu=ОН, NAlk2; R=Ar, Alk; Hlg=Br, I; де Ar є арил, Alk - алкіл. Комп’ютерна верстка Л. Литвиненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 4
ДивитисяДодаткова інформація
Автори англійськоюSlyvka Mykhailo Vasyliovych, Usenko Ruslan Mykolaiovych, Lendiel Vasyl Heorhiiovych
Автори російськоюСливка Михаил Васильевич, Усенко Руслан Николаевич, Лендел Василий Георгиевич
МПК / Мітки
МПК: C07D 249/12
Мітки: похідних, одержання, поліфункціональних, 1,2,4-триазолу, спосіб
Код посилання
<a href="https://ua.patents.su/6-106610-sposib-oderzhannya-polifunkcionalnikh-pokhidnikh-124-triazolu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання поліфункціональних похідних 1,2,4-триазолу</a>
Попередній патент: Гідропіроліз біомаси для отримання високоякісного рідкого пального
Наступний патент: Інгібітори зовнішнього медулярного калієвого каналу нирок
Випадковий патент: Керамічна маса










