Спосіб визначення стресового стану базидіоміцетів та екологічного стану місця їх зростання за вмістом продуктів перекисного окиснення ліпідів
Формула / Реферат
Спосіб визначення стресового стану базидіоміцетів та екологічного стану місця їх зростання за вмістом продуктів перекисного окиснення ліпідів, що включає визначення вмісту тіобарбітурової кислоти як активних продуктів в культурах грибів, який відрізняється тим, що визначення їх вмісту проводять в дикорослих плодових тілах базидіоміцетів із різних за екологічними умовами місць зростання та міцеліальних культурах цих грибів при штучному культивуванні в оптимальних умовах і при дії температурних стресорів.
Текст
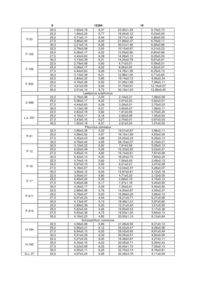
Спосіб визначення стресового стану базидіоміцетів та екологічного стану місця їх зростання за 3 12384 4 том реакцій вільно-радикального окислення і суного стану місця їх зростання, який відрізняється проводжується утворенням активних форм кисню. від прототипу визначенням вмісту продуктів ПОЛ Є і інші експериментальні дані про здатність ксиекзо- та ендогенного походження базидіальних лотрофних базидіоміцетів утворювати високоактимакроміцетів з різних місць зростання та умов кувні кисневі радикали, які, як вважають можуть прольтивування. вокувати деструкцію лігніну і целюлози. Оскільки Поставлене завдання вирішується тим, що в вільні радикали мають також здатність ініціювати способі визначення стресового стану базидіоміцеперекисне окиснення різноманітних компонентів тів та екологічного стану місця їх зростання за вміклітини, і в першу чергу ліпідів, важливими є оцінка стом продуктів перекисного окиснення ліпідів виможливості протікання і активності процесів ПОЛ в значають вміст тіобарбітурова кислота - активних міцелії ксилотрофних базидіоміцетів та її порівняпродуктів в культурах грибів згідно корисної моделі льна характеристика. визначення їх вмісту проводять в дикоростучих Отже, розробка способів оцінки стресового плодових тілах базидіоміцетів з різних за екологічстану базидіоміцетів на несприятливі умови кульними умовами місць зростання та міцеліальних тивування чи навколишнього середовища, біоіндикультурах цих грибів при штучному культивуванні кації екологічного стану довкілля на основі визнав оптимальних умовах і за дії температурних стречення активності процесів ПОЛ грибів є сорів. актуальною задачею розвитку мікології, біотехноПропонований спосіб є новим тому, що він не логії та екології. відомий з рівня техніки та об'єктів дослідження. Відомі дослідження за якими доведено, що Приклад 1 ксилотрофні базидіоміцети володіють як засобами Визначення вмісту продуктів перекисного окиантиоксидантного захисту, так і здатні до ініціації снення ліпідів у плодових тілах. Для дослідів з вміреакцій ПОЛ. Баланс цих процесів встановлює сту ТБК-АП беруть плодові тіла приблизно одного інтенсивність ПОЛ на певному стаціонарному ріввіку з яких отримують і нові чисті міцеліальні кульні, який потенційно вищий у грибів білої гнилі у тури (ізоляти, штами). Відповідно, плодові тіла і порівнянні з грибами бурої гнилі і може розглядаштами мають однакові назви. Дикоростучі плодові тися в якості біохімічної адаптації цієї групи грибів тіла базидіоміцетів зібрані з територій, які відріздо виживання в умовах окисного стресу, обумовняються за екологічними умовами. Штами зимоволеного вільнорадикальними реакціями, які прохого гриба F-vv і F-203 виділено з плодових тіл, які дять в процесі деструкції лігніну і ПОЛ [8]. Наворосли на пні робінії (Robinia pseudoacacia L.) та дяться дані з вмісту в міцелії ксилотрофних ушкодженому ясені ланцетному (Fraxinus базидіоміцетів активних продуктів, що реагують з lanceolata Borkn.) відповідно. Плодові тіла штамів тіобарбітуровою кислотою (ТБК-АП) і вмісту жироF-105 і F-109 були зібрані з деревини явора (Acer розчинних ТБК-АП у грибів різних груп [9]. Порівpseudoplatanus L.), штам F-03 - на горілих залишнюється антиокисна активність міцеліальної біоках дерева, встановити систематичне положення маси і культуральної рідини деяких базидіоміцетів якого неможливо. Трутовик сірчано-жовтий, штами [1, 2]. В роботах не наводяться дані з рівня процеС-096 і L.S.-201 зібрано на вербах (Salix alba L.). су ПОЛ дикоростучих плодових тіл і культур грибів, Всі плодові тіла гливи звичайної росли на пнях які зростали на територіях з різними екологічними тополі: штами Р-01 і Р-12 - тополі канадської умовами. (Populus deltoides Marsh.), штами Р-16 і Р-17 - тоНайбільш близькими за технічною суттю і дополі білої (Populus alba L.), штами Р-211 і Р-212 сяжності результату є визначення вмісту продуктів тополі самаркандської (Populus bolleana Lauche). ПОЛ в міцелії деяких їстівних макроміцетів і порівСхізофіл звичайний, штам Н-184 зібрано з дереняння їх активності [12]. Об'єктами дослідження вини явора (A. pseudoplatanus L.), штам Н-185 - з верби (S. alba L.). Характеристика штамів макробули штами Р-01 DNU, Р-20 ІВК (550), Рміцетів, які були використані в роботі надана в 35 ІВК (551), Р-77 DNU, D-112 DNU гливи таблиці 1. звичайної (Pleurotus ostreatus (Jacq.: Fr.) Kumm.), Для оцінки активності ПОЛ використовують штам P-fl DNU гливи флоридської (Pleurotus тест з тіобарбітуровою кислотою - ТБК-тест. Метод floridae) та штами 511 ІВК, 523 ІВК сіїтаке заснований на визначенні кількості забарвленого (Lentinus edodes (Berk.) Sing.) з колекцій культур продукту, який маємаксимум поглинання в червошапинкових грибів Інституту ботаніки ім. М.Г. Хоному видимому спектрі при 532нм. Забарвлений лодного (ІВК) і культур макроміцетів ДонНУ (DNU) продукт утворюється в результаті взаємодії двох [12]. Не надаються дані про залежність вмісту ТБКмолекул ТБК з однією молекулою малонового діаАП у плодових тілах та культурах в залежності від льдегіду (МДА) - одного із вторинних продуктів місця збору плодових тіл, дії несприятливих факПОЛ. Встановлено, що реакцію з ТБК дає не тільки торів довкілля чи умов культивування. МДА, а й багато інших карбонільних сполук, які В основу корисної моделі покладено завдання утворюються під час ПОЛ. Тому разом їх називарозробки біологічного способу діагностики стресоють ТБК-активні продукти (ТБК-АП) [5]. вого стану базидіоміцетів та моніторингу екологіч 5 12384 6 Таблиця 1 Характеристика колекційних культур лікарських базидіальних макроміцетів, які були використані в роботі Вид гриба Flammulina velutipes (Curt.: Fr.) Sing. Laetiporus sulphurous (Bull.: Fr.) Bond et Sing. Pleurotus ostreatus (Jacq.: Fr.) Kumm. Schizophillum commune Fr. Штам F-vv F-03 F-105 F-109 F-203 С-096 L.s.-201 Р-01 Р-12 Р-16 Р-17 Р-211 Р-212 Н-184 Н-185 S.c.-01 Місце походження м.Донецьк ДБС НПП "СГ" НПП "СГ" м.Донецьк НПП "СГ" НПП "СГ" м.Донецьк ДБС НПП "СГ" НПП "СГ" м.Донецьк м.Донецьк НПП "СГ" НПП "СГ" м.Донецьк Лікарська дія [1, 3, 10] антибактеріальна, антивірусна, антифунгальна, проти пухлинна, імуномодулююча, гіпоглікемічна, тромболітична, гіполіпідемічна антибактеріальна, антифунгальна, антидіарейна поліпшує роботу м'язів, седативна, антивірусна, антифунгальна, протипухлинна, радіопротекторна, імуномодулююча, гіполіпідемічна застосовується у гінекології, антифунгальна, протипухлинна Примітка. ДБС: Донецький ботанічний сад HAH України, НПП "СГ": національний природний парк "Святі Гори" В таблиці 2 наведено результати дослідів з визначення вмісту ТБК-AП в дикоростучих плодових тілах макроміцетів, які були використані в ро боті. Експериментальні дані піддавали дисперсійному аналізу, порівняння середніх - за методом Дункана [10]. Таблиця 2 Вміст продуктів перекисного окиснення ліпідів у міцели дикоростучих плодових тіл деяких базидіоміцетів Плодові тіла F-vv F-03 F-105 F-109 F-203 С-096 L.s.-201 Р-01 Вміст ТБК-АП, нмоль МДА/г 22,97±0,79 19,23±0,91 7,03±0,29 7,51±0,61 27,01±0,90 5,97±0,65 4,18±0,40 20,71±1,23 Отже, виходячи з отриманих результатів дослідів, дикоростучі плодові тіла базидіоміцетів, які зібрані з різних за екологічними умовами місць зростання мають рівень вмісту ТБК-АП, що вірогідно відрізняється. Рівень ПОЛ плодових тіл, які зібрані в м.Донецьку значно вищий вмісту ТБК-АП міцелію плодових тіл з дендрарію і НПП "Святі Гори". Для останніх відмічено мінімальний вміст продуктів ПОЛ в міцелії. Дослід виявив і ймовірну порівняльну різницю інтенсивності процесів ПОЛ, характерну для різних видів макроміцетів. Приклад 2 Виділення чистих культур, їх пересіви та культивування. Зібрані плодові тіла звільняють від залишків субстрату. Для подальших досліджень використовують бажано одновікові зразки. Штами грибів отримують за методами, які звичайно застосовуються для одержання чистих культур мак Плодові тіла Р-12 Р-16 Р-17 Р-211 Р-212 Н-184 Н-185 S.c.-01 Вміст ТБК-АП, нмоль МДА/г 9,75±0,67 6,18±0,42 5,00±0,81 14,03±0,63 21,07±0,60 31,18±0,21 31,23±0,12 27,93±0,29 роміцетів, а саме вилученням "тканинних" ізолятів із свіжезібраних плодових тіл [6]. Чисті міцеліальні культури штамів підтримують шляхом пересівів через 5-6 місяців на агаризоване знехмілене пивне сусло (4° по Баллінгу), або інші агаризовані живильні середовища [6]. Для вивчення росту і визначення вмісту ТБКАП, штами вирощують поверхнево в колбах Erienmeyer об'ємом 250мл, які містять 50мл глюкозо-пептонного середовища з початковим рН 5,70 при температурі 27,5°С протягом 20 діб. Ріст штамів оцінюють за накопиченням біомаси (абсолютно сухий міцелій) ваговим методом [6]. Визначають вміст продуктів ПОЛ у міцелії та культуральному фільтраті (КФ) на 20 добу культивування штамів. Оптимальні вік та умови ферментації встановлюють в попередніх дослідах. Наприкінці культивування міцелій відділяють від культурального філь 7 12384 8 трату, залишки якого видаляють за допомогою 20-ту добу культивування зафіксовано для штамів фільтрувального паперу. Для отримання гомогесхізофілу звичайного, вірогідно низький ріст - для нату (МГ), міцелій розтирають в ступці. Суміш штамів сірчано-жовтого трутовика. Вміст ТБК-АП у центрифугують при 3000об/хв. на протязі 10 хвиміцелії досліджених штамів перевищує такий кульлин. Визначають вміст ТБК-АП у МГ в присутності турального фільтрату. Вірогідно високе сумарне 20% трихлороцтової кислоти. Спектри поглинання накопичення продуктів ПОЛ, і як слідство - підвиТБК-АП реєструють на спектрофотометрі, наприщений загальний розвиток процесів перекисного клад на СФ-26 при 532нм та перераховують на окиснення ліпідів характерне для міцелію штамів, вміст у наномолях МДА на 1г маси досліджуваного виділених з плодових тіл грибів, зростаючих на матеріалу [9]. рН розчинів визначають потенціометериторії м.Донецька. Вміст речовин, які реагують тричним методом. Порівняння значень середніх з тіобарбітуровою кислотою, як в міцелії, так і в проводять за методом Дункана [10]. культуральному фільтраті культур лікарських баВ таблиці 3 наводяться дані з росту і вмісту зидіоміцетів, що виділені з дикоростучих плодових ТБК-АП в міцелії та культуральних фільтратах тіл у національному природному парку "Святі Голікарських базидіоміцетів, розраховані на основі ри" знаходиться на мінімальному рівні. В ході досаналізу нативних гомогенатів. Аналіз отриманих ліду не встановлено залежності вмісту ТБК-АП в експериментальних даних свідчить про наступне. міцелії чи КФ штамів від їх ростових показників. Найвищі показники росту - накопичення біомаси на Таблиця 3 Вміст продуктів перекислого окиснення ліпідів в культурах деяких штамів базидіоміцетів Штам F-vv F-03 F-105 F-109 F-203 С-096 L.s.-201 Р-01 Р-12 Р-16 Р-17 Р-211 Р-212 Н-184 Н-185 S.c.-01 Вміст ТБК-АП, нмоль МДА/г МГ КФ 20,33±0,59 8,05±0,95 19,71±1,46 4,90±0,05 12,50±0,90 6,60±0,88 9,56±0,50 4,92±0,57 21,00±1,69 7,08±0,11 2,14±0,21 1,89±0,08 1,81±0,11 0,70±0,02 16,10±1,69 4,83±0,09 10,33±0,20 5,52±0,01 8,21±0,11 3,47±0,08 4,68±0,18 4,15±0,12 15,89±0,20 3,66±0,13 15,65±0,53 3,17±0,38 25,02±0,60 8,61±0,44 30,40±1,72 7,05±0,13 26,59±2,41 9,01±0,23 Біомаса, г/л 3,27±0,22 3,17±0,15 3,38±0,48 3,14±0,32 3,66±0,28 2,55±0,06 2,13±0,13 4,71±0,23 4,14±0,18 4,26±0,12 4,13±0,50 4,78±0,37 5,11±0,46 6,03±0,41 5,89±0,57 6,18±0,78 Таким чином, забруднення довкілля призводить до біохімічної адаптації базидіоміцетів до екологічних умов зростання і характерного прискорення процесів окиснєння ліпідів, та як слідство - накопичення продуктів ПОЛ в міцелії і культуральному фільтраті. Визначення вмісту ТБК-АП можна використовувати як тест для встановлення екологічного стану місця зростання грибів. Приклад 3 Вплив температури культивування на рівень ПОЛ досліджених штамів базидіальних макроміцетів. Штами культивують в колбах Erienmeyer на рідкому глюкозо-пептонному середовищі при 22,5; 25,0; 27,5 та 30,0°С протягом 20 діб. Вміст ТБК-АП у міцелію та культуральному фільтраті визначають за прикладом 2. Таблиця 4 Вплив температури культивування на ріст, рН живильного середовища та інтенсивність процесів ПОЛ штамів деяких базидіоміцетів Штам Температура, °С Біомаса, г/л 1 2 3 F-vv 22,5 25,0 27,5 рН 4 Flammulina velutipes 2,82±0,18 5,82 4,18±0,11 6,18 3,43±0,15 6,27 Вміст ТБК-АП, нмоль МДА/г МГ КФ 5 6 17,01±1,06 20,33±0,59 24,15±0,17 7,23±0,21 8,05±0,95 9,27±0,58 F-03 F-105 F-106 F-203 C-096 L.s.-201 P-01 P-12 P-16 Р-17 Р-211 Р-212 H-184 Н-185 S.c.-01 9 30,0 22,5 25,0 27,5 30,0 22,5 25,0 27,5 30,0 22,5 25,0 27,5 30,0 22,5 25,0 27,5 30,0 22,5 25,0 27,5 30,0 22,5 25,0 27,5 30,0 22,5 25,0 27,5 30,0 22,5 25,0 27,5 30,0 22,5 25,0 27,5 30,0 22,5 25,0 27,5 30,0 22,5 25,0 27,5 30,0 22,5 25,0 27,5 30,0 22,5 25,0 27,5 30,0 22,5 25,0 27,5 30,0 22,5 12384 1,92±0,19 6,37 1,94±0,24 5,77 4,71±0,11 6,44 3,86±0,40 6,20 2,21±0,14 6,36 2,79±0,08 5,93 5,06±0,17 6,22 4,44±0,63 6,29 3,13±0,39 6,21 2,79±0,08 5,93 5,06±0,17 6,22 4,44±0,63 6,29 3,13±0,39 6,21 2,84±0,32 5,85 4,18±0,26 6,52 3,81±0,09 6,02 2,51±0,14 6,73 Laetiporus sulphurous 2,79±0,08 5,93 5,06±0,17 6,22 4,44±0,63 6,29 3,13±0,39 6,21 2,82±0,18 5,82 4,18±0,11 6,18 3,43±0,15 6,27 1,92±0,19 6,37 Pleurotus ostreatus 3,86±0,26 5,22 4,99±0,02 4,97 5,35±0,43 4,88 4,79±0,44 4,95 3,12±0,22 5,62 6,02±0,49 5,26 5,85±0,14 4,92 4,42±0,13 5,20 3,74±0,14 5,60 5,97±0,10 5,55 5,18±0,07 5,10 3,80±0,12 6,00 3,50±0,01 5,80 5,46±0,24 5,35 5,40±0,08 5,17 4,26±0,17 5,29 2,88±0,56 5,76 5,79±0,47 5,03 6,07±0,23 4,54 4,13±0,47 5,13 2,99±0,39 5,20 5,82±0,04 4,26 5,93±0,38 4,75 4,16±0,23 4,90 Schizophillum commune 4,58±0,08 5,89 5,95±0,21 6,12 6,84±0,13 6,25 5,91±0,29 6,30 5,27±0,02 6,05 5,30±0,10 6,20 5,22±0,09 6,25 4,92±0,11 6,25 4,67±0,24 5,95 10 23,00±1,29 18,04±0,12 19,71±1,46 21,89±0,37 30,01±1,46 10,15±0,67 12,50±0,90 14,08±0,13 14,20±0,79 4,71±0,01 9,56±0,05 14,78±1,26 12,96±1,05 19,14±0,72 21,00±1,69 31,70±0,91 30,16±1,03 9,15±0,73 5,03±0,50 4,90±0,05 6,76±0,11 6,58±0,86 4,21±0,23 6,60±0,88 8,05±0,50 8,61±0,91 0,59±0,01 4,92±0,57 6,25±0,13 5,71±0,65 6,06±0,34 7,08±0,11 12,14±0,67 12,06±0,45 2,14±0,21 2,07±0,02 3,24±0,01 3,50±0,47 1,81±0,06 2,00±0,06 2,74±0,01 2,91±0,05 1,89±0,08 0,92±0,01 2,70±0,03 1,96±0,11 0,70±0,20 1,05±0,04 0,67±0,03 1,01±0,02 19,01±0,67 16,10±1,69 24,00±0,24 26,15±0,37 7,91±0,56 10,33±0,20 15,14±0,61 16,20±0,70 7,00±0,45 8,21±0,01 12,04±0,57 12,87±0,61 4,71±0,20 4,68±0,18 7,27±1,16 7,30±0,91 14,00±0,67 15,89±0,20 18,21±0,71 19,48±1,01 12,31±0,40 15,65±0,53 19,50±1,20 20,00±1,10 3,96±0,11 4,83±0,09 6,29±0,13 6,10±0,21 5,05±0,12 5,52±0,01 7,67±0,08 7,60±0,24 2,48±0,13 3,47±0,08 5,28±0,07 5,12±0,18 2,12±0,05 4,15±0,12 5,40±0,50 5,40±0,50 4,00±0,37 3,66±0,13 6,21±0,58 5,97±0,60 3,51±0,50 3,17±0,38 5,60±0,13 6,12±0,84 21,48±0,56 25,02±0,41 25,02±0,60 30,05±0,51 16,48±0,67 20,05±0,71 30,40±1,72 32,70±2,14 20,38±3,16 8,21±0,12 8,28±0,56 8,61±0,44 8,60±0,09 4,27±0,11 5,20±0,43 7,05±0,13 8,16±0,81 5,11±0,04 11 25,0 27,5 30,0 5,37±0,31 6,07±0,15 5,40±0,09 Виходячи з отриманих даних (таблиця 4), найбільш придатною, оптимальною температурою для росту штамів сірчано-жовтого трутовика є 22,5-25°С, зимового опенька - 25°С, а гливи звичайної і схізофілу звичайного - 25-27,5°С. За умови дії температурного стресора підвищенні температури культивування до 30°С спостерігається зниження ростових показників та вірогідне підвищення вмісту продуктів ПОЛ в міцелії і КФ досліджених базидіоміцетів. Залежності між зміною показників росту штамів, кислотності середовища та вмістом продуктів ПОЛ екзо- і ендогенної природи не виявлено. Таким чином, отримані результати показали, що несприятливі екологічні умови зростання та підвищена температура культивування в порівнянні з оптимальною для росту, ведуть до значного підвищення вмісту продуктів ПОЛ у дикоростучих плодових тілах та культуральному фільтраті і міцелію штамів базидіальних макроміцетів. Запропонований спосіб визначення стресового стану базидіоміцетів та екологічного стану місця їх зростання відрізняється новизною, технічно простий та дає можливість отримати достовірні діагностичні дані. Джерела інформації: 1. Бабицкая В.Г., Щерба В.В. Антиоксидантная активность грибов -деструкторов лигноцеллюлозных субстратов // Прикл. биохимия и микробиология. 2002. Т.38, №2. - С.169-173. 2. Бадалян C.M., Гаспарян А.В., Гарибян Н.Г. Исследование антиоксидантной активности некоторых базидиальных макромицетов // Микол. и фитопатол. 2003. Т.37, вып.5. - С.63-67. 3. Белова Н.В. Перспективы использования биологически активных соединений высших базидиомицетов // Микол. и фитопатол. 2004. Т.38, вып.2. - С.1-6. 4. Бухало А.С., Соломко Е.Ф., Митропольская Н.Ю. Базидіальні макроміцети з лікарськими влас Комп’ютерна верстка А. Рябко 12384 6,07 6,20 6,15 12 25,48±2,02 26,59±2,41 27,16±1,07 7,96±0,76 9,01±0,23 8,89±0,23 тивостями // Укр. ботан. журн. - 1996. - 53, №3. С.192-201. 5. Владимиров Ю.А., Арчаков А.И. Перекисное окисление липидов в биологических мембранах. М.: Наука, 1972. - 252с. 6. Дудка И.А., Вассер С.П., Элланская И. А. Методы экспериментальной микологии. Справочник. - К.: Наук. думка, 1982. - 550с. 7. Капич А.Н. Антиокислительная активность экстрактов мицелия ксилотрофных базидиомицетов // Микол. и фитопатол. 1995. Т.29, вып.5-6. С.35-40. 8. Капич А.Н., Шишкина Л.Н. перекисное окисление липидов и его регуляция в мицелии ксилотрофных базидиомицетов // Микробиология. 1995. Т.64, №3. - С.320-326. 9. Капич А.Н., Гвоздкова Т.С. Содеожание в грибах продуктов перекисного окисления липидов, реагирующих с тиобарбитуровой кислотой // Микол. и фитопатол. 1998. Т.32, вып.4. - С.30-36. 10. Приседський Ю.Г. Статистична обробка результатів біологічних експериментів. - Донецьк: Кассиопея, 1999. - 210с. 11. Соломко Э.Ф., Дудка И.А. Перспективы использования высших базидиомицетов в микробиологической промышленности// ВНИСЭТИ: Обзорная информация, сер.3. - М., 1985. - 48с. 12. Федотов О.В. Вміст продуктів перекисного окиснення ліпідів в міцелії грибів родів Pleurotus (Fr.) Kumm. та Lentinus (Berk.) Sing. / Збірник наукових праць Луганського національного аграрного університету. - Луганськ: ЛНАУ, 2003. - №22 (34). С.79-81. (прототип) 13. Fedotov O.V. Antioxidizing activity of mycelium of mushroom stocks Pleurotus (Fr.) Kumm. and Flammulina (Curt.: Fr.) Sing. // IJMM. 2001. Vol.3. N2-3. - P.143-144. 14. Tardif A. La Mycotherapie ou Les proprietes Medicinales des Champignons. - Paris, 2000. - 167p. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod of determining the stress state of basidiomycetes and of the ecological state of the place of growing thereof according to the content of lipid peroxidation products
Автори англійськоюFedotov Oleh Valeriiovych
Назва патенту російськоюСпособ определения стрессового состояния базидиомицетов и экологического состояния места их произрастания по содержанию продуктов перекисного окисления липидов
Автори російськоюФедотов Олег Валериевич
МПК / Мітки
Мітки: стану, спосіб, перекисного, зростання, стресового, екологічного, визначення, продуктів, окиснення, базидіоміцетів, вмістом, ліпідів, місця
Код посилання
<a href="https://ua.patents.su/6-12384-sposib-viznachennya-stresovogo-stanu-bazidiomicetiv-ta-ekologichnogo-stanu-miscya-kh-zrostannya-za-vmistom-produktiv-perekisnogo-okisnennya-lipidiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення стресового стану базидіоміцетів та екологічного стану місця їх зростання за вмістом продуктів перекисного окиснення ліпідів</a>
Попередній патент: Плоскощілинна екструзійна головка
Наступний патент: Багатошарова плівка vb2-vn
Випадковий патент: Фенольна смола, спосіб її одержання, апретувальний склад для мінеральних волокон, його застосування та ізоляційний матеріал