Спосіб культивування sтrертомyсеs аvеrмітіlіs
Номер патенту: 14514
Опубліковано: 09.01.1997
Автори: Ісаєнко Володимир Миколайович, Дріняєв Віктор Антоновіч, Крамаренко Раїса Миколаївна, Чугуй Валентина Олексіївна, Карпутіна Маргарита Віталіївна, Михалєвська Тетяна Вячеславівна
Формула / Реферат
1. Способ культивирования Streptoniyces avermitilis, включающий выращивание вегетативного посевного материала в стерильной питательной среде, содержащей лактозу, водопроводную воду, проведение процесса биосинтеза авермекти-нов при внесении вегетативного посевного материала в стерильную ферментационную среду, содержащую глюкозу, кукурузный экстракт, соевую муку, водопроводную воду, отличающийся тем, что в питательную среду для вегетативного посевного материала дополнительно вводят кукурузный экстракт в количестве 1,0-1,5%, белково-витаминпый концентрат 0,4-0,6%, вегетативный посевной материал добавляют в ферментационную среду, включающую глюкозу в количестве 4,5-5,0%, проводят процесс биосинтеза в течение 36-48 ч, затем добавляют глюкозу в количестве 1,0-2,0% и дополнительно биостимулятор растительного происхождения в количестве 0,5-3,0% с содержанием сухих веществ 9,0-12,0%.
2. Способ по п. 1, отличающийся тем, что в качестве биостимулятора растительного происхождения используют гидролизат из клубней топинамбура в количестве 2,0-3,0% с содержанием редуцирующих веществ 9,0-12,0%.
3. Способ по п. 1, отличающийся тем, что в качестве биостимулятора растительного происхождения используют экстракт из клубней топинамбура в количестве 0,5-1,0%.
4. Способ по п. 1, отличающийся тем, что в качестве биостимулятора растительного происхождения используют экстракт из листьев топинамбура в количестве 0,5-1,0%.
Текст
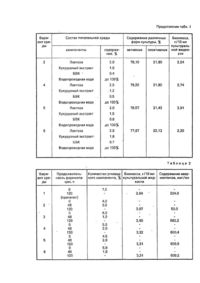
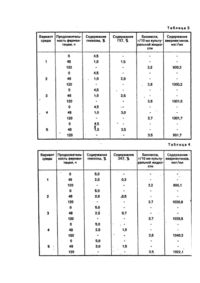
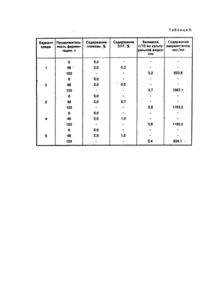
Изобретение oтносится к микробиологической отрасли и может быть использовано в производстве биологически активных веществ - авермектинов. Продуцентом авермектинов является культура Streptomyces avermltilis. В современном микробиологическом производстве для получения авермектинов применяется способ, включающий в себя стадию роста спор на твердой агаризованной среде, стадию получения вегетативного посевного материала (ВПМ) и продуктивную ферментацию продолжительностью до 8 сут при постоянной температуре 27728°С с использованием в качестве источников питания: углерода - декстрозу, азота -комбинацию пептона с автолизатом дрожжей (Albers-Schonberg G., Burg R. W., Miller T.W, et аr. Strain of Streptomyces for producing antlparasitic Compounds: Pat. USA № 4429042). Однако данный способ не приемлем для культивирования отечественных штаммов Streptomyces avermltllis. Известен способ культивирования S.avermitllls ВКМ Ас 1301 (Черменский Д. Н., Аданин В. М., Дриняев В. А., Ковалев В. Н., Головлева Л. А. Авермектины. Биотехнологические особенности штамма-продуцента Streptomyces avermltilis ВКМ Ас 1301. - Прикладная биохимия и микробиология, 1991, т. 27, вып. 6, с. 838-844), включающий выращивание ВПМ в колбах на качалке с числом оборотов n=220 мин -1 при 28°С в течение 24-72 ч на стерильной питательной среде следующего состава (г/л): лактоза - 20; соевая мука - 15; дрожжевой экстракт -5. Затем ВПМ в количестве 10 % вносят в стерильную ферментационную среду, имеющую состав, %: глюкоза - 7; соевая мука -1,2; сухие дрожжи - 0,6; кукурузный экстракт - 0,3; кальций углекислый 0,6; остальное - водопроводная вода. Все компоненты среды вносят в начале процесса ферментации. Культивирование осуществляют в металлических ферментерах при 27°С в течение 120 ч. При таком способе культивирования выход авермектина В і составляет 60 мкг на 1 мл культуральной жидкости. Однако данный способ культивирования не обеспечивает максимальный выход авермектинов при культивировании S.avermltHis ВНИИСХМ-51, а также не учитывает свойство культуры подвергаться значительному расщеплению (диссоциации) с выделением непродуктивных форм, В основу изобретения поставлена задача усовершенствования способа культивирования S.avermitllis путем изменения состава питательной среды для получения ВПМ и состава ферментационной среды, а также применения двухсгадийной задачи углеводного компонента и биостимулятора растительного происхождения в ферментационную среду обеспечить улучшение качества ВПМ, сокращение длительности процесса биосинтеза, увеличить содержание авермектинов при использовании дешевого растительного сырья. Поставленная задача решается тем, что в способе культивирования S.avermltilis, включающем выращивание ВПМ в стерильной питательной среде, содержащей лактозу, водопроводную, воду, проведение процесса биосинтеза авермектинов при внесении ВПМ в стерильную ферментационную среду, содержащую глюкозу, кукурузный экстракт, соевую муку, водопроводную воду, согласно изобретению, в питательную среду для ВПМ дополнительно вводят кукурузный экстракт & количестве 1,0-1,5%, белково-витаминный концентрат (БВК) 0,40,6%, ВПМ добавляют в ферментационную среду, включающую глюкозу в количестве 4,5-5,0 %, проводят процесс биосинтеза в течение 36-48 ч, затем добавляют глюкозу в количестве 1,0-2,0 % и дополнительно биостимулятор растительного происхождения в количестве 0,5гЗ,0% с содержанием сухи х веществ (СВ) 9,0-12,0 %. Можно в качестве биостимулятора растительного происхождения использовать гидролизат из клубней топинамбура (ГКТ) в количестве 2,0-3,0% с содержанием редуцирующи х веществ (РВ) 9,0-12,0 %. Можно в качестве биостимулятора растительного происхождения использовать экстракт из клубней топинамбура (ЭКТ) в количестве 0,5-1,0 %. Можно в качестве биостимулятора растительного происхождения использовать экстракт из листьев топинамбура (ЭЛТ) в количестве 0,5-1,0%. Причинно-следственная связь между предлагаемыми признаками и ожидаемым техническим результатом заключается в следующем. Предлагаемый способ культивирования S.avermitilis имеет ряд преимуществ по сравнению с существующими. Применяемые составы питательных сред для выращивания ВПМ S.a vermitilis отечественных штаммов приводят к образованию значительного количества неактивных форм культуры - аспорогенных, карликовых и нетипичных. Снижение процента выщепления неактивных форм продуцента при использовании питательной среды предлагаемого состава происходит, повидимому, за счет ее обеднения азотистыми компонентами. Снижение содержания пептидов и аминокислот в питательной среде обусловлено исключением из ее состава соевой муки. Частичная компенсация азотистых и рострoвых компонентов, присутствующи х в исключенной из предлагаемой питательной среды соевой муке, осуществляется благодаря включению в ее состав БВК (сухие дрожжи), представляющего собой биомассу кормовых дрожжей, выращиваемую биотехнологическими предприятиями на парафинах нефти, а также добавлением в среду к укур узного экстракта, являющегося отходом крахмалопаточного производства. Кроме того, введение БВК в питательную среду дает возможность исключить из ее состава дорогостоящий дрожжевой экстракт. Из всех известных продуцентов отечественных штаммов S.avermitills для исследований выбран S.avermltilis ВНИИСХМ-51. Изменение процента неактивных форм S.avermitilis при использовании различных количеств предлагаемых компонентов питательной среды для получения ВПМ, в сравнении со средойпрототипом, представлены в табл.1. Из табл. 1 видно, что наиболее результативными для получения качественного ВПМ являются варианты сред 3-5. Известно, что биосинтез авермектинов-двухстадийный процесс. На первой стадии, продолжительность которой соетавляет36-48 ч, идет накопление биомассы продуцента до достижения стационарной фазы роста, На второй стадии происходит непосредственно биосинтез авермектинов при медленной скорости роста биомассы клеток. Можно предположить, что применение более обедненной по углеводному компоненту ферментационной среды на 1-й стадии биосинтеза приводит к накоплению более продуктивной биомассы и, следовательно, внесение вначале процесса ферментации we всего сразу углеродсодержащего компонента, а лишь большей его части, интенсифицирует процесс накопления авермектинов на 2-й стадии биосинтеза и способствует сокращению времени ферментации. Однако, для обеспечения медленного обновления биомассы на 2-ой стадии необходимо дополнительно внести оставшийся углеводный компонент. Оптимальные процентные соотношения углеводного компонента, вносимые на 1-ой и 2-й стадиях ферментации составляют 4,5-5,0 и 1,0-2,0 % соответственно (табл. 2). Таким образом, варианты сред 4-6 (табл. 2) двухстадийного внесения углеводного компонента в ферментационную среду приняты нами за фенову, В предлагаемом способе культивирования S.avermitflis решается важная задача, предъявляемая к микробиологическому производству, -увеличение количества получаемого продукта и применение дешевого легковозобновляемого сырья. В заявляемом способе замена части углеводного компонента ферментационной среды глюкозы на ГКТ, содержащей наряду с биостимуляторами фруктозу (углевод, наиболее предпочтительный для питания S.avermltilis) приводит к увеличению содержания авермектинов на 15-25%. ГКТ готовят по стандартной методике (Нахманович Б. М. Гидролиз инулина в соках цикория. - Труды КТИПП им. Микояна, К., 1938, №1,с. 31-42). Топинамбур, являющийся источником дорогостоящей фруктозы, может быть также ценным сырьем для микробиологического производства с точки зрения наличия в нем, особенно в листьях, значительного количества стимуляторов биосинтеза органических кислот, аминокислот, ферментов, витаминов и минеральных ве ществ. При использовании в ферментационной среде в качестве добавки к глюкозе ЭКТ содержание авермектинов увеличивается на 15-30 %, а ЭЛТ-на 30-45%. ЭКТ и ЭЛТ готовят общепринятым способом (Бурштейн Л. И. Методы исследования пищевых продуктов. К., Госмедиздат УССР, 1963, с. 643). Такое увеличение биосинтетической активности продуцента авермектинов обусловлено, повидимому, наличием в корнеплодах и листьях топинамбура стимуляторов биосинтеза, например, фумаровой кислоты, являющейся характерным химическим признаком рода Heliantus семейства сложноцветных, большим количеством неидентифицированных органических кислот (56-72 % - в клубнях и 64-81 % от общего количества кислот- в листьях), а также наличием полного состава незаменимых аминокислот, содержание которых, особенно в зеленой массе, является повышенным по сравнению с другими культурами. Способ осуществляют следующим образом. Споровый материал S.avermitilis вносят в качалочные колбы, содержащие питательную среду следующего состава (%): лактоза - 2,0-4,0; кукур узный экстракт- 1,0-1,5; БВК - 0,4-0,6; остальное - водопроводная вода. Колбы устанавливают на качалку с числом оборотов 220 мин" и выращивают ВПМ при 28°С в течение 36-60 ч. Затем ВПМ в количестве 10 % передают в ферментер, содержащий ферментационную среду следующего состава,%: глюкоза 4,5-5,0; кукурузный экстракт - 0,3-0,6; соевая мука - 0,9-1,2; БВК -0,6-1.2; остальное водопроводная вода. Ферментацию осуществляют при 28°С. После 36-48 ч ведения процесса биосинтеза (стационарная фаза) в ферментер добавляют глюкозу в количестве 1,0-2,0 % и дополнительно биостимулятор растительного происхождения с 9,0-12,0 % СВ в количестве 0,53,0 %. В качестве такого биостимулятора растительного происхождения можно использовать различные добавки, приготовленные на основе топинамбура. Например, гидроли-зат из клубней топинамбура в количестве 2,0-3,0 % с содержанием редуцирующи х веществ 9,0-12,0 %. Или можно использовать экстракт из клубней топинамбура в количестве 0,5-1,0 %, Возможно также использование экстракта из листьев топинамбура в количестве 0,5-1,0 %. Примеры 1-3 осуществления способа приведены с использованием штамма S.avermitllls ВНИИСХМ-51, а пример 4 -штамма S.avermitllis ВНИИСМ-54. Пример 1. Споровый материал S.avermlttlls ВНИИСХМ-51 вносят в конические колбы емкостью 750 мл, содержащие питательную среду следующего состава (%): лактоза -2,0; кукурузный экстракт -1,2; БВК -0,5; остальное - водопроводная вода, Колбы устанавливают на качалку с числом оборотов n=220 мин-1 и выращивают ВПМ при 28°С в течение 48 ч. Затем ВПМ в количестве 10 % передают в ферментер, содержащий ферментационную среду следующе го состава (%): глюкоза - 4,5; кукурузный экстракт - 0,3; соевая мужа - 1,2; БВК - 0,6; остальное водопроводная вода. Проводят процесс биосинтеза в течении 48 Ч, после чего добавляют глюкозу в количестве 1 % и дополнительно ГКТ с СВ 9,0-12,0 % и продолжают культивировать до 120 ч. Оптимальное количество вносимого в ферментационную среду ГКТ составляет 2,0-3,0 % (табл. 3, варианты 2-4). Пример 2. Выращивание ВПМ осуществляют таким же способом, как и в примере 1. После этого ВПМ в количестве 10 % передают в ферментер, содержащий ферментационную среду следующего состава, %: глюкоза - 5,0; кукурузный экстракт - 0,3; соевая "мука - 1,2; БВК - 0,9; остальное - водопроводная вода. Проводят процесс биосинтеза в течение 48 ч, после чего добавляют глюкозу в количестве 2,0% и дополнительно ЭКТ с СВ 9,0-12,0 % и культивируют продуцент до 120 ч. Оптимальное количество вносимого в ферментационную среду ЭКТ составляет 0,5-1,0 % (табл. 4, варианты 2-4). Пример 3. Все операции осуществляют как в примере 2, только после 48 ч ферментации в ферментер наряду с 2,0% глюкозы дополнительно вносят ЭЛТ с СВ 9,0-12,0 % и осуществляют выращивание продуцента до 120 ч. Оптимальное количество вносимого в ферментационную среду ЭЛТ составляет 0,5-1,0 % (табл. 5, варианты 2-4). Пример 4. В качестве продуцента авермектинов использовали штамм S.avermitlUs ВНИИСХМ-54. Способ осуществляли как в примере 2 при добавлении в ферментационную среду 0,5 % ЭКТ. В результате культивирования продуцента содержание авермектинов в культуральной жидкости после 120 ч ведения процесса биосинтеза составляло 2070 мг/мл.
ДивитисяДодаткова інформація
Автори англійськоюIsaienko Volodymyr Mykolaiovych, Chuhui Valentyna Oleksiivna, Kramarenko Raisa Mykolaivna
Автори російськоюИсаенко Владимир Николаевич, Чугуй Валентина Алексеевна, Крамаренко Раиса Николаевна
МПК / Мітки
МПК: C12R 1/465, C12N 1/20, C12P 17/18, C12P 1/06
Мітки: спосіб, avermitilis, культивування, sтrертомyсеs
Код посилання
<a href="https://ua.patents.su/6-14514-sposib-kultivuvannya-strertomyses-avermitilis.html" target="_blank" rel="follow" title="База патентів України">Спосіб культивування sтrертомyсеs аvеrмітіlіs</a>
Попередній патент: Спосіб оцінки професійної адаптації
Наступний патент: Електричний фільтр для ловлення часток пилу
Випадковий патент: Спосіб модуляції сd95-опосередкованого апоптозу