Спосіб визначення пептидів, притаманних білкам рослинного походження
Номер патенту: 45059
Опубліковано: 26.10.2009
Автори: Дроздов Олексій Леонідович, Кошелєв Олег Станіславович, Шалапута Тетяна Миколаївна, Гайдаш Олександра Миколаївна, Китенко Наталія Вікторівна, Білоножко Максим Васильович
Формула / Реферат
Спосіб визначення пептидів, притаманних білкам рослинного походження, що включає підготовку проби до тестування, екстрагування білків, їх розділення на пептиди під впливом домішки трипсину, очищення, рідинне хроматографування, мас-спектрометричне сканування пептидів, формування і оцінку пептидної карти за допомогою комп'ютерної програми, який відрізняється тим, що додатково як елюент рідинної хроматографії залучають суміш ацетонітрилу з водою, з перемінним градієнтом співвідношень об'ємних частин 0:100-100:0 в динаміці рідинного хроматографування, доводять його тривалість до 20 хв., іонізують пептиди шляхом електророзпилювання, сканують позитивні іони мас-спектрометричним шляхом, в діапазоні 10-2000 атомних одиниць маси, за пептидною картою ідентифікують піки іонів пептидів за часом утримання та співвідношенням маси іона до його заряду, та констатують їх рослинне походження, якщо піки позитивних іонів пептидів фіксують в діапазоні 500-1000 атомних одиниць маси.
Текст
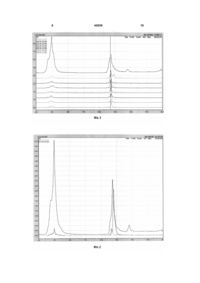
Спосіб визначення пептидів, притаманних білкам рослинного походження, що включає підготовку проби до тестування, екстрагування білків, їх розділення на пептиди під впливом домішки трип 3 До основи дійсної корисної моделі поставлена задача винайти спосіб визначення пептидів притаманних білкам рослинного походження, використання котрого дозволило б на основі опрацювання шляхів пептидного картування збільшити точність тестування та лабораторні зручності. Поставлена задача вирішується тим, що при використанні у відомому способі визначення пептидів притаманних білкам рослинного походження, що включає підготовку проби до тестування, екстрагування білків, їх розділення на пептиди під впливом домішки трипсину, очищення, рідинне хроматографування, мас-спектрометричне сканування пептидів, формування і оцінку пептидної карти за допомогою комп'ютерної програми, відповідно до корисної моделі, додатково як елюент рідинної хроматографії залучають суміш ацетонітрилу з водою, з перемінним градієнтом співвідношень об'ємних частин 0:100-100:0 в динаміці рідинного хроматографування, доводять його тривалість до 20хвил., іонізують пептиди шляхом електророзпилювання, сканують позитивні іони мас-спектрометричним шляхом, в діапазоні 102000 атомних одиниць маси, за пептидною картою ідентифікують піки іонів пептидів за часом утримання та співвідношенням маси іону до його заряду, та констатують їх рослинне походження, якщо піки позитивних іонів пептидів фіксують в діапазоні 500-1000 атомних одиниць маси. Причинно-наслідковий зв'язок сукупності відмітних ознак дійсної корисної моделі з вищезазначеним технічним результатом полягає в наступному. Застосування суміші ацетонітрилу з водою з перемінним градієнтом співвідношень об'ємних частин від 0:100 до 100:0(%) протягом хроматографування оптимізує розділення пептидних фрагментів при їх відокремленні як від залишків проби, так і продуктів трипсинового автолізу. Тобто, зміна об'ємних співвідношень ацетонітрила і води в межах 0:100-100:0 підвищує елюенцію хроматографування, необхідну для збільшення точності кінцевого результату та покращення лабораторних зручностей. На інший погляд заявника, суміш ацетонітрилу з водою забезпечує спорідненість досліджуваної субстанції та води з елюентом, утворює між періодами їх утримання інтервали, що є достатніми для виявлення слабковиражених піків і допускає реалізацією, якомога, більшої чутливості, лінійності, у розширеному діапазоні характеристичних пептидів. Проведення рідинного хроматографування протягом 20хвил. в умовах градієнтного елюювання аналізату прискорює розділення компонентів проби. У порівнянні з ізократичним елююванням, це активує процес поділу пептидних піків і скорочує термін оцінки, у порівнянні з ізократичним елююванням, що відповідає рішенню поставленої задачі. Іонізація пептидів шляхом електророзпилювання забезпечує утворення одно- (z=1) чи багатозарядних (z=n) позитивних молекулярних іонів пептидів, відповідно до закономірностей: М+Н+=МН+ М+nН+=(МНn)n+ 45059 4 де: М - нейтральна молекула пептидного фрагменту; + H - Протон, отриманій внаслідок електризації суміші води та ацетонітрилу у потоці газоподібного азоту; + МН - протонований однозарядний молекулярний іон; n - кількість зарядів. Сканування позитивних іонів масспектрометричним шляхом, переважно в діапазоні 10-2000 атомних одиниць маси (ат.од.м.), виявляє пептиди білків рослинного та тваринного походження, а ідентифікація хроматографічних піків іонів пептидів, за часом утримання і співвідношенням маси іону до його заряду (m/z) за допомогою пептидної карти, дозволяє виявити іони пептидів рослинного походження, в діапазоні 5001000ат.од.м. у даному ряді. Таким чином, в результаті хроматографічного мас-сканування виникає тримірна картина, де одним виміром є час утримання хроматографічних піків, другим - значення співвідношень мас позитивних молекулярних іонів пептидів до їхнього заряду (m/z), а третім - інтенсивність аналітичного сигналу, яка залежить від кількості задетектованих молекулярних іонів пептидів (мал. 1). При цьому ділянка мас-хроматограми, на відрізку значень позитивних іонів 500-1000ат.од.м., що фіксується в межах 10-14хвил. пептидної карти, інформує про наявність в аналізаті білків рослинного походження. За цих умов збільшується точність тестування, оскільки пропонований діапазон фіксації позитивних іонів є більш показовим для протеїнів рослинного походження, ніж для білків м'ясних продуктів, а кількісні характеристики пептидів на цьому відрізку дозволяють типувати й відрізняти протеїни рослинного походження (в нашому випадку сої) від натуральних тваринних білків. Ідентифікація хроматографічних піків іонів пептидів за часом їх утримання, та співвідношенням маси до заряду (m/z) характеризує конкретний пептид більш вірогідно, ніж форма вищезазначеного «відбитка» за прототипом. Це забезпечує типову кваліфікацію і відрізнення протеїнів рослинного походження від натуральних тваринних білків. Перевершення точності досягається й за рахунок кількісних значень вищенаведених характеристик. Поряд із цим, це підвищує лабораторні зручності, адже застосування кількісних критеріїв та їх диференціювання у мас-спектральному діапазоні виключає дослідження структури та послідовності чергування амінокислот пептидів, застосування бази форм тандемних мас-спектрів пептидів і необхідність її регулярного поновлення. Тож, запропоновані відмінні ознаки корисної моделі є суттєвими, адже за сукупністю вони необхідні і достатні для вирішення поставленої задачі й досягнення заявленого технічного результату. Сукупність відмінних суттєвих ознак, що характеризує дійсний спосіб, невідома з рівня техніки, а від того є новою, поширюється на усі випадки його багаторазової реалізації та розповсюджується на затребуваний об'єм його правового захисту. Відомості, які підтверджують можливість відтворення способу визначення пептидів притаман 5 них білкам рослинного походження, з можливістю перевершення вищезазначеного технічного результату, полягають в наступному. Спосіб ілюструється зображенням характеристичних пептидів сої (Фіг.1, 2), виглядом пептидів трипсину (Фіг..3) і технічною характеристикою (табл.1). Сутність. Для відтворення способу залучають хроматографічну мас-спектрометричну систему «Shimadzu LCMS-2010EV» (Японія), що складається з дегазатора «Shimadzu DGU-20A3», двох плунжерних насосів «Shimadzu LC-20AD», градієнтної системи високого тиску та хроматографічних колонок «Marcherey-Nagel» (Ø 2мм і довжиною 125мм). Для мас-специфічного сканування на довжин хвиль 190-800 нм залучають спектрометричний діодноматричний детектор «Shimadzu SPD-M20A» (Японія) у комплексі з квадрупольним масспектрометричним детектором і пристосуванням для іонізації потоку елюенту «Shimadzu LCMS2010EV» (Японія). Як хроматографічний елюент залучають суміш ацетонітрилу з водою, з перемінним градієнтом співвідношення їхніх об'ємних частин 0:100–100:0 в динаміці хроматографування. Також застосовують оберненофазовий сорбент «Nucleosil 100-5 С18 HD», у вигляді 5мкм гранул, передколонку 10мм довжини і термостат «Shimadzu CTO-20A» (Японія), а для оцінки пептидної карти - комп'ютерну програму «LCMSsolution» («Shimadzu», Японія). Щоб підготовити пробу до тестування, її послідовно піддають гомогенізації, диспергуванню, інкубації, центрифугуванню та мікроскопічній фільтрації. Це сприяє безперешкодній реалізації процесу та перевершенню вищезазначеного технічного результату в напрямах посилення точності і покращення лабораторних зручностей за рахунок усунення викривлень форм хроматографічних піків, кількісних значень запропонованих характеристик пептидної карти і без залучення бази форм тандемних мас-спектрів пептидів. Надалі, під впливом домішки трипсину, здійснюють гідроліз білків та розділяють їх на пептиди, піддають очищенню, рідинному хроматографуванню, використовуючи хроматографічну систему «Shimadzu». Здійснюють мас-спектрометричне сканування, за допомогою квадрупольного масспектрометричного детектора «Shimadzu», формують пептидну карту та оцінюють її за допомогою комп'ютерної програми «LCMSsolution». При цьому як елюент рідинної хроматографії залучають суміш ацетонітрилу з водою, з перемінним градієнтом співвідношень об'ємних частин 0:100-100:0 в динаміці хроматографування. Доводять її тривалість до 20хв. Іонізують вивільнені пептиди шляхом електророзпилювання та сканують їх позитивні іони мас-спектрометричним шляхом в діапазоні 10-200ат.од.м., за допомогою квадрупольного масспектрометричного детектора «Shimadzu». За пептидною картою ідентифікують хроматографічні піки останніх, за такими кількісними показниками як час утримання та співвідношенням маси іону до його заряду. При цьому констатують рослинне походження позитивних іонів пептидів, якщо їх 45059 6 фіксують в діапазоні 500-1000ат.од. маси, тобто визначають наявність пептидів притаманних рослинним білкам (у нашому випадку сої). Висока селективність та специфічність спектрометричного шляху сканування позитивних іонів шляхом мас-фільтрування, допускає виявлення в одному хроматографічному піці одного часу утримання і декілька мас-піків (в діапазоні 5001000ат.од.м), достатніх для визначення у продукті слідів характеристичних пептидів рослинного походження високоточним чином, оскільки після селективного подрібнення білків і протеїнів трипсином, виникає можливість ідентифікації пептидних зв'язків, сформованих карбоксильними групами амінокислот лізину, аргініну та груп пептидів, що об'єктивно характеризують різновиди походження білків та протеїнів. Технічна характеристика способу, що низведена у таблиці, інформує про числові дані хроматографування підготовленого зразку рослинного білку, характерні для відокремлення пептидів притаманних рослинам (у нашому випадку сої) від інших. В таблиці показано час виходу з хроматографічної колонки продуктів автолізу трипсину, а саме: 14-15 хвилин, та співвідношення маси до заряду (m/z) позитивних молекулярних іонів пептидів, що є продуктами автолізу, а саме: 516, 560, 604, 648, 692, 736, 780, 824, 868ат.од.м., тобто тих складових пептидної карти, які не є притаманними рослинним пептидам. В таблиці також наведений час виходу з хроматографічної колонки пептидів, які є продуктом трипсинового подрібнення білків об'єкту, що аналізується (у нашому випадку сої), а саме: 11-12 хвилин, та співвідношення маси до заряду (m/z) позитивних молекулярних іонів пептидів 504, 548, 592, 608, 613, 636, 680, 724 та 768ат.од.м. При цьому, саме пептиди з m/z=608 та 613 й є притаманними білкам рослинного походження (у нашому випадку білкам сої). За цих умов істотно збільшують точність тестування та покращують лабораторні зручності. Приклад. Пробу біологічного об'єкту піддавали тестуванню на наявність домішки сої. Вибір сої для визначення пептидів притаманних рослинним білкам у нашому випадку обумовлений найбільшою поширеністю продуктів з неї, в якості харчових [2]. Для цього аналізат, масою до 150г, піддавали гомогенізації за допомогою побутового блендера (подрібнювача тканин), задля диспергування, порушення клітинної структури та реалізації однорідної маси. Гомогенат у кількості 0,02г відбирали у скляний гомогенізатор, розтирали маточкою, додаючи 0,5% розчин амонійно-гідрокарбонатного буферу при рН=8,2, трьома порціями по 0,5мл. Здійснювали диспергування 8,2 рН амонійногідрокарбонатним буфером, що забезпечувало вивільнення протеїнів та їх переведення у суспензію. Отриману суміш обсягом ∼20мл диспергували у цьому ж буфері. Кислотність диспергованої суспензії обирали як адекватну до трипсину, що є ферментом підшлункової залози людини. Від диспергованої проби відбирали 4мл аліквоту, до котрої додавали першу 0,5мл порцію свіжоприготовленого розчину трипсину на 0,001Н хлорводневої 7 кислоти, а потім перемішували та інкубували при Т° 37°С у сухоповітряному термостаті біля 12 годин. Потім додавали другу 0,5мл порцію суміші трипсину на 0,001Н хлорводневої кислоти, що сприяло подрібненню протеїнів на пептидні ланцюжки по карбоксильним групам амінокислот лізину й аргініну. Порційне введення трипсину в інкубоване середовище було необхідним для обмеження його автолізу, адже трипсин має протеїнове походження та схильний до подрібнення на пептидні фрагменти. Це дозволило отримати характеристичні пептидні фрагменти, притаманні білкам як тваринного, так і рослинного походження. Подрібнення протеїнів на пептидні фрагменти трипсину здійснювали при Т° 37°С. Для вивільнення нерозчинених залишків, які заважають хроматографічному розділенню пептидних фрагментів, аналізат піддавали центрифугуваню. Центрифугування здійснювали зі швидкістю ~1500об/хвил протягом 5 хвил, а потім переносили у пластикові мікроконтейнери типу «Епендорф» і завершували його з кутовою швидкістю ~7000об/хвил. через 10хвил. Для стабілізації хроматографічної системи отриманий супернатант піддавали мікроскопічній фільтрації, задля зменшення забруднення хроматографічної колонки твердими мікрочастинками. Після підготовки проби до екстрагування білків, в ній визначали наявність пептидів, притаманних білкам рослинного походження. Для цього 10мкл фільтрату впорскували у хроматограф «Shimadzu», а як елюент хроматографічного процесу застосовували суміш ацетонітрилу з водою, з перемінним градієнтом співвідношень об'ємних частин 0:100-100:0 в динаміці хроматографування. Застосування елюенту в межах перемінного градієнту співвідношень об'ємних частин його компонентів сприяло оптимізації елюенції, а від того, збільшенню точності тестування. 20 хвилинна тривалість рідинного хроматографування була прийнятною в напрямах збільшення точності тестування та лабораторних зручностей 45059 8 за рахунок точного поділу пептидних піків в діапазоні сканування та скорочення тривалості оцінки аналізату. Для утворення одно- чи багатозарядних позитивних молекулярних іонів пептидів їх піддавали іонізації шляхом електророзпилювання. Позитивні іони останніх сканували за допомогою квадрупольного мас-спектрометричного детектора «Shimadzu», в діапазоні співвідношень мас іонів до заряду 10-2000ат.од. маси, з можливістю виявлення пептидів білків як рослинного, так і тваринного походження. Використовуючи пептидну карту, отриману програмою «LCMSsolution», ідентифікували хроматографічні піки іонів пептидів за часом утримання та співвідношенням маси іону до його заряду та констатували рослинне походження іонів пептидів (у нашому випадку пептидів притаманних сої), оскільки характерні для них мас-піки 608 і 613ат.од.м. фіксували в діапазоні 5001000ат.од.м. (див. Фіг.1). Наданий приклад конкретного використання способу демонструє можливість багаторазового використання кількісних характеристик пептидів, типової кваліфікації при відрізнення протеїнів рослинного походження від натуральних тваринних білків, без апгрейту комп'ютерної бази нових форм тандемних мас-спектрів пептидів, що покращує точність і лабораторні зручності, а поряд із цим, розширює межі пептидного картування у сфері контролювання якості харчових продуктів, біологічно-активних добавок та регуляції вмісту соєвих білків у лікарських препаратах, що у перспективі зв'язується з покращенням якості харчових продуктів і результативності лабораторної праці, що відповідає умові «промислова придатність». Характеристика способу, яка зазначена у формулі, визначає межі його правового статусу та забезпечує відрізнення від об'єктів аналогічного призначення, а з урахуванням наведених тверджень, допускає можливість його кваліфікації як корисної моделі процесу. Таблиця Технічна характеристика визначення характеристичних пептидів сої Показники та од. їх вимірювання Час виходу піків продуктів автолізу трипсину, хвил m/z позитивних молекулярних іонів пептидів, що виникають внаслідок автолізу трипсину, ат.од.м. Час виходу піків пептидів, притаманних білкам рослинного походження, хвил m/z позитивних молекулярних іонів пептидів притаманних білкам рослинного походження, ат.од.м. m/z позитивних молекулярних іонів пептидів притаманних білкам сої, ат.од.м. Значення 14-15 516, 560, 604, 648, 692, 736, 780, 824, 868 11-12 504, 548, 592, 608, 613, 636, 680, 724, 768 608, 613 Джерела інформації: 1. Масс-спектрометрия в органической химии / А.Т.Лебедев. -М.: БИНОМ. Лаборатория знаний, 2003. С.321-323. 2. Гігієна харчування з основами нутриціології. / В.І.Ципріян та ін. Навч. посібник - К.:3доров'я, 1999. 568с. 9 45059 10 11 Комп’ютерна верстка Н. Лиcенко 45059 Підписне 12 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for determination of peptides specific for proteins of plant origin
Автори англійськоюDrozdov Oleksii Leonidovych, Koshelev Oleh Stanislavovych, Bilonozhko Maksym Vasyliovych, Kytenko Natalia Viktoprivna, Haidash Oleksandra Mykolaivna, Shalaputa Tetiana Mykolaivna
Назва патенту російськоюСпособ определения пептидов, характерных для белков растительного происхождения
Автори російськоюДроздов Алексей Леонидович, Кошелев Олег Станиславович, Билоножко Максим Васильевич, Китенко Наталья Викторовна, Гайдаш Александра Николаевна, Шалапута Татьяна Николаевна
МПК / Мітки
МПК: G01N 33/15, G01N 30/00
Мітки: визначення, білкам, походження, рослинного, притаманних, пептидів, спосіб
Код посилання
<a href="https://ua.patents.su/6-45059-sposib-viznachennya-peptidiv-pritamannikh-bilkam-roslinnogo-pokhodzhennya.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення пептидів, притаманних білкам рослинного походження</a>
Попередній патент: Катодний матеріал літієвого джерела струму
Наступний патент: Імпульсний стабілізатор напруги
Випадковий патент: Панель опалубки (варіанти)