Похідні 3,6-диметил-n,4-діарил-4,7-дигідроізоксазоло[5,4-b]піридин-5-карбоксамідів і спосіб їх одержання
Номер патенту: 99692
Опубліковано: 10.09.2012
Автори: Муравйова Олена Олександрівна, Афанасіаді Людмила Михайлівна, Десенко Сергій Михайлович, Чебанов Валентин Анатолійович, Руденко Роман Володимирович
Формула / Реферат
1. Похідні 3,6-диметил-N,4-діарил-4,7-дигідроізоксазоло[5,4-b]піридин-5-карбоксамідів формули І
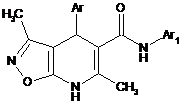 , I
, I
де Аr = С6Н5; 2-СН3О-С6Н4; 3-СН3О-С6Н4; 4-СН3О-С6Н4;
4-СН3-С6Н3; 2-СН3С6Н4; 4-Сl-С6Н4; 4-Вr-С6Н4;
4-F-C6H4; 3-Cl-C6H4; 2-Cl-C6H4; 3-Br-C6H4; 2,4-диCl-C6H3;
3,4-диCl-C6H3; 2,6-диCl-C6H3; 3-F-C6H4; 2-F-C6H4;
2-F-6-Cl-C6H3; 3,4-диCH3O-C6H3; 2,4-диCH3O-C6H3;
2,5-диCH3O-C6H3; 2,3-диCH3O-C6H3; 3,4,5-триCH3O-C6H2;
2,4,5-триCH3O-C6H2; 4-SCH3-C6H4; 4-CH(CH3)2-C6H4;
4-CH3CH2-C6H4; 4-CH3CH2O-C6H4; 2-CH3CH2O-C6H4;
4-CN-C6H4; 4-COOH-C6H4; 4-COOCH3-C6H4; 4-NO2-C6H4;
3-NO2-C6H4; 4-OH-C6H4; 3-OH-C6H4; 3,4-диOH-C6H3;
3-CH3O-4-OH-C6H4;4-CH3O-3-OH-C6H4;
3-CH3CH2O-4-OH-C6H4; 3-CH3O-4-CH3CH2O-C6H4;
α-C4H3S; β-C4H3S; α-C5H4N; β-C5H4N;
Ar1 = C6H5; 2-CH3O-C6H4; 4-СН3О-С6Н4;
2,4-диCH3-C6H3; 2-CH3-C6H4; 4-ClC6H4.
2. Спосіб одержання похідних формули І
 , I
, I
де Аr = С6Н5; 2-СН3О-С6Н4; 3-СН3О-С6Н4; 4-СН3О-С6Н4;
4-СН3-С6Н3; 2-СН3С6Н4; 4-Сl-С6Н4; 4-Вr-С6Н4;
4-F-C6H4; 3-Cl-C6H4; 2-Cl-C6H4; 3-Br-C6H4; 2,4-диCl-C6H3;
3,4-диCl-C6H3; 2,6-диCl-C6H3; 3-F-C6H4; 2-F-C6H4;
2-F-6-Cl-C6H3; 3,4-диCH3O-C6H3; 2,4-диCH3O-C6H3;
2,5-диCH3O-C6H3; 2,3-диCH3O-C6H3; 3,4,5-триCH3O-C6H2;
2,4,5-триCH3O-C6H2; 4-SCH3-C6H4; 4-CH(CH3)2-C6H4;
4-CH3CH2-C6H4; 4-CH3CH2O-C6H4; 2-CH3CH2O-C6H4;
4-CN-C6H4; 4-COOH-C6H4; 4-COOCH3-C6H4; 4-NO2-C6H4;
3-NO2-C6H4; 4-OH-C6H4; 3-OH-C6H4; 3,4-диOH-C6H3;
3-CH3O-4-OH-C6H4; 4-CH3O-3-OH-C6H4;
3-СН3СН2О-4-ОН-С6Н4; 3-СН3О-4-СН3СН2О-С6Н4;
α-C4H3S; β-C4H3S; α-C5H4N; β-C5H4N;
Ar1 = C6H5; 2-CH3O-C6H4; 4-CH3O-C6H4;
2,4-диCH3-C6H3; 2-CH3-C6H4; 4-ClC6H4,
який відрізняється тим, що проводять конденсацію рівномолярних кількостей 5-аміно-3-ізоксазолу, відповідних заміщених метиленактивних 1,3-дикарбонільних сполук і ароматичних альдегідів у середовищі диметилформаміду або н-бутилового спирту в одну стадію при кипінні протягом 2 - 5 хвилин до утворення цільового продукту.
Текст
Реферат: Пропонуються сполуки 3,6-диметил-N,4-діарил-4,7-дигідроізоксазоло[5,4-b]піридин-5карбоксаміди - загальної формули І H3C Ar O N H N O N H Ar 1 CH3 ,I де Аr = С6Н5; 2-СН3О-С6Н4; 3-СН3О-С6Н4; 4-СН3О-С6Н4; 4-СН3-С6Н3; 2-СН3С6Н4; 4-Сl-С6Н4; 4-Вr-С6Н4; 4-F-C6H4; 3-Cl-C6H4; 2-Cl-C6H4; 3-Br-C6H4; 2,4-диCl-C6H3; 3,4-диCl-C6H3; 2,6-диCl-C6H3; 3-F-C6H4; 2-F-C6H4; 2-F-6-Cl-C6H3; 3,4-диCH3O-C6H3; 2,4-диCH3O-C6H3; 2,5-диCH3O-C6H3; 2,3-диCH3O-C6H3; 3,4,5-триCH3O-C6H2; 2,4,5-триCH3O-C6H2; 4-SCH3-C6H4; 4-CH(CH3)2-C6H4; UA 99692 C2 ОПИС ДО ПАТЕНТУ НА ВИНАХІД (12) UA 99692 C2 4-CH3CH2-C6H4; 4-CH3CH2O-C6H4; 2-CH3CH2O-C6H4; 4-CN-C6H4; 4-COOH-C6H4; 4-COOCH3-C6H4; 4-NO2-C6H4; 3-NO2-C6H4; 4-OH-C6H4; 3-OH-C6H4; 3,4-диOH-C6H3; 3-CH3O-4-OH-C6H4;4-CH3O-3-OH-C6H4; 3-CH3CH2O-4-OH-C6H4; 3-CH3O-4-CH3CH2O-C6H4; α-C4H3S; β-C4H3S; α-C5H4N; β-C5H4N; Ar1 = C6H5; 2-CH3O-C6H4; 4-СН3О-С6Н4; 2,4-диCH3-C6H3; 2-CH3-C6H4; 4-ClC6H4, і спосіб їх одержання, що включає взаємодію рівномолярних кількостей 5-аміно-3-ізоксазолу, відповідних заміщених метиленактивних 1,3-дикарбонільних сполук і ароматичних альдегідів у середовищі диметилформаміду або н-бутилового спирту в одну стадію при кипінні протягом 2-5 хвилин до утворення цільового продукту; одержану реакційну масу охолоджують до кімнатної температури, відфільтровують відповідний кінцевий продукт, промивають ацетоном і сушать. Технічне рішення забезпечує більш широкий асортимент 4,7-дигідроізоксазоло[5,4-b]піридин-5карбоксамідів, дозволяє зменшити тривалість технологічного процесу до 0,5 години, здешевити вартість кінцевих продуктів, що значно розширює можливості використання цих речовин у біології, фармації, медицини і сільському господарстві. H3C Ar O N H N O N H CH3 Ar 1 UA 99692 C2 Винахід належить до галузі органічної хімії, а саме 3,6-диметил-N, 4-діарил-4,7дигідроізоксазоло[5,4-b]піридин-5-карбоксамідів формули І і способів їх одержання. Ar H3C O N H N O 5 10 15 20 25 30 35 N H CH3 ,I де Аr = С6Н5; 2-СН3О-С6Н4; 3-СН3О-С6Н4; 4-СН3О-С6Н4; 4-СН3-С6Н3; 2-СН3С6Н4; 4-Сl-С6Н4; 4-Вr-С6Н4; 4-F-C6H4; 3-Cl-C6H4; 2-Cl-C6H4; 3-Br-C6H4; 2,4-диCl-C6H3; 3,4-диCl-C6H3; 2,6-диCl-C6H3; 3-F-C6H4; 2-F-C6H4; 2-F-6-Cl-C6H3; 3,4-диCH3O-C6H3; 2,4-диCH3O-C6H3; 2,5-диCH3O-C6H3; 2,3-диCH3O-C6H3; 3,4,5-триCH3O-C6H2; 2,4,5-триCH3O-C6H2; 4-SCH3-C6H4; 4-CH(CH3)2-C6H4; 4-CH3CH2-C6H4; 4-CH3CH2O-C6H4; 2-CH3CH2O-C6H4; 4-CN-C6H4; 4-COOH-C6H4; 4-COOCH3-C6H4; 4-NO2-C6H4; 3-NO2-C6H4; 4-OH-C6H4; 3-OH-C6H4; 3,4-диOH-C6H3; 3-CH3O-4-OH-C6H4;4-CH3O-3-OH-C6H4; 3-CH3CH2O-4-OH-C6H4; 3-CH3O-4-CH3CH2O-C6H4; -C4H3S; -C4H3S; -C5H4N; -C5H4N; Ar1=C6H5; 2-CH3O-C6H4; 4-СН3О-С6Н4; 2,4-диCH3-C6H3; 2-CH3-C6H4; 4-ClC6H4. Ці сполуки вже достатньо тривалий час привертають увагу хіміків-синтетиків, що обумовлено декількома причинами. Одна з них - це можливість тонко маніпулювати структурою цих сполук для досягнення необхідних фізико-хімічних та фармакологічних властивостей. Ізоксазол є важливою складовою багатьох фізіологічно активних речовин, які мають гіпоглікемічну, аналгетичну, протизапальну, антибактеріальну, антиканцерогенну активності [Shin K. D. et. al., J. Biol. Chem., 2005, 280, 41439; Simoni D. et. al., J. Med. Chem., 2001, 44, 2308]; використовуються як лікарські препарати при лікуванні хвороби Альцгеймера, шизофренії, гіпертонії [Rowley М. et. al., J. Med. Chem., 39, 1996; Wittenberger S., J. Org. Chem., 61, 356, 1996]. Крім того, вони також відомі як гербіцидні, фунгіцидні, пестицидні і інсектицидні препарати [Pinho М., Curr. Org. Chem. 9, 925, 2005]. Наявність у сполуках ізоксазольного і ізоксазолопіридинового фрагментів передбачає виявлення таких видів фізіологічної активності, як антиконвульсивна і антидеприсивна [Tatee Т. et. al., Chem. Pharm. Bull., 35, 3676, 1987]. Використання складних азотовмісних гетероциклічних сполук як біологічно активних речовин потребує підвищення ступеня доступності цих класів і розвитку й удосконалення методів їх синтезу. Відомий структурний аналог сполук, що заявляються, - похідні 3-метил-4-арилфуро[3,4b]ізоксазоло[4,5-е]піридин-5(7Н)ону формули II і спосіб їх одержання [Shu-Jiang Тu et al., J. Comb. Chem., 11, № 3, 428-432, 2009] Ar O CH3 N O O N 40 Ar 1 , II де Аr=4-F-C6H4, 3-F-C6H4, 4-CH3O-C6H4, 3-NO2-C6H4, 3,4-диСН3ОС6Н3 і ін. Недоліком відомої структури II є неможливість широкої модифікації замісників у молекулі, оскільки вона обмежена тільки зміною арильної складової ароматичних альдегідів. Спосіб одержання відомої сполуки формули II одностадійний і здійснюється за схемою: O H3C O + N O NH2 H O O H2O, MW + Ar O 1 Ar CH3 N O N O . UA 99692 C2 5 10 Авторами вказано, що оптимальними умовами проходження реакції є взаємодія рівномолярних кількостей заміщеного бензальдегіду, 5-аміно-3-метилізоксазолу і тетронової кислоти у воді при мікрохвильовому випромінюванні при температурі 120 °C протягом 5-7 хвилин. Виходи технічних продуктів складають 84-91 %. Після перекристалізації виходи чистих продуктів складають 60-70 %. При використанні аліфатичних альдегідів в цих умовах автори не одержали сполуки структури II. До недоліків способу одержання сполук формули II можна віднести також використання тільки циклічних метиленактивних речовин - тетронової кислоти і 1,3-індандіону. Використання мікрохвильового випромінювання викликає додаткові енерговитрати, хоч і протягом незначного періоду часу. У зв'язку з викладеним технічне рішення має обмежене використання. Відомий аналог сполук, що заявляються, за хімічною структурою і способом одержання заміщені 4,7-дигідроізоксазоло[5,4-b]піридини загальної формули III і спосіб їх одержання [Yamamori Т. et al., Tetrahedron, 41, № 5, p. 913-915, 1985]. R2 Ar O R1 N O 15 20 N H R3 , ІІІ де R1=CH3, C2H5O; R2=CH3, С6Н5O, 4-СН3О-С6Н4; Ar=CH3, C6H5, 3-NO2-C6H4; R3=CH3, C6H5. Спосіб одержання сполук формули III складається з двох стадій і реалізується за схемою: R2 O O H O R3 Ar O R3 R1 30 35 40 45 NH2 R2 Ar O O R1 N O Ar 25 + N + R1 O N H R3 III . На першій стадії дикарбонільну метиленактивну сполуку конденсують з ароматичними альдегідами у присутності свіжоперегнаного піперидину. Одержують відповідний ,ненасичений кетон. На другій стадії суміш рівномолярних кількостей ,-ненасиченого кетону і 5-аміноізоксазолу у 10 мл трет-бутанолу нагрівають 3 дні в атмосфері азоту. Відганяють розчинник у вакуумі, залишок хроматографують на силікагелі (елюент - суміш дихлоретану і етилацетату (10:1)). Тверду речовину перекристалізовують із етилацетату або із ізопропілового ефіру. Виходи технічних продуктів складають 70-93 %. Після хроматографування і подальшої перекристалізації виходи чистих речовин повинні бути приблизно 45-50 %. Автори відзначають, що реакція не універсальна і в залежності від розчинника, в якому проходить конденсація, можуть утворюватися або індивідуальні заміщені 4,7дигідроізоксазоло[5,4-b]піридини, або суміш двох речовин з переважним значним виходом побічного продукту. Так, при використанні як розчинника для реакції ,-ненасичених кетонів і 5аміноізоксозолів ізопропілового або трет-бутилового спирту при кип'ятінні можна одержувати або індивідуальні продукти або суміш двох речовин у метиловому спирті. В протонних розчинниках (бензол, ацетонітрил) утворюються індивідуальні сполуки зі "слідовими" виходами (7-8 %). Загальний час проведення реакції складає приблизно 5-5,5 днів (40-45 годин). До недоліків способу одержання сполук формули III слід віднести указану вище неуніверсальність реакції і тривалість синтезу, що приводить до додаткових витрат реактивів, робочого часу і енерговитрат. Кінцевий продукт потребує обов'язкової очистки хроматографування і перекристалізації з отруйних і горючих розчинників. Використання дорогого скрапленого газу - азоту протягом трьох днів, вакуумної відгонки розчинника, невисокі виходи чистих продуктів теж є недоліками способу одержання сполук формули III. В основу винаходу поставлено задачу пошуку нових сполук у низці 4,7дигідроізоксазоло[5,4-b]піридинів з варіацією замісників, а також універсального і доступного 2 UA 99692 C2 5 способу їх одержання, який дозволив би значно скоротити тривалість процесу, підвищити вихід і якість кінцевих продуктів за рахунок зміни структури компонентів суміші, що реагує, і умов проведення синтезу. Рішення поставленої задачі досягається розробкою похідних 3,6-диметил-N,4-діарил-4,7дигідроізоксазоло[5,4-b]піридин-5-карбоксамідів загальної формули І H3C Ar O N H N O 10 15 20 25 30 35 40 45 N H Ar 1 CH3 ,I де Аr = С6Н5; 2-СН3О-С6Н4; 3-СН3О-С6Н4; 4-СН3О-С6Н4; 4-СН3-С6Н3; 2-СН3С6Н4; 4-Сl-С6Н4; 4-Вr-С6Н4; 4-F-C6H4; 3-Cl-C6H4; 2-Cl-C6H4; 3-Br-C6H4; 2,4-диCl-C6H3; 3,4-диCl-C6H3; 2,6-диCl-C6H3; 3-F-C6H4; 2-F-C6H4; 2-F-6-Cl-C6H3; 3,4-диCH3O-C6H3; 2,4-диCH3O-C6H3; 2,5-диCH3O-C6H3; 2,3-диCH3O-C6H3; 3,4,5-триCH3O-C6H2; 2,4,5-триCH3O-C6H2; 4-SCH3-C6H4; 4-CH(CH3)2-C6H4; 4-CH3CH2-C6H4; 4-CH3CH2O-C6H4; 2-CH3CH2O-C6H4; 4-CN-C6H4; 4-COOH-C6H4; 4-COOCH3-C6H4; 4-NO2-C6H4; 3-NO2-C6H4; 4-OH-C6H4; 3-OH-C6H4; 3,4-диOH-C6H3; 3-CH3O-4-OH-C6H4;4-CH3O-3-OH-C6H4; 3-CH3CH2O-4-OH-C6H4; 3-CH3O-4-CH3CH2O-C6H4; -C4H3S; -C4H3S; -C5H4N; -C5H4N; Ar1=C6H5; 2-CH3O-C6H4; 4-СН3О-С6Н4; 2,4-диCH3-C6H3; 2-CH3-C6H4; 4-ClC6H4. Рішення поставленої задачі забезпечується також тим, що в способі одержання сполук формули І, згідно з винаходом, проводять конденсацію рівномолярних кількостей 5-аміно-3ізоксазолу, відповідних заміщених метиленактивних 1,3-дикарбонільних сполук формули СН3COCH2СОNHАr1 і ароматичних альдегідів формули CHOАr у середовищі диметилформаміду або н-бутилового спирту в одну стадію при кипінні протягом 2-5 хвилин до утворення цільового продукту. Сполуки, що заявляються, являють собою тугоплавкі (т. пл. >200 °C) кристалічні складні азотовмісні речовини, які добре розчиняються в спиртах, ацетоні, ацетонітрилі, мало розчинні в толуолі, не розчиняються у воді. Слід визначити, що структура сполук формули І представляє інтерес як з точки зору потенційних життєво важливих біологічно активних речовин, так і для практичного використання в медичній діагностиці, біологічних дослідженнях, фармакологічній науці. Компоненти реакції (дикарбонільні сполуки і ароматичні альдегіди) - доступні речовини, що випускаються промисловістю, що дає можливість широкої модифікації хімічної структури сполук формули І шляхом варіювання замісників Аr і Аr 1 у піридиновому фрагменті і дозволяє розширити асортимент нових потенційних біологічно активних 4,7-дигідроізоксазоло[5,4b]піридинів. Експериментальним шляхом встановлено, що використання висококиплячих розчинників - нбутилового спирту (т. кип. 117,5 °C) або диметилформаміду (т. кип. 153 °C), в процесі синтезу сполук структури формули І дозволяє одержувати чисті цільові продукти. Це, в свою чергу, дозволяє підвищити якість і вихід готових продуктів, скоротити тривалість процесу до 2-5 хвилин, а також знизити витрати робочого часу і енерговитрати. Використання будь-якого із компонентів реакції у більшому або меншому співвідношенні, ніж рівномолярні, приводить до утворення суміші продуктів, що не прореагували, вихідних і кінцевих речовин. Спосіб одержання похідних 3,6-диметил-N,4-діарил-4,7-дигідроізоксазоло[5,4-b]піридин-5карбоксамідів, що заявляються, здійснюється за схемою: 3 UA 99692 C2 H3C H3C O O 10 15 20 25 30 35 40 45 50 NH2 , ДМФА або бутанол + + N 5 H O H3C NAr1 Ar O Ar O NAr1 N O N H CH3 I . Спосіб, що заявляється, є одностадійним, проходить шляхом хімічної взаємодії всіх реагентів відразу у визначених умовах реакції, що дає можливість підвищити вихід, скоротити кількість технологічних стоків. Суміш рівномолярних кількостей 5-аміно-3-ізоксазолу, відповідних 1,3-дикарбонільних сполук і ароматичного альдегіду кип'ятять у н-бутиловому спирті або диметилформаміді протягом 2-5 хвилин. Осад, що випав при охолоджені, відфільтровують, промивають ацетоном, сушать. Виходи сполук, що заявляються, складають 80-95 %. У таблиці 1 дано порівняльні дані способу, що заявляється, і способів-аналогів. Характеристики сполук, що заявляються, наведено у таблиці 2. Слід відмітити, що спосіб одержання сполук формули І дає можливість одержувати індивідуальні речовини визначеного складу при застосуванні як ароматичних, так і аліфатичних альдегідів. Спосіб одержання сполук формули І, що заявляються, ілюструється наступними прикладами. Приклад 1. Одержання 3,6-диметил-N,4-дифеніл-4,7-дигідроізоксазоло[5,4-b]піридин-5карбоксамідів Суміш, що складається з 0,10 г (1 ммоль) 5-аміно-3-ізоксазолу, 0,10 г (1 ммоль) бензальдегіду, 0,18 г (1 ммоль) аніліду ацетооцтової кислоти, кип'ятять у диметилформаміді протягом 2 хвилин. Осад, що випав, відфільтровують, промивають 10 мл ацетону, сушать. Вихідні дані: Т. пл. 202-203 °C. Вихід 0,31 г (90 %). 1 Спектр H-ЯМР (ДМСО-d6), (м. ч.): 1,74 (с, 3Н, СН3), 2,02 (с, 3Н, СН3), 5,16 (с, 1Н, СН), 6,907,48 (м, 10Н, АrН), 9,55 (1Н, с, ΝΗ), 9,70 (1Н, с, CONH). Приклад 2. Одержання 3,6-диметил-4-(4-метилфеніл)-N-феніл-4,7-дигідроізоксазоло[5,4b]піридин-5-карбоксамідів Суміш, що складається з 0,10 г (1 ммоль) 5-аміно-3-ізоксазолу, 0,12 г (1 ммоль) 4метилбензальдегіду, 0,18 г (1 ммоль) аніліду ацетооцтової кислоти, кип'ятять у бутанолі протягом 5 хвилин. Осад, що випав, відфільтровують, промивають 10 мл ацетону, сушать. Вихідні дані: Т. пл. 223-224 °C. Вихід 0,48 г (90 %). 1 Спектр Н-ЯМР (ДМСО-d6), (м. ч.): 1,72 (с, 3Н, СН3), 2,02 (с, 3Н, СН3), 2,19 (с, 3Н, СН3), 5,15 (с, 1H, СН), 6,95-7,47 (м, 9Н, АrН), 9,54 (1Н, с, ΝΗ), 9,62 (1Н, с, CONH). Решту прикладів зведено у таблицю 2. Структуру заміщених 3,6-диметил-N,4-діарил-4,7-дигідроізоксазоло[5,4-b]піридин-51 карбоксамідів підтверджено Н-ЯМР спектрами. Спектри ЯМР виміряні на спектрометрі VARIAN Mercury VX-200 (200 МГц) у розчинах дейтеродиметилсульфоксиду (DMSO-d6), внутрішній стандарт - тетраметилсилан. Як видно із тексту матеріалів заявки і даних таблиць 1 і 2, технічне рішення, що пропонується, має наступні переваги: - структура, що заявляється, забезпечує одержання більш широкого асортименту похідних 4,7-дигідроізоксазоло[5,4-b]піридин-5-карбоксамідів з покращеними властивостями; - дозволяє широко варіювати замісники у піридиновому фрагменті. Спосіб одержання сполук формули І є багатокомпонентним одностадійним процесом і дозволяє: - зменшити тривалість технологічного процесу до 0,5 години; - значно підвищити вихід і якість цільових продуктів; - одержувати індивідуальні сполуки без домішок побічних речовин; - за рахунок застосування доступних різноманітних ароматичних альдегідів і активних метиленових компонентів - 1,3-дикарбонільних сполук - широко модифікувати замісники у піридиновому фрагменті. 4 UA 99692 C2 Спосіб одержання сполук формули І, що заявляються, простий у технологічному використанні і доступний у технологічному використанні, у лабораторних і в умовах промислового виробництва з невеликими витратами. Таблиця 1 Кількість Тривалість стадій процесу, год. Спосіб, що заявляється Спосіб-одержання сполук формули III Спосіб-одержання сполук формули II 1 0,5 2 44-45 1 0,5 Вихід реакції 85-90 70-93 після перекр. ~45-50 84-91 після перекр. ~60-70 Очистка кінцевих продуктів не потрібна потрібно хроматографування, перекристалізація потрібна перекристалізація 5 Таблиця 2 № Сполука за способом, що заявляється Аr=4-Вr-С6Н4 1 Аr1=С6Н5 Τ пл., °C Вихід, % Час реакції, хвилини 263-264 95 2 2 Аr=4-СН(СН3)2-C6H4 Аr1=С6Н5 215-216 85 2 3 Аr=4-СН3СН2-С6Н4 Аr1=С6Н5 217-218 90 2 4 Аr=4-Сl-С6Н4 Аr1=2-СН3-С6Н4 255-256 90 2 5 Аr=4-Вr-С6Н4 Аr1=2-CH3-С6Н4 232-233 95 2 6 Аr=3,4,5-триСН3О-С6Н2 Аr1=2-СН3-С6Н4 217-218 80 2 7 Аr=4-СН3-С6Н4 Аr1=2,4-диСН3-С6Н3 225-226 90 2 8 Аr=4-СН3О-С6H4 Аr1=2,4-диСН3-С6Н3 213-214 90 2 5 1 Спектр Н-ЯМР 1,74 (с, 3Н, СН3), 2,02 (с, 3Н, СН3), 5,20 (с, Н, СН), 6,96-7,48 (м, 9Н, АrН), 9,59 (1Н, с, ΝΗ), 9,80 (1Н, с, CONH) 1,12 (д, J=6,9 Гц, 6Н, 2СН3), 1,75 (с, 3Н, СН3), 2,02 (с, 3Н, СН3), 2,79 (м, Н, СН), 5,16 (с, 1Н, СН), 6,96-7,48 (м, 9Н, АrН), 9,57 (1Н, с, ΝΗ), 9,72 (1Н, с, CONH) 1,10 (т, J=7,3 Гц, 3Н, СН3), 1,75 (с, 3Н, СН3), 2,02 (с, 3Н, СН3), 2,56 (кв, 2Н, СН2), 5,16 (с, 1Н, СН), 6,96-7,49 (м, 9Н, АrН), 9,56 (1Н, с, ΝΗ), 9,71 (1Н, с, CONH) 1,74 (с, 3Н, СН), 1,78 (с, 3Н, СН3), 2,09 (с, 3Н, СН3), 5,18 (с, 1H, СН), 6,97-7,37 (м, 8Н, АrН), 9,06 (1Н, с, ΝΗ), 9,75 (1Н, с, CONH) 1,74 (с, 3Н, СН3), 1,78 (с, 3Н, СН3), 2,09 (с, 3Н, СН3), 5,17 (с, 1Н, СН), 6,99-7,47 (м, 8Н, АrН), 9,06 (1Н, с, ΝΗ), 9,75 (1H, с, CONH) 1,74 (с, 3Н, СН3), 1,78 (с, 3Н, СН3), 2,09 (с, 3Н, СН3), 3,75 (с, 9Н, 3СН3О), 5,17 (с, 1Н, СН), 7,02-7,47 (м, 6Н, А3Н), 9,06 (1Н, с, ΝΗ), 9,75 (1Н, с, CONH) 1,72 (с, 6Н, 2СН3), 2,07 (с, 3Н, СН3, 2,17 (с, 3, СН3), 2,23 (с, 3Н, СН3), 5,10 (с, 1Н, СН), 6,85-7,09 (м, 7Н, Аr), 8,88 (1Н, с, NH), 9,62 (1Н, с, CONH) 1,72 (с, 6Н, 2СН3), 2,07 (с, 3Н, СН3), 2,17 (с, 3Н, СН3), 3,75 (с, 3Н, СН3О), 5,10 (с, 1H, СН), 6,85-7,09 (м, 7Н, АrН), 8,88 (1Н, с, NH), 9,62 (1Н, с, CONH) UA 99692 C2 ФОРМУЛА ВИНАХОДУ 1. Похідні 3,6-диметил-N,4-діарил-4,7-дигідроізоксазоло[5,4-b]піридин-5-карбоксамідів формули І Ar H3C O N H N O 5 10 15 20 N H CH3 Ar O ,I де Аr = С6Н5; 2-СН3О-С6Н4; 3-СН3О-С6Н4; 4-СН3О-С6Н4; 4-СН3-С6Н3; 2-СН3С6Н4; 4-Сl-С6Н4; 4-Вr-С6Н4; 4-F-C6H4; 3-Cl-C6H4; 2-Cl-C6H4; 3-Br-C6H4; 2,4-диCl-C6H3; 3,4-диCl-C6H3; 2,6-диCl-C6H3; 3-F-C6H4; 2-F-C6H4; 2-F-6-Cl-C6H3; 3,4-диCH3O-C6H3; 2,4-диCH3O-C6H3; 2,5-диCH3O-C6H3; 2,3-диCH3O-C6H3; 3,4,5-триCH3O-C6H2; 2,4,5-триCH3O-C6H2; 4-SCH3-C6H4; 4-CH(CH3)2-C6H4; 4-CH3CH2-C6H4; 4-CH3CH2O-C6H4; 2-CH3CH2O-C6H4; 4-CN-C6H4; 4-COOH-C6H4; 4-COOCH3-C6H4; 4-NO2-C6H4; 3-NO2-C6H4; 4-OH-C6H4; 3-OH-C6H4; 3,4-диOH-C6H3; 3-CH3O-4-OH-C6H4;4-CH3O-3-OH-C6H4; 3-CH3CH2O-4-OH-C6H4; 3-CH3O-4-CH3CH2O-C6H4; α-C4H3S; β-C4H3S; α-C5H4N; β-C5H4N; Ar1 = C6H5; 2-CH3O-C6H4; 4-СН3О-С6Н4; 2,4-диCH3-C6H3; 2-CH3-C6H4; 4-ClC6H4. 2. Спосіб одержання похідних формули І H3C N H N O 25 30 35 40 Ar 1 N H Ar 1 CH3 ,I де Аr = С6Н5; 2-СН3О-С6Н4; 3-СН3О-С6Н4; 4-СН3О-С6Н4; 4-СН3-С6Н3; 2-СН3С6Н4; 4-Сl-С6Н4; 4-Вr-С6Н4; 4-F-C6H4; 3-Cl-C6H4; 2-Cl-C6H4; 3-Br-C6H4; 2,4-диCl-C6H3; 3,4-диCl-C6H3; 2,6-диCl-C6H3; 3-F-C6H4; 2-F-C6H4; 2-F-6-Cl-C6H3; 3,4-диCH3O-C6H3; 2,4-диCH3O-C6H3; 2,5-диCH3O-C6H3; 2,3-диCH3O-C6H3; 3,4,5-триCH3O-C6H2; 2,4,5-триCH3O-C6H2; 4-SCH3-C6H4; 4-CH(CH3)2-C6H4; 4-CH3CH2-C6H4; 4-CH3CH2O-C6H4; 2-CH3CH2O-C6H4; 4-CN-C6H4; 4-COOH-C6H4; 4-COOCH3-C6H4; 4-NO2-C6H4; 3-NO2-C6H4; 4-OH-C6H4; 3-OH-C6H4; 3,4-диOH-C6H3; 3-CH3O-4-OH-C6H4; 4-CH3O-3-OH-C6H4; 3-СН3СН2О-4-ОН-С6Н4; 3-СН3О-4-СН3СН2О-С6Н4; α-C4H3S; β-C4H3S; α-C5H4N; β-C5H4N; Ar1 = C6H5; 2-CH3O-C6H4; 4-CH3O-C6H4; 2,4-диCH3-C6H3; 2-CH3-C6H4; 4-ClC6H4, який відрізняється тим, що проводять конденсацію рівномолярних кількостей 5-аміно-3ізоксазолу, відповідних заміщених метиленактивних 1,3-дикарбонільних сполук і ароматичних альдегідів у середовищі диметилформаміду або н-бутилового спирту в одну стадію при кипінні протягом 2-5 хвилин до утворення цільового продукту. Комп’ютерна верстка М. Ломалова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 6
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of 3,6-dimethyl-n,4-diaryl-4,7-dihydroisoxazolo[5,4-b]pyridine-5-carboxamides and process fro the preparation thereof
Автори англійськоюMuraviova Olena Oleksandrivna, Rudenko Roman Volodymyrovych, Chebanov Valentyn Anatoliiovych, Desenko Serhii Mykhailovych, Afanasiadi Liudmyla Mykhailivna
Назва патенту російськоюПроизводные 3,6-диметил-n,4-диарил-4,7-дигидроизоксазоло[5,4-b]пиридин-5-карбоксамидов и способ их получения
Автори російськоюМуравьева Алена Александровна, Руденко Роман Владимирович, Чебанов Валентин Анатолиевич, Десенко Сергей Михайлович, Афанасиади Людмила Михайловна
МПК / Мітки
МПК: C07D 261/20, C07D 221/04
Мітки: похідні, одержання, спосіб, 3,6-диметил-n,4-діарил-4,7-дигідроізоксазоло[5,4-b]піридин-5-карбоксамідів
Код посилання
<a href="https://ua.patents.su/8-99692-pokhidni-36-dimetil-n4-diaril-47-digidroizoksazolo54-bpiridin-5-karboksamidiv-i-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Похідні 3,6-диметил-n,4-діарил-4,7-дигідроізоксазоло[5,4-b]піридин-5-карбоксамідів і спосіб їх одержання</a>
Попередній патент: Посівна секція для сівалок прямого посіву
Наступний патент: Спосіб остеопластики коміркового відростка щелепи
Випадковий патент: Пристрій для виводу інформації












