Спосіб одержання 4-бромо-2,5-диметил-1-r-1н-пірол-3-карбальдегідів
Номер патенту: 76099
Опубліковано: 25.12.2012
Автори: Чайковська Олександра Олексіївна, Штиль Наталія Анатоліївна, Саватєєв Олександр Сергійович, Костюк Олександр Миколайович, Смалій Радомир Володимирович
Формула / Реферат
Спосіб одержання 4-бромо-2,5-диметил-1-R-1H-пірол-3-карбальдегідів загальної формули 1,
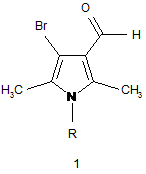 ,
,
де R= C6H4-Alk-4, C6H4-OH-4, C6H4-OAlk-4, C6H4-Hal-4,
який відрізняється тим, що 2,5-диметил N-заміщені піроли формілюють комплексом Р(О)Сl3/ДМФА при 0 °С, з отриманням 2,5-диметил-1-R-1H-пірол-3-карбальдегідів, котрі потім бромують бромідом міді (II) при 0 °С в ацетонітрилі, з наступним виділенням цільових продуктів звичайним методом.
Текст
Реферат: Спосіб одержання 4-бромо-2,5-диметил-1-R-1H-пірол-3-карбальдегідів включає формілювання 2,5-диметил N-заміщених піролів комплексом Р(О)Сl3/ДМФА при 0 °С, з отриманням 2,5диметил-1-R-1H-пірол-3-карбальдегідів, котрі потім бромують бромідом міді (II) в ацетонітрилі з наступним виділенням цільових продуктів. UA 76099 U (54) СПОСІБ ОДЕРЖАННЯ 4-БРОМО-2,5-ДИМЕТИЛ-1-R-1H-ПІРОЛ-3-КАРБАЛЬДЕГІДІВ UA 76099 U UA 76099 U 5 10 15 20 Корисна модель належить до органічної хімії, зокрема до методів синтезу раніше невідомих 4-бромо-2,5-диметил-1-R-1H-пірол-3-карбальдегідів, які є перспективними вихідними речовинами для синтезу різних типів піроловмісних сполук, що можуть знайти застосування в техніці, сільському господарстві, медицині та хімічній промисловості. 4-Бромо-2,5-диметил-1-R-1H-пірол-3-карбальдегіди є ключовими вихідними сполуками синтезу низки речовин з корисними властивостями, адже пірольний цикл є структурним фрагментом феромонів [1], гормонів рослин [2], алкалоїдів (піролнітрин, дибромофакелін) [3,4]. 4-Бромо-2,5-диметил-1H-пірол-3-карбальдегіди виступають важливими синтетичними інтермедіатами в синтезі аналогів активатора протеїнкінази С (РКС)-лінгбіатоксину А [5] та антибіотика верукарину Ε [6]. Крім того, на основі 4-бромо-2,5-диметил-1-R-1H-пірол-3-карбальдегідів можуть бути синтезовані невідомі раніше піроловмісні бідентантні Р- та Ν-вмісні хіральні металокомплексні каталізатори реакцій асиметричного синтезу. Такі каталізатори, зокрема, надзвичайно перспективні в реакціях асиметричного алільного алкілування (ААА), котрі є новітнім синтетичним шляхом до стереоселективного утворення нових С-С зв'язків [7]. Корисність цих перетворень важко переоцінити, адже продукти ААА-реакцій є важливими інтермедіатами в синтезі лікарських засобів та інших біологічно активних речовин. Методи синтезу 4-бромо-2,5-диметил-1-R-1H-пірол-3-карбальдегідів в літературі майже не описані. Відома лише одна робота [8], в якій представлено метод синтезу лише одного представника цього типу сполук, а саме 4-бромо-1H-пірол-3-карбальдегіду. Br Br 2.1 eq NBS, THF N N -78 Si (i-Pr)3 0 C Si (i-Pr)3 3 2 O Li Br N Br 0 N C Si (i-Pr)3 Si (i-Pr)3 4 25 30 35 Br H [H] N -78 O H CH3 2eq t-BuLi, THF 3 H O CH3 5 N H 6 56 % Представлений метод базується на початковому бромуванні вихідного Nтриізопропілсилілпіролу 2 2,1 еквівалентами бромосукциніміду при -78 °C з отриманням дибромопохідної 3, подальшому монолітіюванні отриманої сполуки 3 легкозаймистим mбутіллітієм при -78 °C, обробки монолітіевої похідної 4 диметилформальдегідом і подальшим видаленням захисного силильного угрупування. Недоліком цього методу є багатостадійність, низький вихід кінцевого продукту (56 %), використання наднизьких температур та дорогих і небезпечних реактивів (t-BuLi). Метод також не є універсальним, а автори в представленій роботі приводять його лише схематично, не надаючи докладної методики. Задачею корисної моделі є розробка простого, доступного, ефективного методу синтезу 4бромо-2,5-диметил-1-R-1H-пірол-3-карбальдегідів. Поставлена задача досягається двостадійним перетворенням. На першій стадії в результаті формілювання 2,5-диметил-1-арилпіролів 7 комплексом Р(О)Сl3/ДМФА при 0 °C отримують 2,5диметил-1-R-1H-пірол-3-карбальдегіди (8). На другій стадії отримані з високим виходом (97 %) сполуки 8 бромують доступним та безпечним CuBr2 при 0 °C в ацетонітрилі, з утворенням цільових продуктів 9 з виходом 93-96 %. 1 UA 76099 U O Br H POCl3 H3C CH3 N H3C CH3 N DMF R R , де R=C6H4-Alk-4, C6H4-OH-4, C6H4-OAlk-4, С6Н4-Наl-4 O O Br H H3C N CH3 H CuBr2 H3C N CH3 CH3CN, 0 0 C R 8 5 10 15 20 25 30 35 40 R 9 Корисна модель підтверджується наступними прикладами. Приклад 1. Загальний спосіб отримання 4-бромо-2,5-диметил-1-R-1H-пірол-3-карбальдегідів, де R=C6H4-Alk-4, С6Н4-ОН-4, С6Н4-ОАlk-4, С6Н4-Наl-4. I стадія. Отримання 2,5-диметил-1-R-1H-пірол-3-карбальдегідів. До 32,5 мл (30,8 г, 0,42 моль) ДМФА при охолодженні льодом та перемішуванні прикапують 20,3 мл (32,5 г, 0,21 моль) РОСl3- Реакційну суміш перемішують ще 10хв., а далі прикапують розчин 0,21 моль 2,5-диметил-1-R-1H-піролу 7 в 162 мл ДМФА. Далі суміш перемішують ще 2 год. з поступовим нагріванням до кімнатної температури. Утворений розчин виливають в охолоджений розчин 25,3г (0,63 моль) NaOH у 100 г води, при цьому випадає осад 2,5-диметил1-R-1H-пірол-3-карбальдегіду 8, який відфільтровують, промивають теплою водою та висушують. II стадія. Отримання 4-бромо-2,5-диметил-1-R-1H-пірол-3-карбальдегідів. До охолодженого до 0 °C розчину 0,012 моль 2,5-диметил-1-R-1H-пірол-3-карбальдегіду 8 в ацетонітрилі (100 мл) при перемішуванні додають 8,12 г (0,36 моль) броміду міді (II). Реакційну суміш перемішують ще 4 год. при охолодженні до 0 °C, а потім поступово нагрівають до кімнатної температури. Утворений розчин виливають у воду, при цьому випадає осад 4-бромо2,5-диметил-1-R-1H-трол-3-карбальдегіду 9, який відфільтровують, промивають водою, перекристалізують з ізопропанолу та висушують. Приклад 2. Отримання 4-бромо-2,5-диметил-1-(4-метилфеніл)-1H-пірол-3-карбальдегіду (9 а). 2,5-Диметил-1-(4-метилфеніл)-1H-пірол-3-карбальдегід (8 а). Маса сполуки 8 а 39 г (вихід 96 %), к.т. 98 °C. 1 H ЯМР (400 МГц, CDCl3): 1.95 (3Н, с, СН3), 2.25(3Н, с, СН3), 2.42 (3Н, с, СН3), 6.34 (1Н, с, СН, Ру), 7.05 (2Н, д, J=8.0, Аг), 7.28 (2Н, д, J=8.0, Аr), 9.84 (1Н, с,С(О)Н). 4-Бромо-2,5-диметил-1-(4-метилфеніл)-1H-пірол-3-карбальдегід (9 а). Маса сполуки 9 а 3,3 г (вихід 94 %), к.т. 118 °C. 1 H ЯМР (400 МГц, CDCl3): 1.95 (3Н, с, СН3), 2.26 (3Н, с, СН3), 2.42 (3Н, с, СН3), 7.02 (2Н, д, J=8.0, Аr), 7.29 (2Н, д, J=8.0, Аr), 9.92 (1Н, с, С(О)Н). Приклад 3. Отримання 4-бромо-2,5-диметил-1-(4-етоксифеніл)-1H-пірол-3-карбальдегіду (9б). 2,5-Диметил-1-(4-етоксифеніл)-1H-пірол-3-карбальдегід (8 б). Маса сполуки 8 б 47 г (вихід 92 %), к.т. 91 °C. 1 H ЯМР (400 МГц, CDCl3): 1.37 (3Н, т, J=7.2, ОСН2СН3) 1.95 (3Н, с, СН3), 1.98 (3Н, с, СН3), 4.05 (2Н, кв, J=7.2, ОСН2СН3), 6.33 (1Н, с, СН, Ру), 6.77 (2Н, д, J=8.0, Аr), 7.15 (2Н, д, J=8.0, Аr), 9.82 (1Н, с, С(О)Н). 4-Бромо-2,5-диметил-1-(4-етоксифеніл)-1H-пірол-3-карбальдегід (9 б). Маса сполуки 9 б 3,6 г (вихід 93 %), к.т. 115 °C. 2 UA 76099 U 1 5 10 15 20 25 30 35 40 45 H ЯМР (400 МГц, CDCl3): 137 (3Н, т, J=7.2, OCH2CH3), 2.15 (3Н, с, СН3), 2.28 (3Н, с, СН3), 4.06 (2Н, кв, J=7.2, ОСН2СН3), 6.79 (2Н, д, J=8.0, Аr), 7.25 (2Н, д, J=8.0, Аr), 10.02 (1Н, с, С(О)Н). Приклад 4. Отримання 4-бромо-2,5-диметил-1-(4-бромофеніл)-1H-пірол-3-карбальдегіду (9 в). 2,5-Диметил-1-(4-бромофеніл)-1H-пірол-3-карбальдегід (8 в). Маса сполуки 8 в 57 г (вихід 97 %), к.т. 105 °C. 1 H ЯМР (400 МГц, CDC13): 1.96 (3Н, с, СН3), 2.00 (3Н, с, СН3), 6.35 (1Н, с, СН, Ру), 7.22 (2Н, д, J=8.0, Аr), 7.56 (2Н, д, J=8.0, Аr), 9.85 (1Н, с, С(О)Н). 4-Бромо-2,5-диметил-1 -(4-бромофеніл)-1H-пірол-3-карбальдегід (9 в). Маса сполуки 9 в 4,1 г (вихід 96 %), к.т. 127 °C. 1 H ЯМР (400 МГц, CDCl3): 2.17 (3Н, с, СН3), 2.31 (3Η, с, СН3), 7.31 (2Н, д, J=8.0, Аr), 7.78 (2Н, д, J=8.0, Аr), 10.10 (1Н, с, С(О)Н). Таким чином, запропонована корисна модель дозволяє з високим виходом та з доступних та безпечних вихідних речовин отримувати невідомі раніше 4-бромо-2,5-диметил-1-К-1Я-пірол-3карбальдегіди, що відкриває широкі можливості застосування їх в хімічній промисловості, а їх похідних у сільському господарстві, медицині та фармакології. Джерела інформації: 1. a) Evershed R.P., E.D. Morgan The amounts of trail pheromone substances in the venom of workers of four species of attine ants-Insect Biochemistry-V.13-1983-P.469-474.; b) Trojanowicz M. Main Concepts of Chemical and Biological Sensing-Combinatorial Methods for Chemical and Biological Sensors Integrated Analytical Systems-V.I.-2009-P. 25-60. 2. a) Arikawa Y., Nishida H., Kurasawa O., Hasuoka Α., Hirase K., Inatomi N., Hori Y., Matsukawa J., Imanishi Α., Kondo M., Tarui N., Hamada Т., Takagi T.J., Takeuchi Т., Kajin M. Discovery of a Novel Pyrrole Derivative l-[5-(2-Fluorophenyl)-1 -(pyridin-3-ylsulfonyl)-1H-pyrrol-3-yl]-Nmethylmethanamine Fumarate (TAK-438) as a Potassium-Competitive Acid Blocker (P-CAB). - J. Med. Chem. - V. 4-2012-P.234-246.; b) Panter К. Е., James L. F. Natural plant toxicants in milk. J.Anim.Sci.-1990-V.68-P. 892-904. 3. Di Santo R., Costi R., Artico M., Massa S., Lampis G., Deidda D., Pompei R. Pyrrolnitrin and related pyrroles endowed with antibacterial activities against Mycobacterium tuberculosis-Bioorg. Med. Chem.-1998-V. 8-P.2931-2936. 4. Kennedy J. P., Brogan J. Т., Lindsley С W. Total Synthesis and Biological Evaluation of the Marine Bromopyrrole Alkaloid Dispyrin: Elucidation of Discrete Molecular Targets with Therapeutic Potential.- J. Nat. Prod.-2008-V. 71-P. 1783-1786. 5. Волошко Л.Н., Плющ А.В., Титова Η.Η. Токсины цианобактерий -Альгология - 2008 - Т. 18 - № 1 - С. 3-21. 6. a) Ishihara J., Nonaka R., Terasawa Υ., Shiraki R., Yabu K., Kataoka H., Ochiai Y., Tadano K. Total synthesis of (-)-verrucarol, a component of naturally occurring verrucarin A. - Tetrahedron Lett.1997-V. 38. -P. 8311-8314. b) Muchowski J.M., Naef R. 3-Lithiopyrroles by Halogen-Metal Interchange of 3-bromo-l(triisopropylsilyl)pyrroles. Synthesis of Verrucarin Ε and Other 3-Substituted Pyrroles. Helv.Chim.Acta.-1984-V. 67. - P. 1168-1172. 7. Theisen K., Maita K., Olmstead M., Attar S. Synthesis and Characterization of New, Chiral P-N Ligands and Their Use in Asymmetric Allylic Alkylation. -Organometallics.-2010-V.29. - P. 6334-6342. 8. Shum P.W., Kozikowski A.P. A convenient method for the synthesis of unsymmetrical 3,4disubstituted pyrroles. - Tetrahedron Lett.-1990-V. 31. - P. 6785-6788. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 50 Спосіб одержання 4-бромо-2,5-диметил-1-R-1H-пірол-3-карбальдегідів загальної формули 1, O Br H3C H N CH3 R 1 , 3 UA 76099 U 5 де R=C6H4-Alk-4, C6H4-OH-4, C6H4-OAlk-4, C6H4-Hal-4, який відрізняється тим, що 2,5-диметил N-заміщені піроли формілюють комплексом Р(О)Сl3/ДМФА при 0 °С, з отриманням 2,5-диметил-1-R-1H-пірол-3-карбальдегідів, котрі потім бромують бромідом міді (II) при 0 °С в ацетонітрилі, з наступним виділенням цільових продуктів звичайним методом. Комп’ютерна верстка Г. Паяльніков Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 4
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 4-bromo-2,5-dimethyl-1-r-1h-pyrrol-3-carbaldehydes
Автори англійськоюChaikovska Oleksandra Oleksiivna, Shtyl Natalia Anatoliivna, Smalii Radomir Volodymyrovych, Kostiuk Oleksandr Mykolaiovych, Savateev Oleksandr Serhiiovych
Назва патенту російськоюСпособ получения 4-бромо-2,5-диметил-1-r-1н-пиррол-3-карбальдегидов
Автори російськоюЧайковская Александра Алексеевна, Штиль Наталия Анатолиевна, Смалий Радомир Владимирович, Костюк Александр Николаевич, Саватеев Александр Сергеевич
МПК / Мітки
МПК: C07D 211/02
Мітки: спосіб, 4-бромо-2,5-диметил-1-r-1н-пірол-3-карбальдегідів, одержання
Код посилання
<a href="https://ua.patents.su/6-76099-sposib-oderzhannya-4-bromo-25-dimetil-1-r-1n-pirol-3-karbaldegidiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 4-бромо-2,5-диметил-1-r-1н-пірол-3-карбальдегідів</a>
Попередній патент: Спосіб створення поверхні, інертної до неспецифічної білкової адсорбції
Наступний патент: Спосіб лікування анемії зі зниженим рівнем заліза у хворих на ревматоїдний артрит
Випадковий патент: Спосіб обробки вкладишів підшипників ковзання










