Спосіб одержання 7-арил(гетарил)-5-оксо-2,3,6,7-тетрагідротіазоло[3,2-а]піримідину
Номер патенту: 78955
Опубліковано: 10.04.2013
Автори: Сова Олександр Миколайович, Князєва Ірина Володимирівна, Вакула Володимир Миколайович, Яременко Федір Георгійович
Формула / Реферат
Спосіб одержання 7-арил(гетарил)-5-оксо-2,3,6,7-тетрагідротіазоло[3,2-а]піримідину загальної формули:
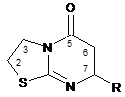 ,
,
де R- феніл, заміщений феніл, або гетарил,
реакцією циклоконденсації 2-амінотіазоліну, який відрізняється тим, що як один з реагентів використовують 5-арил-(гетарил)метилен-2,2-диметил-1,3-діоксан-4,6-діони, а реакцію проводять в органічних розчинниках, зокрема у нижчих спиртах.
Текст
Реферат: Спосіб одержання 7-арил(гетарил)-5-оксо-2,3,6,7-тетрагідротіазоло[3,2-а]піримідину включає реакцією циклоконденсації 2-амінотіазоліну. Як один з реагентів використовують 5-арил(гетарил)метилен-2,2-диметил-1,3-діоксан-4,6-діони. При цьому реакцію проводять в органічних розчинниках. UA 78955 U (54) СПОСІБ ОДЕРЖАННЯ 7-АРИЛ(ГЕТАРИЛ)-5-ОКСО-2,3,6,7-ТЕТРАГІДРОТІАЗОЛО[3,2-а]ПІРИМІДИНУ UA 78955 U UA 78955 U Корисна модель належить до галузі органічної хімії, а саме - хімії гетероциклів і стосується способу одержання похідних 5-оксо-2,3,6,7-тетрагідротіазоло[3,2-а]піримідину формули І: O 3 N 5 2 7 S 5 10 6 N R, де R1 феніл, заміщений феніл, або гетарил, які є потенційними біологічно активними сполуками. Серед представників 5-оксотіазоло[3,2-а]піримідину відомі сполуки з різноманітними видами фармакологічної дії. Зокрема, 7-метил-2,3-дигідро-5-оксотіазоло[3,2-а]піримідин виявляє анальгетичну активність [1]. 7-Феніл-5-оксо-2,3,6,7-тетрагідротіазоло[3,2-а]піримідин має протиревматичні [2, 3] та антиалергенні [2, 4] властивості при низькій токсичності (при пероральному введені мишам ЛД50 становить 300-900 мг/кг). Відомий спосіб одержання 7-алкіл-2,3-дигідро-5-оксотіазоло[3,2-а]піримідину, який полягає у взаємодії β-оксоестерів з 2-амінотіазоліном формули II або його рівноважної іміноформи (формула ІІІ) у середовищі етанолу при кип'ятінні реакційної суміші [1]. Однак, цим способом можливе одержання лише 2,3-дигідропохідних І. 15 3 N 3 2 S 20 25 30 35 NH 2 S NH2 NH II III Другим варіантом способу одержання похідних загальної формули І є взаємодія галогенангідриду α,β-ненасиченої кислоти з амінотіазоліном. Наприклад, хлорангідрид цинамової кислоти піддають взаємодії з AT або його рівноважною іміноформою у середовищі хлороформу у присутності триетиламіну. Виділення продукту передбачає колонкову хроматографію і кристалізацію. Вихід 7-феніл-5-оксо-2,3,6,7-тетрагідротіазоло[3,2-а]піримідину (І.1, R = Ph) становить 12,9 % [2, 4]. Третій метод передбачає взаємодію амінотіазоліну з алкіловим ефіром цинамової кислоти. Реакцію проводять без розчинника або в органічному ароматичному розчиннику, наприклад, бензолі, толуолі чи ксилолах у присутності антиоксиданту, наприклад, гідрохінону. Процедура виділення передбачає послідовну екстракцію 2н НСl та метиленхлоридом, колонкову хроматографію і кристалізацію. За цим методом вихід І.1 становить 7,2 % [2, 4]. Четвертий метод використовує як напівпродукт синтезу I.1 4-феніл-4,5-дигідро-2-тіоурацил, який піддають взаємодії з диброметаном у середовищі органічного розчинника (безводний ДМФ) у присутності дисперсії гідриду натрію в мінеральній олії. Після хроматографічного розділення і кристалізації вихід I.1 становить 10,5 % [2, 3]. Однак, початковий 4-феніл-4,5дигідро-2-тіоурацил, в свою чергу, одержується з бензальдегіду, тіосечовини та кислоти Мельдрума з виходом 33 % [5]. Отже, загальний вихід I.1 за цим методом 3,4 %. П'ятий метод одержання I.1 полягає у термічному елімінуванні карбетоксилу в сполуці IV, яке відбувається з виходом 50 % при тривалому нагріванні у диметилсульфоксиді у присутності NaCl. Але необхідний проміжний продукт IV одержується з виходом 11 % з бензальдегіду, амінотіазоліну та діетилмалонату після хроматографічного розділення ізомерів. Загальний вихід сполуки І.1, у перерахунку на бензальдегід, становить 6,5 % [6, 7]. O COOEt N S 40 N Ph IV Отже, відомі методи одержання І.1 дають виходи, що не перевершують 12,9 % (у перерахунку на амінотіазолін). До недоліків відомих схем належать також низька технологічність, використання дорогих та токсичних розчинників. Задачею корисної моделі є розробка нового технологічного та економічного способу синтезу 7-арил(гетарил)-5-оксо-2,3,6,7-тетрагідротіазоло[3,2-а]піримідину. 1 UA 78955 U 5 Поставлена задача вирішується тим, що як реагенти в синтезі використовують амінотіазолін та доступні іліденові похідні кислоти Мельдрума, а саму реакцію здійснюють при нагріванні в органічних розчинниках, зокрема у нижчих спиртах. Технічний результат - спрощення синтезу цільових сполук за рахунок зменшення кількості стадій процесу, усунення необхідності використання дорогих і токсичних реагентів та розчинників. Спосіб одержання 7-арил(гетарил)-5-оксо-2,3,6,7-тетрагідротіазоло-[3,2-а]піримідину ілюструється схемою: O O RCHO O O O NH2 R S II O O 10 N O N S N R O VI V I Необхідні для реалізації цієї схеми іліденпохідні загальної формули V одержано конденсацією Кньовенагеля з кислотою Мельдрума (2,2-диметил-4,6-діоксо-1,3-діоксан, VI), виходи в таких реакціях становлять 74-88 % [8, 9]. Характеристики деяких похідних І, одержаних запропонованим способом, наведено в таблиці. Таблиця 7-Арил(гетарил)-5-оксо-2,3,6,7-тетрагідротіазоло[3,2-а]піримідини І Сполука № І.1 І.2 І.3 І.4 І.5 І.6 І.7 І.8 І.9 Арил(гетарил) Т. пл., °C Вихід, % Брутто-формула феніл 4-бромфеніл 4-хлорфеніл 3-гідроксифеніл 3,4-дигідроксифеніл 4-метоксифеніл 3,4-диметоксифеніл 3-етокси-4дифлуорометоксифеніл 1,3-диметилпіразол-4-іл 110-112 112-113 109-111 182-183 84-87 136-138 176-178 89 54 50 26 48 53 33 C12H12N2SO C12H11N2SOBr C12H11N2SOCl C12H12N2SO2 C12H12N2SO3 C13H14N2SO2 C14H16N2SO3 232 311 267 248 264 262 292 96-97 51 C15H16N2SO3F2 342 131-134 72 C11H14N4OS 250 Mr 15 20 25 30 35 Хімічна будова всіх одержаних сполук доведена спектральними методами (ПМР, ІЧ), молекулярні маси визначені за даними мас-спектрометрії електронного удару. Приклад 1. Одержання 7-феніл-5-оксо-2,3,6,7-тетрагідротіазоло-[3,2-а]піримідину (І.1). Початкову сполуку - 5-бензиліден-2,2-диметил-1,3-діоксан-4,6-діон (V.1, де Ar=Ph) (т. пл. 7880 °C, літ. [8] т. пл. 80 - 82 °C) одержано з бензальдегіду і кислоти Мельдрума з виходом 86 %. До розчину 0,28 г (1,21 ммоль) сполуки V.1 та 0,12 г (1,21 ммоль) 2-амінотіазоліну в 6 мл ізопропілового спирту додають одну краплю триетиламіну і кип'ятять впродовж години. До реакційної суміші додають 5 крапель води і охолоджують. Через 2 години осад, що випав, відфільтровують, промивають спиртом, висушують і кристалізують зі спирту. Одержують 0,25 г -1 (1,08 ммол) сполуки І.1. 14 спектр (у КВr): 1688 см (νC=O), 1636 (νC=N). ПМР спектр у дейтерохлороформі (δ, м.ч. /КССВ у Гц/, мультиплетність, віднесення): 7,28-7,36 (м., 5Н, Ph); 4,83 /5,5; 12,2/ (д.д., 1Н, 7-СН); 3,98 /8,5; 11,5/ (д.т., 2Н, 3-СН2); 3,20 (м., 2Н, 2-СН2); 2,79 /5,9; 16,5/ (д.д., 1Н, 6-СНе); 2,51/12,4; 16,4/ (д.д., 1Н, 6-СНа). Мас-спектр (m/z, інтенсивність, віднесення): 232 (100 %, [М]), 231 (27 %, [М-Н]), 203 (47 %, [М-Н-СО]), 189 (65 %, [М-Н-СН2СО]). Приклад 2. Одержання 7-(1,3-диметилпіразол-4-іл)-5-оксо-2,3,6,7-тетрагідротіазоло[3,2а]піримідину (І.9). Одержання проміжної сполуки - 5[(1,3-диметил-1Н-піразол-4-іл)метилен]-2,2-диметил-1,3діоксан-4,6-діону (V.9, де Аr=1,3-диметил-1Н-піразол-4-іл). До розчину 0,26 г (1,80 ммоль) 2,2диметил-1,3-діоксан-4,6-діону та 0,23 г (1,8 ммоль) 1,3-диметилпіразол-4-карбальдегіду у спирті додають одну краплю триетиламіну і кип'ятять впродовж півгодини. Реакційну суміш охолоджують, осад відфільтровують, сушать та кристалізують зі спирту. Одержують 0,43 г (1,71 2 UA 78955 U 5 10 15 20 25 30 35 40 45 50 55 ммоль) сполуки V (R = 1,3-диметил-1Н-піразол-4-іл) (вихід 95 %) з т. пл. 215 - 216 °C. ІЧ спектр -1 (у КВr): 1736 та 1704 см (νC=O). ПМР спектр у дейтеродиметилсульфоксиді (δ, м.ч. /КССВ у Гц/, мультиплетність, віднесення): 8,96 (с., 1Н, СН=); 8,17 (с, 1Н, Prz); 3,90 (с, 3Н, 1'-Me-Prz); 2,36 (с, 3Н, 3'-Me-Prz); 1,69 (с, 6Н, СМе2). Mac-спектр (m/z, інтенсивність, віднесення): 250 (34 % [М]), 235 (3 %, [М-Ме]), 192 (100 %, [М-Ме2СО]), 148 (98 %, [PrzC3HO]), 119 (87 %, [PrzC2]). До розчину 0,60 г (2,40 ммоль) V.9 та 0,25 г (2,40 ммоль) 2-амінотіа-золіну в 10 мл спирту додають 2 краплі триетиламіну і кип'ятять впродовж 1,5 годин. Після охолодження осад, що випав, відфільтровують, промивають спиртом, висушують і кристалізують з цього ж розчинника. -1 Одержують 0,43 г (1,72 ммоль) сполуки І.9. 14 спектр (у КВг): 1695 см (vc=o), 1644(vc=N). ПМР спектр у дейтеродиметилсульфоксиді (δ, м.ч. /КССВ у Гц/, мультиплетність, віднесення): 7,37 (с, 1Н, Prz); 4,71 /5,7; 9,9/ (д.д., 1Н, 7-СН); 4,05 (м., 2Н, 3-СН2); 3,69 (с, 3Н, 1'-Me-Prz); 3,29 (м., 2Н, 2-СН2); 2,63 (м., 1Н, 6-СНе); 2,37 (м., 1Н, 6-СНа); 2,09 (с, 3Н, 3'-Me-Prz). Мас-спектр (m/z, інтенсивність, віднесення): 250 (100 %, [М]), 249 (28 %, [М-Н]), 221 (40 %, [М-Н-СО]), 207 (58 %, [М-Н-СН2СО]). Враховуючи високі виходи і легкість одержання початкових ариліденпохідних кислоти Мельдрума та помірні або високі виходи кінцевих сполук І, можна стверджувати, що загальні виходи у перерахунку на альдегіди перевершують всі відомі приклади. Так, запропонований метод дозволяє одержати сполуку І.1 з виходом 77 %, у перерахунку на бензальдегід. При цьому процедура синтезу не потребує використання високовартісних і токсичних розчинників та хроматографічної очистки продуктів реакції. Таким чином, запропоновано високопродуктивний спосіб одержання 7-арил(гетарил)-5-оксо2,3,6,7-тетрагідротіазоло[3,2-а]піримідину з використанням простих, комерційно доступних реагентів та розчинників. Джерела інформації. 1. Заявка 778911 BE, МПК 7 C07D513/04. 7-substd-2,3-dihydrothiazolo[3,2,a]pyrimidin-5-ones [Electronic resourse] / заявник SEPERIC. - № BE19720778911; заявл. 03.02.1972; опубл. 30.05.1972. - Режим доступу: http://worldwide.espacenet.com. 2. Пат. 45251 ЕР, МПК 7 А61К31/519; А61Р29/00; C07D513/02; C07D513/04. Thiazolo[3,2a]pyrimidine derivatives, their preparation and pharmaceutical compositions containing them [Electronic resourse] / F. Debarre, J. L. Fabre, D. Farge, C. James (FR); заявник і патентовласник Rhone Poulenc Sante (FR). - № EP19810401178; заявл. 23.07.1981; опубл. 03.02.1982. - Режим доступу: http://worldwide.espacenet.com. 3. Пат. 1145932 SU, МПК 7 А61К31/519; А61Р29/00; C07D513/02; C07D513/04. Method of obtaining derivatives of 2,3,6,7-tetrahydrothiazolo[3,2-a]pyrimidine-5-on [Electronic resourse] / F. Debarr, Z. L. Fabr, D. Farzh, K. Zham (FR); заявник і патентовласник Rhone Poulenc IND (FR). - № SU19823430886; заявл. 05.05.1982; опубл. 15.03.1985. Режим доступу: http://worldwide.espacenet.com. 4. Пат. 1091859 SU, МПК 7 А61К31/519; А61Р29/00; C07D513/02; C07D513/04. Process for preparing derivatives of 2,3,6,7-tetrahydrothiazolo[3,2-a]pyrimidin-5-one (modifications) on [Electronic resourse] / F. Debarr, Z. L. Fabr, D. Farzh, K. Zham (FR) ; заявник і патентовласник Rhone Poulenc IND (FR). - № SU19813317055; заявл. 23.07.1981; опубл. 07.05.1984. - Режим доступу: http://worldwide.espacenet.com. 5. Svĕtlik, J. A different role of Meldrum's acid in the Biginelli reaction [Text] / J. Svĕtlik, L. Veizerová // Helvetica Chimica Acta. - 2011. - Vol. 94. - P. 199-205. 6. New thiazolo[3,2-a]pyrimidine derivatives, synthesis and structure-activity relationships [Text] / E. Jeanneau-Nicolle, M. Benoit-Guyod, A. Namil [et al.] // Eur. J. Med. Chem. - 1992. - Vol. 27. - P. 115-120. 7. Jeanneau-Nicolle, E. One-pot synthesis of thiazolidino[3,2-a]pyrimidine derivatives [Text] / E. Jeanneau-Nicolle, M. Benoit-Guyod, A. Namil // Synth. Commun. - 1991. - Vol. 21, N 14. - P. 14431454. 8. A quick and clean procedure for synthesis of 5-arylmethylene-2,2-dimethyl-1,3-dioxane-4,6diones in aqueous media [Text] / T. S. Jin, R. Q. Zhao, M. Li [etal.] // Arkivoc. - 2006. - Vol. 7, N xiv. P. 53-58. 9. Condensation of aromatic aldehydes with acidic methylene compounds without catalyst [Text] / D. Shi, Y. Wang, Z. Lu, G. Dai // Synth. Commun. - 2000. - Vol. 30, N 4. - P. 713-726. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 60 Спосіб одержання 7-арил(гетарил)-5-оксо-2,3,6,7-тетрагідротіазоло[3,2-а]піримідину загальної формули: 3 UA 78955 U O 3 N 5 2 S 5 6 7 N R, де R- феніл, заміщений феніл, або гетарил, реакцією циклоконденсації 2-амінотіазоліну, який відрізняється тим, що як один з реагентів використовують 5-арил-(гетарил)метилен-2,2-диметил-1,3-діоксан-4,6-діони, а реакцію проводять в органічних розчинниках, зокрема у нижчих спиртах. Комп’ютерна верстка Д. Шеверун Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 4
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 7-aryl(hetaryl)-5-oxo-2,3,6,7-tetrahydrothiazolo[3,2-a]pyrimidine
Автори англійськоюYaremenko Fedir Heorhiiovych, Sova Oleksandr Mykolaiovych, Vakula Volodymyr Mykolaiovych, Kniazieva Iryna Volodymyrivna
Назва патенту російськоюСпособ получения 7-арил(гетарил)-5-оксо-2,3,6,7-тетрагидротиазоло[3,2-а]пиримидина
Автори російськоюЯременко Федор Георгиевич, Сова Александр Николаевич, Вакула Владимир Николаевич, Князева Ирина Владимировна
МПК / Мітки
МПК: C07D 513/02, C07D 513/04
Мітки: 7-арил(гетарил)-5-оксо-2,3,6,7-тетрагідротіазоло[3,2-а]піримідину, спосіб, одержання
Код посилання
<a href="https://ua.patents.su/6-78955-sposib-oderzhannya-7-arilgetaril-5-okso-2367-tetragidrotiazolo32-apirimidinu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 7-арил(гетарил)-5-оксо-2,3,6,7-тетрагідротіазоло[3,2-а]піримідину</a>
Попередній патент: Підставка під вудлище
Наступний патент: Спосіб синтезу тугоплавких неорганічних сполук
Випадковий патент: Пиловловлювач зі змоченими жалюзі










