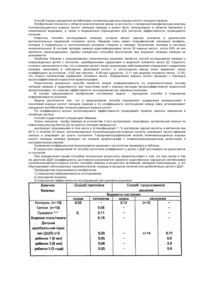
Новий ген елонгази та спосіб отримання поліненасичених кислот жирного ряду
Номер патенту: 86340
Опубліковано: 27.04.2009
Автори: Цанк Торстен, Церінгер Ульріх, Лерхль Йенс, Хайнц Ернст, Ренц Андреас
Формула / Реферат
1. Виділена нуклеїнова кислота, що включає нуклеотидну послідовність, яка кодує поліпептид, що елонгує кислоти жирного ряду з 16, 18 або 20 атомами вуглецю з принаймні двома подвійними зв'язками в молекулі кислоти на принаймні два атоми вуглецю, вибрану з групи, що включає
a) представлену в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5 або SEQ ID NO:7 послідовність нуклеїнової кислоти,
б) послідовність нуклеїнової кислоти, яка згідно з виродженістю генетичного коду походить від наведеної в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5 або SEQ ID NO:7 послідовності,
c) похідні наведеної в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5 або SEQ ID NO:7 послідовності, які кодують поліпептиди наведеної в SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6 або SEQ ID NO:8 амінокислотної послідовності і мають принаймні 50%-ну гомологію на амінокислотному рівні, без значного зниження ферментативної активності поліпептидів.
2. Виділена послідовність нуклеїнової кислоти за п. 1, яка відрізняється тим, що походить з рослини, водорості або гриба.
3. Виділена послідовність нуклеїнової кислоти за п. 1 або 2, яка відрізняється тим, що походить з організмів Physcomitrella, Thraustochytrium або Crythecodinium.
4. Генний конструкт, який включає виділену нуклеїнову кислоту за будь-яким з пп. 1-3, при якому нуклеїнова кислота функціонально зв'язана з одним або декількома регуляторними сигналами.
5. Генний конструкт за п. 4, який відрізняється тим, що експресія його гена посилена регуляторними сигналами.
6. Генний конструкт, який включає послідовність нуклеїнової кислоти за будь-яким з пп. 1-3 або генний конструкт за п. 4 або 5, який відрізняється тим, що додатково включає принаймні ще одну нуклеїнову кислоту, яка кодує ген біосинтезу кислоти жирного ряду.
7. Генний конструкт за п. 6, який відрізняється тим, що нуклеїнова кислота, яка кодує ген біосинтезу кислоти жирного ряду, вибрана з групи, що включає D19–, D17–, D15–, D12–, D9–, D8–, D6–, D5–, D4–десатуразу, різні гідроксилази, D12–ацетиленазу, ацил–ACP–тіоестерази, b–кетоацил–ACP–синтази або b–кетоацил–ACP–редуктази.
8. Спосіб одержання поліненасичених кислот жирного ряду, який включає вирощування організму, що включає виділену нуклеїнову кислоту за п. 1 або генний конструкт за п. 5 для кодування поліпетида, який елонгує кислоту жирного ряду з 16, 18 або 20 атомами вуглецю з принаймні двома подвійними зв'язками в молекулі кислоти на принаймні два атоми вуглецю за умов, при яких утворюються поліненасичені кислоти жирного ряду в організмі.
9. Спосіб за п. 8, який відрізняється тим, що одержують поліненасичені кислоти жирного ряду, що являють собою молекули кислоти жирного ряду з 18, 20 або 22 атомами вуглецю з принаймні двома подвійними зв'язками в молекулі кислоти.
10. Спосіб за п. 8 або 9, який відрізняється тим, що молекули кислоти жирного ряду з 18, 20 і 22 атомами вуглецю виділяють з організму у формі олії, ліпіду або вільної кислоти жирного ряду.
11. Спосіб за будь-яким з пп. 8-10, який відрізняється тим, що як організм використовують мікроорганізм, тварину або рослину.
12. Спосіб за будь-яким з пп. 8-11, який відрізняється тим, що як організм використовують трансгенну рослину.
13. Спосіб за будь-яким з пп. 8-12, який відрізняється тим, що використовують кислоту жирного ряду з 16, 18 або 20 атомами вуглецю, яка є кислотою жирного ряду з трьома подвійними зв'язками в молекулі.
Текст
1. Виділена нуклеїнова кислота, що включає нуклеотидну послідовність, яка кодує поліпептид, що елонгує кислоти жирного ряду з 16, 18 або 20 атомами вуглецю з принаймні двома подвійними зв'язками в молекулі кислоти на принаймні два атоми вуглецю, вибрану з групи, що включає a) представлену в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5 або SEQ ID NO:7 послідовність нуклеїнової кислоти, 2 (19) 1 3 86340 4 тида, який елонгує кислоту жирного ряду з 16, 18 або 20 атомами вуглецю з принаймні двома подвійними зв'язками в молекулі кислоти на принаймні два атоми вуглецю за умов, при яких утворюються поліненасичені кислоти жирного ряду в організмі. 9. Спосіб за п. 8, який відрізняється тим, що одержують поліненасичені кислоти жирного ряду, що являють собою молекули кислоти жирного ряду з 18, 20 або 22 атомами вуглецю з принаймні двома подвійними зв'язками в молекулі кислоти. 10. Спосіб за п. 8 або 9, який відрізняється тим, що молекули кислоти жирного ряду з 18, 20 і 22 атомами вуглецю виділяють з організму у формі олії, ліпіду або вільної кислоти жирного ряду. 11. Спосіб за будь-яким з пп. 8-10, який відрізняється тим, що як організм використовують мікроорганізм, тварину або рослину. 12. Спосіб за будь-яким з пп. 8-11, який відрізняється тим, що як організм використовують трансгенну рослину. 13. Спосіб за будь-яким з пп. 8-12, який відрізняється тим, що використовують кислоту жирного ряду з 16, 18 або 20 атомами вуглецю, яка є кислотою жирного ряду з трьома подвійними зв'язками в молекулі. Винахід стосується нового гена елонгази з наведеними в послідовностях SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 або їх гомологів, похідних або аналогів, генного конструкта, який містить ці гени або їх гомологи, похідні або аналоги, а також їх застосування. Винахід стосується також і вектора або трансгенних організмів, які містять ген елонгази з послідовністю SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 або його гомологів, похідних або аналогів. Далі винахід стосується застосування послідовностей генів елонгази одних або в комбінації з іншими елонгазами і/або іншими генами біосинтезу кислот жирного ряду. Винахід стосується також і нового гена елонгази з послідовністю SEQ ID NR:1 або його гомологів, похідних або аналогів. Далі винахід стосується способу одержання поліненасичених кислот жирного ряду, а також способу внесення ДНК в організми, які виробляють велику кількість олій і, зокрема, олій з високим вмістом поліненасичених кислот жирного ряду. Крім того, винахід стосується композиції олій і/або кислот жирного ряду з високим вмістом поліненасичених кислот жирного ряду із щонайменше двома подвійними зв'язками і/або композицій триацилгліцерину з високим вмістом поліненасичених кислот жирного ряду із щонайменше двома подвійними зв'язками. Певні продукти і побічні продукти наявних у природі процесів обміну речовин у клітинах корисні для широкого спектра промисловості, включаючи промисловість кормів, харчових, косметичних і фармацевтичних засобів. До цих, що позначаються спільно як "тонкі хімікати", молекул відносяться ліпіди і кислоти жирного ряду, серед яких поліненасичені кислоти жирного ряду представляють особливий клас. Поліненасичені кислоти жирного ряду (polyunsaturated fatty acids, PUFAs) додають, наприклад, у композиції дитячого харчування, щоб одержати більш високу поживну цінність цих препаративних форм. Поліненасичені кислоти жирного ряду здійснюють, наприклад, позитивний вплив на рівень холестерину в крові людини і тому придатні для захисту від серцевих захворювань. Тонкі хімікати і поліненасичені кислоти жирного ряду можуть виділятися з тваринних джерел, як напри клад, в риби, або з мікроорганізмів. Вирощуванням цих організмів можна одержувати і виділяти велику кількість однієї або декількох бажаних молекул. Особливо придатними мікроорганізмами для одержання поліненасичених кислот жирного ряду є такі мікроорганізми, як штами Thraustochytrien або Schizochytrien, такі водорості, як Phaeodactylum tricornutum або види Crypthecodinium, такі інфузорії, як Stylonychia або Colpidium, такі гриби, як Mortierella, Entomophthora або Mucor. За допомогою селекції штамів було розвинуто багато штамів-мутантів або відповідних мікроорганізмів, які виробляють ряд корисних сполук, що включають поліненасичені кислоти жирного ряду. Селекція штамів з підвищеним виробництвом певних молекул представляє собою, однак, складний процес, що займає багато часу. Крім того, недоліком є те, що за допомогою одного певного мікроорганізму можна одержувати тільки певні ненасичені кислоти жирного ряду, відповідно, тільки певний спектр кислот жирного ряду. Альтернативно до цього виробництво тонких хімікатів може здійснюватися виробництвом у великих масштабах рослин, які розвинуті таким чином, що вони виробляють вищенаведені поліненасичені кислоти жирного ряду. Особливо добре придатними для цієї мети рослинами є рослини з олійними плодами, які містять велику кількість ліпідних сполук, такі, як рапс, канола, льон, соя, соняшник, огірочник і енотера. Однак, придатні також і інші корисні рослини, які містять олії або ліпіди і кислоти жирного ряду, такі, як наведені в описі до даного винаходу. За допомогою звичайних методів розведення був розроблений ряд рослин-мутантів, які виробляють спектр бажаних ліпідів і кислот жирного ряду, співфакторів і ферментів. Селекція нових сортів рослин з підвищеним виробництвом певної молекули є складним процесом, який потребує багато часу, і навіть іноді неможлива, якщо сполуки у відповідних рослин немає в природі, як у випадку поліненасичених кислот жирного ряду з 20 і 22 атомами вуглецю і таких з більш довгими вуглецевими ланцюгами. Даний винахід пропонує нові молекули нуклеїнових кислот, які придатні для ідентифікації і виділення генів елонгази біосинтезу поліненасичених кислот жирного ряду і які можуть застосовуватися для модифікації олій, кислот жирного ряду, ліпідів, сполук, що походять від ліпідів, і особливо пере 5 важно для одержання поліненасичених кислот жирного ряду, тому що дотепер є потреба в нових генах, які кодують ферменти, що беруть участь у біосинтезі ненасичених кислот жирного ряду і забезпечують їх одержання в технічних масштабах. Зокрема, є потреба у ферментах біосинтезу кислот жирного ряду, які дозволяють елонгацію поліненасичених кислот жирного ряду з двома і більш подвійними зв'язками в молекулі. Нуклеїнові кислоти, що заявляються, кодують ферменти, які мають такі властивості. Такі мікроорганізми, як Phaeodactylum, Colpidium, Mortierella, Entomophthora, Mucor, Crypthecodinium, також інші водорості, гриби, інфузорії і рослини, зокрема, олійні рослини, застосовуються в промисловості для одержання великої кількості тонких хімікатів у великих масштабах. За умови наявності векторів клонування і генетичної маніпуляції вищенаведених мікроорганізмів і інфузорій, описуваних у WO 98/01572 і WO 00/23604, або водоростей або споріднених організмів, таких, як Phaeodactylum tricornutum, описуваних авторами Falciatore і ін. [1999, Marine Biotechnology 1(3):239-251]; а також авторами Dunahay і ін. [1995, Genetic transformation of diatoms, J. Phycol. 31:10004-1012] і в джерелах, що цитуються в них, молекули нуклеїнових кислот, що заявляються, можуть застосовуватися для генетичних змін цих організмів, так що вони стають кращими виробниками одного або декількох тонких хімікатів, особливо ненасичених кислот жирного ряду. Ця підвищена продуктивність або ефективність виробництва одного тонкого хімікату може викликатися шляхом здійснення прямої маніпуляції над геном, що заявляється, або непрямої маніпуляції над геном. Мох і водорості є єдиними відомими рослинними системами, які виробляють значні кількості поліненасичених кислот жирного ряду, таких, як арахідонова кислота (ARA) і/або ейкозапентаєнова кислота (ЕРА) і/або докозугексаєнова кислота (DHA). Мох містить поліненасичені кислоти жирного ряду в мембранових ліпідах, у той час як водорості, споріднені з водоростями організми й окремі гриби акумулюють кількості поліненасичених кислот жирного ряду в триацилгліцерольній фракції, які варті того, щоб згадати тут. Внаслідок цього молекули нуклеїнової кислоти, які виділяються з таких штамів, що акумулюють поліненасичені кислоти жирного ряду також і в триацилгліцерольній фракції, особливо придатні для модифікації систем виробництва ліпідів і поліненасичених кислот жирного ряду в одному хазяїні, зокрема в мікроорганізмах, приведених вище, і в рослинах, таких, як олійні рослини, наприклад, рапс, канола, льон, соя, соняшник, огірочник, рицина, олійна пальма, Carthamus tinctorius, кокосовий горіх або какао. Далі нуклеїнові кислоти з мікроорганізмів, що акумулюють триацилгліцерол, можуть застосовуватися для ідентифікації таких послідовностей ДНК і ферментів в інших видах, які придатні для модифікації біосинтезу молекул-попередників поліненасичених кислот жирного ряду у відповідних організмах. Зокрема, такі мікроорганізми, як Crypthecodinium cohnii і Thraustochytrium species є 86340 6 мікроорганізмами, що акумулюють такі поліненасичені кислоти жирного ряду, як ARA, ЕРА або DHA у триацилгліцеролах. Thraustochytrien є фітогенетично спорідненими зі штамами Schizochytrien. Хоча ці організми не мають тісної спорідненості з таким мохом, як Physcomitrella, на рівні послідовності ДНК і, зокрема, на рівні поліпептидів можна установити схожість послідовностей у такій мірі, що молекули ДНК у гетерологічних експериментах по гібридизації, порівнянню послідовностей і експериментах із застосуванням полімеразної ланцюгової реакції (ПЛР) також ідентифіковані, виділені і функціонально охарактеризовані з еволюційно дуже віддалених організмів. Зокрема, можна одержувати консенсусні послідовності, які придатні для гетерологічного скринінга або для функціонального комплементування і передбачення функцій гена в третіх видах. Здатність ідентифікувати ці функції, наприклад, передбачення специфічності субстрату, може мати істотне значення. Далі, ці молекули нуклеїнової кислоти можуть служити як опорні послідовності для картування споріднених геномів або для одержання ПЛРзатравок. Нові молекули нуклеїнових кислот кодують білки, які позначаються тут як специфічних елонгаз поліненасичених кислот жирного ряду (PSE). Ці специфічні елонгази поліненасичені кислоти жирного ряду (PSE) можуть виконувати, наприклад, функцію, яка бере участь в обміні речовин (наприклад, у біосинтезі або розщепленні) сполук, що необхідні для синтезу ліпідів або кислот жирного ряду, таких, як поліненасичені кислоти жирного ряду або ж у трансмембранному транспортуванні одного або декількох композицій ліпідів і/або кислот жирного ряду або в клітину або з клітини. У даному винаході докладно представлене виділення таких генів елонгази. У перший раз заявником були виділені гени елонгази, що придатні для виробництва довго ланцюгових поліненасичених кислот жирного ряду, переважно, з більш ніж вісімнадцятьма або двадцятьма атомами вуглецю у вуглецевому ланцюзі кислоти жирного ряду і/або щонайменше з двома подвійними зв'язками у вуглецевому ланцюзі і при цьому походять з типових організмів, які містять велику кількість поліненасичених кислот жирного ряду в триацилгліцерольній фракції. Внаслідок цього мова йде тут про ген специфічної елонгази полізаміщеної кислоти жирного ряду (PSE), відповідно про гени або білки (PSE). Інші відомі патентні заявки і публікації не розкривають і не показують функціонально активний PSE-ген, незважаючи на те, що є різні відомі патентні заявки, які показують елонгацію насичених кислот жирного ряду з короткими або середніми ланцюгами (WO 98/46776 і US 5,475,099) або елонгацію або одержання довголанцюгових кислот жирного ряду, які мають не більше одного подвійного зв'язку або приводять до довголанцюгової кислоти жирного ряду (див.: WO 98/54954, WO 96/13582, WO 95/15387). Даний винахід описує виділення нових елонгаз з новими властивостями. Виходячи з приведеної в SEQ ID NO:1 послідовності можна було виявити інші нуклеїнові кислоти, які 7 кодують елонгази, що елонгують ненасичені кислоти жирного ряду. Такі публікації, як WO 99/64616, WO 98/46763, WO 98/46764, WO 98/46765, описують одержання поліненасичених кислот жирного ряду в трансгенних рослинах і показують клонування і функціональну експресію відповідних активностей десатурази, зокрема, із грибів, однак не кодуючи PSE ген або функціональну PSE-активність (при цьому PSE означає специфічну поліненасиченим кислотам жирного ряду елонгазу). Експресія активності десатурази приводить до зміщення вмісту кислот жирного ряду в трансгенних рослинах, однак, підвищення вмісту ненасичених кислот жирного ряду тут не спостерігається. У цих публікаціях описується одержання триєнової кислоти з 18 атомами вуглецю у вуглецевому ланцюзі на основі гамаліноленової кислоти, однак, не показується одержання особливо довголанцюгових поліненасичених кислот жирного ряду (з 20 і більше атомами вуглецю у вуглецевому ланцюзі, а також триєнових кислот більш ненасичених типів). Для одержання довголанцюгових поліненасичених кислот жирного ряду поліненасичені кислоти жирного ряду з 18 або 20 атомами вуглецю повинні подовжуватися за рахунок ферментативної активності елонгази щонайменше на два атоми вуглецю. Послідовність нуклеїнових кислот за винаходом SEQ ID NO:1 кодує першу елонгазу рослин, яка може елонгувати жирні кислоти з 18 або 20 атомами вуглецю з щонайменше двома подвійними зв'язками в кислоті жирного ряду щонайменше на два атоми вуглецю. Після одного циклу подовження ця ферментативна активність приводить до С20-кислоти жирного ряду і після двох, трьох і чотирьох циклів подовження до кислот жирного ряду з 22, 24 або 26 атомами вуглецю. За допомогою інших описуваних елонгаз (SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11) можуть бути синтезовані також і інші довголанцюгові поліненасичені кислоти жирного ряду. Вони можуть застосовуватися окремо, декілька або в сумі з елонгазою поліненасиченої жирної кислоти з моху Physcomitrella patens (SEQ ID NO:1) для підвищення вмісту поліненасиченої кислоти жирного ряду в новому способі одержання поліненасичених кислот жирного ряду. Активність елонгаз згідно з винаходом приводить переважно до кислот жирного ряду з 20 атомами вуглецю з щонайменше двома подвійними зв'язками в молекулі кислоти жирного ряду, переважно з трьома або чотирма подвійними зв'язками в молекулі кислоти жирного ряду і/або до кислоти жирного ряду з 22 атомами вуглецю із щонайменше двома подвійними зв'язками в молекулі, переважно, з п'ятьма або шістьма подвійними зв'язками в молекулі. Після того, як відбулося подовження за допомогою ферменту згідно з винаходом, можуть здійснюватися інші стадії дезатурації, щоб одержати високо ненасичені кислоти жирного ряду. Тому продукти активності елонгази і можливих інших дезатурацій приводять до кращих поліненасичених кислот жирного ряду з високим ступенем дезатурації, до таких, як докозудієнова кислота, арахідинова кислота, 6-ейкозатриендигомо- 86340 8 ліноленова кислота, ейкозапентаєнова кислота, 3-ейкозатриєнова кислота, 3-ейкозатетраєнова кислота, докозупентаєнова кислота або докозугексаєнова кислота. Субстратами ферментативної активності згідно з винаходом є, наприклад, таксолова кислота; 7,10,13-гексадекатриєнова кислота, 6,9-октадекадієнова кислота, лінолева кислота, піноленова кислота, - або -ліноленова кислота або стеаридонова кислота, а також арахідонова кислота, ейкозатетраєнова кислота, докозупентаєнова кислота, ейкозапентаєнова кислота. Кращими субстратами є лінолева кислота, -ліноленова кислота і/або -ліноленова кислота, а також арахідонова кислота, ейкозатетраєнова кислота, докозупентаєнова кислота, ейкозапентаєнова кислота. Особливо кращими є арахідонова кислота, докозупентаєнова кислота, ейкозапентаєнова кислота. Кислоти жирного ряду, що містять 16 або 18 атомів вуглецю, з щонайменше двома подвійними зв'язками в кислоті жирного ряду можуть подовжуватися ферментативною активністю згідно з винаходом у формі вільної кислоти жирного ряду або у формі естеру, такого як фосфоліпіди, гліколіпіди, сфінголіпіди, фосфогліцериди, моноацилгліцерин, діацилгліцерин або триацилгліцерин. Для харчування людини особливе значення має кон'югована лінолева кислота "CLA". Під CLA розуміють, зокрема, такі кислоти жирного ряду, як 9 cis 11trans 10trans,12cis С18:2 або ізомер С18:2 , які внаслідок ферментативних систем людини після попадання в організм можуть насичуватися, відповідно елонгуватися і сприяти зміцнювальним здоров'я ефектам. Елонгазами згідно з винаходом можуть елонгуватися також і такі кон'юговані кислоти жирного ряду із щонайменше двома подвійними зв'язками в молекулі і разом з цим такі сприятливі здоров'ю кислоти жирного ряду можуть вводитись в харчування людини. Іншими прикладами для кон'югованих кислот жирного ряду є альфа-паринарна кислота, елеостеаринова кислота і календульну кислота. За умов векторів клонування для застосування в рослинах і при трансформації рослин, яка описується в публікаціях: Plant Molecular Biology and Biotechnology (CRC Press, Boca Raton, Florida), Розділ 6/7, Стор.71-119 (1993); F.F. White, Vectors for Gene Transfer in Higher Plants, : Transgenic Plants, том 1, Engineering and Utilization, Видавн.: Kung und R. Wu, Academic Press, 1993, 15-38; B. Jenes та інш., Techniques for Gene Transfer, Transgenic Plants, том 1, Engineering and Utilization, Видавн.: Kung und R. Wu, Academic Press (1993), 128-143; Potrykus, Annu. Rev. Plant Physiol. Plant Molec. Biol. 42 (1991), 205-225)), нуклеїнові кислоти згідно з винаходом можуть застосовуватися для змін методом генної інженерії широкого спектра рослин, так що ці рослини стають кращими, більш ефективними виробниками продуктів, що одержують від одного або декількох ліпідів, таких, як поліненасичені кислоти жирного ряду. Це підвищене виробництво або більш висока ефективність виробництва продукту, що одержується від одного з ліпідів, наприклад, поліненасичених кислот жирного ряду, може викликатися прямим впливом маніпуляції або непрямим впливом цієї маніпуляції. 9 Є ряд механізмів, за допомогою яких можна впливати на зміну PSE-білка згідно з винаходом, на вихід, виробництво і/або ефективність виробництва-тонкого хімікату з олійної рослини або мікроорганізму на основі зміненого білка. Число або активність PSE-білка або PSE-гена можуть бути підвищені, так що може бути одержана більш велика кількість цих сполук, тому що організмам не вистачало цієї активності і здатності до біосинтезу перед уведенням відповідного гена. Також може давати при цьому переваги і застосування різних дивергентних, тобто різних на рівні ДНК, послідовностей. Внесення PSE-гена або декількох PSE-генів у організм або клітину може підвищити не тільки процес біосинтезу до кінцевого продукту, але і також підвищити відповідний вміст триацилгліцерину або створити його заново. Число або активність інших генів, що сприяють імпорту поживних речовин, необхідних для біосинтезу одного або декількох тонких хімікатів (наприклад, кислот жирного ряду, полярних і нейтральних ліпідів), може бути також підвищена, так що підвищується концентрація цих попередників, співфакторів або проміжних сполук всередині клітин або всередині накопичувального блоку, внаслідок чого здатність клітини продукувати поліненасичені кислоти жирного ряду підвищується, як викладається нижче. Кислоти жирного ряду і ліпіди самі бажані як тонкі хімікати; оптимізацією активності або підвищенням числа одного або декількох PSE, що беруть участь у біосинтезі цих сполук, або руйнуванням активності одного або декількох PSE, що беруть участь у розкладанні цих сполук, можна підвищити вихід, виробництво і/або ефективність виробництва молекул кислот жирного ряду або ліпідів з рослин або мікроорганізмів. Мутагенез PSE-гена, що заявляється, може також приводити до PSE-білка зі зміненою активністю, що безпосередньо впливає на виробництво одного або декількох бажаних тонких хімікатів. Наприклад, можна підвищити число або активність PSE-гена, що заявляється, так що нормальні відходи або побічні продукти обміну речовин в клітині (кількість яких можливо внаслідок надвиробництва бажаних тонких хімікатів підвищується) можуть ефективно експортуватися з молекули, перш ніж вони зруйнують інші молекули або процеси всередині клітини (які б знижували життєздатність клітин), або можуть заважати біосинтезу тонких хімікатів (внаслідок чого знижується вихід, виробництво й ефективність виробництва бажаних тонких хімікатів). Далі, відносно великі внутрішньоклітинні кількості бажаних тонких хімікатів можуть бути токсичними щодо клітин або ж можуть заважати механізмам зворотного зв'язку ферментів, таким, як алостерична регуляція, наприклад, якби вона (регуляція) шляхом підвищення активності або кількості інших, наступних по ходу реакції, ферментів або інгібувальних ферментів шляху поліненасичених кислот жирного ряду могла збільшувати алокацію поліненасичених кислот жирного ряду в триацилгліцеридній фракції, то можна було б підвищити життєздатність вихідних клітин, що у свою чергу приводить до кращого розвитку клітин 86340 10 у культурах або до посівного зерна, що виробляє бажані тонкі хімікати. Ген PSE, що заявляється, може бути також таким, що маніпулюється таким чином, що одержується відповідна кількість різних молекул ліпідів і кислот жирного ряду. Це може здійснювати вирішальний вплив на композицію ліпідів мембрани клітини і виробляти нові олії додатково до одержання синтезованих поліненасичених кислот жирного ряду. У зв'язку з тим, що кожний тип ліпіду має різні фізичні властивості, зміна композиції ліпідів мембрани може значно змінювати рухомість мембрани. Зміни рухомості мембрани можуть впливати на транспортування молекул через мембрану, а також на зберігання клітини, причому обидва приведених фактора мають вирішальний вплив на виробництво тонких хімікатів. У рослинах ці зміни можуть впливати також і на інші ознаки, такі, як толерантність щодо абіотичних або біотичних стресових ситуацій. Біотична й абіотична толерантність до стресу є загальною ознакою, яку бажано передавати як спадкоємну ознаку на широкий спектр рослин, таких, як кукурудза, пшениця, жито, овес, рис, ячмінь, соєві боби, земляний горіх, бавовник, рапс і канола, маніок, перець, соняшник і тагетес, такі пасльонові рослини, як картопля, тютюн, баклажани і томати, види горошку, горох, люцерна, чагарникові рослини (кава, какао, чай), види Salix, дерева (олійна пальма, кокосова пальма) і витривалі злакові і кормові продукти рільництва. Ці кормові продукти рільництва як інші форми виконання винаходу є кращими цільовими рослинами для генної інженерії. Особливо кращими рослинами згідно з винаходом є олійні рослини, такі, як соєві боби, земляний горіх, рапс, канола, соняшник, сафлор, дерева (олійні пальми, кокосові пальми) або продукти рільництва, такі, як кукурудза, пшениця, жито, овес, пшениця, рис, ячмінь, люцерна або такі рослини, як кава, какао, чай. Винахід стосується таким чином виділених молекул нуклеїнових кислот (наприклад, кДНК), які включають нуклеотидні послідовності, що кодують специфічну елонгазу поліненасичених кислот жирного ряду PSE або декілька елонгаз PSE або їх біологічно активні частини, або фрагменти нуклеїнових кислот, які як затравки або зонди гібридизації придатні для виявлення або ампліфікації нуклеїнових кислот, що кодують елонгазу PSE, (наприклад, ДНК або мРНК). При особливо кращій формі виконання винаходу молекула нуклеїнової кислоти включає одну з наведених у SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQIDNO:7, SEQ ID NO:9 і SEQ ID NO:11 нуклеотидних послідовностей або кодуючу ділянку або комплемент однієї з цих послідовностей. При іншій кращій формі виконання винаходу виділена молекула нуклеїнової кислоти включає нуклеотидну послідовність, яка гібридизована з нуклеотидною послідовністю, представленою в послідовності SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11, або з її частиною або є щонайменше на приблизно 50%, переважно приблизно на 60%, більш переважно щонайменше на 70%, 80% або 90% або ще більш переважно щонайменше приблизно на 95%, 96%, 97%, 98%, 99% або біль 11 86340 ше гомологічною до неї. При інших кращих формах виконання винаходу виділена молекула нуклеїнової кислоти кодує одну з наведених у SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 амінокислотних послідовностей. Кращий ген елонгази PSE має переважно також щонайменше одну з описуваних тут активностей елонгази PSE. При ще одній формі виконання винаходу виділена молекула нуклеїнової кислоти кодує білок або частину його, причому білок або його частина містить аміноксилотну послідовність, яка має настільки достатню гомологію до представленої в SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 амінокислотної послідовності, що білок або його частина зберігають активність елонгази PSE. Переважно білок або його частина, що кодується молекулою нуклеїнової кислоти, зберігає здатність брати участь в обміні речовин необхідних для побудови клітинної мембрани рослин сполук або у транспортуванні молекул через ці мембрани. При ще одній формі виконання білок, що кодується молекулою нуклеїнової кислоти, має гомологію щонайменше на приблизно 50%, переважно щонайменше на приблизно 60% і більш переважно щонайменше на приблизно 70%, 80% або 90% і особливо переважно щонайменше приблизно на 95%, 96%, 97%, 98%, 99% або більше до представленої в послідовності SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 амінокислотної послідовності. При ще одній кращій фо 12 рмі виконання білок є білком повної довжини, який в основному частково має гомологію до загальної амінокислотної послідовності SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 (яка походить від представленої в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 однієї відкритої рамки зчитування) і в повній довжині може бути виділена відомими фахівцю методами й експериментами. При ще одній кращій формі виконання виділена молекула нуклеїнової кислоти походить від Phytophthora infestans, Physcomitrella patens, Crypthecodinium cohnii або Thraustochytrium і кодує білок (наприклад, гібридний білок елонгази PSE), що містить біологічно активні домени, що принаймні приблизно на 50% або більше мають гомологію до представленої в послідовності SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 амінокислотної послідовності і зберігає здатність брати участь в обміні речовин сполук, необхідних для побудови клітинної мембрани рослин або брати участь у транспортуванні молекул через ці мембрани, або набуває щонайменше одну з активностей елонгації в поліненасичених кислотах жирного ряду, таких, як ARA, ЕРА або DHA, або їх молекул-попередників, або ж має одну з наведених у таблиці 1 активностей, і містить гетерологічні послідовності нуклеїнових кислот, що кодують гетерологічний поліпептид або регуляторні білки. Таблиця 1 Зразок кислоти жирного ряду від шести трансгенних дріжджових штамів у мл.%. Долі введеної та спожитої -ліноленової кислоти виділені числами, написаними жирним шрифтом, долі елонгованих продуктів підкреслені і долі елонгованої -ліноленової кислоти виділені числами, написаними жирним шрифтом (останній рядок) Кислоти жирного ряду [мол.-%] 16:0 9 16:1Δ 18:0 9 18:1Δ 6,9,12 18:3Δ 8,11,14 20:3Δ 6,9,12 18:3Δ елонгація pYES2 pY2PSE1a pY2PSE1b pY2PSE1c pY2PSE1d 17,0 28,0 6,5 25,9 22,6 17,6 26,8 6,0 23,5 15,7 10,3 16,4 28,0 6,4 27,0 13,2 9,0 16,3 27,9 5,6 25,2 16,4 8,6 17,6 25,1 6,1 21,4 22,8 7,1 39,6 40,5 34,4 23,7 При іншій формі виконання виділена молекула нуклеїнової кислоти має довжину щонайменше в 15 нуклеотидів і гібридизується у жорстких умовах з молекулою нуклеїнової кислоти, що містить представлену в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 нуклеотидну послідовність. Переважно виділена молекула нуклеїнової кислоти відповідає наявній в природі молекулі нуклеїнової кислоти. Особливо бажана виділена молекула нуклеїнової кислоти кодує наявну в природі елонгазу PSE з Crypthecodinium, Phytophthora або Thraustochytrium або її біологічно активну частину. Винахід також стосується векторів, наприклад, рекомбінантних векторів експресії, які містять щонайменше одну молекулу нуклеїнової кислоти згідно з винаходом, і клітини-хазяїни, в які введені ці вектори, зокрема, мікроорганізми, клітини рослин, рослинні тканини, органи і цілі рослини. При одній з форм виконання винаходу така клітина-хазяїн може накопичувати сполуки тонких хімікатів, зокрема, поліненасичені кислоти жирного ряду збираються для виділення бажаних сполук клітини. Композиції (олії, ліпіди, триацилгліцериди, кислоти жирного ряду) або PSE можуть потім виділятися із середовища або клітини-хазяїна, якими для рос 13 лин є клітини, які містять і накопичують тонкі хімікати, особливо переважно клітини накопичувальних тканин, таких, як оболонки насіння, бульби, клітини епідермісу і насіння. Далі винахід стосується генетично змінених рослин, переважно, вищезгаданих рослин, що мають олійні плоди, особливо переважно рослин рапсу, льону або Physcomitrella patens, в які введений ген елонгази PSE. При одній із форм виконання винаходу геном рапсу, льону або Physcomitrella patens змінений як трансген шляхом уведення молекули нуклеїнової кислоти згідно з винаходом, яка кодує дику форму і мутовану послідовність елонгази PSE. При іншій формі виконання винаходу є зміненим ендогенний ген елонгази PSE у геномі організмів Physcomitrella patens, Phytophthora infestans, Crypthecodinium або Thraustochytrium, наприклад, шляхом гомологічної рекомбінації зі зміненим геном PSE або мутагенезу і детекції за допомогою ДНК-послідовності, тобто функціонально зруйнований. При іншій формі виконання рослинний організм належить до сімейства з Physcomitrella, Ceratodon, Funaria, рапсу або льону, причому Physcomitrella, рапс або льон бажані. При ще одній формі виконання винаходу Physcomitrella, рапс або льон застосовується для одержання бажаної сполуки, такої, як ліпіди і кислоти жирного ряду, причому поліненасичені кислоти жирного ряду особливо бажані. При ще одній формі виконання винаходу мох Physcomitrella patens може застосовуватися для демонстрації функції гена елонгази при застосуванні гомологічної рекомбінації на базі описуваних у винаході нуклеїнових кислот. Винахід далі стосується виділеного гена специфічної елонгази поліненасичених кислот жирного ряду (PSE) або його частини, наприклад, його біологічно активної частини. При кращій формі виконання винаходу виділена елонгаза PSE або її частина може брати участь в обміні речовин, необхідних для побудови мембранної клітини в організмі або клітині рослини сполук або у транспортуванні молекул через мембрани. При ще одній кращій формі виконання винаходу виділена PSE або її частина має достатню гомологію до амінокислотної послідовності, представленої в SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12, щоб цей протеїн або його частина зберегла свою здатність брати участь в обміні речовин, необхідних для побудови мембранної оболонки в мікроорганізмах або клітинах рослин сполук або у транспортуванні молекул через ці мембрани. Винахід також стосується виділеного препарату однієї елонгази PSE. При кращій формі виконання ген елонгази PSE включає амінокислотну послідовність з SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 та SEQ ID NO:12. Далі винахід стосується виділеного білка повної довжини, який має гомологію в основному до загальної амінокислотної послідовності, представленої в SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO12 (які кодуються показаними в SEQ ID NO:1, SEQ ID 86340 14 NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 відкритими рамками зчитування). При іншій формі виконання білок щонайменше на приблизно 50%, переважно щонайменше на приблизно 60% і особливо переважно щонайменше на приблизно 70%, 80% або 90% і більш переважно щонайменше на приблизно 95%, 96%, 97%, 98%, 99% гомологічний амінокислотній послідовності, представленій в SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12. При інших формах виконання винаходу виділена елонгаза PSE має амінокислотну послідовність, яка щонайменше на приблизно 50% гомологічна до однієї з амінокислотних послідовностей, наведених у SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 і може брати участь в обміні речовин, необхідних для одержання кислот жирного ряду в мікроорганізмі або клітині рослини або у транспортуванні молекул через ці мембрани або ж має одну або декілька елонгуючих поліненасичені кислоти жирного ряду активностей, причому здійснюють елонгацію переважно ненасичених вуглеводневих ланцюгів з 16 або 18 або 20 атомами вуглецю з подвійними зв'язками щонайменше в двох місцях. Альтернативно до цього виділена PSE може мати амінокислотну послідовність, що кодується нуклеотидною послідовністю, яка гібридизується з нуклеотидною послідовністю, представленою в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11, наприклад, гібридизується при жорстких умовах, або гомологічна до неї щонайменше на приблизно 50%, переважно щонайменше на приблизно 60%, більш переважно щонайменше на приблизно 70%, 80% або 90% і ще більш переважно щонайменше на приблизно 95%, 96%, 97%, 98%, 99% або більше. Також є кращим таке виконання, при якому кращі форми PSE мають також описану тут активність PSE. Поліпептид специфічної до поліненасичених кислот жирного ряду елонгази PSE або його біологічно активна частина може бути функціонально зв'язаний з неспецифічним поліненасиченим кислотам жирного ряду PSE-поліпептидом, так що утворюється гібридний білок. При кращій формі виконання винаходу цей гібридний білок має активність, яка відрізняється від активності тільки елонгази PSE. При іншій формі виконання винаходу цей гібридний білок бере участь в обміні речовин сполук, які необхідні для синтезу ліпідів або кислот жирного ряду, співфакторів і ферментів у мікроорганізмах і рослинах, або беруть участь у транспортуванні молекул через мембрани клітин. При особливо кращій формі виконання винаходу введення цього гібридного білка в клітину-хазяїн модулює виробництво бажаної сполуки клітинами. При кращому варіанті виконання винаходу ці гібридні білки одержують також активність Δ4-, Δ5- або Δ6-, Δ8-, Δ15-, Δ17-або Δ19-десатурази одні або в комбінації. Іншим об'єктом винаходу є спосіб одержання тонких хімікатів. Цей спосіб полягає або у вирощуванні придатного мікроорганізму або ж у вирощуванні рослинних клітин, тканини, органів або цілої 15 рослини, і включає заявлені нуклеотидні послідовності, представлені в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 або їх гомологи, похідні або аналоги або конструкт гена, що включає послідовності SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 або їх гомологи, похідні або аналоги, або вектор, що містить ці послідовності або конструкт гена, який сприяє експресії молекули нуклеїнової кислоти елонгази PSE, так що має місце виробництво тонких хімікатів. При одній із кращих форм виконання способу, що заявляється, він включає стадію одержання клітини, яка містить послідовність нуклеїнових кислот елонгази згідно з винаходом, причому трансформується клітина з послідовністю нуклеїнових кислот елонгази, з конструктом гена або вектором, який сприяє експресії нуклеїнової кислоти елонгази PSE. При іншій формі виконання винаходу цей спосіб включає стадію одержання тонких хімікатів з культури. При особливо кращій формі виконання способу клітина відноситься до ряду інфузорій, мікроорганізмів, таких, як гриби, або до рослин, зокрема, до рослин з олійними плодами, особливо переважно до мікроорганізмів або олійних рослин. Іншим об'єктом винаходу є спосіб модуляції виробництва молекули мікроорганізмом. Цей спосіб містить об'єднання клітини з речовиною, яка модулює активність елонгази PSE або експресію нуклеїнової кислоти PSE, так що виробляється зміна асоційованою клітиною активності щодо такої ж активності у відсутності речовини. При кращій формі виконання модулюється/модулюються один шлях або два шляхи обміну речовин клітини для ліпідів і кислот жирного ряду, співфакторів і ферментів або ж транспортування сполук через ці мембрани, так що підвищується вихід або виробництво бажаного тонкого хімікату цим мікроорганізмом. Речовина, що модулює активність PSE, може бути такою речовиною, яка стимулює активність PSE або експресію нуклеїнової кислоти PSE або яка може застосовуватися як проміжний продукт при біосинтезі кислоти жирного ряду. Прикладами речовини, яка стимулює активність PSE або експресію нуклеїнової кислоти PSE, є, серед інших, малі молекули, активні елонгази PSE, а також кодуючі елонгази PSE нуклеїнові кислоти, які введені в клітину. Прикладами речовин, які інгібують активність або експресію елонгази PSE, є, серед інших, малі молекули і/або антисмислові молекули нуклеїнових кислот елонгази PSE. Іншим об'єктом винаходу є спосіб модуляції виходу бажаної сполуки з клітини, що містить введення в клітину дикого типу або мутантного гена елонгази PSE, який утримується в окремій плазміді або ж інтегрований у геном клітини-хазяїна. При інтегруванні в геном інтеграція може бути випадковою або здійснюватися такою рекомбінацією, що нативний ген замінюється введеною копією, внаслідок чого модулюється виробництво клітиною бажаної сполуки, або застосуванням гена у формі trans, так що ген функціональнозв'язаний з функціональним вузлом експресії, який містить щонайменше одну послідовність, що забезпечує експресію гена, і щонайменше одну послідовність, що 86340 16 забезпечує поліаденілювання функціонально транскрибованого гена. При кращій формі виконання виходи продукту модифіковані. При ще одній кращій формі кількість бажаного хімікату збільшується, причому кількість небажаних сполук, що заважають, може знижуватися. При особливо кращій формі виконання бажаним тонким хімікатом є ліпід або кислота жирного ряду, співфактор або фермент. При ще більш бажаній формі виконання цими тонкими хімікатами є поліненасичені кислоти жирного ряду. Переважно вони вибираються з групи, яка включає арахідонову кислоту (ARA), ейкозапентаєнову кислоту (ЕРА) або докозугексаєнову кислоту (DHA). Опис сутності винаходу. Згідно із даним винаходом розроблені PSEнуклеїнові кислоти і молекули білка елонгази PSE, які беруть участь в обміні речовин ліпідів і кислот жирного ряду, співфакторів поліненасичених кислот жирного ряду (PUFA) і ферментів у моху Physcomitrella patens, Phytophthora infestans, Crypthecodinium або Traustochytrium або в транспортуванні ліпофільних сполук через мембрани. Сполуки згідно з винаходом можуть застосовуватися для модуляції виробництва тонких хімікатів з організму, наприклад, з таких мікроорганізмів, як інфузорії, гриби, дріжджі, бактерії, водорості і/або з таких рослин, як кукурудза, пшениця, жито, овес, пшениця, рис, ячмінь, соєві боби, земляний горіх бавовник, таких видів, як рапс, канола і суперка олійна, перець, соняшник, огірочник, енотера або тагетес, таких пасльонових, як картопля, тютюн, баклажани і томати, видів в'юна, гороху, маніоку, люцерни, чагарникових рослин (кава, какао, чай), видів Salix, дерев (олійна пальма, кокосовий горіх) і витривалих злакових і кормових польових культур, або безпосередньо (наприклад, якщо надекспресія або оптимізація білка біосинтезу кислоти жирного ряду має прямий вплив на вихід, виробництво і/або ефективність виробництва кислоти жирного ряду з модифікованих організмів) можуть мати непрямий вплив, який приводить до підвищення виходу, виробництва і/або ефективності виробництва бажаної сполуки або до зниження небажаних сполук (наприклад, якщо модуляція обміну речовин ліпідів і кислот жирного ряду, співфакторів і ферментів приводить до зміни виходу, виробництва і/або ефективності виробництва або вмісту бажаних сполук всередині клітин, що у свою чергу може вплинути на виробництво одного або декількох тонких хімікатів). Винахід пояснюється нижче більш докладно. І. Тонкі хімікати і поліненасичені кислоти жирного ряду PUFA Термін "тонкі хімікати" відомий фахівцю в даній галузі й означає молекули, які виробляються організмами і знаходять застосування в різних галузях промисловості, як, наприклад, фармацевтична, сільсько-господарська і косметична, однак не обмежуються ними. Ці сполуки включають ліпіди, кислоти жирного ряду, співфактори, ферменти і т.п. (такі, наприклад, що описуються в публікації Kuninaka, А. (1996) Nucleotides and related compounds, стор.561-612, у публікації Biotechnology том. 6, авторів Rehm і ін., Видавн. 17 VCH: Вайнхайм і в наведеній там літературі), ліпіди, насичені і ненасичені кислоти жирного ряду (наприклад, арахідонова кислота), вітаміни і співфактори (такі, що описані у джерелі Ullmann's Encyclopedia of Industrial Chemistry, том. А27, Vitamins, стор.443-613 (1996) Видавн. VCH: Вайнхайм і в приведених там літературних джерелах, і в публікації Ong, A.S., Niki, E., & Packer, L. (1995) Nutrition, Lipids, Health and Disease Proceedings of the UNESCO/Confederation of Scientific and Technological Associations in Malaysia and the Society for Free Radical Research - Asien, що відбулася 1.-3. вересня 1994 у Пенангі, у Малазії, AOCS Press (1995)), Enzyme und sämtliche anderen von Gutcho (1983) in Chemicals by Fermentation, Noyes Data Corporation, ISBN: 0818805086, і в наведених у ньому літературних джерелах. Обмін речовин і застосування визначених тонких хімікатів пояснюються нижче більш докладно. Комбінація різних молекул-попередників і ферментів біосинтезу приводить до одержання різних молекул кислот жирного ряду, що впливає на сполуку мембрани. Можна припустити, що поліненасичені кислоти жирного ряду (PUFAs) не тільки вбудовані в триацилгліцерин, але і також у ліпіди мембран. Синтез мембран є процесом, який добре характеризується і в якому беруть участь багато компонентів, включаючи ліпіди як частину мембрани Білайра. Виробництво нових кислот жирного ряду, наприклад, поліненасичених кислот жирного ряду (PUFAs), може приводити до нових властивостей функцій мембран всередині клітини або організму. Клітинні мембрани виконують багато функцій у клітині. Насамперед і в першу чергу мембрана обмежує вміст клітини від оточення, внаслідок чого надає клітині цілісності. Мембрани можуть служити як поріг щодо входу небезпечних або небажаних сполук і також виходу бажаних сполук. Докладний опис і функції мембран і механізмів, які беруть участь, представлені в публікаціях Bamberg, Ε., і ін. (1993) Charge transport of ion pumps on lipid bilayer membranes, Q. Rev. Biophys. 26:1-25; Gennis, R.B. (1989) Pores, Channels and Transporters, in: Biomembranes, Molecular Structure and Function, Springer: Heidelberg, стор.270-322; та Nikaido, Η., і Saier, Η. (1992) Transport proteins in bacteria: common themes in their design, Science 258:936-942, і в літературних джерелах, що цитуються в них. Синтез ліпідів підрозділяється на два етапи: синтез кислот жирного ряду і їх зв'язування з snгліцерин-3-фосфатом, а також приєднання або модифікація полярної головної групи. Звичайні ліпіди, що застосовуються в мембрані, містять фосфоліпіди, гліколіпіди, сфінголіпіди і кислоти жирного ряду. Синтез кислот жирного ряду починається з перетворення ацетил-СоА або в малоніл-СоА за допомогою ацетил-СоА-карбоксилази або в ацетил-АСР за допомогою ацетилтрансацилази. Після реакції конденсації ці обидві молекули продукту зв'язують разом за допомогою ацетоацетил-АСР, який перетворюється за допомогою ряду реакцій конденсації, відновлення і дегідратизації, так що одержується насичена молекула кислоти 86340 18 жирного ряду з бажаною довжиною ланцюга. Виробництво кислот жирного ряду з цих молекул каталізується специфічними десатуразами, а саме або аеробно за допомогою молекулярного кисню або анаеробно (щодо синтезу кислот жирного ряду в мікроорганізмах див. джерело F.C. Neidhardt і ін. (1996) Е. соlі und Salmonella. ASM Press: Вашингтон, D.C., стор.612-636 і літературні джерела, що містяться там; Lengeler і ін. (Видавн.) (1999) Biology of Procaryotes. Thieme: Stuttgart, Нью Йорк, і літературні джерела, що містяться там, а також Magnuson, К., і ін. (1993) Microbiological Reviews 57:522-542 і літературні джерела, що там наведені). Попередниками для біосинтезу поліненасичених кислот жирного ряду є, наприклад, лінолева і ліноленова кислота. Ці кислоти жирного ряду, що містять 18 атомів вуглецю, повинні подовжуватися до 20 або 22 атомів вуглецю, щоб одержати кислоти жирного ряду типу ланцюга ейкозу і докозу. За допомогою різних десатураз, таких як ферменти, що мають активність Δ6-десатурази, Δ5- і Δ4десатурази, можуть одержуватися, екстрагуватися і застосовуватися для різних цілей, наприклад, для виробництва кормів, косметичних, фармацевтичних цілей, арахідонова кислота, ейкозапентаєнова кислота і докозупентаєнова кислота, а також різні інші довголанцюгові поліненасичені кислоти жирного ряду. Для одержання довголанцюгових поліненасичених кислот жирного ряду, згаданих вище, поліненасичені кислоти жирного ряду, що містять 16, 18 або 20 атомів вуглецю, повинні подовжуватися на два атоми вуглецю за допомогою ферментативної активності елонгази. Послідовності нуклеїнових кислот згідно з винаходом кодують першу мікробну елонгазу з типових поліненасичених кислот жирного ряду в продуцентах, які містять триацилгліцерольну фракцію і які можуть подовжувати кислоти жирного ряду, що містять 16 або 18 або 20 атомів вуглецю, з щонайменше двома подвійними зв'язками в кислоті жирного ряду на щонайменше два атоми вуглецю або шляхом послідовного перетворення кислоти жирного ряду з 16 або 18 атомами вуглецю в кислоту жирного ряду з 20 атомами вуглецю і потім кислоту жирного ряду з 20 атомами вуглецю в кислоту жирного ряду, що містить 22 або більшу парну кількість атомів вуглецю з щонайменше одним подвійним зв'язком. Після однієї стадії елонгації ця ферментативна активність приводить до кислоти жирного ряду з 20 атомами вуглецю, і після другої, третьої і четвертої стадії елонгації до кислот жирного ряду з 22, 24 або 26 атомами вуглецю. За допомогою елонгази згідно з винаходом можуть бути синтезовані і більш довгі поліненасичені кислоти жирного ряду. Активність елонгаз згідно з винаходом приводить переважно до кислот жирного ряду з 20 і/або 22 атомами вуглецю з щонайменше двома подвійними зв'язками в молекулі кислоти жирного ряду, до кислот жирного ряду з 20 атомами вуглецю з щонайменше трьома, чотирма або п'ятьма подвійними зв'язками, особливо переважно, трьома подвійними зв'язками в молекулі кислоти жирного ряду, до кислот жирного ряду з 22 атомами вугле 19 цю переважно з трьома, чотирма, п'ятьма або шістьма подвійними зв'язками, особливо переважно з п'ятьма або шістьма подвійними зв'язками в молекулі кислоти жирного ряду. Після елонгації за допомогою ферменту згідно з винаходом можуть здійснюватися інші стадії дезатурації. Тому продукти активності елонгази і можливих інших стадій дезатурації приводять до кращих поліненасичених кислот жирного ряду з більш високим ступенем дезатурації, до таких, як докозудієнова кислота, арахідонова кислота, 6-ейкозутриендигомо-лінолева кислота, ейкозапентаєнова кислота, 3ейкозутриєнова кислота, 3-ейкозатетраєнова кислота, докозупентадієнова кислота або докозугексадієнова кислота. Субстратами цієї ферментативної активності згідно з винаходом є, наприклад, таксолова кислота, 7,10,13-гексадекатриєнова кислота, 6,9-октадекадієнова кислота, лінолева кислота, -ліноленова кислота, піноленова кислота, -ліноленова кислота, арахідонова кислота, ейказпентадієнова кислота або стеаридонова кислота. Кращими субстратами є лінолева кислота, ліноленова кислота і/або -ліноленова кислота, відповідно, арахідонова кислота, ейказатетраєнова кислота або ейказапентаєнова кислота. Кислоти жирного ряду, що містять 16 або 18 або 20 атомів вуглецю, з щонайменше двома подвійними зв'язками в молекулі можуть елонгуватися за допомогою ферментативної активності згідно з винаходом у формі вільної кислоти жирного ряду або у формі естеру, як фосфоліпіди, гліколіпіди, сфінголіпіди, фосфогліцериди, моноацилгліцерин, діацилгліцерин або триацилгліцерин. Далі кислоти жирного ряду повинні транспортуватися в різних модифікаціях і вбудовуватися в триацилгліцеридний накопичувальний ліпід. Іншою важливою стадією синтезу ліпідів є перенос кислот жирного ряду в полярні головні групи, наприклад, за допомогою ацилтрансферази гліцерину і кислоти жирного ряду (див. публікацію Frentzen, 1998, Lipid, 100(4-5):161-166). Публікації стосовно біосинтезу кислот жирного ряду в рослинах, дезатурації, обміну речовин ліпідів і транспортування через мембрану сполук, що містять жири, бета-окислювання, модифікації кислот жирного ряду і співфакторів, накопичення і побудови триацилгліцерину, включаючи наявні в них літературні джерела, наведені нижче: Кіnnеу, 1997, Genetic Engeneering, Видавн.: JK Setlow, 19:149-166; Ohlrogge і Browse, 1995, Plant Cell 7:957-970; Shanklin і Cahoon, 1998, Annu. Rev. Plant Physiol. Plant Моl. Biol. 49:611-641; Voelker, 1996, Genetic Engeneering, Видавн.: JK Setlow, 18:111-13; Gerhardt, 1992, Prog. Lipid R. 31:397417; Gühnemann-Schäfer & Kindl, 1995, Biochim. Biophys Acta 1256:181-186; Kunau і ін., 1995, Prog. Lipid Res. 34:267-342; Stymne і ін., 1993, у: Biochemistry and Molecular Biology of Membrane and Storage Lipids of Plants, Видавн.: Murata und Somerville, Rockville, American Society of Plant Physiologists, 150-158, Murphy & Ross 1998, Plant Journal. 13(1):1-16. Вітаміни, співфактори і такі "тонкі хімікати", як поліненасичені кислоти жирного ряду охоплюють групу молекул, які більш високо розвинуті тварини 86340 20 вже не можуть синтезувати і разом з цим сприймати або ж більш високо розвинуті тварини самі можуть у недостатньому ступені продукувати і тому повинні додатково їх одержувати, хоча вони можуть бути легко синтезовані іншими організмами, такими, як бактерії. Біосинтез цих молекул в організмах, які їх можуть продукувати, у таких, як бактерії, загалом вже описувався (див. публікації Ullmann's Encyclopedia of Industrial Chemistry, "Vitamins", том A27, стор.443-613, Видавн. VCH: Вайнхайм, 1996; Michal, G. (1999) Biochemical Pathways: An Atlas of Biochemistry and Molecular Biology, John Wiley & Sons; Ong, A.S., Niki, E., & Packer, L. (1995) "Nutrition, Lipids, Health and Disease" Proceedings of the UNESCO/Confederation of Scientific and Technological Associations in Malaysia and the Society for Free Radical Research Asia, проведеної 1.-3. верес. 1994 у Пенангі, Малазія, AOCS Press, Champaign, IL X, 374стор. Вищенаведені молекули є або самі біологічно активними молекулами або попередніми стадіями біологічно активних речовин, які служать елементами, що передають електрони, або проміжними продуктами при великій кількості шляхів обміну речовин. Ці сполуки мають поряд зі своєю поживною цінністю, також і промислове значення як барвники, антиокислювачі і каталізатори або інші допоміжні речовини (огляд структури, активності і промислової застосовності цих сполук див., наприклад, в енциклопедії Ullmann's Encyclopedia of Industrial Chemistry, "Vitamins", том A27, стор.443613, Видавн. VCH: Вайнхайм, 1996). Поліненасичені кислоти жирного ряду мають різні функції і сприятливі здоров'ю ефекти, наприклад, при коронарних серцевих захворюваннях, затравочних механізмах, у дитячому харчуванні і т.п. Публікації і літературні джерела, включаючи джерела, що в них цитуються, див. у: Simopoulos, 1999, Am. J. Clin. Nutr. 70 (3. Suppl.):560-569, Takahata і ін., Biosc. Biotechnol. Biochem. 1998, 62(11):2079-2085, Willich und Winther, 1995, Deutsche Medizinische Wochenschrift 120(7): стор.229 і далі. Даний винахід заснований щонайменше частково на відкритті нових молекул, які позначаються тут молекулами нуклеїнової кислоти специфічної елонгази поліненасичених кислот жирного ряду PSE і білка, які впливають на побудову клітинної мембрани в PhyscomitrelIa patens, Crypthecodinium cohnii, Phytophthora infestans, Thraustochytrium і/або Ceratodon purpureus і, наприклад, впливають на рух молекул через цю мембрану. При одній з форм виконання винаходу молекули PSE беруть участь в обміні речовин, необхідних для побудови мембрани клітини в організмі, такому, як мікроорганізми і рослини, або які впливають на непряме транспортування молекул через цю мембрану. При кращій формі виконання винаходу активність молекул PSE згідно з винаходом сприяє регуляції виробництва компонентів мембрани і транспорту через мембрану і впливає на виробництво бажаних тонких хімікатів цим організмом. При особливо кращій формі виконання винаходу модульована активність молекул PSE згідно з винаходом, так що вихід, виробництво і/або ефективність процесів обміну речовин мікроорганізмів або рослин, які 21 регулюють елонгази PSE згідно з винаходом, модульовані і змінена ефективність транспортування сполук через мембрани, що прямо або побічно модулює вихід, виробництво й ефективність виробництва бажаних тонких хімікатів мікроорганізмами або рослинами. Термін PSE або PSE-поліпептид охоплює білки, які беруть участь у процесі обміну речовин, необхідних для побудови клітинних мембран в організмі, наприклад, у мікроорганізмах або рослинах, сполук або у транспортуванні молекул через ці мембрани. Прикладами для PSE є наведені в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 послідовності, їх гомологи, похідні або аналоги. Поняття "елонгази PSE" або "послідовності PSE нуклеїнових кислот" включають такі послідовності нуклеїнових кислот, які кодують PSE і при яких частина може бути кодуючою ділянкою, і відповідними 5'- і 3'ділянками послідовності, що не транслюються. Прикладами для PSE-генів є представлені в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 послідовності. Поняття "виробництво" або "продуктивність" відомі фахівцю в даній галузі і позначають концентрацію продукту ферментації (наприклад, бажаного тонкого хімікату), який утворюється у певний проміжок часу й у певному об'ємі ферментації (наприклад, кг продукту за годину на літр). Поняття "ефективність виробництва" охоплює час, який необхідно для одержання певної кількості продукту (наприклад, скільки часу необхідно клітині для забезпечення певної пропускної здатності тонкого хімікату). Термін "вихід" або "вихід продукту" щодо вуглецю також відомий фахівцю в даній галузі й охоплює ефективність перетворення джерела вуглецю в продукт (тобто тонкий хімікат). Це звичайно виражається в кг продукту на кг джерела вуглецю. Підвищенням виходу або виробництва сполуки підвищується кількість одержаних молекул або придатних одержаних молекул цієї сполуки у певній кількості культури протягом певного проміжку часу. Терміни "біосинтез" або "шлях біосинтезу" відомі фахівцю в даній галузі й означають синтез сполуки, переважно органічної сполуки клітиною з проміжної сполуки, наприклад, у багатостадійному і сильно регульованому процесі. Терміни "розщеплення" або "шлях розщеплення" відомі фахівцю в даній галузі й означають розщеплення сполуки, переважно, органічної сполуки клітиною в продукти розщеплення (говорячи загалом, малі або менш комплексні молекули), наприклад, у багатостадійному і сильно регульованому процесі. Термін "обмін речовин" відомий фахівцю й охоплює сукупність біохімічних реакцій, які мають місце в організмі. Обмін речовин певної сполуки (наприклад, обмін речовин кислоти жирного ряду) охоплює сукупність шляхів біосинтезу, модифікації і розщеплення цієї сполуки в клітині, в яку входить ця сполука. При іншій формі виконання винаходу молекули PSE можуть модулювати виробництво бажаної молекули, наприклад, тонкого хімікату, у мікроорганізмі або рослині. Є цілий ряд механізмів, якими можна безпосередньо впливати на зміну PSR, на 86340 22 вихід, виробництво і/або ефективність виробництва тонкого хімікату зі штаму мікроорганізму або рослини, які містять цей змінений білок. Число або активність PSE, які беруть участь у транспортуванні молекул тонкого хімікату всередині клітини або з клітини, може бути підвищено, так що більш великі кількості цих сполук транспортуються через мембрани, з яких вони можуть бути легко одержані і перетворені одна в одну. Далі кислоти жирного ряду, триацилгліцерини і/або ліпіди є самі бажаними тонкими хімікатами. Оптимізацією активності або підвищенням числа однієї або декількох PSE згідно з винаходом, які беруть участь у біосинтезі цих сполук, або перешкодами активності однієї або декількох PSE, які беруть участь у розщепленні цих сполук, є можливість підвищення виходу, виробництва і/або ефективності виробництва молекул кислот жирного ряду і ліпідів з організмів, наприклад, мікроорганізмів або рослин. Мутагенез гена PSE згідно з винаходом може викликати утворення PSE зі зміненою активністю, які безпосередньо впливають на виробництво одного або декількох бажаних тонких хімікатів з мікроорганізмів або рослин. Наприклад, елонгази PSE згідно з винаходом, які беруть участь в експорті продуктів розщеплення, можуть мати велику чисельність або активність, так що вони можуть більш ефективно експортувати нормальні відходи процесу обміну речовин клітини (кількість яких, можливо, підвищена внаслідок надвиробництва бажаних тонких хімікатів), перш ніж вони можуть ушкоджувати молекули в клітинах (що знижувало б життєстійкість клітини) або заважати біосинтезу тонких хімікатів (що знижувало б вихід, виробництво або ефективність виробництва бажаних тонких хімікатів). Відносно великі внутрішньоклітинні кількості бажаних тонких хімікатів можуть також бути токсичними для клітини, так що підвищенням активності або числа транспортерів, які можуть експортувати ці сполуки з клітини, можна підвищити життєздатність клітини в культурі, що знову ж приводить до більш великої кількості клітин, які виробляють бажані тонкі хімікати. Енголази PSE згідно з винаходом можуть також бути змінені таким чином, що виробляються відповідні кількості різних молекул ліпідів і кислот жирного ряду. Це може значно впливати на сполуку ліпіду клітинної мембрани. У зв'язку з тим, що кожний тип ліпіду має різні фізичні властивості, зміною композиції ліпідів мембрани можна чітко змінити рухомість мембрани. Зміни рухомості мембрани можуть впливати на транспортування молекул через мембрану, а також цілісність клітини, що має значний вплив на виробництво тонких хімікатів з мікроорганізмів і рослин у ферментативній культурі у великих масштабах. Мембрани рослин додають специфічні властивості, такі, як толерантність до тепла, холоду, солі, сухості, а також толерантність проти патогенів, таких, як бактерії і гриби. Тому модуляція компонентів мембрани впливає на здатність рослин до виживання при вищенаведених стресових параметрах. Це може здійснюватися за допомогою зміни сигнальних каскадів або безпосередньо через змінену сполуку мембрани (див., наприклад, 23 86340 публікацію: Chapman, 1998, Trends in Plant Science, 3(11):419-426) і впливати на сигнальні каскади (див. публікацію Вінга 1999, Plant Physiology, 120:645-651) або толерантність до холоду, як описано в WO 95/18222. Виділені згідно з винаходом послідовності нуклеїнових кислот містяться, наприклад, у геномі штаму Thraustochytrium, який можна придбати в банку "American Type Culture Collection" (АТССколекцію) з номером штаму АТСС26185 (Thraustochytrium), відповідно, у випадку Crypthecodinium - наприклад, з Provasoli-Guillard National Center for Culture of Marine Phytoplancton ((CCMP) West Boothbay Harbour, ME, США) з номером штаму ССМР316. У випадку Phytophthora infestans наведені молекули нуклеїнових кислот, виділені зі штаму АТСС 48886. Нуклеотидна послідовність ізольованих кДНК із Physcomitrella, Crypthecodinium, Phytophthora infestans або Thraustochytrium і одержані амінокислотні послідовності Physcomitrella patens-PSEs представлені в SEQ ID NO:1 до SEQ ID NO:12. Були проведені комп'ютерні аналізи, які класифікують і/або ідентифікують ці нуклеотидні послідовності як послідовності, що кодують білки, які беруть участь в обміні речовин компонентів мембрани, або білки, що беруть участь у транспо 24 ртуванні сполук через клітинні мембрани, відповідно, біосинтезу поліненасичених кислот жирного ряду PUFA. EST's з номерами в банку даних PP001019019F, CC001042041R, PI001002014R, а також TC002034029R, TC002034029R-11 і TC002014093R у банку даних винахідника представляють послідовності згідно з винаходом, наведені в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11. Аналогічним чином позначаються парціальні поліпептиди як PP001019019F, CC001042041R, PI001002014R, а також TC002034029R, TC002034029R-11 і TC002014093R і представляють послідовності згідно з винаходом в SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 згідно з таблицею 2. Повний інсерт фрагмента ESTs TC002034029R був секвенований і була одержана SEQ ID NO:3, яка є повною послідовністю з TC002034029R. TC002034029R-11 описує послідовність повної довжини елонгази з Thraustochytrium. Назва інших клонів аналогічна. До того ж різним клонам були надані відповідні найменування гена. Скорочення: Тс означає Thraustochytrium, Cc означає Crypthecodinium, Pp означає Physcomitrella patens, Pi означає Phytophthora infestans. Таблиця 2 Позначення estнайменування PP001019019F TC002034029R TC002014093R СС001042041R TC002034029R-11 РІ001002014R Найменування гена Поліпептид SEQ ID NO Нуклеїнова кислота SEQ ID NO 2 4 6 8 10 12 1 3 5 7 9 11 Pp_PSE1 Tc_PSE1 Тс_PSE2 Сс_PSE1 Tc_PSE1_1 Pi_PSE1 Даний винахід стосується також і білків з амінокислотною послідовністю, яка в основному гомологічна амінокислотній послідовності, наведеній в SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12. Тут застосовується білок з амінокислотною послідовністю, яка в основному гомологічна вибраній амінокислотній послідовності, щонайменше, на приблизно 50% гомологічна вибраній амінокислотній послідовності, наприклад, загальній вибраній амінокислотній послідовності. Білок з амінокислотною послідовністю, яка в основному гомологічна вибраній амінокислотній послідовності, може також бути гомологічною щонайменш на приблизно від 50 до 60%, переважно щонайменш на приблизно від 60 до 70% і особливо переважно щонайменш на приблизно від 70 до 80%, від 80 до 90% або від 90 до 95% і найбільш переважно, щонайменш на приблизно 96%, 97%, 98%, 99% або більше до вибраної амінокислотної послідовності. Елонгаза PSE згідно з винаходом або її біологічно активна частина або її фрагмент може брати участь в обміні речовин, необхідних для побудови клітинних мембран у мікроорганізмах або рослинах, сполук або у транспортуванні молекул через ці мембрани або ж мати одну або декілька необ хідних для елонгації поліненасичених кислот жирного ряду з 16 або 18, відповідно, 20 атомами вуглецю, а також споріднених поліненасичених кислот жирного ряду. Різні аспекти винаходу описуються нижче. А. Виділені молекули нуклеїнової кислоти Однією формою виконання винаходу є виділені нуклеїнові кислоти, які походять з мікроорганізмів, що виробляють поліненасичені кислоти жирного ряду і кодують поліпетиди, які елонгують кислоти жирного ряду з 16 або 18 атомами вуглецю з щонайменше двома подвійними зв'язками в кислоті жирного ряду щонайменше на два атоми вуглецю або елонгують кислоту жирного ряду з 20 атомами вуглецю з щонайменше двома подвійними зв'язками в кислоті жирного ряду на щонайменше два атоми вуглецю. Інша форма виконання винаходу полягає у виділених нуклеїнових кислотах, які включають нуклеотидні послідовності, що кодують поліпептиди, які елонгують кислоти жирного ряду з 16, 18 або 20 атомами вуглецю з щонайменше двома подвійними зв'язками в кислоті жирного ряду й вибрані з групи, що включає 25 а) представлені в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 послідовності нуклеїнових кислот, б) послідовність нуклеїнових кислот, які згідно з виродженістю генетичного коду походять від наведених у SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 послідовностей, або в) похідні наведеної в 7SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 послідовності, які кодують поліпептиди наведеної в SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 амінокислотної послідовності і мають щонайменше 50% гомологію на амінокислотному рівні, без значного зниження ферментативної дії поліпептидів. Вищенаведені нуклеїнові кислоти згідно з винаходом, які діють як елонгази з 16, 18 або 20 атомами вуглецю, походять від таких організмів, як інфузорії, гриби, водорості, рослини або динофлагеляти, які можуть синтезувати поліненасичені кислоти жирного ряду, переважно з грибів або водоростей, особливо переважно з таких, як Phytophthora, Physcomitrella, Crypthecodinium, Thraustochytrium або Schizochytrium і надзвичайно переважно з Phytophthora infestans, Physcomitrella patens, Crypthecodinium cohnii або Thraustochytrium sp., Schizochytrium sp. або близьких, споріднених організмів. Винахід стосується виділених молекул нуклеїнової кислоти, які кодують PSE-поліпептиди або їх біологічно активні частини, а також фрагментів нуклеїнових кислот, які є достатніми для застосування як зондів гібридизації або затравки для ідентифікації або ампліфікації кодованої за допомогою PSE нуклеїнової кислоти (наприклад, ДНК специфічної поліненасиченим кислотам жирного ряду елонгази). Поняття "молекула нуклеїнової кислоти", застосовуване в даному описі, означає молекули ДНК (наприклад, кДНК або геномну ДНК) або молекули РНК (наприклад, мРНК), а також аналоги ДНК або РНК, які одержують за допомогою нуклеотидного аналога. Це поняття охоплює до того ж нетрансльовані послідовності на 3'- і на 5'-кінцях кодуючої ділянки гена: щонайменше приблизно 100 нуклеотидів послідовності 5'-кінця кодуючої ділянки і щонайменше приблизно 20 нуклеотидів послідовності 3'-кінця кодуючої ділянки гена. Молекула нуклеїнової кислоти може бути одноланцюговою або дволанцюговою, однак є переважно дволанцюговою ДНК. "Виділена" молекула нуклеїнової кислоти відокремлюється від інших молекул нуклеїнової кислоти, які є в природному джерелі нуклеїнової кислоти. "Виділена" нуклеїнова кислота переважно не має послідовностей, які природним чином фланкують нуклеїнову кислоту в геномній ДНК організму, з якого походить нуклеїнова кислота (наприклад, послідовності, що знаходяться на 5'- або 3'-кінцях нуклеїнової кислоти). При різних формах виконання винаходу виділена молекула нуклеїнової кислоти елонгази PSE може, наприклад, містити трохи менше, ніж приблизно 5тис. п.о., 4тис. п.о., 3тис. п.о., 2тис. п.о., 1тис. п.о., 0,5тис. п.о. або 0,1тис. п.о. нуклео 86340 26 тидних послідовностей, що природним образом фланкують молекулу нуклеїнової кислоти у геномній ДНК клітини, від якої походить нуклеїнова кислота (наприклад, клітина Physcomitrella patens). "Виділена" молекула нуклеїнової кислоти, така, як молекула кДНК, може, крім того, бути в основному вільною від іншого клітинного матеріалу або культурального середовища, якщо вона одержана рекомбінантною технікою або вільна від хімічних попередніх стадій або інших хімікатів, якщо вони хімічно синтезуються. Молекула нуклеїнової кислоти згідно з винаходом, наприклад, молекула нуклеїнової кислоти з наведеною в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 нуклеотидною послідовністю або її частини, може виділятися при застосуванні молекулярнобіологічної стандартної техніки і той, що є в розпорядженні, інформації про послідовність. Також і за допомогою порівняльних алгоритмів може бути ідентифікована, наприклад, гомологічна послідовність або гомологічні, консервативні ділянки послідовності на рівні ДНК або амінокислоти. Наприклад, може бути виділена з Phytophthora-, Physcomitrella-, Crypthecodiniumабо ThraustochytriumкДНК із Phythophthora, Physcomitrella-, Crypthecodiniumабо Thraustochtrium- банку даних, при цьому застосовуються повні послідовності SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і/або SEQ ID NO:11 або частина їх як зонди гібридизації, а також стандартна техніка гібридизації (як наприклад, описано в публікації Sambrook і ін., Molecular Cloning: A Laboratory Manual. 2. Aufl., Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989). Крім того, молекула нуклеїнової кислоти, що складає повну послідовність SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 або їх частина, може бути виділена полімеразною ланцюговою реакцією, при цьому застосовуються олігонуклеотидні затравки, які утворюються на базі цієї послідовності або її частини, зокрема, ділянок навколо His-Box-мотивів послідовності з SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 або модифікацій таких визначених окремо амінокислот (наприклад, молекула нуклеїнової кислоти, що охоплює повну, наведену в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 послідовність, або її частину, за допомогою полімеразної ланцюгової реакції при застосуванні олігонуклеотидних затравок, які утворені на базі такої ж послідовності SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11). Далі особливо придатні для цього часткові послідовності, представлені на Фіг.10. Наприклад, можна виділяти мРНК із клітин (наприклад, способом екстракції гуанідину тіоціанату авторів Chirgwin і ін. (1979) Biochemistry 18:5294-5299) і кДНК можна одержувати за допомогою зворотної транскриптази (наприклад, зворотної транскриптази Moloney-MLV, одержуваної на фірмі Gibco/BRL, Bethesda, MD, або реверсивної транскриптази AMV, одержуваної на фірмі 27 Seikagaku America, Inc., St. Petersburg, FL). Синтетичні олігонуклеотидні затравки для ампліфікації за допомогою полімеразної ланцюгової реакції можуть бути одержані на базі наведеної в SEQ ID NO:1, 3, 5, 7, 9 або 11 нуклеотидної послідовності або за допомогою представлених на Фіг.10 послідовностей амінокислот. Нуклеїнова кислота згідно з винаходом може бути ампліфікована при застосуванні кДНК або альтернативно геномної ДНК як матриці або придатної олігонуклеотидної затравки згідно із стандартною технікою полімеразної ланцюгової реакції. Ампліфікована в такий спосіб нуклеїнова кислота може бути клонована в придатний вектор і може бути охарактеризована за допомогою аналізу послідовності ДНК. Олігонуклеотиди, що відповідають нуклеотидній послідовності PSE, можуть бути одержані стандартним способом синтезу, наприклад, за допомогою автоматичного приладу синтезу ДНК. Представлена в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 кДНК включає послідовності, які кодують елонгази PSE (тобто "кодуюча ділянка"), а також 5'-нетранслатовані послідовності і 3'нетранслатовані послідовності. Альтернативно до цього молекула нуклеїнової кислоти може включати тільки кодуючу ділянку однієї з послідовностей у SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 або може містити цілі геномні фрагменти, виділені з геномної ДНК. Послідовність SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 ідентифікується такою ж нумерацією EST, що і SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11, так що вони можуть бути легко відкориговані. При ще одній кращій формі виконання винаходу виділена молекула нуклеїнової кислоти згідно з винаходом включає таку молекулу нуклеїнової кислоти, що є комплементом однієї з наведених у SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 нуклеотидних послідовностей або її частини. Молекула нуклеїнової кислоти, яка є комплементарною до наведених у SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 нуклеотидних послідовностей, є тоді досить комплементарною, коли вона може бути гібридизована з однією з наведених у SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 послідовностей, внаслідок чого виникає більш стабільний дуплекс. Гомолог нових послідовностей нуклеїнової кислоти елонгази з послідовністю SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 означає, наприклад, алельні варіанти з щонайменше приблизно від 50 до 60%, переважно щонайменше приблизно від 60 до 70%, ще більш переважно щонайменше приблизно від 70 до 80%, від 80 до 90% або від 90 до 95% і ще більш переважно щонайменше приблизно 95%, 96%, 97%, 98%, 99% або більшою гомологією до наведених в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 86340 28 нуклеотидних послідовностей або їх гомологів, похідних або аналогів або до їх частини. При ще одній кращій формі виконання винаходу виділена молекула нуклеїнової кислоти містить послідовність нуклеїнових кислот, які гібридизують з однієї з наведених у SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 послідовностей нуклеїнових кислот або їх частиною, наприклад, гібридизується при стрингентних умовах. Алельні варіанти охоплюють, зокрема, функціональні варіанти, які одержуються делецією, інсерцією або заміщенням нуклеотидів із наведеної в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 послідовності, причому метою є краще збереження ферментативної активності синтезованих білків, що походять від цього, для інсерції одного або декількох генів. Білки, які ще мають ферментативну активність елонгази, означають такі білки, із щонайменше 10%, переважно 20%, особливо переважно 30%, ще більш переважно 40% первинної ферментативної активності, у порівнянні з кодованими SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 білками. Елонгази, які мають ще вищенаведену активність, є елонгазами, ферментативна активність яких не значно знижена. Гомологи до наведених в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 послідовностей представляють собою, наприклад, бактеріальні гомологи, гомологи грибів і рослин, вкорочені послідовності, одноланцюгові ДНК або РНК кодуючої і некодуючої послідовності ДНК. Гомологи наведених у SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 послідовностей означають також і похідні, такі, як, наприклад, варіанти промоторів. Промотори проти ходу приведених нуклеотидних послідовностей можуть бути модифіковані за допомогою одного або декількох заміщень нуклеотидів, за допомогою інсерції (інсерцій) і/або делеції (делецій), без втрати функціональності активності промоторів. Далі є можливість підвищення активності промоторів за допомогою модифікації їх послідовності або їх повної заміни більш активними промоторами, навіть з гетерологічних організмів. Крім того, молекула нуклеїнової кислоти згідно з винаходом може включати тільки частину кодуючої ділянки однієї з наведених у SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 послідовностей, наприклад, фрагмент, який може застосовуватися як зонд або затравка, або фрагмент, який кодує біологічно активну ділянку елонгази PSE. Визначені з клонування гена елонгази PSE з Physcomitrella patens, Phytophthora infestans, Thraustochytrium і Crypthecodinium послідовності нуклеїнових кислот дозволяють одержання зондів і затравок, які виконані для ідентифікування і/або клонування гомологів елонгази PSE в інших типах клітин і організмах, а також гомологів елонгази PSE з інших мохів або споріднених видів. Зонд/затравка охоплює звичайно в основному очищений олігонуклеотид. Нуклеотид охоплює в основному ділянку нуклеотидної 29 послідовності, яка при жорстких умовах гібридизується із щонайменше 12, переважно приблизно 16, більш переважно приблизно 25, 40, 50 або 75 нуклеотидами, що ідуть один за одним, смислової ділянки однієї з наведених у SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 послідовностей, антисмислової ділянки однієї з наведених у SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 послідовностей або її гомологів, похідних або аналогів або наявних у природі мутантів. Затравки на базі нуклеотидної послідовності з SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 можуть застосовуватися в реакції ПЛР для клонування гомологів елонгази PSE. Зонди на базі нуклеотидних послідовностей елонгази PSE можуть застосовуватися для визначення транскриптів або геномних послідовностей, які кодують той же самий або гомологічний білок. При кращій формі виконання винаходу зонд охоплює до того ж зв'язану з ним групу маркерів, наприклад, радіоізотоп, флуоресцентну сполуку, фермент або співфактор ферменту. Ці зонди можуть застосовуватися як частина пробного набору геномних маркерів для ідентифікації клітин, які помилково експресують елонгазу PSE, наприклад, вимірювання кількості PSE кодуючої нуклеїнової кислоти зразку клітин, наприклад, вимірювання рівня PSE-мРНК або для визначення того, чи мутує або делетує геномний PSE-ген. При іншій формі виконання винаходу молекула нуклеїнової кислоти згідно з винаходом кодує білок або його частину, який/яка включає послідовність амінокислот, яка досить гомологічна до послідовності амінокислот у SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12, щоб білок або його частина зберігав здатність брати участь в обміні речовин, необхідних для побудови клітинної мембрани в мікроорганізмах або рослинах сполук або у транспортуванні молекул через ці мембрани. Застосовуване тут поняття "достатньо гомологічні" стосується білків або їх частин, амінокислотні послідовності яких мають мінімальне число ідентичних або еквівалентних залишків амінокислоти (наприклад, залишок амінокислоти з таким же бічним ланцюгом, що і залишок амінокислоти в одній із наведених у SEQ ID NO:2 до 12 послідовностей) із представленої в SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 амінокислотної послідовності так, що білок або його частина може брати участь в обміні речовин, необхідних для побудови клітинної мембрани в мікроорганізмах або рослинах сполук або у транспортуванні молекул через ці мембрани. Складові частини білка цього шляху обміну речовин для компонентів мембрани або системи транспортування через мембрану можуть грати важливу роль при виробництві і секреції одного або декількох тонких хімікатів. Приклади цієї активності тут також описуються. У такий спосіб "функція елонгази PSE" сприяє або прямо або побічно виходу, виробництву і/або ефективності виробництва одного або декількох тонких хімікатів. Приклади 86340 30 субстратспецифічності PSE каталітичної активності наведені в таблиці 1. При ще одній формі виконання винаходу похідні молекули нуклеїнової кислоти згідно з винаходом кодують білки з гомологією щонайменше приблизно від 50 до 60%, переважно, щонайменше приблизно від 60 до 70% і ще більш переважно щонайменше приблизно від 70 до 80%, від 80 до 90%, від 90 до 95% і найбільш переважно щонайменше приблизно 96%, 97%, 98%, 99% або більше до представленої в SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 послідовності амінокислот. Гомологи послідовності амінокислот по всій ділянці визначені за допомогою програми PileUp (J. Моl. Evolution., 25, 351-360, 1987, Higgins і ін., CABIOS, 5, 1989:151153) або BESTFIT або GAP (див. публікацію Henikoff, S. and Henikoff, J.G. (1992). Amino acid substitution matrices from protein blocks. Proc. Natl. Acad. Sci. USA 89: 10915-10919) Частини білків, що кодуються молекулами нуклеїнової кислоти PSE згідно з винаходом, є переважно вірогідно активними частинами однієї з елонгаз PSE. Застосовуване тут поняття "біологічно активна частина елонгази PSE", включає ділянку, наприклад, домен/мотив елонгази PSE, який може брати участь в обміні речовин, необхідних для побудови клітинної мембрани в мікроорганізмах або рослинах сполук або у транспортуванні молекул через ці мембрани або має зазначену в таблиці 1 активність. Для визначення того, чи може елонгаза PSE або її біологічно активна частина брати участь в обміні речовин, необхідних для побудови клітинної мембрани в мікроорганізмах або рослинах сполук або у транспортуванні молекул через ці мембрани, може проводитися тест ферментативної активності. Цей тест, описуваний у нижченаведеному прикладі 8, відомий фахівцю в даній галузі. Додаткові фрагменти нуклеїнових кислот, що кодують біологічно активні ділянки елонгази PSE, можуть бути одержані шляхом виділення частини однієї з наведених у SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 послідовностей, експресії кодованої ділянки елонгази PSE або пептиду (наприклад, за допомогою рекомбінантної експресії In vitro) і визначення активності кодованої частини елонгази PSE або пептиду. Винахід стосується також і молекули нуклеїнової кислоти, яка відрізняється від однієї з наведених у SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO: 11 нуклеотидних послідовностей (або її частин) внаслідок виродженості генетичного коду і, разом з цим, кодують ту ж елонгазу PSE, що і та, яка кодується представленою в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 нуклеотидною послідовністю. При іншій формі виконання винаходу виділена молекула нуклеїнової кислоти згідно з винаходом кодує нуклеотидну поблідовність, яка кодує білок з представленою в SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 послідовністю амінокислот. При ще одній формі виконання винаходу молекула нуклеїнової кислоти 31 згідно з винаходом кодує білок елонгази PSE повної довжини, який загалом є гомологічним послідовності амінокислот у SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 або SEQ ID NO:12 (яка кодується представленим у SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 відкритою рамкою зчитування) і може ідентифікуватися і виділятися відомими методами. Додатково до представлених в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 нуклеотидних послідовностей елонгази PSE фахівець у даній галузі може бачити, що поліморфізми послідовності ДНК, які приводять до зміни в аміноксилотних послідовностях елонгаз PSE, можуть існувати всередині однієї популяції (наприклад, популяції Physcomitrella, Phytophthora, Crypthecodinium або Thraustochytrium). Ці генетичні поліморфізми існують у гені PSE між особинами всередині популяції внаслідок природної варіації. Застосовувані при цьому терміни "ген" і "рекомбінантний ген" означають молекули нуклеїнової кислоти з однією відкритою рамкою зчитування, яка кодує елонгазу PSE, переважно елонгазу PSE з Phytophthora, Physcomitrella, Crypthecodinium або Thraustochytrium. Ці природні варіанти звичайно сприяють варіації від 1 до 5% у нуклеотидній послідовності гена елонгази PSE. Усі ці варіації нуклеотиду і отримані в результаті поліморфізми аміноксилот в елонгазі PSE, які є результатом природної варіації і які не змінюють функціональну активність елонгаз PSE, входять у рамки даного винаходу. Молекули нуклеїнової кислоти, що відповідають природним варінтам, а не Physcomitrella-, Phytophthora-, Crypthecodiniumабо Thraustochytrium -гомологам, -похідним і аналогам Phytophthora-, Physcomitrella-, Crypthecodiniumабо Thraustochytrium -кДНК, можуть виділятися на основі їх гомології до описуваної тут нуклеїнової кислоти Phytophthora-, Physcomitrella-, Crypthecodinium- або Thraustochytrium -PSE при застосуванні Physcomitrella-, Phytophthora-, Crypthecodinium- або Thraustochytrium-кДНК або її частини в якості зонда гібридизації згідно із стандартною технікою гібридизації з кДНК. При іншій формі виконання винаходу ізольована молекула нуклеїнової кислоти згідно з винаходом має довжину щонайменше в 15 нуклеотидів гібридизує при жорстких умовах з молекулою нуклеїнової кислоти, яка має представлену в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 нуклеотидну послідовність. При іншій формі виконання винаходу нуклеїнова кислота має довжину щонайменше в 25, 50, 100, 250 або більше нуклеотидів. Застосовуване тут поняття "гібридизує при жорстких умовах" описує умови гібридизації і промивання, при яких нуклеотидні послідовності, які щонайменше на 60% гомологічні одна до одної, залишаються гібридизованими одна з одною. Такі умови полягають переважно в тому, що послідовності, які гомологічні одна до одної щонайменше приблизно на 65%, особливо переважно щонайменше приблизно на 70% і ще 86340 32 більш переважно щонайменше приблизно на 75% або більше, звичайно залишаються гібридизованими одна з одною. Ці умови відомі фахівцю в даній галузі й описуються в публікації Current Protocols in Molecular Biology, John Wiley & Sons, N.Y. (1989), 6.3.1-6.3.6. Кращим, однак не обмежуючим прикладом для таких умов гібридизації є гібридизації в 6 SSC (хлорид натрію/цитрат натрію) при приблизно 45°С, з подальшою однією або декількома стадіями промивання в 0,2 SSC, 0,1% додецилсульфат натрію (SDS) при 50 до 65°С. Фахівцю в даній галузі відомо, що ці умови гібридизації розрізняються в залежності від типу нуклеїнової кислоти і, якщо наприклад, застосовується органічний розчинник, в залежності від температури і концентрації буфера. Температура, наприклад, при стандартних умовах гібридизації може мати значення в залежності від типу нуклеїнової кислоти між 42°С і 58°С у водному буфері з концентрацією від 0,1 до 5 SSC (рН 7,2). У випадку органічного розчинника у вищенаведеному буфері, наприклад 50% формаміду, температура при умовах гібридизації дорівнює приблизно 42°С. Кращими умовами гібридизації для ДНК : ДНК гібрида є, наприклад, 0,1 SSC і від 20°С до 45°С, переважно, між 30°С і 45°С. Кращими умовами гібридизації для ДНК : ДНК-гібрида, наприклад, 0,1 SSC і від 30°С до 55°С, переважно від 45°С до 55°С. Вищенаведені температури гібридизації призначені, наприклад, для нуклеїнової кислоти з довжиною приблизно 100п.о. і вмістом G + С у 50% у присутності формаміду. Фахівець у даній галузі знає, як можна визначити умови гібридизації за допомогою вищенаведеного навчального матеріалу, а також таких джерел: Sambrook і ін., "Molecular Cloning", Cold Spring Harbor Laboratory, 1989; Hames und Higgins (Видавн.) 1985, "Nucleic Acids Hybridization: A Practical Approach", IRL Press at Oxford University Press, Oxford; Brown (Видавн.) 1991, "Essential Molecular Biology: A Practical Approach", IRL Press at Oxford University Press, Oxford. Виділена молекула нуклеїнової кислоти згідно з винаходом, яка прижорстких умовах гібридизується з послідовністю з SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11, відповідає наявній в природі молекулі нуклеїнової кислоти. Застосовуваний тут термін "наявна в природі" нуклеїнова кислота означає молекулу РНК або ДНК із нуклеотидною послідовністю, яка зустрічається в природі (наприклад кодує природний білок). При одній формі виконання винаходу нуклеїнова кислота кодує елонгазу, що зустрічається в природі Physcomitrella patens-PSE, Phytophthora infestans-PSE, Crypthecodinium cohniiPSE або Thraustochytrium-PSE. Додатково до варіантів, що зустрічаються в природі, PSE-послідовності, які можуть існувати в популяції, фахівець може розпізнати, що також і зміни за допомогою мутації можуть бути внесені в нуклеотидну послідовність, представлену в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11, що приводить до змін послідовності амінокислот кодованої елонгази PSE без того, що ушкоджується функціональність 33 білка PSE. Наприклад, заміщення нуклеотидів, які на "несуттєвих" залишках амінокислот приводять до амінокислотних заміщень, можуть бути одержані в представленій у SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 послідовності. "Несуттєвим" залишком амінокислоти є залишок, що може змінюватися в послідовності дикого типу елонгаз PSE (SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12). Без зміни активності PSE, на противагу цьому "істотний" залишок амінокислоти потрібний для активності PSE. Інші залишки амінокислоти (наприклад такі, які не консервативними в домені з активністю PSE або є тільки напівконсервативними) можуть бути несуттєвими для активності і можуть змінюватися без зміни активності PSE. Внаслідок цього винахід стосується молекули нуклеїнової кислоти, яка кодує елонгази PSE, що містять змінені залишки амінокислоти, які не є істотними для PSE - активності. Ці елонгази PSE відрізняються за послідовністю амінокислот від представленої в SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 послідовності і зберігають щонайменше одну з описуваних тут PSE-активностей. Виділена молекула нуклеїнової кислоти при одній формі виконання включає нуклеотидну послідовність, яка кодує білок, причому білок має послідовність амінокислот із щонайменше приблизно 50%-ою гомологією до представленої в SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 послідовності амінокислот і може брати участь в обміні речовин, необхідних для побудови мембрани клітини в Phytophthora, Physcomitrella, Crypthecodinium або Thraustochytrium сполук або у транспортуванні молекул через ці мембрани. Кодований молекулою нуклеїнової кислоти білок є гомологічним переважно щонайменше приблизно на 50 до 60% до представлених в SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 послідовностей, особливо переважно щонайменше приблизно на 60 до 70% є гомологічним до представлених в SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 послідовностей і ще більш переважно щонайменше приблизно на 70 до 80%, 80 до 90%, 90 до 95% до представлених в SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 послідовностей і найбільше переважно щонайменше приблизно на 96%, 97%, 98% або 99% є гомологічним до представлених в SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 послідовностей. Для визначення процентної гомології двох амінокислотних послідовностей (наприклад, однієї представленої в SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 послідовності і її однієї мутованої форми) або двох нуклеїнових кислот послідовності для їх оптимального порівняння одна з одною пишуться одна під одною (наприклад, пробіли можуть вводитися в послідовність білка або нуклеїнової кислоти, щоб досягти оптимального вирівнювання з 86340 34 іншим білком або з іншою нуклеїновою кислотою). Залишки амінокислот або нуклеотидів у відповідному положенні амінокислоти або положенні нуклеотиду потім порівнюються. Якщо одне положення в послідовності (наприклад в одній з послідовностей з SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12) зайнято тим же амінокислотним залишком або тим же нуклеотидом, що і відповідне місце в іншій послідовності (наприклад, мутованій формі, вибраній з SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 послідовності), тоді молекули в цьому положенні гомологічні (тобто "гомологія" амінокислоти або нуклеїнової кислоти, застосовуваних тут, відповідає "ідентичності" амінокислоти або нуклеїнової кислоти). Процентна гомологія між обома послідовностями є функцією числа ідентичних положень, які є загальними для обох послідовностей (тобто % гомологія дорівнює числу ідентичних положень/значення числа положень, помноженому на 100). Подібна молекула нуклеїнової кислоти, яка кодує елонгазу PSE, яка гомологічна послідовності білка з SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12, може бути одержана за допомогою здійснення одного або декількох заміщень, приєднанням або селекцією нуклеотидів у наведеній в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 послідовності, так що одне або кілька заміщень, приєднань або селекція амінокислоти може бути введена в кодований білок. Мутації можуть бути внесені в одну з наведених у SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 послідовностей шляхом стандартних методів, таких, як сайтспецифічний мутагенез або викликаний ПЛР мутагенез. Переважно, консервативне заміщення амінокислот здійснюється на одному або декількох вищенаведених несуттєвих амінокислотних залишках. При "консервативному заміщенні амінокислот" залишок амінокислоти заміняється залишком амінокислоти зі схожим бічним ланцюгом. Сімейства амінокислот з однаковими бічними ланцюгами охоплюють амінокислоти з основними бічними ланцюгами (наприклад, лізин, аргінін, гістидин), кислотними бічними ланцюгами (наприклад, аспарагінова кислота, глутамінова кислота), незарядженими, полярними бічними ланцюгами (наприклад, гліцин, аспарагін, глутамін, серин, треонін, тирозин, цистеїн), неполярними бічними ланцюгами, (наприклад, аланін, валін, лейцин, ізолейцин, пролін, фенілаланін, метіонін, триптофан), бетарозгалуженими бічними ланцюгами (наприклад, треонін, валін, ізолейцин) і ароматичними бічними ланцюгами (наприклад, тирозин, фенілаланін, триптофан, гістидин). Вищенаведений несуттєвий залишок амінокислоти в елонгазі PSE заміняється переважно іншим залишком амінокислоти з того ж сімейства бічних ланцюгів. Альтернативно при іншій формі виконання винаходу мутації можуть вноситися за принципом випадковості по всій або по частині кодуючої елонгазу PSE послідовності, наприклад, за допомогою насичувального мутаге 35 незу насичення і одержані в результаті мутанти можуть перевірятися на описану тут PSEактивність, щоб ідентифікувати мутанти, які зберігають PSE-активність. Після мутагенезу однієї з наведених у SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 послідовностей кодований білок може бути рекомбінантно експресований, і активність білка може бути визначена при застосуванні нижчеописуваних тестів (див. приклади). Додатково до молекул нуклеїнових кислот, що кодують вищеописані елонгази PSE, даний винахід стосується виділених молекул нуклеїнової кислоти, які є "антисмисловими". "Антисмислова" нуклеїнова кислота включає нуклеотидну послідовність, яка комплементарна до "смислової" нуклеїнової кислоти, що кодує білок, наприклад, комплементарна до кодуючого ланцюга дволанцюгової кДНКмолекули або комплементарна до послідовності мРНК. Отже, антисмислова нуклеїнова кислота може зв'язуватися з утворенням вуглеводневого містка зі смисловою нуклеїновою кислотою. Антисмислова нуклеїнова кислота може бути комплементарна до загального, кодуючого PSE ланцюга або тільки до його частини. При одній формі виконання винаходу молекула антисмислової нуклеїнової кислоти є "антисмисловою" до "кодуючої ділянки" кодуючого ланцюга нуклеотидної послідовності, яка кодує PSE. Поняття "кодуюча ділянка" означає ділянку нуклеотидної послідовності, яка містить кодони, які транслюються в залишки нуклеїнової кислоти (наприклад, вся кодуюча ділянка, яка починається і закінчується термінальним кодоном, тобто останнім кодоном перед термінальним кодоном). При іншій формі виконання винаходу молекула антисмислової нуклеїнової кислоти є "антисмисловою" до "некодуючої ділянки" кодуючого ланцюга послідовності нуклеїнових кислот, яка кодує PSE. Поняття "некодуюча ділянка" стосується 5'- і 3'-послідовностей, які фланкують кодуючу ділянку і не трансльовані в амінокислоти (тобто які позначають 5'- і 3'-нетранслатованими ділянками). З урахуванням описуваних, кодуючих PSE послідовностей кодуючого ланцюга (наприклад, наведені в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 послідовності) антисмислові нуклеїнові кислоти згідно з винаходом можуть бути виконані згідно з методом спарювання основ Уотсона-Кріка. Молекула антисмислової нуклеїнової кислоти може бути комплементарна до загальної кодуючої ділянки PSEмPHK, однак найбільш переважно може бути олігонуклеотидом, який є "антисмисловим" тільки на частині кодуючої або некодуючої ділянки PSEмPHK. Антисмисловий олігонуклеотид може, наприклад, бути комплементарним до ділянки, яка оточує місце трансляції PSE-мPHK. Антисмисловий олігонуклеотид може мати довжину, наприклад, приблизно 5, 10, 15, 20, 25, 30, 35, 40, 45 або 50 і більше нуклеотидів.Переважно антисмисловий олігонуклеотид має довжину від 15 до 25 нуклеотидів. Антисмислова нуклеїнова кислота згідно з винаходом може при застосуванні хімічного синтезу і ферментативної реакції елонгації бути зкон 86340 36 струйована відомим фахівцю в даній галузі способом. Антисмислова нуклеїнова кислота (наприклад, антисмисловий олігонуклеотид) може бути, наприклад, хімічно синтезована, причому застосовуються наявні в природі нуклеотиди або будьяким чином модифіковані нуклеотиди, які створені так, що вони підвищують біологічну стабільність молекул або підвищують фізичну стабільність утвореного між антисмисловою і смисловою нуклеїновими кислотами дуплекса, наприклад, застосовуються похідні фосфортіоату й архідинзаміщені нуклеотиди. Прикладами для модифікованих нуклеотидів, які можуть застосовуватися для одержання антисмислової нуклеїнової кислоти, є, серед інших, 5-фторурацил, 5-бромурацил, 5хлорурацил, 5-йодурацил, гіпоксантин, ксантин, 4ацетилцитозин, 5-(карбоксигідроксиметил)урацил, 5-карбоксиметиламінометил-2-тіоуридин, 5карбокси-метиламінометилурацил, дигідроурацил, бета-D-галактозилквеозин, інозин, N6ізопентеніладенін, 1-метилгуанін, 1-метилінозин, 2,2-диметилгуанін, 2-метиладенін, 2-метилгуанін, 3-метилцитозин, 5-метилцитозин, N6-аденін, 7метилгуанін, 5-метиламінометилурацил, 5метоксиамінометил-2-тіоурацил, бета-Dманозилквеозин, 5'-метоксакарбоксиметилурацил, 5-метоксиурацил, 2-метилтіо-N6-ізопентиладенін, урацил-5-оксиоцтова кислота (ν), вібутоксозин, псевдоурацил, квеозин, 2-тіоцитозин, 5-метил-2тіоурацил, 2-тіоурацил, 4-тіоурацил, 5метилурацил, метиловий естер урацил-5оксиоцтової кислоти, урацил-5-оксиоцтова кислота (ν), 5-метил-2-тіоурацил, 3-(3-аміно-3-N-2карбоксипропіл)урацил, (acp3)w і 2,6-діамінопурин. Антисмисолова нуклеїнова кислота альтернативно може бути одержана біологічно при застосуванні вектора експресії, в який субклонується нуклеїнова кислота з антисмисловою орієнтацією (тобто РНК, яка транскрибується введеною нуклеїновою кислотою, орієнтована до цільової нуклеїнової кислоти в антисмисловому напрямку, що нижче описується більш докладно). Молекули антисмислової нуклеїнової кислоти згідно з винаходом звичайно вводяться в клітину або виходять in situ, так що вони гібридизуються із клітинною мРНК і/або геномною ДНК, що кодує елонгазу PSE, або зв'язуються з нею, щоб інгібувати експресію білка, наприклад, за допомогою інгібування транскрипції і/або трансляції. Гібридизація може здійснюватися за допомогою звичайної комплементарності нуклеотиду з утворенням стабільного дуплекса або, наприклад, у випадку молекули антисмислової нуклеїнової кислоти, яка зв'язує ДНК-дуплекс, за допомогою специфічної взаємодії у великих витках подвійної спіралі. Антисмислова молекула може бути модифікована таким чином, що вона специфічно зв'язується з рецептором або експресованим на вибраній поверхні клітини антигеном, наприклад, за допомогою зв'язування молекули антисмислової нуклеїнової кислоти з пептидом або антитілом, який/яке зв'язується з рецептором поверхні клітини або антигеном. Молекула антисмислової нуклеїнової кислоти може також при застосуванні описуваних векторів вводитись в клітини. Для одержання дос 37 татньої внутрішньоклітинної концентрації антисмислової молекули кращими є конструкти векторів, в яких антисмислова молекула нуклеїнової кислоти знаходиться під контролем прокаріотичного, вірусного або еукаріотичного, включаючи рослинний, промотора. При ще одній формі виконання винаходу антисмислова молекула нуклеїнової кислоти згідно з винаходом є α-аномерною молекулою нуклеїнової кислоти. α-аномерна молекула нуклеїнової кислоти утворює специфічні дволанцюгові гібриди з комплементарною РНК, причому ланцюги на противагу звичайним β-одиницям розміщуються паралельно один до одного, [див. публікацію Gaultier і ін. (1987) Nucleic Acids Res. 15:6625-6641]. Антисмислова молекула нуклеїнової кислоти може до того ж містити 2'-о-метилрибонуклеотид [див. публікацію Inoue і ін. (1987) Nucleic Acids Res. 15:6131-6148] або химерний РНК-ДНК-аналог [див. публікацію Inoue і ін. (1987) FEBS Lett. 215:327330]. При ще одній формі виконання винаходу антисмислова нуклеїнова кислота згідно з винаходом є рибозимом. Рибозими представляють каталітичні РНК-молекули з рибонуклеазною активністю, які можуть розщеплювати одноланцюгову нуклеїнову кислоту, таку, як мРНК, в якій вони мають комплементарну ділянку. У зв'язку з цим рибозими, наприклад, рибозими Хаммерхідар [описані в публікації Haselhoff und Gerlach (1988) Nature 334:585591] можуть застосовуватися для каталітичного розщеплення транскриптів PSE-мРНК, щоб цим інгібувати трансляцію PSE-мРНК. Рибозим зі специфічністю до кодуючої елонгазу PSE нуклеїнової кислоти може бути побудований на базі нуклеотидної послідовності описуваної в даній заявці PSEкДНК (тобто. 38_ck21_g07fwd у послідовності SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11) або на базі описуваного в даній заявці способу одержання гетерологічної послідовності. Наприклад, може бути побудована похідна тетрагімену-L-19-IVS-PHK, причому нуклеотидна послідовність активного місця комплементарна до нуклеотидної послідовності, яка повинна розщеплюватися в кодуючій енголазу PSE мРНК. Див., наприклад, публікації Cech і ін., US 4,987,071 і Cech і ін., US 5,116,742. Альтернативно PSE-мРНК може застосовуватися для селекції каталітичної РНК зі специфічною рибонуклеазною активністю з колекції молекул РНК [див., наприклад, Bartel, D., und Szostak, J.W. (1993) Science 261:1411-1418]. Альтернативно генна експресія елонгази PSE може бути інгібована таким чином, що нуклеотидні послідовності, комплементарні до регуляторної ділянки PSE-нуклеотидної послідовності (наприклад, PSE-промотору і/або енхансеру), керуються таким чином, що утворюються структури потрібної спіралі, які інгібують транскрипцію PSE-гена в цільовій клітині [див. загалом публікацію Helene, C. (1991) Anticancer Drug Res. 6(6) 569-84; Helene, С, і ін. (1992) Ann. N.Y. Acad. Sci. 660:27-36; і Maher. LJ. (1992) Bioassays 14(12):807-815]. Б. Генний конструкт 86340 38 Інший об'єкт винаходу стосується нового генного конструкта, який містить виділену нуклеїнову кислоту, що походить з Physcomitrella, Phytophthora, Crypthecodinium або Thraustochytrium і кодує поліпептид, який елонгує кислоти жирного ряду з 16, 18 або 20 вуглецевими атомами з щонайменше двома подвійними зв'язками в кислоті жирного ряду на щонайменше два атоми вуглецю, або містить генну послідовність, наведену в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11, її гомологи, похідні або аналоги, які функціонально зв'язані з одним або декількома регуляторними сигналами, переважно для підвищення генної експресії. Прикладами для таких регуляторних послідовностей є послідовності, що зв'язуються з індукторами і репресорами, таким чином регулюють експресію нуклеїнової кислоти. Додатково до цих нових регуляторних послідовностей може ще бути також і природна регуляція цих послідовностей перед власне структурними генами, кращим чином генетично модифікована, так що природна регуляція виключається і підвищується експресія генів. Генний конструкт, однак, може мати більш просту структуру, це означає, що не були вставлені додаткові регуляторні сигнали перед послідовністю SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 або її гомологами і природний промотор зі своєю регуляцією не був делетований. Замість цього природна регулятивна послідовність була мутована таким чином, що далі регуляція відсутня, а експресія посилена. Генний конструкт може переважно влючати одну або декілька так званих енхансер-послідовностей, які функціонально зв'язані з промотором і дозволяють проводити підвищену експресію послідовності нуклеїнових кислот. Також є можливість інсерції на 3'-кінці ДНК-послідовності додаткової послідовності, наприклад, ще одного регуляторного елемента або термінаторів. Гени елонгази в генному конструкті можуть бути в одній або декількох копіях. Кращою є наявність інших генів у генному конструкті для інсерції інших генів в організмі. Кращі регуляторні послідовності для нового способу є, наприклад, у промоторах, таких, як cos-, qtac-, trp-, tet-, trp-tet-, Ipp-, lac-, Ipp-lac-, lacl , T7-, T5-, T3-, gal-, trc-, аrа-, SP6-, -PR- або -РLпромоторі і застосовуються переважно у грамнегативних бактеріях. Інші кращі регуляторні послідовності є, наприклад, у грам-позитивних промоторах amy і SPO2, у дріжджових або грибних промоторах ADC1, MFa, АС, Р-60, CYC1, GAPDH, TEF, rpY28, ADH або в рослинних промоторах CaMV/35S [див. публікацію Franck і ін., Cell 21 (1980) 285-294], PRP1 [Ward і ін., Plant. Моl. ВіоІ. 22 (1993)], SSU, OCS, Iib4, usp, STLS1, В33, nos або в убіквітин- або фезеолін-промоторі. У цьому зв'язку кращими є також індуковані промотори, такі, як описані в ЕР-А-0 388 186 (індуковані бензилсульфонамідом), Plant J. 2, 1992:397-404 (Gatz і ін., індуковані тетрацикліном), ЕР-А-0 335 528 (індуковані абсцизовою кислотою) або в WO 93/21334 (індуковані етанолом або циклогексанолом) промотори. Іншими придатними рослинними промоторами є промоторFBP-азицитозоля або ST 39 LSI-промотор картоплі (див. публікацію Stockhaus і ін., ЕМВО J. 8, 1989, 2445), промотор фосфорибозилпірофосфатамідотрансферази з гліцину макс (номер банку генів U87999) або описаний у ЕР-А-0 249 676 нодієн-специфічний промотор. Особливо кращими промоторами є такі промотори, які дозволяють проводити експресію в тканинах, що беруть участь у синтезі кислот жирного ряду. Особливо кращими є специфічні для насіння промотори, такі, як usp-, LEB4-, фазеолін- або напіновий промотор. Іншими особливо кращими промоторами є специфічні для насіння промотори, які можуть застосовуватися для однодольних або дводольних рослин і описуються в US 5,608,152 (напіновий промотор з рапсу), WO 98/45461 (фазеоліновий промотор з Arobidopsis), US 5,504,200 (фазеоліновий промотор з Phaseolus vulgaris), WO 91/13980 (Все4-промотор з Brassica), у публікації Baeumlein і ін., Plant J., 2, 2, 1992:233-239 (LЕВ4-промотор з легумінози), причому ці промотори придатні для дводольних. Приведені далі промотори придатні, наприклад, для однодольних: lpt-2- або lpt-1промотор з ячменю (WO 95/15389 і WO 95/23230), хордеїн-промотор з ячменю й інші, описані в WO 99/16890 промотори. В принципі є можливість застосовувати всі природні промотори зі своїми регуляторними послідовностями, наведеними вище, для нового способу, також можна застосовувати додатково синтезовані промотори. Генний конструкт, як описано вище, може включати інші гени, які варто вводити в організм. Є можливість, що дає переваги, вводити в організмихазяїни регуляторні гени, такі, як гени для індукторів, рецепторів або ферментів, які внаслідок їх ферментативної активності беруть участь у регуляції одного або декількох генів біосинтезу, і експресувати у них. Ці гени можуть бути гетерологічного або гомологічного походження. Вбудовані гени можуть мати свій власний промотор або знаходитися під контролем промотору послідовності SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 або їх гомологів, похідних або аналогів. Переважно генний конструкт для експресії інших наявних генів включає ще 3'- і/або 5'-кінцеві регуляторні послідовності для підвищення експресії, які вибираються в залежності від вибраного організму-хазяїна і гена або генів для оптимальної експресії. Ці регуляторні послідовності повинні, як наведено вище, забезпечувати специфічну експресію генів і білків. В залежності від організма-хазяїна це означає, наприклад, те, що ген експресується або надекспресується тільки після індукції або що він відразу експресується і/або надекспресується. Крім того, регуляторні послідовності або фактори можуть впливати на експресію введеного гена і таким чином підвищувати її. Таким чином є можливість посилення регуляторних елементів на рівні транскрипції при застосуванні сильних сигналів транскрипції, таких, як промотори і/або енхансери. Однак, є також і можливість посилення трансляції наприклад шляхом поліпшення стабільності мРНК. Переважно послідовності нуклеїнових кис 86340 40 лот згідно з винаходом клонуються разом із щонайменше одним геном-репортером у генний конструкт (означає експресійну касету, конструкт нуклеїнової кислоти), який вводиться в організм через вектор або безпосередньо в геном. Цей генрепортер повинен забезпечувати легке виявлення методами аналізу, флуоресценсії, хемометодом, біолюмінесценсії, або опору, або фотометричного виміру. Як приклад для гена-репортера варто привести резистентні до антибіотика або гербіциду гени, гени гідролази, гени флуорисцентного білка, гени біолюмінесценсії, гени обміну речовин цукру або нуклеотиду або гени біосинтезу, такі, як Ura3ген, llv2-гєн, ген люциферази, ген b-галактозидази, gfp-ген, ген 2-дезоксиглюкоза-6фосфатфосфатази, ген b-глюкуронідази, ген bлактамази, ген неоміцинфосфотрансферази, ген гігроміцинфосфотрансферази або ген BASTA (резистентний глюфозинату ген). Ці гени дозволяють легку вимірюваність і визначення кількості активності до транскрипції і разом з цим експресії генів. Цим можна визначати місця геномів, які виявляють різну продуктивність. Послідовності нуклеїнових кислот згідно з винаходом з наведеною в SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 послідовністю, які можуть кодувати елонгазу, можуть міститися в одній або декількох копіях в експресійній касеті (у генному конструкті). Експресійна касета (тобто генний конструкт, конструкт нуклеїнової кислоти) може містити щонайменше ще одну нуклеїнову кислоту, яка кодує ген переважно з біосинтезу кислоти жирного ряду, і яка повинна бути внесена в організми-хазяїни. Ці гени можуть знаходиться під роздільною регуляцією або під тим же регіоном регуляції, що і гени елонгаз згідно з винаходом. При цих генах мова йде, наприклад, про інші гени біосинтезу, переважно синтезу кислот жирного ряду, які дозволяють підвищений синтез. Як приклади можна привести гени для Δ19-, Δ17-, Δ15-, Δ12-, Δ9-, Δ8-, Δ6-, Δ5-, Δ4-десатурази, різні гідролази, Δ12-ацетиленази, ацил-АСР-тіоестерази, β-кетоацил-АСР-синтази або β-кетоацил-АСР-редуктази. Переважно в конструкті нуклеїнової кислоти застосовуються гени десатурази. Також і ці гени можуть бути в одній або декількох копіях у генному конструкті. В. Рекомбінантні вектори експресії і клітинихазяїни Іншим об'єктом винаходу є вектори, переважно, експресійні вектори, що містять нуклеїнову кислоту згідно з винаходом або генний конструкт згідно з винаходом, які кодують елонгазу PSE (або її частину). Термін "вектор" стосується молекули нуклеїнової кислоти, яка може транспортувати іншу нуклеїнову кислоту, з якою вона зв'язана. Типом вектора є "плазміда", що відноситься до кільцьової дволанцюгової ДНК-петлі, в яку можуть бути ліговані додаткові ДНК-сегменти. Іншим типом вектора є вірусний вектор, причому у вірусний геном можуть бути ліговані додаткові ДНКсегменти. Певні вектори можуть автономно репліруватись в одній клітині-хазяїні, в яку вони вбудовані (наприклад, бактеріальний вектор з бактеріальним стрибком реплікації і епісомальні вектори 41 ссавців). Інші вектори (наприклад, неепісомальні вектори ссавців) при вбудуванні в клітину-хазяїна інтегрують у геном клітини-хазяїна і внаслідок цього реплікують разом з геномом-хазяїном. До того ж певні вектори можуть керувати експресією генів, з якими вони функціонально зв'язані. Ці вектори позначаються "експресійними векторами". Звичайно експресійні вектори, які придатні для ДНКрекомбінації, мають форму плазміди. У даному описі терміни "плазміда" і "вектор" можуть замінятися один одним, тому що плазміда є найбільш часто застосовуваною формою вектора. Винахід, однак, включає також і інші форми експресійних векторів, такі, як вірусні вектори (наприклад, ретровіруси, аденовіруси і споріднені аденовіруси), які виконують такі ж функції. Далі термін "вектор" включає й інші вектори, відомі фахівцю в даній галузі, наприклад, фаги, віруси, такі, як SV40, CMV, бакуловірус, аденовірус, транспозони, ISелементи, фасміди, фагеміди, косміди, лінійні або кругові ДНК, а також РНК. Рекомбінантні експресійні вектори згідно з винаходом включають нуклеїнову кислоту згідно з винаходом або генний конструкт згідно з винаходом у формі, яка придатна для експресії нуклеїнової кислоти в клітині-хазяїні, що означає те, що рекомбінантні експресійні вектори включають одну або декілька регуляторних послідовностей, вибраних на базі застосовуваних для експресії клітинхазяїнів, які функціонально зв'язані з підлягаючою експресії послідовністю нуклеїнової кислоти. У рекомбінантному експресійному векторі поняття "функціонально зв'язані" означає те, що послідовність нуклеїнової кислоти в такий спосіб зв'язана з регуляторною послідовністю, що можлива експресія послідовності нуклеїнових кислот і вони зв'язані одна з одною, що обидві послідовності виконують передбачену, призначену для послідовності функцію (наприклад, у системі in-vitroтранскрипції/трансляції або в клітині-хазяїні, якщо вектор вбудований у клітину-хазяїна). Термін "регуляторна послідовність" включає інші елементи контролю експресії (наприклад, сигнали поліаденілювання). Регуляторні послідовності описані в публікації Goeddel: Gene Expression Technology: Methods у Enzymology 185, Academic Press, San Diego, CA (1990), або див.: Gruber und Crosby, у публікації: Methods in Plant Molecular Biology and Biotechnolgy, CRC Press, Boca Raton, Florida, Видавн.: Glick und Thompson, глава 7, 89-108, включаючи наведені в них літературні джерела. Регуляторні послідовності включають такі послідовності, які управляють конститутивною експресією послідовності нуклеїнової кислоти в багатьох типах клітини-хазяїна і такі, що управляють безпосередньо експресією послідовності нуклеїнової кислоти тільки у певних клітинах-хазяїнах за певних умов. Фахівець у даній галузі знає, що побудова експресійних векторів може залежати від таких факторів, як вибір клітин-хазяїв, що підлягають трансформації, величина експресії бажаного білка і т.п. Експресійні вектори згідно з винаходом можуть вбудовуватися в клітину-хазяїна, щоб завдяки цьому одержувати білки або пептиди, включаючи гібридні білки або пептиди, які кодуються 86340 42 нуклеїновими кислотами, описуваними тут (наприклад, елонгази PSE, мутантні форми елонгаз PSE, гібридні білки і т.п.). Рекомбінантні експресійні вектори згідно з винаходом можуть бути побудовані для експресії елонгаз PSE у прокаріотичних і еукаріотичних клітинах. Наприклад, гени елонгаз PSE можуть бути експресовані в бактеріальних клітинах, таких, як С. glutamicum, клітини комах (при застосуванні експресійних векторів Baculovirus), клітини дріжджів і грибів [див. публікацію Romanos, M.A., і ін. (1992) "Foreign gene expression in yeast: a review", Yeast 8:423-488; van den Hondel, C.A.M.J.J., і ін. (1991) "Heterologous gene expression in filamentous fungi", y: More Gene Manipulations in Fungi, J.W. Bennet & L.L. Lasure, Видавн., Стор.396-428: Academic Press: San Diego; і van den Hondel, C.A.M.J.J., & Punt, P.J. (1991) "Gene transfer systems and vector development for filamentous fungi, y: Applied Molecular Genetics of Fungi, Peberdy, J.F., і ін., Видавн., Стор.1-28, Cambridge University Press: Cambridge], Algen [Falciatore і ін., 1999, Marine Biotechnology. 1, 3:239-251)], інфузорії типів: Holotrichia, Peritrichia, Spirotrichia, Suctoria, Tetrahymena, Paramecium, Colpidium, Glaucoma, Platyophrya, Potomacus, Pseudocohnilembus, Euplotes, Engelmaniella і Stylonychia, зокрема Stylonychia lemnae, з векторами за способом трансформації, описаному в WO 98/01572, у такі клітини багатоклітинних рослин [див. Schmidt, R. und Willmitzer, L. (1988) "High efficiency Agrobacterium fumefaciens-mediated transformation of Arabidopsis thaliana leaf and cotyledon explants" Plant Cell Rep.:583-586; Plant Molecular Biology and Biotechnology, С Press, Boca Raton, Florida, Розділ 6/7, S.71-119 (1993); F.F. White, B. Jenes і ін., Techniques for Gene Transfer, y: Transgenic Plants, том 1, Engineering and Utilization, Видавн.: Kung und R. Wu, Academic Press (1993), 128-43; Potrykus, Annu. Rev. Plant Physiol. Plant Molec. Biol. 42 (1991), 205-225 (і в цитованих там літературних джерелах)], або клітини ссавців. Придатні клітинихазяїни наведені також у публікації Goeddel, Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, CA (1990). Рекомбінантний експресійний вектор може бути альтернативно, наприклад, при застосуванні Т7-промоторрегуляторної послідовності і Т7-полімерази, транскрибований і трансльований in vitro. Експресія білків у прокаріотах здійснюється в більшості випадків за допомогою векторів, які містять конститутивні або індуковані промотори, які управляють експресією гібридних або негібридних білків. Вектори злиття вбудовують ряд амінокислот у кодований білок, звичайно на амінокінці рекомбінантного білка, однак, також і на карбоксильному кінці або ж зливаються всередині придатних ділянок із білком. Вектори злиття звичайно мають три задачі: 1) посилення експресії рекомбінантного білка; 2) підвищення розчинності рекомбінантного білка і 3) підтримка очищення рекомбінантного білка впливом в якості ліганда при афінному очищенні, наприклад, за допомогою так званих HisTag. При експресійних векторах злиття протеолітичне місце розщеплення часто вбудовується в 43 місце з'єднання вузла злиття і рекомбінантного білка, так що відділення рекомбінантного білка від вузла злиття можливе після очищення гібридного білка. Ці ферменти і їх відповідні послідовності розпізнавання включають фактор Ха, тромбін і ентерокіназу. Типовими експресійними векторами злиття є серед інших pGEX [див. Pharmacia Biotech Inc; Smith, D.B., und Johnson, K.S. (1988) Gene 67:3140], pMAL [див. New England Biolabs, Beverly, MA] und pRIT5 [Pharmacia, Piscataway, NJ], при яких глутатіон-S-трансферазу (GST), малтозу, Езв'язуючий білок, відповідно, білок А піддають злиттю з цільовим білком. При одній з форм виконання винаходу кодуюча PSE послідовність клонована в експресійний вектор pGEX, так що одержують вектор, який кодує гібридний білок, який включає від N-кінця до С-кінця GST-тромбіновий сайт розщеплення-Х-білка. Гібридний білок може піддаватися очищенню за допомогою афінної хроматографії при застосуванні смоли глутатіоарагози. Рекомбінантна елонгаза PSE, яка не може зливатися з GST, може бути одержана розщепленням гібридного білка тромбіном. Прикладами придатних Е. coli-експресійних векторів, що індукуються та не зливаються, є серед іншого рТrс (див. публікацію Amann і ін. (1988) Gene 69:301-315) і рЕТ 11d (див. Studier і ін., Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, Kalifornien (1990) 6089). Експресія цільового гена з pTrc-вектора заснована на транскрипції за допомогою РНКполімерази-хазяїна гібридного trp-lac-промотору. Цільова експресія гена з рЕТ 11d-вектора заснована на транскрипції Т7-gn10-Іас-промотору злиття, що передається співекспресованою вірусною РНК-полімеразою (Т7 gn1). Ця вірусна полімераза готується штамами-хазяїнами BL21 (DE3) або HMS174 (DE3) -профага, який переводить Т7 gn1-ген під транскрипційний контроль lacUV 5промотора. Інші, придатні для прокаріотичних організмів вектори відомі спеціалісту в даній галузі. Цими векторами є, наприклад, вектори в Е. coli pLG338, pACYC184, pBR-серія, а саме pBR322, pUC-серія, а саме pUC18 або pUC19, М113mp-серія, рКС30, pRep4, pHS1, pHS2, pPLc236, pMBL24, pLG200, 113 pUR290, plN-Ill -B1, pgt11 або pBdCI, у Streptomyces plJ101, plJ364, plJ702 або plJ361, у Bacillus pUB110, pC194 або pBD214, у Corynebacterium pSA77 або pAJ667. Стратегією максимізації експресії рекомбінантного білка є експресія білка в бактерії-хазяїні, здатність якої до протеолітичного розщеплення рекомбінантного білка порушена [див. Gottesman, S., Gene Expression Technology: Methods in Enzymotogy 185, Academic Press, San Diego, Kalifornien (1990) 119-128]. Іншою стратегією є зміна послідовності нуклеїнової кислоти, що вбудовується у експресійний вектор, так що окремими кодонами для кожної амінокислоти є такі, що переважно застосовуються у вибраній для експресії бактерії, такий, як С. glutamicum [див. Wada і ін. (1992) Nucleic Acids Res. 20:2111-2118]. Зміна послідовності нуклеїнової кислоти згідно з винаходом 86340 44 здійснюється за допомогою стандартної техніки синтезу ДНК. При ще одній формі виконання винаходу вектор експресії елонгази PSE є експресійним вектором дріжджів, наприклад, вектор експресії в дріжджах S. cerevisiae включає pYepSeс1 [див. Baldari і ін. (1987) Embo J. 6:229-234], pMFa [див. Kurjan und Herskowitz (1982) Cell 30:933-943], pJRY88 [див. Schultz (Шульц) і ін. (1987) Gene 54:113-123], також pYES2 [див. Invitrogen Corporation, San Diego, CA]. Вектори і способи конструкції векторів, які придатні для застосування в інших грибах, таких, як філаментні гриби, включає вектори, що описуються в публікаціях: van den Hondel, C.A.M.J.J., & Punt, P.J. (1991) "Gene transfer systems and vector development for filamentous fungi, y: Applied Molecular Genetics of fungi, J.F. Peberdy і ін., Видавн., Стор.1-28, Cambridge University Press: Cambridge, або в: More Gene Manipulations in Fungi [J.W. Bennet & L.L. Lasure, Видавн., Стор.396-428: Academic Press: San Diego]. Іншими придатними векторами дріжджів є, наприклад, pAG-1, YEp6, YEp13 або pEMBLYe23. Альтернативно до цього елонгази PSE згідно з винаходом можуть бути експресовані при застосуванні векторів бакуловірусу. Вектори бакуловірусу, які є для експресії білків у вирощених клітинах комах (наприклад, у клітинах Sf9) включають рАссерію [див. Smith і ін. (1983) Моl. Cell Biol. 3:21562165] і pVL-серію [див. Lucklow und Summers (1989) Virology 170:31-39]. Вищенаведені вектори представляють тільки невеликий огляд можливих придатних векторів. Інші плазміди відомі фахівцю і наведені, наприклад, у публікації: Cloning Vectors (див. Видавн. Pouwels, P.H., та інш., Elsevier, Amsterdam-Нью Йорк-Oxford, 1985, ISBN 0 444 904018). При ще одній формі виконання винаходу нуклеїнова кислота згідно з винаходом експресується в клітинах ссавців при застосуванні експресійного вектора ссавців. Приклади таких векторів включають pCDM8 [див. Seed, В. (1987) Nature 329:840] і рМТ2РС [див. Kaufman і ін. (1987) ЕМВО J. 6:187195]. При застосуванні в клітинах ссавців контрольні функції експресійного вектора часто забезпечуються вірусними регуляторними елементами. Застосовувані звичайно промотори походять, наприклад, від поліоми, аденовірусу2, цитомегалівірусу і мавпячого вірусу (Simian Virus) 40. Інші придатні системи експресії для прокаріотичних і еукаріотичних клітин наведені в главах 16 і 17 публікації Sambrook, J., Fritsch, E.F., und Maniatis, Т., Molecular Cloning: A Laboratory Manual, 2. Auflage, Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989. При іншій формі виконання рекомбінантний вектор експресії у ссавців може управляти експресією нуклеїнової кислоти переважно у певному типі (наприклад, застосовуються тканиноспецифічні регуляторні елементи для експресії нуклеїнової кислоти). Тканиноспецифічні регуляторні елементи відомі фахівцю. Необмежувальними прикладами для придатних тканиноспецифічних регуляторних елементів є серед інших промотор альбуміну [специфічний печінці; див. Pinkert і ін. (1987) Genes 45 Dev. 1:268-277], лімфоспецифічні промотори [див. Calame und Eaton (1988) Adv. Immunol. 43:235275], зокрема, промотори Т-рецепторів клітин [див. Winoto und Baltimore (1989) EMBO J. 8:729-733] і імуноглобуліни [див. Banerji і ін. (1983) Cell 33:729740; Queen und Baltimore (1983) Cell 33:741-748], нейроноспецифічні промотори [наприклад, нейрофіламентпромотор; Byrne und Ruddle (1989) PNAS 86:5473-5477], специфічні для підшлункової залози промотори [Edlund та інш., (1985) Science 230:912916] і специфічні для молочної залози промотори [наприклад, промотор молочної сироватки; див. US 4,873,316 і ЕР-А-0 264 166). Також вони включають регулюючі розвиток промотори, наприклад, hox-промотори миші [див. Kessel und Gruss (1990) Science 249:374-379] і промотор фетобілка [див. Campes und Tilghman (1989) Genes Dev. 3:537546]. При ще одній формі виконання винаходу елонгази PSE згідно з винаходом можуть бути експресовані в одноклітинних рослинних клітинах (наприклад, водоростях), див. Falciatore і ін., 1999, Marine Biotechnology 1 (3):239-251 і наведені там літературні джерела, і в рослинних клітинах з високорозвинених рослин (наприклад, таких Spermatophyten, як продукти рільництва). Приклади експресійних векторів рослин включають такі вектори, як описані в публікаціях: Becker, D., Kemper, E., Schell, J., und Masterson, R. (1992) "New plant binary vectors with selectable markers located proximal to the left border", Plant Моl. Biol. 20:1195-1197; і Bevan, M.W. (1984) "Binary Agrobacterium vectors for plant transformation", Nucl. Acids Res. 12:8711-8721; Vectors for Gene Transfer in Higher Plants; in: Transgenic Plants, том 1, Engineering and Utilization, Видавн.: Kung і R. Wu, Academic Press, 1993, Стор.15-38. Іншими придатними рослинними векторами є, наприклад, наведені серед іншого в "Methods in Plant Molecular Biology and Biotechnology" (CRC Press), Розділ 6/7, Стор.71119. Переважними векторами є так звані біфункціональні вектори або бінарні вектори, що реплікуються в Е. соlі і в агробактеріях. Експресійна касета рослини містить переважно регуляторні послідовності, які можуть управляти експресією генів у клітинах рослин і функціонально зв'язані, так що кожна послідовність може виконувати свою функцію, наприклад функцію термінації транскрипції, наприклад, сигнали поліаденілування. Кращими сигналами поліаденілювання є такі, що походять від t-ДНК Agrobacterium tumefaciens, як відомий під назвою ген 3 октопінсинтази Ті-плазміди рТіАСН5 [див. Gielen і ін., ЕМВО J. 3 (1984) 835ff.] або його функціональні еквіваленти, однак також придатні і всі інші функціонально активні в рослинах термінатори. У зв'язку з тим, що експресія генів у рослинах дуже часто не обмежується рівнями транскрипції, рослинна експресійна касета містить переважно інші, функціонально зв'язані послідовності, такі, як енхансери трансляції, наприклад, надпослідовність, що містить 5'-нетрансльовану лідерну послідовність з вірусу тютюнової мозаїки, що підвищує співвідношення білка до РНК [див. Gallie і ін., 1987, Nucl. Acids Research 15:8693-8711]. 86340 46 Експресія гена в рослинах повинна бути функціонально зв'язана з придатним промотором, що проводить експресію у визначений період часу і специфічно тканині або клітинам. Переважно промоторами, які сприяють конститутивній експресії [див. Benfey і ін., ЕМВО J. 8 (1989) 2195-2202], такими ж як похідні від рослинних вірусів, є 35S CAMV [див. Franck і ін., Cell 21 (1980) 285-294], 19S CaMV (див. також US 5,352,605 і WO 84/02913) або рослинні промотори, описані в US 4,962,028, малої підгрупи рибулозо-1,5біфосфаткарбоксилази. Іншими кращими послідовностями для функціонального зв'язування в експресійних касетах є послідовності-мішені, які необхідні для подачі генного продукту у свою відповідну частину клітини [див. огляд у публікації Kermode, Crit. Rev. Plant Sci. 15, 4 (1996) 285-423 і в наведених там літературних джерелах], наприклад, у вакуоль, ядро клітини, усі види пластидів, такі, як амілопласти, хлоропласти, хромопласти, позаклітинний простір, мітохондрії, ендоплазматична ретикулум, пероксисоми й інші частини клітин рослин. Експресія генів рослин може бути полегшена за допомогою хімічно індукованого промотору [див. огляд у публікації Gatz 1997, Annu. Rev. Plant Physiol. Plant Моl. Biol., 48:89-108]. Хімічно індуковані промотори придатні особливо тоді, коли бажане здійснення експресії генів специфічне для певного періоду часу. Прикладами таких промоторів є індукований саліциловою кислотою промотор (WO 95/19443), індукований тетрацикліном промотор [див. Gatz і ін. (1992) Plant J. 2, 397-404] і індукований етанолом промотор. Придатними промоторами можуть бути також і промотори, які реагують на біотичні й абіотичні стресові умови, наприклад, індукований патогеном промотор PRP1-гена [див. Ward і ін., Plant. Моl. ВіоІ. 22 (1993) 361-366], індукований теплом hsp80-промотор з помідора (US 5,187,267), індукований холодом промотор альфаамілази з картоплі (див. WO 96/12814), або індукований пораненнями pinll-промотор (ЕР-А-0 375 091). Кращі зокрема такі протомотри, які викликають генну експресію в тканині й органах, в яких має місце біосинтез олії, у клітинах насіння, наприклад, клітинах ендоспермса розвинутого ембріона. Придатними промоторами є промотор напінового гена з рапсу (US 5,608,152), USP-промотор з Vicia faba [див. Baeumlein та інш., Моl Gen Genet, 1991, 225 (3):459-67], олеозиновий промотор з Arabidopsis (WO 98/45461), фазеолін-промотор з Phaseolus vulgaris (US 5,504,200), Все4-промотор з Brassica (WO 91/13980) або легінум-В4-промотор [див. LeB4; Baeumlein і ін., 1992, Plant Journal, 2 (2):2339], також промотори, які викликають специфічну для насіння експресію в таких однодольних рослинах, як кукурудза, ячмінь, пшениця, жито, рис і т.д. Придатними промоторами є промотор Ipt2-або lpt1-гена з ячменю (WO 95/15389 і WO 95/23230) або описані в WO 99/16890 промотори (з гена гордеїну ячменя, гена глутеліну рису, гена орицину рису, гена проламіну рису, гена гліадину пшениці, гена глутеліну пшениці, гена зеїну кукурудзи, гена 47 глутеліну вівса, гена казерину сорго, гена секаліну жита). Також особливо придатними є промотори, які викликають специфічну для пластид експресію, тому що пластиди є тією частиною, в якій синтезуються попередники, а також окремі кінцеві продукти біосинтезу ліпідів. Придатні промотори, такі, як вірусні промотори ДНК-полімерази, описані WO 95/16783 і WO 97/06250, clpP-промотори з Arabidopsis, описані в WO 99/46394. Винахід стосується також і рекомбінантного експресійного вектора, який включає молекулу ДНК згідно з винаходом, клоновану в антисмисловому напрямку в експресійний вектор, тобто молекула ДНК функціонально зв'язана з регуляторною послідовністю таким чином, що забезпечується можливість експресії (за допомогою транскрипції молекули ДНК) молекули РНК, яка є "антисмисловою" до PSE-мРНК. Можуть бути вибрані регуляторні послідовності, які функціонально зв'язані з клонованою в антисмисловому напрямку нуклеїновою кислотою і управляють безперервною експресією молекули антисмислової РНК у великій кількості типів клітин, наприклад, можуть бути вибрані вірусні промотори і/або енхансери або регуляторні послідовності, які управляють безперервною, специфічною тканині або клітині експресією антисмислової РНК. Антисмисловий вектор експресії може бути у формі рекомбінантної плазміди, фагеміду або атенуйованого вірусу, в якому антисмислова нуклеїнова кислота виробляється під контролем високоефективної регуляторної ділянки, активність якої може визначатися типом клітини, в яку введений вектор. Пояснення регуляції генної експресії за допомогою антисмислового гена див. В публікації Weintraub, Η., і ін., AntisenseRNA as a molecular tool for genetic analysis, Reviews - Trends in Genetics, том 1(1) 1986. Іншим об'єктом винаходу є клітини-хазяїни, в які введений рекомбінантний експресійний вектор. Терміни "клітина-хазяїн" і "рекомбінантна клітинахазяїн" можуть взаємно замінятися. Само собою зрозуміло, ці терміни стосуються не тільки визначених цільових клітин, але і потомків або потенційних потомків цієї клітини. У зв'язку з тим, що в поколіннях, які ідуть один за одним, внаслідок мутації або впливів навколишнього середовища можуть виникати різні модифікації, ці потомки не обов'язково ідентичні батьківській клітині, однак їх усе ще позначають цим терміном. Клітина-хазяїн може бути прокаріотичною або еукаріотичною клітиною. Наприклад, елонгаза PSE може бути експресована в клітинах бактерій, таких як С. glutamicum, в клітинах комах, клітинах грибів або ссавців (наприклад, в клітинах китайського хом'ячка (СНО) або COS-клітинах), водоростей, інфузорій, клітин рослин, грибів або інших мікроорганізмів, таких, як С. glutamicum. Інші придатні клітини-хазяїни відомі фахівцю в даній галузі. Вектор ДНК може вводитися в прокаріотичні або еукаріотичні клітини за допомогою звичайних методів трансформації або трансфекції. Терміни "трансформація" і "трансфекція", "кон'югація" і "трансдукція", застосовувані в описі, включають багато відомих з рівня техніки способів вбудування 86340 48 чужої нуклеїнової кислоти (наприклад, ДНК) у клітину-хазяїна, включаючи співпреципітацію фосфату кальцію або хлориду кальцію, викликану DEAEдекстраном трансфекцію, ліпофекцію, природну комплементацію, хімічно індукований перенос, електропорацію або бомбардування зарядженими частинками. Придатні способи трансформації або трансфекції клітин-хазяїнів можна знайти в публікації авторів Sambrook і ін. (Molecular Cloning: A Laboratory Manual., 2. Aufl., Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989) і інших довідниках, таких, як Methods in Molecular Biology, 1995, том 44, Agrobacterium protocols, Видавн.: Gartland und Davey, Humana Press, Totowa, New Jersey. Щодо стабільної трансфекції клітин ссавців відомо, що в залежності від застосованого вектора експресії і застосованого метода трансфекції тільки мала частина клітин інтегрує чужу ДНК у свій геном. Для ідентифікації і селекції інтегрованих клітин у клітину-хазяїна вбудовується звичайно один ген, який кодує маркер, що селектується (наприклад, стійкість до антибіотика, разом з цільовим геном). Переважні маркери, що селектуються, включають такі маркери, які забезпечують стійкість до таких медикаментів, як G418, гігроміцин і метотрексат, або в рослинах такі, які забезпечують стійкість до гербіцидів, таких, як гліфосфат або гліфозінат. Іншими придатними маркерами є маркери, що кодують гени, які беруть участь у біосинтезі наприклад, цукру або амінокислот, такіх, як галактозидаза, ura3 або ilv2. Маркери, які кодують такі гени, як люцифераза, gfp або інші гени флуоресценції, також придатні. Ці маркери можуть застосовуватися в мутантах, в яких ці гени не є функціональними, тому що вони делетовані за допомогою звичайних способів. Далі маркери, що кодують нуклеїнову кислоту, яка кодує маркер, що селектується, можуть вбудовуватися в клітинухазяїна на тому ж векторі, що і вектор, який кодує елонгазу PSE, або можуть вбудовуватися в особливий вектор. Клітини, що стабільно трансфіковані вбудованою нуклеїновою кислотою, можуть бути ідентифіковані, наприклад, за допомогою медикаментозної селекції (наприклад, виживають клітини, які інтегрували маркер, що селектується, а інші клітини гинуть). Для одержання гомологічно рекомбінантного мікроорганізму створюють вектор, який містить щонайменше одну ділянку гена PSE, по якому проведена селекція, приєднання або заміщення, щоб цим змінювати ген PSE, наприклад, піддавати функціональній дизрупції. Цей ген PSE є переважно геном з Physcomitrella, Phytophthora, Crypthecodinium або Thraustochytrium, може, однак, застосовуватися гомолог або аналог з інших організмів, навіть із грибів, комах або ссавців. При одній кращій формі виконання винаходу вектор виконаний таким чином, що ендогенний ген PSE при гомологічній рекомбінації піддається функціональній дизрупції (тобто не кодує функціональний білок; він називається також Knock-out-вектором). Альтернативно вектор може бути виконаний таким чином, що ендогенний ген PSE мутує при гомологічній рекомбінації або змінюється іншим чином, 49 однак усе ще кодує функціональний білок (наприклад, ділянка, що лежить у протилежній орієнтації, може бути змінена таким чином, що експресією змінюється ендогенна PSE). Для одержання точкової мутації гомологічної рекомбінації можуть застосовуватися гібриди ДНК-РНК, які відомі з джерел Cole-Strauss і ін., 1999, Nucleic Acids Research 27(5): стор.1323-1330 і Kmiec, Gene therapy, 19999, American Scientist, 87(3): стор.240247. У векторі для гомологічної рекомбінації змінена ділянка гена елонгази PSE на своєму 5'- і 3'кінці фланкована додатковою нуклеїновою кислотою гена PSE, так що можлива гомологічна рекомбінація між екзогенним геном PSE, на якому є вектор, і ендогенним геном PSE у мікроорганізмі або в рослині. Додаткова фланкуюча PSE-нуклеїнова кислота має достатню довжину для успішної гомологічної рекомбінації ендогенним геном. Звичайно у векторі міститься від кілька сотень до тисячі пар основ фланкуючої ДНК (як на 5'-, так і на 3'-кінці) [опис векторів для гомологічної рекомбінації див., наприклад, публікацію Thomas, K.R., і Capecchi, M.R. (1987) CeIl 51:503 або рекомбінації в Physcomitrella patens на базі кДНК у публікації Strepp і ін., 1998, Proc. Natl. Acad. Sci. USA 95 (8):4368-4373]. Вектор вводиться в мікроорганізм або клітину рослини, наприклад, за допомогою ДНК із використання поліетиленгліколю як медіатор, і клітини, в яких уведений ген елонгази PSE гомологічно рекомбінований з ендогенним геном PSE, селектуються відомими фахівцю в даній галузі методами. При іншій формі виконання винаходу можуть бути одержані рекомбінантні організми, такі, як мікроорганізми і рослини, які містять вибрані системи, що дозволяють проводити регульовану експресію вбудованого гена. Включення гена PSE у вектор, який введений під контролем оперона Іас, дозволяє, наприклад, експресію гена PSE тільки в присутності ізопропіл--тіогалактозиду. Ці системи регуляції відомі фахівцю. Клітина-хазяїн згідно з винаходом, така, як прокаріотична або еукаріотична клітина-хазяїн, що росте в культурі або в полі, може застосовуватися для одержання (тобто експресії) елонгази PSE. В рослинах може використовуватися додатково альтернативний спосіб прямого переносу ДНК у квітки, що розвиваються, за допомогою електропорації або переносу гена за допомогою агробактерій. Отже винахід стосується способу виробництва елонгаз PSE при застосуванні клітин-хазяїнів згідно з винаходом. При одній з форм виконання спосіб включає вирощування клітини-хазяїна згідно з винаходом (в яку вбудований рекомбінантний ген експресії, що кодує елонгазу PSE, або в геном якої введений ген, що кодує дикий тип елонгази PSE або змінену елонгазу PSE) у придатному середовищі доти, поки не буде одержана елонгаза PSE. Спосіб включає при іншій формі виконання винаходу виділення елонгаз PSE із середовища або клітини-хазяїна. Клітини-хазяїни, що в принципі придатні для прийому нуклеїнової кислоти згідно з винаходом, нового генного продукту згідно з винаходом або вектора згідно з винаходом, є прокаріо 86340 50 тичними або еукаріотичними організмами. Переважно застосовуваними організмами є такі організми, як бактерії, гриби, дріжджі, тваринні або рослинні клітини. Іншими кращими організмами є тварини або рослини або їх частини. Під поняттям "тварина" варто розуміти таке, що не включає людину. Переважно застосовуються гриби, дріжджі або рослини, особливо переважно гриби і рослини, зокрема, такі рослини, як рослини з олійними плодами, що містять велику кількість ліпідних сполук, такі, як рапс, рицина, енотера, канола, льон, соя, сафлор, земляний горіх, соняшник, огірочник, олійна пальма, кокосовий горіх, або такі рослини, як кукурудза, пшениця, жито, овес, рис, ячмінь, пшениця, бавовна, маніок, перець, тагетес, картопля, тютюн, баклажани, томати, горошок, люцерна, чагарникові рослини (кава, какао, чай), види Salix, дерева (олійна пальма, кокосовий горіх), а також злакові і кормові рослини. Особливо кращі рослини з олійними плодами, такі, як соя, земляний горіх, рапс, люцерна, рицина, льон, енотера, соняшник, сафлор, дерева (олійна пальма, кокосовий горіх). Згідно із кращою формою виконання винахід стосується також клітини рослини, яка включає полінуклеотид або вектор згідно з винаходом. Далі кращі трансгенні рослини або тканини рослин, що включають клітини згідно з винаходом. При іншій кращій формі виконання даний винахід стосується тих частин рослин, які придатні для збору врожаю і до такого матеріалу, який придатний до розмноження трансгенних рослин згідно з винаходом і які або містять клітини рослин згідно з винаходом, які експресують нуклеїнову кислоту згідно з винаходом, або містять клітини, які мають підвищений рівень білка згідно з винаходом. Придатними для збору врожаю є в принципі всі частини рослин, зокрема, квіти, пилок, плоди, сіянці, корені, листя, насіння, бульби, стебла і т.п.. Матеріал для розмноження охоплює, наприклад, насіння, фрукти, сіянці, бульби, кореневища і черенки. Г. Виділена, специфічна поліненасиченим кислотам жирного ряду елонгаза (PSE) Інший об'єкт винаходу стосується виділених елонгаз PSE і їх біологічно активних частин. "Виділений" або "очищений" білок або його біологічно активна частина в основному вільні від клітинного матеріалу, якщо вони виробляються ДНКрекомбінантною технікою, або хімічними попередніми стадіями або іншими хімікатами, якщо вони хімічно синтезовані. Поняття "в основному вільний від клітинного матеріалу" включає композиції елонгаз PSE, в яких білок відділений від клітинних компонентів клітин, в яких він природно або рекомбінантно виробляється. При одній формі виконання винаходу поняття "в основному вільний від клітинного матеріалу" охоплює композиції PSE з менше, ніж 30% (у перерахуванні на суху вагу) вмістом не елонгаз PSE (позначених тут як "забруднюючий білок"), особливо переважно менше, ніж 20% вмістом неелонгаз PSE, і ще більш переважно менше, ніж 10 вмістом неелонгаз PSE, і найкраще переважно менше, ніж 5%. Якщо PSE або її біологічно активна частина одержана рекомбінантно, то вона в основному 51 вільна від живильного середовища, тобто живильне середовище дорівнює менше, ніж 20%, переважно менше, ніж 10% і особливо переважно менше, ніж 5% об'єму композиції білка. Поняття "в основному вільний від хімічних сполук попередніх стадій або інших хімікатів" включає композиції PSE, в яких білок відділений від хімічних попередніх стадій або інших хімікатів, що беруть участь у синтезі білка. При ще одній формі виконання винаходу поняття "в основному вільний від хімічних сполук попередніх стадій або інших хімікатів" включає композиції PSE з менш, ніж 30% (у перерахуванні на суху вагу) хімічних сполук попередніх стадій або не-PSE-хімікатів, переважно, менше, ніж 20% хімічних сполук попередніх стадій або неPSE-хімікатів, особливо переважно менш, ніж приблизно 10% хімічних сполук попередніх стадій або не-PSE-хімікатів і найбільш переважно менше, ніж 5% сполук хімічних попередніх стадій або не-PSEхімікатів. При кращих формах виконання винаходу виділені білки або їх біологічно активні частини не мають забруднюючих білків з того ж організму, з якого походить елонгаза PSE. У випадку білка згідно з винаходом, що включає наведену в SEQ ID NO:10 послідовність, або кодується геном, що включає послідовність SEQ ID NO:9, варто враховувати те, що послідовність починається з двох Met. Це може привести до того, що при трансляції відповідної кодуючої послідовності нуклеїнової кислоти експресуються дві похідні білка згідно з винаходом, починаючи з першого або другого Met. Експресійне співвідношення двох похідних може, в залежності від виду експресії або організмухазяїна, коливатися між 0 і 1. У такий спосіб охоплюється елонгаза PSE, яка містить обидві наведені похідні або тільки одну похідну. Обидві похідні можуть мати різну активність, локалізацію, термін напівобміну, механізми регуляції і т.п. Ці білки одержують звичайно рекомбінантною експресією, наприклад, з Physcomitrella, Phytophthora, Crypthecodinium або Thraustochytrium-PSE у таких рослинах, як Physcomitrella patens відповідно, вищенаведені або мікроорганізмах, наприклад, бактеріях, таких, як Е. coli, Bacillus subtilis, C. glutamicum, грибах, таких, як Mortierella, дріжджах, таких, як Saccharomyces, або інфузоріях, таких, як Colpidium або водоростях, таких, як Phaeodactylum. Виділена елонгаза PSE або її частина може брати участь в обміні речовин, необхідних для побудови клітинної мембрани в Physcomitrella, Phytophthora, Crypthecodinium або Thraustochytrium сполук або у транспортуванні молекул через ці мембрани. При кращих формах виконання винаходу білок або його частина охоплює амінокислотну послідовність, яка є настільки достатньо гомологічною до амінокислотної послідовності з SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12, що білок або його частина зберігають здатність брати участь в обміні речовин, необхідних для побудови клітинної мембрани в Physcomitrella, Phytophthora, Crypthecodinium або Thraustochytrium сполук або у транспортуванні молекул через ці мембрани. Частина білка є біоло 86340 52 гічно активною частиною, як тут описується. При ще одній кращій формі виконання винаходу елонгаза PSE згідно з винаходом має одну з наведених у SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 амінокислотних послідовностей. При ще одному кращому варіанті виконання PSE має амінокислотну послідовність, яка кодується нуклеотидною послідовністю, що гібридизується з неклеотидною послідовністю з SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11. При ще одній формі виконання PSE має амінокислотну послідовність, яка кодується нуклеотидною послідовністю, яка є гомологічною щонайменше приблизно від 50 до 60%, переважно, щонайменше приблизно від 60 до 70%, особливо переважно щонайменше приблизно від 70 до 80%, від 80 до 90%, від 90 до 95% і ще більш переважно щонайменше приблизно 96%, 97%, 98%, 99% або ще більш гомологічна одній з представлених SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 амінокислотних послідовностей. Краща PSE згідно з винаходом має також щонайменше одну з описуваних тут активностей. Наприклад, краща елонгаза PSE згідно з винаходом включає амінокислотну послідовність, яка кодується нуклеотидною послідовністю, наприклад, при жорстких умовах гібридизується з нуклеотидною послідовністю з SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5, SEQ ID NO:7, SEQ ID NO:9 і SEQ ID NO:11 і може брати участь в обміні речовин, необхідних для побудови клітинної мебрани в Physcomitrella, Phytophthora, Crypthecodinium або Thraustochytrium сполук або у транспортуванні молекул через ці мембрани або може продовжувати одну або кілька поліненасичених кислот жирного ряду з щонайменше двома подвійними зв'язками і довжиною ланцюга в 16 або 18 атомів вуглецю. При іншій формі виконання PSE є гомологічною до наведеної в SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 амінокислотної послідовності і зберігає функціональну активність білка однієї з наведених у SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 послідовностей, однак її амінокислотна послідовність відрізняється внаслідок природних варіацій або мутагенезу, як докладно описано вище. При ще одній кращій формі виконання винаходу PSE є білком, що включає амінокислотну послідовність, яка щонайменше на приблизно від 50 до 60%, переважно щонайменше приблизно від 60 до 70% і особливо переважно, щонайменше приблизно від 70 до 80%, від 80 до 90%, від 90 до 95% і найбільш переважно щонайменше приблизно 96%, 97%, 98%, 99% або більш гомологічна до однієї повної послідовності з SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 і має щонайменше одну, описану тут активність. При іншій формі виконання винахід стосується повного білка з Physcomitrella, Phytophthora, Crypthecodinium або Thraustochytrium, який в основному є гомологічним до повної, представленої в SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID 53 86340 NO:8, SEQ ID NO:10 і SEQ ID NO:12 амінокислотної послідовності. Біологічно активні частини елонгази PSE включають пептиди, які включають амінокислотні послідовності, що походять від амінокислотної послідовності елонгази PSE, наприклад, наведену в SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10 і SEQ ID NO:12 амінокислотну послідовність або амінокислотну послідовність білка, який є гомологічним до елонгази PSE, яка має менше амінокислот, ніж елонгаза PSE повної довжини або білок повної довжини, який є гомологічним до елонгази PSE і має щонайменше одну активність PSE. Звичайно біологічно активні частини (пептиди, наприклад, пептиди, що мають довжину в 5, 10, 15, 20, ЗО, 35, 36, 37, 38, 39, 40, 50, 100 або більше амінокислот), включають домен або мотив із щонайменше однією активністю елонгази PSE. Крім того, інші біологічно активні частини, в яких делетовані інші ділянки білка, можуть бути одержані рекомбінантною технікою і можуть перевірятися на одну або декілька описуваних активностей. Біологічно активні частини елонгази PSE включають переважно один або декілька вибраних доменів/мотивів або їх частини з біологічною активністю. Такі домени або мотиви можуть бути ідентифіковані частково за допомогою послідовного аналізу, наприклад, за допомогою підтримуваних технікою обробки даних методів. У послідовностях згідно з винаходом є так звані КК-мотиви. Автор Kermode у публікації 1996, Critical Reviews in Plant Sciences 15 (4):285-423 описує ККмотиви, подвійний лізин, який був знайдений в основному як ККХХ або Κ Φ Κ XXX -мотив і впливає на метаболічний цикл ER в апараті Гольджі і разом з цим термін перебування білка і його ферментативної активності у певному місці, зокрема, на ендоплазматичному ретикулюмі. Мотиви подвійного лізина були знайдені, наприклад, у 12-десатуразах (див. Arondel і ін. 1992, Science 258:1353) є в елонгазах згідно з винаходом, зокрема такі мотиви описані як локалізовані на карбоксильному кінці. Елонгаза з моху PSE1:СKQKGAKTE кінець KTKKA SEQ ID NO 2: KKSTPAAKK SEQ ID NO 4 TN KHLK SEQ ID NO 6: При цьому може йти мова про можливу варіацію гена. Є залишки Lys, які впливають на утворення мішені, і локалізацію на поверхні або в середині ендоплазматичного ретикулуму. Маскування цієї послідовності модифікування, або просторова модифікація близькості до карбоксильного кінця, наприклад, за допомогою злиття з зеленим флуоресцентним білком можуть використовуватися для здійснення впливу на розподіл. 54 Елонгази PSE одержують переважно технікою рекомбінантної ДНК. Наприклад, кодуюча білок·молекула нуклеїнової кислоти клонується у вектор експресії (як описано вище), вектор експресії вводиться у клітині-хазяїні (як описано вище) і елонгаза PSE експресується у клітину-хазяїна. Елонгаза PSE може бути виділена з клітини за допомогою придатного методу очищення, наприклад, за допомогою стандартного методу очищення білків. Альтернативно до рекомбінантної експресії елонгаза PSE, поліпептид або пептид можуть бути хімічно синтезовані за допомогою стандартної техніки синтезу пептидів. Крім того, нативна елонгаза PSE може виділятися з клітин (наприклад, із клітин ендотелію) наприклад, при застосуванні анти-РSЕ-антитіла, яке може бути одержане стандартною технікою, причому застосовується PSE згідно з винаходом або її фрагмент. Винахід пропонує також химерні PSE-білки або гібридні PSE-білки. Застосовуване тут поняття "химерний PSE-білок" або "гібридний PSE-білок" включає PSE-поліпептид, який функціонально зв'язаний з не-PSE-поліпептидом. Поняття "PSEполіпептид" стосується поліпептиду з амінокислотною послідовністю, яка відповідає елонгазі PSE, у той час як "не-PSE-поліпептид" стосується поліпептиду з амінокислотною послідовністю, яка відповідає білку, що в основному не є гомологічним до елонгази PSE, наприклад, білку, який відрізняється від PSE і походить з того ж організму або з іншого організму. Щодо гібридного білка поняття "функціонально зв'язаний" означає те, що PSEполіпептид, не-PSE-поліпептид, злиті один з одним таким чином, що обидві послідовності виконують передбачену, додану застосовуваній послідовності функцію. He-PSE-поліпептид може зливатися на N-кінці або на С-кінці PSE-поліпептиду. При одній формі виконання винаходу гібридний білок (білок злиття) є GST-PSE-білком злиття, при якому PSEпослідовності об'єднані на С-кінці GSTпослідовностей. Ці білки злиття можуть полегшувати очищення рекомбінантних елонгаз PSE. При ще одній формі виконання білок злиття є елонгазою PSE, що має гетерологічну сигнальну послідовність на її N-кінці. У певних клітинах-хазях (наприклад, клітинах-хазях ссавців) експресія і/або секреція елонгази може бути підвищена застосуванням гетерологічної сигнальної послідовності. Химерний PSE-білок або PSE-гібридний білок (білок злиття) одержують стандартною технікою рекомбінантної ДНК. Наприклад, ДНК-фрагменти, які кодують різні поліпептидні послідовності, можуть лігуватися один до одного за допомогою звичайної техніки в рамці зчитування, причому наприклад, гладкі або виступаючі кінці можуть застосовуватися для лігування, рестрикційного розщеплення ферментів для одержання власних кінців, заповнення кінців, обробки лужними фосфатами, щоб запобігати небажані сполуки, і ферментативного лігування. При ще одній формі виконання ген злиття може бути синтезований звичайними методами, включаючи автоматичний синтез ДНК. Альтернативно може проводитися ПЛР-ампліфікування генних фрагментів із застосуванням анкерної затравки, створення комплемен 55 тарних переходів між генними фрагментами, що ідуть один за одним, які потім можуть гібридизуватися один з одним і реампліфікуватися, так що одержують химерну послідовність (див. наприклад, Current Protocols in Molecular Biology, Видавн. Ausubel і ін., John Wiley & Sons: 1992). Крім того, на ринку можна придбати багато з експресованих векторів, які вже кодують одиницю злиття (наприклад, GST-поліпептид). Кодуюча елонгазу PSE-нуклеїнова кислота може клонуватися в такий експресійний вектор, так що одиниця злиття в рамці зчитування зв'язана з PSE-білком. Гомології до елонгази PSE можуть бути одержані мутагенезом, наприклад, специфічним точковим мутагенезом або вкороченими PSE. Поняття "гомологія" стосується при цьому варіантної форми елонгази PSE, яка діє як агоніст або антагоніст до активності PSE. Агоніст елонгази PSE може в основному зберігати ту ж активність, що і активність або частина біологічної активності PSE. Антагоніст PSE може інгібувати одну або декілька активностей наявної в природі форми PSE за допомогою, наприклад, конкурентного зв'язку з розміщеним по ходу транскрипції або проти ходу транскрипції елементом каскаду обміну речовин для компонента клітинної мембрани, який включає елонгазу PSE, або за допомогою зв'язку з PSE, що сприяє транспортуванню сполук через клітинні мембрани, внаслідок чого інгібується транслокація. При альтернативній формі виконання винаходу гомології елонгази PSE можуть бути ідентифіковані за допомогою скринінга комбінаторних банків мутантів, наприклад, вкорочених мутантів PSE у відношенні активності агоністів або антагоністів PSE. При ще одній формі виконання мозаїчний банк PSE-варіантів може бути одержаний комбінаторним мутагенезом на рівні нуклеїнової кислоти і кодований мозаїчним банком генів. Мозаїчний банк PSE-варіантів може бути одержаний, наприклад, за допомогою ферментативного лігування суміші синтетичних олігонуклеотидів у генних послідовностях, так що можна експресувати дегенерований набір потенційних PSE-послідовностей як індивідуальні поліпептиди або альтернативно як набір більш великих білків злиття (наприклад, для виявлення фагів), які містять цей набір PSEпослідовностей. Є цілий ряд способів, які можуть застосовуватися для одержання банків потенційних PSE-гомологів з виродженої олігонуклеотидної послідовності. Хімічний синтез дегенерованої генної послідовності може проводитися в автоматичному пристрої для синтезу ДНК і синтезований ген може бути потім легований у придатний експресійний вектор. Застосування виродженого набору генів забезпечує наявність у суміші всіх послідовностей, що кодують бажаний набір потенційних PSE-послідовностей. Способи синтезу вироджених олігонуклеотидів відомі фахівцю в даній галузі [див., наприклад, Narang, S.A. (1983) Tetrahedron 39:3; Itakura і ін. (1984) Annu. Rev. Biochem. 53:323; Itakura і ін., (1984) Science 198:1056; Ike та інш. (1983) Nucleic Acids Res. 11:477]. Додатково банки PSE-фрагментів можуть використовуватися для одержання мозаїчної попу 86340 56 ляції PSE-фрагментів для скринінга і для подальшої селекції гомологів елонгази PSE. При одній формі виконання винаходу банк фрагментів кодуючої послідовності може бути одержаний за допомогою обробки дволанцюгового PCR-фрагмента кодуючої PSE-послідовності нуклеазою за умов, при яких відбуваються розриви подвійних ланцюгів тільки один раз на молекулу, за допомогою денатурації дволанцюгової ДНК, ренатурування ДНК при утворенні дволанцюгової ДНК, яка може охоплювати смислову/антисмислову пару різних продуктів з розривом подвійного ланцюга, видалення одноланцюгових ділянок із заново утвореного дуплекса обробкою S1-нуклеазою і лігування одержаного в результаті банку фрагментів у експресійний вектор. Цим способом може бути одержаний експресійний банк, який кодує N-кінцеві, С-кінцеві і внутрішні фрагменти елонгази PSE різної величини. Фахівцям відомо кілька методів скринінга генних продуктів у комбінаторних банках, які одержані точковою мутацією або вкороченням, і відомі для скринінга кДНК-банків для одержання генних продуктів з вибраними властивостями. Ці методи можна підганяти під швидкісний скринінг банків генів, які одержані комбінаторним мутагенезом PSEгомологів. Найбільш часто застосовувані методи скринінга великих банків генів, які можна піддавати аналізу з високою пропускною здатністю, включають звичайно клонування банку генів у експресійні вектори, що реплікуються, трансформацію придатних клітин з одержаним в результаті банком векторів і експресію комбінаторних генів за умов, при яких полегшується виявлення бажаної активності виділення вектора, що кодує ген, продукт якого був виявлений. Повторюваний мутагенез (REM), новий метод, який підвищує частоту функціональних мутантів у банках, може в комбінації з тестом скринінга застосовуватися для ідентифікації PSEгомологів [див. публікації Arkin und Yourvan (1992) Proc. Natl. Acad. Sci. USA 89:7811-7815; Delgrave і ін. (1993) Protein Engineering 6(3):327-331]. Можуть також застосовуватися комбінації вищенаведених методів. Іншим відомим методом зміни каталітичних властивостей ферментів, відповідно, кодуючих їх генів є так називаний "Gen-Shuffling" (див., наприклад. WO 97/20078 або WO 98/13487), який представляє комбінацію генних фрагментів, причому ця нова комбінація додатково може варіюватися помилковими полімеразними ланцюговими реакціями, і разом з цим створює високу підлягаючу тесту різноманітність послідовностей. Передумовою для застосування такого методу є придатна система скринінга, щоб перевіряти створену різноманітність генів на її функціональність. Зокрема, для скринінга активності елонгаз передумовою є спосіб скринінга, який визначає ферментативну активність у залежності від поліненасичених кислот жирного ряду. Відносно активностей елонгази зі специфічністю до поліненасичених кислот жирного ряду у видах Mucor, які можуть бути відомими способами трансформації бажаними генними конструктами, можна використовувати токсичність арахідонової кислоти в при 57 сутності метаболіту (саліцилової кислоти або похідних саліцилової кислоти) (див. Eroshin і ін., Mikrobiologiya, том 65, No.1, 1996, Стор.31-36), щоб проводити перший скринінг, що базується на рості. Одержані в результаті клони можуть тоді піддаватися аналізу на вміст ліпідів за допомогою газової хроматографії, щоб визначати вихідні речовини і продукти за їх видом і кількістю. При ще одній формі виконання винаходу тести на базі клітин можуть використовуватися для аналізу химерного PSE-банку при застосуванні інших відомих фахівцю в даній галузі способів. При ще одній формі виконання даний винахід стосується антитіла, яке специфічно зв'язується з поліпептидом згідно з даним винаходом або з частинами, наприклад, епітопами, такого білка. Антитіло згідно з винаходом може застосовуватися для того, щоб ідентифікувати і виділяти інші елонгази, зокрема, елонгази PSE. Ці антитіла можуть бути моноклональними антитілами, поліклональними антитілами або синтетичними антитілами, а також фрагментами цих антитіл, такими, як наприклад, Fab-, Fv- або scFV-фрагменти. Моноклональні антитіла можуть бути одержані, наприклад, способом, описаним спочатку авторами Kohler und Milstein, у публікації Nature 256 (1975), 485, і Galfro, Meth. Enzymol. 73 (1981). Антитіла і їх фрагменти можуть також бути одержані, наприклад, способом, описаним у Harlow & Lane, "Antibodies, a Laboratory Manual", CSH, Press, Cold Spring Harbor, 1988. Ці антитіла можуть застосовуватися для того, щоб преципітувати і локалізувати білки згідно з винаходом або щоб перевіряти синтез цих білків, наприклад, у рекомбінантному організмі, а також для ідентифікації сполук, які взаємодіють із білками згідно з винаходом. У багатьох випадках зв'язок антитіл з антигенами еквівалентний із зв'язком інших лігандів і антилігандів. Далі винахід стосується способу ідентифікації агоністів або антагоністів елонгаз, зокрема елонгаз PSE, який включає а) приведення клітин, які експресують поліпептид згідно з даним винаходом, у контакт із речовиною-кандидатом, б) тестування активності PSE; с) порівняння активності PSE зі стандартною активністю в присутності речовини-кандидата, причому підвищення активності PSE вище стандарту показує, що речовина-кандидат є агоністом, і зниження активності PSE показує, що речовинакандидат є антагоністом. Речовина-кандидат може бути синтезованою або одержаною мікробіологічно речовиною і є присутньою, наприклад, у клітинних екстрактах, наприклад, рослин, тварин або мікроорганізмів. Далі ця речовина може бути відомою з рівня техніки, однак дотепер вона не відома як така, що підвищує або знижує активність елонгаз PSE. Реакційна суміш може бути вільним від клітин екстрактом або ж може включати клітину або клітинну культуру. Придатні методи відомі фахівцю й описуються, rd наприклад, у Alberts, Molecular Biology the cell, 3 Edition (1994), як приклад Розділ 17. Приведені речовини можуть, наприклад, додаватися до реакційної суміші або живильного середовища або ж 86340 58 ін'єктуватися в клітини або набризкуватись на рослину. Якщо ідентифікований зразок, яка містить активну згідно з винаходом речовину, то є можливість або виділити речовину безпосередньо від первісного зразка або можна розділити зразок на різні групи, наприклад, якщо вона складається з великої кількості різних компонентів, щоб знизити число різних речовин на зразок і потім повторювати спосіб згідно з винаходом з таким "субзразком" первісного зразка. В залежності від складності проби вищеописані стадії можуть повторюватися кілька разів, переважно доти, поки ідентифікований згідно з винаходом зразок не включає тільки мале число речовин або тільки одну речовину. Переважно ідентифікована способом згідно з винаходом речовина або її похідні приводяться в препаративну форму, так що вони придатні для застосування в сфері розведення рослин, або клітинних, або тканевих культур. Речовинами, що проатестовані й ідентифіковані способом згідно з винаходом, можуть бути такі: експресійні бібліотеки, наприклад, кДНКбібліотеки, пептиди, білки, нуклеїнові кислоти, антитіла, малі органічні речовини, гормони, PNA або їм подібні (див. Milner, Nature Medicin 1 (1995), 879880; Hupp, Cell. 83 (1995), 237-245; Gibbs, Cell. 79 (1994), 193-198 і наведені там джерела). Ці речовини можуть також бути функціональними похідними або аналогами відомих інгібіторів або активаторів. Способи одержання хімічних похідних або аналогів відомі фахівцю в даній галузі. Наведені похідні й аналоги можуть бути перевірені згідно з відомими з рівня техніки способами. Клітина або тканина, яка може застосовуватися для способу згідно з винаходом, є переважно клітиноюхазяїном, рослинною клітиною або рослинною тканиною, згідно з винаходом, як описано вище. У відповідності з цим винахід стосується речовини, яка ідентифікована способом згідно з винаходом. Речовина є, наприклад, гомологом елонгази PSE згідно з винаходом. Гомологи елонгаз PSE можуть бути одержані мутагенезом, наприклад, точковою мутацією або делецією елонгази PSE. Застосовуване тут поняття "гомолог" є формою елонгаз PSE, яка діє як агоніст або антагоніст для активності елонгаз PSE. Агоніст може мати в основному однакову або частину біологічної активності елонгаз PSE. Антагоніст елонгаз PSE може інгібувати одну або декілька активностей природної форми елонгаз PSE, наприклад, зв'язуватися з членом обміну речовини, що знаходиться по ходу транскрипції або проти ходу транскрипції, при синтезі кислот жирного ряду, який включає елонгази PSE, або зв'язується з PSE і при цьому знижувати або інгібувати активність. Отже, винахід стосується також і антитіла або його фрагменту, який інгібує активність елонгаз PSE згідно з винаходом. Далі винахід стосується антитіла, яке специфічно розпізнає, відповідно, зв'язує вищеописані агоністи або антагоністи згідно з винаходом. Винахід стосується також і композиції, яка включає антитіло, ідентифікований способом згідно з винаходом стоп- або антисмислову молекулу. 59 Д. Застосування і способи згідно з винаходом Приведені в описі молекули нуклеїнової кислоти, білки, гомологи білків, гібридні білки, антитіла, затравки, вектори і клітини-хазяїни можуть застосовуватися для одного або декількох наведених нижче способів, а саме ідентифікації організмів Physcomitrella patens, Crypthecodinium, Phytophthora infestans або Thraustochytrium і споріднених організмів, картування геномів організмів, які є спорідненими організмам Physcomitrella, Phytophthora, Crypthecodinium або Thraustochytrium, ідентифікації і локалізації послідовностей Physcomitrella, Phytophthora, Crypthecodinium або Thraustochytrium, вивчення еволюції, визначення білків PSE, необхідних для функції, модуляції активності елонгази PSE, модуляції обміну речовин одного або декількох компонентів клітинної мембрани, модуляції транспортування через мебрану одного або декількох сполук, а також модуляції виробництва клітинами бажаної сполуки, такої, як тонкий хімікат. Молекули нуклеїнової кислоти елонгази PSE мають велику кількість можливостей застосування. Вони можуть застосовуватися для ідентифікації такого організму, як Physcomitrella, Phytophthora, Crypthecodinium або Thraustochytrium або найближчих споріднених організмів. Вони можуть також застосовуватися для ідентифікації наявності організмів Physcomitrella, Crypthecodinium, Phytophthora або Thraustochytrium або їх родичів у змішаній популяції мікроорганізмів. Даний винахід пропонує послідовності нуклеїнових кислот ряду генів Physcomitrella, Phytophthora, Crypthecodinium або Thraustochytrium, за допомогою зондування екстрагованих геномних ДНК культури суцільної або змішаної популяції мікроорганізмів зондом, який перекриває зони гена з Physcomitrella, Crypthecodinium, Phytophthora або Thraustochytrium або його частини, що властиво тільки одному організму, можна визначити, чи є цей організм у наявності. Організми Physcomitrella, Crypthecodinium, Phytophthora або Thraustochytrium самі застосовуються для комерційного виробництва поліненасичених кислот. Нуклеїнові кислоти згідно з винаходом придатні, крім того, для виробництв поліненасичених кислот жирного ряду також і в інших організмах, зокрема, якщо необхідно досягати того, що кислоти жирного ряду, одержані в результаті, повинні також вбудовуватися у фракції триацилгліцеролу. Далі молекули нуклеїнової кислоти і білка можуть застосовуватися як маркери для специфічних областей генома. Вони придатні не тільки для картування генома, але і для функціонального вивчення білків з організмів Physcomitrella, Phytophthora, Crypthecodinium або Thraustochytrium. Для ідентифікації ділянки генома, з яким зв'язується певна ДНК сполучного білка з Physcomitrella, Crypthecodinium, Phytophthora або Thraustochytrium, геном організмів Physcomitrella, Crypthecodinium, Phytophthora або Thraustochytrium може, наприклад, розщеплюватися і фрагменти ДНК сполучного білка можуть інкубуватися з ним. Ті фрагменти, що зв'язують білок, можуть додатково зондуватися молекулами 86340 60 нуклеїнової кислоти згідно з винаходом, переважно, що легко визначається; зв'язування однієї такої молекули з геномним фрагментом дозволяє локалізацію на геномній карті організмів Physcomitrella, Phytophthora, Crypthecodinium або Thraustochytrium і полегшує, якщо це проводиться кілька разів з різними ферментами, швидке визначення послідовності нуклеїнових кислот, з якими зв'язується білок. Молекули нуклеїнової кислоти згідно з винаходом можуть до того ж бути досить гомологічними до послідовностей споріднених видів, щоб ці молекули нуклеїнової кислоти могли служити як маркери для конструкції геномної карти споріднених грибів або водоростей. Молекули нуклеїнової кислоти елонгази PSE придатні також для досліджень еволюції і структури білків. Процеси обміну речовин і транспортування через мембрани, в яких беруть участь молекули згідно з винаходом, використовуються багатьма прокаріотичними і еукаріотичними клітинами, порівнянням послідовностей молекул нуклеїнової кислоти згідно з винаходом з такими послідовностями, які кодують такі ж ферменти з інших організмів, може бути визначена ступінь еволюції і спорідненості організмів. Відповідним чином таке порівняння дозволяє визначення того, які ділянки послідовностей є консервативними і які ні, що може допомогти при визначенні ділянок білка, які необхідні для ферментативної функції. Цей тип визначення є дуже цінним для досліджень інженерії білків і може вказувати на те, в якій мірі мутагенез надає толерантності білку без втрати функціональності. Маніпуляція молекул нуклеїнової кислоти елонгази PSE згідно з винаходом може привести до одержання елонгаз PSE з функціональними розходженнями по відношенню до дикого типу елонгаз PSE. Ефективність і активність цих білків можуть бути поліпшені, вони можуть бути в клітині в більшій кількості, ніж звичайно, або їх ефективність або активність може бути знижена. Поліпшена ефективність або активність означає, наприклад, те, що фермент має більш високу селективність і/або активність, переважно щонайменше на 10% більш високу активність, зокрема, щонайменше на 20% більш високу активність, особливо переважно щонайменше на 30% більш високу активність, ніж первинний фермент. Є ряд механізмів, за допомогою яких можна безпосередньо впливати на зміну виходу елонгази PSE згідно з винаходом, на виробництво і/або ефективність виробництва тонкого хімікату, який містить такий змінений білок. Виробництво сполук тонких хімікатів з таких культур, як інфузорії, водорості або гриби, у великих масштабах чітко збільшується, якщо клітина виділяє бажані сполуки, тому що ці сполуки можуть бути легко виділені з живильного середовища (на противагу до екстракції з маси культивованих клітин). В іншому випадку очищення можна поліпшити за рахунок того, що клітина накопичує in vivo сполуки в спеціалізованому розділі з механізмом концентрації. Для рослин, що експресують елонгази PSE, підвищене транспортування може привести до кращого розподілу всередині рослинної тканини й органів рос
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel elongase gene and the rpocess for preparation of multiple-unsaturated fatty acids
Автори англійськоюHEINZ ERNST, ZANK THORSTEN, Tseringer Ulrikh, Lerkhl Yents, Rents Andreas
Назва патенту російськоюНовый ген элонгазы и способ получения полиненасыщенных кислот жирного ряда
Автори російськоюХайнц Эрнст, Цанк Торстен, Церингер Ульрих, Лерхль Иенс, Ренц Андрэас
МПК / Мітки
МПК: C12N 15/54, C12N 15/09, C12P 7/64, C11C 3/00, C12N 15/82
Мітки: поліненасичених, жирного, отримання, елонгази, кислот, новий, спосіб, ген, ряду
Код посилання
<a href="https://ua.patents.su/63-86340-novijj-gen-elongazi-ta-sposib-otrimannya-polinenasichenikh-kislot-zhirnogo-ryadu.html" target="_blank" rel="follow" title="База патентів України">Новий ген елонгази та спосіб отримання поліненасичених кислот жирного ряду</a>
Попередній патент: Спосіб видалення вірусів із біологічної рідини з використанням мікрочасток
Випадковий патент: Пристрій для нижнього пресування