Спосіб отримання пероксиестерів аліфатичних карбонових кислот
Номер патенту: 53389
Опубліковано: 15.01.2003
Автори: Юр'єв Руслан Сергійович, Воронов Станіслав Андрійович, Дончак Володимир Андрійович
Формула / Реферат
Спосіб отримання пероксиестерів аліфатичних карбонових кислот, що включає ацилювання гідропероксиду карбоновою кислотою в присутності промотора, який відрізняється тим, що ацилювання здійснюють також в присутності органічної основи, наприклад триетиламіну або піридину, а як промотор використовують трифлуороцтовий ангідрид.
Текст
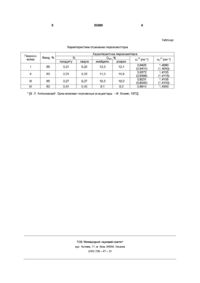
Спосіб отримання пероксиестерів аліфатичних карбонових кислот, що включає ацилювання пдропероксиду карбоновою кислотою в присутності промотора, який відрізняється тим, що ацилювання здійснюють також в присутності органічної основи, наприклад триетиламіну або піридину, а як промотор використовують трифлуороцтовий ангідрид Винахід відноситься до органічної хімії ациклічних і карбоциклічних сполук, зокрема пероксиестерів, які можуть бути використані як високоефективні ініціатори радикальної полімеризації і структуруючи агенти в технології пластичних мас Відомий спосіб отримання пероксиестерів аліфатичних карбонових кислот (ПАКК) ацилюванням пдропероксидів ангідридами карбонових кислот [Pmcock R Е // J Am Chem Soc, 1964, v 29, P 3099 - 3100] в присутності каталізаторів (ацетатів натрію, кобальту) або без них [Химия перекисных соединений Изд АН СССР , 1963, с 295] Відомий спосіб отримання ПАКК ацилюванням пдропероксидів хлороанпдридами карбонових кислот в присутності органічних основ (трет-амшів, піридину) при температурах -2 - +5°С в органічному розчиннику (пентан, діетиловий етер) [Bartlett Р D J Am Chem Soc, 1957, v 80, P 1398 1405] Але при цьому необхідно попередньо синтезувати ВІДПОВІДНІ ацилюючі агенти - ангідриди або хлороанпдриди їх проходить в достатньо жорстких умовах, тому не завжди є можливим, наприклад, у випадку термолабільних карбонових кислот Відомий спосіб отримання ПАКК взаємодією пдропероксидів із карбо-кислотами в присутності мінеральної кислоти як каталізатора реакції апелювання [Ляшенко О К , Нестерова И П , Антоновский В Л // Хим пром , 1974, № 9, С 659 660] Однак застосування відносно високих концентрацій мінеральних кислот і високої температури значно підвищує ступінь розкладу пероксивмівсних сполук, і як наслідок зменшує вихід пероксиестерів Найбільш близьким по своїй суті до запропо нованого є спосіб отримання ПАКК ацилюванням пдропероксиду карбоновою кислотою в присутності промотора [Hecht R e a Ber, 1963, В 96, S 1281 - 1284, Staab Н А є а Вег, 1965, В 98, S 1122-1127] В якості останнього використовують карбонілдммідазол, який спочатку взаємодіє з карбоновою кислотою з утворенням імідазоліду, який далі взаємодіє з пдропероксидом з утворенням пероксиестеру Однак внаслідок протікання побічних процесів кінцеві пероксиестери важко піддаються очищенню, тому їх вихід становить лише 60 - 80% До того ж ціна карбонілдимідазолу суттєво обмежує його використання В основу винаходу поставлено завдання створення способу отримання ПАКК, в якому використання нового більш доступного промотора забезпечило би пріоритетність протікання реакції ацилювання пдропероксиду кислотою, що збільшує вихід цільового естеру і спрощує процес його виділення та очищення Поставлене завдання вирішується тим, що в способі отримання пероксиестерів аліфатичних карбонових кислот ацилюванням пдропероксиду карбоновою кислотою в присутності промотора, згідно винаходу, ацилювання здійснюють також в присутності органічної основи, наприклад триетиламіну або піридину, а як промотор використовують трифлуороцтовий ангідрид (ТФА) Це забезпечує пріоритетність протікання реакції ацилювання пдропероксиду і як наслідок зростання виходу пероксиестеру При цьому ТФА в умовах реакції взаємодіє із карбоновою кислотою з утворенням змішаного ангідриду, являється ефективним ацилюючим агентом, і який в подаль 00 со го ю 53389 шому взаємодіє з пдропероксидом з утворенням ВІДПОВІДНОГО пероксиестеру Органічна основа виконує роль акцептора ІОНІВ ВОДНЮ І унеможливлює тим протікання побічних процесів розкладу пероксивмісних сполук, які можуть викликатись високою кислотністю середовища Побічні продукти реакції, а також залишки реагентів легко ВІДДІЛЯЮТЬСЯ ВІД ЦІЛЬОВОГО пероксиестеру промиванням органічної фази водним розчином гідрокарбонату натрію Для здійснення способу отримання пероксиестерів карбонових кислот використовувались 1) аліфатичні карбонові кислоти - оцтова ГОСТ 61-75, - н-бутанова ТУ 6-09-530-75, - н-ундеканова ТУ 6-09-18-13-75, 2) ТФА (Merck) Cat No 808261, 3) трет-бутилпдропероксид (ТБГП) і третамілпдропероксид (ТАГП) отримували ВІДПОВІДНО ІЗ 2-метил-2-пропанолу ТУ 6-09-4069-83 або 2метил-2-бутанолу ТУ 6-09-3578-74 і 30% пероксиду водню ГОСТ 10929-76 в присутності сірчаної кислоти ГОСТ 4204-77 [Milas N А , Surgenos D M Studies in Organic Peroxides, VIII T-Butyl Hydroperoxide and di-t-Butyl Peroxide // J Amer Chem Soc 1946 v 68 № 2 P 205-206] 4) піридин (Merck) осч , Cat No 107462, 5) триетиламш (Merck) Cat No 808352, 6) хлороформ ТУ 6-09-4263-76, 7) толуен ГОСТ 5789-78, 8) гідрокарбонат натрію ГОСТ 4201 -79, 9) вода, дистилят Ідентифікацію пероксиестерів проводили методом тонкошарової хроматографії на пластинах Silufol UV-254 за допомогою речовини-свідка, у ролі якої виступали пероксиестери тієї ж структури, які синтезувалися із ВІДПОВІДНИХ хлороанпдридів карбонових кислот [Bartlett P D J Am Chem Soc , 1957, v 80, Р 1398 - 1405] Елюент - суміш 1,2-дихлороетану і толуену (1 1) Як специфічний проявник на пероксивмісні сполуки використовували суміш льодяної оцтової кислоти і насиченого розчину йодиду калію (10 1) Структуру отриманих пероксиестерів підтверджували також за допомогою ІЧ-спектроскопм ІЧ-спектри записували на спектрофотометрі "Specord M-80" Вміст активного кисню (Оакт) в перо кс и есте pax визначали йодометрією [В Л Антоновський, М М Бузланова Аналитическая химия органических пероксидных соединений -М Химия, 1978] Сутність винаходу ілюструється наступними прикладами Приклад 1 Отримання третбутилпероксиацетату (І) До розчину 6г оцтової кислота в 50мл толуену при перемішуванні додавали 21 г ТФА, Через 20хв реакційну масу охолоджували до температури 2°С і поступово додавали при перемішуванні 4,5г ТБГП і 16г піридину Реакційну масу охолодженні перемішували протягом 1 год, далі промивали розчином гідрокарбонату натрію (тричі по 60мл) для нейтралізації трифлуороцтової кислоти Із органічного шару пониженому тиску (20 торр) і температурі в бані не більше 50°С відганяли розчинник, пероксиестер очищали фракційною перегонкою при залишковому тиску 1 - 2 торр Вихід трет-бутилперацетату 5,8г (88%) В ІЧ-спектрі продукту присутні інтенсивні характеристичні смуги поглинання v (С = 0) пероксиестерної групи (1760см1) Характеристики пероксиестеру І наведені в таблиці Приклад 2 Отримання третамілпероксиацетату (II), Здійснювали аналогічно прикладу 1 Співвідношення реагентів г Оцтова кислота 6, ТАГП 5,2, ТФА 21, Піридин 16, Розчинник (мл) толуєн 50 Вихід 6,1Г (83%) Характеристики пероксиестеру II наведені в таблиці Приклад 3 Отримання третбутилпероксибутаноату (III) Здійснювали аналогічно прикладу 1, тільки замість піридину брали триетиламш Співвідношення реагентів г н-Бутанова кислота 8,8, ТБГП 4,5, ТФА 21, Триетиламш 21, Розчинник (мл) хлороформ 50, Вихід 6,8Г (85%) Характеристики пероксиестеру III наведені в таблиці Приклад 4 Отримання третбутилпероксиундеканоату (IV) Здійснювали аналогічно прикладу 1 Співвідношення реагентів г н-Ундеканова кислота 8,8, ТБГП 4 5, ТФА 21, Піридин 16, Розчинник (мл) хлороформ 50 Вихід 10,3Г (80%) Характеристики пероксиестеру IV наведені в таблиці 53389 Таблиця Характеристики отриманих пероксиестерів Характеристики пероксиестерів Пероксиестер Вихід, % I 88 II продукту Rf Оакт, % свідка знайдено розрах 0,21 0,20 12,0 12,1 83 0,23 0,23 11,0 10,9 III 85 0,27 0,27 10,3 10,0 IV 80 0,41 0,40 6,1 6,2 d 4 2 0 (літ *) nD2° (літ *) 0,9425 (0,9415) 0,9372 (0,9386) 0,9231 (0,9245) 0,8913 1,4060 (1,4050) 1,4135 (1,4115) 1,4155 (1,4153) 1,4350 [В Л Антоновский Органические перекисные инициаторы - М Химия, 1972] ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)236-47-24
ДивитисяДодаткова інформація
Назва патенту англійськоюA process for aliphatic carbonic acids peroxyesthers preparation
Автори англійськоюVoronov Stanislav Andriiovych, Donchak Volodymyr Andriiovych
Назва патенту російськоюСпособ получения пероксиэфиров алифатических карбоновых кислот
Автори російськоюВоронов Станислав Андреевич, Дончак Владимир Андреевич
МПК / Мітки
МПК: C07C 409/00, C07C 407/00
Мітки: пероксиестерів, кислот, отримання, карбонових, спосіб, аліфатичних
Код посилання
<a href="https://ua.patents.su/3-53389-sposib-otrimannya-peroksiesteriv-alifatichnikh-karbonovikh-kislot.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання пероксиестерів аліфатичних карбонових кислот</a>
Попередній патент: Пристрій та спосіб в.тищенка для видобування вугілля на тонких пластах пологого спаду
Наступний патент: Водорозчинний ненасичений дериват декстрану та спосіб його отримання
Випадковий патент: Спосіб лікування різних типів дискінезій жовчовивідних шляхів при хронічному некам'яному холециститі