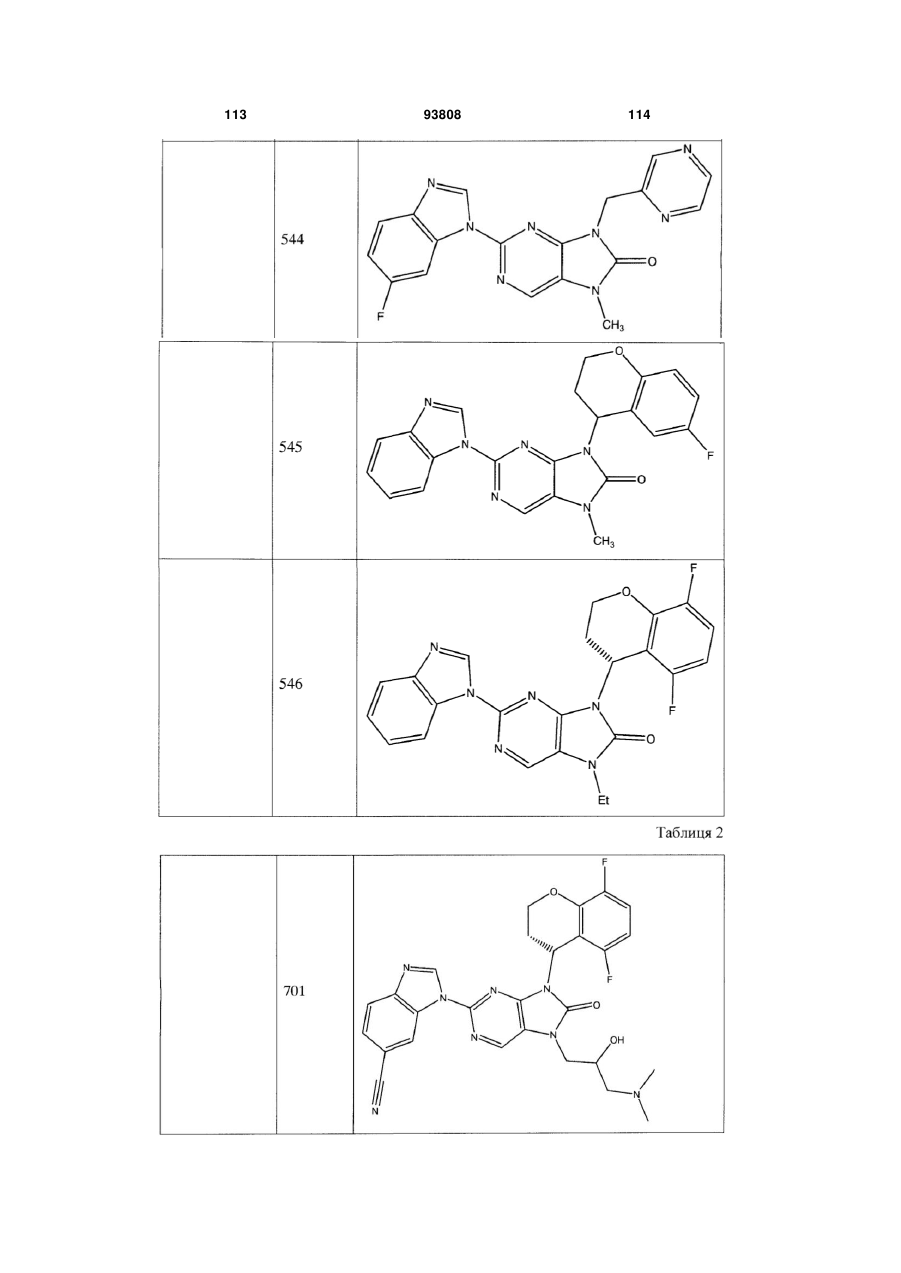
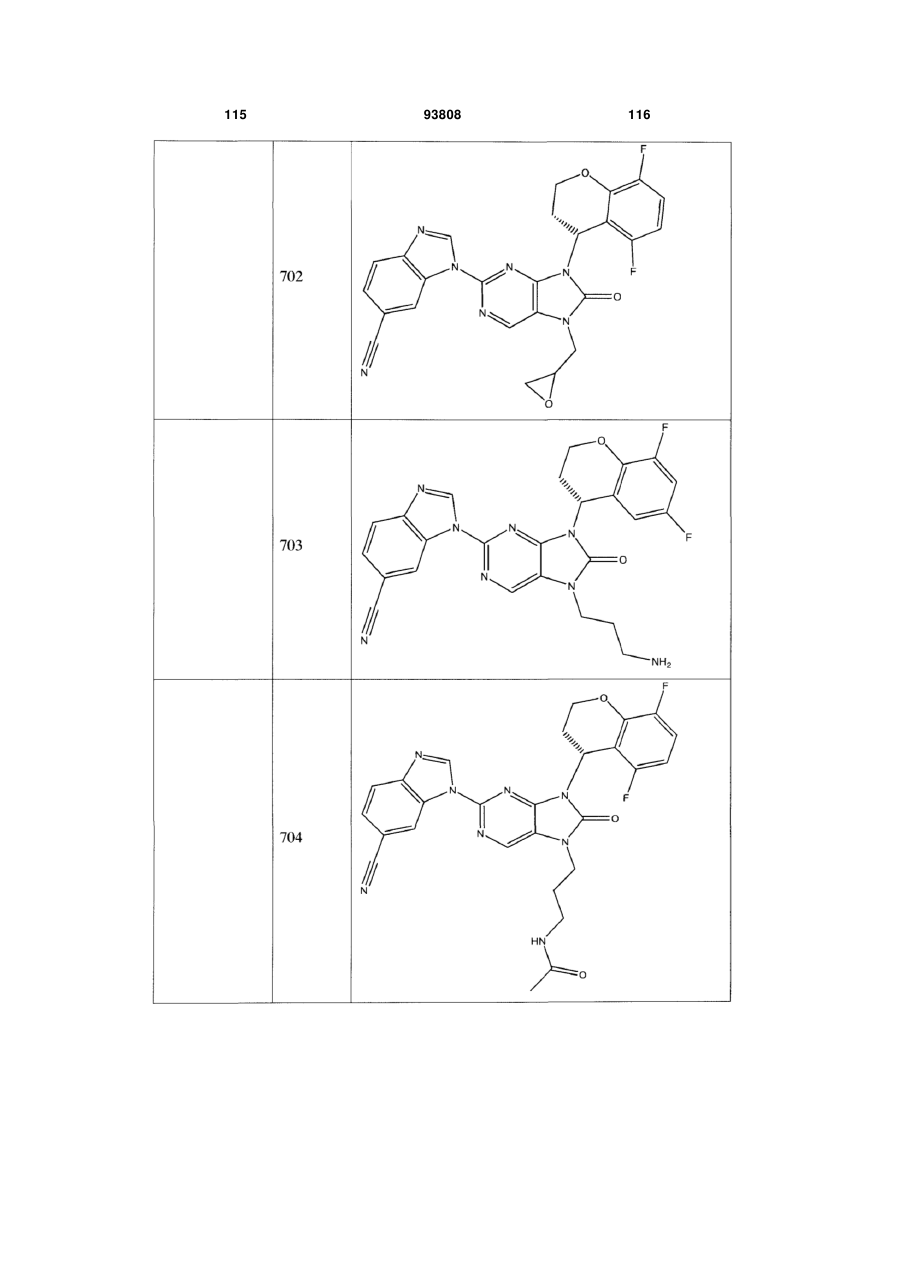
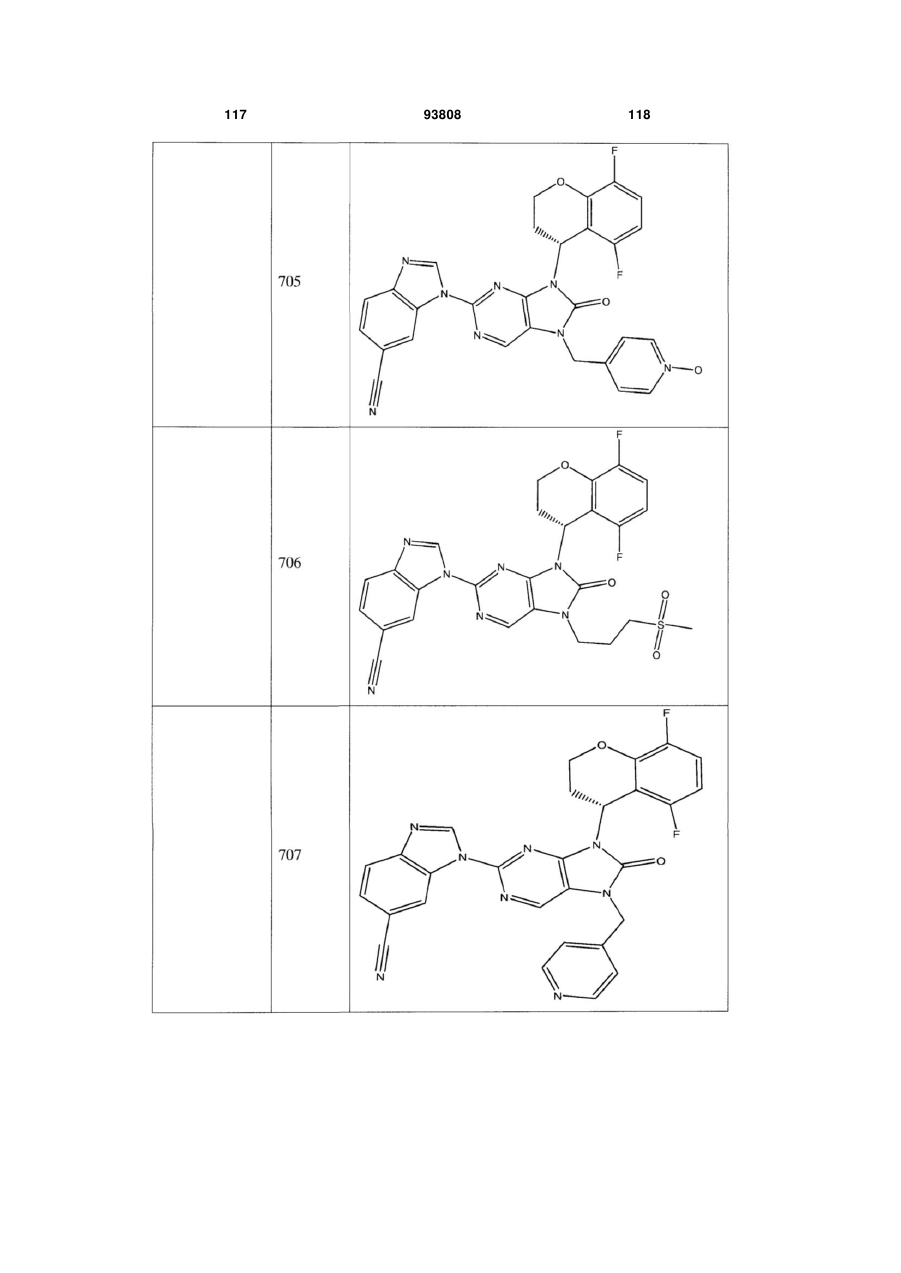
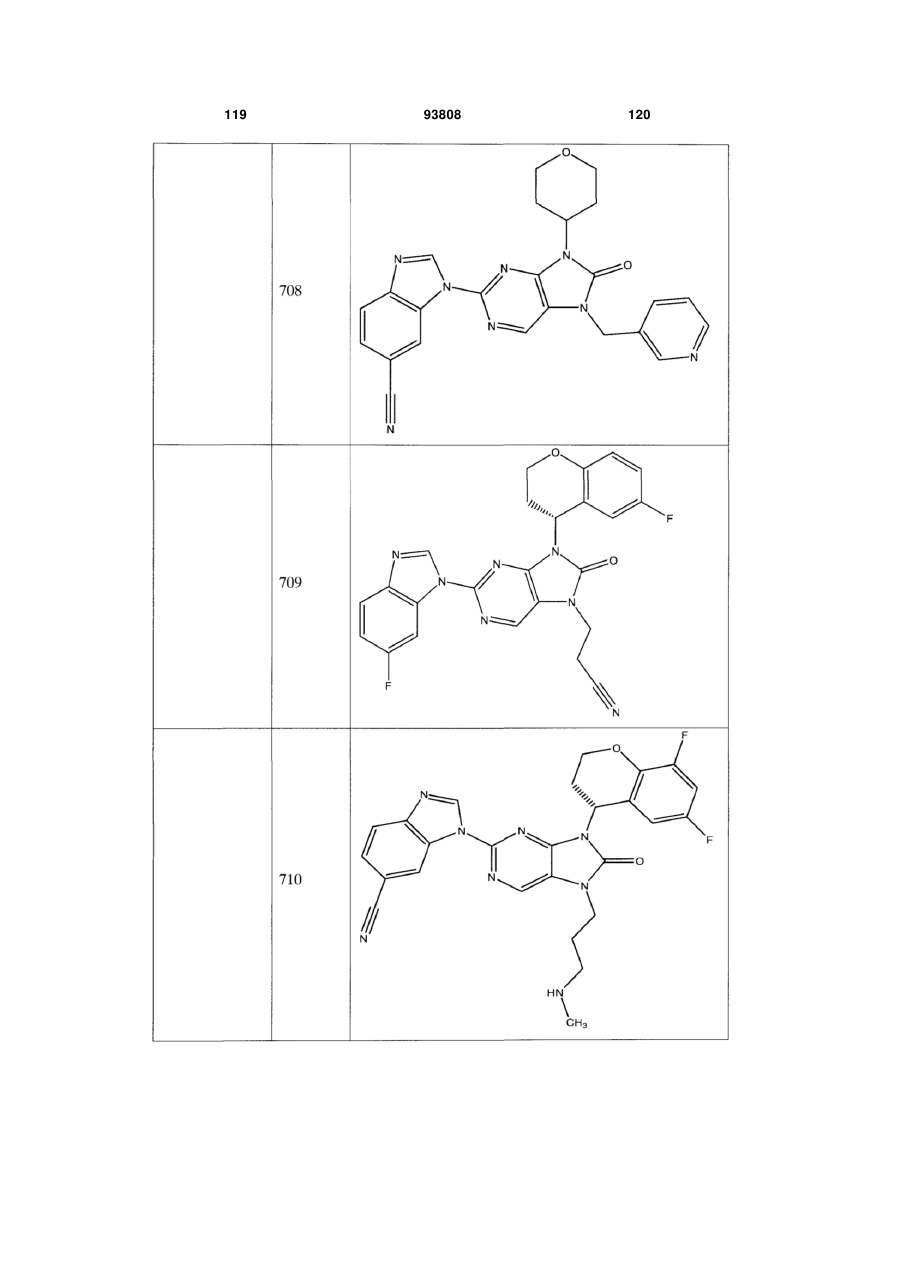
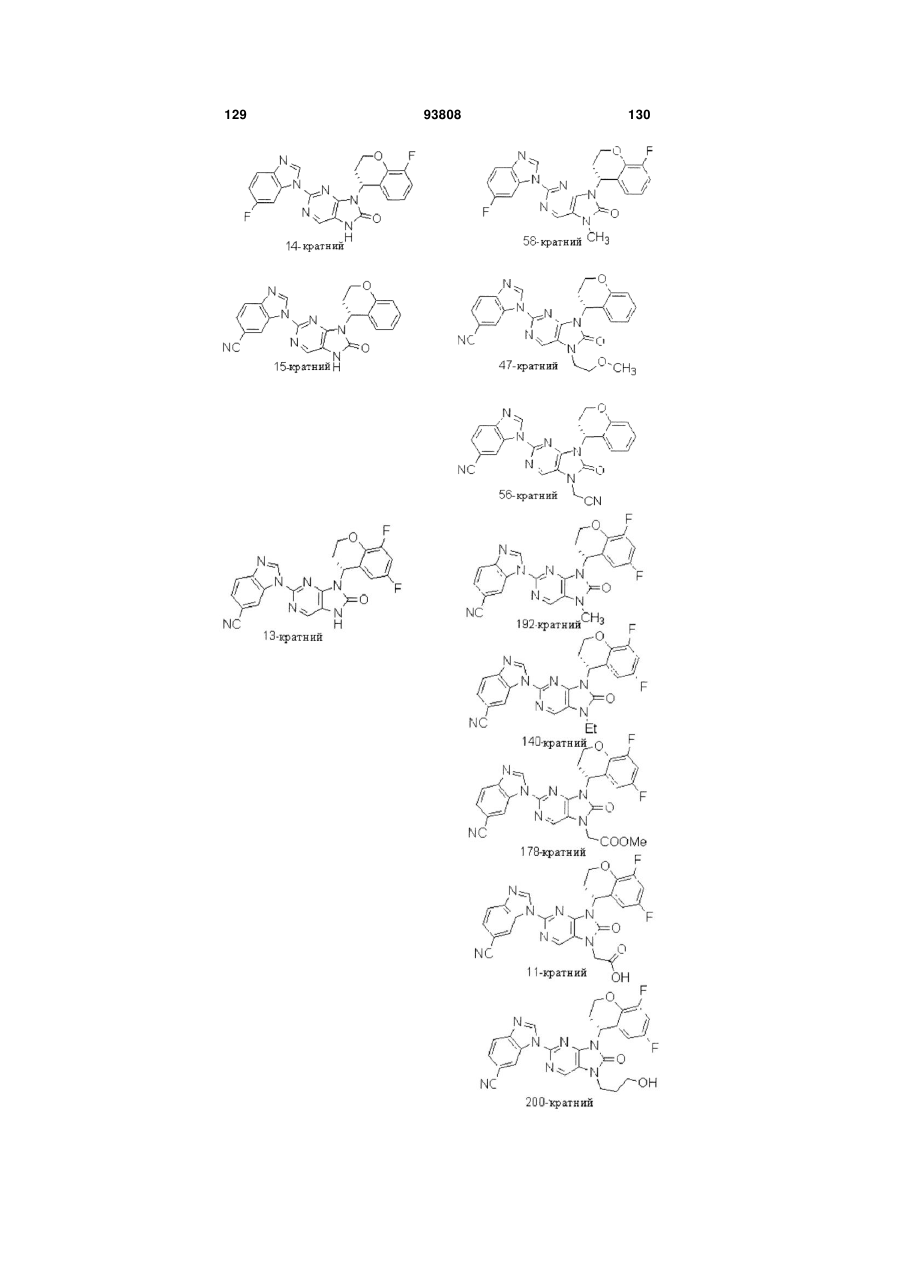
7-заміщені похідні пурину для імуносупресії
Номер патенту: 93808
Опубліковано: 10.03.2011
Автори: Кінгсбарі Селіа, Хо Кок-Кан, Ольмейєр Майкл, Бонштедт Адольф, Куінтеро Джордж
Формула / Реферат
1. Сполука, яка відповідає Формулі III
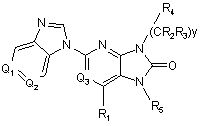 , III
, III
у зазначеній сполуці
Q1 й Q2 незалежно вибрані з групи, що складається з СХ1 СХ2 і атома азоту, за умови, що Q1 й Q2 одночасно не являють собою атоми азоту;
Q3 являє собою N або СН;
Х1 й Х2 незалежно вибрані з групи, що складається з атома водню, (С1-С6)алкілу, ціаногрупи, атома галогену, галогено(С1-С6)алкілу, гідроксильної групи, (С1-С6)алкоксигрупи; галогено(С1-С6)алкоксигрупи й нітрогрупи;
R1 вибраний з групи, що складається з атома водню і (С1-С6)алкілу;
у дорівнює нулю або цілому числу, вибраному з 1, 2 і 3;
для кожного фрагмента (CR2R3) R2 й R3 незалежно вибрані з групи, що складається з атома водню і (С1-С6)алкілу;
R4 вибраний із групи, що складається з алкілу, гетероциклілу, арилу, гетероарилу, заміщеного алкілу, заміщеного гетероциклілу, заміщеного арилу, заміщеного гетероарилу;
R5 вибраний із групи, що складається з алкілу, гетероциклілу, заміщеного гетероциклілу і (C1-С6)алкілу, в яких
(a) один або два фрагменти СН2 заміщені групою, вибраною з NH або N(алкілу);
(b) один або два фрагменти СН2 заміщені О;
(c) один або два фрагменти СН2 заміщені (С=О);
(d) два СН2 заміщені групою СН=СН або С≡С; або
(e) включають будь-яке хімічно стійке сполучення (а), (b) (с) і (d);
і в яких від нуля до трьох атомів водню заміщені групами, вибраними з наступних замісників:
(a) атома галогену, гідроксигрупи, ціаногрупи, (нижчий алкіл)сульфонілу, (нижчий алкіл)сульфонілоксигрупи, аміногрупи, (нижчий алкіл)аміногрупи, ди(нижчий алкіл)аміногрупи, алкоксіаміногрупи, сульфоніламіногрупи, ациламіногрупи, ариламіногрупи, (нижчий алкокси)групи;
(b) гетероциклілу або гетероциклілу, що має від одного до трьох замісників, вибраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу і алкоксикарбонілу;
(c) фенілу або фенілу, що має від одного до трьох замісників, вибраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу, ациламіногрупи, ціаногрупи, карбоксигрупи, алкоксикарбонілу, галогеноалкілу та гетероциклілу;
(d) гетероарилу або заміщеного гетероарилу, що має від одного до трьох замісників, вибраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу і алкоксикарбонілу.
2. Сполука за п. 1, що відповідає Формулі:
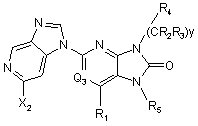 .
.
3. Сполука за п. 2, що відповідає Формулі:
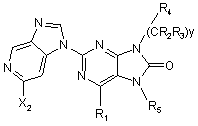 .
.
4. Сполука за п. 2, що відповідає Формулі:
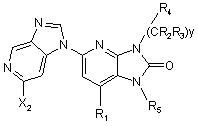 .
.
5. Сполука за п. 1, що відповідає Формулі:
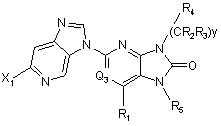 .
.
6. Сполука за п. 5, що відповідає Формулі:
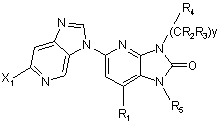 .
.
7. Сполука за п. 5, що відповідає Формулі:
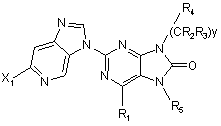 .
.
8. Сполука за п. 1, що відповідає Формулі:
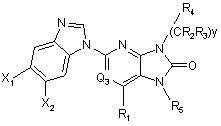 .
.
9. Сполука за п. 8, що відповідає Формулі:
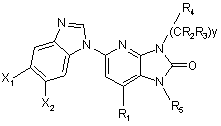 .
.
10. Сполука за п. 8, що відповідає Формулі:
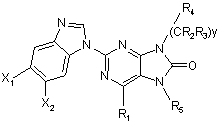 .
.
11. Сполука за будь-яким із пп. 1-10, у якій Х1 й Х2 незалежно вибрані з групи, що включає атом водню, ціаногрупу, атоми хлору, фтору, метил, трифторметил і трифторметоксигрупу.
12. Сполука за будь-яким із пп. 1-10, у якій R1 являє собою Н.
13. Сполука за будь-яким із пп. 1-10, у якій, у дорівнює 1 або 2, і R2 й R3 являють собою атоми водню або метильні радикали.
14. Сполука за п. 13, у якій R4 вибрані із групи, що включає феніл, хінолін, піридин, піразин або їх заміщені аналоги.
15. Сполука за будь-яким із пп. 1-10, у якій у дорівнює нулю.
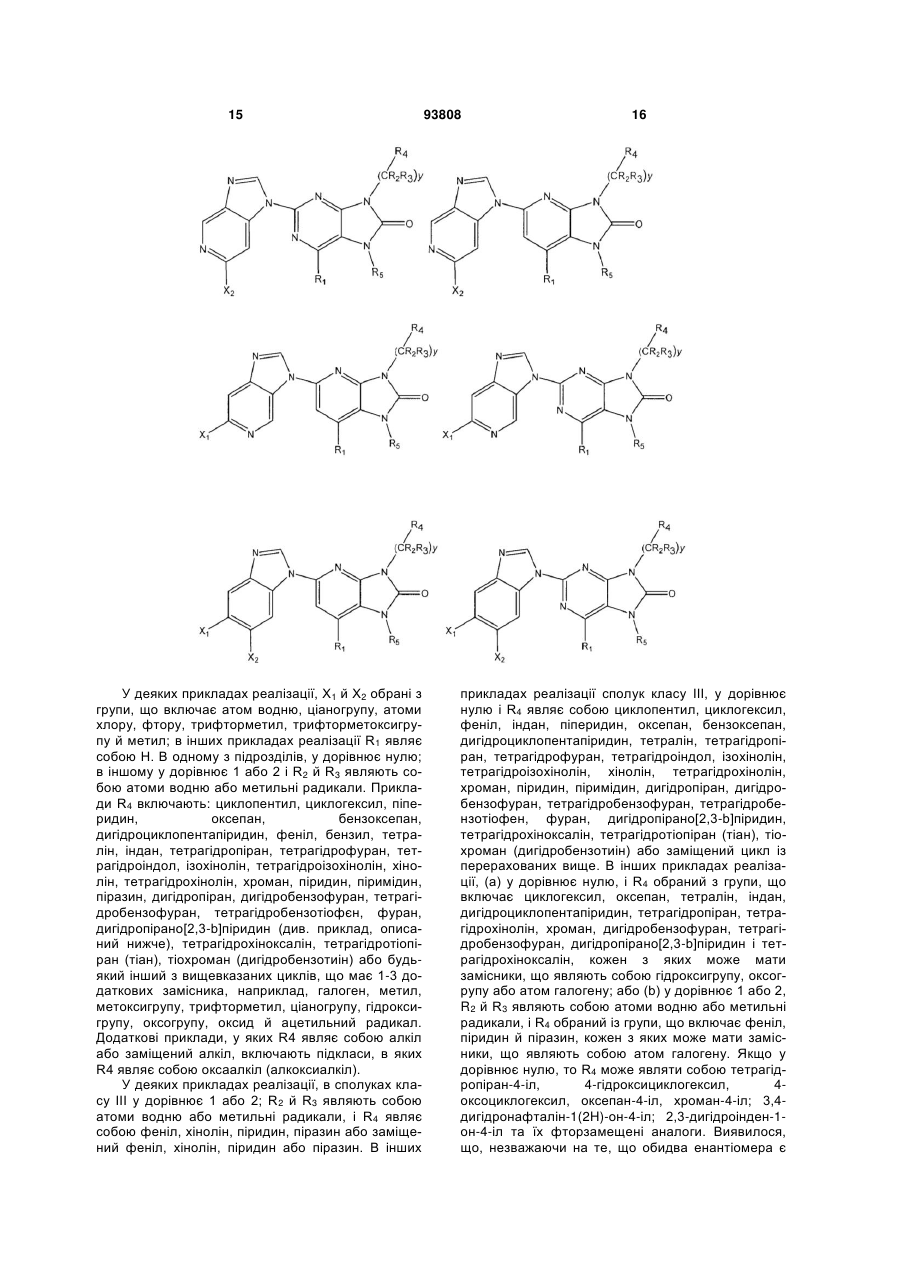
16. Сполука за п. 15, у якій R4 вибрані із групи, що включає циклопентил, циклогексил, феніл, індан, тетралін, піперидин, оксепан, бензоксепан, дигідроциклопентапіридин, тетрагідропіран, тетрагідрофуран, тетрагідроіндол, ізохінолін, тетрагідроізохінолін, хінолін, тетрагідрохінолін, хроман, піридин, піримідин, дигідропіран, дигідробензофуран, тетрагідробензофуран, тетрагідробензотіофен, фуран, дигідропірано[2,3-b]піридин, тетрагідрохіноксалін, тетрагідротіопіран (тіан), тіохроман (дигідробензотіїн) та їх заміщені аналоги.
17. Сполука за будь-яким із пп. 1-10, у якій
(а) у дорівнює нулю, і R4 вибраний із групи, що включає циклогексил, тетралін, індан, оксепан, бензоксепан, дигідроциклопентапіридин, тетрагідропіран, тетрагідрохінолін, хроман, дигідробензофуран, тетрагідробензофуран, дигідропірано[2,3-b]піридин і тетрагідрохіноксалін, кожен з яких може мати замісники, що являють собою гідроксигрупу, оксогрупу або атом галогену; або
(b) у дорівнює 1 або 2, R2 й R3 являють собою атоми водню або метильні радикали, і R4 вибраний із групи, що включає феніл, піридин і піразин, кожен з яких може мати замісники, що являють собою атом галогену.
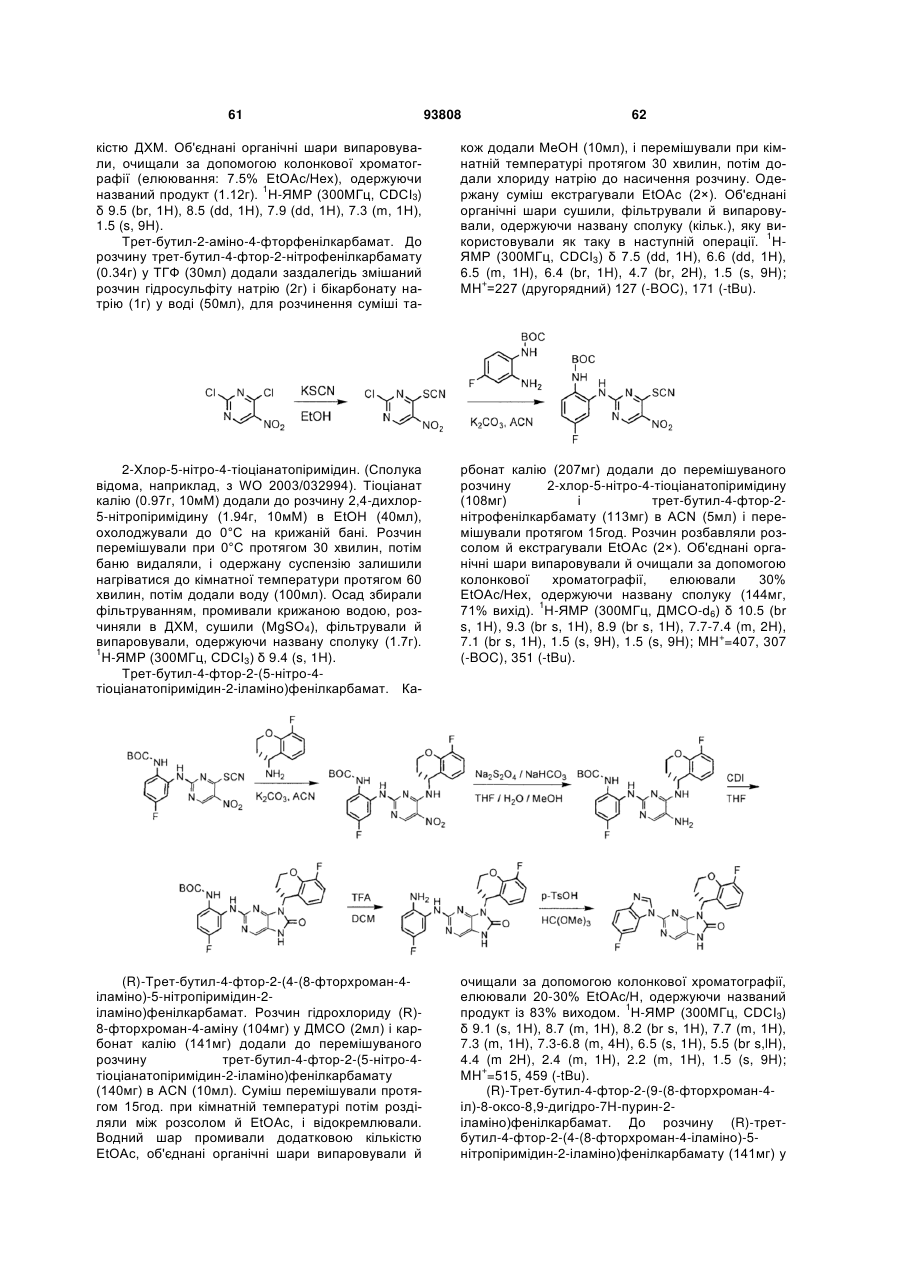
18. Сполука за п. 17, в якій у дорівнює 0, і R4 вибраний із хроман-4-ілу; 3,4-дигідронафталін-1(2H)-он-4-ілу; 2,3-дигідроінден-1-он-4-ілу та їх фторзаміщених аналогів.
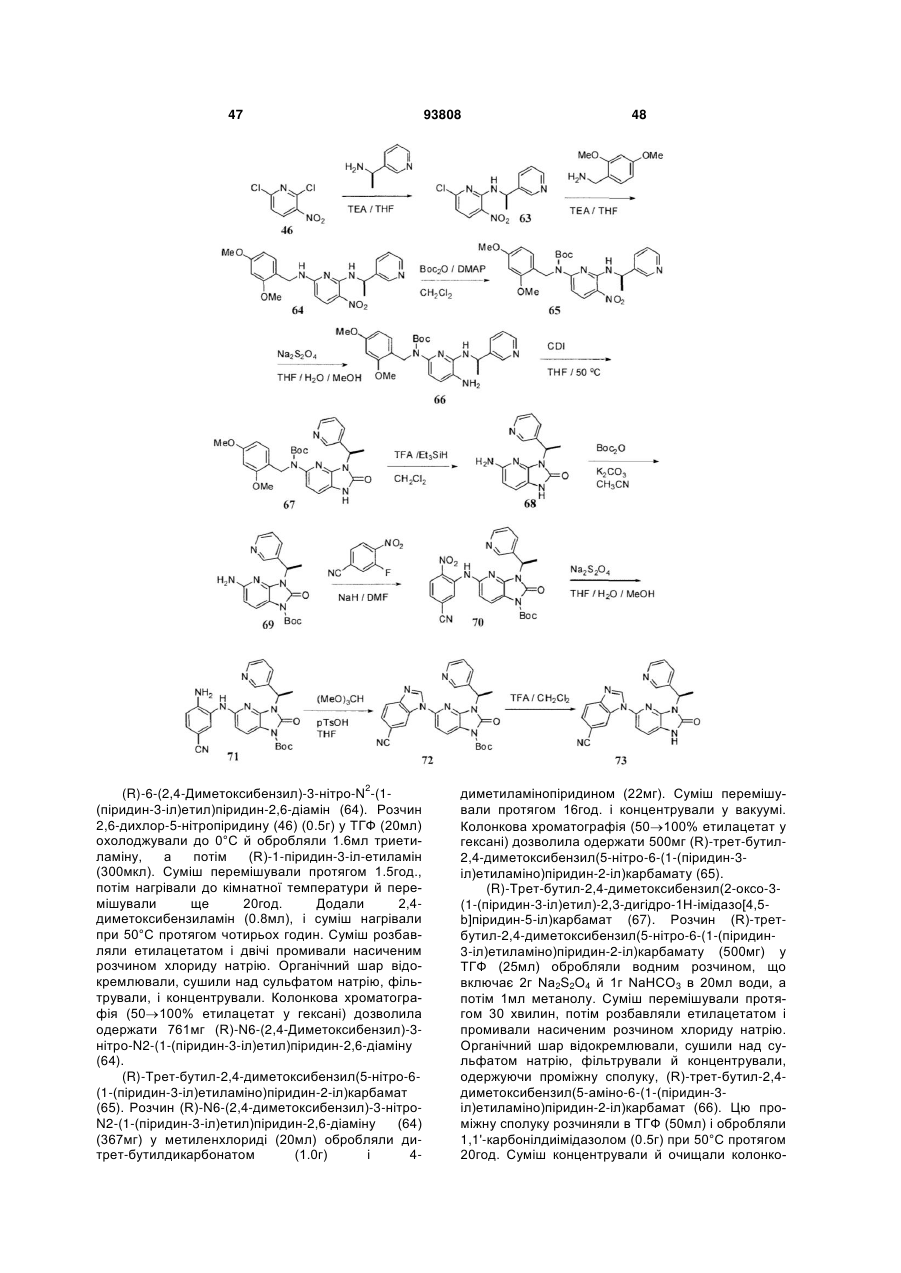
19. Сполука за п. 18, в якій R4 являє собою хроман-4-іл, і атом вуглець в 4 положенні молекули хроману знаходиться в (R)-конфігурації.
20. Сполука за п. 17, в якій у дорівнює 0, і R4 являє собою
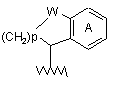 ,
,
у якій
W являє собою СН2, С=О або О;
р дорівнює 1, 2 або 3;
А являє собою шестичленний гетероароматичний цикл, що містить 1 або 2 атоми азоту, або
бензольний цикл, можливо заміщений одним або двома атомами фтору;
хвиляста лінія означає точку приєднання до молекули пуринону.
21. Сполука за п. 20, в якій атом вуглецю, відмічений зірочкою,
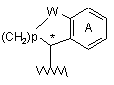
знаходиться в (R)-конфігурації.
22. Сполука за п. 17, в якій у дорівнює 1, і R4 вибраний із групи, що включає дифторфеніл, фторфеніл, хлорфеніл, хлорфторфеніл, піридин-3-іл і піразин-3-іл.
23. Сполука за п. 17, в якій у дорівнює нулю, і R4 вибраний із групи, що включає тетрагідропіран-4-іл, 4-гідроксициклогексил, 4-оксоциклогексил і оксепан-4-іл.
24. Сполука за п. 10, в якій Х1 й Х2 незалежно вибрані із групи, що включає атом водню, ціаногрупу, атоми хлору й фтору, і R1 являє собою Н.
25. Сполука за п. 24, в якій
(a) у дорівнює нулю, і R4 вибрані із групи, що включає циклогексил, тетралін, індан, оксепан, бензоксепан, дигідроциклопентапіридин, тетрагідропіран, тетрагідрохінолін, хроман, дигідробензофуран, тетрагідробензофуран, дигідропірано[2,3-b]піридин, тетрагідрохіноксалін, кожен з яких може мати замісники, що являють собою гідроксигрупу, оксогрупу або атом галогену; або
(b) у дорівнює 1 або 2, R2 й R3 являють собою атоми водню або метильні радикали, і R4 вибрані з групи, що включає феніл, піридин і піразин, кожен з яких може мати замісники, що являють собою атом галогену.
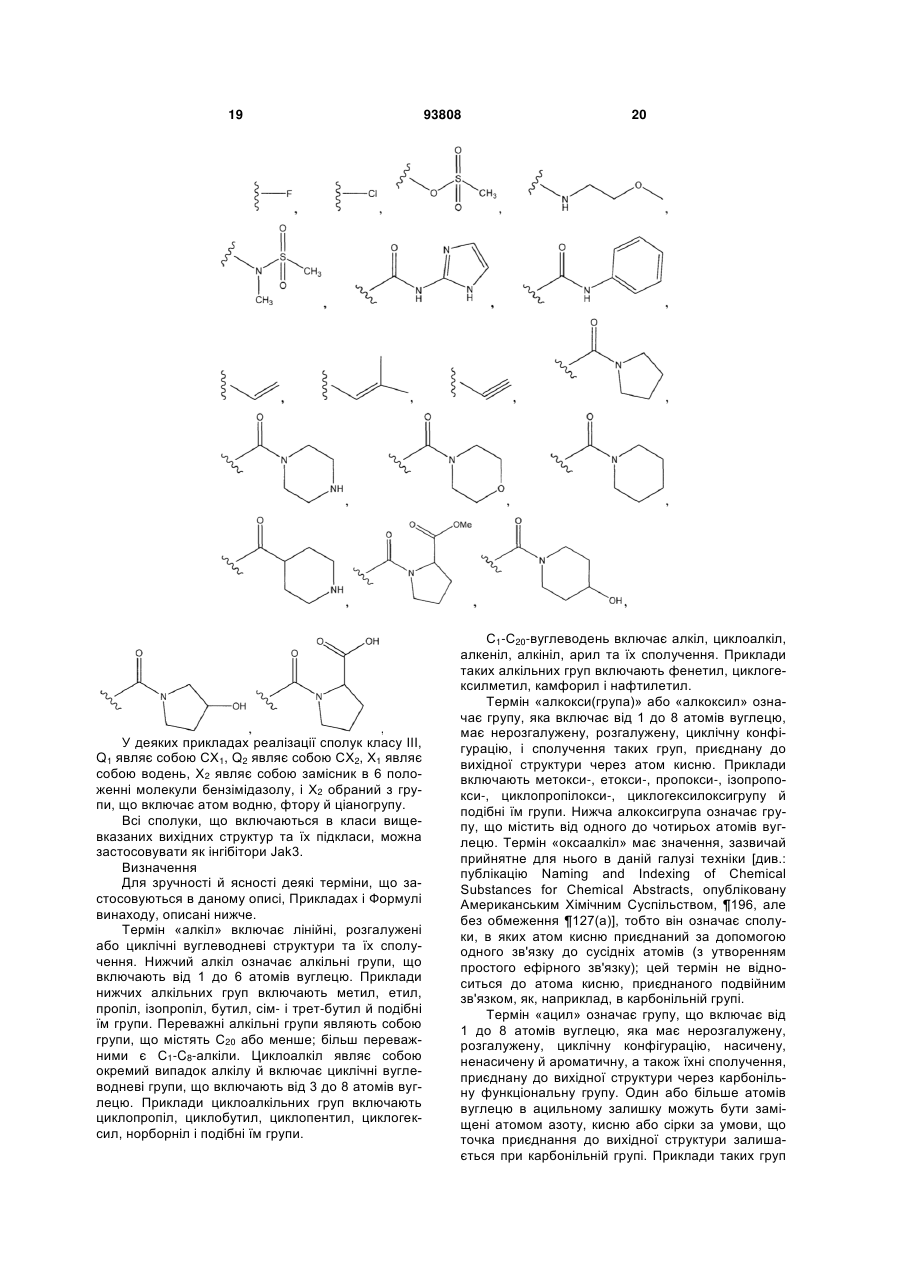
26. Сполука за п. 25, в якій R5 являє собою (С1-С6)алкіл, у якому
(a) один або два фрагменти СН2 заміщені групою, вибраною з NH і N(алкілу);
(b) один або два фрагменти СН2 заміщені О;
(c) один або два фрагменти СН2 заміщені (С=О);
(d) два СН2 заміщені групою СН=СН або С≡С; або
(e) включають будь-яке хімічно стійке сполучення (а), (b) (с) і (d);
і в яких від нуля до трьох атомів водню заміщені групами, вибраними з наступних замісників:
(а) атома галогену, гідроксигрупи, ціаногрупи, (нижчий алкіл)сульфонілу, (нижчий алкіл)сульфонілоксигрупи, аміногрупи, (нижчий алкіл)аміногрупи, ди(нижчий алкіл)аміногрупи, алкоксіаміногрупи, сульфоніламіногрупи, ациламіногрупи, ариламіногрупи, (нижчий алкокси)групи;
(b) гетероциклілу або гетероциклілу, що має від одного до трьох замісників, вибраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу і алкоксикарбонілу;
(c) фенілу або фенілу, що має від одного до трьох замісників, вибраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу, ациламіногрупи, ціаногрупи, карбоксигрупи, алкоксикарбонілу, галогеноалкілу та гетероциклілу; і
(d) гетероарилу або заміщеного гетероарилу, що має від одного до трьох замісників, вибраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу і алкоксикарбонілу.
27. Сполука за п. 26, в якій у дорівнює 0, і R4 являє собою
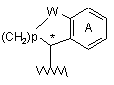 ,
,
у якій атом вуглецю, відмічений зірочкою, знаходиться в (R)-конфігурації;
W являє собою СН2, С=О або О;
р дорівнює 1, 2 або 3;
А являє собою шестичленний гетероароматичний цикл, що містить 1 або 2 атоми азоту, або
бензольний цикл, можливо заміщений одним або двома атомами фтору; і
хвиляста лінія означає точку приєднання до молекули пуринону.
28. Сполука за п. 27, в якій Х1 являє собою атом водню, Х2 являє собою замісник у положенні 6 бензімідазолу, і Х2 вибраний з атома водню, фтору чи ціаногрупи.
29. Сполука за будь-яким із пп. 1-10, у якій R5 являє собою (С1-С6)алкіл або (С1-С6)фторалкіл.
30. Сполука за п. 29, у якій у дорівнює 0, R4 являє собою
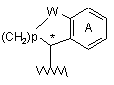 ,
,
в якій атом вуглецю, відмічений зірочкою, знаходиться в (R)-конфігурації;
W являє собою СН2, С=О або О;
р дорівнює 1, 2 або 3;
А являє собою шестичленний гетероароматичний цикл, що містить 1 або 2 атоми азоту, або
бензольний цикл, можливо заміщений одним або двома атомами фтору;
хвиляста лінія означає точку приєднання до молекули пуринону.
31. Сполука за будь-яким із пп. 1-10, в якій R5 являє собою (С1-С6)алкіл, і в якій від нуля до трьох атомів водню заміщені групами, вибраними з наступних замісників: гідроксигрупи, карбоксигрупи, ціаногрупи, (нижчий алкіл)сульфонілу (нижчий алкіл)сульфонілоксигрупи, аміногрупи, (нижчий алкіл)аміногрупи, ди(нижчий алкіл)аміногрупи, алкоксіаміногрупи, сульфоніламіногрупи, ациламіногрупи, ариламіногрупи й (нижчий алкокси)групи.
32. Сполука за п. 31, в якій у дорівнює 0, і R4 являє собою
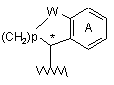 ,
,
в якій атом вуглецю, відмічений зірочкою, знаходиться в (R)-конфігурації;
W являє собою СН2, С=О або О;
р дорівнює 1, 2 або 3;
А являє собою шестичленний гетероароматичний цикл, що містить 1 або 2 атоми азоту, або
бензольний цикл, можливо заміщений одним або двома атомами фтору;
хвиляста лінія означає точку приєднання до молекули пуринону.
33. Фармацевтична композиція, що містить фармацевтично прийнятний носій і терапевтично ефективну кількість щонайменше однієї сполуки за будь-яким із пп. 1-32.
34. Спосіб лікування порушення, яке залежить від інгібування Янус-кінази 3, що включає введення пацієнтові, який потребує такого лікування, терапевтично ефективної кількості сполуки, що відповідає Формулі III
 , III
, III
у зазначеній сполуці
Q1 й Q2 незалежно вибрані із групи, що складається з СХ1, СХ2 і атома азоту, за умови, що Q1 й Q2 одночасно не являють собою атоми азоту;
С3 являє собою N або СН;
X1 й Х2 незалежно вибрані із групи, що складається з атома водню, (С1-С6)алкілу, ціаногрупи, атома галогену, галогено(С1-С6)алкілу, гідроксильної групи, (С1-С6)алкоксигрупи; галогено(С1-С6)алкоксигрупи й нітрогрупи; R1 вибрані із групи, що складається з атома водню і (С1-С6)алкілу; у дорівнює нулю або цілому числу, вибраному з 1, 2 й 3;
для кожного фрагмента (CR2R3) R2 й R3 незалежно вибрані з групи, що складається з атома водню і (С1-С6)алкілу;
R4 вибраний із групи, що складається з алкілу, гетероциклілу, арилу, гетероарилу, заміщеного алкілу, заміщеного гетероциклілу, заміщеного арилу, заміщеного гетероарилу;
R5 вибраний із групи, що складається з алкілу, гетероциклілу, замішеного гетероциклілу і (С1-С6)алкілу, в яких
(a) один або два фрагменти СН2 заміщені групою, вибраною з NH і N(алкілу);
(b) один або два фрагменти СН2 заміщені О;
(c) один або два фрагменти СН2 заміщені (С=О);
(d) два CH2 заміщені групою СН=СН або С≡С; або
(e) включають будь-яке хімічно стійке сполучення (а), (b), (с) і (d);
і в яких від нуля до трьох атомів водню заміщені групами, вибраними з наступних замісників:
(a) атома галогену, гідроксигрупи, ціаногрупи, (нижчий алкіл)сульфонілу, (нижчий алкіл)сульфонілоксигрупи, аміногрупи, (нижчий алкіл)аміногрупи, ди(нижчий алкіл)аміногрупи, алкоксіаміногрупи, сульфоніламіногрупи, ациламіногрупи, ариламіногрупи, (нижчий алкокси)групи;
(b) гетероциклілу або гетероциклілу, що має від одного до трьох замісників, вибраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу і алкоксикарбонілу;
(c) фенілу або фенілу, що має від одного до трьох замісників, вибраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу, ациламіногрупи, ціаногрупи, карбоксигрупи, алкоксикарбонілу, галогеноалкілу та гетероциклілу;
(d) гетероарилу або заміщеного гетероарилу, що має від одного до трьох замісників, вибраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу і алкоксикарбонілу.
35. Спосіб лікування порушення, яке залежить від інгібування Янус-кінази 3, який включає введення пацієнтові, що потребує такого лікування, терапевтично ефективної кількості сполуки, яка відповідає Формулі III
 , III
, III
у зазначеній сполуці
Q1 й Q2 незалежно вибрані із групи, що складається з СХ1, СХ2 і атома азоту, за умови, що Q1 й Q2 одночасно не являють собою атоми азоту;
С3 являє собою N або СН;
Х1 й Х2 незалежно вибрані із групи, що складається з атома водню, ціаногрупи, атома фтору або хлору;
R1 являє собою атом водню;
у дорівнює нулю або цілому числу, вибраному з 1, 2 й 3;
для кожного фрагмента (CR2R3) R2 й R3 незалежно вибрані із групи, що складається з атома водню і (С1-С6)алкілу;
R4 вибраний із групи, що складається з алкілу, гетероциклілу, арилу, гетероарилу, заміщеного алкілу, заміщеного гетероциклілу, заміщеного арилу, заміщеного гетероарилу;
R5 вибраний із групи, що складається з алкілу, гетероциклілу, заміщеного гетероциклілу і (С1-С6)алкілу, в яких
(a) один або два фрагменти СН2 заміщені групою, вибраною з NH і N(алкілу);
(b) один або два фрагменти СН2 заміщені О;
(c) один або два фрагменти СН2 заміщені (С=О);
(d) два СН2 заміщені групою СН=СН або С≡С; або
(e) включають будь-яке хімічно стійке сполучення (а), (b), (с) і (d);
в яких від нуля до трьох атомів водню заміщені групами, вибраними з наступних замісників:
(a) атома галогену, гідроксигрупи, ціаногрупи, (нижчий алкіл)сульфонілу, (нижчий алкіл)сульфонілоксигрупи, аміногрупи, (нижчий алкіл)аіміногрупи, ди(нижчий алкіл)аміногрупи, алкоксіаміногрупи, сульфоніламіногрупи, ациламіногрупи, ариламіногрупи, (нижчий алкокси)групи;
(b) гетероциклілу або гетероциклілу, що має від одного до трьох замісників, вибраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу і алкоксикарбонілу;
(c) фенілу або фенілу, що має від одного до трьох замісників, вибраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу, ациламіногрупи, ціаногрупи, карбоксигрупи, алкоксикарбонілу, галогеноалкілу й гетероциклілу;
(d) гетероарилу або заміщеного гетероарилу, що має від одного до трьох замісників, вибраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу й алкоксикарбонілу.
36. Спосіб за будь-яким з п. 34 або п. 35, у якому зазначене порушення вибране із групи, що включає аутоімунне захворювання, запальне захворювання, захворювання, опосередковуване тучними клітинами, гематологічне злоякісне новоутворення й відторгнення пересадженого органа.
37. Спосіб за п. 36, в якому зазначене порушення являє собою відторгнення трансплантата кісткового мозку.
38. Спосіб за п. 36, в якому зазначене гематологічне злоякісне новоутворення вибране з групи, що включає лейкемію й лімфому.
39. Спосіб за п. 36, в якому зазначене порушення являє собою астму.
40. Спосіб за п. 36, в якому зазначене аутоімунне захворювання вибране із групи, що включає органоспецифічне й неорганоспецифічне аутоімунне захворювання.
41. Спосіб за п. 36, в якому зазначене порушення являє собою сухий кератокон'юнктивіт.
42. Спосіб за п. 36, в якому зазначене гематологічне злоякісне новоутворення являє собою хронічну мієлогенну лейкемію.
43. Спосіб за будь-яким з п. 34 або п. 35, в якому зазначене порушення вибране із групи, що включає лейкемічну форму лімфоми Т-клітин шкірних покривів і гостру лімфобластичну лейкемію.
44. Спосіб лікування порушення, вибраного із групи, що включає аутоімунне захворювання, запальні захворювання, захворювання, опосередковувані тучними клітинами, гематологічне злоякісне новоутворення і відторгнення пересадженого органа, що включає введення пацієнтові, який потребує такого лікування, терапевтично ефективної кількості сполуки, яка відповідає Формулі III
 , III
, III
у якій
Q1 й Q2 незалежно вибрані із групи, що складається з СХ1, СХ2 і атома азоту, за умови, що Q1 й Q2 одночасно не являють собою атоми азоту;
Q3 являє собою N або СН;
X1 й Х2 незалежно вибрані із групи, що складається з атома водню, (С1-С6)алкілу, ціаногрупи, атома галогену, галогено(С1-С6)алкілу, гідроксильної групи, (С1-С6)алкоксигрупи; галогено(С1-С6)алкоксигрупи і нітрогрупи;
R1 вибраний із групи, що складається з атома водню і (С1-С6)алкілу;
у дорівнює нулю або цілому числу, вибраному з 1, 2 й 3;
для кожного фрагмента (CR2R3) R2 й R3 незалежно вибрані із групи, що складається з атома водню і (С1-С6)алкілу;
R4 вибраний із групи, що складається з алкілу, гетероциклілу, арилу, гетероарилу, заміщеного алкілу, заміщеного гетероциклілу, заміщеного арилу, заміщеного гетероарилу;
R5 вибраний із групи, що складається з алкілу, гетероциклілу, гетероциклілу та (C1-С6)алкілу, у яких
(a) один або два фрагменти СН2 заміщені групою, вибраною з NH і N(алкілу);
(b) один або два фрагменти СН2 заміщені О;
(c) один або два фрагменти СН2 заміщені (С=О);
(d) два СН2 заміщені групою СН=СН або С≡С; або
(e) включають будь-яке хімічно стійке сполучення (а), (b) (с) і (d);
і в яких від нуля до трьох атомів водню заміщені групами, вибраними з наступних замісників:
(a) атома галогену, гідроксигрупи, ціаногрупи, (нижчий алкіл)сульфонілу, (нижчий алкіл)сульфонілоксигрупи, аміногрупи, (нижчий алкіл)аміногрупи, ди(нижчий алкіл)аміногрупи, алкоксіаміногрупи, сульфоніламіногрупи, ациламіногрупи, ариламіногрупи, (нижчий алкокси)групи;
(b) гетероциклілу або гетероциклілу, що має від одного до трьох замісників, вибраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу, алкоксикарбонілу;
(c) фенілу або фенілу, що має від одного до трьох замісників, вибраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу, ациламіногрупи, ціаногрупи, карбоксигрупи, алкоксикарбонілу, галогеноалкілу чи гетероциклілу;
(d) гетероарилу або заміщеного гетероарилу, що має від одного до трьох замісників, вибраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу чи алкоксикарбонілу.
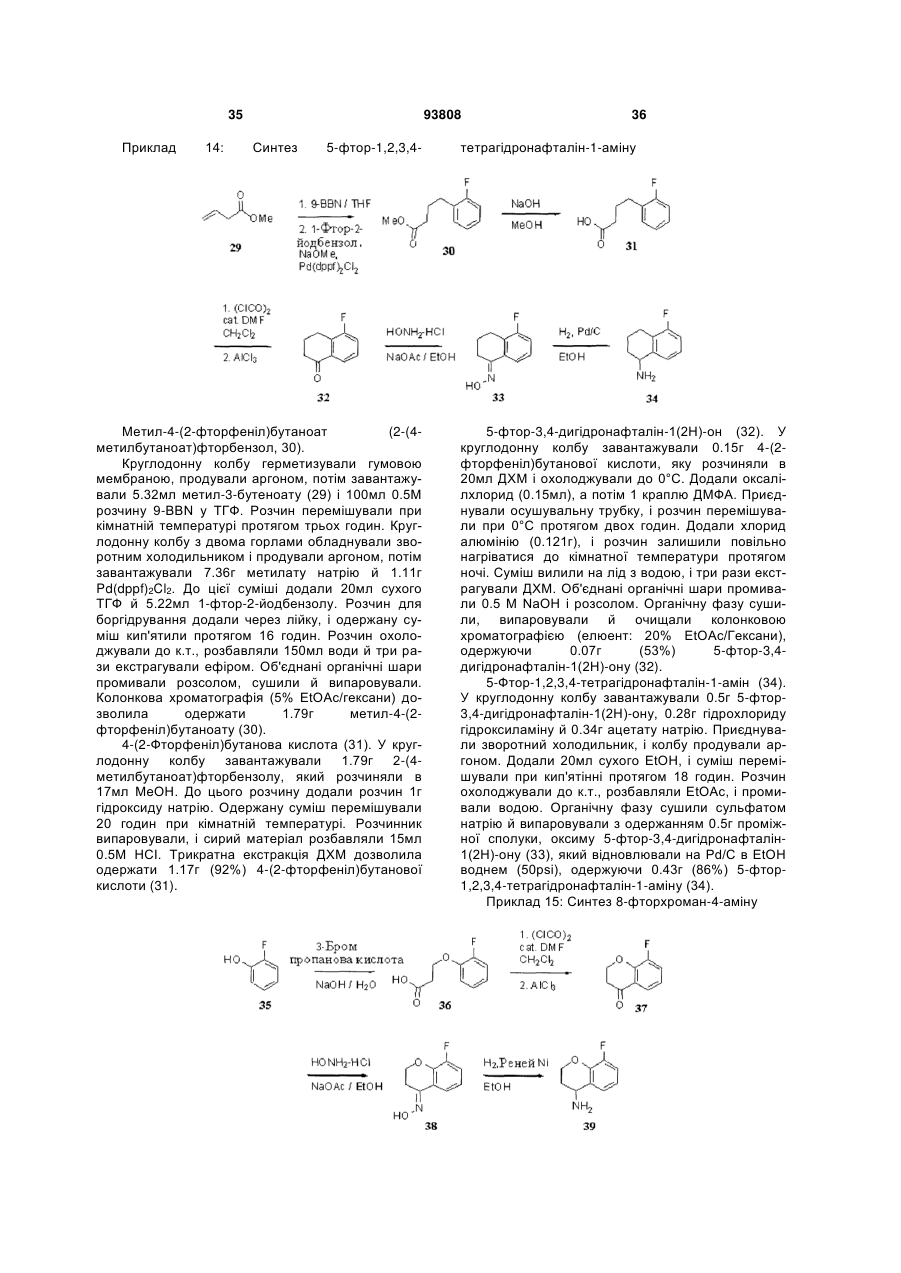
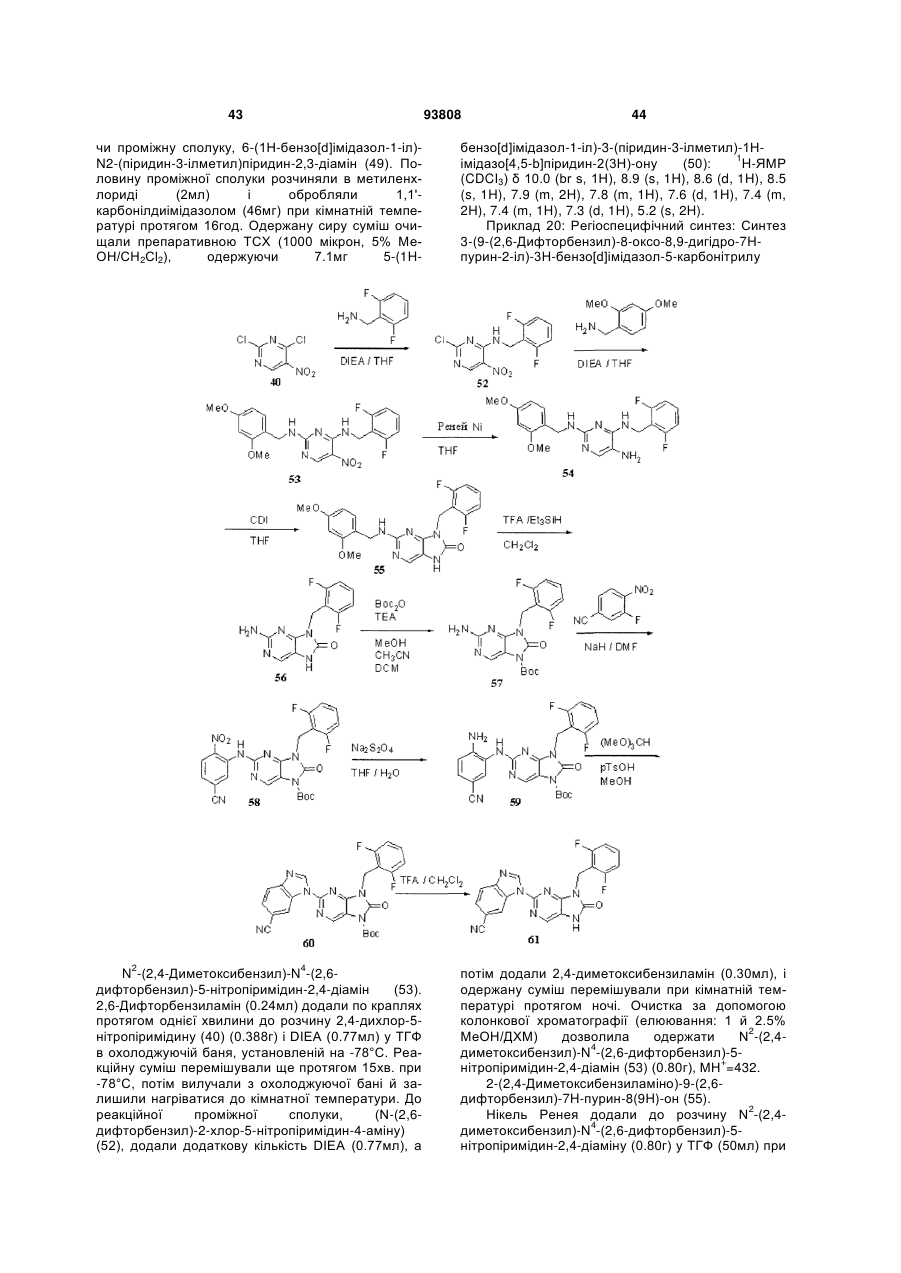
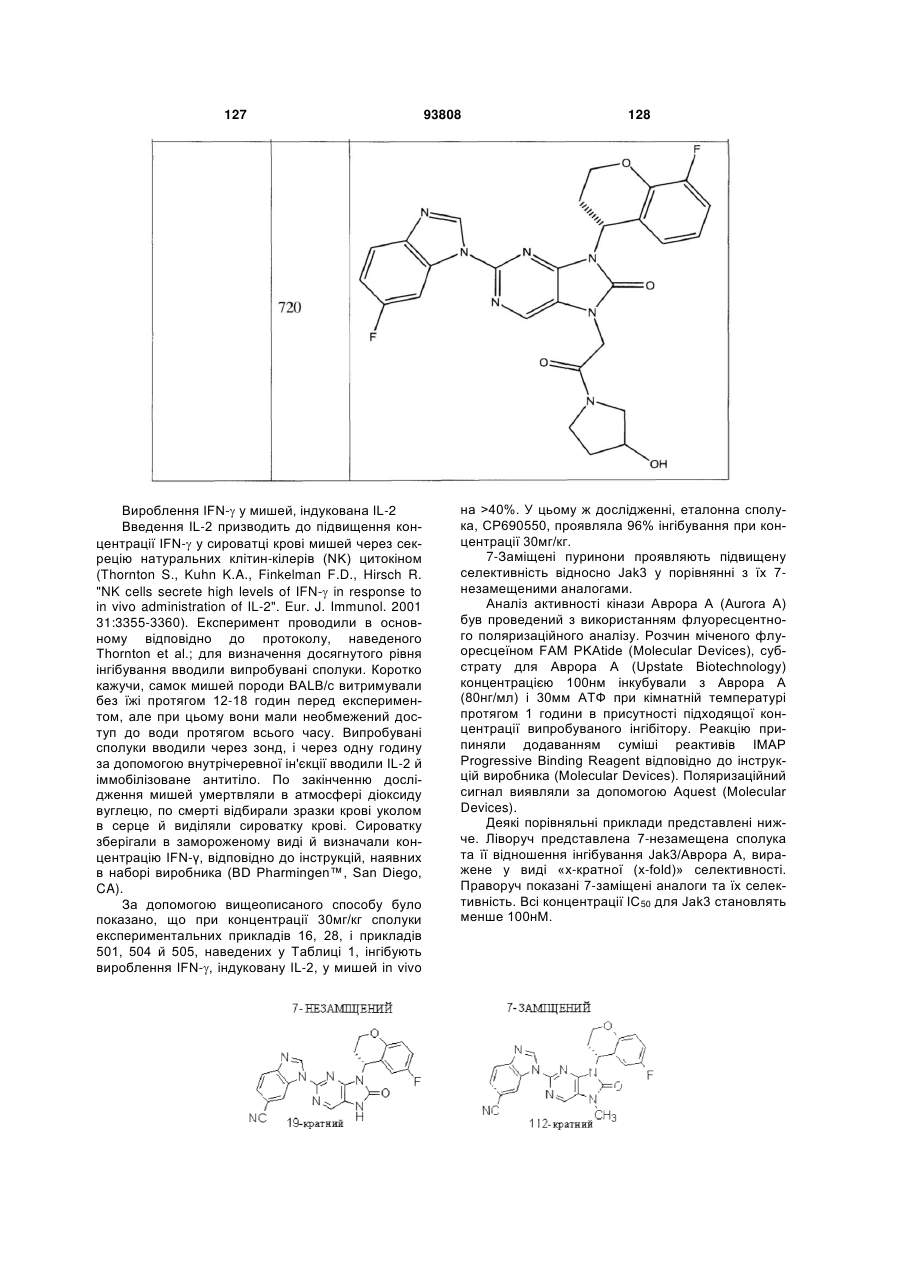
Текст
1. Сполука, яка відповідає Формулі III R4 N (CR2R3)y N N N O Q1 Q3 N Q2 2 (19) 1 3 93808 R4 N N N N . 4. Сполука за п. 2, що відповідає Формулі: R4 N (CR2R3)y N N N O N N . 5. Сполука за п. 1, що відповідає Формулі: R4 N (CR2R3)y N N N O Q3 X1 N N R1 R5 . 6. Сполука за п. 5, що відповідає Формулі: R4 N (CR2R3)y N N N O X1 N N R1 R5 . 7. Сполука за п. 5, що відповідає Формулі: R4 N (CR2R3)y N N N O N X1 N N R1 R5 . 8. Сполука за п. 1, що відповідає Формулі: R4 N (CR2R3)y N N N O Q3 X1 N X2 R1 R5 . 9. Сполука за п. 8, що відповідає Формулі: (CR2R3)y N O N R1 R5 . 10. Сполука за п. 8, що відповідає Формулі: R4 N (CR2R3)y N N N O N X1 N X2 R5 R1 N X1 X2 R5 R1 X2 N N O R4 N (CR2R3)y N N X2 4 R1 R5 . 11. Сполука за будь-яким із пп. 1-10, у якій Х1 й Х2 незалежно вибрані з групи, що включає атом водню, ціаногрупу, атоми хлору, фтору, метил, трифторметил і трифторметоксигрупу. 12. Сполука за будь-яким із пп. 1-10, у якій R1 являє собою Н. 13. Сполука за будь-яким із пп. 1-10, у якій, у дорівнює 1 або 2, і R2 й R3 являють собою атоми водню або метильні радикали. 14. Сполука за п. 13, у якій R4 вибрані із групи, що включає феніл, хінолін, піридин, піразин або їх заміщені аналоги. 15. Сполука за будь-яким із пп. 1-10, у якій у дорівнює нулю. 16. Сполука за п. 15, у якій R4 вибрані із групи, що включає циклопентил, циклогексил, феніл, індан, тетралін, піперидин, оксепан, бензоксепан, дигідроциклопентапіридин, тетрагідропіран, тетрагідрофуран, тетрагідроіндол, ізохінолін, тетрагідроізохінолін, хінолін, тетрагідрохінолін, хроман, піридин, піримідин, дигідропіран, дигідробензофуран, тетрагідробензофуран, тетрагідробензотіофен, фуран, дигідропірано[2,3-b]піридин, тетрагідрохіноксалін, тетрагідротіопіран (тіан), тіохроман (дигідробензотіїн) та їх заміщені аналоги. 17. Сполука за будь-яким із пп. 1-10, у якій (а) у дорівнює нулю, і R4 вибраний із групи, що включає циклогексил, тетралін, індан, оксепан, бензоксепан, дигідроциклопентапіридин, тетрагідропіран, тетрагідрохінолін, хроман, дигідробензофуран, тетрагідробензофуран, дигідропірано[2,3b]піридин і тетрагідрохіноксалін, кожен з яких може мати замісники, що являють собою гідроксигрупу, оксогрупу або атом галогену; або (b) у дорівнює 1 або 2, R2 й R3 являють собою атоми водню або метильні радикали, і R4 вибраний із групи, що включає феніл, піридин і піразин, кожен з яких може мати замісники, що являють собою атом галогену. 18. Сполука за п. 17, в якій у дорівнює 0, і R4 вибраний із хроман-4-ілу; 3,4-дигідронафталін-1(2H)он-4-ілу; 2,3-дигідроінден-1-он-4-ілу та їх фторзаміщених аналогів. 5 19. Сполука за п. 18, в якій R4 являє собою хроман-4-іл, і атом вуглець в 4 положенні молекули хроману знаходиться в (R)-конфігурації. 20. Сполука за п. 17, в якій у дорівнює 0, і R4 являє собою W A (CH2)p , у якій W являє собою СН2, С=О або О; р дорівнює 1, 2 або 3; А являє собою шестичленний гетероароматичний цикл, що містить 1 або 2 атоми азоту, або бензольний цикл, можливо заміщений одним або двома атомами фтору; хвиляста лінія означає точку приєднання до молекули пуринону. 21. Сполука за п. 20, в якій атом вуглецю, відмічений зірочкою, W (CH2)p * A знаходиться в (R)-конфігурації. 22. Сполука за п. 17, в якій у дорівнює 1, і R4 вибраний із групи, що включає дифторфеніл, фторфеніл, хлорфеніл, хлорфторфеніл, піридин-3-іл і піразин-3-іл. 23. Сполука за п. 17, в якій у дорівнює нулю, і R4 вибраний із групи, що включає тетрагідропіран-4іл, 4-гідроксициклогексил, 4-оксоциклогексил і оксепан-4-іл. 24. Сполука за п. 10, в якій Х1 й Х2 незалежно вибрані із групи, що включає атом водню, ціаногрупу, атоми хлору й фтору, і R1 являє собою Н. 25. Сполука за п. 24, в якій (a) у дорівнює нулю, і R4 вибрані із групи, що включає циклогексил, тетралін, індан, оксепан, бензоксепан, дигідроциклопентапіридин, тетрагідропіран, тетрагідрохінолін, хроман, дигідробензофуран, тетрагідробензофуран, дигідропірано[2,3b]піридин, тетрагідрохіноксалін, кожен з яких може мати замісники, що являють собою гідроксигрупу, оксогрупу або атом галогену; або (b) у дорівнює 1 або 2, R2 й R3 являють собою атоми водню або метильні радикали, і R4 вибрані з групи, що включає феніл, піридин і піразин, кожен з яких може мати замісники, що являють собою атом галогену. 26. Сполука за п. 25, в якій R5 являє собою (С1С6)алкіл, у якому (a) один або два фрагменти СН2 заміщені групою, вибраною з NH і N(алкілу); (b) один або два фрагменти СН2 заміщені О; (c) один або два фрагменти СН2 заміщені (С=О); (d) два СН2 заміщені групою СН=СН або С≡С; або (e) включають будь-яке хімічно стійке сполучення (а), (b) (с) і (d); і в яких від нуля до трьох атомів водню заміщені групами, вибраними з наступних замісників: 93808 6 (а) атома галогену, гідроксигрупи, ціаногрупи, (нижчий алкіл)сульфонілу, (нижчий алкіл)сульфонілоксигрупи, аміногрупи, (нижчий алкіл)аміногрупи, ди(нижчий алкіл)аміногрупи, алкоксіаміногрупи, сульфоніламіногрупи, ациламіногрупи, ариламіногрупи, (нижчий алкокси)групи; (b) гетероциклілу або гетероциклілу, що має від одного до трьох замісників, вибраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу і алкоксикарбонілу; (c) фенілу або фенілу, що має від одного до трьох замісників, вибраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу, ациламіногрупи, ціаногрупи, карбоксигрупи, алкоксикарбонілу, галогеноалкілу та гетероциклілу; і (d) гетероарилу або заміщеного гетероарилу, що має від одного до трьох замісників, вибраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу і алкоксикарбонілу. 27. Сполука за п. 26, в якій у дорівнює 0, і R4 являє собою W (CH2)p * A , у якій атом вуглецю, відмічений зірочкою, знаходиться в (R)-конфігурації; W являє собою СН2, С=О або О; р дорівнює 1, 2 або 3; А являє собою шестичленний гетероароматичний цикл, що містить 1 або 2 атоми азоту, або бензольний цикл, можливо заміщений одним або двома атомами фтору; і хвиляста лінія означає точку приєднання до молекули пуринону. 28. Сполука за п. 27, в якій Х1 являє собою атом водню, Х2 являє собою замісник у положенні 6 бензімідазолу, і Х2 вибраний з атома водню, фтору чи ціаногрупи. 29. Сполука за будь-яким із пп. 1-10, у якій R5 являє собою (С1-С6)алкіл або (С1-С6)фторалкіл. 30. Сполука за п. 29, у якій у дорівнює 0, R4 являє собою W (CH2)p * A , в якій атом вуглецю, відмічений зірочкою, знаходиться в (R)-конфігурації; W являє собою СН2, С=О або О; р дорівнює 1, 2 або 3; А являє собою шестичленний гетероароматичний цикл, що містить 1 або 2 атоми азоту, або бензольний цикл, можливо заміщений одним або двома атомами фтору; хвиляста лінія означає точку приєднання до молекули пуринону. 31. Сполука за будь-яким із пп. 1-10, в якій R5 являє собою (С1-С6)алкіл, і в якій від нуля до трьох атомів водню заміщені групами, вибраними з на 7 93808 ступних замісників: гідроксигрупи, карбоксигрупи, ціаногрупи, (нижчий алкіл)сульфонілу (нижчий алкіл)сульфонілоксигрупи, аміногрупи, (нижчий алкіл)аміногрупи, ди(нижчий алкіл)аміногрупи, алкоксіаміногрупи, сульфоніламіногрупи, ациламіногрупи, ариламіногрупи й (нижчий алкокси)групи. 32. Сполука за п. 31, в якій у дорівнює 0, і R4 являє собою W (CH2)p * A , в якій атом вуглецю, відмічений зірочкою, знаходиться в (R)-конфігурації; W являє собою СН2, С=О або О; р дорівнює 1, 2 або 3; А являє собою шестичленний гетероароматичний цикл, що містить 1 або 2 атоми азоту, або бензольний цикл, можливо заміщений одним або двома атомами фтору; хвиляста лінія означає точку приєднання до молекули пуринону. 33. Фармацевтична композиція, що містить фармацевтично прийнятний носій і терапевтично ефективну кількість щонайменше однієї сполуки за будь-яким із пп. 1-32. 34. Спосіб лікування порушення, яке залежить від інгібування Янус-кінази 3, що включає введення пацієнтові, який потребує такого лікування, терапевтично ефективної кількості сполуки, що відповідає Формулі III R4 N (CR2R3)y N N N O Q1 Q3 N Q2 R1 R5 , III у зазначеній сполуці Q1 й Q2 незалежно вибрані із групи, що складається з СХ1, СХ2 і атома азоту, за умови, що Q1 й Q2 одночасно не являють собою атоми азоту; С3 являє собою N або СН; X1 й Х2 незалежно вибрані із групи, що складається з атома водню, (С1-С6)алкілу, ціаногрупи, атома галогену, галогено(С1-С6)алкілу, гідроксильної групи, (С1-С6)алкоксигрупи; галогено(С1С6)алкоксигрупи й нітрогрупи; R1 вибрані із групи, що складається з атома водню і (С1-С6)алкілу; у дорівнює нулю або цілому числу, вибраному з 1, 2 й 3; для кожного фрагмента (CR2R3) R2 й R3 незалежно вибрані з групи, що складається з атома водню і (С1-С6)алкілу; R4 вибраний із групи, що складається з алкілу, гетероциклілу, арилу, гетероарилу, заміщеного алкілу, заміщеного гетероциклілу, заміщеного арилу, заміщеного гетероарилу; 8 R5 вибраний із групи, що складається з алкілу, гетероциклілу, замішеного гетероциклілу і (С1С6)алкілу, в яких (a) один або два фрагменти СН2 заміщені групою, вибраною з NH і N(алкілу); (b) один або два фрагменти СН2 заміщені О; (c) один або два фрагменти СН2 заміщені (С=О); (d) два CH2 заміщені групою СН=СН або С≡С; або (e) включають будь-яке хімічно стійке сполучення (а), (b), (с) і (d); і в яких від нуля до трьох атомів водню заміщені групами, вибраними з наступних замісників: (a) атома галогену, гідроксигрупи, ціаногрупи, (нижчий алкіл)сульфонілу, (нижчий алкіл)сульфонілоксигрупи, аміногрупи, (нижчий алкіл)аміногрупи, ди(нижчий алкіл)аміногрупи, алкоксіаміногрупи, сульфоніламіногрупи, ациламіногрупи, ариламіногрупи, (нижчий алкокси)групи; (b) гетероциклілу або гетероциклілу, що має від одного до трьох замісників, вибраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу і алкоксикарбонілу; (c) фенілу або фенілу, що має від одного до трьох замісників, вибраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу, ациламіногрупи, ціаногрупи, карбоксигрупи, алкоксикарбонілу, галогеноалкілу та гетероциклілу; (d) гетероарилу або заміщеного гетероарилу, що має від одного до трьох замісників, вибраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу і алкоксикарбонілу. 35. Спосіб лікування порушення, яке залежить від інгібування Янус-кінази 3, який включає введення пацієнтові, що потребує такого лікування, терапевтично ефективної кількості сполуки, яка відповідає Формулі III R4 N (CR2R3)y N N N O Q1 Q3 N Q2 R1 R5 , III у зазначеній сполуці Q1 й Q2 незалежно вибрані із групи, що складається з СХ1, СХ2 і атома азоту, за умови, що Q1 й Q2 одночасно не являють собою атоми азоту; С3 являє собою N або СН; Х1 й Х2 незалежно вибрані із групи, що складається з атома водню, ціаногрупи, атома фтору або хлору; R1 являє собою атом водню; у дорівнює нулю або цілому числу, вибраному з 1, 2 й 3; для кожного фрагмента (CR2R3) R2 й R3 незалежно вибрані із групи, що складається з атома водню і (С1-С6)алкілу; R4 вибраний із групи, що складається з алкілу, гетероциклілу, арилу, гетероарилу, заміщеного алкілу, заміщеного гетероциклілу, заміщеного арилу, заміщеного гетероарилу; 9 R5 вибраний із групи, що складається з алкілу, гетероциклілу, заміщеного гетероциклілу і (С1С6)алкілу, в яких (a) один або два фрагменти СН2 заміщені групою, вибраною з NH і N(алкілу); (b) один або два фрагменти СН2 заміщені О; (c) один або два фрагменти СН2 заміщені (С=О); (d) два СН2 заміщені групою СН=СН або С≡С; або (e) включають будь-яке хімічно стійке сполучення (а), (b), (с) і (d); в яких від нуля до трьох атомів водню заміщені групами, вибраними з наступних замісників: (a) атома галогену, гідроксигрупи, ціаногрупи, (нижчий алкіл)сульфонілу, (нижчий алкіл)сульфонілоксигрупи, аміногрупи, (нижчий алкіл)аіміногрупи, ди(нижчий алкіл)аміногрупи, алкоксіаміногрупи, сульфоніламіногрупи, ациламіногрупи, ариламіногрупи, (нижчий алкокси)групи; (b) гетероциклілу або гетероциклілу, що має від одного до трьох замісників, вибраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу і алкоксикарбонілу; (c) фенілу або фенілу, що має від одного до трьох замісників, вибраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу, ациламіногрупи, ціаногрупи, карбоксигрупи, алкоксикарбонілу, галогеноалкілу й гетероциклілу; (d) гетероарилу або заміщеного гетероарилу, що має від одного до трьох замісників, вибраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу й алкоксикарбонілу. 36. Спосіб за будь-яким з п. 34 або п. 35, у якому зазначене порушення вибране із групи, що включає аутоімунне захворювання, запальне захворювання, захворювання, опосередковуване тучними клітинами, гематологічне злоякісне новоутворення й відторгнення пересадженого органа. 37. Спосіб за п. 36, в якому зазначене порушення являє собою відторгнення трансплантата кісткового мозку. 38. Спосіб за п. 36, в якому зазначене гематологічне злоякісне новоутворення вибране з групи, що включає лейкемію й лімфому. 39. Спосіб за п. 36, в якому зазначене порушення являє собою астму. 40. Спосіб за п. 36, в якому зазначене аутоімунне захворювання вибране із групи, що включає органоспецифічне й неорганоспецифічне аутоімунне захворювання. 41. Спосіб за п. 36, в якому зазначене порушення являє собою сухий кератокон'юнктивіт. 42. Спосіб за п. 36, в якому зазначене гематологічне злоякісне новоутворення являє собою хронічну мієлогенну лейкемію. 43. Спосіб за будь-яким з п. 34 або п. 35, в якому зазначене порушення вибране із групи, що включає лейкемічну форму лімфоми Т-клітин шкірних покривів і гостру лімфобластичну лейкемію. 44. Спосіб лікування порушення, вибраного із групи, що включає аутоімунне захворювання, запальні захворювання, захворювання, опосередковувані тучними клітинами, гематологічне злоякісне новоутворення і відторгнення пересадженого органа, що включає введення пацієнтові, який потребує 93808 10 такого лікування, терапевтично ефективної кількості сполуки, яка відповідає Формулі III R4 N (CR2R3)y N N N O Q1 Q3 N Q2 R1 R5 , III у якій Q1 й Q2 незалежно вибрані із групи, що складається з СХ1, СХ2 і атома азоту, за умови, що Q1 й Q2 одночасно не являють собою атоми азоту; Q3 являє собою N або СН; X1 й Х2 незалежно вибрані із групи, що складається з атома водню, (С1-С6)алкілу, ціаногрупи, атома галогену, галогено(С1-С6)алкілу, гідроксильної групи, (С1-С6)алкоксигрупи; галогено(С1С6)алкоксигрупи і нітрогрупи; R1 вибраний із групи, що складається з атома водню і (С1-С6)алкілу; у дорівнює нулю або цілому числу, вибраному з 1, 2 й 3; для кожного фрагмента (CR2R3) R2 й R3 незалежно вибрані із групи, що складається з атома водню і (С1-С6)алкілу; R4 вибраний із групи, що складається з алкілу, гетероциклілу, арилу, гетероарилу, заміщеного алкілу, заміщеного гетероциклілу, заміщеного арилу, заміщеного гетероарилу; R5 вибраний із групи, що складається з алкілу, гетероциклілу, гетероциклілу та (C1-С6)алкілу, у яких (a) один або два фрагменти СН2 заміщені групою, вибраною з NH і N(алкілу); (b) один або два фрагменти СН2 заміщені О; (c) один або два фрагменти СН2 заміщені (С=О); (d) два СН2 заміщені групою СН=СН або С≡С; або (e) включають будь-яке хімічно стійке сполучення (а), (b) (с) і (d); і в яких від нуля до трьох атомів водню заміщені групами, вибраними з наступних замісників: (a) атома галогену, гідроксигрупи, ціаногрупи, (нижчий алкіл)сульфонілу, (нижчий алкіл)сульфонілоксигрупи, аміногрупи, (нижчий алкіл)аміногрупи, ди(нижчий алкіл)аміногрупи, алкоксіаміногрупи, сульфоніламіногрупи, ациламіногрупи, ариламіногрупи, (нижчий алкокси)групи; (b) гетероциклілу або гетероциклілу, що має від одного до трьох замісників, вибраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу, алкоксикарбонілу; (c) фенілу або фенілу, що має від одного до трьох замісників, вибраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу, ациламіногрупи, ціаногрупи, карбоксигрупи, алкоксикарбонілу, галогеноалкілу чи гетероциклілу; (d) гетероарилу або заміщеного гетероарилу, що має від одного до трьох замісників, вибраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу чи алкоксикарбонілу. 11 Даний винахід відноситься до похідних пуринону, що застосовуються як імунодeпресанти. Імуносупресія (придушення імунітету) являє собою важливий клінічний підхід до лікування аутоімунних захворювань й запобігання відторгнення органів і тканин. Незважаючи на клінічну ефективність, доступні в цей час імунодепресанти, що включають азатіоприн, циклоспорин і такролімус, часто викликають небажані побічні ефекти, включаючи ниркову токсичність, гіпертонію, порушення з боку шлунково-кишкового тракту й запалення ясен. Відомо, що як імунодепресанти можна застосовувати інгібітори гирозинкінази Jak3 (див. патент США 6313129). Члени класу Янус-кіназ (Jak), що включають нерецепторні внутрішньоклітинні іирозинкінази, являють собою компоненти цитокінової передачі сигналу. На цей момент були ідентифіковані чотири члени цього класу: Jak1, Jak2, Jak3 й Tyk2. Кіназа Jak3 відіграє ключову роль у механізмі внутрішньоклітинної сигналізації, опосередковуваної цитокіновими рецепторами. При зв'язуванні цитокінів з їх рецепторами відбувається активація кіназ Jak і фосфорилювання рецепторів, при якому утворюються ділянки для вбудовування інших сигнальних молекул, зокрема, членів класу переносників сигналу й активаторів транскрипції STAT (signal transducer and activator of transcription). У той час як експресія Jak1, Jak2 й Tyk2 є відносно константною, експресія Jak3 регулюється в часі й просторі. Jak3 в основному експресується в клітинах гематопоетичних ліній; вона конститутивно експресується в клітинах-природних кіллерах (NKклітинах) й тимоцитах, і її вироблення може бути індуковане в Т-клітинах, В-клітинах і мієлоїдних клітинах (огляд представлений у публікації Ortmann, et al., 1999 та Yamaoka, et al., 2004). Jak3 також експресується в тучних клітинах, і її ферментативна активність підсилюється при утворенні зшивок Ig рецептор/Fе є RI (Malaviya and Uckun, 1999). Було показано, що специфічний інгібітор Jak3, CP-690550, активний при пероральному введенні, діє як ефективний імунодепресант і продовжує життя тварин при пересадці серця у мишей і при пересадці нирок у мавп (Changelian, et al., 2003). Крім того, порушення функції Jak3 зв'язують із лейкемічною формою шкірної лімфоми Т-клітин (ретикульоз Сезарі) і гострою лімфобластичною лейкемією (ГЛЛ), яка є найбільш частою формою рака у дітей. Ідентифікація інгібіторів Jak3 забезпечує основу для нових клінічних підходів до лікування лейкемії й лімфом різних типів (огляд представлений в публікації Uckun, et al, 2005). Є відомості про те, що дві похідні диметоксихіназоліну, WHI-P131 (JANEX-1) і WHI-P154 (JANEX-2), є селективними інгібіторами Jak3 у лейкозних клітинах (Sudbeck et al., 1999). Також було показано, що Jak3 бере участь у розвитку алергійних реакцій, опосередковуваних тучними клітинами, і запальних захворювань, а 93808 12 також служить мішенню при таких станах, як астма й анафілаксія. Таким чином, сполуки, які інгібують Jak3, можна застосовувати при таких станах, як лейкемія й лімфома, відторгнення трансплантатів органів і кісткового мозку, алергійні реакції, опосередковувані тучними клітинами, а також запальні захворювання й порушення. Було виявлено, що сполуки, які відповідають загальній Формулі III, являють собою ефективні й селективні інгібітори Jak3: III у зазначених сполуках, Q1 й Q2 незалежно обрані з групи, що складається з СХ1, СХ2 і атома азоту, за умови, що Q1 й Q2 одночасно не являють собою атоми азоту; Q3 являє собою N або СН; Χ1 й Х2 незалежно обрані з групи, що складається з атома водню, (С1-С6)алкілу, ціаногрупи, атома галогену, галогено(С1-С6)алкілу, гідроксильної групи, (С1-С6)алкоксигрупи; галогено(С1С6)алкоксигрупи й нітрогрупи; R1 обраний з групи, що складається з атома водню й (С1-С6)алкілу; у дорівнює нулю або цілому числу, обраному з 1, 2 і 3; для кожного фрагмента (CR2R3) R2 й R3 незалежно обрані з групи, що складається з атома водню і (С1-С6)алкілу; R4 обраний із групи, що складається з алкілу, гетероциклілу, арилу, гетероарилу, заміщеного алкілу, заміщеного гетероциклілу, заміщеного арилу, заміщеного гетероарилу; і R5 обраний із групи, що складається з алкілу, гетероциклілу, заміщеного гетероциклілу й (С1С6)алкілу, в яких (a) один або два фрагменти СH2 заміщені групою, обраною з NH й ІЧ(алкілу); (b) один або два фрагменти СН2 заміщені О; (c) один або два фрагменти СН2 заміщені (С=О); (d) два СН2 заміщені групою СН=СН або СС; або (e) включають будь-яке хімічно стійке сполучення (а), (b) (с) і (d); і в яких від нуля до трьох атомів водню заміщені групами, обраними з наступних замісників: (a) атома галогену, гідроксигрупи, ціаногрупи, (нижчий алкіл)сульфонілу, (нижчий алкіл)сульфонілоксигрупи, аміногрупи, (нижчий алкіл)аміногрупи, ди(нижчий алкіл)аміногрупи, алкоксиаміногрупи, сульфоніламіногрупи, 13 ациламіногрупи, ариламіногрупи, (нижчий алкокси)групи; (b) гетероциклілу й гетероциклілу, що має від одного до трьох замісників, обраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу й алкоксикарбонілу; (c) фенілу й фенілу, що має від одного до трьох замісників, обраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу, ациламіногрупи, ціаногрупи, карбоксигрупи, алкоксикарбонілу, галогеноалкілу й гетероциклілу; і (d) гетероарилу й заміщеного гетероарилу, що має від одного до трьох замісників, обраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу й алкоксикарбонілу. Члени зазначених класів сполук придатні для інгібування активності Jak3, і як такі, можуть бути застосовані в тих випадках, у яких необхідне клінічне придушення імунітету й при лікуванні гематологічних ракових захворювань. Зазначені сполуки більш селективні відносно Jak3, ніж відносно щодо Аврора-А-кіназ, у порівнянні з відповідними сполуками, в яких R5 являє собою атом водню. Інший аспект даного винаходу відноситься до фармацевтичних композицій, що включають терапевтично ефективну кількість щонайменше однієї сполуки, яка відповідає загальній Формулі III, або фармацевтично прийнятної солі зазначеної сполуки; і фармацевтично прийнятний носій. Інший аспект даного винаходу відноситься до способу лікування захворювання, який включає зміну реакції відповіді, опосередковуваної тирозинкіназою Jak3. Зазначений спосіб включає здійснення контакту між Jak3 і щонайменше однією сполукою, що відповідає загальній Формулі III. Інший аспект даного винаходу відноситься до способу придушення імунної системи пацієнта, який потребує такого впливу, що включає введення пацієнтові терапевтично ефективної кількості щонайменше однієї сполуки, яка відповідає загальній Формулі III. Ще один аспект даного винаходу відноситься до способу лікування захворювання або порушення, обраного з групи, що включає: аутоімунне захворювання, запальне захворювання, захворювання, опосередковуване тучними клітинами, гематологічне злоякісне новоутворення і відторгнення пересадженого органа у пацієнта, який потребує такого лікування, що включає введення пацієнтові терапевтично ефективної кількості щонайменше однієї сполуки, яка відповідає загальній Формулі III. Придушення активності імунної системи бажане для запобігання або лікування відторгнення тканини або органа після проведення операції трансплантації і для запобігання й лікування захворювань і порушень, що викликаються порушеннями активності імунної системи, зокрема, 93808 14 аутоімунних порушень і захворювань. Приклади аутоімунних порушень включають: реакцію «трансплантат проти хазяїна» (ТПХ), інсулінозалежний діабет (Типу І), аутоімунний тиреоїдит (тиреоїдит Хашимото) і хвороба Грейвса (дифузійний токсичний зоб), перніціозну анемію, хворобу Адісона, хронічний активний гепатит, хворобу Крона, виразковий коліт, ревматоїдний артрит, розсіяний склероз, системний еритематозний вовчак, псоріаз, склеродермію й міастенію gravis. Сполуки згідно із даним винаходом, придатні для запобігання й лікування захворювань і порушень, пов'язаних з алергійними реакціями, опосередковуваними гучними клітинами, і запалень, наприклад, сухого кератокон'юнктивіту. Інші показання, при яких можуть бути використані інгібітори Jak3, включають лейкемії й лімфоми. Визначення замісників вводяться один раз у міру позначення відповідних замісників і далі використовуються без змін протягом всієї специфікації. Перший аспект винаходу відноситься до пуринонів й імідазопіридинонів, що відповідають загальній Формулі III: III Члени класу III зручно розділяти на підкласи на основі природи Q. Якщо Q1 являє собою азот й Q2 являє собою вуглець, то сполуки відносяться до підкласу пуринонів й імідазо[4,5-b]піридинонів, до яких приєднаний імідазо[4,5-с]піридин. Якщо Q1 являє собою вуглець і Q2 являє собою азот, то сполуки відносяться до підкласу пуринонів й імідазо[4,5-b]піридинонів, до яких приєднаний імідазо[5,4-с]піридин. Якщо як Q1, так і Q2 являють собою вуглець, то сполуки відносяться до підкласу пуринонів й імідазо[4,5-b]піридинонів, до яких приєднаний бензімідазол. Аналогічно, цей клас може бути підрозділений на підкласи на основі природи Q1. Якщо Q1 являє собою азот, то сполуки відносяться до підкласу пуринонів, до яких приєднаний або імідазо[4,5-с]піридин, або імідазо[5,4-с]піридин або бензімідазол. Якщо Q1 являє собою вуглець, то сполуки відносяться до підкласу імідазо[4,5b]піридинонів, до яких приєднаний або імідазо[4,5с]піридин, або імідазо[5,4-с]піридин або бензімідазол. Структури, що відповідають зазначеним підкласам, показані нижче: 15 У деяких прикладах реалізації, Х1 й Х2 обрані з групи, що включає атом водню, ціаногрупу, атоми хлору, фтору, трифторметил, трифторметоксигрупу й метил; в інших прикладах реалізації R1 являє собою Н. В одному з підрозділів, у дорівнює нулю; в іншому у дорівнює 1 або 2 і R2 й R3 являють собою атоми водню або метильні радикали. Приклади R4 включають: циклопентил, циклогексил, піперидин, оксепан, бензоксепан, дигідроциклопентапіридин, феніл, бензил, тетралін, індан, тетрагідропіран, тетрагідрофуран, тетрагідроіндол, ізохінолін, тетрагідроізохінолін, хінолін, тетрагідрохінолін, хроман, піридин, піримідин, піразин, дигідропіран, дигідробензофуран, тетрагідробензофуран, тетрагідробензотіофєн, фуран, дигідропірано[2,3-b]піридин (див. приклад, описаний нижче), тетрагідрохіноксалін, тетрагідротіопіран (тіан), тіохроман (дигідробензотиін) або будьякий інший з вищевказаних циклів, що має 1-3 додаткових замісника, наприклад, галоген, метил, метоксигрупу, трифторметил, ціаногрупу, гідроксигрупу, оксогрупу, оксид й ацетильний радикал. Додаткові приклади, у яких R4 являє собою алкіл або заміщений алкіл, включають підкласи, в яких R4 являє собою оксаалкіл (алкоксиалкіл). У деяких прикладах реалізації, в сполуках класу III у дорівнює 1 або 2; R2 й R3 являють собою атоми водню або метильні радикали, і R4 являє собою феніл, хінолін, піридин, піразин або заміщений феніл, хінолін, піридин або піразин. В інших 93808 16 прикладах реалізації сполук класу III, у дорівнює нулю і R4 являє собою циклопентил, циклогексил, феніл, індан, піперидин, оксепан, бензоксепан, дигідроциклопентапіридин, тетралін, тетрагідропіран, тетрагідрофуран, тетрагідроіндол, ізохінолін, тетрагідроізохінолін, хінолін, тетрагідрохінолін, хроман, піридин, піримідин, дигідропіран, дигідробензофуран, тетрагідробензофуран, тетрагідробензотіофeн, фуран, дигідропірано[2,3-b]піридин, тетрагідрохіноксалін, тетрагідротіопіран (тіан), тіохроман (дигідробензотиін) або заміщений цикл із перерахованих вище. В інших прикладах реалізації, (а) у дорівнює нулю, і R4 обраний з групи, що включає циклогексил, оксепан, тетралін, індан, дигідроциклопентапіридин, тетрагідропіран, тетрагідрохінолін, хроман, дигідробензофуран, тетрагідробензофуран, дигідропірано[2,3-b]піридин і тетрагідрохіноксалін, кожен з яких може мати замісники, що являють собою гідроксигрупу, оксогрупу або атом галогену; або (b) у дорівнює 1 або 2, R2 й R3 являють собою атоми водню або метильні радикали, і R4 обраний із групи, що включає феніл, піридин й піразин, кожен з яких може мати замісники, що являють собою атом галогену. Якщо у дорівнює нулю, то R4 може являти собою тетрагідропіран-4-іл, 4-гідроксициклогексил, 4оксоциклогексил, оксепан-4-іл, хроман-4-іл; 3,4дигідронафталін-1(2H)-он-4-іл; 2,3-дигідроінден-1он-4-іл та їх фторзамещені аналоги. Виявилося, що, незважаючи на те, що обидва енантіомера є 17 активними сполуками, сполуки, в яких атом вуглецю у 4 положенні молекули хроману знаходиться в (R)-конфігурації, мають більш високу ефективність. Деякі із сполук вищевказаних підкласів, в яких у дорівнює нулю, також можуть бути описані формулою, у якій R4 являє собою Відповідно із зазначеною формулою, W являє собою СН2, С=О або О; p дорівнює 1, 2 або 3; і А являє собою шестичленний гстероароматичний цикл, що містить 1 або 2 атоми азоту, або бензольний цикл, можливо заміщений одним або двома атомами фтору. Хвиляста лінія означає точку приєднання до молекули пуринону. Сполуки, в яких атом вуглецю відзначений зірочкою являють собою сполуки, для яких енантіомер, що має конфігурацію (R), виявляється більш ефективним у порівнянні з відповідним (S) енантіомером. Інші приклади здійснення включають сполуки, в яких у дорівнює 1, і R4 обраний з групи, що включає дифторфеніл, фторфеніл, хлорфеніл, хлорфторфеніл, піридин-3-іл і піразин-3-іл. У деяких прикладах реалізації сполук класу III, Х1 й Х2 обраний з групи, що включає атом водню, ціаногрупу, атоми хлору, фтору, трифторметил, трифторметоксигрупу й метил. У більш конкретних прикладах реалізації, Хі обраний з групи, що включає атом водню, ціаногрупу й атом фтору; Q1 й Q2 являють собою СХ1; Q3 являє собою N й R1 являє собою Н. У деяких прикладах реалізації, у дорівнює нулю, і R4 обраний з групи, що включає циклогексил, тетралін, індан, оксепан, дигідроциклопентапіридин, тетрагідропіран, тетрагідрохінолін, хроман, дигідробензофуран, тетрагідробензофуран, дигідропірано[2,3-b]піридин і тетрагідрохіноксалін, кожен з яких може мати замісники, що являють собою гідроксигрупу, оксогрупу або атом галогену. В інших прикладах реалізації у дорівнює 1 або 2, R2 й R3 являють собою атоми водню або метильні радикали, і R4 обраний з групи, що включає феніл, піридин і піразин, кожен з яких може мати замісники, що являють собою атом галогену. У деяких прикладах реалізації, R5 являє собою (С1-С6)алкіл, в якому були зроблені деякі заміщен 93808 18 ня й переміщення. В одному з прикладів здійснення, (а), один або два фрагменти СН2 можуть бути заміщені групою NH або ІЧ(алкіл). Зазначені залишки також називаються азаалкілами. Прикладом такого залишку R3 є CH2CH2CH2N(CH3)CH2CN, який може розглядатися як 5-ціанопентан, в якому одна з груп СН2 заміщена групою N(СН3). В одному з прикладів здійснення, (b), один або два фрагменти СН2 можуть бути заміщені О. Зазначені залишки також називаються оксаалкілами. В одному з прикладів здійснення, (с), один або два фрагменти СН2 можуть бути заміщені (С=О). Прикладом такого залишку R5 є який може розглядатися як 2-(4морфолініл)етил, в якому одна з груп СН2 заміщена групою C=O. В одному з прикладів здійснення, (d), дві групи СН2 заміщені групою СН=СН або СС. Прикладом такого залишку R5 є 3-метилбут2-ен-1-іл [-СН2СН=С(СН3)3]. Інший приклад здійснення включає (e), будь-яке хімічно стійке сполучення (а), (b) (с) і (d). Прикладом такого залишку R5 є -CH2CH2CH2NHC(=O)CH2CN, який може розглядатися як 6-ціаногексан, в якому одна з груп СН2 заміщена групою NH, і одна з груп СН2 заміщена групою С=О. Термін «хімічно стійкий» повинен бути зрозумілий фахівцям-хімікам. Він включає сполуки, які можуть бути виділені або очищені, і які не піддаються значному розкладанню при фізіологічному рН у водному розчині або піддаються розкладанню з такою швидкістю, що через 1 годину при кімнатній температурі залишається >99% вихідної сполуки. Від нуля до трьох атомів водню, присутніх у всіх зазначених сполуках можуть бути заміщені групами, обраними з наступних замісників: (a) атома галогену, гідроксигрупи, ціаногрупи, (нижчий алкіл)сульфонілу, (нижчий алкіл)сульфонілоксигрупи, аміногрупи, (нижчий алкіл)аміногрупи, ди(нижчий алкіл)аміногрупи, алкоксиаміногрупи, сульфоніламіногрупи, ациламіногрупи, ариламіногрупи, (нижчий алкокси)групи; (b) гетероциклілу й гетероциклілу, що має від одного до трьох замісників, обраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу й алкоксикарбонілу; (с) фенілу й фенілу, що має від одного до трьох замісників, обраних з атома галогену, гідроксигрупи, алкоксигрупи, алкілу, ациламіногрупи, ціаногрупи, карбоксигрупи, алкоксикарбонілу, галогеноалкілу й гетероциклілу. Нижче наведені деякі необмежуючі приклади вищевказаних замісників для (С1-С6)алкілу: 19 У деяких прикладах реалізації сполук класу III, Q1 являє собою СХ1, Q2 являє собою СХ2, Х1 являє собою водень, Х2 являє собою замісник в 6 положенні молекули бензімідазолу, і Х2 обраний з групи, що включає атом водню, фтору й ціаногрупу. Всі сполуки, що включаються в класи вищевказаних вихідних структур та їх підкласи, можна застосовувати як інгібітори Jak3. Визначення Для зручності й ясності деякі терміни, що застосовуються в даному описі, Прикладах і Формулі винаходу, описані нижче. Термін «алкіл» включає лінійні, розгалужені або циклічні вуглеводневі структури та їх сполучення. Нижчий алкіл означає алкільні групи, що включають від 1 до 6 атомів вуглецю. Приклади нижчих алкільних груп включають метил, етил, пропіл, ізопропіл, бутил, сім- і трет-бутил й подібні їм групи. Переважні алкільні групи являють собою групи, що містять С20 або менше; більш переважними є C1-C8-алкіли. Циклоалкіл являє собою окремий випадок алкілу й включає циклічні вуглеводневі групи, що включають від 3 до 8 атомів вуглецю. Приклади циклоалкільних груп включають циклопропіл, циклобутил, циклопентил, циклогексил, норборніл і подібні їм групи. 93808 20 С1-С20-вуглеводень включає алкіл, циклоалкіл, алкеніл, алкініл, арил та їх сполучення. Приклади таких алкільних груп включають фенетил, циклогексилметил, камфорил і нафтилетил. Термін «алкокси(група)» або «алкоксил» означає групу, яка включає від 1 до 8 атомів вуглецю, має нерозгалужену, розгалужену, циклічну конфігурацію, і сполучення таких груп, приєднану до вихідної структури через атом кисню. Приклади включають метокси-, етокси-, пропокси-, ізопропокси-, циклопропілокси-, циклогексилоксигрупу й подібні їм групи. Нижча алкоксигрупа означає групу, що містить від одного до чотирьох атомів вуглецю. Термін «оксаалкіл» має значення, зазвичай прийнятне для нього в даній галузі техніки [див.: публікацію Naming and Indexing of Chemical Substances for Chemical Abstracts, опубліковану Американським Хімічним Суспільством, ¶196, але без обмеження ¶127(а)], тобто він означає сполуки, в яких атом кисню приєднаний за допомогою одного зв'язку до сусідніх атомів (з утворенням простого ефірного зв'язку); цей термін не відноситься до атома кисню, приєднаного подвійним зв'язком, як, наприклад, в карбонільній групі. Термін «ацил» означає групу, що включає від 1 до 8 атомів вуглецю, яка має нерозгалужену, розгалужену, циклічну конфігурацію, насичену, ненасичену й ароматичну, а також їхні сполучення, приєднану до вихідної структури через карбонільну функціональну групу. Один або більше атомів вуглецю в ацильному залишку можуть бути заміщені атомом азоту, кисню або сірки за умови, що точка приєднання до вихідної структури залишається при карбонільній групі. Приклади таких груп 21 включають: ацетил, бензоїл, пропіоніл, ізобутирил, трет-бутоксикарбоніл, бензилоксикарбоніл і подібні їм групи. Нижчий ацил означає групу, що містить від одного до чотирьох атомів вуглецю. Терміни «арил» й «гетероарил» означають ароматичний або гетероароматичний цикл, який включає 5 або 6 членів, що містить 0-3 гетероатоми, обрані з О, N або S; біциклічну ароматичну або гетероароматичну циклічну систему, що включає 9 або 10 членів й містить 0-3 гетероатоми, обраних з О, N або S; або трициклічну ароматичну або гетероароматичну циклічну систему, що включає 13 або 14 членів й містить 0-3 гетероатоми, обрані з О, N або S. Ароматичні карбоциклічні цикли, що включають від 6 до 14 членів, включають, наприклад, бензол і нафталін, і відповідно до мети даного винаходу, конденсовані фрагменти, наприклад, тетрагідронафталін (тетралін), індан і флуорен, у яких один або більше циклів, але не обов'язково всі, є ароматичними. Ароматичні гетероциклічні цикли, що включають від 5 до 10 членів, включають, наприклад, імідазол, піридин, індол, тіофен, бензопіранон, тіазол, фуран, бензімідазол, хінолін, ізохінолін, хіноксалін, піримідин, піразин, тетразол і піразол. Термін «арилалкіл» означає замісник, в якому арильний залишок приєднаний до вихідної структури через алкіл. Приклади арилалкілів включають: бензил, фенетил і подібні їм фрагменти. Термін «гетероарилалкіл» означає замісник, у якому гетероарильний залишок приєднаний до вихідної структури через алкіл. Приклади гетероарилалкілів включають, наприклад, піридинілметил, піримідинілетил і подібні їм фрагменти. Термін «гетероцикл» означає циклоалкіл, у якому від одного до трьох атомів вуглецю заміщені гетероатомом, обраним з групи, що складається з Ν, Ο й S. Гетероатоми азоту й сірки можуть перебувати в окисленому стані. У деяких контекстах (відмінних від даного опису) термін «гетероцикл» може включати гетероарил; відповідно до мети даної заявки, гетероцикл являє собою насичений гетероцикл і не включає гетероарил. Якщо мається на увазі гетероарил, його називають конкретним чином. Приклади гетероциклів включають піролідин, морфолін, діоксан, тетрагідрофуран і подібні їм сполуки. Приклади гетероциклільних залишків додатково включають піперазиніл, 2оксопіперазиніл, 2-оксопіперидиніл, 2-оксопіролідиніл, 4-піперидиніл, піразолідиніл, оксазолідиніл, ізоксазолідиніл, тіазолідиніл, хінуклідиніл, тетрагідрофурил, тетрагідропіраніл, тіаморфолініл, тіаморфолінілсульфоксид і тіаморфолінілсульфон. Азотистий гетероцикл являє собою гетероцикл, що містить щонайменше один атом азоту в циклі; він може містити додаткові атоми азоту, а також інші гетероатоми. Заміщені алкіл, арил, циклоалкіл, гетероцикліл, гетероарил тощо означають алкіл, арил, циклоалкіл, гетероцикліл або гетероарил, в яких до трьох атомів Η у кожному залишку заміщені атомом галогену, галогеноалкілом, гідроксигрупою, нижчою алкоксигрупою, гідрокси(нижчим алкілом), карбоксигрупою, карбоалкоксигрупою (також названою алкоксикарбонілом), карбоксамідогругюю 93808 22 (також названою алкіламінокарбонілом), гетероциклілкарбонілом, ціаногрупою, карбонілом, нітрогрупою, аміногрупою, алкіламіногрупою, діалкіламіногрупою, (нижчою алкокси)аміногрупою, ариламінокарбонілом, меркаптогрупою, алкілтіогрупою, сульфоксидом, сульфоксидаміногрупою, сульфоном, ациламіногрупою, амідиногрупою, алкенілом, циклоалкілом, фенілом, заміщеним фенілом, бензилом, заміщеним бензилом, гетероарилом, феноксигрупою, бензолсульфонілом, бензилоксигрупою або гетероарилоксигрупою. Якщо вихідна структура являє собою гетероцикл, у якому можливе таке заміщення, то зазначений термін також включає оксиди, наприклад піридин-Nоксид, тіопірансульфоксид і тіопіран-8,8-діоксид. Як було зазначено вище, два атоми водню, приєднані до одного атома вуглецю, можуть бути заміщені карбонілом з утворенням оксопохідного. Слід зазначити, що залишки оксо-заміщених арилів включають тетралон (3,4-дигідронафталін-1(2H)он) й інданон (2,3-дигідроінден-1-он). Терміни «галоген» і «галогено» означають атоми фтору, хлору, брому або йоду. Деякі із сполук, розглянутих у даному описі, можуть містити один або більше асиметричних центрів і, таким чином, можуть утворювати енантіомери, діастереомери та інші стереоізомерні форми, які можуть бути визначені з точки зору абсолютної стереохімії як (R)- або (S)-конфігурації. Даний винахід включає всі такі можливі ізомери, а також їх рацемічні й оптично чисті форми. Оптично активні (R)- і (S)-ізомери можуть бути приготовлені з використанням хіральних синтонів або хіральних реагентів або розділені з використанням традиційних методик. Якщо сполуки, що розглянуті в даному описі, містять олефінові подвійні зв'язки або інші геометричні центри асиметрії, то, якщо не зазначене інше, вважають, що ці сполуки включають як Е-, так й Z-геометричні ізомери. Аналогічно, всі таутомерні форми також включені в даний винахід. Конфігурації будь-якого вуглець-вуглецевого подвійного зв'язку, які приводять у даному описі, позначені лише для зручності й не означають конкретної конфігурації; так, вуглець-вуглецевий подвійний зв'язок, довільним чином позначений в даному описі як «транс-зв'язок», може являти собою Ζ, Ε або суміш зазначених зв'язків у будь-якій пропорції. Використовувані в даному описі графічні представлення рацемічних, амбіскалемічних (ambiscalemic) і скалємічних (scalemic) або енантіомерно чистих сполук узяті з публікації Maehr J. Chem. Ed. 62, 114-120 (1985): суцільні й штрихові клиноподібні штрихи використані для позначення абсолютної конфігурації хірального елемента; хвилясті лінії вказують на відмову від позначення якого-небудь стереохімічного явища, яке може виникнути завдяки наявності зазначеного зв'язку; суцільні й штрихові жирні лінії являють собою геометричні позначення, що вказують на показувану відносну конфігурацію, але означають рацемічний характер; і клиноподібні позначення й пунктирні або штрихові лінії означають енантіомерно чисті сполуки, що мають невизначену абсолютну конфігурацію. 23 93808 24 Варто розуміти, що сполуки згідно із даним винаходом, можуть містити радіоактивні ізотопи, тобто, зазначені сполуки можуть містити один або більше атомів, атомна маса або масове число якого відрізняється від атомної маси або масового числа, що зазвичай зустрічається в природі. Радіоізотопи водню, вуглецю, фосфору, фтору, хлору та йоду включають 3Н, 14С, 35S, 18F, 36Сl й 125І, відповідно. Сполуки, які містять такі радіоізотопи та/або інші радіоізотопи інших атомів, включені в область, що захищається даним винаходом. Радіоізотопи тритій, тобто Н, і вуглець-14, тобто, С, особливо переважні, завдяки простоті їх приготування й легкості виявлення. Мічені радіоактивними ізотопами сполуки згідно із даним винаходом, можуть бути в загальному випадку приготовлені способами, добре відомими фахівцям у даній галузі техніки. Такі мічені радіоактивними ізотопами сполуки зручно готувати, виконуючи процедури, описані в Прикла дах, із заміною немічених радіоактивними ізотопами реагентів легко доступними реагентами, міченими радіоактивними ізотопами. Через високу спорідненість активного центру ензими JAK3, мічені радіоактивними ізотопами сполуки, згідно із даним винаходом, застосовані у визначеннях JAK3. В одному із прикладів здійснення, R4 являє собою гетероцикл. Гетероцикли, що згадуються у прикладах, являють собою моноциклічні й біциклічні гетероцикли або моноциклічні й біциклічні гетероцикли, що мають один або два замісника. Якщо у не являє собою нуль, то переважним частковим випадком гетероциклілу R4 є гетероарил. Приклади азотистих гетероциклів включають піперидин, піридин, піразин, піримідин, піридин, хінолін, ізохінолін, тетрагідрохінолін, тетрагідроізохінолін та їх різні заміщені похідні, наприклад, Кисневмісний гетероцикл являє собою гетероцикл, що містить у циклі щонайменше один атом кисню; він може містити й додаткові атоми кисню, а також інші гетероатоми. Приклади кисневмісних гетероциклів включають тетрагідропіран, хроман та їх різні заміщені похідні, наприклад: добре відома фахівцям у даній галузі техніки й використовується в контексті здійснення процесів, які включають проведення послідовних операцій обробки рядом реагентів. У цьому контексті термін «захисна група» означає групу, яку застосовують для маскування функціональної групи при проведенні операції способу, в якої, у протилежному випадку, ця функціональна група буде реагувати, але протікання такої реакції небажане. Захисна група запобігає протіканню реакції на зазначеному етапі, але може бути згодом вилучена з утворенням вихідної функціональної групи. Видалення або захисної групи або «зняття захисту» виконують після завершення реакції або реакцій, в яких може брати участь захищувана функціональна група. Так, якщо зазначена послідовність реагентів, як це зазначено нижче в способах, пропонованих згідно із даним винаходом, звичайний фахівець у даній галузі техніки може підібрати групи, придатні для використання як «захисні групи». Групи, що підходять для цієї мети розглянуті в стандартних керівництвах з хімії, наприклад, у публікації Protective Хімічний синтез У даному описі зустрічається термінологія, що відноситься до «захисту», «зняття захисту» й «захищених» функціональних груп. Така термінологія 25 Groups in Organic Synthesis, T.W. Greene [John Wiley & Sons, New York, 1991], включеній в даний опис за посиланням. Повний список абревіатур, застосовуваних фахівцями в органічній хімії, є в першому томі кожного випуску Journal of Organic Chemistry. Список, який зазвичай є в таблиці, озаглавленій "Standard List of Abbreviations", включений уданий опис за посиланням. Взагалі, сполуки, пропоновані згідно із даним винаходом, можуть бути приготовлені за допомогою способів, розглянутих у загальних схемах реакцій, наприклад, описаних нижче, або їх модифікацій, з використанням доступних вихідних матеріалів, реагентів і традиційних процедур синтезу. У цих реакціях також можна зробити модифікації, які самі по собі відомі, але не зазначені в даному описі. Вихідні матеріали, наприклад, у випадку підходящим чином заміщених похідних бензімідазолу, або комерційно доступні, або можуть бути синтезовані відповідно до наведених прикладів, або можуть бути одержані у відповідності з способами, добре відомими фахівцям у даній галузі техніки. Даний винахід також відноситься до фармацевтичних композицій, які включають як активні речовини сполуки, розглянуті в даному описі. Відповідно до даного опису, термін «фармацевтична композиція» означає препарат однієї або більше сполук, розглянутих у даному описі, або фізіологічно прийнятних солей або розчинів зазначених сполук, який включає інші хімічні компоненти, наприклад, фізіологічно підходящі носії й наповнювачі. Так, фармацевтичні композиції, застосовувані відповідно до даного винаходу, можуть бути приготовлені традиційним способом з використанням одного або більше фізіологічно прийнятних носіїв, які включають наповнювачі й допоміжні речовини, що сприяють включенню активних сполук у препарати, які можуть бути використані для фармацевтичних цілей. Вид конкретного препарату залежить від обраного способу введення препарату. Сполуки, які інгібують Jak-3, можуть бути включені у фармацевтичні композиції й введені пацієнтові-ссавцеві, наприклад, пацієнтові-людині в різних формах, адаптованих для обраного способу введення, тобто, перорального або парентерального, внутрішньовенного, внутрім'язового, топічного, трансдермального або підшкірного способу. Для перорального введення, сполуки можуть бути легко приготовлені змішуванням активних сполук із фармацевтично прийнятними носіями, добре відомими в даній галузі техніки. Такі носії дозволяють вводити сполуки, пропоновані згідно із даним винаходом, у таблетки, пігулки, драже, капсули, рідини, гелі, сиропи, суспензії й подібні до них суміші, призначені для перорального вживання пацієнтом. Фармакологічні препарати для перорального використання можуть бути виготовлені із застосуванням твердого наповнювача, з можливим розмелюванням одержаної суміші, і приготуванням суміші у виді гранул, за необхідності, після додавання підходящих допоміжних речовин, з ме 93808 26 тою одержання серцевини таблетки або драже. Зокрема, підходящі наповнювачі являють собою такі наповнювачі, як, наприклад, цукри, що включають лактозу, сахарозу, манніт або сорбіт; препарати целюлози, наприклад, маїсовий крохмаль, пшеничний крохмаль, рисовий крохмаль, картопляний крохмаль, желатин, трагакантову камедь, метилцелюлозу, гідроксипропілметилцелюлозу, натрій-карбометилцелюлозу; та/або фізіологічно прийнятні полімери, наприклад, полівінілпіролідон (ПВП). За необхідності в композиції можуть бути додані дезинтегруючі речовини, наприклад, поперечнозшитий полівінілпіролідон, агар або альгінова кислота або її сіль, наприклад, альгінат натрію. Крім того, при виготовленні препаратів може бути використане ентеросолюбільне покриття, оскільки може бути бажане запобігання впливу середовища шлунка на сполуки, пропоновані згідно із даним винаходом. Фармацевтичні композиції, які можуть бути введені перорально, включають щільно заповнювані капсули, виготовлені з желатину, а також м'які, герметизуємі капсули, виготовлені з желатину й пластифікатора, наприклад, гліцерину або сорбіту. Щільно заповнювані капсули можуть містити активні інгредієнти, змішані з наповнювачем, наприклад, лактозою, зв'язувальними речовинами, наприклад, крохмалями, ковзкими речовинами, наприклад, тальком або стеаратом магнію й, можливо, стабілізаторами. Активні сполуки, що знаходяться у м'яких капсулах, можуть бути розчинені або суспендовані в підходящих рідинах, наприклад, парафінових оліях, рідкому парафіні або рідких поліетиленгліколях. Крім того, у композицію можуть бути додані стабілізатори. Всі склади, застосовувані для перорального введення, повинні бути виготовлені у виді стандартних форм, що підходять для обраного способу введення. Для введення у виді ін'єкцій, сполуки, пропоновані згідно із даним винаходом, можуть бути приготовлені у виді водних розчинів, переважно, розчинені у фізіологічно сумісних буферних розчинах, наприклад, розчині Хенка або Рінгера (Hank або Ringer) або фізіологічному сольовому буферному розчині. Для трансмукозального й трансдермального введення в композицію можуть бути включені змочувальні речовини, придатні для проникнення через відповідний бар'єр. Такі змочувальні речовини, що включають, наприклад ДМСО або поліетиленгліколь, відомі в даній галузі техніки. Для введення за допомогою інгаляції, сполуки, застосовувані згідно із даним винаходом, зручно виготовляти у виді аерозольного спрею, що розпорошується з контейнера, який знаходиться під тиском, або розпилювача, що включає підходящі газивитискувачі, наприклад, дихлордифторметан, трихлорфторметан, дихлортетрафторетан або діоксид вуглецю. У випадку використання аерозолю, який знаходиться під тиском, стандартна лікарська доза може бути визначена при використанні клапана, що дозує певну кількість аерозолю. Капсули й картриджі, виготовлені, наприклад, з желатину, застосовувані в інгаляторі або апараті для вду 27 вання, можуть містити порошкову суміш сполуки й підходящої порошкової основи, наприклад, лактози або крохмалю. Фармацевтичні композиції, призначені для парентерального введення, включають водні розчини активних інгредієнтів, що знаходяться у водорозчинній формі. Крім того, суспензії активних сполук можуть бути приготовлені у виді підходящих для ін'єкцій суспензій у олії. Підходящі ліпофільні розчинники або носії включають жирні олії, наприклад, конопельну олію, або синтетичні ефіри жирних кислот, наприклад, етилолеат, тригліцериди або ліпосоми. Водні суспензії для ін'єкцій можуть містити речовини, які підвищують в'язкість суспензії, наприклад, натрійкарбоксиметилцелюлозу, сорбіт або декстран. Можливо, суспензія також може включати підходящі стабілізатори або речовини, які підвищують розчинність сполук й які дозволяють готувати розчини з високою концентрацією. Сполуки, пропоновані згідно із даним винаходом, також можуть бути виготовлені у виді композицій для перректального введення, наприклад, супозиторіїв або утримуючих клізм, у яких використовують, наприклад, традиційні основи для супозиторіїв, наприклад, кокосову олію або інші гліцериди. Залежно від тяжкості й реакції відповіді стану, що піддається лікуванню, препарати також можуть бути введені у виді однократного дозування композиції з уповільненим вивільненням, і при цьому курс лікування може становити від декількох діб до декількох тижнів або до повного видужання або до зменшення хворобливого стану. Кількість композиції, що вводиться, зрозуміло, залежить від багатьох факторів, що включають тип пацієнта, який піддається лікуванню, тяжкості захворювання, способу введення й рішення лікаря. Сполуки, пропоновані згідно із даним винаходом, можуть бути введені перорально або за допомогою ін'єкцій при дозуванні, що становить від 0,001 до 2500мг/кг на добу. Діапазон доз для дорослої людини звичайно становить від 0,005мг до 10г/добу. Таблетки або інші лікарські форми, що виготовляють у виді дискретних одиниць, можуть містити таку кількість сполуки, пропонованої згідно із даним винаходом, яка ефективна при дозуванні, що міститься в одній лікарській формі, або при введенні декількох лікарських форм, наприклад, що містять від 5мг до 500мг, зазвичай приблизно від 10мг до 200мг. Точна кількість сполуки, що вводиться пацієнтові, повинна бути визначена лікарем. Проте, застосовувана доза залежить від ряду факторів, що включають стать і вік пацієнта, тип порушення, що піддається лікуванню, і його тяжкість. Крім того, спосіб введення може варіюватися залежно від стану і його тяжкості. Відповідно до даного опису, і, як відомо фахівцям у даній галузі техніки, термін «сполука» включає солі, сольвати й комплекси включення зазначеної сполуки. Термін «сольват» означає сполуку, що відповідає Формулі І або II, у твердому стані, у якому молекули підходящого розчинника включені в кристалічну решітку сполуки. Розчинник, що підходить для терапевтичного введення, являє собою 93808 28 фізіологічно прийнятний при дозі, що вводиться, розчинник. Приклади розчинників, що підходять для терапевтичного введення, являють собою етанол і воду. Якщо розчинник являє собою воду, то сольват називають гідратом. Загалом, сольвати утворюються при розчиненні сполуки в підходящому розчиннику й виділенні сольвату при охолодженні або використанні протирозчинника. Сольват зазвичай сушать або піддають азеотропному розділенню у звичайних умовах. Комплекси включення описані в публікації Remington: The Science and Practice of Pharmacy 19th Ed. (1995) том І, стор. 176-177, включеній в даний опис за посиланням. Найбільш часто застосовувані комплекси включення містять комплекси включення із циклодекстринами, і всі комплекси із циклодекстринами, як природними, так і синтетичними, включені в галузь, визначену Формулою винаходу. Термін «фармацевтично прийнятна сіль» означає солі, приготовлені з фармацевтично прийнятних нетоксичних кислот або основ, що включають неорганічні кислоти й основи та органічні кислоти й основи. Якщо сполуки, пропоновані згідно із даним винаходом, являють собою основи, то солі можуть бути приготовлені з фармацевтично прийнятних нетоксичних неорганічних й органічних кислот. Підходящі фармацевтично прийнятні солі приєднання кислот до сполук, пропонованих згідно із даним винаходом, включають солі оцтової, бензолсульфонової (безилат), бензойної, камфорсульфонової, лимонної, етенсульфонової, фумарової, глюконової, глютамінової, бромоводневої, соляної, ізетіонової, молочної, малеїнової, яблучної, мигдальної, метансульфонової, слизевої, азотної, памоїнової, пантотенової, фосфорної, бурштинової, сірчаної, винної, п-толуолсульфонової кислоти й подібних їм кислот. Якщо зазначені сполуки містять кислотний бічний ланцюг, то підходящі фармацевтично прийнятні солі приєднання основ до сполук, пропонованих згідно із даним винаходом, включають солі металів, що включають солі алюмінію, кальцію, літію, магнію, калію, натрію й цинку, або органічні солі приєднання лізину, Ν,Ν'-дибензилетиленедіаміну, хлорпрокаїну, холіну, діетаноламіну, етилендіаміну, меглумін (Nметилглюкаміну) і прокаїну. Відповідно до даного опису, термін «запобігання» означає введення медикаменту заздалегідь ізметою попередження або пом'якшення нападу. Фахівці в галузі медицини (до яких адресований спосіб, обумовлений відповідно Формули даного винаходу) повинні розуміти, що термін «запобігати» НЕ є абсолютним терміном. У медицині цей термін означає профілактичне введення лікарського засобу з метою зниження ймовірності або серйозності стану, і даний термін використовується в даному описі відповідно цьому значенню. Крім того, варто розуміти, що інгредієнти, названі вище конкретним чином, і склади, пропоновані згідно із даним винаходом, можуть включати інші засоби, звичайно застосовувані в даній галузі техніки залежно від типу конкретного складу, наприклад засоби, застосовувані для перорального введення, можуть включати смакові добавки. 29 Композиції можуть бути укладені в пакувальний пристрій або дозуючий пристрій, що може містити одну або декілька стандартних лікарських форм, що містять активний інгредієнт. Приклади пакувальних пристроїв включають металеві або пластмасові фольги, наприклад, блістерну упаковку й розпилювач для інгаляції. До пакувального пристрою або дозуючого пристрою можуть бути прикладені інструкції для введенню лікарського засобу. Композиції, що включають сполуку, пропоновану згідно із даним винаходом, що приготовлені в сумісному фармацевтичному носії, також можуть бути поміщені в підходящий контейнер, оснащений інструкцією для лікування зазначеного стану. Показання Сполуки, пропоновані згідно із даним винаходом, можна застосовувати для інгібування активності Jak3 або для інгібування активності, опосередковуваної Jak3, і також можна застосовувати як імунодепресивні засоби при трансплантації органів і тканин, що включають трансплантацію кісткового мозку, і для лікування аутоімунних і запальних захворювань й ускладнень, що виникають при зазначених захворюваннях і станах. Лікуванню можуть піддаватися надгостре, гостре й хронічне відторгнення пересадженого органа. Надгостре відторгнення виникає протягом декількох хвилин після пересадки. Гостре відторгнення зазвичай відбувається протягом часу, що становить від шести до дванадцяти місяців, після пересадки. Надгостре й гостре відторгнення зазвичай оборотні, якщо їх піддають лікуванню імунодепресивними засобами. Хронічне відторгнення, що характеризується поступовим зниженням функціонування органу, все ще є великою проблемою для пацієнтів з пересадженими тканинами, оскільки воно може виникати в будь-який момент після проведення трансплантації. У даний час відомі приблизно 75 різних аутоімунних порушень, які можуть бути розділені на два типи: органоспецифічні (в основному, спрямовані на один орган) і неорганоспецифічні (такі, що впливають на різні органи) захворювання. Приклади органоспецифічних аутоімунних порушень включають: інсулінозалежний діабет (Типу І), який вражає підшлункову залозу, Аутоімунний тиреоїдит (тиреоїдит Хашімото) і хворобу Грейвса (дифузійний токсичний зоб), які вражають щитовидну залозу, перніціозну анемію, яка вражає шлунок, хворобу Кушінга й хворобу Аддісона, які вражають наднирки, хронічний активний гепатит, який вражає печінку; синдром полікістозу яєчників (СПКЯ) (синдром Штейна-Левенталя), глютеїнову хворобу, псоріаз, запальну хворобу кишечнику (ЗХК) і анкілозуючий спонділоартрит (хворобу Бехтерева). Приклади неорганоспецифічних аутоімунних порушень включають: ревматоїдний артрит, розсіяний склероз, системний червоний вовчак й міастенію гравіс. Діабет І типу виникає через селективну агресію аутореактивних Т-клітин відносно β-клітин, які 93808 30 виробляють інсулін і знаходяться в острівцях Лангерганса. Використання Jak3 як цільового матеріалу при лікуванні цього захворювання основане на тому відомому факті, що велика кількість цитокінів, які передають сигнал через шлях Jak, беруть участь в аутоімунному руйнуванні β-клітин, опосередковуваному Т-клітинами. Насправді, було показано, що інгібітор Jak3, JANEX-1 запобігає мимовільному розвитку аутоімунного діабету в моделі діабету І типу в мишей NOD. Реакція «трансплантат проти хазяїна» (ТПХ) являє собою патологічний стан, ініційований Тклітинами донора, який часто розвивається після пересадки алогенного (генетично відрізняється) кісткового мозку. Достатня кількість експериментальних і клінічних досліджень показала, що Тклітини донора є принциповими медіаторами й ефекторами реакції ТПХ. Jak3 відіграє ключову роль в індикуванні ТПХ, і було показано, що лікування інгібітором Jak3, JANEX-1, знижує тяжкість реакції ТПХ (огляд наведений у публікації Cetkovic-Cvrlje and Ucken, 2004). Експресія Jak3 й Jak3 тучними клітинами являє собою ключовий регулятор відповідних реакцій IgE, опосередковуваних тучними клітинами, що включають вироблення медіаторів запалення. Було показано, що Jak3 являє собою перспективний цільовий матеріал у розробці лікування алергійних реакцій, опосередковуваних тучними клітинами. Алергійні порушення, пов'язані з активацією тучних клітин, включають негайні реакції гіперчутливості типу І, наприклад, алергійний риніт (сінну лихоманку), алергійний уртикарний сип (кропивницю), ангіоневротичний набряк (набряк Квінке), алергійну астму й анафілаксію, тобто, «анафілактичний шок». Ці порушення лікують або запобігають за допомогою інгібування активності Jak3, наприклад, за допомогою введення інгібітору Jak3, пропонованого відповідно даному винаходу. Відповідно даному винаходу, інгібітори Jak3 можуть бути введені профілактично, тобто, до виникнення гострої алергійної реакції, або вони можуть бути введені після виникнення цієї реакція або в обох цих випадках. Запалення тканин й органів виникає при великій кількості різних порушень та захворювань, і, з деякими змінами, виникає через активацію рецепторів родини цитокінів. Необмежуючі приклади запальних порушень, пов'язаних з активацією Jak3, включають: запалення шкірних покривів через вплив випромінювання, астму, алергійне запалення й хронічне запалення. Інгібітори Jak3, пропоновані згідно із даним винаходом, також можуть бути використані для лікування деяких злоякісних захворювань, що включають ракові захворювання шкірних покривів і гематологічні злоякісні новоутворення, наприклад, лімфоми та лейкемії. Далі винахід буде описаний за допомогою наступних необмежуючих прикладів, які наведені для ілюстрації винаходу й не обмежують галузь його застосування. 31 93808 Приклади Нижченаведені скорочення й терміни мають вказане значення у всій специфікації: Ас= ацетил Вu= бутил ДХМ= дихлорметан=метиленхлорид=СН2СІ2 DEAD= діетилазодикарбоксилат DIC= диізопропілкарбодиімід DIEA= Ν,Ν-диізопропілетиламін ДМФА= Ν,Ν-диметилформамід ДМСО= диметилсульфоксид ЕА (ЕtOАс)= етилацетат ГХ= газова хроматографія год= години НОАс= оцтова кислота HOBt= гідроксибензотриазол Me= метил Pd(dppf)2Cl2= дихлор[1,1'біс(дифенілфосфінофероцен]паладій 32 Ph= PhOH= RT= sat'd= s-= t-= TBDMS= ТФОК= ТГФ= TMOF= TMS= tosyl= Trt= феніл фенол кімнатна температура (к.т.) насичений вторинний третинний т-бутилдиметилсиліл трифтороцтова кислота тетрагідрофуран триметилортоформат триметилсиліл р-толуолсульфоніл трифенілметил У Прикладах 1-15 описані синтези деяких попередників і проміжних сполук, пропонованих згідно із даним винаходом. Приклад 1. Синтез 3,4-діамінобензонітрилу Розчин 4-аміно-3-нітробензонітрилу (1) (3.0г) в етанолі (80мл) продували азотом протягом 5 хвилин. Додали паладій на вугіллі (10%, 300мг), і суміш насичували воднем. Суміш перемішували в атмосфері водню (балон) протягом семи годин. Суміш продували азотом і фільтрували через целіт. Фільтрат концентрували у вакуумі, одержуючи названу сполуку, 3,4-діамінобензонітрил (2). Пример 2: Синтез 3Н-бензо[d]імідазол-5карбонітрилу Суміш 3,4-діамінобензонітрилу (2) (1.0г) і (етоксиметилен)малононітрилу (1.4г) кип'ятили в 50мл ізопропілового спирту протягом 16год. Суміш концентрували у вакуумі, одержуючи названу сполуку, 3Н-бензо[d]імідазол-5-карбонітрил (3). Приклад 3: Синтез 6-(Трифторметокси)-1Нбензо[d]імідазол Розчин 4,5-дифтор-2-нітроаніліну (6) (1.0г) в 30мл ТГФ обробляли розчином, що включає 6г Na2S2O4 й 3г NaHCO3 в 30мл води. Після додавання водного розчину додали метанол (10мл), так щоб суміш залишалася гомогенною. Суміш перемішували протягом двох годин і потім розбавляли 100мл етилацетату й 100мл води. Органічний шар відокремлювали, і водний шар знову екстрагували 100мл метиленхлориду. Об'єднані органічні шари сушили над сульфатом натрію, фільтрували, і концентрували, одержуючи сиру проміжну сполуку 4,5-дифторбензол-1,2-діамін (7). Проміжну сполуку кип'ятили з (етоксиметилен)малононітрилом (1.1г) в 25мл ізопропілового спирту протягом 16год. Суміш концентрували у вакуумі і одержаний сирий продукт суспендували у воді й фільтрували. Осад промивали водою й сушили на повітрі, одержуючи 380мг 5,6-дифтор-1Н-бензо[d]імідазолу (8). Приклад 5: Синтез 5,6-диметокси-1Нбензо[d]імідазолу 6-(Трифторметокси)-1Н-бензо[d]імідазол (4) був приготовлений у два етапи з 2-нітро-4(трифторметокси)аніліну (5) відповідно процедур, застосовуваних для приготування 3Нбензо[d]імідазол-5-карбонітрилу (3) з 4-аміно-3нітробензонітрилу (1, приклади 1, 2). Приклад 4: Синтез 5,6-дифтор-1Нбензо[d]імідазолу Названа сполука, 5,6-диметокси-1Нбензо[d]імідазол (10) була приготовлена нагріванням дигідрохлориду 4,5-диметокси-1,2фенілендіаміну (9) в мурашиній кислоті при 220°С у мікрохвильовій печі з наступною концентрацією у вакуумі. 33 Приклад 6: Синтез 6-фтор-1Hбензо[d]імідазолу (11) і 6-(трифторметил)-1Нбензо[d]імідазолу (12). Названі сполуки були приготовлені відповідно до опису Патентної заявки США No.2004/0087601, заявленої винахідниками даного винаходу. Приклад 7: Бензімідазол (13), 5азабензімідазол (14), 6-хлор-5-фторбензімідазол (15) і 5-метилбензімідазол (16). Названі сполуки комерційно доступні. Приклад 8. Синтез первинного аміну, піразин2-ілметанаміну Каталізатор нікеля Ренея обережно промивали ТГФ і метанолом, так, щоб при цьому каталізатор залишався вологим. Маса вологого каталізатора після промивання склала 2.5г. Цей матеріал додали до розчину піразинкарбонітрилу (17) (3.0г) в 7N метанольному розчині аміаку (120мл). Суміш струшували при тиску 50p.s.i. в атмосфері водню протягом 1.5 годин. Суміш фільтрували, і фільтрат концентрували у вакуумі, одержуючи сиру названу сполуку. Очистку проводили перетворенням сирого аміну в трет-бутилкарбамат під дією надлишку ди-трет-бутилдикарбонату в метиленхлориді. Колонкова хроматографія (70:27:3 гексани:етилацетат:метанол) дозволила одержати 0.50г чистого трет-бутилпіразин-2-ілметилкарбамату. Чистий піразин-2-ілметанамін (18) був одержаний у виді солі ТФОК при знятті захисту з карбамату під дією 1:1 ТФОК / СН2СІ2. Приклад 9: Синтез 3-амінометил-2фторпіридин У круглодонну колбу завантажували 0.3г (2.46мМ) 3-ціано-2-фторпіридину (19), який потім розбавляли 20мл EtOH. Розчин продували аргоном, і потім в атмосфері аргону додали 60мг 10% Pd/C (20% мас.). Систему потім закривали мембраною й поміщали у вакуум. Потім приєднали балон з воднем, і реакційну суміш перемішували протягом трьох годин (відслідковували за допомогою ТСХ). Потім реакційну суміш знову поміщали у вакуум, і потім витримували на повітрі й фільтрували (залишаючи каталізатор вологим). Одержаний розчин сушили й випаровували з одержанням 93808 34 0.28г (90%) названої сполуки, 3-амінометил-2фторпіридину (20). Приклад 10: Синтез 3-Амінометил-6метоксипіридину (21), 3-Амінометил-6метилпіридину (22) і 3-Амінометилхіноліну (23) Названі аміни були одержані з відповідних нітрилів з використанням процедури, відповідно до якої одержували 3-амінометил-2-фторпіридин (20) з 3-ціано-2-фторпіридину (див. Приклад 9). Приклад 11: метоксипіридину Синтез 3-амінометил-2 У круглодонну колбу завантажували 0.44г (3.23мМ) 2-метокси-3-піридинкарбоксальдегіду (24), 1.24г (16.15мМ) ацетату амонію й 0.61г (19.69мМ) ціаноборгідриду натрію. Потім колбу продували аргоном, і потім через шприц додали 50мл сухого МеОН. Реакційну суміш перемішували протягом 2 діб, протягом яких МеОН випаровувався. Додали 25мл води, і суміш доводили до рН2 концентрованої НСI. Суміш двічі екстрагували EtOAc для видалення спиртового побічного продукту. Суміш доводили до рН10 додаванням гранул гідроксиду натрію, насичували NaCl і двічі екстрагували ДХМ і один раз ЕtOАс. Об'єднані органічні шари сушили й випаровували з одержанням 0.31г (69%) 3-амінометил-2-метоксипіридину (25). Приклад 12: Синтез 3-(á-аміноетил)-2хлорпіридину (26) Названий амін був одержаний з відповідного кетону з використанням процедури, відповідно до якої одержували 3-амінометил-2-метоксипіридин з 2-метокси-3-піридинкарбоксальдегіду (24; Приклад 11). Приклад 13: Синтез 3-амінометил-4метилпіридин У круглодонну колбу завантажували 0.45г (3.30мМ) 4-метилнікотинаміду (27). Колбу продували аргоном, і через шприц додали 50мл сухого ТГФ. Одержаний розчин охолоджували до 0°С, і додали 2.5мл (4.96мМ) 2М розчини комплексу боран-диметилсульфіду (у ТГФ). Приєднали барботер, розчин залишили нагріватися до кімнатної температури (к.т.) протягом ночі. Розчин гасили МеОН, сушили й випаровували з одержанням 0.38г (95%) 3-амінометил-4-метилпіридину (28). 35 Приклад 14: 93808 Синтез 5-фтор-1,2,3,4 Метил-4-(2-фторфеніл)бутаноат (2-(4метилбутаноат)фторбензол, 30). Круглодонну колбу герметизували гумовою мембраною, продували аргоном, потім завантажували 5.32мл метил-3-бутеноату (29) і 100мл 0.5М розчину 9-BBN у ТГФ. Розчин перемішували при кімнатній температурі протягом трьох годин. Круглодонну колбу з двома горлами обладнували зворотним холодильником і продували аргоном, потім завантажували 7.36г метилату натрію й 1.11г Pd(dppf)2Cl2. До цієї суміші додали 20мл сухого ТГФ й 5.22мл 1-фтор-2-йодбензолу. Розчин для боргідрування додали через лійку, і одержану суміш кип'ятили протягом 16 годин. Розчин охолоджували до к.т., розбавляли 150мл води й три рази екстрагували ефіром. Об'єднані органічні шари промивали розсолом, сушили й випаровували. Колонковахроматографія (5% ЕtOАс/гексани) дозволила одержати 1.79г метил-4-(2фторфеніл)бутаноату (30). 4-(2-Фторфеніл)бутанова кислота (31). У круглодонну колбу завантажували 1.79г 2-(4метилбутаноат)фторбензолу, який розчиняли в 17мл МеОН. До цього розчину додали розчин 1г гідроксиду натрію. Одержану суміш перемішували 20 годин при кімнатній температурі. Розчинник випаровували, і сирий матеріал розбавляли 15мл 0.5М НСI. Трикратна екстракція ДХМ дозволила одержати 1.17г (92%) 4-(2-фторфеніл)бутанової кислоти (31). 36 тетрагідронафталін-1-аміну 5-фтор-3,4-дигідронафталін-1(2Н)-он (32). У круглодонну колбу завантажували 0.15г 4-(2фторфеніл)бутанової кислоти, яку розчиняли в 20мл ДХМ і охолоджували до 0°С. Додали оксалілхлорид (0.15мл), а потім 1 краплю ДМФА. Приєднували осушувальну трубку, і розчин перемішували при 0°С протягом двох годин. Додали хлорид алюмінію (0.121г), і розчин залишили повільно нагріватися до кімнатної температури протягом ночі. Суміш вилили на лід з водою, і три рази екстрагували ДХМ. Об'єднані органічні шари промивали 0.5 Μ NaOH і розсолом. Органічну фазу сушили, випаровували й очищали колонковою хроматографією (елюент: 20% EtOAc/Гексани), одержуючи 0.07г (53%) 5-фтор-3,4дигідронафталін-1(2Н)-ону (32). 5-Фтор-1,2,3,4-тетрагідронафталін-1-амін (34). У круглодонну колбу завантажували 0.5г 5-фтор3,4-дигідронафталін-1(2Н)-ону, 0.28г гідрохлориду гідроксиламіну й 0.34г ацетату натрію. Приєднували зворотний холодильник, і колбу продували аргоном. Додали 20мл сухого EtOH, і суміш перемішували при кип'ятінні протягом 18 годин. Розчин охолоджували до к.т., розбавляли ЕtOАс, і промивали водою. Органічну фазу сушили сульфатом натрію й випаровували з одержанням 0.5г проміжної сполуки, оксиму 5-фтор-3,4-дигідронафталін1(2Н)-ону (33), який відновлювали на Pd/C в EtOH воднем (50psi), одержуючи 0.43г (86%) 5-фтор1,2,3,4-тетрагідронафталін-1-аміну (34). Приклад 15: Синтез 8-фторхроман-4-аміну 37 3-(2-Фторфенокси)пропанова кислота (36). Суміш 2-фторфенолу (35) (15г), 3-бромпропанової кислоти (20г) і NaOH (11г) кип'ятили в 50мл води. Розчин охолоджували до к.т. і підкислювали до рН2 додаванням 3М НСI. Одержаний осад вилучали фільтруванням, одержуючи 9.27г названої сполуки у виді білої твердої речовини. Фільтрат екстрагували три рази EtOAc, одержуючи 2.5г менш чистої сполуки (36). 8-фторхроман-4-он (37). Оксалілхлорид (8.79мл) і одну краплю ДМФА додали до крижаного розчину 3-(2-фторфенокси)пропанової кислоти (9.27г) у ДХМ (50мл). Розчин перемішували при 0°С протягом двох годин, додали хлорид алюмінію (7.39г, 55.42мМ), і розчин перемішували протягом 16 годин при кімнатній температурі. Суміш вилили на лід з водою три рази екстрагували ДХМ. Об'єднані органічні шари промивали 0.5М NaOH і розсолом, сушили, випаровували й очищали колонковою хроматографією (елюент: 20% ЕtOАс/Нех), одержуючи 8-фторхроман-4-он (37) (8.20г, 98%). 8-фторхроман-4-амін (39). У круглодонну колбу завантажували 8-фторхроман-4-он (8.2г), гідрохлорид гідроксиламіну (3.78г) і ацетат натрію (4.46г). Приєднали зворотний холодильник, колбу продували аргоном, додали сухий EtOH (20мл), і суміш перемішували при кип'ятінні протягом 18 годин. Розчин охолоджували до к.т., розбавляли ЕtOАс і промивали водою. Органічну фазу сушили й випаровували з одержанням проміжного оксиму 8-фторхроман-4-ону (38), який відновлювали на нікелі Ренея в EtOH при 50 PSI, одержуючи названий амін (39) (4.69г, 57%). Розділення 8-фторхроман-4-аміну 93808 38 Кажучи коротко, суміш 8-фторхроман-4-аміну (3.40г), метил-2-метоксиацетату (2.44г) і Novozyme 435 (Aldrich, 0.68г) у безводному трет-бутилметиловому ефірі (75мл) нагрівали при кип'ятінні в атмосфері аргону протягом двох годин (протягом цього часу відношення ацильованого до неацильованого продукту склало 1:1 за даними РХВР). Тверду речовину, одержану при охолодженні, збирали фільтруванням і розчиняли в EtOAc. Суміш фільтрували для видалення біокаталізатора й промивали один раз 0.5М НСI для видалення будь-якого залишкового (S)-aміну. Розчинник випаровували, і продукт перекристалізовували з трет-бутил-метилового ефіру, одержуючи (R)-N-(8фторхроман-4-іл)-2-метоксиацетамід (0.78г). Розчинник реакції й маточник від перекристалізації три рази промивали 0.5Μ НСI і концентрували, одержуючи додаткову кількість (R)-N-(8фторхроман-4-іл)-2-метоксиацетаміду (0.83г). Об'єднані кислотні водні шари підлуговували NaOH й екстрагували ДХМ, одержуючи (S)-8фторхроман-4-амін (39а) (1.6г). Розчин (R)-N-(8фторхроман-4-іл)-2-метоксиацетаміду (0.78г) в 8М НСI в EtOH (50мл) нагрівали при кип'ятінні протягом чотирьох годин. Розчинники видаляли з охолодженої реакційної суміші, одержану тверду речовину розчиняли в 50мл 0.5М NaOH, висолювали NaCl(s) і чотири рази екстрагували ДХМ, одержуючи (R)-8-фторхроман-4-амін (0.48г (87%)) (39b). Процентний вміст її визначали за допомогою хіральної РХВР: Chiralcel OD-H (0.46×25 см. аналітична колонка, Daicel Chemical Industries) спосіб: ізократичний 5% (0.05% ΤΦΟΚ/EtOH) 95% (0.05% ТФОК/Нех), к.т.=7.2хв. (S)-енантіомер, к.т.=9.2хв. (R)-енантіомер. Приклад 16: Синтез 2-(1H-Бензо[d]імідазол-1іл)-9-((R)-8-фторхроман-4-іл)-7H-пурин-8(9Н)-ону 39 93808 40 2-(1H-Бензо[d]імідазол-1-іл)-N-((R)-8фторхроман-4-іл)-5-нітропіримідин-4-амін. (R)-8-фторхроман-4-амін (60мг, Приклад 15) додали до розчину 2,4-дихлор-5-нітропіримідину (70мг) і DIEA (0.14мл) у ТГФ (5мл) при -78°С. Реакційну суміш перемішували ще протягом 15хв. при -78°С, потім вилучили з охолоджуючої бані й залишили нагріватися до кімнатної температури. Одномолярний розчин натрієвої солі бензімідазолу (0.7мл, вихідний розчин, приготовлений додаванням гідриду натрію до розчину бензімідазол у ТГФ) додали до реакційної проміжної сполуки, ((R)-2-хлор-N-(8-фторхроман-4-іл)-5нітропіримідин-4-аміну), і одержану суміш перемішували при кімнатній температурі протягом ночі. Очистка за допомогою колонкової хроматографії (елюювання 1 МеОН/ДХМ) дозволила одержати названу сполуку (120мг), МН+=407. 2-(1H-Бензо[d]імідазол-1-іл)-9-((R)-8фторхроман-4-іл)-7H-пурин-5(9H)-он. Свіжоприготовлений розчин гідросульфіту натрію (тех., 0.5г) і бікарбонату натрію (0.25г) в Н2О (5мл) додали до розчину вищевказаної нітросполуки (120мг) у ТГФ (10мл). Суміш енергійно перемішували протягом 30хв., потім екстрагували EtOAc (2×) і ДХМ (2×), об'єднані органічні шари промивали розсолом, сушили, фільтрували й концентрували, одержуючи проміжну сполуку, 2-(1H-бензо[d]імідазол-1-іл)-7у((R)-8-фторхроман-4-іл)піримідин-4,5-діамін, який використовували як такий у наступній операції. Карбонілдиімідазол (0.2г) додали до розчину вищевказаного аміну в ТГФ (10мл). Одержану суміш перемішували при кімнатній температурі протягом ночі, додали силікагель, потім розчинники видаляли під зменшеним тиском й очищали за допомогою колонкової хроматографії, елюювання 5% МеОН/ДХМ, одержуючи названий продукт (28мг), МН+=403, 1H ЯМР (CDCI3) δ 10.6 (s, 1H), 8.9 (s, 1H), 8.3 (s, 1H), 7.8 (m, 2H), 7.3 (m. 2H), 7.0 (m, 1H), 6.7 (m, 1H), 5.9 (dd, 1H), 4.7 (m, 1H), 4.4 (t, 1H), 2.7 (m, 1H), 2.3 (m, 1H) м.д., 19F ЯМР δ -135.7 (m). Хіральна РХВР - відсутність іншого енантіомера, Спосіб: Chiralcel OD-H (0.46×25см. аналітична колонка, Daicel Chemical Industries) ізократичний 15% (0.05% ТФОК/ЕtOН) 85% (0.05% ТФОК/Нех), к.т.=19.5хв. (R)-енантіомер, к.т.=22.4хв. (S)енантіомер. Приклад 17: Нерегіоспецифічний синтез похідних бензімідазолпуринону: Синтез 5-нітро-N(піридин-3-ілметил)-2-(6-(трифторметокси)-1Нбензо[d]імідазол-1-іл)піримідин-4-аміну (42) і 5нітро-N-(піридин-3-ілметил)-2-(5(трифторметокси)-1H-бензо[d]імідазол-1іл)піримідин-4-аміну (44) 2-Хлор-5-нітро-N-(піридин-3ілметил)піримідин-4-амін (41). Розчин 2,4-дихлор5-нітропіримідину (40) (5г) у метиленхлориді (60мл) охолоджували до -78°С й обробляли 3(амінометил)піридином (2.8г). Суміш перемішували при -78°С протягом шести годин, і концентрували у вакуумі при кімнатній температурі, одержуючи сирий 2-хлор-5-нітро-N-(піридин-3ілметил)піримідин-4-амін (41), який використовували без подальшої очистки. 5-Нітро-N-(піридин-3-ілметил)-2-(6(трифторметокси)-1Н-бензо-1-іл)імідазол-1іл)піримідин-4-амін (42) і 5-нітро-N-(піридин-3ілметил)-2-(5-(трифторметокси)-1Нбензо[d]імідазол-1-іл)піримідин-4-амін (44). Суспензію сирого 2-хлор-5-нітро-Н-(піридин-3ілметил)піримідин-4-аміну (52мг) в ацетонітрилі (10мл) обробляли 6-(трифторметокси)-1Н бензо[d]імідазолом (40мг), карбонатом калію (0.5г), і нагрівали при 80°С протягом чотирьох годин. Суміш розбавляли водою й екстрагували метиленхлоридом. Органічний шар відділяли, сушили сульфатом натрію, фільтрували й концентрували у вакуумі. Колонкова хроматографія (70:22:8 метиленхлорид:етилацетат:метанол) дозволила одержати 12мг 5-нітро-N-(піридин-3-ілметил)-2-(5(трифторметокси)-1Н-бензо[d]імідазол-1іл)піримідин-4-аміну у виді першого з елюємих ізомерів й 15мг 5-нітро-N-(піридин-3-ілметил)-2-(6(трифторметокси)-1Н-бензо[d]імідазол-1іл)піримідин-4-аміну у виді другого елюємого ізомеру. Ізомер з більшим Rf: 1H-ЯМР (CDCI3) δ 9.2 (s, 1H), 8.9 (s, 1H), 8.8 (m, 1H), 8.6 (s, 1H), 8.5 (d, 1H), 8.2 (d, 1H, віднесення: H-7 бензімідазольного цик 41 93808 42 лу), 7.6 (d, 1H), 7.6 (s, 1H, віднесення: H-4 бензімідазольного циклу), 7.2 (dd, 1H), 4.9 (d, 2H). Ізомер з меншим Rt: 1H-ЯМР (CDCI3) δ 9.2 (s, 1H), 8.9 (s, 1H), 8.8 (m, 1H), 8.6 (s, 1H), 8.5 (d, 1H), 8.2 (s, 1H, віднесення: H-7 бензімідазольного циклу), 7.7 (d, 1H, віднесення: Н-4 бензімідазольного циклу), 7.6 (d, 1H), 7.2 (dd, 1H), 7.1 (d, 1H), 4.9 (d, 2H). Приклад 18: Нерегіоспецифічний синтез похідних бензімідазолпуринону: Синтез 9-(Піридин-3ілметил)-2-(6-(трифторметокси)-1Нбензо[d]імідазол-1-іл)-7Н-пурин-8(9Н)-ону (43) і 9(піридин-3-ілметил)-2-(5-(трифторметокси)-1Нбензо[d]імідазол-1-іл)-7Н-пурин-8(9Н)-ону (45) Названі сполуки були синтезовані з 5-нітро-N(піридин-3-ілметил)-2-(6-(трифторметокси)-1Нбензо[d]імідазол-1-іл)піримідин-4-аміну (42) і 5нітро-N-(піридин-3-ілметил)-2-(5(трифторметокси)-1Н-бензо[d]імідазол1іл)піримідин-4-аміну (44) відповідно до тих же методик, які були використані для перетворення (R)-трет-бутил-2,4-диметоксибензил(5-нітро-6-(1 (піридин-3-іл)етиламіно)піридин-2-іл)карбамату в (R)-трет-бутил-2,4-диметоксибензил(2-оксо-3-(1(піридин-3-іл)етил)-2,3-дигідро-1Н-імідазо[4,5b]піридин-5-іл)карбамат (67; Приклад 22, описаний нижче). 6-Трифторметокси ізомер (не сіль): 1H-ЯМР (CD3OD) δ 9.3 (s, 1Н), 8.8 (br s, 1H), 8.6 (s, 1H, віднесення: H-7 бензімідазольного циклу), 8.6 (m, 1H), 8.4 (s, 1H), 8.1 (d, 1H), 7.9 (d, 1H, віднесення: H-4 бензімідазольного циклу), 7.5 (dd, 1H), 7.4 (dd, 1H), 5.4 (s, 2H). 5-Трифторметокси ізомер (не сіль): 1H-ЯМР (CD3OD) δ 9.3 (s, 1H), 8.8 (s, 1H), 8.7 (d, 1H, віднесення: H-7 бензімідазольного циклу), 8.5 (d, 1H), 8.3 (s, 1H), 7.9 (d, 1H), 7.6 (s, 1H, віднесення: H-4 бензімідазольного циклу), 7.4 (dd, 1H), 7.3 (dd, 1H), 5.3 (s, 2H). Приклад 19: Нерегіоспецифічний синтез похідного оксоімідазопіридину й імідазопіридину: Синтез 5-(1Н-Бензо[d]імідазол-1-іл)-3-(піридин-3ілметил)-1Н-імідазо[4,5-b]піридин-2(3Н)-ону (50) 6-(1Н-Бензо[d]імідазол-1-іл)-3-нітро-N(піридин-3-ілметил)піридин-2-амін (48). Розчин 2,6-дихлор-3-нітропіридину (46) (0.5г) в ацєтонітрилі (20мл) охолоджували до 0°С й обробляли триетиламіном (0.36мл), а потім 3(амінометил)піридином (0.26мл). Суміш перемішували протягом 30 хвилин при 0°С і восьми годин при кімнатній температурі. Одержаний розчин, який містив проміжну сполуку, 6-хлор-3-нітро-N(піридин-3-ілметил)піридин-2-амін (47), переносили в запаяну трубку, що містить бензімідазол (0.84г) і карбонат калію (3г) та нагрівали при 70°С протягом 16год. Суміш охолоджували й фільтру вали. Осад промивали водою й сушили на повітрі, одержуючи 239мг названої сполуки (48). 5-(1H-Бензо[d]імідазол-1-іл)-3-(піридин-3ілметил)-1H-імідазо[4,5-b]піридин-2(3Н)-он (50) і 5(1Н-бензо[d]імідазол-1-іл)-3-(піридин-3-ілметил)3Н-імідазо[4,5-b]піридин (51). Розчин 6-(1Нбензо[d]імідазол-1-іл)-3-нітро-Н-(піридин-3ілметил)піридину-2-аміну (48) (50мг) в 1мл ДМСО обробляли розчином Na2S2O4 (300мг) в 1мл води. Суміш перемішували протягом двох годин і розбавляли 50мл етилацетату. Суміш три рази промивали 50мл аліквотами насиченого розчину хлориду натрію, сушили над сульфатом натрію, фільтрували й концентрували у вакуумі, одержую 43 93808 44 чи проміжну сполуку, 6-(1Н-бензо[d]імідазол-1-іл)N2-(піридин-3-ілметил)піридин-2,3-діамін (49). Половину проміжної сполуки розчиняли в метиленхлориді (2мл) і обробляли 1,1'карбонілдиімідазолом (46мг) при кімнатній температурі протягом 16год. Одержану сиру суміш очищали препаративною ТСХ (1000 мікрон, 5% МеОН/СН2Сl2), одержуючи 7.1мг 5-(1H бензо[d]імідазол-1-іл)-3-(піридин-3-ілметил)-1Н1 імідазо[4,5-b]піридин-2(3Н)-ону (50): H-ЯМР (CDCI3) δ 10.0 (br s, 1H), 8.9 (s, 1H), 8.6 (d, 1H), 8.5 (s, 1H), 7.9 (m, 2H), 7.8 (m, 1H), 7.6 (d, 1H), 7.4 (m, 2H), 7.4 (m, 1H), 7.3 (d, 1H), 5.2 (s, 2H). Приклад 20: Регіоспецифічний синтез: Синтез 3-(9-(2,6-Дифторбензил)-8-оксо-8,9-дигідро-7Hпурин-2-іл)-3Н-бензо[d]імідазол-5-карбонітрилу N2-(2,4-Диметоксибензил)-N4-(2,6дифторбензил)-5-нітропіримідин-2,4-діамін (53). 2,6-Дифторбензиламін (0.24мл) додали по краплях протягом однієї хвилини до розчину 2,4-дихлор-5нітропіримідину (40) (0.388г) і DIEA (0.77мл) у ТГФ в охолоджуючій баня, установленій на -78°С. Реакційну суміш перемішували ще протягом 15хв. при -78°С, потім вилучали з охолоджуючої бані й залишили нагріватися до кімнатної температури. До реакційної проміжної сполуки, (N-(2,6дифторбензил)-2-хлор-5-нітропіримідин-4-аміну) (52), додали додаткову кількість DIEA (0.77мл), а потім додали 2,4-диметоксибензиламін (0.30мл), і одержану суміш перемішували при кімнатній температурі протягом ночі. Очистка за допомогою колонкової хроматографії (елюювання: 1 й 2.5% МеОН/ДХМ) дозволила одержати N2-(2,4диметоксибензил)-N4-(2,6-дифторбензил)-5нітропіримідин-2,4-діамін (53) (0.80г), МН+=432. 2-(2,4-Диметоксибензиламіно)-9-(2,6дифторбензил)-7H-пурин-8(9H)-он (55). Нікель Ренея додали до розчину N2-(2,4диметоксибензил)-N4-(2,6-дифторбензил)-5нітропіримідин-2,4-діаміну (0.80г) у ТГФ (50мл) при 45 продувці аргоном. Суспензію відкачували, заповнювали воднем (балон) і перемішували протягом 16год. Одержану суміш фільтрували через шар целіту, який ретельно промивали ТГФ й МеОН, 2 4 одержуючи N -(2,4-диметоксибензил)-N -(2,6дифторбензил)піримідин-2,4,5-триамін (54), який використовували як такий у наступній реакції. Карбонілдиімідазол (0.93г) додали до розчину N2-(2,4-диметоксибензил)-N4-(2,6дифторбензил)піримідин-2,4,5-триаміну (54) у ТГФ (20мл) і одержану суміш перемішували при кімнатній температурі протягом ночі, потім розчинники видаляли під зменшеним тиском, і суміш розчиняли в EtOAc і три рази промивали водою. Органічні шари сушили, фільтрували й випаровували та очищали за допомогою колонкової хроматографії, елюючи 2.5 й 4% МеОН/ДХМ, одержуючи 2-(2,4Диметоксибензиламіно)-9-(2,6-дифторбензил)-7Hпурин-8(9Н)-он (55) (0.58г), МН+=428. Трет-бутил-9-(2,6-дифторбензил)-2-аміно-8оксо-8,9-дигідропурин-7-карбоксилат (57). Розчин ТФОК/ДХМ у співвідношенні 1:1 (10мл) додали до 2-(2,4-диметоксибензиламіно)-9-(2,6дифторбензил)-7H-пурин-8(9Н)-ону (55) (0.58г) і перемішували протягом 30 хвилин, після чого додали триетилсилан (2мл), і суміш перемішували ще 4год. Розчинники видаляли у вакуумі, залишок розчиняли в мінімальній кількості МеОН й обробляли Еt2О, одержуючи ТФОК сіль 9-(2,6дифторбензил)-2-аміно-7Н-пурин-8(9Н)-ону (56) (0.55г), МН+=278, у виді злегка рожевої твердої речовини. 9-(2,6-Дифторбензил)-2-аміно-7H-пурин-8(9Н)он (0.55г) розчиняли в суміші MeOH/ACN/ДХМ (40мл) і Еt3N (2мл) і додавали ди-тpетбутилдикарбонат (0.61г), і суміш перемішували при кімнатній температурі протягом ночі. Розчинники реакції видаляли, і сирий матеріал розчиняли в ДХМ і промивали Н2О, випаровували й очищали за допомогою колонкової хроматографії, елюючи 2 й 3% МеОН/ДХМ, одержуючи названий продукт (57) (0.36г), МН+=378, МН+-Вос=278 (основний), (М Na)+=400 й (2М+Na)+=777 також спостерігали. Трет-бутил-9-(2,6--дифторбензил)-2-(5-ціано2-нітрофеніламіно)-8-оксо-8,9-дигідропурин-7карбоксилат (58). До розчину трет-бутил-9-(2,6дифторбетип)-2-аміно-8-оксо-8,9-дигідропурин-7карбоксилату (57) (191мг) і 3-фтор-4нітробензонітрилу (415мг) у ДМФА (5мл) при -40°С і продувці аргоном додали гідрид натрію (88мг, 95%). Реакційну суміш залишили нагріватися до 20°С протягом 3год., потім гасили додаванням насиченого водного розчину NH4CI, при досягненні кімнатної температури суміш розбавляли EtOAc і розділяли. Органічні шари промивали розсолом (3×), сушили, фільтрували й випаровували, очищали за допомогою колонкової хроматографії, (елюювання: ДХМ й 1 й 2.5% МеОН/ДХМ), одержуючи трет-бутил-9-(2,6-дифторбензил)-2-(5ціано-2-нітрофеніламіно)-8-оксо-8,9-дигідропурин7-карбоксилат (58) (288мг), МН+=524. Трет-бутил-9-(2,6-дифторбензил)-2-(6-ціано1Н-бензо[d]імідазол-1-іл)-8-оксо-8,9-дигідропурин7-карбоксилат (60). Свіжоприготовлений розчин 93808 46 гідросульфіту натрію (тех., 1г) і бікарбонату натрію (0.5г) в Н2О (10мл) додали до розчину вищевказаної нітросполуки (58) (288мг) у ТГФ (10мл). Суміш енергійно перемішували протягом 5 хвилин, екстрагували ДХМ (3×), об'єднані органічні шари промивали розсолом, сушили, фільтрували й концентрували, одержуючи проміжну сполуку, трет-бутил9-(2,6-дифторбензил)-2-(2-аміно-5ціанофеніламіно)-8-оксо-8,9-дигідропурин-7карбоксилат (59), який використовували як такий у наступній операції. Каталітичну кількість моногідрату паратолуолсульфонової кислоти додали до розчину вищевказаного проміжного аміну й триметилортоформату (3мл) в МеОН (10мл). Через 1год. сирий матеріал був нанесений на силікагель й очищений колонковою хроматографією (елюювання: 1 й 2% МеОН/ДХМ), з одержанням трет-бутил-9-(2,6дифторбензил)-2-(6-ціано-1Н-бензо[d]імідазол-1іл)-8-оксо-8,9-дигідропурин-7-карбоксилату (60) (164мг), МН+=504 й МН+-ВОС=404. 3-(9-(2,6-Дифторбензил)-8-оксо-8,9-дигідро7Н-пурин-2-іл)-3,Н-бензо[d]імідазол-5-карбонітрил (61). Розчин ТФОК/ДХМ у співвідношенні 1:1 (10мл) додали до трет-бутил-9-(2,6дифторбензил)-2-(6-ціано-1Н-бензо[d]імідазол-1іл)-8-оксо-8,9-дигідропурин-7-карбоксилату (60) і перемішували протягом 1год. Розчинники видаляли у вакуумі, і одержану тверду речовину обробляли Еt2О, і суспендували в 6N НСI. Видалення розчинників і розтирання одержаної твердої речовини з Еt2О дозволило одержати названу сполуку (61) (68мг) у виді НСI солі, МН+=404, 1H ЯМР (d6ДМСО) δ 11.8 (s, 1Н), 9.2 (s, 1H), 8.8 (s, 1H), 8.0 (s, 1H), 7.9 (d, 1H), 7.8 (broad s, 1H), 7.4 (d, 1H), 7.4 (quintet, 1H), 7.1 (m, 2H), 5.2 (s, 2H) м.д., 19F ЯМР δ -114.3 (m). Приклад 21: Синтез 3-(8-оксо-9-(тетрагідро2Н-піран-4-іл)-8,9-дигідро-7Н-пурин-2-іл)-3Нбензо[d]імідазол-5-карбонітрилу (62) Названа сполука може бути синтезована відповідно до тих же методик, які описані в синтезі 3(9-(2,6-дифторбензил)-8-оксо-8,9-дигідро-7Hпурин-2-іл)-3Н-бензо[d]імідазол-5-карбонітрилу (61, Приклад 20). 1 H ЯМP (d6-ДМСО) 11.71 (s, 1H), 9.34 (s, 1Н), 8.94 (d, J=1.5 Hz, 1Н), 8.38 (s, 1H), 8.00 (d, J=8.1 Hz, 1H), 7.79 (dd, J=8.1, 1.5 Hz, 1H), 4.57 (m, 1H), 4.04 (m, 2H), 3.50 (m, 2H), 2.59 (m, 2H), 1.79 (m, 2H); Mac. (MH+) 362.1. Приклад 22: Регіоспецифічний синтез похідного оксоімідазопіридину: Синтез 3-(2-оксо-3-((R)-1(піридин-3-іл)етил)-2,3-дигідро-1Н-імідазо[4,5b]піридин-5-іл)-3Н-бензо[d]імідазол-5-карбонітрилу 47 (R)-6-(2,4-Диметоксибензил)-3-нітро-N2-(1(піридин-3-іл)етил)піридин-2,6-діамін (64). Розчин 2,6-дихлор-5-нітропіридину (46) (0.5г) у ТГФ (20мл) охолоджували до 0°С й обробляли 1.6мл триетиламіну, а потім (R)-1-піридин-3-іл-етиламін (300мкл). Суміш перемішували протягом 1.5год., потім нагрівали до кімнатної температури й перемішували ще 20год. Додали 2,4диметоксибензиламін (0.8мл), і суміш нагрівали при 50°С протягом чотирьох годин. Суміш розбавляли етилацетатом і двічі промивали насиченим розчином хлориду натрію. Органічний шар відокремлювали, сушили над сульфатом натрію, фільтрували, і концентрували. Колонкова хроматографія (50100% етилацетат у гексані) дозволила одержати 761мг (R)-N6-(2,4-Диметоксибензил)-3нітро-N2-(1-(піридин-3-іл)етил)піридин-2,6-діаміну (64). (R)-Трет-бутил-2,4-диметоксибензил(5-нітро-6(1-(піридин-3-іл)етиламіно)піридин-2-іл)карбамат (65). Розчин (R)-N6-(2,4-диметоксибензил)-3-нітроN2-(1-(піридин-3-іл)етил)піридин-2,6-діаміну (64) (367мг) у метиленхлориді (20мл) обробляли дитрет-бутилдикарбонатом (1.0г) і 4 93808 48 диметиламінопіридином (22мг). Суміш перемішували протягом 16год. і концентрували у вакуумі. Колонкова хроматографія (50100% етилацетат у гексані) дозволила одержати 500мг (R)-трет-бутил2,4-диметоксибензил(5-нітро-6-(1-(піридин-3іл)етиламіно)піридин-2-іл)карбамату (65). (R)-Трет-бутил-2,4-диметоксибензил(2-оксо-3(1-(піридин-3-іл)етил)-2,3-дигідро-1Н-імідазо[4,5b]піридин-5-іл)карбамат (67). Розчин (R)-третбутил-2,4-диметоксибензил(5-нітро-6-(1-(піридин3-іл)етиламіно)піридин-2-іл)карбамату (500мг) у ТГФ (25мл) обробляли водним розчином, що включає 2г Na2S2O4 й 1г NаНСО3 в 20мл води, а потім 1мл метанолу. Суміш перемішували протягом 30 хвилин, потім розбавляли етилацетатом і промивали насиченим розчином хлориду натрію. Органічний шар відокремлювали, сушили над сульфатом натрію, фільтрували й концентрували, одержуючи проміжну сполуку, (R)-трет-бутил-2,4диметоксибензил(5-аміно-6-(1-(піридин-3іл)етиламіно)піридин-2-іл)карбамат (66). Цю проміжну сполуку розчиняли в ТГФ (50мл) і обробляли 1,1'-карбонілдиімідазолом (0.5г) при 50°С протягом 20год. Суміш концентрували й очищали колонко 49 вою хроматографією (25% МеОН у метиленхлориді), одержуючи 413мг (R)-трет-бутил-2,4диметоксибензил(2-оксо-3-(1-(піридин-3-іл)етил)2,3-дигідро-1Н-імідазо[4,5-b]піридин-5іл)карбамату (67). (R)-Трет-бутил-5-аміно-2-оксо-3-(1-(піридин-3іл)етил)-2,3-дигідроімідазо[4,5-b]піридин-1карбоксилат (69). Розчин (R)-трет-бутил-2,4диметоксибензил(2-оксо-3-(1-(піридин-3-іл)етил)2,3-дигідро-1Н-імідазо[4,5-b]піридин-5іл)карбамату в метиленхлориді (15мл) обробляли ТФОК (15мл) і триетилсиланом (1.0мл) протягом однієї години. Суміш концентрували, одержуючи проміжну сполуку, (R)-5-аміно-3-(1-(піридин-3іл)етил)-1Н-імідазо[4,5-b]піридин-2(3Н)-он (68), який розчиняли в ацетонітрилі (50мл) і енергійно перемішували з ди-тpет-бутилдикарбонатом (1.0г) і карбонатом калію (3.0г) протягом 2год. Додали метиленхлорид (200мл) і воду (100мл), і органічний шар відокремлювали. Водний шар екстрагували додатково 100мл метиленхлориду. Об'єднані органічні шари відокремлювали, сушили над сульфатом натрію, фільтрували, і концентрували. Колонкова хроматографія (234% МеОН у метиленхлориді) дозволила одержати 235мг (R)трет-бутил-5-аміно-2-оксо-3-(1-(піридин-3-іл)етил)2,3-дигідроімідазо[4,5-b]піридин-1-карбоксилату (69). (R)-Трет-бутил-5-(5-ціано-2-нітрофеніламіно)2-оксо-3-(1-(піридин-3-іл)етил)-2,3дигідроімідазо[4,5-b]піридин-1-карбоксилат (70). Розчин (R)-трет-бутил-5-аміно-2-оксо-3-(1(піридин-3-іл)етил)-2,3-дигідроімідазо[4,5b]піридин-1-карбоксилату (94мг) і 3-фтор-4нітробензонітрилу (225мг) у ДМФА (6мл) охолоджували до -25°С й обробляли NaH (60% мас. у мінеральній олії, 75мг) і залишили повільно нагріватися до -15°С. Суміш перемішували протягом чотирьох годин при температурі від -20°С до 15°С, потім розбавляли ЕtOАс і гасили насиченим розчином хлориду амонію. Органічну фазу три рази промивали розсолом, відокремлювали, сушили над сульфатом натрію, фільтрували й концентрували. Колонкова хроматографія (2% МеОН у метиленхлориді) дозволила одержати 100мг (R)трет-бутил-5-(5-ціано-2-нітрофеніламіно)-2-оксо-3(1-(піридин-3-іл)етил)-2,3-дигідроімідазо[4,5b]піридин-1-карбоксилату (70). Трет-бутил-5-(6-ціано-1Н-бензо[d]імідазол-1іл)-2-оксо-3-((R)-1-(піридин-3-іл)етил)-2,3дигідроімідазо[4,5-b]піридин-1-карбоксилат (72). Розчин (R)-трет-бутил-5-(5-ціано-2 93808 50 нітрофеніламіно)-2-оксо-3-(1-(піридин-3-іл)етил)2,3-дигідроімідазо[4,5-b]піридин-1-карбоксилату (70) (100мг) у ТГФ (5мл) обробляли водним розчином, що включає 0.5г Na2S2O4 й 0.25г NаНСО3 в 5мл води. Суміш швидко змінила червоний колір на ясно-жовтий, котрий вказував на відновлення нітрогрупи. Суміш розбавляли етилацетатом і промивали насиченим розчином хлориду натрію. Органічний шар відокремлювали, сушили над сульфатом натрію, фільтрували й концентрували, одержуючи проміжну сполуку, (R)-трет-бутил 5-(2аміно-5-ціанофеніламіно)-2-оксо-3-(1-(піридин-3іл)етил)-2,3-дигідроімідазо[4,5-b]піридин-1карбоксилат (71). Цю проміжну сполуку розчиняли в ТГФ (5мл), ДМФА (1мл), і триметилортоформаті (2мл). Суміш обробляли 10мг ртолуолсульфонової кислоти й перемішували протягом 20год. Суміш розбавляли етилацетатом і один раз промивали насиченим розчином бікарбонату натрію та двічі насиченим розчином NaCl. Органічний шар відокремлювали, сушили над сульфатом натрію, фільтрували, і концентрували. Колонкова хроматографія (2% МеОН у метиленхлориді) дозволила одержати 57мг трет-бутил-5-(6ціано-1Н-бензо[d]імідазол-1-іл)-2-оксо-3-((R)-1(піридин-3-іл)етил)-2,3-дигідроімідазо[4,5b]піридин-1-карбоксилату (72). 3-(2-Оксо-3-((R)-1-(ніридин-3-іл)етил)-2,3Дигідро-1H-імідазо[4,5-b]піридин-5-іл)-3Нбензо[d]імідазол-5-карбонітрил (73). Розчин третбутил-5-(6-ціано-1Н-бензо[d]імідазол-1-іл)-2-оксо3-((R)-1-(піридин-3-іл)етил)-2,3-дигідроімідазо[4,5b]піридин-1-карбоксилату (72) (57мг) у метиленхлориді (1мл) обробляли ТФОК (1мл) протягом однієї години. Суміш концентрували й одержану сіль ТФОК перетворювали в сіль НСI розчиненням в 5мл ЕtOН і додаванням 0.5мл конц. НСI, і потім концентруванням розчину у вакуумі. Процес повторювали, і одержаний залишок розчиняли в мінімальній кількості метанолу й обробляли додаванням етилового ефіру. Після 3 обробок вилучали НСI сіль 3-(2-оксо-3-((R)-1-(піридин-3іл)етил)-2,3-дигідро-1Н-імідазо[4,5-b]піридин-5-іл)3Н-бензо[d]імідазол-5-карбонітрилу (73) (39мг) у виді коричнюватої твердої речовини: 1H-ЯМР (CD3OD) δ 9.9 (br s, 1H), 9.2 (s, 1H), 9.0 (m, 2H), 8.5 (s, 1H), 8.3 (m, 1H), 8.2 (m, 1H), 8.1 (d, 1H), 7.9 (d, 1H), 7.8 (d, 1H), 6.3 (q, 1H), 2.3 (d, 3H). Приклад 24. Синтез 2-(1H-Вензо[d]імідазол-1іл)-9-(цис-3-метил-тетрагідро-2Н-піран-4-іл)-7Нпурин-8(9Н)-ону 51 2-Xлop-N-(цис-3-метил-тетрагідро-2Н-піран-4іл)-5-нiтpoпipимiдин-4-aмiн. До суспензії 0.24г гідрохлориду цис-3-метил-тетрагідро-2Н-пірап-4-амту (WO 2004/041161) і DIEA (1.5мл) у ТГФ (10мл) при -78°С додали 2,4-дихлор-5-нітропіримідин (0.72г). Суміш залишили повільно досягати кімнатної температури й перемішували протягом 16 годин. Суміш розбавляли EtOAc й 3 рази промивали розсолом. Органічний шар відокремлювали, сушили над сульфатом натрію й концентрували у вакуумі. Колонкова хроматографія (20(40% ЕtOАс/гексани) дозволила одержати 289мг названої сполуки. 2-(1H-Бeнзo[d]iмiдaзoл-1-iл)-N-(циc-3-метилтетрагідро-2H-пipaн-4-iл)-5-нітропіримідин-4-амін. До розчину 2-хлор-N-(цис-3-метил-тетрагідро-2Нпіран-4-іл)-5-нітропіримідин-4-аміну (115мг) в ацетонітрилі (5мл) додали карбонат калію (300мг) і бензімідазол (150мг). Суміш перемішували при 70°С протягом 2.5 годин. Після розведення 70мл ЕtOАс, суміш промивали розсолом, сушили над сульфатом натрію й концентрували у вакуумі. Колонкова хроматографія (50100% EtOAc/гексани) дозволила одержати 99мг названої сполуки. 2-(1Н-Бензо[d]імідазол-1-іл)-9-(цис-3-метилтетрагідро-2Н-піран-4-іл)-7Н-пурин-8(9Н)-он. До розчину 2-(1Н-бензо[d]імідазол-1-іл)-N-(цііс-3метил-тетрагідро-2H-піран-4-іл)-5-нітропіримідин4-аміну (51мг) у ТГФ (10мл) додали розчин гідросульфіту натрію (300мг) і бікарбонату натрію (150мг) у воді (10мл). Суміш на короткий час стала синьою, а потім безбарвною. Для підтримання гомогенності розчину додали метанол (1мл). Суміш розбавляли 70мл EtOAc і двічі промивали розсолом. Водні промивні води екстрагували ще 50мл EtOAc, і потім об'єднані органічні шари сушили над сульфатом натрію й концентрували у вакуумі, одержуючи 2-(1H-бензо[d]імідазол-1-іл)-N-(цис-5метил-тетрагідро-2Н-піран-4-іл)піримідин-4,5діамін. Проміжний діамін розчиняли в ТГФ (5мл) і обробляли 1,1'-карбонілдиімідазолом (80мг) при 50°С протягом 16 годин. Суміш розбавляли 50мл EtOAc й 3 рази промивали розсолом. Органічний шар відокремлювали, сушили над сульфатом натрію й концентрували у вакуумі. Колонкова хроматографія (24% МеОН/ДХМ) дозволила одержати 19.3мг названої сполуки. 1Н-ЯМР (300МГц, 5% CD3OD в CDCI3) δ 8.9 (s, 1H), 8.5 (d, 1H), 8.2 (s, 93808 52 1H), 7.8 (d, 1H), 7.4 (t, 1H), 7.3 (t, 1H), 4.7 (m, 1H), 4.2 (d(br), 1H), 3.9 (d, 1H), 3.7 (d, 1H), 3.5 (m, 2H), 2.3 (t(br), 1H), 1.8 (d(br), 1H), 1.2 (d, 3H). Приклад 25 2-(5,6-Дихлор-1H-бензо[d]імідазол-1-іл)-9-((R)8-фторхроман-4-іл)-7Н-пурин-8(9Н)-он. Розчин (R)2-хлор-N-(8-фторхроман-4-іл)-5-нітропіримідин-4аміну в ацетонітрилі обробляли 5,6дихлорбензімідазол і карбонатом калію. Суміш перемішували при кип'ятінні протягом 6 годин, охолоджували до кімнатної температури, розбавляли 150мл EtOAc і двічі промивали порціями по 30мл води. Органічний шар відокремлювали, сушили сульфатом магнію, фільтрували й концентрували у вакуумі. Очистка колонковою хроматографією (2% МеОН/ДХМ) дозволила одержати проміжний нітропіримідинамін. Названа сполука синтезована із проміжного нітропіримідинаміну відповідно до методик, описаних в Прикладі 24. 1 Н-ЯМР (300МГц, CDCI3) δ 8.7 (s, 1H), 8.3 (s, 1H), 8.2 (s, 1H), 7.8 (t, 1H), 7.0 (t, 1H), 6.6 (m, 2H), 5.9 (t, 1H), 4.6 (m, 1H), 4.4 (m, 1H), 3.0 (m, 1H), 2.3 (m, 1H). 2-(5,6-диметил-1Н-бензо[d]імідазол-1-іл)-9((R)-8-фторхроман-4-іл)-7Н-пурин-8(9Н)-он. Названа сполука синтезована з 5,6дихлорбензімідазолу відповідно до методик, описаних в Прикладі 25. 1Н-ЯМР (300МГц, CDCI3) δ 9.6 (s, 1H), 8.8 (s, 1H), 8.3 (s, 1H), 8.0 (s, 1H), 7.6 (s, 1H), 7.0 (t, 1H), 6.7 (m, 1H), 5.9 (t, 1H), 4.7 (m, 1H), 4.5 (m, 1H), 3.2 (m, 2H), 2.4 (d, 6H). 53 9-((R)-8-фторхроман-4-іл)-2-(6(трифторметил)-1Н-бензо[d]імідазол-1-іл)-7Нпурин-8(9Н)-OH й 9-((R)-8-фторхроман-4-іл)-2-(5(трифторметил)-1Н-бензо[d]імідазол-1-іл)-7Нпурин-8(9Н)-он. Названі сполуки синтезовані з 5трифторметилбензімідазолу (US 2004/0087601) відповідно до методик, описаних в Прикладі 25. Очистка колонковою хроматографією (2% МеОН/ДХМ) дозволила спочатку виділити елюювання 6-трифторметильний ізомер (1H-ЯМР (300МГц, CDCl3) δ 8.8 (d, 2H), 8.4 (s, 1H), 7.9 (d, 1H), 7.6 (d, 2H), 7.0 (t, 1H), 6.7 (m, 2Н), 5.9 (t, 1H), 4.7 (m, 1H), 4.4 (m, 1H), 3.0 (m, 1H), 2.4 (m, 1H).), а потім 5трифторметильний ізомер 1Н-ЯМР (300МГц, CDCI3) δ 9.0 (s, 1H), 8.4 (s, 1H), 8.1 (s, 1H), 8.0 (d, 1H), 7.6 (d, 2H), 7.0 (m, 1H), 6.8 (m, 2H), 5.9 (t, 1H), 4.7 (m, 1H), 4.4 (m, 1H), 2.9 (m, 1H), 2.4 (m, 1H). Ν-((R)-8-Φторхроман-4-іл)-2-(3Η-імідазо[4,5с]піридин-3-іл)-5-нітропіримідин-4-амін й Ν-((R)-8Φторхроман-4-іл)-2-(1Η-імідазо[4,5-с]піридин-1-іл)5-нітропіримідин-4-амін. Названі сполуки синтезовані з 5-азабензімідазолу відповідно до методики, описаної в Прикладі 25. Очистка колонковою хроматографією (1% МеОН/ДХМ) дозволила одержати N-((R)-8-фторхроман-4-іл)-2-(3Н-імідазо[4,5с]піридин-3-іл)-5-нітропіримідин-4-амін у виді першого з елююємих ізомерів: (1H-ЯМР (300МГц, CDCI3.) δ 9.8 (s, 1H), 9.4 (s, 1H), 9.2 (s, 1H), 8.9 (d, 1H), 8.6 (d, 1H), 7.8 (d, 1H), 7.1 (m, 2H), 6.9 (m, 1H), 5.8 (q, 1H), 4.6 (m, 1H), 4.4 (m, 1H), 2.6 (m, 1H), 2.4 (m, 1H).). N-((R)-8-фторхроман-4-іл)-2-(1Німідазо[4,5-с]піридин-1-іл)-5-нітропіримідин-4-амін 4-(2,4-диметоксибензиламіно)-3нітробензонітрил. Розчин 4-фтор-3нітробензонітрилу (5.0г) у ТГФ (100мл) обробляли DIEA (6.3мл) і 2,4-диметоксибензиламіном (5.0мл), і потім перемішували протягом 24год. Розчинник випаровували, і сиру суміш розчиняли в ЕtOАс 93808 54 вимивався у виді другого ізомеру: (1H-ЯМР (300МГц, CDCI3) δ 9.4 (s, 1Н), 9.2 (s, 1H), 9.1 (s, 1H), 8.9 (d, 1H), 8.6 (d, 1H), 8.4 (d, 1H), 7.1 (m, 2H), 6.9 (m, 1H), 5.7 (q, 1H), 4.5 (m, 1H), 4.4 (m, 1H), 2.6 (m, 1H), 2.4 (m, 1H).). 9-((R)-8-фторхроман-4-іл)-2-(3Н-імідазо[4,5с]піридии-3-іл)-7Н-пурин-8(9Н)-он. Названа сполука синтезована з Н-((R)-8-фторхроман-4-іл)-2-(3Німідазо[4,5-с]піридин-3-іл)-5-нітропіримідин-4-аміну відповідно до методик, описаних в Прикладі 24. 1 Н-ЯМР (300МГц, CDCI3) δ 9.8 (s, 1H), 9.4 (s, 1H), 8.6 (d, 1H), 8.3 (m, 2H), 7.0 (t, 1H), 6.7 (m, 2H), 5.9 (t, 1H), 4.6 (m, 1H), 4.4 (m, 1H), 2.8 (m, 1H), 2.4 (m, 1H). 9-((R)-8-фторхроман-4-іл)-2-(1Н-імідазо[4,5с]піридин-1-іл)-7Н-пурин-8(9Н)-он. Названа сполука синтезована з N-((R)-8-фторхроман-4-іл)-2-(1Hімідазо[4,5-с]піридин-1-іл)-5-нітропіримідин-4-аміну відповідно до методик, описаних в Прикладі 24. 1 Н-ЯМР (300МГц, CDCI3) δ 9.3 (d, 2Н), 8.4 (d, 1H), 8.3 (d, 2Н), 7.0 (t, 1Н), 6.7 (m, 2H), 5.9 (t, 1H), 4.6 (m, 1H), 4.4 (m, 1H), 2.8 (m, 1H), 2.4 (m, 1H). Приклад 26. Синтез 3-(9-((R)-6,8дифторхроман-4-іл)-8-оксо-8,9-дигідро-7Н-пурин-2іл)-3Н-бензо[d]імідазол-5-карбонітрил: (100мл). Розчин один раз промивали 1 Μ НСI і двічі насиченим водним NaCl (100мл кожного). Органічний шар відокремлювали, сушили над Na2SО4, фільтрували й концентрували у вакуумі. Колонкова хроматографія (20% ЕtOАс/ДХМ) дозволила одержати 9.25г названої сполуки. 55 93808 56 4-(2,4-Диметоксибензиламіно)-3амінобензонітрил. Розчин 4-(2,4диметоксибензиламіно)-3-нітробензонітрилу (4.54г) у ТГФ (400мл) обробляли розчином гідросульфіту натрію (20г) і бікарбонату натрію (10г) у дистильованій воді (350мл). Негайно додали достатню кількість метанолу (50мл) для підтримання гомогенного розчину. Через 15 хвилин додали ЕtOАс (500мл) і насичений водний NaCl (500мл), і органічний шар відокремлювали. Водний шар екстрагували знову 400мл EtOAc. Об'єднані органічні шари промивали насиченим водним NaCl (500мл) і відокремлювали. Органічну фазу сушили над Na2SO4, фільтрували й концентрували у вакуумі, одержуючи 4.33г названої сполуки. 4-(2,4-Диметоксибензиламіно)-3-(5-нітро-4тіоціанатопіримідин-2-іламіно)бензонітрил. Розчин 4-(2,4-диметоксибензиламіно)-3амінобензонітрилу (3.9г) в ацетонітрилі (100мл) охолоджували до 0°С й обробляли карбонатом калію (6.3г), а потім розчином, що містить 3г 2хлор-5-нітро-4-тіоціанатопіримідину (WO 2003/032994) в ацетонітрилі (50мл). Суміш перемішували протягом 30 хвилин при 0°С й 30 хвилин при кімнатній температурі, що призвело до утворення осаду. Суміш гасили при 0°С додаванням 4% оцтової кислоти (150мл) і фільтрували. Осад розмішували в 100мл ацетонітрилу й знову фільтрували. Осад промивали ацетонітрилом, що призвело до повільного розчинення продукту у фільтраті. Після сушіння на повітрі, 1.5г названої сполуки залишилися у виді осаду. Фільтрат екстрагували EtOAc, сушили над Na2SO4, фільтрували й концентрували у вакуумі. Колонкова хроматографія (020% EtOAc/ДХМ) і перекристалізація з ацетонітрилу дозволила одержати 0.415г додаткової кількості названої сполуки. (R)-4-(2,4-Диметоксибензиламіно)-3-(4-(6,8дифторхроман-4-іламіно)-5-нітропіримідин-2іламіно)бензонітрил. Часткову суспензію 4-(2,4диметоксибензиламіно)-3-(5-нітро-4тіоціанатопіримідин-2-іламіно)бензонітрилу (415мг) в 40мл ацетонітрилу обробляли розчином НСI солі (R)-6,8-дифторхроман-4-аміну (320мг) у ДМСО (10мл), а потім карбонатом калію (1.0г). Суміш перемішували протягом 24 годин, і потім розбав ляли EtOAc (200мл). Суміш один раз промивали насиченим водним розчином хлориду амонію (200мл) і 3 рази насиченим водним розчином NaCl (200мл кожного). Органічний шар відокремлювали, сушили над Na2SO4, фільтрували й концентрували у вакуумі. Колонкова хроматографія (2040% EtOAc/гексани) дозволила одержати 358мг названої сполуки. 57 (R)-4-(2,4-Диметоксибеіізиламіно)-3-(9-(6,8дифторхромаи-4-іл)-8-оксо-8,9-дигідро-7Н-пурин2-іламіно)бензонітрил. Розчин (R)-4-(2,4диметоксибензиламіно)-3-(4-(6,8-дифторхроман-4іламіно)-5-нітропіримідин-2-іламіно)бензонітрилу (358мг) у ТГФ (25мл) обробляли розчином гідросульфіту натрію (1.5г) і бікарбонату натрію (1.5г) в 20мл дистильованої води. Для підтримання гомогенного розчину додали метанол (5мл). Через 15 хвилин, суміш розбавляли EtOAc (100мл) і промивали насиченим водним розчином NaCl (2×100мл). Органічний шар відокремлювали, сушили над Na2SO4, фільтрували й концентрували у вакуумі, 3-(9-((R)-6,8-Дифторхроман-4-іл)-8-оксо-8,9дигідро-7Н-пурин-2-іл)-3Н-бензо[d]імідазол-5карбонітрил. Розчин (R)-4-(2,4диметоксибензиламіно)-3-(9-(6,8-дифторхроман-4іл)-8-оксо-8,9-дигідро-7Н-пурин-2іламіно)бензонітрилу (230мг) у ДХМ (5мл) обробляли ТФОК (5мл) і триетилсиланом (1мл) протягом 16год. Суміш концентрували у вакуумі, одержуючи проміжну сполуку, (R)-4-аміно-3-(9-(6,8дифторхроман-4-іл)-8-оксо-8,9-дигідро-7Н-пурин-2іламіно)бензонітрил. Цю проміжну сполуку розчиняли в 5мл ТГФ й обробляли 3мл триметилортоформату, а потім р-толуолсульфоновою кислотою (3мг). Через 1 годину, суміш розбавляли ЕtOАс (100мл) і один раз промивали насиченим водним розчином бікарбонату натрію (100мл). Органічний шар відокремлювали, сушили над Na2SO4, фільтрували й концентрували у вакуумі. Колонкова хроматографія (50100% ЕtOАс/гексани) дозволила одержати 78мг названої сполуки. 1H-ЯМР (300МГц, 5% CD3OD в CDCI3) δ 8.8 (s, 1H), 8.7 (s, 1H), 8.2 (s, 1H), 7.8 (d, 1H), 7.6 (dd, 1H), 6.8 (td, 1H), 6.4 (dd, 1H), 5.8 (dd, 1H), 4.6 (m, 1H), 4.4 (td, 1H), 2.9 (m, 1H), 2.3 (m, 1H). 93808 58 одержуючи проміжну сполуку, (R)-4-(2,4диметоксибензиламіно)-3-(5-аміно-4-(6,8дифторхроман-4-іламіно)піримідин-2іламіно)бензонітрил. Цю проміжну сполуку розчиняли в ТГФ (5мл) і обробляли карбонілдиімідазолом (0.55г) протягом 16 годин. Суміш розбавляли ЕtOАс (100мл) і двічі промивали насиченим водним розчином NaCl (2×100мл). Органічний шар відокремлювали, сушили над Na2SO4, фільтрували й концентрували у вакуумі. Колонкова хроматографія (2(3% МеОН/ДХМ) дозволила одержати 230мг названої сполуки. 3-(9-((R)-Хроман-4-іл)-8-оксо-8,9-дигідро-7Нпурин-2-іл)-3Н-бензо[d]імідазол-5-карбонітрил. Названа сполука синтезована з (R)-хроман-4-аміну відповідно до методик, описаних в Прикладі 26. 1 H-ЯМР (300МГц, 5% CD3OD в CDCI3) δ 8.8 (s, 1H), 8.5 (s, 1H), 8.2 (s, 1H), 7.8 (d, 1H), 7.5 (dd, 1H), 7.1 (m, 2H), 6.8 (d, 1H), 6.7 (td, 1H), 5.8 (dd, 1H), 4.5 (m, 1H), 4.3 (td, 1H), 2.8 (m, 1H), 2.3 (m, 1H). 3-[9-(8-Фтор-хроман-4-іл)-8-оксо-8,9-дигідро7Н-пурин-2-іл]-3Н-бензоімідазол-5-карбонітрил. Названа сполука синтезована з (R)-8-фторхроман4-аміну відповідно до методик, описаних в Прикладі 26. 1H-ЯМР (300МГц, CDCI3) δ 8.8 (s, 1H), 8.6 59 (s, 1H), 8.2 (s, 1H), 7.8 (d, 1H), 7.6 (d, 1H), 7.0 (t, 1H), 6.6 (m, 2H), 5.8 (t, 1H), 4.6 (m, 1H), 4.4 (m, 1H), 2.8 (m, 1H), 2.4 (m, 1H). 93808 60 карбонітрил. Названа сполука синтезована з (R)-6фторхроман-4-аміну відповідно до методик, описаних в Прикладі 26. 1H ЯМР (300МГц, CDCI3+5%CD3OD): δ 8.86 (s, 1H), 8.41 (s, 1H), 8.18 (s, 1H), 7.72 (d, 1H), 7.51 (d, 1H), 7.0-7.1 (m, 1H), 6.8-6.9 (m, 1H), 6.49 (dd, 1H), 5.76 (br t, 1H), 4.4-4.5 (m, 1H), 4.24 (br t, 1H), 2.7-2.9 (m, 1H), 2.2-2.3 (m, 1H). Умови введення хроманіламіну були вдосконалені, як описано нижче: 3-(9-((R)-6-Фторхроман-4-іл)-8-оксо-8,9дигідро-7Н-пурин-2-іл)-3Н-бензо[d]імідазол-5 (R)-4-(2,4-Диметоксибензиламіно)-3-(4-(6фторхроман-4-іламіно)-5-нітропіримідин-2іламіио)бензонітрил. Розчин 4-(2,4диметоксибензиламіно)-3-(5-нітро-4тіоціанатопіримідин-2-іламіно)бензонітрилу (139мг) у безводному ДМСО (3мл) додали до розчину гідрохлориду (R)-6-фторхроман-4-аміну (79мг) у безводному ДМСО (3мл) і DIEA (0.21мл), одержаний темно-червоний розчин перемішували при кімнатній температурі в атмосфері Аr, і протягом цього часу розчин посвітлів до жовтих кольорів. По завершенню реакції, суміш охолоджували до 0°С на крижаній бані, і додали воду (25мл) (виділення тепла). Одержану жовту тверду речовину збирали фільтруванням, промивали додатковою кількістю води, сушили на повітрі й потім розчиняли в СН2СІ2, органічний розчин сушили (MgSO4), фільтрували й випаровували, одержуючи названу сполуку (кільк.), ЯМР CDCI3 1H δ 9.0 (s, 1H), 8.6 (d, 1H), 7.7 (br s, 1H), 7.4 (dd, 1H), 7.1 (d, 1H), 7.0-6.8 (m, 4H), 6.5-6.4 (m, 2H), 5.2 (br s, 1H), 4.3 (s, 2H), 4.2 (br s, 2H), 3.8 (s, 6H), 2.2 (br s, 1H), 1.8 (br s, 1H); 19F δ -123 м.д.;МН+=572. Цей матеріал обробляли відповідно до методик, описаних в Прикладі 26, одержуючи 3-(9-((R)6-фторхроман-4-іл)-8-оксо-8,9-дигідро-7H-пурин-2іл)-3H-бензо[d]імідазол-5-карбонітрил. 3-(9-((R)-7-Фторхроман-4-іл)-8-оксо-8,9дигідро-7Н-пурин-2-іл)-3Н-бензо[d]імідазол-5карбонітрил. Названа сполука синтезована з (R)-7фторхроман-4-аміну відповідно до методик, опи1 саних в Прикладі 26. H ЯМР (300МГц, CDCI3+5%CD3OD): δ 8.86 (s, 1H), 8.58 (s, 1H), 8.19 (s, 1H), 7.79 (d, 1H), 7.56 (d, 1H), 6.7-6.9 (m, 2H), 6.4-6.5 (m, 1H), 5.78 (br t, 1H), 4.5-4.6 (m, 1H), 4.32 (brt, 1H), 2.7-2.9 (m, 1H), 2.2-2.4 (m, 1H). 3-[9-(5,8-Дифтор-хроман-4-іл)-8-оксо-8,9дигідро-7Н-пурин-2-іл]-3Н-бензоімідазол-5карбонітрил. Названа сполука синтезована з (R)5,8-дифторхроман-4-аміну відповідно до методик, описаних в Прикладі 26. 1H-ЯМР (300МГц, CDCI3) δ 8.8 (s, 1H), 8.7 (s, 1H), 8.2 (s, 1H), 7.8 (d, 1H), 7.6 (d, 1H), 7.0 (m, 1H), 6.4 (m, 1H), 5.9 (t, 1H), 4.6 (m, 1H), 4.4 (m, 1H), 2.5 (m, 2H). Приклад 27. Синтез 2-(6-фтор-1Hбензо[d]імідазол-1-іл)-9-((R)-8-фтор-хроман-4-іл)7H-пурин-8(9Н)-ону: 4-Фтор-2-нітро-феніл-ди-трет-бутилімідодикарбонат. Каталітичну кількість DMAP додали до суміші 4-фтор-2-нітробензоламіну (0.78г) і ди-трет-бутил-дикарбонату (2.18г) у ДХМ (20мл) і перемішували при кімнатній температурі протягом 15год. Суміш розбавляли Н2О і двічі екстрагували ДХМ, об'єднані органічні шари сушили, фільтрували й випаровували, одержуючи біс-ВОС матеріал (кільк.). 1Н-ЯМР (300МГц, CDCl3) δ 7.8 (dd, 1H), 7.3 (m, 2H), 1.4 (s, 18H). Трет-бутил-4-фтор-2-нітрофенілкарбамат. (Процедура: Connell, R. D.; Rein, Т.; Akermark, В.; Helquist, P. J. J. Org. Chem. 1988, 53, 3845) До перемішуваного розчину Біс-ВОС-матеріалу в ДХМ (20мл) додали ТФОК (0.58мл). Через 3год. реакцію гасили водн. NaHCО3 (5мл), додали розсіл, і суміш відокремлювали й екстрагували додатковою кіль
ДивитисяДодаткова інформація
Назва патенту англійською7-substituted purine derivatives for immunosuppression
Автори англійськоюOhlmeyer, Michael, Bohnstedt, Adolph, Kingsbury, Celia, Ho, Koc-Kan, Quintero, Jorge
Назва патенту російською7-замещенные производные пурина для иммуносупрессии
Автори російськоюОльмейер Майкл, Бонштедт Адольф, Кингсбари Селиа, Хо Кок-Кан, Куинтеро Джордж
МПК / Мітки
МПК: C07D 487/04, C07D 519/00, A61K 31/522, A61P 37/06
Мітки: імуносупресії, 7-заміщені, пурину, похідні
Код посилання
<a href="https://ua.patents.su/66-93808-7-zamishheni-pokhidni-purinu-dlya-imunosupresi.html" target="_blank" rel="follow" title="База патентів України">7-заміщені похідні пурину для імуносупресії</a>
Попередній патент: Пристрій для відновлення вогнетривкої кладки шахтної печі
Наступний патент: Фільтр струмів нульової послідовності основної та вищих гармонік
Випадковий патент: Спосіб визначення вмісту теофіліну