Сполуки n-арилтриазолу як антагоністи рецепторів лізофосфатидної кислоти (lpar)
Номер патенту: 110310
Опубліковано: 10.12.2015
Автори: Сіддурі Ачютарао, Цянь Імінь, Гамільтон Метью Майкл, Гебріель Стівен Дімс
Формула / Реферат
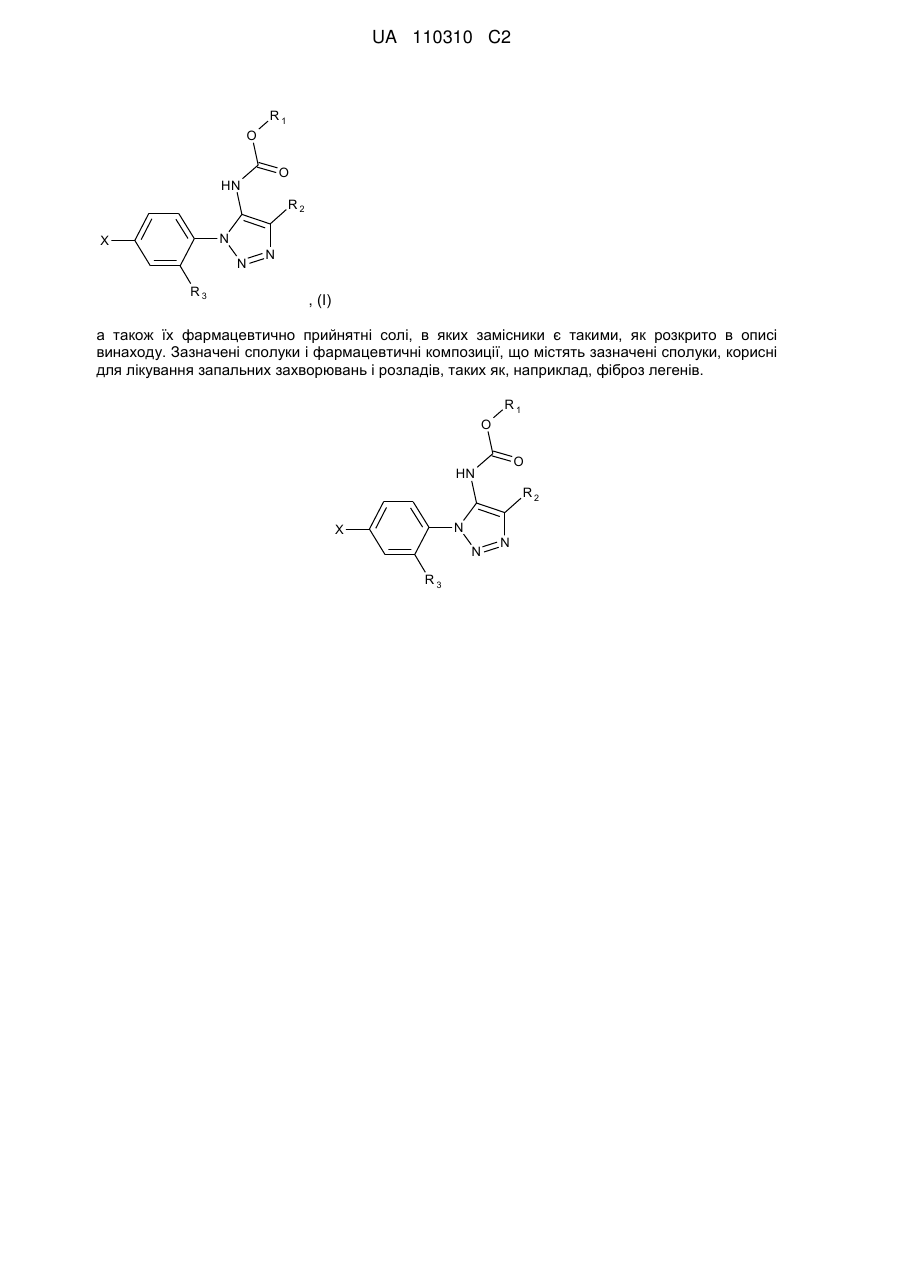
1. Сполука формули (І):
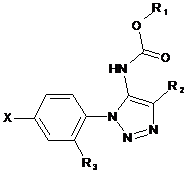 , (І)
, (І)
де:
R1 позначає нижчий алкіл або інданіл, причому зазначений нижчий алкіл незаміщений або заміщений циклоалкілом, незаміщеним фенілом або фенілом, заміщеним галогеном або -CF3;
R2 позначає водень або нижчий алкіл;
R3 позначає водень, фтор або -ОСН3;
X позначає циклоалкілоцтову кислоту або
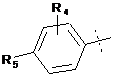 ;
;
R4 позначає водень або галоген;
R5 позначає водень, ціаногрупу, тетразолциклопропіл, метансульфоніламінокарбонілциклопропіл або
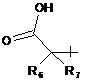 ;
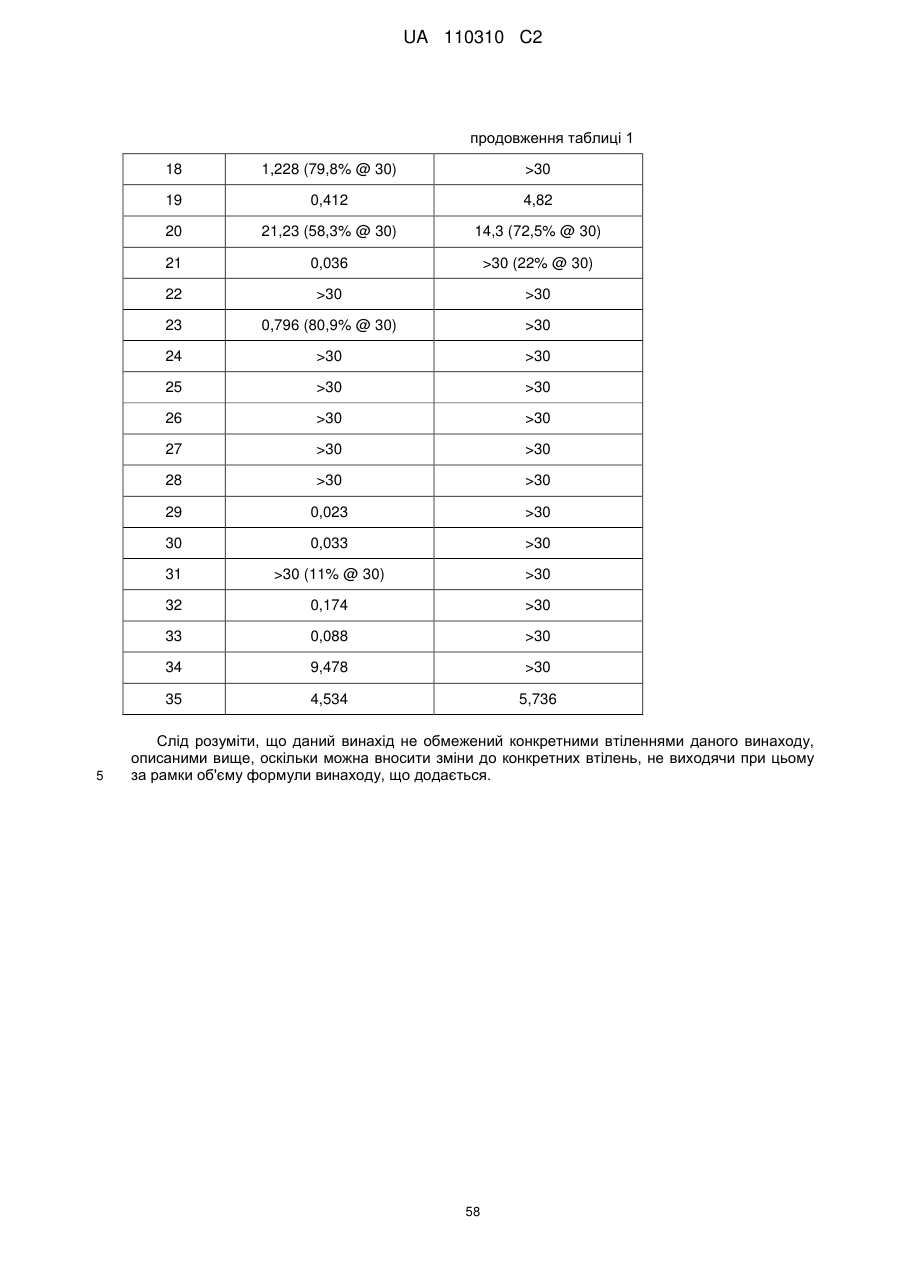
;
R6 і R7 позначають незалежно один від одного водень або нижчий алкіл; або
R6 і R7, спільно з атомом вуглецю, до якого вони приєднані, утворюють циклоалкільну групу;
або її фармацевтично прийнятна сіль.
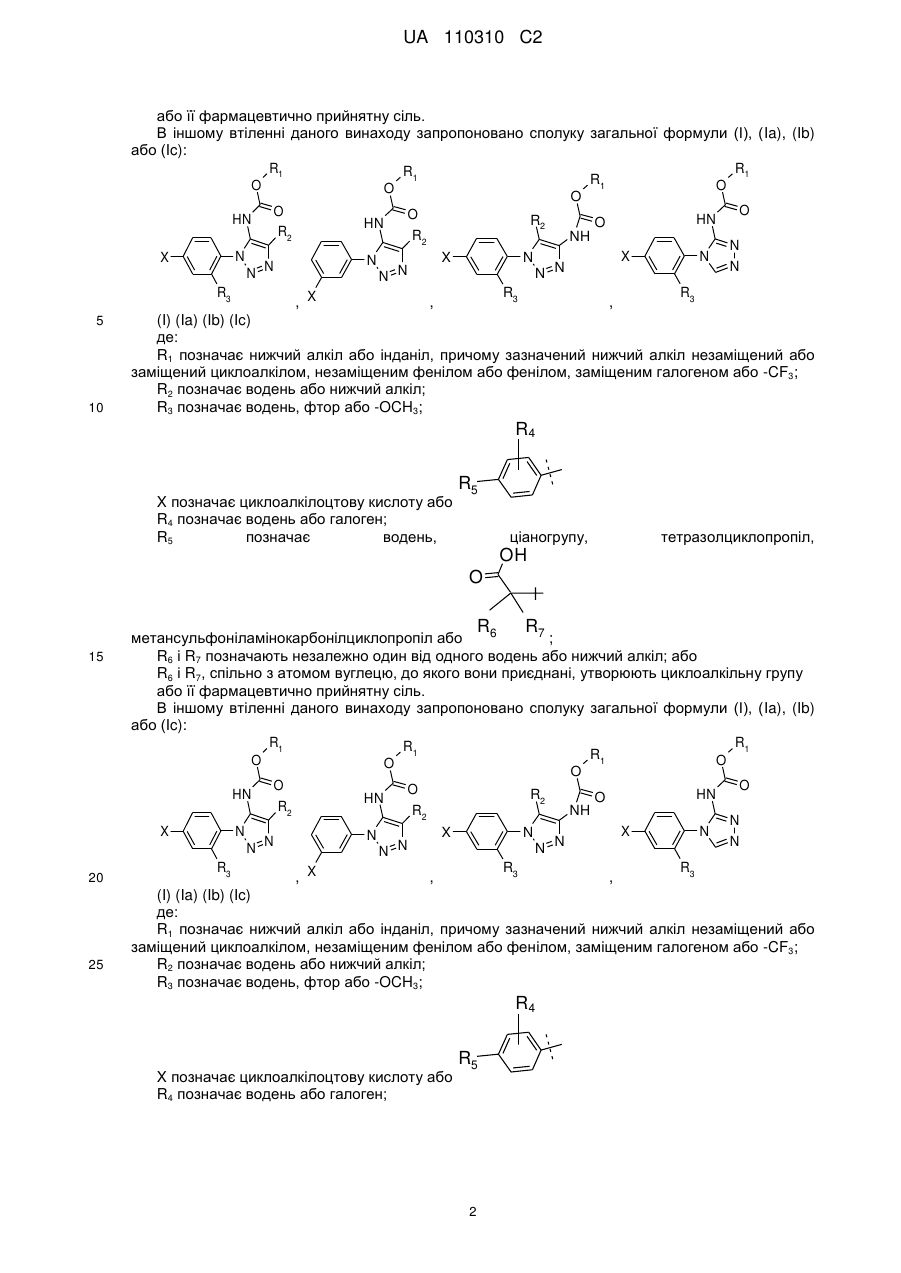
2. Сполука загальної формули (І), (Ia), (Ib) або (Іс):
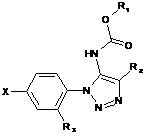 ,
,
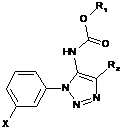 ,
,
 ,
,
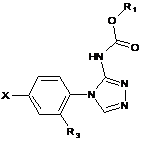 ,
,
(I)
(Іa)
(Іb)
(Іс)
де:
R1 позначає нижчий алкіл або інданіл, причому зазначений нижчий алкіл незаміщений або заміщений циклоалкілом, незаміщеним фенілом або фенілом, заміщеним галогеном або -CF3;
R2 позначає водень або нижчий алкіл;
R3 позначає водень, фтор або -ОСН3;
X позначає циклоалкілоцтову кислоту або
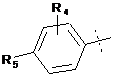 ;
;
R4 позначає водень або галоген;
R5 позначає водень, ціаногрупу, тетразолциклопропіл, метансульфоніламінокарбонілциклопропіл або
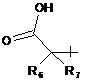 ;
;
R6 і R7 позначають незалежно один від одного водень або нижчий алкіл; або
R6 і R7, спільно з атомом вуглецю, до якого вони приєднані, утворюють циклоалкільну групу;
або її фармацевтично прийнятна сіль.
3. Сполука формули (І), (Ia), (Ib) або (Іс):
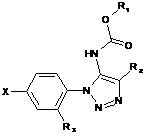 ,
,
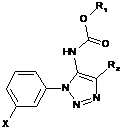 ,
,
 ,
,
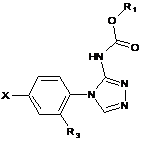 ,
,
(I)
(Іa)
(Іb)
(Іс)
де:
R1 позначає нижчий алкіл або інданіл, причому зазначений нижчий алкіл незаміщений або заміщений циклоалкілом, незаміщеним фенілом або фенілом, заміщеним галогеном або -CF3;
R2 позначає водень або нижчий алкіл;
R3 позначає водень, фтор або -ОСН3;
X позначає циклоалкілоцтову кислоту або
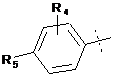 ;
;
R4 позначає водень або галоген;
R5 позначає водень, ціаногрупу, тетразолциклопропіл, метансульфоніламінокарбонілциклопропіл або
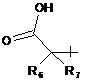 ;
;
R6 і R7 позначають незалежно один від одного водень, нижчий алкіл або нижчий алкеніл; або
R6 і R7, спільно з атомом вуглецю, до якого вони приєднані, утворюють циклоалкільну групу;
або її фармацевтично прийнятна сіль.
4. Сполука за будь-яким з пп. 1-3, де R1 позначає незаміщений нижчий алкіл.
5. Сполука за будь-яким з пп. 1-4, де R1 позначає диметилпропіл, бутил або ізопропіл.
6. Сполука за будь-яким з пп. 1-3, де R1 позначає нижчий алкіл, заміщений циклоалкілом, незаміщений феніл або феніл, заміщений галогеном або -CF3.
7. Сполука за п. 6, де R1 позначає -СН(СН3)-феніл, -СН(СН3)-фторфеніл, -СН(СН3)-трифторметилфеніл, етилциклопропіл або етилциклобутил.
8. Сполука за будь-яким з пп. 1-7, де R2 позначає нижчий алкіл.
9. Сполука за будь-яким з пп. 1-8, де R2 позначає метил.
10. Сполука за будь-яким з пп. 1-9, де R3 позначає водень.
11. Сполука за будь-яким з пп. 1-10, де X позначає циклогексилоцтову кислоту.
12. Сполука за будь-яким з пп. 1-10, де X позначає
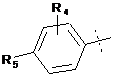 .
.
13. Сполука за п. 12, де R4 позначає водень або фтор.
14. Сполука за п. 12, де R5 позначає водень, ціаногрупу, тетразолциклопропіл або метансульфоніламінокарбонілциклопропіл.
15. Сполука за п. 12, де R5 позначає
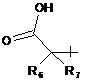 .
.
16. Сполука за п. 12, де R6 і R7 позначають незалежно один від одного водень або метил.
17. Сполука за п. 12, де R6 і R7, спільно з атомом вуглецю, до якого вони приєднані, утворюють циклопропільну групу.
18. Сполука за п. 1 де R1 позначає нижчий алкіл або інданіл, причому зазначений нижчий алкіл незаміщений або заміщений циклоалкілом або незаміщеним фенілом; R2 позначає водень або нижчий алкіл; R3 позначає водень, фтор або -ОСН3; X позначає циклоалкілоцтову кислоту або
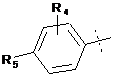 ;
;
при цьому R4 позначає водень або галоген, а R5 позначає водень, ціаногрупу, тетразолциклопропіл, метансульфоніламінокарбонілциклопропіл або
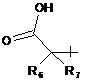 ;
;
при цьому R6 і R7 позначають незалежно один від одного водень або нижчий алкіл; або R6 і R7, спільно з атомом вуглецю, до якого вони приєднані, утворюють циклоалкільну групу;
або її фармацевтично прийнятна сіль.
19. Сполука за п. 1, де R1 позначає нижчий алкіл, заміщений незаміщеним фенілом; R2 позначає водень або нижчий алкіл; R3 позначає водень, фтор або -ОСН3; X позначає циклоалкілоцтову кислоту або
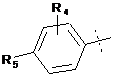 ;
;
при цьому R4 позначає водень або галоген і R5 позначає водень, ціаногрупу, тетразолциклопропіл, метансульфоніламінокарбонілциклопропіл або
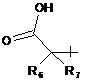 ;
;
при цьому R6 і R7 позначають незалежно один від одного водень або нижчий алкіл; або R6 і R7, спільно з атомом вуглецю, до якого вони приєднані, утворюють циклоалкільну групу;
або її фармацевтично прийнятна сіль.
20. Сполука за п. 1, де R1 позначає нижчий алкіл або інданіл, причому зазначений нижчий алкіл незаміщений або заміщений циклоалкілом, незаміщеним фенілом або фенілом, заміщеним галогеном або -CF3; R2 позначає етил; R3 позначає водень, фтор або -ОСН3; X позначає циклоалкілоцтову кислоту або
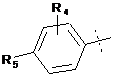 ;
;
при цьому R4 позначає водень або галоген і R5 позначає водень, ціаногрупу, тетразолциклопропіл, метансульфоніламінокарбонілциклопропіл або
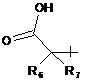 ;
;
при цьому R6 і R7 позначають незалежно один від одного водень або нижчий алкіл; або R6 і R7, спільно з атомом вуглецю, до якого вони приєднані, утворюють циклоалкільну групу;
або її фармацевтично прийнятна сіль.
21. Сполука за п. 1, де R1 позначає нижчий алкіл або інданіл, причому зазначений нижчий алкіл незаміщений або заміщений циклоалкілом, незаміщеним фенілом або фенілом, заміщеним галогеном або -CF3; R2 позначає водень або нижчий алкіл; R3 позначає водень, фтор або -ОСН3; X позначає циклоалкілоцтову кислоту або
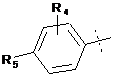 ;
;
при цьому R4 позначає водень або галоген, a R5 позначає
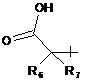 ;
;
при цьому R6 і R7, спільно з атомом вуглецю, до якого вони приєднані, утворюють циклоалкільну групу;
або її фармацевтично прийнятна сіль.
22. Сполука за п. 1, де R1 позначає нижчий алкіл, заміщений незаміщеним фенілом; R2 позначає водень або нижчий алкіл; R3 позначає водень, фтор або -ОСН3; X позначає циклоалкілоцтову кислоту або
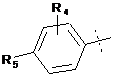 ;
;
при цьому R4 позначає водень або галоген, a R5 позначає
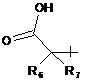 ;
;
при цьому R6 і R7, спільно з атомом вуглецю, до якого вони приєднані, утворюють циклоалкільну групу;
або її фармацевтично прийнятна сіль.
23. Сполука за п. 1, де R1 позначає нижчий алкіл або інданіл, причому зазначений нижчий алкіл незаміщений або заміщений циклоалкілом, незаміщеним фенілом або фенілом, заміщеним галогеном або -CF3; R2 позначає водень або нижчий алкіл; R3 позначає водень, фтор або -ОСН3; X позначає циклоалкілоцтову кислоту або
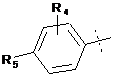 ;
;
при цьому R4 позначає водень або галоген, a R5 позначає метансульфоніламінокарбонілциклопропіл;
або її фармацевтично прийнятна сіль.
24. Сполука формули (Іа) за п. 2 або 3, де R1 позначає нижчий алкіл, заміщений незаміщеним фенілом; R2 позначає нижчий алкіл; X позначає
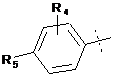 ;
;
при цьому R4 позначає водень і R5 позначає
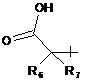 ;
;
R6 і R7 позначають водень, або R6 і R7, спільно з атомом вуглецю, до якого вони приєднані, утворюють циклоалкільну групу;
або її фармацевтично прийнятна сіль.
25. Сполука формули (Іb) за п. 2 або 3, де R1 позначає нижчий алкіл, заміщений незаміщеним фенілом; R2 позначає нижчий алкіл; R3 позначає водень; X позначає
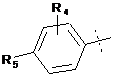 ;
;
при цьому R4 позначає водень і R5 позначає
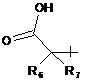 ;
;
при цьому R6 і R7 позначають водень або R6 і R7, спільно з атомом вуглецю, до якого вони приєднані, утворюють циклоалкільну групу;
або її фармацевтично прийнятна сіль.
26. Сполука формули (Іс) за п. 2 або 3, де R1 позначає нижчий алкіл, заміщений незаміщеним фенілом; R3 позначає водень; X позначає
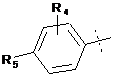 ;
;
при цьому R4 позначає водень і R5 позначає
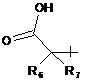 ;
;
при цьому R6 і R7, спільно з атомом вуглецю, до якого вони приєднані, утворюють циклоалкільну групу;
або її фармацевтично прийнятна сіль.
27. Сполука за п. 1, де зазначену сполуку вибирають з групи, яка включає:
1-{4'-[4-мeтил-5-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]біфеніл-4-іл}циклопропанкарбонову кислоту;
{4'-[4-мeтил-5-((R)-1-фeнiлeтoкcикapбoнiлaмiнo)-[1,2,3]тpиaзoл-1-iл]бiфeнiл-4-iл}оцтову кислоту;
1-(4'-[5-мeтил-4-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]біфеніл-4-іл}циклопропанкарбонову кислоту;
{4'-[5-метил-4-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]біфеніл-4-іл}оцтову кислоту;
1-(4'-{5-[(R)-1-(2-фторфеніл)етоксикарбоніламіно]-4-метил-[1,2,3]триазол-1-іл}біфеніл-4-іл)циклопропанкарбонову кислоту;
1-(4'-{4-метил-5-[(R)-1-(2-трифторметилфеніл)етоксикарбоніламіно]-[1,2,3]триазол-1-іл}біфеніл-4-іл)циклопропанкарбонову кислоту;
1-(4'-{4-метил-5-[(R)-1-(3-трифторметилфеніл)етоксикарбоніламіно]-[1,2,3]триазол-1-іл}біфеніл-4-іл)циклопропанкарбонову кислоту;
1-{4'-[5-((R)-індан-1-ілоксикарбоніламіно)-4-метил-[1,2,3]триазол-1-іл]біфеніл-4-іл}циклопропанкарбонову кислоту;
1-{4'-[5-((R)-1,2-диметилпропоксикарбоніламіно)-4-метил-[1,2,3]триазол-1-іл]біфеніл-4-іл}циклопропанкарбонову кислоту;
1-{4'-[5-((R)-втор-бутоксикарбоніламіно)-4-метил-[1,2,3]триазол-1-іл]біфеніл-4-іл}циклопропанкарбонову кислоту;
1-[4'-(5-ізопропоксикарбоніламіно-4-метил-[1,2,3]триазол-1-іл)-біфеніл-4-іл]циклопропанкарбонову кислоту;
1-{4'-[5-(1-циклопропілетоксикарбоніламіно)-4-метил-[1,2,3]триазол-1-іл]біфеніл-4-іл}циклопропанкарбонову кислоту;
1-{4'-[5-(1-циклобутилетоксикарбоніламіно)-4-метил-[1,2,3]триазол-1-іл]біфеніл-4-іл}циклопропанкарбонову кислоту;
1-[4'-(5-трет-бутоксикарбоніламіно-4-метил-[1,2,3]триазол-1-іл)-біфеніл-4-іл]циклопропанкарбонову кислоту;
1-{3-фтор-4'-[4-метил-5-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]біфеніл-4-іл}циклопропанкарбонову кислоту;
1-{3'-метокси-4'-[4-метил-5-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]біфеніл-4-іл}циклопропанкарбонову кислоту;
1-{4'-[4-етил-5-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]біфеніл-4-іл}циклопропанкарбонову кислоту;
{4'-[4-етил-5-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]біфеніл-4-іл}оцтову кислоту;
1-(4'-{4-етил-5-[(R)-1-(3-трифторметилфеніл)етоксикарбоніламіно]-[1,2,3]триазол-1-іл}біфеніл-4-іл)циклопропанкарбонову кислоту;
{4'-[4-етил-5-((R)-1-(3-трифторметилфенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]біфеніл-4-іл}оцтову кислоту;
1-{4'-[5-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]біфеніл-4-іл}циклопропанкарбонову кислоту;
{4'-[5-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]біфеніл-4-іл}оцтову кислоту;
2-метил-2-{4'-[4-метил-5-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]біфеніл-4-іл}пропіонову кислоту;
(R)-1-(4'-(4-метил-5-((1-фенілетокси)карбоніламіно)-1Н-1,2,3-триазол-1-іл)біфеніл-3-іл)циклопропанкарбонову кислоту;
1-{3'-[4-метил-5-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]біфеніл-4-іл}циклопропанкарбонову кислоту;
{3'-[4-мeтил-5-((R)-1-фeнiлeтoкcикapбoнiлaмiнo)-[1,2,3]тpиaзoл-1-iл]-бiфeнiл-4-iл}oцтoву кислоту;
(R)-1-фенілетиловий ефір (3-біфеніл-4-іл-5-метил-3Н-[1,2,3]триазол-4-іл)карбамінової кислоти;
(R)-1-фенілетиловий ефір [3-(4'-ціанобіфеніл-4-іл)-5-метил-3Н-[1,2,3]триазол-4-іл]карбамінової кислоти;
(R)-1-фенілетил-1-(4'-(1-(1Н-тетразол-5-іл)циклопропіл)біфеніл-4-іл)-4-метил-1Н-1,2,3-триазол-5-ілкарбамат;
(R)-1-фенілетиловий ефір {3-[4'-(1-метансульфоніламінокарбонілциклопропіл)-біфеніл-4-іл]-5-метил-3Н-[1,2,3]триазол-4-іл}карбамінової кислоти;
1-{4'-[3-((R)-1-фенілетоксикарбоніламіно)-[1,2,4]триазол-4-іл]біфеніл-4-іл}циклопропанкарбонову кислоту;
(R)-1-(4'-(4-метил-5-((1-фенілетокси)карбоніламіно)-1Н-1,2,3-триазол-1-іл)біфеніл-4-іл)циклобутанову кислоту;
(R)-2-{4'-[4-метил-5-(1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]біфеніл-4-іл}пент-4-енову кислоту;
(R)-2-(4-(4-(4-метил-5-((1-фенілетокси)карбоніламіно)-1Н-1,2,3-триазол-1-іл)феніл)циклогексил)оцтову кислоту або
(R)-1-(3-трифторметилфеніл)етиловий ефір {3-[4'-(1-метансульфоніламінокарбонілциклопропіл)біфеніл-4-іл]-5-метил-3Н-[1,2,3]триазол-4-іл}карбамінової кислоти.
28. Сполука за будь-яким з пп. 1-27 для застосування як терапевтично активної речовини.
29. Фармацевтична композиція, що включає терапевтично ефективну кількість сполуки за будь-яким з пп. 1-27 і терапевтично інертний носій.
30. Застосування сполуки за будь-яким з пп. 1-27 для лікування або профілактики фіброзу легенів.
31. Застосування сполуки за будь-яким з пп. 1-27 для виготовлення лікарського засобу для лікування або профілактики фіброзу легенів.
32. Сполука за будь-яким з пп. 1-27 для лікування або профілактики фіброзу легенів.
33. Спосіб лікування або профілактики фіброзу легенів, що включає стадію, за якою пацієнтові, який цього потребує, вводять ефективну кількість сполуки, розкритої в будь-якому з пп. 1-27.
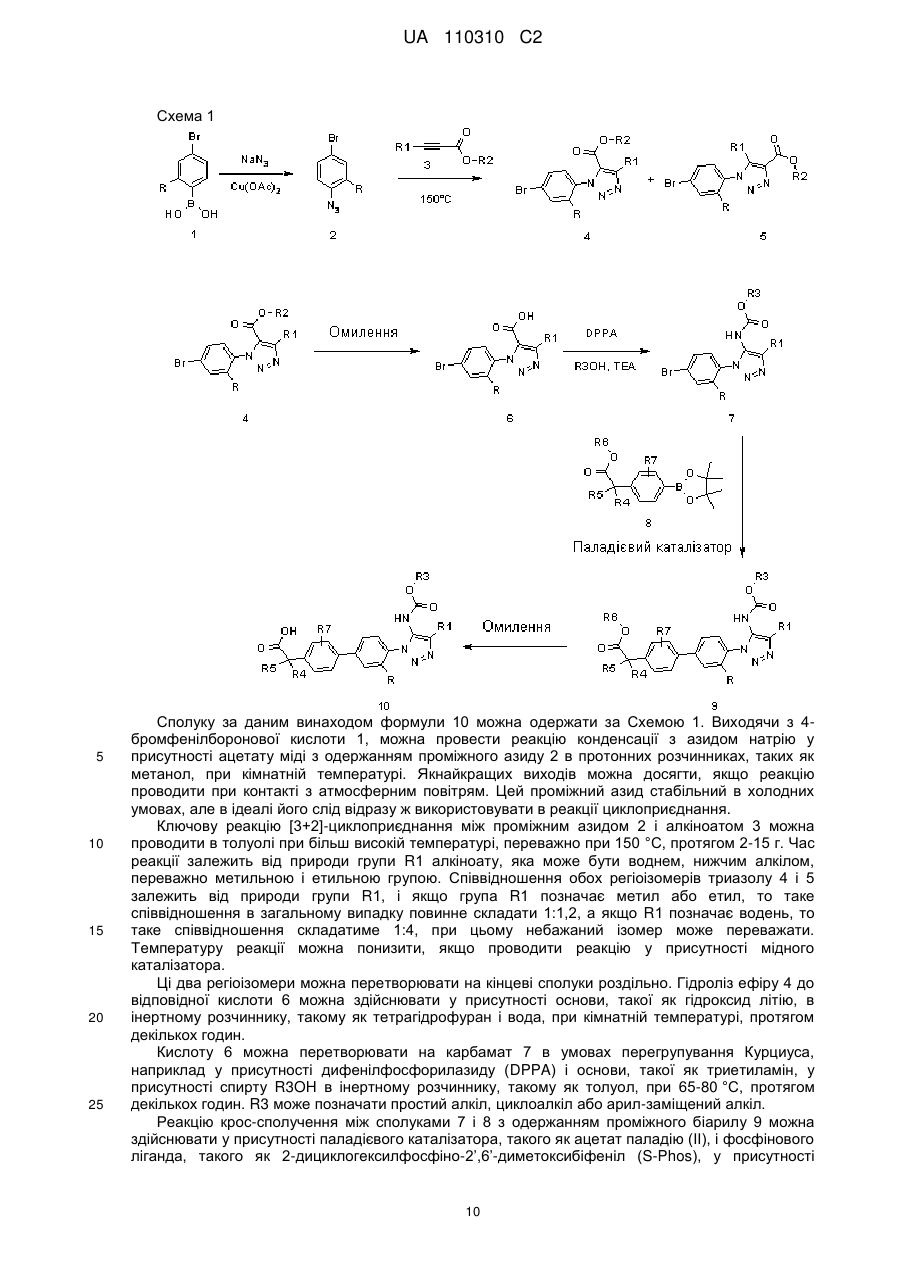
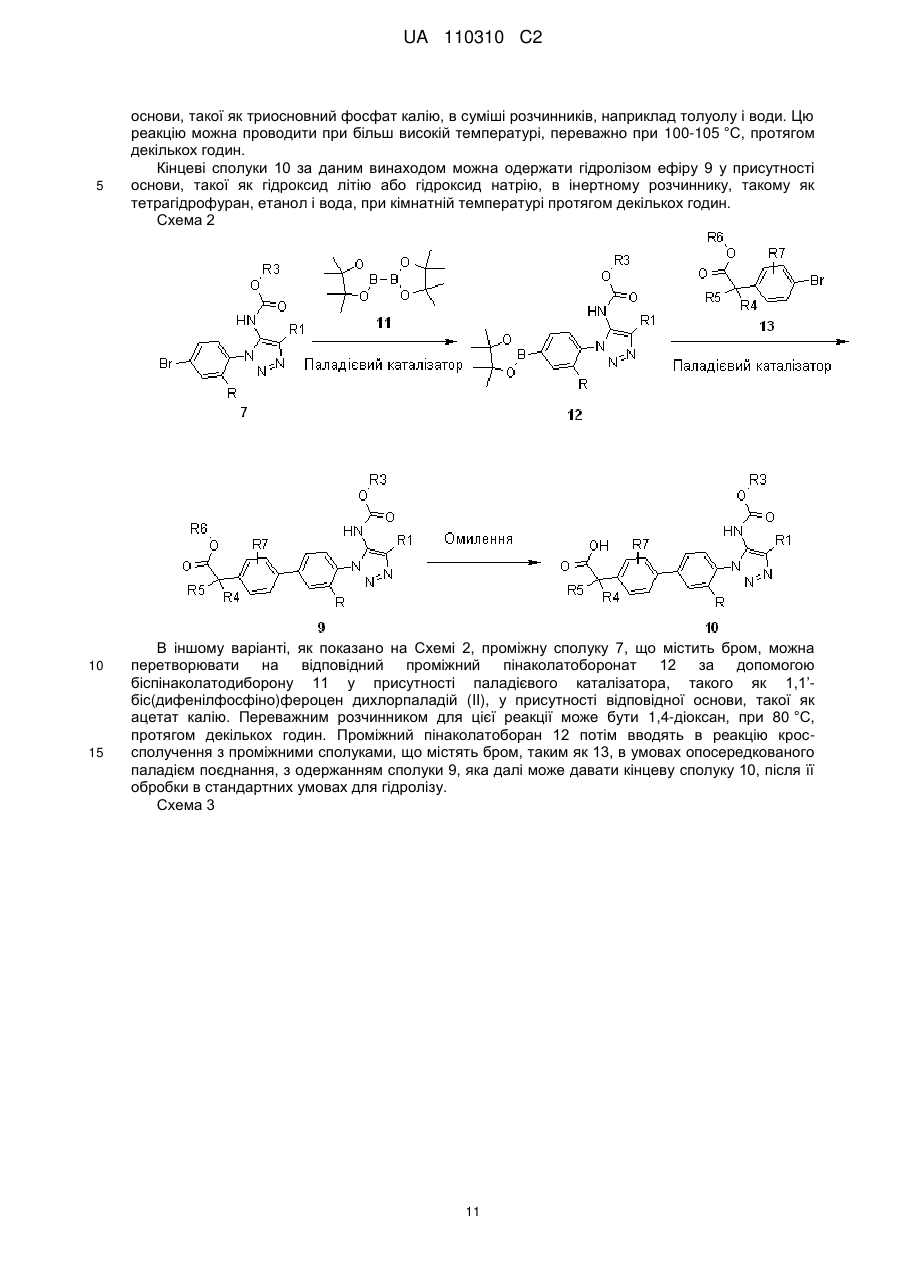
Текст
Реферат: Запропоновані сполуки формули (І): UA 110310 C2 (12) UA 110310 C2 R1 O O HN R2 N X N R3 N , (І) а також їх фармацевтично прийнятні солі, в яких замісники є такими, як розкрито в описі винаходу. Зазначені сполуки і фармацевтичні композиції, що містять зазначені сполуки, корисні для лікування запальних захворювань і розладів, таких як, наприклад, фіброз легенів. R1 O O HN R2 N X N R3 N UA 110310 C2 5 10 15 20 25 30 Даний винахід відноситься до органічних сполук, корисних для лікування та/або профілактики у ссавців запального захворювання або розладу, зокрема, до сполук Nарилтриазолу, їх одержання, фармацевтичних композицій, що їх містять, та їх застосування як антагоністів лізофосфатидної кислоти (LPA). LPA є сімейством біологічно активних фосфоліпідів, які діють як медіатор ростового фактора за рахунок взаємодії з рецепторами LPA, що належать до сімейства рецепторів, зв'язаних з Gбілком (GPCR). Дане сімейство ліпідів має довгі насичені (наприклад C18:0 або C16:0) або ненасичені (C18:1 або C20:4) вуглецеві ланцюги, приєднані до гліцерину за допомогою ефірного зв'язку. У біологічних системах LPA синтезується в ході багатостадійних процесів за участю ферментів, через де-етерифікацію мембранних фосфоліпідів. До ферментів, що беруть участь в синтезі LPA, відносяться лізофосфоліпаза D (lysoPLD), аутотаксин (ATX), фосфоліпаза A1 (PLA1), фосфоліпаза A2 (PLA2) і ацилгліцеринкіназа (AGK) (British J. of Pharmacology 2012, 165, 829-844). Було ідентифіковано щонайменше шість рецепторів LPA (LPAR1-6). Сигнальний шлях LPA викликає широкий спектр біологічних відгуків в багатьох клітинах різних типів, які можуть приводити до клітинного зростання, клітинної проліферації, клітинної міграції і клітинного скорочення. Активація LPA-шляху зв'язана з багатьма захворюваннями, включаючи рак, алергічне запалення дихальних шляхів, а також фіброз нирок, легенів і печінки. Таким чином, націлювання на рецептори LPA або метаболічні ферменти LPA може давати нові підходи до лікування істотних з медичної точки зору захворювань, що включають психоневрологічні розлади, невропатичний біль, безпліддя, серцево-судинні захворювання, запалення, фіброз і рак (Annu. Rev. Pharmacol. Toxicol. 2010, 50, 157-186; J. Biochem. 2011, 150, 223-232). Фіброз є результатом неконтрольованого процесу заліковування тканини, який веде до надмірного накопичення позаклітинного матриксу (ECM). Недавно було зроблено повідомлення про те, що у пацієнтів з ідіопатичним пневмосклорозом (IPF) спостерігається над-експресія рецептора LPA1. Миші, нокаутовані по рецептору LPA1, були захищені від індукованого блеоміцином фіброзу легенів (Nature Medicine 2008, 14, 45-54). Таким чином, антагонізм рецептора LPA1 може бути корисний для лікування фіброзу, наприклад фіброзу нирок, фіброзу легенів, фіброзу артерій і системного склерозу. В одному втіленні даного винаходу запропоновано сполуку загальної формули (I): R1 O HN N X O R2 N N R3 35 (I) де: R1 позначає нижчий алкіл або інданіл, причому зазначений нижчий алкіл незаміщений або заміщений циклоалкілом, незаміщеним фенілом або фенілом, заміщеним галогеном або групою -CF3; R2 позначає водень або нижчий алкіл; R3 позначає водень, фтор або -OCH3; R4 40 X позначає циклоалкілоцтову кислоту або R4 позначає водень або галоген; R5 позначає водень, R5 ; ціаногрупу, тетразолциклопропіл, OH O R R 6 7 метансульфоніламінокарбонілциклопропіл або ; R6 і R7 позначають незалежно один від одного водень або нижчий алкіл; або R6 і R7, спільно з атомом вуглецю, до якого вони приєднані, утворюють циклоалкільну групу 1 UA 110310 C2 5 10 або її фармацевтично прийнятну сіль. В іншому втіленні даного винаходу запропоновано сполуку загальної формули (I), (Ia), (Ib) або (Ic): R1 R1 R1 R1 O O O O O O O HN HN R2 O HN R2 R2 NH N N N X X N X N N N N N N N N R3 R3 R3 , X , , (I) (Ia) (Ib) (Ic) де: R1 позначає нижчий алкіл або інданіл, причому зазначений нижчий алкіл незаміщений або заміщений циклоалкілом, незаміщеним фенілом або фенілом, заміщеним галогеном або -CF3; R2 позначає водень або нижчий алкіл; R3 позначає водень, фтор або -OCH3; R4 X позначає циклоалкілоцтову кислоту або R4 позначає водень або галоген; R5 позначає водень, R5 ціаногрупу, тетразолциклопропіл, OH O R 15 20 25 R 6 7 метансульфоніламінокарбонілциклопропіл або ; R6 і R7 позначають незалежно один від одного водень або нижчий алкіл; або R6 і R7, спільно з атомом вуглецю, до якого вони приєднані, утворюють циклоалкільну групу або її фармацевтично прийнятну сіль. В іншому втіленні даного винаходу запропоновано сполуку загальної формули (I), (Ia), (Ib) або (Ic): R1 R1 R1 R1 O O O O O O O HN HN R2 O HN R2 R2 NH N N N X X N X N N N N N N N N R3 R3 R3 , X , , (I) (Ia) (Ib) (Ic) де: R1 позначає нижчий алкіл або інданіл, причому зазначений нижчий алкіл незаміщений або заміщений циклоалкілом, незаміщеним фенілом або фенілом, заміщеним галогеном або -CF3; R2 позначає водень або нижчий алкіл; R3 позначає водень, фтор або -OCH3; R4 X позначає циклоалкілоцтову кислоту або R4 позначає водень або галоген; R5 2 UA 110310 C2 R5 позначає водень, ціаногрупу, тетразолциклопропіл, OH O R 5 10 15 20 25 30 35 40 45 50 55 R 6 7 метансульфоніламінокарбонілциклопропіл або ; R6 і R7 позначають незалежно один від одного водень, нижчий алкіл або нижчий алкеніл; або R6 і R7, спільно з атомом вуглецю, до якого вони приєднані, утворюють циклоалкільну групу або її фармацевтично прийнятні солі. Ще в одному втіленні даного винаходу запропонована фармацевтична композиція, що включає терапевтично ефективну кількість сполуки формули (I) і терапевтично інертний носій. Ще в одному втіленні даного винаходу запропонований спосіб лікування або профілактики фіброзу легенів, що включає стадію введення терапевтично ефективної кількості сполуки формули (I) пацієнтові, який цього потребує. Всі документи, на які нижче дани посилання або на яких заснований даний опис, явним чином включені в зміст даної заявки за допомогою посилання. Якщо не вказане інше, нижче наступні спеціальні терміни мають розкрите далі значення. У даному тексті термін “алкіл”, окремо або в комбінації з іншими групами, означає моновалентний насичений аліфатичний вуглеводневий радикал з розгалуженим або лінійним ланцюгом, що включає від одного до двадцяти атомів вуглецю, переважно від одного до шістнадцяти атомів вуглецю, переважніше, від одного до десяти атомів вуглецю. Термін “нижчий алкіл”, окремо або в комбінації з іншими групами, означає алкільний радикал з розгалуженим або лінійним ланцюгом, що включає від одного до дев'яти атомів вуглецю, переважно від одного до шести атомів вуглецю, переважніше від одного до чотирьох атомів вуглецю. Цей термін далі розкритий прикладами таких радикалів, як метил, етил, н-пропіл, ізопропіл, н-бутил, втор-бутил, ізобутил, трет-бутил, н-пентил, 3-метилбутил, н-гексил, 2етилбутил і т. п. Термін “циклоалкіл” означає моновалентний моно- або полікарбоциклічний радикал, що включає від трьох до десяти, переважно від трьох до шести атомів вуглецю. Цей термін далі розкритий прикладами таких радикалів, як циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, норборніл, адамантил і т. п. У переважному втіленні “циклоалкільні” групи можуть не обов'язково містити один, два, три або чотири заступники, при цьому мається на увазі, що зазначені заступники не заміщені у свою чергу далі. Кожен заступник може незалежно бути алкілом, алкоксигрупою, галогеном, аміногрупою, гідроксилом або киснем (O=), якщо не вказане інше. Приклади циклоалкільних груп включають, без обмеження, можливо заміщений циклопропіл, можливо заміщений циклобутил, можливо заміщений циклопентил, можливо заміщений циклопентеніл, можливо заміщений циклогексил, можливо заміщений циклогексилен, можливо заміщений циклогептил і т. п., або такі, які наведені в конкретних прикладах в даному описі. Термін “гетероциклоалкіл” означає моно- або поліциклічне алкільне кільце, в якому один, два або три з кілець атома вуглецю заміщені гетероатомом, таким як N, O або S. Прикладами гетероциклоалкільних груп є, без обмеження, морфолініл, тіоморфолініл, піперазиніл, піперидиніл, піролідиніл, тетрагідропіраніл, тетрагідрофураніл, 1,3-діоксаніл і т. п. Гетероциклоалкільні групи можуть бути незаміщеними або заміщеними, і можуть приєднуватися за допомогою свого вуглецевого каркаса або за рахунок свого(їх) гетероатома(ів), де це можливо, при цьому мається на увазі, що зазначені заступники у свою чергу не заміщені далі. Термін “арил” означає ароматичний моно- або полікарбоциклічний радикал, що включає від 6 до 12 атомів вуглецю, зокрема щонайменше одне ароматичне кільце. Приклади таких груп включають, без обмеження, феніл, нафтил, 1,2,3,4-тетрагідронафталін, 1,2-дигідронафталін, інданіл, 1H-інденіл і т. п. Термін "гетероарил" означає ароматичний моно- або поліциклічний радикал, що включає від 5 до 12 атомів, містить щонайменше одне ароматичне кільце, що включає один, два або три кільцеві гетероатоми, вибранї з N, O, і S, при цьому залишені атоми кільця є атомами C. Приклади таких груп включають, без обмеження, піридин, тіазол і піраніл. Алкільна, нижча алкільна, арильна і гетероарильна групи, описані вище, можуть незалежно містити один, два або три заступники, при цьому мається на увазі, що зазначені заступники у свою чергу не заміщені далі. Заступники можуть включати, наприклад, галоген, нижчий алкіл CF3, -SO2CH3, алкоксигрупу, -C(O)CH3, -OH, -SCH3 и -CH2CH2OH. Використовуваний в даному тексті термін “алкокси” позначає алкіл-O-; а термін “алкоїл” означає алкіл-CO-. Алкоксигрупи-замісники або алкокси-містячі групи-заступники можуть бути 3 UA 110310 C2 5 10 15 20 25 30 35 40 45 50 55 60 заміщені, наприклад, однією або більше алкільними групами, при цьому мається на увазі, що зазначені заступники у свою чергу не заміщені далі. Використовуваний в даному тексті термін “галоген” означає радикал фтору, хлору, брому або йоду, переважно радикал фтору, хлору або брому, і переважніше радикал фтору або хлору. Сполуки формули I можуть містити один або більше асиметричних атомів вуглецю і можуть існувати у формі оптично чистих енантіомерів, сумішей енантіомерів, таких як, наприклад, рацемати, оптично чисті діастереомери, суміші діастереомерів, діастереомерні рацемати або суміші діастереомерних рацематів. Оптично активні форми можна одержати, наприклад, розділенням рацематів, шляхом асиметричного синтезу або за допомогою асиметричної хроматографії (хроматографії з хіральними абсорбентами або елюентом). Даний винахід охоплює всі такі форми. У даному тексті термін “фармацевтично прийнятна сіль” означає будь-яку фармацевтично прийнятну сіль сполуки формули (I). Солі можна одержати за участю фармацевтично прийнятних нетоксичних кислот і основ, включаючи неорганічні і органічні кислоти і основи. Такі кислоти включають, наприклад, оцтову, бензолсульфонову, бензойну, камфорсульфонову, лимонну, етенсульфонову, дихлороцтову, мурашину, фумарову, глюконову, глутамінову, гіпурову, бромоводневу, хлороводневу, ізетіонову, молочну, малеїнову, яблучну, мигдальну, метансульфонову, муцинову, азотну, щавлеву, памоєву, пантотенову, фосфорну, янтарну, сірчану, винну, п-толуолсульфонову і т. п. Особливо переважними є фумарова, хлороводнева, бромоводнева, фосфорна, янтарна, сірчана і метансульфонова кислота. Прийнятні солі, одержані за участю основи, включають солі лужних металів (наприклад натрію, калію), лужноземельних металів (наприклад кальцію, магнію) і солі алюмінію. При здійсненні способу за даним винаходом ефективна кількість будь-якої сполуки за даним винаходом, або поєднання будь-якої із сполук за даним винаходом, або її фармацевтично прийнятної солі, вводять будь-яким стандартним і прийнятний способом, відомим в даній області техніки, як окремо, так і в поєднанні. Таким чином, сполуки або композиції можна вводити перорально (наприклад, через щокову порожнину), сублінгвально, парентерально (наприклад, внутрішньом'язово, внутрішньовенно або підшкірно), ректально (наприклад, за допомогою супозиторіїв або промивань), трансдермально (наприклад, шляхом шкірної електропорації) або інгаляцією (наприклад, за допомогою аерозолю), а також у формах з твердим, рідким або газоподібним дозуванням, включаючи таблетки і суспензії. Введення можна проводити у вигляді одиничної дозованої лікарської форми в тривалій терапії або терапії одноразовою дозою, за розсудом. Терапевтична композиція може також бути у формі масляної емульсії або дисперсії у поєднанні з ліпофільною сіллю, такою як сіль памоєвої кислоти, або у формі біодеградованої композиції з пролонгованим вивільненням для підшкірного або внутрішньом'язового введення. Корисні фармацевтичні носії, використовувані для виготовлення композицій, можуть бути твердими, рідкими або газоподібними. Таким чином, композиції можуть мати форму таблеток, пілюль, капсул, супозиторіїв, порошків, покритих кишково-розчинною оболонкою або інших захищених лікарських форм (наприклад, пов'язаних з іонообмінними смолами або упакованих в ліпідно-білкові везикули), форм з пролонгованим вивільненням, розчинів, суспензій, еліксирів, аерозолів і т. п. Носій можна вибирати з різних видів масел, включаючи мінеральне, тварине, рослинне або синтетичне, наприклад, арахісове масло, соєве масло, мінеральне масло, кунжутне масло і т. п. Переважними рідкими носіями є вода, фізіологічний розчин, водна декстроза і гліколі, в т.ч. (у разі ізотонічних з кров'ю складів) для розчинів, що ін'єктуються. Наприклад, лікарські форми для внутрішньовенного введення включають стерильні водні розчини діючої(их) речовини(н), які виготовляють шляхом розчинення твердого(их) діючої(их) речовини(н) у воді з одержанням водного розчину і подальшої стерилізації розчину. Відповідні фармацевтичні ексципієнти включають крохмаль, целюлозу, тальк, глюкозу, лактозу, желатин, мальтозу, рис, муку, крейду, силікагель, стеарат магнію, стеарат натрію, гліцерин моностеарат, хлорид натрію, сухе знежирене молоко, гліцерин, пропіленгліколь, воду, етанол і т. п. У такі композиції можна вводити стандартні фармацевтичні добавки, наприклад консерванти, стабілізатори, зволожуючі агенти і емульгатори, солі для варіювання осмотичного тиску, буфери і т. п. Прийнятні фармацевтичні носії та їх лікарські форми описані в наступному джерелі: Remington's Pharmaceutical Sciences (E. W. Martin). Такі композиції у будь-якому випадку міститимуть ефективну кількість діючої речовини разом з відповідним носієм, для забезпечення належної форми дозування для належного введення реципієнтові. Доза сполуки за даним винаходом залежить від ряду факторів, таких як, наприклад, спосіб введення, вік і маса тіла суб'єкта, а також стан суб'єкта, якому проводять лікування, і зрештою, вона буде визначена лікарем-куратором і ветеринаром. На таку кількість діючої речовини, 4 UA 110310 C2 5 10 15 20 визначену лікарем-куратором або ветеринаром, дано посилання в даному тексті, а також у формулі винаходу, під терміном “терапевтично ефективна кількість". Наприклад, доза сполуки за даним винаходом зазвичай складає в інтервалі приблизно від 1 до 1000 мг на добу. Переважно терапевтично ефективною кількістю є кількість приблизно від 1 мг до 500 мг на добу. В одному втіленні даного винаходу запропоновано сполуку формули (I), де R1 позначає диметилпропіл, бутил або ізопропіл. В іншому втіленні даного винаходу запропоновано сполуку формули (I), де R1 позначає нижчий алкіл, заміщений циклоалкіл, незаміщений феніл або феніл, заміщений галогеном або CF3. В іншому втіленні даного винаходу запропоновано сполуку формули (I), де R1 позначає CH(CH3)-феніл, -CH(CH3)-фторфеніл, -CH(CH3)-трифторметилфеніл, етилциклопропіл або етилциклобутил. В іншому втіленні даного винаходу запропоновано сполуку формули (I), де R2 позначає нижчий алкіл. В іншому втіленні даного винаходу запропоновано сполуку формули (I), де R2 позначає метил. В іншому втіленні даного винаходу запропоновано сполуку формули (I), де R3 позначає водень. В іншому втіленні даного винаходу запропоновано сполуку формули (I), де X позначає циклогексилоцтову кислоту. В іншому втіленні даного винаходу запропоновано сполуку формули (I), де X позначає R4 R5 25 . В іншому втіленні даного винаходу запропоновано сполуку формули (I), де R4 позначає водень або фтор. В іншому втіленні даного винаходу запропоновано сполуку формули (I), де R5 позначає водень, ціаногрупу, тетразолциклопропіл або метансульфоніламінокарбонілциклопропіл. В іншому втіленні даного винаходу запропоновано сполуку формули (I), де R5 позначає OH O R6 30 35 R7 . В іншому втіленні даного винаходу запропоновано сполуку формули (I), де R6 і R7 позначають незалежно один від одного водень або метил. В іншому втіленні даного винаходу запропоновано сполуку формули (I), де R6 і R7, спільно з атомом вуглецю, до якого вони приєднані, утворюють циклопропільну групу. В іншому втіленні даного винаходу запропоновано сполуку загальної формули (I), де R1 позначає нижчий алкіл або інданіл, причому зазначений нижчий алкіл незаміщений або заміщений циклоалкілом або незаміщеним фенілом; R2 позначає водень або нижчий алкіл; R3 R4 R5 позначає водень, фтор або -OCH3; X позначає циклоалкілоцтову кислоту або при цьому R4 позначає водень або галоген, а R5 позначає водень, ; ціаногрупу, OH O R 40 R 6 7 тетразолциклопропіл, метансульфоніламінокарбонілциклопропіл або ; при цьому R6 і R7 позначають незалежно один від одного водень або нижчий алкіл; або R6 і R7, спільно з атомом вуглецю, до якого вони приєднані, утворюють циклоалкільну групу, або їх фармацевтично прийнятні солі. 5 UA 110310 C2 В іншому втіленні даного винаходу запропоновано сполуку загальної формули (I), де R1 позначає нижчий алкіл, заміщений незаміщеним фенілом; R2 позначає водень або нижчий алкіл; R3 позначає водень, фтор або -OCH3; X позначає циклоалкілоцтову кислоту або R4 R5 ; при цьому R4 позначає водень або галоген, а R5 позначає водень, ціаногрупу, OH O 5 10 R R 6 7 тетразолциклопропіл, метансульфоніламінокарбонілциклопропіл або ; при цьому R6 і R7 позначають незалежно один від одного водень або нижчий алкіл; або R6 і R7, спільно з атомом вуглецю, до якого вони приєднані, утворюють циклоалкільну групу; або її фармацевтично прийнятну сіль. В іншому втіленні даного винаходу запропоновано сполуку загальної формули (I), де R1 позначає нижчий алкіл або інданіл, причому зазначений нижчий алкіл незаміщений або заміщений циклоалкілом, незаміщеним фенілом або фенілом, заміщеним галогеном або -CF3; R2 позначає етил; R3 позначає водень, фтор або -OCH3; X позначає циклоалкілоцтову кислоту R4 або R5 ; при цьому R4 позначає водень або галоген, а R5 позначає водень, OH O R 15 20 R 6 7 ціаногрупу, тетразолциклопропіл, метансульфониламінокарбонілциклопропіл або ; при цьому R6 і R7 позначають незалежно один від одного водень або нижчий алкіл; або R6 і R7, спільно з атомом вуглецю, до якого вони приєднані, утворюють циклоалкільну групу; або її фармацевтично прийнятну сіль. В іншому втіленні даного винаходу запропоновано сполуку загальної формули (I), де R1 позначає нижчий алкіл або інданіл, причому зазначений нижчий алкіл незаміщений або заміщений циклоалкілом, незаміщеним фенілом або фенілом, заміщеним галогеном або -CF3; R2 позначає водень або нижчий алкіл; R3 позначає водень, фтор або -OCH3; X позначає R4 циклоалкілоцтову кислоту або R5 ; при цьому R4 позначає водень або галоген, а R5 OH O R 25 R 6 7 позначає ; при цьому R6 і R7, спільно з атомом вуглецю, до якого вони приєднані, утворюють циклоалкільну групу; або її фармацевтично прийнятна сіль. В іншому втіленні даного винаходу запропоновано сполуку загальної формули (I), де R1 позначає нижчий алкіл, заміщений незаміщеним фенілом; R2 позначає водень або нижчий алкіл; R3 позначає водень, фтор або -OCH3; X позначає циклоалкілоцтову кислоту або OH R4 R5 O ; при цьому R4 позначає водень або галоген, а R5 позначає 6 R6 R7 ; при UA 110310 C2 5 цьому R6 і R7, спільно з атомом вуглецю, до якого вони приєднані, утворюють циклоалкільну групу; або її фармацевтично прийнятну сіль. В іншому втіленні даного винаходу запропоновано сполуку загальної формули (I), де R1 позначає нижчий алкіл або інданіл, причому зазначений нижчий алкіл незаміщений або заміщений циклоалкілом, незаміщеним фенілом або фенілом, заміщеним галогеном або -CF3; R2 позначає водень або нижчий алкіл; R3 позначає водень, фтор або -OCH3; X позначає R4 R5 10 циклоалкілоцтову кислоту або ; при цьому R4 позначає водень або галоген, а R5 позначає метансульфоніламінокарбонілциклопропіл; або її фармацевтично прийнятну сіль. В іншому втіленні даного винаходу запропоновано сполуку загальної формули (Ia), де R1 позначає нижчий алкіл, заміщений незаміщеним фенілом; R2 позначає нижчий алкіл; X позначає OH R4 O R5 15 R R 6 7 ; при цьому R4 позначає водень, а R5 позначає ; R6 і R7 позначають водень або R6 і R7, спільно з атомом вуглецю, до якого вони приєднані, утворюють циклоалкільну групу; або її фармацевтично прийнятну сіль. В іншому втіленні даного винаходу запропоновано сполуку загальної формули (Ib), де R1 позначає нижчий алкіл, заміщений незаміщеним фенілом; R2 позначає нижчий алкіл; R3 R4 позначає водень; X позначає R5 ; при цьому R4 позначає водень, а R5 позначає OH O R6 20 R7 ; при цьому R6 і R7 позначає водень, або ж R6 і R7 спільно з атомом вуглецю, до якого вони приєднані, утворюють циклоалкільну групу; або її фармацевтично прийнятну сіль. В іншому втіленні даного винаходу запропоновано сполуку загальної формули (Ic), де R1 позначає нижчий алкіл, заміщений незаміщеним фенілом; R3 позначає водень; X позначає OH R4 O R5 25 30 35 R R 6 7 ; при цьому R4 позначає водень, а R5 позначає ; при цьому R6 і R7 спільно з атомом вуглецю, до якого вони приєднані, утворюють циклоалкільну групу; або її фармацевтично прийнятну сіль. Зокрема сполуки формули (I) включають наступні: 1-{4'-[4-метил-5-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}циклопропанкарбонова кислота; {4'-[4-метил-5-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}-оцтова кислота; 1-{4'-[5-метил-4-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}циклопропанкарбонова кислота; {4'-[5-метил-4-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}-оцтова кислота; 1-(4'-{5-[(R)-1-(2-фторфеніл)-етоксикарбоніламіно]-4-метил-[1,2,3]триазол-1-іл}-біфеніл-4-іл)циклопропанкарбонова кислота; 1-(4'-{4-метил-5-[(R)-1-(2-трифторметил-феніл)-етоксикарбоніламіно]-[1,2,3]триазол-1-іл}біфеніл-4-іл)-циклопропанкарбонова кислота; 7 UA 110310 C2 5 10 15 20 25 30 35 40 45 50 55 60 1-(4'-{4-метил-5-[(R)-1-(3-трифторметилфеніл)-етоксикарбоніламіно]-[1,2,3]триазол-1-іл}біфеніл-4-іл)-циклопропанкарбонова кислота; 1-{4'-[5-((R)-індан-1-ілоксикарбоніламіно)-4-метил-[1,2,3]триазол-1-іл]-біфеніл-4-іл}циклопропанкарбонова кислота; 1-{4'-[5-((R)-1,2-диметилпропоксикарбоніламіно)-4-метил-[1,2,3]триазол-1-іл]-біфеніл-4-іл}циклопропанкарбонова кислота; 1-{4'-[5-((R)-втор-бутоксикарбоніламіно)-4-метил-[1,2,3]триазол-1-іл]-біфеніл-4-іл}циклопропанкарбонова кислота; 1-[4'-(5-ізопропоксикарбоніламіно-4-метил-[1,2,3]триазол-1-іл)-біфеніл-4-іл]циклопропанкарбонова кислота; 1-{4'-[5-(1-циклопропілетоксикарбоніламіно)-4-метил-[1,2,3]триазол-1-іл]-біфеніл-4-іл}циклопропанкарбонова кислота; 1-{4'-[5-(1-циклобутилетоксикарбоніламіно)-4-метил-[1,2,3]триазол-1-іл]-біфеніл-4-іл}циклопропанкарбонова кислота; 1-[4'-(5-трет-бутоксикарбоніламіно-4-метил-[1,2,3]триазол-1-іл)-біфеніл-4-іл]циклопропанкарбонова кислота; 1-{3-фтор-4'-[4-метил-5-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}циклопропанкарбонова кислота; 1-{3’-метокси-4'-[4-метил-5-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4іл}-циклопропанкарбонова кислота; 1-{4'-[4-етил-5-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}циклопропанкарбонова кислота; {4'-[4-етил-5-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}-оцтова кислота; 1-(4'-{4-етил-5-[(R)-1-(3-трифторметилфеніл)-етоксикарбоніламіно]-[1,2,3]триазол-1-іл}біфеніл-4-іл)-циклопропанкарбонова кислота; {4'-[4-етил-5-((R)-1-(3-трифторметилфенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл4-іл}-оцтова кислота; 1-{4'-[5-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}циклопропанкарбонова кислота; {4'-[5-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}-оцтова кислота; 2-метил-2-{4'-[4-метил-5-((R)-1-фенілетоксикарбоніламіно) -[1,2,3]триазол-1-іл]-біфеніл-4-іл}пропіонова кислота; (R)-1-(4’-(4-метил-5-((1-фенілетокси)карбоніламіно)-1H-1,2,3-триaзол-1-іл)біфеніл-3іл)циклопропанкарбонова кислота; 1-{3'-[4-метил-5-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}циклопропанкарбонова кислота; {3'-[4-метил-5-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}-оцтова кислота; (R)-1-фенілетиловий ефір (3-біфеніл-4-іл-5-метил-3H-[1,2,3]триазол-4-іл)-карбамінової кислоти; (R)-1-фенілетиловий ефір [3-(4'-ціанобіфеніл-4-іл)-5-метил-3H-[1,2,3]триазол-4-іл]карбамінової кислоти; (R)-1-фенілетил-1-(4’-(1-(1H-тетразол-5-іл)циклопропіл)біфеніл-4-іл)-4-метил-1H-1,2,3триазол-5-ілкарбамат; (R)-1-фенілетиловий ефір {3-[4'-(1-метансульфоніламінокарбонілциклопропіл)-біфеніл-4-іл]5-метил-3H-[1,2,3]триазол-4-іл}-карбамінової кислоти; 1-{4’-[3-((R)-1-фенілетоксикарбоніламіно)-[1,2,4]триазол-4-іл]-біфеніл-4-іл}циклопропанкарбонова кислота; (R)-1-(4’-(4-метил-5-((1-фенілетокси)карбоніламіно)-1H-1,2,3-триазол-1-іл)біфеніл-4іл)циклобутанова кислота; (R)-2-{4’-[4-метил-5-(-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}-пент-4енова кислота; (R)-2-(4-(4-(4-метил-5-((1-фенілетокси)карбоніламіно)-1H-1,2,3-триазол-1-іл)феніл) циклогексил)оцтова кислота; або (R)-1-(3-трифторметилфеніл)-етиловий ефір {3-[4'-(1метансульфоніламінокарбонілциклопропіл)-біфеніл-4-іл]-5-метил-3H-[1,2,3]триазол-4-іл}карбамінової кислоти. В іншому втіленні даного винаходу запропоновано сполуку формули (I) для застосування як терапевтично активної речовини. 8 UA 110310 C2 5 10 15 20 25 30 35 40 45 50 55 В іншому втіленні даного винаходу запропонована фармацевтична композиція, що включає терапевтично ефективну кількість сполуки формули (I) і терапевтично інертний носій. В іншому втіленні даного винаходу запропоновано застосування сполуки формули (I) для лікування або профілактики фіброзу легенів. В іншому втіленні даного винаходу запропоновано застосування сполуки формули (I) для виготовлення лікарського засобу для лікування або профілактики фіброзу легенів. В іншому втіленні даного винаходу запропоновано сполуку формули (I) для лікування або профілактики фіброзу легенів. В іншому втіленні даного винаходу запропоновано сполуку формули (I), якщо вона одержана описаним нижче способом. В іншому втіленні даного винаходу запропонований спосіб лікування або профілактики фіброзу легенів, що включає стадію введення терапевтично ефективної кількості сполуки формули (I) пацієнтові, який цього потребує. В іншому втіленні даного винаходу запропонований винахід, розкритий вище. Слід розуміти, що сполуки загальної формули I за даним винаходом можна дериватизувати за функціональними групами з одержанням похідних, які здатні перетворюватися назад в початкову сполуку in vivo. Фізіологічно прийнятні і метаболічно лабільні похідні, здатні давати початкові сполуки загальної формули I in vivo, також охоплені об'ємом даного винаходу. Сполуки за даним винаходом можна одержати, виходячи з комерційно доступних початкових речовин, або використовуючи загальні синтетичні схеми і способи, відомі фахівцеві в даній області техніки. Хімічні реактиви можна замовляти в таких компаніях, як, наприклад, Aldrich, Argonaut Technologies, VWR, Lancaster, Princeton, Alfa, Oakwood, TCI, Fluorochem, Apollo, Matrix, Maybridge або Meinoah. Хроматографічні матеріали і устаткування можна придбати в таких компаніях, як, наприклад, Analogix, Inc, Берлінгтон, Вісконсин; Biotage AB, Шарлотсвілль, Вірджинія; Analytical Sales and Services, Inc., Промптон Плейнс, Нью Джерсі; Teledyne Isco, Лінкольн, Небраска; VWR International, Бриджпорт, Нью Джерсі; Varian Inc., Пало-Альто, Каліфорнія, і Multigram II Mettler Toledo Instrument Newark, Делавер. Колонки Biotage, ISCO і Analogix є попередньо упакованими колонками з силікагелем, використовуваними для стандартної хроматографії. Кінцевісполуки і проміжні продукти були названі з використанням функції AutoNom2000 для програми MDL ISIS Draw. Даний винахід стосується також введення терапевтично ефективної кількості сполуки формули I в комбінації або асоціації з іншими лікарськими речовинами або діючими речовинами для лікування запальних або алергічних захворювань і розладів. В одному втіленні даний винахід відноситься до способу лікування та/або профілактики таких захворювань або розладів, що включає введення людині або тварині одночасно, послідовно або роздільно терапевтично ефективної кількості сполуки формули I та іншої лікарської речовини діючої речовини (наприклад іншої протизапальної або протиалергічної лікарської речовини або агента). Ці інші лікарські речовини або діючі агенти можуть мати такій же, схожий або абсолютно інший механізм дії. Прийнятні інші лікарські речовини або діючі агенти можуть включати, без обмеження: бета-2-адренергічні агоністи, такі як альбутерол або салметерол; кортикостероїди, такі як дексаметазон або флутиказон; антигістамінні препарати, такі як лоратадин; лейкотрієнові антагоністи, такі як монтелукаст або зафрилукаст; терапевтичні агенти проти IgE-антитіл, такі як омалізумаб; протиінфекційні препарати, такі як фусидова кислота (зокрема, для лікування атопічного дерматиту); протигрибкові агенти, такі як клотримазол (зокрема, для лікування атопічного дерматиту); імунодепресанти, такі як такролімус і пімекролімус; інші антагоністи фосфодіестерази PGD2, що діють на інші рецептори, такі як антагоністи DP; інгібітори фосфодіестерази 4 типу, такі як циломіласт; лікарські речовини, що модулюють продукцію цитокінів, такі як інгібітори TNF-альфа-перетворюючого ферменту (TACE); лікарські речовини, що модулюють активність цитокінів Th2: IL-4 і IL-5, такі як блокуючі моноклональні антитіла і розчинні рецептори; агоністи PPAR-гамма, такі як росиглітазон; та інгібітори 5-ліпоксигенази, такі як зілейтон. Сполуки за даним винаходом можна одержувати будь-яким стандартним шляхом. Відповідні способи для синтезу цих сполук представлені в прикладах. В цілому, сполуки формули I можна одержувати відповідно до схем, представлених нижче. Наприклад, конкретні сполуки за даним винаходом можна одержати, використовуючи підхід, представлений на Схемі 1. 9 UA 110310 C2 Схема 1 5 10 15 20 25 Сполуку за даним винаходом формули 10 можна одержати за Схемою 1. Виходячи з 4бромфенілборонової кислоти 1, можна провести реакцію конденсації з азидом натрію у присутності ацетату міді з одержанням проміжного азиду 2 в протонних розчинниках, таких як метанол, при кімнатній температурі. Якнайкращих виходів можна досягти, якщо реакцію проводити при контакті з атмосферним повітрям. Цей проміжний азид стабільний в холодних умовах, але в ідеалі його слід відразу ж використовувати в реакції циклоприєднання. Ключову реакцію [3+2]-циклоприєднання між проміжним азидом 2 і алкіноатом 3 можна проводити в толуолі при більш високій температурі, переважно при 150 °C, протягом 2-15 г. Час реакції залежить від природи групи R1 алкіноату, яка може бути воднем, нижчим алкілом, переважно метильною і етильною групою. Співвідношення обох регіоізомерів триазолу 4 і 5 залежить від природи групи R1, і якщо група R1 позначає метил або етил, то таке співвідношення в загальному випадку повинне складати 1:1,2, а якщо R1 позначає водень, то таке співвідношення складатиме 1:4, при цьому небажаний ізомер може переважати. Температуру реакції можна понизити, якщо проводити реакцію у присутності мідного каталізатора. Ці два регіоізомери можна перетворювати на кінцеві сполуки роздільно. Гідроліз ефіру 4 до відповідної кислоти 6 можна здійснювати у присутності основи, такої як гідроксид літію, в інертному розчиннику, такому як тетрагідрофуран і вода, при кімнатній температурі, протягом декількох годин. Кислоту 6 можна перетворювати на карбамат 7 в умовах перегрупування Курциуса, наприклад у присутності дифенілфосфорилазиду (DPPA) і основи, такої як триетиламін, у присутності спирту R3OH в інертному розчиннику, такому як толуол, при 65-80 °C, протягом декількох годин. R3 може позначати простий алкіл, циклоалкіл або арил-заміщений алкіл. Реакцію крос-сполучення між сполуками 7 і 8 з одержанням проміжного біарилу 9 можна здійснювати у присутності паладієвого каталізатора, такого як ацетат паладію (II), і фосфінового ліганда, такого як 2-дициклогексилфосфіно-2’,6’-диметоксибіфеніл (S-Phos), у присутності 10 UA 110310 C2 5 10 15 основи, такої як триосновний фосфат калію, в суміші розчинників, наприклад толуолу і води. Цю реакцію можна проводити при більш високій температурі, переважно при 100-105 °C, протягом декількох годин. Кінцеві сполуки 10 за даним винаходом можна одержати гідролізом ефіру 9 у присутності основи, такої як гідроксид літію або гідроксид натрію, в інертному розчиннику, такому як тетрагідрофуран, етанол і вода, при кімнатній температурі протягом декількох годин. Схема 2 В іншому варіанті, як показано на Схемі 2, проміжну сполуку 7, що містить бром, можна перетворювати на відповідний проміжний пінаколатоборонат 12 за допомогою біспінаколатодиборону 11 у присутності паладієвого каталізатора, такого як 1,1’біс(дифенілфосфіно)фероцен дихлорпаладій (II), у присутності відповідної основи, такої як ацетат калію. Переважним розчинником для цієї реакції може бути 1,4-діоксан, при 80 °C, протягом декількох годин. Проміжний пінаколатоборан 12 потім вводять в реакцію кроссполучення з проміжними сполуками, що містять бром, таким як 13, в умовах опосередкованого паладієм поєднання, з одержанням сполуки 9, яка далі може давати кінцеву сполуку 10, після її обробки в стандартних умовах для гідролізу. Схема 3 11 UA 110310 C2 На Схемі 3 зображено перетворення іншого регіоізомеру 5 на відповідну кінцеву сполуку 17, в тих же умовах реакції, як зазначено вище. Схема 4 5 10 На Схемі 4 показаний синтез не наявних в продажі заміщених проміжних арилборонатів. 4Бромфенілацетонітрил 18 можна перетворювати на сполуку 19 шляхом обробки 1-бром-2хлоретаном і гідроксидом натрію у присутності каталізатора фазового перенесення, такого як хлорид бензилтриетиламонію, при 50 °C, протягом декількох годин. Потім ціаногрупу в сполуці 19 можна гідролізувати до відповідної кислоти, яку можна обробляти метилйодидом у присутності основи, такої як карбонат калію, з одержанням сполуки 20. Проміжну сполуку 20, що містить бром, можна вводити в реакцію з біспінаколатодибороном в умовах реакції, що каталізується паладієм, з утворенням проміжного боронату 21. Схема 5 O O R7 Br O Br R7 O Br Br NaH 15 22 23 12 UA 110310 C2 5 10 15 20 Як показано на Схемі 5, проміжні 1-(4-бромфеніл)циклобутан або циклопентан карбоксилат, такі як сполуки 23, можна одержати з етил-2-(4-бромфеніл)ацетату 22 і 1,3-дибромпропану або 1,4-дибромбутану у присутності сильної основи, такої як гідрид натрію, в апротонних розчинниках, таких як DMF, при температурі від 0 °C до кімнатної, протягом декількох годин. Сполуки за даним винаходом формули 30 можна одержати за Схемою 6. Цільовий етил-2(4-йодциклогексил)ацетат 25 можна одержати з етил-2-(4-гідроксициклогексил)ацетату 24 за допомогою йоду і трифенілфосфіну у присутності імідазолу в дихлорметані. Потім етил-2-(4йодциклогексил)ацетат 25 можна вводити в реакцію з активованим цинковим пилом в безводному THF при 60 °C протягом декількох годин з одержанням проміжної сполуки, що містить цинк, яку можна вводити в реакцію крос-сполучення з проміжною сполукою 27, що містить бром, у присутності Pd(dba)2 і три-o-толілфосфіну, в безводному THF при 60 °C, з одержанням продукту конденсації 28. Трет-бутиловий ефір сполуки 28 можна гідролізувати до кислоти 29 у присутності TFA. Потім проводять перегрупування Курциуса і застосовують умови обмилення, показані на Схемі 1, з одержанням сполуки 30. Сполуки за даним винаходом формули 33 можна одержати за Схемою 7. Проміжний пінаколатоборонат 12 можна вводити в реакцію з проміжною сполукою 31, що містить бром, у присутності паладієвого каталізатора, такого як ацетат паладію (II), і фосфінового ліганда, такого як 2-дициклогексилфосфіно-2’,6’-диметоксибіфеніл (S-phos), в змішаній системі розчинників, таких як толуол і вода, при 105 °C, з одержанням сполуки 32. Сполуку 32 можна перетворювати на бажану сполуку 33 з використанням азидотриметилсилану і оксиду ди-нбутилолова в толуолі при 100 °C протягом декількох годин. Схема 6 Схема 7 13 UA 110310 C2 Схема 8 5 10 На схемі 8 представлений синтез ацилметилсульфонамідів і одержуваних з них кінцевих сполук. Кислоту 34 можна перетворювати на хлорид кислоти, який можна вводити в реакцію з метансульфонамідом у присутності основи, такої як гідрид натрію, з одержанням Nацилсульфонаміду 35. Проміжний арилборонат 36 можна одержати з арилброміду 35. Кінцеву стадію крос-сполучення із сполукою 7 можна здійснювати у присутності паладієвого каталізатора, такого як PdCl2(dppf)CH2Cl2), ліганда DPPF і основи, такої як карбонат натрію, в суміші розчинників, наприклад DMF і води. Цю реакцію можна проводити при більш високій температурі, переважно при 85 °C, протягом декількох годин з одержанням кінцевої сполуки 37. Схема 9 14 UA 110310 C2 5 10 15 20 Похідну N-арил-1,2,4-триазолу 47 можна одержати за Схемою 9. 4-Броманілін можна вводити в реакцію з тіофосгеном в лужних умовах з одержанням ізотіоціанату 38, який можна перетворювати на тіосечовину 39 в ході реакції з аміаком. Метилування тіосечовини можна здійснити у присутності метилйодиду з одержанням проміжної сполуки 40, яку можна перетворювати на 1N-аміно-2N-арилгуанідин 41 шляхом реакції з гідразином. Обробка аміногуанідину 41 мурашиною кислотою може давати ключовий 4N-арил-4H-3-аміно-1,2,3триазол 42. В умовах реакції сполучення Сузукі сполуку 42 можна конденсувати з бороновою кислотою 43 з одержанням сполуки 44, у присутності паладієвого каталізатора. Сполуку 44 можна спочатку депротонувати з допомогою біс(гексаметилдисиліл)аміду літію, а потім вводити в реакцію з імідазолкарбаматом 45 з одержанням ключового карбамату 46. Імідазолкарбамат 45 можна одержати з відповідного фенілетанолу і карбонілдіімідазолу (CDI). У лужних умовах гідроліз сполуки 46 може давати похідну 4N-арил-4H-1,2,3-триазолу 47. Інші аналоги сполук даного хімічного класу можна одержати таким же способом, як показано на Схемі 9. Приклади Не дивлячись на те, що в даному описі представлені і розкриті конкретні приклади втілень, сполуки за даним винаходом можна одержати з відповідних початкових речовин способами, які в загальному вигляді розкриті в даному тексті, та/або способами, доступними середньому фахівцеві в даній області техніки. Використовувана абревіатура: DPPA: дифенілфосфорилазид; 15 UA 110310 C2 5 10 DPPF: 1,1'-біс(дифенілфосфіно)фероцен; S-Phos: дициклогексил(2’,6’-диметокси[1,1’-біфеніл]-2-іл)-фосфін; DBA: дибензиліденацетон; DCM: дихлорметан; DMF: диметилформамід; EA: етилацетат; ACN: ацетонітрил; LiHMDS: біс(триметилсиліл)амід літію; TEA: триетиламін; THF: тетрагідрофуран; TLC: тонкошарова хроматографія. Приклад 1 1-{4'-[4-Метил-5-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}циклопропанкарбонова кислота N N N O O N O O 15 20 25 30 35 40 45 50 Стадія 1: 1-Азидо-4-бромбензол У реакційній судині на 350 мл 4-бромфенілборонову кислоту (21,17 г; 105 ммоль), азид натрію (10,3 г; 158 ммоль) і ацетат міді (II) (1,91 г; 10,5 ммоль) об'єднували з MeOH (200 мл) з одержанням коричневої суспензії. Реакційну суміш перемішували при кімнатній температурі протягом ночі при контакті з атмосферним повітрям протягом 23 г. Реакційну суміш концентрували, розбавляли сумішшю етилового ефіру / гексану (380/20 мл; перший органічний шар) і промивали водою (100 мл; перший водний шар) і сумішшю насиченого розчину NH4Cl / концентрованого NH4OH (200/300 мл; другий водний шар). До першого водного шару додавали насичений NH4Cl і концентрований розчин NH4OH (60/40 мл) і одержаний органічний шар відокремлювали, промивали другим водним шаром і об'єднували з першим органічним шаром. Перший водний шар екстрагували другий раз ефіром (300 мл) і органічний шар промивали другим водним шаром. Органічні шари об'єднували, висушували над MgSO4 і зберігали в холодильнику протягом ночі. Неочищену речовину доводили до кімнатної температури, фільтрували, концентрували з одержанням червоно-жовтого масла, яке розчиняли в гексані (20 мл) і наносили на силікагель (120 г Redisep), елюювали гексаном з одержанням 1-азидо-4бромбензолу (19,5 г; вихід 93,4%) у вигляді жовтого масла. LC/MS розр. для C6H4BrN3 (m/e) + 197/199, фактич. 170/172 (M-N2+H, ES ). Стадія 2: Метиловий ефір 3-(4-бромфеніл)-5-метил-3H-[1,2,3]триазол-4-карбонової кислоти У реакційній судині на 350 мл 1-азидо-4-бромбензол (10 г; 50,5 ммоль) і метилбут-2-іноат (5,45 г; 5,56 мл; 55,5 ммоль) об'єднували з толуолом (106 мл) з одержанням жовтої суспензії. Судину закривали і нагрівали на масляній бані при 150 °C протягом 4,5 г. Охолоджували і зберігали при кімнатній температурі протягом 6 діб. Реакційну суміш фільтрували і одержану тверду речовину промивали толуолом і EtOAc (3 х 15 мл). Фільтрат концентрували, розчиняли у мінімальній кількості DCM і очищали флеш-хроматографією (силікагель, 0%-50% EtOAc в гексані). Потрібні фракції об'єднували, концентрували і висушували з суміші DCM / гексан з одержанням метилового ефіру 3-(4-бромфеніл)-5-метил-3H-[1,2,3]триазол-4-карбонової кислоти (4,5 г; вихід 30,1%) у вигляді світло-коричневої твердої речовини. LC/MS розр. для C11H10BrN3O2 + (m/e) 295/297, фактич. 296/298 (M+H, ES ). Стадія 3: 3-(4-Бромфеніл)-5-метил-3H-[1,2,3]триазол-4-карбонова кислота У круглодонну колбу на 1 л з метиловим ефіром 3-(4-бромфеніл)-5-метил-3H-[1,2,3]триазол4-карбонової кислоти (4,5 г; 11,5 ммоль), розчиненої в THF (200 мл) (коричневий розчин), додавали LiOH (2,77 г; 115 ммоль), переважно розчинений у воді (75 мл; з нагріванням). Цей розчин перемішували при кімнатній температурі протягом 16 г. Реакційну суміш концентрували, розводили водою (сумарний об'єм 400 мл), екстрагували етиловим ефіром (2 х 100 мл). Водний шар підкисляли за допомогою 1 н HCl і одержаний осад фільтрували, промивали водою і 16 UA 110310 C2 5 10 15 20 25 30 35 40 45 50 55 60 гексаном і висушували у вакуумі. Одержану білу тверду речовину частково розчиняли в DCM і ACN, переносили в круглодонну колбу і висушували з одержанням 3-(4-бромфеніл)-5-метил-3H[1,2,3]триазол-4-карбонової кислоти (3.6 г; вихід 110%) у вигляді брудно-білої твердої речовини. + LC/MS розр. для C10H8N3O2 (m/e) 281/283, фактич. 281/284 (M+H, ES ). Стадія 4: (R)-1-Фенілетиловий ефір [3-(4-бромфеніл)-5-метил-3H-[1,2,3]триазол-4-іл]карбамінової кислоти У реакційній судині на 350 мл 3-(4-бромфеніл)-5-метил-3H-[1,2,3]триазол-4-карбонову кислоту (3.6 г; 12.8 ммоль) (R)-1-фенілетанол (3,04 г; 3 мл; 24,9 ммоль) і триетиламін (3,27 г; 4,5 мл; 32,3 ммоль) об'єднували з толуолом (100 мл) з одержанням жовтого розчину, і до цієї суміші додавали дифенілфосфоразидат (8,94 г; 7 мл; 32,5 ммоль). Через атмосферу реакційної судини продували азот, судину закривали, нагрівали на масляній бані при 65 °C протягом 2 г і охолоджували до кімнатної температури протягом ночі. Реакційну суміш концентрували з одержанням жовтого в'язкого масла, розбавляли за допомогою DCM і очищали флешхроматографією (силікагель, 0-50% EtOAc в гексані). Потрібні фракції об'єднували, концентрували, висушували з суміші DCM / гексан, з одержанням (R)-1-фенілетилового ефіру [3-(4-бромфеніл)-5-метил-3H-[1,2,3]триазол-4-іл]-карбамінової кислоти (4,07 г; вихід 79,5%) у вигляді білої твердої речовини. LC/MS розр. для C18H17BrN4O2 (m/e) 400/402, фактич. 401/403 + (M+H, ES ). Стадія 5: 1-(4-Бромфеніл)-циклопропанкарбонітрил У круглодонній колбі на 1 л об'єднували 2-(4-бромфеніл)ацетонітрил (59,57 г; 304 ммоль) (напіврозплавлений при 60 °C для перенесення), 1-бром-2-хлоретан (65,4 г; 456 ммоль) і Nбензил-N,N-триетилетанаміній хлорид (5,54 г; 24,3 ммоль) і нагрівали на масляній бані при 50 °C з одержанням світло-коричневого розчину. До цієї суміші додавали по краплях свіжоприготований розчин NaOH (72,9 г; 1,82 моль) в 72 мл води (не повністю розчинений). Колбу з NaOH і додатково воронку промивали водою, і одержані змиви також додавали до реакційної суміші. Цю суміш перемішували на масляній бані при 50 °C з конденсатором протягом ночі, 22 г. Реакційну суміш охолоджували, розбавляли водою (500 мл), екстрагували за допомогою DCM (2 х 300 мл). Органічні шари промивали водою (2 х 300 мл), 1 н HCl (2 х 300 мл) і сольовим розчином (300 мл), висушували над MgSO4, фільтрували, концентрували і висушували з одержанням 1-(4-бромфеніл)циклопропанкарбонітрилу (66,8 г; вихід 99%) у вигляді жовтої твердої речовини. LC/MS розр. для C10H8BrN (m/e) 221/223, фактич. 222/224 + + (M+H, ES ), 263/265 (M+ACN+H, ES ). Стадія 6: 1-(4-Бромфеніл)-циклопропанкарбонова кислота У круглодонній колбі на 2 л 1-(4-бромфеніл)циклопропанкарбонітрил (66,8 г; 301 ммоль) об'єднували з LiOH (144 г; 6,02 моль), частково розчиненим у воді (1,1 л), з одержанням червоної суспензії і перемішували на масляній бані при кип'яченні із зворотним холодильником протягом 7 г. Реакційну суміш охолоджували до кімнатної температури протягом вихідних. Одержану брудно-біло-сіру суміш розбавляли водою (~ 1 л) і екстрагували за допомогою EtOAc (2 х 400 мл), утримуючи тверду речовину у водному шарі. Водний шар підкисляли за допомогою концентрованої HCl до pH~3 і одержаного осаду фільтрували і промивали гексаном (4 рази, сумарний об'єм 0,9 л) з одержанням 1-(4-бромфеніл)циклопропанкарбонової кислоти (73,3 г; вихід 101%) у вигляді брудно-білої твердої речовини. LC/MS розр. для C10H9BrO2 (m/e) 240/242, + фактич. 241/243 (M+H, ES ), 239/241 (M-H, ES ). Стадія 7: Метиловий ефір 1-(4-бромфеніл)-циклопропанкарбонової кислоти У круглодонній колбі на 2 л 1-(4-бромфеніл)циклопропанкарбонову кислоту (73.6 г; 305 ммоль) об'єднували з DMF (0,5 л) з одержанням світлого червоно-коричневого розчину, і до цього розчину при перемішуванні на магнітній мішалці додавали K2CO3 (127 г; 916 ммоль). Приблизно через 10 хв випадав білий осад і розчин ставав неперемішуваним. Речовину переносили в трьохгорлову колбу на 3 л, розбавляли за допомогою DMF (1 л) і перемішували на магнітній мішалці. До суміші додавали по краплях протягом 1 г метилйодид (217 г; 95,4 мл; 1,53 моль), розчинений в DMF (0,1 л). Одержану білу суспензію перемішували при кімнатній температурі протягом ночі. Реакційну суміш розділяли на дві частини, і кожну половину частково концентрували (видаляли об'єм ~300 мл), розбавляли водою (1 л) і екстрагували за допомогою EtOAc (2 х 500 мл). Кожен шар EtOAc промивали водою (500 мл) і сольовим розчином (250 мл), об'єднували, висушували над MgSO4, фільтрували, концентрували, об'єднували з іншою половиною, концентрували з одержанням метилового ефіру 1-(4-бромфеніл)циклопропанкарбонової кислоти (73,3 г; вихід 94,1%) у вигляді світло-коричневого масла. LC/MS + розр. для C11H11BrO2 (m/e) 254/256, фактич. 255/257 (M+H, ES ). Стадія 8: Метиловий ефір 1-[4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-феніл]циклопропанкарбонової кислоти 17 UA 110310 C2 5 10 15 20 25 30 35 40 45 50 55 60 У реакційній судині на 350 мл метиловий ефір 1-(4-бромфеніл)-циклопропанкарбонової кислоти (20 г; 78,4 ммоль), BISPIN (23,9 г; 94,1 ммоль) і ацетат калію (15,4 г; 157 ммоль) об'єднували з 1,4-діоксаном (150 мл) з одержанням світло-коричневої суспензії. Через цю суміш продували азот протягом 5 хв, додавали PdCl2(dppf) (3,2 г; 3,92 ммоль) і судину закривали і нагрівали на масляній бані при 80 °C протягом 4 г. Реакційну суміш фільтрували через Celite (промивали за допомогою DCM), концентрували, розбавляли етиловим ефіром (500 мл), промивали водою (2 х 500 мл) і сольовим розчином (250 мл). У водному шарі містилася чорна тверда речовина, її фільтрували і одержану тверду речовину промивали етиловим ефіром. Фільтрат екстрагували етиловим ефіром (500 мл) і промивали тим же сольовим розчином. Шари етилового ефіру об'єднували, висушували над MgSO4, фільтрували і концентрували з одержанням червоного масла. Неочищену речовину очищали флеш-хроматографією (силікагель, 0%-20% EtOAc в гексані). Потрібні фракції об'єднували, концентрували, висушували з DCM з одержанням метилового ефіру 1-[4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)феніл]-циклопропанкарбонової кислоти (20,83 г; вихід 87,9%) у вигляді твердої речовини від білого до білого/дуже слабо-жовтого. LC/MS розр. для C17H23BO4 (m/e) 302, фактич. 303 (M+H, + ES ). Стадія 9: Метиловий ефір 1-{4'-[4-метил-5-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол1-іл]-біфеніл-4-іл}-циклопропанкарбонової кислоти У судині на 350 мл метиловий ефір 1-[4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)феніл]-циклопропанкарбонової кислоти (2,49 г; 8,22 ммоль) (R)-1-фенілетиловий ефір [3-(4бромфеніл)-5-метил-3H-[1,2,3]триазол-4-іл]-карбамінової кислоти (3,0 г; 7,48 ммоль), 2дициклогексилфосфіно-2',6'-диметоксибіфеніл (SPhos) (921 мг; 2,24 ммоль) і ацетат паладію (II) (252 мг; 1,12 ммоль) об'єднували з толуолом (120 мл) (через який попередньо продували азот протягом 20 хв) з одержанням світло-жовтого розчину. До цієї суміші додавали фосфат трикалію (4,76 г; 22,4 ммоль), розчинений у воді (30,0 мл) (через яку попередньо продували азот протягом 20 хв). Атмосферу в реакційній судині замінювали на азот, судину закривали, нагрівали на масляній бані при 100 °C протягом 4 г і охолоджували до кімнатної температури протягом ночі. Реакційну суміш розбавляли за допомогою EtOAc (50 мл) і вод (100 мл), фільтрували і промивали водою (30 мл) і EtOAc (50 мл). Фільтрат відокремлювали додаванням сольового розчину (50 мл) і органічний шар промивали сольовим розчином (150 мл). Водний шар екстрагували за допомогою EtOAc (2 х 150 мл) і кожний органічний шар промивали тим же сольовим розчином. Органічні шари об'єднували, висушували над MgSO4, фільтрували, концентрували, розчиняли у мінімальній кількості DCM і очищали флеш-хроматографією (силікагель, 0%-50% EtOAc в гексані). Потрібні фракції об'єднували, концентрували і висушували з DCM / гексан з одержанням метилового ефіру 1-{4'-[4-метил-5-((R)-1фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}-циклопропанкарбонової кислоти (2.65 г; вихід 71,4%) у вигляді білої твердої речовини. LC/MS розр. для C29H28N4O4 (m/e) 496, + фактич. 497 (M+H, ES ). Стадія 10: 1-{4'-[4-Метил-5-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4іл}-циклопропанкарбонова кислота У круглодонній колбі на 1 л метиловий ефір 1-{4'-[4-метил-5-((R)-1фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}-циклопропанкарбонової кислоти (2,65 г; 5,34 ммоль) об'єднували з THF (50 мл) з одержанням жовтого розчину. До цієї суміші додавали по краплях розчин LiOH (1,28 г; 53,4 ммоль), розчинений у воді (12,5 мл; нагрівали для часткового розчинення). Реакційну суміш колбу закривали і нагрівали на масляній бані при 60 °C протягом 5 г. Реакційну суміш охолоджували до кімнатної температури протягом ночі. Реакційну суміш розбавляли водою (100 мл), концентрували, розбавляли великою кількістю води (500 мл) і підкисляли за допомогою 1 н HCl. Одержаний осад фільтрували, промивали водою і гексаном і висушували у вакуумі і в ексикаторі. Неочищений продукт (2,8 г), у вигляді білої твердої речовини, обробляли гарячим ACN і перекристалізовували з EtOAc, суміші EtOH / вода і IPA / вода. Ці спроби очищення були неуспішними, і одержану тверду речовину (2,0 г) очищали обернено-фазною флеш-хроматографією (C18 Silicycle 120 г; 60 мл хв 20-100% ACN/H2O 20 хв). Потрібні фракції об'єднували, концентрували, розбавляли водою, і одержаний осад фільтрували і промивали водою і гексаном з одержанням 1,65 г білої твердої речовини. Одержану тверду речовину кристалізували з ACN з одержанням 1-{4'-[4-метил-5-((R)-1фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}-циклопропанкарбонової кислоти (1,48 г; вихід 57,5%) у вигляді білої твердої речовини. LC/MS розр. для C28H26N4O4 (m/e) 482, + 1 фактич. 483 (M+H, ES ). H ЯМР (DMSO-d6) δ: 12,40 (br. s., 1H), 9,69 (br. s., 1H), 7,83 (d, J = 7,0 Гц, 2H), 7,67 (d, J = 8,3 Гц, 2H), 7,58 (d, J = 8,0 Гц, 2H), 7,47 (d, J = 8,5 Гц, 2H), 7,00 - 7,42 (m, 5H), 5,71 (br. s., 1H), 2,18 (s, 3H), 1,29 - 1,69 (m, 5H), 1,13 - 1,26 (m, 2H). 18 UA 110310 C2 Приклад 2 {4'-[4-Метил-5-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}-оцтова кислота N N N O O N O O 5 10 15 20 25 30 35 40 45 Стадія 1: Етиловий ефір [4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-феніл]-оцтової кислоти У реакційній судині на 350 мл етил-2-(4-бромфеніл)ацетат (25 г; 103 ммоль), BISPIN (31,3 г; 123 ммоль) і ацетат калію (20,2 г; 206 ммоль) об'єднували з 1,4 діоксаном (190 мл) з одержанням білої суспензії. Через цю суміш продували азот протягом 5 хв, додавали PdCl2(dppf) (4,2 г; 5,14 ммоль), судину закривали і нагрівали на масляній бані при 80 °C протягом 3 г. Реакційну суміш фільтрували, промивали етиловим ефіром, концентрували, розбавляли водою (500 мл) і екстрагували етиловим ефіром (2 х 300 мл), і органічні шари промивали сольовим розчином (250 мл). Шари етилового ефіру об'єднували, висушували над MgSO4, фільтрували і концентрували з одержанням червоного масла. Неочищену речовину очищали флеш-хроматографією (силікагель, 0%-20% EtOAc в гексані). Потрібні фракції об'єднували, концентрували і висушували з DCM з одержанням етилового ефіру [4-(4,4,5,5тетраметил-[1,3,2]діоксаборолан-2-іл)-феніл]-оцтової кислоти (25,14 г; вихід 84,2%) у вигляді + білої твердої речовини/масла. LC/MS розр. для C16H23BO4 (m/e) 290, фактич. 291 (M+H, ES ). Стадія 2: Етиловий ефір {4'-[4-метил-5-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]біфеніл-4-іл}-оцтової кислоти У судині на 20 мл етиловий ефір [4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-феніл]оцтової кислоти (79,5 мг; 0,274 ммоль) (R)-1-фенілетиловий ефір [1-(4-бромфеніл)-5-метил-1H[1,2,3]триазол-4-іл]-карбамінової кислоти (100 мг; 0,249 ммоль), фосфат трикалію (159 мг; 0,748 ммоль), 2-дициклогексилфосфіно-2',6'-диметоксибіфеніл (SPhos) (30,7 мг; 0,0748 ммоль) і ацетат паладію (II) (8,4 мг; 0,037 ммоль) об'єднували з толуолом (2 мл) і водою (0,5 мл) (через які попередньо продували азот протягом 20 хв) з одержанням світло-жовтої суспензії. Атмосферу в реакційній судині замінювали на азот, судину закривали, нагрівали в сухому блоці при 100 °C протягом 6 г і охолоджували до кімнатної температури протягом ночі. Реакційну суміш розбавляли за допомогою EtOAc (50 мл) і промивали водою (50 мл) і сольовим розчином. Водні шари екстрагували за допомогою EtOAc (50 мл). Органічні шари об'єднували, висушували над MgSO4, фільтрували, концентрували, розчиняли у мінімальній кількості DCM і очищали флеш-хроматографією (силікагель, 0%-60% EtOAc в гексані). Потрібні фракції об'єднували, концентрували і висушували з суміші DCM / гексан з одержанням етилового ефіру {4'-[4-метил5-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}-оцтової кислоти (40 мг; 0,0826 ммоль, вихід 33,1%) у вигляді безбарвної воскоподібної твердої речовини. LC/MS розр. + для C28H28N4O4 (m/e) 484, фактич. 485 (M+H, ES ). Стадія 3: {4'-[4-Метил-5-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}оцтова кислота У круглодонній колбі на 200 мл етиловий ефір {4'-[4-метил-5-((R)-1фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}-оцтової кислоти (34 мг; 0,0702 ммоль) об'єднували з THF (2 мл) з одержанням жовтого розчину. До цієї суміші додавали по краплях розчин LiOH (16,8 мг; 0,702 ммоль), розчинений у воді (0,5 мл; нагрітий для часткового розчинення). Колбу з реакційною сумішшю закривали і нагрівали на масляній бані при 60 °C протягом 11 г. Реакційну суміш охолоджували до кімнатної температури, розбавляли водою і підкисляли за допомогою 1 н HCl. Одержаний осад фільтрували, промивали водою і гексаном і висушували у вакуумі з одержанням 1-{4'-[5-метил-4-((R)-1-фенілетоксикарбоніламіно)[1,2,3]триазол-1-іл]-біфеніл-4-іл}-циклопропанкарбонової кислоти (40 мг; вихід 62,4%) у вигляді + брудно-білої твердої речовини. LC/MS розр. для C26H24N4O4 (me) 456, фактич. 457 (M+H, ES ). 1 H ЯМР (DMSO-d6) δ: 12,42 (br. s., 1H), 9,19 - 9,80 (m, 1H), 7,83 (d, J = 6,5 Гц, 2H), 7,69 (d, J = 8,0 19 UA 110310 C2 5 10 15 20 25 30 35 40 45 50 55 Гц, 2H), 7,57 (d, J = 7,3 Гц, 2H), 7,08 - 7,47 (m, 7H), 5,69 (br. s., 1H), 3,65 (s, 2H), 2,16 (s, 3H), 1,13 - 1,64 (m, 3H) Приклад 3 1-{4'-[5-Метил-4-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}циклопропанкарбонова кислота N N O N O N O O Стадія 1: Метиловий ефір 1-(4-бромфеніл)-5-метил-1H-[1,2,3]триазол-4-карбонової кислоти У реакційній судині на 20 мл 1-азидо-4-бромбензол (1,647 г; 8,32 ммоль і метилбут-2-іноат (0,816 г; 0,8 мл; 8,32 ммоль) об'єднували з толуолом (15 мл) з одержанням жовтого розчину. Через атмосферу судини продували азот, судину закривали і опромінювали мікрохвилями при 150 °C протягом 1 г. Одержану тверду речовину в реакційній суміші фільтрували і промивали толуолом з одержанням метилового ефіру 1-(4-бромфеніл)-5-метил-1H-[1,2,3]триазол-4карбонової кислоти (0,33 г; 1,11 ммоль, вихід 13,3%). Фільтрат концентрували, переміщали в реакційну судину з толуолом (10 мл), додавали метилбут-2-іноат (816 мг; 0,8 мл; 8,32 ммоль) і проводили реакцію так само, як описано вище. Реакційну суміш з мінімальною кількістю твердої речовини наносили на силікагель і очищали флеш-хроматографією (силікагель, 0%-40% EtOAc в гексані). Потрібні фракції об'єднували, концентрували і висушували з суміші DCM / гексан з одержанням метилового ефіру 1-(4-бромфеніл)-5-метил-1H-[1,2,3]триазол-4-карбонової кислоти (0,87 г; вихід 35,3%) у вигляді світло-коричневої твердої речовини. Осад з реакційної суміші не об'єднували з виділеним продуктом з колонки. LC/MS розр. для C11H10BrN3O2 (m/e) 295/297, + фактич. 296/298 (M+H, ES ). Стадія 2: 1-(4-Бромфеніл)-5-метил-1H-[1,2,3]триазол-4-карбонова кислота У круглодонну колбу на 500 мл з метиловим ефіром 1-(4-бромфеніл)-5-метил-1H[1,2,3]триазол-4-карбонової кислоти (0,87 г; 2,9 ммоль) розчиняли в THF (30 мл) (коричневий розчин) додавали LiOH (0,71 г; 30 ммоль), переважно розчинений у воді (7 мл; з нагріванням). Цей розчин перемішували при кімнатній температурі протягом ночі. Реакційну суміш концентрували, розводили водою (сумарний об'єм 100 мл) і екстрагували етиловим ефіром (2 х 100 мл). Водний шар підкисляли за допомогою 1 н HCl. Одержаний осад фільтрували, промивали водою і гексаном, висушували у вакуумі і на ліофілізаторі з одержанням 1-(4бромфеніл)-5-метил-1H-[1,2,3]триазол-4-карбонової кислоти (3,6 г; вихід 110%) у вигляді коричневої твердої речовини. LC/MS розр. для C10H8N3O2 (m/e) 281/283, фактич. 281/284 (M+H, + ES ). Стадія 3: (R)-1-Фенілетиловий ефір [1-(4-бромфеніл)-5-метил-1H-[1,2,3]триазол-4-іл]карбамінової кислоти У реакційній судині на 20 мл 1-(4-бромфеніл)-5-метил-1H-[1,2,3]триазол-4-карбонову кислоту (0,67 г; 2,38 ммоль) (R)-1-фенілетанол (0,29 г; 0,29 мл; 2,4 ммоль) і триетиламін (0,24 г; 0,33 мл; 2,4 ммоль) об'єднували з толуолом (100 мл) з одержанням жовтого розчину і до цієї суміші додавали дифенілфосфорилазид (0,65 г; 0,5 мл; 2,4 ммоль). Повітря в реакційній судині продували азотом, судину герметизували, нагрівали в сухому блоці при 80 °C протягом 4 г і охолоджували до кімнатної температури протягом ночі. Реакційну суміш розбавляли за допомогою EtOAc (100 мл) і промивали водою (100 мл) і сольовим розчином (50 мл). Водні шари екстрагували за допомогою EtOAc (100 мл). Органічні шари об'єднували, висушували над MgSO4, фільтрували, концентрували, розчиняли у мінімальній кількості DCM і очищали флешхроматографією (силікагель, 0%-25% EtOAc в гексані). Потрібні фракції об'єднували, концентрували, висушували з суміші DCM / гексан, з одержанням (R)-1-фенілетилового ефіру [1-(4-бромфеніл)-5-метил-1H-[1,2,3]триазол-4-іл]-карбамінової кислоти (0,507 г; вихід 53,2%) у вигляді брудно-білої твердої речовини. LC/MS розр. для C18H17BrN4O2 (m/e) 400/402, фактич. + 401/403 (M+H, ES ). Стадія 4: Метиловий ефір 1-{4'-[5-метил-4-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол1-іл]-біфеніл-4-іл}-циклопропанкарбонової кислоти У судині на 20 мл метиловий ефір 1-[4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-феніл]циклопропанкарбонової кислоти (75,3 мг; 0,249 ммоль) (R)-1-фенілетиловий ефір [1-(4бромфеніл)-5-метил-1H-[1,2,3]триазол-4-іл]-карбамінової кислоти (100 мг; 0,249 ммоль), фосфат трикалію (159 мг; 0,748 ммоль), 2-дициклогексилфосфіно-2',6'-диметоксибіфеніл (SPhos) (30,7 мг; 0,0748 ммоль) і Pd(OAc)2 (8,4 мг; 0,037 ммоль) об'єднували з толуолом (2 мл) і водою (0,5 мл) (через які попередньо продували азот протягом 20 хв) з одержанням світло-жовтого 20 UA 110310 C2 5 10 15 20 25 30 35 40 45 50 55 розчину. Повітря в реакційній судині продували азотом, судину закривали, нагрівали в сухому блоці при 100 °C протягом 5 г і охолоджували до кімнатної температури протягом ночі. Реакційну суміш розбавляли за допомогою EtOAc (50 мл) і промивали водою (50 мл) і сольовим розчином. Водні шари екстрагували за допомогою EtOAc (50 мл). Органічні шари об'єднували, висушували над MgSO4, фільтрували, концентрували, розчиняли у мінімальній кількості DCM і очищали флеш-хроматографією (силікагель, 0%-100% EtOAc в гексані). Потрібні фракції об'єднували, концентрували і висушували з суміші DCM / гексан з одержанням метилового ефіру 1-{4'-[5-метил-4-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}циклопропанкарбонової кислоти (74 мг; вихід 59,8%) у вигляді білої твердої речовини. LC/MS + розр. для C29H28N4O4 (m/e) 496, фактич. 497 (M+H, ES ). Стадія 5: 1-{4'-[5-Метил-4-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4іл}-циклопропанкарбонова кислота У круглодонній колбі на 200 мл метиловий ефір 1-{4'-[5-метил-4-((R)-1фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}-циклопропанкарбонової кислоти (66 мг; 0,133 ммоль) об'єднували з THF (3 мл) з одержанням жовтого розчину. До цієї суміші додавали по краплях розчин LiOH (31,8 мг; 1,334 ммоль) у воді (1 мл), частково розчиненого шляхом нагрівання. Колбу з реакційною сумішшю закривали і нагрівали на масляній бані при 60 °C протягом 11 г. Реакційну суміш охолоджували до кімнатної температури розбавляли водою і підкисляли за допомогою 1 н HCl. Одержаний осад фільтрували, промивали водою, етиловим ефіром і гексаном і висушували у вакуумі з одержанням 1-{4'-[5-метил-4-((R)-1фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}-циклопропанкарбонової кислоти (40 мг; вихід 62,4%) у вигляді брудно-білої твердої речовини. LC/MS розр. для C28H26N4O4 (m/e) + 1 482, фактич. 483 (M+H, ES ). H ЯМР (DMSO-d6) δ: 12,39 (br. s., 1H), 9,59 (br. s., 1H), 7,89 (d, J = 8,5 Гц, 2H), 7,69 (dd, J = 8,3, 5,3 Гц, 4H), 7,28 - 7,49 (m, 7H), 5,79 (q, J = 6,5 Гц, 1H), 2,21 (s, 3H), 1,43 - 1,63 (m, 5H), 1,14 - 1,25 (m, 2H). Приклад 4 {4'-[5-Метил-4-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}-оцтова кислота N N O N O N O O Стадія 1: Метиловий ефір {4'-[5-метил-4-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1іл]-біфеніл-4-іл}-оцтової кислоти У судині на 20 мл етиловий ефір [4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-феніл]оцтової кислоти (86,8 мг; 0,299 ммоль) (R)-1-фенілетиловий ефір [1-(4-бромфеніл)-5-метил-1H[1,2,3]триазол-4-іл]-карбамінової кислоти (100 мг; 0,249 ммоль), фосфат трикалію (159 мг; 0,748 ммоль), 2-дициклогексилфосфіно-2',6'-диметоксибіфеніл (SPhos) (30,7 мг; 0,0748 ммоль) і Pd(OAc)2 (8,4 мг; 0,037 ммоль) об'єднували з толуолом (2 мл) і водою (0,5 мл) (через які попередньо продували азот протягом 20 хв) з одержанням світло-жовтого розчину. Повітря в реакційній судині продували азотом, судину закривали, нагрівали в сухому блоці при 100 °C протягом 16 г і охолоджували до кімнатної температури протягом ночі. Реакційну суміш фільтрували через Celite, концентрували, розчиняли в суміші DCM / EtOAc / MeOH, наносили на силікагель і очищали флеш-хроматографією (силікагель, 0%-40% EtOAc в гексані). Потрібні фракції об'єднували, концентрували і висушували з суміші DCM / гексан з одержанням метилового ефіру {4'-[5-метил-4-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4іл}-оцтової кислоти (56,6 мг; вихід 54,3%) у вигляді білої твердої речовини. LC/MS розр. для + C28H28N4O4 (m/e) 484, фактич. 485 (M+H, ES ). Стадія 2: {4'-[5-Метил-4-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}оцтова кислота У круглодонній колбі на 200 мл метиловий ефір {4'-[5-метил-4-((R)-1фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}-оцтової кислоти (59 мг; 0,122 ммоль) об'єднували з THF (3 мл) з одержанням жовтого розчину. До цієї суміші додавали по краплях розчин LiOH (29,2 мг; 1,22 ммоль) у воді (1 мл), нагрітий для часткового розчинення. Колбу з реакційною сумішшю закривали, нагрівали на масляній бані при 60 °C протягом 3,5 г і охолоджували до кімнатної температури протягом ночі. Реакційну суміш розбавляли водою і підкисляли за допомогою 1 н HCl. Одержаний осад екстрагували за допомогою EtOAc (2 х 75 мл). Органічні шари промивали сольовим розчином (50 мл), об'єднували, висушували над MgSO4, фільтрували, концентрували і висушували з суміші DCM / гексан з одержанням {4'-[5 21 UA 110310 C2 5 метил-4-((R)-1-фенілетоксикарбоніламіно)-[1,2,3]триазол-1-іл]-біфеніл-4-іл}-оцтової кислоти (50 мг; вихід 90%) у вигляді брудно-білої твердої речовини. LC/MS розр. для C26H24N4O4 (m/e) 456, + 1 фактич. 457 (M+H, ES ). H ЯМР (DMSO-d6) δ: 12,44 (br. s., 1H), 9,62 (br. s., 1H), 7,95 (d, J = 8,5 Гц, 2H), 7,76 (t, J = 8,0 Гц, 4H), 7,22 - 7,59 (m, 7H), 5,85 (q, J = 6,5 Гц, 1H), 3,71 (s, 2H), 2,27 (s, 3H), 1,60 (d, J = 6,0 Гц, 3H). Приклад 5 1-(4'-{5-[(R)-1-(2-Фторфеніл)-етоксикарбоніламіно]-4-метил-[1,2,3]триазол-1-іл}-біфеніл-4-іл)циклопропанкарбонова кислота N N N O O N O O F 10 15 20 25 30 35 40 45 50 Стадія 1: (R)-1-(2-Фторфеніл)-етиловий ефір [3-(4-бромфеніл)-5-метил-3H-[1,2,3]триазол-4іл]-карбамінової кислоти У реакційній судині на 20 мл 3-(4-бромфеніл)-5-метил-3H-[1,2,3]триазол-4-карбонову кислоту 100 мг; 0,354 ммоль), (R)-1-(2-фторфеніл)етанол (49,6 мг; 49 мкл; 0,354 ммоль) і триетиламін (35,8 мг; 49,3 мкл; 0,354 ммоль) об'єднували з толуолом (2,5 мл) з одержанням жовтої суспензії і до цієї суміші додавали дифенілфосфорилазид (97,4 мг; 76,3 мкл; 0,354 ммоль). Повітря в реакційній судині продували азотом, судину закривали, нагрівали на масляній бані при 80 °C протягом 4 г і охолоджували до кімнатної температури протягом ночі. Вносили додаткові реагенти: (R)-1-(2-фторфеніл)етанол (24,8 мг; 24,5 мкл; 0,177 ммоль), триетиламін (72,6 мг; 100 мкл; 0717 ммоль) і дифенілфосфорилазид (97,4 мг; 76,3 мкл; 0,354 ммоль). Повітря в реакційній судині продували азотом, судину закривали, нагрівали на масляній бані при 80 °C протягом 2 г і охолоджували до кімнатної температури. Реакційну суміш наносили на Celite і очищали флешхроматографією (силікагель, 12 г Redisep, 20 мл/хв, 0%-40% EtOAc в гексані). Потрібні фракції об'єднували, концентрували, висушували з суміші DCM / гексан, з одержанням (R)-1-(2фторфеніл)-етилового ефіру [3-(4-бромфеніл)-5-метил-3H-[1,2,3]триазол-4-іл]-карбамінової кислоти (95,7 мг; вихід 64,4%) у вигляді твердої речовини. LC/MS розр. для C18H16BrFN4O2 (m/e) + 418/420, фактич. 419/421 (M+H, ES ). Стадія 2: Метиловий ефір 1-(4'-{5-[(R)-1-(2-фторфеніл)-етоксикарбоніламіно]-4-метил[1,2,3]триазол-1-іл}-біфеніл-4-іл)-циклопропанкарбонової кислоти У судині на 20 мл метиловий ефір 1-[4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-феніл]циклопропанкарбонової кислоти (74,4 мг; 0,246 ммоль) (R)-1-(2-фторфеніл)-етиловий ефір [3-(4бромфеніл)-5-метил-3H-[1,2,3]триазол-4-іл]-карбамінової кислоти (86 мг; 0,205 ммоль), фосфат трикалію (131 мг; 0,615 ммоль), 2-дициклогексилфосфіно-2',6'-диметоксибіфеніл (Sphos) (25,3 мг; 0,0615 ммоль) і Pd(OAc)2 (6,91 мг; 0,0308 ммоль) об'єднували з толуолом (2 мл) і водою (0,5 мл) (через які попередньо продували азот протягом 20 хв) з одержанням світло-жовтої суспензії. Повітря в реакційній судині продували азотом, судину закривали, нагрівали на масляній бані при 100 °C протягом 4 г і охолоджували до кімнатної температури протягом ночі. Реакційну суміш розбавляли за допомогою EtOAc (8 мл), фільтрували через Celite, промивали за допомогою EtOAc (2 х 6 мл), висушували, розчиняли у мінімальній кількості DCM і очищали флеш-хроматографією (силікагель, 0%-50% EtOAc в гексані). Потрібні фракції об'єднували, концентрували і висушували з суміші DCM / гексан з одержанням метилового ефіру 1-(4'-{5-[(R)1-(2-фторфеніл)-етоксикарбоніламіно]-4-метил-[1,2,3]триазол-1-іл}-біфеніл-4-іл)циклопропанкарбонової кислоти (47,8 мг; вихід 45,3%) у вигляді білої твердої речовини. LC/MS + розр. для C29H27FN4O4 (m/e) 514, фактич. 515 (M+H, ES ). Стадія 3: 1-(4'-{5-[(R)-1-(2-Фторфеніл)-етоксикарбоніламіно]-4-метил-[1,2,3]триазол-1-іл}біфеніл-4-іл)-циклопропанкарбонова кислота У круглодонній колбі на 20 мл метиловий ефір 1-(4'-{5-[(R)-1-(2-фторфеніл)етоксикарбоніламіно]-4-метил-[1,2,3]триазол-1-іл}-біфеніл-4-іл)-циклопропанкарбонової кислоти (42 мг; 0,0816 ммоль) об'єднували з THF (2 мл) з одержанням жовтого розчину. До цієї суміші додавали по краплях розчин LiOH (34,3 мг; 0,816 ммоль) у воді (0,5 мл), нагрітий для часткового розчинення. Судину закривали, нагрівали на масляній бані при 60 °C протягом 11 г і 22 UA 110310 C2 5 10 охолоджували до кімнатної температури протягом ночі. Реакційну суміш розбавляли водою (35 мл) і підкисляли за допомогою 1 н HCl. Одержаний осад фільтрували, промивали водою і гексаном і висушували у вакуумі і в ексикаторі з одержанням 1-(4'-{5-[(R)-1-(2-фторфеніл)етоксикарбоніламіно]-4-метил-[1,2,3]триазол-1-іл}-біфеніл-4-іл)-циклопропанкарбонової кислоти (44 мг; вихід 108%) у вигляді білої твердої речовини. LC/MS розр. для C28H25FN4O4 (m/e) 500, + 1 фактич. 501 (M+H, ES ). H ЯМР (DMSO-d6) δ: 12,39 (br. s., 1H), 9,74 (br. s., 1H), 7,84 (d, J = 6,5 Гц, 2H), 7,67 (d, J = 8,0 Гц, 2H), 7,58 (d, J = 8,0 Гц, 2H), 7,47 (d, J = 8,0 Гц, 2H), 6,69 - 7,42 (m, 4H), 5,89 (br. s., 1H), 2,17 (br. s., 3H), 1,26 - 1,74 (m, 5H), 1,14 - 1,24 (m, 2H). Приклад 6 1-(4'-{4-Метил-5-[(R)-1-(2-трифторметилфеніл)-етоксикарбоніламіно]-[1,2,3]триазол-1-іл}біфеніл-4-іл)-циклопропанкарбонова кислота N N N O O N F F O O F 15 20 25 30 35 40 45 Стадія 1: (R)-1-(2-трифторметилфеніл)-етиловий ефір [3-(4-бромфеніл)-5-метил-3H[1,2,3]триазол-4-іл]-карбамінової кислоти У реакційній судині на 20 мл 3-(4-бромфеніл)-5-метил-3H-[1,2,3]триазол-4-карбонову кислоту 100 мг; 0,354 ммоль), (R)-1-(2-трифторметилфеніл)етанол (67,4 мг; 0,354 ммоль) і триетиламін (35,8 мг; 49,3 мкл; 0,354 ммоль) об'єднували з толуолом (2,5 мл) з одержанням жовтої суспензії, і до цієї суміші додавали дифенілфосфорилазид (97,4 мг; 76,3 мкл; 0,354 ммоль). Повітря в реакційній судині продували азотом, судину закривали, нагрівали на масляній бані при 80 °C протягом 4 г і охолоджували до кімнатної температури протягом ночі. Вносили додаткові реагенти: (R)-1-(2-трифторметилфеніл)етанол (33,7 мг; 0,177 ммоль), триетиламін (72,6 мг; 100 мкл; 0,717 ммоль) і дифенілфосфорилазид (97,4 мг; 76,3 мкл; 0,354 ммоль). Повітря в реакційній судині продували азотом, судину закривали, нагрівали на масляній бані при 80 °C протягом 2 г і охолоджували до кімнатної температури. Реакційну суміш наносили на Celite і очищали флеш-хроматографією (силікагель, 12 г Redisep, 20 мл/хв, 0%-40% EtOAc в гексані). Потрібні фракції об'єднували, концентрували, висушували з суміші DCM / гексан, з одержанням (R)-1-(2-трифторметилфеніл)-етилового ефіру [3-(4-бромфеніл)-5-метил-3H-[1,2,3]триазол-4-іл]карбамінової кислоти (99,7 мг; вихід 59,9%) у вигляді брудно-білої твердої речовини. LC/MS + розр. для C19H16BrF3N4O2 (m/e) 468/470, фактич. 469/471 (M+H, ES ). Стадія 2: Метиловий ефір 1-(4'-{5-[(R)-1-(2-трифторметилфеніл)-етоксикарбоніламіно]-4метил-[1,2,3]триазол-1-іл}-біфеніл-4-іл)-циклопропанкарбонової кислоти У судині на 20 мл метиловий ефір 1-[4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-феніл]циклопропанкарбонової кислоти (69,4 мг; 0,230 ммоль) (R)-1-(2-трифторметилфеніл)-етиловий ефір [3-(4-бромфеніл)-5-метил-3H-[1,2,3]триазол-4-іл]-карбамінової кислоти (90 мг; 0,192 ммоль), фосфат трикалію (122 мг; 0,575 ммоль), 2-дициклогексилфосфіно-2',6'диметоксибіфеніл (Sphos) (23,6 мг; 0,0575 ммоль) і Pd(OAc)2 (6,5 мг; 0,0288 ммоль) об'єднували з толуолом (2 мл) і водою (0,5 мл) (через які попередньо продували азот протягом 20 хв) з одержанням світло-жовтої суспензії. Повітря в реакційній судині продували азотом, судину закривали, нагрівали на масляній бані при 100 °C протягом 4 г і охолоджували до кімнатної температури протягом ночі. Реакційну суміш розбавляли за допомогою EtOAc (8 мл), фільтрували через Celite, промивали за допомогою EtOAc (2 х 6 мл), висушували, розчиняли у мінімальній кількості DCM і очищали флеш-хроматографією (силікагель, 0%-50% EtOAc в гексані). Потрібні фракції об'єднували, концентрували і висушували з суміші DCM / гексан з одержанням метилового ефіру 1-(4'-{5-[(R)-1-(2-трифторметилфеніл)-етоксикарбоніламіно]-4метил-[1,2,3]триазол-1-іл}-біфеніл-4-іл)-циклопропанкарбонової кислоти (50,3 мг; вихід 46,5%) у вигляді білої твердої речовини. LC/MS розр. для C30H27F3N4O4 (m/e) 564, фактич. 565 (M+H, + ES ). 23 UA 110310 C2 5 10 15 20 Стадія 3: 1-(4'-{5-[(R)-1-(2-трифторметилфеніл)-етоксикарбоніламіно]-4-метил[1,2,3]триазол-1-іл}-біфеніл-4-іл)-циклопропанкарбонова кислота У круглодонній колбі на 20 мл метиловий ефір 1-(4'-{5-[(R)-1-(2-трифторметилфеніл)етоксикарбоніламіно]-4-метил-[1,2,3]триазол-1-іл}-біфеніл-4-іл)-циклопропанкарбонової кислоти (45 мг; 0,0797 ммоль) об'єднували з THF (2 мл) з одержанням жовтого розчину. До цієї суміші додавали по краплях розчин LiOH (33,5 мг; 0,797 ммоль) у воді (0,5 мл), нагрітий для часткового розчинення. Судину закривали і нагрівали на масляній бані при 60 °C протягом 11 г і охолоджували до кімнатної температури протягом ночі. Реакційну суміш розбавляли водою (35 мл) і підкисляли за допомогою 1 н HCl. Одержаний осад екстрагували в органічний шар за допомогою EtOAc (2 х 30 мл), промивали сольовим розчином (30 мл), висушували або MgSO4, фільтрували, концентрували і висушували з суміші DCM / гексан, з одержанням 38,8 мг неочищеного продукту. Цей продукт очищали в ході препаратівної ВЕРХ (Gilson, Pursuit 10 мкм, 20 х 100 мм C18, 30 мл/хв, від 30 до 100% ACN/H2O, 8 хв). Потрібні фракції об'єднували, концентрували і висушували з суміші DCM / гексан. Продукт розчиняли в DCM і осаджували додаванням гексану. Одержану тверду речовину фільтрували і промивали гексаном, висушували у вакуумі з одержанням 1-(4'-{5-[(R)-1-(2-трифторметилфеніл)етоксикарбоніламіно]-4-метил-[1,2,3]триазол-1-іл}-біфеніл-4-іл)-циклопропанкарбонової кислоти (17,2 мг; вихід 39,2%) у вигляді брудно-білої твердої речовини. LC/MS розр. для C29H25F3N4O4 + 1 (m/e) 550, фактич. 551 (M+H, ES ). H ЯМР (DMSO-d6) δ: 12,40 (br. s., 1H), 9,77 (br. s., 1H), 7,83 (d, J = 7,3 Гц, 2H), 7,63 - 7,78 (m, 5H), 7,39 - 7,62 (m, 5H), 5,96 (br. s., 1H), 2,15 (br. s., 3H), 1,50 (d, J = 2,3 Гц, 5H), 1,20 (d, J = 2,0 Гц, 2H). Приклад 7 1-(4'-{4-Метил-5-[(R)-1-(3-трифторметилфеніл)-етоксикарбоніламіно]-[1,2,3]триазол-1-іл}біфеніл-4-іл)-циклопропанкарбонова кислота N N N O O N O O 25 30 35 40 45 CF3 Стадія 1: (R)-1-(3-Трифторметилфеніл)-етиловий ефір [3-(4-бромфеніл)-5-метил-3H[1,2,3]триазол-4-іл]-карбамінової кислоти У реакційній судині на 20 мл 3-(4-бромфеніл)-5-метил-3H-[1,2,3]триазол-4-карбонову кислоту (195 мг; 0,691 ммоль) (R)-1-(3-(трифторметил)феніл)етанол (197 мг; 1,04 ммоль) і триетиламін (145 мг; 0,2 мл; 1,43 ммоль) об'єднували з толуолом (10 мл) з одержанням жовтого розчину, і до цієї суміші додавали дифенілфосфорилазид (383 мг; 0,3 мл; 1,39 ммоль). Повітря в реакційній судині продували азотом, судину закривали, нагрівали на масляній бані при 65 °C протягом 2,5 г і охолоджували до кімнатної температури протягом ночі. Реакційну суміш розбавляли за допомогою EtOAc і промивали водою, насиченим розчином хлориду амонію і сольовим розчином. Водні шари одноразово екстрагували за допомогою EtOAc. Органічні шари об'єднували, висушували над MgSO4, фільтрували, концентрували, розбавляли за допомогою DCM і очищали флеш-хроматографією (силікагель, 0%-30% EtOAc в гексані). Потрібні фракції об'єднували, концентрували і висушували з суміші DCM / гексан, з одержанням (R)-1-(3трифторметилфеніл)-етилового ефіру [3-(4-бромфеніл)-5-метил-3H-[1,2,3]триазол-4-іл]карбамінової кислоти (118,1 мг; вихід 36,4%) у вигляді безбарвної воскоподібної твердої + речовини. LC/MS розр. для C19H16BrF3N4O2 (m/e) 468/470, фактич. 469/471 (M+H, ES ). Стадія 2: Метиловий ефір 1-(4'-{4-метил-5-[(R)-1-(3-трифторметилфеніл)етоксикарбоніламіно]-[1,2,3]триазол-1-іл}-біфеніл-4-іл)-циклопропанкарбонової кислоти У судині на 20 мл метиловий ефір 1-[4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-феніл]циклопропанкарбонової кислоти (89,6 мг; 0,297 ммоль) (R)-1-(3-трифторметилфеніл)-етиловий ефір [3-(4-бромфеніл)-5-метил-3H-[1,2,3]триазол-4-іл]-карбамінової кислоти (116 мг; 0,247 ммоль), 2-дициклогексилфосфіно-2',6'-диметоксибіфеніл (SPhos) (30,4 мг; 0,0742 ммоль), фосфат трикалію (157 мг; 0,742 ммоль) і Pd(OAc)2 (8,3 мг, 0,0371 ммоль) об'єднували з толуолом (4 мл) і водою (1 мл) (через які попередньо продували азот протягом 20 мін) з 24 UA 110310 C2 5 10 15 20 25 30 одержанням світло-жовтої суспензії. Повітря в реакційній судині продували азотом, судину закривали, нагрівали на масляній бані при 80 °C протягом 3,5 г і охолоджували до кімнатної температури протягом ночі. Вносили додаткові реагенти: метиловий ефір 1-[4-(4,4,5,5тетраметил-[1,3,2]діоксаборолан-2-іл)-феніл]-циклопропанкарбонової кислоти (45 мг; 0,149 ммоль), 2-дициклогексилфосфіно-2',6'-диметоксибіфеніл (SPhos) (32 мг; 0,0779 ммоль), фосфат трикалію (57 мг; 0,269 ммоль) і Pd(OAc)2 (10 мг; 0,0445 ммоль). Повітря в реакційній судині продували азотом, судину закривали, нагрівали в сухому блоці при 80 °C протягом 4 г і охолоджували до кімнатної температури протягом ночі. Реакційну суміш розбавляли за допомогою EtOAc і промивали водою і сольовим розчином. Водні шари екстрагували за допомогою EtOAc. Органічні шари об'єднували, висушували над MgSO4, фільтрували, концентрували, розчиняли у мінімальній кількості DCM і очищали флеш-хроматографією (силікагель, 0%-50% EtOAc в гексані). Потрібні фракції об'єднували, концентрували і висушували з суміші DCM / гексан з одержанням метилового ефіру 1-(4'-{4-метил-5-[(R)-1-(3трифторметилфеніл)-етоксикарбоніламіно]-[1,2,3]триазол-1-іл}-біфеніл-4-іл)циклопропанкарбонової кислоти (63,5 мг; вихід 45,5%) у вигляді білої твердої речовини. LC/MS + розр. для C30H27F3N4O4 (m/e) 564, фактич. 565 (M+H, ES ). Стадія 3: 1-(4'-{4-Метил-5-[(R)-1-(3-трифторметилфеніл)-етоксикарбоніламіно][1,2,3]триазол-1-іл}-біфеніл-4-іл)-циклопропанкарбонова кислота У круглодонній колбі на 250 мл метиловий ефір 1-(4'-{4-метил-5-[(R)-1-(3трифторметилфеніл)-етоксикарбоніламіно]-[1,2,3]триазол-1-іл}-біфеніл-4-іл)циклопропанкарбонової кислоти (214,5 мг; 0,452 ммоль) об'єднували з THF (8 мл) і етанолом (8 мл) з одержанням жовтого розчину. До цієї суміші додавали по краплях NaOH (1 н; 4,5 мл; 4,5 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом ночі. Реакційну суміш розбавляли водою, концентрували, розбавляли великою кількістю води і підкисляли за допомогою 1 н HCl. Одержаний осад фільтрували, промивали водою і гексаном і висушували у вакуумі і в ексикаторі з одержанням 1-(4'-{4-метил-5-[(R)-1-(3-трифторметилфеніл)етоксикарбоніламіно]-[1,2,3]триазол-1-іл}-біфеніл-4-іл)-циклопропанкарбонової кислоти (174 мг; вихід 83,6%) у вигляді білої твердої речовини. LC/MS розр. для C26H28N4O4 (m/e) 460, фактич. + 1 461 (M+H, ES ). H ЯМР (DMSO-d6) δ: 12,39 (br. s., 1H), 9,47 (br. s., 1H), 7,88 (d, J = 7,8 Гц, 2H), 7,64 (dd, J = 18,7, 8,2 Гц, 4H), 7,46 (d, J = 8,3 Гц, 2H), 4,67 (br. s., 1H), 2,36 (br. s., 1H), 2,20 (s, 3H), 1,54 - 2,02 (m, 6H), 1,43 - 1,53 (m, 2H), 1,17 - 1,31 (m, 2H), 1,05 (br. s., 3H). Приклад 8 1-{4'-[5-((R)-Індан-1-ілоксикарбоніламіно)-4-метил-[1,2,3]триазол-1-іл]-біфеніл-4-іл}циклопропанкарбонова кислота N N N O O N O O 35 40 45 50 Стадія 1: (R)-Індан-1-іловий ефір [3-(4-бромфеніл)-5-метил-3H-[1,2,3]триазол-4-іл]карбамінової кислоти У реакційній судині на 20 мл 3-(4-бромфеніл)-5-метил-3H-[1,2,3]триазол-4-карбонову кислоту 100 мг; 0,354 ммоль), (R)-2,3-дигідро-1H-інден-1-ол (47,6 мг; 0,354 ммоль) і триетиламін (35,8 мг; 49,3 мкл; 0,354 ммоль) об'єднували з толуолом (2,5 мл) з одержанням жовтої суспензії, і до цієї суміші додавали дифенілфосфорилазид (97,4 мг; 76,3 мкл; 0,354 ммоль). Повітря в реакційній судині продували азотом, судину закривали, нагрівали на масляній бані при 80 °C протягом 4 г і охолоджували до кімнатної температури протягом ночі. Вносили додаткові реагенти: (R)-2,3дигідро-1H-інден-1-ол (23,8 мг; 0,177 ммоль), триетиламін (72,6 мг; 100 мкл; 0717 ммоль) і дифенілфосфорилазид (97,4 мг; 76,3 мкл; 0,354 ммоль). Повітря в реакційній судині продували азотом, судину закривали, нагрівали на масляній бані при 80 °C протягом 2 г і охолоджували до кімнатної температури. Реакційну суміш наносили на Celite і очищали флеш-хроматографією (силікагель, 12 г Redisep, 20 мл/хв, 0%-40% EtOAc в гексані). Потрібні фракції об'єднували, концентрували, висушували з суміші DCM / гексан, з одержанням (R)-індан-1-ілового ефіру [3-(4бромфеніл)-5-метил-3H-[1,2,3]триазол-4-іл]-карбамінової кислоти (81,6 мг; вихід 55,7%) у вигляді брудно-білої твердої речовини. LC/MS розр. для C19H17BrN4O2 (m/e) 412/414, фактич. 25 UA 110310 C2 + 5 10 15 20 25 30 35 413/415 (M+H, ES ). Стадія 2: Метиловий ефір 1-{4'-[5-((R)-індан-1-ілоксикарбоніламіно)-4-метил-[1,2,3]триазол1-іл]-біфеніл-4-іл}-циклопропанкарбонової кислоти У судині на 20 мл метиловий ефір 1-[4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-феніл]циклопропанкарбонової кислоти (64,1 мг; 0,212 ммоль) (R)-індан-1-іловий ефір [3-(4бромфеніл)-5-метил-3H-[1,2,3]триазол-4-іл]-карбамінової кислоти (73 мг; 0,177 ммоль), фосфат трикалію (112 мг; 0,530 ммоль), 2-дициклогексилфосфіно-2',6'-диметоксибіфеніл (Sphos) (21,8 мг; 0,0530 ммоль) і Pd(OAc)2 (6,0 мг; 0,0265 ммоль) об'єднували з толуолом (2 мл) і водою (0,5 мл) (через які попередньо продували азот протягом 20 хв) з одержанням світло-жовтої суспензії. Повітря в реакційній судині продували азотом, судину закривали, нагрівали на масляній бані при 100 °C протягом 4 г і охолоджували до кімнатної температури протягом ночі. Реакційну суміш розбавляли за допомогою EtOAc (8 мл), фільтрували через Celite, промивали за допомогою EtOAc (2 х 6 мл), висушували, розчиняли у мінімальній кількості DCM і очищали флеш-хроматографією (силікагель, 0%-50% EtOAc в гексані). Потрібні фракції об'єднували, концентрували і висушували з суміші DCM / гексан з одержанням метилового ефіру 1-{4'-[5-((R)індан-1-ілоксикарбоніламіно)-4-метил-[1,2,3]триазол-1-іл]-біфеніл-4-іл}-циклопропанкарбонової кислоти (59,5 мг; вихід 66,2%) у вигляді білої твердої речовини. LC/MS розр. для C30H28N4O4 + (m/e) 508, фактич. 509 (M+H, ES ). Стадія 3: 1-{4'-[5-((R)-Індан-1-ілоксикарбоніламіно)-4-метил-[1,2,3]триазол-1-іл]-біфеніл-4-іл}циклопропанкарбонова кислота У круглодонній колбі на 20 мл метиловий ефір 1-{4'-[5-((R)-індан-1-ілоксикарбоніламіно)-4метил-[1,2,3]триазол-1-іл]-біфеніл-4-іл}-циклопропанкарбонової кислоти (53 мг; 0,104 ммоль) об'єднували з THF (2 мл) з одержанням жовтого розчину. До цієї суміші додавали по краплях розчин LiOH (43,8 мг; 1,04 ммоль) у воді (0,5 мл), нагрітий для часткового розчинення. Судину закривали, нагрівали на масляній бані при 60 °C протягом 11 г і охолоджували до кімнатної температури протягом ночі. Реакційну суміш розбавляли водою (35 мл) і підкисляли за допомогою 1 н HCl. Одержаний осад фільтрували і промивали водою і гексаном і висушували у вакуумі з одержанням 1-{4'-[5-((R)-індан-1-ілоксикарбоніламіно)-4-метил-[1,2,3]триазол-1-іл]біфеніл-4-іл}-циклопропанкарбонової кислоти (28 мг; вихід 54,3%) у вигляді білої твердої + 1 речовини. LC/MS розр. для C29H26N4O4 (m/e) 494, фактич. 495 (M+H, ES ). H ЯМР (DMSO-d6) δ: 12,38 (br. s., 1H), 9,56 (br. s., 1H), 7,87 (d, J = 8,3 Гц, 2H), 7,68 (d, J = 8,3 Гц, 2H), 7,60 (br. s., 2H), 7,48 (d, J = 8,0 Гц, 2H), 7,29 (br. s., 3H), 7,11 - 7,21 (m, 1H), 6,04 (br. s., 1H), 3,00 (br. s., 1H), 2,85 (br. s., 1H), 2,30 - 2,45 (m, 1H), 2,09 - 2,28 (m, 3H), 2,00 (br. s., 1H), 1,42 - 1,61 (m, 2H), 1,21 (d, J = 3,0 Гц, 2H). Приклад 9 1-{4'-[5-((R)-1,2-Диметилпропоксикарбоніламіно)-4-метил-[1,2,3]триазол-1-іл]-біфеніл-4-іл}циклопропанкарбонова кислота N N N O O N O O 40 45 50 Стадія 1: (R)-1-2-Диметилпропіловий ефір [3-(4-бромфеніл)-5-метил-3H-[1,2,3]триазол-4-іл]карбамінової кислоти У реакційній судині на 20 мл 3-(4-бромфеніл)-5-метил-3H-[1,2,3]триазол-4-карбонову кислоту 100 мг; 0,354 ммоль), (R)-3-метилбутан-2-ол (31,2 мг; 38,6 мкл; 0,354 ммоль) і триетиламін (35,8 мг; 49,3 мкл; 0,354 ммоль) об'єднували з толуолом (2,5 мл) з одержанням жовтої суспензії і до цієї суміші додавали дифенілфосфорилазид (97,4 мг; 76,3 мкл; 0,354 ммоль). Повітря в реакційній судині продували азотом, судину закривали, нагрівали на масляній бані при 80 °C протягом 4 г і охолоджували до кімнатної температури протягом ночі. Вносили додаткові реагенти: (R)-3-метилбутан-2-ол (15,6 мг; 19,3 мкл; 0,177 ммоль), триетиламін (72,6 мг; 100 мкл; 0717 ммоль) і дифенілфосфорилазид (97,4 мг; 76,3 мкл; 0,354 ммоль). Повітря в реакційній судині продували азотом, судину закривали, нагрівали на масляній бані при 80 °C протягом 2 г і охолоджували до кімнатної температури. Реакційну суміш наносили на Celite і очищали флешхроматографією (силікагель, 0%-40% EtOAc в гексані). Потрібні фракції об'єднували, концентрували, висушували з суміші DCM / гексан, з одержанням (R)-1-2-диметилпропілового 26 UA 110310 C2 5 10 15 20 25 30 35 40 ефіру [3-(4-бромфеніл)-5-метил-3H-[1,2,3]триазол-4-іл]-карбамінової кислоти (93,6 мг; вихід 71,9%) у вигляді брудно-білої твердої речовини. LC/MS розр. для C15H19BrN4O2 (m/e) 366/368, + фактич. 367/369 (M+H, ES ). Стадія 2: Метиловий ефір 1-{4'-[5-((R)-1,2-диметилпропоксикарбоніламіно)-4-метил[1,2,3]триазол-1-іл]-біфеніл-4-іл}-циклопропанкарбонової кислоти У судині на 20 мл метиловий ефір 1-[4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-феніл]циклопропанкарбонової кислоти (82,9 мг; 0,274 ммоль) (R)-1,2-диметилпропіловий ефір [3-(4бромфеніл)-5-метил-3H-[1,2,3]триазол-4-іл]-карбамінової кислоти (84 мг; 0,229 ммоль), фосфат трикалію (146 мг; 0,686 ммоль), 2-дициклогексилфосфіно-2',6'-диметоксибіфеніл (Sphos) (28,2 мг; 0,0686 ммоль) і Pd(OAc)2 (7,7 мг; 0,0343 ммоль) об'єднували з толуолом (2 мл) і водою (0,5 мл) (через які попередньо продували азот протягом 20 хв) з одержанням світло-жовтої суспензії. Атмосферу в реакційній судині замінювали на азот, судину закривали, нагрівали на масляній бані при 100 °C протягом 4 г і охолоджували до кімнатної температури протягом ночі. Реакційну суміш розбавляли за допомогою EtOAc (8 мл), фільтрували через Celite, промивали за допомогою EtOAc (2 х 6 мл), висушували, розчиняли у мінімальній кількості DCM і очищали флеш-хроматографією (силікагель, 0%-50% EtOAc в гексані). Потрібні фракції об'єднували, концентрували і висушували з суміші DCM / гексан з одержанням метилового ефіру 1-{4'-[5-((R)1,2-диметилпропоксикарбоніламіно)-4-метил-[1,2,3]триазол-1-іл]-біфеніл-4-іл}циклопропанкарбонової кислоти (80 мг; вихід 75,6%) у вигляді білої твердої речовини. LC/MS + розр. для C26H30N4O4 (m/e) 462, фактич. 463 (M+H, ES ). Стадія 3: 1-{4'-[5-((R)-1,2-диметилпропоксикарбоніламіно)-4-метил-[1,2,3]триазол-1-іл]біфеніл-4-іл}-циклопропанкарбонова кислота У круглодонній колбі на 20 мл метиловий ефір 1-{4'-[5-((R)-1,2диметилпропоксикарбоніламіно)-4-метил-[1,2,3]триазол-1-іл]-біфеніл-4-іл}циклопропанкарбонової кислоти (45 мг; 0,0797 ммоль) об'єднували з THF (2 мл) з одержанням жовтого розчину. До цієї суміші додавали по краплях розчин LiOH (33,5 мг; 0,797 ммоль) у воді (0,5 мл), нагрітий для часткового розчинення. Судину закривали, нагрівали на масляній бані при 60 °C протягом 6 г і охолоджували до кімнатної температури протягом ночі. Реакційну суміш розбавляли водою (35 мл) і підкисляли за допомогою 1 н HCl. Одержаний осад екстрагували в органічний шар за допомогою EtOAc (2 х 30 мл), промивали сольовим розчином (30 мл), висушували над MgSO4, фільтрували, концентрували і висушували з суміші DCM / гексан з одержанням 1-{4'-[5-((R)-1,2-диметилпропоксикарбоніламіно)-4-метил-[1,2,3]триазол-1-іл]біфеніл-4-іл}-циклопропанкарбонової кислоти (42,4 мг; вихід 58,3%) у вигляді білої твердої + 1 речовини. LC/MS розр. для C25H28N4O4 (m/e) 448, фактич. (M+H, ES ). H ЯМР (DMSO-d6) δ: 12,37 (br. s., 1H), 9,43 (br. s., 1H), 7,88 (d, J = 8,0 Гц, 2H), 7,57 - 7,73 (m, 4H), 7,46 (d, J = 8,3 Гц, 2H), 4,50 (br. s., 1H), 2,21 (s, 3H), 1,71 (br. s., 1H), 1,40 - 1,57 (m, 2H), 1,00 - 1,32 (m, 5H), 0,84 (br. s., 6H). Приклад 10 1-{4'-[5-((R)-втор-Бутоксикарбоніламіно)-4-метил-[1,2,3]триазол-1-іл]-біфеніл-4-іл}циклопропанкарбонова кислота N N N O O N O O 45 50 Стадія 1: (R)-втор-Бутиловий ефір [3-(4-бромфеніл)-5-метил-3H-[1,2,3]триазол-4-іл]карбамінової кислоти У реакційній судині на 20 мл 3-(4-бромфеніл)-5-метил-3H-[1,2,3]триазол-4-карбонову кислоту 100 мг; 0,354 ммоль), (R)-бутан-2-ол (26,3 мг; 32,6 мкл; 0,354 ммоль) і триетиламін (35,8 мг; 49,3 мкл; 0,354 ммоль) об'єднували з толуолом (2,5 мл) з одержанням жовтої суспензії і до цієї суміші додавали дифенілфосфорилазид (97,4 мг; 76,3 мкл; 0,354 ммоль). Повітря в реакційній судині продували азотом, судину закривали, нагрівали на масляній бані при 80 °C протягом 4 г і охолоджували до кімнатної температури протягом ночі. Вносили додаткові реагенти: (R)-бутан2-ол (13,2 мг; 16,3 мкл; 0,177 ммоль), триетиламін (72,6 мг; 100 мкл; 0717 ммоль) і дифенілфосфорилазид (97,4 мг; 76,3 мкл; 0,354 ммоль). Повітря в реакційній судині продували азотом, судину закривали, нагрівали на масляній бані при 80 °C протягом 2 г і охолоджували до 27 UA 110310 C2 5 10 15 20 25 30 35 40 кімнатної температури. Реакційну суміш наносили на Celite і очищали флеш-хроматографією (силікагель, 0%-40% EtOAc в гексані). Потрібні фракції об'єднували, концентрували і висушували з суміші DCM / гексан, з одержанням (R)-втор-бутилового ефіру [3-(4-бромфеніл)-5метил-3H-[1,2,3]триазол-4-іл]-карбамінової кислоти (99,5 мг; вихід 79,5%) у вигляді брудно-білої + твердої речовини. LC/MS розр. для C14H17BrN4O2 (m/e) 352/354, фактич. 353/355 (M+H, ES ). Стадія 2: Метиловий ефір 1-{4'-[5-((R)-втор-бутоксикарбоніламіно)-4-метил-[1,2,3]триазол-1іл]-біфеніл-4-іл}-циклопропанкарбонової кислоти У судині на 20 мл метиловий ефір 1-[4-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-феніл]циклопропанкарбонової кислоти (92,4 мг; 0,306 ммоль), (R)-втор-бутиловий ефір [3-(4бромфеніл)-5-метил-3H-[1,2,3]триазол-4-іл]-карбамінової кислоти (90 мг; 0,255 ммоль), фосфат трикалію (162 мг; 0,764 ммоль), 2-дициклогексилфосфіно-2',6'-диметоксибіфеніл (Sphos) (31,4 мг; 0,0764 ммоль) і Pd(OAc)2 (8,6 мг; 0,0382 ммоль) об'єднували з толуолом (2 мл) і водою (0,5 мл) (через які попередньо продували азот протягом 20 хв) з одержанням світло-жовтої суспензії. Атмосферу в реакційній судині замінювали на азот, судину закривали, нагрівали на масляній бані при 100 °C протягом 4 г і охолоджували до кімнатної температури протягом ночі. Реакційну суміш розбавляли за допомогою EtOAc (8 мл), фільтрували через Celite, промивали за допомогою EtOAc (2 х 6 мл), висушували і розчиняли у мінімальній кількості DCM і очищали флеш-хроматографією (силікагель, 0%-50% EtOAc в гексані). Потрібні фракції об'єднували, концентрували і висушували з суміші DCM / гексан з одержанням метилового ефіру 1-{4'-[5-((R)втор-бутоксикарбоніламіно)-4-метил-[1,2,3]триазол-1-іл]-біфеніл-4-іл}-циклопропанкарбонової кислоти (53,6 мг; вихід 46,9%) у вигляді білої твердої речовини. LC/MS розр. для C25H28N4O4 + (m/e) 448, фактич. 449 (M+H, ES ). Стадія 3: 1-{4'-[5-((R)-втор-Бутоксикарбоніламіно)-4-метил-[1,2,3]триазол-1-іл]-біфеніл-4-іл}циклопропанкарбонова кислота У круглодонній колбі на 20 мл метиловий ефір 1-{4'-[5-((R)-втор-бутоксикарбоніламіно)-4метил-[1,2,3]триазол-1-іл]-біфеніл-4-іл}-циклопропанкарбонової кислоти (37 мг; 0,0825 ммоль) об'єднували з THF (2 мл) з одержанням жовтого розчину. До цієї суміші додавали по краплях розчин LiOH (34,6 мг; 0,825 ммоль) у воді (0,5 мл), нагрітий для часткового розчинення. Судину закривали і нагрівали на масляній бані при 60 °C протягом 6 г і охолоджували до кімнатної температури протягом ночі. Реакційну суміш розбавляли водою (35 мл) і підкисляли за допомогою 1 н HCl. Одержаний осад екстрагували в органічний шар за допомогою EtOAc (2 х 30 мл), промивали сольовим розчином (30 мл), висушували над MgSO4, фільтрували, концентрували і висушували з суміші DCM / гексан з одержанням 1-{4'-[5-((R)-вторбутоксикарбоніламіно)-4-метил-[1,2,3]триазол-1-іл]-біфеніл-4-іл}-циклопропанкарбонової кислоти (40 мг; вихід 112%) у вигляді білої твердої речовини. LC/MS розр. для C24H26N4O4 (m/e) + 1 434, фактич. 435 (M+H, ES ). H ЯМР (DMSO-d6) δ: 12,37 (br. s., 1H), 9,44 (br. s., 1H), 7,88 (d, J = 8,5 Гц, 2H), 7,56 - 7,72 (m, 4H), 7,46 (d, J = 8,3 Гц, 2H), 4,61 (br. s., 1H), 2,21 (s, 3H), 1,38 - 1,66 (m, 4H), 1,03 - 1,34 (m, 5H), 0,85 (dd, J = 10,7, 6,9 Гц, 3H). Приклад 11 1-[4'-(5-Ізопропоксикарбоніламіно-4-метил-[1,2,3]триазол-1-іл)-біфеніл-4-іл]циклопропанкарбонова кислота N N N O O N O O 45 50 Стадія 1: Ізопропіловий ефір [3-(4-бромфеніл)-5-метил-3H-[1,2,3]триазол-4-іл]-карбамінової кислоти У реакційній судині на 20 мл 3-(4-бромфеніл)-5-метил-3H-[1,2,3]триазол-4-карбонову кислоту 100 мг; 0,354 ммоль), пропан-2-ол (21,3 мг; 27,1 мкл; 0,354 ммоль) і триетиламін (35,8 мг; 49,3 мкл; 0,354 ммоль) об'єднували з толуолом (2,5 мл) з одержанням жовтої суспензії і до цієї суміші додавали дифенілфосфорилазид (97,4 мг; 76,3 мкл; 0,354 ммоль). Повітря в реакційній судині продували азотом, судину закривали, нагрівали на масляній бані при 80 °C протягом 4 г і охолоджували до кімнатної температури протягом ночі. Вносили додаткові реагенти: пропан-2ол (10,7 мг; 13,6 мкл; 0,177 ммоль), триетиламін (72,6 мг; 100 мкл; 0717 ммоль) і дифенілфосфорилазид (97,4 мг; 76,3 мкл; 0,354 ммоль). Повітря в реакційній судині продували азотом, судину закривали, нагрівали на масляній бані при 80 °C протягом 2 г і охолоджували до 28
ДивитисяДодаткова інформація
Назва патенту англійськоюCompounds n-aryl triazole as antagonists receptors lisophosphatidic acid (lpar)
Автори англійськоюGabriel, Stephen, Deems, Hamilton, Matthew Michael, Qian, Yimin, Sidduri, Achyutharao
Назва патенту російськоюСоединения n-арил триазола как антагонисты рецепторов лизофосфатидной кислоты (lpar)
Автори російськоюГебриель Стивен Димс, Гамильтон Мэтью Майкл, Цянь Иминь, Сиддури Ачютарао
МПК / Мітки
МПК: C07D 249/14, C07D 249/06, A61P 29/00, A61P 37/00, A61K 31/4196, A61K 31/4192
Мітки: n-арилтриазолу, лізофосфатидної, сполуки, антагоністи, lpar, кислоти, рецепторів
Код посилання
<a href="https://ua.patents.su/67-110310-spoluki-n-ariltriazolu-yak-antagonisti-receptoriv-lizofosfatidno-kisloti-lpar.html" target="_blank" rel="follow" title="База патентів України">Сполуки n-арилтриазолу як антагоністи рецепторів лізофосфатидної кислоти (lpar)</a>
Попередній патент: Саморегульовано-напружена балка чекановича
Наступний патент: Система для виявлення та знищення цілей
Випадковий патент: Обмежник ковзання