Сполуки заміщених діазепанів як антагоністи орексинових рецепторів
Номер патенту: 106873
Опубліковано: 27.10.2014
Автори: Коулман Пол Дж., Рокер Ентоні Дж., Бергман Джеффрі М., Бреслін Майкл Дж., Кокс Крістофер Д., Мерсер Сваті П.
Формула / Реферат
1. Сполука формули І:
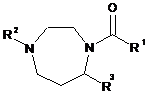 , I
, I
де:
R1 є фенілом, заміщеним R1a, R1b i R1c;
R2 є гетероарилом, заміщеним R2a, R2b і R2c;
R1a, R1b, R1c, R2a, R2b і R2c незалежно вибирають з групи, що складається з
(1) водню,
(2) галогену,
(3) гідроксилу,
(4) -(С=О)m-Оn-С1-6алкілу, де m дорівнює 0 або 1, n дорівнює 0 або 1 (де, якщо m дорівнює 0 або n дорівнює 0, то присутній зв'язок), де сусідні R2a і R2b або R2b і R2c можуть бути з'єднані разом, з утворенням циклоалкільного або циклоалкоксикільця, і де алкіл є незаміщеним або заміщений одним або декількома замісниками, вибраними з R13,
(5) -(С=О)m-Оn-С3-6циклоалкілу, де циклоалкіл є незаміщеним або заміщений одним або декількома замісниками, вибраними з R13,
(6) -(С=О)m-С2-4алкенілу, де алкеніл є незаміщеним або заміщений одним або декількома замісниками, вибраними з R13,
(7) -(С=О)m-С2-4алкінілу, де алкініл є незаміщеним або заміщений одним або декількома замісниками, вибраними з R13,
(8) -(С=О)m-Оn-фенілу або (С=О)m-Оn-нафтилу, де феніл або нафтил є незаміщеним або заміщений одним або декількома замісниками, вибраними з R13,
(9) -(С=О)m-Оn-гетероциклу, де гетероцикл є незаміщеним або заміщений одним або декількома замісниками, вибраними з R13,
(10) -(C=O)m-NR10R11, де R10 і R11 незалежно вибирають з групи, що складається з
(a) водню,
(b) С1-6алкілу, який є незаміщеним або заміщений одним або декількома замісниками, вибраними з R13,
(c) С3-6алкенілу, який є незаміщеним або заміщений одним або декількома замісниками, вибраними з R13,
(d) циклоалкілу, який є незаміщеним або заміщений одним або декількома замісниками, вибраними з R13,
(е) фенілу, який є незаміщеним або заміщений одним або декількома замісниками, вибраними з R13, і
(f) гетероциклу, який є незаміщеним або заміщений одним або декількома замісниками, вибраними з R13,
(11) -S(O)2-NR10R11,
(12) -S(O)q-R12, де q дорівнює 0, 1 або 2, і де R12 вибирають з групи визначень для R10 і R11,
(13) -СО2H,
(14) -CN,
(15) -NO2,
(16) =O і
(17) -В(ОН)2,
за умови, що щонайменше один з R2a, R2b або R2c є галогеном або С1-6алкілом, або де сусідні R2a і R2b або R2b і R2c можуть бути з'єднані разом, з утворенням циклоалкільного або циклоалкоксикільця, де алкіл, циклоалкіл або циклоалкокси є незаміщеними або заміщені одним або декількома замісниками, вибраними з R13;
R3 являє собою С1-6алкіл або С3-6циклоалкіл, які є незаміщеними або заміщені одним або декількома замісниками, вибраними з R13;
R13 вибирають з групи, що складається з
(1) галогену,
(2) гідроксилу,
(3) -(С=О)m-Оn-С1-6алкілу, де алкіл є незаміщеним або заміщений одним або декількома замісниками, вибраними з R14,
(4) -Оn-(С1-3)перфторалкілу,
(5) -(С=О)m-Оn-С3-6циклоалкілу, де циклоалкіл є незаміщеним або заміщений одним або декількома замісниками, вибраними з R14,
(6) -(С=О)m-С2-4алкенілу, де алкеніл є незаміщеним або заміщений одним або декількома замісниками, вибраними з R14,
(7) -(С=О)m-Оn-фенілу або (С=О)m-Оn-нафтилу, де феніл або нафтил є незаміщеним або заміщений одним або декількома замісниками, вибраними з R14,
(8) -(С=О)m-Оn-гетероциклу, де гетероцикл є незаміщеним або заміщений одним або декількома замісниками, вибраними з R14,
(9) -(C=O)m-NR10R11,
(10) -S(O)2-NR10R11,
(11) -S(O)q-R12,
(12) -СО2Н,
(13) -CN,
(14) =O і
(15) -NO2;
R14 вибирають з групи, що складається з
(1) гідроксилу,
(2) галогену,
(3) С1-6алкілу,
(4) -С3-6циклоалкілу,
(5) -О-С1-6алкілу,
(6) -О(С=О)-С1-6алкілу,
(7) -NH-C1-6алкілу,
(8) фенілу,
(9) гетероциклу,
(10) -СО2Н і
(11) -CN;
або її фармацевтично прийнятна сіль.
2. Сполука за п. 1 формули Iа
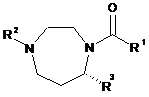 Іa
Іa
або її фармацевтично прийнятна сіль.
3. Сполука за п. 1 формули Iе
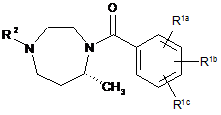 Iе
Iе
або її фармацевтично прийнятна сіль.
4. Сполука за п. 1, де R1 являє собою феніл, який є незаміщеним або заміщений одним або декількома замісниками, вибраними з
(1) галогену,
(2) гідроксилу,
(3) -Оn-С1-6алкілу, де n дорівнює 0 або 1 (де, якщо n дорівнює 0, то присутній зв'язок), і де алкіл є незаміщеним або заміщений одним або декількома замісниками, вибраними з R13,
(4) -Оn-фенілу, де феніл є незаміщеним або заміщений одним або декількома замісниками, вибраними з R13,
(5) -гетероциклу, де гетероцикл є незаміщеним або заміщений одним або декількома замісниками, вибраними з R13,
(6) -NR10R11, де R10 і R11 незалежно вибирають з групи, що складається з
(a) водню,
(b) С1-6алкілу, який є незаміщеним або заміщений одним або декількома замісниками, вибраними з R13,
(7) -S(O)2-NR10R11,
(8) -СО2Н,
(9) -CN,
(10) -NO2 і
(11) -В(ОН)2.
5. Сполука за п. 4, де R1 являє собою феніл, який є незаміщеним або заміщений одним або декількома замісниками, вибраними з метилу, -CF3, галогену, -OCF3, -OCH3, -OCH2CH3, -CO2CH3, -CN, -N(CH3), -NH(CH2CH3), -NO2, -В(ОН)2, триазолілу або фенілу.
6. Сполука за п. 5, де R1 являє собою феніл, який є незаміщеним або заміщений одним або декількома замісниками, вибраними з метилу або триазолілу.
7. Сполука за п. 1, де R2 являє собою гетероарил, який є незаміщеним або заміщений одним або декількома замісниками, вибраними з
(1) галогену,
(2) гідроксилу,
(3) -Оn-С1-6алкілу, де n дорівнює 0 або 1 (де, якщо n дорівнює 0, то присутній зв'язок), і де алкіл є незаміщеним або заміщений одним або декількома замісниками, вибраними з R13,
(4) -Оn-фенілу, де феніл є незаміщеним або заміщений одним або декількома замісниками, вибраними з R13,
(5) -гетероциклу, де гетероцикл є незаміщеним або заміщений одним або декількома замісниками, вибраними з R13,
(6) -NR10R11, де R10 і R11 незалежно вибирають з групи, що складається з
(a) водню,
(b) С1-6алкілу, який є незаміщеним або заміщений одним або декількома замісниками, вибраними з R13,
(7) -S(O)2-NR10R11,
(8) -СО2Н,
(9) -CN і
(10) -NO2,
за умови, що щонайменше один замісник є галогеном або С1-6алкілом, або де два сусідніх замісники з'єднані разом з утворенням циклоалкільного кільця.
8. Сполука за п. 7, де R2 вибирають з групи, що складається з
(1) бензімідазолілу,
(2) бензотіазолілу,
(3) бензоксазолілу,
(4) циклопентилпіримідинілу,
(5) дигідроциклопентапіримідинілу,
(6) дигідрохінолінілу,
(7) фуропіримідинілу,
(8) піразолопіримідинілу,
(9) піридинілу,
(10) піридопіримідинілу,
(11) піримідинілу,
(12) хіназолінілу,
(13) хінолінілу,
(14) хіноксалінілу,
(15) тетрагідрохіназолінілу,
(16) тіадіазолілу і
(17) тієнопіримідинілу,
які заміщені галогеном або С1-6алкілом і необов'язково заміщені гідроксильною групою, -О-С1-6алкілом, кетогрупою, -NH2 або фенілом.
9. Сполука за п. 8, де R2 вибирають з групи, що складається з
(1) 1,3-бензоксазол-2-ілу,
(2) 2-(6,7-дигідро-5Н-циклопента[d]піримідин)ілу,
(3) 2-(7,8-дигідрохінолін-5(6Н)-он)ілу,
(4) 2-(фуро[2,3]піримідин)ілу,
(5) 2-(піразоло[3,4]піримідин)ілу,
(6) 2-піридинілу,
(7) 2-(піридо[2,3-d]піримідин-7(8Н)-он)ілу,
(8) 2-піримідинілу,
(9) 2-хіназолінілу,
(10) 2-хіноксалінілу,
(11) 2-(5,6,7,8-тетрагідрохіназолін)ілу,
(12) 2-(тієно[2,3-d]піримідин)ілу і
(13) 2-(тієно[2,3]піримідин-4-амін)ілу,
які заміщені метилом, хлором або фтором.
10. Сполука за п. 1, де один з R2a, R2b або R2c є галогеном або С1-6алкілом, і інші з R2a, R2b або R2c є воднем.
11. Сполука за п. 1, де R3 являє собою С1-6алкіл, який є незаміщеним або заміщений одним або декількома замісниками, вибраними з групи, що складається з
(1) галогену,
(2) гідроксилу,
(3) -С1-6алкілу,
(4) -(С1-3)перфторалкілу,
(5) -О-(С1-3)перфторалкілу,
(6) -С3-6циклоалкілу і
(7) -С2-4алкенілу.
12. Сполука за п. 11, де R3 є С1-6алкілом.
13. Сполука за п. 11, де R3 є метилом.
14. Фармацевтична композиція, яка містить інертний носій і сполуку за п. 1 або її фармацевтично прийнятну сіль.
15. Сполука за п. 1 або її фармацевтично прийнятна сіль для застосування в медицині.
16. Застосування сполуки за п. 1 або її фармацевтично прийнятної солі для отримання лікарського засобу для лікування або профілактики порушення сну.
17. Спосіб покращення якості сну у потребуючих цього пацієнтів-ссавців, який включає введення пацієнту терапевтично ефективної кількості сполуки за п. 1 або її фармацевтично прийнятної солі.
18. Спосіб лікування безсоння у потребуючих цього пацієнтів-ссавців, який включає введення пацієнту терапевтично ефективної кількості сполуки за п. 1 або її фармацевтично прийнятної солі.
19. Спосіб лікування або контролювання ожиріння у потребуючих цього пацієнтів-ссавців, який включає введення пацієнту терапевтично ефективної кількості сполуки за п. 1 або її фармацевтично прийнятної солі.
Текст
інгібітори 11β HSD-1 (11-бета гідроксистероїддегідрогенази типу 1), такі як BVT 3498, BVT 2733; (58) амінорекс; (59) амфехлорал; (60) амфетамін; (61) бензфетамін; (62) хлорфентермін; (63) клобензорекс; (64) клофорекс; (65) кломінорекс; (66) клортермін; (67) циклекседрин; (68) декстроамфетамін; (69) дифеметоксидин, (70) N-етиламфетамін; (71) фенбутразат; (72) фенісорекс; (73) фенпропорекс; (74) флудорекс; (75) флумінорекс; (76) фурфурилметиламфетамін; (77) левамфетамін; (78) левофацетоперан; (79) мефенорекс; (80) метамфепрамон; (81) метамфетамін; (82) норпсевдоефедрин; (83) пенторекс; (84) фендиметразин; (85) фенметразин; (86) піцилорекс; (87) фітофарм 57 і (88) зонісамід. У іншому варіанті здійснення сполуки, що розглядаються, можуть застосовуватися в комбінації з антидепресивними або заспокійливими агентами, включаючи інгібітори зворотного захоплення норепінефрину (включаючи трициклічні третинні аміни і трициклічні вторинні аміни), інгібітори зворотного захоплення серотоніну (SSRI), інгібітори моноамінооксидази (МАОІ), 14 UA 106873 C2 5 10 15 20 25 30 35 40 45 50 55 60 оборотні інгібітори моноамінооксидази (RIMA), інгібітори зворотного захоплення серотоніну і норадреналіну (SNRI), антагоністи кортикотропін-рилізинг-фактора (CRF), антагоністи аадренорецепторів, антагоністи рецепторів нейрокініну-1, атипові антидепресанти, бензодіазепіни, агоністи або антагоністи 5-НТ1А, зокрема часткові агоністи 5-НТ1А, антагоністи кортикотропін-рилізинг-фактора (CRF). Специфічні агенти включають амітриптилін, кломіпрамін, доксепін, іміпрамін і триміпрамін, амоксапін, десипрамін, мапротилін, нортриптилін і протриптилін; флуоксетин, пароксетин і серталін, ізокарбоксазид, фенелзин, транілципромін і селегілін; моклобемід; венлафаксин; апрепінат; бупропіон, літій, нефазодон і вілоксазин; алпразолам, хлордіазепоксид, клоназепам, хлоразепат, діазепам, халазепам, лоразепам, оксазепам і празепам; буспірон, флесиноксан, гепірон і іпсапірон і їх фармацевтично прийнятні солі. У іншому варіанті здійснення сполуки, що розглядаються, можуть застосовуватися в комбінації з агентами проти хвороби Альцгеймера; інгібіторами бета-секретази; інгібіторами гамма-секретази; засобами, що посилюють секрецію гормону росту; рекомбінантом гормону росту; інгібіторами HMG-CoA-редуктази; NSAID, включаючи ібупрофен; вітаміном Е; антиамілоїдними антитілами; антагоністами СВ-1 рецепторів або зворотними агоністами СВ-1 рецепторів; антибіотиками, такими як доксициклін і рифампін; антагоністами рецепторів Nметил-D-аспартату (NMDA), такими як мемантин; інгібіторами холінестерази, такими як галантамін, ривастигмін, донепезил і такрин; засобами, що посилюють секрецію гормону росту, такими як ібутаморен, мезилат ібутаморену і сапроморелін; антагоністами гістаміну Н3; агоністами АМРА; інгібіторами PDE IV; зворотними агоністами GABА А або нейрональними нікотиновими антогоністами. У іншому варіанті здійснення сполуки, що розглядаються, можуть застосовуватися в комбінації з седативними засобами, снодійними засобами, анксіолітиками, нейролептиками, заспокійливими агентами, циклопіролонами, імідазопіридинами, піразолопіримідинами, малими транквілізаторами, агоністами і антагоністами мелатоніну, мелатонінергічними агентами, бензодіазепінами, барбітуратами, антагоністами 5НТ-2 і подібними, такими як: адиназолам, алобарбітал, алонимід, алпразолам, амітриптилін, амобарбітал, амоксапін, бентазепам, бензоктамін, бротизолам, бупропіон, буспріон, бутабарбітал, буталбітал, капурид, карбоклорал, хлорал бетаїн, хлорал гідрат, хлордіазепоксид, хломіпрамін, клоназепам, клоперидон, клоразепат, клоретат, клозапін, ципразепам, десипрамін, декскламол, діазепам, дихлоралфеназон, дивалпроекс, дифенгідрамін, доксепін, естазолам, етхлорвінол, етомідат, фенобам, флунітразепам, флуразепам, флувоксамін, флуоксетин, фосазепам, глутетимід, галазепам, гідроксизин, іміпрамін, літій, лоразепам, лорметазепам, мапротилін, меклоквалон, мелатонін, мефобарбітал, мепробамат, метаквалон, мідафлур, мідазолам, нефазодон, нізобамат, нітразепам, нортриптилін, оксазепам, паралдегід, пароксетин, пентобарбітал, перлапін, перфеназин, фенелзин, фенобарбітал, празепам, прометазин, пропофол, протриптилін, квазепам, реклазепам, ролетамід, секобарбітал, серталін, супроклон, темазепам, тіоридазин, траказолат, транілципромін, тразодон, триазолам, трепіпам, трицетамід, триклофос, трифлуоперазин, триметозин, триміпрамін, улдазепам, венлафаксин, залеплон, золазепам, золпідем і їх солі, і їх комбінації, і подобні, або сполуки, що розглядаються, можуть бути введені разом з використовуванимифізичними методами, наприклад зі світлолікуванням або елекростимуляцією. У іншому варіанті здійснення сполуки, що розглядаються, можуть застосовуватися в комбінації з леводопою (з або без селективного інгібітору екстрацеребральної карбоксилази, як карбідопа або бензеразид), антихолінергічними засобами, такими як біпериден (необов'язково у вигляді його гідрохлориду або лактатної солі) і гідрохлорид тригексифенідилу (бензексол), інгібіторами СОМТ, такими як ентакапон, інгібіторами МОА-В, антиоксидантами, антагоністами аденозинових рецепторів А2а, холінергічними агоністами, антагоністами рецепторів NMDA, антагоністами рецепторів серотоніну і агоністами рецепторів допаміну, такими як алентемол, бромокриптин, феолдопам, лізурид, наксаголід, перголід і праміпексол. Потрібно мати на увазі, що агоністи допаміну можуть бути в формі фармацевтично прийнятних солей, наприклад гідроброміду алентемолу, мезилату бромокриптину, мезилату фенолдопаму, гідрохлориду наксаголіду і мезилату лізуриду і праміпексолу, і звичайно використовуються в несольових формах. У іншому варіанті здійснення сполуки, що розглядаються, можуть застосовуватися в комбінації з ацетофеназином, алентемолом, бензгексолом, бромокриптином, біпериденом, хлорпромазином, хлорпротиксеном, клозапіном, діазепамом, фенолдопамом, флуфеназином, галоперидолом, леводопою з бенсеразидом, леводопою з карбідопою, лізуридом, локсапіном, месоридазином, моліндолоном, наксаголідом, оланзапіном, перголідом, перфеназином, 15 UA 106873 C2 5 10 15 20 25 30 35 40 45 50 55 60 пімозидом, праміпексолом, рисперидоном, сулпіридом, тетрабеназином, тригексифенідилом, тіоридазином, тіотиксеном або трифлуоперазином. У іншому варіанті здійснення сполуки, що розглядаються, можуть застосовуватися в комбінації із сполуками, вибраними з фенотіазину, тіоксантену, гетероциклічних бензодіазепінів, бутирофенону, дифенілбутилпіперидину і нейролептичного агента класу індолів. Відповідні приклади фенотіазинів включають хлорпромазин, мезоридазин, тіоридазин, ацетофеназин, флуфеназин, перфеназин і трифлуоперазин. Відповідні приклади тіоксантенів включають хлорпротиксен і тіотиксен. Прикладом бензодіазепіну є клозапін. Прикладом бутирофенону є галоперидол. Прикладом дифенілбутилпіперидину є пімозид. Прикладом індолу є моліндолон. Інші нейролептичні агенти включають локсапін, сулпірид і рисперидон. Потрібно мати на увазі, що нейролептичні агенти, коли використовуються в комбінації із сполуками, що розглядаються, можуть бути присутніми в формі фармацевтично прийнятних солей, наприклад гідрохлориду хлорпромазину, безилату мезоридазину, гідрохлориду тіоридазину, малеату ацетофеназину, гідрохлориду флуфеназину, енатату флурфеназину, деканоату флуфеназину, гідрохлориду тіотиксену, деканоату галоперидолу, сукцинату локсапіну і гідрохлориду моліндону. Перфеназин, хлорпротиксен, клозапін, галоперидол, пімозид і рисперидон звичайно використовуються в несольовій формі. У іншому варіанті здійснення сполуки, що розглядаються, можуть застосовуватися в комбінації з аноректичним агентом, таким як амінорекс, амфехлорал, амфетамін, бензфетамін, хлорфентермін, клобензорекс, клофорекс, кломінорекс, клортермін, циклекседрин, дексфенфлурамін, декстроамфетамін, діетилпропіон, дифеметоксидин, N-етиламфетамін, фенбутразат, фенфлурамін, фенізорекс, фенпропорекс, флудорекс, флумінорекс, фурфурилметиламфетамін, левамфетамін, левофасетоперан, мазіндол, мефенорекс, метамфепрамон, метамфетамін, норпсевдоефедрин, пенторекс, фендиметразин, фенметразин, фентермін, фенілпропаноламін, піцилорекс і сибутрамін; інгібіторами зворотного захоплення серотоніну (SSRI); галогенованими похідними амфетаміну, включаючи хлорфентермін, клофорекс, клортермін, дексфенфлурамін, фенфлурамін, піцилорекс і сибутрамін, і їх фармацевтично прийнятні солі. У іншому варіанті здійснення сполуки, що розглядаються, можуть застосовуватися в комбінації з агоністом опіатів, інгібітором ліпоксигенази, таким як інгібітор ліпоксигенази-5, інгібітором циклооксигенази, таким як інгібітор циклооксигенази-2, інгібітором інтерлейкіну, таким як інгібітор інтерлейкіну-1, антагоністом NMDA, інгібітором оксиду азоту або інгібітором синтезу оксиду азоту, нестероїдним протизапальним агентом або цитокінсупресуючим протизапальним агентом, наприклад, такими сполуками, як ацетамінофен, аспірин, кодеїн, фентаніл, ібупрофен, індометацин, кеторолак, морфін, напроксен, фенацетин, піроксикам, стероїдні анальгетики, суфентаніл, сунліндак, тенідап і подібні. Аналогічно, сполуки, що розглядаються, можуть бути введені спільно із знеболюючим засобом; потенціюючим засобом, таким як кофеїн, Н2-антагоніст, симетикон, гідроксид алюмінію або магнію; протинабряковим засобом, таким як фенілфрин, фенілпропаноламін, псевдоферин, оксиметазолін, ефенефрин, нафазолін, ксилометазолін, пропілгекседрин або ліводезоксіефедрин; протикашльовим засобом, таким як кодеїн, гідрокодон, караміфен, карбетапентан або декстраметорфан; діуретиком; і сомногенним або несомногенним антигістамінним засобом. Сполуки даного винаходу можуть бути введені оральним, парентеральним (наприклад, внутрішньом'язово, внутрішньоочеревинно, внутрішньовенно, за допомогою ICV-введення, шляхом інтрацистернальної ін'єкції або інфузії, шляхом підшкірної ін'єкції або імпланта), за допомогою інгаляційного спрею, назальним, вагінальним, ректальним, сублінгвальним або топікальним шляхами введення і можуть бути складені, як самі по собі, так і разом, у відповідну дозовану форму, що містить традиційні нетоксичні фармацевтично прийнятні носії, ад'юванти і наповнювачі для кожного способу введення. Крім лікування теплокровних тварин, таких як миші, щури, коні, худоба, вівці, собаки, кішки, мавпи і т. д., сполуки винаходу є ефективними для застосування людьми. Фармацевтичні композиції для введення сполук даного винаходу можуть бути легко представлені у вигляді дозованої форми і можуть бути одержані за допомогою добре відомих способів фармацевтики. Всі способи включають стадію змішування активного інгредієнта з носієм, який включає один або декілька допоміжних інгредієнтів. Як правило, фармацевтичні композиції одержують шляхом однорідного і тісного перемішування активного інгредієнта з рідким носієм або дрібноподрібненим твердим носієм або з обома і з подальшим, при необхідності, формуванням продукту в необхідний лікарський засіб. У фармацевтичну композицію активна сполука включається в кількості, достатній для забезпечення необхідного ефекту при хворобливих процесах або станах. Використовуваний в даному описі термін 16 UA 106873 C2 5 10 15 20 25 30 35 40 45 50 "композиція" призначений для включення продукту, що містить певні інгредієнти в певних кількостях, а також будь-який продукт, який одержують, прямо або непрямо, внаслідок комбінації інгредієнтів в певних кількостях. Фармацевтичні композиції, призначені для орального введення, можуть бути одержані згідно з будь-яким відомим способом виробництва фармацевтичних композицій, і такі композиції можуть містити один або декілька агентів, вибраних з групи, що складається з підсолоджувачів, ароматизаторів, барвників і консервантів, для забезпечення кращої фармацевтичної елегантності і надання складу приємного смаку. Таблетки містять активний інгредієнт в суміші з нетоксичними фармацевтично прийнятними ексципієнтами, які є придатними для виробництва таблеток. Наприклад, дані ексципієнти можуть бути інертними розріджувачами, такими як карбонат кальцію, карбонат натрію, лактоза, фосфат кальцію або фосфат натрію; гранулюючими і подрібнюючими агентами, такими як кукурудзяний крохмаль або альгінова кислота; зв'язувальними агентами, такими як крохмаль, желатин, камедь, і лубрикантами, такими як стеарат магнію, стеаринова кислота або тальк. Таблетки можуть бути непокритими або можуть бути покриті відомими способами для уповільненого дезінтегрування і абсорбції в шлунково-кишковому тракті, забезпечуючи, тим самим, пролонговану дію протягом більшого періоду часу. Композиції для орального введення також можуть бути представлені у вигляді твердих желатинових капсул, де активний інгредієнт змішаний з інертним твердим розріджувачем, наприклад карбонатом кальцію, фосфатом кальцію або каоліном, або у вигляді м'яких желатинових капсул, де активний інгредієнт змішаний з водою або масляним середовищем, наприклад арахісовим маслом, рідким парафіном або оливковою олією. Водні суспензії містять активні речовини в суміші з ексципієнтами, придатними для одержання водних суспензій. Масляні суспензії можуть бути одержані шляхом суспендування активного інгредієнта у відповідному маслі. Також можуть використовуватися емульсії типу вода в маслі. Дисперсні порошки і гранули, придатні для одержання водних суспензій шляхом додавання води, забезпечують активний інгредієнт в суміші з диспергуючим або зволожуючим агентом, суспендуючим агентом і одним або декількома консервантами. Фармацевтичні композиції даного винаходу можуть бути у вигляді стерильної водної або масляної суспензії для ін'єкцій. Сполуки даного винаходу також можуть бути введені у вигляді супозиторіїв для ректального введення. Для місцевого застосування можуть використовуватися креми, мазі, желе, розчини або суспензії і т. д., що містять сполуки даного винаходу. Сполуки даного винаходу також можуть бути одержані для введення за допомогою інгаляції. Сполуки даного винаходу також можуть бути одержані для введення за допомогою трансдермальних пластирів відомими в даній галузі способами. У наступних прикладах і на наступних схемах показані деякі способи одержання сполук даного винаходу. Вихідні речовини одержують згідно з відомими в даній галузі методиками або як показано в даному описі. У даному описі використовуються наступні абревіатури: Me: метил; Et: етил; t-Bu: трет-бутил; Аr: арил; Рh: феніл; Вn: бензил; Ас: ацетил; ТГФ: тетрагідрофуран; DEAD: діетилазодикарбоксилат; DIPEA: N,N-діізопропілетиламін; ДМСО: диметилсульфоксид; EDC: N-(3-диметиламінопропіл)-N'-етилкарбодіімід; НОВТ: гідроксибензотриазолгідрат; Вос: трет-бутоксикарбоніл; Et3N: триетиламін; DCM: дихлорметан; DCE: дихлоретан; BSA: бичачий сироватковий альбумін; ТФОК: трифтороцтова кислота; ДМФА: N,N-диметилформамід; МТВЕ: метилтретбутиловий ефір; SOCl2: тіонілхлорид; CDI: карбонілдіімідазол; кт: кімнатна температура; ВЕРХ: високоефективна рідинна хроматографія. Сполуки даного винаходу можуть бути одержані різними способами. У деяких випадках кінцевий продукт може бути далі модифікований, наприклад, за допомогою маніпуляції із замісниками. Такі маніпуляції можуть включати, але не обмежуються ними, реакції відновлення, окислення, алкілування, ацилування і гідролізу, які звичайно відомі фахівцеві в даній галузі. У деяких випадках для проведення вказаних вище реакцій схеми можуть бути змінені для полегшення проведення реакцій і для уникнення небажаних продуктів реакції. Наступні приклади наведені для того, щоб винахід можна було зрозуміти більш детально. Дані приклади є виключно ілюстративними і не повинні тлумачитися як такі, що обмежують винахід будь-яким чином. Схема А 17 UA 106873 C2 NH O I N N N N H O NH N N HO HO CsCO3, CuI, ДМФА мк-хв., 120оC A-1 NH O I N N N N H O NH N N HO HO CsCO3, CuI, ДМФА мк-хв., 120оC Me Me O I N N N O N H HO N N HO K3PO4 H2O, Br CuI, ДМФА, 60оC Br 5 10 15 20 A-2 A-3 2-(2Н-1,2,3-триазол-2-іл)бензойна кислота (А-1) Розчин 2-йодобензойної кислоти (3,0 г, 12,09 ммоль) в ДМФА обробляють (1,5 г, 21,7 ммоль) 1,2,3-триазолом, 7,08 г (21,7 ммоль) CsCO3, 114 мг (0,60 ммоль) CuI і 310 мг (2,17 ммоль) трансN,N'-диметилциклогексан-1,2-діаміном. Суміш нагрівають при 120 °C протягом 10 хвилин в мікрохвильовому реакторі. Реакційну суміш охолоджують до кімнатної температури, розбавляють EtOAc і фільтрують через целіт. Залишок очищають при градієнтному елююванні на SiO2 (MeOH в DCM з 0,1 % АсОН), одержуючи необхідну 2-(2Н-1,2,3-триазол-2-іл)бензойну кислоту, що швидко елююється, А-1. 1 Дані для сполуки А-1: Н-ЯМР (500 МГц, ДМСО-d6) δ 13,05 (ушир.с, 1Н), 8,12 (с, 2Н), 7,817,52 (м, 4Н) м. ч. Небажана 2-(1Н-1,2,3-триазол-2-іл)бензойна кислота елююється іншою. 2-(2Н-1,2,3-триазол-2-іл)-5-метилбензойна кислота (А-2) Розчин 2-йод-5-метилбензойної кислоти (4,0 г, 15,3 ммоль) в ДМФА (10 мл) обробляють 1,2,3-триазолом (2,1 г, 30,5 ммоль), CsCO3 (9,95 г, 30,5 ммоль), CuI (0,145 г, 0,76 ммоль) і трансN,N'-диметилциклогексан-1,2-діаміном (0,43 г, 3,05 ммоль). Суміш нагрівають при 120 °C протягом 10 хвилин в мікрохвильовому реакторі. Реакційну суміш охолоджують до кімнатної температури, розбавляють водою і промивають EtOAc. Водну фазу підкисляють 1н. НСl і екстрагують ЕtOАс. Органічний шар сушать над Na2SO4, фільтрують і концентрують. Залишок очищають при градієнтному елююванні на SiO 2 (MeOH в DCM з 0,1 % АсОН), одержуючи 2-(2Н 18 UA 106873 C2 5 10 15 1,2,3-триазол-2-іл)-5-метилбензойну кислоту, що швидко елююється, А-2 з подальшим небажаним регіоізомером, 2-(1Н-1,2,3-триазол-2-іл)-5-метилбензойною кислотою. 1 Дані для сполуки А-2: Н-ЯМР (500 МГц, ДМСО-d6) δ 12,98 (ушир.с, 1Н), 8,04 (с, 2Н), 7,727,45 (м, 3Н), 2,41 (с, 3Н) м.ч. 5-Бром-2-(2Н-1,2,3-триазол-2-іл)бензойна кислота (А-3) Розчин 5-бром-2-йодбензойної кислоти (10,0 г, 30,6 ммоль) в ДМФА обробляють (2,11 г, 30,6 ммоль) 1,2,3-триазолом 14,09 г (61,2 ммоль) K3РО4·Н2О і 583 мг (3,06 ммоль) CuI. Суміш нагрівають при 60 °C протягом 3 годин при перемішуванні в атмосфері N 2. Реакційну суміш охолоджують до кімнатної температури, розбавляють водою і підкисляють 1н. НСl. Суміш тричі розділяють в EtOAc. Органічні шари збирають, промивають насиченим розчином солі, сушать над Mg2SO4, фільтрують і концентрують. Залишок очищають колонковою хроматографією (EtOAc в гексані, 1 % АсОН буфер), одержуючи необхідну 5-бром-2-(2Н-1,2,3-триазол-2іл)бензойну кислоту, що швидко елююється, А-3. 1 Дані для сполуки А-3: Н-ЯМР (500 МГц, ДМСО-d6) δ 13,4 (ушир.с, 1Н), 8,12 (м, 2Н), 7,94-7,88 (м, 2Н), 7,78-7,73 (м, 1Н) м.ч. Небажана 5-бром-2-(1Н-1,2,3-триазол-2-іл)бензойна кислота елююється іншою. Схема В CHO н-бутанол, TsOH моногідрат F O Дін-Старк NO2 F O NO2 B-1 1.Pd-C, EtOAc F POCl3, N 2. трифосген, Et3N; потім NH3; потім HCl 25 30 35 40 N кип. зі звор. холод. N OH B-2 20 F N Cl B-3 2-(Дибутоксиметил)-4-фтор-1-нітробензол (В-1) Розчин 5-фтор-2-нітробензальдегіду (75 г, 443 ммоль), моногідрату паратолуолсульфокислоти (8,4 г, 44,3 ммоль) і н-бутанолу (122 мл, 1,33 моль) кип'ятять із зворотним холодильником в толуолі (630 мл) з використанням насадки Діна-Старка протягом 15 годин. Реакційну суміш охолоджують, концентрують і розподіляють між водою (1 л) і ЕtOАс (1л). Органічний шар промивають водою (1 л) і насиченим розчином солі (1 л), сушать над Na 2SO4 і концентрують. Неочищену реакційну суміш очищають колонковою хроматографією (ЕtOАс в гексані, 1 % буфер триетиламіну), одержуючи сполуку В-1 у вигляді масла. 1 Дані для сполуки В-1: Н-ЯМР (500 МГц, CDCl3) δ 7,92 (дд, J=8,5, 4,5 Гц, 1Н), 7,54 (дд, J=9,0, 3,0 Гц, 1H), 7,15-7,11 (м, 1Н), 6,05 (с, 1Н), 3,67-3,52 (м, 4Н), 1,63-1,57 (м, 4Н), 1,43-1,35 (м, 4Н), 0,94-0,91 (м, 6Н) м.ч.; мас-спектрометрія з низьким розрізненням (МСНР) (М+Н) m/z=169,8 знайдено, 300,3 обчислено (спостерігається втрата ацеталю). 6-Фтор-2-хлорхіназолін (В-3) До розчину сполуки В-1 (26,1 г, 87 ммоль) в ЕtOАс (350 мл) в атмосфері азоту при 25 °C додають Pd-C (10 % мас., 2,3 г) і реакційну суміш вміщують в атмосферу водню (1 атм). Реакційну суміш перемішують протягом 12 годин, фільтрують через целіт і концентрують. Залишок знову розчиняють в ТТФ (350 мл) і охолоджують до 0 °C. До одержаного розчину додають триетиламін (45,0 мл, 323 ммоль) і по краплях трифосген (8,6 г, 29,1 ммоль) в ТГФ (60 мл). Реакційну суміш перемішують 10 хвилин і додають аміак в метанолі (46,1 мл, 323 ммоль, 7М розчин). Реакційну суміш перемішують при 0 °C протягом 10 хвилин і швидко нагрівають до кімнатної температури. Через 15 хвилин, при кімнатній температурі реакційну суміш 19 UA 106873 C2 5 10 15 підкисляють 4М НСl в діоксані (120 мл) до рН 2. Реакційну суміш перемішують при кімнатній температурі протягом 1 години і відразу концентрують. Залишок піддають азеотропній перегонці з толуолом і метанолом, одержуючи сполуку В-2 у вигляді жовтого твердого залишку. Дані для сполуки В-2: мас-спектрометрія з низьким розрізненням (М+Н) m/z=164,9 знайдено; 165,1 обчислено. Твердий жовтий залишок розчиняють в чистому оксихлориді фосфору (130 мл) і кип'ятять із зворотним холодильником (120 °C) протягом 1 години. Реакційну суміш охолоджують і надлишок розчинника видаляють у вакуумі. Неочищену реакційну суміш змішують з EtOAc (600 мл) і повільно гасять водою (500 мл) при 0 °C. Водну фазу екстрагують EtOAc (2 × 200 мл), об'єднані органічні фази сушать над Mg2SO4 і концентрують. Неочищену реакційну суміш очищають колонковою хроматографією (ЕtOАс/дихлорметан), одержуючи сполуку В-3 у вигляді не зовсім білої твердої речовини. 1 Дані для сполуки В-3: Н-ЯМР (500 МГц, CDCl3) δ 9,29 (с, 1H), 8,04 (дд, J=9,0, 5,0 Гц, 1Н), 7,77-7,72 (м, 1H), 7,59 (дд, J=7,5, 2,5 Гц, 1H) м.ч.; мас-спектрометрія з низьким розрізненням (М+Н) m/z=183,2 знайдено, 183,0 обчислено. Схема С Me Me S NH2 K S O Me Et N SH EtOH OH Cl DCM O O C-2 C-1 20 25 30 N POCl3, PCL5 4-Метил-1,3-бензоксазол-2-тіол (С-1) Розчин 2-аміно-м-крезолу (4,0 г, 32,5 ммоль) і етилксантату калію (10,4 г, 65,0 ммоль) в 30 мл EtOH кип'ятять із зворотним холодильником протягом 3 годин. Розчинник видаляють на роторному випарнику, залишок розчиняють приблизно в 50 мл води і додають оцтову кислоту до рН~5. Утворену в результаті тверду речовину відділяють фільтруванням і сушать у вакуумі, одержуючи сполуку С-1 у вигляді білої твердої речовини. Дані для сполуки С-1: РХ-МС: час утримання=1,67 хвилини; m/z (M+H)=166,0 знайдено; 166,0 обчислено. 4-Метил-2-хлор-1,3-бензоксазол (С-2) До суспензії сполуки С-1 (1,6 г, 9,7 ммоль) в РОСl3 (4,5 мл, 48,4 ммоль) додають РСl5 (2,2 г, 10,6 ммоль) і приблизно 10 мл СН2Сl2. Після перемішування протягом ночі розчинники видаляють випарюванням на роторному випарнику, залишок розподіляють між СН 2Сl2 і 5 % водної Na2CO3. Після розділення шарів органічний шар промивають водою, сушать над Na 2SO4 і концентрують. Залишок очищають хроматографією на силікагелі (ЕtOАс/гексан), одержуючи сполуку С-2 у вигляді білої твердої речовини. Дані для сполуки С-2: РХ-МС: час утримання=2,28 хвилини; m/z (М+Н)=168,0 знайдено; 168,0 обчислено. Схема D Cl N SH O POCl3, PCL5 Cl N Cl DCM O D-1 35 40 45 2,5-Дихлор-1,3-бензоксазол (D-1) До суспензії 2-меркапто-5-хлоробензоксозолу (5,0 г, 26,9 ммоль) в РОСl3 (12,6 мл, 135 ммоль) додають РСl5 (6,2 г, 129,6 ммоль) і приблизно 20 мл СН2Сl2. Після перемішування протягом 5 днів розчинники видаляють випарюванням на роторному випарнику, залишок розподіляють між ЕtOАс і насиченим водним NaHCO 3. Після розділення шарів органічний шар промивають насиченим розчином солі, сушать над Na2SO4 і концентрують. Залишок розчиняють в мінімальній кількості СНСl3, додають гексан і невелику кількість твердої речовини відфільтровують. Фільтрат концентрують, одержуючи сполуку D-1 у вигляді білої твердої речовини. Дані для сполуки D-1: РХ-МС: час утримання=2,38 хвилини; m/z (М+Н)=188,0 знайдено; 188,0 обчислено. Схема Е 20 UA 106873 C2 O O Me + Et2O NHBoc H2 N 1.HCl(газ),EtOAc Me потім CBz-Cl, TEA NHBoc N O 2.Na(OAc)3BH, HOAc, DCM O E-1 O NH N O Boc2O, TEA Me O O DCM N N O O Me E-2 E-3 Chiralpak AD O O O O N N + O N N O Me Me E-4 5 10 15 20 25 30 O O E-5 Метилкетон (Е-1) Розчин Вос-етилендіаміну (20,0 г, 125 ммоль) в 250 мл Et 2O по краплях обробляють 10,2 мл (125 ммоль) метилвінілкетону і залишають перемішуватися протягом 24 годин. Потім реакційну суміш охолоджують до 0 °C і додають 22,6 мл (162 ммоль) триетиламіну, з подальшим додаванням 19,6 мл (137 ммоль) бензилхлорформіату. Реакційну суміш залишають повільно нагріватися до кімнатної температури при перемішуванні протягом ночі. Реакційну суміш розбавляють ЕtOАс, промивають водним 10 % розчином лимонної кислоти, потім насиченим NaHCO3 і потім насиченим розчином солі. Органічну фазу сушать над Na 2SO4, фільтрують і концентрують, одержуючи сполуку Е-1 у вигляді блідо-жовтого масла. Дані для сполуки Е-1: РХМС: час утримання=2,22 хвилини; m/z (М+Н)=265,2 знайдено; 365,2 обчислено (спостерігається втрата Вос-групи). Бензил-5-метил-1,4-діазепан-1-карбоксилат (Е-2) Розчин 39,0 г (107 ммоль) сполуки Е-1 в 300 мл EtAc насичують НСl (газ), колбу закривають і перемішують протягом 2 годин. Розчинники видаляють на роторному випарнику, залишок розчиняють в 1М НСl, промивають Et2O, підлуговують NaOH і екстрагують тричі 2:1 СНСl3/ЕtOН. Об'єднані органічні фази промивають насиченим розчином солі, концентрують, розчиняють в СН2Сl2 і фільтрують, одержуючи 19,2 г коричневого масла. Одержану речовину розчиняють в 200 мл СН2Сl2 і до неї додають 5 мл НОАс. Після перемішування протягом 2 годин додають 23,1 г (109 ммоль) Na(OAc)3BH і одержану суміш перемішують протягом 48 годин при кімнатній температурі. Деяку кількість розчинника видаляють на роторному випарнику і залишок переносять в ділильну лійку, що містить насичений розчин NaHCO 3 і 2:1 CHCl3/EtOH. Шари розділяють і водний шар ще двічі екстрагують СНСl3/ЕtOН. Об'єднані органічні шари промивають мінімальною кількістю насиченого розчину солі, концентрують, розчиняють в СН2Сl2, фільтрують і концентрують, одержуючи сполуку Е-2 у вигляді коричневого масла. Дані для сполуки Е-2: РХ-МС: час утримання=1,12 хвилини; m/z (М+Н)=249,1 знайдено; 249,2. 1-Бензил-4-трет-бутил-5-метил-1,4-діазепан-1,4-дикарбоксилат (Е-3) До розчину 23,8 г (96 ммоль) сполуки Е-2 в 200 мл СН2Сl2 додають 26,7 мл (192 ммоль) триетиламіну і 25,1 г (115 ммоль) дитрет-бутилдикарбонату. Після перемішування протягом ночі при кімнатній температурі реакційну суміш розбавляють СН2Сl2 і переносять в ділильну лійку, 21 UA 106873 C2 5 10 15 промивають насиченим розчином NaHCO3, сушать над Na2SO4 і концентрують. Залишок очищають хроматографією на силікагелі (EtOAc/гексан), одержуючи сполуку Е-3 у вигляді безбарвного масла. Дані для сполуки Е-3: РХ-МС: час утримання=2,64 хвилини; m/z (М+Н)=249,2 знайдено; 349,4 обчислено (спостерігається втрата Вос-групи). 1-Бензил-4-трет-бутил-(5R)-5-метил-1,4-діазепан-1,4-дикарбоксилат (Е-4) і 1-бензил-4-третбутил-(5S)-5-метил-1,4-діазепан-1,4-дикарбоксилат (Е-5) Енантіомери сполуки Е-3 препаративно розділяють на колонці 1050 см Chiralpak AD при ізократичному елююванні 60 % EtOH і 40 % гексанами (що містять 0,1 % діетиламіну) при швидкості потоку 175 мл/хвилину. В даних умовах за один прохід може бути розділено близько 6 г сполуки Е-3. Аналітичний аналіз проводять на колонці 0,4625 см Chiralpak AD з 60 % EtOH і 40 % гексанами (що містять 0,1 % діетиламіну) при швидкості потоку 1 мл/хвилину. Перший енантіомер (Е-4), що елююється, який вважався (R)-енантіомером, є бажаним ізомером і має час утримання 4,12 хвилин. Він являє собою безбарвну смолу >98 % е.н. Другий енантіомер (Е5), що елююється, який вважався (S)-енантіомером, є другорядним ізомером і має час утримання 4,82 хвилини. Він являє собою безбарвну смолу ~90 % е.н. Схема F O O HCl(газ), EtOAc N N O O N O HO NH Me Me F-1 E-4 O N N A-1 EDC, HOAt, NMM ДМФА N O Pd(OH)2, H2 N N N N O O O N O EtOAc N N N HN Me N Me F-2 F F-3 N N B-3 TEA, ДМФА O N Cl F N N N N N N Me F-4 20 25 30 Бензил-(5R)-5-метил-1,4-діазепан-1-карбоксилат (F-1) Розчин 15 г (43,0 ммоль) сполуки Е-4 в 350 мл EtOAc насичують НСl (газ), колбу закривають і перемішують протягом 15 хвилин. Розчин знову насичують НСl (газ), колбу закривають і перемішують протягом 30 хвилин, потім леткі речовини видаляють на роторному випарнику, одержуючи 13,0 г гідрохлоридної солі сполуки F-1 у вигляді безбарвної смоли. Дані для сполуки F-1: PX-MC: час утримання=1,10 хвилини; m/z (М+Н)=249,2 знайдено; 249,3 обчислено. Бензил-(5R)-5-метил-4-[2-(2Н-1,2,3-триазол-2-іл)бензоїл]-1,4-діазепан-1-карбоксилат (F-2) До розчину 12,0 г (42,3 ммоль) гідрохлоридної солі сполуки F-1, 8,8 г (46,6 ммоль) сполуки А1, 6,92 г (50,8 ммоль) 1-гідроксі-7-азабензотриазолу і 18,6 мл (169 ммоль) N-метилморфоліну в 200 мл ДМФА додають 12,2 г (63,5 ммоль) EDC і реакційну суміш перемішують протягом ночі при кімнатній температурі. Реакційну суміш розподіляють між EtOAc і 10 % водним KHSO4, промивають водою, насиченим розчином NaHCO3, водою, насиченим розчином солі, сушать над MgSO4 і концентрують на роторному випарнику. Попередні кислі і основні шари екстрагують з використанням EtOAc. Органічні екстракти промивають насиченим розчином солі, сушать, концентрують і об'єднують з одержаним вище органічним залишком. Весь залишок очищають хроматографією на силікагелі (ЕtOАс/гексан), одержуючи сполуку F-2 у вигляді безбарвного 22 UA 106873 C2 5 10 15 20 масла. Дані для сполуки F-2: PX-МС: час утримання=2,25 хвилини; m/z (М+Н)=420,3 знайдено; 420,5 обчислено. (7R)-7-метил-1-[2-(2Н-1,2,3-триазол-2-іл)бензоїл]-1,4-діазепан (F-3) Круглодонну колбу, що містить розчин 12,2 г (29,0 ммоль) сполуки F-2 в 250 мл EtOAc, відкачують при зниженому тиску і три рази продувають N2. Потім в колбу додають 20,4 г 20 % Pd(OH)2 на вуглеці. Колбу знову відкачують при зниженому тиску, три рази продувають N 2 і потім три рази Н2. Реакційну суміш перемішують в атмосфері Н2 протягом ночі, потім фільтрують через пухкий шар целіту, промивають EtOAc і потім МеОН. Фільтрат концентрують, одержуючи сполуку F-3 у вигляді безбарвної твердої речовини. Дані для сполуки F-3: PX-MC: час утримання=0,81 хвилини і 1,01 хвилини (в даних умовах спостерігається два конформери); m/z (M+H)=286,2 знайдено; 286,3 обчислено. 2-{(5R)-5-метил-4-[2-(2Н-1,2,3-триазол-2-іл)бензоїл]-1,4-діазепан-1-іл}-6-фторхіназалін (F-4) До 3,0 г (10,5 ммоль) сполуки F-3 в 50 мл ДМФА додають 4,40 мл (31,5 ммоль) триетиламіну і 1,92 г (10,5 ммоль) сполуки В-3 і суміш нагрівають на масляній бані при 75 °C протягом 4 годин, температуру бані знижують до 50 °C і реакційну суміш перемішують протягом ночі при даній температурі. Після охолоджування до кімнатної температури реакційну суміш розбавляють EtOAc, промивають насиченим водним розчином NaHCO 3, водою, насиченим розчином солі і сушать над MgSO4. Після концентрування на роторному випарнику залишок очищають колонковою флеш-хроматографією (гексан/ЕtOАс), одержуючи сполуку F-4 у вигляді жовтої твердої речовини. Дані для сполуки F-4: РХ-МС: час утримання=1,88 хвилини і 1,95 хвилини (в даних умовах спостерігається два конформери); m/z (M+H)=432,1949 знайдено; 432,1943 обчислено. Схема G O O N HO NH N N N O O O Me N N N N Me F-1 N O A-2 Me EDC, HOAt, TEA ДМФА O Pd(OH)2, H2 EtOAc HN Cl N N N N Cl Cl O N Me G-1 D-1 O N N N N N N O Me Me G-2 TEA, ДМФА G-3 Me Me 25 30 35 40 Бензил-(5R)-5-метил-4-[5-метил-2-(2Н-1,2,3-триазол-2-іл)бензоїл]-1,3-діазепан-1карбоксилат (G-1) До розчину 22,3 г (78 ммоль) гідрохлоридної солі сполуки F-1, 15,9 г (78 ммоль) сполуки А-2, 12,8 г (94 ммоль) 1-гідроксі-7-азабензотриазолу і 43,1 мл (392 ммоль) N-метилморфоліну в 300 мл ДМФА додають 22,5 г (118 ммоль) EDC і реакційну суміш перемішують протягом ночі при кімнатній температурі. Реакційну суміш розподіляють між EtOAc і насиченим водним розчином NaHCO3, промивають водою, насиченим розчином солі, сушать над MgSO 4 і концентрують на роторному випарнику. Залишок очищають колонковою хроматографією на силікагелі (ЕtOАс/гексан), одержуючи сполуку G-1 у вигляді безбарвної смоли. Дані для сполуки G-1: РХМС: час утримання=2,22 хвилини; m/z (M+H)=434,2 знайдено; 434,2 обчислено. (7R)-7-метил-1-[5-метил-2-(2Н-1,2,3-триазол-2-іл)бензоїл]-1,4-діазепан (G-2) Круглодонну колбу, що містить розчин 29,6 г (68,3 ммоль) сполуки G-1 і 200 мл МеОН, відкачують при зниженому тиску і три рази продувають N2. Потім в колбу додають 2,4 г 20 % Pd(OH)2 на вуглеці. Колбу знову відкачують при зниженому тиску, три рази продувають N 2 і потім три рази Н2. Реакційну суміш перемішують в атмосфері Н2 протягом трьох днів, потім 23 UA 106873 C2 5 10 15 фільтрують через пухкий шар целіту, промивають ЕtOАс і потім МеОН. Фільтрат концентрують, одержуючи сполуку G-2 у вигляді білої піни. Дані для сполуки G-2: РХ-МС: час утримання=0,96 хвилини і 1,13 хвилини (в даних умовах спостерігається два конформери); m/z (M+H)=300,0 знайдено; 300,2 обчислено. 5-Хлор-2-{(5R)-5-метил-4-[5-метил-2-(2Н-1,2,3-триазол-2-іл)бензоїл]-1,4-діазепан-1-іл}-1,3бензоксазол (G-3) До 21,0 г (70,1 ммоль) сполуки G-2 в 250 мл ДМФА додають 29,3 мл (210 ммоль) триетиламіну і 13,2 г (70,1 ммоль) сполуки D-1 і суміш нагрівають на масляній бані при 75 °C протягом 2 годин. Після охолоджування бані до кімнатної температури реакційну суміш розбавляють EtOAc, промивають насиченим водним розчином NaHCO 3, водою, насиченим розчином солі і сушать над MgSO4. Після концентрування на роторному випарнику залишок очищають колонковою флеш-хроматографією (гексан/ЕtOАс), одержуючи смолу. Смолу перемішують в суміші 250 мл ЕtOАс і 300 мл гексану протягом ночі. Після фільтрування одержують сполуку G-3 у вигляді білої твердої речовини. Дані для сполуки G-3: РХ-МС: час утримання=2,29 хвилини; m/z (M+H)=451,1 знайдено; 451,2 обчислено; мас-спектрометрія високого розрізнення (хімічна іонізація при атмосферному тиску) [МСВР (АРСІ)] m/z (M+H)=451,1631 знайдено; 451,1644 обчислено. Схема Н N O N N HO O NH N O A-3 Br Me Me EDC, HOAt, NMM ДМФА F-1 O O CO, Pd(OAc)2, DPPP, N N N N TEA, ДМСО, MeOH Pd(OH)2, H2 EtOAc, MeOH Me H-2 H3CO2C O N N N Cl N Me H3CO2C N N N N N O ТЕА, ДМФА Me Cl O N NaOH, ТГФ, MeOH, H2O O N O D-1 H-3 Cl Cl N H-1 Br N O HN N N N N O N O O H-4 N N H3CO2C N N N O Me H-5 20 25 HO2C Бензил-(5R)-4-[5-бром-2-(2Н-1,2,3-триазол-2-іл)бензоїл]-5-метил-1,4-діазепан-1-карбоксилат (Н-1) До розчину 2,5 г (8,8 ммоль) гідрохлоридної солі сполуки F-1, 2,35 г (8,8 ммоль) сполуки А-3, 1,43 г (10,5 ммоль) 1-гідроксі-7-азабензотриазолу і 4,83 мл (43,9 ммоль) N-метилморфоліну в 35 мл ДМФА додають 2,52 г (13,2 ммоль) EDC і реакційну суміш перемішують протягом ночі при кімнатній температурі. Реакційну суміш розподіляють між ЕtOАс і насиченим водним розчином NaHCO3, промивають водою, насиченим розчином солі, сушать над MgSO 4 і концентрують на роторному випарнику. Залишок очищають колонковою хроматографією на силікагелі (EtOAc/гексан), одержуючи сполуку Н-1 у вигляді білої твердої речовини. Дані для сполуки Н-1: 24 UA 106873 C2 5 10 15 20 25 30 35 40 45 РХ-МС: час утримання=2,28 хвилини і 2,34 хвилини (в даних умовах спостерігається два конформери); m/z (M+H)=498,1 знайдено; 498,1 обчислено. Бензил-(5R)-4-[5-(метоксикарбоніл)-2-(2Н-1,2,3-триазол-2-іл)бензоїл]-5-метил-1,4-діазепан-1карбоксилат (Н-2) Через розчин 2,63 г (5,3 ммоль) сполуки Н-1, 118 мг (0,53 ммоль) ацетату паладію(II), 218 мг (0,53 ммоль) 1,3-біс(дифенілфосфіно)пропану і 2,21 мл (15,8 ммоль) триетиламіну в 20 мл метанолу і 10 мл ДМСО при 80 °C протягом 10 хвилин барботують монооксид вуглецю. Потім реакційну суміш підключають до балона з монооксидом вуглецю і перемішують протягом ночі при 80 °C. Реакційну суміш розподіляють між ЕtOАс і насиченим водним розчином NаНСО 3, промивають водою, насиченим розчином солі, сушать над MgSO 4 і концентрують на роторному випарнику. Залишок очищають колонковою хроматографією на силікагелі (EtOAc/гексан), одержуючи сполуку Н-2 у вигляді безбарвної смоли. Дані для сполуки Н-2: РХ-МС: час утримання=2,10 хвилини і 2,36 хвилини (в даних умовах спостерігається два конформери); m/z (M+H)=478,1 знайдено; 478,2 обчислено. Метил-3-{(7R)-[7-метил-1,4-діазепан-1-іл]карбоніл}-4-(2Н-1,2,3-триазол-2-іл)бензоат (Н-3) Круглодонну колбу, що містить розчин 750 мг (1,57 ммоль) сполуки Н-2 в 100 мл ЕtOАс і 20 мл МеОН, відкачують при зниженому тиску і три рази продувають N 2. Потім в колбу додають 1,1 г 20 % Pd(OH)2 на вуглеці. Колбу знову відкачують при зниженому тиску, три рази продувають N2 і потім три рази Н2. Реакційну суміш перемішують в атмосфері Н2 протягом 24 годин, потім фільтрують через пухкий шар целіту, промивають ЕtOАс і потім МеОН. Фільтрат концентрують, одержуючи сполуку Н-3 у вигляді безбарвної смоли. Дані для сполуки Н-3: РХ-МС: час утримання=1,01 хвилини і 1,13 хвилини (в даних умовах спостерігається два конформери); m/z (M+H)=344,1 знайдено; 344,2 обчислено. Метил-3-{[(7R)-4-(5-хлор-1,3-бензоксазол-2-іл)]-[7-метил-1,4-діазепан-1-іл]карбоніл}-4-(2Н1,2,3-триазол-2-іл)бензоат (Н-4) До 540 мг (1,57 ммоль) сполуки Н-3 в 10 мл ДМФА додають 0,22 мл (1,57 ммоль) триетиламіну і 310 мг (1,65 ммоль) сполуки D-1 і суміш нагрівають на алюмінієвому термоблоці при 50 °C протягом ночі. Після охолоджування до кімнатної температури реакційну суміш розбавляють ЕtOАс, промивають насиченим водним розчином NaHCO 3, водою, насиченим розчином солі і сушать над MgSO4. Після концентрування на роторному випарнику залишок очищають колонковою флеш-хроматографією (гексан/ЕtOАс), одержуючи сполуку Н-4 у вигляді білої твердої речовини. Дані для сполуки Н-4: РХ-МС: час утримання=2,24 хвилини; m/z (M+H)=495,1 знайдено; 495,2 обчислено; мас-спектрометрія високого розрізнення (хімічна іонізація при атмосферному тиску) m/z (M+H)=495,1561 знайдено; 495,1542 обчислено. 3-{[(7R)-4-(5-хлор-1,3-бензоксазол-2-іл)-7-метил-1,4-діазепан-1-іл]карбоніл}-4-(2Н-1,2,3триазол-2-іл)бензойна кислота (Н-4) До розчину 120 мг (0,25 ммоль) сполуки H-4 в МеОН/ТГФ/H2О, кожного з яких по 20 мл, додають 1,94 мл (1,94 ммоль) 1М водного розчину гідроксиду натрію і суміш перемішують протягом ночі при кімнатній температурі. Для видалення органічних розчинників реакційну суміш концентрують, потім розбавляють ЕtOАс, тричі промивають 1М NaOH. Водні шари підкисляють 1М НСl, тричі промивають ЕtOАс, органічні шари об'єднують, промивають водою, насиченим розчином солі і сушать над MgSO4. Після концентрування на роторному випарнику залишок суспендують в суміші Еt2О/гексан і концентрують, одержуючи сполуку Н-5 у вигляді білої твердої речовини. Дані для сполуки Н-5: РХ-МС: час утримання=1,94 хвилини; m/z (M+H)=481,1 знайдено; 481,1 обчислено; мас-спектрометрія високого розрізнення (хімічна іонізація при атмосферному тиску) m/z (M+H)=481,1409 знайдено; 481,1386 обчислено. Схема І Cl O N Cl N N LAH N N ТГФ O N 50 N N N O Me Me H-4 O N N І-1 H3CO2C OH [3-{[(7R)-4-(5-хлор-1,3-бензоксазол-2-іл)-7-метил-1,4-діазепан-1-іл]карбоніл}-4-(2Н-1,2,3триазол-2-іл)феніл]метанол (I-1) 25 N UA 106873 C2 5 10 До 400 мг (0,81 ммоль) сполуки Н-4 в 10 мл ДМФА додають 0,70 мл (1,62 ммоль) 2,3М розчину літійалюмогідриду в ТГФ і суміш перемішують протягом 30 хвилин при кімнатній температурі. Реакційну суміш гасять водою, потім розбавляють ЕtOАс, промивають 1М НСl, водою, насиченим розчином солі і сушать над MgSO 4. Після концентрування на роторному випарнику залишок очищають колонковою флеш-хроматографією (гексан/ЕtOАс), концентрують, суспендують в Et2O/гексан і знову концентрують, одержуючи сполуку I-1 у вигляді білої твердої речовини. Дані для сполуки I-1: РХ-МС: час утримання=1,86 хвилини; m/z (M+H)=467,l знайдено; 467,1 обчислено; мас-спектрометрія високого розрізнення (хімічна іонізація при атмосферному тиску) m/z (M+H)=467,1623 знайдено; 467,1593 обчислено. Схема J F NH2 F F NH2 N F N 1. гліоксилова к-та, EtOH 2. POCl3 Cl J-1 O N N N N N HN O F N Me F-3 20 25 30 35 40 N N N N F Me J-2 ТЕА, ДМФА 15 N 2-Хлор-6,7-дифторхіноксалін (J-1) Розчин 4,5-дифтор-1,2-фенілендіаміну (3 г, 20,82 ммоль) в ЕtOН (100 мл) обробляють гліокисловою кислотою (2,34 мл, 21,02 ммоль, 50 % мас. у воді) і нагрівають при кип'ятінні протягом 3 годин. Суміш охолоджують до 0 °C і тверду речовину відділяють фільтруванням. Одержану речовину розбавляють РОСl3 (29,1 мл, 312 ммоль) і перемішують при кип'ятінні із зворотним холодильником протягом 1 години. Холодильник видаляють і через суміш продувають N2, що приводить до концентрування. Залишок розбавляють DCM, охолоджують до 0 °C і повільно додають 5 % водний розчин NaHCO 3. Суміш виливають в ділильну лійку і розділяють шари. Органічну фазу промивають 5 % водним розчином NНСО 3, сушать над Na2SO4, фільтрують і концентрують. Неочищену речовину розчиняють в СНСl 3, обробляють 12 г силікагелю і концентрують до дрібного порошку. Порошок завантажують на силікагель і очищають при ізократичному елююванні (10 % ЕtOАс в DCM), одержуючи сполуку J-1 у вигляді не зовсім білої твердої речовини. 1 Дані для сполуки J-1: Н-ЯМР (500 МГц, CDCl3) δ 8,8 (с, 1Н), 7,9 (м, 1H), 7,8 (м, 1Н) м.ч. 6,7-Дифтор-2-{(5R)-5-метил-4-[2-(2Н-1,2,3-триазол-2-іл)бензоїл]-1,4-діазепан-1-іл}хіноксалін (J-2) До 711 мг (2,5 ммоль) сполуки F-3 в 10 мл ДМФА додають 1,04 мл (7,5 ммоль) триетиламіну і 500 мг (2,5 ммоль) сполуки J-1 і суміш нагрівають на алюмінієвому термоблоці при 75 °C протягом 5 годин. Після охолоджування до кімнатної температури реакційну суміш розбавляють EtOAc, промивають насиченим водним розчином NaHCO3, водою, насиченим розчином солі і сушать над MgSO4. Після концентрування на роторному випарнику залишок очищають колонковою флеш-хроматографією (гексан/EtOAc), концентрують, суспендують в суміші Et2O/гексан і знову концентрують, одержуючи сполуку J-2 у вигляді жовтої твердої речовини. Дані для сполуки J-2: РХ-МС: час утримання=2,20 хвилини; m/z (М+Н)=450,0 знайдено; 450,2 обчислено; мас-спектрометрія високого розрізнення (хімічна іонізація при атмосферному тиску) m/z (M+H)=450,1862 знайдено; 450,1848 обчислено. Схема K 26 UA 106873 C2 N O HN CN 1. Дифосген, ацетонітрил l Me NH2 S 2. Цинк, NH4OH EtOH N N N Me Me Me N S F-3 Cl N O N N Me K-1 5 10 15 20 25 N N N S ТЕА, ДМФА N K-2 5-Метил-2-хлортієно[2,3-d]піримідин (K-1) До 1,5 г (10,9 ммоль) 2-аміно-4-метилтіофен-3-карбонітрилу в ацетонітрилі (9 мл) додають 2,0 мл (16,3 ммоль) дифосгену і суміш нагрівають в закритій трубці при 100 °C протягом 15 годин. Після охолоджування до кімнатної температури реакційну суміш повільно виливають у воду і розподіляють між водою і EtOAc. Органічну фазу промивають насиченим розчином NH 4Cl, сушать над MgSO4 і концертують. Одержану жовту тверду речовину розчиняють в етанолі (30 мл), до одержаної суспензії додають 2,4 г (36,1 ммоль) цинкового пилу і 3,1 мл (22,6 ммоль) гідроксиду амонію і реакційну суміш нагрівають при 78 °C протягом 1 години. Після охолоджування реакційної суміші до кімнатної температури суміш фільтрують через целіт, розподіляють між EtOAc і водою і екстрагують EtOAc (2×100 мл). Органічну фазу сушать над MgSO4, концентрують і залишок очищають колонковою флеш-хроматографією (ЕtOАс/гексан), одержуючи сполуку K-1 у вигляді не зовсім білої твердої речовини. Дані для сполуки K-1: РХМС: час утримання=2,03 хвилини; m/z (M+H)=185,1 знайдено; 185,0 обчислено. 5-Метил-2-{(5R)-5-метил-4-[2-(2Н-1,2,3-триазол-2-іл)бензоїл]-1,4-діазепан-1-іл}тієно[2,3d]піримідин (K-2) До 27 мг (0,15 ммоль) 5-метил-2-хлортієно[2,3-d]піримідину і 42 мг (0,15 ммоль) сполуки F-3 в ДМФА (1,0 мл) додають 0,1 мл (0,73 ммоль) триетиламіну і суміш нагрівають при 90 °C протягом 15 годин. Після охолоджування до кімнатної температури реакційну суміш виливають у воду і розподіляють між водою і ЕtOАс. Органічну фазу промивають насиченим розчином NH4Cl, сушать над MgSO4 і концертують. Залишок очищають колонковою флешхроматографією (ЕtOАс/гексан), одержуючи сполуку K-2 у вигляді не зовсім білої пінистої твердої речовини. Дані для сполуки K-2: РХ-МС: час утримання=2,68 хвилини; m/z (М+Н)=434,1 знайдено; 434,2 обчислено; мас-спектрометрія високого розрізнення m/z (M+H)=434,1769 знайдено; 434,1764 обчислено. Схема L Cl O O N Сечовина, NaOMe цинк, NH4OH O EtOH N EtOH Cl L-1 O HN Cl N N N N O N Me N N F-3 N Cl N N N N N Me ТЕА, ДМФА L-3 L-2 30 2,4-Дихлор-5,6,7,8-тетрагідрохіназолін (L-1) До 10,0 г (58,8 ммоль) етил-2-оксоциклогексанкарбоксилату в етанолі (200 мл) додають 19,4 мл (118 ммоль) метоксиду натрію і 4,6 г (76 ммоль) сечовини і суміш нагрівають при 80 °C протягом 15 годин. Після охолоджування до кімнатної температури білу тверду речовину 27 N UA 106873 C2 5 10 15 20 відфільтровують і декілька разів промивають холодним діетиловим ефіром. Після сушіння у високому вакуумі білу тверду речовину розчиняють в чистому оксихлориді фосфору (77 мл) і нагрівають при 120 °C протягом 1 години. Реакційну суміш охолоджують до кімнатної температури і надлишок оксихлориду фосфору видаляють випарюванням на роторному випарнику. Залишок розподіляють між ЕtOАс (400 мл) і водою (200 мл) і органічну фазу послідовно промивають насиченим розчином NaHCO 3 (200 мл) і насиченим розчином солі (200 мл). Органічну фазу сушать над MgSO4 і концентрують. Залишок очищають колонковою флешхроматографією (ЕtOАс/гексан), одержуючи сполуку L-1 у вигляді злегка жовтої твердої речовини. Дані для сполуки L-1: РХ-МС: час утримання=2,49 хвилини; m/z (М+Н)=203,1 знайдено; 203,0 обчислено. 2-Хлор-5,6,7,8-тетрагідрохіназолін (L-2) 4,7 г (23,1 ммоль) сполуки L-1 дехлорують, аналогічно описаному для сполуки K-1, одержуючи сполуку L-2 у вигляді білої твердої речовини. Дані для сполуки L-2: PX-MC: час утримання=1,92 хвилини; m/z (М+Н)=169,2 знайдено; 169,1 обчислено. 2-{(5R)-5-метил-4-[2-(2Н-1,2,3-триазол-2-іл)бензоїл]-1,4-діазепан-1-іл}-5,6,7,8тетрагідрохіназолін (L-3) 284 мг (1,68 ммоль) сполуки L-2 і 400 мг (1,40 ммоль) сполуки F-3 піддають сполученню, аналогічно описаному для сполуки K-2, одержуючи сполуку L-3 у вигляді білої твердої речовини. Дані для сполуки L-3: РХ-МС: час утримання=1,73 хвилини; m/z (М+Н)=418,1 знайдено; 418,2 обчислено; мас-спектрометрія високого розрізнення m/z (M+H)=418,2348 знайдено; 418,2355 обчислено. Схема М Cl O O N 1. Сечовина, HCl O 2. NaOH N цинк, NH4OH EtOH Cl M-1 O Cl HN N N Cl N N N N O N Me N F-3 N N N N N M-2 ТЕА, ДМФА Me M-3 25 30 35 40 2,4-Дихлор-6,7-дигідро-5Н-циклопента[d]піримідин (М-1) До 10,0 г (64,0 ммоль) етил-2-оксоциклопентанкарбоксилату в етанолі (130 мл) додають 0,80 мл (9,6 ммоль) концентрованої НСl і 5,8 г (96 ммоль) сечовини і суміш нагрівають при 80 °C протягом 4 годин. Після охолоджування до кімнатної температури тверду речовину відфільтровують і декілька разів промивають холодним діетиловим ефіром. Після сушіння у високому вакуумі білу тверду речовину розчиняють в 1н. NaOH (100 мл) і нагрівають при 110 °C протягом 1 години. Реакційну суміш охолоджують до кімнатної температури і підкисляють 3н. НСl до рН 2 і тверду речовину відділяють фільтруванням. Тверду речовину промивають холодним діетиловим ефіром і сушать в глибокому вакуумі протягом ночі (трохи модифікована методика з Eur. J. Med. Chem. 1980, 15, 317-322). Після сушіння у високому вакуумі тверду речовину розчиняють в чистому оксихлориді фосфору (55 мл) і нагрівають при 120 °C протягом 1 години. Реакційну суміш охолоджують до кімнатної температури і надлишок оксихлориду фосфору видаляють випарюванням на роторному випарнику. Залишок розподіляють між EtOAc (400 мл) і водою (200 мл) і органічну фазу послідовно промивають насиченим розчином NaHCO 3 (200 мл) і насиченим розчином солі (200 мл). Органічну фазу сушать над MgSO 4 і концентрують. Залишок очищають колонковою флеш-хроматографією (ЕtOАс/гексан), одержуючи сполуку М-1 у вигляді білої твердої речовини. Дані для сполуки М-1: РХ-МС: час утримання=2,40 хвилини; m/z (М+Н)=189,1 знайдено; 189,0 обчислено. 28
ДивитисяДодаткова інформація
Автори англійськоюBergman Jefferey M., Breslin, Michael, J., Coleman, Paul, J., Cox, Christopher, D., Mercer, Swati, P., Roecker, Anthony, J.
Автори російськоюБреслин Майкл Дж., Коулман Пол Дж., Кокс Кристофер Д., Мерсер Свати П., Рокер Энтони Дж.
МПК / Мітки
МПК: C07D 413/14, C07D 403/14, C07D 495/04, A61K 31/551, C07D 491/052, A61P 3/04, C07D 491/048, C07D 471/04, C07D 487/04, A61P 25/20, C07D 401/14
Мітки: рецепторів, діазепанів, сполуки, заміщених, антагоністи, орексинових
Код посилання
<a href="https://ua.patents.su/45-106873-spoluki-zamishhenikh-diazepaniv-yak-antagonisti-oreksinovikh-receptoriv.html" target="_blank" rel="follow" title="База патентів України">Сполуки заміщених діазепанів як антагоністи орексинових рецепторів</a>
Попередній патент: Сталеві труби, облицьовані відлитим під тиском бетоном або розчином, і способи їх виготовлення
Наступний патент: Харчовий продукт
Випадковий патент: Спосіб "діма ш" визначення типу міжпівкульової асиметрії












