Похідні піразолу, їх сільськогосподарсько прийнятні солі та гідрати, що мають гербіцидні властивості, спосіб їх отримання (варіанти), гербіцидна композиція, спосіб боротьби з небажаними рослинами
Номер патенту: 39167
Опубліковано: 15.06.2001
Автори: МОДРІДЗЕР Курт, РОДЖЕРС Майкл Девід, ДАТРА Герард Ентоні, МІШКЕ Дебора Ейлін, ХАМПЕР Брюс Камерон, ВУДАРТ Скотт Сантфорд
Формула / Реферат
1. Производные пиразола общей формулы (I)
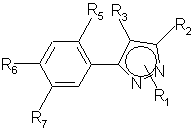 ,
,
(I)
где
R i = водород или C1-C6-алкил, необязательно замещенный галогеном,
R 2 = СFз, CF2H или CF2Cl,
R 3 = Cl или Вг,
R 5 = F, Cl или Н,
R 6 = Н, Hal, NO2, NH2, CN, ОН, ОС1-С4-алкил,
R 7 = Hal, NO2, NH2, CN, ОН, R8, OR8, SR8, CO2R8, CONHR8, NHR8, NHCOR8,
r8 = С1-С4-алкил, необязательно замещенный R9, С2-С5-алкенил, необязательно замещенный R9, или
С2-С5-алкинил, необязательно замещенный R9,
R 9 = Н, Hal, CN, ОН, NO2, ОС1-C4-алкил, NH2, NHC1-C4-алкил, N(С1-С4-алкил)2, СО2С1-
С4-алкил, СОNНС1-С4-алкил,
или R6 и R7, взятые вместе, образуют гетероцикл
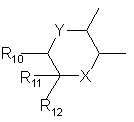 ,
,
где
Х = О, S, NH, NR8,
Y = О, S(О)m, NH, НС1-С4-алкил,
m = 0,1 или 2,
R 10 = Н, СНз, ОСНз, Ph или F,
R 11 и R 12 = каждый Н или вместе образуют =О,
их сельскохозяйственно приемлемые соли и гидраты, обладающие гербицидными свойствами.
2. Производные по п. 1, отличающиеся тем, что представляют собой вещества общей формулы (II)
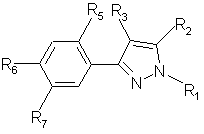 ,
,
(II)
где
R1 = водород или С1-С6-алкил, необязательно замещенный галогеном,
R2 = СF3, CF2H или СF2СІ,
R3 = СІ или Вr,
R5 = F, СІ или Н,
R6 = Hal, NO2, NH2, CN, ОН, ОС1-С4-алкил,
R7 = Hal, NO2, NH2, CN, OH, R8, OR8, SR8, CO2R8, CONHR8, NHR8, NHCOR8,
R8 = С1-С4-алкил, необязательно замещенный R9, C2-C5-алкенил, необязательно замещенный R9, или С2-С5-алкинил, необязательно замещенный R9,
R9 = Н, Hal, CN, ОН, NO2, ОС1-С4-алкил, NH2, NНС1-C4-алкил, N(C1-C4-алкил)2, CO2C1-С4-алкил, CONHC1-C4-алкил,
или R6 и R7, взятые вместе, образуют гетероцикл
 ,
,
где
Х = О, S, NH, NR8,
Y = О, S(O)m, NH, NC1-C4-алкил,
m = 0,1 или 2,
R 10 = Н, СНз, ОСНз, Ph или F,
R11 и R12 = каждый Н или вместе образуют =O.
3. Производные по п. 2, отличающиеся тем, что
R1 = СН3,
R2 = СF3, CF2H или CF2Cl,
R3 =Сl или Br,
R5 = F,
R6 =Наl,
R7 = пропаргилокси, аллилокси, ОСНR13СОR14, где R13 = водород, метил или этил, R14 =ОН, ОС1-С4-алкил, NH2, NНС1-С4-алкил, N(С1-С4-алкил)2,
или R6 и R7, взятые вместе, образуют гетероцикл
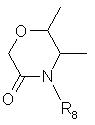 ,
,
где
R8 = С1-С4-алкил, необязательно замещенный R9, С2-C5-алкенил, необязательно замещенный R9, или С2-C5-алкинил, необязательно замещенный R9,
R9 = Н, Hal, CN, ОН, NO2, ОС1-С4-алкил, NH2, NHC1-C4-алкил, N(С1-С4-алкил)2, CO2C1-С4-алкил, СОNНС1-С4-алкил.
4. Производные по п. 3, отличающиеся тем, что выбраны из группы, включающей
4-хлор-З -(4-хлор-2-фтор-5-пропаргилоксифенил)-1-метил-5-(трифторметил)-1Н-пиразол,
этил-2-(2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторфенокси)пропионат,
1 -метилэтил-(2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторфенокси)ацетат,
4-хлор-З-(4-хлор-2-фтор-5-(метоксиметокси)фенил)-1-метил-5-(трифторметил)-1Н-пиразол,
4-хлор-З -(4-хлор-2-фтор-5-(метоксиэтокси)фенил)-1-метил-5-(трифторметил)-1Н-пиразол,
1,1 -диметилэтил-(2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторфенокси)ацетат,
(2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторфенокси)уксусную кислоту,
2-этокси-1-метил-2-оксоэтил-2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-
3-ил)-4-фторбензоат,
2-метокси-1-метил-2-оксоэтил-2-хлор-5-(4-хлор-1-метил-5 -(трифторметил)-1Н-
пиразол-3-ил)-4-фторбензоат,
этил-2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторбензоат,
1-метилэтил-2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-
фторбензоат,
6-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-7-фтор-4-(2-пропинил)-2Н-
1,4-бензоксазин-3(4Н)-он.
5. Производное по п. 3, отличающееся тем, что является 4-хлор-3-(4-хлор-2-фтор-5-пропаргилоксифенил)-1 -метил-5-(трифторметил)-1 Н-пиразолом.
6. Производное по п. 3, отличающееся тем, что является 1-метилэтил-(2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторфенокси)ацетатом.
7. Производное по п. 3, отличающееся тем, что является 2-метокси-1-метил-2-оксоэтил-2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторбензоатом.
8. Производное по п. 3, отличающееся тем, что является 1-метилэтил-2-хлор-5-(4-хлор-1-
метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторбензоатом.
9. Производное по п. 3, отличающееся тем, что является 6-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-7-фтор-4-(2-пропинил)-2Н-1,4-бензоксазин-3(4Н)-оном.
10. Способ получения производных пиразола общей формулы (I)
 ,
,
(I)
где
R 1 = водород или С1-С6-алкил, необязательно замещенный галогеном,
R2 = CF3, CF2H или CF2Cl,
R3 = СІ или Br,
R5 = F, CI или Н,
R6 = H, Hal, NO2, NH2, CN, OH, ОС1-C4-алкил,
R7 = Hal, NO2, NH2, CN, OH, R8, OR8, SR8, CO2R8, CONHR8, NHR8, NHCOR8,
R8 = С1-С4-алкил, необязательно замещенный R9, С2-С5-алкенил, необязательно замещенный R9, или С2-С5-алкинил, необязательно замещенный R9,
R9 = Н, Hal, CN, ОН, NO2, ОС1-C4-алкил, NH2, NHC1-C4-алкил, N(C1-C4-алкил)2, CO2C1-
С4-алкил, CONHC1-C4-алкил,
или R6 и R7, взятые вместе, образуют гетероцикл
 ,
,
где
X=O, S, NH, NR8,
Y = О, S(O)m, NH, НС1-С4-алкил,
m = 0,1 или 2,
R10 = H, СН3, ОСН3, Ph или F,
R11 и R12 = каждый Н или вместе образуют = O,
отличающийся тем, что
а) вводят во взаимодействие соединение общей формулы (А)
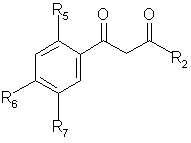 ,
,
(A)
где R2, R5, R6, R7 указаны выше, с гидразином общей формулы NH2NHR'1, где R'1 = Н или
R1, с получением соединения общей формулы (В)
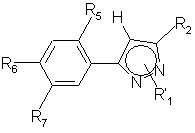 ,
,
(B)
где R2, R5, R6, R'1 указаны выше,
б) при необходимости, алкилируют соединение общей формулы (В), где R'1 = H, c получением соединения общей формулы (В), где R'1 = R1,
в) галогенируют соединения общей формулы (В), где R'1 = R1 сульфурилгалогенидом или N-галогенсукцинимидом с получением производных пиразола общей формулы (I),
г) при необходимости, переводят производное пиразола общей формулы (І), в его сельскохозяйственно приемлемую соль или гидрат.
11.Способ по п. 10, отличающийся тем, что алкилирование проводят в отсутствие основания.
12. Способ по п.11, отличающийся тем, что
R1 =СН3,
R2 = CF3, CF2H или СF2СІ,
R3 = Cl или Br,
R5 = F,
R6 = Hal,
R7 = пропаргилокси, аллилокси, OCHR13COR14, где R13 = водород, метил или этил, R14 =ОН, ОС1-С4-алкил, NH2, NHC1-C4-алкил, N(С1-С4-алкил)2,
или R6 и R7, взятые вместе, образуют гетероцикл
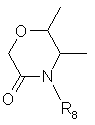 ,
,
где
R8 =C1-C4-алкил, необязательно замещенный R9, С2-С5-алкенил, необязательно замещенный R9, или С2-С5-алкинил, необязательно замещенный R9,
R9 = Н, Hal, CN, ОН, NO2, ОС1-С4-алкил, NH2, NНС1-C4-алкил, N(C1-C4-алкил)2, CO2C1-С4-алкил, CONHC1-C4-алкил.
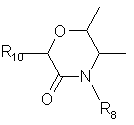
13. Способ получения производных пиразола общей формулы (I')
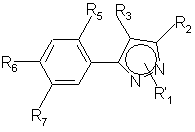 ,
,
(I`)
где
R1 = CH3,
R2 = СF3, CF2H или СF2СІ,
R3 = СІ или Вr,
R5 = F, СІ или Н,
R6 = Hal, NO2, NH2, CN, ОН, ОС1-С4-алкил,
R7 = OR8, NHR8, NHCOR8,
R8 = С1-С4-алкил, необязательно замещенный R9, C2-C5-алкенил, необязательно замещенный R9, или С2-С5-алкинил, необязательно замещенный R9,
R9 = Н, Hal, CN, ОН, NO2, ОС1-С4-алкил, NH2, NНС1-C4-алкил, N(C1-C4-алкил)2, CO2C1-С4-алкил, CONHC1-C4-алкил,
отличающийся тем, что
производное пиразола общей формулы (I'), где R'7 = NH2 или ОН, а остальные указаны выше, алкилируют или ацилируют.
14. Способ по п. 13, отличающийся тем, что производное пиразола общей формулы (I), где R'7 = NH2 или ОН, алкилируют.
15. Способ по п. 14, отличающийся тем, что где R'7 =ОН и R8 = С1-С4-алкил, необязательно замещенный R9, С2-С5-алкенил, необязательно замещенный R9, или С2-С5-алкинил, необязательно замещенный R9.
R9 = СО2С1-С4-алкил или СОNНС1-С4-алкил.
16. Способ по п. 15, отличающийся тем, что R8 = пропаргил, СН2СО2СH(СН3)2, СH(СН3)СО2Еt или – СН2СООН.
17. Способ получения производных пиразола общей формулы (I")
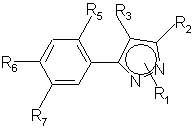 ,
,
(I``)
где
R1 = СН3,
R2 = СF3, CF2H или CF2Cl,
R3 = CI или Br,
R5 = F, Сl или Н,
R6 и R7, взятые вместе, образуют гетероцикл
 ,
,
где
Y = О, S(O)m, NH, NC1-С4-алкил,
m = 0,1 или 2,
R8 = С1-С4-алкил, необязательно замещенный R9, С2-С5-алкенил, необязательно замещенный R9, или С2-С5-алкинил, необязательно замещенный R9,
R9 = Н, Hal, CN, ОН, NO2, ОС1-С4-алкил, NH2 NНС2-C4-алкил, N(С1-С4-алкил)2, СО2С1-С4-алкил, СОNНС1-С4-алкил,
R10 = Н, СН3, ОСН3, Рh или F,
отличающийся тем, что
производное пиразола общей формулы (I"), где R"8 = Н, а остальные указаны выше,
алкилируют.
18. Способ по п. 17, отличающийся тем, что R8 = С1-С4-алкил, необязательно замещенный R9 С2-С5-алкенил, необязательно замещенный R9, или С2-С5-алкинил, необязательно замещенный R9,
R9 = СО2С1-С4-алкил или СОNНС1-С4-алкил.
19. Способ по п. 18, отличающийся тем, что R8 = пропаргил.
20. Способ получения производных пиразола общей формулы (I'")
 ,
,
(I```)
где
R1 = CH3,
R2 = СF3, CF2H или СF2СІ,
R3 = СІ или Вr,
R5 = F, СІ или Н,
R6 = H, Hal, NO2, NH2, CN, ОН, ОС1-С4-алкил,
R7 =CO2R8,
R8 = С1-С4-алкил, необязательно замещенный R9, C2-C5-алкенил, необязательно замещенный R9, или С2-С5-алкинил, необязательно замещенный R9,
R9 = Н, Hal, CN, ОН, NO2, ОС1-С4-алкил, NH2, NНС1-C4-алкил, N(C1-C4-алкил)2, CO2C1-С4-алкил, CONHC1-C4-алкил,
отличающийся тем, что
производное пиразола общей формулы (І"'), где R"'7 = СООН, а остальные указаны выше, алкилируют.
21. Способ по п. 20, отличающийся тем, что R8 = С1-С4-алкил, необязательно замещенный R9, C2-C5-алкенил, необязательно замещенный R9, или C2-C5-алкинил, необязательно замещенный R9,
R9 = СО2С1-С4-алкил или CONHC1-C4-алкил.
22. Способ по п. 21, отличающийся тем, что R8 = СН(СНз)2 или СН(СНз)СО2Еt.
23. Гербицидная композиция, содержащая активный компонент и сельскохозяйственно приемлемый носитель, отличающаяся тем, что активным компонентом является производное пиразола общей формулы (I)
 ,
,
(I)
где
R1 = водород или С1-С6-алкил, необязательно замещенный галогеном,
R2 = СF3, CF2H или СF2СІ,
R3 = СІ или Вr,
R5 = F, СІ или Н,
R6 = H, Hal, NO2, NH2, CN, ОН, ОС1-С4-алкил,
R7 = Hal, NO2, NH2, CN, OH, R8, OR8, SR8, CO2R8, CONHR8, NHR8, NHCOR8,
R8 = С1-С4-алкил, необязательно замещенный R9, C2-C5-алкенил, необязательно замещенный R9, или С2-С5-алкинил, необязательно замещенный R9,
R9 = Н, Hal, CN, ОН, NO2, ОС1-С4-алкил, NH2, NНС1-C4-алкил, N(C1-C4-алкил)2, CO2C1-С4-алкил, CONHC1-C4-алкил,
или R6 и R7, взятые вместе, образуют гетероцикл
 ,
,
где
X=O, S, NH, NR8,
Y = О, S(O)m, NH, НС1-С4-алкил,
m = 0,1 или 2,
R10 = H, СН3, ОСН3, Ph или F,
R11 и R12 = каждый Н или вместе образуют = O,
или его сельскохозяйственно приемлемая соль и гидрат в гербицидно эффективном количестве.
24. Гербицидная композиция по п. 23, отличающаяся тем, что активным компонентом является производное пиразола общей формулы (II)
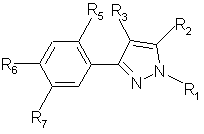 ,
,
(II)
где
R1 = водород или С1-С6-алкил, необязательно замещенный галогеном,
R2 = СF3, CF2H или СF2СІ,
R3 = СІ или Вr,
R5 = F, СІ или Н,
R6 = Hal, NO2, NH2, CN, ОН, ОС1-С4-алкил,
R7 = Hal, NO2, NH2, CN, OH, R8, OR8, SR8, CO2R8, CONHR8, NHR8, NHCOR8,
R8 = С1-С4-алкил, необязательно замещенный R9, C2-C5-алкенил, необязательно замещенный R9, или С2-С5-алкинил, необязательно замещенный R9,
R9 = Н, Hal, CN, ОН, NO2, ОС1-С4-алкил, NH2, NНС1-C4-алкил, N(C1-C4-алкил)2, CO2C1-С4-алкил, CONHC1-C4-алкил,
или R6 и R7, взятые вместе, образуют гетероцикл
 ,
,
где
X=O, S, NH, NR8,
Y = О, S(O)m, NH, НС1-С4-алкил,
m = 0,1 или 2,
R10 = H, СН3, ОСН3, Ph или F,
R11 и R12 = каждый Н или вместе образуют = O.
25. Гербицидная композиция по п. 24, отличающаяся тем, что
R1 =СН3,
R2 = CF3, CF2H или СF2СІ,
R3 = Cl или Br,
R5 = F,
R6 = Hal,
R7 = пропаргилокси, аллилокси, OCHR13COR14, где R13 = водород, метил или этил, R14 =
ОН, ОС1-С4-алкил, NH2, NHC1-C4-алкил, N(С1-С4-алкил)2,
или R6 и R7, взятые вместе, образуют гетероцикл
 ,
,
где
R8 = С1-С4-алкил, необязательно замещенный R9, С2-C5-алкенил, необязательно замещенный R9, или С2-C5-алкинил, необязательно замещенный R9,
R9 = Н, Hal, CN, ОН, NO2, ОС1-С4-алкил, NH2, NHC1-C4-алкил, N(С1-С4-алкил)2, CO2C1-С4-алкил, СОNНС1-С4-алкил.
26. Гербицидная композиция по п. 25, отличающаяся тем, что активный компонент выбран из группы, включающей
4-хлор-3-(4-хлор-2-фтор-5-пропаргилоксифенил)-1-метил-5-(трифторметил)-1Н-пиразол,
этил-2-( 2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторфенокси)пропионат,
1-метилэтил-(2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторфенокси)ацетат,
4-хлор-З -(4-хлор-2-фтор-5 -(метоксиметокси)фенил)-1-метил-5 -(трифторметил)-1 Н-пиразол,
4-хлор-З -(4-хлор-2-фтор-5 -(метоксиэтокси)фенил)-1-метил-5 -(трифторметил)-1 Н-пиразол,
1,1 -диметилэтил-(2-хлор-5 -(4-хлор-1-метил-5 -(трифторметил)-1 Н-пиразол-3 -ил)-4-фторфенокси)ацетат,
(2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторфенокси)уксусную кислоту,
2-этокси-1 -метил-2-оксоэтил-2-хлор-5 -(4-хлор-1 -метил-5 -(трифторметил)-1 Н-пиразол-
3-ил)-4-фторбензоат,
2-метокси-1-метил-2-оксоэтил-2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторбензоат,
этил-2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторбензоат,
1-метилэтил-2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторбензоат,
б-(4-хлор-1 -метил-5-(трифторметил)-1Н-пиразол-3-ил)-7-фтор-4-( 2-пропинил)-2Н-1,4-бензоксазин-3(4Н)-он.
27. Гербицидная композиция по п. 26, отличающаяся тем, что активным компонентом является 4-хлор-3-(4-хлор-2-фтор-5-пропаргилоксифенил)-1-метил-5-(трифторметил)-1H-пиразол.
28. Гербицидная композиция по п. 26, отличающаяся тем, что активным компонентом является 1-метилэтил-(2-хлор-5-(4-хлор-1-метил-5 -(трифторметил)-1Н-пиразол-3 -ил)-4-фторфенокси)ацетат.
29. Гербицидная композиция по п. 26, отличающаяся тем, что активным компонентом является 2-метокси-1 -метил-2-оксоэтил-2-хлор-5 -(4-хлор-1-метил-5 -(трифторметил)-1Н-пиразол-3-ил)-4-фторбензоат.
30. Гербицидная композиция по п. 26, отличающаяся тем, что активным компонентом является 1-метилэтил-2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторбензоат.
31. Гербицидная композиция по п. 26, отличающаяся тем, что активным компонентом является 6-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-7-фтор-4-(2-пропинил)-2Н-1,4-бензоксазин-3(4Н)-он.
32. Способ борьбы с нежелательньми растениями в сельскохозяйственных культурах, отличающийся тем, что наносят на место их произрастания гербицидно эффективное количество активного компонента, которым является производное пиразола общей формулы (I)
 ,
,
(I)
где
R1 = водород или С1-С6-алкил, необязательно замещенный галогеном,
R2 = СF3, CF2H или СF2СІ,
R3 = СІ или Вr,
R5 = F, СІ или Н,
R6 = Н, Hal, NO2, NH2, CN, ОН, ОС1-С4-алкил,
R7 = Hal, NО2, NH2, CN, OH, R8, OR8, SR8, CO2R8, CONHR8, NHR8, NHCOR8,
R8 = С1-С4-алкил, необязательно замещенный R9, C2-C5-алкенил, необязательно замещенный R9, или С2-С5-алкинил, необязательно замещенный R9,
R9 = Н, Hal, CN, ОН, NO2, ОС1-С4-алкил, NH2, NНС1-C4-алкил, N(C1-C4-алкил)2, CO2C1-С4-алкил, CONHC1-C4-алкил,
или R6 и R7, взятые вместе, образуют гетероцикл
 ,
,
где
X=О, S, NH, NR8,
Y = О, S(О)m, NH, NС1-С4-алкил,
m = 0,1 или 2,
R10 = H, СН3, ОСН3, Ph или F,
R11 и R12 = каждый Н или вместе образуют = O,
или его сельскохозяйственно приемлемая соль и гидрат в гербицидно эффективном количестве.
33. Способ борьбы по п. 32, отличающийся тем, что в качестве активного компонента используют производное пиразола общей формулы (II)
 ,
,
(II)
где
R1 = водород или С1-С6-алкил, необязательно замещенный галогеном,
R2 = СF3, CF2H или СF2СІ,
R3 = СІ или Вr,
R5 = F, СІ или Н,
R6 = Hal, NO2, NH2, CN, ОН, ОС1-С4-алкил,
R7 = Hal, NO2, NH2, CN, OH, R8, OR8, SR8, CO2R8, CONHR8, NHR8, NHCOR8,
R8 = С1-С4-алкил, необязательно замещенный R9, C2-C5-алкенил, необязательно замещенный R9, или С2-С5-алкинил, необязательно замещенный R9,
R9 = Н, Hal, CN, ОН, NO2, ОС1-С4-алкил, NH2, NНС1-C4-алкил, N(C1-C4-алкил)2, CO2C1-С4-алкил, CONHC1-C4-алкил,
или R6 и R7, взятые вместе, образуют гетероцикл
 ,
,
где
X=O, S, NH, NR8,
Y = О, S(O)m, NH, НС1-С4-алкил,
m = 0,1 или 2,
R10 = H, СН3, ОСН3, Ph или F,
R11 и R12 = каждый Н или вместе образуют = O.
34. Способ борьбы по п. 33, отличающийся тем, что в качестве активного компонента используют производное пиразола общей формулы (II), где
R1 =СН3,
R2 = CF3, CF2H или СF2СІ,
R3 = Cl или Br,
R5 = F,
R6 = Hal,
R7 = пропаргилокси, аллилокси, OCHR13COR14, где R13 = водород, метил или этил, R14 = ОН, ОС1-С4-алкил, NH2, NHC1-C4-алкил, N(С1-С4-алкил)2,
или R6 и R7, взятые вместе, образуют гетероцикл
 ,
,
где
R8 = С1-С4-алкил, необязательно замещенный R9, C2-C5-алкенил, необязательно замещенный R9, или С2-С5-алкинил, необязательно замещенный R9,
R9 = Н, Hal, CN, ОН, NO2, ОС1-С4-алкил, NH2, NНС1-C4-алкил, N(C1-C4-алкил)2, CO2C1-С4-алкил, CONHC1-C4-алкил.
35. Способ борьбы по п. 34, отличающийся тем, что активный компонент выбирают из группы, включающей
4-хлор-З-(4-хлор-2-фтор-5-пропаргилоксифенил)-1-метил-5-(трифторметил)-1H-пиразол,
этил-2-( 2-хлор-5-(4-хлор-1-метил-5-( трифторметил) –1H-пиразол-3-ил)-4-фторфенокси)пропионат,
1 -метилэтил-(2-хлор-5 -(4-хлор-1 -метил-5 -(трифторметил)-1Н-пиразол-3 -ил)-4-фторфенокси)ацетат,
4-хлор-З -(4-хлор-2-фтор-5-(метоксиметокси)фенил)-1-метил-5 -(трифторметил)-1Н-пиразол,
4-хлор-3-(4-хлор-2-фтор-5-(метоксиэтокси)фенил)-1-метил-5-(трифторметил)-1Н-пиразол,
1,1 -диметилэтил-(2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторфенокси)ацетат,
(2-хлор-5 -(4-хлор-1 -метил-5 -(трифторметил)-1Н-пиразол-3 -ил)-4-фторфенокси)уксусную кислоту,
2-этокси-1-метил-2-оксоэтил-2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3 -ил)-4-фторбензоат,
2-метокси-1-метил-2-оксоэтил-2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3 -ил)-4-фторбензоат,
этил-2-хлор-5 -(4-хлор-1 -метил-5 -(трифторметил)-1Н-пиразол-3 -ил)-4-фторбензоат,
1-метилэтил-2-хлор-5 -(4-хлор-1-метил-5 -(трифторметил)-1Н-пиразол-3 -ил)-4-фторбензоат,
6-(4-хлор-1 -метил-5 -(трифторметил)-1 Н-пиразол-3 -ил)-7-фтор-4-( 2-пропинил)-2Н-1,4-бензоксазин-З (4Н)-он.
36. Способ борьбы по п.35, отличающийся тем, что активный компонент выбран из группы, включающей
4-хлор-3-(4-хлор-2-фтор-5-пропаргилоксифенил)-1-метил-5-(трифторметил)-1Н-пиразол,
1-метилэтил-(2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторфенокси)ацетат,
2-метокси-1 -метил-2-оксоэтил-2-хлор-5 -(4-хлор-1 -метил-5 -(трифторметил)-1Н-пиразол-3-ил)-4-фторбензоат,
1 -метилэтил-2-хлор-5 -(4-хлор-1 -метил-5 -(трифторметил)-1Н-пиразол-3 -ил)-4-фторбензоат,
б-(4-хлор-1 -метил-5-(трифторметил)-1Н-пиразол-3-ил)-7-фтор-4-(2-пропинил)-2Н-1,4-бензоксазин-3(4Н)-он.
37. Способ борьбы по п. 34, отличающийся тем, что сельскохозяйственньми культурами являются соя, бобы, хлопок, кукуруза, пшеница или ячмень.
Текст
1. Производные пиразола общей формулы (I) 39167 R3 =Сl или Br, R5 = F, R6 =Наl, R7 = пропаргилокси, аллилокси, ОСНR13СОR14, где R13 = водород, метил или этил, R14 =ОН , ОС1-С4алкил, NH2, NНС1-С4-алкил, N(С1-С4-алкил)2, или R6 и R7, взятые вместе, образуют ге тероцикл 9. Производное по п. 3, отличающееся тем, что является 6-(4-хлор-1-метил-5-(трифторметил)-1Нпиразол-3-ил)-7-фтор-4-(2-пропинил)-2Н-1,4-бензоксазин-3(4Н)-оном. 10. Способ получения производных пиразола общей формулы (I) R5 R3 O R6 N N O R2 N R1 R7 , (I) где R 1 = водород или С 1-С6-алкил, необязательно замещенный галогеном, R2 = CF3 , CF2H или CF 2Cl, R3 = СІ или Br, R5 = F, CI или Н, R6 = H, Hal, NO2 , NH2, CN, OH, ОС 1-C4-алкил, R7 = Hal, NO2, NH2, CN, OH, R 8, OR8, SR8, CO2R8, CONHR8, NHR8, NHCOR 8, R8 = С1-С4-алкил, необязательно замещенный R9, С2-С5-алкенил, необязательно замещенный R9, или С2-С5-алкинил, необязательно замещенный R9, R9 = Н, Hal, CN, ОН, NO2, ОС1-C4-алкил, NH2, NHC1-C4-алкил, N(C1-C4-алкил)2, CO2C1-С4-алкил, CONHC1-C4-алкил, или R6 и R7, взятые вместе, образуют ге тероцикл R8 , где R8 = С1-С4-алкил, необязательно замещенный R9, С2-C5-алкенил, необязательно замещенный R9, или С2-C5-алкинил, необязательно замещенный R9, R9 = Н, Hal, CN, ОН, NO2, ОС1-С4-алкил, NH2, NHC1-C4-алкил, N(С1-С4-алкил)2, CO2C1-С4-алкил, СОNНС1-С4-алкил. 4. Производные по п. 3, отличающиеся тем, что выбраны из группы, включающей 4-хлор-З-(4-хлор-2-фтор-5-пропаргилоксифенил)1-метил-5-(трифторметил)-1Н-пиразол, этил-2-(2-хлор-5-(4-хлор-1-метил-5(трифторметил)-1Н-пиразол-3-ил)-4фтор фенокси)пропионат, 1-метилэтил-(2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторфенокси)ацетат, 4-хлор-З-(4-хлор-2-фтор-5-(метоксиметокси)фе ни л)-1 -ме ти л-5 -(три фто рме ти л)-1Н -пиразо л, 4 -хлор -З-(4-хлор-2-фтор -5-(ме токсиэтокси )фе ни л)-1 -ме ти л-5 -(три фто рме ти л)-1Н -пиразо л, 1 ,1 -диме тилэти л-(2 -хлор -5-(4 -хлор -1-ме тил-5 (три фто рме ти л)-1Н -пираз ол-3-ил)-4-фторфе нок си )ацета т, (2-хлор-5 -(4 -хло р-1-ме ти л-5-(три фторме тил)1Н-пиразол-3-ил)-4 -фтор фен окси)ук сусн ую кисло ту, 2-этокси -1-ме тил-2-оксо этил-2-хлор-5 -(4 -хлор1-мети л-5-(три фторме тил)-1Н -пиразол-3-и л)-4фтор бензоа т, 2-метокси-1-метил-2-оксоэтил-2-хлор-5-(4-хлор-1ме ти л-5-(три фторме ти л)-1Н -пира зол -3 -ил)-4фторбензоат, этил-2-хлор-5-(4-хлор-1-метил-5-(трифторметил)1Н-пиразол-3-ил)-4-фторбензоат, 1-метилэтил-2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторбензоат, 6-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол3-ил)-7-фтор-4-(2-пропинил)-2Н-1,4-бензоксазин3(4Н)-он. 5. Производное по п. 3, отличающееся тем, что является 4-хлор-3-(4-хлор-2-фтор-5-пропаргилоксифенил)-1 -метил-5-(трифторметил)-1Н-пиразолом. 6. Производное по п. 3, отличающееся тем, что является 1-метилэтил-(2-хлор-5-(4-хлор-1-метил5-(три фтормети л)-1Н-пиразол-3-и л)-4-фтор фе нокси)ацетатом. 7. Производное по п. 3, отличающееся тем, что является 2-метокси-1-метил-2-оксоэтил-2-хлор-5(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3ил)-4-фторбензоатом. 8. Производное по п. 3, отличающееся тем, что является 1-метилэтил-2-хлор-5-(4-хлор-1-метил-5(трифторметил)-1Н-пиразол-3-ил)-4-фторбензоатом. Y R10 R11 X R12 , где X=O, S, NH, NR 8, Y = О, S(O) m, NH, NС1-С4-алкил, m = 0,1 или 2, R10 = H, СН3, ОСН3 , Ph или F, R11 и R12 = каждый Н или вместе образуют = O, отличающийся тем, что а) вводят во взаимодействие соединение общей формулы (А) R5 O O R2 R6 R7 , (A) где R2, R5, R6, R7 указаны выше, с гидразином общей формулы NH2NHR'1, где R'1 = Н или R1, с получением соединения общей формулы (В) R5 H R2 R6 N R7 N R'1 , (B) где R2, R5 , R6, R7, R'1 указаны выше, б) при необходимости, алкилируют соединение общей формулы (В), где R'1 = H, c получением соединения общей формулы (В), где R' 1 = R1 , 2 39167 в) галогенируют соединения общей формулы (В), где R'1 = R1, сульфурилгалогенидом или Nгалогенсукцинимидом с получением производных пиразола общей формулы (I), г) при необходимости, переводят производное пиразола общей формулы (І), в его сельскохозяйственно приемлемую соль или гидрат. 11.Способ по п. 10, отличающийся тем, что алкилирование проводят в отсутствие основания. 12. Способ по п.11, отличающийся тем, что R1 =СН3, R2 = CF3 , CF2H или СF 2СІ, R3 = Cl или Br, R5 = F, R6 = Hal, R7 = пропаргилокси, аллилокси, OCHR13COR14, где R13 = водород, метил или этил, R14 =ОН, ОС1-С4алкил, NH2, NHC1-C4-алкил, N(С1-С4-алкил)2, или R6 и R7, взятые вместе, образуют ге тероцикл 16. Способ по п. 15, отличающийся тем, что R8 = пропаргил, СН2СО2СH(СН3)2, СH(СН3)СО2Еt или – СН2СООН. 17. Способ получения производных пиразола общей формулы (I") R5 R3 R2 R6 N N R1 R7 , (I’’) где R1 = СН3, R2 = СF3, CF2H или CF2Cl, R3 = CI или Br, R5 = F, Сl или Н, R6 и R7, взятые вместе, образуют гетероцикл O N O R8 , где R8 =C1-C4-алкил, необязательно замещенный R9, С2-С5-алкенил, необязательно замещенный R9, или С2-С5-алкинил, необязательно замещенный R9, R9 = Н, Hal, CN, ОН, NO2, ОС1-С4-алкил, NH2, NНС1-C4-алкил, N(C1-C4-алкил)2, CO2C1-С4-алкил, CONHC1-C4-алкил. 13. Способ получения производных пиразола общей формулы (I') R5 R3 R2 R6 N R7 где Y = О, S(O) m, NH, NC1-С4-алкил, m = 0,1 или 2, R8 = С1-С4-алкил, необязательно замещенный R9, С2С5-алкенил, необязательно замещенный R9, или С 2С5-алкинил, необязательно замещенный R9, R9 = Н, Hal, CN, ОН, NO2, ОС1-С4-алкил, NH2, NНС1-C4-алкил, N(С1-С4-алкил)2, СО2С1-С4-алкил, СОNНС1-С4-алкил, R10 = Н, СН3, ОСН3, Рh или F, отличающийся тем, что производное пиразола общей формулы (I"), где R"8 = Н, а остальные указаны выше, алкилируют. 18. Способ по п. 17, отличающийся тем, что R8 = С1-С4-алкил, необязательно замещенный R9, С2С5-алкенил, необязательно замещенный R9, или С2-С5-алкинил, необязательно замещенный R9, R9 = СО2С1-С 4-алкил или СОNНС 1-С4-алкил. 19. Способ по п. 18, отличающийся тем, что R8 = пропаргил. 20. Способ получения производных пиразола общей формулы (I'") N R'1 , (I’) где R1 = CH3, R2 = СF3, CF 2H или СF2СІ, R3 = СІ или Вr, R5 = F, СІ или Н, R6 =H, Hal, NO2, NH2, CN, ОН, ОС1-С4-алкил, R7 = OR8 , NHR8, NHCOR 8, R8 = С1-С4-алкил, необязательно замещенный R9, C2C5-алкенил, необязательно замещенный R9, или С 2С5-алкинил, необязательно замещенный R9, R9 = Н, Hal, CN, ОН, NO2, ОС1-С4-алкил, NH2, NНС1-C4-алкил, N(C1-C4-алкил)2, CO2C1-С4-алкил, CONHC1-C4-алкил, отличающийся тем, что производное пиразола общей формулы (I'), где R' 7 = NH2 или ОН, а остальные указаны выше, алкилируют или ацилируют. R5 R3 R6 N R7 (I’’’) R2 N R1 , где R1 = CH3, R2 = СF3, CF 2H или СF2СІ, R3 = СІ или Вr, R5 = F, СІ или Н, R6 = H, Hal, NO2 , NH2, CN, ОН, ОС 1-С4-алкил, R7 =CO2R8, R8 = С1-С4-алкил, необязательно замещенный R9, C2C5-алкенил, необязательно замещенный R9, или С 2С5-алкинил, необязательно замещенный R9, R9 = Н, Hal, CN, ОН, NO2, ОС1-С4-алкил, NH2, NНС1-C4-алкил, N(C1-C4-алкил)2, CO2C1-С4-алкил, CONHC1-C4-алкил, 14. Способ по п. 13, отличающийся тем, что производное пиразола общей формулы (I), где R'7 = NH 2 или ОН, алкилируют. 15. Способ по п. 14, отличающийся тем, что R'7= ОН и R8 = С1-С4-алкил, необязательно замещенный R9, С2-С5-алкенил, необязательно замещенный R9, или С2-С5-алкинил, необязательно замещенный R9. R9 = СО2С1-С 4-алкил или СОNНС 1-С4-алкил. 3 39167 отличающийся тем, что производное пиразола общей формулы (І"'), где R"' 7 = СООН, а остальные указаны выше, алкилируют. 21. Способ по п. 20, отличающийся тем, что R8 = С1-С4-алкил, необязательно замещенный R9, C2C5-алкенил, необязательно замещенный R9, или C2-C5-алкинил, необязательно замещенный R9, R9 = СО2С1-С4-алкил или CONHC1-C4-алкил. 22. Способ по п. 21, отличающийся тем, что R8 = СН(СНз)2 или СН(СНз)СО2Еt. 23. Гербицидная композиция, содержащая активный компонент и сельскохозяйственно приемлемый носитель, отличающаяся тем, что активным компонентом является производное пиразола общей формулы (I) R5 R3 R5 = F, СІ или Н, R6 = Hal, NO2, NH2, CN, ОН, ОС1-С4-алкил, R7 = Hal, NO2, NH2, CN, OH, R 8, OR8, SR8, CO2R8, CONHR8, NHR8, NHCOR 8, R8 = С1-С4-алкил, необязательно замещенный R9, C2C5-алкенил, необязательно замещенный R9, или С 2С5-алкинил, необязательно замещенный R9, R9 = Н, Hal, CN, ОН, NO2, ОС1-С4-алкил, NH2, NНС1-C4-алкил, N(C1-C4-алкил)2, CO2C1-С4-алкил, CONHC1-C4-алкил, или R6 и R7, взятые вместе, образуют ге тероцикл Y R1 0 R 11 R2 R6 N R1 2 , где X=O, S, NH, NR 8, Y = О, S(O) m, NH, NС1-С4-алкил, m = 0,1 или 2, R10 = H, СН3, ОСН3 , Ph или F, R11 и R12 = каждый Н или вместе образуют = O. 25. Гербицидная композиция по п. 24, отличающаяся тем, что R1 =СН3, R2 = CF3 , CF2H или СF 2СІ, R3 = Cl или Br, R5 = F, R6 = Hal, R7 = пропаргилокси, аллилокси, OCHR13COR14, где R13 = водород, метил или этил, R14 =ОН, ОС1-С4алкил, NH2, NHC1-C4-алкил, N(С1-С4-алкил)2, или R6 и R7, взятые вместе, образуют ге тероцикл N R1 R7 , (I) где R1 = водород или С1-С6-алкил, необязательно замещенный галогеном, R2 = СF3, CF 2H или СF2СІ, R3 = СІ или Вr, R5 = F, СІ или Н, R6 = H, Hal, NO2 , NH2, CN, ОН, ОС 1-С4-алкил, R7 = Hal, NO2, NH2, CN, OH, R 8, OR8, SR8, CO2R8, CONHR8, NHR8, NHCOR 8, R8 = С1-С4-алкил, необязательно замещенный R9, C2-C5-алкенил, необязательно замещенный R9, или С2-С5-алкинил, необязательно замещенный R9, R9 = Н, Hal, CN, ОН, NO2, ОС1-С4-алкил, NH2, NНС1-C4-алкил, N(C1-C4-алкил)2, CO2C1-С4-алкил, CONHC1-C4-алкил, или R6 и R7, взятые вместе, образуют ге тероцикл O N O Y X R12 , где X=O, S, NH, NR 8, Y = О, S(O) m, NH, NС1-С4-алкил, m = 0,1 или 2, R10 = H, СН3, ОСН3 , Ph или F, R11 и R12 = каждый Н или вместе образуют = O, или его сельскохозяйственно приемлемая соль и гидрат в гербицидно эффективном количестве. 24. Гербицидная композиция по п. 23, отличающаяся тем, что активным компонентом является производное пиразола общей формулы (II) R5 R3 R2 R6 N R8 , где R8 = С1-С4-алкил, необязательно замещенный R9, С2-C5-алкенил, необязательно замещенный R9, или С2-C5-алкинил, необязательно замещенный R9, R9 = Н, Hal, CN, ОН, NO2, ОС1-С4-алкил, NH2, NHC1-C4-алкил, N(С1-С4-алкил)2, CO2C1-С4-алкил, СОNНС1-С4-алкил. 26. Гербицидная композиция по п. 25, отличающаяся тем, что активный компонент выбран из группы, включающей 4-хлор-3-(4-хлор-2-фтор-5-пропаргилоксифенил)1-метил-5-(трифторметил)-1Н-пиразол, этил-2-(2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторфе нокси)пропионат, 1-метилэтил-(2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторфенокси)ацетат, 4-хлор-З-(4-хлор-2-фтор-5-(метоксиметокси)фенил)-1-метил-5 -(трифторметил)-1Н-пиразол, 4-хлор-З-(4-хлор-2-фтор-5-(метоксиэтокси)фенил)1-метил-5 -(трифторметил)-1Н-пиразол, 1,1-диметилэтил-(2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторфенокси)ацетат, (2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Нпиразол-3-ил)-4-фторфенокси)уксусную кислоту, R10 R11 X N R1 R7 , (II) где R1 = водород или С1-С6-алкил, необязательно замещенный галогеном, R2 = СF3, CF 2H или СF2СІ, R3 = СІ или Вr, 4 39167 2-этокси-1-метил-2-оксоэтил-2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторбензоат, 2-метокси-1-метил-2-оксоэтил-2-хлор-5-(4-хлор-1метил-5-(трифторметил)-1Н-пиразол-3-ил)-4фторбензоат, этил-2-хлор-5-(4-хлор-1-метил-5-(трифторметил)1Н-пиразол-3-ил)-4-фторбензоат, 1-метилэтил-2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторбензоат, 6-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол3-ил)-7-фтор-4-(2-пропинил)-2Н-1,4-бензоксазин3(4Н)-он. 27. Гербицидная композиция по п. 26, отличающаяся тем, что активным компонентом является 4-хлор-3-(4-хлор-2-фтор-5-пропаргилоксифенил)1-метил-5-(трифторметил)-1H-пиразол. 28. Гербицидная композиция по п. 26, отличающаяся тем, что активным компонентом является 1-метилэтил-(2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторфенокси)ацетат. 29. Гербицидная композиция по п. 26, отличающаяся тем, что активным компонентом является 2-метокси-1-метил-2-оксоэтил-2-хлор-5-(4хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)4-фторбензоат. 30. Гербицидная композиция по п. 26, отличающаяся тем, что активным компонентом является 1-метилэтил-2-хлор-5-(4-хлор-1-метил-5-(три фторметил)-1Н-пиразол-3-ил)-4-фторбензоат. 31. Гербицидная композиция по п. 26, отличающаяся тем, что активным компонентом является 6-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-7-фтор-4-(2-пропинил)-2Н-1,4-бензоксазин-3(4Н)-он. 32. Способ борьбы с нежелательными растениями в сельскохозяйственных культура х, отличающийся тем, что наносят на место их произрастания гербицидно эффективное количество активного компонента, которым является производное пиразола общей формулы (I) R5 R3 Y R1 0 R 11 X R1 2 , где X=О, S, NH, NR 8, Y = О, S(О) m, NH, NС1-С4-алкил, m = 0,1 или 2, R10 = H, СН3, ОСН3 , Ph или F, R11 и R12 = каждый Н или вместе образуют = O, или его сельскохозяйственно приемлемая соль и гидрат в гербицидно эффективном количестве. 33. Способ борьбы по п. 32, отличающийся тем, что в качестве активного компонента используют производное пиразола общей формулы (II) R 5 R3 R2 R6 N N R1 R7 , (II) где R1 = водород или С1-С6-алкил, необязательно замещенный галогеном, R2 = СF3, CF 2H или СF2СІ, R3 = СІ или Вr, R5 = F, СІ или Н, R6 = Hal, NO2, NH2, CN, ОН, ОС1-С4-алкил, R7 = Hal, NO2, NH2, CN, OH, R 8, OR8, SR8, CO2R8, CONHR8, NHR8, NHCOR 8, R8 = С1-С4-алкил, необязательно замещенный R9, C2-C5-алкенил, необязательно замещенный R9, или С2-С5-алкинил, необязательно замещенный R9, R9 = Н, Hal, CN, ОН, NO2, ОС1-С4-алкил, NH2, NНС1-C4-алкил, N(C1-C4-алкил)2, CO2C1-С4-алкил, CONHC1-C4-алкил, или R6 и R7, взятые вместе, образуют ге тероцикл R2 Y R1 0 R6 N R7 N R 11 R1 X R1 2 , (I) , где X=O, S, NH, NR 8, Y = О, S(O) m, NH, NС1-С4-алкил, m = 0,1 или 2, R10 = H, СН3, ОСН3 , Ph или F, R11 и R12 = каждый Н или вместе образуют = O. 34. Способ борьбы по п. 33, отличающийся тем, что в качестве активного компонента используют производное пиразола общей формулы (II), где R1 =СН3, R2 = CF3 , CF2H или СF 2СІ, R3 = Cl или Br, R5 = F, R6 = Hal, R7 = пропаргилокси, аллилокси, OCHR13COR14, где R13 = водород, метил или этил, R14 = ОН, ОС1-С4алкил, NH2, NHC1-C4-алкил, N(С1-С4-алкил)2, или R6 и R7, взятые вместе, образуют ге тероцикл где R1 = водород или С1-С6-алкил, необязательно замещенный галогеном, R2 = СF3, CF 2H или СF2СІ, R3 = СІ или Вr, R5 = F, СІ или Н, R6 = Н, Hal, NO2 , NH2, CN, ОН, ОС 1-С4-алкил, R7 = Hal, NО2, NH2, CN, OH, R 8, OR8, SR8, CO2R8, CONHR8, NHR8, NHCOR 8, R8 = С1-С4-алкил, необязательно замещенный R9, C2-C5-алкенил, необязательно замещенный R9, или С2-С5-алкинил, необязательно замещенный R9, R9 = Н, Hal, CN, ОН, NO2, ОС1-С4-алкил, NH2, NНС1-C4-алкил, N(C1-C4-алкил)2, CO2C1-С4-алкил, CONHC1-C4-алкил, или R6 и R7, взятые вместе, образуют ге тероцикл 5 39167 2-этокси-1 -метил-2-оксо эти л-2-хлор-5-(4-хлор-1метил-5-(три фторметил)-1Н-пиразол-3-ил)-4фтор бензоат, 2-метокси-1-метил-2-оксоэтил-2-хлор-5-(4-хлор-1метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторбензоат, этил-2-хлор-5-(4-хлор-1 -метил-5 -(трифторметил)1Н-пиразол-3 -ил)-4-фторбензоат, 1-метилэтил-2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3 -ил)-4-фторбензоат, 6-(4-хлор-1 -метил-5 -(трифторметил)-1Н-пиразол3 -ил)-7-фтор-4-( 2-пропинил)-2Н-1,4-бензоксазинЗ (4Н)-он. 36. Способ борьбы по п.35, отличающийся тем, что активный компонент выбран из группы, включающей 4-хлор-3-(4-хлор-2-фтор-5-пропаргилоксифенил)1-метил-5-(трифторметил)-1Н-пиразол, 1-метилэтил-(2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторфенокси)ацетат, 2-метокси-1-метил-2-оксоэтил-2-хлор-5 -(4-хлор-1 метил-5-(трифторметил)-1Н-пиразол-3-ил)-4фторбензоат, 1-метилэтил-2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3 -ил)-4-фторбензоат, 6-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол3-ил)-7-фтор-4-(2-пропинил)-2Н-1,4-бензоксазин3(4Н)-он. O N O R8 , где R8 = С1-С4-алкил, необязательно замещенный R9, C2-C5-алкенил, необязательно замещенный R9, или С2-С5-алкинил, необязательно замещенный R9, R9 = Н, Hal, CN, ОН, NO2, ОС1-С4-алкил, NH2, NНС1-C4-алкил, N(C1-C4-алкил)2, CO2C1-С4-алкил, CONHC1-C4-алкил. 35. Способ борьбы по п. 34, отличающийся тем, что активный компонент выбирают из группы, включающей 4-хлор-З-(4-хлор-2-фтор-5-пропаргилоксифенил)1-метил-5-(трифторметил)-1H-пиразол, этил-2-(2-хлор-5-(4-хлор-1-метил-5-(трифторметил)–1H-пиразол-3-ил)-4-фторфенокси)пропионат, 1 -метилэтил-(2-хлор-5 -(4-хлор-1 -метил-5 -(трифторметил)-1Н-пиразол-3-ил)-4-фторфенокси)ацетат, 4-хлор-З-(4-хлор-2-фтор-5-(метоксиметокси)фенил)-1-метил-5 -(трифторметил)-1Н-пиразол, 4-хлор-3-(4-хлор-2-фтор-5-(метоксиэтокси)фе нил)1-метил-5-(трифторметил)-1Н-пиразол, 1,1-диметилэтил-(2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторфенокси)ацетат, (2-хлор-5 -(4-хлор-1 -ме тил-5 -(три фторметил)1Н-пиразол-3 -ил)-4 -фтор фенокси)уксусн ую кислоту, 37. Способ борьбы по п. 34, отличающийся тем, что сельскохозяйственными культурами являются соя, бобы, хлопок, кукуруза, пшеница или ячмень. _______________________ Настоящее изобретение относится к гербицидным соединениям, в общем определенными родовыми признаками в названии изобрете ния, к содержащим их составам (композициям) и способам получения указанных соединений. В литературе известны различные соединения производные замещенного 3-арил и 5-арилпиразола. Такие соединения имеют различную полезность, например применяются в качестве химических промежуточных соединений, фармацевтических средств и гер бицидов. радикалами, такими как радикалы, замещенные в арильной или пиразольной части. Соединения выше указанного типа, имеющие полезность как гербициды, обычно требуют норм расхо да в 5 или 10 или более килограмм на гектар для достижения адекватных результа тов в борьбе с сорняками. В соответствии с этим целью настояще го изобретения является предложение нового класса соединений типа арилпиразола, имеющих уни кально высокую единичную фи тотоксическую активность против спектра сорняков, включающе го уз колиственные и шикоролиственные сорняки, при высокой степени безопасности для многих ви дов культур, в особенности мелкозернистых хле бов и/или пропашных культур, таких как пшеница, ячмень, кукуруза, соя-бобы, земляные орехи и т.д. В ЕР 0290904 раскрыты соединения, имеющие в структуре фе нильный радикал, присоединенный к атому азота в положении 1 пиразольного цикла и галогеналкильный радикал, присоединенный в положении 3. Соединения имеют инсектицидную активность. В ЕР 0289879 раскрыты соединения, не имеющие в структуре фенильный радикал и галогеналкильный радикал, присоединенный к пиразольному кольцу. Соединения имеют инсектицидную и митицидную активность. Среди замещенных 3-арил-5-(галоид)алкилпиразолов и 5-арил-3-(галоид)алкилпиразолов в данной области техники известны соединения, имеющие различные заместите ли-радикалы в арильном и/или пиразольном фрагментах сое динения, например алкил, карбоксил, алкоксикарбонил, формил, фенил и фенил, замещен ный различными группами, такими как алкил, галоид или нитрогруппы и т.д. Например, известны соединения этого ти па, в кото рых арильная часть представляет собой замещенный или незамещенный фе нильный радикал, в котором заместителями являются алкил, циклоалкил, трифторметил и т.д., а радикал пиразола замещен в разных положениях у атомов азота или углерода алкилом, галоге ном, алкоксилом, гетероциклами, S(O)nR-группами, в которых n есть 0–2, а R может быть различными 6 39167 В ЕР 0269806 раскрыты соединения, полезные как регуляторы роста расте ний и агенты, обеспечивающие бе зопасность гербицидов. Описываемые здесь 1-(гало)алкил-3-(замещенный)арил-4-гало-5-галоалкпиразолы и 1-(гало)-5-(замещен ный)арил-4-гало-3-галоалкилпиразолы являются новыми. Настоящее изобретение относится к гербицидно активным соединениям, составам, содержащим эти соединения, способам получения этих соединений и способам применения их в качестве гербицидов. Гербицидные соединения согласно настояще му изобретению включают соединения, характеризуемые структурой формулы I: R5 R3 R2 = CF3 , CF2H или CF 2Cl, R3 = Cl или Br, R5 = F, Cl или H, R6 = H, Hal, NO2 , NH2, CN, OH, OC 1–C4-алкил, R7 = Hal, NO2, NH2, CN, OH, R 8, OR8, SR8, CO2R8, CONHR8, NHR8, NHCOR8, R8 = C1–C4-алкил, необязательно замещенный R9, C2–C5-алкенил, необязательно замещенный R9, или С2–С5-алкинил, необязательно замещенный R9, R9 = H, Hal, CN, OH, NO2, OC 1–C4-алкил, NH2, NHC1–C4-алкил, N(C1–C4-алкил)2, CO2C1–C4алкил, CONHC1-C4-алкил, или R6 и R7, взятые вместе, образуют ге тероцикл R2 Y R10 R6 N N R11 R1 X R 12 , где X = O, S, NH, NR 8, Y = O, S(O) m, NH, NC 1–C4-алкил, m = 0,1 или 2, R10 = H, CH3, OCH3, Ph или F, R11 и R12 = каждый H или вместе образуют = O. Особо предпочтительными соединениями настояще го изобретения являются соединения согласно формуле II, в которых: R1 = CH 3, R2 = CF3 , CF2H или CF 2Cl, R3 = Cl или Br, R5 = F, R6 = Hal, R7 = пропаргилокси, аллилокси, OCHR13COR14, где R13 = во дород, метил или этил, R14 = ОН, OC1–C4-алкил, NH2, NHC 1–C4-алкил, N(C1–C4-алкил)2, или R6 и R7, взятые вместе, образуют ге тероцикл R7 (I) где R1 = H или С1–С6-алкил, необязательно замещенный галогеном, R2 = CF3 , CF2H или CF 2Cl, R3 = Cl или Br, R5 = F, Cl или H, R6 = H, Hal, NO2 , NH2, CN, OH, OC 1–C4-алкил, R7 = Hal, NO2, NH2, CN, OH, R 8, OR8, SR8, CO2R8, CONHR8, NHR8, NHCOR8, R8 = C1–C4-алкил, необязательно замещенный R9, C2–C5-алкенил, необязательно замещенный R9, или С2–С5-алкинил, необязательно замещенный R9, R9 = H, Hal, CN, OH, NO2, OC 1–C4-алкил, NH2, NHC1–C4-алкил, N(C1–C4-алкил)2, CO2C1–C4алкил, CONHC1-C4-алкил, или R6 и R7, взятые вместе, образуют ге тероцикл O Y R10 R11 N X O R 12 , R2 R6 N , где R8 = C1–C4-алкил, необязательно замещенный R9, C2–C5-алкенил, необязательно замещенный R9, или С2–С5-алкинил, необязательно замещенный R9, R9 = H, Hal, CN, OH, NO2, OC 1–C4-алкил, NH2, NHC1–C4-алкил, N(C1–C4-алкил)2, CO2C1–C4алкил, CONHC1-C4-алкил. Предпочти тельные конкретные соединения в соответствии с настоящим изобретением включают следующие: 4-хлор-3-(4-хлор-2-фтор-5-пропаргилоксифе нил) -1-метил- 5-(трифторметил)-1Н-пиразол, 2-(2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторфе нокси)пропановая кислота, эти ловый эфир, (2-хлор-5-(4-хлор -1-метил-5 -(три фторметил)-1Н-пиразол-3-ил)-4-фтор фе нокси)уксусная кислота, 1-мети лэти ловый эфир, 4-хлор-3-(4-хлор-2-фтор-5-(метоксиметокси)фенил)-1-метил-5-(трифторметил)-1Н-пиразол, где X = O, S, NH, NR 8, Y = O, S(O) m, NH, NC 1–C4-алкил, m = 0,1 или 2, R10 = H, CH3, OCH3, Ph или F, R11 и R12 = каждый H или вместе образуют = O. Предпочти тельным подклассом замещенных арилпиразольных соединений в настоящем изобретении являются соединения, соответствующие фор муле II: R5 R 3 R8 N R1 R7 , (II) где R1 = H или С1–С6-алкил, необязательно замещенный галогеном, 7 39167 4-хлор-3-(4 -хлор-2-фтор -5-(метоксиэтокси)фе нил)-1-метил-5-(три фторметил)-1Н-пи разол, (2-хлор-5-(4 -хлор-1-ме тил-5-(три фторметил)-1Н-пиразол-3-ил)-4-фтор фе нокси)уксусная кислота, 1,1 -диметилэтило вый эфир , (2-хлор-5-(4-хлор -1-метил-5 -(три фторметил)-1Н-пиразол-3-ил)-3-фтор фе нокси)уксусная кислота, 2-хлор-5-(4-хлор-1-метил- 5-(трифторметил)1Н-пиразол-3-ил) -4-фторбензойная кислота, 2этокси-1-метил-2-оксоэтиловый эфир, 2-хлор-5-(4-хлор-1-метил- 5-(трифторметил)1Н-пиразол-3-ил) -4-фторбензойная кислота, 2-метокси-1-метил-2-оксоэтиловый эфир, 2-хлор-5-(4-хлор-1-метил- 5-(трифторметил)1Н-пиразол-3-ил) -4-фторбензойная кислота, этиловый эфир, 2-хлор-5-(4-хлор-1-метил- 5-(трифторметил)1Н-пиразол-3-ил) -4-фторбензойная кислота, 1метилэтиловый эфир и 6-(4-хлор-1-метил-5(трифторметил)-1Н-пиразол-3-ил)-7- фтор-4-(2-пропил)-2Н-1,4-бензоксазин-3(4Н)-он. Хо тя все вышеприведенные соединения проявили высокую эффективность при использовании их на большом количестве культур, испытания, проведенные на настоящее время, показывают, что наибольший интерес представляют соединения № 135, 137, 261, 282 и 446. Эти соединения коллективно обеспечивают прекрасную защиту от таких устойчивых широколистных сорняков, как щирица, дур нишник, канатник Теофраста и конопля (hemp sesbania) в различных куль турах, таких как кукуруза, соя-бобы и орехи и в лесном хозяйстве против деревьев и вьющи хся растений. Другие из соединений согласно настоящему изобрете нию проявляют прекрасные гербицидные свойства против сорняков в други х культурах, таких как пшеница и ячмень. Некоторые из соединений согласно настояще му изобретению могут иметь более одного возможного сте реоизомера, и эти стереоизомеры могут разливаться в их гербицидной эффективности. Показанные структуры показаны с намерением включать все возможные стереоизомеры. Вышеприведенные соединения допускают различный режим их применения, например довсхо довая и/или послевсхо довая обработка, поверхностное нанесение, предпосевное внедрение и т.д. Другой аспект настоящего изобретения относится к способам получения соединений согласно формулам I–III и их предшественников, промежуточных и/или исходных соединений. Эти аспекты будут бо лее подробно обсуждены ниже. Другие аспекты настояще го изобретения относятся к гербицидным составам, содержащим соединения формулы I–III и к способам применения этих составов в качестве средств уничтожения нежелательных сорняков. Далее, к области настоящего изобрете ния относится то, что замещенные арилпиразольные соединения согласно формулам I–III могут быть включены в рецептуру соста вов, содержащи х другие гербицидные соединения в качестве согербицидов, например ацета миды, особенно ацетани лиды, тиокарбаматы, мочевины, сульфонилмочевины, сульфонамиды, имидазолиноны, бензойная кислота и ее производные, дифениловые эфи ры, соли глифосатов и т.д. В та кие гербицидные рецептуры могут быть включены другие добавки как желательные и подхо дящие, например антидоты (добавки, повышающие безопасность) для гербицидов, средства предуп реждения болезней расте ний, такие как фунгициды, инсектициды, нематоциды и другие пестициды. Используемые здесь термины "алкил", "алкенил", "алкинил", взятые отдельно или в составной форме, например галоидалкил, галоидалкенил, алкокси, алкоксиалкил и т.д. охва тывают как линейные, так и соединения с разветвленной цепью. Предпочтительные представители алкилов – это низшие алкилы, имеющие от 1 до 4 углеродных атомов, а предпочтительными предста вителями алкенилов и алкинилов являются таковые, имеющие от 2 до 4 углеродных ато мов. Термин галоидалкил (галоалкил) употреблен для обозначения алкильных радикалов, замещенных одним или более чем одним атомом галогена (хлор, бром, иод или фтор), предпочтительными членами этого класса являются те соединения, которые имеют от 1 до 4 углеродных ато мов, в особенности галоидметильные радикалы, например трифторметил. В полигалоидалкилах га логены могут быть одинаковыми или смешанными. Не исчерпывающий перечень представителей алкильных, алкенильных, алкинильных, циклоалкильных, циклоалкилалкильных, циклоалкенильных и циклоалкенилалкильных радикалов включает: метил, этил, изомерные пропилы, бутилы, пентилы, гексилы, гепти лы, окти лы, нонилы, децилы и т.д.; винил, аллил, кротил, металлил, изомерные бутенилы, пенте нилы, гексенилы, гептенилы, октенилы; эти нилы, изомерные пропинилы, бутинилы, пентинилы, гексинилы и т.д.; алкокси-, полиалкокси-, алкоксиалкил- и полиалкоксиалкильные аналоги вышеприведенных алкильных гр упп, например метокси, этокси, пропоксилы, бутоксилы, петоксилы и гексоксилы и соответствующие полиалкоксилы и алкоксиалкилы, например метоксиметокси, метоксиэтокси, этоксиметокси, этоксиэтокси, метоксиметил, метоксиэтил, этоксиметил, этоксиэтил, пропоксиметил, изопропоксиметил, бутоксиметил, изобутоксиметил, трет-бутоксиметил, пентоксиметил, гексоксиметил, и т.д., циклопропил, циклобутил, циклопентил, циклогексил, циклопентил, циклопропиметил, циклобутилметил, циклопентилметил и т.д.; изомерные циклопентены, циклогексены и циклогептены, имеющие моноили ди-ненасыщенность; представите ли арильных, аралкильных и алкарильных гр упп включают фе нил, изомерные толилы и ксилилы, бензил, нафтил и т.д. Представители моно-, ди- и три-галоидалкилов включают: хлорметил, хлорэтил, бромметил, бромэтил, иодметил, иодэтил, хлорпропил, бромпропил, иодпропил 1,1-дихлорметил, 1,1-дибромметил, 1,1-дихлорпропил, 1,2-дибромпропил, 2,3дибромпропил, 1-хлор-2-бромэтил, 2-хлор-3бромпропил, трифторметил, три хлорметил, и т.д. 8 39167 Представители ге тероциклических соединений включают: алкилтиодиазолил, пиперидил, пиперидилалкил, диоксоланилалкил, тиазолил, алкилтиазолил, бензотиазолил, га лоидбензотиазолил, фурил, алкилзамещенный фурил, фурилалкил, пиридил, алкилпиридил, алкилоксазолил, тетрагидрофурилалкил, 3-циантиенил, тиенилалкил, алкилзамещенный тиенил, 4,5-полиалкилен-тиенил, пиперидинил, алкилпиперидинил, пиридил, ди- или тетрагидропиридинил, алкилтетрагидроморфолил, алкилморфолил, азабициклононил, диазабициклоалканил, бензоалкилпирролидинил, оксазолидинил, пергидрооксазолидинил, алкилоксазолидил, фурилоксазолидинил, тиенилоксазолидинил, пиридилоксазолидинил, пиримидинилоксазолидинил, бензооксазолидинил, С3–7-спироциклоалкилоксазолидинил, алкиламиноалкенил, алкилденимин, пирролидинил, пиперидонил, пергидроазепинил, пергидроазоцинил, пиразолил, дигидропиразолил, пиперазинил, пергидро-1,4-диазепинил, хи нолинил, изохи нолинил, ди-, тетра- и пергидрохи нолил- или -изохи нолил, индолил и ди- и пергидроиндолил и указанные гетероциклические члены, замещенные радикалами, такими как радикалы, определенные в формулах I–III. Под "сельскохо зяйственно-приемлемыми солями" соединений, определенных выше указанными формулами, имеется в виду соль или соли, которые легко ионизируются в водной среде, образуя катион или анион указанных соединений и соответствующий солевой анион и катион, причем соли не уменьшают гербицидных свойств данного гербицида и позволяют приготовлять различные смеси, например гербицидно-антидотные композиции без ненужных проблем смешения, суспензии, стабильности, применения оборудования по нанесению, упаковки и т.д. Под "гербицидно эффективным" имеется в виду количество гербицида, требуемое для существенного повреждения или разруше ния значительной части обработанных нежелательных растений или сорняков. Хо тя это и не твердое правило, но с коммерческой точки зрения желательно уничтожение 80–85 или более процентов сорняков, однако коммерчески значительное подавление роста сорняков может быть достигнуто и при значительно более низких уровнях, в частности с некоторыми очень вредными, стойкими к гербицидам растениями. Подробное описание изобретения. Ниже описываются соединения в соответствии с настоящим изобретением, получаемые в ряде способов. В ши роком аспекте предпочтительный общий способ получения соединений формул I–III лучше все го может быть рассмотрен по отдельным стадиям способа, требующимся для получения необхо димых промежуточных продуктов, непосредственных предшественников и конечных продуктов вышеприведенных формул. Продукты "способа I" являются промежуточными продуктами, необхо димыми для "способов II – XVI". Продукты в соответствии с фор мулами I – III получаются либо одним способом "II – XVI" ли бо любой комбинацией "способов II – XVI". Следует ясно понимать, что рассматриваются различные модифи кации, очевидные для специалиста в данной области. Конкретные варианты описываются ниже в примерах 1–42. В последовательности стадий процесса, описываемых ниже, различные символы, определяющие радикалы-заместители, например R1–R24, X, Y и т.д. имеют те же значения, что и для соединений формулы I–III, если не указано иное. Способ I. Этот способ описывает приготовление важных промежуточных соединений формулы В или изомерных смесей их, полезных в общем процессе получения формул I–III. Способ получения соединений формулы В исходит из соединений формулы А. Соединения формулы А го товятся известными средствами из замещенных ацетофе нонов, которые также известны из уровня техники. Имеется в виду, что структура, представляемая формулой А, воплощает все возможные тауто мерные формы или смеси ее. Соединения формулы А могут быть приготовлены в любом безводном растворите ле или смеси растворите лей; предпочтительными растворителями являются эфир, спирты, диметилсульфоксид, толуол, бензол, и т.д., реакцией замещенного ацетофе нола в присутствии эфира с сильным основанием, таким как алкоксид щелочного металла, амид щелочного металла или гидрид щелочного металла, причем предпочтительны алкоксиды щелочного металла, такие как метоксид натрия. Температура реакции нахо дится в пределах от -100оС до 200оС, предпочти тельно от -78оС до 50оС. Период реакции может быть выбран в пределах от нескольких минут до нескольких недель в зависимости от количеств реагентов, температуры реакции и т.д. По окончании реакции соединение формулы А вы деляют разбавлением реакционной смеси водой, возможно с последующим подкислением водного слоя или, альтернативно, разбавлением реакционной смеси водным раствором кислоты. Затем продукт выделяется методом кристаллизации или экстракции растворите лем. Если необхо димо, продукт очищается стандартными методами. Циклизация этого промежуточного соединения с образованием соединений формулы В может быть приведена в любом подхо дящем растворите ле действием гидразина или замещенных гидразинов, предпочтительно алкилгидразинами. Температура реакции в пределах от -78оС до 200оС, предпочтительно от 10оС до 120оС. Период реакции может быть выбран в пределах от немногих минут до нескольких недель в зависимости от количеств реагентов, температуры реакции и т.д. Продукт выделяют после окончания реакции путем фильтрации и/или концентрирования реакционной смеси. Если необходимо, продукт очищают стан дартными методами, такими как экстракция, кристаллизация, колоночная хроматография и т.д. В случае добавления гидразина к соединениям формулы А по лучающийся пиразол форму 9 39167 лы С может быть обработан алкилирующим агентом для получения соединений формулы В. В этом случае продукты формулы В могут быть получены обработкой выше упомянутых соединений алкилирующим агентом, таким как метилиодид, аллилбромид, диметилсуль фат и т.д. Предпочтительными растворителями являются толуол, диметилсульфоксид, ацетон, диметилформамид, диоксан и т.д. Реакция может быть проведена с основанием или без него. В случае применения основания можно применять карбонаты щелочного металла или металла, та кие как карбонат натрия или гидроксид натрия. Температура реакции нахо дится в пределах от -78оС до 200оС, предпочтительно 10оС – 120оС. Время реакции может быть выбрано в пределах от немногих минут до нескольких недель в зависимостиот количества реагентов, температуры реакции и т.д. Продукт выделяют после окончания реакции фильтрацией и/или концентрированием реакционной смеси. При необхо димости продукт очищают стандартными методами, такими как экстракция, кристаллизация, колоночная хроматография и т.д. В данном описании способа один класс продуктов в соответствии с фор мулой I, в которой R3 представляет собой галоген, получали галогенированием соответствующе го соединения формулы В. В данном способе R1 может иметь вышеуказанное значение и включать еще гидроген. Любой инертный растворитель может быть использован в этой реакции, который заметно не препятствует протеканию реакции или реакция может проводиться без растворителя. Такие растворите ли включают, но не ограничены ими, органические кислоты, неорга нические кислоты, углеводороды, галоге нированные углеводороды, ароматические углеводороды, эфи ры и сульфиды, сульфоксиды или сульфо ны. Галогенирующие агенты, пригодные для вышеозначенных реакций, включают бром, хлор, N-бромсукцинамид, N-хлорсукцинамид, сульфурилхлорид и т.д. С некоторыми галогенирующими агентами предпочти тельно использовать органическую перекись или свет в качестве катализатора. Количество га логенирующе го агента может варьировать от менее чем один молярный эквивалент до избытка. Температура реакции лежит в пределах от -100оС до 200оС, предпочтительно от 10оС до 100оС. Время реакции может быть выбрано в пределах от немногих минут до нескольких недель в зави симости от количества реагентов, температуры реакции и т.д. По окончании реакции продукт вы деляют разбавлением реакционной смеси водой и затем продукт вы деляют методом кристаллизации или экстракцией растворите лем. Если необхо димо, продукт очи щают стандартными методами. Способ III. Этот раздел описывает способ получения соединений в соответствии с формулой D (соединение формулы I, в котором один из R4 – остатков является нитрогруп пой) исхо дя из соединений формулы I. Соединения, представленные формулой С, могут существовать в двух воз можных таутомерных формах, либо как 5-арилпиралол либо как 3арилпиразол. Имеется в ви ду, что 5-арилпиразол, изображенный формулой С, включает обе возможные тауто мерные формы. Таблица 1 показывает ти пичные примеры соединений формулы С. Во всех таблицах в данном описании точки кипения и точки плавления измерены в градусах Цельсия (оС) и, если не указано иное, приведенные показатели преломления относятся к 25оС. 2-фтор-4-хлор-5-метоксиацето фенон, используемый для получения соединения №№ 3, 4 и 9 по вышеприведенному способу, получали из 2хлор-4-фтор фенола методами, известными из уровня техники (C. A. Buehler and D.E. Pearson, Survey of Organic Synthesis, pages 285–382, Wiley – Interscience, New York, 1970). Обработка 2-хлор4-фто ранизола четыреххлористым титаном и дихлорметилметилэфиром при комнатной температуре дает 2-фтор-4-хлор-5-метоксибензальдегид. 2-Фтор-4-хлор-5-метоксибензальдегид превращали в 2-фтор-4-хлор-5-метоксиацетофенон обработкой метилом Гриньяра с последующим окислением с использованием стандартных методов, известных из уровня техники. Вышеупомянутый 2-фтор-4-хлор-5-метоксиацетофе нон и его аналог – предшественник 2фтор-4-хлор-5-метоксибензальдегид и способы получения их составляют предмет изобрете ния других лиц (Брус С. Хэмпер и Киндрик Л. Лешински), которое использовано здесь правопреемником. Нитрующие агенты, как то концентрированная азотная кислота, ды мящая серная кислота, алкилнитраты и ацетилнитраты, пригодны для этой реакции. Могут быть использованы растворители, как то: минеральные кислоты, органические кислоты, органические растворители, как то: уксусный ангидрид или метиленхлорид и вода или смеси этих растворителей. Нитрирующий агент может быть использован в эквимолярных количествах или в из бытке. Температура реакции нахо дится в пределах от -100оС до 200оС, предпочтительно от 10оС до 100оС. Время реакции может быть выбрано в пределах от немногих минут до нескольких дней в зависимости от количества реагентов, температуры реакции и т.д. По окончании Таблицы 2 и 3 показывают ти пичные примеры соединений, полученных по способу I. Способ II. 10 39167 реакции продукт вы деляют разбавлением реакционной смеси водой и продукт выделяют такими методами, как кристаллизация или экстракция растворителем. Если необхо димо, продукт очищают стандартными методами. Способ IV. В описании этого способа один класс продуктов в соответствии с формулой F (разновидность соединений формулы II) получали замещением Z-радикала соответствующе го соединения формулы Е, в которой Z является любой подхо дящей покидающей груп пой выше указанных R4-членов. во. Растворитель для реакции может включать либо орга нические, либо неорганические кислоты, такие как уксусная кислота или хлористоводородная кислота, и может быть использован в виде концентрированных растворов кислот или разбавленных водных растворов. Температура реакции нахо дится в пределах от 0оС до 200оС, предпочтительно от 10оС до 120оС. Время реакции может быть выбрано в пределах от немногих минут до нескольких недель в зави симости от количеств реагентов, температуры реакции и т.д. По окончании реакции продукт вы деляют разбавлением реакционной смеси водой и продукт выделяют такими мето дами, как кристаллизация или экстракция растворителем. Если необходимо, продукт очи щают стан дартными методами. Альтернативно соединения формулы G могут быть восста новлены каталитическим гидрированием. Для каталитического гидрирования, которое может проводиться при атмосфер ном или повышенном давлении, подходящие катализаторы включают никель Ренея, палладированный уголь, палладиевую чернь, палладий на любой подхо дящем носителе, окись палладия, плати ну, платиновую чернь и т.д. Растворители включают любой инертный растворитель, который заметно не препятствуе т реакции, включая спирты, эфи ры и т.п. Продукт выделяют фильтрацией и концентрированием реакционной смеси. Если необходимо, продукт очищается стандартными методами, такими как экстракция, кристаллизация, колоночная хроматография и т.д. Образование продуктов фор мулы Е может быть достигнуто обработкой соединений формулы D алкоксидом, тиоалкоксидом, амином и т.д. или спиртом, меркаптаном, амином и т.д. в присутствии основания в любом подходящем растворителе или смеси растворите лей. Предпочтительные растворители – диметилсуль фоксид, ацетон, диметилформамид, диоксан, вода и т.д. или смеси растворителей, включая двухфазные смеси (такие как вода и метиленхлорид или другой органический растворитель). Основанием может быть органическое основание (такое как триалкиламин или другой органический амин) или неорга ническое основание (карбонат щелочного металла, как то: карбонат калия или натрия или гидроокись щелочного металла, такая как гидроокись натрия). В случае двух несмеши вающихся жидких фаз желательно добавлять катализатор фазового переноса, такой как галоидный бензилтриалкиламмоний или другую аммониевую соль. Температура реакции нахо дится в пределах от -100оС до 200оС, предпочтительно от -10оС до 100оС. Время реакции может быть выбрано в пределах от немногих минут до нескольких недель в зависимости от количества реагентов, температуры реакции и т.д. Продукт выделяют после окончания реакции путем фильтрации и/или концентрации реакционной смеси. Если необходимо, продукт очищают стандартными мето дами, такими как экстракция, кристаллизация, колоночная хроматография и т.д. Способ V. При описании этого способа соединения формулы I получаются из соединений формулы G (соединения формулы I, в кото рой один из R 4-членов является нитроостатком). Б. Аминовый радикал продук та стадии А может быть превращен в целый ряд функциональных групп, например галоген (предпочтительно), цианогруппу, гидроксил и т.д. В случае конверсии радикала амина в галоген раствор или суспензия продукта стадии А обрабатывается медными солями, включая галогениды меди (II), га логениды меди (I) или другие медные соли и их смеси, и алкилнитритом или орга ническим нитратом, таким как т-бутилнитрит. В этой реакции может быть применен любой подхо дящий растворитель, хотя предпочтительны безводные растворители, та кие как безводный ацетонитрил. Температура реакции нахо дится в пределах от 0оС до 200оС, предпочтительно от 10о до 100оС. Продолжительность реакции может быть выбрана в пределах от немногих минут до нескольких недель в зависимости от количества реагентов, температуры реакции и т.д. Продукт вы деляют после окончания реакции фильтрацией и/или концентрированием реакционной смеси. Если необходимо, продукт очищают стандартными мето дами, такими как экстракция, кристаллизация, колоночная хроматография и т.д. Операции альтернативного способа по превраще нию радикаламина в различные функциональные группы, в том числе упомянутые в предыдущем абзаце, включают использование различных обычных процедур, например реакции Сандмауера, Меервайна и т.д., в которых применяются в качестве промежуточных продук тов соли диазония. Способ VI. При описании этого способа соединения согласно формуле I, в которой один из R4-членов яв А. Напервой стадии этого двухста дийного способа соединения в соответствии с формулой G восстанавливаются с получением производного в соответствии с формулой I, где один из R 4-радикалов является аминогруппой. Восстановители, пригодные в кислой среде, включают, но не ограничены этим, металлы, такие как железо, цинк или оло 11 39167 ляется YH, го товят из соединений формулы I, в которой один из R4-членов представляет собой YR15, а R15 не является водородом. Реакция может проводиться как в растворе или суспензии в любом подхо дящем растворителе, так и без растворителя. Мо жет применяться кислота Льюиса, такая как (но этот перечень не ограничен) BBr3, AlCl3 и т.д., или неорганические или органические кислоты, та кие как хлористо водородная, серная, бромисто водородная, уксусная кислоты и т.д. Аль тернативно могут быть использованы нуклеофильные реагенты деалкилирования, в том числе триметилсилилиодид, цианидные соли, меркаптидные соли, галогениды щелочных металлов и т.д. Температура реакции находится в пределах от 0оС до 200оС, предпочти тельно от 10о до 100оС. Продолжительность реакции может быть выбрана в пределах от немногих минут до нескольких недель в зависимости от количества реагентов, температуры реакции и т.д. Продукт выделяют после окончания реакции фильтрацией и/или концентрированием реакционной смеси. Если необхо димо, продукт очищают стандартными методами, такими как экстракция, кристаллизация, колоночная хроматография и т.д. Способ VII. При описании этого способа соединения в соответствии с формулой I (которая включает соединения формул II и III), в кото рой один из R4-членов представляет собой YR15, а R15 не является водородом, готовят из соединений в соответствии с формулой I, в которой один из R4-членов представляет собой YH или NR16R17 . стандартными мето дами, такими как экстракция, кристаллизация, колоночная хроматография и т.д. Способ VIII Этот способ описывает получение соединений формулы К (формулы II, в которой R7 представляет собой YCH2-p(R25) p–COYR 27) из соответствующи х соединений формулы. В радикалах R25–27 члены R4 имеют вышеуказанное значение; Y – члены независимо имеют вышеуказанное значение и p представляет собой целое число от 0 до 2. А. На первой стадии этого двухста дийного способа соединения формулы Н превращают в соединения формулы J путем гидролиза радикала YR26. Реакция может проводиться в любом подходящем растворителе или смеси растворителей, с катализатором или без катализатора, в присутствии основания или кислоты. Предпочтительными растворителями являются вода, спирты, диоксан, диметилсульфоксид, ук сусная кислота, ацетон, диметилформамид и т.д. В случае щелочного гидролиза предпочти тельны неорганические основания, такие как гидроксиды щелочных металлов. В случае кислотного гидролиза могут применяться неорганические кислоты, такие как концентрированная хлористоводородная кислота или серная кислота, органические кислоты или смеси таких кислот. Температура реакции находится в пределах от 0оС до 200оС, предпочтительно от 10оС до 100оС. Период реакции может быть выбран от немногих минут до нескольких недель в зависимости от количеств реагентов, температуры реакции и т.д. После окончании реакции продукт вы деляют разбавлением реакционной смеси водой и/или обработкой раствора кислотой (в случае щелочного гидролиза) и продукт затем выделяют таким методом, как кристаллизация или экстракция. Если необходимо, продукт очищают стандартными методами. Б. Последняя стадия этого способа включает преобразование соединений формулы J в соединения формулы К с помощью любого из целого ряда стандартных мето дов получения производных карбоновых кислот. Эта стадия процесса представляет собой этерификацию или реакцию образования амида. Этерификация может быть проведена с использованием избытка спирта в соответствии с целевым эфиром в присутствии минеральной кислоты (например, серной кислоты). Производные амида могут быть получены об В представительных ва риантах это го способа образование вышеуказанных продук тов может быть осуществлено обработкой исходных материалов алкилирующим агентом, та ким как алкилгалоид или алкилсуль фонат, например метилиодид, аллилбромид, пропаргилбромид, метиловый эфир фенилсульфо новой кислоты и т.д., или ацилирующим агентом. Реакция может быть проведена в любом подхо дящем растворителе или смеси растворителей, с ката лизато ром или без него, в присутствии или отсутствии основания. Предпочтительными растворителями являются диметилсульфоксид, ацетон, диметилформамид, диоксан и т.д. или смеси растворителей, включая двухфазные смеси (та кие как вода и метиленхлорид или другой органический растворитель). В случае двух несмеши вающихся жидких фаз желательно добавлять катализатор фа зового переноса, та кой как бензилтриалкиламмонийгалоид или другу аммониевую соль. Основанием может быть органическое основание (такое как триалкиламин или другой органический амин) или неорга ническое основание (карбонат щелочного металла или щелочной металл, та кой как карбонат натрия или калия или гидроокись натрия). Температура реакции нахо дится в пределах от 0оС до 200оС, предпочтительно от 10оС до 100оС. Продолжительность реакции может быть выбрана в пределах от немногих минут до нескольких недель в зависимости от количества реагентов, температуры реакции и т.д. Продукт вы деляют после окончания реакции фильтрацией и/или концентрированием реакционной смеси. При необхо димости, продукт очищают 12 39167 работкой соединений формулы К желательным аминоэфиром – без растворите ля или в подхо дящем растворителе. Реакции этерификации или амидообразования могут также быть проведены в присутствии инертного растворителя и дегидратирующего агента. Альтернативно продукт стадии А может быть превращен в галоидангидрид или ангидрид кислоты и обработан спиртом или амином. Приготовление галоидангидрида кислоты осуществляется в присутствии галогенирующего агента, такого как тионилхлорид, пятихлористый фосфор, оксалилхлорид и т.д. (этот перечень не является исчерпывающим) с растворителями или без растворите ля. Может быть использован любой инертный растворитель, не вступающий в реакцию. С целью ускорения этой реакции может быть добавлено ката лити ческое количество аминного основания, такого как триэтиламин, пиридин или диметилформамид и т.д. Температура реакции находится в пределах от -20оС до точки кипения используе мого растворителя. Продолжительность реакции варьирует от нескольких минут до 48 часов в зави симости от количеств используе мых реагентов и температуры реакции. По окончании реакции избыток галогенирующе го агента и растворите ля (растворителей) удаляют из продукта реакции выпариванием или дистилляцией. Полученный галоидангидрид кислоты может быть подвергнут действию амина или спирта непосредственно или очищен обычными средствами. Галоидангидрид кислоты обрабатывают спиртом или амином, получая соединение формулы К. Реакция может проводиться в отсутствии растворителя, в присутствии инертного растворителя или смесей растворителей, включая двухфазные смеси (такие как вода и метиленхлорид или другой орга нический раство ритель). С целью ускорения этой реакции может быть прибавлено основание, такое как триэтиламин, пиридин, гидроокись щелочного металла и/или каталитическое количество катализатора фазового переноса, такого как хлористый бензилтриалкиламмоний или другая аммониевая соль. Температура реакции нахо дится в пределах от -20оС до точки кипения применяемого растворителя. Продолжительность реакции варьируют от нескольких минут до 48 часов в за висимости от количеств применяемых реагентов и температуры реакции. Продукт вы деляют после окончания реакции путем фильтрации и/или концентрирования реакционной смеси. При необхо димости продукт очи щают стандартными методами, такими как экстракция, кристаллизация, колоночная хроматография и т.д. Соединения, требуемые в качестве исходных материалов для способов IX–XI, получаются путем вышеприве денных способов II– VIII. А. На первой стадии этого двухста дийного процесса соединения в соответствии с формулой L превращают в соединения формулы М восстановлением нитрорадикала в радикал амина и последующей циклизацией. Выбором условий реакции можно получить либо нециклизованный амин (соединения формулы L, где нитрорадикал замещается радикалом амина), либо циклизованный продукт. Как правило, условия реакции выбираются таким образом, чтобы циклизованный продукт получался непосредственно. Аль тернативно нециклизованный амин может быть выделен стандартным методом и циклизован с получением соединения формулы М в отдельной стадии с использованием стандартных условий. Восстановители, применяемые в кислой среде, включают (но не ограничивают этим перечнем) металлы, такие как железо, цинк или олово. Растворитель, используемый в реакции, может включать органические или неорганические кислоты, та кие как уксусная или хло ристоводородная кислота, и может быть использован либо как концентрированный кислый раствор или разбавленные водные растворы. Температура реакции нахо дится в пределах от 0оС до 200оС, предпочтительно от 10оС до 120оС. Продолжительность реакции может быть выбрана в пределах от немногих минут до нескольких недель в зависимости от количеств реагентов, температуры реакции и т.д. По оконча нии реакции про дукт вы де ляют разбавле нием реакционной сме си во дой и выделяют та ким мето дом, как кристалли зация и экстракция ра ство рите лем. Если необхо ди мо, продукт о чи ща ют стан дартными ме то дами. Способ IX. При описании этого способа соединения в соответствии с формулой N получаются из соединений в соответствии с формулой М (соединения формулы II, где R6 представляет собой YCH2-q (R28)q COOR29 , R7–нитрорадикал, Y имеет вышеуказанное значение, q целое число от 0 до 2, а радикалы R28–30 определены выше для указанных R4-чле нов), как описывается ниже. Альтернативно соединения формулы L могут быть восста новлены каталитическим гидрированием. Ката лизато ры, подхо дящие для каталитического гидрирования, которое может быть осуществлено при нормальном или повышенном давлении, включают никель Ренея, палладий на угле, 13 39167 палладиевую чернь, палла дий на любом подходящем но сите ле и т.д. Ра ство ры включают любой инертный растворитель, кото рый заметно не препятствуе т реакции, включая спирты, эфиры и т.д. Вы бором условий реакции можно получить ли бо нециклизован ный амин (соединения фор мулы М, в кото рой нитрорадикал замещен аминовым радикалом), или цикли зован ный продукт. Как прави ло, условия реакции выбирают та кими, что бы непосредствен но получался циклизованный продук т. С др угой сто роны, не циклизованный амин может быть вы делен стандартными мето дами и цикли зован с по лучением соединений фор мулы М в отдельной ста дии с использова нием стандартных условий. Про дукт после оконча ния реакции выде ляют фильтрацией и концентрированием реакционной смеси. Если необхо димо, продукт очи щают стан дартными мето дами, та кими как экстракция, кристаллизация, хро матография на колонках и т.д. В. В этой ста дии про дукт со ста дии А превращают в сое динения фор мулы N. Образование продук тов, оп ределенных вы ше, может прово диться путем обработки соединений формулы М алкилир ующим аген том, та ким как алкилгалоид или алкилсульфо нат, например мети лиодид, а ллилбромид, пропаргилбромид, мети ловый эфир фе нилсуль фо кислоты и т.д., или ацилирующим агентом. Реакция может быть осуществлена в подхо дящем раство рите ле или смеси раство рителей, с ка тали зато ром или без ката лизато ра, в присутствии или отсутствии основания. Предпочтитель ными растворите лями являются диметилсульфок сид, аце тон, ди метилфор мамид, диоксан и т.д. или смеси растворите лей, включая двухфаз ные смеси (та кие как вода и мети ленхло рил или др угой ор ганический раство ритель). В случае двух не смеши вающи хся жидких фаз желатель но добавлять ката лизатор фа зового переноса, та кой как бензилтриалкила монийга лоид или др угая аммониевая соль. Основанием может быть орга ническое основание (та кое как триалкиламин или др угой ор ганический амин) или неорга ническое основание, такое как карбонат или гидроокись калия или натрия. Температура реакции нахо дится в пределах о т 0оС до 200оС , предпочтитель но от 10оС до 120оС. Продолжитель ность реакции может быть выбрана в пределах от немноги х ми нут до нескольких не дель в за ви симости от количества реагенто в, тем пературы реакции и т.д. Про дукт после оконча ния реакции выде ляют фильтрацией и/или концентрирова нием реакционной смеси. Если необхо ди мо, продукт очи ща ют стан дартными мето дами, та кими как экстракция, кристаллизация, хро мато графия на колонках и т.д. Способ X. При описании этого способа соединения в соответствии с формулой Q, в которой R33 не является водородом, получают из соединений согласно формуле О (соединения формулы II, в которой R6 представляет собой нитрорадикал, R7 YCH2-r(R31)r–COOR 32 , Y имеет вышеуказанное значение, r представляет собой целое число от 0 до 2, а радикалы R31–33 определены ранее для R4членов. А. На первой стадии этого двухста дийного способа соединения в соответствии с формулой О превращают в соединения формулы Р восстановлением нитрорадикала в радикал амина и последующей циклизацией. Выбором условий реакции можно получить либо нециклизованный амин (соединения формулы Н, в которой нитрорадикал замещен аминовым радикалом), либо циклизованный продукт. Как правило, условия реакции выбираются так, чтобы получать непосредственно циклизованный продукт. Вп рочем, нециклизованный амин может быть выделен стандартными методами и циклизован с получением соединения формулы Р в отдельной стадии с использованием стандартных условий. Восстановители, подхо дящие в кислой среде, включают (не ограничены этим перечнем) металлы, такие как железо, цинк или олово. Растворитель, применяемый в реакции, может включать либо органические, либо неорганические кислоты, та кие как уксусная или хлористо водородная кислота, и может быть применен в виде концентрированных кислых растворов или разбавленных водных растворов. Температура реакции нахо дится в пределах от 0оС до 200оС, предпочтительно от 10оС до 120оС. Продолжительность реакции может быть выбрана в пределах от немногих минут до нескольких недель в зависимости от количества реагентов, температуры реакции и т.д. По окончании реакции продукт отделяют разбавлением реакционной смеси водой и затем выделяют такими мето дами, как кристаллизация или экстракция растворителем. Если необходимо, продукт очи щают стан дартными методами. Альтернативно соединения формулы О могут быть восста новлены каталитическим гидрированием. Ката лизато ры, подхо дящие для каталитического гидрирования, которое может проводиться при нормальном или повышенном давлении, включают никель Ренея, палладированный уголь, палладиевую чернь, палладий на любом подхо дящем носителе, окись палладия, плати ну, платиновую чернь и т.д. Растворители включают любой инертный растворитель, заметно не препятствующий реакции, включая спирты, эфи ры и т.д. Выбором условий реакции можно получить либо нециклизованный амин (соединения формулы О, в которой нитрорадикал замещен аминовым радикалом), либо циклизованный продукт. Как правило, условия реакции подбираются так, чтобы непосредственно получать циклизованный продукт. Впрочем, нециклизованный амин может быть выделен стандартными методами и циклизован, ис 14 39167 пользуя стандартные условия. Продукт изолируют по окончании реакции путем фильтрации или концентрированием реакционной смеси. Если необхо димо, продукт очищают стандартными методами, такими как экстракция, кристаллизация, хроматография на колонках и т.д. Б. На этой стадии продукт со стадии А превращают в соединения формулы Q, в которой R33 не является водородом. Образование продуктов, определенных выше, может быть проведено обработкой соединений формулы Р алкилирующим агентом, таким как алкилгалоид или алкилсульфонат, например метилиодид, алкилбромид, пропаргилбромид, метиловый эфир фенилсульфоновой кислоты и т.д., или ацилирующим агентом. Реакция может быть проведена в любом подходящем растворителе или смеси растворителей, с катализатором или без катализатора, в присутствии или отсутствии основания. Предпочтительными растворителями являются диметилсульфоксид, ацетон, диметилформамид, диоксан и т.д. Основанием может быть органическое основание (такое как триалкиламин или другой органический амин) или неорганическое основание, такое как карбонат или гидроксид калия или натрия. Температура реакции находится в пределах от 0оС до 200оС, предпочтительно от 10оС до 120оС. Продолжительность реакции может быть выбрана в пределах от немногих минут до нескольких недель в зависимости от количеств реагентов, температуры реакции и т.д. Продукт выделяют после окончания реакции фильтрацией и/или концентрированием реакционной смеси. Если необхо димо, продукт очищают стандартными методами, такими как экстракция, кристаллизация, хроматография на колонках и т.д. Способ XI. Этот раздел описывает способ получения соединений в соответствии с формулой S из соединений формулы R (соединения формулы II, в которой R6 является аминовым радикалом, R7 представляет собой YC(R34)sCCR35, Y имеет вышеуказанное значение, s есть целое число от 0 до 2, а радикалы R34–36 являются ранее определенными R4-членами). I) и других медных солей и их смесей, и алкилнитратом или органическим нитритом, таким как т-бутилнитрит. Температура реакции находится в пределах от 0оС до 200оС, предпочтительно от 10оС до 120оС. Продолжительность реакции может быть выбрана в пределах от немногих минут до нескольких недель в зави симости от количеств реагентов, температуры реакции и т.д. Продукт выделяют после окончания реакции фильтрацией и/или концентрированием реакционной смеси. Если необхо димо, продукт очищают стандартными методами, такими как экстракция, кристаллизация, колоночная хроматография и т.д. Способ XII. Этот способ описывает получение соединений формулы U, V, W, X, Y или Z (соединения формулы II, в которой заместитель R7 представляет собой алкил, замещенный алкил, галоидалкил, карбоксальдегид, карбоновую кислоты или производное карбоновой кислоты, такое как CXYR8 или CXR9) из соединений формулы Т. Радикалы R37 и R38 имеют то же значение, которое было ранее определено для R4-членов, а X1 и X2 являются галогенами. Схемы процесса показаны ниже. W В первой стадии этого процесса соединения формулы Т превращаются либо в соединения формулы U или W, либо в смесь этих продук тов. Любой инертный растворитель может быть использован в этой реакции, который не препятствуе т заметно протеканию реакции. Такие растворите ли включают, но не исчерпываются этим перечнем, органические кислоты, неорганические кислоты, углеводороды, галогенированные углеводороды, аромати ческие углеводороды, эфи ры, сульфоксиды или сульфо ны. Галогенирующие агенты, подхо дящие для вы шеуказанных реакций, включают бром, хлор, N-бромсукцинамид, N-хлорсукцинамид, сульфурилхлорид и т.д. С некоторы S Способ получения соединений формулы S исходит из соединений формулы R. В этой реакции может применяться любой подхо дящий растворитель, хотя предпочти тельны безводные растворите ли, такие как ацетонитрил. Раствор или суспензию соединения формулы R обрабатывают медными солями, включая галогениды меди (II), галогениды меди (I), смеси галогенидов меди (II и 15 39167 ми галогенирующи ми агентами желательно использовать органическую перекись или свет в качестве ката лизато ра. Количество галогенирующего агента может варьировать от менее чем один моль до избытка. Температура реакции нахо дится в переделах от -78оС до 200оС, предпочти тельно от 10оС до 120оС. Продолжительность реакции может быть выбрана от немногих минут до нескольких недель в зависимости от количества реагентов, температуры реакции и т.д. По окончании реакции продукт или продукты выделяют, разбавляя реакционную смесь водой и выделяя продукт (продукты) таким методом, как кристаллизация или экстракция растворителями. Если необхо димо, продукт (продукты) очищают стандартными методами. Соединения формулы U могут быть превраще ны в соединения формулы V замеще ния радикала галогена X1 подходящим нуклеофилом. Образование продуктов формулы С может происходить в результате обработки соединений формулы U анионом алкоксида, тиоалкоксида, цианида, амина, алкила или арила и т.д. или спиртом, меркапта ном, амином и т.д. в присутствии основания в любом подходящем растворителе или смеси растворителя. Предпочтительными растворителями являются диметилсуль фоксид, ацетон, диметилформамид, диоксан, вода и т.д. или смесь раство рителей, включая двухфазные смеси (такие как вода и метиленхлорид или другой органический растворитель). Основанием может быть органическое основание (такое как триалкиламин или другой органический амин) или неорга ническое основание (карбонат щелочного металла, такой как карбонат калия или карбонат натрия или гидроокись щелочного металла, такая как гидроокись натрия). В случае двух несмешивающи хся жидких фаз желательно добавлять катализатор фа зового переноса, такой как бензилтриалкиламмонийгалоид или другая аммониевая соль. Температура реакции нахо дится в переделах от -78оС до 200оС, предпочтительно от 10оС до 120оС. Продолжительность реакции может быть выбрана в пределах от немногих минут до нескольких недель в зависимости от количеств реагентов, температуры реакции и т.д. Продукт отделяют после окончания реакции фильтрацией и/или концентрированием реакционной смеси. Если необхо димо, продукт очищают стан дартными методами, такими как экстракция, кристаллизация, колоночная хроматография и т.д. Образование продуктов фор мулы X может происходить в результате кислотного гидролиза соединений формулы W. Для осуществления кислотного гидролиза соединения формулы W подвергают действию избытка минеральной кислоты, такой как хлористо водородная или серная кислоты, причем предпочтителен избыток серной кислоты. Температура реакции нахо дится в переделах от 0оС до точки кипения инертного растворите ля, предпочтительно от 10оС до 120оС. Продолжительность реакции может быть выбрана от немногих минут до нескольких недель в зависимости от количеств реагентов, температуры реакции и т.д. По окончании реакции продукт или продук ты отделяются разбавлением реакционной смеси водой и выделяются, например, методами кристаллизации или экстракции растворителем. Если необходимо, продукт (продукты) очищают стандартными методами. Соединения формулы Y получаются окислением соединений формулы X. В этой реакции можно пользоваться любым инертным растворителем, включая углеводороды, ароматические углеводороды, пиридин и его производные, воду и т.д. Применяемые окислители включают, но не ограничиваются этим перечнем, перманганат калия или дихромат калия. Температура реакции находится в переделах от -50оС до точки кипения инертного растворителя, предпочти тельно от 10оС до 120оС. Продолжительность реакции может быть выбрана в пределах от немногих минут до нескольких недель в зави симости от количеств реагентов, температуры реакции и т.д. По окончании реакции продукт или продукты отделяют разбавлением реакционной смеси водой и выделением таким методом, как кристаллизация или экстракция растворителем. Если необхо димо, продукт (продукты) очищают стандартными методами. Последняя стадия этого процесса включает преобразование соединений формулы Y в соединения формулы Z посредством любого из целого ряда стандартных способов получения производных карбоновых кислот. Эта ста дия процесса является этерификацией или реакцией амидообразования. Это может быть осуществлено непосредственно из соединений формулы Y или че рез соль щелочного металла соединения формулы Y. Этерифи кацию можно проводить, используя избыток спирта, соответствующе го целевому эфи ру, в присутствии минеральной кислоты (например, серной кислоты). Производные амида могут быть получены обработкой соединения формулы Y желаемым аминоэфиром без растворителя или в прохо дящем растворите ле. Реакции этерификации или амидообразования могут быть также проведены в присутствии инертного растворителя и дегидратирующе го агента. Альтернативно соединения формулы Y могут быть превращены в га лоидангидрид или ангидрид кислоты и обработаны спиртом или амином. Приготовление галоидангидрида кислоты осуществляется в присутствии галогенирующего агента, та кого как тионилхлорид, пяти хлористый фосфор, оксалилхлорид и т.д. (этот перечень не исчерпывающий) в присутствии инертного растворите ля или без растворите ля. Может быть использован любой инертный растворитель, который не препятствует реакции. Может быть добавлено каталитическое количество аминового основания, такого как триэтиламин, пиридин или диметилформамид или тому подобное, для ускорения этой реакции. Температура реакции нахо дится в переделах от -20оС до точки кипения использованного растворителя. Продолжительность реакции находится в пределах от нескольких минут до 48 часов в зависимости от количеств применяемых реагентов и температуры реакции. По окончании реакции избыточный галогенирующий агент и растворитель (раство рители) уда ляют из продукта реакции выпариванием или дистилляцией. Галоидангидрид кислоты обрабатывают спиртом или амином, получая соединение формулы Z. Реакция может быть проведена в отсутствии растворителя, в при 16 39167 сутствии инертного растворителя или со смесью растворителей, включающей двухфазные смеси (такие как вода и мети ленхлорид или другой органический растворитель). С целью ускорения этой реакции может быть добавлено основание, такое как триэтиламин, пиридин, щелочной металл, и/или каталитическое количество катализатора фа зового переноса, такого как бензилтриалкиламмонийгалоид или другая аммониевая соль. Температура реакции нахо дится в переделах от -20оС до точки кипения применяемого растворите ля. Продолжительность реакции составляет от нескольких минут до 48 часов в зависимости от количеств применяемых реагентов и температуры реакции. Продукт выделяют после окончания реакции фильтрацией и/или концентрацией реакционной смеси. Если необхо димо продукт очищают стандартными мето дами, такими как экстракция, кристаллизация, колоночная хроматография и т.д. Способ XIII. Этот раздел описывает способ получения соединений в соответствии с формулой I, в которой один из R4-остатков является тиоловой группой (формула АА), исходя из соединений в соответствии с фор мулой I. По окончании реакции продукт отделяют разбавлением реакционной смеси водой и продукт затем выделяют та ким методом как кристаллизация или экстракция растворителем. Если необходимо, продукт очи щают стандартными мето дами. Способ XIV. Этот раздел описывает способ получения соединений согласно формуле I, в которой один из R4-остатков представляет собой циклический (тио)кетальный или (тио)ацетальный радикал (формула СС), исходя из соединений в соответствии с фор мулой BB. R39 представляет собой водород или ранее определенный R4-член, А и В представляют собой незави симо О или S, а n является целым число от 0 до 2. В этом способе желаемые соединения формулы СС готовятся из соединений формулы ВВ превращением карбионильной группы в циклическую (тио)ацетальную или (тио)кетальную гр уппу. Альдегидная или кетонная группа соединения формулы ВВ обрабаты вается диолом, дитиолом или гидроксиотилом. Может быть использован любой растворитель, который не препятствует прогрессу реакции, такой как галогенированные углеводороды, аромати ческие углеводороды, эфи ры, алкилнитрилы, минеральные кислоты и т.д. Альтернативно реакция может быть проведена в отсутствии растворителя. Как правило, реакция может проводиться в присутствии кислоты, та кой как минеральные кислоты, органические кислоты и т.д. Температура реакции находится в переделах от 25оС до точки кипения применяемого растворителя. Продолжительность реакции может быть выбрана в пределах о т немногих минут до нескольких недель в зависимости от количеств реагентов, температуры реакции и т.д. По окончании реакции продукт или продукты выделяют концентрированием реакционной смеси и очищают таким методом, как кристаллизация или экстракция растворите лем. Если необходимо, продукт (продукты) подвергают дальнейшей очистке стандартными методами. Способ XV. Этот раздел описывает способ получения соединений согласно формуле DD, исхо дя из соединений согласно формуле BB. В этом способе желаемые продук ты получают путем приготовления производного галоидсульфо нила и последующего восстановления с получением соединений АА. Мо жет быть использован любой растворитель, который не препятствуе т течению реакции, такой как галогенированные углеводороды, эфиры, алкилнитрилы, минеральные кислоты, и т.д. Для образования производных хлор сульфонила предпочтителен избыток хлорсуль фоновой кислоты как в качестве реагента, так и в качестве растворите ля. Температура реакции нахо дится в переделах от 25оС до точки кипения применяемого растворителя. Продолжительность реакции может быть выбрана в пределах от немногих минут до нескольких недель в зависимости от количеств реагентов, температуры реакции и т.д. После окончания реакции продукт или продукты отделяются разбавлением реакционной смеси водой, и продукты затем выделяются таким методом, как кристаллизация или экстракция растворителем. Если необходимо, продукт (продукты) очищаются стандартными мето дами. Восстановление производного га лоидсульфо нила может проводиться в органических или неорганических кислотах, таких как уксусная кислота или хлористоводородная кислота или смесях указанных кислот в инертных растворите лях. Восстанови тели, подхо дящие в кислой среде, включают, но не ограничены этим перечнем, металлы, такие как железо, цинк или олово. Температура реакции нахо дится в переделах от 0оС до 150оС, предпочтительно от 10оС до 150оС. Продолжительность реакции может быть выбрана в пределах от немногих минут до несколько недель в зависимости от количеств реагентов, температуры реакции и т.д. R39–41 представляют собой прежде определенные R4-члены. Соединения формулы DD получают конверсией кетонной или альдегидной группы соединений формулы ВВ в алкеногруппу. Пре 17 39167 образование может быть осуществлено обработкой соединения формулы ВВ реактивом типа реактива Витти га, таким как алкилиденфосфоран, илиды, полученные из солей фосфо ния или эфиров фосфо ния, алкилиденсульфураны и т.д. Подхо дящие растворители включают, но не ограничиваются этим перечнем, ароматические углеводороды, спирты, алканы, эфиры, галогенированные углеводороды и т.д. Температура реакции находится в переделах от -50оС до точки кипения применяемого растворителя. Продолжительность реакции может быть выбрана от немногих минут до нескольких недель в зависимости от количеств реагентов, температуры реакции и т.д. По окончании реакции продукт или продукты вы деляют путем концентрирования реакционной смеси и продукт (продук ты) затем очищают методом кристаллизации или экстракции растворителем. Если необходимо, продукт (продукты) подвергают дальнейшей очистке стандартными методами. Способ XVI. Этот раздел описывает способ получения соединений в соответствии с формулой ЕЕ, исходя из соединений согласно формуле ВВ. ного металла, такие как гидроокись натрия. Продолжительность реакции может быть выбрана в пределах от немногих минут до нескольких недель в зависимости от количеств реагентов, температуры реакции и т.д. По окончании реакции продукт или продук ты выделяют концентрированием реакционной смеси и, продукт (продук ты) очищают такими методами, как кристаллизация или экстракция растворителем. Если необхо димо, продукт (продукты) подвергают дальнейшей очистке. Нижеследующие примеры 1–42 описывают конкретные варианты осуществления способа получения предста вителей соединений в соответствии с настоящим изобретением. Примеры 1–4 описывают конкретные воплоще ния способа I. Пример 1. Этот пример описывает получение 3-(2,5дифторфе нил)-1-метил-5-(трифторметил)-1Н-пиразола (соединение № 40) и 5-(2,5-дифторфенил)1-метил- 3-(трифторметил)-1Н-пиразола (соединение № 20). А. 28,5 г 2,5-дифторацетофенона и 26 г этилового эфира трифторуксусной кислоты перемешивали в 400 мл безводного эфира и охлаждали в ледяной бане. Затем прибавляли в течение более 5 минут 42 мл 25%-ного (вес.) раствора метоксида натрия в метаноле. После перемешивания в течение 1 часа при комнатной температуре реакционную смесь экстрагировали водой, воду подкисляли и экстрагировали метиленхлоридом, получая 42 г 1-(2,5-дифторфенил)-3-(трифторметил)-пропан-1,3-дион. В. 34,5 г 1-(2,5-дифторфе нил)-3-(трифторметил)-пропан-1,3-дион растворяли в 250 мл уксусной кислоты и медленно добавляли к раствору 9,5 мл метилгидразина. Смесь нагревали при 100оС в течение 5 минут, затем охлаждали и разбавляли водой. Раствор эфира промывали водой и раствором карбоната калия, затем сушили сульфа том магния, фильтровали и концентрировали. Остаток хроматографи ровали, получая 9,5 г 3-(2,5-дифторфе нил)-1-метил-5-(трифторметил)-1Н-пиразола. Аналитич. рассчитано для С 11Н7N2F5 : C 50,39%, H 2,69%, N 10,68% найдено: C 50,48%, H 2,72%, N 10,64%. и 21,11 г 5-(2,5-дифторфе нил)-1-(метил-3трифторметил)-1Н -пиразол (т.пл. 38–39оС). Аналитич. рассчитано для С 11H7N2F5 : C 50,39%, H 2,69%, N 10,68%, найдено: C 50,63%, H 2,65%, N 10,40%. Пример 2. Этот пример описывает получение 5-(2,4дифторфе нил)-3-(трифторметил)-1Н-пиразола (соединение № 6). А. К раствору 40,0 г (0,256 моля) 2', 4'-дифторацетофе нона (имеющегося в продаже) в 400 мл диэтилового эфира при 0оС прибавляли (0,405 моля) этилового эфи ра трифторуксусной кислоты. При 5оС добавляли в течение более 15 минут 80 мл 25%-ного (вес.) раствора метоксида натрия в метаноле (0,37 моля). Реакционную смесь перемешивали в течение ночи при 25оС. Смесь выливали на 300 мл ледяной воды и добавляли 21,3 мл (0,37 моля) уксусной кислоты. Органический слой дважды промывали водой, суши ли над безводным MgSO4 и концентрировали в вакууме, получая 62,85 г (97%) 4-(2,4-дифторфенил)-1,1,1 R39 и R42 представляют собой прежде определенные R4-члены. В этой стадии процесса соединения формулы ЕЕ, которые имеют оксимный заместитель в качестве одного из фенильных радикалов, получают из соединений формулы ВВ. Кетонный или альдегидный заместитель соединения формулы ВВ может быть превращен в оксим любым из двух методов. Исходный альдегид или кетон формулы ВВ может быть обработан О-замещенным оксимом с получением оксима формулы ЕЕ. Из этого соединения в дальнейшем могут быть получены производные стандартными методами, известными специалисту. Примеры этого подхо да включают, но не ограничиваются этим, обработку альдегида или кетона (аминокси) уксусной кислоты или другой 2-(аминоокси)карбоновой кислотой и конверсию получающейся карбоновой кислоты в любое из целого ряда производных карбоновой кислоты, как то: амиды, сложные эфиры, сложные тиоэфиры и т.д. Альтернативно оксим может быть получен обработкой соединений формулы ВВ гидроксиламином или гидроксиламиновыми солями. Получающий ся оксим может быть алкилирован с получением производных путем обработки алкилирующим агентом, таким как галоидалкилы, алкилсуль фонаты и т.д. Подходящими для вышеуказанных реакций включают, но не ограничены этим перечнем, ароматические углеводороды, алканы, эфиры, спирты, галогенированные углеводороды и т.д. Температура реакции нахо дится в переделах от -50оС до точки кипения применяемого растворителя. Реакция может быть проведена с основанием или без основания. В случаях применения основания им может быть ацетат натрия, карбонаты ще лочных металлов, такой как карбонат натрия, или гидроокиси щелоч 18 39167 трифтор-4-гидрокси-3-бутен-2-она в виде желтого масла. 1Н–ЯМР (CDCl3), ч./млн: 6,61 (с, 1Н), 6,87 (м, 1Н), 6,97 (м, 1Н), 7,97 (м, 1Н). Аналитич. рассчитано для С 10Н5F5O2 : C 47,64%, H 2,00% найдено: C 47,70, H 1,96%. В. При 24оС 15,0 г (0,06 моля) продукта стадии А растворяли в 50 мл ледяной уксусной кислоты и обрабатывали 2 мл (0,064 моля) безводного гидразина, добавляемого в те чение более 5 минут. Реакционную смесь нагревали до 95оС в течение 30 минут. Реакционную смесь охлаждали и выливали в 300 мл ледяной воды. Суспензию отфильтровывали, и осадок на фильтре промывали водой и сушили воздухом, получая 13,86 г (94%) 5-(2,4-дифторфенил)-3-(трифторметил)-1Н-пиразола в виде твердого вещества белого цвета, т.пл. 157–158оС. Аналитич. рассчитано для С 10Н5F5N2 : C 48,40, H 2,03, N 11,29 найдено: C 48,38, H 2,03, N 11,32. Пример 3. Этот пример описывает получение 3-(2,4дифторфе нил)-1-метил-5-(трифторметил)-1Н-пиразола (соединение № 42) и 5-(2,4-дифторфенил)1-метил-3-(трифторметил)-1Н-пиразола (соединение № 21). Суспензию 13,6 г (0,055 моля) продукта стадии Б, 7,7 г (0,056 моля) K2CO3 и 3,7 мл (0,06 моля) метилиодида в 150 мл ацетона перемеши вали в те чение ночи при 25оС. Раствор разбавляли 300 миллилитрами холодной воды и экстрагировали трижды этилацетатом. Этилацетатные вытяжки промывали рассолом, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очища ли хроматографи чески, используя 5%-ный этилацетат в гексане в качестве элюента, получая 78,3 г (58%) 3-(2,4-дифторфе нил)-1-метил-5(трифторметил)-1Н-пиразола в ви де твердого вещества белого цвета, т.пл. 51оС. Аналитич. рассчитано для С 11Н7F5N2 : C 50,39, H 2,69, N 10,68. найдено: C 50,36, H 2,70, N 10,70. С помощью хроматографии, описанной в вышеприведенном способе приготовления, получали вторую фракцию, которую со бирали, концентрировали и оста ток кристаллизовали, получая 4,0 г (28% выход) 5-(2,4-дифторфе нил)-1-метил-3(трифторметил)-1Н-пиразола в ви де твердого вещества белого цвета, т.пл. 37–38оС. Аналитич. рассчитано для С 11Н7F5N2 : C 50,39, H 2,69, N 10,68 найдено: C 50,40, H 2,67, N 10,67. Пример 4. Этот пример описывает приготовление 3-(2,5-дифторфе нил)-1-метил-5-(трифторметил)-1Н-пиразола (соединение № 40). Раствор 8,5 г (34 ммоля) сухого 5-(2,5-дифторфенил)-1Н-3-(трифторметил)-1Н-пиразола в 100 мл безводного толуола нагревали с обратным хо лодильником в аппарате, оснащенном ловушкой Дина-Старка, и обрабатывали 3,25 мл диметилсульфа та. Смесь нагревали с обратным холодильником 5 часов, давали остыть и промывали 10%ным (вес./об.) водным NaOH. Органическую фа зу сушили MgSO 4 и концентрировали, получая 7,74 г (86,2%) прозрачного почти бесцветного масла, nD 1,4925 (25о). Аналитич. рассчитано для С 11Н7N2F5 : C 50,39, H 2,69, N 10,68% найдено: C 50,48, H 2,72, N 10,64%. Примеры 5–7 описывают конкретные воплоще ния способа 11. Пример 5. Этот пример описывает приготовление 4хлор- 5-(2,5-дифторфе нил)-1-метил-5-(трифторметил)-1Н-пиразола (соединение № 361). При 25оС 5,24 г (0,02 моля) 3-(2,5-дифторфе нил)-1-метил-5-(трифторметил)-1Н-пиразола растворяли в 40 мл ледяной уксусной кислоты и в течение более 1 часа барботировали 2,1 г (0,03) моля хлоргаза. Реакционную смесь перемешивали 2 часа. Реакционный раствор выливали в 200 мл ледяной воды и экстрагировали этилацета том. Органический слой промывали водой, насыщенным раствором NaHCO3, рассолом и сушили над безводным MgSO4 и десорбировали в вакууме. Оста ток очища ли хроматографически с использованием 3%-ного раствора этилацетата в гексане в качестве элюента, получая 5,87 г (99%) 4-хлор- 5(2,5-дифторфе нил)-1-метил-5-(трифторметил)-1Нпиразола в ви де легкого желтого масла, nD25 1,4977. Аналитич. рассчита но для С 11Н6Cl1F5N2 : C 44,56, H 2,04, N 9,44, Cl 11,95%. найдено: C 44,53, H 2,00, N 9,44, Cl 11,94%. Пример 6. Этот пример описывает получение 4-хлор- 3-(2,5-дифтор-4-нитрофенил)-1-метил5-(трифторметил)-1Н-пиразола (соединение № 389). К 5,00 г 3-(2,5-дифтор-4-нитрофенил)-1-метил-5-(трифторметил)-1Н-пиразола, растворенным в 50 мл уксусной кислоты, прибавляли 15 мл сульфурилхлорида. Смесь мягко орошали 2 мл порциями сульфурилхлорида, добавляемыми каждые 15 минут. После 6 часов смесь охлаждали, затем разбавляли водой и экстрагировали эфиром. Эфир промывали трижды водой, сушили безводным сульфатом магния, фильтровали и концентрировали. Оста ток хроматографи ровали, получая количественный выход 4-хлор- 3-(2,5-дифтор-4нитрофе нил)-1-метил-5-(трифторметил)-1Н-пиразола. Аналитически рассчитано для C11H5N3O2Cl1F5: C 38,67, H 1,48, N 12,30% найдено: C 38,73, H 1,48, N 12,34%. Пример 7. Этот пример описывает получение 4-хлор3-(4-хлор-2 -фтор -5-ме токси фе нил)-1-(1-ме тилэтил) -5-(трифторметил)-1Н-пиразола (соединение № 489). К раствору 1,6 г 3-(4-хлор-2-фтор-5-метоксифе нил)-1-(1-метилэтил) -5-(трифторметил)- 1Н-пиразола в 20 мл диметилформамида прибавляли 2,0 г N-хлорсукцинимида. Раствор нагревали до 80оС в те чение 2 часов, давали остыть и вы ливали в ледяную во ду. Водную смесь экстрагировали трижды метиленхлоридом, объединенные органические вытяжки промывали водой, суши ли MgSO4 и концентрировали, получая сырое масло. Масло очищали хроматографией и перегоняли из колбы в колбу, получая 1,54 г 4-хлор- 3-(4-хлор-2-фтор-5метоксифе нил)-1-(1-метилэтил)-5-(трифторметил)1Н-пиразола в ви де желтого масла, nD 1,5192 (24oC). 19 39167 Аналитически рассчитано для С 14H12N2O1F4Cl1: C 45,31, H 3,26, N 7,55% найдено: C 45,19, H 3,27, N 7,49%. Примеры 8–10 описывают конкретные воплощения способа III. Пример 8. Этот способ описывает получение 3-(2,5дифтор-4-нитрофе нил)-1-метил-5-(трифторметил)- 1Н-пиразола (соединение № 388). К охлажденному льдом раствору 50 мл дымящей азотной кислоты (90%) медленно прибавляли 8,29 г 3-(2,5-дифторфе нил)-1-метил-5-(трифторметил)- 1Н-пиразола. После добавления смеси давали нагреться до комнатной температуры и затем осторожно нагревали до 52оС. Нагрева ние вели 2,5 часа, затем охлаждали и выливали на лед. Образовавшуюся смесь экстрагировали эфиром, который затем промывали дважды водой, суши ли безводным сульфа том натрия, фильтровали и растворитель удаляли путем концентрирования под вакуумом. Остаток очища ли, используя комбинацию хроматографии и кристаллизации, получая 5,62 г 3-(2,5-дифтор-4-нитрофе нил)-1-метил-5(трифторметил)- 1Н-пиразола, т.пл. 80–81оС. Аналитически рассчитано для С 11Н6N3O2 F5: C 43,01, H 1,97, N 13,68% найдено: C 42,99, H 1,97, N 13,68%. Пример 9. Этот пример описывает получение 4-бром3-(2,5-дифтор-4-нитрофенил)-1-метил-5-(трифторметил)- 1Н-пиразола (соединение № 396). При 15оС 9,5 г (0,03 моля) 4-бром- 3-(2,5дифторфе нил)-1-метил-5-(трифторметил)- 1Н-пиразола медленно добавляли к 100 мл дымящей азотной кислоты. Реакцию нагревали до 28оС в течение периода 20 минут. Реакционную смесь перемеши вали при 30оС в течение 4 часов. Смесь выливали в 500 мл льда. После перемешивания в течение 1 часа суспензию экстраги ровали трижды метиленхлоридом. Метиленхлоридные вытяжки промывали водой, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очища ли хроматографи чески, используя 10%-ный раствор этилацетата в гексане в качестве элюента, и получали 5,84 г (55%) 4-бром-3-(2,5-дифтор-4-нитрофе нил)- 1-метил-5-(трифторметил)- 1Н-пиразола в виде белого твердого вещества, т.пл. 45,5оС. Аналитически рассчитано для С 11H5Br1F5N3O2: C 34,22, H 1,31, N 10,88% найдено: C 34,25, H 1,38, N 10,76%. Пример 10. Этот пример описывает получение 4-хлор3-(2,5-дифтор-4-нитрофенил)-1-метил-5-(трифторметил)- 1Н-пиразола (соединение № 389). Раствор 5,9 г 4-хлор- 5-(2,5-дифторфе нил)1-метил- 5-(трифторметил)- 1Н-пиразола в 6 мл концентрированной H2SO4 охлаждали до 15оС и подвергали действию по каплям раствора 1,8 г 70% HNO3 в 2 мл концентрированной H2SO4. Реакционную смесь перемешивали при 30оС в течение 5 часов и затем обрабаты вали дополнительно 1,8 г 70%-ной HNO3. После перемешивания в течение ночи при комнатной температуре смесь выливали в 250 мл ледяной воды и экстрагировали метиленхлоридом. Метиленхлоридные вытяжки трижды промывали насыщенным водным NaHCO3, дважды водой, суши ли MgSO4 и концентрировали в вакууме. Полученный в результате материал хроматографи ровали через кремневый ангидрид, используя 10%-ный раствор этилацетата в гексане в качестве элюента, получая 3,93 г (58%) 4-хлор-3(2,5-дифтор-4-нитрофе нил)-1-метил-5-(трифторметил)- 1Н-пиразола. Аналитически рассчитано для С11H5N3O 2Cl1F5 : C 38,67, H 1,48, N 12,30% найдено: C 38,73, H 1,48, N 12,34%. Примеры 11–15 описывают конкретные воплощения способа IV. Пример 11. Этот пример описывает приготовление 4хлор-3-(2-фтор-5-метокси-4-нитрофе нил)-1-метил5-(трифторметил)-1Н-пиразола (соединение № 390). 5,04 г 4-хлор- 3-(2,5-дифтор-4-нитрофе нил)1-метил-5-(трифторметил)- 1Н-пиразола растворяли в безводном эфире и раствор охлаждали на ледяной бане, затем прибавляли 3,7 мл 25%-ного (вес.) раство ра метоксида натрия в мета ноле. После добавления ледяную баню удаляли и смесь перемеши вали в те чение 30 минут при комнатной температуре. Затем раствор экстраги ровали 4 раза водой, суши ли над безводным сульфа том магния, фильтровали и концентрировали. Остаток хроматографи ровали, получая 4,63 г 4-хлор-3-(2фтор-5-метокси-4-нитрофе нил)-1-метил-5-(трифторметил)- 1Н-пиразола, т.пл. 115–116оС. Аналитически рассчитано для C12H8N3O3Cl1F4: C 40,75, H 2,28, N 11,88% найдено: C 40,84, H 2,24, N 11,88%. Пример 12. Этот пример описывает получение 4-хлор-3(2-фтор-4-метокси-5-нитрофе нил)-1-метил-5-(трифторметил)-1Н-пиразола (соединение № 387). При 35оС 13,7 г (0,04 моля) 4–хлор–3–(2,4дифтор-5-нитрофе нил)-1-метил-5-(трифторметил)-1Н-пиразола, 5,5 г (0,04 моля) К2СО3 и 100 мл метанола перемешивали в те чение 1 часа. Реакционную смесь охлаждали, разбавляли 100 мл холодной воды и экстрагировали четыре раза этилацетатом. Этилацетатные вытяжки промывали рассолом, сушили над безводным MgSO4 и десорбировали в вакууме. Остаток очища ли хроматографи чески с использованием 25%-ного раствора этилацетата в гексане в качестве элюента, получая 13,0 г (90%) 4-хлор-3-(2-фтор-4-метокси-5-нитрофе нил)-1-метил-5-(трифторметил)-1Н-пиразола в ви де белого твер дого ве щества, т.пл. 116оС. Аналитически рассчитано для С 12H8Cl1F4N3O3: C 40,75, H 2,28, N 11,88% найдено: C 40,74, H 2,34, N 11,90%. Пример 13. Этот пример описывает получение (5-(4хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)4-фтор-2-нитрофе нил) тиоуксусной кислоты, этиловый эфир (соединение № 393). При 25оС 1,5 г (4,5 ммоля) 4-хлор- 3-(2,5дифтор-4-нитрофе нил)-1-метил-5-(трифторметил)- 1Н-пиразола, 0,69 г (5,0 ммоля) K2CO3, 0,55 мл (5,0 ммоля) этилового эфи ра меркаптоуксусной кислоты и 0,05 г (0,5 ммоля) CuF2 были суспендированыв 15 мл 1-метил-2-пирролидинона. Реакционную смесь перемешивали при 28оС в течение 24 часов. Смесь охлаждали, разбавляли 100 мл холодной воды и экстрагировали четыре раза этилаце 20 39167 татом. Этилацетатные вытяжки промывали рассолом, сушили над безводным MgSO4 и десорбировали в вакууме. Остаток очищали хроматографически, с использованием 10%-ного раствора диэтилового эфира и 15%-ного раствора метиленхлорида в гексане в качестве элюента, получая 0,86 г (43%) (5-(4хлор-1-метил-5- (трифторметил)-1Н-пиразол-3-ил)-4фтор-2-нитрофенил)тиоуксусную кислоту, этиловый эфир в виде твердого вещества желтого цвета, т.пл. 79оС. Аналитически рассчитано для C15H12Cl1F4N3O4S1: C 40,78, H 2,74, N 9,51, S 7,26% найдено: C 40,89, H 2,69, N 9,61, S 7,31%. Пример 14. Этот пример описывает приготовление (5(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3ил)-4-фтор-N- метил-2-нитро-N-пропилбензоламин (соединение № 402). При 25оС 6,83 г (0,02 моля) 4-хлор-3-(2,5дифтор-4-нитрофе нил)-1-метил-5-(трифторметил)-1Н-пиразола, 4,1 г (0,03 моля) К2СО3, 3,1 мл (0,03 моля) N-метил-N-пропиламина и каталитическое количество CuF2 суспендировали в 50 мл 1-метил-2-пирролидинона. Реакционную смесь перемеши вали при 35оС в течение 2 часов. Смесь охлаждали, разбавляли 100 мл холодной воды и экстрагировали четыре раза этилацета том. Этилацетатные вытяжки промывали рассолом, суши ли над безводным MgSO4 и де сорбировали в ва кууме. Остаток очищали хроматографи чески с использованием 15%-ного раствора этилацетата в гексане в качестве элюента, получая 6,8 г (86%) 5(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3ил)-4-фтор-N-метил-2-нитро-N-пропилбензоламина в виде оранжевого масла, nD25 1,5534. Аналитически рассчитано для С 15H15Cl1F4N4O2: C 45,64 H 3,83, N14,19% найдено: C 45,52, H 3,87, N 14,32%. Пример 15. Этот пример описывает приготовление (4(4-хлор-1-метил-5- (трифторметил)-1Н-пиразол-3ил)- 5-фтор-2-нитрофе нокси)уксусной кислоты, бутилового эфи ра (соединение № 498). Раствор 3,4 г (0,01 моля) 4-хлор-3-(2,4-дифтор-5-нитрофенил)- 1-метил-5-(трифторметил)-1Нпиразола и 1,4 мл (0,011 моля) бутилгликолата в 25 мл безводного ТГФ охлаждали до 0оС. Поддерживая температуру ниже 5оС, порциями добавляли 0,33 г (0,11 моля) NaH. Как только добавление было закончено, реакционной смеси давали нагреться до 25оС. После 3 часов смесь осторожно закаляли водой и экстрагировали этилацета том. Этилацетатные вытяжки промывали рассолом, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали хроматографи чески 20%-ным этилацетат/гексаном, получая 3,25 г (72%) (4-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-5-фтор-2-нитрофе нокси)уксусной кислоты, бути лового эфира в ви де легкого желтого масла, т.пл. 65оС. Этот пример описывает получение 4-хлор-3(4-хлор-2-фтор-5-метоксифе нил)-1-метил-5-(трифторметил)-1Н-пиразола (соединение № 312). А. К раствору 4,05 г 4-хлор-3-(2-фтор-5-метокси-4-нитрофе нил)-1-метил-5-(трифторметил)1Н-пиразола в 50 мл уксусной кислоты прибавляют 1,39 г (0,0249 моля) железного порошка. Реакционную смесь нагревали близко к орошению в течение 2 часов, обрабатывали 1,39 граммами железного порошка и нагревали близко к орошению еще один час. После охлаждения, концентрирования и хроматографии выделяли 3,54 г 4-хлор-3(4-амино-2-фтор-5-метоксифенил)-1-метил-5-(трифторметил)-1Н-пиразола. Б. 3,064 г 4-хлор-3-(4-амино-2-фтор-5-метоксифенил)- 1-метил-5-(трифторметил)-1Н-пиразола растворяли в 50 мл безводного ацетонитрила и прибавляли 1,90 г безводного хло рида меди (II). Затем по каплям добавляли в течение 10 минут 1,93 мл т-бутилнитрита (те хн. 90%), растворенного в 10 мл безводного ацетонитрила, еще 20 минут перемеши вали и затем концентрировали. Остаток собирали в этилацетат, экстрагировали трижды 10%-ной соляной кислотой, сушили безводным сульфа том магния, фильтровали, концентрировали и хроматографи ровали, получая 2,10 г 4-хлор3-(4-хлор-2-фтор-5-метоксифенил)-1-метил-5-(трифторметил)-1Н-пиразола, т.пл. 70–71оС. Аналитически рассчитано для С 12H8N2O1Cl1F4: C 42,01, H 2,35, N 8,16% найдено: C 42,15, H 2,34, N 8,18%. Пример 17. Этот пример описывает получение 2-хлор-5(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3ил)- 4-фтор-N-метил-N-пропилбензоламина (соединение № 166). А. Раствор 5,2 г (0,013 моля) 5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фтор-Nметил-2-нитро-N-пропилбензоламина в 100 мл уксусной кислоты нагревали до 80оС в атмосфе ре азота. Тепло и азот удаляли и прибавляли в течение 5 мин. тремя порциями 2,2 г (0,039 моля) железного порошка. Раствор перемешивали при 80оС еще 30 мин. Раствор охлаждали через Celiteâ . Фильтрат разбавляли 100 мл воды и экстрагировали трижды этилацетатом. Этилацетатные вытяжки промывали насыщен ным раствором NaHCO3, сушили над безводным MgSO4 и концентрировали в вакууме. Оста ток очища ли хроматографи чески с использованием 30%-ного раствора этилацетата в гексане в качестве элюента, получая 3,85 г (80%) 5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол3-ил)-4-фтор-N-метил-N-пропил-1,2-бензендиамина в виде легкого желтого масла, nD25 1,5352. Аналитически рассчитано для C15H17Cl1F4N4: C 49,39, H 4,70, N 15,36%. найдено: C 49,40, H 4,64, N 15,16%. Б. Все оборудование сушили пламенем в атмосфере азота. Раствор 3,35 г (9,2 моля) продукта стадии А в 60 мл ацетонитрила при 25 оС подвергали действию 0,9 г (9,2 ммоля) CuCl и 1,8 г (13,3 ммоля) CuCl2. В течение 5 минут прибавляли раствор 2,2 мл (18,4 ммоля) 90%-ного т-бутилнитрита. Через 2 часа смесь десорбировали при 28оС в вакууме. Оста ток от реакции собирали в этилацетате и промывали трижды 10%-ным раствором HCl, дважды рассолом и суши ли над безводным Аналитически рассчитано для С 17H16Cl1F4N3O5: C 45,00, H 3,55, N 9,26% найдено: С 44,97, Н 3,56, N 9,29%. Приме ры 16–19 описывают конкретные воплоще ния способа V. Пример 16. 21 39167 MgSO4 и концентрировали в вакууме. Остаток очища ли хроматографи чески с использованием 20%ного раство ра этилацетата в гексане в качестве элюента, получая 2,45 г (70%) 2-хлор-5-(4-хлор-1метил-5-(три фтор метил)-1Н-пи разол-3 -ил)-4 фтор-N-метил-N-пропилбензоламина в виде прозрачного бесцветного масла. nD25 1,5030. Аналитически рассчитано для C15H15Cl2F4N3: C46,89, H 3,94, N 10,94% найдено: C 46,84, H 3,83, N 10,93%. Пример 18. Этот пример описывает приготовление 4бром-3-(4-хлор–2-фтор-5-метоксифе нил)-1-метил5-(трифторметил)-1Н-пиразола (соединение № 313). А. Раствор 3,16 г (7,9 ммоля) 4-бром-3-(2фтор-5-метокси-4-нитрофе нил)-1-метил-5-(трифторметил)-1Н-пиразола в 59 мл уксусной кислоты нагревали до 80оС в атмосфе ре азота. Теп ло и азот удаляли и прибавляли в течение 5 мин тремя порциями 1,76 г (31,6 ммоля) железного порошка. Раствор перемеши вали при 80оС в течение еще 30 мин. Раствор охлаждали и фильтровали через Celiteâ . Фильтрат разбавляли 100 мл воды и экстрагировали трижды диэтиловым эфиром. Эфирные вытяжки промывали рассолом, сушили над безводным MgSO4 и концентрировали в ва кууме. Оста ток очища ли хроматографически с использованием 40%-ного раствора этилацетата в гексане в качестве элюента, получая 2,4 г (83%) 4-(4-бром1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-5фтор-2-метокси-бензенамина в виде твердого вещества белого цвета, т.пл. 85–86оС. Аналитически рассчитано для C12H10Br1F4N3O1: C 39,15, H 2,74, N 11,41% найдено: C 39,13, H 2,74, N 11,40%. Б. Все оборудование сушили пламенем в атмосфере азота. Раствор 6,6 г (0,0179 моля) продукта стадии А в 100 мл акрилонитрила охлаждали до 5оС. Прибавляли 1,8 г (0,018 ммоля) CuCl и 3,7 г (0,027 ммоля) CuCl2 при 5оС. Добавляли раствор 4,8 мл (0,036 ммоля) 90%-ного т-бутилнитрита в 15 мл ацетонитрила в те чение 15 минут и затем давали нагреться до 28оС. Через 2 часа при 28оС реакционную смесь десорбировали под вакуумом. Оста ток от реакции собирали в диэти ловом эфире и трижды промывали 10%-ным раствором HCl, дважды рассолом и сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали хроматографи чески с использованием 20%-ного раствора этилацетата в гексане в качестве элюента, получая 6,3 г (91%) 4-бром-3-(4хлор-2-фтор-5-метоксифенил)-1-метил-5-(трифторметил)-1Н-пиразола в ви де твердого белого тела, т.пл. 85–86оС. Аналитически рассчитано для C12H8Br1Cl1F4N2O1: C 37,19, H 2,08, N 7,23% найдено: C 37,23, H 2,08, N 7,24%. Пример 19. Этот пример описывает приготовление 4хлор-3-(5-хлор-2,4-дифторфе нил)-1-метил-5-(трифторметил)-1Н-пиразола (соединение № 354). А. Раствор 3,4 г (0,01 моля) 4-хлор-3-(2,4дифторфе нил-5-нитрофе нил)-1-метил-5-(трифторметил)-1Н-пиразола в 50 мл уксусной кислоты нагревали до 80оС в атмосфере азота. Тепло и азот уда ляли и прибавляли в течение 5 мин тремя пор циями 1,7 г (0,03 моля) железного порошка. Раствор перемеши вали при 80оС еще 30 мин. Раствор охлаждали и фильтровали через Celiteâ . Фильтрат разбавляли 100 мл воды и экстрагировали трижды этилацетатом. Этилацетатные вытяжки промывали насыщен ным раствором NaHCO3, сушили над безводным MgSO4 и концентрировали в вакууме. Оста ток очища ли хроматографи чески с использованием 35%-ного этилацетата в гексане в качестве элюента, получая 2,46 г (79%) 5-(4-хлор1-метил- 5-(трифторметил)-1Н-пиразол-3-ил)-2,4дифторбензоламина в ви де твердого белого вещества, т.пл. 82оС. Аналитически рассчитано для C11H7Cl1F5N3: C 42,40, H 2,26, N 13,48% найдено: C 42,40, H 2,26, N 13,49%. Б. Все оборудование сушили пламенем в атмосфере азота. Раствор 2,0 г (6,4 ммоля) продукта стадии А в 50 мл ацетонитрила при 25оС обрабатывали 0,63 г (6,4 ммоля) CuCl и 1,2 г (9,4 ммоля) CuCl2. В течение 5 минут добавляли раствор 1,74 мл (5,0 ммоля) 90%-ного т-бутилнитрита. Через 4 часа при 28оС реакционную смесь десорбировали в вакууме. Остаток от реакции собирали в этилацетате и промывали трижды 10%-ным раствором HCl, дважды рассолом и сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали хроматографически с использованием 10%-ного раствора этилацетата в гексане в качестве элюента, получая 1,63 г (78%) 4-хлор-3-(5-хлор-2,5-дифторфенил)-1метил-5-(трифторметил)-1Н-пиразола в виде белого твердого вещества, т.пл. 50–51оС. Аналитически рассчитано для C11H5Cl2F5N2: C 39,91, H 1,52, N 8,46% найдено: C 39,89, H 1,52, N 8,39%. Примеры 20-21 описывают конкретные воплощения способа VI. Пример 20. Этот способ описывает приготовление 4хлор-3-(4-хлор-2-фтор-5-гидроксифенил)-1-метил5- (гидроксифенил)-1-метил-5-(трифторметил)-1Нпиразола (соединение № 325). 1,39 г 4-хлор-3-(4-хлор-2-фтор-5-метоксифенил)-1-метил-5- (трифторметил)-1Н-пиразола раство ряли в 80 мл безводного метиленхлорида и затем охлаждали на сухой ледяной/ацетоновой бане и прибавляли 0,14 мл трибромида бора. После того как ей давали нагреться до комнатной температуры, в смесь добавляли еще 0,28 мл трибромида бора. Еще добавляли 1,0 мл трибромида бора и перемеши вали при комнатной температуре в течение 6 часов. После перемешива ния добавляли 30–50 мл охлажденной ледяной воды и смесь перемеши вали в течение 10 минут. Ор ганическую фа зу экстрагировали водой, сушили безводным сульфа том магния, фильтровали и концентрировали, получая 1,258 г 4-хлор-3-(4-хлор-2-фтор-5гидроксифе нил)-1-метил-5-(трифторметил)-1Н-пиразола, т.пл. 123,0–126,0оС. Аналитически рассчитано для С 11H6N2O1Cl2F4: C 40,15, H 1,84, N 8,51% найдено: C 40,08, H 1,87, N 8,48%. Пример 21. Этот пример описывает получение 4-(4хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)5-фтор-2-нитрофе нола (соединение № 429). 22 39167 При 25оС 13,16 г (0,04 моля) 4-хлор-3-(4хлор-2-фтор-5-гидроксифенил)-1-метил-5-(трифторметил)-1Н-пиразола, 6,1 г (0,44 моля) К2СО3 и 4,8 мл (0,44 моля) этилового эфи ра бромуксусной кислоты суспендировали в 25 мл ацетона. Реакционную смесь перемешивали при 25оС в течение 16 часов. Реакционный раствор выливали в 150 мл ледяной воды, фильтрова ли, промывали водой и суши ли воздухом. Остаток перекристаллизовывали из гексана, получая 16,6 г (100%) (2-хлор-5(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3ил)-4-фторфе нокси)-уксусной кислоты, эти ловый эфир в ви де твердого вещества белого цвета, т.пл. 130–131оС. Аналитически рассчитано для С 15H12Cl2F4N2O3: C 43,40, H 2,91, N 6,75% найдено: C 43,54, H 2,91, N 6,77%. Примеры 25 и 26 описывают конкретные воплоще ния способа VIII. Пример 25. Этот пример описывает получения 2-(2хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторфе нокси)-N-метил-пропанамида (соединение № 237). А. К суспензии 1,4 г (3,3 ммоля) 2-(2-хлор-5(4-хлор-1-метил-5-(трифторметил)- 1Н-пиразол-3ил)-4-фторфе нокси)-пропановой кислоты, эти ловый эфир, в 50 мл воды и 30 мл 1,4-диоксана добавляли 1,3 мл (3,3 ммоля) 10%-ного раствора NaOH. Через 30 минут раствор охлаждали и устанавливали рН на значении 3 с помощью концентрированной HCl. Реакционную смесь экстрагировали диэтиловым эфиром. Раствор эфи ра промывали водой, суши ли над безводным MgSO4 и концентрировали в ва кууме. Остаток перекристаллизовывали из метилциклогексана, получая 1,3 г (100%) 2-(2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторфе нокси)-пропановую кислоту в ви де твердого вещества белого цвета, т.пл. 150–151оС. Аналитически рассчитано для С14H10Cl2F4N2O3: C 41,92, H 2,51, N 6,98% найдено: C 41,96, H 2,48, N 7,00%. Б. К раство ру 0,8 г (2,0 ммоля) продукта стадии А в 100 мл метиленхлорида прибавляли 0,5 мл (6,0 ммоля) оксалилхлорида в течение 5 минут, вызывая выделение газа. Когда выделение газа закончилось, добавляли одну каплю ДМФ и раствор перемешивали до тех пор, пока не прекращалось выделение газа. Раствор десорбировали до сухости в ва кууме. Оста ток растворяли в 10 мл ТГФ и прибавляли к раствору 5 мл 40% водного метиламина и 10 мл ТГФ при 0 оС в течение 5 минут. Реакционную смесь перемеши вали в течение 30 минут при комнатной температуре. Раствор разбавляли 100 мл холодной воды, экстрагировали этилацетатом. Этилацетат промывали рассолом, суши ли над безводным MgSO4 и концентрировали в ва кууме. Твердое вещество перекристаллизовывали из метилциклогексана, получая 0,83 г (99%) 2-(2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторфенокси)-Nметилпропанамид в виде твердого вещества белого цвета, т.пл. 134,5–135,5оС. Аналитически рассчитано для C15H13Cl2F 4N3O 2: C 43,50, H 3,16, N 10,16% найдено: C 43,70, H 3,16, N 10,20%. Раствор 1,4 г (4 ммоля) 4-хлор-3-(2-фтор-4метокси-5-нитрофенил)-1-метил-5-(трифторметил)-1Н-пиразола в 20 мл метиленхлорида охлаждали до 0оС. Затем медленно в течение 10 минут прибавляли 5,0 мл 1М раствора BBr3 (4,9 ммоля) в метиленхлориде. Раствор перемешивали в течение ночи при комнатной температуре. Раствор промывали дважды водой, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток перекристаллизовывали из гексана, получая 0,7 г (54%) 4-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-5-фтор-2-нитрофе нил в виде твердого вещества бежевого цвета, т.пл. 89–90оС. Аналитически рассчитывали для C11H6Cl1F4N3O3: C 38,90, H 1,78, N 12,37% найдено: С 38,93, H 1,78, N 12,16%. Примеры 22–24 описывают конкретные воплощения способа VII. Пример 22. Этот пример описывает приготовление 4хлор-3-(4-хлор-2-фтор-5-пропаргилоксифенил)-1метил-5-(трифторметил)-1Н-пиразола (соединение № 261). 1,01 г 4-хлор-3-(4-хлор-2-фтор-5-гидроксифе нил)-1-метил-5-(трифторметил)-1Н-пиразола, 0,44 г безводного карбоната калия и 0,5 мл пропаргилбромида (80% по весу в то луо ле) растворяли в 20–30 мл безводного ДМФ. Смесь нагревали при 65оС в течение 90 минут. После охлаждения смесь разбавляли водой и затем экстрагировали трижды эфиром. Объединенные эфирные вытяжки дважды промывали водой, суши ли безводным сульфа том магния, фильтровали, концентрировали и хроматографи ровали, получая 1,05 г 4-хлор3-(4-хлор-2-фтор-5-пропарги локсифе нил)-1-метил5- (трифторметил)-1Н-пиразола, т.пл. 89,5–91,0оС. Аналитически рассчитано для C14H8N2O 1Cl2F4 : C 45,80, H 2,20, N 7,63% найдено: С 45,93, H 2,21, N 7,61%. Пример 23. Этот пример описывает приготовление 4-(4хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)5-фтор-2-нитрофе нокси)уксусной кислоты, эти лового эфи ра (соединение № 386). При 25оС 6,11 г (0,018 моля) 4-(4-хлор-1-метил-5- (трифторметил)-1Н-пиразол-3-ил)-5-фтор-2нитрофе нола, 2,5 г (0,019 моля) К2СО3 и 2,0 мл (0,019 моля) этилового эфира бромуксусной кислоты суспендировали в 100 мл ацетона. Реакционную смесь перемешивали при 40оС в течение 4 часов. Смесь охлаждали, разбавляли 100 мл холодной воды и экстрагировали четыре раза этилацетатом . Этилацетатные вытяжки промывали рассолом, сушили над безводным MgSO4 и десорбировали в вакууме. Остаток перекристаллизовывали из метилциклогексана, получая 7,5 г (99%) 4-(4-хлор-1-метил5-(трифторметил)-1Н-пиразол-3-ил)-5-фтор-2-нитрофенокси) уксусной кислоты, этиловый эфир, в виде легкого желтого масла, т.пл. 95–96оС. Аналитически рассчитано для С15H12Cl1F 4N3O 5: C 42,32, H 2,84, N 9,87% найдено: C 42,30, H 2,83, N 9,85%. Пример 24. Этот пример описывает получение (2-хлор5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол3-ил)- 4-фторфенокси) уксусной кислоты, эти лового эфи ра (соединение № 290). 23 39167 Пример 26. Этот пример описывает получение 2-(2хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторфе нокси)пропановой кислоты, 3-метилбутилового эфи ра (соединение № 288). К раствору 1,9 г (5,0 ммоля) 2-(хлор-5-(4хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)4-фторфе нокси)-пропановой кислоты в 50 мл метиленхлорида прибавляли 1,3 мл (15,0 ммоля) оксалилхлорида в те чение 5 минут, вы зывая выделение газа. Когда выделение газа прекращалось, добавляли одну каплю ДМФ и раствор перемешивали до тех пор, пока не прекраща лось выделение газа. Раствор десорбировали до сухости в ва кууме. Хлорангидрид кислоты растворяли в 40 мл 3метил-1-бутанола и нагревали до образования флегмы в течение одного часа. Реакционную смесь охлаждали, разбавляли 100 мл холодной воды и экстрагировали этилацета том. Этилацетат промывали рассолом, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очища ли хроматографи чески с использованием 25%ного раство ра этилацетата в гексане в качестве элюента, получая 2,17 г (95%) 2-(2-хлор-5-(4-хлор1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4фтор фенокси)-пропановой кислоты, 3-метилбутилового эфира, в виде твердого вещества белого цвета, т.пл. 128 оС. Аналитически рассчитано для C18H18Cl2F 4N2O 3: C 47,28, H 3,97, N 6,13% найдено: C 47,32, H 3,95, N 6,17%. Пример 27. Этот пример описывает получение 2Н-1,4бензоксазин-3 (4Н)-она, 6-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-7-фтор-4-(2-пропинил)-2Н-1,4-бензоксазин-3 (4Н)-она (соединение № 446) и является конкретным воплощением способа IX. А. Раствор 4,5 г (0,0106 моля (4-(4-хлор-1метил-5-(трифторметил)-1Н-пиразол-3-ил)-5фтор-2-нитрофенокси)-уксусной кислоты, эти лового эфи ра, в 75 мл уксусной кислоты нагревали до 80оС в атмосфере азота. Тепло и азот удаляли и прибавляли в течение 5 минут тремя порциями 1,8 г (0,033 моля) железного порошка. Раствор перемешивали при 80оС еще 3 часа. Раствор охлаждали и фильтровали через Celiteâ . Фильтрат разбавляли 100 мл воды и экстрагировали трижды эти лацетатом. Этилацетатные вытяжки промывали насыщенным раство ром NaHCO3, суши ли над безводным MgSO4 и концентрировали в ва кууме. Остаток перекристаллизовывали из метилциклогексан/этилацетата, получая 2,95 г (80%) 6-(4хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил) -7-фтор-2Н-1,4-бензоксазин-3(4Н)-она в виде твердого вещества белого цвета, т.пл. 207оС. Аналитически рассчитано для С13H8Cl1F4N3 O2 : C 44,65, H 2,31, N 12,02% найдено: C 44,66, H 2,31, N 11,97%. Б. При 25оС 3,0 г (8,6 ммоля) продукта стадии А, 1,22 г (6,0 ммоля) K2CO3 и 0,79 мл (8,8 ммоля) 80%-го пропаргилбромида суспендировали в 50 мл ацетона. Реакционную смесь перемеши вали при 40оС в течение 6 часов. Реакцию охлаждали, разбавляли 100 мл холодной воды и экстрагировали четыре раза этилацета том. Этилацетатные вытяжки промывали рассолом, суши ли над без водным MgSO4 и десорбирова ли в вакууме. Остаток перекристаллизовывали из метилциклогексана, получая 2,97 г (89%) 2Н-1,4-бензоксазин-3(4Н)она, 6-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-7-фтор-4-(2-пропинил)-2Н-1,4-бензоксазин-3(4Н)-она в виде твердого ве щества бежевого цвета, т.пл. 142–143оС. Аналитически рассчитано для C16H10Cl1F 4N3O 2: C 49,57, H 2,60, N 10,84% найдено: C 49,58, H 2,62, N 10,85%. Пример 28. Этот пример описывает получение 7-(4хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил) -6-фтор-4-(2-пропинил)-2Н-1,4-бензоксазин-3(4Н)она (соединение № 479) и является конкретным воплоще нием способа X. А. Раствор 2,3 г (5,4 ммоля (5-(4-хлор-1-метил-5-(трифторметил)- 1Н-пиразол-3-ил)-4-фтор-2нитрофе нокси)-уксусной кислоты, эти лового эфира, в 50 мл уксусной кислоты нагревали до 80 оС в атмосфе ре азота. Тепло и азот уби рали и в течение 5 минут тремя порциями прибавляли 0,9 г (16,2 ммоля) железного порошка. Раствор перемешивали при 80оС еще 50 минут. Раствор охлаждали и фильтровали через Celiteâ . Фильтрат разбавляли 100 мл воды и экстрагировали трижды эти лацетатом. Этилацетатные вытяжки промывали насыщенным раство ром NaHCO3, суши ли над безводным MgSO4 и концентрировали в ва кууме. Остаток перекристаллизовыва ли из метилциклогексан/этилацета та, получая 0,96 г (50%) 7-(4хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил) -6-фтор-2Н-1,4-бензоксазин-3(4Н)-она в виде белого твердого вещества, т.пл. 242оС. Аналитически рассчитано для С13H8Cl1F4N3 O2 : C 44,65, H 2,31, N 12,02% найдено: C 44,61, H 2,27, N 11,99%. Б. При 25оС 2,7 г (7,7 ммоля) продукта стадии А, 1,1 г (8,0 ммоля) K2CO3 и 0,9 мл (8,0 ммоля) 80%-ного пропаргилбромида суспендировали в 25 мл ДМСО. Смесь перемешивали при 45оС в течение 10 часов. Смесь охлаждали, разбавляли 100 мл холодной воды и экстрагировали четы ре раза этилацетатом. Этилацетатные вытяжки промывали рассолом, суши ли над безводным MgSO4 и десорбировали в ва кууме. Остаток очищали хроматографически с использованием метиленхлорида в качестве элюента, получая 2,7 г (90%) 7-(4-хлор1-метил-5-(трифторметил)-1Н-пиразол-3-ил) -6фтор-4-(2-пропинил)-2Н-1,4-бензоксазин-3(4Н)-она о в ви де белого твер дого ве щества, т.пл. 184 С. Аналитически рассчитано для C16H10Cl1F 4N3O 2: C 49,57, H 2,60, N 10,84% найдено: C 49,48, H 2,56, N 10,95%. Пример 29. Этот пример описывает получение цис- и транс-4-хлор-3- (3-хлорметилен)-5-фтор-2,3-дигидро-6-бензофуранил)-2-метил-5-(трифторметил)1Н-пиразола (соединение № № 481 и 482) и является конкретным воплоще нием способа XI. Все оборудование суши ли пламенем под азотом. Раствор 2,0 г (5,75 ммоля) 4-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил) -5-фтор-2(2-пропилокси)бензоламина в 100 мл ацетонитрила при 25оС обрабатывали 0,6 г (5,75 ммоля) CuCl и 0,8 г (5,75 ммоля) CuCl2. В течение 5 минут добавляли 1,1 мл (8,6 ммоля) 90%-ного т-бутилнит 24 39167 рита. Через 6 часов при 28оС реакционную смесь десорбировали в ва кууме. Остаток от реакции собирали в этилацета те и промывали трижды 10%ным раствором HCl, дважды рассолом и суши ли над безводным MgSO4 и концентрировали в ва кууме. Остаток очищали хроматографи чески с использованием 20%-ного раствора этилацетата в гексане в качестве элюента, получая 0,73 г (35%) цис-4-хлор-3-(3-(хлор- метилен)-5-фтор-2,3-дигидро-6-бензофуранил)-1-метил-5-(трифторметил)1Н-пиразола в ви де белого твер дого вещества, т.пл. 140,5–142,5оС. Аналитически рассчитано для C14H8Cl2F4N2 O1 : C 45,80, H 2,20, N 7,63, Cl 19,31% найдено: C 45,64, H 2,22, N 7,60, Cl 19,29%. Хроматография, описанная выше, да вала вто рую фракцию после основного компонента. Эту фракцию собирали, десорбировали и остаток кристаллизовали из гексана, получая 0,68 г (32%) транс-4-хлор-3-(3-хлорметилен)-5-фтор-2,3-дигидро-6-бензофуранил)-1-метил-5-(трифторметил)1Н-пиразола в виде твердого вещества цвета беж, т.пл. 132–135оС. Аналитически рассчитано для С14H8Cl2F4N2 O1 : C 45,80, H 2,20, N 7,63, Cl 19,31% найдено: С 45,71, H 2,23, N 7,63, Cl 19,28%. Примеры 30–37 описывают конкретные воплощения способа XII. Пример 30. Этот пример описывает получение 3-[5(бромметил)-4-хлор-2-фторфенил]-4-хлор-1-метил-5-(трифторметил)-1Н-пиразола (соединение № 108). Суспензию 3-[5-метил-4-хлор-2-фторфенил]4-хлор-1-метил-5-(трифторметил)-1Н-пиразола (25 г, 76,4 ммоля) и N-бромсук цинимида (13,6 г, 76,4 ммоля) в 100 мл четыреххлористого углерода в 500-миллилитровой круглодонной колбе, оснащенной магнитной мешалкой, обрабатывали каталитическим количеством бензоила. Температуру поднимали для образования флегмы в течение одного часа. Реакционную смесь охлаждали до комнатной температуры, фильтровали и концентрировали, получая 31,5 г белого твер дого ве щества. Материалы дважды перекристаллизовыва ли из гексана, получая 15,3 г (49%) 3-[5-(бромметил)-4хлор-2-фтор фенил]-4-хлор-1-метил-5-(трифторметил)-1Н-пиразола в ви де белого твердого вещества, т.пл. 112–114оС. Аналитически рассчитано для С12H7N2F 4Cl2Br1: С 35,50, H 1,74, N 6,90% найдено: C 35,57, H 1,76, N 6,88%. Пример 31. Этот пример описывает получение (((2-хлор5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол3-ил)-4-фторпропенил)метил) тио)ук сусной кислоты, эти лового эфи ра (соединение № 123). Смесь 1,62 г (4,0 ммоля) 3-[5-(бромметил)-4хлор-2- фторфенил]-4-хлор-1-метил-5-(трифторметил)-1Н-пиразола, 0,44 мл этилового эфи ра меркаптоуксусной кислоты и 0,55 г K2CO3 суспендировали в 25 мл ацетона. Реакционную смесь оставляли перешиваться на ночь при комнатной температуре. После разбавления 100 мл холодной воды смесь экстрагировали этилацетатом, органические вытяжки промывали водой, суши ли MgSO4 и концентрировали в вакууме. Остаток очища ли хроматографи чески, получая 1,7 г (96%) (((2хлор-5-(4-хлор-1-метил- 5-(трифторметил)-1Н-пиразол-3-ил)-4-фторфе нил)метил)тио)уксусной кислоты, эти лового эфи ра в ви де твердого вещества белого цве та, т.пл. 63оС. Аналитически рассчитано для C16H14Cl2F 4N2O 2S1: C 43,16, H 3,17, N 6,29% найдено: C 43,16, H 3,16, N 6,27%. Пример 32. Этот пример описывает получение 2-хлор-5[4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3ил] -4-фтор бензометанола (соединение № 122). К раствору 7,1 г (0,0175 ммоля) 3-[5-(бромметил)-4-хлор-2-фторфенил]-4-хлор-1-метил-5(трифторметил)-1Н-пиразола в 20 мл ДМФ прибавляли 1,5 г (0,018 ммоля) ацета та натрия. Смесь выливали в 100 мл холодной воды и твердое отфильтрованное вещество сушили. Продукт перекристаллизовывали из этанол/воды и получали 6,0 г (90%) 2-хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторбензолметанол, ацетата (эфир), т.пл. 90оС. Аце тат растворяли в 10 мл 1,4-диоксана и 10 мл воды и добавляли 6,3 мл (0,0158 моля) 10%-го раствора NaOH. Через 30 минут раствор нейтрализовали концентрированной HCl, фильтровали и твердое вещество сушили. Твердое вещество перекристаллизовывали из этанол/воды, получая 5,4 г (99%) 2-хлор-5[4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3ил]-4-фторбензолметанола в ви де твердого вещества белого цвета, т.пл. 103оС. Аналитически рассчитано для C12H8N2O 1F4Cl2 : C 42,01, H 2,35, N 8,16% найдено: С 41,88, H 2,34, N 8,09%. Пример 33. Этот пример описывает получение ((2-хлор5- (4-хлор-1-метил-5-(трифторметил)-1Н-пиразол3-ил) -4-фторфе нил)метокси)-уксусной кислоты, 1метилэтилэфира (соединение № 119). При 25оС 1,7 г (5,0 ммоля) 2-хлор-5- [4-хлор1-метил-5-(трифторметил)-1Н-пиразол-3-ил]-4фтор бензолметанола, 0,8 г (5,5 ммоля) K2CO3 и 0,7 мл (5,5 ммоля) изопропилового эфира бромуксусной кислоты суспендировали в 15 мл ДМСО. Смесь перемешивали всю ночь при 45оС. Смесь охлаждали, разбавляли 100 мл холодной воды и экстрагировали четыре раза этилацета том. Этилацетатные вытяжки промывали рассолом, суши ли над безводным MgSO4 и де сорбировали в ва кууме. Остаток очищали хроматографи чески с использованием 10%-ного раствора этилацетата в гексане в качестве элюента, получая 0,9 (41%) ((2хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил-4-фторфе нил)метокси)-уксусной кислоты, 1-метилэтилового эфи ра в ви де твердого вещества белого цвета, т.пл. 55оС. Аналитически рассчитано для C17H16Cl2F 4N2O 3: C 46,07, H 3,64, N 6,32% найдено: С 46,21, H 3,69, N 6,11%. Пример 34. Этот пример описывает получение 4-хлор-3[4-хлор-5-(дибромметил)-2-фтор фенил]-1-метил-5(трифторметил)-1Н-пиразола (соединение № 132). В 250 миллилитровой круглодонной колбе, оснащенной магнитной мешалкой, гото вили сус 25 39167 пензию 3-[5-метил-4-хлор-2-фторфенил]- 4-хлор-1метил-5-(трифторметил)-1Н-пиразола (8,18 г, 25 ммоля) и N-бромсук цинимида (8,9 г, 50,0 ммоля) в 50 мл четыреххлористо го углерода. Прибавляли каталитическое количество перекиси бензоила и поднимали температуру до образования флегмы и поддерживали ее в течение 3,5 часов. Реакционную смесь охлаждали до комнатной температуры, фильтровали и концентрировали. Остаток очищали хроматографи чески, получая 10,6 г (85%) 4хлор-3- [4-хлор-5-(дибромметил)-2-фторфенил]- 1метил-5-(трифторметил)-1Н-пиразола в виде твердого вещества белого цвета, т.пл. 89–92оС. Аналитически рассчитано для С12H6N2F 4Cl2Br2: C 29,72, H 1,25, N 5,78% найдено: C 29,72, H 1,25, N 5,78%. Пример 35. Этот пример описывает получение 2-хлор-5[4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3ил]-4- фтор бензальдегида (соединение № 133). В 100 миллилитровой круглодонной колбе, оснащенной магнитной мешалкой, 4-хлор-3-[4хлор-5-(дибромметил)-2-фтор фенил]-1-метил-5(трифторметил)-1Н-пиразол (5,0 г, 10,0 ммоля) перемеши вали в те чение 30 минут в 20 мл серной кислоты. Получающийся прозрачный желтый раствор оставляли стоять при комнатной температуре на 10 дней, перемеши вали короткое время для уда ления цвета и выливали на 200 мл льда/воды. Водную смесь экстрагирова ли эфиром и органический слой сушили MgSO4, фильтровали и концентрировали, получая 3,15 г белого цве та твердого вещества, которое перекристаллизовывали из холодных гексанов, получая 25 г (71%) 2-хлор5-[4-хлор-1-метил-5-(трифторметил)-1Н-пиразол3-ил]-4- фтор бензальдегида в ви де твердого вещества белого цвета, т.пл. 70–72оС. Аналитически рассчитано для C12H6N2O 1F4Cl2 : C 42,26, H 1,77, N 8,21% найдено: С 42,22, H 1,78, N 8,24%. Пример 36. Этот пример описывает получение 2-хлор-5[4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил]4-фторбензойной кислоты (соединение № 149). К раствору 2-хлор-5-[4-хлор-1-метил-5(трифторметил)-1Н-пиразол-3-ил]-4-фторбензальдегида (4,5 г, 13,2 ммоля) в 14 мл ацетона прибавляли 13 мл (26 ммоля) реакти ва Джоунса. Раствор перемеши вали при температуре окружающей среды в течение 2 часов и выливали в 400 мл воды. Получающееся твердое вещество отфильтровывали и сушили на воздухе, получая 4,5 г (96%) 2хлор-5-[4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил]-4-фторбензойной кислоты в ви де твердого вещества белого цвета. Пробу для анализа перекристаллизовывали из эфира/гексанов, т.пл. 179–181оС. Аналитически рассчитано для C13H6N2O 2F4Cl2 : C 40,36, H 1,69, N 7,84% найдено: C 40,49, H 1,74, N 7,77%. Пример 37. Этот пример описывает получение 2-хлор-5[4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3ил]-4-фторбензойной кислоты, 1-метилэтилового эфи ра (соединение № 135). К раствору 4,3 г (0,012 моля) 2-хлор-5-[4хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил] 4- фторбензойной кислоты в 50 мл метиленхлорида прибавляли 3,1 мл (0,036 ммоля) оксалилхлорида, вызывая выделение газа. Когда это выделение прекраща лось, добавляли одну каплю ДМФ и раствор перемешивали, пока не прекратится выделение газа. Раствор концентрировали в вакууме и получающий ся остаток растворяли в 25 мл изопропанола и нагревали до 60оС в течение 1 часа. Раствор охлаждали, вы ливали в 200 мл хо лодной воды и твер дое вещество отфильтровывали и сушили. Продукт перекристаллизовывали из этанола/воды, получая 1,69 г (70%) 2-хлор-5-[4-хлор- 1метил-5-(трифторметил)-1Н-пиразол-3-ил]-4-фторбензойной кислоты, 1-метилэтилового эфира, в виде твердого вещества белого цвета, т.пл. 69оС. Аналитически рассчитано для C15H12Cl2F 4N2O 2: C 45,13, H 3,03, N 7,02% найдено: C 45,14, H 3,04, N 7,03%. Примеры 38 и 39 описывают конкретные воплоще ния способа XIII. Пример 38. Этот пример описывает получение 2-хлор-5-[4хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил]-4фторбензолсульфонилхлорида (соединение № 346). Раствор 4-хлор-3-(4-хлор-2-фторфенил) 1метил-5-(трифторметил)-1Н-пиразола в 20 мл хлорсуль фоновой кислоты нагревали при 120оС в масляной бане в течение четырех ча сов и давали остыть до комнатной температуры. Прибавляли метиленхлорид и раствор прибавляли по каплям к перемеши ваемой смеси льда и воды (осторожно, крайне реакционноспособен). Слои разделяли, водный слой промывали мети ленхлоридом. Объединенные органические слои сушили MgSO4, фильтровали и концентрировали и получающийся твердый остаток промывали очень малым количеством эфира и перекристаллизовывали из гексанов, получая 1,65 г (63%) 2-хлор-5-[4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил]-4-фторбензолсуль фонилхлорид в ви де твердого вещества белого цвета, т.пл. 116–117оС. Аналитически рассчитано для C11H5N2O 2S1F 4Cl3: C 32,10, H 1,22, N 6,81, Cl 25,84% найдено: C 32,15, H 1,17, N 6,76, Cl 25,77%. Пример 39. Этот пример описывает получение 2-хлор-5[4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3ил]-4-фтортиофе нол (соединение № 343). К раствору 12,8 г (0,031 моля) 2-хлор-5-[4хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил]4- фторбензолсульфо нилхлорида в 100 мл уксусной кислоты прибавляют 40,7 г (0,62 моля) цинкового порошка. Суспензию перемеши вали при 80оС в течение 4 часов, давали ей остыть и фильтровали через Celiteâ . Фильтрат выливали в 1,0 л воды, твердое вещество отфильтровывали и сушили. Твердое вещество перекристаллизовывали из этанол/воды, получая 10,2 г (95%) 2-хлор-5-[4хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил]4-фтортиофе нола в ви де твердого ве щества белого цвета, т.пл. 56–58оС. Аналитически рассчитано С11H6N2S1 F4Cl2: C 38,28, H 1,75, N 8,12% найдено: C 38,29, H 2,02, N 8,12%. Пример 40. 26 для 39167 Этот пример описывает получение 4-хлор-3(4-хлор-5-(1,3-диоксолан-2-ил)-2-(фторфенил)-1метил-5-(трифторметил)-1Н-пиразола (соединение № 100) и является конкретным воплощением способа XIV. В аппарате, оснащенном ловушкой ДинаСтарка для азеотропного удаления воды, нагревали 2,4 г (7,0 ммоля) 2-хлор-5-[4-хлор-1-метил-5(трифторметил)-1Н-пиразол-3-ил]-4-фторбензальдегида, 0,4 мл (7,7 ммоля) этиленгликоля и каталитическое количество п-толуолсульфо новой кислоты в 50 мл толуо ла до образования флегмы в течение 24 часов. Образующуюся смесь концентрировали и остаток суши ли хроматографически, получая 1,65 г (61%) 4-хлор-3-(4-хлор-5-(1,3-диоксолан-2-ил)-2-фторфенил) 1-метил-5-(трифторметил)-1Н-пиразола в ви де прозрачного бесцветного масла, nD25 1,5348. Аналитически рассчитано для C14H10Cl2F 4N2O 2: C 43,66, H 2,62, N 7,27% найдено: C 43,67, H 2,59, N 7,24%. Пример 41. Этот пример описывает получение 3-(2хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторфе нил) пропановой кислоты, метилового эфи ра (соединение № 128) и является конкретным воплощением способа XV. К раствору 2,3 г (6,8 ммоля) 2-хлор-5-[4хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил]4-фторбензальдегида в 25 мл мета нола прибавляли 2,27 г (6,8 ммоля) метил(трифенилфосфо ранилиден)ацетата, поддерживая температуру ниже 35оС. Реакционную смесь оставляли перемешиваться на 15 минут и разбавляли этилацета том, промывали рассолом, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очища ли хроматографи чески с использованием 20%ного раство ра этилацетата в гексане в качестве элюента, получая 2,0 г (74%) 3-(2-хлор-5-(4-хлор1-метил-5-(трифторметил)1Н-пиразол-3-ил)-4фтор фенил)пропановой кислоты, метилового эфира в виде твер дого ве щества белого цвета, т.пл. 117оС. Аналитически рассчитано для C15H10Cl2F 4N2O 2: C 45,36, H 2,54, N 7,05% найдено: С 45,41 Н 2,59, N 7,03%. Пример 42. Этот пример описывает получение ((((2хлор-5-(4-хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)-4-фторфе нил) метилен)амино)окси)уксусной кислоты (соединение № 130) и является конкретным воплощением способа XVI. Смесь 3,4 г (0,01 моля) 2-хлор-5-[4-хлор-1метил-5-(трифторметил)-1Н-пиразол-3-ил]-4-фторбензальдегида, 2,73 г (0,0125 моля) полугидрохлорида карбоксиметоксиламина и 1,03 г (0,0125 моля) ацетата натрия в 50 мл этанола нагревали до образования флегмы в течение 2 часов. Реакционную смесь оставляли охлаждаться, обрабатывали 150 мл воды, полученный осадок собирали и сушили. Продукт перекристаллизовывали из метилциклогексана с минимальным количеством этилацетата, получая 3,35 г (81%) ((((2-хлор-5-(4хлор-1-метил-5-(трифторметил)-1Н-пиразол-3-ил)4-фторфе нил) метилен)амино)окси)уксусной кислоты в виде твердого вещества белого цвета, т.пл. 170оС. Аналитически рассчитано для C14H19Cl2F 4N3O 3: C 40,60, H 2,19, N 10,15% найдено: C 40,54, H 2,28, N 10,17%. Таблицы 4–6 показывают примеры соединений, полученных в соответствии со способами II– XVI. В таблице 4 перечислены примеры 1-метил5-арилпиразольных соединений. В таблице 5 приведены примеры 1-метил-3-арилпиразолов. Таблица 6 содержит различные соединения, большинство из которых вк лючает соединения, в которых R6 и R7 циклизова ны, образуя конденсированные гете роциклические структуры. В таблице 6 представлены различные соединения в соответствии с формулой I, структуры которых неудобны для указания в таблицах 4 и 5. Предвсхо довые испытания гербицида. Как отмечалось выше, соединения согласно настояще му изобретению оказались неожиданно эффективными в качестве гербицидов. Испытания на предвсхо довую гер бицидную активность проводились следующим образом: верхний слой почвы помещали в алюминиевый лоток и уплотняли на глубину 0,95–1,27 см от верха лотка. Затем в почву высевалось заданное число семян каждого вида различных однодольных и двудольных однолетних растений и/или вегетативные побеги различных ви дов многолетних расте ний. Затем непосредственно на грядку с семенами наносили известное качество активного ингредиента, растворенного или суспендированного в органическом растворителе, например в ацетоне, или в воде в качестве носителя, и грядку затем накрывали слоем необработанной почвы, заполняя лоток вровень с его краями. После обработки лотки уста навливали на скамью в теплице, где их поливали снизу как требуется для обеспечения достаточной влаги для прорастания и роста. Приблизительно через 10–14 дней (обычно 11 дней) после высева и обработки лотки осматривали и результаты (% ингибирования) записывали. Таблицы 7 и 7А содержат результаты испытаний предвсхо довой гербицидной активности на сорняках соединений согласно настояще му изобрете нию. Гербицидная оценка, показанная в этих таблицах, представляет собой процент ингибирования каждого вида расте ний. Виды растений, рассматриваемые как сорняки, которые использовались в одной из серий испытаний, данные о которых показаны в таблицах, иденти фицированы по буквенным рубрикам над графа ми в соответствии со следующим Yens – Yellow nutsedge (желтая осока) Anbg – мятлик однолетний (Annual bluegrass) Sejg – саженец джонсоновой травы (гумай) – Seedling johnsongrass Dobr – костер кровельный – Dawny Brome Bygr – просо петушье – Barnyardgrass Modl – вьюнок пурпур ный (ипомеа) – Morningglory Cobu – дурнушник – Coklebur Vele – канатник Теофраста – Vel vetleaf Inmu – горчица индийская – Indian Mustard Wibw – гречишка вьюнковая – Wild buckwheat 27 39167 В таблицах ниже отмечено, что символ "С" представляет собой 100%-ное уничтожение сорняков, а символ "N" указывает, что соответствующий вид высевали, но по тем или иным причинам данные не получены. Послевсхо довые испытания гербицида. Послевсхо довая гербицидная активность некоторых различных соединений согласно настоящему изобретению была продемонстрирована испытанием в теплице следующим образом. Верхний слой почвы помещали в алюминиевый лоток, имеющий отверстия в днище, и уплотняли до глубины 0,95–1,27 см от верха лотка. В почву вносили заданное количество семян каждого из различных ви дов однолетних двудольных и однодольных растений и/или вегетативные отростки многолетних видов растений и вдавливали их в поверхность почвы. Семена и/или вегетативные отростки покрывали почвой и выравнивали. Лотки затем помеща ли на скамью в теплице и поливали снизу, как требовалось. После того как расте ния достигали желаемого возраста (две или три недели), каждый лоток индивидуально перемещали в оросительную камеру и орошали с помощью распылите ля, работающего при давлении распыления 170,3 кПа (10 фун тов на кв. дюйм) при отмеченных расходных нормах. Раствор для распыления содержал определенное количество смеси эмульги рующе го агента, та кое, что содержание эмульгатора в распылительном растворе или суспензии составляло около 0,4% по объему. Распылительный раствор или суспензия содержит достаточное количество испытуе мого хи миката, чтобы получить нормы расхода активного ингредиента, соответствующие таковым в таблицах 8 и 8А, при применении обще го количества раствора или суспензии, эквивалентного 1870 л/га (200 галлон/акр.). Лотки возвращали в теплицу и поливали как прежде, и приблизительно через 10–14 дней (обычно 11 дней) наблюдали повреждение растений в сравнении с контрольными, а в некоторых случаях наблюдали снова через 24–28 дней (обычно через 25 дней) после орошения. Послевсхо довая гербицидная активность, показанная в этих таблицах, представляет собой процент ингибирования каждого вида растений. Гербицидные составы согласно настоящему изобретению, включая концентраты, требующие разбавления перед применением, могут со держать по меньшей мере один активный ингредиент и одну добавку в жидкой или твердой форме. Составы го товят смешением активного ингредиента с добавкой, включающей разбавители, наполнители, носите ли и модифи цирующие агенты для получения составов в фор ме тонко размельченных твердых частиц, гранул, ша риков, растворов, дисперсий и эмульсий. Так, предполагается, что активный ингредиент мог бы быть использован с такими добавками, как тонко дисперсные твердые вещества, жидкости органического происхождения, вода, смачивающий агент, диспергатор, эмульгатор и любое подходящее их со четание. Подхо дящие смачивающие агенты включают алкилбензол- и алкилнафталинсульфо наты, сульфи рованные жирные спирты, амины или амиды кислот, длинноцепные кислотные эфиры изотионата натрия, эфиры сульфосук цината натрия, эфи ры сульфи рованных или сульфо нированных жирных кислот, сульфо наты нефти, сульфо нированные растительные масла, дитрет-ацетиленовые гликоли, полиоксиэтиленовые производные алкилфенолов (в частности изооктилфе нола и нонилфе нола) и полиоксиэтиленовые производные моно-высши х жирно-кислотных эфи ров гекситангидридов (например, сорбитана). Предпочтительными диспергирующи ми агентами являются метилцеллюлоза, поливиниловый спирт, лигнинсульфо наты натрия, нафталинсуль фонаты натрия, полимерные алкилнафталинсуль фонаты, нафталинсульфо наты натрия и полиметилен-нафталинсульфо нат. Смачивающи ми порошками являются вододиспергируе мые составы, содержащие один или несколько активных ингредиентов, инертный твердый наполнитель-расширитель и один или более смачивающи х и диспергирующи х аген тов. Инертными твердыми наполнителями-расширителями являются обычно минеральное происхождение, как-то природные глины, диатомовая земля и синте тические минералы, производные кремнезема и т.п. Примеры таких расши рителей включают каолиниты, аттапульгитная глина и синте тический силикат магния. Соста вы смачивающи х порошков согласно настояще му изобретению обычно содержат от 0,5 до 60 частей (предпочтительно от 5 до 20 частей) активного ингредиента, от 0,25 до 25 частей (предпочтительно от 1 до 15 частей) смачивающе го агента, от 0,25 до 25 частей (предпочтительно от 1,0 до 15 частей) диспергатора и от 5 до 95 частей (предпочти тельно от 5–50 частей) инертного твердого наполнителя-расширите ля, все части суть весовые части от общего состава. Где требуется, примерно от 1,0 до 2,0 частей твердого инертного расширителя, может быть заменено ингибитором коррозии или противовспенивающим агентом или обоими. Другие рецептуры включают дустовые концентраты, содержащие от 0,1 до 60% по весу активного ингредиента на подхо дящем расширителе; эти дусты могут быть разбавлены для применения в концентрациях в пределах от 0,1 до 10% по весу. Водные суспензии или эмульсии могут быть получены путем перемеши вания неводного раствора водонераство римого активного ингредиента и эмульгатора с водой до получения однородного состояния и последующего гомогенизирования с получением устойчивой эмульсии весьма тонко распределенных частиц. Получающаяся концентрированная водная суспензия характеризуется ее крайне малыми размерами частиц, так что после разбавления и распыления достигается весьма равномерное покрытие. Подходящие концентрации таких рецептур составляют от 0,1 до 60%, предпочтительно от 5 до 50% по весу, активного ингредиента, причем верхний предел определяется пределом растворимости активного ингредиента в раство рителе. Концентраты – это обычно растворы активного ингредиента в несмешивающи хся с водой или частично несмеши вающихся с водой растворителях вместе с поверхностно-активным веществом. Подходящие растворители для активного ингредиента согласно настоящему изобретению включают диметилфор мамид, диметилсульфоксид, метилпирролидон, углеводороды 28 39167 и не смешивающие ся с водой эфиры, сложные эфи ры или кето ны. Однако могут быть приготовлены другие жидкие концентраты высокой крепости растворением активного ингредиента в растворите ле с последующим разбавлением, например керосином, до концентраций распыления. Соста вы концентратов, описываемые здесь, обычно содержат от 0,1 до 95 частей (предпочтительно 5–60 частей) активного ингредиента, от 0,25 до 50 частей (предпочтительно от 1–25 частей) поверхностно-активного вещества и, где требуется, от 5 до 94 частей растворителя, все части суть весовые части от обще го веса эмульгированного масла. Гранулы являются физически устойчивыми дисперсными композициями, содержащими активный ингредиент, сцепленный с основной матрицей инертного тонкодисперсного наполнителя-расширите ля или распределенный через нее. Для облегчения выще лачивания активного ингредиента из дисперсного наполнителя-расширителя в составе может присутствовать поверхностно-активное вещество. Природные глины, пирофиллиты, иллит и вермикулит являются примерами классов применимых дисперсных минеральных расширителей. Предпочти тельными расши рителями являются пористые адсорбирующие предварительно формованные частицы, такие как предварительно гранулированный и просеянный аттапульгит или термически расширенный дисперсный вермикулит и тонкодисперсные глины, такие как каолиновые глины, гидратированный аттапульгит или бентонитные глины. Эти расширители распыляются на активный ингредиент или смешиваются с ним для образования гербицидных гра нул. Гранулированные составы согласно настояще му изобретению могут содержать от 0,1 до примерно 30 частей по весу активного ингредиента на 100 частей по весу гли ны и от 0 до 5 частей по весу поверхностно-активного вещества на 100 частей дисперсной глины. Соста вы согласно настоящему изобретению могут также содержать другие добавки, например удобрения, другие гербициды, другие пестициды, добавки, повышающие безопасность применяемых составов и т.п., используемых как таковые или в комбинации с вышеописанными добавками. Хи микаты, кото рые могут использоваться в сочетании с активными ингредиентами настоящего изобретения, включают, например, триазины, мочевину, суль фонилмочеви ну, карбаматы, ацетамиды, ацетанилиды, урацилы, производные уксусной кислоты или фенола, тиокарбаматы, триазолы, азолопиримидины, бензойную кислоту и ее производные, нитрилы, бифе ниловые эфиры, нитробензолы и т.п., как-то: 5-бром-3-изопропил-6-мети лурацил 1,1'-диметил-4,4'-бипиридин 2-(4-изопропил-4-метил-5-оксо-2-имидазолин-2-ил)-3- хинолинкарбоновая кислота Изопропиламиновая соль 2-(4-изопропил-4метил-5-оксо-2-имидазолин-2-ил) никотиновой кислоты Ме тиловый эфир 6-(4-изопропил-4-метил-5оксо-2-имидазолин-2-ил)-м-толиловой кислоты и метиловый эфир 2-(4-изопропил-4-метил-5-оксо-2имидазолин-2-ил)-п-толиловой кислоты Мочевина/суль фомочевина N-(4-хлорфенокси)фенил-N,N-диметилмочевина N,N-диметил-N'-(3-хлор-4-метилфе нил)мочевина 3-(3,4-дихлорфе нил)-1,1-диметилмочевина 1,3-диметил-3-(2-бензотиазолил)мочевина 3-(п-хлорфенил)-1,1-диметилмочевина 1-бутил-3-(3,4-дихлорфе нил)-1-метилмочевина 2-хлор-N-[(4-метокси-6-метил-1,3,5-триазин2-ил) аминокарбонил]-бензолсульфо намид N-(2-метоксикарбонилфенил суль фонил)-N'(4,6-бисдифторметоксипиримидин-2-ил)мочевина Ме тиловый эфир 2-[{[/(4,3-диметил-2-пиримидинил)амино/ карбонил]амино}сульфонил]бензойной кислоты Этиловый эфир 1-{метил-2-[{[/(4,6-диметил-2пиримидинил)амино/карбонил]амино}сульфонил]}бензойной кислоты Ме тил-2-{[/(4,6-диметокси-пиримидин-2ил)амино карбонил/амино]-сульфонилметил}бензойной кислоты Метиловый эфир 2-[{[/(4-метокси-6-метил-1,3,5триазин-2-ил)-амино/карбонил]амино}сульфонил]бензойной кислоты Карбаматы/тиокарбаматы 2-хлораллиловый эфир диэтилдитиокарбаминовой кислоты S-(4-хлорбензил)N,N-диэтилтиокарбамат Изопропиловый эфир N-(3-хлорфенил)карбаминовой кислоты S-2,3-дихлораллиловый эфир N,N-диизопропилтиокарбаминовой кислоты S-N,N-дипропилтиокарбамат S-пропиловый эфир N,N-дипропилтиокарбаминовой кислоты S-2,3,3-трихлораллил-N,N-диизопропилтиокарбамата Ацетамиды/ацетанилиды/анилины/амиды 2-хлор-N,N-диаллилацетамид N,N-диметил-2,2-дифенилацетамид N-(2,4-диметилтиен-3-ил)-N-(1-метоксипроп2-ил)-2-хлорацетамид N-(1Н-пиразол-1-илметил)-N-(2,4-диметилтиенил -3-ил)-2-хлорацетамид N-(1-пиразол-1-илметил)-N-(4,6-диметоксипиримидин -5-ил)-2-хлорацетамид N-{2,4-диметил-5-[/(Трифторметил)сульфонил/амино]фенил}-ацетамид N-изопропил-2-хлорацетанилид N-изопропил-1-(3,5,5-триметилциклогексен1-ил)-2-хлорацетамид 2,'6'-диэтил-N-(бутоксиметил)-2-хло рацетанилид 2,'6'-диэтил-N-(2-н-пропоксиэтил)-2-хлорацетанилид Гетероциклические производные азота/серы 2-хлор-4-этиламино-6-изопропиламино-Sтриазин 2-хлор-4,6-бис(изопропиламино)-S-триазин 2-хлор-4,6-бис(этиламино)-S-триазин 3-изопропил-1Н-2,1,3-бензотиадиазин-4(3Н)-он 2,2-диоксид 3-амино-1,2,4-триазол 6,7-дигидродипиридо (1,2-2', 1'-с)- пиразидииниевая соль 29 39167 2,'6'-диэтил-N-(1-пиразол-1-илметил)-2-хлорацетанилид 2,'6'-диэтил-N-метоксиметил-2-хло рацета нилид 2'-метил-6'-этил-N-(2-метоксимпроп-2-ил)-2хло рацетанилид 2'-метил-6'-этил-N-(этоксиметил)-2-хло рацетанилид a, a, a-трифтор-2,6-динитро-N,N-дипропил-п-толуи дин N-(1,1-диметилпропинил)-3,5-дихлорбензамид Кислоты/сложные эфиры/спирты 2,2-дихлорпропионовая кислота 2-метил-4-хлорфеноксиуксусная кислота 2,4-дихлорфеноксиуксусная кислота Ме ти л-2 -[4 -(2 ,4 -ди хлорфе н окси )фен ок си]пропионат 3-амино-2,5-дихлорбензойная кислота 2-метокси-3,6-дихлорбензойная кислота 2,3,6-трихлорфе нилуксусная кислота N-1-нафтилполуа мид фталевой кислоты 5-[2-хлор-4-(трифторметил)фенокси]-2-нитробензоат натрия 4,6-динитро-о-втор.-бутилфенол N-(фосфонметил)гли цин и его соли Бутиловый эфир (R)-[2-{4-[(5-трифторметил)-2пиридинил]окси} фенокси]пропановой кислоты Простые эфи ры 2,4-дихлорфенол-4-нитрофе ниловый эфир 2-хлор- d, d, d-три фтор-п-толил-3-этокси-4нитродифениловый эфир 5-(2-хлор-4-трифторметилфе нокси)-N-метилсульфо нил-2- нитробензамид 1'-(карбоэтокси)этиловый эфир 5-[2-хлор-4(трифторметил)-фенокси]2-нитробензойной кислоты Разное 2,6-дихлорбензонитрил Кислая натриевая соль метансернокислоты Натриевая соль метанмышьяковой кислоты 2-(2-хлорфенил)метил-4-, 4-диметил-3- изоксазолидинон 7-оксабицикло-(2,2,1)-гептан, 1-метил-4-(1метилэтил)-2-(2- метилфенилметокси)-, экзоглифо сат и его соли. Удобрения, которые могут использоваться в сочетании с активными ингредиентами, включают, например, нитрат аммония, мочевину, поташ и суперфосфат. Другие полезные добавки включают материалы, в которых укореняются и растут растительные организмы, такие как компост, навоз, гумус, песок и т.п. Гербицидные рецептуры описанных вы ше типов, рассматриваемые как находящиеся в сфере настояще го изобретения, показаны ниже в нескольких иллюстративных примерах. регистрированная торговая марка Union Carbide Corp.) – 1,11 Фенол – 5,34 Мо нохлорбензол – 76,96–100,00 Б. Соединение № 261 – 25,0 Свободная кислота комплексного органического фосфа та ароматического или алифати ческого гидрофобного основания (например, GAFAC RE–610) – 5,00 Блок-сополимер полиоксиэтилен/полиоксипропилена с бутанолом (например, тергитол ХН) – 1,60 Циклогексанон – 4,75 Мо нохлорбензол – 63,65–100,00 В. Соединение № 291 – 12,0 Свободная кислота комплексного органического фосфата ароматическое или алифа тическое гидрофобное основание (например, GAFAC RE– 610, зарегистрированная торговая марка GAF Corp.) – 6,00 Блок-сополимер полиоксиэтилена/полиоксипропилена с бута нолом (например, тергитол ХН, зарегистрированная торговая марка Union Carbide Corp.) – 1,5 Циклогексанон – 5,5 Мо нохлорбензол – 75,0–100,0 Г. Соединение № 229 – 20,0 Свободная кислота комплексного органического фосфа та ароматического или алифати ческого гидрофобного основания (например, GAFAC RE–610) – 5,00 Блок-сополимер полиоксиэтилена/полиоксипропилена с бутанолом (например, тергитол ХН) – 2,0 Циклогексанон – 5,00 Мо нохлорбензол – 68,0–100,0 Д. Соединение № 312 – 11,0 Свободная кислота комплексного органического фосфа та или аромати ческое или алифатическое гидрофобное основание (например, GAFAC RE–610, зарегистрированная торговая марка GAF Corp.) – 5,59 Блок-сополимер полиоксиэтилена/полиоксипропилена с бута нолом (например, тергитол ХН, зарегистрированная торговая марка Union Carbide Corp.) – 1,11 Циклогексанон – 5,34 Мо нохлорбензол – 76,96–100,0 Е. Соединение № 282 – 25,0 Свободная кислота комплексного органического фосфа та ароматического или алифати ческого гидрофобного основания (например, GAFAC RE–610) – 5,00 Блок-сополимер полиоксиэтилена/полиоксипропилена с бутанолом (например, тергитол ХН) – 1,60 Циклогексанон – 4,75 Мо нохлорбензол – 63,65–100,0 II. Текучие рецептуры – Весовые проценты А. Соединение № 261 – 25,0 Ме тилцеллюлоза – 0,3 Аэрогель кремнезема – 1,5 Лигносуль фонат натрия – 3,5 N-метил-N-олеилтаурат натрия – 1,0 Вода – 67,7–100,00 Б. Соединение № 270 – 45,0 Ме тилцеллюлоза – 0,3 1. Эмульгируемые концентраты – Весовые проценты А. Соединение № 308 – 11,00 Свободная кислота комплексного органического фосфата или ароматического или алифатического гидрофобного основания (например, GAFAC RE–610, зарегистрированная торговая марка GAF Corp. – 5,59 Блок-сополимер полиоксиэтилен/полиоксипропилена с бутанолом (например, тергитол ХН, за 30
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of pyrazole, agriculturally acceptable salts and hydrates thereof having herbicide properties, method for the preparation thereof (variants), method for controlling undesired plants
Автори англійськоюDATRA Gerard Entony, KHAMPER Brjus Kameron, MISHKE Debora Ehjlin, MODRIDZER Kurt, RODZHERS Majkl David, VUDARD Skott Santford
Назва патенту російськоюПроизводные пиразола, их сельскохозяйственно приемлемые соли и гидраты, обладающие гербицидными свойствами, способ их получения (варианты), гербицидная композиция, способ борьбы с нежелательными растениями
Автори російськоюДАТРА Герард Энтони, ХАМПЕР Брюс Камерон, МИШКЕ Дебора Эйлин, МОДРИДЗЕР Курт, РОДЖЕРС Майкл Дэвид, ВУДАРТ Скотт Сантфорд
МПК / Мітки
МПК: C07D 409/04, C07D 231/16, C07D 405/10, C07D 498/04, C07C 49/835, C07C 45/45, C07D 231/12, C07D 405/04, C07D 403/04, C07D 231/18, C07D 409/12, C07D 413/04, C07D 411/00, C07D 401/12, C07D 413/14, C07D 413/10, C07D 417/04, C07C 45/29, C07D 403/10, C07D 413/12, C07C 49/80, C07D 405/12, A01N 43/56, C07D 521/00, C07D 231/22, C07D 409/10
Мітки: гербіцидна, властивості, отримання, гербіцидні, спосіб, рослинами, боротьби, гідрати, солі, варіанти, прийнятні, мають, похідні, сільськогосподарсько, небажаними, піразолу, композиція
Код посилання
<a href="https://ua.patents.su/68-39167-pokhidni-pirazolu-kh-silskogospodarsko-prijjnyatni-soli-ta-gidrati-shho-mayut-gerbicidni-vlastivosti-sposib-kh-otrimannya-varianti-gerbicidna-kompoziciya-sposib-borotbi-z-nebazhani.html" target="_blank" rel="follow" title="База патентів України">Похідні піразолу, їх сільськогосподарсько прийнятні солі та гідрати, що мають гербіцидні властивості, спосіб їх отримання (варіанти), гербіцидна композиція, спосіб боротьби з небажаними рослинами</a>
Попередній патент: Склад для обробки пар тертя
Наступний патент: Система для перетворення змінного струму у постійний для живлення навантажень
Випадковий патент: Пристрій для підведення електроенергії з неповоротної частини машини на поворотну












