Спосіб прогнозування шляхів морфогенезу in vitro за ступенем ефективності введення в культуру ліній та сортів м’якої пшениці triticum aestivum l. зі встановленим станом локусів генів vrn та ppd
Номер патенту: 106559
Опубліковано: 25.04.2016
Автори: Жмурко Василь Васильович, Авксентьєва Ольга Олександрівна, Петренко Вікторія Анатоліївна
Формула / Реферат
Спосіб прогнозування шляхів морфогенезу in vitro за ступенем ефективності введення в культуру ліній та сортів м'якої пшениці Triticum aestivum L. зі встановленим станом локусів генів VRN та PPD, що включає введення в культуру in vitro, отримання первинного калусу та аналіз ступеня його ефективності, який відрізняється тим, що за результатами першого етапу - введення в культуру in vitro та співставлення зі станом локусів генів як VRN або PPD дають орієнтовний прогноз щодо здатності відповідних генотипів ліній та сортів м'якої пшениці до подальшого напрямку реалізації морфогенетичного потенціалу шляхом калусогенезу - утворення соматичних калусів або морфогенезу - утворення морфогенних калусів.
Текст
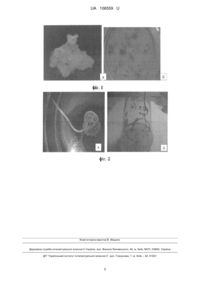
Реферат: Спосіб прогнозування шляхів морфогенезу in vitro за ступенем ефективності введення в культуру ліній та сортів м'якої пшениці Triticum aestivum L. зі встановленим станом локусів генів VRN та PPD включає введення в культуру in vitro, отримання первинного калусу та аналіз ступеня його ефективності. За результатами першого етапу - введення в культуру in vitro та співставлення зі станом локусів генів як VRN або PPD дають орієнтовний прогноз щодо здатності відповідних генотипів ліній та сортів м'якої пшениці до подальшого напрямку реалізації морфогенетичного потенціалу шляхом калусогенезу - утворення соматичних калусів або морфогенезу - утворення морфогенних калусів. UA 106559 U (54) СПОСІБ ПРОГНОЗУВАННЯ ШЛЯХІВ МОРФОГЕНЕЗУ IN VITRO ЗА СТУПЕНЕМ ЕФЕКТИВНОСТІ ВВЕДЕННЯ В КУЛЬТУРУ ЛІНІЙ ТА СОРТІВ М'ЯКОЇ ПШЕНИЦІ TRITICUM AESTIVUM L. ЗІ ВСТАНОВЛЕНИМ СТАНОМ ЛОКУСІВ ГЕНІВ VRN ТА PPD UA 106559 U UA 106559 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до галузі біотехнології і може бути використана для орієнтовного добору генотипів сортів та ліній м'якої пшениці Triticum aestivum L. з тим чи іншим напрямом реалізації морфогенного потенціалу, а також у дослідженнях з клітинної та генетичної інженерії, селекції рослин м'якої пшениці в залежності від сформульованого завдання біотехнологічних досліджень. Відомо, що серед сортів та ліній пшениці є форми з високою та низькою індукційною і регенераційною здатністю до культивування за умов in vitro. Оскільки здатність рослин до калусогенезу є реалізацією взаємодії генотипу та умов культивування (генотип - середовище), за стандартизації умов культивування головним чинником в ефективності первинного калусогенезу є генотип вихідної рослини [1]. У м'якої пшениці ідентифіковані дві генетичні системи регуляції типу та темпів її розвитку: система генів VRN, що детермінує потребу в яровизації та система генів PPD, яка визначає ступінь фотоперіодичної чутливості пшениці [2]. Сорти та лінії пшениць, що різняться за локусами та алельним станом (домінантний/рецесивний) генів цих систем за умов культивування in vivo розрізняються тривалістю онтогенезу в цілому та швидкістю темпів розвитку [2]. Дані генетичні системи впливають на напрям реалізації морфогенетичного потенціалу за умов in vitro: лінії, які несуть домінантні алелі локусів PPD В1а і VRN В1а проявляють in vitro підвищену здатність формувати соматичні калуси, а лінії з домінантними алелями локусів PPD A1a, PPD D1a та VRN A1a, VRN D1a, навпаки, інтенсивно формують морфогенні калуси [3-5]. Таким чином, аналізуючи ефективність першого етапу введення в культуру in vitro - частоту первинного калусогенезу та співставляючи відомості зі стану локусів генів VRN та PPD можна прогнозувати орієнтовний напрямок реалізації морфогенного потенціалу щодо формування соматичних або морфогенних калусів. Оскільки головною проблемою біотехнологічних досліджень рослин пшениці залишається високий ступінь залежності результативності тих чи інших способів від генотипу вихіднихдонорних рослин і до цього часу не створено надійної технології масового виробництва лінійрегенерантів, на цей час пошук ефективних способів встановлення генетичної детермінації морфогенетичних процесів in vitro та розробка на їх основі універсальних засобів оптимізації способів культивування соматичних клітин рослин є актуальними. Відомі спроби пошуку біохімічних маркерів прогнозування морфогенетичного потенціалу калусних клітин пшениці [6]. Як такий маркер запропонований біохімічний показник проліферативний антиген ініціалів (ПАІ) соматичних калусів пшениці. Способом імуноферментного аналізу встановлено зв'язок між морфогенетичними процесами в калусах та накопиченням особливого білкового компонента - проліферативного антигену ініціальних клітин меристем та в цілому показано, що зниження вмісту ПАІ характеризує процес калусогенезу, а підвищення концентрації ПАІ відбувається у процесі вторинної диференціації та регенерації рослин пшениці м'якої в культурі in vitro. Однак недоліками цього способу є дуже велика трудомісткість та потреба вдосконалення способу отримання та очищення моноспецифічних антитіл проліферативного антигену ініціалів (ПАІ) соматичних калусів пшениці і використання специфічної імунохімічної тест-системи [6]. Найближчим аналогом запропонованої корисної моделі за технічною суттю є робота, що включає добір генотипів пшениці з високою здатністю до гаплопродукції шляхом тестування на перших етапах культури пиляків in vitro [7]. Цей спосіб дозволяє після 20-30 діб культивування робити орієнтовний прогноз щодо здатності до андрогенезу того чи іншого генотипу та виявляти кращі з них для подальшої роботи з отримання лінійного матеріалу досліджуваних сортів та ліній пшениці. Як маркер гаплопродукційної здатності використовують цитологічний моніторинг першого етапу культури пиляків in vitro. Однак, недоліком цього способу можна вважати те, що за результатами перших етапів введення в культуру in vitro прогнозують здатність генотипів м'якої пшениці тільки до одного з шляхів морфогенезу, а саме андрогенезу. Крім того, як експлант для введення досліджуваних генотипів пшениці в культуру in vitro використовують пиляки, які отримують у певну фазу розвитку рослин пшениці, тобто доступність експланту обмежена часом. Враховуючи, що м'яка пшениця Triticum aestivum L., як і інші злаки, є досить складним об'єктом для експериментальної біотехнології, а за сучасності в основних селекційних дослідженнях інтенсивно використовуються способи in vitro, актуальним завданням є скорочення часу культивування та зниження затрат і собівартості процесу. В основу пропонованої корисної моделі поставлено задачу розробити такий спосіб прогнозування шляхів морфогенезу in vitro на ранніх етапах культивування, який би дозволив прогнозувати більш широкий спектр напрямків морфогенезу in vitro ліній та сортів м'якої 1 UA 106559 U 5 10 15 20 25 30 35 40 45 50 55 пшениці Triticum aestivum L. зі встановленим станом локусів генів VRN та PPD та був оснований на використанні як експланту більш доступного матеріалу - зрілих зародків пшениці. Поставлена задача вирішується шляхом аналізу ступеня ефективності первинного калусогенезу ліній та сортів м'якої пшениці та співставлення зі станом локусів системи генів контролю темпів та типу розвитку Triticum aestivum L. Спосіб дає можливість на перших етапах введення в культуру in vitro дослідних ліній та сортів пшениці прогнозувати подальший напрям реалізації морфогенетичного потенціалу, за рахунок чого здійснюється швидкий добір генотипів, значно скорочується тривалість та собівартість процесу культивування in vitro. Спосіб здійснюється наступним чином. Визначення ефективності первинного калусогенезу за використання як експланту зрілих зародків пшениці. 1. Стерилізація насіння пшениці досліджуваних генотипів. При використанні як експлантів зрілих зародків насіння пшениці було апробовано 4 режими стерилізації. Найбільш ефективним виявився наступний: - відбирають по 25 виповнених зернівок досліджуваного генотипу пшениці, - промивають у мильному розчині протягом 15 хвилин, - ретельно, протягом 20 хвилин промивають у проточній воді, - занурюють на 2 хвилини у 70 % розчин етанолу, - стерилізують 20 хвилин у 2,5 % розчині комерційного препарату "Білизна", - тричі по 10 хвилин промивають у стерильній дистильованій воді. 2. Активація росту зародків. Простерилізовані зернівки переносять у термостат за температури 26 °C та культивують протягом 20-24 годин для прокльовування насіння - активації росту зрілих зародків. 3. Вичленення зрілих зародків. За стерильних умов (робота у ламінарному боксі) відокремлюють пророслі зародки від ендосперму та переносять у чашки Петрі (5-7 зародків на одну чашку Петрі) з середовищем для індукції первинного калусогенезу. 4. Індукція первинного калусогенезу. Було випробувано 3 модифікації живильного середовища для індукції первинного калусогенезу ізольованих зрілих зародків м'якої пшениці. Найефективнішим було наступне: Культивування експлантів проводять на агаризованому живильному середовищі МурасигеСкуга з повним набором макро- та мікросолей, що містить 0,1 мг/л амінокислоти гліцину, 10 мг/л AgNO3 та 2 мг/л 2,4-Д - стимулятора росту для індукції первинного калусогенезу. Культивування здійснюється у термостаті за температури 26 °C протягом 3-4 тижнів. 5. Аналіз ступеня первинного калусогенезу здійснюють, проводячи моніторинг утворення первинного калусу на експлантах досліджуваних генотипів пшениці, здійснюючи заміри раз на тиждень. Розрахунок частоти первинного калусогенезу проводять за формулою: Ефективність первинного калусогенезу = кількість експлантів, що утворили первинний каллус / загальна кількість пасированих експлантів × 100 %. 6. Співставлення зі станом локусів системи генів контролю темпів та типу розвитку пшениці. Використовуючи каталог сортів м'якої пшениці по генотипах системи локусів Vrn (чутливість до яровизації) [8] встановлюють наявність та стан локусів генів VRN A1a, VRN B1a, VRN D1a та прогнозують орієнтовний ступінь реалізації морфогенного потенціалу. Приклад 1 Досліджували вплив генотипу на частоту первинного калусогенезу ізогенних за генами контролю типу та швидкості розвитку ліній м'якої пшениці (6 ліній та сорт, який є рецесивним за всіма генами VRN та PPD). Результати дослідів (табл. 1) показали, що усі генотипи формували калус, але з різною частотою (62,9 % - 96,1 %). Початок калусогенезу при формуванні калусних тканин при використанні зрілих зародків відбувався на 7-10 добу з дня перенесення на середовище культивування. Зі зрілих зародків формувався щільний, малооводнений, жовтуватий калус, що характеризувався наявністю елементів диференціації (фіг. 1 а, б). На фіг. 1 зображено калусогенез in vitro ізогенних за генами контролю темпів та типу розвитку ліній пшениці: а – щільний, малооводнений, жовтуватий калус, сформований зі зрілих зародків; б – утворення первинного калусу за культивування на індукційному середовищі МС + 0,1 мг/л гліцину + 10 мг/л AgNO3+2 мг/л 2,4-Д. 2 UA 106559 U Таблиця 1 Частота утворення первинного калусу зі зрілих зародків ізогенних за генами типу та темпів розвитку ліній пшениці сорту Миронівська 808, % Ізолінія РPD D1a PPD B1a PPD A1a VRN A1a VRN B1a VRN D1a **pm M-808 5 10 15 20 25 30 Загальна кількість експлантів 75±1 75±1 75±1 75±1 75±1 75±1 75±1 Кількість експлантів, що ***ворили калус 55±2 72±2 47±1 56±1 69±1 49±1 63±1 Частота калусогенезу, % 73,3±4,2 96,1±3,7 62,9±2,1 74,3±2,1 93,2±3,7 66,6±1,5 84,4±3,1 Отже, генотипи зі станом домінантних алелей локусів PPD В1а та VRN B1a, які за умов in vivo розвиваються найповільніше, характеризуються максимальними показниками ефективності первинного калусогенезу. Приклад 2 Досліджували шляхи подальшого напрямку реалізації морфогенетичного потенціалу за ефективністю непрямого морфогенезу соматичних калусів сортів та ліній пшениці зі встановленим станом локусів генів VRN та PPD. Первинні соматичні калуси сортів та ліній м'якої пшениці, що утворилися за культивування на живильному середовищі для індукції калусогенезу, що містить 0,1 мг/л амінокислоти гліцину, 10 мг/л AgNO3 та 2 мг/л 2,4-Д, за стерильних умов (робота у ламінарному боксі) пасивували на регенераційне живильне середовище. Були випробувані 2 модифікації живильного середовища для аналізу морфогенезу in vitro. Більш ефективним виявилось поживне середовище наступного складу: макро- та мікросолі за Мурасиге-Скугом, вітаміни за Гамбургом, фітогормони - 0,5 мг/л ІОК + 0,5 мг/л кінетину (табл. 2). Культивували калуси досліджуваних ізоліній за температури 26 °C, освітленості 2 кЛк, 16-годинного фотоперіоду протягом 1-1,5 місяця. Аналізували ступінь прояву морфогенного потенціалу, проводячи моніторинг появи новоутворень на соматичних калусах досліджуваних генотипів пшениці. Отримані результати ефективності морфогенезу співставляли зі станом локусів системи генів контролю темпів та типу розвитку пшениці. На 10-15 добу культивування на регенераційному середовищі були зафіксовані процеси гемогенезу - формування колеоптилів, ризогенезу - формування коренів та геморизогенезу одночасне формування надземних та підземних морфогенних структур проростків пшениці (фіг. 2 а, б). Морфогенез прозорого, гомогенного, крихкого калусу, відбувався тільки шляхом ризогенезу. На фіг. 2 зображено морфогенез in vitro ізогенних за генами контролю темпів та типу розвитку ліній пшениці: а – морфогенез калусної тканини по шляху геморизогенезу; б – непрямий морфогенез за культивування на регенераційному середовищі МС + 0,5 мг/л ІОК + 0,5 мг/л кінетину. Таблиця 2 Ефективність морфогенезу ізогенних за генами типу та темпів розвитку ліній пшениці сорту Миронівська 808 за культивування на регенераційному середовищі, % Ізолінія, генотип РPD D1a PPD В1a PPD A1a VRN A1a VRN B1a VRN D1a **pm M-808 Склад середовища MC+0,5 мг/л ІОК + 0,5 мг/л кінетину МС + 0,5 мг/л 2,4-Д + 0,5 мг/л кінетину 89,7±2,3 73,2±4,1 55,5±1,9 35,5±1,1 95,0±3,4 88,3±2,9 48,5±1,6 30,0±0,7 26,2±0,4 18,3±0,5 35,9±0,7 22,0±0,9 33,1±1,2 21,6±0,8 3 UA 106559 U 5 10 15 20 25 30 35 40 Усі досліджувані генотипи ізогенних ліній пшениці формували морфогенні структури, але з різною частотою (табл. 2). Максимальними показниками морфогенезу in vitro характеризувалися ізолінії з генотипами PPD A1a та PPD D1а серед фотоперіодично чутливих ізоліній та ізолінії VRN A1a та VRN D1a серед ізоліній, що різняться за потребою в яровизації. Тобто встановлено, що генотипова детермінація процесів калусогенезу та морфогенезу в досліджуваних ізолініях та сортах проявлялась протилежним чином: максимальне стимулювання калусогенезу супроводжувалося мінімальними показниками морфогенезу і навпаки. Доведена принципова можливість прогнозування подальших шляхів реалізації морфогенного потенціалу первинних калусів у ліній та сортів м'якої пшениці зі встановленим станом локусів генів контролю темпів розвитку пшениці. Таким чином, запропонована корисна модель прогнозування шляхів морфогенезу in vitro дозволяє за показником ефективності первинного калусогенезу ліній та сортів м'якої пшениці зі встановленим станом локусів генів VRN та PPD давати орієнтовний прогноз подальшого напрямку реалізації морфогенного потенціалу - шляхом формування соматичних калусів або шляхом формування морфогенного калусу. Джерела інформації: 1. Tyankova N.D., Zagorska N.A. Genetic control in vitro response in wheat (Triticum aestivum L.) // In Vitro Cell. Dev. Biol., Plant. - 2001. - 37, № 5-P. 524-530. 2. Стельмах А.Ф., Файт В.И., Мартынюк В.Р. Генетические системы типа и контроля скорости развития пшеницы // Цитологія и генетика. - 2000. - Т.34, № 2. - С. 39-45. 3. Avksentyeva О.A., Petrenko V.A., Tichenko A.A. and Zhmurko V.V. Callus initiation and morphogenesis in vitro culture of isogenetic on gene type and rate of development in winter wheat lines // Annual Wheat Newsletter. -August 2008. - Vol. 54. - P. 150-152. 4. Авксентьева О.А., Петренко В.А. Роль генотипа, состава среды и типа экспланта в формировании первичного каллюса изогенных линий пшеницы // Вісник Харківського національного університету імені В.Н. Каразіна. - № 771. - Серія: Біологія. - Випуск 9. - 2009. – С. 157-166. 5. Авксентьева О.А., Петренко В.А., Жмурко В.В. Особенности морфогенеза in vitro изогенных по генам PPD - контроля фотопериодической чувствительности линий озимой пшеницы Triticum aestivum L. // Фізіологія рослин: проблеми і перспективи розвитку. - К.: Логос, 2009. - Т.2. - С. 585-593. 6. Евсеева Н.В., Ткаченко О.В., Лобачев Ю.В. Биохимическая оценка морфогенетического потенциала каллусных клеток пшеницы in vitro // Физиология растений. - 2007. - Т.54, № 2. - С. 306-311. 7. Патент на корисну модель А01Н1/04 № 33983, Україна Спосіб прогнозування гаплопродукційної здатності генотипів озимої м'якої пшениці на основі цитологічного моніторингу першого етапу культури пиляків in vitro / Ігнатова C.O., Шестопал О.Л., Лобанова К.І., Жосонар М.В. (Україна). - u200801382. Заяв. 04.02.2008, Зареєстр. 25.07.2008; Опубл. 25.07.2008, Бюл. № 14. 8. Стельмах А.Ф., Авсенин В.И., Воронин А.Н. Каталог сортов яровой мягкой пшеницы по генотипам системы локусов Vrn (чувствительность к яровизации). - Одесса, 1987. - 110 с. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 45 50 Спосіб прогнозування шляхів морфогенезу in vitro за ступенем ефективності введення в культуру ліній та сортів м'якої пшениці Triticum aestivum L. зі встановленим станом локусів генів VRN та PPD, що включає введення в культуру in vitro, отримання первинного калусу та аналіз ступеня його ефективності, який відрізняється тим, що за результатами першого етапу введення в культуру in vitro та співставлення зі станом локусів генів як VRN або PPD дають орієнтовний прогноз щодо здатності відповідних генотипів ліній та сортів м'якої пшениці до подальшого напрямку реалізації морфогенетичного потенціалу шляхом калусогенезу утворення соматичних калусів або морфогенезу - утворення морфогенних калусів. 4 UA 106559 U Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 5
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod to forecast ways of morphogenesis in vitro according to effectiveness of bringing into cultivation lines and varieties of soft wheat triticum aestivum l. with determined condition of gene loci vrn and ppd
Автори англійськоюZhmurko Vasyl Vasyliovych, Avksentieva Olha Oleksandrivna, Petrenko Viktoria Anatoliivna
Назва патенту російськоюСпособ прогнозирования путей морфогенеза in vitro по степени эффективности введения в культуру линий и сортов мягкой пшеницы triticum aestivum l. с установленным состоянием локусов генов vrn и ppd
Автори російськоюЖмурко Василий Васильевич, Авксентьева Ольга Александровна, Петренко Виктория Анатольевна
МПК / Мітки
Мітки: генів, спосіб, ефективності, шляхів, введення, vitro, пшениці, культуру, ступенем, морфогенезу, сортів, прогнозування, м'якої, triticum, встановленим, станом, локусів, ліній, aestivum
Код посилання
<a href="https://ua.patents.su/7-106559-sposib-prognozuvannya-shlyakhiv-morfogenezu-in-vitro-za-stupenem-efektivnosti-vvedennya-v-kulturu-linijj-ta-sortiv-myako-pshenici-triticum-aestivum-l-zi-vstanovlenim-stanom-lokusiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб прогнозування шляхів морфогенезу in vitro за ступенем ефективності введення в культуру ліній та сортів м’якої пшениці triticum aestivum l. зі встановленим станом локусів генів vrn та ppd</a>
Попередній патент: Спосіб отримання 6-метилурацил-5-сульфохлориду
Наступний патент: Прямий різець з механічним кріпленням пластин
Випадковий патент: Дренажно-екранно-модульна система з суміжними дренами