Спосіб отримання спіро-l6-ізотіазолідин-1,1,4-тріонів
Номер патенту: 110455
Опубліковано: 25.12.2015
Автор: КИЇВСЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ ІМЕНІ ТАРАСА ШЕВЧЕНКА
Формула / Реферат
Спосіб отримання спіро-l6-ізотіазолідин-1,1,4-тріонів формули 1:
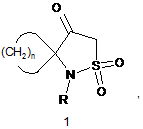
де R є С1-С6алкілом, n є від 2 до 6, в якому змішують гідрохлориди метилових естерів циклічних амінкислот з мезилхлоридом в присутності основи в органічному розчиннику, далі змішують отримані сульфонаміди з С1-С6алкілйодидом в присутності основи в органічному розчиннику, циклізують диметилсульфонаміди в органічному розчиннику в присутності алкоголятів лужних металів та виділяють цільові продукти шляхом гарячої екстракції органічним розчинником з наступною вакуумною сублімацією.
Текст
Реферат: Даний винахід стосується галузі органічної хімії, зокрема хімії гетероциклічних сполук, а 6 саме синтезу нових спіро- -ізотіазолідин-1,1,4-тріонів. Задача винаходу - одержання розширеного асортименту сполук, які можуть бути застосовані в медицині як сполуки для одержання фізіологічно активних речовин. Технічний результат: доступність вихідних сполук: високий вихід цільових продуктів - 8591 %; використання більш стійких вихідних речовин; простота виділення продуктів реакцій; виділення чистих сполук, які не потребують додаткової очистки. O ( C H 2 ) n N R 1 O S O , UA 110455 C2 (12) UA 110455 C2 UA 110455 C2 Даний винахід стосується галузі органічної хімії, зокрема хімії гетероциклічних сполук, а 6 саме способу отримання нових спіро- -ізотіазолідин-1,1,4-тріонів, 1: O (CH2)n N R S O O , 1 5 10 де R є Alk (С1-С6алкіл), n є від 2 до 6. Винахід може бути використаний в біології, хімії та медицині для створення фармацевтичних препаратів, ізостерів тетрамової кислоти [1, 2]. Найбільш близьким до запропонованого винаходу є метод отримання 2,3,3триметилізотіазолідин-1,1,4-тріону 4 [3], за яким процес відбувається в дві стадії, виходячи з етил-N,2-диметилаланшату 2. На першій стадії відбувається мезилювання метансульфонілхлоридом в діетиловому етері в присутності триетиламіну з утворенням естеру 3 (вихід 50 %), який циклізується в ізотіазолідин 4 в етиловому спирті в присутності метилату натрію з виходом 60 % (схема 1). Схема 1 O CO2Et H3C H3C NH CH3 15 20 25 30 35 40 2 H3C MeSO2Cl Et3N, Et2o H3C CO2Et MeONa, EtOH NSO2CH3 H3C O S N H3C CH3 O CH3 3 4 Недоліком цього способу є: використання пожежонебезпечного діетилового етеру; трудомісткість процесу виділення цільового продукту (використання іонообмінної смоли); низькі виходи на кожній стадії; необхідність додаткової очистки продуктів В основу винаходу поставлено задачу створити новий, більш зручний спосіб отримання 6 нових спіро- -ізотіазолідин-1,1,4-тріонів 1, підвищити виходи продуктів реакції, зменшити трудомісткість виділення продуктів, час проведення самої реакції та підвищити безпеку проведення синтезів. 6 Поставлена задача вирішується при здійснені способу отримання нових спіро- ізотіазолідин-1,1,4-тріонів 1 в три стадії, виходячи з гідрохлоридів естерів циклічних амінокислот 5. Мезилюванням аміногрупи естерів циклічних амінокислот за допомогою мезилхлориду в органічному розчиннику в присутності основи отримують сульфонаміди. Алкілуванням сульфонамідів за допомогою метилйодиду в присутності основи в органічному розчиннику та подальшою циклізацією отриманих диметилсульфонамідів в органічному розчиннику в 6 присутності алкоголятів лужних металів отримують цільові спіро- -ізотіазолідин-1,1,4-тріони 1 за схемою 2. Першу стадію (утворення продукту 6) проводять в дихлорометані при температурі не вище 5 °C, випаровують розчинник, додають воду, підкисляють мінеральною кислотою, екстрагують та переганяють при зниженому тиску або кристалізують з органічного розчинника. Диметилсульфонаміди 7 (друга стадія) утворюються при обробці сульфонамідів 6 метилйодидом в диметилформаміді в присутності поташу, випаровують розчинник, заливають водою, екстрагують та переганяють при зниженому тиску або кристалізують з органічного розчинника. На третій стадії сполуку 7 циклізують в диметилформаміді в присутності третбутилату калію при температурі 0-40 °C (четверта стадія), після гарячої екстракції та 6 сублімації отримують цільові спіро- -ізотіазолідин-1,1,4-тріони 1 з високими виходами. 1 UA 110455 C2 Схема 2 CO2Me (CH2)n NH2.HCl MeSO2Cl CO2Me (CH2)n CH2Cl2, Et3N 5a-e NSO2Me H 6a-e n=2-6 Mel K2CO3, DMF O tert-BuOK (CH2)n N Me 1a-e 5 10 15 20 25 30 35 40 S O CO2Me (CH2)n DMF NSO2Me O Me 7a-e Одержані продукти мають достатню чистоту для подальшого використання. Однак, якщо є 6 потреба у додатковій чистоті продукту, то одержані за заявленим способом нові спіро- ізотіазолідин-1,1,4-тріони можуть бути очищені загальновідомими методами, такими як 6 кристалізація, перегонка. В результаті виділяють чисті спіро- -ізотіазолідин-1,1,4-тріони з 8591 % виходом. Винахід підтверджується наступними прикладами, які ілюструють, але не обмежують об'єм даного винаходу. 6 Методика синтезу спіро- -ізотіазолідин-1,1,4-тріонів (1) Перша стадія: Сульфонаміди 6 Метил-1-аміноциклоалкілкарбоксилату гідрохлорид (5) (50 ммоль) додають до розчину триетиламіну (150 ммоль) в дихлорометані (250 мл). Після повного розчинення твердого залишку суміш охолоджують за допомогою льодяної бані. Далі прикапують розчин метансульфонілхлориду (60 ммоль) у дихлорометані (50 мл) при температурі нижче 5 °C. Суміш перемішують за кімнатної температури впродовж 12 годин. Надлишок дихлорометану та триетиламіну відганяють при зниженому тиску, до залишку додають воду (150 мл) та підкисляють мінеральною кислотою до рН = 3. Залишок екстрагують етилацетатом (5 × 50 мл), екстракт сушать над Na2SO4 та відганяють розчинник за допомогою роторного випаровувача. Після вакуумної перегонки одержують безбарвну маслянисту рідину (сполуки 6а-d). Сполука 6е була очищена шляхом кристалізації. n=2, Метил-1-метилсульфонамідо-1-циклопропанкарбоксилат (6а) 1 Вихід - 86 %; Т. кип. = 115-119 °C (0.3 мм рт. ст.); ЯМР Н , м. ч.: 1,62 (с, 2 Н, циклопропіл), 1,64 (с, 2 Н, циклопропіл), 3,15 (с, 3 Н, SO2CH3), 3,88 (с, 3 Н, СО2СН3), 6,27 (роз. с, 1 Н, NH); 13 -1 ЯМР С , м. ч.: 18,01, 36,25, 42,54, 52,62, 173,13; ІЧ спектр , см : 3280, 3028, 2957, 1733, + 1318, 1148, 522. Мас-спектр: m/z=194.2 [М+Н] . Знайдено, %: С - 37,51, Н - 5,68, N -7,14. Розраховано для C6H11NO4S, %: С - 37,30, Н - 5,74, N - 7,25. n=3, Метил-1-метилсульфонамідо-і-циклобутанкарбоксилат (6b) 1 Вихід - 89 %; Т. кип. = 120-125 °C (0,3 мм рт. ст.); ЯМР Н , м.ч.: 11,99-2,10 (м, 2 Н, циклобутил), 2,36-2,44 (м, 2 Н, циклобутил), 2,56-2,63 (м, 2 Н, циклобутил), 3,02 (с, 3 Н, SO 2CH3), 13 3,81 (с, 3 Н, СО2СН3), 6,03 (роз. с, 1 Н, NH); ЯМР С , м. ч.: 15,42, 32,41, 43,38, 52,48, 60,53, -1 173,43; ІЧ спектр , см : 3281, 3006, 2958, 1732, 1304, 1142, 979, 524. Мас-спектр: m/z=206.1 [MH] . Знайдено, %: С - 40,61, Н - 6,28, N - 6,66. Розраховано для C7H13NO4S, %: С - 40,57, Н - 6,32, N - 6,76. n=4, Метил-1-[(метилсульфоніл)аміно]циклопентанкарбоксилат (6с) 1 Вихід - 88 %; Т. кип. = 127-130 °C (0,3 мм рт. ст.); ЯМР Н , м. ч.: 1,90-2,05 (м, 4 Н, циклопентил), 2,11-2,22 (м, 2 Н, циклопентил), 2,23-2,33 (м, 2 Н, циклопентил), 3,12 (с, 3 Н, 13 SO2CH3), 3,89 (с, 3 Н, СО2СН3), 5,97 (роз. с, 1 Н, NH); ЯМР С , м. ч.: 22,55, 36,04, 43,41,52,52, -1 62,82, 173,69; 14 спектр , см : 3279, 2954, 1738, 1330, 1141, 976, 526. Мас-спектр: m/z=222.2 2 UA 110455 C2 + 5 10 15 20 25 30 35 40 45 50 55 [M+H] . Знайдено, %: С - 43,13, Н - 6,76, N - 6,38. Розраховано для C8H, 5NO4S, %: С - 43,42, Н 6,83, N - 6,33. n=5, Метил-1-[(метилсульфоніл)аміно]циклогексанкарбоксилат (6d) 1 Вихід - 90 %; Т. кип. = 135-137 °C (0,3 мм рт. ст.); ЯМР Н , м. ч.: 1,40-1,56 (м, 1 Н, циклогексил), 1,70-1,85 (м, 5 Н, циклогексил), 1,97-2,13 (м, 4 Н, циклогексил), 3,12 (с, 3 Н, 13 SO2CH3), 3,87 (с, 3 Н, СО2СН3), 6,00 (роз. с, 1 Н, NH); ЯМР С , м. ч.: 22,01, 28,38, 37,28, 43,90, -1 51,43, 64,15, 174,02; 14 спектр , см : 3262, 2937, 1732, 1318, 1137, 972, 530. Мас-спектр: + m/z=236,2 [M+H] . Знайдено, %: С - 45,85, Н - 7,32, N - 6,01. Розраховано для C9H17NO4S, %: С 45,94, Н - 7,28, N - 5,95. n=6, Метил-1-[(метилсульфоніл)аміно]циклогептанкарбоксилат (6е) 1 Вихід - 94 %; Т. топ. = 49 °C (циклогексан); ЯМР Н , м. ч.: 1,44-1,65 (м, 8 Н, циклогептил), 1 2 1 2 1,91 (дд, J =15 Гц, J =8,4 Гц, 2 Н, циклогептил), 2,03 (дд, J =15 Гц, J =8,5 Гц, 2 Н, циклогептил), 13 2,90 (с, 3 Н, SO2CH3), 3,67 (с, 3 Н, CO2CH3), 7,28 (роз. с, 1 Н, NH); ЯМР С , м. ч.: 21,84, 29,29, -1 36,61, 43,57, 51,79, 64,82, 174,61; 14 спектр , см : 3273, 2928, 1739, 1312, 1132, 974, 529. Мас+ спектр: m/z=250,2 [M+H] . Знайдено, %: С - 48,10, Н - 7,57, N - 5,59. Розраховано для C10H19NO4S, %: С - 48,14, H - 7,68, N - 5,62. Друга стадія: Диметилсульфонаміди 7 Метил-1-метилсульфонамід-1-циклоалкілкарбоксилат (6) (10 ммоль) розчиняють в сухому диметилформаміді (35 мл). При перемішуванні за кімнатної температури додають K2СО3 (20 ммоль) і метилйодид (20 ммоль). Колбу оснащують холодильником Дімрота та гумовою кулькою. Під час реакції спостерігається слабка екзотерма. Суміш перемішують впродовж 12 годин, осад відфільтровують та двічі промивають диметилформамідом (5 мл). Надлишок диметилформаміду випаровують при зниженому тиску, до залишку додають воду (15 мл) та екстрагують дихлорометаном (5 × 15 мл). Екстракт осушують над Na 2SO4, розчинник відганяють за допомогою роторного випаровувача. Після вакуумної перегонки залишку отримують світложовту маслянисту рідину (сполуки 7а-с). Сполуки 7d, e були очищені шляхом кристалізації. n=2, Метил-1-диметилсульфонамідо-і-циклопропанкарбоксилат (7а) 1 Вихід - 95 %; Т. кип. = 98-103 °C (0,3 мм рт. ст.); ЯМР Н , м.ч.: 1,48-1,76 (уш. с, 4 Н, 13 циклопропіл), 3,02 (с, 3 Н, NCH3), 3,04 (с, 3 Н, SO2CH3), 3,78 (с, 3 Н, СО2СН3); ЯМР С , м. ч.: -1 17-23 (роз. с), 35,74, 39,00, 42,44, 52,30, 172,42; ІЧ спектр , см : 3019, 2956, 1732, 1335, 1147, + 522. Мас-спектр: m/z=208.2 [М+Н] . Знайдено, %: С - 40,44, Н - 6,27, N - 6,81. Розраховано для C7H13NO4S, %: С - 40,57, Н 6,32, N - 6,76. n=3, Метил-1-диметилсульфонамідо-1-циклобутанкарбоксилат (7b) 1 Вихід - 92 %; Т. кип. = 100-105 °C (0,3 мм рт. ст.); ЯМР Н , м. ч.: 1,80-1,88 (м, 1 Н, циклобутил), 2,02-2,14 (м, 1 Н, циклобутил), 2,43-2,58 (м, 4 Н, циклобутил), 2,79 (с, 3 Н, NCH3), 13 2,84 (с, 3 Н, SO2CH3), 3,79 (с, 3 Н, СО2СН3); ЯМР С , м. ч.: 14,72, 31,58, 32,40, 38,98, 52,00, -1 64,60, 173,35; ІЧ спектр v, см : 3008, 2958, 1731, 1337, 962, 768, 526. Мас-спектр: m/z=222,0 + [M+H] . Знайдено, %: С - 43,34, Н - 6,79, N - 6,27. Розраховано для C82H15NO4S, %: С - 43,42, Н 6,83, N - 6,33. n=4, Метил-1-[метил(метилсульфоніл)аміно]циклопентанкарбоксилат (7с) 1 Вихід - 89 %; Т. кип. = 110-115 °C (0,3 мм рт. ст.); ЯМР Н , м. ч.: 1,68-1,76 (м, 4 Н, циклопентил), 1,97-2,06 (м, 2Н, циклопентил), 2,15-2,25 (м, 2 Н, циклопентил), 2,79 (с, 3 Н, 13 NCH3), 2,85 (с, 3 Н, SO2CH3), 3,68 (с, 3 Н, СО2СН3); ЯМР С , м. ч.: 23,74, 33,07, 37,08, 39,83, -1 51,98, 72,99, 173,65; ІЧ спектр , см : 2953, 1737, 1332, 1145, 963, 524. Мас-спектр: m/z=236,2 + [М+Н] . Знайдено, %: С - 45,88, Н - 7,21, N - 5,98. Розраховано для C9H17NO4S, %: С - 45,94, Н 7,28, N - 5,95. n=5 Метил-1-[метил(метилсульфоніл)аміно]циклогексанкарбоксилат (7d) 1 Вихід - 93 %; Т. топ. = 53 °C (циклогексан); ЯМР Н , м. ч.: 1.24-1.41 (м, 1 Н, циклогексил), 1,47-1.66 (м, 5 Н, циклогексил), 1,83-1,93 (м, 2 Н, циклогексил), 1,99-2,08 (м, 2 Н, циклогексил), 1З 2,87 (с, 3 Н, NCH3), 2,89 (с, 3 Н, SO2CH3), 3,67 (с, 3 Н, СО2СН3); ЯМР С , м. ч.: 22,28, 24,68, -1 31,29, 32,88, 40,19, 51,67, 65,57, 172,99; ІЧ спектр , см : 2951, 1739, 1321, 1139, 960, 526. Мас+ спектр: m/z=250,3 [М+Н] . Знайдено, %: С - 48,13, Н - 7,63, N - 5,59. Розраховано для C10H19N04S, %: С - 48,17, H - 7,68, N - 5,62. n=6, Метил 1-[метил(метилсульфоніл)аміно]циклогептанкарбоксилат (7е) 1 Вихід - 96 %; Т. топ. = 72 °C (циклогексан); ЯМР Н , м. ч.: 1,48-1,65 (м, 8 Н, циклогептил), 1 2 1 2 1,94 (дд, J =14,6 Гц, J =8м3 Гц, 2 Н, циклогептил), 2,16 (дд, J =14,6 Гц, J =8,3 Гц, 2 Н, 1З циклогептил), 2,84 (с, 3 Н, NCH3), 2.89 (с, 3 Н, SO2CH3), 3.66 (с, 3 Н, СО2СН3); ЯМР С , м. ч.: -1 23,23, 29,30, 31,13, 35,60, 39,79, 51,71, 68,97, 173,75; ІЧ спектр , см : 2914, 1735, 1325, 1145, 3 UA 110455 C2 + 5 10 15 20 25 30 35 40 45 50 963, 529. Мас-спектр: m/z=264,2 [М+Н] . Знайдено, %: С - 50,02, Н - 7,99, N - 5,34. Розраховано для C11H21NO4S, %: С – 50м17, Н - 8,04, N - 5,32. 6 Третя стадія: Спіро- -ізотіазолідин-1,1,4-тріони 1 Розчин метил-1-диметилсульфонамід-і-циклоалкілкарбоксилату 7 (4,5 ммоль) в диметилформаміді (5 мл) прикапують при перемішуванні за кімнатної температури до розчину трет-бутилату калію (9,6 ммоль) в диметилформаміді (20 мл). В ході реакції спостерігається слабка екзотерма. Суміш перемішують впродовж 12 годин за кімнатної температури. Прикапують оцтову кислоту (1,5 мл) і випаровують розчинник при зниженому тиску та температурі, що не перевищує 60 °C. Залишок розтирають з водою (10 мл) та екстрагують дихлорометаном (5 × 5 мл). Екстракт осушують над Na 2SO4 та відганяють розчинник за допомогою вакуумного роторного випаровувача. Чисту речовину у вигляді безбарвних кристалів отримують шляхом сублімації при 100 °C та 0,3 мм рт. ст. Аналітично чисті зразки були одержані шляхом подальшої кристалізації. 6 n=2, 4-Метил-5 -тіа-4-азаспіро[2.4]гептан-5,5,7-тріон (1а) 1 Вихід - 75 %; Т. топ. 78-79 °C (ізопропанол); ЯМР Н , м. ч.: 1.43 (с, 2 Н, циклопропіл), 1,50 13 (с, 2 Н, циклопропіл), 2,76 (с, 3 Н, NCH 3), 4,24 (с, 2 Н, СН2); ЯМР С , м. ч.: 17,18, 34,39, 54,23, -1 55,30, 202,59; ІЧ спектр , см : 3022, 2957, 1735, 1332, 1211, 1102, 832. Мас-спектр: m/z=174,0 [M-H] . Знайдено, %: С - 40,98, Н - 5,03, N - 7,77. Розраховано для C6H9NO3S, %: С - 41,13, Н 5,18, N - 7,99. 6 n=3, 5-Метил-6 -тіа-5-азаспіро[3.4]октан-6,6,8-тріон (1b) 1 Вихід - 82 %; Т. кип. = 98-103 °C (0,3 мм рт. ст.), Т. топ. = 50-51 °C (циклогексан); ЯМР Н , м. ч.: 1,84-1м94 (м, 1 Н, циклобутил), 2,04-2,16 (м, 1 Н, циклобутил), 2,41-2,53 (м, 4 Н, 13 циклобутил), 2,91 (с, 3 Н, NCH3), 3.72 (с, 2 Н, СН2); ЯМР С , м. ч.: 14,41, 24,18, 28,88, 54,62, -1 71,76, 202,54; ІЧ спектр , см : 2998, 2948, 1756, 1317, 1222, 1135, 1057. Мас-спектр: m/z=190,1 + [M+H] . Знайдено, %: С - 44,28, Н - 5,83, N - 7,27. Розраховано для C7H11NO3S, %: С - 44,43, Н 5,86, N - 7,40. 6 n=4, 1-Метил-2 -тіа-1-азаспіро[4.4]нонан-2,2,4-тріон (1с) 1 Вихід - 85 %; Т. топ. 49 °C (циклогексан:етилацетат=20:1); ЯМР Н , м. ч.: 1,66-1,81 (м, 4Н, 13 циклопентил), 1,88-1,97 (м, 4 Н, циклопентил), 2,70 (с, 3 Н, NCH3), 4,27 (с, 2 Н, СН2); ЯМР С , -1 м. ч.: 22,50, 25,96, 33,00, 54,05, 77,90, 203,20; ІЧ спектр , см : 2963, 1757, 1313, 1136, 993. Мас+ спектр: m/z=204,2 [М+Н] . Знайдено, %: С - 47,13, Н - 6,38, N - 6,78. Розраховано для C8H13NO3S, %: С - 47,27, Н - 6,45, N - 6,89. 6 n=5, 1-Метил-2 -тіа-1-азаспіро[4.5]декан-2,2,4-тріон (Id) 1 Вихід - 85 %; Т. топ. 95 °C (циклогексан); ЯМР Н , м. ч.: 1,60-1,87 (м, 10 Н, циклогексил), 13 2,70 (с, 3 Н, NCH3), 4,18 (с, 2 Н, СН2); ЯМР С , м. ч.: 21,65, 21,95, 24,13, 29,27, 54,38, 69,68, -1 + 200,83; ІЧ спектр , см : 2937, 1751, 1319, 1145, 1031. Мас-спектр: m/z=218,2 [М+Н] . Знайдено, %: С - 49,68, Н - 6,76, N - 6,36. Розраховано для C9H15NO3S, %: С - 49,75, Н - 6,96, N - 6,45. 6 n=6, 1-Метил-2 -тіа-1-азаспіро[4.6]ундекан-2,2,4-тріон (le) Вихід - 91 %; Т. топ. 87 °C 1 (циклогексан); ЯМР Н , м. ч.: 1,50-1,73 (м, 8 Н, циклогептил), 1,90-2,04 (м, 4 Н, циклогептил), 13 2,75 (с, 3 Н, NCH3), 4,24 (с, 2 Н, СН2); ЯМР С , м. ч.: 22,72, 22,95, 31,13, 33,34, 53,60, 73,81, -1 + 201,87; ІЧ спектр , см : 2931, 1757, 1312, 1137, 1018. Мас-спектр: m/z=232,2 [M+H] . Знайдено, %: С - 51,88, Н - 7,39, N - 5,98. Розраховано для C10H17NO3S, %: С - 51,92, Н - 7,41, N - 6,06. Таким чином, техніним результатом винаходу є розробка методу отримання раніше 6 невідомих спіро- -ізотіазолідин-1,1,4-тріонів формули 1 з високими виходами на всіх стадіях. Використання гідрохлоридів естерів циклічних амінокислот 5 як вихідних речовин зумовлено тим, що вони краще та довше зберігаються і не потребують додаткових операцій перед 6 використанням. При використанні методики, що патентується, процес отримання спіро- ізотіазолідин-1,1,4-тріонів формули 1 набагато безпечніший для здоров'я виконавця, немає необхідності використовувати пожежонебезпечний діетиловий етер, значно спрощено процес виділення продуктів. Джерела інформації: 1. Royles, В. J. L. Chem. Rev, 1995, 95, 1981. 2. Schobert, R.; Schlenk, A. Bioorg. Med. Chem., 2008, 16, 4203. 3. Stachel, H.-D.; Drasch, G. Arch. Pharm. 1985, 318, 304. 55 ФОРМУЛА ВИНАХОДУ 6 Спосіб отримання спіро- -ізотіазолідин-1,1,4-тріонів формули 1: 4 UA 110455 C2 O (CH2)n N R S O O , 1 5 де R є С1-С6алкілом, n є від 2 до 6, в якому змішують гідрохлориди метилових естерів циклічних амінкислот з мезилхлоридом в присутності основи в органічному розчиннику, далі змішують отримані сульфонаміди з С1-С6алкілйодидом в присутності основи в органічному розчиннику, циклізують диметилсульфонаміди в органічному розчиннику в присутності алкоголятів лужних металів та виділяють цільові продукти шляхом гарячої екстракції органічним розчинником з наступною вакуумною сублімацією. Комп’ютерна верстка Д. Шеверун Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 5
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07D 275/04, C07C 317/30, C07C 317/12
Мітки: спосіб, спіро-l6-ізотіазолідин-1,1,4-тріонів, отримання
Код посилання
<a href="https://ua.patents.su/7-110455-sposib-otrimannya-spiro-l6-izotiazolidin-114-trioniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання спіро-l6-ізотіазолідин-1,1,4-тріонів</a>
Попередній патент: Привід обертання форм машин відцентрового лиття
Наступний патент: Реактор надшвидкого піролізу твердих вуглевмісних речовин
Випадковий патент: Спосіб випробування кавітаційного апарату











