Спосіб одержання стереоізомерів дигідро-1-інденолів формули 1 з використанням кінетичного розділення рацематів у присутності ферментів burkholderia cepacia lipase або candida antarctica lipase b
Номер патенту: 120692
Опубліковано: 10.11.2017
Автори: Колодяжна Анастасія Олегівна, Колодяжна Ольга Олегівна, Колодяжний Олег Іванович
Формула / Реферат
Спосіб одержання (S)- і (R)-стереоізомерів дигідро-1-інденолів формули 1 з використанням кінетичного розділення рацематів у присутності ліпази Burkholderia серасіа або ліпази Candida antarctica В
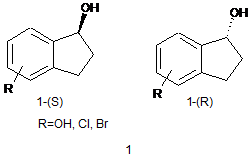 ,
,
що здатний забезпечити одержання продуктів 1 з високою енантіомерною чистотою.
Текст
Реферат: Спосіб одержання (S)- і (R)-стереоізомерів дигідро-1-інденолів формули 1 з використанням кінетичного розділення рацематів у присутності ліпази Burkholderia серасіа або ліпази Candida antarctica В. Він здатний забезпечити одержання продуктів 1 з високою енантіомерною чистотою. UA 120692 U (54) СПОСІБ ОДЕРЖАННЯ СТЕРЕОІЗОМЕРІВ ДИГІДРО-1-ІНДЕНОЛІВ ФОРМУЛИ 1 З ВИКОРИСТАННЯМ КІНЕТИЧНОГО РОЗДІЛЕННЯ РАЦЕМАТІВ У ПРИСУТНОСТІ ФЕРМЕНТІВ BURKHOLDERIA CEPACIA LIPASE АБО CANDIDA ANTARCTICA LIPASE B UA 120692 U UA 120692 U 5 10 15 20 25 30 Дана корисна модель забезпечує одержання стереоізомерів дигідро-1-інденолів високої енантіомерної чистоти ферментативним поділом їх рацематів і наступним деацилуванням в присутності біокаталізаторів ферментів - Burkholderia cepacia lipase або Candida Antarctica lipase В. Запропонована корисна модель належить до галузі органічного синтезу, а саме створення методу синтезу енантіомерів заміщених у бензольному кільці дигідро-1-інденолів ферментативним кінетичним поділом їх рацематів і наступним деацилуванням в присутності біокаталізатора - Burkholderia cepacia або Candida Antarctica lipase В. Найбільш близькою за сукупністю ознак є окисне кінетичне розділення рацемічного інденолу використанням ацетону як акцептора водню в присутності металоорганічного каталізатора [RuCl2-(PPh3) (фероценілоксазолідинфосфін)] [1]. Недоліком цього методу є необхідність застосування важкодоступного і дорого рутенійового каталізатора, більш низькі виходи і недостатня енантіомерна чистота продукту. Крім цього цей метод проводять тільки в міліграмовій шкалі вихідних реагентів. Ще один спосіб одержання похідних 1-інденолів використовує каталітичне гідрування інденонів у присутності оптично активного каталізатора Ru-PEG-BsDPEN [1, 2], а також із оптично активним складним каталізатором RuCl[(1S, 2S)-ptosyl-N-CH(C6H5)CH(C6H5)-NH2](eta;6-p-cymene)/Bu4NBr [3]. Досліджувалось хіральне гідроксилювання ОН і NH2 заміщених інденолів етилбензолдегідрогеназою [4]. Запропоновано також розділення рацемічних сумішей інденолів за допомогою препаративної хроматографії, що потребує використання високодорогих прецизійних приладів і хіральних хроматографічних колонок [5] які є важкодоступними. В основу запропонованої корисної моделі поставлено задачу створення простого стереоселективного методу синтезу заміщених в ароматичному кільці дигідро-1-інденолів, який забезпечив би можливість одержання цих речовин із високими виходами і високою хімічною чистотою. Поставлена задача вирішується тим, що реакцію кінетичного розділення рацемічних дигідро-1-інденолів проводять ферментативну транс-естерифікацію вінілацетатом в присутності ліпази Burkholderia cepacia. Альтернативним методом досягнення розділення рацемічних сумішей на енантіомери дигідро-1-інденолів був запропонований ферментативний гідроліз рацемічних ацетатів дигідро1-інденолів у буферному розчині з постійною рН 7.2 в присутності ферменту Candida Antarctica lipase В O OH O (S) + O O (S) OH (R) 35 0C + МТБЕ R R R O O OH O O (S) (R) pH 7.2, 40 0C + CALB R R R CALB = Candida antarctica lipase B 35 40 Неочікуваним виявилося, що дигідро-1-індендіол заміщений у бензольному кільці регіоселективно ацилюється тільки по гідроксильній групі розміщеній у циклопентановому кільці. Проведення реакції кінетичної трансестерифікації в трет-бутилметилефірному (МТБЕ) середовищі в присутності біокаталізатора Burkholderia cepacia, температура 35 °C, а також завершення реакції при 50 %-ній конверсії забезпечує гладку і однозначну реакцію між реагентами, яка завершується ацилуванням тільки (R)-енантіомеру рацемічної суміші, що дає інденол, що не прореагував, абсолютної конфігурації (S) і ацил інденол конфігурації (R) забезпечує розділення стереомерів цієї суміші з високим хімічним виходом і високою оптичною чистотою. Подальший гідроліз (R)-ацил інденолу дає інденол конфігурації (R). І, таким чином, ми одержуємо енантіомери інденолу. 1 UA 120692 U 5 10 15 20 25 30 35 40 45 50 55 60 Проведення реакції кінетичного ферментативного гідролізу ацил інденолу проводять у двофазній системі буферним розчином з рН 7.2/ МТБЕ середовищі у присутності ферменту CALB, при температурі 45 °C, а також завершення реакції при 50 %-ній конверсії забезпечує гладку реакцію гідролізу, що приводить до утворення (R)-енантіомера інденолу і ацил інденолу, що не прореагував, конфігурації (S), що забезпечує розділення стереомерів цієї суміші з високим хімічним виходом і високою оптичною чистотою. Подальший гідроліз (S)-ацил інденолу, що не прореагував, дає інденол конфігурації (S). І, таким чином, ми одержуємо пару (S) та (R)енантіомерів інденолу. У такій сукупності та послідовності запропоновані вище операції раніше не використовувалися. На основі цього вважаємо, що запропоноване нами технічне рішення відповідає критерію "новизна". Суть запропонованої корисної моделі пояснюємо конкретними прикладами. Приклад 1. 5-хлор-2,3-дигідро-1Н-інден-1-ол (R)-1а Розчин рацемічного (R/S)-5-хлор-2,3-дигідро-1Н-інден-1-олу (1/7 г, 0,01 моль), ліпазу Burkholderia серасіа (0,1 г), вінілацетату (3 мл) у МТБЕ (3 мл) перемішують при температурі +24° С. Процес ацилування інденолу контролюють за допомогою ТШХ і ЯМР. Реакційну суміш перемішують до 50 % конверсії вихідного спирту, що займає приблизно 18 г. Реакційну суміш відфільтровують, упарюють під вакуумом, одержану речовину розділяють на ацетат інденолу, який має абсолютну конфігурацію (R) і інденол, що не прореагував, який має абсолютну конфігурацію (S), методом хроматографії на силікагелі з використанням елюенту - гексанетилацетат-етанолу (95:5-3:1). Одержаний дигідроінденол (S)-1a додатково перекристалізовують з толуолу. 20 Вихід оптично активного дигідроінденолу (S)-1a-50 %, т. топ. 85 °C. [α]D +25 (С=3, СНСl3). 1 Спектр ЯМР Н, (CDCl3), δ, м. ч. (J, Гц): δH 1,69 с (1H, ОН); 1,95 м (1Н, СН); 2,48 м (1Н, СН); 2,80 м (1Н, СН); 3,01 м (1Н, СН); 5,19 т (1Н, СНОН); 7,18 м (2Н, Н-Аr); 7,32 м (1Н, Н-Аг). 13 Спектр ЯМР С, (CDCl3), δ, м. ч. (J, Гц): δС 30,1; 35,9; 76,1; 126; 127, 128,9; 133.8; 143; 143,1. Знайдено, %: С, 64,35; Н, 5,34; СІ, 21,25. С 9Н9С1О. Обчислено, %: С, 64,11; Н, 5,38; СІ, 21,02. Приклад 2. (S)-5-Хлор-2,3-дигідро-1Н-інден-1-іл ацетат 2а Ацетат одержаний в прикладі 1 очистили перегонкою у вакуумі. 20 Вихід 45 %, т. кип 75 °C, [α]D +76,36 (С=1, СНСl3). 1 Спектр ЯМР Н, (CDCl3), δ, м. ч. (J, Гц): δН 2,15 с (3Н, СН3СО); 2,13 м (1H, СН); 2,55 м (1Н, СН); 2,9 м (1Н, СН); 3,1 м (1Н, СН); 6,13 с (1Н, СНОН); 7,2 м (1Н), 7,25 м (1Н), 7,57 м (1Н, Н-Аг). 13 Спектр ЯМР С, (CDCl3), δ, м. ч. (J, Гц): δC 21,1; 30,3; 32,2; 79,7; 125,5; 126,7; 129,1; 134,2; 139,1; 144,1; 170,4. Знайдено, %: С, 62,72; Н, 5,26. С11Н11СlО2. Обчислено, %: С, 62,72; Н, 5,26. Приклад 3. (S)-5-хлор-2,3-дигідро-1Н-інден-1-ол 1а Ацетат 2а (2.1 г, 0,01 моль) гідролізують за допомогою К2СО3 (2 г) в 20 мл метанолу при перемішуванні і кімнатній температурі. Хід гідролізу контролюють ТШХ-аналізом. Розчинник упарюють і залишок екстрагують етилацетатом. Потім екстракт упарюють і залишок перекристалізовують з гексану. Одержали чистий дигідроінденол 16. 20 Вихід 45 %, т. топ. 85-86 °C. [α]D -25 (С=3, СНСl3). 1 Спектр ЯМР Н, (CDCl3), δ, м. ч. (J, Гц): δН 1,95 м (1Н, СН); 2,48 м (1Н, СН); 2,80 м (1Н, СН); 3,01 м (1Н, СН); 5,19 т (1Н, СНОН); 7,18 м (2Н, Н-Аг); 7,32 м(1Н, Н-Аг). 13 Спектр ЯМР С, (CDCl3), δ, м. ч. (J, Гц): δС 30,1; 35,9; 76,1; 126; 127, 128,9; 133,8; 143; 143,1. Знайдено, %: С, 64,02; Н, 5,51. С9Н9СlО. Обчислено, %: С, 64,11; Н, 5,38. Приклад 4. (8)-5-хлор-2,3-дигідро-1Н-інден-1-ол 1a (S/R)-5-Хлор-2,3-дигідро-1Н-інден-1-іл ацетат 2а розчиняють в МТБЕ, додають фосфатний буфер (0,05 М; рН=7,2). Додають ліпазу CALB (20 % від маси субстрату). Перемішують приблизно 12-18 годин при кімнатній температурі. Контроль реакції проводять по ЯМР. По завершенні реакції ліпазу відфільтровують. Органічну фазу відокремлюють від води. Воду промивають МТБЕ 2 рази. Об'єднані органічні розчини висушують сульфатом натрію і упарюють. Оптичну чистоту контролюють методом ЯМР дериватизованого кислотою Мошера 20 продукту. Вихід (R)-інденолу - 45 %. [α]D -25 (С=3, СНСl3). Вихід (S)-ацилінденолу, що не 20 прореагував, 46 % [δ]D +81 (С=1, СНСl3). Приклад 5. (S)-5-Бром-2,3-дигідро-1Н-інден-1-ол 1б Розчин (S/R)-5-Бром-2,3-дигідро-1Н-інден-1-ол (R)-1б (2,3 г, 0,01 моль), ліпазу Burkholderia серасіа (0,2 г), вінілацетат (3 мл) і МТБЕ (10 мл) перемішували при температурі +24° С. Утворення ацетильованого продукту контролюють за допомогою ТШХ і ЯМР. Реакційну суміш перемішують до 50 % конверсії вихідного спирту, що зайняло 18 годин. Реакційну суміш 2 UA 120692 U 5 10 15 20 25 30 35 40 45 50 55 відфільтровують, упарюють у вакуумі, одержане масло очищають хроматографією на силікагелі з елюентом гексан-етилацетат-етанол (95:53:1). Розділений дигідро-1Н-інден-1-ол 16 перекристалізовують з толуолу. 20 Вихід 50 %, т. топ. 100 °C. [α]D +50 (С=3, СНСl3). 1 Спектр ЯМР Н, (CDCl3), δ, м. ч. (J, Гц): δH 1,88-1,99 (м, 2Н), 2,42-2,53 (м, 1Н), 2,74-2,85 (м, 1Н), 2,97-3,07 (м, 1Н), 5,18 (т, J=6.6 Гц, 1Н), 7,26 (д, J=2.7 Гц, 1H), 7,34 (с, 1Н),7,37 (д, J=3,0Гц, 1Н); Знайдено, %: С, 50,44; Н, 4,41. С9Н9ВrO: Обчислено, %: С, 50,73; Н, 4,26. Приклад 6. (R)-5-Бром-2,3-дигідро-1Н-інден-1-іл ацетат 2б Ацетат одержаний в попередньому прикладі 4 очистили перегонкою у вакуумі. Вихід 40 %. Т.кип. 100 °C (0,01 мм рт. ст.), [α]D=-74,02 (С 1,15, CDCl3). 1 Спектр ЯМР Н, (CDCl3), δ, м. ч. (J, Гц): 2,05 с (3Н, СН3СО); 2,55 м (1Н, СН); 2,9 м (1Н, СН); 3,1 м (1Н, СН); 6,13 с (1Н, СНО); 7,2 м (1Н), 7,25 м (1Н), 7,57 м (1Н, Н-Аг). 13 Спектр ЯМР С, (CDCl3), δ, м. ч. (J, Гц): δС 21,1; 29,5; 32,2; 79,7; 121,4; 123,2; 124,5; 131,6; 141,4; 143; 170,4. Приклад 7. (R) -5-Бром-2,3-дигідро-1Н-інден-1-ол (R)-3,37b Ацетат (0,01 моль) гідролізують за допомогою К2СО3 (2 г) в 20 мл метанолу при перемішуванні і кімнатній температурі. Хід гідролізу контролюють ТШХ - аналізом. Розчинник упарюють і залишок екстрагують етилацетатом. Потім екстракт упарюють і залишок перекристалізовують з гексану. 20 Спирти перекристалізовують з толуолу. Вихід 50 %, т. топ. 85 °C. [α]D +25 (С=3,СНСl3). 1 Спектр ЯМР Н, (CDCl3), δ, м. ч. (J, Гц): δH 1,69 с (1Н, ОН); 1,95 м (1Н, СН); 2,48 м (1Н, СН); 2,80 м (1Н, СН); 3,01 м (1Н, СН); 5,19 т (1Н, СНОН); 7,18 м (2Н, Н-Аг); 7,32 м (1Н, Н-Аг). 13 Спектр ЯМР С, (CDCl3), δ, м. ч. (J, Гц): δС 30,1; 35,9; 76,1; 126; 127, 128,9; 133,8; 143; 143,1. Знайдено, %: С, 50,45; Н, 4,29. С9Н9ВrO: Розраховано, %:С, 50,73; Н, 4,26. Приклад 8. (S/R)-5-Бром-2,3-дигідро-1Н-інден-1-іл ацетат 2б розчиняють в МТБЕ, додають фосфатний буфер (0,05 М; рН=7,2). Додають ліпазу CALB (20 % від маси субстрату). Перемішують приблизно 12-18 годин при кімнатній температурі. Контроль реакції проводять по ЯМР. По завершенні реакції ліпазу відфільтровують. Органічну фазу відокремлюють від води. Водну фазу промивають МТБЕ 2 рази. Об'єднані органічні розчини висушують сульфатом натрію і упарюють. Оптичну чистоту контролюють методом ЯМР дериватизованою кислотою 20 Мошера продукту. Вихід (R)-інденолу - 45 %. [α]D -25 (С=3, СНСІ3). Вихід (S)-ацилінденолу, що 20 не прореагував, 44 % [α]D +75(С=1,СНСl3). Приклад 9. (ІІ)-2,3-Дигідро-1Н-інден-1,4-діол 1в Розчин (S/R)-2,3-Дигідро-1Н-інден-1,4-діол 1в (1,5 г, 0,01 моль), ліпазу Burkholderia серасіа (0,2 г), вінілацетат (10 мл) і МТБЕ (3 мл) перемішують при температурі +24° С. Утворення ацетильованого продукту контролюють за допомогою ТШХ і ЯМР. Реакційну суміш перемішують до 50 % конверсії вихідного спирту, що зайняло 18 год. Реакційну суміш відфільтровують, упарюють у вакуумі, одержане масло очищають хроматографією на силікагелі з використанням елюенту гексан-етилацетат-етанолу (95:53:1). Спирти перекристалізовують з толуолу. Вихід 50 %, Т. топ. 135 °C, [α]= +42.95 (с=1, СНСІ3). 1 Спектр ЯМР Н, (CDCl3), δ, м. ч. (J, Гц): δH 2,0 м (1Н, СН); 2,25 с (1Н, ОН); 2,5 м (1Н, СН); 2,75 м (1Н, СН); 3,0 м (1Н, СН); 4,8 ш (1Н, ОН); 5,25 м (1Н, СНОН); 6,75 м (Ш, Н=Аr); 7,05 м (1Н, Н=Аr); 7,2 м (1Н, Н=Аr). 13 Спектр ЯМР С, (CDCl3), δ, м. ч. (J, Гц): δС 26,21 с (СН); 35,11 с (СН); 75,82с (СНОН); 114,16с (С-Аr); 115,39с (С-Аr); 128,86 с (С-Аr); 128,99с (С-Аr); 147,63 с (С-Аr); 153,25 с [С(ОН)Аr]. Знайдено, %: С, 71,45; Н, 6,82 С9Н10O2. Обчислено, %: С, 71,98; Н, 6,71 Приклад 10. (S)-5-гідрокси-2,3-дигідро-1Н-інден-1-іл ацетат 2в 1 Ацетат, отриманий в прикладі 7 очистили перегонкою у вакуумі. Вихід 40 %. Спектр ЯМР Н, (CDCl3), δ, м. ч. (J, Гц): δH 2,1 с (3Н, СН3СО); 2,2 м (1Н, СН2); 2,4м (1Н, СН2) 2,7 м (2Н, СН2); 5,7 ш (ОН); 6,12 (СНО); 6,56 с; 6,65 с; 7,15 с; 7,16 с (3Н, Н-Аr). Знайдено, %: С 68,45; Н 6,19. С11Н12О3 Обчислено, %: С 68,74; Н 6,29. Приклад 11. (S)-2,3-Дигідро-1Н-інден-1,5-діол 1в (S)-2,3-Дигідро-1Н-інден-1,4-діол 1-ацетат 2в (5 ммоль) гідролізують у фосфатно-буферному водяному розчині при постійному рН 7,2 з використанням Burkholderia cepacia як біокаталізатора (0,2 г) при перемішуванні і кімнатній температурі. Гідроліз контролюють за 1 допомогою ТШХ і Н ЯМР. Далі ліпазу фільтрують і промивають метиленхлоридом. Розчинник упарюють і залишок екстрагують етилацетатом. Потім екстракт упарюють, залишок 3 UA 120692 U 5 10 15 20 25 30 35 40 кристалізують з гексану з одержанням відновленого спирту. Вихід 42 %. Т. топ. 135 °C, [α]= 42,95 (с=1, СНСl3). 1 Спектр ЯМР Н, (CDCl3), δ, м. ч. (J, Гц): δH 2,0 м (1Н, СН); 2,25 с (1Н, ОН); 2,5 м (Ш, СН); 2,75 м (1Н, СН); 3.0 м (1Н, СН); 4,8 ш (1Н, ОН); 5,25 м (1Н, СНОН); 6,75 м (1Н, Н=Аr); 7,05 м (1Н, Н=Аr); 7.2 м (1Н, Н=Аr). 13 Спектр ЯМР С, (CDCl3), δ, м. ч. (J, Гц): δС 26,21 с (СН); 35,11 с (СН); 75,82с (СНОН); 114,16с (С-Аr); 115,39 с (С-Аr); 128,86 с (С-Аr); 128,99с (С-Аr); 147,63 с (С-Аr); 153,25 с [С(ОН)Аr]. Знайдено, %: С, 71,66; Н, 6,92. С9Н10O2: Обчислено, %: С, 71,98; Н, 6,71 Приклад 12. Визначення оптичної чистоти сполук. Енантіомерний надлишок сполук визначають шляхом утворення естерів Мошера МТРА з галогенциклоалканолами. До розчину спирту (0,1 ммоль) і піридину (0,2 ммоль) в 0,5 мл абсолютного ТГФ додають розчин МТРА (26 мг, 0,11 ммоль) в 0,5 мл ТГФ при -70 °C. Температуру підвищують до кімнатної і реакційну суміш центрифугують. Одержаний розчин 19 аналізують за допомогою спектрів ЯМР F. Два сигнали були виявлені для рацемічних дигідроінденолів і тільки один сигнал був присутній у кінетично розділених сполуках. Приведені приклади 1-10 свідчать, що запропонований біокаталізатор дає можливість одержувати обидва оптичні енантіомери дигідро-1-інденолів формули 1 з високими виходами і високою енантіомерною чистотою у розчині метил-трет-бутилового ефіру при кімнатній температурі і помірній кількості біокаталізатора, що спрощує процес досягнення цих продуктів. Одержані похідні 1-інденолів є важливими проміжними продуктами у синтезі важливих фармпрепаратів Інденавіру і Ладостигілу [5-8]. Джерела інформації: 1. US Patent 2006/0199974 Al/ Process for the synthesis of enantiomeric indanylamine derivatives// Boulton L.Т., Lennon I.C; Bahar E. 2. Luo Z., Qin F., Yan S., Li X…An efficient и promising method to prepare Ladostigil (TV3326) via asymmetric transfer hydrogenation catalyzed by Ru-Cs-DPEN in an HCOONa-H2O-surfactant system// Tetrahedron: Asymmetry 2012. - Vol. 23. - P. 333-338. 3. U.S. Patent Nos.: 6,645,961 B1 Dry granulation formulation for an HIV protease inhibitor. C. Y. Lui, D. Ostovic, A. V. Katdare, C. Stelmach. 4. Patent WO 2012/101011 A2, 2012 / New aryl-benzocycloalkyl amide derivatives// Aebi J., Binggeli A., Hertel C, Konkar A. A., Kuehne H., Kuhn В., Maerki H. P., Wang H. 5. Weinreb O., Mandel S., Bar-Am O. Multifunctional neuroprotective derivatives of rasagiline as anti-Alzheimer's disease drugs. Neurotherapeutics: J.Amer. Soc. Experiment. NeuroTherap. 2009. Vol 6. - P. 163-74. 6. Dudzik A., Kozik В., Tataruch M., Wójcik A., Knack D., Borowski Т., Heider J., Witko M., Szaleniec M. The reaction mechanism of chiral hydroxylation of p-OH and p-NH2 substituted compounds by ethylbenzene dehydrogenase Can. J. Chem. 2013. - Vol. 91. - P. 775-786. 7. Weinstock M, Luques L, Bejar C, Shoham S. /Ladostigil, a novel multifunctional drug for the treatment of dementia co-morbid with depression// J. Neural Transmission. 2006. - Vol 70. - P. 443446. 8. "Crixivan (indinavir sulfate) Capsules. Prescribing Information. Revised December 2013" (PDF). Merck & Co., Inc. Retrieved 6 February 2014. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 45 Спосіб одержання (S)- і (R)-стереоізомерів дигідро-1-інденолів формули 1 з використанням кінетичного розділення рацематів у присутності ліпази Burkholderia серасіа або ліпази Candida antarctica В 50 OH R OH R 1-(S) 1-(R) R=OH, Cl, Br 1 , 4 UA 120692 U що здатний забезпечити одержання продуктів 1 з високою енантіомерною чистотою. Комп’ютерна верстка Л. Бурлак Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 5
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07C 27/08, C07C 27/22
Мітки: рацематів, burkholderia, candida, спосіб, lipase, antarctica, стереоізомерів, використанням, ферментів, кінетичного, формули, дигідро-1-інденолів, cepacia, одержання, присутності, розділення
Код посилання
<a href="https://ua.patents.su/7-120692-sposib-oderzhannya-stereoizomeriv-digidro-1-indenoliv-formuli-1-z-vikoristannyam-kinetichnogo-rozdilennya-racemativ-u-prisutnosti-fermentiv-burkholderia-cepacia-lipase-abo-candida.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання стереоізомерів дигідро-1-інденолів формули 1 з використанням кінетичного розділення рацематів у присутності ферментів burkholderia cepacia lipase або candida antarctica lipase b</a>
Попередній патент: Пристрій для визначення та контролю механічного гальмівного моменту трамвайного вагона
Наступний патент: Пристрій для переміщення вантажів
Випадковий патент: Лінійка викладача











