Спосіб модифікації слюди, субстрату для атомно-силової мікроскопії
Номер патенту: 13571
Опубліковано: 17.04.2006
Автори: Лиманська Ольга Юріївна, Клімов Олег Іванович, Лиманська Людмила Олександрівна, Драч Максим Іванович, Волянський Юрій Леонідович, Руденко Станіслав Станіславович, Лиманський Олександр Петрович
Формула / Реферат
Спосіб модифікації слюди, субстрату для атомно-силової мікроскопії, що включає створення схеми одержання модифікованої слюди з регульованою поверхневою щільністю аміногруп за допомогою 3-амінопропілтриетоксисилану (АПТЕС) в газовій фазі, який відрізняється тим, що використовують трикратну дистиляцію АПТЕС (для амінослюди з підвищеною щільністю заряду) і неперегнаний АПТЕС (для амінослюди зі зниженою щільністю заряду) за наведеним протоколом модифікації свіжосколотої слюди у скляному ексикаторі об'ємом 2,5 л, заповненому аргоном, а саме АПТЕС - 120 мкл - поміщають на 4 години, та N,N-діізопропілетиламін - 40 мкл - поміщають на 5 годин.
Текст
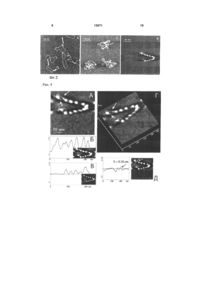
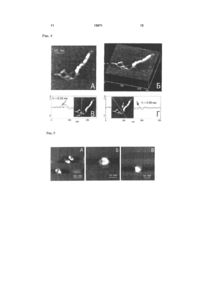
Спосіб модифікації слюди, субстрату для атомно-силової мікроскопії, що включає створення 3 льки суперспіралізація ДНК відіграє ключову роль у генетичних процесах у клітині, оброблена сперміном та спермідіном слюда була використана для візуалізації особливостей третинної структури ДНК за допомогою АСМ. Для характеристики своєрідної якості субстрату, тобто модифікованої тим чи іншим реагентом слюди, використовують форму суперспіральних молекул ДНК, яка надзвичайно чутлива до поверхневої щільності заряду слюди, а також контурну довжину ДНК, число супервитків або вузлів, виключений об'єм ДНК, суперспіральну щільність. АСМ зображення суперспіральної ДНК pUC19, іммобілізованої на слюді, що оброблена сперміном, показали, що переважна більшість ланцюгів молекул ДНК закручена у суперспіраль, але в той же час існують і релаксовані фрагменти молекул. Максимальна суперспіральна щільність закручених молекул наближається до значення = -0.12. Проте слюда, оброблена сперміном або спермідіном, має ряд суттєвих недоліків, одними з яких є неможливість варіювати поверхневу щільність заряду, проведення дослідження у невеликому інтервалі іонної сили та рН, що виключає можливість значної зміни поверхневої щільності заряду слюди, а також відсутність технології зберігання зразка з іммобілізованими біомолекулами для повторних досліджень. Існує також спосіб модифікації свіжосколотої слюди аміногрупами у розчині похідного аміносилана 3-амінопропілтриетоксісилана (АПТЕС) з утворенням на поверхні слюди само-асоційованих моношарів позитивно заряджених аміногруп [Fang Y., Hoh J. Surface-directed DNA condensation in the absence of soluble multivalent cations // Nucleic Acids Res. - 1998. - V. 26. - P. 588-593]. Зазначений спосіб модифікації слюди дозволяє візуалізувати за допомогою АСМ як релаксовані молекули ДНК, так і конденсовані мультимолекулярні структури тороїди та джгути. Проте, через неконтрольовану поверхневу щільність аміногруп модифікованої таким чином слюди, понад 70 % молекул плазмідної ДНК знаходяться у тороїдальній конформації, що робить непридатним даний спосіб для АСМ візуалізації та досліджень плектономічних молекул ДНК. Істотним недоліком даного способу є використання недистильованого АПТЕС. Емпірично встановлено, що високоякісні АСМ зображення молекул суперспіральної ДНК можливо отримувати тільки на слюді, обробленій перегнаним АПТЕС. Найбільш близьким є спосіб отримання стандартної амінослюди за допомогою модифікації свіжосколотої слюди аміногрупами у парах перегнаного 3-амінопропілтриетоксісилана [Lyubchenko Y., Shiyakhtenko L. Visualization of supercoiled DNA with atomic force microscopy in situ // Proc. Natl. Acad. Sci. USA. - 1997. - V. 94, №4. - P. 496-501]. Було показано, що даний спосіб отримання стандартної амінослюди є найпридатнішим для іммобілізації та вивчення структурних особливостей суперспіральних молекул ДНК. Також важливо, що молекули ДНК мали певну рухливість на поверхні стандартної амінослюди, а форма плектономічних молекул ДНК для висушеного у повітрі зразка є такою же, як і для зразка стандартної амінослюди з іммобілізованими молекулами ДНК у розчині. 13571 4 Істотною перевагою над існуючими методами вищенаведеного способу модифікації слюди є можливість тривалого зберігання зразків ДНК протягом декількох місяців без погіршення якості АСМ зображень при повторному скануванні. Суттєвим недоліком способу отримання стандартної амінослюди за допомогою модифікації у парах АПТЕС є невисока поверхнева щільність активних аміногруп, а також відсутність її регулювання. Було встановлено, що тільки 50% поверхневих аміногруп є протонованими, тому молекули ДНК з суперспіральною щільністю 0.08 були візуалізовані на даному субстраті. В той же час за допомогою електронної мікроскопії та у теоретичних роботах були досліджені суперспіральні молекули ДНК з суперспіральною щільністю =-0.12. У зв'язку з вищевикладеним в основу корисної моделі покладено задачу підвищення гідрофобності та поверхневої щільності аміногруп стандартної амінослюди шляхом забезпечення можливості регулювання поверхневої щільності заряду модифікованої амінослюди. Задача, яку покладено в основу корисної моделі, вирішується тим, що у відомому способі модифікації слюди у парах АПТЕС шляхом створення схеми модифікації слюди з застосуванням трьохкратної дистиляції АПТЕС, згідно з корисною моделлю, використовують такий протокол модифікації свіжосколотої слюди у скляному ексикаторі об'ємом 2.5 л в атмосфері аргону: 3-амінопропілтриетоксісилан (АПТЕС) 120мкл, 4 години; N,N-діізопропілетиламін - 40мкл, 5 годин. Дистиляцію АПТЕС проводять за зменшеного тиску в атмосфері аргону. Для аміномодифікації слюди свіжосколоту слюду витримують у скляному ексикаторі у парах АПТЕС та N,Nдіізопропілетиламіна протягом 24 годин. Амінослюду зі зменшеною поверхневою щільністю заряду отримують шляхом обробки свіжосколотої слюди у парах неперегнаного АПТЕС. Заявлену модифіковану слюду можна зберігати в ексикаторі в атмосфері аргону протягом одного місяця. Оскільки зв'язування ДНК з полікатіонами визначається двома факторами - іонними та гідрофобними взаємодіями, - відзначимо, що використовувані субстрати для АСМ можна розташувати в порядку зростання гідрофобності та поверхневої щільності заряду таким чином: модифікована амінослюда зі зменшеною щільністю заряду < свіжосколота слюда < стандартна амінослюда < модифікована амінослюда з підвищеною щільністю заряду. Якісно ці висновки були підтверджені простим дослідженням. Крапля водного розчину, що експонували на свіжосколотій слюді, яка є гідрофільною, розтікалась по поверхні слюди. В той же час при поміщенні на поверхні стандартної амінослюди крапля розчину приймала форму еліпсоїда, а на поверхні модифікованої амінослюди зі збільшеною щільністю заряду -форму, наближену до кульки. Корисну модель ілюстровано прикладами. Приклад 1. Наведені Фіг.1 АСМ-зображення суперспіральної ДНК pGEMEX показують колоса 5 льний вплив поверхневих властивостей амінослюди на конформацію молекул. Наведені кадри доволі великого розміру (2мкм х 2мкм) демонструють, що поверхня амінослюди містить тільки молекули ДНК та вільна від забруднень, домішних наночасток, що супроводжують деякі АСМдослідження. Молекули ДНК, іммобілізовані на стандартній амінослюді (А), знаходяться у наближеній до плектономічної конформації, в той час як підвищення поверхневої щільності заряду веде до вражаючої компактизації молекул ДНК (Б) Дуже важливим для оцінки властивостей поверхні модифікованої слюди є той факт, що зображення (форма та кількість) молекул ДНК на модифікованій амінослюді після її зберігання протягом двох тижнів є подібними до зображення молекул на свіжовиготовленій стандартній амінослюді. Це означає, що, по-перше, кількість активних (тобто протонованих) аміногруп на поверхні модифікованої амінослюди значно перевищує кількість аміногруп на поверхні стандартної амінослюди, а, подруге, їхня стійкість щодо окислення значно перевищує стійкість аміногруп стандартної амінослюди. Фіг.1 .Зображення суперспіральної ДНК pGEMEX (довжина 3993пн) у повітрі, отримане за допомогою атомно-силового мікроскопа після нанесення розчину ДНК у ТЕ буфері на поверхню стандартної (А) та модифікованої амінослюди з підвищеною щільністю заряду (Б), яка характеризується вищою поверхневою щільністю аміногруп порівняно зі стандартною амінослюдою. Представлено суперспіральні молекули ДНК з різним рівнем компактизації: від плектономічних (А) до надсуперспіральних молекул (Б) з різною довжиною суперспіральної осі. Дві молекули у тороїдальній та наближеній до тороїдальної конформації показано білими вертикальними стрілками, а два сфероїди - похилими чорними стрілками. Розмір кадру: А - 2мкм х 2мкм, Б - 2мкм х 2мкм. Приклад 2. Поверхневі властивості стандартної амінослюди були охарактеризовані візуалізацією суперспіральних молекул ДНК, адсорбованих на амінослюді. Показано, що метод характеризації, заснований на візуалізації конформації плектономічно суперспіральних молекул ДНК, є надзвичайно інформативним навіть порівняно з АСМ у режимі силових вимірювань, оскільки дозволяє отримати додаткову інформацію про поверхневі властивості амінослюди. Фіг.2. АСМ зображення поодиноких суперспіральних молекул ДНК pGEMEX, іммобілізованих на різних субстратах: свіжосколотій слюді (А), отримане після нанесення краплі розчину ДНК у 10мМ HEPES буфері, що містить 2.5 мМ MgCb, стандартній амінослюді (Б) та модифіковаиій амінослюді з підвищеною щільністю аміногруп (В). Розмір кадру. А - 583нм х 583нм; Б - 500нм х 500нм; В - 500нм х 500нм. Контурна довжина ДНК pGEMEX становить: (А) - 1243нм; (Б) - 1216нм; (В) - 873нм. Довжина суперспіральної осі молекул ДНК: (А) - 466нм; (В) - 382нм. Приклад 3. Модифікована амінослюда зпідвищеною гідрофобністю за своєю стабільністю та поверхневою щільністю аміногруп значно перевищує стандартну амінослюду. Саме завдяки цим 13571 6 відмінностям іммобілізація суперспіральної ДНК на модифіковану амінослюду дозволила отримати зображення поодиноких молекул ДНК з таким надзвичайно високим рівнем суперспіралізації, який раніше не було досліджено ні експериментально, ні навіть розглянуто теоретично. Стиснуті, подібно до пружини, суперспіральні молекули ДНК зі зменшеною відстанню між парами основ вздовж осі дуплекса Η ~ 2 Å порівняно з добре відомими формами ДНК було названо новою формою ДНК - SДНК. Фіг.3. АСМ зображення поодинокої надсуперспіральної ДНК pGEMEX у S-формі, отримане після іммобілізації на поверхні модифікованої амінослюди, яка характеризується підвищеною поверхневою щільністю аміногруп. Розмір кадру: 250нм х 250нм. Відстань між нуклеотидами уздовж осі дуплекса для даної молекули дорівнює Η = 2.19А. Стрілками показано дві нитки, кожна з яких утворена подвійною спиральюДНК, що закручені у праву надсуперспіральну ДНК зі 1 надвитками (вузлами), які чітко розрізняються. (Б), (В) Поздовжні перерізи суперспіральної молекули ДНК pGEMEX. Січна площина проведена перпендикулярно площині рисунка через лінію, показану на вставках. Об'єм молекули розрахований як добуток ширини молекули на суму площин подовжніх перерізів. Шість (Б) та п'ять пиків (В) на профілях перерізів відповідають шести та п'яти вузлам. (Г) Тривимірне зображення молекули. Стрілками вказано нитки дуплекса, які частково розійшлися, що утворюють надсуперспіральну молекулу. (Д) Поперечний переріз, виконаний через нитки дуплекса, які розійшлися. На вставці показано лінію, через яку проведено січну площину перпендикулярно площині рисунка. Два піки відповідають профілям перерізів двох ниток, з яких була визначена їх висота. Максимальна висота піка відповідає висоті фрагмента молекули. Стрілками на перерізі та на вставці показані пік та відповідна йому подвійна спіраль ДНК, висота якої складає h = 0.38 ± 0.05нм. Приклад 4. Молекула суперспіральної ДНК pGEMEX (Фіг.4), іммобілізована на модифікованій амінослюді, різко відрізняється за своїми параметрами від молекул ДНК, адсорбованих на стандартній амінослюді: зросла кількість вузлів зросла, довжина суперспіральної осі зменшилася до 382нм, а розрахована з АСМ-зображення контурна довжина склала L =776нм. Оскільки секвенована послідовність ДНК pGEMEX складає 3993п.н., була визначена відстань між нуклеотидами вздовж осі подвійної спіралі ДНК. Фіг.4. (A) ACM зображення поодинокої лівої надсуперспіральної ДНК pGEMEX в S-формі, іммобілізованої на поверхні модифікованої амінослюди з підвищеною поверхневою щільністю аміногруп. Контурна довжина молекули ДНК становить L = 776нм, що відповідає відстані між парами нуклеотидів уздовж осі подвійної спіралі Η = 1.94А. Розмір кадру: 250нм х 250нм. (Б) Тривимірне зображення молекули. (В) Профіль попе-речного перерізу, виконаного січною площиною вздовж лінії, яка показана на вставці. Стрілки вказують на пік та відповідний йому фрагмент нитки подвійної спіралі ДНК, висота якої складає h = 0.38нм. (Г) 7 Профіль поперечного перерізу, виконаного уздовж лінії, що показана на вставці. Стрілка вказує на пік, з якого була визначена висота відповідної частини подвійної спіралі ДНК h = 0.40нм. Приклад 5. Намагаючись відповісти на запитання, чому різні молекули ДНК компактизовано до різного рівня, можна припустити, що (і) на поверхні модифікованої амінослюди протоновані аміногрупи іммобілізовані неоднорідно; (іі) найкомпактизованіші структури - сфероїди та напівсфероїди утворюються на ділянках модифікованої амінослюди з максимальною щільністю активних аміногруп. Локалізація морфологічно близьких форм ссДНК (наприклад, мінітороїдів, зображення яких наведено на Фіг.5 на ділянках слюди розміром ~ 500нм х 500нм вказує на те, що поверхнева щільність заряду модифікованої амінослюди варіює. А наявність такого градієнта щільності заряду і веде до різного екранування фосфатних груп ДНК та, як наслідок, до утворення варіантів компактизованих ссДНК, що морфологічно відрізняються. Крім того, досліджуваний зразок ДНК містить набір топоізомерів, що характеризуються різною суперспіральною щільністю. У випадку, якщо характерний час компактизації ДНК має близьке значення до часу досягнення молекулами ДНК поверхні амінослюди, топоізомери з різною кількістю супервитків можуть конденсуватися в агрегати з різним рівнем компактизації. Фіг.5. АСМ зображення компактизованих молекул суперспіральної ДНК pGEMEX, іммобілізованих на поверхні модифікованої амінослюди з підвищеною поверхневою щільністю аміногруп. (А) Три мінітороіди, утворені поодинокими молекулами ДНК. Розмір кадру: 400 х 400нм. (Б) Напівсфероїд, висота якого у максимумі hmax = 2.6нм. Висота некомпактизованої нитки ДНК дорівнює hmin = 0.3нм, що відповідає дволанцюговій ДНК. Розмір кадру: 250нм х 250нм. (В) Сфероїд, висота якого дорівнює hmax = 3.45нм. Розмір кадру: 250нм х 250нм. 13571 8 Приклад 6. Тягнені молекули ДНК формуються у процесі підготовки зразка для АСМ, а саме в процесі промивання слюди ультрачистою водою після експозиції з розчином ДНК. Через використання амінослюди зі зменшеною щільністю поверхневих аміногруп, різко зменшується число утворених зв'язків між електронегативними сайтами ДНК та позитивно зарядженими аміногрупами слюди. Тому під впливом струму води молекули ДНК витягуються паралельно напрямку, в якому проводиться промивання поверхні слюди. Отримані дані для тягнених молекул ДНК pGEMEX добре узгоджуються з раніше опублікованими результатами робіт з дослідження тягнених ДНК різними методами, в яких продемонстровано, що ДНК можна розтягти, подовжуючи її у 1.7 раза, що відповідає збільшенню міжнуклеотидної відстані до Η = 5.8Å. Рис.6. АСМ зображення витягнутих суперспіральних молекул ДНК pGEMEX, іммобілізованих на амінослюді зі зменшеною щільністю аміногруп. Å - контурна довжина ДНК L = 1943нм, що відповідає відстані між нуклеотидами уздовж осі подвійної спіралі Η = 4,87Å. Розмір кадру: 1.13мкм x 1.13мкм. Б - контурна довжина ДНК L = 2140нм, Η = 5.36Å. Розмір кадру: 1.07мкмх 1.07мкм. Таким чином, у даному винаході представлено схему отримання модифікованої у парах аміносилана АПТЕС амінослюди з регулюємою поверхневою щільністю аміногруп для іммобілізації біомакромолекул, насамперед лінійних та суперспіральних молекул ДНК. Модифікована амінослюда з підвищеною поверхневою щільністю аміногруп може бути використана у якості субстрату для візуалізації in vitro за допомогою атомносилової мікроскопії біомакромолекул за умов, наближених за гідрофобністю та щільністю заряду до параметрів клітинного ядра in vivo, а також для вивчення процесів конденсації та компактизації поодиноких молекул лінійної та суперспіральної ДНК. 9 13571 10 11 13571 12 13 Комп’ютерна верстка Д. Дорошенко 13571 Підписне 14 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for modification of mica, substrate for an atomic-power microscopy
Автори англійськоюLymanskyi Oleksandr Petrovych, Lymanska Olha Yuriivna, Volians`kyi Yurii Leonidovych, Volianskyi Yurii Leonidovych, Lymanska Liudmyla Oleksandrivna
Назва патенту російськоюСпособ модификации слюды, субстрата для атомно-силовой микроскопии
Автори російськоюЛыманский Александр Петрович, Лыманская Ольга Юриевна, Волянский Юрий Леонидович, Лиманская Людмила Александровна
МПК / Мітки
МПК: B28D 1/00, C12Q 1/68, C12Q 1/04
Мітки: слюди, атомно-силової, спосіб, мікроскопі, субстрату, модифікації
Код посилання
<a href="https://ua.patents.su/7-13571-sposib-modifikaci-slyudi-substratu-dlya-atomno-silovo-mikroskopi.html" target="_blank" rel="follow" title="База патентів України">Спосіб модифікації слюди, субстрату для атомно-силової мікроскопії</a>
Попередній патент: Спосіб монтажу вагоноштовхача роторного пересувного вагоноперекидача
Наступний патент: Двовалковий брикетувальний прес
Випадковий патент: Похідні амінодикарбонових кислот, їх застосування та лікарський засіб