Спосіб отримання сульфонілфеніл- беttа-d-тіоксилозидів
Номер патенту: 26438
Опубліковано: 30.08.1999
Автори: РЕНО Патріс, САМРЕТ Сот, Байгровіч Жерсі, Мілле Жан
Формула / Реферат
1. Способ получения сульфонилфенил-b-D-тиоксилозидов формулы I
где X представляет собой атом серы или атом кислорода;
R представляет собой алкильную C1-C4 группу; замещенную аминогруппу NR1R2, где R1 и R2, идентичные или различные, каждый представляет собой алкильную C1-C4-группу; a R1 и R2 взятые вместе, могут образовывать с атомом азота, с которым они связаны, пиперидинильную или морфолинильную группу или фенильную группу, возможно замещенную в пара-положении цианогруппой или атомом галогена;
Y представляет собой атом водорода или CH3CO-группу;
отличающийся тем, что соединения формулы II
где X и R определены, как указано выше, подвергают взаимодействию с производными тиоксилозида формулы III
или IV
или V
где Hal представляет собой атом галогена, такого как хлор или бром (причем атом брома является предпочтительным атомом галогена),
Y представляет собой CH3CO группу; в инертном растворителе, в соотношении 1моль соединения II на 0,6 - 1,2моль соединения III или IV или V в присутствии кислотного акцептора или кислоты Льюиса;
при необходимости полученное таким образом соединение формулы I, где Y является CH3CO-группой, подвергают деацилированию при температуре, в интервале от 0° до температуры реакционной среды, в низшем C1-C4-спирте (предпочтительно в метаноле) в присутствии алкоголята металла (предпочтительно метилата магния или метилата натрия) для получения соединения формулы I, где Y является H.
2. Способ по п.1, отличающийся тем, что используют соединение формулы II, где X представляет собой атом серы, полученное путем конденсации в сильноосновной среде диметиламинотиокарбадоилхлорида формулы VI
с соединением формулы IIa
где R имеет значения, указанные выше, для получения соединения формулы VII
где R определен, как указано выше; затем проводят перегруппировку соединения формулы VII, полученного указанным способом, при нагревании до получения соединения формулы VIII
где R определен, как указано выше, с последующей обработкой его алкоголятом металла (предпочтительно метанолятом натрия или магния) в низшем C1-C4 спирте, диметилформамиде или диоксане до получения соединения формулы II, где X является S.
Текст
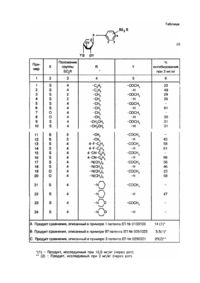
Изобретение относится к синтезу новых биологически активных соединений, в частности к получению сульфонилфенил-b-D-тиоксилозидов, которые могут найти применение в терапии в качестве противотромбозных агентов, особенно венозных противотромбозных агентов. Известны производные бензоилфенилозидов и a-гидроксибензилфенилозидов в качестве противоязвенных агентов, антикоагулянтов тромбоцитов, противотромбозных агентов и оксигенаторов мозга [3]. Известны также бензилфенилозиды, применяемые в качестве гипохолестеролемических и гиполипидемических агентов, причем некоторые из этих соединений, в частности продукт из примера 1, обладают помимо прочего противотромбозными свойствами [1]. Известны производные бензоилфенилтиоксилозы, a-гидроксибензилфенилтиоксилозы и бензилфенилтиоксилозы, предложенные в качестве противотромбозных агентов [2]. Заявителем было обнаружено, что сульфонилфенил-b-D-тиоксилозиды в соответствии с изобретением, структурно отличающиеся от продуктов известного уровня техники, являются полезными при лечении и предупреждении болезней, связанных с нарушениями кровообращения, особенно в качестве венозных противотромбозных агентов. Новые продукты в соответствии с изобретением отличаются тем, что они выбираются среди сульфонилфенил-b-D-тиоксилозидов общей формулы где X представляет собой атом серы или атом кислорода; R представляет собой алкильную гр уппу C1-C4 , замещенную аминогруппу NR1R2 (где R1 и R2 , идентичные или различные, каждый представляет собой алкильную группу C 1-C4, a R1 и R2 взятые вместе, могут образовывать с атомом азота, с которым они связаны, пиперидинильную или морфолинильную группу) или фенильную группу, возможно замещенную в параположении цианогруппой или атомом галогена; Y представляет собой атом водорода или CH3CO группу. Под алкильной группой C1-C4 понимают углеводородный остаток, разветвленный или линейный, содержащий от 1 до 4 атомов углерода, причем предпочтительной алкильной группой является метильная группа. Под атомом галогена здесь понимают атомы хлора, фтора и брома, причем предпочтительным атомом галогена является атом фтора. В соответствии с изобретением предпочитают соединения формулы I, в которой X представляет собой атом серы. Соединения формулы I и соответствующие ацилированные соединения могут быть получены в соответствии с реакцией гликолизирования, отличающейся тем, что: - проводят реакцию соединения формулы II где X и R определены, как указано выше, с производным тиоксилозы, выбранной из группы, содержащей галогениды ацилтиоксилозила формулы III перацилированные тиоксилозы формулы IV трихлорацетимидаты ацилтиоксилозила формулы V в которых Hal представляет собой атом галогена, такой как хлор или бром (причем атом брома является предпочтительным), a Y представляет собой CH3CO группу; в инертном растворителе с содержанием 1моль соединения II на примерно от 0,6 до 1,2моль соединения III, IV или V, а частности в присутствии кислотного акцептора и/или кислоты Льюиса, - если необходимо, то полученное таким образом соединение с формулой I, где Y является CH3CO гр уппой, подвергают реакции деацилирования при температуре, заключенной в интервале от 0°C и температурой реакционной среды, в низшем спирте C1-C4 (предпочтительно в метаноле) в присутствии алкоголята металла (предпочтительно метилата магния или метилата натрия, с целью получения соединения формулы I, в которой Y является водородом. Соединения III, IV и V могут находиться в a- или b-конфигурации или в виде аномерной смеси двух конфигураций. Реакции гликозилирования соединений формулы II проводят либо исходя из соединения III в присутствии катализатора, такого как соли или оксиды серебра, ртути или цинка, либо исходя из соединения V в присутствии кислоты Льюиса, особенно эфирной вытяжки трифторида бора или хлорида цинка, либо же исходя из соединения IV в присутствии кислоты Льюиса. В соответствии с предпочтительным вариантом осуществления изобретения целесообразно проводить конденсацию 1моль соединения формулы II с примерно 1,1 - 1,2моль галогенида ацилтиоксилозила III в инертном растворителе, выбранном среди полярных или неполярных растворителей (таких как, например, диметилформамид, тетрагидрофуран, диоксан, ацетонитрил, нитрометан, бензол, толуол, ксилолы и их смеси), в присутствии цианида ртути. Преимущественно используют бромид 2,3,4-три-O-ацетил-5-тио-a-D-ксилопиранозила в смеси бензол нитрометан 1/1 (по объему) в присутствии от 1,1 до 1,3моль цианида ртути при температуре, в интервале от 0°C и температурой реакционной смеси, предпочтительно при 40 - 50°C, в течение 1 - 4ч, предпочтительно в течение примерно 2ч. В соответствии со вторым предпочтительным вариантом осуществления изобретений целесообразно проводить конденсацию 1моль соединения формулы II с примерно 1,1 - 1,2моль галогенида ацилтиоксилозила III в инертном растворителе (таком как, например, дихлорметан или ацетонитрил) в присутствии имидазолата серебра и хлорида цинка. Преимущественно используют бромид 2,3,4-три-O-ацетил-5-тио-D-ксилопиранозила в дихлорметане или в смеси дихлорметан/ацетонитрил в присутствии 1,5 - 1,7моль имидазолата серебра и 2 - 2,2моль хлорида цинка при температуре, в интервале от 0°C и температурой реакционной среды, предпочтительно при температуре примерно 40 - 60°C, в течение 24 - 48ч. В соответствии с третьим предпочтительным вариантом осуществления изобретения целесообразно проводить конденсацию 1моля соединения формулы II с примерно 0,6 - 1моль галогенида ацилтиоксилозила III в инертном растворителе (таком как, например, толуол и/или ацетонитрил) в присутствии оксида цинка. Преимущественно используют бромид 2,3,4-три-O-ацетил-5-тио-D-ксилопиранозила в смеси толуол/ацетонитрил в присутствии 0,5 - 1,2моль оксида цинка при температуре, заключенной между комнатной температурой и температурой флегмы реакционной среды, предпочтительно при температуре примерно 40 60°C, в течение 18 - 48ч. В соответствии с че твертым предпочтительным вариантом осуществления изобретения целесообразно проводить конденсацию 1моль соединения формулы II с примерно 1,1 - 1,3моль трихлорацетамида ацилтиоксилозила в инертном растворителе (таком как, например, дихлорметан или ацетонитрил) в присутствии эфирной вытяжки трифторида бора или хлорида цинка. Преимущественно используют три хлорацитимидат 2,3,4-три-O-ацетил-5-тио-a-D-ксилопиранозила в дихлорметане в присутствии 0,1 - 0,4моль эфирной вытяжки трифторида бора, растворенной в дихлорметане или в ацетонитриле, или в присутствии хлорида цинка при температуре, заключенной между -40°C и комнатной температурой (15 - 25°C), предпочтительно при температуре примерно от -20°C до 0°C, в течение 1 - 5ч. Реакция гликозилирования приводит во всех случаях к смеси изомеров с a- или b-конфигурацией в изменяющихся соотношениях. Изомер с b-конфигурацией выделяется в соответствии с известными специалисту методами, такими как, например, дробная кристаллизация или хроматография, особенно "флэш-хроматография" (т.е. хроматография на колонке с кремнеземом под давлением в соответствии с методикой, описанной W.C. Stiel et al., J. Org. Chem., (1978), 42 (№14), 2923). Полученные производные подвергаются, в случае необходимости, деацилированию, в частности деацилированию, которое осуществляется при температуре, в интервале от 0°C и температурой реакционной среды, в низшем спирте C1-C4 в присутствии соответствующего алкоголята металла. Предпочтительно выбирают метанол в качестве низшего спирта и метанолят натрия или магния в качестве алкоголята металла. Реакция деацилирования, в случае необходимости, может быть проведена без выделения образованного промежуточного ацилированного соединения. Можно также проводить реакцию деацилирования энзиматическим путем, например, при действии эстеразы свиной печени. Для получения промежуточных соединений формулы II, где X = S, осуществляют конденсацию в сильноосновной среде диметиламинотиокарбамилхлорида формулы VI с соединением формулы IIa где R имеет значение, указанное выше, с целью получения соединения формулы VII где R имеет значение, указанное выше; подвергают полученное таким образом соединение формулы VII перегруппировке Ньюмана (J. Org. Chem. (1966) 31, p.3980) при нагревании с целью получения соединения формулы VIII где R имеет значение, указанное выше; обрабатывают полученное таким образом соединение формулы VIII алкоголятом металла, предпочтительно метанолята натрия или магния, в низшем спирте C1-C4, предпочтительно в метаноле, диметилформамиде или диоксане с целью получения соединения формулы II, где X = S. Можно также получить промежуточные соединения формулы II, где X = S, путем нуклеофильного замещения подходящего галогенбензольного соединения в соответствии с методом, описанным Testaferri L., Tefrahedron Letters, vol.21, p.3099 - 3100 (1980). Некоторые промежуточные соединения формулы II, где X = S, являются новыми соединениями. Соединения формулы: где R1 представляет собой атом фтора, атом брома или цианогруппу, составляют, следовательно, один из предметов изобретения. Новые соединения могут входить в терапевтические составы вместе с инертными физиологически приемлемыми веществами. Соединения формулы I применяются в терапии в качестве противотромбозных агентов. Они особенно полезны при предупреждении и при лечении нарушений венозного кровообращения. Другие характеристики и преимущества изобретения будут лучше поняты при последующем рассмотрении примеров получения, никоим образом не ограничивающих, а данных в качестве иллюстрации, и результатов фармакологических испытаний. В примерах получения, приведенных ниже, соединения были названы с уточнением a- или b-конфигурации, когда указанная конфигурация была определена. Когда конфигурация не указывается, что означает, что соответствующий продукт является аномерной смесью a- и b-конфигурацией в соотношениях, которые не определялись. Получение I. Ia. Получение 4-(фенилсульфонил)-бензолтиола. В атмосфере азота прибавляют 1,25г тиометанолята натрия к раствору, содержащему 15г (0,0593моль) 1хлор-4-(фенилсульфонил)-бензола в 150мл гексаметилфосфорамида. Полученную смесь нагревают в течение 4ч при 100°C, затем после охлаждения гидролизуют смесью вода/лед. Полученную реакционную среду экстрагируют этилацетатом, затем полученную водную фазу приливают к 4н. раствору хлороводородной кислоты при температуре 0°C. Образованный продукт выделяется в виде осадка. После фильтрования, промывания водой до нейтрального значения pH и сушки получают 13,44г (с выходом: 90,5%) ожидаемого продукта. Температура плавления (Tпл) = 117°C. Ib. Получение 4-(фенилсульфонил)-фенил-2,3,4-три-O-ацетил-1,5-дитио-b-D-ксилопиранозида (пример 1). В атмосфере азота прибавляют 10,6г цианида ртути (Hg(CN)2) к раствору, содержащему 10г (0,0399моль) 1меркапто-4-(фенилсульфонил)-бензола в 300мл смеси толуол/нитрометан 1/1 (по об.), затем полученную смесь перемешивают в течение 1ч при 40 - 45°C. Наблюдают выделение осадка. Затем 17,7г (0,0498моль) 2,3,4-три-Oацетил-1-бром-5-тио-b-D-ксилопиранозида прибавляют к смеси. После перемешивания в течение 3,5ч при 40 45°C реакционная среда становится прозрачной. Органическую фазу, полученную после охлаждения, промывают последовательно при помощи 1н, раствора хлороводородной кислоты при температуре 0°C, 1н. раствора гидроксида натрия при температуре 0°C водой, затем при помощи насыщенного раствора хлорида натрия. После выпаривания растворителей получают 24г пенообразного вещества желтого цвета, которое кристаллизуется при добавлении эфира. В конце получают 8,6г ожидаемого продукта (выход 41%). T = 159°C. [a]D23 = +58,2° (c = 0,5; CHCl 3). Ic. Получение 4-(фенилсульфонил)-фенил-1,5-дитио-b-D-ксилопиранозида (пример 2). Прибавляют 0,35см 3 метилата натрия, растворенного в метаноле (с концентрацией 3,5М), к суспензии, состоящей из 6,5г 4-(фенилсульфонил)-фенил-2,3,4-три-O-ацетил-1,5-дитио-b-D-ксилопиранозида в 150мл метанола. Полученную смесь перемешивают при комнатной температуре в течение 1,5ч в атмосфере азота, затем прибавляют 250см 3 тетрагидрофурана. Получают прозрачный раствор перед прибавлением смолы Амберлит RIR 120 H+ до pH 6. Фильтруют и выпаривают растворители при пониженном давлении. После перекристаллизации в смеси метанол/вода 50/50 с последующим растворением в смеси этанол/вода 50/50 и лиофилизацией (вакуумной сушкой) получают 3,3г ожидаемого продукта (выход 67%). Tпл = область плавления 85 - 97°C. [a]D23 = +44,8° (c = 0,42; диметилсульфоксид). Получение II. IIa. Получение 1-бром-2-(метилсульфонил)-бензола. Раствор, содержащий 5г (0,0246моль) 1-бром-2-(метилтио)-бензола в 10мл метанола, охлаждают до температуры 0°C в атмосфере азота, затем прибавляют 1,27г 3-хлорпероксибензойной кислоты (МХПБК) с содержанием 50%. Перемешивание при 0°C поддерживают в течение 45мин, затем добавляют 6г фторида калия и продолжают гидролиз в течение 12ч. Полученную среду фильтруют на Целите R, затем полученный продукт после выпаривания растворителей очищают методом "флэш-хроматографии" при элюировании смесью толуол/этилацетат 95/5. Получают 5,63г (вы ход 97%) ожидаемого продукта. Tпл = 98°C. IIb. Получение 2-(метилсульфонил)-бензолтиола. Проводя реакцию способом, аналогичным получению Ia, получают ожидаемый продукт. Tпл = 57°C. IIc. Получение 2-(метилсульфонил)-фенил-2,3,4-три-O-ацетил-1,5-дитио-b-D-ксилопиранозида (пример 3). Прибавляют 8,43г (0,0251моль) 1-бром-2,3,4-три-O-ацетил-5-тио-b-D-ксилопиранозида к смеси, содержащей 4,3г (0,0228 моль) 1-меркапто-2-(метилсульфонил)-бензола и 1,95г оксида цинка в 90мл толуол/ацетонитрил 1/1 (по об.), и полученную смесь нагревают при 45°C в течение 2ч. Полученную реакционную среду фильтруют на Целите R, затем органическую фаз у промывают посредством 1н. раствора HCl, 1н. раствора гидроксида натрия, затем водой до нейтрального значения pH. После выпаривания растворителей при пониженном давлении получают маслянистую жидкость, которую кристаллизуют при добавлении эфира. Затем 5,33г полученного кристаллизованного продукта очищают методом "флэш-хроматографии" при элюировании смесью толуол/этилацетат 8/2. Получают 4,35г (выход 41%) ожидаемого продукта. Tпл = 209°C. [a]D20 = +38,4° (c = 0,5; CHCl 3). IId. Получение 2-(метилсульфонил)-фенил-1,5-дитио-b-D-ксилопиранозида (пример 4). Проводя реакцию способом, аналогичным получению Ic, получают ожидаемый продукт. Tпл = 139°C. [a]D20 = +38,8° (c = 0,5; CH 3OH). Получение III. IIIa. Получение 4-(метилсульфонил) фенил-2,3,4-три-O-ацетил-1,5-дитио-b-D-ксилопиранозида (пример 5). Проводя реакцию способом, аналогичным получению IIc, получают бесцветн ую маслянистую жидкость, которая кристаллизуется в эфире. Tпл = 105 - 110°C. [a]D20 = +71° (c = 0,5; CHCl 3) IIIb. Получение 4-(метилсульфонил)фенил-1,5-дитио-b-D-ксилопиранозида (пример 6). Проводя реакцию способом, аналогичным получению Ic, получаю ожидаемый продукт после перекристаллизации в смеси метанол/этанол. Tпл > 250°C. [a]D20 = +19,2° (c = 0,5; CH 2Cl2/CH3OOH 1/1 (V/V). Получение IV. IVa. Получение 4-(метилсульфонил) фенил-2,3,3-три-O-ацетил-5-тио-b-D-ксилопиранозида (пример 7). Смесь, содержащую 2г (0,012 моль) 1-гидрокси-4-(метилсульфонил)-бензола, 3,17г хлорида цинка (ZnCl2), 4,5г (0,013 моль) 1-бром-2,3,4-три-O-ацетил-5-тио-b-D-ксилопиранозида и 3,1г (0,0177 моль) имидозалата серебра (C3H3AgN2) в 70мл метиленхлориде, нагревают в течение 20ч при 50°C. После охлаждения реакционную среду фильтруют, затем полученную органическую фазу промывают последовательно посредством 1н. раствора хлороводородной кислоты, воды и 1н. раствора гидроксида натрия, потом растворитель выпаривают при пониженном давлении. После очистки методом "флэш-хроматографии" при элюировании смесью толуол/этилацетат 3/1 (по об.) с последующим осаждением в этиловом эфире получают 1,1г ожидаемого продукта (выход 21,2%). Tпл - 168°C. [a]D22 = -75° (c = 0,6; CHCl 3) IVb. Получение 4-(метилсульфонил)-фенил-5-тио-b-D-ксилопиранозида (пример 8). Проводя реакцию способом, аналогичным получению Ic, получают ожидаемый продукт после лиофилизации. Tпл = 180°C. [a]D22 = -77,2° (c = 0,5; CH 3OH). Получение V. Va. Получение 4-(этилсульфонил)-бензолтиола. Проводя реакцию способом, аналогичным получению Ia, получают ожидаемый продукт в виде маслянистой жидкости. nD24 = 1,5891. Vd. Получение 4-(этилсульфонил)-фенил-2,3,4-три-O-ацетил-1,5-дитио-b-D-ксилопиранозида (пример 9). Проводя реакцию способом, аналогичным получению Ib, получают ожидаемый продукт. Tпл = 136 - 137°C. [a]D23 = +36,7° (c = 0,45; CHCl 3). Vc. Получение 4-(этилсульфонил)-фенил-1,5-дитио-b-D-ксилопиранозида (пример 10). Проводя реакцию способом, аналогичным получению Ic, получают ожидаемый продукт. Tпл = 130 - 135°C. [a]D23 =+26,8° (c = 0,485; метанол). Получение VI. VIa. Получение 4-(метилсульфонил)-фенил-2,3,4-три-O-ацетил-1,5-дитио-b-D-ксилопиранозида (пример 11). Проводя реакцию способом, аналогичным получению IIc, получают ожидаемый продукт. Tпл = 147 - 150°C. [a]D21 = -10,5° (c = 0,3; CHCl 3). VIb. Получение 4-(метилсульфонил)-фенил-1,5-дитио-b-D-ксилопиранозида (пример 12). Проводя реакцию способом, аналогичным получению Ic, получают ожидаемый продукт. Tпл = 169 - 172°C. [a]D22 = -12,2° (c = 0,45; диметилсульфоксид). Получение VII. VIIa. Получение 4-[(4-фторфенил)-сульфонил]-бензолтиола. К суспензии, состоящей из 1г (0,00398 моль) 4-[(4-фторфенил)-сульфонил]-бензоламина, растворенного в хлороводородной кислоте (1,68мл концентрированной хлороводородной кислоты в 5мл воды), при температуре 5°C прибавляют раствор нитрита натрия (302мг в 1мл воды). После 5-минутного перемешивания этот раствор по каплям добавляют к раствору, содержащему 2,47г этилксантата калия в 5мл воды при 70°C. Реакционную смесь разбавляют этил ацетатом. Органическую фазу промывают 1н. раствором гидроксида натрия, насыщенным раствором хлорида натрия, потом сушат на сульфате магния. После выпаривания растворителей остаток извлекают посредством 15мл этанола. Прибавляют 1,47г гидроксида калия и нагревают при 45°C в течение 10мин. Затем реакционную смесь приливают к водоледяному раствору и частично очищают экстракцией этилацетатом. Водную фазу, о хлажденную при помощи льда, подкисляют путем прибавления концентрированной хлороводородной кислоты, затем экстрагируют этилацетатом. Органическую фазу сушат на сульфате магния и растворители выпаривают досуха. Получают таким образом 640мг (выход 60%) ожидаемого продукта. Tпл = 116°C. VIIb. Получение 4-[(4-фторфенил)-сульфонил]-фенил-2,3,4-три-O-ацетил-1,5-дитио-b-D-ксилопиранозида (пример 13). Проводя реакцию способом, аналогичным получению IIc, получают ожидаемый продукт. Tпл = 80°C. [a]D21 = +48,4° (c = 0,5; CHCl 3). VIIc. Получение 4-[(4-фторфенил)-сульфонил]-фенил-1,5-дитио-b-D-ксилопиранозида (пример 14). Проводя реакцию способом, аналогичным получению Ic, получают ожидаемый продукт. Tпл = 136 - 138°C. [a]D21 = +40° (c = 0,5; диметилсульфоксид). Получение VIII. VIIIa. Получение 4-[(метоксифенил)-сульфонил]-бензонитрила. В смесь, состоящую из 120мл этанола и 12мл воды, добавляют 6г (0,0248моль) 1-[(4-метоксифенил)-тио]бензонитрила, затем 18,45г гексагидратированного монопероксифталата магния. Реакционную смесь выдерживают при температуре 40°C в течение 20мин. После гидролиза в ледяной воде раствор фильтруют и твердое вещество белого цвета промывают водой. Получают таким образом 5,2г (выход 77%) ожидаемого продукта. Tпл = 135°C. VIIIb. Получение 4-[(4-гидроксифенил)-сульфонил]-бензонитрила. Смесь, состоящую из 5,12г (0,0187 моль) 4-[(4-метоксифенил)-сульфонил]-бензонитрила и 21,6г хлоргидрата пиридиния, выдерживают при 200°C в течение 2ч. После охлаждения реакционную среду гидролизуют 1н. раствором хлороводородной кислоты. Образованный осадок фильтруют, промывают 1н. раствором хлороводородной кислоты, затем водой до нейтрального значения pH. Получают таким образом 4,5г (выход 99%) ожидаемого продукта в виде твердого ве щества серого цвета. Tпл = 177°C. VIIIc. Получение диметилтиокарбамата O-4-[(4-цианофенил)-сульфонил]-фенила. К раствору, содержащему 570мг гидроксида калия в 35мл воды, прибавляют 2,36г (0,0097 моль) 4-[(4гидрокеифенил)-сульфонил]-бензонитрила. Раствор выдерживают в течение 15мин при комнатной температуре. После охлаждения до температуры 0°C прибавляют по капле раствор, содержащий 1,38г N,Nдиметилтиокарбамилхлорида в 35мл ацетона. Спустя 4ч реакционную смесь гидролизуют 1н. раствором хлороводородной кислоты. Раствор экстрагируют этилацетатом. Органическую фазу промывают водой до нейтрального значения pH, сушат на сульфате магния и концентрируют досуха. Получают таким образом 3г (выход 100%) ожидаемого продукта. Tпл = 158 - 167°C. VIIId. Получение диметилтиокарбамата S-{4-[(4-цианофенил)-сульфонил]-фенил}. Выдерживают 3г (0,0096 моль) диметилтиокарбамата O-{4-[(4-цианофенил)-сульфонил]-фенила} при 200°C в течение 30мин. После хроматографирования на силикагеле при элюировании смесью толуол/этилацетат 8/2 (б/об) получают 2,29г (выход 76%) ожидаемого продукта. Tпл = 140°C. VIIIe. Получение 4-[(4-меркаптофенил)-сульфонил]-бензонитрила. К раствору, содержащему 2,25г (0,0075 моль) диметилтиокарбамата S-{4-[(4-цианофенил)-сульфонил]фенила} в 45мл N,N-диметилформамида при 0°C, прибавляют 4,1мл метанолята натрия (8% Na (вес/об) в метаноле). Затем реакционную смесь гидролизуют 1н. ледяным раствором хлороводородной кислоты. После фильтрования образованный осадок промывают водой, затем сушат. Получают таким образом 1,54г (выход 78%) ожидаемого продукта. Tпл = 166°C. VIIIf. Получение 1-[(4-цианофенил)-сульфонил]-фенил-2,3,4-три-O-ацетил-1,5-дитио-b-D-ксилопиранозида (пример 15). Проводя реакцию способом, аналогичным получению Ib, получают ожидаемый продукт. Tпл = 194 - 195°C. [a]D20 = +51° (c = 0,5; CHCl 3). VIIIg. Получение 4-[(4-цианофенил)-сульфонил]-фенил-1,5-дитио-b-D-ксилопиранозида (пример 16). Проводя реакцию способом, аналогичным получению Ic, получают ожидаемый продукт. Tпл = 175 - 183°C. [a]D20 = +58,6° (c = 0,5; диметилсульфоксид.) Получение IX. IXa. Получение 4-(N,N-диметилсульфонамидил)-фенил-2,3,4-три-O-ацетил-1,5-дитио-b-D-ксилопиранозида (пример 17). Проводя реакцию способом, аналогичным получению Ib, получают ожидаемый продукт. Tпл = 120°C. [a]D20 = +35,4° (c = 0,56; CHCl 3). IXb. Получение 4-(N,N-диметилсульфонамидил)-фенил-1,5-дитио-b-D-ксилопиранозида (пример 18). Проводя реакцию способом, аналогичным получению Ic, получают ожидаемый продукт. Tпл = 208 - 213°C. [a]D24 = +21,4° (c = 0,42; диметилсульфоксид). Получение X. Xa. Получение 4-(N,N-диметилсульфонамидил)-фенил-5-тио-b-D-ксилопиранозида (пример 20). Проводя реакцию способом, аналогичным получению Ic, получают ожидаемый продукт. Tпл = 205°C. [a]D21 = -70,4° (c = 0,27; метанол). Получение XI. XIa. Получение 4-меркапто-N-(1-пиперидинил)-бензолсульфонамида. Проводя реакцию способом, аналогичным получению Ia, получают ожидаемый продукт. Tпл = 93°C. XIb. Получение 4-[N-(1-пиперидинил)-сульфонамидил]-фенил-2,3,4-три-O-ацетил-1,5-дитио-b-Dксилопиранозида (пример 21). Проводя реакцию способом, аналогичным получению Ib, получают ожидаемый продукт. Tпл = 175 - 180°C. [a]D22 = +39,8° (c = 0,425; CHCl 3). XIc. Получение 4-[N-(1-пиперидинил)-сульфонамидил]-фенил-1,5-дитио-b-D-ксилопиранозида (пример 22). Проводя реакцию способом, аналогичным получению Ic, получают ожидаемый продукт. Tпл = 145 - 149°C. [a]D22 = +23,8° (c = 0,21; метанол). Получение XII. XIIa. Получение 4-меркапто-N-(1-морфолинил)-бензолсульфонамида. Проводя реакцию способом, аналогичным получению Ia, получают ожидаемый продукт. Tпл = 128°C. XIIb. Получение 4-[N-(1-морфолинил)-сульфонамидил]-фенил-2,3,4-три-O-ацетил-1,5-дитио-b-Dксилопиранозида (пример 23). Проводя реакцию способом, аналогичным получению Ib, получают ожидаемый продукт. Tпл = 120 - 123°C. [a]D22 = +39° (c = 0,39; CHCl 3). XIIc. Получение 4-[N-(1-морфолинил)-сульфонамидил]-фенил-1,5-дитио-b-D-ксилопиранозида (пример 24). Проводя реакцию способом, аналогичным получению Ic, получают ожидаемый продукт. Tпл = 90 - 105°C. [b]D22 = +20,4° (c = 0,56; диметилеульфоксид). В таблице приведены соединения в соответствии с изобретением. Противотромбозная активность продуктов в соответствии с изобретением выявлялась согласно следующему протоколу исследования венозного тромбоза. Создают венозный застой (крови) в результате гиперкоагуляции в соответствии с методикой, описанной Wessler et al., (J. Applied Physiol, 1959, p.943 - 946). Используемый гиперкоагулирующий агент, как и в методике, описанной J. Haupman et al. (Trombosis and Haemostasis, 43, (2), 1980, p.118), представляет собой раствор с активированным фактором X (Xa), который поставляется фирмой Flow Laboratories (71 Knat на 12,5мл физиологического раствора). Исследование проводится на крысах-самцах Wistar (не натощак) весом от 250 до 280г, разделенных на группы по 10 животных в каждой. Исследуемые продукты вводятся через рот в виде суспензии в ПЭГ 400. Тромбоз вызывается спустя 4ч после этой обработки, а образованный тромб извлекается и взвешивается. Полученные результаты при дозе 3мг/кг (через рот) приведены в таблице. В этой таблице также приводятся результаты, полученные с продуктами по известному уровню те хники. Источники информации 1. ЕП №0133103, кл. C07H15/20, 1985. 2. ЕП №0290321, кл. C07H15/203, 1988. 3. ЕП №0051023, кл. C07H15/20, 1982.
ДивитисяДодаткова інформація
Автори англійськоюSamreth Sot, Baigrovich Jersi, Millet Jean
Автори російськоюСамрет Сот, Байгрович Жерси, Милле Жан
МПК / Мітки
МПК: A61K 31/7028, C07C 333/00, C07H 15/203, C07C 323/65, C07H 5/00, A61P 7/02, A61P 9/00, A61K 31/70, A61K 31/7034
Мітки: спосіб, отримання, сульфонілфеніл, беttа-d-тіоксилозидів
Код посилання
<a href="https://ua.patents.su/7-26438-sposib-otrimannya-sulfonilfenil-betta-d-tioksilozidiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання сульфонілфеніл- беttа-d-тіоксилозидів</a>
Попередній патент: Похідні син-ізомеру цефалоспорину, їх оптично активні антиподи або рацемічна суміш, а також їх фармацевтично прийнятні кислотно-адитивні солі
Наступний патент: Спосіб одержання еластомерних фторованих співполімерів
Випадковий патент: Цифровий колориметр